METODE CEPAT KUANTIFIKASI KUININA DALAM
SEDIAAN FARMASI DAN KULIT KINA SECARA
SPEKTROFOTOMETRI DERIVATIF ULTRAVIOLET
EGUN DARYADI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
EGUN DARYADI, Metode Cepat Kuantifikasi Kuinina dalam Sediaan Farmasi dan Kulit Kina secara Spektrofotometri Derivatif Ultraviolet. Dibimbing oleh ELLY SURADIKUSUMAH dan IRMANIDA BATUBARA.
ABSTRACT
EGUN DARYADI, A Rapid Method for Quantification of Quinine in Pharmaceutical Dosage Form and Cinchona Bark Using Ultraviolet Derivative Spectrophotometry. Supervised by ELLY SURADIKUSUMAH and IRMANIDA BATUBARA.
METODE CEPAT KUANTIFIKASI KUININA DALAM
SEDIAAN FARMASI DAN KULIT KINA SECARA
SPEKTROFOTOMETRI DERIVATIF ULTRAVIOLET
EGUN DARYADI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Metode Cepat Kuantifikasi Kuinina dalam Sediaan Farmasi dan Kulit Kina secara Spektrofotometri Derivatif Ultraviolet
Nama : Egun Daryadi NIM : G44201034
Menyetujui:
Pembimbing I, Pembimbing II,
Ir. Elly Suradikusumah, MS Irmanida Batubara, S.Si, M.Si
NIP 130350043 NIP 132312528
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Dr. Ir. Yonny Koesmaryono, MS NIP 131473999
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas nikmat dan karunia-Nya sehingga karya ilmiah ini dapat diselesaikan. Karya ilmiah yang berjudul Metode Cepat Kuantifikasi Kuinina dalam Sediaan Farmasi dan Kulit Kina secara Spektrofotometri Derivatif Ultraviolet ini disusun berdasarkan penelitian yang dilakukan oleh penulis di Laboratorium Kimia Analitik, Departemen Kimia, dan Pusat Studi Biofarmaka, Lembaga Penelitian dan Pengembangan Masyarakat, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Ir. Elly Suradikusumah, MS dan Irmanida Batubara, S.Si, M.Si selaku pembimbing atas arahan dan saran selama penelitian dan penulisan skripsi ini, Hibah Penelitian A2 dari Program Hibah Kompetisi A2 Departemen Kimia, Institut Pertanian Bogor atas dana yang telah diberikan, Pusat Studi Biofarmaka atas fasilitas yang diberikan, dan Mohamad Rafi, S.Si atas arahan dan dorongan semangat yang telah diberikan. Terima kasih disampaikan pula kepada kedua orang tua atas kasih sayang yang telah diberikan, adikku eneng, Palaskari 17 (Perhimpunan Alumni Asrama Sukasari 17) atas bantuan dana selama penulis kuliah, Mas Heri, Kang Atep, Jaim, Om Eman, dan semua staf di Laboratorium Kimia Analitik.
Terima kasih juga disampaikan kepada Tim Derivatif (Opie, Woro, Wiji, Ira, dan Nersi), penghuni Asrama IPB Sukasari, Eka, sahabat D-Complex, dan teman-teman Kimia 38 atas dorongan semangat yang telah diberikan.
Semoga karya ilmiah ini dapat bermanfaat.
Bogor, Juni 2006
RIWAYAT HIDUP
Penulis dilahirkan di Sukabumi pada tanggal 22 April 1984 dari ayah Dedi Marmoyo dan Ibu Ade Maryati. Penulis merupakan anak pertama dari dua bersaudara.
Tahun 2001 penulis lulus dari SMU Negeri 1 Cisaat dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur USMI (Undangan Seleksi Masuk IPB). Penulis memilih masuk Program Studi Kimia, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR TABEL... ix
DAFTAR LAMPIRAN... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA ... 1
Sediaan Farmasi... 1
Kina ... 2
Kuinina ... 2
Spektrofotometri ... 2
Spektrofotometri Derivatif UV... 3
Kromatografi Cair Kinerja Tinggi ... 4
Validasi Metode Analisis... 4
BAHAN DAN METODE ... 5
Bahan dan Alat ... 5
Metode Penelitian ... 5
HASIL DAN PEMBAHASAN... 6
Spektrum Absorpsi Standar dan Contoh... 6
Pencarian Kondisi Optimum... 7
Pengukuran dengan Metode SDUV... 9
Pengukuran dengan Metode Kromatografi Cair Kinerja Tinggi (KCKT)... 10
Perbandingan antara Metode SDUV dan Metode KCKT... 10
Validasi Metode... 11
SIMPULAN DAN SARAN... 12
Simpulan ... 12
Saran ... 12
DAFTAR PUSTAKA ... 12
DAFTAR GAMBAR
Halaman
1 Kulit kina (C. Succirubra) ... 2
2 Struktur kuinina ... 2
3 Spektrum derivatif ... 4
4 Spektrum serapan standar kuinina (hitam) dan contoh obat (biru)... 7
5 Spektrum serapan standar kuinina (hitam) dan contoh kulit kina (biru)... 7
6 Spektrum serapan standar kuinina dengan berbagai tingkat kecepatan penyapuan pada turunan ke-0 ... 7
7 Spektrum serapan standar kuinina dengan berbagai tingkat kecepatan penyapuan pada turunan ke-1... 7
8 Spektrum serapan standar kuinina ( ) dan obat ( ) pada turunan ke-0 (a) dan ke-1 (b)... 8
9 Spektrum serapan standar kuinina ( )dan kulit kina ( ) pada turunan ke-0 (a), ke-1 (b), dan ke-2 (c) ... 8
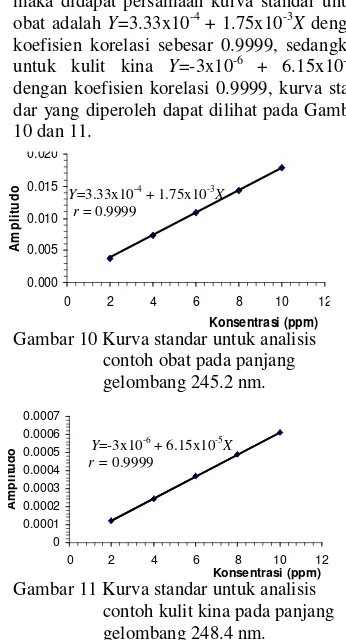
10 Kurva standar untuk analisis contoh obat pada panjang gelombang 245.2 nm ... 9
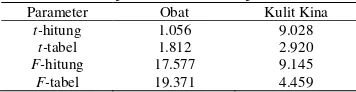
11 Kurva standar untuk analisis contoh kulit kina pada panjang gelombang 248.4 nm 9 12 Kurva standar dengan metode KCKT (detektor UV =280 nm) ... 10
13 Kurva standar kuinina untuk obat pada penentuan linearitas ... 11
14 Kurva standar kuinina untuk kulit kina pada penentuan linearitas ... 11
DAFTAR TABEL
Halaman 1 Kondisi optimum metode SDUV... 92 Waktu retensi dan luas puncak pada analisis KCKT ... 10
3 Hasil uji t-Student dan uji F ... 10
4 Kadar kuinina dalam contoh pada penentuan %SBR ... 11
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 15
2 Amplitudo standar pada analisis kuinina dengan metode SDUV ... 16
3 Penentuan kadar kuinina dengan metode SDUV... 18
4 Kromatogram standar kuinina konsentrasi a. 10 ppm; b. 20 ppm; c. 30 ppm ... 19
5 Kromatogram obat Quinine Tablet Salut® pada konsentrasi 24 ppm a. ulangan 1; b. ulangan 2; c. ulangan 3... 20
6 Kromatogram contoh kulit kina pada konsentrasi 12 ppm a. ulangan 1; b. ulangan 2; c. ulangan 3... 21
7 Penentuan kadar kuinina dengan metode KCKT... 22
8 Penentuan uji t-Student dan uji F ... 23
9 Penentuan simpangan baku relatif ... 25
10 Penentuan linearitas ... 26
11 Penentuan akurasi ... 27
PENDAHULUAN
Penemuan obat-obat baru terus berkem- bang sehingga komponen aktif dari obat-obat itu perlu diketahui kadarnya agar kualitas, keamanan, dan khasiat dari suatu obat atau sediaan farmasi terjamin. Secara tradisional penentuan komponen kimia dalam sediaan farmasi dilakukan dengan cara “kimia basah” atau wet chemistry yang akan memakan banyak waktu, tenaga, dan bahan kimia. Oleh karena itu, dibutuhkan suatu metode analisis baru yang lebih cepat, mudah, dan lebih murah.
Saat ini telah banyak dikembangkan metode-metode analisis yang cepat, mudah, dan murah dari kombinasi teknik spektroskopi seperti spektroskopi UV (analisis basah) dengan metode kemometrik (analisis kering/ data kimia). Teknik gabungan ini telah banyak digunakan untuk analisis, karakterisasi, dan kontrol kualitas dalam bidang pertanian, farmasi, dan biomedis (Wang & Asgharnejad 2000; Kazemipour et al. 2002). Salah satu teknik yang berkembang ialah spektrofoto- metri derivatif.
Teknik spektrofotometri derivatif ultra-violet (SDUV) menawarkan beberapa keuntungan dibandingkan dengan spektrofoto- metri UV konvensional seperti dapat memilih puncak yang tajam di antara spektrum yang lebar dan meningkatkan resolusi dari spektrum yang tumpang tindih. Metode ini juga dapat menghasilkan daerah sidik jari yang lebih baik dibandingkan dengan spektrum absorpsi yang umum (Hassan 2000; El Gindy 2000; Surekha & Jain 2000; Raggi
et al. 2000; Karpinska et al. 1998, diacu dalam Ansari et al. 2004). Spektrofotometri derivatif UV yang dikombinasikan dengan teknik zero crossing untuk teknik pemrosesan data telah banyak digunakan untuk analisis kuantitatif pada formulasi obat (Uslu & Ozkan 2002).
Salah satu komponen aktif dalam obat/ sediaan farmasi adalah alkaloid seperti kuinina, yaitu alkaloid yang berasal dari pohon Cinchona. Banyak teknik yang dapat digunakan untuk menganalisis kuinina. Sawyer et al. (1984) menggunakan teknik spektrofluorometri, Babaloa et al. (1993) menggunakan teknik kromatografi cair kinerja tinggi (KCKT), dan Saad et al. (2001) menggunakan teknik potensiometri. Teknik KCKT membutuhkan peralatan yang cukup mahal serta waktu analisis yang relatif lama, sedangkan teknik potensiometri umumnya membutuhkan waktu yang lama dan gangguan
elektrokimia dari senyawa lain yang terdapat pada contoh yang dianalisis.
Dalam penelitian ini, dilakukan kuan-tifikasi kuinina dalam sediaan farmasi dan kulit kina secara spektrofotometri derivatif UV. Data yang diperoleh dibandingkan dengan metode referensi yang umum digunakan oleh perusahaan farmasi dalam menganalisis kuinina untuk melihat keakuratan metode yang dikembangkan. Menurut US Pharmacopeia (2003), kuinina dianalisis dengan menggunakan metode kromatografi cair kinerja tinggi (KCKT).
Penelitian ini bertujuan mengembangkan metode analisis yang cepat, mudah, dan murah untuk kuantifikasi kuinina dalam sediaan farmasi dan kulit kina secara spektrofotometri derivatif UV. Metode yang dikembangkan diharapkan dapat digunakan sebagai metode alternatif bagi kalangan industri farmasi dan jamu.
Pengembangan metode baru ini penting karena dapat menghemat tenaga, biaya, dan waktu. Dengan dikembangkannya metode ini, analisis untuk mengetahui kadar komponen aktif dalam sediaan farmasi dapat lebih mudah dilakukan sehingga kualitas, keamanan, dan khasiat dari sediaan farmasi dapat terjaga.
TINJAUAN PUSTAKA
Sediaan Farmasi2
Contoh sediaan farmasi yang akan digunakan dalam penelitian ini adalah Quinine Tablet Salut® yang mengandung kuinina sulfat ((C20H24N2O2)2.H2SO4). Obat ini termasuk dalam sediaan farmasi bentuk tablet dan diproduksi oleh PT Kimia Farma. Kuinina sulfat biasanya digunakan sebagai obat anti malaria yang disebabkan oleh
Plasmodium Falciparum yang resisten (Bagian Farmakologi FKUI 1995).
Kina
Kina merupakan tanaman tropis yang berasal dari Amerika Selatan. Terdapat sekitar 35 jenis alkaloid dalam tanaman kina, alkaloid yang paling banyak adalah alkaloid kuinolina (McCalley 2002; Verpoorte 1994; Wijnsma et al. 1988, diacu dalam Gatti et al. 2004). Ada empat jenis alkaloid kuinolina yang ber-manfaat dalam bidang klinis, yaitu kuinina, kuinidin, sinkonin, dan sinkonidin (Bagian Farmakologi FKUI 1995).
Tanaman ini memiliki beberapa jenis spesies. Di antara berbagai jenis tanaman kina, jenis Cinchona succirubra merupakan jenis kina yang paling tinggi kandungan kuininanya, yaitu sekitar 4-14% (Taylor 2005). Bentuk fisik kulit kina dapat dilihat pada Gambar 1.
Klasifikasi tanaman kina menurut Tjitrosoepomo (1994) adalah sebagai berikut: Divisi : Spermatophyta
Sub Divisi : Angiospermae Kelas : Dikotiledonae Suku : Rubiaceae Genus : Cinchona
Spesies : Cinchonasuccirubra.
Gambar 1 Kulit kina (C. succirubra).
Kuinina
Kuinina termasuk dalam senyawa alkaloid, yaitu senyawa bersifat basa yang mengandung satu atau lebih atom nitrogen, biasanya dalam gabungan sebagai bagian dari sistem siklik (Harborne 1987). Kuinina atau dikenal dengan nama kina termasuk dalam golongan kuinolina dan merupakan alkaloid penting yang diperoleh dari pohon Cinchona. Alkaloid ini telah berabad-abad digunakan oleh
penduduk asli di Amerika Selatan sebagai obat tradisional (Bagian Farmakologi FKUI 1995). Sejak kuinina bisa disintesis, peng-gunaannya secara ilmiah berkembang dengan pesat tetapi cara pembuatannya sulit dan mahal sehingga sumber alam masih tetap dipertahankan.
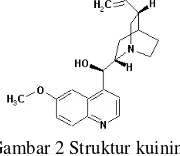
Senyawa ini mengandung gugus kuinolina yang terikat pada cincin kuinuklidin melalui ikatan alkohol sekunder, selain itu juga mengandung rantai samping –metoksi dan –vinil. Struktur kuinina sama dengan kuinidin kecuali konfigurasi sterik alkohol sekun-dernya (Bagian Farmakologi FKUI 1995). Struktur dari kuinina dapat dilihat pada Gambar 2.
Gambar 2 Struktur kuinina.
Kuinina digunakan untuk terapi malaria yang disebabkan oleh P. falciparum yang resisten, dan dianjurkan digunakan bersama antimalaria lain karena obat ini kurang efektif dan lebih toksik daripada antimalaria sintetik (Bagian Farmakologi FKUI 1995). Efek samping dari kuinina ini adalah dapat menyebabkan sinkonisme dengan gejala sakit kepala, gangguan pendengaran, pandangan kabur, diare, dan mual.
Spektrofotometri
Spektrofotometri adalah metode pengukur-an ypengukur-ang didasarkpengukur-an pada interaksi cahaya dengan materi (Hendayana et al. 1994). Metode ini dapat dianggap sebagai perluasan suatu pemeriksaan visual yang lebih men-dalam dari absorpsi energi radiasi oleh macam-macam zat kimia sehingga dapat dilakukan pengukuran kuantitatifnya dengan ketelitian yang lebih besar (Day & Underwood 2002). Penyerapan sinar tampak dan ultraviolet oleh suatu molekul akan menghasilkan transisi di antara tingkat energi elektronik molekul tersebut. Transisi tersebut pada umumnya antara orbital ikatan dan orbital antiikatan (Sudjadi 1985).
3
yang diserap, frekuensi (v), dan panjang gelombang ( ) adalah
λ
c h v h
E= × = ×
Keterangan:
h : tetapan Planck (6,63 x 10-34 J detik)
v
: frekuensi (detik)c
: kecepatan cahaya (3 x 108 m/detik).λ : panjang gelombang (nm)
Daerah spektrum ultraviolet (UV) terletak pada panjang gelombang 200-380 nm (Harris & Bashford 1987). Hukum Lambert-Beer merupakan hukum empiris yang merumuskan tentang intensitas serapan. Hukum ini menyatakan bahwa, fraksi penyerapan sinar tidak tergantung dari intensitas sumber cahaya tetapi sebanding dengan jumlah molekul yang menyerap. Dari hukum Lambert-Beer dapat diketahui hubungan antara absorbansi, tebal cuplikan, dan konsentrasi. Hubungannya dirumuskan sebagai berikut:
A b c I Io
Log =ε =
Keterangan:
Io : intensitas sinar awal
I : intensitas sinar yang diteruskan
ε : absorptivitas molar
c
: konsentrasib : tebal cuplikan
A : serapan atau absorbansi
Spektrofotometri Derivatif UV
Spektrofotometri derivatif UV adalah teknik yang berguna untuk mendapatkan informasi kualitatif dan kuantitatif dari spektrum yang memiliki pita yang tidak terpisah/ tumpang tindih (Aydogmus et al.
2002). Spektrofotometri derivatif telah di-gunakan secara luas sebagai alat untuk analisis kuantitatif, karakterisasi, dan kontrol kualitas di bidang pertanian, farmasi, dan biomedis (Wang & Asgharnejad 2000; Kazemipour et al. 2002). Menurut O’Haver (1979), spektrofotometri derivatif menawar-kan pendekatan alternatif yang sederhana untuk perbaikan sensitivitas dan spesifisitas dalam kimia klinis.
Teknik spektrofotometri derivatif UV menawarkan beberapa keuntungan diban-dingkan dengan spektrofotometri UV konvensional seperti dapat memilih puncak yang tajam di antara spektrum yang lebar dan meningkatkan resolusi dari spektrum yang tumpang tindih. Metode ini juga dapat
menghasilkan daerah sidik jari (fingerprint)
yang lebih baik dibandingkan dengan spektrum absorpsi yang umum (Hassan 2000; El Gindy 2000; Surekha & Jain 2000; Raggi
et al. 2000; Karpinska et al. 1998, diacu dalam Ansari et al. 2004). Spektrofotometri derivatif UV yang dikombinasikan dengan teknik zero crossing untuk teknik pemrosesan data telah banyak digunakan untuk analisis kuantitatif pada formulasi obat (Uslu & Ozkan 2002).
Metode matematika, optik, dan elektronik dapat digunakan untuk menghasilkan spek-trum derivatif, akan tetapi yang lebih sering digunakan untuk menurunkan spektrum adalah metode matematika. Perubahan spek-trum UV-tampak menjadi turunannya seringkali menghasilkan profile yang lebih kompleks daripada spektrum aslinya, infor-masi yang terkandung tidak bertambah akan tetapi mungkin berkurang karena kehilangan data (Owen 1996). Efek yang tidak diinginkan dari proses derivatisasi adalah penurunan
signal to noise ratio (S/N) karena noise akan selalu ada dalam spektrum (Owen 1996). Teknik penghalusan spektrum dapat diguna-kan untuk mengurangi penurunan S/N adiguna-kan tetapi penggunaannya harus hati-hati karena jika terlalu tinggi derajat smoothing/ pengha-lusan yang digunakan akan mendistorsi spektrum derivatif.
Spektrum digambarkan sebagai absorbansi dan merupakan fungsi dari panjang gelom-bang, spektrum turunannya adalah
Turunan Ke-0 : A= f(λ)
Turunan Ke-1 : '(λ)
λ f
d dA
=
Turunan Ke-2 : 2 "( )
2 λ λ f d A d =
Sebagai contoh, untuk mendapatkan turunan pertama dari spektrum aslinya dapat digunakan persamaan sebagai berikut:
1 2 1 2 λ λ λ − − = A A
d dA
Dalam turunan pertama, nilainya dimulai dan berakhir pada nilai nol, melewati nol pada panjang gelombang yang sama sebagai λmax dari pita absorbansi. Untuk lebih jelasnya dapat dilihat pada pada Gambar 3.
4
Gambar 3 Spektrum derivatif.
Konsentrasi analat sebanding dengan absorbansi pada panjang gelombang yang sesuai. Dalam spektrofotometri derivatif, konsentrasi analat sebanding dengan ampli-tudo dari puncak turunan ke-n pada panjang gelombang yang sesuai. Pengukuran ampli-tudo puncak derivatif dapat diukur dari garis nol (Dz), dengan lintasan puncak yang lebih panjang (DL) atau lebih pendek (Ds).
Kromatografi Cair Kinerja Tinggi (KCKT)
Kromatografi cair kinerja tinggi (KCKT) merupakan pengembangan dari kromatografi cair, dan banyak digunakan untuk teknik pemisahan analitik. Sistem ini menggunakan pompa bertekanan tinggi dan detektor yang sensitif. Metode ini banyak digunakan karena memiliki beberapa keuntungan seperti sensitif, dapat digunakan untuk analisis kuantitatif, dapat digunakan untuk senyawa yang mudah menguap (atsiri), dan hasil yang didapatkan akurat (Skoog et al. 1998).
Komponen utama dalam KCKT ini adalah sistem pompa, tempat penyuntikan analat, kolom kromatografi, detektor, penguat sinyal, dan perekam. Bentuk KCKT yang paling banyak digunakan adalah penukar ion, partisi, dan adsorpsi (USP 2003).
Dalam kromatografi partisi digunakan fase gerak dan fase diam dengan polaritas yang berbeda. Jika fase gerak bersifat polar, dan fase diam bersifat nonpolar maka disebut kromatografi fase balik (reverse phase). Jika sebaliknya fase gerak bersifat nonpolar, sedangkan fase diamnya polar disebut fase normal (normal phase).
Untuk keperluan analisis kuantitatif, digunakan istilah respons puncak. Istilah ini mencakup luas puncak, tinggi puncak serta pengukuran elektronik lainnya. Tinggi puncak mudah diukur, akan tetapi sangat dipengaruhi perubahan waktu retensi yang disebabkan oleh variasi suhu dan komposisi pelarut. Parameter yang lebih akurat dalam analisis kuantitatif adalah luas puncak (USP 2003).
Validasi Metode Analisis
Validasi metode adalah proses penetapan dan evaluasi unjuk kerja sebuah metode analisis sesuai cara-cara yang ditentukan oleh konsensus bersama organisasi internasional seperti AOAC (Garfield 1992). Beberapa parameter yang diukur pada validasi metode adalah presisi, limit deteksi, limit kuantitasi, linearitas, dan akurasi. Validasi metode berguna untuk mengevaluasi unjuk kerja suatu metode analisis.
Presisi
Presisi menurut ICH (International Certified Harmonization) dalam Chan (2004) adalah kedekatan antara seri pengukuran yang berasal dari banyak sampel (multiple sample)
atau kedekatan nilai satu sama lain. Analisis kimia mempunyai presisi tinggi bila nilai-nilai yang diperoleh perbedaannya kecil satu sama lain. Presisi dibagi dua, yaitu ketertiruan (reproducibility) dan keterulangan ( repeat-ibility). Ketertiruan adalah presisi yang dihitung dari hasil penetapan ulangan dengan menggunakan metode yang sama, namun dilakukan oleh operator, peralatan, labora-torium, dan waktu yang berbeda. Keter-ulangan adalah presisi yang diperoleh dari hasil pengulangan dengan menggunakan metode, operator, laboratorium, dan waktu yang sama. Presisi dapat dinyatakan dengan beberapa cara antara lain kisaran, simpangan rata-rata, dan simpangan baku. Menurut SAC-SINGLAS (2002), presisi pada analisis kimia biasanya dinyatakan dalam persen simpangan baku relatif (%SBR).
Keterangan:
n
= Banyaknya ulanganxi
= Nilai hasil analisis = Nilai rata-rata hasil analisis5
Kriteria %SBR menurut AOAC (Asociation Official of Analytical Chemistry) adalah sebagai berikut:
1.Sangat tepat : %SBR <1 2.Tepat : %SBR 1-2 3.Sedang : %SBR 2-5 4.Tidak tepat : %SBR >5
Linearitas
Linearitas menurut ICH dalam Chan (2004) adalah kemampuan untuk men-dapatkan hasil dari variabel data (contohnya absorbans) yang proporsional terhadap konsentrasi dalam contoh. Menurut Owen (1996), linearitas yaitu kemampuan suatu metode untuk mendapatkan hasil yang proporsional baik secara langsung maupun dengan transformasi matematika dari kon-sentrasi analat pada interval konkon-sentrasi tertentu.
Akurasi
Akurasi menurut ICH adalah kedekatan antara nilai yang didapatkan dengan nilai sebenarnya atau nilai referensi (Chan 2004). Suatu analisis disebut teliti bila nilai yang diperoleh dekat dengan nilai teoritis. Akurasi sering dituliskan dengan persen perolehan kembali. Persen perolehan kembali menunjuk-kan besarnya penambahan standar yang mampu diidentifikasi kembali dengan suatu metode.
% Perolehan kembali 100%
3 2
1− ×
= C C C Keterangan: 1
C = Konsentrasi analat dalam contoh yang ditambahkan standar
2
C = Konsentrasi analat dalam contoh
3
C = Konsentrasi standar yang ditambahkan
Limit Deteksi dan Limit Kuantitasi
Limit deteksi adalah konsentrasi terendah dari analat dalam contoh yang dapat ditentukan berbeda nyata secara statistika dari pengukuran blanko (SAC-SINGLAS 2002). Limit deteksi ini penting ditentukan karena apabila contoh yang akan dianalisis konsentrasinya berada di bawah limit deteksi maka keberadaan analat menjadi tidak terukur atau konsentrasi yang diperoleh berbeda dengan kenyataan. Limit kuantitasi adalah konsentrasi analat terendah yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima (Owen 1996).
Limit Deteksi =
s σ × 3 . 3 Limit Kuantitasi s σ × =10 Keterangan:
: Simpangan baku intersep dari kurva standar
s : Kemiringan (slope) dari kurva standar
BAHAN DAN METODE
Bahan dan AlatBahan-bahan yang digunakan adalah etanol, metanol, asam asetat, trietilamina, air bebas ion, akuades, NaOH, standar kuinina sulfat, sampel obat QuinineTabletSalut®, dan kulit kina (Cinchona succirubra).
Peralatan yang digunakan adalah spektrofotometer UV-VIS Hitachi U-2800,
software UV-solutions versi 2 Hitachi,
microsoft excel, peralatan kromatografi cair kinerja tinggi Hitachi L-2000 series, kolom C18, neraca analitik, dan alat-alat kaca lainnya.
Metode Penelitian
Penelitian dilakukan dari bulan Juni 2005 sampai bulan Februari 2006. Penelitian dilaksanakan dalam empat tahapan kerja, yaitu preparasi standar dan contoh, penentuan kondisi optimum, pembuatan kurva standar dan pengukuran contoh, pengukuran dengan metode referensi (KCKT), dan validasi metode. Diagram alir penelitian dapat dilihat pada Lampiran 1.
Preparasi Standar dan Contoh
6
Penentuan Kondisi Optimum
Standar dan contoh yang telah disiapkan kemudian diukur dengan spektrofotometer menggunakan kecepatan penyapuan 100 nm/menit, 200 nm/menit, 400 nm/menit, 800 nm/menit, dan 1200 nm/menit untuk mencari kecepatan penyapuan (scanspeed) yang tepat. Pada spektrum yang didapatkan kemudian dilakukan pencarian orde turunan, orde penghalusan, dan jumlah jendela yang tepat untuk mendapatkan kondisi optimum metode.
Pembuatan Kurva Standar dan Pengukuran Contoh
Dibuat seri larutan standar dengan konsentrasi 2 ppm, 4 ppm, 6 ppm, 8 ppm, dan 10 ppm dari larutan stok standar yang telah disiapkan. Setelah itu standar diukur dengan spektrofotometer. Pada spektrum UV yang didapatkan kemudian dilakukan teknik peng-ukuran amplitudo Ds, Dz, dan DL dan dipilih yang mempunyai linearitas terbaik yang sesuai dengan kondisi optimum yang telah didapatkan. Setelah dibuat kurva standar, di-lakukan pengukuran contoh dengan kondisi yang sama sehingga konsentrasi dari contoh dapat diketahui dengan memasukkan ampli-tudo yang didapatkan pada persamaan kurva standar. Analisis contoh dilakukan sebanyak sembilan kali ulangan.
Pengukuran dengan Metode Referensi (KCKT)
Untuk preparasi contoh, sebanyak 0.0484 gram contoh obat ditimbang lalu dilarutkan dengan 80 ml metanol dan dikocok selama 30 menit. Setelah larut, kemudian ditera dalam labu takar 100 ml dan dilakukan penyaringan. Sebanyak 3 ml contoh obat hasil penyaringan diencerkan dengan fase gerak dalam labu takar 25 ml. Untuk contoh kulit kina ditimbang sebanyak 0.0200 gram kina lalu ditambahkan metanol 40 ml dan NaOH 0.5 ml. Dilakukan ultrasonikasi terhadap contoh selama 20 menit. Setelah itu contoh ditera dalam labu takar 50 ml, kemudian disaring (0.45µm nylon, 25 mm) dan sebanyak 5 ml hasil saringan dilarutkan dengan fase gerak dalam labu takar 10 ml.
Untuk preparasi larutan stok standar, ditimbang sebanyak 0.0115 gram standar kuinina dan dilarutkan dengan menggunakan fase gerak, setelah itu ditera dalam labu takar 100 ml. Dari larutan stok ini, dibuat larutan standar dengan konsentrasi 10 ppm, 20 ppm, dan 30 ppm.
Fase gerak yang digunakan adalah campuran metanol:asam asetat:trietilamin:air
(800:30:10:1160), sedangkan fase diamnya adalah kolom C18. Laju alir yang digunakan 1 ml/menit, volume injeksi 20 µl, dan detektor yang digunakan adalah UV 280 nm.
Validasi Metode
Presisi
Disiapkan contoh obat dan kulit kina dengan konsentrasi setara kuinina 6 ppm, lalu diukur dengan spektrofotometer sebanyak sembilan kali ulangan. Persentase simpangan baku relatif (%SBR) ditentukan untuk melihat presisi metode yang digunakan.
Linearitas
Disiapkan tiga seri kurva standar dengan konsentrasi 2 ppm, 4 ppm, 6 ppm, 8 ppm, dan 10 ppm. Setelah itu dilakukan pengukuran menggunakan spektrofotometer. Linearitas diperoleh dengan metode regresi linear (least square regression method).
Akurasi
Akurasi ditentukan dengan uji persen perolehan kembali. Dibuat larutan stok contoh obat dan kulit kina berturut-turut 100 ppm dan 50 ppm. Sebanyak 0.75 ml stok obat dimasukkan dalam labu takar 25 ml, kemudian dimasukkan masing-masing 0.25 ml, 0.75 ml, dan 1.25 ml stok standar dalam labu tersebut. Penambahan larutan stok standar dilakukan masing-masing tiga kali ulangan. Setelah itu contoh diukur dengan menggunakan spektrofotometer. Untuk contoh kulit kina dilakukan seperti contoh obat, akan tetapi larutan stok kulit kina yang ditambahkan sebanyak 1.5 ml.
Limit Deteksi dan Limit Kuantitasi
Sebanyak tiga seri deret standar dengan konsentrasi 2 ppm, 4 ppm, 6 ppm, 8 ppm, dan 10 ppm diukur dengan menggunakan spektro-fotometer. Limit deteksi dan limit kuantitasi dihitung dari simpangan baku intersep dan rataan kemiringan dari kurva standar.
HASIL DAN PEMBAHASAN
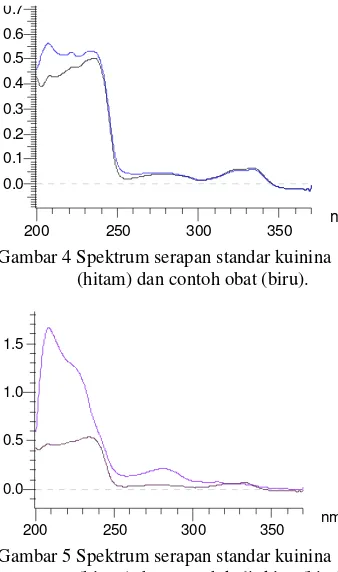
Spektrum Absorpsi Standar dan Contoh7
memberikan serapan pada spektrum yang dihasilkan. Hal ini dapat dilihat dari spektrum yang dihasilkan (Gambar 4 dan 5). Dengan menggunakan konsentrasi setara kuinina yang sama antara standar dan contoh, yaitu 6 ppm, terlihat bahwa spektrum contoh memiliki serapan lebih besar dibandingkan serapan standar. Efek serapan dari senyawa lain penyusun contoh ini merupakan kelemahan dari spektrofotometri konvensional.
200 250 300 350
nm 0.0
0.1 0.2 0.3 0.4 0.5 0.6 0.7
Gambar 4 Spektrum serapan standar kuinina (hitam) dan contoh obat (biru).
200 250 300 350
nm 0.0
0.5 1.0 1.5
Gambar 5 Spektrum serapan standar kuinina (hitam) dan contoh kulit kina (biru).
Kelemahan spektrofotometri konvensional ini dapat diatasi dengan cara melakukan derivatisasi spektrum. Dengan menggunakan metode spektrofotometri derivatif ultraviolet (SDUV), spektrum akan diderivatisasi sehingga dapat memilih puncak yang tajam diantara spektrum yang lebar dan meningkatkan resolusi dari spektrum yang tumpang tindih. Metode ini juga dapat menghasilkan daerah sidik jari (fingerprint)
yang lebih baik dibandingkan dengan spektrum absorpsi yang umum (Hassan 2000; El Gindy 2000; Surekha & Jain 2000; Raggi
et al 2000; Karpinska et al 1998, diacu dalam Ansari et al. 2004).
Pencarian Kondisi Optimum
Kondisi optimum metode perlu dicari sebelum menentukan kadar kuinina dalam contoh. Pencarian kondisi optimum metode meliputi pencarian kecepatan penyapuan (scan speed), orde turunan (derivative order),
orde penghalusan (smoothing order), dan jumlah jendela (number of point).
200 250 300 350
nm 0.0
0.1 0.2 0.3 0.4 0.5 0.6
Gambar 6 Spektrum serapan standar kuinina dengan berbagai tingkat kecepatan penyapuan pada turunan ke-0.
200 250 300 350 nm
-0.040 -0.035 -0.030 -0.025 -0.020 -0.015 -0.010 -0.005 0.000 0.005 0.010
Gambar 7 Spektrum serapan standar kuinina dengan berbagai tingkat kecepatan penyapuan pada turunan ke-1. Keterangan: ( ) 100 nm/ menit
( ) 200 nm/ menit ( ) 400 nm/ menit ( ) 800 nm/ menit ( ) 1200 nm/ menit
Parameter pertama yang dicari dalam penentuan kondisi optimum metode adalah kecepatan penyapuan (scan speed). Contoh dan standar dengan konsentrasi setara kuinina yang sama, yaitu 6 ppm diukur menggunakan spektrofotometer dengan kecepatan penya-puan 100 nm/menit, 200 nm/menit, 400 nm/menit, 800 nm/menit, dan 1200 nm/menit. Pengukuran dilakukan pada kisaran panjang gelombang 200-370 nm.
8
200 250 300 350
nm 0.0
0.1 0.2 0.3 0.4 0.5 0.6 0.7
200 250 300 350
nm -0.010
-0.005 0.000 0.005
200 250 300 350
nm 0.0
0.5 1.0 1.5
200 250 300 350
nm -0.01
0.00 0.01 0.02 0.03 0.04
200 250 300 350
nm -0.0015
-0.0010 -0.0005 0.0000 0.0005 0.0010 0.0015
spektrum diderivatisasi maka akan terlihat perbedaannya (Gambar 6 dan 7). Semakin tinggi tingkat kecepatan penyapuan yang dilakukan maka puncak yang dihasilkan akan semakin lebar. Hal ini tidak diinginkan karena hasil analisis menjadi tidak akurat. Pelebaran puncak ini terjadi karena semakin tinggi tingkat kecepatan penyapuan maka kisaran jumlah data yang harus diolah semakin banyak, sehingga bentuk puncak setelah diturunkan akan semakin lebar.
Kecepatan penyapuan yang dipilih untuk pengukuran kadar kuinina dalam obat dan
kulit kina adalah 200 nm/menit. Pemilihan ini berdasarkan pada sensitivitas dari spektrum yang dihasilkan. Spektrum yang dihasilkan dengan kecepatan penyapuan 400 nm/menit, 800 nm/menit,dan 1200 nm/menit terlalu halus, hal ini tidak diinginkan karena dengan spektrum yang terlalu halus data yang ada akan berkurang. Kecepatan penyapuan 100 nm/menit tidak digunakan karena memiliki sensitivitas yang sama dengan kecepatan penyapuan 200 nm/ menit, tetapi waktu yang dibutuhkan untuk melakukan pengukuran lebih lama.
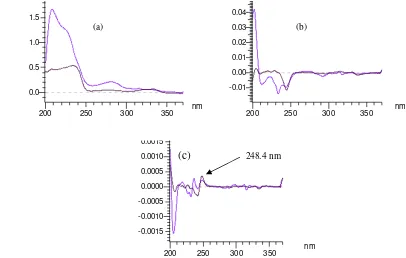
(a) (b)
245.2 nm
Gambar 8 Spektrum serapan standar kuinina ( ) dan obat ( )pada turunan ke-0 (a) dan ke-1 (b).
(a) (b)
(c)
248.4 nm
9
0 0.0001 0.0002 0.0003 0.0004 0.0005 0.0006 0.00070 2 4 6 8 10 12
Konsentrasi (ppm) A m p li tu d o 0.000 0.005 0.010 0.015 0.020
0 2 4 6 8 10 12
Konsentrasi (ppm) A m p li tu d o
Orde turunan berpengaruh terhadap sensitivitas dan linearitas spektrum. Semakin tinggi orde turunan yang digunakan, maka sensitivitas dan linearitas dari spektrum akan semakin rendah (Ansari et al. 2004). Selain penurunan sensitivitas dan linearitas, semakin tinggi orde turunan yang dilakukan maka gangguan dari noise alat akan semakin tinggi. Spektrum dengan orde turunan ke-0 atau spektrum asli hasil pengukuran obat dan kulit kina memiliki puncak yang bertumpang tindih. Dengan melakukan derivatisasi, pun-cak yang bertumpang tindih dapat dipisahkan (Gambar 8 dan 9).
Orde turunan yang dipilih untuk contoh obat adalah orde turunan ke-1, sedangkan untuk contoh kulit kina orde turunan ke-2. Orde turunan itu dipilih karena terdapat puncak yang berimpit antara spektrum standar dengan spektrum contoh. Hal ini menandakan bahwa, efek matriks dari contoh pada konsentrasi zat aktif (kuinina) yang sama telah hilang dan diduga itu adalah serapan dari kuinina.
Persamaan regresi linier diperoleh dari larutan standar dengan konsentrasi 2 ppm, 4 ppm, 6 ppm, 8 ppm, dan 10 ppm. Kisaran konsentrasi ini memberikan linearitas yang baik untuk pengukuran kuinina. Pada panjang gelombang 245.2 nm (obat) dan panjang gelombang 248.4 (kulit kina) terlihat puncak yang berimpit antara standar dan contoh, pada panjang gelombang inilah akan dihitung amplitudo dari standar dan contoh. Amplitudo merupakan respon yang terukur, amplitudo yang digunakan adalah Dz, yaitu amplitudo yang diukur dari garis nol.
Semakin tinggi tingkat orde turunan yang dilakukan maka akan terjadi penurunan signal to noise ratio (S/N). Untuk mengatasi hal ini maka diperlukan suatu teknik untuk memper-tahankan signal to noise ratio (S/N). Teknik yang dilakukan adalah dengan melakukan proses penghalusan. Teknik ini meliputi orde penghalusan dan jumlah jendela, keduanya mempengaruhi besarnya amplitudo dari spek-trum. Semakin tinggi orde penghalusan yang digunakan maka amplitudo akan semakin besar, sedangkan semakin besar jumlah jende-la yang digunakan maka amplitudo akan semakin kecil, hal ini terjadi karena semakin banyak data yang harus diolah untuk menghaluskan spektrum. Besarnya amplitudo dari standar dapat dilihat pada Lampiran 2.
Kondisi optimum yang dipilih diharapkan dapat menghasilkan spektrum yang tidak terlalu halus dan juga tidak terlalu kasar. Jika spektrum terlalu kasar maka sulit sekali untuk
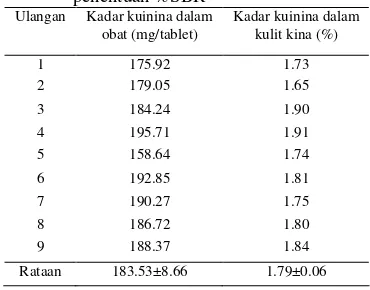
membedakan serapan kuinina dari serapan matriks contoh. Akan tetapi, jika spektrum terlalu halus maka akan ada data yang hilang akibat distorsi spektrum. Kondisi optimum untuk tiap contoh akan berbeda, hal ini terjadi karena perbedaan matriks atau senyawa penyusun dari contoh. Kondisi optimum yang dipilih dapat dilihat pada Tabel 1.
Tabel 1 Kondisi optimum metode SDUV
Parameter Obat Kulit Kina
Kecepatan penyapuan 200 200
Orde turunan 1 2
Orde penghalusan 2 3
Jumlah jendela 19 31
Panjang gelombang ( ) 245.2 nm 248.4 nm
Pengukuran dengan Metode SDUV
Dengan melakukan derivatisasi pada spek-trum standar sesuai dengan kondisi optimum, maka didapat persamaan kurva standar untuk obat adalah Y=3.33x10-4 + 1.75x10-3X dengan koefisien korelasi sebesar 0.9999, sedangkan untuk kulit kina Y=-3x10-6 + 6.15x10-5X
dengan koefisien korelasi 0.9999, kurva stan-dar yang diperoleh dapat dilihat pada Gambar 10 dan 11.
Y=3.33x10-4
+ 1.75x10-3
X r = 0.9999
Gambar 10 Kurva standar untuk analisis contoh obat pada panjang gelombang 245.2 nm.
Y=-3x10-6
+ 6.15x10-5
X
r = 0.9999
Gambar 11 Kurva standar untuk analisis contoh kulit kina pada panjang gelombang 248.4 nm.
10
0 200000 400000 600000 800000 1000000 1200000 14000000 10 20 30 40
Konsentrasi (ppm) L u a s a re a
dan 1.87±0.06% untuk kulit kina, hasil tersebut merupakan rerata dari sembilan kali ulangan.
Pengukuran dengan Metode Kromatografi Cair Kinerja Tinggi (KCKT)
KCKT merupakan metode referensi yang digunakan dalam penelitian ini. Metode ini dapat digunakan untuk analisis kualitatif maupun kuantitatif. Untuk analisis kualitatif dilakukan dengan cara membandingkan waktu retensi contoh dengan standar, sedangkan untuk analisis kuantitatif dilakukan dengan menghitung konsentrasi contoh berdasarkan kurva standar yang diperoleh dari hasil plot antara luas puncak dengan konsentrasi standar. Sistem KCKT yang digunakan dalam penelitian ini adalah sistem fase terbalik, yang berarti fase diam yang digunakan bersifat non- polar, sedangkan fase geraknya bersifat polar. Kolom C18 digunakan sebagai fase diam, dan fase geraknya adalah campuran metanol:asam asetat:trietilamin:air (800:30:10:1160). Sistem elusi yang digunakan isokratik dengan laju alir 1 ml/menit, volume injeksi 20 µl, dan detektor UV 280 nm.
Standar dibuat dengan konsentrasi 10 ppm, 20 ppm, dan 30 ppm, sedangkan contoh dibuat dengan konsentrasi setara kuinina 24 ppm untuk obat dan 12 ppm untuk kulit kina dengan melarutkannya dalam fase gerak. Setelah itu masing-masing contoh dianalisis sebanyak tiga kali ulangan. Waktu retensi dan luas puncak standar dan contoh dapat di lihat pada Tabel 2, sedangkan kromatogramnya pada Lampiran 4, 5, dan 6.
Tabel 2 Waktu retensi dan luas puncak pada analisis KCKT
Contoh Waktu
retensi (mnt)
Luas puncak
Standar 10 ppm 5.447 397711
Standar 20 ppm 5.440 807911
Standar 30 ppm 5.437 1198343 Obat ulangan 1 5.447 989434 ulangan 2 5.453 946207 ulangan 3 5.457 992613 Kulit kina ulangan 1 5.443 241401 ulangan 2 5.453 250858 ulangan 3 5.460 280891
Setelah dilakukan analisis, dapat diketahui bahwa waktu retensi kuinina adalah 5.4 menit. Hal ini diperoleh dengan membandingkan puncak yang diperoleh antara standar dan contoh.
Y=689.67 + 40031.60X
r = 0.9999
Gambar 12 Kurva standar dengan metode KCKT (detektor UV =280 nm).
Dengan menggunakan metode regresi linier antara luas puncak dan konsentrasi didapat persamaan kurva standar Y = 689.67 + 40031.60X dengan koefisien korelasi sebesar 0.9999. Kurva standar yang diperoleh dapat dilihat pada Gambar 12. Kadar kuinina contoh dapat diperoleh dengan memasukkan luas puncak yang didapat pada persamaan di atas (Lampiran 7). Kadar kuinina yang diperoleh sebesar 167.00±11.41 mg/tablet untuk obat dan 3.17±0.61% untuk kulit kina, hasil ini merupakan rata-rata dari tiga kali ulangan.
Perbandingan antara Metode SDUV dan Metode KCKT
Metode SDUV merupakan metode yang cepat, murah, dan mudah bila dibandingkan dengan metode KCKT. Dalam metode SDUV tidak perlu dilakukan proses ekstraksi contoh terlebih dahulu, sehingga waktu analisis tidak terlalu lama. Selain itu, dalam metode SDUV tidak terlalu banyak menggunakan bahan kimia dan tahapan kerjanya tidak rumit, sehingga metode ini lebih murah dan mudah. Teknik KCKT membutuhkan peralatan yang cukup mahal, waktu analisis yang relatif lama, dan biasanya prosedur yang digunakan relatif rumit.
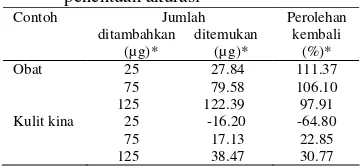
Hasil Pengukuran kadar kuinina metode SDUV dibandingkan dengan metode KCKT menggunakan uji statistika yaitu uji t-Student dan uji F. Hasil yang didapatkan untuk contoh obat dengan metode SDUV tidak berbeda nyata dengan hasil metode KCKT, sedangkan untuk contoh kulit kina hasil yang didapatkan berbeda nyata. Hal itu terlihat dari hasil uji
t-Student dan uji F (Tabel 3).
Tabel 3 Hasil uji t-Student dan uji F
Parameter Obat Kulit Kina
t-hitung 1.056 9.028
t-tabel 1.812 2.920
F-hitung 17.577 9.145
11
0 0.0001 0.0002 0.0003 0.0004 0.0005 0.0006 0.0007 0.00080 2 4 6 8 10 12
Konsentrasi (ppm) A m p li tu d o 0.000 0.005 0.010 0.015 0.020 0.025
0 2 4 6 8 10 12
Konsentrasi (ppm) A m p li tu d o
Berdasarkan Tabel 3 nilai t-hitung dan
F-hitung untuk obat lebih kecil daripada t-tabel dan F-tabel pada selang kepercayaan 95%, sehingga dikatakan tidak berbeda nyata. Hasil ini berarti bahwa pada analisis obat kedua metode mempunyai efektivitas, efisiensi, dan keragaman yang sama. Untuk kulit kina nilai
t-hitung dan F-hitung lebih besar dari nilai
t-tabel dan F-tabel pada selang kepercayaan 95%, hasil ini menyatakan bahwa keduanya berbeda nyata. Penentuan uji uji t-Student dan uji F dapat dilihat pada Lampiran 8.
Perbedaan hasil yang didapatkan pada analisis kulit kina terjadi karena pada analisis dengan menggunakan metode KCKT dilaku-kan proses ekstraksi terlebih dahulu untuk mendapatkan kuinina, sedangkan pada analisis dengan metode SDUV tidak dilakukan proses ekstraksi. Untuk analisis obat, proses yang digunakan cenderung sama antara metode KCKT dan metode SDUV.
Validasi Metode
Validasi metode dilakukan untuk mengevaluasi unjuk kerja metode analisis yang digunakan, yaitu metode SDUV. Valid-asi metode ini perlu dilakukan karena metode SDUV merupakan metode baru yang dikem-bangkan untuk analisis kuantitatif kuinina. Beberapa parameter yang dilakukan adalah pengukuran presisi, linearitas, akurasi, limit deteksi, dan limit kuantitasi.
Penentuan presisi yang dilakukan adalah keterulangan (intraday repeatibility), yaitu presisi yang diperoleh dari hasil pengulangan dengan menggunakan metode, operator, labo-ratorium dan waktu yang sama. Presisi dila-kukan dengan menghitung nilai simpangan baku relatif (%SBR). Pengukuran contoh dilakukan sebanyak sembilan kali ulangan. Hasil yang didapatkan bisa dilihat dalam Tabel 4.
Berdasarkan Tabel 4 maka %SBR yang didapatkan untuk obat adalah 6.13%, sedang-kan untuk kulit kina 4.68%. Penentuan %SBR dapat dilihat dalam Lampiran 9. Hasil yang didapatkan untuk obat termasuk dalam kate-gori tidak tepat menurut AOAC karena nilai yang didapatkan lebih besar dari 5%, sedangkan untuk kulit kina masuk dalam kategori sedang. Besarnya %SBR yang didapatkan bisa terjadi karena metode SDUV tidak dapat menghasilkan keterulangan pengu-kuran yang baik, dan bisa juga terjadi karena kesalahan pada saat preparasi.
Tabel 4 Kadar kuinina dalam contoh pada penentuan %SBR
Ulangan Kadar kuinina dalam obat (mg/tablet)
Kadar kuinina dalam kulit kina (%)
1 175.92 1.73
2 179.05 1.65
3 184.24 1.90
4 195.71 1.91
5 158.64 1.74
6 192.85 1.81
7 190.27 1.75
8 186.72 1.80
9 188.37 1.84
Rataan 183.53±8.66 1.79±0.06
Konsentrasi standar yang dibuat untuk pengukuran linearitas adalah 2 ppm, 4 ppm, 6 ppm, 8 ppm, dan 10 ppm. Pengukuran linearitas dilakukan sebanyak tiga kali ulangan, kemudian spektrum yang didapatkan diderivatisasi sesuai dengan kondisi optimum tiap contoh. Persamaan regresi yang didapat
Y = 1.5x10-4 + 2.015x10-3X untuk obat dan Y = -7x10-6 + 6.75x10-5X untuk kulit kina, dengan koefisien korelasi yang didapatkan cukup besar yaitu 0.9999 hasil rata-rata dari tiga kali ulangan untuk kedua contoh. Hasil ini menunjukkan bahwa metode SDUV mampu mendapatkan hasil uji yang proporsional terhadap konsentrasi kuinina dalam contoh. Kurva standar penentuan linearitas dapat di lihat pada Gambar 13 dan Gambar 14, sedangkan perhitungannya dapat di lihat pada Lampiran 10.
Y = 1.5x10-4
+ 2.015x10-3
X r = 0.9999
Gambar 13 Kurva standar kuinina untuk obat pada penentuan linearitas.
Y = -7x10-6
+ 6.75x10-5
X
r = 0.9999
12
Akurasi sering dituliskan dengan persen perolehan kembali (percentrecovery). Persen perolehan kembali menunjukkan besarnya penambahan standar yang mampu diiden-tifikasi kembali dengan suatu metode. Penentuan akurasi dapat dilihat pada Lampiran 11.
Berdasarkan Tabel 5, besarnya nilai perolehan kembali untuk obat berkisar antara 97.91%-111.37%, sedangkan untuk kulit kina sangat kecil yaitu -64.80%-30.77%. Nilai perolehan kembali yang kecil menunjukkan besarnya pengaruh matriks dalam contoh, sehingga mempengaruhi pembacaan alat ter-hadap analat.
Tabel 5 Data perolehan kembali pada penentuan akurasi
Contoh Jumlah ditambahkan ditemukan (µg)* (µg)*
Perolehan kembali
(%)* Obat 25 27.84 111.37
75 79.58 106.10 125 122.39 97.91 Kulit kina 25 -16.20 -64.80 75 17.13 22.85 125 38.47 30.77 *rerata dari tiga kali ulangan
Limit deteksi menunjukan konsentrasi terendah dari analat dalam contoh yang berbeda nyata dengan blanko, sedangkan limit kuantitasi adalah konsentrasi analat terendah yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima. Limit deteksi dan limit kuantitasi ditentukan berdasarkan simpangan baku intersep dan rerata dari kemiringan kurva standar. Limit deteksi untuk obat dan kina berturut-turut adalah sebesar 0.1261 ppm dan 0.3543 ppm, sedangkan limit kuantitasinya adalah 0.3823 ppm dan 1.0736 ppm. Perhitungan limit deteksi dan limit kuantitasi dapat dilihat pada Lampiran 12.
Perbedaan nilai limit deteksi dan limit kuantitasi yang didapatkan untuk obat dan untuk kulit kina terjadi karena perbedaan matriks yang ada pada masing-masing contoh. Nilai limit deteksi dan limit kuantitasi contoh kulit kina lebih besar daripada contoh obat, hal ini terjadi karena matriks dalam contoh kulit kina lebih banyak dan lebih beragam dibandingkan dengan matriks contoh obat.
SIMPULAN DAN SARAN
SimpulanMetode SDUV merupakan metode yang cepat, mudah, dan murah untuk kuantifikasi
kuinina. Metode ini dapat digunakan untuk penentuan kuinina dalam obat tetapi tidak dapat digunakan untuk penentuan kuinina dalam kulit kina tanpa pemisaahan terlebih dahulu. Hasil yang didapatkan dengan menggunakan metode SDUV untuk obat dan kulit kina berturut-turut adalah 174.32±14.79 mg/tablet dan 1.87±0.06%, sedangkan dengan menggunakan metode KCKT adalah 167.00±11.41 mg/tablet dan 3.17±0.61%. Hasil yang didapatkan untuk obat secara statistika (uji t-Student dan uji F) tidak berbeda nyata, sedangkan untuk kulit kina berbeda nyata. Pengukuran validasi metode memberikan nilai %SBR untuk obat 6.13% dan untuk kulit kina 4.68%, linearitas untuk kedua contoh sebesar 0.9999, akurasi untuk obat berkisar antara 93.06%-116.37%, sedangkan untuk kulit kina -64.80%-31.84%, limit deteksi untuk obat dan kulit kina berturut-turut adalah 0.1261 ppm dan 0.3543 ppm, sedangkan limit kuantitasinya adalah 0.3823 ppm untuk obat dan 1.0736 ppm untuk kulit kina.
Saran
Perlu dilakukan pemisahan terlebih dahulu untuk penentuan kuinina dalam kulit kina karena ternyata metode SDUV tidak dapat menghilangkan gangguan matriks yang ada pada kulit kina. Selain itu, perlu dilakukan parameter-parameter validasi yang lain (robustness, spesifisitas, dan uji kesesuaian sistem).
DAFTAR PUSTAKA
Ansari M, Kazemipour M, Baradaran M, Jalalizadeh H. 2004. Derivative spectro-photometric method for determination of losartan in pharmaceutical formulation.
IJPT 3:21-25.
Ansel HC. 1989. Pengantar Bentuk Sediaan Farmasi. Ed ke-4. Farida Ibrahim, penerjemah; Jakarta: UI Press. Terjemahan dari: Introduction to Pharmaceutical Dosage Forms.
Aydogmus Z, Cetin SM, Ozgur MU. 2002. Determination of ascorbic acid in veget-ables by derivative spectrophotometry.
13
Babaloa CP, Bolaji OO, Dixon PA, Ogunbona FA. 1993. Column liquid chromatograph-ic analysis of quinine in human plasma, saliva, and urine [Abstrak]. J Chromatogr
616:151-154.
Bagian Farmakologi FKUI. 1995. Farmako-logi dan Terapi. Ed ke-4. Jakarta: Gaya Baru.
Chan CC. 2004. Potency Method Validation. Di dalam: Chan CC, Lee YC, Lam H, Zhang XM, editor. Analytical method Validation and Instrument Performance Verification. New Jersey: John Willey & Sons. hlm 11-25.
Day RA & Underwood AL. 2002. Analisis Kimia Kuantitatif. Ed ke-6. Hilarius Wibi, Lemeda Simarmata, editor. Jakarta: Erlangga.
Garfield FM. 1992. Qualitical Assurance Pri-nciple for Analytical Laboratories. Par-lington: AOAC International.
Gatti R, Gioia MG, Caprini V. 2004. Deter-mination of cichona alkaloids and vitamin B6 by high performance liquid chromato-graphy with fluorescence detection. Anal Chim Act 512:85-91.
Harborne JB. 1987. Metode Fitokimia. Ed ke-2. Kosasih Fadmawinata, penerjemah; Bandung: ITB.
Harris DA & Bashford CL. 1987. Spectro-photometry and Spectrofluorimetry: A Practical Approach. Oxford: IRL Press.
Hendayana S, Kadarohman A, Sumarna A, Supriatna A. 1994. Kimia Analitik Instru-men. Ed ke-1. Semarang: IKIP Semarang Press.
Kazemipour M, Noroozian E, Tehrani MS, Mahmoudin M. 2002. A new second deri-vative spectrophotometric method for det-ermination of permethrin in shampoo. [komunikasi singkat]. J Pharm Biomed Anal 30:1183-1189.
O’Haver TC. 1979. Potential clinical applica-tions of derivative and wavelength modu-lation spectrometry. Clin Chem 25: 1548-1553.
Owen T. 1996. Fundamentals of UV-Visible Spectroscopy. Waldborn: Hewlett-Packard.
Saad B, Saleh MI, Rahman IA, Mansor SM. 2001. Polyvinyl chloride-based membran-es for flow injection analysis of quinine in beverages. J AOAC Int. 84: 1151-1157.
[SAC-SINGLAS] Singapore Accreditation Council-Singapore Laboratory Accredita-tion Scheme. 2002. Method Validation for Chemical Testing. Singapore: SPRING Singapore.
Sawyer DT, Heineman WR, Beebe JM. 1984.
Chemistry Eksperiments for Instru-mentals Methods. New York: John Willey & Sons.
Skoog DA, Holler FJ, Nieman TA. 1998.
Principles of Instrumental Analysis. Ed ke-5. Florida: Harcourt Brace.
Skujins S. 1986. Application of UV-Visible Derivative Spectrophotometry. Steinha-userstrasse: Varian AG.
Sudjadi MS. 1985. Penentuan Struktur Senya-wa Organik. Jakarta: Ghalia Indonesia.
Taylor L. 2005. The Healing Power of Rain-forest Herbs. http://www.raintree.com/ quinine.htm. [3 Mei 2005].
Tjitrosoepomo G. 1994. Taksonomi Tumbuh-an Obat-obatTumbuh-an. Yogyakarta: Gajah Mada Press.
Uslu B & Ozkan SA. 2002. Determination of lavivudine and zidovudine in binary mixtures using first derivative spectro-photometric, first derivative of the ratio-spectra and high-performance liquid chromatography-UV methods. Anal Chim Act 466:175-185.
[USP] United States Pharmacopeia. 2003.
The United States Pharmacopeia. Ed ke-26. Rockville: USP.
14
15
Lampiran 1 Diagram alir penelitian
Standar Kuinina Obat
(Quinine Tablet Salut®)
Metode Spektrofotometri Derivatif
Spektrum UV
Pengolahan Sinyal dengan Proses Dekonvolusi
Kondisi Optimum
Data
Validasi Metode Pengukuran Standar (Kurva Standar)
dan Contoh
Data Kulit kina
16
Lampiran 2 Amplitudo standar pada analisis kuinina dengan metode SDUV *) Amplitudo standar untuk analisis obat
Amplitudo standar 2-10 ppm untuk analisis obat pada turunan pertama
Dz 2 ppm 4 ppm 6 ppm 8 ppm 10 ppm
1-2-13 0.00392 0.00755 0.01110 0.01461 0.01828
1-2-19 0.00382 0.00738 0.01087 0.01431 0.01789
1-2-25 0.00372 0.00721 0.01060 0.01397 0.01745 1-2-31 0.00361 0.00700 0.01028 0.01355 0.01691 1-2-37 0.00349 0.00677 0.00993 0.01309 0.01633 1-2-43 0.00336 0.00652 0.00956 0.01261 0.01573 1-2-49 0.00323 0.00626 0.00919 0.01212 0.01511 1-2-55 0.00311 0.00603 0.00884 0.01166 0.01451 1-3-13 0.00398 0.00771 0.01134 0.01488 0.01880 1-3-19 0.00394 0.00762 0.01124 0.01479 0.01859 1-3-25 0.00396 0.00763 0.01125 0.01480 0.01852 1-3-31 0.00394 0.00760 0.01121 0.01475 0.01846 1-3-37 0.00392 0.00757 0.01115 0.01467 0.01835 1-3-43 0.00388 0.00752 0.01106 0.01455 0.01818 1-3-49 0.00384 0.00744 0.01093 0.01440 0.01798 1-3-55 0.00379 0.00735 0.01079 0.01422 0.01775 1-4-13 0.00398 0.00771 0.01134 0.01488 0.01880 1-4-19 0.00400 0.00762 0.01129 0.01486 0.01861 1-4-25 0.00396 0.00763 0.01125 0.01480 0.01852 1-4-31 0.00394 0.00760 0.01121 0.01475 0.01846 1-4-37 0.00392 0.00757 0.01115 0.01467 0.01835 1-4-43 0.00388 0.00752 0.01106 0.01455 0.01818 1-4-49 0.00384 0.00744 0.01093 0.01440 0.01798 1-4-55 0.00379 0.00735 0.01079 0.01422 0.01775 Amplitudo standar 2-10 ppm untuk analisis obat pada turunan kedua
DL 2 ppm 4 ppm 6 ppm 8 ppm 10 ppm
2-2-13 0.00027 0.00054 0.00077 0.00100 0.00125 2-2-19 0.00025 0.00050 0.00071 0.00096 0.00121 2-2-25 0.00025 0.00048 0.00070 0.00093 0.00116 2-2-31 0.00023 0.00045 0.00066 0.00088 0.00110 2-2-37 0.00022 0.00043 0.00063 0.00084 0.00106 2-2-43 0.00022 0.00042 0.00061 0.00081 0.00101 2-2-49 0.00020 0.00039 0.00058 0.00077 0.00096 2-2-55 0.00019 0.00038 0.00055 0.00073 0.00092 2-3-13 0.00027 0.00053 0.00076 0.00100 0.00125 2-3-19 0.00025 0.00050 0.00074 0.00096 0.00121 2-3-25 0.00025 0.00048 0.00070 0.00093 0.00116 2-3-31 0.00023 0.00045 0.00066 0.00088 0.00110 2-3-37 0.00022 0.00043 0.00063 0.00084 0.00106 2-3-43 0.00022 0.00042 0.00061 0.00081 0.00101 2-3-49 0.00020 0.00039 0.00058 0.00077 0.00096 2-3-55 0.00019 0.00038 0.00055 0.00073 0.00092
2-4-13 - - - - -
17
Lanjutan
2-4-31 0.00027 0.00052 0.00077 0.00101 0.00126 2-4-37 0.00027 0.00052 0.00076 0.00100 0.00125 2-4-43 0.00026 0.00051 0.00075 0.00098 0.00124 2-4-49 0.00025 0.00050 0.00073 0.00098 0.00122 2-4-55 0.00025 0.00049 0.00073 0.00095 0.00120
*) Amplitudo standar untuk analisis kulit kina
Amplitudo standar 2-10 ppm untuk analisis kulit kina pada turunan kedua
Dz 2 ppm 4 ppm 6 ppm 8 ppm 10 ppm
2-2-19 0.00012 0.00025 0.00039 0.00052 0.00066 2-2-25 0.00012 0.00024 0.00038 0.00050 0.00064 2-2-31 0.00012 0.00024 0.00037 0.00049 0.00061 2-2-37 0.00012 0.00023 0.00035 0.00046 0.00059 2-2-43 0.00011 0.00022 0.00033 0.00044 0.00056 2-2-49 0.00011 0.00021 0.00031 0.00041 0.00052 2-2-55 0.00010 0.00020 0.00029 0.00039 0.00049 2-3-19 0.00012 0.00025 0.00039 0.00052 0.00066 2-3-25 0.00012 0.00024 0.00038 0.00050 0.00064
2-3-31 0.00012 0.00024 0.00037 0.00049 0.00061
2-3-37 0.00012 0.00023 0.00035 0.00046 0.00059 2-3-43 0.00011 0.00022 0.00033 0.00044 0.00056 2-3-49 0.00011 0.0021 0.00031 0.00041 0.00052 2-3-55 0.00010 0.00019 0.00029 0.00039 0.00049
2-4-19 - - - - -
18
Lampiran 3 Penentuan kadar kuinina dengan metode SDUV Amplitudo contoh obat dan kulit kina pada kondisi optimum
1 2 3 4 5 6 7 8 9
Obat 0.01321 0.01178 0.01046 0.01109 0.01181 0.01159 0.00899 0.01132 0.01175 Kina 0.00023 0.00023 0.00024 0.00023 0.00023 0.00020 0.00023 0.00023 0.00023 Data Penimbangan contoh
Ulangan Obat (gram) Kulit kina (gram)
1 0.0120 0.0331
2 0.0119 0.0332
3 0.0125 0.0335
4 0.0124 0.0335
5 0.0118 0.0335
6 0.0119 0.0331
7 0.0119 0.0337
8 0.0120 0.0335
9 0.0120 0.0334
Contoh perhitungan: * Obat (ulangan 1)
Persamaan kurva standar Y=3.33x10-4 + 1.75x10-3X 0.01321=3.33x10-4 + 1.75x10-3X
X=7.3436 ppm
7.3436 ppm =
mg
ml
ml
ml
mg
ml
mg
1197
.
6
6
100
50
3672
.
0
1000
3436
.
7
=
×
=
mg
mg
X
mg
3
.
1605
12
1197
.
6
=
X=818.6582 mg/4 tabletKadar kuinina dalam obat/tablet adalah =
mg
204
.
6646
mg
4
6582
.
818
=
* Kulit kina (ulangan 1)
Persamaan kurva standar Y=-3x10-6 + 6.15x10-5X 0.00023=-3x10-6 + 6.15x10-5X
X=3.7886 ppm
3.7886 ppm=
mg
ml
ml
ml
mg
ml
mg
6314
.
0
6
20
50
1894
.
0
1000
7886
.
3
=
×
=
Kadar kuinina dalam kulit kina adalah:
%
90
.
1
%
100
1
.
33
6314
.
0
=
×
19
Lampiran 4 Kromatogram standar kuinina konsentrasi a. 10 ppm; b. 20 ppm; c. 30 ppm a)
Minutes
0 5 10 15 20 25 30
Volts 0 2 4 Volts 0 2 4 1 .1 2 0 1 .9 4 7 2 .4 7 7 2 .7 4 3 3 .6 8 0 5 .4 4
7 7.4
2 3 1 0 .0 4 0 UV-VIS Retention Time b) Minutes
0 5 10 15 20 25 30
V o lt s 0.0 2.5 5.0 7.5 V o lt s 0.0 2.5 5.0 7.5 1 .1 3 3 3 .2 9 0 3 .6 8 3 5 .4 4
0 7.3
9 7 7 .8 4 7 UV-VIS Retention Time c) Minutes
0 2 4 6 8 10 12 14 16 18 20
20
Lampiran 5 Kromatogram obat Quinine Tablet Salut®pada konsentrasi 24 ppm a. ulangan 1; b. ulangan 2; c. ulangan 3
a)
Minutes
0 5 10 15 20 25 30
V o lt s 0.0 2.5 5.0 7.5 V o lt s 0.0 2.5 5.0 7.5 1.113 2 .4 97 3.683 5.447 7.417 UV-VIS Retention Time b) Minutes
0 5 10 15 20 25 30
V o lt s 0.0 2.5 5.0 7.5 V o lt s 0.0 2.5 5.0 7.5 1 .1 1 3 1 .5 5 7 3 .6 9 0 5 .4 5 3 7 .4 3 7 UV-VIS Retention Time c) Minutes
0 5 10 15 20 25 30
21
Lampiran 6 Kromatogram contoh kulit kinapada konsentrasi 12 ppm a. ulangan 1; b. ulangan 2; c. ulangan 3
a)
Minutes
0 5 10 15 20
V o lt s 0 10 20
1
.1
0
7
1
.4
1
3
1
.7
5
7
2
.2
3
0
3
.0
2
0
3
.3
5
0
3
.6
2
7
4
.0
8
3
5
.4
4
3
b) Minutes0
5
10
15
20
V o lt s
0
10
1.
107
1.
4
13
1.
76
3
2.
23
0
3.
02
3
3.
353
3.
63
3
5.
453
6
.740
7.
400
7
.817
8.
567
c) Minutes0 5 10 15 20
22
Lampiran 7 Penentuan kadar kuinina dengan metode KCKT Data Penimbangan contoh obat dan kulit kina
Contoh – ulangan Bobot (gram)
Obat - 1 0.0497
Obat - 2 0.0485
Obat - 3 0.0482
Kulit kina - 1 0.0200
Kulit kina - 2 0.0205
Kulit kina - 3 0.0202
Contoh perhitungan:
Persamaan kurva standar : Y = 689.67 + 40031.60X r = 0.9999
* Obat (ulangan 1):
989434 = 689.67 + 40031.60X X = 24.6991 ppm =
ml
mg
1000
6991
.
24
=
mg
ml
ml
ml
mg
5826
.
20
3
25
100
46991
.
2
=
×
Kadar kuinina/ 4 tablet =
mg
mg
X
mg
3
.
1605
7
.
49
5826
.
20
=
X= 664.8133 mg
Kadar kuinina/ tablet =
mg
166
.
2033
mg
4
8133
.
664
=
* Kulit kina (ulangan 1):
241401 = 689.67 + 40031.60X
X = 6.0130 ppm =
mg
ml
ml
ml
mg
ml
mg
6013
.
0
5
10
50
3006
.
0
1000
0130
.
6
=
×
=
Kadar kuinina =
100
%
3
.
0065
%
20
6013
.
0
=
×
23
Lampiran 8 Penentuan uji t-Student dan uji F
Parameter Metode SDUV Metode KCKT
σ
(simpangan baku)Obat 19.214 4.583
Kulit kina 0.081 0.245
Kadar kuinina rata-rata 174.32 167.00
Jumlah ulangan 9 3
a) Uji t-Student * Obat
t-hitung =
1
.
056
3
)
583
.
4
(
9
)
214
.
19
(
00
.
167
32
.
174
2 2 2 2 2 1 2 1 2 1=
+
−
=
+
−
− −n
n
X
X
σ
σ
Derajat bebas =
9
.
82
10
)
1
(
)
1
(
22 24 2 1 2 1 4 1 2 2 2 2 1 2 1
=
=
−
+
−
+
n
n
n
n
n
n
σ
σ
σ
σ
Derajat bebas yang diperoleh adalah 10, dan nilai t-tabel yang diperoleh pada selang kepercayaan 95% adalah 1.812.
t-hitung < t-tabel
maka dapat dikatakan bahwa kedua metode tidak berbeda nyata.
* Kulit kina
t-hitung =
9
.
028
3
)
245
.
0
(
9
)
081
.
0
(
17
.
3
87
.
1
2 2 2 2 2 1 2 1 2 1=
+
−
=
+
−
− −n
n
X
X
σ
σ
Derajat bebas =
2
.
15
2
)
1
(
)
1
(
22 24 2 1 2 1 4 1 2 2 2 2 1 2 1
=
=
−
+
−
+
n
n
n
n
n
n
σ
σ
σ
σ
Derajat bebas yang diperoleh adalah 2, dan nilai t-tabel yang diperoleh pada selang kepercayaan 95% adalah 2.920.
t-hitung > t-tabel
24
Lanjutan b) Uji-F * Obat
F-hitung =
17
.
577
)
583
.
4
(
)
214
.
19
(
2 2
2 2
2
1
=
=
σ
σ
nilai F-tabel pada selang kepercayaan 95% adalah 19.371 F-hitung < F-tabel
maka dapat dikatakan bahwa kedua metode tidak berbeda nyata
* Kulit kina
F-hitung =
9
.
145
)
081
.
0
(
)
245
.
0
(
2 2
2 2
2
1
=
=
σ
σ
nilai F-tabel pada selang kepercayaan 95% adalah 4.459 F-hitung > F-tabel
25
Lampiran 9 Penentuan simpangan baku relatif Kadar kuinina pada contoh obat dan kulit kina
Ulangan Obat Kulit kina
1 175.92 1.73
2 179.05 1.65
3 184.24 1.90
4 195.71 1.90
5 158.64 1.74
6 192.85 1.81
7 190.27 1.75
8 186.72 1.80
9 188.37 1.84
Rataan ± batas galat 183.53±8.66 1.79±0.06 - Obat:
SBR =
×
100
%
−
rata
rata
baku
simpangan
=
100
%
53
.
183
2472
.
11
×
= 6.1282 % - Kulit kina
SBR =
×
100
%
−
rata
rata
baku
simpangan
=
100
%
79
.
1
0839
.
0
×
26
Lampiran 10 Penentuan linearitas
Amplitudo standar pada penentuan linearitas obat
Ulangan 2 ppm 4 ppm 6 ppm 8 ppm 10 ppm
Obat-1 0.00401 0.00801 0.01176 0.01565 0.01974 Obat-2 0.00457 0.00883 0.01351 0.01797 0.02215 Obat-3 0.00397 0.00770 0.01167 0.01509 0.01902 Rataan 0.00418 0.00818 0.0123 0.01624 0.02030 Persamaan regresi kurva standar Y = 1.5x10-4 + 2.015x10-3X
r = 0.9999
Amplitudo standar pada penentuan linearitas kulit kina
Ulangan 2 ppm 4 ppm 6 ppm 8 ppm 10 ppm
Kulit kina-1 0.00013 0.00026 0.00038 0.00051 0.00065 Kulit kina-2 0.00014 0.00028 0.00044 0.00059 0.00073 Kulit kina-3 0.00013 0.00025 0.00038 0.00050 0.00063 Rataan 0.00013 0.00026 0.00040 0.00053 0.00067 Persamaan regresi kurva standar Y = -7x10-6 + 6.75x10-5X
27
Lampiran 11 Penentuan akurasi
Amplitudo contoh dan % recovery (% perolehan kembali)
Obat Kulit kina
Standar yang ditambahkan
(µg) - ulangan Amplitudo % recovery Amplitudo % recovery
25 – 1 0.00785 112.48 0.00015 -64.80
25 – 2 0.00772 105.27 0.00015 -64.80
25 – 3 0.00792 116.37 0.00015 -64.80
75 – 1 0.01178 110.17 0.00023 21.07
75 – 2 0.01181 110.73 0.00023 21.07
75 – 3 0.01109 97.41 0.00024 26.40
125 – 1 0.01537 105.94 0.00029 31.84
125 – 2 0.01421 93.06 0.00028 28.64
125 – 3 0.01436 94.73 0.00029 31.84
(*) Obat (25-1):
Amplitudo obat = 0.00785
Persamaan kurva standar Y = 4.15x10-4 + 1.8025x10-3X 0.00785 = 4.15x10-4 + 1.8025x10-3X X = 4.1248 ppm
4.1248 ppm = 4.1248 µg/ ml x 25 ml = 103.1207 µg
% perolehan kembali (% recovery)
100
%
3 2 1
−
×
=
C
C
C
=
100
%
25
75
1207
.
103
×
−
g
g
g
µ
µ
µ
= 112.48 % (*) Kulit kina (75-1):
Amplitudo kina = 0.00023
Persamaan kurva standar Y = 3x10-6 + 6.25x10-5X 0.00023 = 3x10-6 + 6.25x10-5X
X = 3.6320 ppm
3.6320 ppm = 3.6320 µg/ ml x 25 ml = 90.80 µg
% perolehan kembali (% recovery)
100
%
3 2 1
−
×
=
C
C
C
=
100
%
75
75
80
.
90
×
−
g
g
g
µ
µ
µ
28
Lampiran 12 Penentuan limit detaksi (LoD) dan limit kuantitasi (LoQ) (*) Obat
Data pengukuran standar untuk obat
Ulangan Persamaan regresi Koefisien korelasi 1 Y = 1.04x10-4 + 1.955x10-3X 0.9999 2 Y = 1.16x10-4 + 2.215x10-3X 0.9998 3 Y = 2.43x10-4 + 1.874x10-3X 0.9998
LoD =
s
σ
×
3
.
3
= 3