METODE KULTUR CAIR UNTUK PENGEMBANGAN
TEKNOLOGI PERBANYAKAN BENIH BERMUTU
IMRON RIYADI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi berjudul “Embriogenesis Somatik Sagu (Mertoxylon sagu Rottb.) Metode Kultur Cair untuk Pengembangan
Teknologi Perbanyakan Benih Bermutu” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya saya kepada Institut Pertanian Bogor.
Bogor, September 2016
Imron Riyadi
Kultur Cair untuk Pengembangan Teknologi Perbanyakan Benih Bermutu. Dibimbing oleh DARDA EFENDI, BAMBANG SAPTA PURWOKO dan DJOKO SANTOSO.
Tanaman sagu mempunyai potensi penting dalam ketahanan pangan dan energi nasional karena sagu dapat memproduksi karbohidrat sebagai sumber pangan potensial dan sumber energi berkesinambungan yang dapat diperbarui. Tanaman sagu unggul mempunyai produktivitas atau rendemen pati sagu tinggi, umur relatif genjah serta memiliki kualitas tepung pati yang baik. Tanaman sagu unggul ini penting untuk dikembangkan secara massal untuk memenuhi kebutuhan benih tanaman sagu baik untuk peremajaan maupun penanaman baru.
Perbanyakan sagu secara konvensional, menggunakan teknik perbanyakan vegetatif yaitu anakan (sucker), masih memiliki beberapa kendala antara lain:
keterbatasan jumlah produksi, tingkat keseragaman yang rendah (umur, tinggi dan bobot benih), tingginya biaya dan beratnya operasional pengangkutan dari sumber benih ke lahan kebun. Teknologi embriogenesis somatik mempunyai potensi yang efektif dan efisien untuk pengembangan benih sagu unggul secara massal dalam waktu relatif singkat, benih lebih homogen (genetik, umur, tinggi dan bobot benih), biaya dan proses operasional pengangkutan benih dari sumber ke lahan kebun lebih efisien. Teknologi embriogenesis somatik mampu memproduksi benih sagu sebanyak 100000 – 1000000 benih/laboratorium/tahun setelah terlewati proses induksi kalus dan proliferasi kalus maupun embrio somatik yang membutuhkan waktu selama dua tahun. Produksi benih sagu secara konvensional hanya mencapai 500 – 2500 benih/ha/tahun.
Selain teknik kultur media padat, teknik kultur media cair mempunyai potensi pengembangan yang lebih efisien karena dapat menghemat komponen media, lebih efisien biaya dan praktis dalam operasional pengerjaannya. Penghematan biaya media pada kultur cair dapat mencapai 50 – 75 % dibandingkan dengan penggunaan media padat. Kultur media cair yang dikembangkan ada dua teknik yaitu temporary immersion system (TIS) atau sistem perendaman sesaat (SPS) dan kultur suspensi.
Kedua teknik kultur cair tersebut masing-masing memiliki kelebihan untuk produksi benih sagu. Penelitian ini bertujuan untuk meningkatkan efisiensi dalam produksi benih tanaman sagu bermutu.
Alitir yang berasal dari Merauke, Papua yang tersedia di Laboratorium Biak Sel dan Mikropropogasi Tanaman, Pusat Penelitian Bioteknologi dan Bioindustri Indonesia (PPBBI). Percobaan 2 menggunakan kalus embriogenik asal percobaan 1 dan stok kalus di laboratorium sebagai bahan tanam untuk diferensiasi kalus membentuk embrio somatik. Selanjutnya, embrio somatik fase perkembangan dewasa (scutellar
dan coleoptilar) yang terbentuk digunakan sebagai bahan tanam pada percobaan 3
untuk perkecambahan embrio somatik. Kecambah embrio somatik yang terbentuk, digunakan sebagai bahan tanam pada percobaan 4 untuk memacu pertumbuhan dan perkembangan kecambah menjadi planlet. Planlet yang sudah jagur yaitu memiliki daun yang cukup dengan perakaran yang cukup digunakan sebagai bahan penelitian percobaan 5 untuk aklimatisasi planlet menjadi benih sagu yang siap ditanam di kebun. Untuk mengetahui tingkat kesamaan genetik (genetic similarity), diseleksi
sampel daun benih sagu di pesemaian sebagai bahan percobaan 6 yaitu analisis kesamaan genetik sagu asal kultur embriogenesis somatik dengan metode RAPD menggunakan enam primer.
Hasil penelitian dari serangkaian percobaan adalah berupa kalus, embrio somatik fase muda sampai dewasa (globular, elongated, scutellar dan coleoptilar),
kecambah, planlet, benih di pesemaian dan tingkat kesamaan genetik tanaman sagu. Pada percobaan 1, telah diperoleh embriogenesis somatik sagu paling efisien yaitu pada media yang mengandung kinetin dengan konsentrasi 1 mg L-1 (embrio somatik
123.9 buah/Erlenmeyer). Percobaan perbandingan tiga sistem atau metode kultur untuk proliferasi dan induksi embriogenesis somatik, perlakuan terbaik adalah metode kultur suspensi dengan media yang ditambah 2,4-D 5.0 mg L-1 + kinetin 0.1
mg L-1 (384.7 embrio somatik/bejana). Percobaan diferensiasi kalus membentuk
embrio somatik, perlakuan terbaik diperoleh pada perlakuan metode kultur TIS dengan media yang ditambah TDZ 1.0 mg L-1 + kinetin 0.5 mg L-1 (389.2 embrio
somatik/bejana). Proses pendewasaan embrio somatik terefisien diperoleh pada metode kultur suspensi dengan media yang ditambah ABA 0.01 mg L-1 + kinetin 1.0 mg L-1 (55.2 embrio somatik fase dewasa /bejana). Proses perkecambahan embrio
somatik sagu fase dewasa terbaik diperoleh pada metode kultur TIS dengan setengah konsentrasi makro media yang ditambahkan GA3 0.1 mg L-1 + kinetin 2.0 mg L-1
(51.0 kecambah embrio somatik/bejana). Pertumbuhan dan perkembangan kecambah embrio somatik sagu menjadi planlet terefisien diperoleh pada perlakuan metode kultur TIS dengan media yang ditambahkan GA3 0.5 mg L-1 + kinetin 1.0 mg L-1
(tinggi planlet 11.5 mm, jumlah daun 1.7 helai, kelas warna hijau daun 1.8 dan perakaran 7.5 dari setiap 10 sampel). Planlet sagu telah berhasil diaklimatisasi menjadi benih siap tanam di kebun dengan perlakuan aklimatisasi terefisien yang diperoleh pada komposisi media yang terdiri atas top soil, pasir, pupuk kandang dan cocopeat (1:1:0:1) v/v yang dapat menghasilkan persentase benih hidup tertinggi. Hasil analisis RAPD menunjukkan bahwa tingkat keragaman genetik populasi benih sagu sangat rendah yang berarti antar populasi benih sagu tersebut memiliki kesamaan genetik tinggi. Dengan demikian, benih sagu yang dikembangkan tersebut memiliki kestabilan genetik tinggi sehingga mempunyai potensi besar untuk digunakan sebagai metode propagasi benih sagu unggul secara massal.
Using Liquid Culture Method for Technological Development of Elite Clone Seedling Propagation. Under supervision of DARDA EFENDI as chairman, BAMBANG SAPTA PURWOKO and DJOKO SANTOSO as members of the advisory committee.
Sago palm plays an important role in food and energy security since it produces carbohydrate as potential source of food and renewable energy. The elite sago palm clone has high productivity and good quality starch. Elite sago palm clone need to be mass propagated to fulfill in replanting and new planting area.
Sago palm has contraints in vegetative propagation i.e. limited number of sucker produced, low homogenity (age, height and weight), high cost of transportation from seedling source to plantation area. Somatic embryogenesis technology has effective and efficient means for mass production in short time, more homogenous (genetic), more cost efficient and easy transportation of propagule seedling from source to plantation area. Somatic embryogenesis technology has capability for producing 100000 – 1000000 seedling/laboratorium/year when the process of calli induction and proliferation of embryogenic calli and somatic embryo were established in two years. Conventional propagation method of sago palm has potency for producing 500 – 2500 seedlings/ha/year or in larger area circa 100 ha has potency for producing 50000 – 250000 seedlings/100ha/year.
Aside of solid culture, liquid media culture has more efficient in its development since less in component of media, cost and simplere operation. Cost reduction of liquid media may reach 50 – 75% compared to solid media. There were two methods of liquid culture being developed i.e. temporary immersion system (TIS) and suspension culture. Both techniques have advantage for sago palm production over the solid media. The objective of the research was to develop liquid culture methode for increasing effiency of elite sago palm seedling production.
Researches of sago palm somatic embryogenesis comprised of six series of experiments. The first experiment was indirect somatic embryogenesis i.e. somatic embryo induction through suspension culture and somatic embryogenesis in three culture methods. The second experiment was callus differentiation to establish somatic embryo in three culture methods (suspension, TIS and solid media culture) consist of callus differentiation to establish somatic embryo and somatic embryo maturation. The third experiment was somatic embryo germination in those three culture methods. The fourth experiment was germination of somatic embryo development to plantlet. The fifth experiment was plantlet acclimatization to determine good seedlings. The sixth experiment was analysis of genetic similarity of seedling derived from somatic embryogenesis culture using RAPD method.
transplanting in field. To determine the genetic similarity, leaf sampling of seedling in nursery with three different ages were selected in the sixth experiment. RAPD method with six primers for genetic variation of the sago palm seedlings.
In the first experiment (suspension culture) the best somatic embryogenesis media was the one containing kinetin 1 mg L-1 which resulted 123.9 somatic embryos/flask. In the experiment for comparing three culture methods for callus proliferation and somatic embryo induction, the best somatic embryo method was obtained by suspension culture method with media containing 5.0 mg L-1 2,4-D + 0.1 mg L-1 kinetin (384.7 somatic embryos/flask). In the experiment for callus
differentiation to establish somatic embryo, the best result was achieved by TIS culture method with media containing 1.0 mg L-1 TDZ + 0.5 mg L-1 kinetin (389.2
somatic embryos/flask). The best somatic embryo maturation process was obtained by suspension culture method with media containing 0.01 mg L-1 ABA + 1.0 mg L-1
kinetin (55.2 adult somatic embryos/flask). Furthermore, the best somatic embryo germination process of mature stage (scutellar and coleoptilar) was achieved by TIS
culture method with half strength macro media containing 0.1 mg L-1 GA
3 + 2.0 mg
L-1 kinetin (51 germinated somatic embryos/flask). The best growth and development
of germinated somatic embryo to be plantlet was achieved by TIS culture method with media containing 0.5 mg L-1 GA
3 + 1.0 mg L-1 kinetin. Plantlet of sago palm
was successfully acclimated to seedling ready for transplanting in field. The best media composition comprising of top soil, sand, manure and cocopeat (1:1:0:1) gave the highest survival rate. Based on RAPD analysis, it was shown that that genetic variability of sago palm seedlings was very low. It meant that population of sago palm seedling derived from somatic embryogenesis showed the high genetic similarity. This phenomenon indicated that the elite sago palm seedlings derived from somatic embryogenesis developed in this research have high genetic stability which warranted that somatic embryogenesis has high potency for mass elite sago palm propagation.
©
Hak Cipta Milik IPB, tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruhnya karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah dan pengutipan tersebut tidak merugikan kepentingan IPB.
TEKNOLOGI PERBANYAKAN BENIH BERMUTU
IMRON RIYADI
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Pemuliaan dan Bioteknologi Tanaman
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Penguji Luar Komisi pada Ujian Tertutup : 1. Dr Ir Ni Made Armini Wiendi, MS 2. Dr Ir Sudradjat, MS
Nama : Imron Riyadi
NRP : A263120071
Disetujui oleh
Komisi Pembimbing
Dr Ir Darda Efendi, MSi Ketua
Prof Dr Ir Bambang S. Purwoko, MSc Dr Djoko Santoso, MSc Anggota Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pasccasarjana Pemuliaan dan Bioteknologi Tanaman
Dr Yudiwanti Wahyu EK, MS Dr Ir Dahrul Syah, M.Sc Agr
Tanggal Ujian Tertutup : 18 Juli 2016 Tanggal Lulus : Tanggal Sidang Promosi : 25 Agustus 2016
segala limpahan rahmat, nikmat dan karunia-Nya sehingga penulis berhasil menyelesaikan penyusunan disertasi ini yang berjudul : “Embriogenesis Somatik Sagu (Metroxylon sagu Rottbol) Metode Kultur Cair untuk Pengembangan
Teknologi Perbanyakan Benih Bermutu”.
Penulis menyampaikan terima kasih kepada Dr Ir Darda Efendi, MSi sebagai ketua komisi pembimbing, dan kepada Prof Dr Ir Bambang Sapta Purwoko, MSc dan Dr Djoko Santoso, MSc sebagai anggota komisi pembimbing yang banyak memberikan arahan, saran-saran dan tambahan pengetahuan dan wawasan kepada penulis sejak persiapan, pelaksanaan penelitian sampai dengan penyusunan diertasi ini. Penulis juga menyampaikan terima kasih kepada Prof Dr Ir Sudarsono, MSc, Dr Ir Agus Purwito, MSc Agr, Dr Ir Dewi Sukma, MSi, Dr Ir Ni Made Armini Wiendi, MS, Dr Ir Sudradjat, MS, Dr Ir Asep Setiawan, MS, Dr Ir Yudiwanti Wahyu EK, MS dan Dr Ir Priyono, DIRS yang telah bersedia menjadi penguji luar komisi pada ujian pra kualifikasi program Doktor, ujian tertutup dan sidang promosi doktor yang telah memberikan banyak masukan dan saran-saran perbaikan untuk penyempurnaan disertasi ini.
Ucapan terima kasih disampaikan kepada Direktur lama (Dr Ir Darmono Taniwiryono, MSc) dan Direktur baru (Dr Ir Priyono, DIRS) Pusat Penelitian Bioteknologi dan Bioindustri Indonesia (PPBBI), Direktur Utama lama (Dr Ir Didiek Hadjar Goenadi, MSc) dan Direktur Utama baru (Dr Ir Teguh Wahyudi, M.Eng.) Riset Perkebunan Nusantara (RPN) yang telah memberikan kesempatan dan beasiswa pendidikan melalui Program Revitalisasi tahun 2012. Tidak lupa penulis menyampaikan terima kasih kepada Dr Asmini Budiani, MSI Kepala Bidang Riset dan Pengembangan PPBBI, Ir. Sumaryono, MSc Penanggungjawab Laboratorium Biak Sel & Mikropropagasi Tanaman PPBBI, Teknisi dan Pembantu Teknisi Laboratorium Biak Sel & Mikropropagasi Tanaman PPBBI (Pak Ridwan, Yuniasari, SSi dan Akhmad Sudrajat, SSi), Dr. Dorly, MSi Penanggungjawab Laboratorium Mikroteknik Departemen Biologi IPB serta rekan-rekan Program Studi Pemuliaan dan Bioteknologi khususnya angkatan 2012 yang telah membantu baik secara fisik maupun spirit selama berlangsungnya kegiatan penelitian dan dukungannya dalam penulisan disertasi ini.
Penulis menyampaikan terima kasih, rasa hormat dan penghargaan yang tinggi kepada Bapak dan Ibu sebagai orang tua yang telah banyak mendo’akan, mendidik dan menanamkan rasa kedisiplinan dan rasa tanggungjawab serta seluruh keluarga besar atas do’a dan dukungannya. Secara khusus penulis menyampaikan terima kasih kepada istri tercinta Woro Sri Harini, SP dan ketiga anak kami tersayang, Much. Amru Chakim, Chusnul Fauzi Az-Zahro dan Much. Chanif Al-Muhaimin atas segala pengertiannya, do’a, motivasi, dukungan, saran dan masukan, pengorbanan dan kesabarannya dalam mendampingi penulis selama ini.
Akhirnya kepada semua pihak yang telah turut membantu selama penelitian hingga penulisan disertasi ini, penulis menyampaikan terim kasih. Semoga disertasi ini bermanfaat dan barokah, aamiin.
Bogor, September 2016
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... ix
1 PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Tujuan Penelitian ... 4
1.4 Manfaat Penelitian ... 5
1.5 Kebaruan Penelitian ... 5
1.6 Ruang Lingkup Penelitian ... 5
2 TINJAUAN PUSTAKA ... 7
2.1 Deskripsi Botani ... 7
2.2 Taksonomi ... 7
2.3 Penyebaran dan Perkembangan ... 7
2.4 Manfaat dan Potensi ... 7
2.5 Embriogenesis Somatik ... 9
3 EMBRIOGENESIS SOMATIK TIDAK LANGSUNG PADA TANAMAN SAGU DENGAN MENGGUNAKAN TIGA METODE KULTUR ... 13
3.1 Pendahuluan ... 14
3.2 Bahan dan Metode ... 14
3.3 Hasil dan Pembahasan ... 17
3.4 Kesimpulan ... 31
4 DIFERENSIASI KALUS SAGU MEMBENTUK EMBRIO SOMATIK DENGAN MENGGUNAKAN TIGA METODE KULTUR ... 33
4.1 Pendahuluan ... 34
4.2 Bahan dan Metode ... 35
4.3 Hasil dan Pembahasan ... 38
4.4 Kesimpulan ... 50
5 PERKECAMBAHAN EMBRIO SOMATIK SAGU DENGAN MENGGUNAKAN TIGA METODE KULTUR ... 49 51 5.1 Pendahuluan ... 51
5.2 Bahan dan Metode ... 52
5.3 Hasil dan Pembahasan ... 53
5.4 Kesimpulan ... 58
6 PEMBESARAN KECAMBAH EMBRIO SOMATIK SAGU DENGAN MENGGUNAKAN TIGA METODE KULTUR ... 59
6.1 Pendahuluan ... 59
6.2 Bahan dan Metode ... 60
6.3 Hasil dan Pembahasan ... 61
7.2 Bahan dan Metode ... 66
7.3 Hasil dan Pembahasan ... 67
7.4 Kesimpulan ... 70
8 STUDI ANALISIS KESAMAAN GENETIK BENIH SAGU ASAL EMBRIOGENESIS SOMATIK DENGAN MENGGUNAKAN METODE RAPD ... 71
8.1 Pendahuluan ... 71
8.2 Bahan dan Metode ... 72
8.3 Hasil dan Pembahasan ... 74
8.4 Kesimpulan ... 78
9 PEMBAHASAN UMUM ... 79
10 KESIMPULAN UMUM DAN SARAN ... 85
10.1 Kesimpulan ... 85
10.2 Saran ... 85
DAFTAR PUSTAKA ... 87
LAMPIRAN ... 93
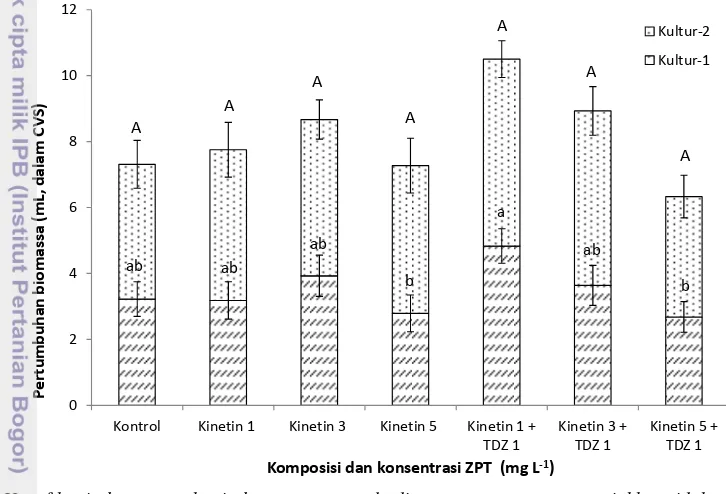
3.1 Bobot segardan warna dominan kultur suspensi sagu pada saat panen
umur 10 minggu ... 21 3.2 Persentase hidup kultur sagu pada kombinasi perlakuan konsentrasi 2,4-D
dengan ketiga metode kultur ... 27 3.3 Perkembangan perubahan warna dominan kultur sagu pada kombinasi
perlakuan konsentrasi 2,4-D dengan ketiga metode kultur ... 28 4.1 Lama waktu kalus berdiferensiasi membentuk embrio somatik tanaman
sagu sampai dengan umur 12 minggu saat panen. ... 42 4.2 Lama waktu pendewasaan dan perubahan warna dominan embrio somatik
tanaman sagu saat panen pada umur enam minggu setelah kultur. ... 49 5.1 Lama waktu perkecambahan dan warna dominan kecambah tanaman sagu
saat panen umur enam minggu ... 57 6.1 Rataan pertumbuhan planlet pada kultur pembesaran kecambah sagu
umur enam minggu ... 62 7.1 Rataan penambahan pertumbuhan benih sagu hasil aklimatisasi pada
umur 10 minggu ... 69 8.1 Konsentrasi dan kemurnian DNA hasil isolasi dari daun tanaman sagu
pada periode umur benih berbeda ... 75 9.1 Kompilasi dan analisis data-data hasil kultur mulai dari tahap induksi
embriogenesis somatik sampai dengan pembesaran kecambah embrio
somatik ... 79 9.2 Perbedaan karakter dan hasil kultur pada metode kultur media padat, TIS
dan suspensi ... 82
DAFTAR GAMBAR
1.1 Diagram alur penelitian “Embriogenesis Somatik Sagu (Metroxyon sagu Rottb.)Metode Kultur Cair untuk Pengembangan Teknologi Perbanyakan
Benih Bermutu” ... 6 2.1 Tahapan embriogenesis somatik pada tanaman dikotil dan monokotil ... 9 3.1 Proses inisiasi kultur suspensi sagu ... 15 3.2 Kultur awal kalus remah sagu (inisiasi embriogenesis somatik) pada ketiga
metode kultur ... 16 3.3 Perkembangan laju pertumbuhan biomassa kultur sagu dalam CVS mulai
awal tanam sampai dengan panen umur 10 minggu ... 18 3.4 Pertumbuhan biomassa kultur suspensi sagu dalam CVS mulai dari kultur
pertama dan kultur kedua ... 19 3.5 Embrio somatik pada kultur suspensi sagu umur 10 minggu ... 20 3.6 Rerata lama waktu inisiasi embrio somatik pada kultur suspensi sagu ... 21 3.7 Rerata jumlah embrio somatik hasil induksi embriogenesis somatik pada
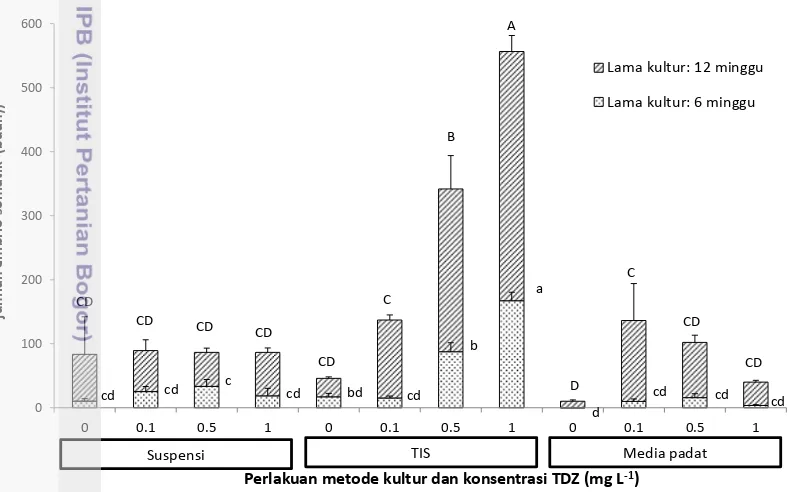
3.9 Induksi embrio somatik sagu pada periode kultur 6 dan 12 minggu pada
kombinasi perlakuan konsentrasi ZPT dengan ketiga bentuk kultur ... 25 3.10 Pertumbuhan dan perkembangan kalus menjadi embrio somatik pada
ketiga metode kultur pada umur 6 minggu 29
3.11 Perkembangan kalus menjadi embrio somatik pada ketiga metode kultur umur 12 minggu ... 30 4.1 Jumlah embrio somatik (sebagian besar stadium globular, beberapa
elongated dan sedikit scutellar dan coleoptilar) tanaman sagu mulai dari
kultur 6 minggu sampai dengan kultur 12 minggu ... 38 4.2 Variasi perolehan bobot segar hasil kultur sagu pada kultur 6 minggu dan
kultur 12 minggu ... 40 4.3 Persentase hidup kultur tanaman sagu mulai dari kultur 6 minggu sampai
dengan kultur 12 minggu ... 41 4.4 Pertumbuhan dan perkembangan kalus menjadi embrio somatik pada
ketiga metode kultur ... 44 4.5 Perolehan bobot basah embrio somatik tanaman sagu pada saat panen
umur enam minggu setelah kultur ... 45 4.6 Pertumbuhan dan perkembangan embrio somatik pada ketiga metode
kultur selama 6 minggu ... 46 4.7 Perkembangan rerata jumlah embrio somatik tanaman sagu pada setiap
fase perkembangan saat panen umur enam minggu setelah kultur ... 47 4.8 Pengelompokan komposisi jumlah embrio somatik (ES) tanaman sagu
stadium muda (globular + elongated) dan stadium dewasa (scutellar +
coleoptilar) padasaat panen umur enam minggu setelah kultur... 48
5.1 Rataan bobot segar total hasil kultur perkecambahan embrio somatik
tanaman sagu saat panen umur enam minggu pada semua perlakuan ... 54 5.2 Rataan jumlah kecambah hasil perkecambahan embrio somatik tanaman
sagu Alitir saat panen umur 6 minggu pada semua perlakuan ... 55 5.3 Rataanjumlah kecambah beserta embrio somatik sekunder total tanaman
sagu saat panen pada semua perlakuan umur 6 minggu ... 56 5.4 Perkecambahan embrio somatik tanaman sagu pada ketiga metode kultur
umur 6 minggu ... 58 6.1 Bobot segar total kultur (planlet + ESS) hasil kultur pada pembesaran
kecambah atau planlet sagu umur 6 minggu ... 61 6.2 Pertumbuhan dan perkembangan kecambah menjadi planlet ketiga metode
kultur sampai umur 6 minggu ... 63 7.1 Rataan persentase benih hidup sagu hasil aklimatisasi pada semua
perlakuan selama 10 minggu ... 68 7.2 Pertumbuhan dan perkembangan planlet sagu sampai menjadi benih ... 70 8.1 Bahan tanaman sagu hasil aklimatisasi sumber DNA dan perangkat
analisis Molekuler 73
8.2 Elektroforegram DNA hasil isolasi dari daun sagu asal kultur
embriogenesis somatik 74
8.3 Profil elektroforesis hasil PCR DNA dari daun sagu asal kultur
somatik menggunakan primer OPC ... 77 9.1 Diagram alur ringkasan embriogenesis somatik sagu berdasarkan metode
kultur terbaik pada setiap tahapan tujuan kultur ... 81
DAFTAR LAMPIRAN
1 Instalasi kultur suspensi pada orbital shaker merk IKA LABOR TECHNIK 95 2 Instalasi kultur TIS merk NALGEN ... 95 3 Instalasi kultur TIS merk RITA ... 95 4 Penghitungan Harga Pokok Produksi (HPP) media kultur embriogenesis
1 PENDAHULUAN
1.1 Latar Belakang
Penguatan ketahanan pangan dan energi dapat dikembangkan dengan meningkatkan pemanfaatan tanaman sumber karbohidrat yang potensial. Berdasarkan data sensus penduduk BPS tahun 2010 jumlah penduduk Indonesia telah mencapai 238.5 juta jiwa dan diprediksi akan bertambah menjadi + 305.6 juta jiwa pada tahun 2035 (BPS 2013). Untuk memenuhi kebutuhan bahan pangan penduduk yang jumlahnya semakin besar tersebut, maka sangat penting upaya diversifikasi bahan pangan pokok sebagai upaya meningkatkan ketahanan pangan nasional. Tanaman sagu merupakan salah satu tanaman penghasil karbohidrat tertinggi per luasan lahan dibandingkan dengan tanaman sumber karbohidrat lainnya. Luas lahan sagu di Indonesia mencapai 5.2 juta ha (Bintoro et al. 2013).
Tanaman sagu mempunyai fungsi ganda sebagai sumber makanan pokok (staple food) dan bioenergi, penghasil bioetanol (Rostiwati et al. 2008).
Pengembangan tanaman sagu berpotensi besar untuk dijadikan sumber karbohidrat yang dapat dimanfaatkan sebagai sumber pangan dan energi. Prediksi kebutuhan pangan di tahun 2035 akan meningkat tajam akibat penambahan penduduk yang cukup besar + 305.6 juta jiwa (BPS 2013). Keadaan tersebut harus diantisipasi dengan penggalian sumber karbohidrat potensial yang dapat digunakan sebagai sumber bahan pangan. Oleh karena itu pengembangan tanaman sagu cukup penting dan potensial sebagai salah satu solusi kebutuhan pangan dan energi (Bintoro et al. 2013).
Tanaman sagu (Metroxylon sagu Rottb.) merupakan salah satu tanaman
penghasil karbohidrat yang sangat potensial dalam mendukung program peningkatan ketahanan pangan nasional (Tarigans 2001; Kanro et al. 2003;
Bintoro et al. 2013). Karbohidrat atau pati disimpan dalam batang tanaman sagu.
Tanaman sagu telah digunakan sejak dahulu sebagai makanan pokok bagi sebagian besar penduduk Indonesia bagian timur yaitu di Maluku dan Papua (Flach 1997; Kanro et al. 2003). Selain sebagai sumber bahan pangan, sagu juga
dapat digunakan sebagai sumber energi yang berupa bioetanol (Rostiwati et al.
2008) dan juga berguna sebagai sumber bahan industri lem (adhessive gel), sirup,
mie dan bahan farmasi (Flach 1997; Bintoro et al. 2013). Dibandingkan dengan
tanaman penghasil karbohidrat lain seperti padi, jagung dan ubi kayu, sagu mempunyai beberapa kelebihan antara lain produktivitasnya yang lebih tinggi yakni dapat menghasilkan 20-40 ton pati kering/ha/tahun setelah mencapai umur panen (+ 8 – 10 tahun) tergantung kultur teknis yang dilakukan pada kebun sagu tersebut (Bintoro et al. 2013). Oleh karena itu, tanaman sagu berpotensi untuk
dijadikan sebagai salah satu tanaman sumber pangan dan energi terbarukan yang mendukung ketahanan pangan dan energi nasional. Program pengembangan sagu yang lebih gencar masih terbatas hanya di beberapa daerah khususnya di Riau dan Papua.
Perbanyakan sagu secara konvensional, menggunakan teknik perbanyakan vegetatif yaitu anakan (sucker), masih memiliki beberapa kendala antara lain:
massal dalam waktu relatif singkat, benih lebih homogen (genetik, umur, tinggi dan bobot benih ), biaya dan proses operasional pengangkutan benih dari sumber ke lahan kebun lebih efisien. Teknologi embriogenesis somatik mampu memproduksi benih sagu sebesar 100000 – 1000000 benih/laboratorium/tahun setelah melalui proses induksi kalus dan proliferasi kalus maupun embrio somatik yang membutuhkan waktu selama dua tahun. Produksi benih sagu secara konvensional hanya mencapai 500 – 2500 benih/ha/tahun (Flach 1997) atau bila kebun lebih luas mencapai 100 ha berpotensi menghasilkan benih sebanyak 50000 – 250000 benih/laboratotium/tahun.
Perbanyakan tanaman sagu secara konvensional dilakukan dengan dua metode yaitu secara generatif menggunakan biji dan secara vegetatif menggunakan anakan. Produksi biji sangat jarang karena tanaman sagu pada umumnya ditebang untuk diambil patinya sesaat sebelum berbunga. Oleh karena itu, sebagian besar tanaman sagu diperbanyak dengan anakan. Namun, untuk membangun perkebunan sagu skala besar, ketersediaan anakan yang seragam merupakan hambatan utama. Dari satu rumpun (cluster) tanaman sagu hanya
dapat diperoleh beberapa 5 – 20 anakan (Flach 1997). Di samping itu, bobot anakan yang baik berkisar antara 2 – 5 kg (Jong dan Widjono 2007; Rostiwati et al. 2008) sehingga menyulitkan dalam pengangkutannya. Hal ini merupakan
kendala yang dihadapi dalam pengembangan tanaman sagu secara massal baik oleh petani besar maupun perusahaan.
Perkembangan bioteknologi tanaman khususnya teknologi kultur in vitro
melalui embriogenesis somatik merupakan terobosan teknologi untuk memperbanyak tanaman unggul secara klonal dan massal dalam waktu relatif singkat. Keberhasilan embriogenesis somatik tanaman dipengaruhi oleh beberapa faktor yaitu komposisi media, jenis eksplan dan genotipe tanaman, penggunaan zat pengatur tumbuh (ZPT), lingkungan mikro seperti aerasi, intensitas cahaya dan temperatur (Tahardi et al. 2002; Alkhateeb 2006; Deo et al. 2010). Faktor yang
paling berpengaruh adalah komposisi dan konsentrasi jenis ZPT yang digunakan dalam media. Biasanya untuk menginduksi embrio somatik diperlukan auksin dalam konsentrasi rendah yang dikombinasikan dengan sitokinin yang sama atau lebih tinggi namun hal ini tergantung pada jenis tanaman. Ada beberapa tanaman yang dapat diinduksi embrio somatiknya hanya dengan menggunakan sitokinin saja. Konsentrasi auksin yang lebih tinggi akan mendorong pertumbuhan kalus dan justru akan menghambat induksi embriogenesis. Intensitas cahaya yang terlalu rendah atau kondisi gelap akan menghambat proses induksi embriogenesis somatik. Pemberian ABA dalam konsentrasi rendah atau sangat rendah dengan peningkatan konsentrasi sitokinin dan tanpa pemberian auksin akan mendorong pendewasaan embrio somatik (Tahardi et al. 2002; Deo et al. 2010).
Teknik kultur in vitro dengan embriogenesis somatik menggunakan kultur
cair telah banyak dikembangkan karena sistem kultur cair berpotensi lebih besar untuk produksi benih tanaman sagu klonal. Penerapan kultur cair ditujukan terutama untuk otomatisasi dan scale-up serta meningkatkan pertumbuhan dan
keseragaman kultur (Hvoslef-Eide et al. 2003), meningkatkan efisiensi proses
produksi. Teknik kultur cair memiliki beberapa kelebihan dibandingkan kultur media padat yaitu: bersifat lebih massal (Etienne dan Berthouly 2002; Hvoslef-Eide et al. 2003; Jones et al. 2007), lebih efisien dalam penggunaan bahan media,
Selain sistem kultur suspensi, teknik kultur cair lain adalah sistem perendaman periodik yang dikenal dengan sistem perendaman sesaat (SPS) atau temporary immersion system (TIS).
Embriogenesis somatik pada tanaman sagu telah dikembangkan oleh Tahardi et al. (2002) menggunakan sistem kultur media padat dengan eksplan
berupa jaringan pucuk meristem anakan muda (sucker). Namun, dalam
perkembangannya terutama untuk tujuan produksi skala lebih besar, sistem kultur media padat tersebut masih memiliki beberapa kendala khususnya dalam skala lebih massal. Biaya produksi embriogenesis somatik tanaman sagu metode kultur media padat memerlukan biaya yang cukup besar. Hal ini mendorong dikembangkannya penelitian embriogenesis somatik sagu yang lebih efisien sebagai terobosan teknologi baru untuk produksi sagu dalam jumlah yang lebih massal dengan waktu yang relatif lebih singkat. Oleh karena itu, kultur embriogenesis somatik tanaman sagu menggunakan metode kultur cair penting dikembangkan untuk meningkatkan efektifitas dan efisiensi proses produksi benih tanaman sagu unggul. Alur dan skema penelitian yang dilakukan dalam rangkaian kegiatan penelitian disertasi ini ditunjukkan pada Gambar 1.1.
1.2 Perumusan Masalah
Tanaman sagu merupakan salah satu tanaman penghasil karbohidrat yang berpotensi tinggi untuk meningkatkan sumber bahan pangan nasional. Tanaman sagu dapat menghasilkan karbohidrat tertinggi per luasan lahan yang sama dibandingkan dengan tanaman sumber karbohidrat lainnya seperti padi, jagung atau umbi-umbian. Kebun tanaman sagu dapat menghasilkan pati sebesar 20 – 40 ton/ha/tahun setelah memasuki masa panen sekitar delapan tahun dari awal penanaman (Bintoro et al. 2013). Tanaman sagu mempunyai fungsi ganda yaitu
sebagai sumber makanan pokok (staple food) dan bioenergi (penghasil bioetanol).
Adanya perkembangan zaman yang mempengaruhi gaya atau pola makan, hampir semua penduduk Indonesia mengonsumsi beras. Kondisi ini mungkin disebabkan karena beras lebih mudah dikelola karena lebih cepat panen dan mudah proses pemanenannya oleh petani. Sebagian penduduk Indonesia di beberapa daerah, nenek moyangnya mengonsumsi jagung, umbi-umbian, talas dan sagu sebagai makanan pokok. Hal ini berdampak pada peningkatan kebutuhan beras secara nasional semakin besar seiring dengan pertumbuhan penduduk yang cepat. Oleh karena itu, penting untuk dikembangkan diversifikasi pangan selain beras. Sagu mempunyai potensi paling besar untuk memenuhi kebutuhan pangan di Indonesia (Bintoro et al. 2013). Tepung sagu dapat diolah menjadi aneka ragam makanan
seperti kue, roti, mie maupun beras analog sebagai pengganti beras padi yang dapat dikembangkan dengan peningkatan teknologi pengolahan tepung pati sagu.
Teknologi embriogenesis somatik tanaman sagu dapat mendorong percepatan dalam upaya pengembangan tanaman sagu unggul. Jenis-jenis tanaman sagu unggul dengan produktivitas dan rendemen pati tinggi dan berumur lebih pendek merupakan tanaman sagu harapan masa depan untuk membantu meningkatkan ketahanan pangan nasional dan energi.
Perbedaan utama kondisi kultur antara metode media padat, suspensi dan TIS adalah frekuensi dan lama kontak eksplan dengan media. Eksplan pada kultur media padat mengalami kontak dengan media secara terus-menerus namun eksplan tetap diam berada pada tempat semula sehingga tingkat penyerapan media dan oksigen pada setiap bagian eksplan tidak sama. Pada kultur suspensi, eksplan terendam dalam media secara terus-menerus dan mengalami pengocokan sehingga tingkat penyerapan media dan oksigen lebih merata dibandingkan dengan kultur media padat. Kultur TIS merupakan modifikasi kultur suspensi dengan mengatur interval dan lama perendaman media sehingga tingkat sirkulasi oksigen (aerasi), penyerapan media lebih baik dibandingkan dengan kultur media padat dan tidak mengalami perendaman media secara terus-menerus seperti pada kultur suspensi.
Aplikasi kultur TIS telah dikembangkan pada tanaman kelapa sawit khususnya untuk meningkatkan pertumbuhan dan perkembangan kalus dan embrio somatik (Sumaryono et al. 2008). Pendewasaan embrio somatik tanaman
sagu telah berhasil dilakukan pada kultur metode TIS untuk menentukan interval dan lama perendaman yang optimal (Riyadi dan Sumaryono 2009). Namun, metode kultur suspensi pada tanaman kelapa sawit maupun sagu belum dikembangkan secara optimal. Kultur suspensi pada tanaman sagu penting dikembangkan untuk tujuan produksi benih yang lebih massal.
Hasil uji lapang benih kelapa sawit asal kultur TIS di kebun Mesuji milik PT Bina Sawit Makmur – PT Sampoerna Agro Tbk menunjukkan pertumbuhan dan perkembangan yang lebih baik dan telah berbunga dan berbuah normal dengan produktivitas yang lebih tinggi dibandingkan dengan kontrol dari kecambah. Abnormalitas buah dan bunga sawit asal kultur TIS yang terbentuk sangat kecil yaitu < 0.05% dengan sex ratio mencapai > 86%. Tanaman kelapa sawit kontrol asal kecambah menghasilkan sex ratio < 42% (Hasil penelitian intern PPBBI – PT Sampoerna Agro dan tidak dipublikasikan). Sex ratio bunga
kelapa sawit dijadikan dasar penghitungan produktifitas buah sawit. Hasil penelitian uji-lapangan kelapa sawit asal kultur TIS ini dapat dijadikan referensi untuk pengembangan kultur embriogenesis somatik metode kultur cair pada tanaman sagu.
1.3 Tujuan Penelitian
Penelitian embriogenesis somatik tanaman sagu metode kultur cair ini terutama ditujukan untuk meningkatkan efisiensi dalam produksi benih tanaman sagu bermutu. Beberapa teknik kultur media cair diteliti dan dikembangkan pada berbagai tahapan kultur in vitro mulai dari proliferasi kalus, induksi
embriogenesis somatik tidak langsung, diferensiasi kalus membentuk embrio somatik, pendewasaan, perkecambahan embrio somatik, pembesaran planlet, aklimatisasi planlet sagu asal kultur embrio somatik dalam upaya akhir memproduksi benih sagu unggul yang siap tanam. Untuk mengetahui tingkat keragaman genetik benih yang dihasilkan, maka dilakukan penelitian analisis kemiripan atau kesamaan genetik benih sagu menggunakan metode RAPD.
kemiripan atau kesamaan genetik benih yang dihasilkan. Secara rinci, penelitian ini mempunyai beberapa tujuan yaitu :
1. Mengembangkan teknologi embriogenesis somatik tanaman sagu pada media cair, khususnya melalui kultur suspensi (suspension culture) dan sistem
perendaman sesaat (SPS) atau temporary immersion system (TIS).
2. Mempelajari pertumbuhan dan perkembangan embrio somatik tanaman sagu pada tiga sistem kultur yang meliputi media padat, media cair metode suspensi dan media cair TIS.
3. Mempelajari dan menentukan perkembangan meristem bipolar (primordia tunas dan akar) embrio somatik menggunakan analisis histologi.
4. Mengembangkan regenerasi embrio somatik tanaman sagu dalam skala semi massal.
5. Mendapatkan embrio somatik dan benih tanaman sagu.
6. Menentukan tingkat kesamaan genetik (genetic similarity) benih sagu asal
kultur embriogenesis somatik.
7. Menentukan metode kultur paling efisien untuk produksi benih sagu teknologi kultur embriogenesis somatik.
1.4 Manfaat Penelitian
1. Pengembangan kultur suspensi dalam proses embriogenesis somatik pada tanaman khususnya pada sagu.
2. Membuktikan tentang keberhasilan kultur cair khususnya metode suspensi dalam proses embriogenesis somatik.
3. Memberikan gambaran perbedaan hasil kultur pada tiga metode kultur yaitu: media padat, cair sistem suspensi dan cair sistem TIS.
4. Dapat dijadikan sebagai acuan pengembangan kultur cair pada tanaman lainnya, khususnya famili Palmae (Arecaceae).
5. Berpotensi untuk dikembangkan dalam skala lebih besar (scalling up) untuk
produksi benih tanaman unggul.
1.5 Kebaruan Penelitian
1. Teknologi kultur suspensi dalam proses embriogenesis somatik tanaman sagu.
2. Didapatkan embrio somatik, planlet dan benih sagu dari metode kultur cair khususnya sistem suspensi.
3. Membuktikan adanya informasi tingkat kesamaan genetik (genetic similarity)
pada populasi benih sagu asal embrio somatik.
4. Potensi pengembangan teknologi kultur in vitro di laboratorium untuk
produksi benih tanaman sagu dengan skala yang lebih besar (> 100 ribu benih/laboratorium/tahun) dengan embrio somatik.
1.6 Ruang Lingkup Penelitian
genetik benih metode RAPD. Rangkaian tahapan penelitian yang dilaksanakan ditunjukkan pada Gambar 1.1 berikut.
: Tahapan penelitian : Hasil akhir setiap tahapan
Gambar 1.1 Diagram alur penelitian “Embriogenesis Somatik Sagu (Metroxyon sagu Rottb.) Metode Kultur Cair untuk Pengembangan Teknologi
Perbanyakan Benih Bermutu”.
Kecambah
4. Pembesaran kecambah pada kultur suspensi, TIS & padat 3. Perkecambahan embrio somatik
pada kultur suspensi, TIS & padat
5. Aklimatisasi planlet asal kultur embriogenesis somatik
6. Analisis tingkat kesamaan genetik benih asal embriogenesis somatik
metode RAPD
1. Embriogenesis somatik tidak langsung: a. Pada kultur suspensi
b. Proliferasi kultur embrionik pada metode suspensi, TIS & padat
2. Diferensiasi kalus membentuk embrio somatik pada kultur suspensi, TIS & padat:
a. Diferensiasi kalus b. Pendewasaan embrio somatik Induksi kalus eksplan tip meristem
dari anakan (sucker) pada media padat
Proliferasi kalus pada media padat untuk stok kalus di Laboratorium
Informasi kesamaan genetik benih Benih bermutu
Embrio somatik fase coleoptilar Kalus embriogenik & Embrio somatik
2 TINJAUAN PUSTAKA
2.1 Deskripsi Botani
Tanaman sagu merupakan tanaman monokotil yang hanya berbunga dalam satu siklus hidupnya. Setelah berbunga, daun tanaman sagu mengecil dan memendek dan selanjutnya tidak memproduksi daun lagi. Setelah buah tumbuh dan membesar, tanaman sagu mengalami senescens sehingga akan layu dan mati. Umur tanaman sagu tergantung jenis atau varietas yang berkisar 6 – 12 tahun pada setiap siklus hidup. Namun tanaman sagu mempunyai anakan (sucker) yang
cukup banyak antara 5 – 20 anakan dengan umur yang berbeda (Flach 1997; Kanro et al. 2003).
Secara umum, tanaman sagu tergolong menjadi dua jenis yaitu sagu berduri dan tidak berduri. Masing-masing jenis sagu tersebut masih terbagi menjadi banyak tipe atau jenis berdasarkan umur, ukuran pohon, kuantitas dan kualitas pati dan lain sebagainya (Flach 1997).
Tinggi tanaman sagu berkisar antara 6 – 16 m dengan diameter batang (tanpa seludang/pelepah) antara 35 – 60 cm. Pada saat umur panen, bobot segar batang mencapai 1 – 2 ton dengan kadar pati antara 150 – 700 kg per batang pohon. Panjang pelepah daun dapat mencapai 5 – 8 m dengan anak daun (leaflets)
sebanyak 100 – 190 buah yang panjangnya 150 cm dan lebarnya 10 cm. Bunga berbentuk inflorescens yang terletak di pucuk tanaman (flos terminalis) yang
muncul hanya sekali dalam satu siklus hidupnya (Flach 1997).
Sagu Alitir merupakan salah satu jenis sagu yang mempunyai produktivitas tinggi di Merauke. Deskripsi tanaman sagu jenis Alitir diperoleh dari data-data berdasarkan keterangan Staf Dinas Kehutanan dan Perkebunan Kabupaten Merauke (Anton dan Katherina, Komunikasi Pribadi) dan tokoh adat dan Kepala Kampung Suku Merauke di Kampung Salor Desa Mimahad Kecamatan Kurik (Martinus Basik Basik, Komunikasi Pribadi) pada saat eksplorasi bahan tanam sagu unggul di Papua. Deskripsi sagu jenis Alitir antara lain: umur 8 – 9 tahun per siklus hidup, jumlah sucker + 10 buah, pelepah berduri
dengan intensitas termasuk sedang, tinggi pohon 10 – 12 m, diameter batang 50 – 70 cm, panjang pelepah daun 5 – 7 m dengan jumlah anak daun (leaflet) 100 –
150 helai dan warna hijau-kebiruan atau hijau-gelap.
Tanaman sagu mempunyai banyak nama atau sebutan yang tersebar di wilayah Indonesia. Secara umum atau nasional tanaman sagu dikenal sebagai rumbia atau sagu. Beberapa nama lokal tanaman sagu yang tersebar di daerah Indonesia antara lain: kirai (Sunda atau Jawa Barat); ambulung, kersulu atau kresula (Jawa Tengah dan Jawa Timur), lapia atau napia (Ambon); tumba
(Gorontalo); Pogalu atau tabaro (Toraja); rambiam atau rabi (Kepulauan Aru)
(Flach 1997).
2.2 Taksonomi
2.3 Penyebaran dan Perkembangan
Luas areal tanaman sagu dunia diperkirakan lebih dari 6 juta ha dengan luas areal tanaman sagu di Indonesia mencapai 5.2 juta ha, di Papua Nugini 1.02 juta ha, dan sisanya di Malaysia, Thailand, Filipina dan lainnya (Flach 1997; Bintoro et al. 2013). Sebagian besar (+ 90%) areal sagu di Indonesia merupakan
tegakan alami terutama di Papua dan Maluku. Populasi tanaman sagu di Sulawesi, Kalimantan, Sumatera, kepulauan Riau dan Mentawai merupakan pertanaman semi-budidaya (Flach 1997; Kanro et al. 2003). Data luas areal sagu mutakhir
mencapai 5.2 juta ha dengan menambahkan adanya perkembangan areal sagu yang dikembangkan oleh Perusahaan Perkebunan seperti PT Sampoerna Agro, PT ANJ, Perhutani, PT Tiga Pilar (Bintoro et al. 2013).
Kriteria tanaman sagu unggul adalah: produksi pati tinggi, umur genjah, kulit batang tipis dan pati berwarna putih (Flach 1997). Produksi pati sagu di berbagai daerah di Indonesia sangat beragam dari 150 sampai 700 kg dengan rata-rata 300 kg pati basah per pohon (Haryanto dan Pangloli 1992). Hal ini disebabkan oleh keragaman genetik yang berada di beberapa daerah dan pulau yang tersebar di Indonesia (Abbas et al. 2009). Apabila genotipe sagu unggul
produksi tinggi (dapat mencapai 700 kg pati basah per pohon) mampu diperbanyak secara klonal maka produktivitas sagu dapat meningkat secara nyata. Kelebihan lain dari kultur in vitro adalah perbanyakan dapat dilakukan secara
massal dalam waktu yang relatif singkat. Untuk tanaman sagu, benih yang dihasilkan juga relatif kecil sehingga pengirimannya akan lebih mudah dan murah.
2.4 Manfaat dan Potensi
Secara turun-temurun sagu telah dimanfaatkan sebagai makanan pokok sebagian penduduk Indonesia bagian timur terutama Maluku, Kepulauan Sulawesi Utara (Sangihe dan Talaut) dan Papua (Flach 1997; Bintoro et al. 2013). Dengan
kemajuan teknik pengolahan, sagu dapat digunakan sebagai makanan olahan lain seperti mie, kue, biskuit dan aneka makanan kering lainnya (Kanro et al. 2003).
Dalam perkembangannya, pati sagu tidak hanya digunakan sebagai bahan makanan namun dapat juga digunakan sebagai bahan baku berbagai industri seperti untuk sirup fruktosa, farmasi, bioplastik, bahan perekat (adhessive gel),
bioetanol (bio energi) dan produk turunan lainnya (Flach 1997; Bintoro et.al
2013). Manfaat lain dari bagian-bagian tanaman sagu adalah sebagai berikut: daun digunakan untuk atap, pelepah digunakan untuk dinding atau pagar rumah, kulit batang digunakan sebagai bahan kayu bakar, seratnya dapat digunakan sebagai pakan ternak.
Dengan semakin luasnya potensi pengembangan pemanfaatan sagu, maka sagu berpotensi besar pada kegiatan industri sehingga akan meningkatkan nilai ekonomi petani sagu. Terkait dengan ketersediaan pangan, maka peningkatan budidaya dan pengolahan sagu dapat membantu pada peningkatan ketahanan pangan nasional sesuai program pemerintah. Selain itu, dengan menipisnya cadangan minyak fosil maka sagu dapat digunakan sebagai sumber bio energi berupa bio fuel yang dapat digunakan sebagai bahan bakar mesin-mesin pabrik
2.5 Embriogenesis Somatik Tanaman
Pengembangan teknologi embriogenesis somatik berdasarkan pada teori
totipotency yang dikemukakan oleh Schleiden (1838) dan Schwann (1839) yang
menyatakan bahwa satu sel tumbuhan atau tanaman mampu tumbuh dan berkembang menjadi individu baru yang sempurna dalam kondisi yang sesuai. Definisi embriogenesis somatik tanaman adalah suatu proses perkembangan sel somatik (baik haploid maupun diploid) yang membentuk individu tumbuhan baru melalui tahap perkembangan embrio yang spesifik tanpa melalui fusi gamet. Pemberian istilah embrio somatik pertama kali disampaikan oleh Tolkin (1964) yang menggambarkan pembentukan organisme dari suatu sel atau kumpulan sel somatik. Embrio somatik dapat dicirikan dari strukturnya yang bipolar, yaitu mempunyai dua calon meristem akar dan meristem tunas (Purnamaningsih 2002; Deo et al. 2010). Tahap perkembangan embrio somatik dimulai dari fase globular,
jantung atau hati (heart), torpedo, dan kotiledon (cotyledone) untuk tanaman
dikotil (Mandal dan Gupta 2002) sedangkan untuk tanaman monokotil tahap perkembangan embrio somatiknya adalah globular, elongated, scutellar dan coleoptilar (Godbole et al. 2002). Secara rinci, proses perkembangan embrio
somatik mulai dari stadium muda (globular) sampai menjadi stadium dewasa
yaitu cotyledone untuk tanaman dikotil dan coleoptilar untuk tanaman monokotil
ditunjukkan pada Gambar 2.1 berikut (George 1996).
Kelebihan benih embriogenesis somatik tanaman adalah mempunyai kemampuan tumbuh dan berkembang di lapangan dengan baik dan kokoh. Hal ini karena embrio somatik mempunyai poros bipolar yang menghubungkan titik tumbuh bagian atas dan titik tumbuh bagian bawah. Titik tumbuh bagian atas atau SAM (shoot apical meristem) akan mendorong pertumbuhan dan perkembangan
tunas, sedangkan titik tumbuh bagian bawah berupa RAM (root apical meristem)
akan mendorong pertumbuhan dan perkembangan perakaran. Melalui poros tersebut, titik tumbuh bagian atas akan mendukung dalam mempengaruhi pertumbuhan dan perkembangan perakaran sehingga akar tumbuh dan berkembang secara kokoh (Tahardi et al. 2002; Deo et al. 2010). Hal ini mirip
seperti pertumbuhan dan perkembangan dari biji yang mempunyai perakaran utama yang kokoh. Perakaran yang kokoh akan berpengaruh terhadap pertumbuhan dan perkembangan tanaman di lapangan sehingga berpengaruh pada hasil panen.
Proses pembentukan atau induksi embrio somatik dimulai dengan mengulturkan bahan tanam berupa eksplan (explants) yang berupa sel, jaringan
ataupun organ. Embrio somatik dapat terbentuk melalui dua jalur, yaitu secara langsung maupun tidak langsung (melewati fase kalus). Keberhasilan induksi embrio somatik dipengaruhi oleh sifat embriogenisitas pada kalus atau sel dengan ciri-ciri sebagai berikut: sel berukuran kecil, sitoplasma padat, inti besar, vakuola kecil-kecil dan mengandung butir pati (Purnamaningsih 2002; Deo et al. 2010).
Keuntungan atau kelebihan teknologi embriogenesis somatik dibandingkan dengan perbanyakan tanaman konvensional adalah dapat diperoleh benih yang bersifat klonal (seragam) dalam waktu relatif singkat dengan jumlah atau skala yang lebih massal (Tahardi et al. 2002; Deo et al. 2010).
Keberhasilan embriogenesis somatik tanaman dipengaruhi oleh beberapa faktor yaitu komposisi media, jenis eksplan dan genotipe tanaman, penggunaan zat pengatur tumbuh (ZPT), lingkungan mikro seperti aerasi, intensitas cahaya dan temperatur (Tahardi et al. 2002; Alkhateeb 2006; Deo et al. 2010). Faktor yang
paling berpengaruh adalah komposisi dan konsentrasi dari jenis ZPT yang digunakan dalam media. Biasanya untuk menginduksi embrio somatik diperlukan auksin dalam konsentrasi rendah yang dikombinasikan dengan sitokinin yang sama atau lebih tinggi namun hal ini tergantung pada jenis tanaman. Ada beberapa tanaman yang dapat diinduksi embrio somatiknya hanya dengan menggunakan sitokinin saja. Konsentrasi auksin yang lebih tinggi akan mendorong pertumbuhan kalus dan justru akan menghambat induksi embriogenesis. Intensitas cahaya yang terlalu rendah atau kondisi gelap akan menghambat proses induksi embriogenesis somatik. Pemberian ABA dalam konsentrasi rendah atau sangat rendah dengan peningkatan konsentrasi sitokinin dan tanpa pemberian auksin akan mendorong pendewasaan embrio somatik (Tahardi et al. 2002; Deo et al. 2010).
Penelitian teknologi embriogenesis somatik telah berhasil dikembangkan pada beberapa tanaman dikotil maupun monokotil (Deo et al. 2010). Khusus pada
tanaman palma, pengembangan embriogenesis somatik juga telah berhasil seperti pada kelapa sawit (Rival et al. 1997), kelapa (Saenz et al. 2006), kurma
(Alkhateeb 2006), pejibaye atau peach palm (Steinmacher et al. 2007) dan sagu
(Tahardi et al. 2002).
eksplan berupa jaringan pucuk meristem dari tunas anakan muda (sucker).
Eksplan dikulturkan pada medium MS (Murashige dan Skoog 1962) yang modifikasi untuk mendapatkan kalus. Selanjutnya, embrio somatik diinduksi dari kalus embriogenik yang merupakan hasil perkembangan kalus tersebut. Perkembangan embrio somatik tanaman sagu pada medium padat juga telah dilaporkan oleh Riyadi et al. (2005). Dari kalus awal seberat 0.3 g dapat
dihasilkan sebanyak 130-200 embrio somatik pada berbagai fase perkembangan dalam waktu 4 minggu. Embrio somatik telah berhasil tumbuh dan berkembang menjadi planlet. Planlet yang telah mempunyai sistem perakaran baik atau sempurna maka selanjutnya diaklimatisasi pada komposisi media yang sesuai. Planlet yang tumbuh dan berkembang menjadi benih dalam sungkup dan pre-nursery selanjutnya ditransfer ke pesemaian (main-nursery) sampai menjadi benih
yang siap tanam di lapang (Riyadi dan Sumaryono 2010). Namun, dalam perkembangannya terutama untuk tujuan produksi skala lebih besar, sistem kultur media padat tersebut masih memiliki beberapa kendala. Beberapa masalah atau kendala kultur media padat sagu antara lain: 1. Adanya variasi embrio somatik yang meliputi warna, ukuran dan tahap perkembangan (Kasi dan Sumaryono 2006) yang kemungkinan diakibatkan oleh perbedaan tingkat penyerapan nutrisi dari media padat. 2. Terdapat planlet yang dihasilkan masih kurang vigor (Sumaryono et al. 2009) sehingga pertumbuhannya menjadi lambat. 3. Kapasitas
produksi embrio somatik masih terbatas. 4. Memerlukan peralatan, bahan media dan tenaga yang relatif banyak. Hal ini mendorong dikembangkannya penelitian embriogenesis somatik sagu yang lebih efisien untuk produksi sagu dalam jumlah yang lebih massal dengan waktu yang relatif lebih singkat.
Teknik kultur in vitro dengan embriogenesis somatik menggunakan kultur
cair telah banyak dikembangkan. Teknik kultur cair memiliki beberapa kelebihan dibandingkan kultur media padat yaitu: bersifat lebih massal (Etienne dan Berthouly 2002; Hvoslef-Eide et al. 2003; Jones et al. 2007), lebih efisien dalam
penggunaan bahan media, peralatan dan tenaga kultur, serta lebih praktis dan ringan proses pengerjaannya. Selain sistem kultur suspensi, teknik kultur cair lain adalah sistem perendaman periodik yang dikenal dengan sistem perendaman sesaat (SPS) atau temporary immersion system (TIS). Pada sistem ini perendaman
berlangsung tidak terus menerus sehingga transfer oksigen cukup, pencampuran memadai, kontaminasi rendah, dan biaya relatif murah (Teisson et al. 1999;
Etienne dan Berthouly 2002).
Aplikasi kultur TIS telah dikembangkan pada tanaman kelapa sawit khususnya untuk meningkatkan pertumbuhan dan perkembangan kalus dan embrio somatik (Sumaryono et al. 2008). Pendewasaan embrio somatik tanaman
3 EMBRIOGENESIS SOMATIK TIDAK LANGSUNG
TANAMAN SAGU (Metroxylon sagu Rottbol) DENGAN
MENGGUNAKAN TIGA METODE KULTUR
1,2Abstrak
Metode kultur in vitro dengan penggunaan media dan zat pengatur tumbuh
(ZPT) yang tepat akan meningkatkan efektifitas dan efisiensi pada proses multiplikasi kalus maupun induksi embriogenesis somatik. Penelitian ini bertujuan untuk menentukan metode induksi embriogenesis somatik tidak langsung tanaman sagu pada kultur cair metode suspensi dan temporary immersion system (TIS) dengan media padat sebagai kontrol. Di samping itu,
penentuan pengaruh ZPT berupa TDZ, kinetin dan 2,4-D terhadap induksi embriogenesis somatik dan multiplikasi kalus sagu. Bahan tanam atau eksplan awal yang digunakan adalah kalus remah hasil induksi dari kultur meristem pucuk tunas anakan sagu. Penelitian terdiri atas dua tahap yaitu induksi embriogenesis somatik sagu metode kultur suspensi dan multiplikasi kalus pada proses induksi embrogenesis somatik pada tiga metode kultur yaitu suspensi, TIS dan media padat. Pada percobaan tahap pertama, kalus tersebut dikulturkan pada media Murashige Skoog (MS) yang dimodifikasi dengan perlakuan konsentrasi kinetin 0, 1, 3 dan 5 mg L-1 kinetin secara tunggal maupun kombinasi dengan thidiazuron
(TDZ) 1.0 mg L-1 sehingga ada tujuh perlakuan. Pada percobaan tahap kedua,
kalus tersebut dikulturkan pada media MS yang dimodifikasi dengan penambahan 2,4-D yang terdiri atas empat konsentrasi: 0, 5, 10 dan 15 mg L-1 dikombinasikan
dengan kinetin 0.1 mg L-1 yang menggunakan tiga metode kultur yaitu kultur
suspensi, TIS dan media padat, sehingga terdapat 12 kombinasi perlakuan. Hasil percobaan pertama menunjukkan bahwa perlakuan terbaik dicapai pada perlakuan kinetin 1 mg L-1 yang menghasilkan embrio somatik sebanyak 123.9
buah/Erlenmeyer dan bobot segar 3.2 g/Erlenmeyer. Hasil percobaan kedua menunjukkan bahwa perlakuan terbaik dicapai oleh metode kultur suspensi dengan media yang mengandung 2,4-D 5 mg L-1 dikombinasikan dengan kinetin
0.1 mg L-1 yang menghasilkan rerata bobot segar kalus sebesar 9.3 g/bejana dan
rerata jumlah embrio somatik sebanyak 384.7 buah/bejana. Selama proses induksi embrio somatik, terjadi perubahan warna kalus dari sebagian besar kekuningan menjadi krem dan putih-kekuningan.
Kata Kunci: 2,4-D, embrio somatik, kinetin, metode kultur, multiplikasi kalus, thidiazuron (TDZ).
1Sebagian makalah (percobaan tahap pertama) telah diproses publikasi di Indian
Journal of Experimental Biology (IJEB).
2Sebagian makalah (percobaan tahap kedua) telah diproses publikasi di Jurnal
3.1 Pendahuluan
Dalam upaya penyediaan benih sagu unggul secara massal, penting untuk dikembangkan teknik perbanyakan in vitro menggunakan embriogenesis
somatik. Proses embriogenesis somatik tanaman dapat dijadikan metode perbanyakan tanaman unggul yang mempunyai beberapa kelebihan yaitu bersifat lebih massal, homogen dan bersifat klonal (Tahardi et al. 2002).Auksin yang dikombinasikan dengan sitokinin sering ditambahkan dalam media untuk menginduksi kalus maupun embrio somatik dengan gradasi konsentrasi auksin. Auksin yang sering digunakan adalah 2,4-D karena lebih kuat daya induksinya dan harganya lebih murah dibandingkan jenis auksin lainnya (Alkhateeb 2006; Cai et al. 2009; You et al. 2011; Munoz-Concha et al. 2011; Hajong et al. 2013;
Boufis et al, 2014). Penelitian embriogenesis somatik tanaman sagu telah berhasil
dikembangkan oleh Tahardi et al. (2002) yang menggunakan sistem kultur media
padat. Namun, untuk pengembangan secara komersial, teknik media padat tersebut masih memiliki beberapa kendala terutama tingkat efisiensi yang rendah. Untuk meningkatkan efektifitas dan efisiensi dalam produksi embrio somatik, maka penelitian embriogenesis somatik sagu dengan teknik media cair penting untuk dikembangkan.
Metode kultur cair telah berhasil dikembangkan pada beberapa tanaman yaitu yam (Dioscorea alata L.) „Pacala Duclos‟ (Jova et al. 2011), black gram
(Vigna mungo L.) Hepper (Muruganantham et al. 2010), cucumber (Cucumis sativus L.) (Konstas & Kintzios 2003), Stevia rebaudiana (Gupta et al. 2014), and Wasabia japonica (Hung et al. 2006). Penerapan kultur cair pada tanaman dapat
menghasilkan benih yang lebih baik dan efisien dibandingkan dengan kultur media padat (Etienne & Berthouly 2002; Hvoslef-Eide et al. 2003).
Penerapan kultur cair ditujukan untuk otomatisasi dan scale-up serta
meningkatkan pertumbuhan dan keseragaman kultur (Muruganantham et al. 2010;
Jova et al. 2011; Gupta et al. 2014). Beberapa teknik kultur cair potensial adalah
perendaman periodik yang dikenal dengan sistem perendaman sesaat (SPS) atau
temporary immersion system (TIS) dan kultur suspensi (suspension culture).
Hasil penelitian pada kelapa sawit menggunakan metode TIS menunjukkan bahwa produksi embrio somatik dari kalus noduler cukup tinggi dan embrio somatik yang dihasilkan lebih seragam (Tahardi, 1998). Pada sistem kultur suspensi, perendaman berlangsung secara terus-menerus yang dikocok (shake) di atas orbital shaker sehingga oksigen maupun nutrisi yang terkandung dalam media
dapat merata homogen dalam larutan media tersebut (Jova et al. 2011;
Munoz-Concha et al. 2011; Boufis et al. 2014; Gupta et al. 2014). Penelitian ini bertujuan
untuk menentukan konsentrasi kinetin dan TDZ dalam proses embriogenesis somatik pada kultur suspensi dan menentukan konsentrasi 2,4-D dalam proses proliferasi kalus bersamaan induksi embrio somatik sagu pada tiga metode kultur yaitu sistem media padat, TIS dan suspensi.
3.2 Bahan dan Metode
3.2.1 Tempat Penelitian dan Bahan Tanaman
Maret 2014 (Percobaan kedua) yang dilakukan di Laboratorium Biak Sel & Mikropropagasi Tanaman, Pusat Penelitian Bioteknologi dan Bioindustri Indonesia, Bogor. Bahan tanaman yang digunakan berupa kalus remah (subkultur 24 kali) yang telah tersedia di laboratorium hasil induksi dan inisiasi dari jaringan meristem pucuk anakan tanaman sagu jenis Alitir asal Merauke, Papua (Gambar 3.1.a).
3.2.2 Rancangan Penelitian
Penelitian ini menggunakan metode rancangan acak lengkap faktorial dengan sepuluh ulangan pada percobaan tahap 1 dan tiga ulangan pada percobaan tahap 2. Data-data hasil pengamatan pada setiap peubah diuji statistik menggunakan analisis keragaman (ANOVA). Perbedaan antar-perlakuan ditentukan dengan uji jarak berganda Duncan atau Duncan Multiple Range Test (DMRT) pada taraf uji α = 0.05. Analisis statistik untuk data-data setiap peubah
menggunakan program SPSS versi 19.
3.2.2.1 Embriogenesis Somatik pada Kultur Suspensi
Kalus remah sebanyak 0.3 g dikulturkan pada media MS yang dimodifikasi (Tahardi et al. 2002) berbentuk cair. Perlakuan yang digunakan
adalah konsentrasi kinetin 0, 1, 3, 5 mg L-1 secara tunggal maupun kombinasi
dengan TDZ 1 mg L-1 sehingga terdapat tujuh perlakuan. Volume media diatur sebanyak 30 mL/bejana menggunakan tabung Erlenmeyer volume 100 mL yang selanjutnya ditempatkan di atas orbital shaker dengan kecepatan 80 rpm selama 10 minggu dengan subkultur sekali pada umur empat minggu (Gambar 3.1.b).
Gambar 3.1 Proses inisiasi kultur suspensi sagu: (a) Kalus remah sebagai sumber inokulum; (b) Populasi kultur suspensi sagu pada orbital shaker; (c) Biomassa awal kultur suspensi pada saat pengukuran dengan alat CVS. Bar = 1 cm untuk a &10 cm untuk b).
3.2.2.2 Embriogenesis Somatik dengan Tiga Metode Kultur Proliferasi Kalus dan Pertumbuhan Biomassa
Perlakuan yang digunakan yaitu kombinasi ZPT dan metode kultur terdiri atas beberapa level sub perlakuan, yaitu : perlakuan konsentrasi 2,4-D terdiri atas 4 level (0, 5, 10 dan 15 mg L-1) yang masing-masing dikombinasikan dengan
kinetin 0.1 mg L-1 kecuali pada 0 mg L-1 (kontrol). Perlakuan metode kultur terdiri atas 3 level antara lain kultur suspensi menggunakan tabung Erlenmeyer 250 mL (Gambar 3.2.b), temporary immersion system (TIS) menggunakan bejana merk
Nalgen volume 500 mL (Gambar 3.2.c) dan media padat menggunakan botol jar (Gambar 3.2.d). Secara rinci, terdapat 12 kombinasi perlakuan yang diuji.
Proses kultur sagu ini diatur dalam kondisi yang sama dan homogen yang meliputi sumber eksplan, kondisi laminar air flow, peralatan kultur (spatula,
pinset, jarum) dan kondisi ruangan tempat kultur. Hal ini untuk membuat kondisi yang homogen dan menjaga dari kontaminasi dari faktor eksternal. Penelitian ini terdiri atas dua kultur yang berkesinambungan yaitu kultur 6 minggu dan kultur 12 minggu. Pada kultur awal atau kultur 6 minggu, sebanyak 0.5 g kalus remah tanaman sagu jenis Alitir dimasukkan dalam bejana/wadah sesuai dengan perlakuan dengan volume media masing-masing sebanyak 50 mL (Gambar 3.2.a). Pada tahap kultur 12 minggu, semua hasil kultur 6 minggu langsung disubkultur sebagai eksplan.
Gambar 3.2 Kultur awal kalus remah sagu (inisiasi embriogenesis somatik) pada ketiga metode kultur: a). Eksplan kalus remah sebelum dikulturkan, b). Kultur suspensi di atas orbital shaker, c). Kultur TIS, dan d).
Kultur media padat di dalam botol jar. Bar = 1 cm.
3.2.2.3 Pelaksanaan Kegiatan Penelitian
Eksplan kalus remah sagu Alitir dikulturkan pada medium padat MS (Murashige dan Skoog 1962) yang dimodifikasi (MMS) seperti dilaporkan oleh Tahardi et al. (2002) sampai terbentuk kalus. Kalus yang dihasilkan dijadikan
eksplan untuk menginduksi embrio somatik sesuai perlakuan yang diuji. Tingkat keasaman medium diatur pada pH 5.7 selanjutnya ditambahkan Gelrite 3 g L-1
khusus pada media padat, sedangkan media untuk TIS ditambahkan antibiotik berupa Rifampicin dan Tetracyclin dengan konsentrasi masing-masing 15 mg L-1
Media padat TIS
Suspensi
a b
untuk menjaga kontaminasi dari bakteri. Selanjutnya media tersebut beserta zat antibiotik yang terkandung disterilisasi dalam autoklaf pada suhu 121 0C dengan
tekanan 1 kg cm-2 selama 20 menit.
Kalus sagu pada semua perlakuan dikulturkan di dalam ruang terang di bawah lampu TL dengan intensitas cahaya 30 μmol foton m-2 s-1 dan lama penyinaran 12 jam dengan suhu ruangan 26 + 1 0C selama 6 minggu (kultur 6
minggu). Percobaan pertama dilakukan subkultur dengan media dan perlakuan ZPT yang sama pada umur 6 minggu (kultur 6 minggu), selanjutnya durasi subkultur (kultur 10 minggu) selama 4 minggu sehingga dipanen pada umur 10 minggu. Pada percobaan kedua, setelah diamati pada umur 6 minggu (kultur 6 minggu) selanjutnya semua kultur disubkultur (kultur 12 minggu) selama 6 minggu lagi pada media yang sama sehingga total kultur selama 12 minggu. Kultur suspensi ditempatkan pada shaker dengan kecepatan 80 rpm. Kultur TIS diatur dengan timer merk AUTONIC yang mengatur interval perendaman setiap 6 jam selama tiga menit per perendaman media.
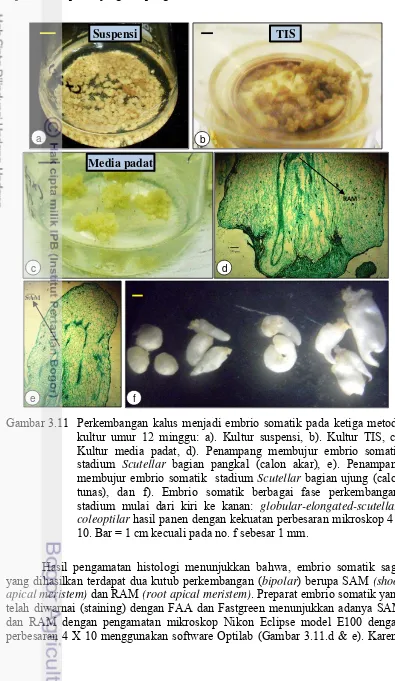
Sampel untuk pengamatan histologi adalah embrio somatik pada stadium
scutellar. Sampel tersebut difiksasi dengan formaldehid/asam asetat/alkohol
(FAA) dengan konsentrasi 50% (v/v) selama 48 jam menurut protocol Johansen (1940). Selanjutnya, sampel tersebut ditransfer ke dalam etanol 70% dan didehidrasi dalam seri etanol. Sampel direndam di dalam parafin dengan temperatur 60 ºC. Selanjutnya, sampel dipotong secara melintang menggunakan mikrotom (rotary microtom) dengan mata pisau terbuat dari baja ketebalan 10 µm.
Hasil potongan ditempatkan di atas kaca objek (slide) dan diwarnai (staining)
dengan Safranin dan Fast Green selama 10 menit (O‟Brien et al. 1965). Kaca
objek permanen yang mengandung sampel tersebut ditutup dengan resin sintetik (Entelan®). Pengambilan foto histologi embrio somatik menggunakan alat bantu mikroskop kamera Nikon Eclipse model E100 dengan perbesaran 4 X 10 menggunakan software Optilab. Skala gambar diatur dengan memproyeksikan pada kondisi optik yang sama.
Peubah yang diamati pada penelitian ini terdiri atas aspek pertumbuhan dan perkembangan, histologi embrio somatik serta persentase hidup (survival rate) kultur in vitro. Secara rinci, peubah yang diamati yaitu: proliferasi kalus
dihitung berdasarkan pertumbuhan biomassa berupa bobot segar [khusus untuk percobaan pertama juga menggunakan metode CVS (Cell Volume after Sedimentation) (Gambar 2.c)], jumlah embrio somatik yang terbentuk, persentase
hidup total kultur dan perubahan warna dominan kultur. Pada alat CVS, telah dipasang mistar dalam ukuran cm yang telah dikalibrasi ke volume dengan satuan mL.
3.3Hasil dan Pembahasan
3.3.1 Embriogenesis Somatik pada Kultur Suspensi
3.3.1.1 Pertumbuhan Biomassa
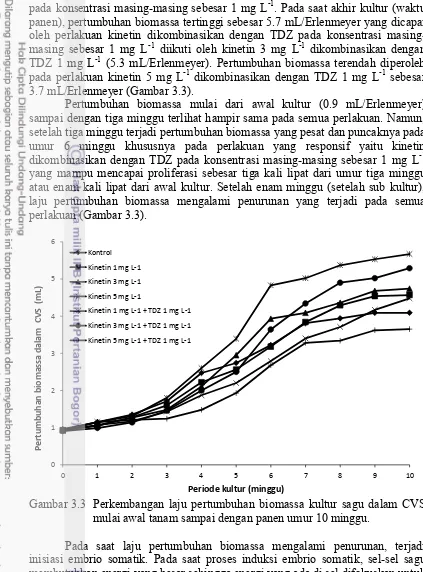
0
pada konsentrasi masing-masing sebesar 1 mg L-1. Pada saat akhir kultur (waktu panen), pertumbuhan biomassa tertinggi sebesar 5.7 mL/Erlenmeyer yang dicapai oleh perlakuan kinetin dikombinasikan dengan TDZ pada konsentrasi masing-masing sebesar 1 mg L-1 diikuti oleh kinetin 3 mg L-1 dikombinasikan dengan
TDZ 1 mg L-1 (5.3 mL/Erlenmeyer). Pertumbuhan biomassa terendah diperoleh pada perlakuan kinetin 5 mg L-1 dikombinasikan dengan TDZ 1 mg L-1 sebesar
3.7 mL/Erlenmeyer (Gambar 3.3).
Pertumbuhan biomassa mulai dari awal kultur (0.9 mL/Erlenmeyer) sampai dengan tiga minggu terlihat hampir sama pada semua perlakuan. Namun, setelah tiga minggu terjadi pertumbuhan biomassa yang pesat dan puncaknya pada umur 6 minggu khususnya pada perlakuan yang responsif yaitu kinetin dikombinasikan dengan TDZ pada konsentrasi masing-masing sebesar 1 mg L-1
yang mampu mencapai proliferasi sebesar tiga kali lipat dari umur tiga minggu atau enam kali lipat dari awal kultur. Setelah enam minggu (setelah sub kultur), laju pertumbuhan biomassa mengalami penurunan yang terjadi pada semua perlakuan (Gambar 3.3).
Gambar 3.3 Perkembangan laju pertumbuhan biomassa kultur sagu dalam CVS mulai awal tanam sampai dengan panen umur 10 minggu.