STATUS RESISTENSI
Tribolium castaneum
HERBST DAN
Araecerus fasciculatus
DE GEER ASAL GUDANG BIJI KAKAO
DI MAKASSAR SULAWESI SELATAN TERHADAP FOSFIN
SRI WIDAYANTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
iii
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Status Resistensi Tribolium castaneum Herbst dan Araecerus fasciculatus De Geer Asal Gudang Biji Kakao di Makassar Sulawesi Selatan terhadap Fosfin adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
SRI WIDAYANTI. Status Resistensi Tribolium castaneum Herbst dan Araecerus fasciculatus De Geer Asal Gudang Biji Kakao di Makassar Sulawesi Selatan terhadap Fosfin. Dibimbing oleh DADANG dan IDHAM SAKTI HARAHAP.
Kakao merupakan salah satu komoditas perkebunan yang mempunyai peranan penting bagi perekonomian Indonesia dan menjadi sumber pendapatan serta devisa negara. Kerusakan biji kakao oleh serangan hama pascapanen selama di penyimpanan dapat menyebabkan kerugian secara ekonomi. Adanya infestasi hama pada biji kakao tersebut menjadi salah satu alasan Amerika Serikat memberlakukan kebijakan automatic detention terhadap produk kakao Indonesia. Pengendalian hama pascapanen pada biji kakao pada umumnya dilakukan melalui penyemprotan dan pengabutan insektisida sintetik serta fumigasi fosfin. Fumigasi fosfin umum dilakukan baik untuk perawatan biji kakao maupun untuk keperluan perlakuan karantina dan pra-pengapalan. Fumigasi yang dilakukan dengan teknik yang tidak baik dan benar, penggunaan dosis yang tidak tepat, serta penggunaan bahan aktif yang sama terus menerus dalam jangka waktu lama dapat menyebabkan berkembangnya generasi hama yang resisten terhadap fosfin.
Tujuan penelitian ini untuk mendeteksi status resistensi serangga Tribolium castaneum Herbst dan Araecerus fasciculatus De Geer asal gudang biji kakao di Makassar Sulawesi Selatan terhadap fosfin dan mengonfirmasi hasil pengujian resistensi melalui pengujian efikasi lapangan untuk mendapatkan dosis fosfin efektif terhadap serangga resisten. Hasil penelitian ini diharapkan dapat menjadi rujukan bagi pengelola penyimpanan biji kakao dalam melakukan fumigasi terutama untuk serangga yang telah resisten terhadap fosfin sebagai bagian dari manajemen pascapanen. Hasil penelitian ini juga diharapkan dapat digunakan sebagai rujukan dalam dunia perdagangan dan perkarantinaan sebagai tindakan pencegahan agar komoditas yang terinfestasi serangga resisten tidak menjadi media penyebar meluasnya perkembangan serangga resisten baik secara nasional maupun internasional.
Penelitian ini dilakukan meliputi pengambilan sampel serangga T. castaneum dan A. fasciculatus dan data penggunaan fosfin di 5 gudang biji
kakao di Makassar yaitu Gudang 1, 2, 3, 4 dan 5 (G1, G2, G3, G4, dan G5), mengidentifikasi dan memperbanyak serangga di Laboratorium Entomologi, SEAMEO BIOTROP, menguji resistensi fase larva, pupa dan imago serangga T. castaneum dan A. fasciculatus terhadap fosfin dengan menggunakan metode standar rekomendasi FAO dan menguji efikasi lapangan serangga yang terdeteksi resisten terhadap fosfin.
ii
imago A. fasciculatus hanya dari G1 sebesar 5.89 kali. Meskipun telah terjadi resistensi berdasarkan metode uji standar FAO, tetapi berdasarkan pengujian efikasi lapangan, hasil penelitian menunjukkan bahwa dosis fosfin 2 tablet/m3
masih dapat digunakan untuk mengendalikan serangga T. castaneum dan A. fasciculatus yang telah resisten.
iii
SUMMARY
SRI WIDAYANTI. Resistance Status of Tribolium castaneum Herbts and Araecerus fasciculatus De Geer from Cocoa Beans Storage in Makassar South economical loss for the farmers. Pest infestation on cocoa beans is among reasons for the United States of America to implement automatic detention to cocoa beans from Indonesia. The post harvest pest control on cocoa beans is conducted by spraying and fogging using synthetic insecticide and fumigation using phosphine. The phosphine fumigation is usually applied for cocoa beans maintenance in the storage, quarantine and pre-shipment purposes. Improper fumigation technique, inappropriate dosages and the use of the same active ingredient continuously over long periods can lead to the development of the generation of pests that are resistant to phosphine.
This research was aimed to detect resistance occurance of Tribolium castaneum Herbst and Araecerus fasciculatus De Geer from cocoa beans storage in Makassar, South Sulawesi to phosphine and to obtain information on effective dosage of phosphine to control resistance strains of insect through efficacy test in the field. Research result are intended to be a guideline for cocoa beans warehouse controller in conducting fumigation, especially for storage pests that have been resistant to phosphine. The research result is also to be used as a guideline for prevention action in trading and quarantine field, so that the infected commodities will not be the disseminating agents for the already resistant storage pests both nationally and internationally.
Four activities were conducted in this research i.e. 1. sampling of storage pests T. castaneum and A. fasciculatus and phosphine usage data in 5 cocoa beans warehouse in Makassar, South Sulawesi Province i.e. Warehouse 1, 2, 3, 4 and 5 (G1, G2, G3, G4 and G5); 2. identification and mass rearing of the sampled storage pests in Entomology Laboratory of SEAMEO BIOTROP; 3. testing resistance on larvae, pupae, and adult of T. castaneum and A. fasciculatus to phosphine using standardized method recommended by FAO; 4. testing in-field efficacy on the sampled storage pests which are detected to be resistant to phosphine.
iv
v
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
vii
STATUS RESISTENSI
Tribolium castaneum
HERBST DAN
Araecerus fasciculatus
DE GEER ASAL GUDANG BIJI KAKAO
DI MAKASSAR SULAWESI SELATAN TERHADAP FOSFIN
SRI WIDAYANTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Entomologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
viii
xi
PRAKATA
Puji dan syukur alhamdulillah penulis panjatkan kehadirat Allah Subhanahu wa ta’ala atas ridho dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian ini mengambil tema resistensi fosfin dengan judul Status Resistensi Tribolium castaneum Herbst dan Araecerus fasciculatus De Geer Asal Gudang Biji Kakao di Makassar Sulawesi Selatan terhadap Fosfin, yang dilaksanakan sejak bulan Juni 2014 sampai Juli 2015 di gudang biji kakao di Makassar Sulawesi Selatan dan Laboratorium Entomologi SEAMEO BIOTROP Bogor.
Penulis menyampaikan terima kasih kepada Prof Dr Ir Dadang, MSc dan Dr Ir Idham Sakti Harahap, MSi selaku ketua dan anggota komisi pembimbing yang telah banyak memberi masukan, arahan, saran, bimbingan dan motivasi serta membagikan ilmunya. Penghargaan dan terima kasih juga penulis sampaikan kepada SEAMEO BIOTROP yang telah memberikan dana untuk pelaksanaan penelitian ini melalui pendanaan DIPA SEAMEO SEAMOLEC, Sekretariat Jenderal, Kementerian Pendidikan dan Kebudayaan Republik Indonesia. Terima kasih juga penulis sampaikan kepada Bapak Nasruddin, SP, Ibu Ambar Sayekti, Bapak Jufri, SP. beserta para staf di Jajaran Balai Besar Karantina Pertanian Makassar, perusahaan fumigator anggota ASPPHAMI Makassar seperti PT Sucofindo Cabang Makassar, PT Terminix Cabang Makassar, PT Pan Asia Superintendence Corp Cabang Makassar, PT Cahaya Timur atas kontribusinya dalam pengumpulan data dan bahan penelitian, serta perusahaan eksportir kakao di Makassar, Sulawesi Selatan atas izin yang diberikan kepada penulis untuk melakukan pengambilan sampel.
Ungkapan terima kasih juga disampaikan kepada ibunda Mukiyah, suami Saptono, ananda Muhammad Nizar Fauza Hanif dan Maula Afiif Najmi Samawa serta seluruh keluarga, atas doa dan dukungannya selama penulis menyelesaikan studi hingga berhasil menyelesaikan tesis. Penulis juga menyampaikan terima kasih kepada Jajaran Pimpinan SEAMEO BIOTROP yang telah memberikan izin penulis untuk melanjutkan studi dan melaksanakan penelitian di SEAMEO BIOTROP, serta rekan-rekan di Laboratorium Entomologi SEAMEO BIOTROP, Mba Wiwi, Mba Herni, Heriyanto dan teman-teman di Laboratorium Riset atas dukungan dan bantuan selama penulis melaksanakan penelitian dan penulisan tesis.
Penulis berharap semoga tesis ini dapat memberikan manfaat bagi yang memerlukannya dan dapat berkontribusi dalam pengkayaan pengetahuan bagi pemangku kepentingan.
Bogor, September 2016
xiii
DAFTAR ISI
DAFTAR ISI xiii
DAFTAR TABEL xv
DAFTAR GAMBAR xvi
DAFTAR LAMPIRAN xvi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 3
Hipotesis Penelitian 3
Manfaat Penelitian 3
TINJAUAN PUSTAKA 4
Nilai Penting Kakao di Indonesia 4
Permasalahan Hama pada Biji Kakao selama Penyimpanan 5
Permasalahan Ekspor Kakao Indonesia 6
T. castaneum Herbst (Coleoptera: Tenebrionidae) 6 A. fasciculatus De Geer (Coleoptera: Anthribidae) 8
Jenis-Jenis Fumigan 8
Penggunaan Fosfin sebagai Fumigan 9
Cara Kerja dan Sifat Fosfin 10
Resistensi Serangga terhadap Fosfin 11
METODE 14
Tempat dan Waktu 14
Bahan dan Alat 14
Pengambilan Sampel Serangga dan Data Penggunaan Fosfin 15 Identifikasi dan Perbanyakan T. castaneum dan A. fasciculatus 15 Status Resistensi T. castaneum dan A. fasciculatus terhadap Fosfin 16 Pengujian Efikasi Lapangan Serangga Resisten terhadap Fosfin 21
HASIL DAN PEMBAHASAN 23
Serangga T. castaneum dan A. fasciculatus 23
Karakteristik Pengelolaan Hama di Lima Gudang Biji Kakao di Makassar 24 Status Resistensi T. castaneum dan A. fasciculatus terhadap Fosfin 27 Efikasi Lapangan Serangga T. castaneum dan A. fasciculatus Resisten
terhadap Fosfin 34
Pembahasan Umum 36
Status Resistensi T. castaneum dan A. fasciculatus terhadap Fosfin 36 Efikasi Lapangan Serangga Resisten terhadap Fosfin 37
xiv
Simpulan 39
Saran 39
DAFTAR PUSTAKA 40
LAMPIRAN 47
xv
DAFTAR TABEL
1 Enam negara dengan produksi biji kakao terbesar di dunia 4 2 Penduga parameter mortalitas imago Tribolium castaneum 14 hari
setelah fumigasi fosfin selama 20 dan 48 jam 27
3 Penduga parameter mortalitas imago Araecerus fasciculatus dan 14 hari setelah fumigasi fosfin selama 20 dan 48 jam 28 4 Nilai LC50, LC99.9, dan RF imago Tribolium castaneum 14 hari setelah
fumigasi fosfin selama 20 dan 48 jam 29
5 Nilai LC50, LC99.9, dan RF imago Araecerus fasciculatus 14 hari setelah
fumigasi fosfin selama 20 dan 48 jam 29
6 Penduga parameter mortalitas pupa Tribolium castaneum 14 hari
setelah fumigasi fosfin selama 20 dan 48 jam 30
7 Penduga parameter mortalitas pupa Araecerus fasciculatus 14 hari
setelah fumigasi fosfin selama 20 dan 48 jam 31
8 Nilai LC50, LC99.9, dan RF pupa Tribolium castaneum 14 hari setelah
fumigasi fosfin selama 20 dan 48 jam 31
9 Nilai LC50, LC99.9, dan RF pupa Araecerus fasciculatus 14 hari setelah
fumigasi fosfin selama 20 dan 48 jam 32
10 Penduga parameter mortalitas larva Tribolium castaneum 14 hari
setelah fumigasi fosfin selama 20 dan 48 jam 32
11 Penduga parameter mortalitas larva Araecerus fasciculatus 14 hari
setelah fumigasi fosfin selama 20 dan 48 jam 33
12 Nilai LC50, LC99.9, dan RF larva Tribolium castaneum 14 hari setelah
fumigasi fosfin selama 20 dan 48 jam 33
13 Nilai LC50, LC99.9, dan RF larva Araecerus fasciculatus 14 hari setelah
fumigasi fosfin selama 20 dan 48 jam 34
xvi
DAFTAR GAMBAR
1 Kisaran konsentrasi yang disarankan untuk pengujian T. castaneum
menurut metode rekomendasi FAO (Busvine 1980) 16
2 Serangga uji dalam cincin paralon dan stoples kaca sebagai ruang fumigasi beserta magnet pengaduk gas (a), Karet penutup lubang tutup
stoples tempat menginjeksikan gas fosfin (b) 17
3 Alat penghasil gas fosfin murni dari formulasi pelet aluminium fosfida, apparatus for generating phosphine (Busvine 1980) 18 4 Pengambilan gas fosfin dari alat penghasil gas fosfin dan aplikasinya
pada stoples gelas dengan menggunakan syringe kedap gas 19 5 Pengaduk magnetik untuk menghomogenkan distribusi gas fosfin di
dalam ruang fumigasi (a), serangga uji dipindahkan ke beaker glass berisi biji kakao, setelah mendapat perlakuan fumigasi fosfin dalam
stoples gelas selama 20 jam atau 48 jam dan 20
6 Serangga T. castaneum: telur, larva, pupa (jantan dan betina), imago 23 7 Karakteristik imago T. castaneum dan T. confusum dapat dilihat dari
perbedaan antena dan jarak kedua mata faset secara ventral 23
8 Serangga A. fasciculatus: larva, pupa, imago 24
9 Frekuensi kegiatan fumigasi di lima perusahaan penyimpan biji kakao
di Makassar, pada kurun waktu tahun 2012-2015 26
DAFTAR LAMPIRAN
1 Persentase mortalitas imago Tribolium castaneum dari lima gudang penyimpanan biji kakao di Makassar dan Bogor setelah pemaparan gas fosfin 20 dan 48 jam di laboratorium pada 14 hari setelah aerasi 48 2 Persentase mortalitas pupa Tribolium castaneum dari lima gudang
penyimpanan biji kakao di Makassar dan Bogor setelah pemaparan 20 dan 48 jam gas fosfin di laboratorium pada 14 hari setelah aerasi 49 3 Persentase mortalitas larva Tribolium castaneum dari lima gudang
penyimpanan biji kakao di Makassar dan Bogor setelah pemaparan gas fosfin 20 dan 48 jam di laboratorium pada 14 hari setelah aerasi 50 4 Persentase mortalitas imago Araecerus fasciculatus dari lima gudang
penyimpanan biji kakao di Makassar dan Wonogiri setelah pemaparan 20 dan 48 jam gas fosfin di laboratorium pada 14 hari setelah aerasi 51 5 Persentase mortalitas pupa Araecerus fasciculatus dari lima gudang
penyimpanan biji kakao di Makassar dan Wonogiri setelah pemaparan 20 dan 48 jam gas fosfin di laboratorium pada 14 hari setelah aerasi 52 6 Persentase mortalitas larva Araecerus fasciculatus dari lima gudang
1
PENDAHULUAN
Latar Belakang
Kakao merupakan salah satu komoditas perkebunan yang mempunyai peranan penting bagi perekonomian Indonesia. Hal ini karena kakao menjadi sumber devisa negara dan sebagai penyerap tenaga kerja baik dari hulu (perkebunan) sampai ke hilir (industri olahan kakao). Saat ini pemerintah menargetkan Indonesia menjadi produsen kakao terbesar dunia agar dapat menggeser posisi Pantai Gading sebagai produsen terbesar pertama. Produksi kakao Indonesia pada tahun 2014 sebesar 709 330 ton, menurun dibandingkan tahun 2013 sebesar 720 860 ton BPS (2016). Pulau Sulawesi merupakan sentra produksi kakao di Indonesia dengan propinsi yang terluas pertanaman kakaonya adalah Sulawesi Selatan.
Salah satu kendala ekspor kakao Indonesia adalah adanya automatic detention (penahanan langsung) yang diberlakukan Amerika Serikat karena ditemukannya serangga hidup pada biji kakao. Automatic detention ini menyebabkan biji kakao Indonesia harus diberikan perlakuan karantina dengan refumigasi. Konsekuensi dari adanya automatic detention ini menyebabkan kakao Indonesia terkena potongan harga US$ 150-300 per ton terutama untuk biji kakao yang bermutu rendah dan tidak fermentasi, tidak termasuk biaya automatic detention/biaya fumigasi sebesar US$ 4 per ton dari harga terminal New York (Departemen Perindustrian 2010). Data peringatan impor (import alert 34-01) dari Amerika Serikat menunjukkan bahwa telah dilakukan automatic detention terhadap kakao Indonesia karena ditemukan serangga hidup pada 144 pengiriman dari 149 pengiriman atau sebesar 96%, yang berasal dari 17 pengirim (USFDA 2014).
Automatic detention diberlakukan selain karena adanya infestasi serangga hidup, juga karena rendahnya mutu biji kakao akibat serangan hama maupun proses pascapanen yang kurang baik. Infestasi hama pada biji kakao diduga dapat terjadi karena kurang sempurnanya fumigasi yang dilakukan sehingga tidak dapat mematikan telur-telur serangga hama.
Kerusakan biji kakao akibat serangan hama dapat terjadi sejak dari lapangan sebelum panen yaitu oleh penggerek buah kakao dan juga pada saat di penyimpanan oleh serangga hama gudang. Jenis serangga yang ditemukan pada sampel biji kakao di gudang penyimpanan eksportir kakao di Sulawesi Selatan adalah Ephestia sp., Corcyra cephalonica Stainton (Lepidoptera: Pyralidae), Araecerus fasciculatus De Geer (Coleoptera: Anthribidae), Tribolium castaneum Herbst (Coleoptera: Tenebrionidae), Oryzaephilus surinamensis (L.) (Coleoptera: Silvanidae), Cryptolestes sp., Carpophilus dimidiatus Fabricius (Coleoptera: Nitidulidae), Ahasverus advena Waltl (Coleoptera: Silvanidae), Necrobia rufipes De Geer (Coleoptera: Cleridae), Alphitobius diaperinus Panzer (Coleoptera: Tenebrionidae) dan Liposcelis sp. (Harahap et al. 2013). Serangga yang utama sebagai hama di penyimpanan biji kakao adalah Ephestia sp., C. cephalonica, A. fasciculatus dan T. castaneum.
2
yang digunakan untuk perawatan dan perlakuan karantina biji kakao adalah fosfin. Dosis fosfin yang digunakan untuk perawatan biji kakao di penyimpanan maupun untuk perlakuan prapengapalan sebelum ekspor menggunakan dosis sesuai permintaan negara tujuan yang seringkali jauh lebih tinggi dari dosis anjuran (Harahap et al. 2013).
Penggunaan fosfin yang semakin sering dan melebihi dosis anjuran dikhawatirkan dapat menimbulkan permasalahan yaitu berkembangnya strain hama yang resisten. Sejak digunakan pertama kali pada tahun 1935, saat ini fosfin telah digunakan secara luas sebagai fumigan untuk mengatasi permasalahan hama di penyimpanan di dunia (Reichmuth 1994, Chaudhry 2000, Nath et al. 2011). Fosfin menjadi pilihan utama karena metil bromida bersifat sebagai bahan perusak lapisan ozon sehingga penggunaannya telah dibatasi (Waterford & Winks 1994). Penggunaan fosfin untuk fumigasi biji-bijian di Australia mencapai 80% (Cao & Wang 2001) sedangkan di China mencapai 90% (Wang & Cao 1999, Ling et al. 2004). Di Indonesia, fosfin juga telah digunakan secara luas, tetapi belum terdapat data penggunaanya secara kuantitatif.
Pemilihan fosfin sebagai alternatif untuk mengendalikan hama di penyimpanan adalah karena fosfin mempunyai karakteristik yang ideal sebagai fumigan seperti mudah dan aman dalam aplikasi, tidak meninggalkan residu pada komoditas, relatif murah, tingkat penetrasinya tinggi, dapat menyebar cepat, dan tidak mempengaruhi viabilitas biji-bijian (Taylor 1989, Liang 1989, 1994, AFHB & ACIAR 1991, Chaudhry 2000, Cao & Wang 2000, Nath et al. 2011, Collins et al. 2001, Prijono 2006, Nayak 2012). Karakteristik inilah yang menyebabkan fosfin mempunyai peranan sangat penting dalam pengelolaan hama di penyimpanan. Hal ini ditunjang dengan kesepakatan Protokol Montreal yang memutuskan untuk menghapuskan penggunaan metil bromida pada tahun 2015, sehingga menyebabkan dunia industri yang memerlukan pengendalian hama di penyimpanan sangat bergantung pada penggunaan fosfin.
Penggunaan fosfin yang sudah lebih dari 60 tahun dan fakta ketergantungan akan penggunaan fosfin yang mengakibatkan penggunaannya yang terus meningkat memberikan dampak yaitu berkembangnya resistensi berbagai jenis hama terhadap fosfin. Kejadian resistensi telah terdeteksi lebih dari 30 tahun yang lalu dan saat ini telah banyak dilaporkan terjadinya resistensi terhadap berbagai jenis hama di penyimpanan di berbagai negara di dunia seperti Brazil, China, Australia, Amerika, Indonesia (Sartori et al. 1991, Chaudhry 2000, Lorini & Collins 2006, Lorini et al. 2007, Harahap et al. 2011, Nayak et al. 2003, Nayak et al 2012). Di Australia, tahun 1997 pertama kali dilaporkan telah terjadi resistensi kuat pada serangga Rhyzopertha dominica dan Cryptolestes ferrugineus (Collins et al. 2001). C. ferrugineus yang ditemukan di Pelabuhan Hamburg Jerman pada biji kakao impor dari Afrika masih dapat bertahan hidup pada paparan fosfin dengan dosis 6 g/m3 yang konsentrasinya di udara mencapai puncak pada 7500 ppm (Klementz & Reichmuth 2007).
3 bahwa Indonesia juga mengimpor biji kakao dari Ghana untuk bahan campuran, sehingga peluang masuknya serangga resisten dari negara tersebut sangat dimungkinkan. Jika serangga resisten berkembang biak akan berimplikasi terhadap biaya pengendalian yang semakin tinggi.
Perumusan Masalah
Status serangga yang resisten terhadap fosfin di dunia telah banyak dilaporkan. Di Indonesia telah terdeteksi berkembangnya resistensi terhadap fosfin pada beberapa jenis hama gudang di penyimpanan beras. Status perkembangan resistensi serangga hama pada biji kakao belum tersedia. Terdapat fakta bahwa Amerika Serikat memberlakukan automatic detention terhadap ekspor kakao Indonesia salah satunya karena ditemukannya serangga hidup. Faktor penyebab ditemukannya serangga hidup diduga adalah karena fumigasi tidak berhasil membunuh semua fase hidup atau fase perkembangan serangga atau serangga telah resisten terhadap fumigan fosfin. Makassar merupakan kota tempat eksportir kakao di propinsi penghasil kakao terbesar di Indonesia. Oleh karena itu untuk mendeteksi kemungkinan terjadinya perkembangan strain resisten serangga A. fasciculatus dan T. castaneum hama pada biji kakao di Makassar perlu dilakukan pemantauan terhadap status resistensinya. Faktor pendorong berkembangnya serangga resisten perlu dipastikan. Dosis efektif untuk mengendalikan serangga resisten perlu ditentukan.
Tujuan Penelitian
Penelitian ini bertujuan menentukan status resistensi terhadap fosfin pada serangga T. castaneum dan A. fasciculatus yang dikoleksi dari penyimpanan biji kakao di Makassar Sulawesi Selatan dan mengonfirmasi hasil pengujian resistensi melalui pengujian efikasi lapangan untuk mendapatkan dosis fosfin efektif terhadap serangga resisten.
Hipotesis Penelitian
Serangga hama utama pada biji kakao, T. castaneum dan A. fasciculatus di gudang penyimpanan biji kakao di Makassar Sulawesi Selatan telah resisten terhadap fosfin.
Manfaat Penelitian
4
TINJAUAN PUSTAKA
Nilai Penting Kakao di Indonesia
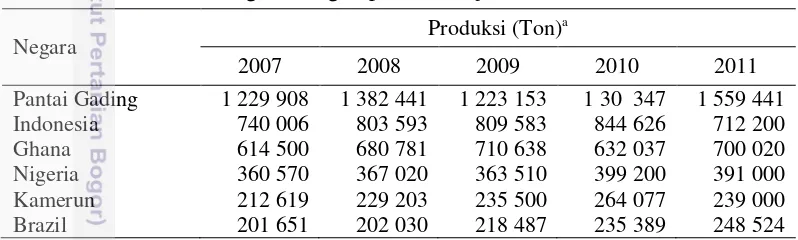
Kakao merupakan salah satu komoditas perkebunan yang berperan penting dalam perkembangan perekonomian nasional. Indonesia sejak tahun 2005 hingga tahun 2011 merupakan produsen kakao terbesar kedua di dunia setelah Pantai Gading. Produksi kakao tahun 2011 Pantai Gading sebesar 1 559 441 ton, Indonesia 712 200 ton, Ghana 700 020 ton, sedangkan produksi tahun 2004 Pantai Gading 1 407 213 ton, Ghana 737 000 ton dan Indonesia 691 704 ton (FAOSTAT 2016). Sulawesi merupakan daerah penghasil kakao terbesar di Indonesia, dengan produksi kakao di beberapa provinsi di Sulawesi pada tahun 2012 adalah sebesar 146.840 ton (Sulawesi Selatan), 144 360 ton (Sulawesi Tengah), dan 122 960 ton (Sulawesi Tenggara) (BPS 2016). Indonesia juga merupakan negara eksportir biji kakao terbesar di Asia Tenggara dan tahun 2006 hingga tahun 2010 berkontribusi sebagai penyumbang lebih dari 94% volume ekspor biji kakao negara ASEAN (Pusdatin Kementan 2014). Enam negara di dunia dengan produksi biji kakao terbesar dapat dilihat pada Tabel 1 (FAOSTAT 2016).
Tabel 1 Enam negara dengan produksi biji kakao terbesar di dunia
Negara Produksi (Ton)
Perkebunan kakao di Indonesia dikelompokkan kedalam 3 kelompok menurut usahanya, yaitu perkebunan rakyat (887 735 Ha), perkebunan negara (49 976 Ha), dan perkebunan swasta (54 737 Ha). Pertumbuhan luas areal perkebunan kakao di berbagai daerah di Indonesia pada tahun 2009-2013 rata-rata sebesar 4%. Areal perkebunan terbesar berada di Pulau Sulawesi, Sumatera Barat, dan Aceh, dengan luas areal mencapai lebih dari 100 000 Ha. Kakao mampu menyumbangkan devisa bagi negara Indonesia sebesar 668 juta US dollar per tahun atau merupakan nomor tiga terbesar dari sektor pertanian setelah kelapa sawit dan karet (Hatmi & Rustijarno 2012). Provinsi Sulawesi Selatan yang merupakan daerah penghasil kakao terbesar di Indonesia mampu menyumbang sebesar 283 juta US dollar per tahun.
5 rasa, kebersihan, serta aspek keseragaman sangat ditentukan oleh perlakuan pada setiap tahapan proses produksinya (Hatmi & Rustijarno 2012). Saat ini, produksi biji kakao secara signifikan terus meningkat, namun mutu yang dihasilkan sangat rendah dan beragam. Luasnya areal perkebunan rakyat sangat mempengaruhi mutu kakao yang dihasilkan. Produksi kakao yang bermutu baik, umumnya dihasilkan dari perkebunan negara maupun swasta yang jumlahnya hanya 30% (Dumadi 2011).
Beberapa faktor yang menyebabkan keragaman mutu biji kakao Indonesia adalah minimnya sarana pengolahan, lemahnya pengawasan mutu pada seluruh tahapan proses pengolahan biji kakao rakyat, serta pengolahan biji kakao yang masih tradisional. Petani di Indonesia umumnya mengeringkan biji kakao dengan cara dijemur, sehingga potensi terkontaminasi cendawan sangat besar ketika kadar air biji kakao yang dijemur masih lebih besar dari 7% (Dumadi 2011). Peningkatan produktivitas, penggunaan varietas unggul, penanganan gangguan OPT disektor on farm perlu diperbaiki untuk mendapatkan kualitas kakao yang lebih baik, sedangkan di sektor off farm, perlu adanya pengerjaan fermentasi dengan benar, pengelolaan hama di penyimpanan yang tepat dan pengolahan kakao yang baik.
Permasalahan Hama pada Biji Kakao selama Penyimpanan
Biji kakao yang banyak diminati oleh pasar, terutama pasar internasional adalah kakao curah. Kakao curah merupakan biji kakao kering dengan kriteria kadar air kurang dari 7.5%, kadar benda asing termasuk hama 0%, kadar biji bercendawan kurang dari 2%, dan kadar biji berkecambah kurang dari 2%. Kakao curah umumnya diekspor untuk memenuhi permintaan pasar Amerika, Belgia, Jerman, dan Swiss (Susanto 1994). Salah satu penyebab rendahnya kualitas biji kakao adalah adanya infestasi serangga hama, hal ini dapat menyebabkan dilakukannya automatic detention oleh negara tujuan ekspor yaitu Amerika Serikat (Sjam et al. 2010).
Serangan serangga hama gudang secara langsung dapat mengakibatkan terjadinya perubahan fisik dan kimia pada biji kakao yang disimpan. Kehilangan atau penurunan bobot merupakan salah satu perubahan fisik yang dapat menurunkan kuantitas produk, sedangkan penurunan kandungan gizi karena degradasi komponen nutrisi seperti protein, karbohidrat, lemak, dan vitamin merupakan perubahan kimiawi yang dapat menurunkan kualitas produk (Winarno 2006). Faktor-faktor yang dapat mempengaruhi pertumbuhan populasi sebagian besar spesies serangga hama gudang adalah suhu, kelembapan relatif dan kadar air bahan yang disimpan. Kandungan nutrisi dan sifat fisik bahan simpan juga sangat menentukan tingkat serangan oleh serangga. Kandungan air yang tinggi (di atas 16%) menyebabkan bahan simpan menjadi lembut dan mudah diserang serangga hama (Syarif & Halid 1993).
6
diperkirakan dapat mencapai 25% - 50% dari total produksi (Sitinjak 1986). Di Indonesia, kerusakan bahan pangan di penyimpanan yang diakibatkan oleh serangan serangga hama mencapai 5% – 10% (Morallo–Rejesus 1978). Hal ini disebabkan karena serangga hama gudang memiliki kemampuan berkembang biak yang cepat, mudah menyebar dan dapat mengakibatkan pertumbuhan cendawan (Halid & Yudawinata 1983).
Permasalahan Ekspor Kakao Indonesia
Kakao merupakan salah satu komoditas ekspor yang menyumbang devisa cukup besar bagi negara Indonesia. Kakao Indonesia kebanyakan diekspor dalam bentuk bahan baku mentah yaitu berupa biji kakao, sebanyak 75% dari total produksi, sedangkan sisanya diolah di dalam negeri untuk menghasilkan produk turunan kakao seperti cocoa powder, cocoa butter, cocoa cake, dan cocoa liquor. Namun demikian, Indonesia masih mengimpor biji kakao karena adanya kebutuhan akan biji kakao yang berkualitas baik (Jauhari & Wirjodirjo 2013). Rendahnya produktivitas kakao Indonesia disebabkan oleh beberapa hal, di antaranya adalah penggunaan benih asalan, belum banyak digunakan benih klonal, masih tingginya serangan hama penggerek buah kakao (PBK), pengelolaan kebun yang masih tradisional dan umur tanaman kakao yang sebagian besar sudah tua yaitu diatas 25 tahun, sedangkan usia produktif tanaman kakao adalah 13-19 tahun (Suryani & Zulfebriansyah 2007).
Permasalahan lain yang menghambat produksi kakao Indonesia adalah beban pajak ekspor kakao olahan yang relatif tinggi, yaitu 30%, sedangkan tarif impor produk olahan kakao hanya sebesar 5%. Lebih kurang 85% produk kakao Indonesia tidak difermentasi, sehingga ekspor kakao Indonesia ke beberapa negara potensial seperti Uni Eropa masih terbatas (Firdaus & Ariyoso 2010). Permasalahan lain adalah rendahnya mutu biji kakao Indonesia terutama kakao yang dihasilkan oleh perkebunan rakyat sehingga dihargai paling rendah di pasaran internasional. Biji kakao Indonesia umumnya tidak difermentasi dan memiliki kadar kotoran tinggi, terinfestasi serangga, cendawan, mikotoksin dan memiliki cita rasa yang lemah (Wahyudi & Misnawi 2007).
Akibat rendahnya mutu kakao Indonesia, maka harga kakao Indonesia dikenakan diskon (automatic discount) yang besarnya antara US$ 150-300 per ton dan diberlakukan automatic detention, khusus untuk pasar Amerika Serikat (Departemen Perindustrian 2010). Oleh karena itu, daya saing kakao Indonesia lebih rendah jika dibandingkan dengan kakao yang dihasilkan negara lain. Di lain pihak, pemberlakuan automatic detention untuk biji kakao kepada seluruh negara pengekspor bisa menjadi peluang untuk memperbaiki mutu biji kakao dalam negeri dengan memperbaiki pengelolaan kakao mulai dari hulu hingga hilir.
T. castaneum Herbst (Coleoptera: Tenebrionidae)
7 menginfestasi hampir semua komoditas yang disimpan di dalam gudang dengan kondisi temperatur optimum 33oC dan kelembapan 70% (Kalshoven 1981). T. castaneum memiliki kisaran inang yang luas. Komoditas dan produk-produk yang dapat diserang di antaranya adalah beras, jagung, gandum, tepung terigu, serealia, kacang-kacangan, kakao, coklat, coklat susu, biskuit, buah kering, bumbu-bumbu, biji bunga matahari, oat, koleksi herbarium dan museum (Mason 2010).
Imago T. castaneum memiliki tubuh pipih memanjang, dengan panjang tubuh antara 2.66-4.4 mm dan berwarna coklat. Pada kepala dan pronotum terdapat banyak sekali bintik-bintik halus. Antena terdiri dari 11 ruas dan 3 ruas terakhir yang membentuk gada (capitate). Bagian mata seolah-olah terbagi oleh sisi samping kepala yang menjorok ke belakang. Telur kumbang ini berwarna putih dan berukuran kecil (panjang 0.5 mm). Telur diletakkan di antara partikel makanan. Ketika diletakkan, telur-telur tersebut ditutupi oleh cairan perekat yang dapat menyebabkan partikel makanan menempel sehingga telur sulit terlihat (Haines 1991). Stadia telur berkisar antara 3-4 hari. Kumbang betina dapat meletakkan telur sampai dengan 1000 telur selama masa hidupnya (Ress 2004) atau sekitar 5-15 butir setiap hari dengan masa peletakan telur selama beberapa bulan (Christensen 1980).
Larva kumbang ini bertipe elateriform, berwarna putih kekuningan, dan aktif bergerak mencari makanan. Panjang larva T. castaneum lebih kurang 10 mm (Ress 2004). Jumlah instar larva T. castaneum diketahui sangat bervariasi. Larva T. castaneum terdiri dari 5-11 instar larva, tetapi umumnya terdiri dari 7-8 instar tergantung pada kondisi lingkungan seperti makanan, suhu, kelembapan, serta individu serangga (Mason 2010) atau 6-8 instar, dengan masa instar pertama biasanya yang terpendek dan masa instar terakhir yang terpanjang (Abdelsamad et al. 1987). Larva bersifat predator fakultatif, karena selain memakan komoditas yang diserang, larva juga memakan serangga lain yang berukuran kecil (Ress 2004). Baik larva maupun imago T. castaneum diketahui memangsa larva ngengat beras, C. cephalonica, yang merupakan kompetitor di lingkungan hidupnya (Alabi et al. 2008). Larva T. castaneum akan naik ke permukaan komoditas yang diserang ketika akan berpupa (Mangoendihardjo 1984), sehingga pada permukaan komoditas akan banyak ditemukan eksuvia larva.
8
A. fasciculatus De Geer (Coleoptera: Anthribidae)
Serangga ini bersifat kosmopolitan dan banyak ditemukan di kawasan tropis dan subtropis. A. fasciculatus merupakan hama penting pada biji kopi dan biji kakao. Kumbang A. fasciculatus juga dapat menyerang rempah-rempah, jagung, kacang tanah, dan beberapa produk makanan (Haines 1991). A. fasciculatus juga dapat menyerang biji pala, gaplek dan biskuit.
Imago A. fasciculatus berukuran 3-5 mm. Bagian protoraks dan elitra memiliki bercak-bercak kecil berwarna coklat atau coklat keabu-abuan yang lebih terang. Elitra lebih pendek daripada abdomen. Siklus hidup A. fasciculatus adalah 46-66 hari pada kondisi suhu 28oC dan kelembaban 70% (El Sayed 1940) dan 34-52 hari pada suhu 29-31oC (Santos 1983). Imago dapat terbang aktif dan menghasilkan telur rata-rata 50 butir (El Sayed 1940). Telur A. fasciculatus diletakkan di dalam bahan makanan oleh serangga betina dan akan menetas dalam waktu 5-8 hari. Perkembangan larva terjadi selama 30 hari dan kemudian akan memasuki masa pupa selama 6-7 hari. Larva hidup di dalam biji dan hanya terdapat satu larva dalam satu biji. Pada jagung, imago dapat hidup selama 27 hari pada kelembaban 50% dan hidup selama 86-134 hari pada kelembapan 90% (Robinson 2005).
Jenis-Jenis Fumigan
Pengendalian hama gudang yang umum dilakukan adalah fumigasi. Fumigasi adalah tindakan pelepasan atau menyalurkan bahan kimia dalam keadaan gas dengan tujuan membunuh organisme (Utomo 1984). Fumigasi dilakukan di ruang kedap udara pada suhu dan tekanan tertentu dengan menggunakan bahan kimia yang biasa disebut sebagai fumigan. Beberapa jenis fumigan yang ada di dunia diantaranya adalah fosfin (PH3), metil bromida
(CH3Br), karbon dioksida (CO2), etil format, hidrogen sianida (HCN), dan sulfuril
fluorida (SO2F2).
Pemilihan fumigan fosfin untuk aplikasi jika komoditas tersebut akan digunakan tidak kurang dari 7 hari dan umumnya digunakan untuk fumigasi biji-bijian yang mengandung minyak, tepung, dan biji yang akan dikecambahkan. Metil bromida digunakan untuk perlakuan yang harus selesai dalam waktu 4 hari atau kurang dan banyak digunakan untuk perlakuan karantina dan pra-pengapalan. Fumigan karbon dioksida digunakan untuk komoditas yang akan disimpan dalam jangka waktu yang cukup lama (lebih dari 15 hari), kemudian komoditas yang akan difumigasi harus bebas dari residu fumigan. Fumigan hidrogen sianida umumnya digunakan untuk mengendalikan hama vertebrata di dalam ruangan, seperti di bangunan atau kapal dan bila fumigasi secara cepat diperlukan dan perkecambahan biji-bijian harus dipertahankan (AFHB & ACIAR 1991).
biji-9 bijian sehingga tidak dapat digunakan untuk fumigasi benih. Selain itu, metil bromida juga merupakan salah satu bahan perusak lapisan ozon. Oleh karena itu, sejak Protokol Montreal diberlakukan, penggunaan metil bromida sebagai fumigan terbatas hanya untuk keperluan karantina dan prapengapalan (Kementan 2011).
Sebagai alternatif dari fumigan metil bromida, saat ini fosfin menjadi salah satu fumigan yang paling banyak digunakan. Meskipun bekerja lebih lambat dibandingkan dengan metil bromida, namun penggunaan fosfin sebagai fumigan relatif lebih aman. Hal ini karena fosfin tidak menyebabkan kerusakan lapisan ozon, selain itu tidak meninggalkan residu pada komoditas yang difumigasi, sehingga komoditas pangan masih aman untuk dikonsumsi (AFHB & ACIAR 1991).
Saat ini, di Indonesia tersedia 2 jenis formulasi fosfin, yaitu fosfin padat dan fosfin cair. Fosfin padat biasanya berbentuk tablet, pelet, kantung dan plate. Tablet fosfin terdiri dari campuran aluminium fosfida, amonium karbamat, dan parafin. Setiap tablet formulasi aluminium fosfida mempunya berat 3 g yang mengandung 1 g fosfin. Fosfin cair biasanya dipilih sebagai alternatif dalam pelaksanaan fumigasi pada komoditas yang bermasalah apabila difumigasi dengan fosfin formulasi padat. Fosfin formulasi cair diperdagangkan dalam silinder tabung bertekanan yang dicampur dengan karbon dioksida (CO2). Kandungan gas
fosfin sebagai bahan aktif dalam suatu formulasi cair tidak lebih dari 5%. Pada umumnya, senyawa fosfin formulasi cair yang diperdagangkan mengandung 2% gas fosfin dan 98% gas CO2. Hal ini karena sifat fosfin yang mudah terbakar
(Barantan 2013).
Fumigan sulfuril flourida memiliki spektrum yang luas dan efektif untuk setiap fase serangga hama dan tikus. Kelebihan dari sulfuril flourida adalah dapat digunakan untuk fumigasi dalam waktu paparan yang lama maupun singkat. Berbeda dengan fosfin yang mudah terbakar, sulfuril flourida tidak mudah terbakar, tidak berwarna, tidak berbau dan gasnya sangat cepat terevaporasi dan menyebar. Sulfuril flourida juga tidak menyebabkan korosif dan tidak menyebabkan kerusakan pada lapisan ozon.
Penggunaan Fosfin sebagai Fumigan
Perlakuan fumigasi menggunakan fumigan fosfin merupakan salah satu alternatif pengganti metil bromida. Fosfin sebagai fumigan pertama kali digunakan pada tahun 1934 dan dilakukan pengembangan formulasi baru, yaitu tablet alumunium fosfida di Jerman pada tahun 1953 (Mordkovich 2004). Fosfin dipilih sebagai alternatif fumigan karena fosfin tidak menimbulkan dampak negatif terhadap lingkungan, khususnya kerusakan pada lapisan ozon (Kementan 2011).
10
yang efektif hampir sama dengan fumigan lainnya. Fosfin tidak mudah larut di dalam air, korosif yaitu dapat bereaksi dengan beberapa logam, seperti tembaga, atau campuran tembaga dengan kuningan. Fosfin juga dilaporkan dapat menyala dengan spontan pada suhu di atas 100oC dan pada tekanan rendah, khususnya dalam udara yang bebas air (AFHB & ACIAR 1991).
Umumnya fosfin digunakan dalam bentuk formulasi padat seperti aluminium fosfida dan magnesium fosfida, namun dalam perkembangannya fosfin juga diformulasikan dalam bentuk gas cair. Di Indonesia fosfin dalam formulasi gas cair (liquefied phosphine) telah tersedia dan efektif untuk mengendalikan berbagai jenis hama seperti T. castaneum, Sitophilus zeamais, Oryzaephilus surinamensis, Ephestia cautella (Lepidoptera: Pyralidae) dan A. fasciculatus (Harahap et al. 2011). Penggunaan fosfin gas cair masih terbatas karena aplikasinya membutuhkan peralatan tambahan seperti alat injeksi jet gun atau menggunakan selang distribusi. Selain itu kemasan fosfin cair berupa tabung bertekanan tinggi yang cukup berat menyebabkan teknik aplikasi fosfin cair menjadi kurang praktis dibandingkan formulasi padat.
Batas residu fosfin untuk inorganic fosfin yang diperbolehkan sesuai dengan Codex Alimentarius, yaitu 0.1 mg/kg pada biji-bijian yang belum diolah dan 0.01 mg/kg pada biji-bijian yang telah diolah (AFHB & ACIAR 1991). Fosfin dapat digunakan untuk fumigasi berbagai jenis komoditas dan produk seperti biji-bijian (beras, jagung, gandum, barley, sorgum), biji-bijian penghasil minyak, kacang-kacangan, kakao, kopi, tembakau, teh, sayuran kering, susu bubuk, kapas, kayu, rotan, benih, tepung terigu, mie, produk dari kulit (Arifin et al. 2006). Fosfin tidak dapat diaplikasikan pada komoditas dengan kadar air tinggi lebih dari 22% (Kementan 2011).
Cara Kerja dan Sifat Fosfin
Bersama-sama dalam satu grup dengan rotenon dan sianida, cara kerja fosfin adalah melalui penghambatan respirasi melalui aksi dari komponen mitokondria dalam rantai respirasi (Chaudry & MacNicoll 1998). Fosfin bekerja melalui penghambatan proses respirasi sel yaitu penghambatan transpor elektron dalam mitokondria kompleks IV yang merupakan lokasi metabolisme energi (Spark & Nauen 2015, IRAC 2016). Fungsi enzim sitokrom c oksidase pada rantai transpor elektron dalam mitokondria terhambat sehingga fosforilase oksidatif juga terhambat dan produksi ATP berkurang (Price 1985, Garry & Lyubimov 2001). Penghambatan produksi ATP mengakibatkan sel kekurangan energi sehingga terjadi penghambatan berbagai proses dalam sel yang mengakibatkan terjadinya kerusakan jaringan, bahkan kematian (Garry & Lyubimov 2001). Target peracunan fosfin adalah mitokondria dan perubahan langsung terhadap fungsi mitokondria berpengaruh terhadap resistensi fosfin (Zuryn et al. 2008). Perbedaan penghambatan respirasi menunjukkan bahwa resistensi terjadi karena penurunan sensitivitas mitokondria (Nakakita & Winks 1981). Faktor-faktor yang dapat berkontribusi terhadap sensitivitas dan resistensi fosfin di antaranya adalah membran potensial mitokondia, laju aliran elektron melalui rantai respirasi mitokondria dan level ATP (Zuryn et al. 2008).
11 atau bau karbit sebagai agen peringatan bahaya. Fosfin tidak larut dalam air dan daya larutnya juga rendah untuk hampir semua zat pelarut. Gas fosfin diperoleh dari penguraian tablet atau pelet yang terdiri atas campuran aluminium fosfida dan amonium karbamat yang menghasilkan hidrogen fosfida dan bubuk sisa. Pada konsentrasi maksimum, aluminium fosfida dapat meninggalkan limbah yang sebagian besar terdiri dari aluminium hidroksida berupa tepung sangat halus. Kecepatan terbentuknya fosfin di udara dari bentuk tablet tergantung pada kelembapan relatif udara dan suhu di ruang fumigasi. Pada tingkat kelembapan lebih dari 70%, penguraian maksimum dari fosfin akan tercapai setelah 72-96 jam. Bila kelembaban kurang dari 50%, konsentrasi maksimum dari gas fosfin yang terbentuk tidak akan tercapai meskipun fumigasi dilakukan selama satu minggu (Majumder & Venugopal 1973).
Fosfin dalam formulasi pelet ataupun padatan akan bereaksi di udara. Reaksi yang terjadi antara gas fosfin dengan alumunium fosfida atau magnesium fosfida dengan uap air di udara adalah sebagai berikut (TDRI 1985):
AlP + 3 H2O Al(OH)3 + PH3
Mg3P2 + 6 H2O 3 Mg(OH)2+ 2 PH3
Gas fosfin yang tertinggal di dalam ruang fumigasi setelah fumigasi selesai dapat dihilangkan secara tuntas dengan cara aerasi dan akan bereaksi dengan udara membentuk asam fosfit yang lazim terdapat di alam. Serbuk yang tersisa dari formulasi padatan atau pelet setelah gas fosfin dilepas masih mengandung sekitar 2% aluminium fosfida yang tidak terurai. Hal ini terjadi karena belum ada bentuk formulasi fosfin dengan 100% penguraian fosfin (Majumder & Venugopal 1973).
Resistensi Serangga terhadap Fosfin
Resistensi terhadap insektisida merupakan perubahan yang diwariskan dalam hal sensitivitas suatu populasi hama yang tercermin dalam kegagalan berulang-ulang dari suatu produk untuk mencapai tingkat pengendalian yang diharapkan jika menggunakan dosis rekomendasi (IRAC 2016). Oleh karena resistensi serangga terhadap insektisida dapat diturunkan pada generasi selanjutnya, maka apabila tidak dikelola dengan baik, serangga yang memiliki gen resisten akan meningkat populasinya. Resistensi terhadap insektisida pada serangga dapat terjadi karena beberapa hal, di antaranya peningkatan kemampuan detoksifikasi insektisida oleh karena bekerjanya enzim-enzim tertentu, penurunan kepekaan tempat sasaran insektisida pada tubuh serangga (Untung 2004), sedangkan menurut IRAC (2016) resistensi muncul sebagai akibat dari penggunaan insektisida yang berlebihan atau penyalahgunaan penggunaan insektisida terhadap spesies hama dan merupakan hasil seleksi dari bentuk tahan suatu hama.
12
(penetration resistance): serangga resisten dapat menyerap racun lebih lambat dari serangga rentan, 3) resistensi metabolik (metabolic resistance): serangga resisten dapat mendetoksifikasi atau menghancurkan toksin lebih cepat dari serangga rentan, atau segera menyingkirkan tubuh mereka dari molekul beracun, 4) resistensi gangguan terhadap lokasi target (altered target-site resistance): lokasi tempat toksin biasa terikat pada serangga dimodifikasi untuk mengurangi efek insektisida. Jenis resistensi yang paling umum adalah resistensi metabolik dan berikutnya adalah resistensi gangguan terhadap lokasi target. Terdapat empat mekanisme resistensi serangga yang utama, yaitu: 1) peningkatan metabolisme produk non-toksik, 2) penurunan sensitivitas lokasi target, 3) penurunan penetrasi insektisida, 4) peningkatan tingkat ekskresi insektisida (Karaagac 2012).
Kasus resistensi terhadap fosfin pada hama gudang telah menjadi masalah utama di berbagai negara. Tingkat resistensi yang sangat tinggi ditemukan di beberapa negara di Asia dan Afrika (Zettler 1997, Sayaboc et al. 1998, Rajendran 1999), selain itu juga banyak ditemukan di Australia (Collins et al. 2001) dan Amerika Selatan (Lorini et al. 2007). Berdasarkan survei global yang dilakukan oleh FAO pada tahun 1972-1973 menunjukkan bahwa hama gudang di 33 dari 82 negara yang disurvey terdeteksi resisten, tidak termasuk Brazil pada saat itu. Namun, 14 tahun kemudian Sartori et al. (1991) melaporkan bahwa di Brazil terdapat populasi Rhyzoperta dominica (F.), T. castaneum (Herbst), Sitophilus oryzae (L.), dan Cryptolestes ferrugineus (Stephens) yang telah resisten tinggi. Di Australia, kasus resistensi fosfin pertama kali ditemukan terjadi pada R. dominica pada tahun 1990 (White & Lambkin 1990). Kasus resistensi fosfin juga telah ditemukan pada beberapa populasi T. castaneum (Herbst) dan R. dominica (F.) dari 10 daerah di Oklahoma (Zettler & Cuperus 1990). Tingginya kasus resistensi fosfin yang terjadi mengakibatkan pentingnya pemahaman mengenai mekanisme resistensi fosfin untuk dapat melakukan manajemen terhadap resistensi tersebut dan perlu ada alternatif senyawa lain selain fosfin untuk mengurangi tingkat resistensi (Bell 2000, Chaudhry et al. 2004).
Salah satu pendapat tentang mekanisme terjadinya resistensi fosfin adalah berkurangnya penyerapan fumigan (Price 1984). Hal ini sangat berhubungan erat dengan laju respirasi serangga. Respirasi juga merupakan indikator yang baik dari respon fisiologis serangga terhadap lingkungan mereka (Chaudhry et al. 2004).
Resistensi dalam banyak kasus terkait dengan sebuah gen/protein tunggal, tetapi juga terdapat kasus dua atau lebih mekanisme resistensi berjalan bersamaan. Pada cara kerja fosfin, mekanisme resistensi yang bekerja merupakan gabungan dari tiga mekanisme yaitu perubahan pada protein respirasi, detoksifikasi metabolik dan penurunan pengambilan fosfin (Chaudry & MacNicoll 1998).
13 kurang ideal untuk melakukan fumigasi seperti ruang penyimpanan yang kurang kedap udara meningkatkan frekuensi kegagalan pengendalian, sehingga cenderung meningkatkan frekuensi aplikasi ataupun konsentrasi aplikasi (Chaudhry 2000, Lorini et al. 2007).
14
METODE
Penelitian ini dilaksanakan dalam empat tahapan kegiatan yaitu: 1) pengambilan sampel serangga dan data kegiatan fumigasi fosfin, 2) identifikasi
dan perbanyakan T. castaneum dan A. fasciculatus, 3) deteksi resistensi serangga T. castaneum dan A. fasciculatus terhadap fumigan fosfin, dan 4) uji efikasi lapangan serangga T. castaneum dan A. fasciculatus resisten terhadap fosfin.
Tempat dan Waktu
Pengambilan sampel serangga T. castaneum dan A. fasciculatus dilakukan di 5 gudang penyimpanan biji kakao milik eksportir biji kakao dan eksportir produk kakao setengah jadi di Makassar, Sulawesi Selatan (selanjutnya disebut G1, G2, G3, G4, dan G5). Serangga reference yang tidak pernah terpapar fosfin yang digunakan sebagai pembanding diambil dari Wonogiri untuk A. fasciculatus, sedangkan untuk T. castaneum diambil dari koleksi serangga di Laboratorium Entomologi yang telah dikembangbiakkan lebih dari 20 generasi. Pengambilan data fumigasi fosfin dilakukan di kantor perusahaan fumigator di Makassar. Identifikasi, perbanyakan serangga, pengujian deteksi resistensi dan pengujian efikasi lapangan serangga T. castaneum dan A. fasciculatus dilaksanakan di Laboratorium Entomologi dan Gudang Penelitian Pascapanen SEAMEO BIOTROP, Jalan Raya Tajur Km 6, Bogor.Kegiatan penelitian dilaksanakan sejak bulan Juni 2014 sampai Juli 2015.
Bahan dan Alat
Bahan dan alat yang diperlukan untuk koleksi serangga di lapangan adalah kantung plastik, stoples plastik, aspirator, spidol, kuas halus, ayakan, dan kain kasa, sedangkan untuk mengumpulkan data riwayat penggunaan fosfin diperlukan kuesioner dan alat tulis.
Bahan dan alat yang diperlukan untuk identifikasi dan perbanyakan serangga adalah stoples plastik, stoples kaca, aspirator, spidol, kuas halus, kertas label, kain kasa, boks transfer, mikroskop dan kamera.
Bahan yang digunakan pada penelitian deteksi resistensi serangga T. castaneum dan A. fasciculatus terhadap fosfin ini adalah serangga T. castaneum asal Makassar dan Bogor, sedangkan A. fasciculatus asal Makassar dan Wonogiri, biji kakao kering, tepung terigu, gaplek, kertas label, H2SO4 10%, air keran, fosfin
15 untuk uji resistensi merupakan modifikasi dari desikator dan cincin gelas yang digunakan dalam metode rekomendasi FAO (Busvine 1980).
Bahan yang diperlukan pada pengujian efikasi lapangan serangga resisten adalah serangga T. castaneum dan A. fasciculatus yang telah dipastikan resisten terhadap fosfin, biji kakao kering, beaker glass, kertas label, fosfin tablet, plastisin dan karet gelang. Peralatan yang digunakan adalah seperangkat peralatan fumigasi seperti bantalan pasir, lakban, selang plastik, alat ukur konsentrasi fosfin, alat ukur kebocoran gas fosfin, mikroskop, cawan petri, kuas halus, nampan plastik, beaker glass, blower beserta belalainya, masker wajah penuh (full face mask) dan ruang fumigasi. Sebagai ruang fumigasi digunakan ruang berbentuk kubus berukuran 1 m x 1 m x 1 m dengan bahan kerangka paralon (diameter 0.5 inchi) dan ditutup plastik PVC dengan ketebalan 150 mikron.
Pengambilan Sampel Serangga dan Data Penggunaan Fosfin
Sampel serangga diambil di gudang biji kakao milik 5 perusahaan perdagangan atau eksportir kakao dan industri kakao di Makassar, Sulawesi Selatan (G1, G2, G3, G4, dan G5). Pengambilan sampel serangga T. castaneum dan A. fasciculatus dilakukan secara langsung menggunakan kuas halus dan aspirator. Pengambilan serangga juga dilakukan terhadap residu kakao yaitu hasil sapuan biji kakao yang berjatuhan yang telah dikumpulkan dalam karung residu. Sampel residu kakao tersebut diayak sehingga serangga yang terdapat pada biji kakao akan berjatuhan dan dapat dikumpulkan menggunakan kuas halus dan aspirator. Serangga T. castaneum dan A. fasciculatus yang ditemukan kemudian dibawa ke laboratorium untuk dilakukan perbanyakan serangga. Serangga reference A. fasciculatus diambil dari komoditas gaplek milik petani yang disimpan di penyimpanan di rumah, sedangkan serangga reference T. castaneum diambil dari koleksi serangga di Laboratorium Entomologi SEAMEO BIOTROP, Bogor.
Pada saat mengambil sampel serangga, juga dihimpun informasi mengenai penggunaan fosfin oleh fumigator. Penggalian informasi mengenai penggunaan fosfin untuk keperluan perawatan komoditas dan untuk keperluan perlakuan karantina dan pra-pengapalan di Makassar dikumpulkan dari perusahaan pelaksana fumigasi dengan cara mengisi kuesioner yang diedarkan dan juga melakukan wawancara. Kuesioner riwayat pelaksanaan fumigasi fosfin pada biji kakao di Makassar diberikan ke perusahaan pelaksana fumigasi fosfin yang tergabung dalam Asosiasi Perusahaan Pengendalian Hama Indonesia (ASPPHAMI) cabang Makassar yang telah terdaftar dan diakui oleh Badan Karantina Pertanian yaitu PT Cahaya Timur, PT Pan Asia Superintendence Cabang Sulawesi Selatan, PT Agricon Putra Cipta Optima/Terminix Cabang Makassar dan PT Sucofindo Cabang Makassar.
Identifikasi dan Perbanyakan T. castaneum dan A. fasciculatus
16
T. castaneum dan A. fasciculatus. Identifikasi dilakukan berdasarkan kunci identifikasi menurut Haines (1991) dan Bosquet (1990).
Serangga hasil koleksi dari lapangan yang telah dipastikan spesiesnya yaitu T. castaneum dan A. fasciculatus, selanjutnya dikembangbiakkan secara massal dengan cara memasukkan sebanyak mungkin imago dari masing-masing spesies tersebut ke dalam stoples kaca berisi kakao dan gaplek untuk A. fasciculatus dan tepung terigu untuk T. castaneum sebagai makanannya. Setiap empat belas hari semua imago dikeluarkan dari stoples dan dipindahkan ke stoples baru berisi pakan baru. Tujuan dari pembiakan dengan cara ini adalah untuk mendapatkan imago dengan umur seragam. Serangga keturunan F1 yang diperoleh dari pembiakan ini digunakan untuk pengujian resistensi dan pengujian efikasi lapangan serangga resisten.
Status Resistensi T. castaneum dan A. fasciculatus terhadap Fosfin
Penelitian ini dilaksanakan dengan mengikuti metode standar FAO nomor 16 (Busvine 1980). Penelitian terdiri dari 6 perlakuan konsentrasi fosfin dan 2 ulangan. Konsentrasi fosfin yang digunakan adalah 0.000, 0.005, 0.014, 0.023, 0.031,dan 0.040 mg/L. Penentuan konsentrasi uji berdasarkan pada kisaran konsentrasi yang disarankan pada metode standar FAO untuk pengujian T. castaneum yaitu antara 0.005 mg/L sampai 0.04 mg/L, sedangkan untuk serangga A. fasciculatus belum terdapat konsentrasi acuan, sehingga pada penelitian ini digunakan kisaran konsentrasi yang sama dengan perlakuan T. castaneum (Gambar 1).
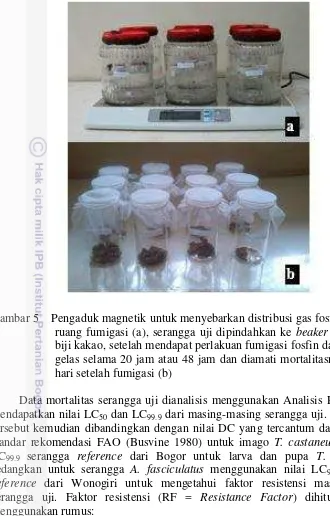
17 Serangga uji yang digunakan adalah fase larva, pupa dan imago T. castaneum dan A. fasciculatus. Umur larva T. castaneum dan A. fasciculatus yang digunakan pada pengujian ini berturut-turut adalah 14 dan 30 hari, sedangkan umur pupa dan imago kedua serangga adalah berturut-turut 1 hari dan 7 hari. Imago A. fasciculatus dikumpulkan dari media pembiakan dengan menggunakan aspirator. Kegiatan ini dilakukan dalam boks transfer berukuran 58 cm x 38 cm x 37 cm untuk menjaga agar serangga tidak terbang keluar, sedangkan larva dan pupa dikumpulkan dengan cara membongkar biji kakao dan gaplek karena larva dan pupa hidup di dalam biji kakao atau di dalam potongan gaplek. Selanjutnya larva dan pupa dipisahkan dari komoditas dengan menggunakan kuas halus. T. castaneum dikumpulkan dengan cara mengayak terigu tempat pembiakannya, kemudian larva, pupa, imago dikumpulkan dengan kuas halus. Serangga uji sebanyak 50 ekor untuk setiap fase dimasukkan ke dalam cincin paralon (diameter 2.5 cm, tinggi 2.5 cm) yang diberi alas kain kasa yang direkatkan menggunakan lem pada bagian dasarnya dan pada bagian atas ditutup kain kasa yang direkatkan menggunakan karet gelang. Stoples kaca diisi satu buah magnet, dan dipasang kawat kasa pada bagian tengahnya. Cincin paralon berisi serangga uji ini diletakkan di atas kawat kasa. Satu stoples kaca merupakan satu ulangan (Gambar 2a).
Gambar 2 Serangga uji dalam cincin paralon dan stoples kaca sebagai ruang fumigasi beserta magnet pengaduk gas (a), Karet penutup lubang tutup stoples tempat menginjeksikan gas fosfin (b)
18
kebocoran gas fosfin. Sumbat karet tersebut sebagai tempat untuk menginjeksikan gas fosfin ke dalam stoples (Gambar 2b). Gas fosfin murni yang akan diaplikasikan ke dalam stoples dapat diperoleh dari alat penghasil gas fosfin mengikuti metode FAO (Busvine 1980).
Gas fosfin murni yang akan diaplikasikan ke dalam stoples dapat diperoleh dari alat penghasil gas fosfin mengikuti metode FAO (Busvine 1980). Peralatan untuk menghasilkan fosfin disiapkan dengan cara memasukkan corong kaca ke dasar tabung gas dan mengatur posisi tabung pengumpul gas di atas corong kaca. Corong kaca diikat menggunakan benang untuk membantu menarik corong kaca pada saat akan memasukkan fosfin pelet. Posisi tabung pengumpul gas dikuatkan dengan memasang klem yang dihubungkan oleh tangkai besi ke tiang besi penyangga (Gambar 3). Tabung gas, tabung pengumpul gas dan tabung pembilas diisi air sampai penuh. Tabung pengumpul dilepaskan terlebih dahulu dari klem. Sekrup penutup tabung pengumpul dibuka dan dipastikan semua udara harus dikeluarkan dari tabung pengumpulan dan tabung pembilas. Selanjutnya sekrup dipasang kembali dan tabung pengumpul diklem kembali pada tiang penyangga.
Gambar 3 Alat penghasil gas fosfin murni dari formulasi pelet aluminium fosfida, apparatus for generating phosphine (Busvine 1980)
Lebih kurang setengah volume air dalam tabung dikeluarkan melalui keran dan digantikan larutan asam sulfat, H2SO4 10% (v/v) dan air (1:1). Larutan dalam
19 tertekan ke bawah. Hal ini mengakibatkan larutan dalam tabung gas naik permukaannya. Semakin banyak gas terbentuk, cairan dalam tabung pengumpul semakin turun sedangkan larutan dalam tabung gas semakin naik. Untuk mencegah larutan meluap harus dilakukan pembuangan larutan dengan membuka keran pembuangan. Gas yang diperoleh cukup sebagai sumber fosfin untuk keperluan pengujian selama beberapa minggu. Pemberian asam sulfat dalam proses ini berfungsi untuk menyerap amonia dan mencegah terjadinya produksi diphosphine (P2H4) yang secara spontan mudah terbakar.
Deteksi resistensi dilaksanakan dengan melakukan fumigasi serangga uji selama 20 jam. Fosfin dengan konsentrasi 0.00, 0.005, 0.014, 0.023, 0.031 dan 0.040 mg/L diambil dari tabung pengumpul gas fosfin dengan menggunakan alat suntik gastight syringe untuk diaplikasikan ke dalam stoples kaca yang telah diisi magnet dan serangga uji (Gambar 4). Gas fosfin yang telah dimasukkan ke dalam stoples kemudian diaduk selama 2 menit menggunakan pengaduk magnetik agar gas tersebut tersebar homogen di seluruh bagian dalam stoples (Gambar 5a). Setelah periode fumigasi, serangga uji dipindahkkan ke beaker glass berisi biji kakao kering sebagai pakan dan ditutup kain kasa (Gambar 5b).
Gambar 4 Pengambilan gas fosfin dari alat penghasil gas fosfin dan aplikasinya pada stoples gelas dengan menggunakan syringe kedap gas
20
Gambar 5 Pengaduk magnetik untuk menyebarkan distribusi gas fosfin di dalam ruang fumigasi (a), serangga uji dipindahkan ke beaker glass berisi biji kakao, setelah mendapat perlakuan fumigasi fosfin dalam stoples gelas selama 20 jam atau 48 jam dan diamati mortalitasnya pada 14 hari setelah fumigasi (b)
Data mortalitas serangga uji dianalisis menggunakan Analisis Probit untuk mendapatkan nilai LC50 dan LC99.9 dari masing-masing serangga uji. Nilai LC99.9
tersebut kemudian dibandingkan dengan nilai DC yang tercantum dalam metode standar rekomendasi FAO (Busvine 1980) untuk imago T. castaneum dan nilai LC99.9 serangga reference dari Bogor untuk larva dan pupa T. castaneum,
sedangkan untuk serangga A. fasciculatus menggunakan nilai LC99.9 serangga
reference dari Wonogiri untuk mengetahui faktor resistensi masing-masing serangga uji. Faktor resistensi (RF = Resistance Factor) dihitung dengan menggunakan rumus:
Nilai LC99.9 serangga uji
RF =
Nilai DC serangga uji atau LC99.9 serangga reference
Jika nilai LC99,9 serangga uji yang diperoleh lebih besar dari nilai
21
Pengujian Efikasi Lapangan Serangga Resisten terhadap Fosfin
Pengujian efikasi lapangan ini dirancang dengan menggunakan Rancangan Split Split Plot. Sebagai petak utama adalah dosis fosfin tablet yang terdiri dari 5 taraf (0, 2, 3, 4, 5 tablet/m3) dalam 3 blok dengan Rancangan Acak Kelompok (RAK). Jenis serangga sebanyak 2 taraf yaitu T. castaneum dan A. fasciculatus sebagai petak bagian, dan 5 lokasi asal serangga sebagai sub petak bagian. Ruang fumigasi yang digunakan bervolume 1 m3 dengan kerangka paralon berukuran 0.5 inchi yang diatur di Gudang Penelitian Pascapanen SEAMEO BIOTROP. Kerangka paralon tersebut ditutup plastik fumigasi yang memiliki ketebalan 150 mikron sehingga membentuk ruangan untuk fumigasi.
Masing-masing sebanyak 20 ekor imago, larva dan pupa T. castaneum dan imago dan pupa A. fasciculatus dimasukkan ke dalam beaker glass (volume 150 mL) masing-masing spesies berisi biji kakao (20 butir). Beaker glass ditutup kain kasa (ukuran lubang 0.5 mm x 0.5 mm) untuk memungkinkan adanya kontak udara, sehingga serangga dapat terekspos gas fosfin.
Biji kakao sebanyak 5 kg dikemas dalam kantung polipropilena. Serangga uji kemudian dimasukkan ke dalam kantung biji kakao. Kantung biji kakao tersebut kemudian dimasukkan ke dalam ruang fumigasi yang masih terbuka. Selang plastik dipasang pada posisi di bawah depan dan bagian atas belakang ruang fumigasi, sedangkan ujung yang lainnya berada di luar ruang fumigasi. Ujung selang monitor yang berada di luar ruang fumigasi ditutup dengan menggunakan plastisin. Selang plastik tersebut digunakan untuk monitoring konsentrasi gas fosfin selama fumigasi berlangsung.
Ruang fumigasi kemudian ditutup dengan plastik fumigasi yang terbuat dari plastik PVC, bagian bawah plastik fumigasi dirapikan dan direkatkan dengan lakban. Selain itu, bagian bawah plastik (sisa plastik) juga ditindih dengan bantalan pasir (sand snake) dengan posisi berselingan seperti susunan bata sehingga tidak memungkinkan gas fosfin keluar dari celah-celah diantara sand snakes dan menciptakan ruang fumigasi kedap udara. Fumigan uji dimasukkan ke dalam ruang fumigasi dengan cara meletakkan fumigan pada cawan petri dan memasukannya ke dalam ruang fumigasi dengan mengangkat bantalan pasir dan plastik fumigasi. Konsentrasi fumigan yang dimasukkan sesuai dengan perlakuan masing-masing, perlakuan kontrol tidak diberi fumigan. Aplikasi fumigan dilakukan dengan cepat dan tepat. Setelah aplikasi fumigan, pemeriksaan kebocoran gas dilakukan dengan menggunakan alat leak detector.
Fumigasi dilakukan selama 7 hari. Pengukuran konsentrasi gas fosfin menggunakan fosfin meter dilakukan mulai 2 jam pertama setelah aplikasi fumigan, jika dari kedua selang monitoring telah menunjukkan keseragaman konsentrasi fosfin dan konsentrasi telah mencapai minimal 200 ppm maka saat itu ditentukan sebagai waktu awal (T0) penghitungan lamanya fumigasi. Pengukuran
konsentrasi fosfin selanjutnya dilakukan pada 24, 48, 96, 120, 144, 168, 192 jam setelah T0. Pada akhir periode fumigasi dilakukan aerasi hingga mencapai tingkat
22
uji dari kantung biji kakao dibawa ke laboratorium untuk dilakukan penghitungan mortalitas.
Data mortalitas digunakan untuk menghitung persentase mortalitas terkoreksi menurut rumus Abbott (1925):
A1 = persentase kematian serangga uji terkoreksi A = persentase kematian serangga uji pada perlakuan C = persentase kematian serangga uji pada kontrol
23
HASIL DAN PEMBAHASAN
Serangga T. castaneum dan A. fasciculatus
Hasil koleksi serangga Tribolium dari kelima lokasi sampling di Makassar menunjukkan bahwa terdapat 2 spesies serangga Tribolium yang ditemukan yaitu T. castaneum dan T. confusum.
T. castaneum (Gambar 6) dan T. confusum dapat dibedakan berdasarkan ciri-ciri berikut yaitu pada T. castaneum antena tiga ruas terakhir membentuk gada sedangkan pada T. confusum antena membesar secara gradual, jarak antar kedua mata faset jika dilihat dari bagian ventral pada T. castaneum lebih pendek dibandingkan pada T. confusum (Gambar 7).
Gambar 6 Serangga T. castaneum: telur, larva, pupa (jantan dan betina), imago
24
Hasil koleksi serangga Araecerus dari kelima lokasi sampling menunjukkan bahwa spesies serangga tersebut adalah A. fasciculatus dengan ciri-ciri pada prothorak dan elitra terdapat pola gelap dan terang yang membentuk belang-belang, tiga segmen terakhir antena lebih panjang dari ruas yang lain dan membentuk loose club (Gambar 8). Dari famili Anthribidae, hanya A. fasciculatus yang menjadi hama penting pada produk simpanan, termasuk hama penting pada biji kakao dan kopi serta dapat ditemukan pada berbagai jenis biji-bijian di penyimpanan (Haines 1990). Serangga A. fasciculatus dilaporkan menyebabkan permasalahan serius pada gaplek di Indonesia (Mangoendihardjo 1981).
Gambar 8 Serangga A. fasciculatus: larva, pupa, imago
Karakteristik Pengelolaan Hama di Lima Gudang Biji Kakao di Makassar
Kelima gudang di Makassar asal serangga T. castaneum dan A. fasciculatus memiliki karakteristik yang mirip dalam hal pengelolaan hama gudang. Pada umumnya mereka melakukan sanitasi dan pengendalian hama secara kimia yaitu melalui penyemprotan (spraying) permukaan stapel (tumpukan karung berisi kakao) dan pengabutan (fogging) menggunakan insektisida piretroid sintetik serta fumigasi menggunakan fosfin. Pengendalian secara kimia dilakukan oleh pihak ketiga (perusahaan pest control dan fumigator). Frekuensi spraying dan fogging umumnya 1 kali sebulan, tetapi fogging di G1 dilakukan satu kali setiap minggu, cold fogging dilakukan 2 kali setiap minggu, sedangkan spraying dilakukan 3 kali seminggu secara spot spraying ataupun blanket spraying tergantung kondisi populasi serangga. Fumigasi untuk perawatan biji kakao pada umumnya dilakukan 3-6 bulan sekali tergantung populasi hama, sedangkan fumigasi untuk keperluan pra-pengapalan yang juga dilakukan di gudang, dilakukan sesuai permintaan.