EKSTRAKSI DAN KARAKTERISASI KOLAGEN
DAN NANOKOLAGEN DARI DAGING
TERIPANG GAMMA (
Stichopus variegatus
)
ALHANA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Ekstraksi dan Karakterisasi Kolagen dan Nanokolagen dari Daging Teripang Gamma (Stichopus variegatus)” adalah benar karya saya dengan arahan dari komisi
pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2015
Alhana
RINGKASAN
ALHANA. Ekstraksi dan Karakterisasi Kolagen dan Nanokolagen dari Daging Teripang Gamma (Stichopus variegatus). Dibimbing oleh PIPIH SUPTIJAH dan KUSTIARIYAH TARMAN.
Kolagen berperan sebagai protein pembangun dalam kulit, tulang, gigi dan otot. Berkurangnya jumlah kolagen dalam tubuh akibat faktor usia dan radiasi ultraviolet memicu kebutuhan suplai kolagen melalui produk-produk pangan maupun nonpangan. Eksplorasi bahan alam yang berpotensi menghasilkan kolagen sangat dibutuhkan dan perlu dikembangkan. Kolagen yang sudah banyak dikomersialkan umumnya berasal dari hewan terestrial, diantaranya sapi dan babi, sehingga organisme laut dapat menjadi alternatif sumber kolagen yang potensial.
Teripang gamma (Stichopus variegatus) merupakan salah satu orgnisme laut filum Echinodermata yang berpotensi sebagai sumber kolagen. Dinding tubuh teripang mengandung kolagen sekitar 70%. Potensi tersebut perlu dikembangkan dan diaplikasikan menjadi produk berbasis kolagen yang aman digunakan. Efektivitas pemanfaatan dalam berbagai produk dipengaruhi oleh ukuran dan bentuk molekul, daya larut, dan kestabilan. Material berukuran nano lebih mudah memasuki bagian dalam tubuh dibandingkan dengan material berukuran lebih besar. Penelitian mengenai ekstraksi kolagen, proses pembuatan nanokolagen, dan karakterisasi fisikokimia dari daging teripang gamma perlu dilakukan untuk aplikasi produk berbasis kolagen. Tujuan penelitian ini menentukan konsentrasi larutan NaOH dan asam asetat terbaik dalam produksi kolagen, memproduksi nanokolagen dan menentukan waktu stirring terbaik terhadap pengecilan ukuran menjadi nanokolagen, serta menentukan karakteristik fisik dan kimia kolagen dan nanokolagen dari daging teripang gamma. penambahan etanol 1:1 (v/v) menghasilkan ukuran 158,88 nm dan ukuran berubah menjadi 234,61 nm setelah disimpan selama 72 jam. Kolagen yang dihasilkan tidak mengandung logam berat (Pb, Hg, As) dan mengandung air 13,64%; protein 67,68%; dan abu 4,15%. Suhu puncak pelelehan kolagen adalah 163,67 °C. Spektra FTIR menunjukkan adanya amida A, amida B, amida I, amida II, dan amida III. Kolagen memiliki struktur α helix dan belum terdegradasi menjadi gelatin. Pola elektroforesis SDS-PAGE kolagen dan nanokolagen berturut-turut menunjukkan pita α1 (117,91 kDa; 115,66 kDa) dan αβ (93,22 kDa; 94,15 kDa). Asam amino utama pada kolagen dan nanokolagen yaitu glisina, alanina, prolina dan asam glutamat. Kolagen dan nanokolagen berturut-turut memiliki derajat putih 69,01% dan 64,36% serta pH 7,37 dan 7,61.
SUMMARY
ALHANA. Extraction dan Characterization of Collagen and Nanocollagen from Sea Cucumber (Stichopus variegatus). Supervised by PIPIH SUPTIJAH and KUSTIARIYAH TARMAN.
Collagen is a structural protein in skin, bone, teeth and tissue. Collagen reduction in the body due to aging and ultraviolet radiation requires collagen supply from food and non-food products. Exploration and further development of natural collagen sources is necessary. Commercial collagen are commonly extracted from terrestrial animals, such as cow and pig, therefore marine organisms can be an alternative potential source of collagen.
Sea cucumber (Stichopus variegatus) is marine organism of the phylum Echinodermata which is potential as source of collagen. Sea cucumber’s body wall contains collagen about 70%. This potency has to be properly developed into a safe application of collagen-based products. The effectivity of application in many collagen-based products is affected by solubility, stability, size and shape of the collagen molecule. Nano-sized materials penetrate the body easier than larger materials. Further research in collagen extraction optimization, production of nanoparticle collagen, and physicochemistry characterization of sea cucumber flesh is necessary for the application of sea cucumber collagen-based products. The purposes of this research were to determine the optimal concentration of NaOH and acetic acid solution in collagen production to produce collagen, the optimal stirring period in accordance to nanocollagen size, and to analyze physical and chemical characteristics of collagen and nanocollagen of sea cucumber flesh.
The best collagen extracted from sea cucumber flesh was obtained with the following processes, pretreatment in 0.3% NaOH 1:10 (w/v), hydrolysis in 0.1% acetic solution 1:10 (w/v), and extracted using distilled water at 45 oC with 1:2 (w/v) ratio. The yield of these processes was 1.5% (wet basis). The particle size of nanocollagen obtained by stirring/sizing process for 3 hours and ethanol addition was 158.88 nm. It was bigger (234,61 nm) due to agglomeration after 72 hours of storage. Heavy metals (Pb, Hg, As) were not detected in the collagen. The collagen contained 13.64% moisture; 67.68% protein; and 4.15% ash. The melting point of the collagen was 163.67 oC. FTIR spectrum showed the existence of amide A, amide B, amide I, amide II, and amide III. SDS-PAGE electrophoresis pattern of collagen and nanocollagen showed α1 (117.91 kDa; 115.66 kDa) and αβ (9γ.ββ kDa; 94.15 kDa) respectively. The major amino acid content of collagen and nanocollagen were glycine, alanine, proline and glutamic acid. Collagen and nanocollagen had 69.01% and 64.36% whiteness and pH 7.37 and 7.61, respectively.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan,
penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
EKSTRAKSI DAN KARAKTERISASI KOLAGEN
DAN NANOKOLAGEN DARI DAGING
TERIPANG GAMMA (
Stichopus variegatus
)
ALHANA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister sains
pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji syukur penulis ucapkan kehadirat Allah SWT yang telah melimpahkan Rahmat dan Karunia-Nya, sehingga penulis dapat menyelesaikan tesis ini dengan judul “Ekstraksi dan Karakterisasi Kolagen dan Nanokolagen dari Daging Teripang Gamma (Stichopus variegatus)”. Tesis ini merupakan salah satu syarat untuk mendapatkan gelar Magister Sains di Program Studi Teknologi Hasil Perairan, Sekolah Pascasarjana, Institut Pertanian Bogor. Bagian dari penelitian sudah diterbitkan dalam Jurnal Pengolahan Hasil Perikanan (JPHPI) 18(2) edisi Agustus 2015.
Kesuksesan penulis mengikuti pendidikan di Sekolah Pascasarjana IPB ini tidak lepas dari dukungan berbagai pihak. Penulis menyampaikan banyak terima kasih yang setulusnya kepada:
1 Dr Pipih Suptijah, MBA sebagai ketua komisi pembimbing dan Dr Kustiariyah Tarman, SPi, MSi sebagai anggota komisi pembimbing atas
kesediaan waktu untuk membimbing, memberikan arahan dan saran selama penyusunan tesis ini.
2 Dr Ir Wini Trilaksani, MSc sebagai penguji tesis dan ketua Program Studi Teknologi Hasil Perairan atas kesediaan waktu dan saran yang diberikan. 3 Prof Dr Ir Joko Santoso, MSi sebagai dosen gugus kendali mutu (GKM) tesis
atas kesediaan waktu dan saran yang diberikan.
4 Kementrian Pendidikan Tinggi dan Kebudayaan yang telah memberikan Beasiswa Unggulan DIKTI tahun 2012-2014 dan dana penelitian melalui BOPTN tahun 2013-2014, serta Pusat Kajian Sumberdaya Pesisir dan Lautan (PKSPL) IPB.
5 Bapak dan Ibu staf pengajar, staf administrasi dan laboran Program Studi Teknologi Hasil Perairan yang telah membantu dan bekerjasama selama penulis menempuh studi.
6 Keluarga besar penulis teruntuk abi Drs. H. Dudi Supiandi, MAg, umi Siti Solihat, SPdI, bapak H. Sabri Hamid, SPd, ibu Hj. Kartini, SPd,
suami Ziaul Haq, ST, putera Muhammad Ashif Barkhiya dan adik-adik (Muhammad Jam’an Marhuman, SE, Akbar Fauzy, SP, Muhammad Zidny Ilman, Ulva Khusnul Hatimah, SE) atas doa, motivasi dan dukungan moril maupun materil selama penulis menempuh studi.
7 Teman-teman S2 THP IPB yang telah membantu dan mendukung proses penelitian sampai penyusunan tesis selesai.
Penulis menyadari bahwa masih terdapat kekurangan dalam penyusunan tesis ini. Jika terdapat kesalahan, penulis memohon maaf yang sebesar-besarnya. Semoga karya ilmiah ini membawa manfaat bagi seluruh masyarakat.
Bogor, Oktober 2015
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xiii
PENDAHULUAN 1
Latar Belakang 1
Rumusan Masalah 3
Tujuan Penelitian 3
Hipotesis Penelitian 3
METODE PENELITIAN 4
Waktu dan Tempat 4
Bahan dan Alat 4
Prosedur Kerja 4
Karakterisasi bahan baku 4
Produksi kolagen (modifikasi dari Cui et al. 2007) 4 Pembuatan nanokolagen (modifikasi dari Coaster et al. 2000) 5
Karakterisasi kolagen dan nanokolagen 5
Prosedur Analisis 5
Rendemen kolagen teripang 5
Analisis kadar air (AOAC 2005) 5
Analisis kadar abu (AOAC 2005) 7
Analisis kadar protein (AOAC 2005) 7
Analisis kadar lemak (AOAC 2005) 7
Analisis logam berat (BSN 1998, BSN 2006) 8
Uji biuret (Gornall et al. 1949) 9
Analisis pH (AOAC 2005) 10
Analisis asam amino (AOAC 1995) 10
Analisis derajat putih (Park 2005) 11
Analisis titik leleh dengan DSC (Martianingsih dan Atmaja 2009) 12 Analisis gugus fungsi dengan FTIR (Munyonga et al. 2004a) 12 Analisis berat molekul dengan SDS-PAGE (Laemmli 1970) 12
Analisis struktur mikroskopis 12
Analisis ukuran partikel dan polidispersitas index nanokolagen 12 (Etzler dan Sanderson 1995)
Analisis Data (Steel dan Torrie 1993) 13
HASIL DAN PEMBAHASAN 14
Karakteristik bahan baku 14
Nanokolagen 18
Karakteristik kolagen dan nanokolagen 19
Gugus fungsi 19
Titik leleh 21
pH 23
Viskositas 23
Derajat putih 23
Asam amino 24
Berat molekul 25
Struktur mikroskopis kolagen dan nanokolagen 26
SIMPULAN DAN SARAN 28
Simpulan 28
Saran 28
DAFTAR PUSTAKA 29
DAFTAR TABEL
1 Larutan BSA dengan konsentrasi 0-1,5 mg/mL 110
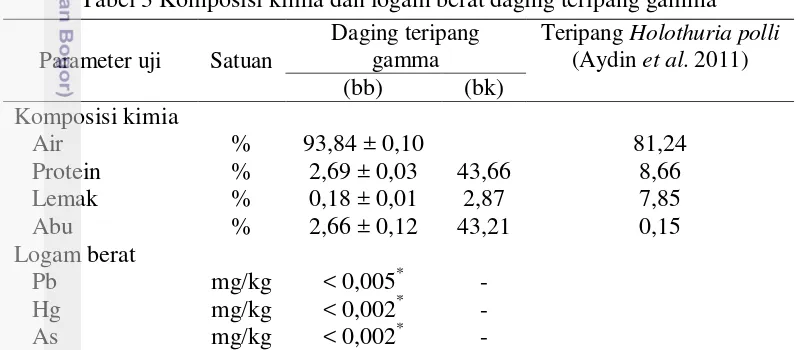
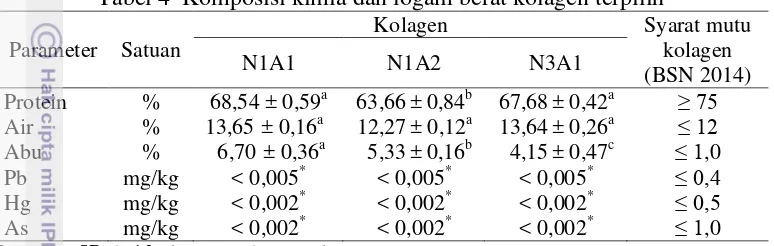
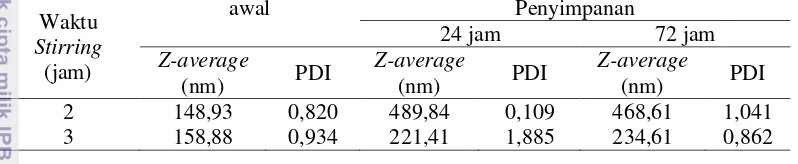
2 Perlakuan kombinasi konsentrasi NaOH dan konsentrasi asam asetat 13 3 Komposisi kima dan logam berat daging teripang gamma 14 4 Komposisi kimia dan logam berat kolagen terpilih 18 5 Ukuran partikel dan indeks polidispersitas (PDI) nanokolagen 19
6 Wilayah serapan FTIR kolagen 20
7 pH, viskositas, dan derajat putih kolagen dan nanokolagen 23 8 Komposisi asam amino kolagen dan nanokolagen 24
DAFTAR GAMBAR
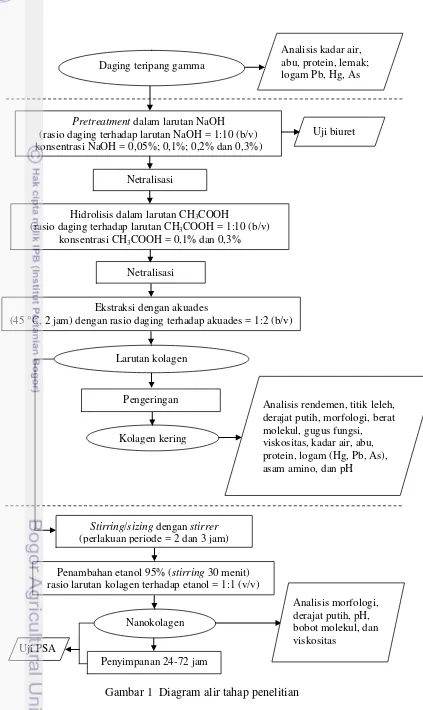
1 Diagram alir tahap penelitian 16
2 Teripang gamma (Stichopus variegatus) 14
3 Konsentrasi protein dalam larutan NaOH sisa perendaman daging 15 teripang gamma. Histogram menunjukkan standardeviasi(n=3).
Perbedaan huruf mengindikasikan perbedaan signifikan (p<0,05)
4 Rendemen kolagen (bb). Histogram menunjukkan standar deviasi (n=3) 17 Perbedaan huruf mengindikasikan perbedaan signifikan (p<0,05)
5 Kolagen kering 17
6 Spektra FTIR kolagen 20
7 Kurva termogram DSC kolagen 22
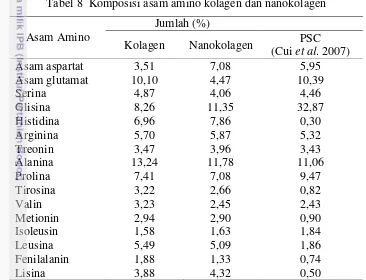
8 Pola elektroforesis SDS-PAGE marker (M), kolagen (K), dan 26 nanokolagen (N)
DAFTAR LAMPIRAN
01 Rata-rata nilai absorbansi standar Bovin Serum Albumin (BSA) dan 37 kurva regresi linier standar BSA
02 Konsentrasi protein larutan NaOH sisa perendaman daging teripang 37 gamma
03 Hasil uji ANOVA dan uji lanjut Duncan nilai konsentrasi protein larutan 37 NaOH sisa perendaman daging
4 Hasil uji ANOVA dan uji lanjut Duncan rendemen kolagen 38 05 Data analisis proksimat kolagen 38 06 Hasil uji ANOVA dan uji lanjut Duncan pengaruh konsentrasi NaOH dan 39 asam asetat terhadap kadar protein kolagen
07 Hasil uji ANOVA dan uji lanjut Duncan pengaruh konsentrasi NaOH dan 39 asam asetat terhadap kadar abu kolagen
08 Hasil uji ANOVA pengaruh konsentrasi NaOH dan asam asetat terhadap 39 kadar air kolagen
09 Data pH kolagen dan nanokolagen 40
10 Data viskositas kolagen dan nanokolagen 40
11 Data derajat putih kolagen dan nanokolagen 40
1 PENDAHULUAN
Latar Belakang
Kolagen merupakan protein utama penyusun struktur jaringan ikat golongan vertebrata dengan proporsi sekitar 30% dari total protein tubuh manusia. Kolagen memegang peranan cukup penting dalam industri makanan, kosmetik, biomedis, dan farmasi (Chai et al. 2010). Kolagen digunakan dalam bidang kosmetik sebagai bahan aktif pada produk perawatan kulit dengan fungsi untuk meningkatkan kelembaban kulit, mencegah keriput, menjaga kulit dari pengaruh buruk radiasi dan menjaga elastisitas. Kolagen pada kulit dapat mengalami kerusakan akibat terpapar sinar radiasi UV-A dan UV-B dari sinar matahari dan kandungan kolagen dalam tubuh manusia berkurang seiring dengan bertambahnya usia (Draelos dan Thaman 2006). Penambahan kolagen dalam formulasi kosmetik ditujukan untuk menggantikan kolagen yang rusak akibat pengaruh lingkungan maupun faktor usia. Keistimewaan penggunaan kolagen berkaitan dengan karakteristik fisikokimia kolagen diantaranya sifat antigenitas rendah, tidak beracun, biocompatible dan biodegradable, sehingga dapat disiapkan dalam berbagai bentuk dalam aplikasi medis (Lee et al. 2001).
Kolagen yang paling banyak di pasaran umumnya berasal dari sapi atau babi yang keamanan dan kehalalannya perlu diwaspadai, sehingga diperlukan alternatif sumber kolagen yang aman dan halal dari hasil perairan. Kolagen dapat diekstrak dari kulit ikan (Ahmad dan Benjakul 2010; Singh et al. 2010; Kittiphattanabawon
et al. 2005), sisik ikan (Li et al. 2008; Matmaroh et al. 2011; Zhang et al. 2011), dan tulang ikan (Kittiphattanabawon et al. 2005). Salah satu biota perairan yang berpotensi sebagai sumber kolagen adalah teripang (Saito et al. 2002; Cui et al. 2007). Teripang termasuk hewan avertebrata yang hidup di dasar laut dan memiliki kemampuan regenerasi sel. Teripang tersebar luas di lingkungan laut mulai dari zona pasang surut sampai laut dalam terutama di Samudra Hindia dan Samudra Pasifik Barat. Di perairan Indonesia terdapat 53 jenis teripang yang meliputi genus Holothuria, Actinopyga, Bohadschia, Labiodemas, Thelonata dan Stichopus. Jenis-jenis teripang yang diperdagangkan secara internasional terdapat 29 jenis, diantaranya yang termasuk ke dalam famili Holothuridae dan
Stichopodidae (Darsono 2007).
Indonesia merupakan salah satu negara pengekspor teripang ke beberapa negara, yaitu China, Jepang, Korea, Singapura, Taiwan dan Australia. Teripang umumnya dipasarkan dalam beberapa bentuk produk, yaitu teripang kering, teripang kaleng, kerupuk teripang, dan minuman kesehatan (jelly gamat). Teripang mempunyai nilai ekonomis penting karena selain sebagai pangan fungsional, teripang juga merupakan sumber biofarmaka dari hasil laut. Beberapa penelitian melaporkan bahwa teripang mengandung bahan bioaktif yang bermanfaat sebagai antihipertensi (Haug et al. 2002), antibakteri dan antifungi (Kumar et al. 2007), antikanker (Meyer dan Gustafson 2008), antikoagulan (Mojica dan Merca 2005; Santos et al. 2015), dan antitumor (Santos et al. 2015).
pelembab kulit. Penelitian mengenai kolagen yang berasal dari teripang masih jarang dilakukan. Dua penelitian yang pernah dilakukan yaitu Saito et al. (2002) yang melaporkan bahwa 70% dinding tubuh teripang Stichopus japonicus
mengandung kolagen dan Cui et al (2007) yang melakukan karakterisasi dan komposisi subunit kolagen dari teripang S. japonicus, padahal teripang memiliki spesies yang beragam dengan karakteristik yang unik antar spesies. Pemanfaatan teripang sebagai sumber kolagen perlu diteliti dan dikembangkan lebih lanjut untuk memberi nilai tambah produk. Salah satu jenis teripang ekonomis penting yang belum dimanfaatkan secara optimal adalah teripang gamma. Teripang gamma memiliki tubuh bulat panjang seperti mentimun dengan panjang berkisar antara 25-35 cm, berwarna hijau kecoklatan dengan bercak-bercak yang tidak teratur, dan terdapat lekukan teratur pada tubuhnya.
Aplikasi kolagen perlu mempertimbangkan manfaat dan efektivitasnya. Efektivitas penetrasi bahan-bahan aktif dalam kosmetik dipengaruhi oleh karakteristik fisik dan kimia dari bahan aktif tersebut, misalnya ukuran dan bentuk molekul, daya larut, dan kestabilan (Achyar 1986). Chai et al. (2010) menyatakan bahwa berat molekul juga merupakan salah satu faktor yang mempengaruhi penetrasi kolagen ke dalam kulit. Teknologi nanopartikel dapat digunakan untuk memaksimalkan penyerapan kolagen dalam tubuh.
Nanopartikel pertama kali dikembangkan sekitar tahun 1970. Penggunaan nanopartikel pada awalnya dirancang sebagai agen pembawa untuk vaksin dan anti kanker (Majeti dan Ravikumar 2000). Nanopartikel telah menjadi bagian yang penting dari penelitian di bidang penghantaran makanan dan obat (Hans dan Lowman 2002). Keuntungan utama dari makanan atau penghantar obat dalam ukuran nanopartikel adalah kemungkinan makanan (obat) tersebut dapat dihantarkan sesuai target yang diinginkan dalam tubuh, daya serap yang tinggi, serta kemampuan yang luas untuk mencapai target pada berbagai area tubuh dalam jangka waktu yang lama, biodegradable, dan non toksik (Hans dan Lowman 2002; Weber et al. 2000; Rahimnejad et al. 2009).
Material berukuran nano lebih mudah memasuki bagian dalam kulit dibandingkan dengan material berukuran lebih besar (Hoet et al. 2004). Penelitian sebelumnya menyatakan bahwa nanomaterial dapat dibuat dengan teknologi
supercritical fluid (Reverchon dan Adami 2006) dan Particle Replication In Nonwetting Templates (Rolland et al. 2005, namun teknologi tersebut masih tergolong mahal. Mohanraj dan Chen (2006) membuat nanopartikel dengan beberapa metode, yaitu dispersi polimer, polimerisasi monomer, dan gelasi ionik/koaservasi polimer hidrofilik. Pada penelitian ini dilakukan pembuatan nanopartikel kolagen menggunakan metode yang sederhana dan mudah diterapkan, yaitu dengan stirring yang disertai dengan presipitasi speris.
Rumusan Masalah
Kolagen yang banyak diproduksi umumnya berasal dari kulit hewan terestrial, misalnya babi dan sapi yang perlu diwaspadai kehalalan dan keamanannya. Sumber kolagen dari biota laut memiliki potensi besar untuk dimanfaatkan sebagai bahan kosmetik yang aman, salah satunya teripang gamma. Teripang gamma umumnya tidak dimanfaatkan sebagai bahan pangan karena kenampakannya yang kurang disukai, padahal keberadaannya cukup melimpah di perairan Indonesia. Proses ekstraksi kolagen umumnya hanya menggunakan asam atau basa, ataupun kombinasi asam dan basa, serta dilanjutkan dengan tahapan proses yang kompleks, misalnya disertai dengan sentrifugasi, pengendapan, dan dialisis, sehingga perlu diteliti proses ekstraksi kolagen yang lebih sederhana. Kolagen memiliki bobot molekul yang cukup besar, sehingga diperlukan teknologi pengecilan ukuran melalui nanoteknologi yang dapat meningkatkan efektivitas dan penyerapan kolagen.
Tujuan Penelitian
Tujuan umum penelitian ini adalah memperoleh teknik ekstraksi kolagen dan pembuatan nanokolagen dari daging teripang gamma. Tujuan khususnya, yaitu:
1) menentukan konsentrasi larutan NaOH dan asam asetat terbaik dalam produksi kolagen,
2) menentukan periode stirring terbaik dalam pengecilan ukuran menjadi nanokolagen,
3) menentukan karakteristik fisik dan kimia kolagen dan nanokolagen dari daging teripang gamma.
Hipotesis Penelitian
Tahap produksi kolagen
H0:-Konsentrasi larutan NaOH dan asam asetat tidak berpengaruh terhadap rendemen dan komposisi kimia kolagen
H1: Konsentrasi larutan NaOH dan asam asetat berpengaruh terhadap rendemen dan komposisi kimia kolagen
Tahap pembuatan nanokolagen
2 METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilakukan dari Maret 2014 sampai Maret 2015 di Laboratorium Biokimia Hasil Perairan, Laboratorium Bahan Baku Hasil Perairan Departemen Teknologi Hasil Perairan IPB, Laboratorium Pusat Studi Biofarmaka IPB, Laboratorium Analisa Bahan Departemen Fisika IPB, Laboratorium Departemen Ilmu dan Teknologi Pangan IPB, Laboratorium Kesehatan Organisme Akuatik Departemen Budidaya Perairan IPB, Laboratorium Mikrobiologi PPSHB IPB, dan Laboratorium Saraswanti Indo Genetech Bogor.
Bahan dan Alat
Alat-alat yang digunakan untuk ekstraksi kolagen dan pembuatan nanokolagen diantaranya stirrer (Favorit), magnetic stirrer, freeze dryer (Christ Alpha 2-4 LD UK), rotary evaporator , dan Particle Size Analyzer (Vasco DLS), kromameter CR-310 (Minolta CR-310 Tokya Japan), Atomic Absorption Spectrophotometer (AA6300 Shimadzu Japan), High Performance Liquid Chromatography (Water Coorporation USA), Fourier Transform Infrared Spectrophotometer (Bruker Tensor 37 German), mikroskop, dan Differential Scanning Calorimetry (DSC-60 Shimadzu Kyoto Japan). Bahan utama yang digunakan pada penelitian adalah daging teripang gamma (Stichopus variegatus).
Teripang gamma diperoleh dari Lampung. Bahan-bahan yang digunakan untuk ekstraksi kolagen dan pembuatan nanokolagen terdiri dari NaOH, asam asetat (CH3COOH) (Merck), akuades, dan etanol 95%. Bahan-bahan lain meliputi bahan untuk analisis karakteristik kolagen dan nanokolagen.
Prosedur Kerja
Tahap penelitian meliputi karakterisasi daging teripang gamma, ekstraksi kolagen, pembuatan nanokolagen, dan karakterisasi fisikokimia kolagen dan nanokolagen (Gambar 1).
Karakterisasi Bahan Baku
Daging teripang gamma dianalisis komposisi kimia, meliputi kadar air, abu, protein, dan lemak (AOAC 2005), serta logam berat Pg, Hg (BSN 2006), dan As (BSN 1998).
Produksi Kolagen (modifikasi dari Cui et al. 2007)
Produksi kolagen dilakukan dengan tiga tahap, yaitu tahap pretreatment
menggunakan larutan NaOH, tahap hidrolisis dalam larutan asam asetat (CH3COOH), dan tahap ekstraksi dengan akuades. Proses pretreatment dengan larutan NaOH dan hidrolisis dalam asam asetat dilakukan pada suhu chilling.
digunakan dua variasi konsentrasi asam asetat yaitu 0,1% dan 0,3%. Rasio daging dengan larutan asam asetat adalah 1:10 (b/v). Daging hasil perendaman asam asetat dicuci dengan akuades sampai pH netral sebelum dilanjutkan pada tahap ketiga yaitu ekstraksi dengan akuades pada suhu 45 C selama 2 jam dengan rasio antara daging dan akuades adalah 1:2 (b/v). Hasil ekstrak berupa kolagen larut air, selanjutnya dikeringkan dengan freeze dryer untuk memperoleh kolagen kering.
Pembuatan Nanokolagen (modifikasi dari Coaster et al. 2000)
Proses pembuatan nanokolagen diawali dengan pembuatan kolagen dengan prosedur berdasarkan perlakuan terbaik yang diperoleh pada tahap optimasi ekstraksi kolagen, selanjutnya kolagen diproses lebih lanjut untuk membentuk partikel berukuran kecil (sizing) yaitu dalam bentuk nanopartikel. Pengecilan ukuran dilakukan dengan homogenisasi pada kecepatan tinggi menggunakan
stirrer (suhu ± 10 °C) dengan perlakuan periode stirring 2 dan 3 jam, selanjutnya presipitasi speris dengan cara ditambahkan etanol 95% sedikit demi sedikit dalam kondisi masih distirring. Pada tahap ini digunakan rasio larutan kolagen terhadap etanol 95% 1:1 (v/v). Analisis ukuran partikel kolagen yang dihasilkan pada setiap perlakuan dilakukan menggunakan alat Particle Size Analyzer (PSA). Ukuran nanokolagen juga diukur pada lama penyimpanan 24 dan 72 jam (suhu 10 °C).
Karakterisasi Kolagen dan Nanokolagen
Tahap ini bertujuan untuk menentukan karakteristik fisik dan kimia kolagen maupun nanokolagen yang dihasilkan dari perlakuan terbaik pada penelitian tahap kedua dan ketiga. Karakteristik fisik yang diukur antara lain rendemen, titik leleh, derajat putih, morfologi, berat molekul, gugus fungsi, dan viskositas; karakteristik kimia meliputi kadar air, abu, protein, dan logam berat (Hg, Pb, dan As), asam amino, dan pH.
Prosedur Analisis
Rendemen kolagen teripang
Rendemen kolagen diperoleh dari perbandingan berat kering kolagen dengan berat bahan daging teripang. Rendemen dapat diperoleh dengan rumus:
Rendemen kolagen teripang (%) = Berat kering kolagen
Berat bahan baku (daging ) x 100% Analisis kadar air (AOAC 2005)
Prinsip analisis kadar air adalah mengetahui kandungan air pada bahan. Cawan porselin dikeringkan dalam oven dengan suhu 105 °C selama satu jam. Cawan porselin yang sudah dikeringkan dalam oven dimasukkan dalam desikator (15 menit) dan ditimbang (A). Sampel sebanyak 1 g dimasukkan ke dalam cawan porselin kering serta diketahui beratnya. Cawan berisi sampel dimasukkan dalam oven dengan suhu 102-105 °C selama 5-6 jam atau sampai beratnya konstan. Cawan dimasukkan dalam desikator (30 menit) kemudian ditimbang (C).
Kadar air dihitung dengan rumus:
Kadar air (%) = B−C
B−A x 100%
keterangan: A = Berat cawan kosong (g)
B = Berat cawan yang diisi dengan sampel (g)
Gambar 1 Diagram alir tahap penelitian Uji PSA
Nanokolagen
Penyimpanan 24-72 jam Stirring/sizing dengan stirrer (perlakuan periode = 2 dan 3 jam)
Penambahan etanol 95% (stirring 30 menit) rasio larutan kolagen terhadap etanol = 1:1 (v/v)
Analisis morfologi, derajat putih, pH, bobot molekul, dan viskositas
Daging teripang gamma
Analisis kadar air, abu, protein, lemak; logam Pb, Hg, As
Pretreatment dalam larutan NaOH (rasio daging terhadap larutan NaOH = 1:10 (b/v) konsentrasi NaOH = 0,05%; 0,1%; 0,2% dan 0,3%)
Netralisasi
Uji biuret
Ekstraksi dengan akuades
(45 °C, 2 jam) dengan rasio daging terhadap akuades = 1:2 (b/v)
Larutan kolagen
Pengeringan
Kolagen kering Netralisasi
Analisis rendemen, titik leleh, derajat putih, morfologi, berat molekul, gugus fungsi, viskositas, kadar air, abu, protein, logam (Hg, Pb, As), asam amino, dan pH
Hidrolisis dalam larutan CH3COOH
(rasio daging terhadap larutan CH3COOH = 1:10 (b/v)
Analisis Kadar abu (AOAC 2005)
Prinsip analisis kadar abu adalah mengetahui jumlah abu yang terdapat pada suatu bahan terkait dengan mineral dari bahan yang dianalisis. Cawan abu porselen dibersihkan kemudian dikeringkan dalam oven bersuhu sekitar 105 °C selama 30 menit. Cawan abu porselen yang telah dikeringkan dalam oven dimasukkan dalam desikator (30 menit) dan kemudian ditimbang (A). Sampel sebanyak 5 g (C) ditimbang kemudian dimasukkan ke dalam cawan abu porselen. Cawan abu berisi sampel dibakar di atas kompor listrik sampai tidak berasap dan dimasukkan ke dalam tanur pengabuan dengan suhu 600 °C selama 7 jam. Cawan abu berisi sampel hasil pengabuan dimasukkan dalam desikator (30 menit) kemudian ditimbang (B). Kadar abu dihitung dengan rumus:
Kadar abu (%) = B−A
C x 100%
keterangan: A = Berat cawan abu porselen kosong (g)
B = Berat cawan abu porselen + sampel setelah dikeringkan (g) C = Berat sampel (g)
Kadar protein (AOAC 2005)
Prinsip analisis protein adalah mengetahui kandungan dari protein kasar (crude protein) pada suatu bahan. Sebanyak 0,5 g sampel dimasukkan ke dalam labu Kjeldahl, kemudian ditambahkan sebutir kjeltab dan 10 mL H2SO4. Labu yang berisi larutan tersebut dimasukkan ke dalam alat pemanas dengan suhu 410 °C dan ditambahkan air sebanyak 10 mL. Proses ini dilakukan sampai larutan menjadi jernih. Larutan yang telah jernih didinginkan, kemudian ditambahkan 50 mL akuades dan 20 mL NaOH 40% dan didestilasi. Hasil destilasi ditampung dalam labu Erlenmeyer 125 mL yang berisi 25 mL asam borat (H3BO3) 2% yang mengandung indikator campuran dari bromocresol green 0,1% dan methyl red
0,1% dengan perbandingan 2:1. Destilasi dilakukan dengan menambahkan 50 mL larutan NaOH-Na2S2O3 ke dalam alat destilasi hingga tertampung 40 mL destilat di dalam labu Erlenmeyer dengan hasil destilat berwarna hijau kebiruan. Destilat yang dihasilkan dititrasi dengan HCl 0,09 N sampai warna larutan berubah warna menjadi merah muda. Volume titran dibaca dan dicatat. Perhitungan kadar protein adalah sebagai berikut:
Nitrogen (%) = mL HCl sampel −mL HCl blanko x 0,1 NHCl x fp x 14
mg sampel x 100%
Protein (%) = Nitrogen (%) x faktor konversi (6,25)
Kadar lemak (AOAC 2005)
Kadar lemak dihitung dengan rumus:
Kadar lemak (%) =W3−W1
W2 × 100%
keterangan: W1 = Berat labu lemak kosong (g) W2 = Berat sampel (g)
W3 = Berat labu lemak dengan lemak (g)
Analisis logam berat (BSN 1998, BSN 2006)
Kandungan logam berat (Hg, Pb, dan As) dianalisis menggunakan Atomic Absorption Spectrophotometer (AAS). Metode analisis logam berat didasarkan pada SNI 2354.6-2006 untuk Hg, SNI 2354.7-2006 untuk Pb, dan SNI 01-4866-1998 untuk As. Tahap analisis logam berat diawali dengan pembuatan larutan standar dan kurva kalibrasi logam, dilanjutkan dengan analisis logam berat sampel uji.
Pembuatan larutan standar dan kurva kalibrasi logam:
a. Pembuatan larutan standar dan kurva kalibrasi timbal (Pb)
Larutan standar Pb (1000 µg/mL) sebanyak 10 mL dimasukkan ke dalam labu ukur 100 mL, kemudian ditambahkan 10 ml HNO3 5N dan ditepatkan sampai garis tanda dengan air suling (konsentrasi 100 µg/mL). Larutan kerja untuk pembuatan kurva kalibrasi Pb dibuat dengan memipet 0,0 mL; 0,2 mL; 0,4 mL; 0,6 mL; 1,0 mL; dan 1,5 mL larutan baku 100 µ g/mL, dimasukkan ke dalam labu ukur 50 mL, dan ditepatkan sampai garis tanda (larutan kerja mengandung 0,0; 0,4; 0,8; 1,2; 2; dan 3 µ g/mL). Larutan standar Pb masing-masing diukur serapannya pada panjang gelombang 217,0 nm dengan AAS. Kurva standar didapatkan dari hasil perhitungan absorbansi larutan standar, sehingga diperoleh persamaan regresi linier.
b. Pembuatan larutan standar dan kurva kalibrasi merkuri (Hg)
Larutan standar Hg (1000 µg/mL) sebanyak 10 mL dimasukkan ke dalam labu ukur 100 mL, kemudian ditambahkan 10 ml HNO3 10% (v/v) dan ditepatkan sampai garis tanda dengan air suling (konsentrasi 100 µg/mL). Larutan kerja untuk pembuatan kurva kalibrasi Hg dibuat dengan memipet 0,0 mL; 0,005 mL; 0,01 mL; 0,02 mL; 0,04 mL; dan 0,05 mL larutan baku 100 µg/mL, dimasukkan ke dalam labu ukur 100 mL. Akuades bebas merkuri ditambahkan sebanyak 50 mL, ditambah H2SO4 95% dan 20 mL KMnO4 5% (b/v). Hidroksilamin hidroklorida 10% ditambahkan tetes demi tetes hingga warna ungu dari permanganat hilang. Larutan ditepatkan sampai garis tanda dengan air suling, lalu dikocok hingga homogen (larutan kerja ini mengandung 0; 5; 10; 20; 40; dan 50 µg/L Hg). Larutan standar Hg masing-masing diukur serapannya pada panjang gelombang 253,7 nm dengan AAS. Kurva standar dan regresi linier didapatkan dari hasil perhitungan absorbansi larutan standar.
mengandung 0; 3; 10; 20; 40; dan 80 µg/L). Larutan standar As masing-masing diukur serapannya pada panjang gelombang 193,7 nm dengan AAS. Kurva standar didapatkan dari hasil perhitungan absorbansi larutan standar, sehingga diperoleh persamaan regresi linier.
Analisis logam berat sampel uji
Penentuan kandungan logam berat sampel terbagi atas tiga tahap, yaitu destruksi, pembacaan absorbans sampel, dan perhitungan kandungan logam berat. a. Tahap destruksi
Sampel sebanyak 1 g dimasukkan ke dalam labu Erlenmeyer 100 mL, kemudian ditambahkan 5 mL HNO3 (p), dan didiamkan selama 1 jam pada suhu ruang di ruang asam. Sampel dipanaskan di atas hot plate dengan temperatur rendah selama 4-6 jam, kemudian dibiarkan 24 jam dengan kondisi tertutup. Sampel ditambah dengan 0,4 mL H2SO4 dan dipanaskan kembali selama 1 jam di atas hot plate sampai larutan berkurang (lebih pekat). Selama proses pemanasan berlangsung ditambahkan 2-3 tetes larutan HClO4: HNO3 (2:1) ke dalam sampel sampai terjadi perubahan warna dari coklat menjadi kuning tua dan menjadi kuning muda.
Pemanasan dilanjutkan sekitar 10-15 menit setelah terjadi perubahan warna. Sampel diangkat dan didinginkan, kemudian ditambahkan 2 mL akuades dan 0,6 mL HCl (p). Sampel dipanaskan kembali selama 15 menit. Sampel disaring dengan kertas saring untuk memisahkan endapan yang terbentuk. Sampel dianalisis kandungan logam beratnya dengan Atomic Absorption Spectrophotometer (AAS).
b. Pembacaan absorbansi
Pembacaan absorbansi logam berat Hg dilakukan dengan spektrofotometer penyerapan atom tanpa nyala pada panjang gelombang 253,7 nm, logam berat Pb ditentukan dengan spektrofotometer graphite furnace-argon pada panjang gelombang 217,0 nm dan logam berat As ditentukan dengan lampu katode As dengan panjang gelombang 193,7 nm. Absorbansi larutan blanko dan larutan standar untuk masing-masing logam berat juga diukur dengan cara yang sama. c. Perhitungan
Konsentrasi logam berat sampel dihitung berdasarkan kurva regresi linier dari standar masing-masing logam berat. Selanjutnya kadar logam berat dihitung dengan rumus:
D = kadar contoh μg/L dari hasil pembacaan AAS
E = kadar blanko contoh μg/L dari hasil pembacaan AAS W = berat contoh (g)
V = volume akhir larutan contoh yang disiapkan (mL) Fp = faktor pengenceran
Uji biuret (Gornall et al.1949)
dalam 1000 mL larutan NaOH 0,2 M. Sebanyak 4 mL sampel cair dimasukkan ke dalam tabung reaksi yang bersih dan kering, kemudian ditambahkan pereaksi Biuret sebanyak 6 mL. Campuran dibiarkan pada suhu ruang selama 30 menit atau diinkubasi pada suhu 37 °C selama 10 menit sampai warna ungu terbentuk sempurna. Pengukuran absorbansi campuran dilakukan pada panjang gelombang 520 nm. Prosedur pengukuran absorbansi larutan standar BSA dilakukan dengan cara yang sama seperti larutan sampel dengan konsentrasi BSA 0-1,5 mg/mL dari larutan stok BSA 5 mg/mL dengan komposisi disajikan pada Tabel 1. Nilai absorbansi yang diperoleh kemudian dimasukkan ke dalam kurva standar untuk menentukan konsentrasi protein yang terkandung dalam sampel uji. Kurva regresi linier standar BSA dapat dilihat pada Lampiran 1.
Tabel 1 Larutan BSA dengan konsentrasi 0-1,5 mg/mL Konsentrasi BSA
Sampel sebanyak 1 g dilarutkan dalam 20 mL akuades, ditambahkan 50 mL akuades, dan dihomogenkan. Suhu sampel diukur untuk digunakan sebagai suhu pH meter yang akan digunakan. Alat pH meter dinyalakan dan dibiarkan hingga stabil. Elektroda dicelupkan ke dalam sampel beberapa saat sampai diperoleh nilai pH yang stabil.
Analisis asam amino (AOAC 1995)
Komposisi asam amino ditentukan dengan HPLC. Sebelum dipakai, perangkat HPLC dibilas terlebih dahulu dengan eluen yang akan digunakan selama 2-3 jam. Begitu pula dengan syringe yang akan digunakan dibilas dengan akuades. Analisis asam amino menggunakan HPLC terdiri dari 4 tahap, yaitu: pembuatan hidrolisat protein, pengeringan, derivatisasi, dan injeksi.
a. Pembuatan hidrolisat protein
Preparasi sampel dilakukan dengan membuat hidrolisat protein. Sampel ditimbang sebanyak 0,1 gram dan dihancurkan, sampel yang telah hancur ditambahkan dengan HCl 6 N sebanyak 5-10 mL. Larutan tersebut dipanaskan dalam oven pada suhu 100 °C selama 24 jam. Hal ini dilakukan untuk menghilangkan gas atau udara yang ada pada sampel agar tidak menganggu kromatogram yang dihasilkan. Setelah pemanasan selesai, hidrolisat protein disaring menggunakan milipore berukuran 45 mikron.
b. Pengeringan
asetat, dan trimetilamin dengan perbandingan 2:2:1. Setelah sampel dikeringkan dengan pompa vakum untuk mempercepat proses dan mencegah oksidasi.
c. Derivatisasi
Larutan derivatisasi dibuat dari campuran antara larutan metanol, pikoiodotiosianat, dan trinetilamin dengan perbandingan 3:3:4. Proses derivatasisasi dilakukan agar detektor mudah untuk mendeteksi senyawa yang ada pada sampel. Selanjutnya dilakukan pengenceran dengan cara menambahkan 10 ml asetonitril 60% dan natriun asetat 1 M lalu dibiarkan selama 20 menit. Hasil pengenceran disaring kembali menggunakan milipore berukuran 45 mikron. Larutan derivatisasi sebanyak γ0 μL ditambahkan pada hasil pengeringan.
d. Injeksi ke HPLC
Hasil saringan diambil sebanyak β0 μL untuk diinjeksikan ke dalam HPLC. Untuk perhitungan konsentrasi asam amino pada bahan, dilakukan pembuatan kromatogram standar menggunakan asam amino standar yang telah siap pakai yang mengalami perlakuan yang sama dengan sampel.
Kondisi alat HPLC saat berlangsungnya analisis asam amino: Temperatur kolom : 38 °C
Jenis kolom : Pico tag 3.9 x 150 nm columm Kecepatan alir eluen : 1 mL/menit
Program : Gradien
Tekanan : 3000 psi
Fase gerak : Asetonitril 60% dan Natrium asetat 1 M 40% Detektor : UV / 254 nm
Merk : Waters
Kandungan asam amino pada bahan dapat dihitung dengan rumus yaitu persentase asam amino dalam 100 gram sampel :
Asam amino (%) = Luas area sampel x C x Fp x BM x 100% Luas area standar x bobot sampel
Keterangan:
C = Konsentrasi standar asam amino (0,5 µmol/mL) FP = faktor pengenceran (5 mL)
BM = Bobot molekul dari masing-masing asam amino (g/mol)
Analisis derajat putih (Park 2005)
Analisis warna dilakukan menggunakan kromamater CR-310. Sampel sebanyak 25 mL dimasukkan ke dalam cawan transparan dan ditutup. Pemotretan dengan kromameter dilakukan sebanyak tiga kali pada masing-masing sampel Hasil pengukuran ditampilkan berupa angka digital pada alat. Sistem warna yang digunakan adalah sistem warna Hunter. Sistem warna Hunter Lab memiliki tiga atribut yaitu nilai L*, a*, dan b*. Nilai L menunjukkan kecerahan sampel (warna kromatis, 0: hitam sampai 100: putih). Warna kromatik merah sampai hijau ditunjukkan oleh nilai a (a: 0 sampai 100 untuk warna merah, a: 0 sampai -80 untuk warna hijau). Warna kromatik biru sampai kuning ditunjukkan oleh nilai b (b: 0 sampai 70 untuk warna kuning, b: 0 sampai -70 untuk warna biru). Derajat putih dihitung menggunakan rumus:
Analisis titik leleh dengan DSC (Martianingsih dan Atmaja 2009)
Analisis termal dilakukan menggunakan alat DSC untuk mengetahui karakteristik termal dari kolagen dan nanokolagen yang dihasilkan. Sampel sebanyak 5-10 mg ditempatkan dalam wadah aluminium lalu ditutup. Sampel kemudian dianalisis pada suhu antara 20 °C hingga 300 °C dengan laju pemanasan 10 °C/menit.
Analisis gugus fungsi dengan FTIR (Munyonga et al. 2004a)
Analisis FTIR digunakan untuk mengetahui gugus-gugus fungsi khas dari kolagen. Sampel uji terlebih dahulu dibentuk pelet dengan campuran KBr. Sebanyak 100 mg KBr dan 2 mg sampel uji dicampurkan, kemudian ditumbuk sampai halus dan tercampur rata dalam mortar agate. Campuran tersebut dicetak dalam cetakan pelet. Oksigen yang terkandung dalam campuran diminimalkan dengan meletakan cetakan pelet pada pompa hidrolik yang diberi tekanan sampai tanda 80. Tekanan dalam cetakan diturunkan dengan membuka kran udara. Pelet yang dihasilkan dilepaskan dari cetakan, kemudian diletakan pada tablet holde
untuk dilakukan pengukuran dengan alat FTIR.Pengukuran sampel uji dilakukan pada bilangan gelombang antara 4000-500 cm-1. Spektra FTIR yang dihasilkan menunjukkan puncak-puncak serapan bilangan gelombang dari sampel uji. Gugus-gugus fungsi sampel uji ditentukan berdasarkan puncak serapan bilangan gelombang yang terdeteksi dengan wilayah serapan untuk gugus fungsi protein.
Analisis berat molekul dengan SDS-PAGE (Laemmli 1970)
Sampel kolagen dilarutkan dalam 0.1 M Na3PO4 (pH 7,2) pada konsentrasi 1 mg/mL. Sampel sebanyak 20 µ L ditambahkan dengan buffer sampel dengan rasion 5:1 (v/v). Buffer sampel terdiri dari 10% -merkaptoetanol, 20% gliserol, 1,5% buffer Tris–HCl (pH 6,8), 4% SDS, dan 0.1% bromophenol blue. Sampel dielektroforesis dengan tegangan 60 V dan kuat arus 25 mA selama 3 jam. Setelah elektroforesis, gel direndam dalam larutan etanol 30% dan 10% asam asetat selama 3 jam dengan rasio gel dan larutan 1:5. Larutan diganti dengan 30% etanol dan diagitasi selama 30 menit. Larutan etanol diganti dengan air bebas ion dan diagitasi 10 menit. Gel direndam dengan 0,1% AgNO3 (1:5) selama 30 menit kemudian gel dicuci dengan air bebas ion selama 20 detik, kemudian ditambahkan larutan 2,5% Na2CO3 dan 0,02% formaldehida dengan rasio gel dan larutan 1:5. Setelah itu diinkubasi sampai terbentuk pita. Gel dicuci dalam 1% larutan asam asetat, kemudian dibilas dengan air bebas ion. Berat molekul protein sampel diperkirakan berdasarkan berat molekul marker. Marker yang digunakan adalah
spektra multicolor broad range protein ladder.
Analisis morfologi dengan mikroskop
Sampel kolagen dan nanokolagen diteteskan pada kaca objek dan dibiarkan hingga kering, kemudian ditutup dengan kaca penutup untuk menghindari kontaminasi benda asing pada sampel. Preparat kolagen dan nanokolagen dilihat di bawah mikroskop cahaya dengan perbesaran 100x.
Analisis ukuran partikel dan polidispersitas index nanokolagen (Etzler dan Sanderson 1995)
rapat. Distribusi ukuran partikel dapat diketahui melalui gambar yang dihasilkan. Ukuran tersebut dinyatakan dalam jari-jari untuk partikel yang berbentuk bola. Penentuan ukuran dan distribusi partikel menggunakan PSA dapat dilakuan dengan (1) difraksi sinar laser untuk partikel dari ukuran submikron sampai dengan milimeter, (2) counter principle untuk mengukur dan menghitung partikel yang berukuran mikron sampai dengan milimeter, dan (3) penghamburan sinar untuk mengukur partikel yang berukuran mikron sampai dengan nanometer.
Analisis Data (Steel dan Torrie 1993)
Rancangan yang digunakan untuk tahap perendaman dalam larutan NaOH adalah Rancangan Acak Lengkap (RAL). Perlakuan merupakan konsentrasi NaOH. Semua perlakuan dilakukan sebanyak tiga kali ulangan.
Model rancangan adalah:
Yij= μ + τi+ εij Keterangan:
i = 1, 2, 3, dan 4 j = 1, 2, dan 3
Yij = respon pengaruh konsentrasi NaOH ke-i ulangan ke-j μ = nilai tengah umum
τi = pengaruh konsentrasi NaOH ke-i
εij = pengaruh acak pada konsentrasi NaOH ke-i ulangan ke j
Rancangan yang digunakan untuk rendemen kolagen adalah Rancangan Acak Lengkap (RAL). Perlakuan merupakan kombinasi antara konsentrasi NaOH dan konsentrasi asam asetat (Tabel 2). Semua perlakuan dilakukan sebanyak tiga kali ulangan.
Tabel 2 Perlakuan kombinasi konsentrasi NaOH dan konsentrasi asam asetat Konsentrasi asam asetat Konsentrasi NaOH
0,05% 0,1% 0,3%
Yij = respon pengaruh perlakuan ke-i ulangan ke-j μ = nilai tengah umum
τi = pengaruh perlakuan ke-i
εij = pengaruh acak pada perlakuan ke-i ulangan ke j
3 HASIL DAN PEMBAHASAN
Karakteristik Bahan Baku
Bahan baku yang digunakan dalam penelitian ini adalah bagian daging teripang gamma yang telah dipisahkan dari kulit dan jeroannya. Kenampakan teripang gamma (Stichopus variegatus) dapat dilihat pada Gambar 2.
Gambar 2 Teripang gamma (Stichopus variegatus)
Daging teripang gamma dikarakterisasi terlebih dahulu dengan melakukan analisis komposisi kimia meliputi kadar air, abu, protein, lemak, dan logam berat (Hg, Pb, dan As). Komposisi kimia dan logam berat daging teripang gamma disajikan pada Tabel 3.
Tabel 3 Komposisi kimia dan logam berat daging teripang gamma
Parameter uji Satuan
Daging teripang gamma
Teripang Holothuria polli (Aydin et al. 2011) (bb) (bk)
Komposisi kimia
Air % 93,84 ± 0,10 81,24
Protein % 2,69 ± 0,03 43,66 8,66
Lemak % 0,18 ± 0,01 2,87 7,85
Abu % 2,66 ± 0,12 43,21 0,15
Logam berat
Pb mg/kg < 0,005* -
Hg mg/kg < 0,002* -
As mg/kg < 0,002* -
Rata-rata±SD dari 2 ulangan pada sampel yang sama *)limit deteksi AAS
Daging teripang gamma memiliki kadar air yang tinggi sebesar 93,84%. Kadar air yang tinggi ini menjadikan daging teripang gamma berbentuk seperti lendir pada suhu ruang. Teripang gamma memiliki kadar air lebih tinggi dari teripang Stichopus hermanii (88,56%), H. polii (81,24%), dan kulit Chiloscyllium punctatum (61,96%) (Andirisnanti 2012; Aydin et al. 2015; Kittiphattanabawon et al. 2010). Tingginya kandungan air daging teripang gamma mengakibatkan daging memiliki tekstur yang sangat lunak dan mudah lumer pada suhu ruang. Kandungan protein daging teripang (2,69%) lebih rendah dibandingkan protein
proporsional. Kadar lemak dan abu daging teripang gamma berturut-turut adalah 0,18% dan 2,66%. Kittiphattanabawon et al. (2010) menyatakan bahwa kulit
C. punctatum memiliki kadar abu 12,12%, dan lemak 0,19%. Keberadaan lemak dan mineral pada daging teripang gamma merupakan unsur pengotor yang perlu dihilangkan melalui optimasi proses pretreatment untuk meningkatkan kualitas kolagen yang dihasilkan. Shon et al. (2011) menyatakan bahwa keberadaan lemak dan mineral lainnya akan mengganggu efektivitas kolagen dalam aplikasinya pada berbagai produk.
Analisis kandungan logam berat pada daging teripang gamma dilakukan agar produk kolagen yang dihasilkan terjamin keamanannya dari cemaran logam. Kandungan logam berat Pb, Hg, dan As pada daging teripang gamma (Tabel 3) masih berada dibawah ambang batas kandungan logam berat untuk ikan dan hasil olahannya yang ditetapkan oleh BSN (2009) yaitu 0,3 mg/kg (Pb); 0,5 mg/kg (Hg); dan 1,0 mg/kg (As), sehingga daging teripang gamma aman untuk digunakan sebagai sumber bahan baku kolagen.
Kolagen
Ekstraksi kolagen diawali dengan pretreatment dengan larutan NaOH untuk menghilangkan protein nonkolagen dan kontaminan (lemak, mineral, dan pigmen). Konsentrasi protein dalam larutan NaOH sisa perendaman daging teripang gamma (Gambar 3) ditentukan dengan uji biuret. Data konsentrasi protein yang terlarut dalam larutan NaOH pada perendaman daging teripang gamma dapat dilihat pada Lampiran 2. Berdasarkan hasil uji lanjut (p<0,05), konsentrasi NaOH memberikan pengaruh berbeda nyata terhadap konsentrasi protein nonkolagen (Lampiran 3).
Zhou dan Regenstein (2005) menyatakan penggunaan larutan basa pada proses pretreatment lebih efektif dalam proses pengeluaran protein nonkolagen dan hanya menyebabkan tingkat kehilangan kolagen yang rendah dibandingkan dengan penggunaan larutan asam. Pelepasan zat selain kolagen terjadi akibat hancurnya sebagian ikatan silang pada struktur kolagen dalam kondisi basa (Hinterwaldner 1977). Selama perendaman dalam NaOH memungkinkan masuknya air dan menyebabkan protein nonkolagen yang terjebak dalam matrik kolagen menjadi lebih mudah dilepaskan (Jaswir et al. 2011). Zhou dan Regenstein (2005) menunjukkan bahwa protein nonkolagen dapat dihilangkan dengan perendaman dalam larutan NaOH dengan konsentrasi 0,01 mol/L OH dan 0,1 mol/L OH. Peningkatan konsentrasi diatas 0,1 mol/L OH tidak memberikan pengaruh terhadap penghilangan protein nonkolagen. Penelitian yang dilakukan Shon et al. (2011) menunjukkan bahwa perendaman kulit dengan konsentrasi NaOH 0,15 N selama 48 jam menghasilkan rendemen, viscositas, dan gel strength
kolagen dari kulit ikan skate (Raja kenojei) yang terbaik.
Proses selanjutnya adalah hidrolisis menggunakan asam untuk mengubah struktur serat kolagen menjadi terpisah-pisah lebih sederhana sehingga mempermudah proses ekstraksi pada tahap selanjutnya. Jaswir et al. (2011) mengatakan bahwa penggunaan asam membantu peningkatan H+ yang menyebabkan air lebih mudah masuk ke dalam serat kolagen. Masuknya air disebabkan oleh gaya elektrostatik antara gugus polar pada serat kolagen dengan H+ dari asam atau terbentuknya ikatan hidrogen antara gugus nonpolar pada serat kolagen dengan H+ dari asam, sehingga dapat mendukung rusaknya struktur serat kolagen melalui terganggunya ikatan nonkovalen dan pada akhirnya memudahkan ekstraksi dan kelarutan kolagen.
Netralisasi daging dengan akuades setelah direndam dalam larutan NaOH maupun asam asetat ditujukan agar kolagen memiliki pH mendekati netral. Hinterwaldner (1977) menyatakan bahwa penetralan akan mengurangi sisa asam maupun basa sehingga dihasilkan pH mendekati netral.
Ekstraksi kolagen melalui proses pemanasan dengan suhu 40-45 °C merupakan proses pembentukan struktur triple helix kolagen larut air dan membentuk larutan yang kental. Suhu pemanasan tidak melebihi 45 °C untuk menghindari terjadinya degradasi kolagen menjadi gelatin selama ekstraksi berlangsung. Kołodziejska et al. (2008) menyatakan bahwa degradasi kolagen menjadi gelatin terjadi diatas suhu 45 °C. Proses kerusakan ikatan hidrogen dan kovalen akibat pemanasan kolagen menyebabkan terganggunya kestabilan struktur triple heliks kolagen sehingga terjadi perubahan bentuk menjadi gulungan dan akhirnya kolagen terdegradasi menjadi gelatin yang larut air (Gómez-Guillén
et al. 2011). Kolagen teripang gamma hasil ekstraksi dikeringkan dengan Freeze dryer sehingga diperoleh kolagen dalam bentuk padat. Rendemen kolagen (bb) (Gambar 4) berasal dari kombinasi perlakuan konsentrasi NaOH dan asam asetat.
Rendemen kolagen menunjukkan persentase bobot kolagen yang dihasilkan terhadap bobot daging teripang gamma yang digunakan. Perlakuan konsentrasi NaOH dan asam asetat memberikan pengaruh berbeda nyata (p<0,05) terhadap rendemen kolagen (Lampiran 4). Kolagen N1A1, N1A2, dan N3A1 merupakan tiga perlakuan kolagen yang menghasilkan rendemen tertinggi, yaitu 1,94%; 1,56%; dan 1,50% (bb). Rendemen kolagen teripang gamma tersebut lebih tinggi
Parupeneus heptacanthus (Matmaroh et al. 2011). Zhang et al. (2010) menyatakan bahwa rendemen ASC dan PSC yang diisolasi dari sisik ikan mas (Cyprinus carpio) berturut-turut adalah 0,86% dan 2,32%. Rendahnya rendemen ASC menunjukkan rendahnya solubilitas ikatan silang melalui reaksi aldehida dengan lisina dan hidroksilisina pada telopeptida (Kknott dan Bailley 1998).
Gambar 4 Rendemen kolagen (bb). Histogram menunjukkan standar deviasi (n=3). Perbedaan huruf mengindikasikan perbedaan signifikan (p<0,05)
Berdasarkan pengamatan visual terhadap kolagen kering (Gambar 5) tidak ditemukan tidak ditemukan benda asing. Kolagen memiliki tekstur seperti serat kapas. Kolagen terpilih dengan tiga rendemen tertinggi (N1A1, N1A2, dan N3A1) dianalisis lebih lanjut untuk menentukan perlakuan terbaik.
Gambar 5 Kolagen kering
Komposisi kimia dan logam berat kolagen terpilih dapat dilihat pada Tabel 4. Data analisis proksimat kolagen dilampirkan pada Lampiran 5. Kolagen N1A1 memiliki kadar protein tertinggi dibanding kolagen N1A2 (63,66%) dan N3A1 (67,38%), tetapi tidak berbeda nyata dengan kadar protein kolagen N3A1 (p<0,05) (Lampiran 6). Pada penelitian ini, perlakuan konsentrasi NaOH dan asetat berpengaruh terhadap kadar abu kolagen (Lampiran 7), tetapi tidak memberikan pengaruh terhadap kadar air kolagen (Lampiran 8). Hal ini dikarenakan semua kolagen yang dihasilkan dilanjutkan dengan proses pengeringan yang sama menggunakan freeze dryer. Kolagen dengan perlakuan
konsentrasi asam asetat yang lebih tinggi, yaitu 0,3% menyebabkan kadar protein lebih rendah. Kolagen N3A1 juga memiliki kadar abu paling rendah dibanding N1A1 dan N2A1. Kadar abu yang rendah sangat diharapkan untuk mendapatkan kolagen berkualitas baik. Kolagen N3A1 merupakan perlakuan terpilih untuk dilanjutkan pada pembuatan nanokolagen, karena memiliki kadar protein tertinggi dan kadar abu paling rendah dibanding perlakuan lainnya.
Tabel 4 Komposisi kimia dan logam berat kolagen terpilih Parameter Satuan Rata-rata±SD dari 2 ulangan pada sampel yang sama
*limit deteksi AAS
Kolagen (N3A1) memiliki kandungan protein sebesar 67,68%, kadar air 13,64%, dan abu 4,15%. Kolagen dari penelitian memiliki kandungan protein yang lebih kecil dibanding kolagen kulit ikan pari pada penelitian Nur’aenah (2012), yaitu 86,97%. Kadar abu yang tinggi tidak hanya terdapat pada kolagen teripang gamma, tetapi juga terkandung pada kolagen serbuk dari kulit Raja kanojei mencapai 3,38% (Shon et al. 2011). Kadar abu yang tinggi dapat diminimalisir melalui demineralisasi pada awal tahap ekstraksi kolagen. Matmaroh et al. (2011) berhasil mengurangi kadar abu sisik ikan Parupeneus heptacanthus dari 42,31% menjadi 0,76% melalui demineralisasi menggunakan larutan EDTA-2Na 0,5M dengan rasio 1:10 (b/v) selama 48 jam. Kadar air kolagen kering dari teripang gamma lebih tinggi dibandingkan kadar air kulit (11,78%) dan syarat mutu kolagen berdasarkan BSN (2014). Wadah penyimpanan kolagen kering yang kurang tepat mengakibatkan penyerapan air selama penyimpanan sebelum sampel dianalisis. Berdasarkan BSN (2009), syarat mutu kolagen memiliki kadar air ≤ 1β%, abu ≤1%, dan total nitrogen 1β-14 %. Hasil analisis logam berat, tidak ditemukan adanya Pb, Hg, dan As. Hal ini menunjukkan kolagen yang dihasilkan aman diaplikasikan pada produk pangan maupun nonpangan.
Nanokolagen
Pembuatan nanokolagen dilakukan dengan proses stirring dan penambahan etanol. Proses stirring dilakukan dalam keadaan dingin untuk menghindari kerusakan kolagen. Optimasi periode stirring bertujuan untuk mendapatkan kolagen dengan ukuran terkecil. Ukuran partikel dan indeks polidispersitas (PDI) nanokolagen dapat dilihat pada Tabel 5.
Berdasarkan hasil pengujian ukuran partikel, nanokolagen yang dihasilkan dari perlakuan periode stirring 2 dan 3 jam memiliki ukuran partikel 148,93 dan 158,88 nm. Bolzinger et al. (2011) mendefinisikan nanopartikel dalam kisaran 1
nanopartikel merupakan partikel padat yang memiliki ukuran 10-1000 nm. Hasil tersebut menunjukkan bahwa nanokolagen berhasil dibuat dengan metode stirring
dan penambahan etanol (presipitasi speris). Ketika larutan kolagen diaduk dengan kecepatan tinggi meggunakan stirrer selama dua jam, maka batang-batang kolagen terpotong-potong menjadi ukuran yang lebih pendek. Penambahan etanol menyebabkan berkurangnya jumlah air yang dapat diikat oleh molekul kolagen dan sebaliknya meningkatkan rekasi hidrofobik dengan terbentuknya ikatan hidrogen intramolekul kolagen. Hal ini menyebabkan perubahan struktur kolagen menjadi bentuk terdehidrasi.
Tabel 5 Ukuran partikel dan indeks polidispersitas (PDI) nanokolagen Waktu
Ukuran nanokolagen mengalami perubahan selama penyimpanan. Perlakuan waktu stirring 3 jam menghasilkan nanokolagen berukuran 221,41 nm setelah disimpan 24 jam dan 234,61 setelah 72 jam. Perubahan ukuran tersebut lebih kecil dibanding peningkatan ukuran nanokolagen pada perlakuan stirring 2 jam yang mencapai 468,61 nm setelah 72 jam. Perubahan ukuran nanokolagen selama penyimpanan diduga disebabkan terjadinya agregasi antar nanopartikel kolagen dalam suspensi selama penyimpanan Jun et al. (2011) bahwa agregasi dapat terjadi karena interaksi antar partikel yang lebih besar dibandingkan interaksi partikel dengan pelarut. Oleh karena itu, waktu stirring 3 jam merupakan perlakuan terpilih dalam pembuatan nanokolagen. Nur’aenah (β01β) membuat nanopartikel kolagen dengan ukuran 185,24 nm, sedangkan Azarmi et al. (2006) yang berhasil membuat nanopartikel gelatin type A ukuran partikel adalah 386 nm melalui metode desolvasi dua tahap menggunakan etanol sebagai agen desolvasi pada rasio larutan terhadap etanol sebesar 1:1.
Indeks polidispersitas adalah distribusi massa molekul yang memiliki ukuran bervariasi dalam sampel tertentu yang menunjukkan hasil perhitungan dari berat rata-rata molekul dibagi dengan jumlah rata-rata berat molekul. Semakin mendekati nol berarti distribusinya semakin homogen. Ukuran partikel dan indeks polidispersitas dipengaruhi oleh komposisi matriks, proses pencampuran, dan proses penguapan pelarut organik (Singh dan Lillard 2009).
Karakteristik Kolagen dan Nanokolagen
Karakteristik kolagen dan nanokolagen dari perlakuan terbaik (N3A1) dianalisis untuk mengetahui sifat fisik maupun kimianya, yaitu gugus fungsi dan titik leleh pada kolagen; serta pH, viskositas, derajat putih, asam amino, berat molekul, dan morfologi pada kolagen dan nanokolagen.
Gugus fungsi
menyebabkan terjadinya vibrasi molekul senyawa organik ketika menyerap sinar tersebut. Berdasarkan spektra FTIR kolagen (Gambar 6), kolagen menunjukkan puncak-puncak serapan pada wilayah serapan amida yang meliputi amida A, amida B, amida I, amida II, dan amida III yang merupakan serapan khas pada kolagen. Wilayah serapan FTIR kolagen dapat dilihat pada Tabel 6.
Gambar 6 Spektra FTIR kolagen Tabel 6 Wilayah serapan FTIR kolagen Amida
Wilayah serapan
(cm-1)
Puncak serapan (cm-1)
Keterangan Referensi
Amida A 3400-3440 3417,27 vibrasi stretching NH Sai dan Babu (2001)
Amida B 2935-2915 2926,30 asimetrikal stretching CH2.
Coates (2000)
Amida I 1600-1690 1656,57 vibrasi stretching C=O Kong dan Yu (2007)
Amida II 1480-1575 1550,08 CN stretching,
NH bending Kong dan Yu (2007)
Amida III 1229-1301 1239,15 CN stretching,
NH bending Kong dan Yu (2007)
Keberadaan amida A pada kolagen ditunjukkan dengan adanya serapan pada
v = 3417,27 cm-1. Amida A menunjukkan vibrasi stretching NH yang terdeteksi pada kisaran panjang gelombang 3400-3440 cm-1 (Sai dan Babu 2001). Grup NH berkaitan dengan hidrogen pada rantai peptida. Spektra amida B pada kolagen ditemukan pada bilangan gelombang 2926,30 cm-1. Hal ini sesuai dengan wilayah serapan amida B yang terdapat pada kisaran v = 2935-2915 cm-1. Coates (2000) menyatakan bahwa serapan amida B ini terbentuk dari asimetrikal stretching CH2.
ditemukan pada bilangan gelombang 1656,57 cm-1. Frekuensi bilangan
Lates niloticus berturut-turut adalah 1648 cm-1 dan 1647 cm-1, yang menunjukkan struktur random coil. Amida I gelatin dari kulit luar cumi-cumi berada pada kulit L. niloticus memiliki panjang gelombang amida A, I, II, dan III berturut-turut yaitu 3434 cm-1, 1650 cm-1, 1542 cm-1, dan 1235 cm-1 (Muyonga et al. 2004b). Perbedaan spektra yang ditemukan diduga karena adanya perbedaan struktur molekul kolagen (Matmaroh et al. 2011). Sims et al. 1992 menyatakan bahwa perbedaan hasil uji FTIR dapat disebabkan oleh perbedaan tipe ikatan silang pada jaringan kolagen.
Amida II berkaitan dengan CN stretching dan NH bending yang berada pada wilayah serapan 1480-1575 cm-1 (Kong dan Yu 2007). Hasil spektra FTIR menunjukkan amida II kolagen memiliki bilangan gelombang 1550,08 cm-1. Spektra amida III ditemukan pada bilangan gelombang 1229-1301 cm-1 yang menunjukkan interaksi intermolekuler pada kolagen yang berkaitan dengan CN
stretching dan NH bending (Kong dan Yu 2007). Pada penelitian ini, spektra Amida III pada kolagen teripang gamma ditemukan pada bilangan gelombang 1239,15 cm-1. Nagarajan et al. (2012) menghasilkan gelatin dari kulit luar cumi-cumi yang memiliki gugus fungsi amida III dengan wilayah serapan 1236,86 cm-1 – 1235,79 cm-1. Nikoo et al. (2011) menyatakan wilayah serapan gelatin memiliki nilai bilangan gelombang pada kisaran 1235 cm-1 yang mengindikasikan hilangnya struktur triple helix akibat perubahan α-helix menjadi struktur random coil (single helix) yang disebabkan denaturasi kolagen menjadi gelatin.
Intensitas rasio antara serapan amida III dan 1450 cm-1 adalah 1,17. Intensitas rasio tersebut menunjukkan struktur triple helix pada kolagen. Nilai rasio yang mendekati 1,0 menandakan bahwa kolagen masih memiliki struktur
triple helix (Matmaroh et al. 2011), sehingga kolagen yang dihasilkan dengan proses pemanasan pada suhu 45 °C belum terdegradasi menjadi bentuk gelatin yang ditandai dengan masih terdapatnya struktur triple helix.
Titik leleh
dilakukan dengan mengukur perbedaan aliran panas pada sampel serta mengukur fase-fase transisi, yaitu transisi gelas (Tg), titik leleh (Tm), dan temperatur dekomposisi (Td) pada polimer. Kurva termogram DSC kolagen dapat dilihat pada Gambar 7.
Gambar 7 Kurva termogram DSC kolagen
Kurva termogram DSC kolagen maupun nanokolagen memiliki dua puncak eksotermis. Puncak eksotermis pertama menunjukkan transisi gelasi dari kolagen akibat terputusnya ikatan hidrogen yang mengarah pada pembentukan polimer amorf yaitu gelatin. Transisi gelasi kolagen terjadi pada suhu 100,94 °C. Puncak eksotermis kedua merupakan suhu transisi maksimum yang menunjukkan puncak
melting bahan. Kolagen memiliki Tmax pada suhu 163,67 °C, sedangkan suhu awal dan akhir pelelehannya berturut-turut adalah 162,51 °C dan 173,33 °C.
Stabilitas termal kolagen juga berkaitan dengan komposisi asam imino terutama hidroksiprolin yang berpengaruh terhadap stabilisasi struktur triple helix
(Bae et al. 2008). Suhu denaturasi kolagen dari beberapa spesies memiliki perbedaan, yaitu 57 °C PSC dari S. japonicus (Cui et al. 2007), 41,01 °C PSC dan 41,58 °C ASC dari sisik Parupeneus heptacanthus (Matmaroh et al. 2011). Tingginya nilai Tmax disebabkan oleh perbedaan jenis pelarut kolagen yang digunakan. Pada penelitian ini digunakan air sebagai media pelarut kolagen, sementara umumnya yang digunakan sebagai media pelarut adalah asam asetat. Penelitian Singh et al. (2011) menunjukkan penggunaan air sebagai media pelarut pada pengujian DSC dari Acid Soluble Collagen (ASC) dan Pepsin Soluble Collagen (PSC) dari kulit ikan striped catfish memberikan nilai Tmax yang lebih tinggi dibandingkan ASC maupun PSC yang dilarutkan dalam asam asetat.
Ahmad dan Benjakul (2010) mengatakan adanya asam asetat menyebabkan terputusnya ikatan hidrogen intramolekul yang merupakan penstabil struktur
pH
Nilai pH kolagen berkaitan erat dengan tingkat kelarutan kolagen (Tabarestani et al. 2012). Hasil pengukuran pH kolagen dan nanokolagen menunjukkan kedua bahan tersebut bersifat netral (Lampiran 9). Berdasarkan hasil penelitian, kolagen dan nanokolagen memiliki pH berturut-turut 7,37 dan 7,61 (Tabel 7). Nilai pH kolagen dan nanokolagen pada penelitian ini sesuai dengan standar kolagen yang ditetapkan oleh BSN (2014), bahwa standar nilai pH kolagen berkisar antara 6,5-8. Peng et al. (2004) melaporkan nilai pH pada beberapa merk kolagen berkisar antara 3,8-4,7. Perbedaan nilai pH kolagen tersebut dapat disebabkan perbedaan jenis dan konsentrasi asam atau basa yang digunakan selama proses hidrolisis. Netralisasi mempengaruhi pH akhir kolagen karena proses tersebut dapat mengurangi residu asam maupun basa setelah proses pretreatment dan hidrolisis. Proses penetralan yang baik menghasilkan pH akhir yang mendekati pH netral.
Tabel 7 pH, viskositas, derajat putih kolagen dan nanokolagen
Parameter Satuan Kolagen Nanokolagen
pH - 7,37 ± 0,01 7,63 ± 0,03
Viskositas cP 14,12 ± 0,45 10,27 ± 0,28
Derajat putih % 69,01 ± 0,05 64,36 ± 0,02
Viskositas
Viskositas merupakan daya aliran molekul yang menyatakan kekentalan dalam sistem larutan. Kolagen dan nanokolagen berturut-turut memiliki nilai viskositas 14,12 cP dan 10,27 cP pada suhu 25 °C (Tabel 7). Data viskositas kolagen dan nanokolagen dilampirkan pada Lampiran 10. Nanokolagen memiliki viskositas lebih rendah dibanding kolagen karena proses stirring dalam pembuatan nanokolagen menyebabkan pemotongan molekul kolagen menjadi lebih kecil dan rantai senyawanya menjadi lebih pendek. Billmeyer (1962) menyatakan bahwa senyawa polimer yang lebih pendek memiliki viskositas lebih rendah dibandingkan dengan senyawa polimer yang lebih panjang dari jenis yang sama. Beberapa faktor yang mempengaruhi viskositas antara lain temperatur, gaya tarik antar molekul, dan jumlah molekul terlarut (Zhang et al. 2011). Semakin banyak jumlah molekul, maka semakin tinggi viskositasnya pada suhu yang sama. Viskositas yang tinggi juga berkaitan erat dengan tingginya bobot molekul (Ogawa et al. 2004). Zhang et al. (2011) menyatakan viskositas yang tinggi berkaitan dengan tolakan elektrostatik yang kuat antara molekul kolagen dalam larutan. Ahmad dan Benjakul (2010) menyatakan bahwa pepsin solubilised collagen using porcine pepsin (PPSC) dari kulit Aluterus monocerous memiliki viskositas 19,6 cP pada suhu 4 °C. Kolagen dari Raja kenojei memiliki viskositas 3,25 cP pada suhu 40 °C (Shon et al. 2011)
Derajat putih
bahwa kolagen dari kulit ikan skate (Raja kenojei) memiliki derajat putih mencapai 88,4%. Kolagen dan nanopartikel kolagen dari kulit ikan pari memiliki derajat putih yang berbeda, yaitu 72,48% pada kolagen dan 60,03% pada nanopartikel kolagen (Nur’aenah β01β). Perbedaan warna kolagen berkaitan dengan tingkat efektivitas pengeluaran pigmen selama proses perendaman asam atau basa.
Asam Amino
Molekul dasar kolagen terbentuk dari tiga rantai polipeptida yang saling berpilin membentuk struktur triple helix dengan susunan asam amino yang khas yaitu Gly-X-Y, pada posisi X adalah prolina dan posisi Y adalah hidroksiprolina (Friess 1998). Komposisi asam amino kolagen dan nanokolagen dapat dilihat pada Tabel 8.
Tabel 8 Komposisi asam amino kolagen dan nanokolagen Asam Amino
Kolagen dan nanokolagen mengandung glisina, alanina, dan prolina yang tinggi, yaitu 8,26% glisina, 13,24% alanina, dan 7,41% prolina pada kolagen, serta 11,35% glisina, 11,78% alanina, dan 7,08% prolina pada nanokolagen. Friess (1998) menyatakan bahwa asam amino glisin terdapat pada setiap posisi ketiga susunan asam amino triple helix kolagen (Gly-X-Y), sementara 35% dari asam amino penyusun triple helix kolagen merupakan prolin dan hidroksiprolin. Glisin berperan dalam mengurangi hambatan sterik dan memicu interaksi ikatan hidrogen dalam rantai helix (Fontaine-Vive et al. 2009).