EFEK PENGGUNAAN MIKROENKAPSULASI PROBIOTIK
ANAEROBIK TERHADAP FERMENTABILITAS RANSUM
DAN KADAR AFLATOKSIN DI RUMEN
IN VITRO
NAOMI GRYTA GHOSSANY
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Efek Penggunaan Mikroenkapsulasi Probiotik Anaerobik Terhadap Fermentabilitas Ransum dan Kadar Aflatoksin di Rumen In Vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
Naomi Gryta Ghossany
ABSTRAK
NAOMI GRYTA GHOSSANY. Efek Penggunaan Mikroenkapsulasi Probiotik Anaerobik Terhadap Fermentabilitas Ransum dan Kadar Aflatoksin di Rumen In Vitro. Dibimbing oleh SURYAHADI dan SRI SUHARTI.
Penelitian ini bertujuan untuk mengevaluasi penggunaan mikroenkapsulasi probiotik anaerobik terhadap fermentabilitas ransum dan kadar aflatoksin di rumen in vitro. Penelitian ini menggunakan rancangan acak kelompok (RAK) dengan 4 perlakuan dan 3 kelompok berdasarkan waktu pengambilan rumen. Peubah yang diamati adalah kurva pertumbuhan isolat mikroba rumen, daya simpan mikroenkapsulasi probiotik anaerobik, total volatile fatty acid (VFA), NH3, dan aflatoksin di rumen. Perlakuan yang diberikan adalah R0 = 60% hijauan dan 40% konsentrat, R1 = R0 + 5x108 (cfu g-1 ransum) probiotik bakteri asam laktat, R2 = R0 + 1x108 (cfu g-1 ransum) probiotik mikroba rumen, R3 = R0 + 5x108 (cfu g-1 ransum) probiotik bakteri asam laktat dan 1x108 (cfu g-1 ransum) probiotik mikroba rumen. Hasil penelitian menunjukkan bahwa pertumbuhan optimum isolat mikroba rumen 2 dan 4 terjadi pada jam ke-12 dan jam ke-18. Populasi probiotik mikroenkapsulasi bakteri asam laktat maupun mikroba rumen berdasarkan uji daya simpan masih memenuhi syarat untuk dijadikan probiotik yaitu 108-109 cfu mL-1. Penambahan mikroenkapsulasi probiotik anaerobik belum memberikan pengaruh nyata terhadap produksi VFA total, produksi gas amonia (NH3), dan kadar aflatoksin di rumen.
Kata kunci: aflatoksin, in vitro, mikroenkapsulasi, probiotik anaerobik
ABSTRACT
NAOMI GRYTA GHOSSANY. The Effect of Microencapsulated Anaerobic Probiotic on In vitro Fermentation and Rumen Aflatoxin Concentration. Supervised by SURYAHADI and SRI SUHARTI.
This research was aimed to evaluate the effect of microencapsulated anaerobic probiotic on in vitro fermentation and rumen aflatoxin concentration. This research used randomized block design (RBD) with four treatments and three blocks based on the time of rumen sampling. The variables observed were rumen microbial isolates growth curve, storability of microencapsulated anaerobic probiotic, Total Volatile Fatty Acid (VFA), NH3, and aflatoxin in rumen. The treatments were; R0 = ration (60:40) without any supplementation; R1 = R0 + 5x108 (cfu g-1 ration) lactic acid bacteria probiotic; R2 = R0 + 1x108 (cfu g-1 ration) rumen microbial probiotic; and R3 = R0 + 5x108 (cfu g-1 ration) lactic acid bacteria probiotic and 1x108 (cfu g-1 ration) rumen microbial probiotic. The result showed that optimum growth of rumen microbial are 12th hours and 18th hours. Population of microencapsulated probiotic anaerobic were 108-109 cfu ml-1. The use of microencapsulated anaerobic probiotic did not affect total volatile fatty acid, NH3, and aflatoxin concentration in rumen.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Peternakan
pada
Departemen Ilmu Nutrisi dan Teknologi Pakan
EFEK PENGGUNAAN MIKROENKAPSULASI PROBIOTIK
ANAEROBIK TERHADAP FERMENTABILITAS RANSUM
DAN KADAR AFLATOKSIN DI RUMEN
IN VITRO
NAOMI GRYTA GHOSSANY
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Efek Penggunaan Mikroenkapsulasi Probiotik Anaerobik Terhadap Fermentabilitas Ransum dan Kadar Aflatoksin di Rumen InVitro
Nama : Naomi Gryta Ghossany NIM : D24100008
Disetujui oleh
Dr Ir Suryahadi, DEA Pembimbing I
Dr Sri Suharti, SPt MSi Pembimbing II
Diketahui oleh
Prof Dr Ir Panca Dewi MHK, MSi Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala berkat dan limpahan kasih-Nya sehingga penulis dapat menyelesaikan penyusunan skripsi yang berjudul “Efek Penggunaan Mikroenkapsulasi Probiotik Anaerobik Terhadap Fermentabilitas Ransum dan Kadar aflatoksin di Rumen In Vitro “.
Penelitian ini bertujuan untuk mengevaluasi penggunaan mikroenkapsulasi probiotik anaerobik terhadap fermentabilitas ransum dan kadar aflatoksin di rumen in vitro. Skripsi ini merupakan salah satu syarat untuk kelulusan dan memperoleh gelar Sarjana Peternakan di Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pakan merupakan salah satu faktor yang dapat mempengaruhi produktivitas ternak. Penyediaan hijauan pakan ternak yang berkualitas baik, sulit didapatkan terutama pada musim kemarau dan adanya bahan pencemar seperti aflatoksin yang dapat mencemari bahan baku konsentrat seperti jagung, kedelai, dan hasil olahannya. Hewan ternak yang mengkonsumsi pakan tercemar aflatoksin akan meninggalkan residu aflatoksin dan metabolitnya pada produk ternak seperti daging, telur, dan susu. Hal tersebut menjadi salah satu sumber pencemaran aflatoksin pada manusia. Oleh karena itu dibutuhkan feed additive
yang dapat meningkatkan kinerja fungsi rumen, salah satunya yaitu probiotik untuk menghasilkan produk ternak yang maksimal. Probiotik Lactobacillus acidophilus dapat mengikat aflatoksin sehingga mengurangi penyerapannya di usus. Mikroba rumen dapat mendegradasi aflatoksin di rumen sehingga memungkinkan untuk dijadikan sebagai probiotik. Dalam prakteknya, penyimpanan probiotik masih menjadi kendala sehingga perlu adanya suatu teknik yang dapat diterapkan untuk meningkatkan efektivitas probiotik dalam meningkatkan daya simpan sehingga pemberian probiotik dalam ternak dapat mencapai target sasaran organ usus dan rumen yang dikenal dengan istilah mikroenkapsulasi. Adanya teknik mikroenkapsulasi dalam pembuatan probiotik anaerobik, perlu dilakukan pengujian terhadap fermentabilitas ransum dan kadar aflatoksin di rumen in vitro.
Penulis menyadari penulisan skripsi ini jauh dari kesempurnaan. Kritik dan saran yang membangun sangat penulis harapkan. Semoga karya ilmiah ini bermanfaat bagi pembaca secara umumnya.
Bogor, September 2014
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR LAMPIRAN xii PENDAHULUAN 1 MATERI DAN METODE 2 Lokasi dan Waktu Penelitian 2 Materi 2
Prosedur Penelitian 2 Mikroba dan Penyiapan Probiotik 2 Kurva Pertumbuhan Isolat Mikroba Rumen Sebagai Kandidat probiotik 3 Uji Daya Simpan Mikroenkapsulasi Probiotik Anaerobik 4 Efek Penambahan Mikroenkapsulasi Probiotik Anaerobik Pada Fermentabilitas Ransum dan Kadar Aflatoksin di Rumen 4 HASIL DAN PEMBAHASAN 5 Kurva Pertumbuhan Isolat Mikroba Rumen Sebagai Kandidat probiotik 5 Daya Simpan Mikroenkapsulasi Probiotik Anaerobik 7
Efek Penambahan Mikroenkapsulasi Probiotik Anaerobik pada Fermentabilitas Ransum dan Kadar Aflatoksin di Rumen Secara In Vitro 8 SIMPULAN DAN SARAN 10 Simpulan 10 Saran 10 DAFTAR PUSTAKA 10
LAMPIRAN 13
RIWAYAT HIDUP 14
DAFTAR TABEL
1 Efek mikroenkapsulasi terhadap populasi bakteri asam laktat dan isolat
Mikroba rumen 7
2 Populasi probiotik mikroenkapsulasi dengan umur simpan berbeda 7 3 Rataan konsentrasi NH3, VFA, dan aflatoksin B1 8
DAFTAR LAMPIRAN
1 Hasil perhitungan nilai absorban mikroba rumen isolat 2 dan isolat 4 13
2 Hasil analisis ragam NH3 13
3 Hasil analisis ragam VFA total 13
4 Hasil analisis ragam aflatoksin B1 13
PENDAHULUAN
Kebutuhan komoditas hasil ternak khususnya daging dan susu sapi dari tahun ke tahun terus meningkat seiring dengan meningkatnya populasi penduduk, tingkat pendapatan, dan kesadaran gizi. Di lain pihak ketersediaan daging dan susu yang berasal dari ternak lokal tidak dapat menutupi kebutuhan tersebut sehingga kebutuhan tersebut harus dipenuhi dari impor baik berupa produk ternak seperti daging beku dan susu skim maupun sapi hidup bakalan. Salah satu masalah dalam peningkatan produktivitas ternak adalah faktor pakan. Penyediaan pakan secara kontinyu baik kuantitatif maupun kualitatif masih menjadi masalah serius yang dihadapi oleh peternak ruminansia. Hal ini antara lain disebabkan penyediaan hijauan pakan ternak yang berkualitas baik, sulit didapatkan terutama pada musim kemarau dan adanya bahan pencemar seperti aflatoksin yang dapat mencemari bahan baku konsentrat seperti jagung, kedelai, dan hasil olahannya. Hewan ternak yang mengkonsumsi pakan tercemar aflatoksin akan meninggalkan residu aflatoksin dan metabolitnya pada produk ternak seperti daging, telur, dan susu. Hal tersebut menjadi salah satu sumber pencemaran aflatoksin pada manusia. Secara umum pakan ternak ruminansia di Indonesia mempunyai kualitas rendah, oleh karena itu dibutuhkan feed additive yang dapat meningkatkan kinerja fungsi rumen, salah satunya yaitu probiotik untuk menghasilkan produk ternak yang maksimal.
Fanworth (2001) menyatakan bahwa probiotik merupakan pakan aditif berupa mikroba hidup yang dapat meningkatkan keseimbangan dan fungsi pencernaan hewan inang, manipulasi mikroflora saluran pencernaan untuk tujuan peningkatan kondisi kesehatan serta meningkatkan produksi. Pemberian probiotik dapat menjaga keseimbangan komposisi mikroorganisme dalam sistem pencernaan ternak sehingga dapat meningkatkan daya cerna bahan pakan dan menjaga kesehatan ternak. Probiotik Lactobacillus acidophilus dapat mengikat aflatoksin sehingga mengurangi penyerapannya di usus (Simanjuntak 2005). Mikroba rumen dapat mendegradasi aflatoksin di rumen sehingga memungkinkan untuk dijadikan sebagai probiotik (Suryahadi et al. 2012). Dalam prakteknya, penyimpanan probiotik masih menjadi kendala sehingga perlu adanya suatu teknik yang dapat diterapkan untuk meningkatkan efektivitas probiotik dalam meningkatkan daya simpan sehingga pemberian probiotik pada ternak dapat mencapai target sasaran organ usus dan rumen. Salah satu teknik tersebut dikenal dengan istilah mikroenkapsulasi. Mikroenkapsulasi merupakan proses membungkus (coating) suatu bahan inti. Bakteri probiotik yang digunakan sebagai bahan inti dan diperangkap dengan bahan enkapsulasi tertentu seperti sodium alginat dan susu skim, yang memiliki manfaat untuk melindungi dan mempertahankan probiotik dari pengaruh kondisi lingkungan yang tidak menguntungkan (Wu et al. 2000).
2
MATERI DAN METODE
Lokasi dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Biokimia, Fisiologi, dan Mikrobiologi Nutrisi Fakultas Peternakan IPB, Laboratorium Analisis Pangan dan SEAFAST Center Fakultas Teknologi Pertanian IPB, Laboratorium Nutrisi Ternak Perah Fakultas Peternakan IPB, dan Laboratorium Kesehatan Daerah Jakarta Pusat pada bulan Juni sampai dengan bulan Desember 2013.
Materi
Bahan-bahan yang digunakan dalam penelitian ini adalah cairan rumen sapi dari Rumah Pemotongan Hewan (RPH) Bubulak, larutan McDougall, larutan standar aflatoksin B1. Brain Heart Infunsion (BHI), glukosa, cellebiosa, cystein-HCl, agar bacto, resazurin, hemin, alkohol 75%, MgSO4.7H2O, gliserol 80%, deMan-Rogosa-Sharpe Agar (MRSA), deMan-Rogosa-Sharpe Broth (MRSB), K2HPO4, NaCl, Na2HPO4.2H2O, aquadest, larutan NaCl 1%, larutan HCl 1%, larutan natrium sulfat, kalium natrium tartat, larutan NaOH, gas CO2., konsorsium bakteri asam laktat yang terdiri dari Lactobacillus acidophyllus, Bifidobacterium longum, dan Streptococcus thermophylus yang diperoleh dari Universitas Gadjah Mada, Yogyakarta, mikroba rumen hasil isolat yang telah mampu mendegradasi aflatoksin lebih dari 55% jam-1 dalam rumen (Sisriyeni 2013), dan bahan penyalut untuk enkapsulasi.
Alat-alat yang digunakan dalam penelitian ini yaitu tabung reaksi, tutup karet, isolasi panfix, spoit, penangas air, oven 105oC, pipet mikro, jarum ose, tissue, tabung Hungate, stirer, pipet, bulp, pH meter, inkubator, sentrifuge, kertas saring, gelas piala, pembakar Bunsen, timbangan digital, autoclave, spektrofotometer, cawan petri, labu Erlenmeyer, labu destilasi, lemari pendingin, kromatografi, tabung schoot, laminar, mikroskop, alat untuk pembuatan mikrokapsul yaitu freeze dryer, dan UPLC-MS/MS. UPLC yang digunakan pada penelitian ini menggunakan sistem acquity UPLC H class dan tiap kolom terdiri dari acquity UPLC BEH C18 (2.1 x 50 mm). Mobile phase pada UPLC yaitu A = Methanol (60) dan C = 10 mM Ammonium Acetat (40) dengan kecepatan sebesar 0.2 mL/min dan besarnya volume sebanyak 30 µL pada suhu 35oC selama 3 menit. Sementara itu, MS yang digunakan pada penelitian ini berupa triple quadropol (TQD) dengan menggunakan software massLynx V4.1.
Prosedur Penelitian
Mikroba dan Penyiapan Probiotik
drying pada suhu -90oC sampai dengan -130oC. Ada dua metode dalam freeze drying yang dibedakan menurut tahapan perlakuannya (Lapage et al. 1970), yaitu metode sentrifugasi dan metode prapembekuan. Pada metode sentrifugasi, suspensi mikroba disentrifuse untuk menghindari terjadinya gelembung-gelembung udara ketika berlangsung proses pengisapan sampai suspensi menjadi beku, yang kemudian terjadi proses sublimasi. Pada metode prapembekuan, suspensi mikroba dibekukan terlebih dahulu, lalu dilakukan proses pengisapan, kemudian proses sublimasi. Prinsip freeze drying yang digunakan yaitu probiotik dibekukan dan kandungan airnya dikeluarkan atau dikurangi dengan cara sublimasi, yaitu penguapan langsung dan bentuk es menjadi gas (uap). Dalam proses pembekuan ini, akan terbentuk kristal-kristal es yang mengakibatkan terjadinya peningkatan konsentrasi elektrolit dan proses ini akan memindahkan air dari protein dan DNA sehingga akan merusak sel-sel mikroba. Untuk menghindari kerusakan ini, maka suatu medium pelindung berupa pelarut (cryoprotective medium/suspending fluid) seperti CaCl2 sebanyak 5 % perlu ditambahkan sehingga hasil akhirnya terbentuk kapsul.
Sementara itu, mikroenkapsulasi probiotik mikroba rumen dilakukan dengan memodifikasi teknik enkapsulasi Krasaekoopt et al. (2003) dan dilakukan secara steril. Pada proses enkapsulasi probiotik mikroba rumen, terlebih dahulu dilakukan analisa terhadap pertumbuhan optimal mikroba rumen tersebut untuk dijadikan probiotik sehingga diperoleh pertumbuhan optimal isolat mikroba rumen 2 yaitu pada 12 jam dan isolat mikroba rumen 4 pada 18 jam. Sebanyak 2% sodium alginat, 2% Hi-maize, dan 250 mL kultur bakteri dilarutkan dalam 500 mL akuades. Larutan tersebut dicampurkan ke dalam 200 mL minyak kanola yang sebelumnya telah dicampur 0.2 mL lesitin. Larutan dihomogenkan dengan
magnetic stirrer selama 20 menit hingga teremulsi dan berbentuk seperti cream. Sebanyak 200 mL CaCl2 0.1 M ditambahkan secara perlahan melalui dinding gelas untuk memisahkan air dan minyak. Larutan didiamkan selama 30 menit hingga air dan minyak berpisah secara sempurna. Hasil mikroenkapsulasi akan mengendap pada bagian bawah gelas dan pemisahan dilakukan dengan menggunakan gelas separator. Sebanyak 0.9% larutan NaCl dan 5% gliserol dihomogenkan dengan hasil mikroenkapsulasi yang diperoleh. Selama proses enkapsulasi, dialirkan gas CO2 untuk mempertahankan kondisi anaerob kemudian disimpan pada freezer -4oC. Tahap terakhir dalam proses mikroenkapsulasi adalah
freeze drying.
4
Uji Daya Simpan Mikroenkapsulasi Probiotik Anaerobik
Tujuan percobaan ini adalah untuk menganalisis umur simpan dan daya tahan probiotik sehingga diperoleh probiotik majemuk yang memiliki daya simpan tinggi dan dapat mencapai organ pencernaan dimana probiotik dapat bekerja secara optimal. Probiotik yang terenkapsulasi disimpan selama 0, 2, dan 4 minggu lalu ditentukan daya viabilitasnya dengan dihitung jumlah koloni dari masing-masing probiotik. Perhitungan populasi bakteri total pada isolat mikroba rumen mengikuti petunjuk Ogimoto dan Imai (1981).
Efek Penambahan Mikroenkapsulasi Probiotik Anaerobik pada
Fermentabilitas Ransum dan Kadar Aflatoksin di Rumen Secara In Vitro
Penelitian ini bertujuan untuk mengevaluasi efek kombinasi sinergis dari berbagai probiotik mikroenkapsulasi terhadap fermentabilitas ransum dan kadar aflatoksin di rumen. Penelitian ini menggunakan rancangan acak kelompok (RAK) dengan 4 perlakuan dan 3 ulangan. Perlakuan yang diberikan antara lain
Data yang diperoleh dari hasil perhitungan dianalisa secara statistik dengan menggunakan analisis ragam. Jika terjadi pengaruh yang berbeda nyata antar perlakuan maka dilakukan uji duncan. Peubah yang diamati antara lain NH3, VFA, dan kadar aflatoksin di rumen.
Teknik in vitro (Tilley dan Terry 1963) dilaksanakan dengan mempersiapkan tabung fermentor yang telah diisi dengan pakan berupa 0.5 g campuran hijauan dan konsentrat dengan perbandingan 60% hijauan dan 40% konsentrat. Tabung fermentor ditempatkan dalam shaker water bath dengan suhu 39oC. Kedalam masing masing tabung ditambahkan 40 mL larutan McDougall dengan pH 7, 10 mL cairan rumen, dan 3.75 mL aflatoksin dengan konsentrasi akhir 1.5 ppb. Setiap perlakuan dialiri dengan gas CO2 selama 30 detik agar tetap dalam kondisi anaerob kemudian tabung ditutup dengan penutup karet.
Pengukuran Konsentrasi NH3 (General Laboratory Procedure 1969)
Pengukuran NH3 dengan cara supernatan dan Na2CO3 (terpisah) dimasukkan ke bagian tepi dalam cawan Conway dan bagian tengah lingkaran cawan Conway diisi asam borat. Cawan Conway ditutup rapat dan diinkubasi selama 24 jam. Setelah itu, bagian tengah lingkaran cawan Conway dititrasi dengan 0.0103 N H2SO4 sampai warna kembali ke warna asal asam borat. Perhitungan kadar NH3 dengan menggunakan rumus:
Pengukuran Konsentrasi VFA Total (General Laboratory Procedure 1969)
Analisis VFA dengan cara mendestilasi supernatan hasil fermentasi, kemudian terjadi kondensasi dan ditampung ke dalam gelas Erlenmeyer yang berisi 5 mL 0.5 N NaOH sampai menjadi 300 mL. 2-3 tetes indikator fenolftalin ditambahkan dan dilanjutkan titrasi menggunakan larutan 0.5 N HCl sampai terjadi perubahan warna dari merah jambu menjadi tidak berwarna. Perhitungan konsentrasi VFA total berdasarkan rumus:
Pengukuran dilakukan menggunakan metode (AOAC 2000). Sampel cairan rumen dipipet sebanyak 0.5 mL kemudian dilakukan pembuatan kurva standar aflatoksin B1 yaitu : 0.1 ppb, 0.5 ppb, 1 ppb, 5 ppb, dan 10 ppb. Sampel atau blanko dimasukkan ke dalam seppak C18 yang telah dikondisikan dengan menggunakan 3 ml metanol, 3 mL akuabidest. Seppak dicuci dengan 2 mL akuabidest, dan dielusi dengan 3 mL metanol:acetonitril (1:1), seppak dikeringkan dengan menggunakan turbovab evaporator pada suhu 40oC selama 60 menit. Seppak dilarutkan kembali dengan fase gerak 200 μl (metanol:10 mM ammonium asetat (60:40) dan 30 μl di injeksi ke UPLC-MS/MS.
HASIL DAN PEMBAHASAN
Kurva Pertumbuhan Isolat Mikroba Rumen Sebagai Kandidat Probiotik
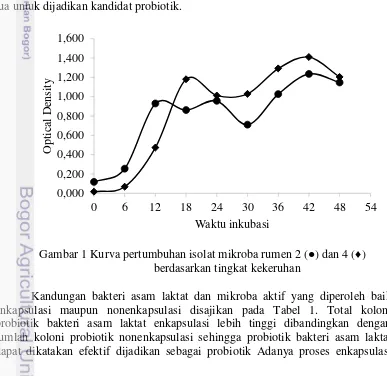
Pertumbuhan optimum isolat mikroba rumen 2 terjadi pada jam ke-12 dan pertumbuhan optimum isolat mikroba rumen 4 terjadi pada jam ke-18 (Gambar 1). Pada waktu tersebut, pertumbuhan isolat mikroba rumen berada pada fase logaritmik. Kecepatan pertumbuhan bakteri pada fase tersebut dipengaruhi oleh media tumbuh isolat dan kondisi lingkungan, seperti: pH, kandungan nutrien, suhu, dan kelembaban udara (Nurwantoro dan Djariah 1994).
6
keadaan bakteri dalam kultur pada waktu tertentu. Fase lag terjadi peningkatan ukuran sel namun belum terlalu banyak membelah diri. Sel mulai memperbanyak diri secara lambat setelah menyesuaikan diri dalam medium baru. Fase eksponensial terjadi pertumbuhan seimbang. Fase stasioner terjadi pengurangan pembelahan bakteri karena penumpukan limbah metabolisme, racun, kekurangan nutrien, dan perubahan kondisi pada lingkungan. Jumlah pertumbuhan sel hidup masih lebih banyak dibandingkan sel mati. Fase kematian ditandai dengan jumlah sel mati lebih banyak daripada sel hidup karena nutrien semakin menurun, energi cadangan di dalam sel habis, dan terkumpulnya produk limbah (Waluyo 2004).
Penentuan titik optimum pada kurva pertumbuhan isolat mikroba rumen dilihat berdasarkan tingkat kekeruhan. Peningkatan kekeruhan pada tiap interval waktu 6 jam digunakan sebagai indikator terjadinya peningkatan massa sel. Titik maksimum mikroba rumen tumbuh sebelum mengalami penurunan yaitu pada jam ke-12 hingga jam ke-24 untuk mikroba rumen isolat 2 sedangkan untuk mikroba rumen isolat 4 terjadi penurunan pada jam ke 24 hingga jam ke-30. Pada kondisi tersebut, mikroba rumen berada pada fase stasioner. Penurunan laju pertumbuhan pada fase tersebut dapat diakibatkan oleh adanya akumulasi substansi toksik hasil metabolisme ataupun dapat terjadi karena kekurangan nutrien sehingga jumlah sel hidup sama dengan jumlah sel mati. Penentuan titik optimum pada jam ke-12 untuk isolat mikroba rumen 2 dan jam ke-18 untuk isolat mikroba rumen 4 dikatakan valid karena penentuan titik optimum setelah mikroba rumen mengalami penurunan dapat dikatakan bahwa isolat mikroba rumen sudah terlalu tua untuk dijadikan kandidat probiotik.
Gambar 1 Kurva pertumbuhan isolat mikroba rumen 2 (●) dan 4 (♦) berdasarkan tingkat kekeruhan
Kandungan bakteri asam laktat dan mikroba aktif yang diperoleh baik enkapsulasi maupun nonenkapsulasi disajikan pada Tabel 1. Total koloni probiotik bakteri asam laktat enkapsulasi lebih tinggi dibandingkan dengan jumlah koloni probiotik nonenkapsulasi sehingga probiotik bakteri asam laktat dapat dikatakan efektif dijadikan sebagai probiotik Adanya proses enkapsulasi
meningkatkan kelangsungan hidup dari kultur dan membantu melindungi sel bakteri dari lingkungan yang merugikan sehingga mampu mengurangi sel bakteri yang mati (Solta 2013). Sementara itu, jumlah koloni probiotik isolat mikroba rumen 2 tidak berbeda pada keduanya namun, total koloni tersebut lebih rendah dibandingkan total koloni probiotik isolat mikroba rumen 4. Hal itu dapat diakibatkan oleh umur maupun masa simpan bakteri tersebut. Semakin tua usia bakteri tersebut maka, akan mempengaruhi pertumbuhannya. Lebih lanjut, total koloni bakteri nonenkapsulasi pada probiotik isolat mikroba rumen 4 lebih tinggi dibandingkan dengan jumlah koloni probiotik enkapsulasi. Hal ini disebabkan karena adanya proses pencampuran dan pengadukan yang dapat menyebabkan masuknya gas O2 ke dalam campuran tersebut. Pengaruh keberadaan oksigen terhadap organisme anaerob dapat menyebabkan peningkatan potensial reduksi oksidasi sehingga dapat mengganggu proses transfer elektron pada respirasi anaerob (Jay 1996). Meskipun demikian jumlah populasi akhir dari bakteri probiotik isolat mikroba rumen 4 masih memenuhi syarat yang dibutuhkan yaitu jumlah populasi bakteri probiotik pada produk yaitu sebesar 107 cfu g-1.
Tabel 1 Efek Mikroenkapsulasi Terhadap Populasi Bakteri Asam Laktat dan Isolat Mikroba Rumen
Pemanfaatan probiotik mikroenkapsulasi bertujuan untuk mengurangi kehilangan dan kerusakan sel bakteri, menstabilkan sel, dan menjaga viabilitas serta stabilitas sel tetap tinggi selama proses produksi (Tamime 2005). Enkapsulasi menekankan pada aspek peningkatan viabilitas sel dalam produk dan saluran pencernaan serta untuk meningkatkan sifat sensori produk (Mortazavian et al. 2007). Mikroenkapsulasi pada probiotik bakteri asam laktat dan kedua isolat mikroba rumen lainnya memberikan pengaruh terhadap total bakteri probiotik yang hidup.
Daya Simpan Mikroenkapsulasi Probiotik Anaerobik
Viabilitas yang dihasilkan selama periode penyimpanan 0, 2, dan 4 minggu cenderung mengalami penurunan baik pada probiotik bakteri asam laktat maupun probiotik mikroba rumen (Tabel 2).
Tabel 2 Populasi Probiotik Mikroenkapsulasi Dengan Umur Simpan berbeda Probiotik Total Koloni Minggu Ke- (cfu g
-1 )
0 2 4
8
Adanya penurunan total koloni bakteri dapat disebabkan oleh aktivitas bakteri selama proses penyimpanan. Penurunan total koloni mikroenkapsulasi probiotik bakteri asam laktat pada minggu kedua sebesar 93.6% sedangkan pada minggu keempat sebesar 31.25%. Sama halnya dengan mikroenkapsulasi probiotik bakteri asam laktat, penurunan total koloni mikroenkapsulasi probiotik mikroba rumen pada minggu kedua sebesar 4.28% sedangkan pada minggu keempat sebesar 43.02%. Mikroenkapsulasi probiotik telah banyak dilakukan untuk meningkatkan ketahanan atau viabilitas sel probiotik selama proses pembuatan produk dan penyimpanan (Capela et al. 2006; Krasaekoopt et al. 2006) serta meningkatkan ketahanan selama dalam jalur pencernaan (pH rendah dan cairan empedu) (Sultana et al. 2000). Mikroenkapsulasi beberapa kultur bakteri termasuk probiotik dilakukan untuk memperpanjang umur simpan dan mengubah menjadi bentuk serbuk agar lebih mudah dalam penggunaan (Krasaekoopt et al. 2003). Periode penyimpanan yang lama akan menghasilkan total koloni bakteri asam laktat dan mikroba rumen yang rendah karena kandungan nutrisi produk selama penyimpanan semakin berkurang. Berkurangnya kandungan nutrisi produk disebabkan oleh proses fermentasi terus berlangsung. Kematian bakteri disebabkan karena nutrien di dalam medium dan energi cadangan sel telah habis (Fardiaz 1998). Namun demikian, sampai minggu keempat, populasi kedua probiotik tersebut tetap tinggi yaitu diatas 108. Menurut Schrezeinmeir dan Vrese (2001), ada beberapa kriteria yang perlu dipertimbangkan untuk mendapatkan produk probiotik dengan pengaruh positif optimal bagi inangnya, diantaranya adalah : (a) spesies bakteri probiotik sebaiknya tidak bersifat patogen, (b) toleran terhadap asam dan garam empedu, (c) memiliki kemampuan menempel dan mengkolonisasi usus, (d) memiliki kemampuan untuk bertahan selama proses pengolahan dan selama waktu penyimpanan, (e) memiliki karakteristik sensor yang baik, (f) memiliki sifat antagonistik terhadap mikroba patogen enterik, (g) terbukti memiliki pengaruh menguntungkan bagi kesehatan inang, (h) produk probiotik diharapkan memiliki jumlah sel hidup yang besar (107-109 cfu ml-1).
Efek Penambahan Mikroenkapsulasi Probiotik Anaerobik pada
Fermentabilitas Ransum dan Kadar Aflatoksin di Rumen Secara In Vitro
Hasil analisis statistik menunjukkan bahwa perlakuan yang digunakan belum memberikan pengaruh nyata terhadap VFA total, NH3, dan kadar aflatoksin di rumen. Pencernaan fermentatif dapat mencerminkan perubahan senyawa-senyawa tertentu menjadi senyawa-senyawa lain yang sama sekali berbeda dengan molekul zat makanan asalnya (Tabel 3).
Tabel 3 Rataan Konsentrasi NH3, VFA, dan Aflatoksin B1
Peubah Perlakuan
R0 R1 R2 R3
NH3 (mM) 8.17±5.72 9.70±5.93 9.71±3.20 13.37±9.78 VFA (mM) 148.93±30.11 175.33±24.02 113.71±28.92 136.72±49.42 Aflatoksin (ppb) 0.004±0.002 0.005±0.004 0.006±0.008 0.001±0.001
Nilai rataan konsentrasi NH3 dari semua perlakuan berkisar 8.17-13.37 mM. Menurut McDonald et al. (2002), Produksi amonia dipengaruhi oleh waktu setelah makan dan umumnya produksi maksimum dicapai pada 2-4 jam setelah pemberian pakan yang bergantung kepada sumber protein yang digunakan dan mudah tidaknya protein tersebut didegradasi. Kadar amonia di dalam rumen merupakan petunjuk antara proses degradasi dan proses sintesis protein oleh mikroba rumen. Jika pakan defisien protein atau proteinnya tahan degradasi, maka konsentrasi amonia di dalam rumen akan rendah dan pertumbuhan mikroba rumen akan lambat yang menyebabkan turunnya kecernaan pakan. Jika laju degradasi protein dalam rumen lebih cepat dari laju sintesa protein, amonia akan terakumulasi dalam cairan rumen dan bukan tidak mungkin konsentrasi optimum dapat terlewati. Setelah konsentrasi optimum tercapai, amonia akan diserap ke dalam darah kemudian dibawa ke hati dan diubah menjadi urea. Sebagian urea dapat kembali ke rumen melalui saliva atau langsung melewati dinding rumen, tetapi sebagian besar diekskresikan sehingga terbuang bersama. Kisaran optimum NH3 dalam rumen berkisar antara 85–300 mg l-1 atau 6-21 mM (McDonald et al. 2002).
Nilai rataan VFA total dari semua perlakuan berkisar 113.71-175.33 mM. McDonald et al. (2002) menjelaskan konsentrasi VFA sangat dipengaruhi oleh jenis pakan, VFA yang tinggi menunjukkan peningkatan kandungan protein dan karbohidrat mudah larut dari pakan. Produksi VFA di dalam cairan rumen dapat digunakan sebagai tolak ukur fermentabilitas pakan (Bachruddin 1996). Peningkatan jumlah VFA menunjukkan mudahnya pakan tersebut difermentasi oleh mikroba rumen. McDonald et al. (2002) menyatakan bahwa produksi VFA yang dihasilkan dalam rumen bergantung pada ransum yang dikonsumsi yaitu antara 200-1500 mg 100-1 ml cairan rumen. Ransum yang berbahan dasar hijauan akan menyebabkan perbandingan asetat dan propionat lebih besar daripada ransum berbahan dasar konsentrat. Sutardi (1979) menjelaskan bahwa kisaran produk VFA untuk pertumbuhan bakteri yang optimal dibutuhkan 80 mM sampai 160 mM.
Rataan kadar aflatoksin dari semua perlakuan adalah 0.001-0.006 ppb.
10
pada lingkungannya dengan hasil akhir berupa energi dan asam-asam lemah seperti asam laktat, asam asetat, dan CO2. Keberadaan asam laktat sebagai produk metabolisme dapat bersifat sebagai salah satu faktor penghambat bagi pertumbuhan A.flavus. Jumlah asam laktat yang berpengaruh terhadap pertumbuhan jamur berkisar antara 0.75% - 1,5%. kecepatan pembentukan Aflatoksin menjadi berkurang akibat cekaman pada substrat pertumbuhannya akibat akumulasi produk metabolit dari bakteri asam laktat (Chiou et al. 2002). Bakteri asam laktat kemungkinan mempunyai kemampuan untuk menurunkan kadar Aflatoksin yang terbentuk dengan suatu mekanisme enzimatik tertentu, walaupun untuk membuktikan hal ini perlu dilakukan penelitian lebih lanjut. Proses pengikatan aflatoksin oleh bakteri belum diketahui pasti. Secara in vitro
molekul aflatoksin diperkirakan akan terikat pada permukaan komponen sel bakteri dan menurunkan perlekatan bakteri pada sel epitel usus (Kankaanpaa et al. 2000).
SIMPULAN DAN SARAN
Simpulan
Pertumbuhan optimum isolat mikroba rumen 2 terjadi pada jam ke-12 sedangkan pertumbuhan optimum isolat mikroba rumen 4 terjadi pada jam ke-18 dimana pada waktu tersebut, pertumbuhan isolat mikroba rumen berada pada fase logaritmik dan mikroba rumen siap dipanen untuk dijadikan kandidat probiotik, populasi mikroenkapsulasi probiotik anaerobik pada umur simpan 0, 2, dan 4 minggu mengalami penurunan baik pada probiotik bakteri asam laktat maupun probiotik mikroba rumen. Kendati demikian, populasi kedua probiotik tetap tinggi yaitu diatas 107-108 cfu ml-1, dan penambahan mikroenkapsulasi probiotik anaerobik belum terdeteksi pengaruhnya terhadap produksi gas ammonia, total asam lemak terbang, dan kadar aflatoksin di rumen secara in vitro.
Saran
Perlu dilakukan penelitian lebih lanjut mengenai probiotik anaerobik mikroenkapsulasi tanpa menggunakan proses freeze drying, penambahan konsentrasi probiotik yang berbeda pada ransum, dan konsentrasi aflatoksin ditingkatkan.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemists. 2000. Aflatoxins M1 and M2 in fluid milk. Liquid Chromatographic Method. 49.3.06. Natural Toxins. AOAC Official Method 982.16. 26th E. Chapter 49. p. 40.
Evaluasi Pakan Ruminansia]. Fakultas Peternakan. Universitas Gadjah Mada. Yogyakarta (ID).
Capela P. 2006. Use of cryoprotein, prebiotics and microencapsulation of bacterial cells in improving the viability of probiotic organisms in freezedried yoghurt [thesis]. Australia (AU): School of Molecular Sciences, Victoria University.
Carvalho AS, Silva J, Ho P, Teixeira P, Malcata FX, Gibbs P. 2004. Relevant factors for the preparation of freeze-dried lactic acid bacteria. Int. Dairy J.
14:835–847.
Chiou CH, Miller M, Wilson DL, Trail F, Linz JE. 2002. Chromosomal Location Plays a role in regultion of aflatoxin gene expression in Aspergillus parasiticus. App. Enviroment. Microbiol (abstrak) Vol 68 (1): 306 -315. Cho SS, Finocchiaro ET. 2010. Handbook of probiotics and probiotics
ingredients: health benefits and food applications. New York (US): CRC Pr.
Fanworth ER. 2001. Probiotics and prebiotics. Di dalam: Wildman, REC (ed.). Nutraceutical and Functional Foods. New York (US): CRC Pr.
Fardiaz S. 1998. Fisiologi fermentasi. Pusat Antar Universitas Pangan dan Gizi IPB, Bogor (ID).
Gagnon M, Kheadr EE, Le Blay G, Flis I. 2004. In vitro inhibition of Escherichia coli 0157:H7 by Bifidobacterial strains of human origin. Int J Food Microbiol. 92 (1):69-78.
General Laboratory Procedures. 1969. Department of Dairy Science. University of Wisconsin, Madison (US).
Jay JM. 1996. Modern food microbiology. 4th Edition. Van Nostrand Company, New York (US).
Kankaanpaa P, Tuomola E, El-Nezami H, Ahokas J, Salminen SJ. 2000. Binding of aflatoxin B1 alters the adhesion properties of Lactobacillus rhamnosus strain GG in a caco-2 model. J Food Prot. 63 (3):412-414.
Krasaekoopt W, B Bhandari, H Deeth. 2003. Review: evaluation of encapsulation techniques of probiotics for yoghurt. Int. Dairy J. 13: 3–13.
Lapage SP, Shelton JE, Mitchell TG, Marckenzic A. 1970. Method in microbiology. Acad Press, London (GB). 3A, pp. 1-2, 170-194.
McDonald P, Edward, RA, Greenhalgh JFD. 2002. Animal nutrion. New York (US). Longman Scientific & Technical.
Mehan VK, Mc Donald D, Haravu LJ, Jayanthi S. 1991. The groundnut aflatoxin problem review and literature database. Int. crops research Institute for the semi arid tropics, India (IN). p. 9,17- 19,58 -63.
Mortazavian A, Razavi SH, Ehsani MR, Sohrabvandi. 2007. Principle and methods of microencapsulation of probiotic microorganisms. Iran (IR). J Bioethanol. 5 (1): 1-18.
Nurwantoro, Djariah AS. 1994. Mikrobiologi pangan hewan-nabati. Yogyakarta (ID). Penerbit Kanisius.
Ogimoto K, Imai S. 1981. Atlas of rumen microbiology. Japan Scientific Societies Press, Tokyo (JP), 231 p.
12
Simanjuntak R. 2005. Decontaminasi aflatoxin B1 melalui pengikatan oleh bakteri asam laktat [Thesis]. Yogyakarta (ID):Universitas Gajah Mada. Sisriyeni D. 2013. Isolasi bakteri yang mampu mendegradasi aflatoksin di rumen
[Thesis]. Bogor (ID): Institut Pertanian Bogor.
Solta R. 2013. Efektivitas penggunaan probiotik terhadap produksi dan kualitas serta kadar aflatoksin M1 pada susu sapi perah [Thesis]. Bogor (ID): Institut Pertanian Bogor.
Sultana K, Godward G, Reynolds N, Arumugaswamy R, Peiris P, Kailasapathy K. 2000. Encapsulation of probiotic bacteria with alginat–starch and evaluation of survival in simulated gastrointestinal conditions and in yoghurt. Int J Food Microbiol. 62: 47–55.
Suryahadi, Wiryawan KG, Evvyernie D, Pantaya D, Sisriyeni D. 2012. Penggunaan probiotik sebagai agen detoksifikasi mikotoksin pada ruminansia. Makalah Seminar Hasil-Hasil Penelitian Institut Pertanian Bogor. LPPM IPB Bogor.
Sutardi T. 1979. Ketahanan protein bahan makanan terhadap degradasi oleh mikroba rumen dan manfaatnya bagi produktivitas ternak. Prosiding Seminar dan Penunjang Peternakan [waktu dan tempat tidak diketahui]. Bogor (ID): Lembaga Penelitian Peternakan.
Tamime AY, Saarela M, Sondergaard AK, Mistry VV, Shah NP. 2005. Production and maintenance of viability of probiotic microorganism in dairy products. Di dalam: Tamime AY, editor. Probiotic Dairy Products. Oxford (OXF): Blackwell Publishing Ltd.hlm 39-63.
Tilley JMA, RA Terry. 1963. A two stage technique for the in vitro digestion of forage crops. J The British Grassland Soc. 18:154-111.
Toure R, Kheadr E, Lacroix C, Moroni O, Fliss I. 2013. Production of antibacterial substances by Bifidobacterial isolates from infant stool active
against Listeria monocytogenes. J Applied Microbiol. 95:1058-1069. Waluyo,Lud. 2004. Mikrobiologi Umum. Malang (ID). Universitas
Muhammadiyah Press.
LAMPIRAN
Lampiran 1 Hasil perhitungan nilai absorban isolat mikroba rumen 2 dan 4 Perlakuan
(Jam ke-)
Nilai Absorban
Isolat mikroba rumen 2 Isolat mikroba rumen 4
0 0.118 0.016
6 0.254 0.068
12 0.929 0.473
18 0.861 1.180
24 0.956 1.011
30 0.709 1.028
36 1.026 1.291
42 1.235 1.410
48 1.146 1.203
Lampiran 2 Hasil analisis ragam NH3
SK JK db KT Fhit Sig
Perlakuan 43.906 3 14.635 0.265 0.848
Kelompok 16.291 2 8.146 0.148 0.866
Galat 331.222 6 55.204
1649.689 12
SK: sumber keragaman, JK: jumlah kuadrat, db: derajat bebas, KT: kuadrat tengah, Fhit: nilai F, Sig: signifikansi.
Lampiran 3 Hasil analisis ragam VFA total
SK JK db KT Fhit Sig
Perlakuan 5931.153 3 1977.051 4.353 0.060
Kelompok 6800.847 2 3400.423 7.487 0.023
Galat 2725.227 6 454.204
Total 263138.560 12
SK: sumber keragaman, JK: jumlah kuadrat, db: derajat bebas, KT: kuadrat tengah, Fhit: nilai F, Sig: signifikansi.
Lampiran 4 Hasil analisis ragam aflatoksin B1
SK JK db KT Fhit Sig
Perlakuan 3.956 3 1.319 0.661 0.605
Kelompok 4.988 2 2.494 1.251 0.352
Galat .000 6 1.994
Total .000 12
14
RIWAYAT HIDUP
Penulis dilahirkan di Pamekasan, Madura pada tanggal 10 Oktober 1991. Penulis merupakan anak pertama dari tiga bersaudara dari pasangan Bapak Achmad Musleh dan Ibu Nurul Laila. Penulis menempuh pendidikan dasar di SDN Barurambat Kota 2 Pamekasan pada tahun 1998-2004. Pendidikan dilanjutkan di SMPN 1 Pamekasan pada tahun 2004-2007 kemudian melanjutkan pendidikan di SMAN 1 Pamekasan pada tahun 2007-2010.
Penulis diterima sebagai mahasiswa di Institut Pertanian Bogor pada tahun 2010 melalui jalur Undangan Seleksi Mahasiswa IPB (USMI). Selama kuliah, penulis pernah menjadi manajer periklanan, marketing, dan media partner UKM Koran Kampus IPB pada tahun 2012, sekretaris biro public relation Badan Eksekutif Mahasiswa Fakultas Peternakan IPB periode 2011/2012, staf kementerian pengembangan sumberdaya manusia Badan Eksekutif Mahasiswa Keluarga Mahasiswa IPB. Penulis pernah mengikuti kegiatan Magang HIMASITER di KPBS Pangalengan Bandung pada tahun 2012. Penulis pernah menjadi salah satu finalis reporter Seputar Indonesia RCTI pada tahun 2012.
UCAPAN TERIMA KASIH
Terima kasih penulis ucapkan kepada Dr.Ir.Suryahadi, DEA dan Dr.Sri Suharti, S.Pt M.Si selaku pembimbing skripsi atas segala bimbingan, kesabaran, dukungan, sumbangan ide, dan materi yang telah diberikan.