BIOLOGI
Opius
sp. (HYMENOPTERA: BRACONIDAE)
PARASITOID LALAT PENGOROK
DAUN KENTANG
Oleh :
RUSLI R.
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRAK
RUSLI
R.
Biologi Opius sp. (Hymenoptera: Braconidae) Lalat Pengorok DaunKentang. Dibimbing oleh AUNU RAUF sebagai ketua, NINA MARYANA sebagai
anggota.
Penelitian dilaksanakan di insektari Jurusan Hama dan Penyakit Tumbuhan,
IPB dan berlangsung sejak Oktober 2001 hingga Juni 2002. Tujuan penelitian adalah untuk memahami biologi parasitoid Opius sp. yang meliputi masa perkembangan, keperidian, masa hidup, nisbah kelamin, dan preferensi terhadap instar inang.
Penelitian menggunakan tanaman kacang merah (Vigna sinensis) sebagai tanaman inang, larva instar -3 untuk percobaan penelitian, dan percobaan preferensi menggunakan larva instar -1, -2 dan -3 sebagai perlakuan. Percobaan menggunakan rancangan acak lengkap (RAL). Data dianalisis dengan sidik ragam dan dilanjutkan dengan uji DNMRT pada taraf nyata 5%, sebagian data dianalisis dengan menggunakan uji -t.
Hasil penelitian menunjukan bahwa rata-rata masa perkembangan parasitoid dari telur sampai muncul imago adalah 13,59 hari. Jurnlah rataan telur yang diletakkan oleh imago betina adalah 109,20 butir, dengan nisbah kelamin 73,47% betina. Rataan masa hidup imago betina adalah 10,08 hari dan jantan adalah 13.90 hari. Pada uji pilihan bebas terhadap instar larva inang, Opius sp. lebih banyak meletakkan telur pada larva instar -3, dan berbeda nyata dengan larva instar -2 dan instar-1. Pada uji tanpa pilihan, semua instar dapat dipilih sebagai inang yang
ditunjukkan oleh kemunculan imago parasitoid dari setiap larva inang. Masa perkernbangan Opius sp. lebih pendek pada inang instar -3 dan -2 dibandingkan pada instar -1. Jurnlah keturunan yang dihasilkan lebih banyak pada inang instar -3.
SURAT PERNYATAAN
Saya yang menyatakan dengan sebenar-benarnya bahwa segala pernyataan
dalan tesis saya yang berjudul:
"
BiologiOpius
sp. (Hymenoptera: Braconidae) Parasitoid Lalat PengorokDaun Kentang "
merupakan gagasan atau hasil penelitian tesis saya sendiri, dengan bimbingan Komisi
Pembimbing, kecuali yang dengan jelas ditunjukkan rujukannya. Tesis ini belum
pernah digunakan untuk memperoleh gelar pada program sejenis di perguruan tinggi
lain.
Semua data dan informasi yang digunakan telah dinyatakan secara jelas dan
dapat diperiksa kebenarannya.
Bogor, Oktober 2002
BIOLOGI Opius
sp. (HYMENOPTERA: BRACONIDAE)
PARASITOID LALAT PENGOROK
DAUN KENTANG
RUSLI R.
Tesis
sebagai saiah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Entomologi/Fitopatologi
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Biologi Opius sp. (Hymenoptera: Braconidae) Parasitoid Lalat Pengorok Daun Kentang
Nama : Rusli R.
NRP : 085 00001
Program Studi : : Entomologi I Fitopatologi
Menyetujui:
1. Komisi Pembimbing
Prof. Dr. Ir. Aunu Rauf, M.Sc. Ketua
Dr. Ir. Nina Maryana, M.S. Anggota
Mengetahui,
2. Ketua Program Studi Program Pascasarjana
Entomologi 1 Fitopatologi
RIWAYAT
HIDUP
Penulis dilahirkan pada tanggal 1 1 Nopember 1969 di Batusangkar, Sumatera Barat, sebagai anak ke enam dari sembilan bersaudara dari Ibu Rosna Zein (almarhumah) dan Bapak Rustam Ruskam (almarhum). Penulis menyelesaikan pendidkan SD tahun 1983 di SD Negeri 3 Batusangkar, SMP tahun 1986 di MTsN Batusangkar dan SMU tahun 1989 di SMU Negeri I Batusangkar, Sumatera Barat.
Pada tahun 1993 penulis mendapat gelar Sarjana Pertanian pada Fakultas Pertanian, Universitas Andalas, Padang. Tahun 1994
-
1995 penulis bekerja sebagai Asisten Afdeling pada PT. Perkebunan Agrowiratama di Pasaman, Sumatera Barat. Kemudian tahun 1996 - 1997 penulis bekerja sebagai karyawan pada P.T. BankDanamond Indonesia, Jakarta. Sejak tahun 1998 sampai sekarang penulis bekerja sebagai staf pengajar pada Fakultas Pertanian, Universitas Riau, Pekanbaru. Tahun
2000 penulis terdaftar sebagai mahasiswa Program Pascasarjana (S2) pada Program Pascasarjana Institut Pertanian Bogor dengan beasiswa dari Direktorat Jendral Pendididkan Tinggi.
PRAKATA
Puji syukur penulis panjatkan ke hadirat Allah SWT karena berkat rahmat dan kurnia-Nya penulis dapat menyelesaikan tesis dengan judul Biologi Opius sp. (Hymenoptera: Bracouidae) Parasitoid Lalat Pengorok D a m Kentang.
Pada kesempatan ini penulis menyampaikan penghargaan dan terima kasih yang setulus-tulusnya kepada Bapak Prof. Dr. Ir. Aunu Rauf, M.Sc. atas kesediaan beliau menjadi Ketua Komisi Pembiinbing, Ibu Dr. Ir. Nina Maryana, M.S. sebagai anggota komisi pembimbing, yang telah banyak memberikan arahan, masukan, bimbingan, dan dorongan dalam pelaksanaan penelitian hingga selesainya penulisan tesis ini. Ucapan terima kasih juga penulis sampaikan kepada Dekan Fakultas Pertanian dan Ketua Jurusan Agronomi, Universitas Riau atas ijin dan kesempatan yang diberikan kepada penulis untuk mengikuti pendidikan Program Master (S2) di IPB, sehingga proses penyelesaian studi berjalan dengan lancar. Pada kesempatan ini pula penulis mengucapkan terima kasih kepada Direktur Program Pascasarjana IPB dan Ketua Program Studi Entomologi/Fitopatologi yang telah mengijinkan penulis
untuk mengikuti pendidikan pada Program Pascasarjaan IPB. Terima kasih
disampaikan pula kepada teknisi laboratorium Ekologi dan Pengelolaan Hama, laboratorium Taksonomi Serangga (pak Wawan, dik Wendy dan bu Ai'syah ), serta teman-teman di Jurusan HPT, IPB atas bantuan dan partisipasinya dalarn kegiatan penelitian hingga penyelesaian tulisan tesis ini. Akhirnya penulis mengucapkan terima kasih pada almarhum Ibuk dan Papa yang ananda muliakan, semoga arwah beliau mendapat tempat yang baik disisi-Nya, serta rasa terima kasihku kepada kakak dan adik, khususnya istri tercinta Jum'atri Yusri dan anailda Nabillah Addini Rusli atas segala dorongan dan kesabarannya selarna ditinggal dalam masa pendidikan.
Tentunya dalam penulisan tesis ini terdapat kekurangan dan kelemahan, untuk itu kritik dan saran untuk perbaikan kegiatan selanjutnya sangat penulis harapakan. Mudah-mudahan tulisan ini dapat memberikan manfaat dan semoga Allah SWT senantiasa memberikan rahmat, taufik, hidayah dan inayah Nya kepada kita semua. Amin.
Bogor, Oktober 2002
DAFTAR IS1
Halaman
DAFTAR TABEL
...
V l l l...
DAFTAR GAMBAR
...
DAFTAR LAMPIRAN
...
PENDAHULUAN
...
Latar Belakang. .
...
Tujuan Penelltian. .
...
Kegunaan Penelltian...
TINJAUAN PUSTAKA
...
Biologi Liriomyza huidobrensis...
Gejala Serangan Liriomyza
...
Biologi Parasitoid Braconidae
...
Pemilihan Inang oleh Parasitoid...
...
Reproduksi dan Penentuan Nisbah Kelamin
Pengaruh Instar Inang
...
Biologi Opius sp...
BAHAN DAN METODE
...
Waktu dan Tempat...
Pemeliharaan Tanaman...
Pembiakan Lalat Pengorok Daun. .
...
Pembiakan Parasitold...
Perkembangan Pradewasa...
...
Keperidian, Masa Hidup Imago. dan Nisbah Kelarnin
Preferensi Terhadap Instar Larva
...
Pengaruh Instar Inang. .
...
Analisis Data...
HASIL DAN PEMBAHASAN
...
Perkembangan Fase Pradewasa...
Masa Hidup Imago dan Keperidian...
Banyaknya Keturunan dan Nisbah Kelarnin...
Preferensi Terhadap Instar Larva...
Pengaruh Instar Inang...
Peluang Pemanfaatan Opius sp.
dalam Pengendalian HayatiLiriomyza spp
...
DAFTAR PUSTAKA..
.
.
. . .
.
. . .
.
. . .
.
. . .
.
. . .
.
. . .
. . .
. . .
. .
. . . .
. . . .
DAFTAR TABEL
Nomor Halaman
Teks
1
.
Ukuran dan masa perkembangan pradewasa Opius sp...
21 2.
Keperidian dan masa peneluran Opius sp...
273
.
Banyaknya keturunan dan nisbah kelamin Opius sp...
294
.
Rataan banyaknya telur parasitoid yang diletakkan pada tiga instarinang
...
315
.
Masa perkembangan pradewasa. banyaknya keturunan dan nisbahDAFTAR GAMBAR
.. Nomor Halaman
Teks
1
.
Kurungan pembiakan L.
huidobrensis dan Opius sp...
16 2.
Kurungan percobaan Opius sp...
183
.
Telur Opius sp.
pada hari pertama diletakkan...
22 4.
Larva instar -1 Opius sp...
23 5.
Larva instar akhir Opius sp...
236
.
Pupa Opius sp...
.
.
...
247
.
Imago jantan Opius sp...
25Lampiran
DAFTAR LAMPIRAN
Halaman
Teks
1. Pertumbuhan dan perkembangan telur Opius sp. setelah diletakan..
.
..
. . .
42PENDAHULUAN
Latar Be!akang
Lalat pengorok daun kentang, Liriomyza huidobrensis (Blanchard)
(Diptera: Agromyzidae), merupakan hama eksotik yang diperkirakan tiba di
Indonesia pada awal tahun 1990-an (Rauf 1995), dan sekarang sudah ditemukan
hampir di semua dataran tinggi di Indonesia. Lalat pengorok daun merupakan
hama yang sangat polifag yang ditunjukan dengan banyaknya tanaman yang dapat
diserang. Menurut Rauf dan Shepard (1999), hama ini ditemukan pada 45 spesies
tanaman dari Famili Cruciferae, Liliaceae, Cucurbitaceae, Umbelliferae,
Compositae, Amaranthaceae, Chenopodiaceae, Solanaceae, Euphorbiaceae,
Convolvulaceae, Basellaceae dan Labitaceae.
Serangan hama ini dapat menimbulkan kerusakan pada tanaman karena
tusukan ovipositor imago dan korokan larva pada jaringan daun sehingga
menurunkan kemampuan fotosintesis tanaman. Serangan berat mengakibatkan
daun mengering dan gugur sebelum waktunya, sehingga kuantitas dan kualitas
umbi kentang menurun. Serangan hama ini dapat menurunkan hasil antara 30%
sampai 70% (Rauf & Shepard 1999).
Upaya pengendalian yang umum dilakukan petani adalah penggunaan
insektisida dengan fiekuensi penyemprotan 2-3 kali per minggu (Rauf 1999).
Namun tindakan tersebut sering tidak mampu menurunkan tingkat serangan.
karena lalat pengorok daun yang menyebar ini diduga berasal dari populasi yang
telah resisten (Parrella & Keil 1984), dan karena larva berada dalam jaringan
2
lain, penggunaan insektisida yang berlebihan dikhawatirkan dapat menimbulkan
dampak buruk seperti resistensi dan resurgensi hama, terbunuhnya musuh alami,
dan pencemaran lingkungan secara umum ( CEQ 1972). Untuk mengurangi
dampak negatif insektisida, diperlukan upaya pengendalian melalui pendekatan
pengendalian hama terpadu (PHT).
Di antara rentetan penelitian yang telah dilakukan untuk mendukung
pengendalian hama terpadu lalat pengorok daun adalah survei musuh alami.
Hingga kini di Indonesia dilaporkan terdapat 13 jenis parasitoid yang berasosiasi
dengan larva Liriomyza spp. yaitu Ascecodes deluchii (Baucek), Crysocharis sp.,
Cirropillus ambiguus (Hanson and LaSalle), Closterocerus sp., Hemiptarsenus
varicornis (Girault), Neochrysocharis formosa (Westwood), Neochrysocharis sp.,
Pnigalio sp., Quadrastichus sp., Zagrammosoma sp. ( semuanya Hymenoptera:
Eulophidae), Gronotoma sp. (Hymenoptera: Eucoilidae), Opius sp. (Hymenoptera:
Braconidae) dan Sphegigaster sp. (Hymenoptera: Pteromalidae) (Rauf et al.
2000). Pada pertanaman sayuran dataran tinggi, jenis parasitoid yang paling
dominan adalah Hemiptarsenus varicornis dan Opius sp. (Supartha 1998; Subaidi
2002). Pengamatan pendahuluan menunjukkan bahwa Opius sp. adalah
endoparasitoid larva-pupa.
Keberhasilan pemanfaatan parasitoid dalam pengendalian hama terpadu
lalat pengorok daun sangat ditentukan oleh tersedianya pengetahuan dasar tentang
berbagai aspek biologi parasitoid tersebut dan hubungan antara parasitoid dengan
inangnya. Pengetahuan mengenai berbagai aspek biologi yang diperlukan antara
lain meliputi perilaku, siklus hidup, perkembangan, fisiologi, reproduksi dan cara
3
(1977) menyatakan bahwa untuk mempertinggi efisiensi pemanfaatan musuh
alami diperlukan pengetahuan mengenai biologi, ekologi dan jenis-jenis inang
serta hubungan antara inang dan parasitoid. Mengingat pengetahuan mengenai
aspek biologi Opius sp. masih sangat terbatas, perlu dilakukan pengkajian lebih
lanjut tentang aspek tersebut dalam menunjang keberhasilan pemanfaatan
parasitoid tersebut dalam pengendalian hama terpadu lalat pengorok daun kentang.
Tujuan Penelitian
Penelitian ini bertujuan untuk memahami biologi parasitoid Opius sp. yang
meliputi masa perkembangan, keperidian, masa hidup, nisbah kelamin, dan
preferensi terhadap inang.
Kegunaan Penelitian
Kegunaan hasil penelitian ini adalah sebagai berikut: 1) memberikan
informasi tentang biologi Opius sp. dalam pengendalian hama terpadu lalat
pengorok daun kentang, 2) mengetahui potensi Opius sp. sebagai agen
pengendalian lalat pengorok daun dan 3) mengetahui cara-cara penanganan Opius
sp. baik dalam pemeliharaan, pengembangbiakan rnaupun pemanfaatannya dalam
TINJAUAN PUSTAKA
Biologi Liriomyza huidobrensis
L. huidobrensis termasuk Subfarnili Phytomyzinae, Famili Agromyzidae,
Ordo Diptera (Spencer & Steyskal 1986). Liriomyza dideskripsikan pertama kali
oleh Blanchard tahun 1926 dari tanaman Cineraria di Argentina (Parrella 1982)
Telur. Imago Liriomyza meletakkan telur dengan menyisipkannya di
bawah epikutikula permukaan daun bagian atas atau di atas epikutikula
permukaan daun bagian bawah. Telur berbentuk ginjal dengan warna agak
keputihan dan tembus pandang dengan ukuran 0,28 mm x 0,15 mm (Parrella
1987). Telur diletakkan satu persatu saling berdekatan satu sama lain dengan
lama stadium telur 2-3 hari. Selama hidupnya, imago betina mampu meletakkan
telur 42-30 1 butir (Supartha 1998).
Larva. Larva L. huidobrensis yang baru menetas langsung makan dan
berlanjut sampai keluar dari daun. Larva instar terakhir keluar dari daun menuju
ke tanah untuk berkepompong. Stadium larva berkisar 6- 12 hari, dengan
perincian instar -1 berkisar 2-4 hari, instar -2 berkisar 2-4 hari dan instar -3
berkisar 2-4 hari (Supartha 1998). Larva berbentuk silinder yang mengecil ke
depan menyerupai ternpayak. Ujung anterior tubuh pipih, sedangkan ujung
posterior terpancung. Larva bergerak melalui gerakan peristaltik dengan tekanan
hidrostatik kerangka luarnya (Parrella 1987).
Prapupa dan pupa. Periode di antara fase larva dan pembentukan
5
jam (Leibee 1984). Lama stadium pupa berkisar antara 8-1 1 hari (Parrella 1987).
Pada spesies L. huidobrensis berkisar antara 9- 12 hari (Supartha 1998)
Imago. Imago Liriomyza muncul dari bagian dorsal posterior puparium
yang prosesnya memerlukan waktu 5 menit sampai satu jam atau lebih. Kematian
imago sering terjadi selama proses tersebut. Imago yang baru muncul bersifat
fototaksis posistif dan naik ke batang tanaman. Ukuran tubuh imago betina lebih
besar daripada jantan dan muncul dari pupa yang lebih besar.
Gejala Serangan Liriomyza
Lalat pengorok daun L. huidobrensis menyebabkan kerusakan pada daun
tanaman karena tusukan ovipositor dan pengisapan cairan daun oleh imago.
Kerusakan yang lebih parah lagi akibat korokan larva Liriomyza dalam daun
tanaman menyebabkan daun menjadi kecoklatan karena matinya jaringan tanaman
(Cisneros & Mujica 2000). Sedangkan serangan pada daun kentang menyebabkan
tanaman mengering seperti gejala penyakit busuk daun (Rauf 1999).
Gejala serangan dimulai pada daun bagian bawah, kemudian daun bagian
tengah, dan serangan lebih parah dapat menyerang bagian pucuk (Cisneros &
Mujica 2000). Chavez dan Raman (1987) melaporkan bahwa di Amerika Serikat
dan Peru, serangan L. huidobrensis dapat mengakibatkan kehilangan hasil pada
kentang sekitar 35% sedangkan di Lembang kehilangan hasil sekitar 34%
(Soeriaatmadja & Udiarto 1996). Lebih lanjut dikemukakan oleh Rauf et al.
(2000) bahwa berdasarkan hasil survei di Bandung dan Garut (Jawa Barat), Banjar
6
Karo (Sumatera Utara), petani setempat melaporkan kehilangan hasil akibat
serangan Lyriomyza pada tanaman kentang sekitar 30 - 70%.
Biologi Parasitoid Braconidae
Famili Braconidae merupakan salah satu kelompok utama parasitoid yang
terdiri dari spesies-spesies yang sangat efektif untuk menekan kenaikan populasi
hama penting tanarnan (Wharton 1993). Opius fletcheri Silv. dan Opius tryoni
Cam. merupakan spesies dari Famili Braconidae yang mempunyai nilai tinggi
dalam pengendalian hayati lalat buah di Hawai. Parasitoid Braconidae dapat
bersifat endoparasotoid atau ektoparasitoid. Umumnya parasitoid endoparasitoid
terdapat pada inang yang hidup terbuka (Clausen 1940).
Menurut Goulet dan Huber (1933), serangga Famili Braconidae umumnya
merupakan serangga kecil yang berukuran jarang melebihi 15 mm. Sayap depan
serangga famili ini tidak mempunyai sel costa dan vena 2m-cu. Ciri-ciri lain dari
Famili Braconidae adalah tergum ke-2 metasoma bergabung dengan tergum ke-3.
Siklus hidup sebagian besar anggota Braconidae relatif singkat. Salah satu
contoh spesies pada Subfamili Microgasterinae, dalam setahun dapat
menghasilkan keturunan hingga beberapa generasi dengan stadia telur 2 sampai 5
hari, stadia larva 6 sampai 15 hari, dan stadia pupa 5 sampai 10 hari (Clausen
1940).
Telur. Pada umumya bentuk telur Famili Braconidae sederhana mulai dari
bentuk oval sampai hampir silindris, kadang-kadang seperti buah pir atau bentuk
yang memanjang dan menyempit kedua ujungnya yang termasuk ke dalam tipe
7
Braconidae adalah tipe mikro, pedikulat, bertangkai dan ensitiforma (Clausen
1940).
Larva. Menurut Hagen (1973), jumlah instar larva parasitoid mulai dari
instar pertama sampai instar terakhir sangat beragam tergantung dengan genus dan
spesiesnya. Selanjutnya Clausen (1940) mengelompokkan larva instar pertama
dalam 5 tipe yaitu himenopteriforma, mandibulata, kaudata, vesikulata dan
polipodeiforma Pada umumnya tubuh larva terdiri atas 13 ruas.
Larva instar terakhir spesies-spesies yang tergolong Braconidae memiliki
bentuk umum dengan beberapa ciri yang membedakan. Bentuk umum larva instar
terakhir itu adalah tipe himenopteriforma (Clausen 1940)
Pupa. Pupa Hymenoptera parasitoid bertipe eksarata yang berkokon atau
tidak berkokon. Parasitoid yang larvanya hidup di dalam inang atau pada inang
yang hidup tersembunyi membuat atau tidak membuat kokon sedang parasitoid
yang menyerang inang yang hidupnya terbuka umumnya membuat kokon (Clausen
1940; Hagen 1973).
Imago. Hymenoptera parasitoid jantan dan betina yang baru keluar dari
pupa dapat segera melakukan kopulasi bila keluar secara bersamaan (Doutt 1973).
Namun pada beberapa spesies kopulasi kadang-kadang terjadi setelah beberapa
hari keluar dari pupa.
Beberapa spesies Hymenoptera parasitoid mengalami periode praoviposisi,
yaitu selang waktu sejak imago betina keluar dari pupa hingga saat peletakkan
telur pertama (Doutt 1973). Periode praoviposisi umumnya singkat, hanya
8
meletakkan telurnya pada saat hari yang sama setelah imago betina keluar dari
Pupa.
Pemilihan Inang oleh Parasitoid
S.ebagian besar parasitoid Hymenoptera dapat memarasit beberapa jenis
inang dan hanya sedikit spesies yang spesifik memarasit satu spesies inang.
Parasitoid yang spesifik tersebut, pada kondisi laboratorium bahkan juga sering
dapat dipelihara pada inang lain yang secara alamiah bukan merupakan inang
karena adanya hambatan waktu dan ruang yang memisahkannya. Kenyataan
bahwa parasitoid dapat dibiakkan di laboratorium dengan serangga bukan inang
alamiah menjadi penting dalam pembiakkan masal parasitoid (Doutt 1959).
Menurut Doutt (1959) terdapat empat tahapan yang harus dilewati agar
parasitoid berhasil memarasit inangnya, yaitu 1) penemuan habitat inang, 2)
penemuan inang, 3) penerimaan inang, dan 4) kesesuaian inang. Selanjutnya
Vinson (1 976) menambahkan pengaturan inang sebagai tahap yang kelima karena
keberhasilan parasitisme juga ditentukan oleh kemampuan parasitoid dalam
mengatur fisiologi inangnya.
Dalam penemuan habitat inang, parasitoid terutama dipandu oleh
rangsangan kimia yang berasal dari senyawa-senyawa volatil. Rangsangan
tersebut dapat berupa bau yang berasal dari makanan atau tanaman yang terluka
atau yang rusak, organisme yang berasosiasi dengan inang atau inang itu sendiri.
Tanaman merupakan isyarat utama karena tanaman mempunyai peran yang
dominan dalam mendukung suatu habitat yang khas. Akibatnya, suatu parasitoid
inang. Parasitoid kadang-kadang juga memarasit inang yang terdapat pada jenis
tanaman tertentu dan tidak pada jenis tanaman yang lain (Vinson 198 1).
Penemuan inang oleh parasitoid dipandu oleh rangsangan fisik dan kimia.
Rangsangan fisik yang berperan terutama suara dan gerakan. Rangsangan kimia
dapat dibagi menjadi dua kelompok. Pertama, rangsangan kimia yang dapat
diterima dari jarak jauh misalnya bau inang. Rangsangan yang diterima
memungkinkan parasitoid untuk melokalisasi areal pencarian inang. Kedua,
rangsangan kimia yang dapat dideteksi hanya dari jarak dekat, yaitu setelah terjadi
kontak fisik. Rangsangan ini biasanya berasal dari senyawa-senyawa padat atau
cair misalnya kotoran inang, sekresi dari kelenjar labium inang, produk inang lain
dan bekas parasitoid lain. Adanya rangsangan ini memungkinkan terjadinya
kontak antara parasitoid dengan inangnya yang dicirikan oleh perilaku pengujian
oleh parasitoid berupa pergerakan memutar dengan cepat dan perubahan
kecepatan pergerakan. Faktor lain yang ikut menentukan penemuan inang adalah
pengalaman dan perilaku orientasi parasitoid (Weseloh 198 1).
Penerimaan inang atau pengenalan inang adalah proses diterima atau
ditolaknya inang untuk peletakkan telur setelah terjadi kontak (Arthur 1981).
Proses tersebut dibagi dalam empat fase yaitu:l) kontak dan pemeriksaan, 2)
penusukan dengan ovipositor, 3) pemasukan ovipositor dan 4) peletakan telur.
Keempat fase tersebut harus lengkap dan berurutan sehingga bila terjadi hambatan
pada salah satu fase, proses dimulai lagi dari awal.
Seperti halnya tahap sebelumnya, penerimaan inang juga dipandu terutama
oleh rangsangan fisik dan kimia. Selain itu, pengalaman parasitoid sebelumnya,
10
peneriman inang. Rangsangan fisik yang berperan adalah kondisi fisik inangnya
seperti ukuran, bentuk, tekstur atau bentuk perrnukaan, warna dan kandungan air.
Rangsangan lainnya adalah pergerakan inang misalnya kegiatan makan inang dan
perkembangan embrio dalam telur. Rangsangan kimia dapat berasal dari senyawa-
senyawa yang terdapat di luar dan di dalam tubuh inang yang dapat dideteksi
dengan antena, tarsi atau ovipositor. Senyawa-senyawa tersebut dapat
disekresikan melalui kutikula, diekskresikan bersama-sama kotoran atau terdapat
pada jaringan-jaringan tertentu dalam tubuh inang (Arthur 198 1).
Kesesuaian inang yang menentukan keberhasilan perkembangan parasitoid
sampai menjadi imago tergantung pada beberapa faktor, yaitu: 1) kemampuan
parasitoid dalam menghindari atau melawan sistim pertahanan inang, 2) kompetisi
dengan parasitoid lain, 3) adanya toksin yang mengganggu atau merusak telur atau
larva parasitoid, dan 4) kesesuaian makanan parasitoid. Faktor lain yang
berpengaruh adalah infeksi patogen, kerentanan inang, faktor lingkungan dan
pengaruh hormon-hormon pengendali serangga (Vinson dan Iwantsch 1980)
Reproduksi dan Penentuan Nisbah Kelamin
Proses produksi telur serangga Hymenoptera dibagi dalam dua kelompok
yaitu sinovigenik dan proovigenik (Doutt 1959; 1973). Pada serangga sinovigenik
telur diproduksi selama hidup imago betina. Banyaknya telur yang diproduksi
lebih tergantung pada makanan imago betina dibanding metabolit yang disimpan
pada stadia pradewasa. Pada serangga proovigenik imago betina yang baru
muncul mengandung telur yang telah matang dan tidak menghasilkan telur lagi
1 1
Reproduksi pada serangga Ordo Hymenoptera berlangsung secara
partenogenetik. Terdapat tiga tipe reproduksi, yaitu teliotoki, deuterotoki dan
arenotoki. Arenotoki merupakan tipe reproduksi yang paling umum pada
Hymenoptera, sedangkan teliotoki dan deuterotoki hanya terjadi pada beberapa
spesies (Doutt 1959).
Pada arenotoki, telur dapat berkembang baik secara partenogenetik
maupun melalui pembuahan. Telur yang dibuahi menjadi diploid dan akan
berkembang menjadi individu-individu betina, sedangkan telur yang tidak dibuahi
tetap haploid dan akan berkembang menjadi individu jantan (Clausen, 1940).
Pada imago betina dari sebagian besar anggota Ordo Hymenoptera terdapat
spermateka yang berfungsi sebagai organ penyimpan sperma yang diterima ketika
kopulasi (Doutt 1973). Jenis kelamin individu ditentukan selama proses peletakan
telur, yaitu ada atau tidaknya pengeluaran sperrna ketika telur melewati muara
spermateka. Oleh karena itu, nisbah kelamin spesies serangga yang demikian
sering sangat beragam dan berfluktuasi tergantung pada kondisi lingkungan.
Faktor-faktor lingkungan sangat berpengaruh pada perilaku imago betina termasuk
perilaku peletakkan telur dan pengaturan pengeluaran sperma yang akhirnya dapat
menentukan jensi kelamin keturunannya. Nisbah kelamin suatu spesies parasitoid
yang berfluktuasi dapat menjadi kendala penggunaan spesies tersebut dalsun
program pengendalian hayati, baik dalam pembiakan massal di laboratorium
maupun dalam kolonisasi.
Proporsi jantan dan betina (nisbah kelamin) keturunan parasitoid
ditentukan oleh beberapa faktor seperti suhu, umur imago, kesesuaian nutrisi,
12
Iwantsch 1980). Flanders (1946) menekankan faktor instrinsik dan ekstrinsik
yang mempengaruhi nisbah kelamin serangga arenotoki. Faktor intrinsik nisbah
kelamin ditentukan oleh: 1) jumlah telur yang d.iletakkan pada setiap peletakan
inang, 2) banyaknya telur dalam ovari yang siap untuk diletakkan, dan 3)
perbedaan kecendrungan kelamin pada perkembangan poliembrionik. Faktor
ekstrinsik yang mempengaruhi nisbah kelamin adalah: 1) perbedaan mortalitas
selama masa perkembangan, 2) interval kawin setelah imago muncul dari pupa,
terutama perbandingan telur yang diletakkan sebelum dan sesudah kawin, 3)
terlalu sering kawin, 4) adanya perbedaan tanggap peletakkan telur sesudah dan
sebelum kawin, 5) adanya unsur pemilihan tempat peletakan telur, dan 6)
kecepatan peletakkan telur,
Pengaruh Instar Inang
Fase perkembangan inang dapat mempengaruhi proses penemuan inang
dan penerimaan inang (Hendrikse et al. 1980; Van Alphen & Drijver 1982). Fase inang juga mempengaruhi kesesuaian parasitoid dan kemarnpuan parasitoid untuk
berhasil dalam pengaturan inangnya (Vinson & Iwantsch 1980; Beckage 1985;
Lawrence 1986). Parasitisasi pada instar inang yang berbeda dan ukuran inang
yang berbeda mempengaruhi kebugaran dan jumlah parasitoid (Hendrikse et al.
1980; Van Alphen & Drijver 1982), nisbah kelamin (King 1989), masa
perkembangan (Lawrence et al. 1976) atau ukuran parasitoid (Lawrence et al.
1976; Liu 1985). Ukuran parasitoid juga berkorelasi yang positif dengan jumlah
telur yang dihasilkan dan effisiensi dalam kemampuan mencari dan memarasit
13
Wietlisbach (1993), menunjukkan bahwa 0. dissitus Muesebeck lebih tertarik
memarasit inang instar lanjut. Bila parasitoid memarasit instar lanjut maka akan
menghasilkan masa perkembangan lebih singkat dan nisbah kelamin
keturunannya berbias ke arah jantan.
Biologi Opius sp.
Parasitoid Opius sp. merupakan endoparasit larva-pupa. Studi biologi dan
morfologi 0. dissitus pada inang L. trfolii telah diteliti oleh Bordat et al. 1995
dan 0. melleus Gahan pada larva lalat buah Famili Tephritidae (Lathrop &
Newton 1933)
Telur 0. dissitus berbentuk lonjong dengan warna putih dan tembus
pandang. Ukuran telur rata-rata 0,22 mm dan lama stadium telur 1-3 hari (Bordat
et al. 1995), sedangkan 0. melleus lama stadium telur lebih panjang yakni 3-6 hari
(Lathrop & Newton 1933). Setelah telur diletakkan, telur mengalami
pertumbuhan dan perkembangan di dalam tubuh inang.
Larva 0. dissitus terdiri atas dua instar, dengan ukuran masing masing 0,47
mm dan 0,99 mm, sedangkan 0. melleus dan Diachasma tryoni (Hyrnenoptera :
Braconidae), larva terdiri atas empat instar (Pemberton & Willard 191 8; Lathrop
& Newton 1933; Bordat et al. 1995). Larva instar satu mempunyai bagian kapsul
kepala yang kokoh dengan dua pengait yang runcing, tubuhnya ramping dan pada
ujungnya terlihat kasar. Larva instar dua berbentuk bulat, dimana pengaitnya telah
hilang dan berada dalam pupa inang yang panjang dengan warna putih krem
Pembentukan pupa ditandai dengan terbentuknya tonjolan tungkai dan
antena yang dapat dibedakan dengan mudah dari bentuk larva. Bagian tubuh,
kepala, toraks dan abdomen dapat terlihat jelas. Awalnya pupa berwarna kuning
pucat dan lama kelamaan bewarna gelap. Tubuh pupa yang berusia lanjut
berwarna hitam dengan ukuran 1,52 mm (Bordat et al. 1995), dan pembentukan
pupa terjadi di dalam tubuh inang (Pemberton & Willard 1918).
Imago 0. dissitus berwarna hitam, dengan ukuran yang hampir sama antara
jantan dan betina, yaitu rata-rata 1,50 mm dan 1,49 mm. Jantan dan betina sulit
dibedakan dengan mata biasa. Antena imago panjang, hitam, dan panjangnya
hampir sama dengan tubuhnya (Bordat et al. 1995). Pada 0. melleus ovipositor
relatif panjang dan merupakan ciri khasnya (Lathrop & Newton 1933).
0. dissitus betina yang baru muncul langsung menusukkan ovipositomya
ke dalam rongga tubuh larva inang tanpa mematikan atau melumpuhkannya.
Larva inang terparasit tetap hidup dan mengorok daun hingga menjadi pupa. dan
telur parasitoid tetap berkembang di dalam tubuhnya sampai keluar menjadi imago
(Bordat et al. 1995). Clausen (1940) melaporkan bahwa imago betina 0. .".
BAHAN DAN METODE
Waktu dan Tempat
Penelitian dilaksanakan di insektari Jurusan Hama dan Penyakit
Tumbuhan, Fakultas Pertanian
-
IPB, dan berlangsung sejak Oktober 2001 hinggaJuni 2002. Selama penelitian berlangsung suhu di insektari berkisar antara 23-25
"C dan kelembaban udara 63-70%. Pencahayaan di insektari menggunakan lampu
neon 40 W yang ditempatkan pada ketinggian 30 cm dari bagian atas kurungan,
dengan 16 jam gelap dan 8 jam terang bergantian.
Pemeliharaan Tanaman
Tanaman inang yang digunakan untuk membiakkan L. huidobrensis adalah
kacang merah (Vigna sinensis (L.) Hassk). Benih kacang merah ditanam dalam
polibag (tinggi 20 cm, diameter 13 cm) dengan menggunakan medium tanah yang
dicampur pupuk kandang dengan perbandingan 3:l. Bibit tanaman disiram setiap
hari agar tumbuh dengan baik. Untuk keperluan pembiakan serangga digunakan
bibit yang berumur delapan hari, yaitu yang memiliki dua helai daun yang telah
berkembang sempurna.
Pembiakan Lalat Pengorok Daun
Serangga inang yang digunakan dalam penelitian ini adalah L. huidobrensis
yang berasal dari populasi pertanaman organik di Cianjur, Jawa Barat. Lalat
pengorok daun ini dibiakan dalam kurungan berkerangka kayu yang berukuran
panjang 80 cm, lebar 40 cm dan tinggi 65 cm (selanjutnya disebut kurungan
meletakkan tanaman. Bagian samping kurungan terbuat dari kain kasa, sedangkan
bagian depan dan belakang serta atas terbuat dari lembaran plastik bening. Pada
bagian depan terdapat pintu untuk memasukkan tanaman dan serangga (Gambar
1 ).
Gambar 1. Kurungan pembiakan L. huidobrensis dan Opius sp.
Ke dalam kurungan pembiakan dimasukkan delapan polibag tanaman
kacang merah, dan selanjutnya dimasukkan populasi lalat pengorok daun hasil
pengumpulan dari lapangan. Setelah 24 jam, tanaman yang telah diteluri oleh lalat
pengorok daun dikeluarkan dan diganti dengan tanaman yang baru. Selama dalam
pembiakan, lalat diberi pakan larutan madu 10% yang diresapkan pada kapas yang
digantung dengan benang pada atap kurungan.
Tanaman yang telah diteluri oleh imago L. huidobrensis dimasukkan ke
dalam kurungan pembiakan lain yang bebas serangga, dan dipelihara hingga telur
menetas menjadi larva. Menjelang larva keluar dari korokan untuk
berkepompong, tangkai daun dipotong dan daun kemudian disimpan dalam wadah
[image:94.580.143.455.200.378.2]17
muncul dan terkumpul pada wadah plastik bercorong lalu digunakan lagi untuk
pembiakan. Sebagian dari tanaman yang telah terinfestasi larva pengorok
digunakan untuk pembiakan parasitoid seperti diuraikan di bawah ini. .
Pembiakan Parasitoid
Parasitoid Opius sp. diperoleh dari pengumpulan larva L. huidobrensis
pada pertanaman kentang di Kecamatan Pengalengan, Bandung-Jawa Barat.
Parasitoid dipelihara dalam kurungan pembiakan, dan diberi larutan madu 10%
sebagai pakan. Ke dalam kurungan kemudian dimasukkan sebanyak delapan
polibag tanaman kacang merah yang daunnya telah terinfestasi larva L.
huidobrensis instar-3. Setelah 24 jam tanaman dikeluarkan dari kurungan dan
diganti dengan tanaman yang baru. Larva instar-3 yang telah diparasit oleh Opius
sp. dimasukkan ke dalam kurungan pembiakan lain yang bebas serangga. Setelah
larva membentuk prapupa, yang ditandai dengan keluarnya larva dari korokan,
tanaman kacang merah dipotong dan dimasukkan ke dalam wadah plastik
bercorong sampai imago parasitoid keluar.
Perkembangan Pradewasa
Delapan tanaman kacang merah yang ditumbuhkan pada polibag yang
daunnya telah terinfestasi larva instar-3 L. huidobrensis dimasukkan ke dalam
kurungan pembiakan parasitoid. Setelah enam jam, tanaman dikeluarkan dan
dipindahkan ke kurungan lain yang bebas dari lalat pengorok maupun parasitoid.
Setiap hari dilakukan pembedahan terhadap 15 larva atau pupa inang untuk
18
warna, dan ukuran dari tiap fase pradewasa parasitoid. Pembedahan dilakukan di
bawah mikroskop binokuler dengan bantuan jarum mikro bertangkai.
Keperidian, Masa Hidup Imago, dan Nisbah Kelamin
Percobaan dilaksanakan dalam kurungan yang berupa kotak plastik
berukuran panjang 20 cm, lebar 20 cm, dan tinggi 30 cm (selanjutnya disebut
[image:96.582.159.457.292.493.2]kurungan percobaan). Bagian depan kurungan (pintu) terbuat dari kain kasa
(Gambar 2).
Gambar 2. Kurungan percobaan Opius sp.
Sepasang imago parasitoid yang baru keluar dari pupa dimasukkan ke
dalam kurungan. Parasitoid diberi pakan larutan madu 10% dengan cara dioleskan
pada dinding kurungan. Ke dalam kurungan kemudian dimasukkan tanaman
kacang merah yang daunnya telah terinfestasi larva L. huidobrensis instar-3
dengan populasi berkisar 40-50 larva. Setiap hari tanaman diganti dengan yang
baru. Tanaman dipotong pada pangkal batang kemudian diletakkan pada wadah
19
plastik) yang telah berisi air. Setelah 24 jam tanaman inang dikeluarkan dari
kurungan dan diganti dengan tanaman inang yang baru. Pergantian tanaman inang
. dilakukan setiap hari sampai imago betina mati. Imago jantan yang masih hidup
diberi pakan larutan madu 10%. Banyaknya telur yang diletakkan dihitung dengan
cara menbedah larva inang setiap hari. Dihitung masa hidup imago betina dan
jantan. Percobaan diulang pada 10 imago betina.
Penentuan nisbah kelamin didasarkan pada prosedur yang sama dengan
percobaan keperidian, kecuali telur dibiarkan berkembang hingga menjadi imago.
Untuk maksud tersebut, daun kacang merah dengan larva instar-3 yang telah
diparasit dipotong dan dimasukkan ke dalam wadah plastik yang telah dialas
dengan kertas tissu. Banyaknya imago jantan dan betina keturunan yang muncul
dicatat. Percobaan diulang pada 10 imago betina.
Preferensi Terhadap Instar Larva
Ke dalam kurungan percobaan secara terpisah dimasukkan tanaman yang
terinfestasi larva instar-1 (umur 3 hari), instar-2 (4 hari), dan instar-3 (5 hari),
masing-masing sebanyak 40-50 larva sebagai perlakuan. Sepasang imago
parasitoid berumur 2 hari kemudian dimasukkan ke dalam kurungan. Pelepasan
parasitoid dilakukan dengan meletakkan tabung kaca (panjang 5 cm, diameter 1
cm) yang berisi imago pada posisi di tengah-tengah dari ketiga perlakuan. Imago
parasitoid diberi pakan larutan madu 10% dengan mengoleskannya pada dinding
kurungan. Setelah 24 jam tanaman inang dikeluarkan. Larva kemudian dibedah
untuk menentukan banyaknya telur yang diletakkan pada setiap instar. Diseksi
20
bertangkai. Disamping itu, diamati juga perilaku parasitoid mulai dari pencarian
inang sampai peletakkan telur pada inang. Percobaan menggunakan rancangan
acak lengkap (RAL) dengan 1 0 ulangan. -
Pengaruh Instar Inang
Secara terpisah ke dalam tiap kurungan percobaan dimasukkan tanaman
kacang merah dengan dua helai daun yang telah terinfestasi larva instar-1, -2, dan
-3 masing-masing sebanyak 40-50 larva sebagai perlakuan. Sepasang imago
parasitoid yang berumur 2 hari kemudian dimasukkan ke dalam tiap kurungan
percobaan. Imago parasitoid diberi pakan larutan madu 10% yang dioleskan pada
dinding kurungan. Setelah 24 jam tanaman kacang merah dikeluarkan dari
kurungan, tangkai daun dipotong dan helai daun kemudian dimasukkan ke dalam
wadah plastik yang dialasi kertas tissu. Masing-masing perlakuan diulang lima
kali. Menjelang kemunculan imago, setiap hari dilakukan pengamatan terhadap
banyaknya keturunan parasitoid yang muncul dan jenis kelaminnya. Selain itu
dicatat pula masa perkembangan pradewasa.
Analisis Data
Data pengamatan dianalisis dengan sidik ragam dan dilanjutkan dengan uji
HASIL DAN PEMBAHASAN
Perkembangan Fase Pradewasa
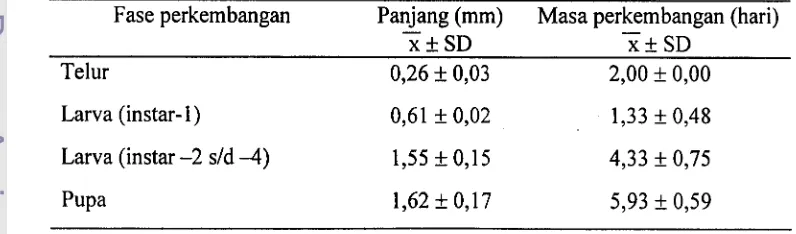
Telur
Secara umum bentuk dan ukuran pradewasa Opius sp. yang diamati dalam
penelitian ini hampir sama dengan yang diperikan oleh Bordat et al. (1995) pada
0. dissitus. Berdasarkan pembedahan inang didapatkan bahwa telur Opius sp.
berbentuk lonjong, dengan salah satu bagian ujungnya sedikit lebih membesar
dibandingkan ujung yang lain. Bentuk telur yang demikian tergolong tipe
himenopteriforma (Hagen 1973). Telur berukuran panjang 0,26 f 0,03 mm (Tabel
l), dan berwarna bening transparan (Gambar 3). Telur mengalami pertumbuhan
dan perkembangan setelah diletakkan dalam inang. Dalam ha1 ini sesuai dengan
keterangan Clausen (1940) bahwa pertumbuhan telur terutama dapat terjadi pada
endoparasitoid Famili Braconidae. Telur Opius sp. pada hari ke dua mengalami
pertumbuhan dan perkembangan dengan pertambahan panjang 1,5 kali (0,26
+
0,03 : 0,39
+
0,03) dan penambahan lebar 1,7 kali (0,lO+
0,Ol: 0,17+
0,Ol) dibandingkan hari pertama telur diletakkan (Lampiran 1).
Tabel 1. Ukuran dan masa perkembangan pradewasa Opius sp.
Fase perkembangan Panjang (mm) - Masa perkembangan (hari) -
x + S D x + S D
Telur 0,26 f 0,03 2,OO f 0,OO
Larva (instar- 1) 0,61 f 0,02 1,33
+
0,48Larva (instar -2 s/d -4) 1,55 f 0,15 4,33 f 0,75
[image:99.575.88.486.563.680.2]Gambar 3. Telur Opius sp. pada hari pertama diletakkan
Lawa
Larva instar-1 transparan dan bersifat motil. Bagian kepala tersklerotisasi
dengan baik dan dalam rongga mulut terlihat jelas adanya sepasang mandibel.
Bagian kepala ini tampak jelas berbeda dengan bagian abdomen. Ruas-ruas
abdomen tampak jelas, dengan ruas terakhir menyempit menyerupai ekor (Gambar
4). Bentuk larva yang demikian tergolong tipe kaudata (Hagen 1973). Larva
instar-1 berukuran panjang 0,61 rt 0,02 mm, dan masa perkembangannya 1,33
+
0,48 hari.
Instar berikutnya memiliki bentuk yang sangat berbeda dengan instar-1.
Bagian kepala kecil dan tidak tampak jelas, serta pada ujung abdomen tidak
terdapat kauda. Secara umum larva instar lanjut benvarna putih susu (Gambar 5).
Pengamatan pada hari ke-5 setelah telur diletakkan, larva berukuran panjang 1,55
+
0,15 mm. Dalam penelitian ini tidak dapat ditentukan secara pasti banyaknya [image:100.582.165.463.76.249.2]23
pada 0. melleus (Lathrop & Newton 1933). Masa perkembangan larva lanjut
[image:101.582.144.463.152.343.2](instar-2 s/d -4) berlangsung selama 4,33
+
0,75 hari.Gambar 4. Larva instar-1 Opius sp
Gambar 5. Larva instar akhir Opius sp.
Pupa
tubuh
Pupa berukuran panjang 1,62
+
0,17 mm. Sebelum membentuk24
dan toraks yang merupakan bakal embelan tubuh parasitoid. Mula-mula pupa
benvarna kuning, kemudian berubah menjadi kuning kecoklatan. Setelah pupa
terbentuk sempurna, warna tubuh berubah menjadi coklat kehitaman (Gambar 6 ) .
Masa perkembangan pupa berlangsung 5,93 f 0,59 hari. Dengan demikian, waktu
yang diperlukan sejak telur diletakkan hingga imago parasitoid muncul sekitar
[image:102.580.144.466.251.435.2]1339 hari.
Gambar 6 . Pupa Opius sp.
Masa Hidup Imago dan Keperidian
Imago parasitoid keluar dengan cara merobek puparium inang. Rataan
ukuran panjang imago jantan (Gambar 7) dan betina (Gambar 8) berturut-turut
adalah 1,72
+
0,13 mm dan 1,80+
O,11 mm. Dengan bantuan mikroskop, imagobetina dapat dibedakan dari jantan dengan adanya ovipositor (0,20 rt 0,01 mm)
Gambar 7. Imago jantan Opius sp.
Gambar 8. Imago betina Opius sp.
Kepala, mesosoma dan metasoma bewarna hitam. Pada bagian kepala
terdapat antena bewarna hitam kecuali pada bagian pangkal ruas pertama flagelum
yang bewarna kuning kecoklatan. Maksila bewarna kuning kecoklatan. Antena
imago jantan terdiri dari 23 ruas sedangkan antena betina terdiri dari 25 ruas
Tungkai bewarna kuning kecoklatan namun pada bagian tarsus warnanya
sedikit lebih gelap. Sayap mempunyai ciri tidak mempunyai costa dan vena 2m-
cu. Bagian metasoma terdiri dari 7 ruas dengan ruas tergum 2 dan 3 menyatu.
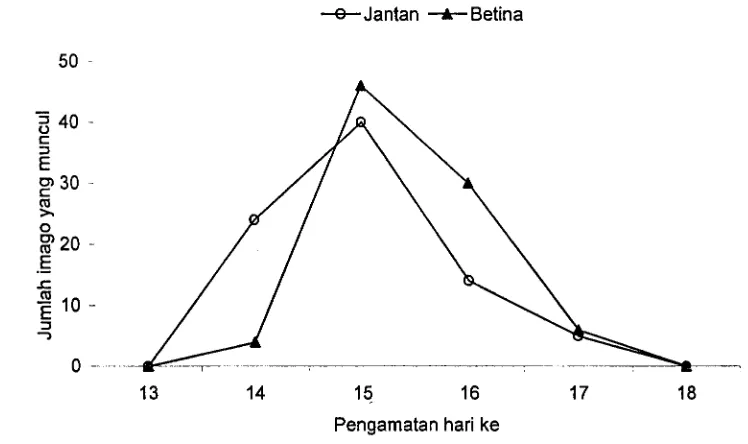
Imago jantan umumnya muncul lebih awal dari pada imago betina.
Pengamatan tambahan terhadap sekelompok telur yang diletakkan pada hari yang
sama menunjukkan bahwa dari 28 ekor imago yang muncul pada hari pertama,
sebanyak 85,71 % adalah jantan dan sisanya betina (Gambar 9). Hal ini sejalan
pula dengan data masa perkembangan pradewasa jantan yang lebih singkat seperti
disajikan pada Tabel 5 di akhir tulisan.
-e- Jantan
-+
Betina50 -
13 14 15 16 17 18 Pengamatan hari ke
Gambar 9. Pola pemunculan imago jantan dan betina
Tidak terdapat perbedaan yang nyata antara masa hidup imago jantan
(13,90
+
6,37 hari) dengan betina (10,80+
4,24 hari) (t = -1,28; db = 18; P =0,2 16). Masa praoviposisi berlangsung 0-3 hari dengan rataan 0,70 hari. Masa
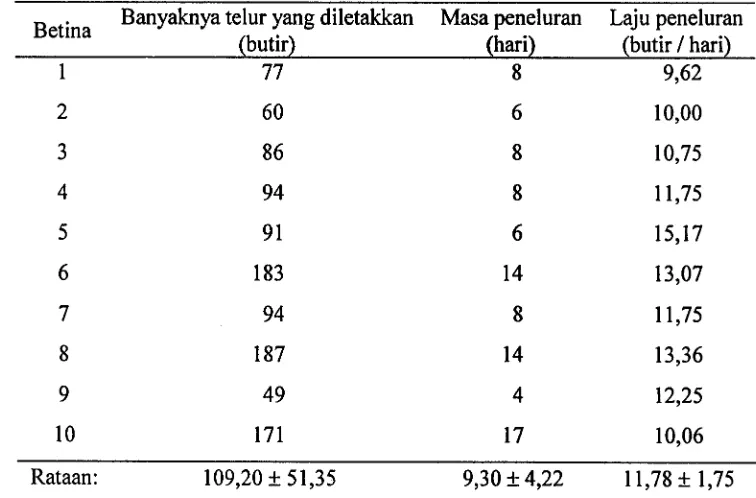
[image:104.575.103.477.325.547.2]Keperidian berkisar antara 49-187 dengan rataan 109,20
+
51,35 butir, dan lajupeletakan telur adalah 11,78
+
1,75 butir per hari.Tabel 2. Keperidian dan masa peneluran Opius sp.
la+:,- Banyaknya telur yang diletakkan Masa peneluran Laju peneluran
(butir) (hari) (butir 1 hari)
Rataan: 109,20 It 51,35 9,30 It 4,22 1 1,78
+
1,75Berdasarkan kohor (10 betina), proporsi individu yang bertahan hidup (I,)
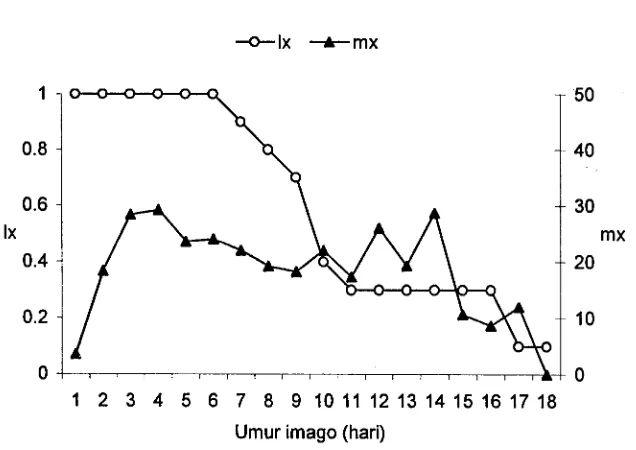
menurun tajarn sejak imago berumur 6 hari (Gambar 10, Lampiran 2). Kurva 1,
yang mendatar pada selang usia 11-16 hari disebabkan oleh adanya tiga individu
betina yang mampu hidup lebih lama. Banyaknya telur yang diletakkan per induk
(m,) meningkat pada saat imago berusia 3 dan 4 hari, dan setelah itu menurun.
Kurva m, meningkat lagi pada hari ke-12 dan 14, karena ketiga imago tadi masih
[image:105.575.105.483.167.416.2]1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 Umur imago (hari)
Gambar 10. Kurva sintasan dan keperidian betina Opius sp.
Banyaknya Keturunan dan Nisbah Kelamin
Banyaknya imago keturunan yang dihasilkan per induk betina parasitoid
berkisar antara 67-182 dengan rataan 113,O
+
43,06 ekor (Tabel 3). Nilai ini tidakberbeda nyata dengan nilai rataan banyaknya telur yang diletakkan (109,2) seperti
yang tercantum pada Tabel 2 sebelumnya (t = -0,18; db = 18; P = 0,860). Hal ini
mengisyaratkan bahwa pada keadaan inang berlimpah tidak terjadi
superparasitisme, banyaknya imago keturunan yang dihasilkan dapat digunakan
untuk menduga tingkat keperidian parasitoid.
Superparasitisme terjadi pada keadaan jumlah inang yang tidak mencukupi
untuk diparasit (Godfray 1994). Untuk menghindari terjadinya superparasitisme
pada percobaan ini digunakan jumlah inang yang berlimpah. Hasil pengamatan
terhadap larva terparasit pada kurungan pembiakan di insektari, terdapat
jumlah larva parasitoid instar -1 sebanyak 2
-
4 larva per inang, bahkan ditemukanjuga 11 larva per inang.
Tabel 3. Banyaknya keturunan dan nisbah kelamin Opius sp.
Banyaknya imago
Betina Nisbah kelamin
keturunan yang dihasilkan (% jantan)
Rataan: 1 13,OO
+
43,06 26,53+
12,27Nisbah kelarnin, yang dinyatakan dengan persentase jantan, berkisar antara
11,94-45,86% dengan rataan 26,53 f 12,27%, dan berbeda nyata dengan nisbah
teoritis 1:l (t = -6,lO; P < 0,001). Nisbah kelamin yang bias betina pada
Hymenoptera juga dilaporkan oleh beberapa peneliti lain (Wylie 1976, Donaldson
& Walter 1984, Mazanec 1988), sebagai akibat sistem reproduksi arenotoki pada
betina yang kawin (Crozier 1977). Pada pola reproduksi tadi, telur berkembang
secara partenogenetik atau zigogenetik tergantung pada terjadi atau tidaknya
pembuahan. Alokasi jenis kelamin pada tiap individu keturunannya dipengaruhi
oleh kondisi inang (Flanders 1946). Dalam penelitian ini digunakan larva instar-3
[image:107.584.100.490.166.423.2]30
parasitoid untuk mengalokasikan lebih banyak jenis kelamin betina pada
keturunannya (Charnov & Skinner 1985).
Preferensi Terhadap Instar Larva
Pemilihan inang seperti ditunjukkan oleh banyaknya telur yang diletakkan
dipengaruhi oleh fase perkembangan inang. Banyaknya telur yang diletakkan oleh
betina Opius sp. secara nyata lebih tinggi pada larva instar-3 (6,25 butir)
dibandingkan pada instar-2 (1,63 butir), sedangkan pada larva instar-1 sama sekali
tidak ditemukan telur parasitoid (Tabel 4) (F = 37,20; db = 2, 21; P < 0,001).
Perbedaan preferensi peletakan telur ini dapat disebabkan oleh perbedaan stimulus
fisik yang dihasilkan oleh setiap instar inang. Beberapa penelitian membuktikan
peranan stimulus vibrasi yang dihasilkan oleh larva pengorok daun dalam
penemuan inang oleh parasitoid (Meyhofer et al. 1994, Casas et al. 1998).
Dilaporkan bahwa rendahnya vibrasi yang dihasilkan oleh larva pengorok daun
Phytonzyza ranunculi Schrank (Diptera: Agromyzidae) yang berukuran kecil
menyebabkan inang lebih sulit ditemukan oleh parasitoid Kratochviliana sp.
(Hymenoptera: Eulophidae) (Sugimoto 1977). Selain itu, secara visual ukuran
korokan yang besar dari larva instar-3 diduga lebih mudah dijumpai oleh
parasitoid daripada korokan yang kecil (Petitt & Wietlisbach 1993). Stimulus
kimia juga dilaporkan berperanan dalam penemuan inang. Parasitoid 0. dissitus
lebih tertarik pada tanaman kacang yang terinfestasi L. sativae Blanchard dari
pada yang tidak (Petitt et al. 1992). Preferensi Opius sp. terhadap instar lanjut L.
Tabel 4. Rataan banyaknya telur parasitoid yang diletakkan pada tiga instar inang
Instar larva Rataan banyaknya telur yang diletakkan (butir)
1 0,00 a
Angka selajur yang diikuti oleh huruf yang sama tidak berbeda nyata (DMRT, a = 0,05); data ditransfonnasi dengan V (x+0,5) sebelum dilakukan analisis
Perilaku pencarian inang imago parasitoid Opius sp. yang diinokulasikan
ke dalam kurungan percobaan yang berisi inang larva instar-1, instar -2 dan instar
-3 yang berada dalam korokan daun kacang, mula-mula parasitoid terbang ke
dinding kurungan. Parasitoid berjalan pada dinding kurungan sambil mengerak-
gerakan antenanya, dan suatu waktu berhenti lalu menekukkan abdomennya ke
dinding kurungan. Kemudian parasitoid mengisap cairan madu yang dioleskan
pada dinding kurungan. Sesaat kemudian, parasitoid terbang menuju daun tempat
inang berada dan mulai melakukan pencarian inang. Setelah menetap pada daun
tanaman, parasitoid mulai bergerak secara acak mengelilingi daun dari bagian atas
sampai ke bagian bawah sambil menyentuhkan antena pada permukaan daun
tanaman dan sesekali parasitoid menekukkan abdomennya pada permukaan daun
tanaman sampai parasitoid menemukan inangnya. Antena sangat berperan sekali
bagi parasitoid sebagai indera pendeteksi dalam pencarian inang. Menurut
Susanto (1985) pemotongan antena pada Inareolata sp. (Hymenoptera:
Ichneumonidae) parasitoid larva Crocidolomiu binotalis Zell menyebabkan
kegagalan parasitoid dalam pencarian inang.
Intensitas sentuhan antena pada permukaan daun meningkat pada saat
[image:109.584.109.488.87.195.2]pemeriksaan korokan inang dengan menelusuri korokan dan sesekali menusukkan
ovipositornya ke dalam korokan secara singkat. Pada saat inang telah ditemukan,
parasi'toid bergerak mengitari inang untuk melakukan pemeriksaan apakah inang
diterima atau tidak. Penerimaan inang ditentukan oleh faktor fisik inang seperti
ukuran dan getaran yang dihasilkan oleh pergerakan inang (Arthur, 1981). Setelah
parasitoid merasa inang ini telah dapat diterima untuk diletaki telur, parasitoid
menekukkan abdomennya ke arah inang dan dilanjutkan dengan penusukan
ovipositor selanjutnya peletakan telur ke dalam tubuh inang. Proses parasitisasi ini
berlangsung lebih kurang 30 detik dan parasitoid berada dalam keadaan diam
tanpa bergerak sama sekali. Setelah meletakkan telur pertama, parasitoid mulai
lagi mencari inang selanjutnya untuk meletakkan telur berikutnya.
Setelah parasitoid memarasit beberapa inang, parasitoid terbang ke dinding
kurungan untuk melakukan pengisapan cairan madu untuk mendapatkan tambahan
energi bagi proses pencarian inang selanjutnya. Pengalaman parasitoid dalam
proses pencarian inang berikutnya lebih singkat dari sebelumnya.
Pengaruh Instar Inang
Instar hang berpengaruh nyata terhadap masa perkembangan pradewasa
parasitoid (Tabel 5). Pada inang instar-3 masa perkembangan pradewasa betina
parasitoid paling singkat (14,78 hari), disusul kemudian pada instar-2 (1 5,65 hari),
dan terlama pada instar-1 (16,69 hari) (F = 153,78; db = 2, 11; P = < 0,001). Hal yang hampir sama ditunjukkan pula oleh pradewasa jantan, masa
dan berbeda nyata dengan pada instar-1 (16,37 hari) ( F = 14,89; db = 2, 9; P =
Pada percobaan tanpa-pilihan, semua instar -dapat dipilih sebagai inang
yang ditunjukkan oleh kemunculan imago parasitoid dari setiap instar larva inang.
Tidak terdapat perbedaan nyata di antara banyaknya imago parasitoid yang muncul
dari ketiga instar inang (F = 1,75; db = 2, 12; P = 0,2153). Walaupun demikian,
inang larva instar-3 menghasilkan keturunan parasitoid yang paling banyak (12,40
ekor) (Tabel 5). Hasil penelitian ini sesuai dengan hasil penelitian Petitt dan
Wietlisbach (1993) tentang 0. dissitus pada inang L. sativae mendapatkan masa
perkembangan pradewasa parasitoid lebih singkat dan keturunan yang dihasilkan
lebih banyak pada inang larva instar lanjut.
Tabel 5. Masa perkembangan pradewasa, banyaknya keturunan dan nisbah kelamin Opius sp. yang dipelihara pada tiga instar larva L. huidobrensis
Instar Masa perkembangan Banyaknya keturunan Nisbah kelamin Inang pradewasa (hari) parasitoid yang muncul (% jantan)
Betina Jantan (ekor)
1 16,69 a 16,37 a 9,60 a 59,29 a
2 15,65 b 14,83 b 9,60 a 21,66 a
3 14,78 c 14,08 b 12,40 a 16,34 a
Angka selajur yang diikuti oleh huruf yang sama tidak berbeda nyata (DMRT, a = 0,05)
Nisbah kelamin keturunan yang berasal dari induk yang kawin sangat
bervariasi dari 100 % betina hingga 83,3 % jantan. Nisbah kelamin parasitoid
yang keluar dari inang instar-1 sekitar 2-3 kali lipat dibandingkan yang keluar dari
instar-2 dan -3 (Tabel 5). Walaupun demikian, perbedaan tadi secara statistik
tidak nyata (F = 3,43; db = 2, 9; P = 0,0780). Pengaruh perbedaan instar inang
[image:111.575.110.488.429.532.2]studi pendahuluan, khususnya karena jumlah ulangan yang sangat terbatas dan
masa peneluran yang terbatas pula (24 jam).
Peluang Pemanfaatan Opius sp. dalam Pengendalian Hayati
Liriomyza spp.
Opius sp. merupakan salah satu parasitoid yang dominan ditemukan pada
areal pertanaman kentang yang diserang oleh lalat pengorok daun Liriomyza spp.
Pengamatan biologi yang dilakukan terhadap Opius sp. dengan menggunakan
inang larva L. huidobremis telah memperlihatkan potensi besar dari Opius sp.
dalam penggunaan parasitoid ini untuk mengendalikan lalat pengorok daun di
lapangan.
Menurut DeBach (1973) ciri-ciri parasitoid yang efektif adalah: a) daya
mencari inang yang tinggi, b) spesifik terhadap inang, c) daya berketnbang biak
yang tinggi, d) kisaran toleransi terhadap lingkungan yang lebar serta kemampuan
memarasit terhadap berbagai instar inang dan f) dapat dikembangbiakan di
laboratorium secara ekonomis. Siklus hidup Opius sp. yang pendek (14,29 hari )
tidak jauh berbeda dengan siklus hidup inangnya yakni L. huidobrensis (28,31
hari), sehingga parasitoid dapat menjaga keseimbangan populasi inangnya di
lapangan. Melihat potensi Opius sp. yang baik dengan keperidian yang tinggi
(109,20 butir),dan nisbah kelamin keturunan yang bias betina (73,47 %),
memberinya peluang parasitoid ini untuk dikembangkan sebagai agens pengendali
lalat pengorok daun.
Opitls sp. dapat memarasit larva instar -1, -2 dan -3 lalat pengorok daun
sehingga inang dapat dikendalikan lebih awal dan larva tidak berkembang menjadi
3 5
sehingga kerugian yang ditimbulkan oleh serangan hama ini dapat ditekan sampai
batas ambang ekonomi.
Perbanyakan parasitoid secara massal di laboratorium merupakan kendala
besar dalam pemanfaatan parasitoid untuk pengendalian hayati. Namun
permasalahan ini tidak menjadi kendala bagi Opius sp. karena parasitoid ini sudah
bisa dibiakkan secara massal di laboratorium dengan menggunakan tanaman
kacang merah sebagai tanaman inang bagi lalat pengorok daun dan larva instar -3
untuk perbanyakan Opius sp. Keberhasilan ini telah menjaga kelimpahan populasi
Opius sp. di laboratorium sehingga ketersedian populasi Opius sp. untuk
pengendalian hayati baik secara augmentasi maupun introduksi tersedia secara
KESIMPULAN DAN SARAN
Penelitian yang dilakukan ini menyediakan inforniasi dasar yang penting
dalam menilai potensi Opius sp. sebagai agens pengendalian hayati lalat pengorok
daun. Siklus hidup yang singkat, keperidian yang tinggi, serta nisbah kelamin
yang bias betina merupakan karakteristik biologi yang diharapkan mampu
mengimbangi populasi lalat pengorok daun di lapangan. Dari segi praktis
pembiakan massal, penggunaan inang instar-3 yang selama ini dilakukan
mendukung ketiga karakteristik tadi, sehingga kelimpahan parasitoid dapat
terpelihara. Pemanfaatan Opius sp. dalam pengendalian hayati masih perlu
ditunjang dengan penelitian lanjutan yang meliputi kapasitas pencarian inang,
kemampuan memencar, tanggap fungsional dan numerik, serta interaksi dengan
DAFTAR PUSTAKA
Arthur AP. 1981. Host acceptance by parasitoids. In: Nordlund DAY Jones RL, Lewis WJ, editor. Semiochemicals, Their Role in Pest Control. New York: John Wiley and Sons. p 97-120.
Beckage NW. 1985. Endocrine interactions between endoparasitic insects and their hosts. Annu Rev Entomol 30:371-413.
Boldt PE. 1974. Tempetarure, humidity and host: effect on rate of search of
Trichogramma evanescens and T. minutum Auctt. Ann Entomol Soc Am 67:706-708.
Bordat D, Coly EV, Roux-Olivera C. 1995. Morphometric, biological and behavioural differences between Herniptarsenus varicornis (Hym., Eulophidae) and Opius dissitus (Hym., Braconidae) parasitoids of
Liriomyza trijiolii (Dipt., Agromyzidae). J Appl Entomol 119: 423-427.
Casas J, Bacher S, Tautz J, Meyhofer R, Piere D. 1998. Leaf vibrations and air movements in a leafininer-parasitoid system. Biological Control 11: 147- 153.
CEQ [Council of Environmental Quality]. 1972. Integrated pest management. Washington: US Gov Printing Ofice.
Charnov EL, Skinner SW. 1985. Complementary approaches to understanding of parasitoid oviposition decision. Environ Entomol 14: 383-39 1.
Chavev GL, Raman KV. 1987. Evaluation of trapping and trap types to reduce
damage to tomato by the leaf-miner Liriomyza huidobrensis
(Diptera:Agromyzidae). Insect Sci Appl 8 (3):369-372
Cisneros F, Mujica N 2000. Developing P M component for leafminer fly in the Canete Valley of Peru. htt~:l/www.cipotato.org/market/P~mRprts/pr95-
961prprzram 4lprog 44.htm. 03 Mei 2000.
Clausen RF. 1940. Entomophagous insect. New York and London: Mc Graw- Hill Book Company, Inc.
Crozier RH. 1977. Evolutionary genetics of the Hymenoptera. Annu Rev Entomol 22: 263-288.
DeBach P. 1973. The scope of biological control. In: DeBach P, editor. Biological Control of Insect Pests and Weeds. London: Chapman and Hall.
Doutt, RL. 1959. Biology of parasitic Hymenoptera. Annu Rev Entomol4:161- 183
Doutt RL. 1973. Some biological control consepts and questions. In: De Bach P, editor. Biological Control of Insect Pests and Weeds, London: Chapman and Hill. p 11 8-142
Donaldson JS, Walter GH. 1984. Sex ratios of Spalangia endulis (Hymenoptera: Pteromalidae) in re