DAFTAR LAMPIRAN
Lampiran 1. Komposisi Medium MS (Murashige & Skoog), pH = 5,6-5,8
Bahan kimia Konsentrasi dalam medium (mg/L)
Lampiran 2. Komposisi Medium GYE (Glucose Yeast Extract), pH = 6,2
Bahan kimia Konsentrasi dalam medium (g/L)
Glukosa 40
Ekstrak Yeast 5
Pepton 5
Agar 15
Lampiran 3. Komposisi Medium PCA (Plate Count Agar), pH = 7
Bahan kimia Konsentrasi dalam medium (g/L)
Pepton-Casein 5,0
Ekstrak Yeast 2,5
D (+) Glukosa 1,0
Agar 15,0
Lampiran 4. Data Berat Basah Kalus Teh (Camellia sinensis L.)
A. Sebelum Dielisitasi pada Medium Induksi (Medium MS dengan penambahan zat pengatur tumbuh 1 mg/L 2,4-D dan 1 mg/L kinetin)
Perlakuan Berat Basah (g) SD
Elisittor 0,00% (Kontrol) 2,26 0,051
Elisittor 0,25% 2,44 0,042
Elisittor 0,50% 2,29 0,145
Elisittor 1,00% 2,39 0,067
Elisittor 2,00% 2,37 0,197
Elisittor 4,00% 2,32 0,072
B. Setelah Dielisitasi pada Medium Perlakuan (Medium MS dengan penambahan zat pengatur tumbuh 1 mg/L 2,4-D + 1 mg/L kinetin + elisitor)
Perlakuan Berat Basah (g) SD
Elisittor 0,00% (Kontrol) 2,45 0,081
Elisittor 0,25% 2,55 0,031
Elisittor 0,50% 2,34 0,206
Elisittor 1,00% 2,52 0,075
Elisittor 2,00% 2,54 0,195
Elisittor 4,00% 2,39 0,075
Uji Statistik Berat Basah Kalus Teh (Camellia sinensis L.)
Lampiran 5. Data Berat Kering Kalus Teh (Camellia sinensis L.) pada Medium Elisitasi (Medium MS dengan penambahan zat pengatur tumbuh
1 mg/L 2,4-D + 1 mg/L kinetin + elisitor)
Perlakuan Berat Kering (g) SD
Elisittor 0,00% (Kontrol) 0,28 0,006
Elisittor 0,25% 0,25 0,021
Elisittor 0,50% 0,28 0,012
Elisittor 1,00% 0,30 0,012
Elisittor 2,00% 0,31 0,015
Elisittor 4,00% 0,29 0,010
Uji Statistik Berat Kering Kalus Teh (Camellia sinensis L.)
Sum of Squares df Mean Square F Sig.
Between Groups ,006 5 ,001 7,175 ,003
Within Groups ,002 12 ,000
Total ,009 17
Uji DNMRT 5%
Perlakuan N Subset for alpha = 0.05
1 2 3
Elisitor 0,25% 3 ,2533
Elisitor 0,00% (Kontrol) 3 ,2833
Elisitor 0,50% 3 ,2833
Elisitor 4,00% 3 ,2900 ,2900
Elisitor 1,00% 3 ,3033 ,3033
Elisitor 2,00% 3 ,3133
Lampiran 6. Data Pertumbuhan Saccharomyces cerevisiae pada Medium GYE
Waktu (Jam)
Jumlah koloni
Rata-Rata Ulangan 1 Ulangan 2
0 0 0 0
2 1 1 1
4 2 4 3
6 14 16 15
8 39 41 40
10 58 62 60
12 65 71 68
14 74 76 75
16 79 81 80
18 75 89 82
20 78 86 82
22 80 82 81
24 79 80 79,5
Estimasi jumlah sel = Jumlah Koloni x 1
Faktor pengenceran (CFU/ml)
Lampiran 7. Data Waktu Retensi dan Luas Area Katekin Standar Konsentrasi Katekin
Standar (ppm)
Waktu Retensi (menit)
Luas Area
U1 U2 U1 U2
50 3,310 3,314 261043 258414
100 3,322 3,327 462233 454066
150 3,336 3,338 668682 665489
200 3,345 3,347 900666 906617
250 3,351 3,354 1227505 1193028
300 3,364 3,362 1389662 1515897
350 3,375 3,374 1533494 1495287
400 3,379 3,378 1741831 1739080
Rata-rata waktu retensi 3,349
Contoh Profil Kromatogram Katekin Standar pada Perangkat HPLC
Kurva Kaliberasi Katekin
R2 = 0,994
Y = 44919,214 + 4359,524 x.
Lampiran 8. Data Waktu Retensi dan Luas Area Katekin Sampel
Perlakuan (ppm)
Waktu Retensi
(menit) Luas Area
U1 U2 U1 U2
Elisitor 0,00%(Kontrol) 3,419 3,415 391316 403071
Elisitor 0,25% 3,396 3,388 1594019 1396304
Elisitor 0,50% 3,405 3,408 1621866 1526124
Elisitor 1,00% 3,417 3,434 1071983 1096319
Elisitor 2,00% 3,437 3,431 396983 425861
Elisitor 4,00% 3,412 3,423 485066 442378
Rata-rata waktu retensi 3,415
Contoh Profil Kromatogram Katekin Sampel pada Perangkat HPLC
Kandungan Katekin Di Dalam Kalus Teh
Perlakuan (ppm) Rata-rata Kandungan Katekin
mg/L mg/ g BK
Elisitor 0,00%(Kontrol) 80,805a 0,485
Elisitor 0,25% 332,660c 1,996
Elisitor 0,50% 350,754c 2,105
Elisitor 1,00% 238,382b 1,430
Elisitor 2,00% 84,070a 0,504
Elisitor 4,00% 96,066a 0,547
Contoh Perhitungan Kandungan Katekin (mg/ g BK)
Kontrol =
Kontrol = 0,485 mg/ g BK
Konsentrasi sampel (mg/L) x volume sampel (L)
Berat sampel (g)
80,805 mg/L x 0,003L
0,5 g
Uji Statistik Kandungan Katekin Di dalam Kalus Teh (Camellia sinensis L.)
Sum of Squares df Mean Square F Sig. Between Groups 160396,722 5 32079,344 141,713 ,000
Within Groups 1358,212 6 226,369
Total 161754,934 11
Uji DNMRT 5%
Perlakuan N Subset for alpha = 0.05
1 2 3
Elisitor 0,00% (Kontrol) 2 80,8050
Elisitor 2,00% 2 84,0695
Elisitor 4,00% 2 96,0660
Elisitor 1,00% 2 238,3815
Elisitor 0,25% 2 332,6600
Elisitor 0,50% 2 350,7535
DAFTAR PUSTAKA
Alamsyah, A. N. 2006. Taklukan Penyakit dengan Teh Hijau. Jakarta: Agro Media Pustaka.
Ali, M. B., Han, E., and Paek, K. 2007. Methyl Jasmonate and Salicylic Acid Induced Oxidative Stress and Accumulation of Phenolic in Phanax gingseng Bioreactor Root Suspension Cultures. J. Molecules. 12: 607-621.
Ariningsih, I dan Anggarwulan, E. 2002. Pertumbuhan Kalus dan Produksi Antrakuinon Mengkudu (Morinda citrifolia L.) pada Media Murashige-Skoog (MS) dengan Penambahan Ion Ca2+ dan Cu2+. Biofarmasi. 1:1-6.
Bambang. 2006. Prospek Teh Indonesia Sebagai Minuman Fungsional. http://www.ipard.com/art_perkebunan/Aug02-06_kb.asp (18/07/13).
Barz, W., Reinhard, E., and Zenk, M. H. 1977. Plant Tissue Culture and Its Biotechnological Applications. Biotechnology. 15: 3-16.
Buitelaar, R. M., Caesario, M. T., and Tramper, J. 1991. Strategies To Improve The Production of Secondary Metabolites With Plant Cell Cultures. Biotechnology. 23-111. Oksodatif Kopling dengan Biokatalis Peroksidase. [Skripsi]. Depok: Universitas Indonesia.
Funk, C., Gugler, K., and Bordelius, P. 1997. Increased Secondary Metabolites Product Formation In Plant Suspension Cultures After Treatment With Yeast Carbohydrate Preparation (Elicitor). Phytochemistry. 26: 401-404.
Hahn, G. M. 1996. Microbial Elicitors and Their Receptors In Plant. Phytopathology. 34: 387-391.
Harold and Graham, N. 1992. Green Tea Composition, Consumption, and Polyphenol Chemistry Preventive Medicine. New York: John Willey and Sons.
Hartman, H. T. 1990. Plant Propagation: Principles and Practice. New Jersey: Prentice-Hall International, Inc.
Hendaryono, D. P.S., dan Wijayani, 1994. Teknik Kultur Jaringan, Pengenalan dan Petunjuk Perbanyakan Tanaman secara Vegetatif Modern. Yogyakarta: Kanisius.
Isaac, S. 1992. Fungal Plant Interactions. London: Chapman & Hall.
Klis, F. M, Boorsma, A. and Groot, P. W. J. 2005. Cell Wall Constructure in Saccharomyces cerevisiae. Willey Inter Science. 23: 185-202.
Kurz, W. G. W. dan F. Constabel. 1991. Produksi dan Isolasi Metabolit Sekunder. Bandung: Penerbit ITB.
Manttel, S. H. and Smith, H. 1993. Cultural Factor That Influence Secondary Metabolites Accumulation In Plant Cell and Tissue Cultures. London: Cambridge University.
Maftuchah., Ardiana, H.K., dan Joko, B.S. 1998. Induksi Kalus Artemisia (Artemisia vulgaris L.) Melalui Kultur In Vitro. Tropika. 6 (2): 135-141.
Missawa, M. 1994. Plant Tissue Culture an Alternative for Production of Useful Metabolites. Canada: Bio International Inc.
Mondal, T. K., Bhattacharya, A., Laxmikumaran, M.,dan Ahuja, P. S. 2004. Recent Advances of Tea (Camellia sinensisL.) Biotechnology, Plant Cell, Tissue and Organ Culture. Phytochemistry. 76: 195-197
Moreno, O. A. 1994. Effect of Differentiation on The Regulation of Indole Alkaloid Production in Catharanthus roseus, Hyoscyamine and Scopolamine in Root Tissue of Datura stramonium by Densiometry in Thin Layer Chromatography. Phytochemistry. 3: 117-121.
Namde, A. G. 2007. Plant Cell Elicitation for Production of Secondary Metabolites. Pharmacognosy. 1: 69-70.
Nurunisa, V. A. 2011. Daya Saing dan Strategi Pengembangan Agribisnis Teh Indonesia. [Skripsi]. Bogor: Fakultas Ekonomi dan Managemen Institut Pertanian Bogor.
Pandiangan, D. 2011. Produksi Katarantin Melalui Kultur Jaringan. Bandung: CV. Lubuk Agung.
Pandiangan, D dan Siahaan, P. 2002. Produksi Alkaloid dari Kalus Tapak Dara. Prosiding Seminar Nasional MIPA . Manado: Universitas Sam Ratulangi.
Peltonen, S., Mannonean, L., and Karjalainen, R. 1997. Elicitor Induced Changes of Phenylalanine Ammonia lyase Activity in Barley Cell Suspension Cultures. Plant Cell Tissue and Organ Cultures. 50: 185-193.
Punyasiri, P. A. N., Abeysinghe, I. S. B., kumar, V., Treutter, D., Duy, D., and Goscha, C. 2004. Flavonoid Biosynthesis in The Tea Plant Camellia sinensis: Properties of Enzymes of The Prominent Epicatechin and Catechin Pathways. Biochemistry. 421 : 22-30.
Purkayastha, R.P. 1996. Phytoalexin Production and Plant Defense. Indian Natn Sci Acad. 62 : 51-64.
Purwianingsih, W. 1997. Efek Pemberian Homogenat Verticillium dahlia & Rhizoctonia solani sebagai Elisitor Terhadap Kandungan Gosipol dalam Kultur Kalus Gossypium hirsutum. [Tesis]. Bandung: Magister Sains Biologi ITB-Bandung.
Rahayu, B., Solichatun., dan Anggarwulan, E. 2003. Pengaruh Asam 2,4 Diklorofenoksiasetat (2,4-D) Terhadap Pembentukan dan Pertumbuhan Kalus serta Kandungan Flavonoid Pada Kultur Kalus Acalypha indica L. Biofarmasi. 1(1): 1-6.
Ratnasari, J., Arbayah, H., dan Rizkita, R. E. 2001. Pengaruh Pemberian Elisitor Ekstrak Khamir Saccharomyces cerevisiae Hansen. Terhadap Kandungan Ajmalisin dalam Kultur Agregat Sel Catharanthus roseus (L.) G. Don. Berita Biologi. 5 : 351-352.
Salisbury, F. B. dan Ross, C. W. 1995. Fisiologi Tumbuhan. Jilid ke-3. Edisi ke-4. Bandung: Institut Teknologi Bandung.
Sastrosupadi, A. 2004. Rancangan Percobaan Praktis Bidang Pertanian. Yogyakarta: Kanisius.
Setiti, E. 2000. Prospek Aplikasi Teknik Kultur Jaringan dalam Agrobisnis. Prosiding. Fakultas MIPA. Surabaya: Unair.
Simanjuntak, T. 2004. Pemanfaatan Pengetahuan Bioteknologi Pada Teh Hijau. Medan: Cakrawala.
Sudibyo, R. S. 2002. Metabolit Sekunder. Manfaat dan Perkembangannya dalam Dunia Farmasi. Yogyakarta: Universitas Gadjah Mada.
Suvarnalatha, G., Rajendran, L., Ravishankar, G. A., and Venkantaraman, L. V. 1994. Alicitation of Anthocyanin Production In Cell Cultures of Carrot (Daucus carota L.) By Using Elicitor and Abiotic Stress. Biotechnology Letters. 16(12): 1275-1280.
Sutini, 2008. Meningkatkan Produksi Flavan-3-ol Melalui Kalus Camellia sinensis L. dengan Elisitor CU 2+. Hayati. 14: 39-44.
Sutini, 2009. Studi Pembentukan Kultur Kalus Camellia sinensis L. dan Deteksi Kandungan Epigallocatechin Gallate-nya. Journal of Biological Research. Surabaya: Unair.
Sutini. 2010. Produksi Epigallocatechin Gallate Melalui Kalus Camellia sinensis L. dengan Induksi Elisitor Cu2+, Asam Salisilat, dan Prekursor Fenilalanin. [Disertasi]. Malang: Program Pascasarjana Fakultas Pertanian Universitas Brawijaya.
Taiz, and Zeiger. 2002. Plant Physiology. USA: Sinauer Associates, Inc.
Watimena, G. A, 1992. Bioteknologi Tanaman. Bogor: Institut Pertanian Bogor.
Yanuar, Y. 2001. Aktivitas Antitoksik Katekin-α-Glukosida Hasil Reaksi Transfer Enzimatik. Bogor: Institut Pertanian Bogor.
Yoshikawa, M. and Sugimoto, K. 1993. A Specific Binding Site on Soybean Membrane for a Phytolexin Elicitor Released from Fungal Cell Walls by
β-1,3-endoglucanase. Plant Cell Physiol. 34:1163-1173.
Yuhernita dan Juniarti. 2011. Analisis Senyawa Metabolit Sekunder dari Ekstrak Metanol Daun Surian yang Berpotensi sebagai Antioksidan. Makara Sains. 15(1): 48-52.
Zahara, N. C. 2011. Pemanfaatan Saccharomyces cerevisiae dalam Sistem Microbial Fuel Cell untuk Produksi Energi Listrik. [Skripsi]. Depok: Universitas Indonesia.
BAB 3
BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Maret 2014 sampai dengan bulan Oktober 2014, di Laboratorium Kultur Jaringan Tumbuhan Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara, dan Laboratorium Pengujian Mutu dan Residu Pestisida Unit Pelaksana Teknis Perlindungan Tanaman Pangan dan Hortikultura Medan.
3.2 Alat dan Bahan
Adapun alat yang digunakan antara lain; botol kultur, pisau kultur, pinset, otoklaf, oven, cawan petri, erlenmeyer, gelas ukur, gelas beaker, neraca analitik, jarum ose bengkok, pipet serologi, pro pipet, pipet tetes, tabung reaksi, bunsen, botol vial, corong, corong pisah, statif dan klem, spatula, alu dan mortar, termometer,
rotarievaporator, sonikator, kertas saring (Whatman 0,2 μm), jarum syringe, hockey stick, vortex, sentrifuge, hot plate, shaker, High Performance Liquid
Chromatography (HPLC) (Shimadzu LC-20 AD UV-Visible Detectorkolom C 18 waters μ bondapak 150 L x 4,6 mm STR ODS II).
Sedangkan bahan yang digunakan antara lain; aluminium foil, cling wrap, plastik tahan panas, karet gelang, ragi Saccharomyces cerevisiae, medium PCA (Plate Count Agar), medium GYE (Glucose Yeast Extract), larutan standar katekin (konsentrasi 50; 100; 150; 200; 250; 300; 350; 400 mg/L), medium MS (Murashige & Skoog), zat pengatur tumbuh 2,4-D (Diklorofenoksi-asetat) 1 mg/L, kinetin 1 mg/L, daun teh (Camellia sinensis L.), larutan Na-hipoklorit 3%, larutan HgCl2 0,1%, akuades steril, alkohol 70%, akuabides, etanol, kloroform, etil asetat
(grade for HPLC).
3.3 Metode Penelitian
kinetin) ditambahkan elisitor dinding sel Saccharomyces cerevisiae (dengan beberapa tingkatan konsentrasi sebagai perlakuan).
A= Kontrol (tanpa elisitor) D = Konsentrasi elisitor 1,00% B= Konsentrasi elisitor 0,25% E = Konsentrasi elisitor 2,00% C= Konsentrasi elisitor 0,50% F = Konsentrasi elisitor 4,00%
Berdasarkan rancangan penelitian di atas diperoleh 6 perlakuan dengan masing-masing ulangan sebanyak 3 ulangan sehingga diperoleh jumlah total sebanyak 18 botol.
3.4 Bahan Penelitian 3.4.1 Bahan Tanaman
Bahan tanaman yang digunakan adalah daun teh (Camellia sinensis) yang diperoleh dari PTPN IV Bah Butong, Sidamanik-Pematangsiantar. Eksplan yang digunakan adalah daun teh posisi 1, 2, dan 3 (Simanjuntak, 2004). Posisi daun teh dapat dilihat pada Gambar 3.1.
Gambar 3.1. Daun teh: (a) posisi 1; (b) posisi 2; (c) posisi 3
3.4.2 Medium Induksi Kalus
Medium yang digunakan untuk menginduksi kalus teh (Camellia sinensis) adalah medium MS (Murashige &Skoog) dengan penambahan zat pengatur tumbuh 1 mg/L 2,4-D (Diklorofenoksi-asetat) dan 1 mg/L kinetin. Komposisi medium MS dapat dilihat pada Lampiran 1, halaman 32.
a
c
b
a
c
b
3.4.3 Medium Pemeliharaan Saccharomyces cerevisiae
Medium yang digunakan untuk pemeliharaan Saccharomyces cerevisiae adalah medium padat GYE (Glucose Yeast Extract). Biakan murni yang didapat, selanjutnya digunakan untuk mengetahui kurva pertumbuhan Saccharomyces cerevisiae pada medium PCA (Plate Count Agar) agar diketahui waktu yang tepat
untuk memanen dinding sel Saccharomyces cerevisiae sebelum digunakan sebagai elisitor. Selanjutnya produksi dinding sel Saccharomyces cerevisiae dilakukan pada medium GYE cair. Komposisi medium GYE dan PCA dapat dilihat pada Lampiran 2, halaman 33 dan Lampiran 3, halaman 34.
3.4.4 Medium Elisitasi
Medium yang digunakan untuk elisitasi adalah medium MS (Murashige & Skoog) dengan penambahan zat pengatur tumbuh 1 mg/L 2,4-D dan 1 mg/L
kinetin dikombinasikan dengan beberapa konsentrasi elisitor dinding sel Saccharomyces cerevisiae (0,00; 0,25; 0,50; 1,00; 2,00; 4,00%).
3.5 Prosedur Penelitian 3.5.1. Penanaman Eksplan
Eksplan dipetik dari pucuk daun teh posisi 1, 2, dan 3 (Simanjuntak, 2004), eksplan dicuci dengan air mengalir. Sterilisasi dilakukan dengan merendam eksplan dalam larutan Na-hipoklorit 3% dan larutan HgCl2 0,1% masing-masing
selama 10 menit sambil dikocok pelan, dibilas dengan akuades steril sebanyak tiga kali. Eksplan dipindahkan pada cawan petri, dihilangkan tepi daunnya, dan dipotong-potong dengan ukuran 1-1,5 cm, kemudian diinokulasi pada medium induksi kalus (medium MS dengan penambahan 2,4-D 1 mg/L dan kinetin 1 mg/L). Selanjutnya eksplan diinkubasi selama 4 minggu di dalam ruang steril. Kalus yang terbentuk disubkultur setiap 4 minggu sekali untuk memperbanyak jumlah kalus, untuk pemeliharaan digunakan alkohol 70% dan disemprotkan pada sekitar botol kultur (Sutini, 2009).
3.5.2 Penentuan Kurva Pertumbuhan Saccharomyces cerevisiae
padat, diinkubasi selama 2 hari untuk mendapatkan biakan murni. Biakan murni Saccharomyces cerevisiae usia 2 hari pada media GYE padat diambil sebanyak 2
ose kemudian disuspensi dengan 10 mL NaCl (0,8%) steril. Suspensi Saccharomyces cerevisiae disetarakan dengan larutan Mc. Farlan, selanjutnya
dibuat pengenceran hingga 10-6. Suspensi Saccharomyces cerevisiae diambil sebanyak 0,1 mL dengan menggunakan pipet serologi kemudian dibuat cawan sebar pada media PCA (Plate Count Agar) setiap 2 jam sekali, selama 24 jam dengan masing-masing sebanyak 2 ulangan (duplo). Jumlah koloni yang terbentuk dihitung pada akhir pengamatan. Berdasarkan data pengamatan yang didapat, diketahui waktu yang tepat (fase stasioner) untuk pemanenan dinding sel Saccharomyces cerevisiae (Sitinjak, 2000). Kurva pertumbuhan S. cerevisiae
dapat dilihat pada Lampiran 6, halaman 37.
3.5.3 Penyiapan Elisitor
Saccharomyces cerevisiae hasil biakan murni pada media GYE padat
diinokulasikan sebanyak 2 ose kedalam 4 mL NaCl steril (0,8%),
3.5.4 Elisitasi
Kalus yang dielisitasi merupakan kalus hasil subkultur kedua. Elisitasi dilakukan dengan cara menambahkan 1 ml ekstrak Saccharomyces cerevisiae (konsentrasi yang sudah ditentukan 0; 0,25; 0,50; 1,00; 2,00; 4;00%) kedalam 10 mL medium induksi (medium MS + 1 mg/L 2,4-D + 1 mg/L kinetin) sebagai media perlakuan, perlakuan kontrol ditambahkan akuades steril. Pemanenan dilakukan satu minggu setelah elisitasi. Selanjutnya kalus ditimbang berat basah dan berat keringnya.
3.5.5 Analisis Kandungan Katekin 1. Ekstraksi
Ekstraksi adalah suatu metode pemisahan berdasarkan sifat dua cairan yang tidak saling campur bila ditambahkan zat yang dapat larut dalam keduanya, maka zat tersebut akan terdistribusi dalam kedua sistem dengan perbandingan yang tetap pada suhu tertentu. Ekstraksi kalus dilakukan dengan cara kalus ditimbang sebanyak 0,5 g, dihaluskan dengan menggunakan mortar dan ditambah
akuabides panas dengan suhu 70-80ºC, didiamkan selama ±30 menit. Setelah dingin disaring, lalu dimasukan ke dalam labu ukur 50 mL. Ampas kalus teh dibilas dengan 10 mL air panas sebanyak 2 kali, didiamkan ±30 menit kemudian disaring. Hasil ekstrak kedua dan ketiga dikumpulkan pada labu ukur yang sama, kemudian ditambahkan akuabides sampai 50 mL. Larutan ekstrak teh diambil sebanyak 25 mL kemudian dikocok pelan dengan 25 mL kloroform di dalam corong pisah maka akan terbentuk fase air (diambil lapisan atas), dari fase air yang didapat, diambil sebanyak 25 mL kemudian diekstraksi dengan 25 mL etil asetat sebanyak 3 kali terbentuk fase etil asetat (diambil lapisan bawah). Fase etil asetat dirotarievaporator pada suhu 700C hingga kering, maka akan diperoleh ekstrak katekin dari fraksi etil asetat. Ekstrak katekin dilarutkan dalam 5 mL etanol (Sutini, 2009).
2. Identifikasi Kandungan Katekin dengan HPLC
konsentrasi 50; 100; 150; 200; 250; 300; 350; dan 400 mg/L, masing-masing konsentrasi disuntikkan pada perangkat HPLC sebanyak 100 μL. Optimalisasi perangakat HPLC seperti; suhu 30-350C, panjang gelombang antara 270-280 nm, kecepatan aliran 1 mL/menit. Setelah kondisi optimal, larutan katekin standar disuntikkan pada HPLC sehingga diperoleh kromatogram yang terdiri dari profil puncak komponen sampel (Lampiran 8, halaman 39). Berdasarkan kromatogram tersebut diperoleh data waktu retensi dan luas area (Lampiran 8, halaman 39). Waktu retensi (tR) yaitu waktu yang diperlukan sampel mulai saat disuntikkan hingga keluar dari kolom dengan sinyal yang terdeteksi oleh detektor (Sutini, 2009).
3.6Variabel Pengamatan 3.6.1 Berat Basah Kalus
Berat basah kalus dapat diketahui dengan cara menimbang kalus sebelum dielisitasi dan setelah dielisitasi menggunakan neraca analitik secara aseptis.
3.6.2 Berat Kering Kalus
Berat kering kalus dapat diketahui dengan cara mengeringkan kalus pada akhir penelitian di dalam oven pada suhu 600C hingga beratnya konstan, kemudian kalus ditimbang dengan menggunakan neraca analitik.
3.6.3 Kandungan Katekin
Kandungan katekin pada sampel dapat diketahui setelah kalus kering diekstraksi dan dianalisis kandungannya berdasarkan waktu retensi dan luas area profil kromatogram yang muncul pada instrumen HPLC. Waktu retensi dapat dijadikan sebagai data analisa kualitatif, sedangkan luas area sampel dapat dijadikan sebagai data analisa kuantitatif
3.7 Analisis Data
BAB 4
HASIL DAN PEMBAHASAN
Kandungan katekin dari kalus teh (Camellia sinensis L.) hasil subkultur kedua yang dielisitasi dengan dinding sel Saccharomyces cerevisiae telah diekstraksi. Data terhadap morfologi kalus, berat basah kalus, berat kering kalus, dan kandungan katekin pada kalus telah diperoleh.
4.1 Morfologi Kalus
Potongan daun teh (Camellia sinensis L.) yang digunakan sebagai sumber eksplan ditanam pada medium MS dengan penambahan zat pengatur tumbuh 1 mg/L 2,4-D dan 1 mg/L kinetin. Potongan kalus terlihat mulai menggembung pada usia 5 hari setelah tanam kemudian diikuti dengan pembentukan kalus pada tepi eksplan yang dipotong. Pertumbuhan kalus yang terbentuk pada awalnya sangat lambat. Kalus yang terbentuk berwarna putih dan teksturnya kompak
Gambar 4.1. Kalus Teh: (a) usia 2 minggu, (1) berwarna putih dan teksturnya kompak, (2) sisa eksplan yang menggembung; (b) usia 12 minggu (sebelum dielisitasi), berwarna putih kehijauan dan teksturnya kompak (perbesaran 10x10); (c) usia 13 minggu (setelah dielisitasi), (3) pada bagian yang bersentuhan dengan media dan tepi kalus berwarna coklat, dan teksturnya kompak (perbesaran 10x10).
Berdasarkan Gambar 4.1a di atas dapat dilihat bahwa pertumbuhan kalus pada bagian tepi yang dipotong menunjukkan respon tanaman untuk melindungi diri dari rangsangan yang diberikan, sehingga jaringan membentuk sel-sel baru dan terus mengalami pembelahan tanpa mengalami diferensiasi. Namun pertumbuhan yang terjadi berlangsung lambat. Sedangkan pada Gambar 4.1b dapat dilihat bahwa pertumbuhan kalus hasil subkultur lebih cepat jika dibandingkan dengan pertumbuhan kalus 4 minggu setelah tanam. Pertumbuhan yang cepat disebabkan oleh kalus yang terbentuk sudah mengalami adaptasi dengan medium baru sehingga kalus dapat menyerap nutrisi dengan baik. Perubahan warna pada kalus dapat disebabkan karena kalus dapat memanfaatkan cahaya (lampu) yang diberikan untuk membentuk pigmen hijau. Sedangkan pada kalus hasil elisitasi, terjadi perubahan warna pada bagian permukaan kalus yang bersentuhan langsung dengan media. Hal ini mungkin disebabkan oleh elisitor yang diberikan mempengaruhi sintesis metabolit sekunder pada kalus yang ditandai dengan perubahan warna pada kalus akibat senyawa fenol yang dihasilkan.
Menurut Evans et al. (2003), ketika jaringan tanaman dilukai, kemudian diletakkan di atas media padat yang sesuai, maka kalus akan terbentuk pada
& 2010), pertumbuhan kalus dari eksplan pucuk daun teh menunjukkan pertumbuhan pada usia 1 sampai 3 minggu. Kalus yang terbentuk dari jaringan yang dipotong kemudian melebar hingga seluruh eksplan membentuk kalus. Namun setelah berumur 4 minggu, pertumbuhan kalus sangat lambat. Hal ini disebabkan karena kalus menyesuaikan diri dengan media baru dan kalus masih berada pada fase lag menuju fase linier, dimana pada fase linier kalus mulai memproduksi metabolit sekunder. Kalus sebaiknya disubkultur untuk mencegah kematian sel.
Menurut Pandiangan (2011), faktor lingkungan utama yang mempengaruhi pertumbuhan kalus pada kultur jaringan adalah cahaya dan suhu, sehingga tingkat kelembaban dalam kultur yang tertutup terpelihara. Umumnya kultur disimpan pada suhu ruang 20-250C. Cahaya disuplai dengan lampu neon kira-kira 30-50 µmol/m2/det. Iradiasi ini cukup untuk memberi respon morfologi pada kultur. Menurut Hendaryono dan Wijayanti (1994), warna kalus yang terbentuk dapat disebabkan oleh adanya pengaruh cahaya sehingga terjadi pigmentasi, dan bagian tanaman yang dijadikan sebagai sumber eksplan. Eksplan yang cenderung
berwarna kecoklatan mungkin disebabkan oleh kondisi eksplan yang secara internal mempunyai kandungan fenol tinggi sehingga dengan adanya cahaya akan menyebabkan teroksidasinya fenol menjadi kuinon.
Merurut Hamdiyati (1999) dan Isaac (1992), warna kecoklatan pada kalus menunjukkan terjadinya sintesis metabolit sekunder. Pencoklatan yang terjadi pada kalus selain karena adanya akumulasi fitoalexin, juga disebabkan adanya sintesis senyawa fenolik. Menurut Peltonen et al. (1997), sintesis senyawa fenolik diinduksi karena adanya serangan senyawa mikroorganisme atau kondisi cekaman lainnya. Salah satu senyawa fenolik DHBA (asam 2,3-dihidro benzoaat) dapat terakumulasi dengan cepat, yaitu sekitar 6 jam setelah elisitasi dilakukan.
4.2 Pengaruh Elisitasi Terhadap Peningkatan Berat Basah Kalus
Tabel 4.1 Rata-rata berat basah kalus sebelum dan setelah dielisitasi
Keterangan: Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DNMRT 5% (p < 0,05).
Berdasarkan uji statistik DNMRT 5% pada Tabel 4.1 di atas, terdapat perbedaan berat basah pada setiap perlakuan yang diberikan. Namun pertambahan berat basah rata-rata paling tinggi terdapat pada perlakuan kontrol (tanpa penambahan elisitor) yakni sebesar 0,19 g, sedangkan pertambahan berat basah paling rendah terdapat pada perlakuan elisitor 0,50% yakni sebesar 0,05 g.
Berat basah kalus yang tinggi mungkin disebabkan karena kandungan air yang tinggi pada kalus. Berat basah yang dihasilkan tergantung pada kecepatan sel-sel tersebut membelah diri, dan medium yang digunakan. Adanya 2,4-D dan kinetin, dalam konsentrasi yang tepat pada kultur dapat mempengaruhi berbagai proses fisiologis. Misalnya 2,4-D yang berfungsi untuk proses pembesaran sel, sedangkan kinetin berfungsi untuk proses pembelahan sel.
Menurut Purwianingsih (1997), berat basah secara fisiologis terdiri dari dua kandungan, yaitu kandungan air dan biomassa. Berat basah yang tinggi disebabkan karena kandungan airnya yang tinggi. Menurut Rahayu et al. (2003), berat basah yang dihasilkan sangat tergantung pada kecepatan sel membelah diri, dan dilanjutkan dengan pembesaran kalus.
Menurut Salisbury dan Ross (1995), zat pengatur tumbuh yang diberikan
Menurut Pandiangan (2002), kebanyakan eksplan menghasilkan auksin dan sitokinin endogen. Dalam kultur jaringan, tambahan auksin dan sitokinin eksogen sebagai zat pengatur tumbuh diberikan untuk memperoleh efek pertumbuhan.
4.3 Pengaruh Elisitasi Terhadap Berat Kering Kalus
Berat kering kalus diketahui setelah menimbang kalus pada akhir penelitian dengan menggunakan neraca analitik. Data berat kering kalus pada akhir penelitian digunakan untuk mengetahui pengaruh elisitor yang diberikan terhadap peningkatan biomassa kalus setelah kalus dielisitasi dengan Saccharomyces cerevisiae. Data berat kering kalus dapat dilihat pada Tabel 4.2 dan Lampiran 5,
halaman 36.
Tabel 4.2 Rata-rata berat kering kalus pada akhir penelitian
Perlakuan Rata-rata (g)
Keterangan: Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DNMRT 5% (p < 0,05).
Berdasarkan uji statistik DNMRT 5%, pada Tabel 4.2 di atas terdapat perbedaan berat kering yang nyata pada hampir setiap perlakuan. Hal ini mungkin disebabkan oleh konsentrasi elisitor yang diberikan pada kalus teh berpengaruh terhadap berat kering kalus. Konsentrasi elisitor 2% memberikan pengaruh paling tinggi terhadap berat kering kalus yakni 0,31 g.
mempengaruhi metabolisme senyawa organik seperti protein sehingga bertambahnya sumber tenaga untuk pertumbuhan yang diikuti peningkatan volume sel.
4.4 Kandungan Katekin
4.4.1 Kandungan Katekin Secara Kualitatif
Kandungan katekin secara kualitatif diperoleh dengan membandingkan waktu retensi larutan standar dengan waktu retensi sampel yang dapat dilihat pada Tabel 4.3. Data waktu retensi larutan standar dan sampel dapat dilihat pada Lampiran 7, halaman 38.
Tabel 4.3 Kandungan katekin secara kualitatif
Rata-rata waktu retensi (menit)
Standar katekin 3,349
Sampel katekin 3,415
Berdasarkan Tabel 4.3 di atas dilihat bahwa rata-rata waktu retensi sampel jika dibandingkan dengan waktu retensi standar tidak jauh berbeda. Senyawa katekin standar mempunyai waktu retensi 3,349 sedangkan sampel katekin mempunyai waktu retensi 3,415. Hal ini menunjukkan perlakuan elisitasi dengan penambahan dinding sel Saccharomyces cerevisiae pada kalus teh mengandung
senyawa katekin.
Menurut Sutini (2010), perbedaan waktu retensi antara standar dan sampel katekin dikarenakan kalus diduga mengandung senyawa lain sehingga waktu retensi terdapat perbedaan yang kurang bermakna. Menurut Hamdiyati (1999), ada perbedaan profil kromatogram tidak menutup kemungkinan ada senyawa yang sama karena walau tinggi puncaknya sedikit berbeda. Hal ini mungkin disebabkan dari konsentrasi senyawa yang tidak sama.
4.4.2 Kandungan Katekin Secara Kuantitatif
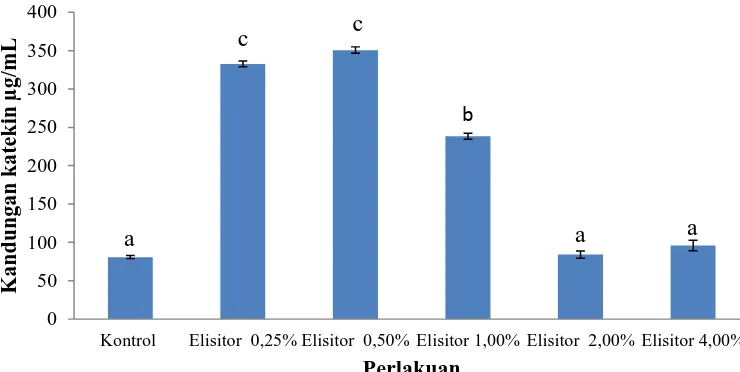
dilihat pada Lampiran 8, halaman 39. Gambar 4.4 di bawah adalah histogram kandungan katekin yang diperoleh setelah kalus dielisitasi.
Gambar 4.2 Kandungan Katekin Secara Kuantitatif
Berdasarkan uji statistik DNMRT 5% dapat diketahui bahwa pemberian elisitor pada kalus yang dielisitasi rata-rata memberikan pengaruh terhadap
peningkatan kandungan katekin yang diperoleh, jika dibandingkan dengan kontrol. Kandungan katekin paling tinggi terdapat pada perlakuan dengan elisitor 0,50% yakni 2,105 mg/g BK. Sedangkan pada perlakuan kontrol (tanpa pemberian elisitor), kandungan katekin yang dihasilkan 0,485 mg/g BK.
Peningkatan kandungan katekin setelah diberi elisitor dinding sel Saccharomyces cerevisiae diduga karena terinduksinya serangkaian proses
metabolisme metabolit sekunder yang mengarah pada akumulasi katekin.
Menurut Purkayastha (1996), tumbuhan mampu menghasilkan senyawa fitoalexin sebagai respon untuk melindungi diri. Penggunaan dinding sel jamur pada kultur jaringan dapat menginduksi tanaman untuk membentuk beberapa enzim untuk pembentukan fitoalexin. Menurut Punyasiri et al. (2004), adanya aktivitas enzim anthocyanidin reduktase, dihydroflavonol 4-reduktase, dan leucoanthocyanidin 4-reduktase pada teh akan mempengaruhi biosintesis flavonoid katekin dan epigallokatekin dalam teh.
Menurut Pandiangan (2011) dan Buitelaar (1991), beberapa faktor yang mempengaruhi kandungan metabolit sekunder dalam kultur yang dielisitasi antara
0
Kontrol Elisitor 0,25% Elisitor 0,50% Elisitor 1,00% Elisitor 2,00% Elisitor 4,00%
lain: konsentrasi elisitor, jenis elisitor, waktu kontak elisitor dengan sel, galur eksplan yang digunakan, waktu penambahan elisitor, fase pertumbuhan sel dalam kultur, dan nutrien yang digunakan di dalam medium. Menurut Ratnasari et al. (2001), konsentrasi elisitor dan waktu pemanenan berpengaruh terhadap post binding effect yaitu proses yang diawali dengan berikatannya elisitor dan reseptor
sehingga dapat menginduksi pembentukan metabolit sekunder. Pada penelitian yang telah dilakukan Ratnasari et al. elisitasi dengan menggunakan dinding sel Saccharomyces cerevisiae 0,5% dan waktu pemanenan 24 jam dapat
meningkatkan produksi ajmalisin dengan presentase peningkatan tertinggi yaitu 216, 508%.
Menurut Ali et al. (2007), adanya elisitor yang bersentuhan dengan dinding sel tumbuhan akan ditangkap oleh reseptor pada membran plasma, kemudian akan merubah potensial plasma membran yang mengaktivasi NADPH oksidase untuk merespon reaktif oxygen spesies (ROS) yang akan menghasilkan anion superoksida dan H2O2 yang bertindak sebagai second messenger yang
membawa sinyal ke inti sel sehingga menghasilkan gen pertahanan, meningkatkan
respon biosintesis metabolit sekunder protease inhibitor dan protein prolin.
Menurut Hahn (1996), sisi aktif dari elisitor glukan ragi adalah 1,6 β-D glukopiranosil. Glukan dari ekstrak ragi secara alami diperkirakan mempunyai binding site yang sesuai dengan reseptor yang terdapat pada permukan sel
tumbuhan. Menurut Hamdiyati (1999), homogenat jamur yang sudah diotoklaf apabila digunakan sebagai bahan elisitor, maka respon sel tumbuhan terhadap elisitor berhubungan langsung dengan komposisi dari dinding sel jamur.
Gambar 4.3 Kurva Hubungan Peningkatan Berat Basah Kalus dengan Produksi Katekin
Berdasarkan Gambar 4.5 di atas, dapat dilihat bahwa seiring dengan peningkatan kandungan katekin yang dihasilkan, berat basah kalus menurun. Pada penelitian ini, perlakuan elisitor 0,50% merupakan perlakuan paling baik dalam meningkatkan kandungkan katekin jika dibandingkan dengan perlakuan lain, karena dapat mengahasilkan kandungan katekin paling tinggi yakni: 2,105
mg/g BK dan pada perlakuan tersebut berat basah kalus yang dihasilkan paling rendah. Sedangkan pada perlakuan elisitor 1,00% kandungan katekin yang dihasilkan mulai menurun, dan berat basah kalus mulai meningkat.
Menurut Zakaria (2010), berat basah kalus tergantung pada kandungan air dalam kalus. Perbedaan berat basah antar kalus disebabkan oleh perbedaan komponen tiap jaringan dalam menyimpan air dan unsur hara, dalam hal ini meliputi difusi, osmosis dan tekanan turgor sel.
Menurut Hamdiyati (1999) dan Moreno (1994), terhambatnya pertumbuhan kalus disebabkan kalus memanfaatkan prekursor untuk mensintesis metabolit sekunder sebagai respon terhadap cekaman yang diberikan. Di dalam sel terjadi persaingan antara jalur metabolisme primer dan sekunder, sehingga apabila jalur metabolisme sekunder aktif, maka jalur metabolisme primer akan terhambat.
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Adapun kesimpulan yang diperoleh dari penelitian ini adalah:
a. Perlakuan kontrol (medium Murashige & Skoog ditambah ZPT 1 mg/L 2,4-D dan 1 mg/L kinetin) memberikan pengaruh paling baik terhadap peningkatan berat basah kultur in vitro kalus teh (Camellia sinensis L.) dengan rata-rata peningkatan berat basah 0,19 g.
b. Peningkatan konsentrasi elisitor dinding sel Saccharomyces cerevisiae cenderung menyebabkan peningkatan berat kering kalus teh.
c. Konsentrasi elisitor dinding sel Saccharomyces cerevisiae 0,50% merupakan konsentrasi elisitor yang paling baik dalam meningkatkan produksi katekin pada kultur kalus teh.
d. Kandungan katekin tertingi 2,105 mg/g BK atau meningkat 4 kali
dibandingkan perlakuan kontrol.
5.2 Saran
BAB 2
TINJAUAN PUSTAKA
2.1Teh (Camellia sinensis L.)
Kata teh berasal dari Cina. Masyarakat Cina daerah Amoy menyebut teh dengan tay sementara masyarakat daerah Kanton menyebutnya cha. Orang Inggris
menyebutnya tea, di daerah Spanyol diucapkan te, dan di Jerman teh disebut dengan tee. Tanaman teh (Camellia sinensis L.) tumbuh dengan baik pada kondisi beriklim hangat dan lembab dengan curah hujan yang cukup tinggi dan juga terdapat banyak paparan sinar matahari, tanah berasam rendah serta drainasi tanah yang baik. Teh dapat tumbuh dengan optimum di daerah pegunungan beriklim sejuk dengan ketinggian lebih dari 1800 meter di atas permukaan laut (Nurunisa, 2011).
Teh merupakan minuman yang sangat bermanfaat bagi kesehatan tubuh. Teh akan meningkatkan sistem pertahanan biologis tubuh terhadap kanker,
membantu penyembuhan penyakit (misalnya mencegah peningkatan kolesterol darah), dapat mengatur gerak fisik tubuh dengan mengaktifkan sistem saraf, dan menghambat proses penuaan karena adanya senyawa katekin yang merupakan antioksidan (Bambang, 2006).
Menurut Harold dan Graham (1992), di dalam teh hijau terkandung komponen-komponen seperti: kafein, epikatekin, epikatekin galat, epigalokatekin, epigalokatekin galat, flavonol, theanin, asam glutamat, asam aspartat, arginin, gula, dan kalium. Berdasarkan potensi aktivitas kesehatan yang paling baik, teh hijau lebih baik dibandingkan dengan jenis lainnya.
2.2Kultur In Vitro Kalus
Kultur jaringan adalah istilah umum yang ditunjukkan pada budidaya secara in vitro terhadap bagian tanaman yang meliputi batang, daun, akar, bunga, kalus, sel,
Menurut Zulkarnain (2009), kultur in vitro memiliki peranan yang penting untuk mendapatkan hasil-hasil yang tidak mungkin dicapai melalui kultur in vivo. Menurut Watimena (1992), teknik kultur in vitro mempunyai keuntungan dalam produksi metabolit sekunder jika dibandingkan dengan tanaman utuh karena kecepatan pertumbuhan sel dan biosintesis dalam kultur yang diinisiasi dari eksplan sangat tinggi dalam periode yang sangat singkat, dan lebih ekonomis. Menurut Sutini (2009), penggunaan kultur in vitro tanaman yang dipelihara di bawah kondisi lingkungan, nutrisi, dan zat pengatur tumbuh yang terkontrol akan menghasilkan metabolit secara kontinyu.
Kalus adalah kumpulan sel-sel yang terbentuk dari sel-sel parenkim yang membelah secara terus menerus dan tidak berdifferensiasi, yang ditumbuhkan dalam keadaan steril pada suatu media buatan, dengan penambahan nutrisi sehingga sel-selnya mampu tumbuh dan mengadakan pembelahan menjadi massa sel yang tidak terdeferensiasi yang disebut kalus (Sutini, 2009). Adapun beberapa tujuan dari kultur kalus antara lain: perbanyakan tanaman melalui pembentukan organ dan embrio, regenerasi varian genetika, mendapatkan tanaman bebas virus,
sebagai sumber untuk produksi protoplas, sebagai bahan awal untuk kreopreservasi, menghasilkan produk metabolit sekunder, dan biotransformasi (Zulkarnain, 2009).
2.3Metabolit Sekunder
Semua makhluk hidup bereproduksi dan perlu melakukan sejumlah transformasi senyawa organik agar dapat melangsungkan kehidupan. Proses transformasi senyawa organik tersebut dilakukan melalui sistem yang terdiri dari reaksi-reaksi kimia beraturan yang dikatalisis dan dikontrol ketat oleh sistem enzimatik dan melibatkan jalur metabolik. Sedangkan senyawa-senyawa organik yang dihasilkan dan terlibat dalam metabolisme disebut sebagai metabolit. Metabolit sekunder merupakan suatu hasil dari proses metabolisme sekunder dimana terjadi metabolisme dengan melibatkan senyawa organik dan spesifik yang terbatas di alam (Sudibyo, 2002).
dan internal. Optimasi faktor tersebut dapat dilakukan dalam dua tahap yaitu tahap pertumbuhan dan tahap produksi. Pada tahap pertumbuhan, kondisi kultur diarahkan untuk memproduksi biomassa sel, sedangkan pada tahap produksi dilakukan pemindahan biomassa sel ke dalam medium produksi dengan tujuan pengkondisian kultur untuk memproduksi metabolit sekunder (Hamdiyati, 1999).
Mantell dan Smith (1983), menjelaskan beberapa faktor yang dapat mempengaruhi akumulasi metabolit sekunder pada kultur in vitro, yaitu:
1. Kondisi Kultur Eksternal (a) Cahaya
Fotoperioditas, kualitas, dan intensitas cahaya dapat mempengaruhi produksi metabolit sekunder secara in vitro. Sebagai contoh, produksi nikotin pada kultur kalus N. tabaccum yang disimpan pada kondisi gelap dapat mengakumulasi nikotin dengan konsentrasi tinggi.
(b) Suhu
Produksi metabolit sekunder dapat dipengaruhi suhu. Sebagai contoh, produksi alkaloid pada kultur kalus Peganum maksimum pada suhu 250C.
(c) Agitasi Kultur
Kecepatan agitasi kultur berpengauh pada pertumbuhan dan akumulasi metabolit sekunder dalam kultur. Sebagai contoh, produksi nikotin pada kultur kalus N. tabaccum maksimum pada 150 rpm.
2. Kondisi kultur Internal (a) Zat pengatur tumbuh
Jenis dan konsentrasi yang tepat dari zat pengatur tumbuh dapat mempengaruhi biosintesis metabolit sekunder. Sebagai contoh, penggunaan 2,4-D pada kultur sel Daucus penambahan 10 mg/L 2,4-D dapat menginduksi sintesis karotenoid dan
ubiquinone hingga maksimum. (b) Makro dan mikro nutrien
(c) Sumber karbon
Sukrosa merupakan salah satu sumber karbon yang banyak digunakan dalam medium kultur. Sebagai contoh, konsentrasi sukrosa 30 g/L dalam kultur suspensi S. aviculare dapat menghambat produksi solasodin.
(d) pH medium
pH medium dapat mempengaruhi sintesis metabolit sekunder pada kultur jaringan tumbuhan. Pertumbuhan optimum kultur sel tumbuhan biasanya terjadi pada pH 5-6.
(e) Prekursor (prazat)
Pemberian prazat ke dalam medium kultur dapat meningkatkan produksi metabolit sekunder. Sebagai contoh, penambahan 500 mg/L fenilalanin pada kultur kalus Coleus blumei dapat meningkatkan asam rosmarinik hingga 100%. (f) Elisitasi
Elisitasi merupakan proses penambahan elisitor pada sel tumbuhan dengan tujuan untuk menginduksi dan meningkatkan pembentukan metabolit sekunder. Sebagai contoh, produksi ajmalisin pada kultur suspensi sel C. roseus dapat ditingkatkan
sebanyak 60% setelah diberi homogenat jamur Phytopthora cactorum yang sudah diotoklaf.
Prekursor biosintesis metabolit sekunder didapatkan dari proses metabolisme primer. Struktur dan jumlah prekursor menentukan kerangka metabolit sekunder yang terbentuk. Pada umumnya struktur metabolit sekunder berupa makromolekul yang terdiri dari tiga senyawa utama seperti: asetat, sikamat dan mevalonat dan beberapa asam amino seperti ornitin dan lisin (Dewick, 1999).
2.4Senyawa Polifenol Katekin
Teh (Camellia sinensis L.) diantaranya mengandung komponen bioaktif polifenol, berperan besar dalam pencegahan berbagai macam penyakit, mencegah radikal bebas yang dapat merusak sel dan menghentikan perkembangan sel-sel liar yang akan berkembang menjadi kanker dan meningkatkan sistem imun sehingga teh dapat dikategorikan sebagai minuman fungsional karena mengandung senyawa aktif yaitu polifenol yang mampu berperan sebagai antioksidan alami, menjaga tubuh dari serangan radikal bebas (Sutini, 2009).
Katekin merupakan salah satu senyawa turunan polifenol yang dikenal memiliki aktivitas biomedisin. Katekin memiliki sifat kelarutan yang rendah dalam air dan tidak stabil. Namun, sintesis senyawa katekin memiliki potensi tinggi untuk diuji dan dimanfaatkan, diantaranya dapat dimanfaatkan sebagai senyawa antioksidan, antibakteri, dan antitumor yang menarik perhatian ilmuwan (Yanuar, 2001).
Menurut Yanuar (2001), secara umum katekin terdapat dalam bentuk tanin terkondensasi yang banyak ditemukan pada teh hijau. Teh hijau mengandung polifenol kurang lebih 30-40% dari berat kering total daun teh yang belum
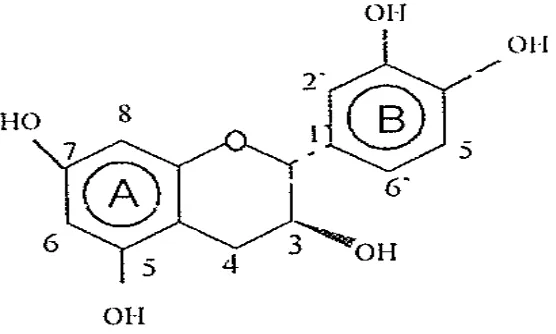
mengalami proses fermentasi. Menurut Alamsyah (2006), teh hijau mengandung katekin 3,3-8,294 mg/ 100 g. Ekstrak teh hijau dalam air hanya mengandung sekitar 0,5% katekin karena katekin segera larut dalam air apabila terdapat dalam bentuk glikosida. Adapun struktur kimia katekin dapat dilihat pada Gambar 2.1.dibawah ini:
2.5 Pola Hubungan Pertumbuhan dengan Produksi Metabolit Sekunder Barz et al. (1977), hubungan pertumbuhan dengan produksi metabolit sekunder dapat dikelompokkan menjadi 5 pola, yaitu:
1. Produksi metabolit sekunder terjadi pada fase lag, misalnya produksi antrakuinon pada kultur suspensi sel M. citrifolia.
2. Produksi metabolit sekunder terjadi pada fase akselerasi, misalnya produksi asam sinamat pada kultur suspensi sel Daucus carota.
3. Produksi metabolit sekunder sejajar dengan pertumbuhan sel, misalnya produksi serpentin pada kultur suspensi sel Catharanthus.
4. Produksi metabolit sekunder terjadi setelah sel memasuki fase stasioner, misalnya produksi shikonin pada kultur suspensi sel Lithospermum.
5. Produksi metabolit sekunder berlawanan dari pertumbuhan sel, misalnya produksi diosgenin pada kultur Dioscorea.
2.6 Elisitasi
Elisitasi adalah teknik pemberian materi abiotik maupun biotik ke dalam
sel tumbuhan sehingga produksi metabolit sekunder pada tumbuhan meningkat sebagai respon tumbuhan dalam mempertahankan diri. Menurut Namde (2007), elisitor abiotik merupakan substansi tidak hidup seperti garam anorganik, faktor fisik seperti sinar UV, pembekuan, pemberian komponen nonessensial seperti agarose, pemberian senyawa-senyawa kimia yang dapat mempengaruhi afinitas DNA, detergen seperti xenobiokimia, fungisida seperti butylamine benomyl, fungisida seperti acifluorofen, ion logam Cu, Cd, Ca, dan konsentrasi pH yang tinggi yang dapat diberikan kepada tumbuhan secara eksogen. Sedangkan elisitor biotik seperti jamur, bakteri baik berupa enzim maupun fragmentasi dari dinding sel mikroorganisme (kitosan dan glukan).
Elisitasi merupakan teknik untuk merangsang pembentukan fitoaleksin dan meningkatkan produksi metabolit sekunder yang terakumulasi akibat cekaman. Substansi yang dapat dijadikan sebagai elisitor dapat berupa mikroorganisme patogen, zat pengatur tumbuh (ZPT), cahaya, temperatur, prekursor, dan kondisi nutrien pada medium apabila diberikan pada konsentrasi yang sedikit pada sel hidup akan menginisiasi pembentukan komponen yang spesifik (Ariningsih dan Anggarwulan, 2002 dan Namde, 2007).
2.6 Saccharomyces cerevisiae
Saccharomyces cerevisiae (yeast) merupakan organisme uniseluler yang
umumnya memperbanyak diri dengan pembentukan tunas (budding) dan bersifat nonpatogen. Pada umumnya yeast berbentuk bulat telur dan memanjang, tidak mempunyai alat gerak, dengan ukuran lebar antara 1-5 µm, sedangkan panjang antara 3-30 µm. Yeast bersifat anaerob fakultatif, artinya dapat hidup dalam keadaan aerorb maupun anaerob. Suhu optimum pertumbuhannya yaitu 300C (Zahara, 2011).
Dinding sel ragi atau khamir secara umum memiliki 4 fungsi utama antara lain: (1) menstabilkan tekanan osmotik di dalam sel, (2) melindungi sel dari tekanan luar, (3) memberi bentuk pada sel, (4) dan mensekresikan protein yang digunakan untuk metabolisme ekstraseluler. Sekitar 10-25% dari total berat kering merupakan dinding sel yang terdiri dari membran dalam berupa polisakarida untuk melindungi cairan dalam sel dan membran luar berupa manno-protein untuk melekat pada media (Klis et al., 2005). Ekstrak khamir digunakan sebagai elisitor pada saat biomassanya mencapai maksimum, dengan harapan bahwa derivat dinding sel khamir yang berupa glukan, kualitas dan kuantitasnya telah mencapai optimum. Komponen yang akan digunakan sebagai elisitor adalah komponen dinding sel Saccharomyces cerevisiae yang diperkirakan berupa glukan. Sisi aktif nya berupa 1,6 β-D glukopiranosil. Glukan dari ekstrak Saccharomyces cerevisiae secara alami diperkirakan mempunyai binding site
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Jumlah tumbuhan berkhasiat obat di Indonesia diperkirakan sekitar 1.260 jenis tumbuhan. Tumbuhan menghasilkan metabolit sekunder yang berpotensi sebagai antioksidan, zat perwarna, penambah aroma makanan, parfum, insektisida dan obat. Ada sekitar 150.000 metabolit sekunder yang sudah diidentifikasi dan sekitar 4.000 jenis metabolit sekunder baru yang teridentifikasi setiap tahunnya (Yuhernita & Juniarti, 2011).
Kandungan metabolit sekunder pada tanaman utuh masih sangat rendah yakni rata-rata sekitar 3-30% dari total berat kering tanaman utuh, sedangkan kebutuhan akan senyawa metabolit sekunder cukup tinggi. Misalnya pada Catharanthus roseus, kandungan vinblastin hanya 3 gram/ton atau sekitar
0,0003% per BK (Nicolos, 1994), shikonin pada kultur suspensi sel Lithospermum
erythorhizon sekitar 20% sedangkan di dalam tanaman utuh 1,5%, ginsenoside
pada kultur kalus Panax ginseng 27% sedangkan di dalam tanaman utuh 4,5% (Missawa, 1994).
Salah satu metabolit sekunder yang saat ini sangat dibutuhkan adalah katekin. Katekin merupakan senyawa dominan dari teh, suatu turunan tanin terkondensasi yang juga dikenal sebagai senyawa polifenol karena banyaknya gugus fungsional hidroksil yang dimilikinya. Katekin berfungsi sebagai senyawa antioksidan, antibakteri, dapat menurunkan kolesterol dan LDL, antidiabetes, dan dapat membantu pencernaan (Mondal et al., 2004).
Selain masih sangat rendahnya kandungan metabolit sekunder dalam tanaman utuh, adanya beberapa kendala seperti: ketersediaan tanaman yang dipengaruhi musim, lahan yang dibutuhkan luas, pemeliharaan tanaman secara intensif seperti penyiangan, pemangkasan, pemberantasan gulma dan penyakit menjadi alasan mengapa produksi metabolit sekunder tanaman perlu ditingkatkan (Setiti, 2000). Produksi metabolit sekunder melalui kultur in vitro merupakan pilihan yang mempunyai harapan dibandingkan dengan produksi tanaman utuh. Alasan penggunaan kultur in vitro yang berbentuk kalus untuk memproduksi metabolit sekunder diantaranya: (a) jaringan kalus tidak terorganisasi, (b) dapat digunakan pada kegiatan kultur selanjutnya tanpa harus menginisiasi ulang, (c) dapat disimpan pada keadaan tertentu/sesuai kebutuhan, dan (d) pembelahan sel terus menerus terjadi sehingga berpotensi tinggi untuk diproduksi metabolit sekundernya (Sutini, 2009).
Saat ini metode yang paling banyak dikembangkan untuk memproduksi metabolit sekunder adalah metode elisitasi. Elisitasi adalah metode yang digunakan untuk menginduksi pembentukan suatu fitoalexin atau metabolit
sekunder lain yang secara normal tidak terakumulasi. Elisitasi dapat dilakukan dengan menambahkan elisitor abiotik maupun biotik pada medium. Elisitor biotik dapat berupa fungi atau ragi (Purwianingsih, 1997).
Banyak penelitian tentang elisitasi yang telah berhasil meningkatkan kandungan bioaktif tumbuhan dengan menggunakan elisitor ragi, terutama Saccharomyces cerevisiae. Antosianin dalam kultur sel Daucus carota berhasil
ditingkatkan kadarnya sebesar 58% dengan menggunakan ekstrak sel Saccharomyces cerevisiae (Survalatha et al., 1994). Penelitian lain menunjukkan
bahwa fraksi karbohidrat dari ekstrak Saccharomyces cerevisiae juga dapat menginduksi sintesis gliseolin sampai 200 µg dalam kultur sel Glycine max dan meningkatkan biosintesis barberin hingga 4 kali lipat pada kultur Thalictrum rugosum (Funk et al., 1997). Sedangkan pada tanaman teh belum ada informasi
1.2Pemasalahan
Produksi katekin pada kultur jaringan teh masih sangat rendah, kandungan katekin yang dihasilkan sekitar 3,3-8,294 mg/100 g BK pada tanaman utuh, sedangkan pada kultur in vitro sekitar 0,45 µg/mL sehingga perlu dilakukan elisitasi untuk meningkatkan kandungan katekin pada teh. Elisitasi merupakan proses penambahan elisitor pada sel tumbuhan dengan tujuan untuk menginduksi dan meningkatkan pembentukan metabolit sekunder atau fitoaleksin yang terbentuk akibat pemberian cekaman. Selain itu, sampai saat ini belum ada informasi mengenai konsentrasi elisitor Saccharomyces cerevisiae yang dapat meningkatkan produksi metabolit sekunder katekin pada kultur kalus teh (Camellia sinensis L.).
1.3Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui konsentrasi dinding sel Saccharomyces cerevisiae yang dapat meningkatkan produksi katekin pada kultur
kalus teh (Camellia sinensis L.) secara in vitro.
1.4Hipotesis
Penambahan ekstrak dinding sel Saccharomyces cerevisiae dapat meningkatkan produksi katekin pada kultur kalus teh (Camellia sinensis L.).
1.5Manfaat
BAB 2
TINJAUAN PUSTAKA
2.1Teh (Camellia sinensis L.)
Kata teh berasal dari Cina. Masyarakat Cina daerah Amoy menyebut teh dengan tay sementara masyarakat daerah Kanton menyebutnya cha. Orang Inggris
menyebutnya tea, di daerah Spanyol diucapkan te, dan di Jerman teh disebut dengan tee. Tanaman teh (Camellia sinensis L.) tumbuh dengan baik pada kondisi beriklim hangat dan lembab dengan curah hujan yang cukup tinggi dan juga terdapat banyak paparan sinar matahari, tanah berasam rendah serta drainasi tanah yang baik. Teh dapat tumbuh dengan optimum di daerah pegunungan beriklim sejuk dengan ketinggian lebih dari 1800 meter di atas permukaan laut (Nurunisa, 2011).
Teh merupakan minuman yang sangat bermanfaat bagi kesehatan tubuh. Teh akan meningkatkan sistem pertahanan biologis tubuh terhadap kanker,
membantu penyembuhan penyakit (misalnya mencegah peningkatan kolesterol darah), dapat mengatur gerak fisik tubuh dengan mengaktifkan sistem saraf, dan menghambat proses penuaan karena adanya senyawa katekin yang merupakan antioksidan (Bambang, 2006).
Menurut Harold dan Graham (1992), di dalam teh hijau terkandung komponen-komponen seperti: kafein, epikatekin, epikatekin galat, epigalokatekin, epigalokatekin galat, flavonol, theanin, asam glutamat, asam aspartat, arginin, gula, dan kalium. Berdasarkan potensi aktivitas kesehatan yang paling baik, teh hijau lebih baik dibandingkan dengan jenis lainnya.
2.2Kultur In Vitro Kalus
Kultur jaringan adalah istilah umum yang ditunjukkan pada budidaya secara in vitro terhadap bagian tanaman yang meliputi batang, daun, akar, bunga, kalus, sel,
Menurut Zulkarnain (2009), kultur in vitro memiliki peranan yang penting untuk mendapatkan hasil-hasil yang tidak mungkin dicapai melalui kultur in vivo. Menurut Watimena (1992), teknik kultur in vitro mempunyai keuntungan dalam produksi metabolit sekunder jika dibandingkan dengan tanaman utuh karena kecepatan pertumbuhan sel dan biosintesis dalam kultur yang diinisiasi dari eksplan sangat tinggi dalam periode yang sangat singkat, dan lebih ekonomis. Menurut Sutini (2009), penggunaan kultur in vitro tanaman yang dipelihara di bawah kondisi lingkungan, nutrisi, dan zat pengatur tumbuh yang terkontrol akan menghasilkan metabolit secara kontinyu.
Kalus adalah kumpulan sel-sel yang terbentuk dari sel-sel parenkim yang membelah secara terus menerus dan tidak berdifferensiasi, yang ditumbuhkan dalam keadaan steril pada suatu media buatan, dengan penambahan nutrisi sehingga sel-selnya mampu tumbuh dan mengadakan pembelahan menjadi massa sel yang tidak terdeferensiasi yang disebut kalus (Sutini, 2009). Adapun beberapa tujuan dari kultur kalus antara lain: perbanyakan tanaman melalui pembentukan organ dan embrio, regenerasi varian genetika, mendapatkan tanaman bebas virus,
sebagai sumber untuk produksi protoplas, sebagai bahan awal untuk kreopreservasi, menghasilkan produk metabolit sekunder, dan biotransformasi (Zulkarnain, 2009).
2.3Metabolit Sekunder
Semua makhluk hidup bereproduksi dan perlu melakukan sejumlah transformasi senyawa organik agar dapat melangsungkan kehidupan. Proses transformasi senyawa organik tersebut dilakukan melalui sistem yang terdiri dari reaksi-reaksi kimia beraturan yang dikatalisis dan dikontrol ketat oleh sistem enzimatik dan melibatkan jalur metabolik. Sedangkan senyawa-senyawa organik yang dihasilkan dan terlibat dalam metabolisme disebut sebagai metabolit. Metabolit sekunder merupakan suatu hasil dari proses metabolisme sekunder dimana terjadi metabolisme dengan melibatkan senyawa organik dan spesifik yang terbatas di alam (Sudibyo, 2002).
dan internal. Optimasi faktor tersebut dapat dilakukan dalam dua tahap yaitu tahap pertumbuhan dan tahap produksi. Pada tahap pertumbuhan, kondisi kultur diarahkan untuk memproduksi biomassa sel, sedangkan pada tahap produksi dilakukan pemindahan biomassa sel ke dalam medium produksi dengan tujuan pengkondisian kultur untuk memproduksi metabolit sekunder (Hamdiyati, 1999).
Mantell dan Smith (1983), menjelaskan beberapa faktor yang dapat mempengaruhi akumulasi metabolit sekunder pada kultur in vitro, yaitu:
1. Kondisi Kultur Eksternal (a) Cahaya
Fotoperioditas, kualitas, dan intensitas cahaya dapat mempengaruhi produksi metabolit sekunder secara in vitro. Sebagai contoh, produksi nikotin pada kultur kalus N. tabaccum yang disimpan pada kondisi gelap dapat mengakumulasi nikotin dengan konsentrasi tinggi.
(b) Suhu
Produksi metabolit sekunder dapat dipengaruhi suhu. Sebagai contoh, produksi alkaloid pada kultur kalus Peganum maksimum pada suhu 250C.
(c) Agitasi Kultur
Kecepatan agitasi kultur berpengauh pada pertumbuhan dan akumulasi metabolit sekunder dalam kultur. Sebagai contoh, produksi nikotin pada kultur kalus N. tabaccum maksimum pada 150 rpm.
2. Kondisi kultur Internal (a) Zat pengatur tumbuh
Jenis dan konsentrasi yang tepat dari zat pengatur tumbuh dapat mempengaruhi biosintesis metabolit sekunder. Sebagai contoh, penggunaan 2,4-D pada kultur sel Daucus penambahan 10 mg/L 2,4-D dapat menginduksi sintesis karotenoid dan
ubiquinone hingga maksimum. (b) Makro dan mikro nutrien
(c) Sumber karbon
Sukrosa merupakan salah satu sumber karbon yang banyak digunakan dalam medium kultur. Sebagai contoh, konsentrasi sukrosa 30 g/L dalam kultur suspensi S. aviculare dapat menghambat produksi solasodin.
(d) pH medium
pH medium dapat mempengaruhi sintesis metabolit sekunder pada kultur jaringan tumbuhan. Pertumbuhan optimum kultur sel tumbuhan biasanya terjadi pada pH 5-6.
(e) Prekursor (prazat)
Pemberian prazat ke dalam medium kultur dapat meningkatkan produksi metabolit sekunder. Sebagai contoh, penambahan 500 mg/L fenilalanin pada kultur kalus Coleus blumei dapat meningkatkan asam rosmarinik hingga 100%. (f) Elisitasi
Elisitasi merupakan proses penambahan elisitor pada sel tumbuhan dengan tujuan untuk menginduksi dan meningkatkan pembentukan metabolit sekunder. Sebagai contoh, produksi ajmalisin pada kultur suspensi sel C. roseus dapat ditingkatkan
sebanyak 60% setelah diberi homogenat jamur Phytopthora cactorum yang sudah diotoklaf.
Prekursor biosintesis metabolit sekunder didapatkan dari proses metabolisme primer. Struktur dan jumlah prekursor menentukan kerangka metabolit sekunder yang terbentuk. Pada umumnya struktur metabolit sekunder berupa makromolekul yang terdiri dari tiga senyawa utama seperti: asetat, sikamat dan mevalonat dan beberapa asam amino seperti ornitin dan lisin (Dewick, 1999).
2.4Senyawa Polifenol Katekin
Teh (Camellia sinensis L.) diantaranya mengandung komponen bioaktif polifenol, berperan besar dalam pencegahan berbagai macam penyakit, mencegah radikal bebas yang dapat merusak sel dan menghentikan perkembangan sel-sel liar yang akan berkembang menjadi kanker dan meningkatkan sistem imun sehingga teh dapat dikategorikan sebagai minuman fungsional karena mengandung senyawa aktif yaitu polifenol yang mampu berperan sebagai antioksidan alami, menjaga tubuh dari serangan radikal bebas (Sutini, 2009).
Katekin merupakan salah satu senyawa turunan polifenol yang dikenal memiliki aktivitas biomedisin. Katekin memiliki sifat kelarutan yang rendah dalam air dan tidak stabil. Namun, sintesis senyawa katekin memiliki potensi tinggi untuk diuji dan dimanfaatkan, diantaranya dapat dimanfaatkan sebagai senyawa antioksidan, antibakteri, dan antitumor yang menarik perhatian ilmuwan (Yanuar, 2001).
Menurut Yanuar (2001), secara umum katekin terdapat dalam bentuk tanin terkondensasi yang banyak ditemukan pada teh hijau. Teh hijau mengandung polifenol kurang lebih 30-40% dari berat kering total daun teh yang belum
mengalami proses fermentasi. Menurut Alamsyah (2006), teh hijau mengandung katekin 3,3-8,294 mg/ 100 g. Ekstrak teh hijau dalam air hanya mengandung sekitar 0,5% katekin karena katekin segera larut dalam air apabila terdapat dalam bentuk glikosida. Adapun struktur kimia katekin dapat dilihat pada Gambar 2.1.dibawah ini:
2.5 Pola Hubungan Pertumbuhan dengan Produksi Metabolit Sekunder Barz et al. (1977), hubungan pertumbuhan dengan produksi metabolit sekunder dapat dikelompokkan menjadi 5 pola, yaitu:
1. Produksi metabolit sekunder terjadi pada fase lag, misalnya produksi antrakuinon pada kultur suspensi sel M. citrifolia.
2. Produksi metabolit sekunder terjadi pada fase akselerasi, misalnya produksi asam sinamat pada kultur suspensi sel Daucus carota.
3. Produksi metabolit sekunder sejajar dengan pertumbuhan sel, misalnya produksi serpentin pada kultur suspensi sel Catharanthus.
4. Produksi metabolit sekunder terjadi setelah sel memasuki fase stasioner, misalnya produksi shikonin pada kultur suspensi sel Lithospermum.
5. Produksi metabolit sekunder berlawanan dari pertumbuhan sel, misalnya produksi diosgenin pada kultur Dioscorea.
2.6 Elisitasi
Elisitasi adalah teknik pemberian materi abiotik maupun biotik ke dalam
sel tumbuhan sehingga produksi metabolit sekunder pada tumbuhan meningkat sebagai respon tumbuhan dalam mempertahankan diri. Menurut Namde (2007), elisitor abiotik merupakan substansi tidak hidup seperti garam anorganik, faktor fisik seperti sinar UV, pembekuan, pemberian komponen nonessensial seperti agarose, pemberian senyawa-senyawa kimia yang dapat mempengaruhi afinitas DNA, detergen seperti xenobiokimia, fungisida seperti butylamine benomyl, fungisida seperti acifluorofen, ion logam Cu, Cd, Ca, dan konsentrasi pH yang tinggi yang dapat diberikan kepada tumbuhan secara eksogen. Sedangkan elisitor biotik seperti jamur, bakteri baik berupa enzim maupun fragmentasi dari dinding sel mikroorganisme (kitosan dan glukan).
Elisitasi merupakan teknik untuk merangsang pembentukan fitoaleksin dan meningkatkan produksi metabolit sekunder yang terakumulasi akibat cekaman. Substansi yang dapat dijadikan sebagai elisitor dapat berupa mikroorganisme patogen, zat pengatur tumbuh (ZPT), cahaya, temperatur, prekursor, dan kondisi nutrien pada medium apabila diberikan pada konsentrasi yang sedikit pada sel hidup akan menginisiasi pembentukan komponen yang spesifik (Ariningsih dan Anggarwulan, 2002 dan Namde, 2007).
2.6 Saccharomyces cerevisiae
Saccharomyces cerevisiae (yeast) merupakan organisme uniseluler yang
umumnya memperbanyak diri dengan pembentukan tunas (budding) dan bersifat nonpatogen. Pada umumnya yeast berbentuk bulat telur dan memanjang, tidak mempunyai alat gerak, dengan ukuran lebar antara 1-5 µm, sedangkan panjang antara 3-30 µm. Yeast bersifat anaerob fakultatif, artinya dapat hidup dalam keadaan aerorb maupun anaerob. Suhu optimum pertumbuhannya yaitu 300C (Zahara, 2011).
Dinding sel ragi atau khamir secara umum memiliki 4 fungsi utama antara lain: (1) menstabilkan tekanan osmotik di dalam sel, (2) melindungi sel dari tekanan luar, (3) memberi bentuk pada sel, (4) dan mensekresikan protein yang digunakan untuk metabolisme ekstraseluler. Sekitar 10-25% dari total berat kering merupakan dinding sel yang terdiri dari membran dalam berupa polisakarida untuk melindungi cairan dalam sel dan membran luar berupa manno-protein untuk melekat pada media (Klis et al., 2005). Ekstrak khamir digunakan sebagai elisitor pada saat biomassanya mencapai maksimum, dengan harapan bahwa derivat dinding sel khamir yang berupa glukan, kualitas dan kuantitasnya telah mencapai optimum. Komponen yang akan digunakan sebagai elisitor adalah komponen dinding sel Saccharomyces cerevisiae yang diperkirakan berupa glukan. Sisi aktif nya berupa 1,6 β-D glukopiranosil. Glukan dari ekstrak Saccharomyces cerevisiae secara alami diperkirakan mempunyai binding site
PRODUKSI KATEKIN PADA KULTUR IN VITRO KALUS
TEH (Camellia sinensis L.) DENGAN ELISITASI Saccharomyces cerevisiae
ABSTRAK
Penelitian tentang “Produksi Katekin Pada Kultur In Vitro Kalus Teh (Camellia sinensis L.) Dengan Elisitasi Saccharomyces cerevisiae” telah dilakukan dari bulan Maret 2014 sampai bulan Oktober 2014 di Laboratorium Kultur Jaringan Tumbuhan Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara, dan Laboratorium Pengujian Mutu dan Residu Pestisida Unit Pelaksana Teknis Perlindungan Tanaman Pangan dan Hortikultura Medan. Penelitian ini bertujuan untuk mengetahui konsentrasi dinding sel Saccharomyces cerevisiae yang dapat meningkatkan produksi katekin pada kultur kalus teh (Camellia sinensis L.) secara in vitro. Rancangan penelitian yang digunakan adalah Rancangan Acak Lengkap (RAL) non faktorial yaitu: medium Murashige dan Skoog + 1 mg/L 2,4-D + 1 mg/L kinetin ditambahkan elisitor dinding sel Saccharomyces cerevisiae (dengan beberapa tingkatan konsentrasi elisitor). Hasil analisis statistik menunjukkan perlakuan kontrol (medium Murashige dan Skoog ditambah 1 mg/L 2,4-D dan 1 mg/L kinetin) memberikan pengaruh paling baik terhadap peningkatan berat basah kalus teh (Camellia sinensis L.), peningkatan konsentrasi elisitor dinding sel Saccharomyces cerevisiae cenderung menyebabkan peningkatan berat kering kalus teh, konsentrasi elisitor dinding sel Saccharomyces cerevisiae 0,50% merupakan konsentrasi elisitor yang paling baik dalam meningkatkan produksi katekin kalus teh dengan kandungan katekin tertinggi 2,105 mg/g BK atau meningkat 4 kali dibandingkan perlakuan kontrol.