BIOTRANSFORMASI MINYAK JAGUNG OLEH Rhodococcus rhodochrous DAN APLIKASINYA UNTUK PENGAMBILAN LOGAM Cd2+
Disusun Oleh :
DWI PUJIASTUTI M0302020
SKRIPSI
Disusun dan Diajukan untuk Memenuhi Sebagian Persyaratan Mendapatkan Gelar Sarjana Sains Kimia
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SEBELAS MARET
HALAMAN PENGESAHAN
Skripsi ini dibimbing oleh : Pembimbing I
Venty Suryanti, M.Phil NIP. 132 162 026
Pembimbing II
Sri Hastuti, M.Si NIP. 132 162 562
Dipertahankan di depan Tim Penguji Skripsi pada:
Hari : Selasa
Tanggal : 10 Juli 2007
Anggota Tim Penguji:
1. Fitria Rahmawati, M.Si 1. ...
NIP. 132 258 066
2. Triana Kusumaningsih, M.Si 2. ...
NIP. 132 240 166
Disahkan oleh :
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret Surakarta
Dekan,
Prof. Drs. Sutarno,M.Sc.,Ph.D. NIP. 131 649 948
Ketua Jurusan Kimia,
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi saya yang berjudul
“BIOTRANSFORMASI MINYAK JAGUNG OLEH Rhodococcus rhodochrous
DAN APLIKASINYA UNTUK PENGAMBILAN LOGAM Cd2+” ini adalah
benar-benar karya saya sendiri yang diajukan untuk memperoleh gelar
kesarjanaan di suatu perguruan tinggi dan sepanjang sepengetahuan saya juga tidak terdapat kerja atau pendapat yang ditulis atau diterbitkan oleh orang lain, kecuali secara tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Surakarta, Agustus 2007
ABSTRAK
Dwi Pujiastuti, 2007. BIOTRANSFORMASI MINYAK JAGUNG OLEH
Rhodococcus rhodochrous DAN APLIKASINYA UNTUK PENGAMBILAN
LOGAM Cd2+.
Telah dilakukan penelitian tentang biotransformasi minyak jagung oleh
Rhodococcus rhodochous dan aplikasinya untuk pengambilan logam Cd2+. Penelitian ini bertujuan untuk mengetahui kondisi optimum dalam biotransformasi minyak jagung, mengetahui gugus fungsi produk hasil biotransformasi minyak jagung yang diperoleh dan mengetahui produk hasil biotransformasi minyak jagung apakah suatu biosurfaktan, serta mengetahui kapasitas penyerapan logam Cd2+.
Penentuan kondisi optimum dilakukan dengan pengamatan yang meliputi kepadatan sel bakteri (Optical density/OD), tegangan permukaan dan indeks emulsi selama 12 hari pada media fermentasi dengan konsentrasi minyak jagung 0%, 5%, 10%, dan 20% (v/v), pada suhu kamar dan kecepatan putar 150 rpm.
Recovery hasil biotransformasi minyak jagung dengan ekstraksi menggunakan pelarut dengan tingkat kepolaran meningkat, yaitu n-heksana, kloroform, etil asetat, dan butanol. Hasil biotransfrormasi minyak jagung diidentifikasi dengan spektrofotometer Infra Merah untuk mengetahui gugus fungsinya dan dilakukan karakterisasi. Aplikasi hasil biotransformasi minyak jagung untuk pengambilan logam Cd2+ pada kondisi pH 6, temperatur kamar, dan waktu kontak 5 dan 10 menit.
Hasil penelitian diperoleh kondisi optimum untuk biotransformasi minyak jagung adalah 7 hari fermentasi dengan konsentrasi minyak jagung 20% (v/v) dalam media fermentasi. Hasil biotransformasi minyak jagung dari ekstrak kloroform mempunyai tegangan permukaan air terrendah yaitu 0,048 N/m dan indeks emulsi terbesar yaitu 96%. Identifikasi dengan FT-IR menunjukkan adanya gugus hidroksi (-OH), gugus keton (C=O) dan rantai panjang alifatik. Hasil biotransformasi minyak jagung membentuk emulsi antara air dengan minyak sawit sebesar 97% dan mampu menurunkan tegangan permukaan minyak sawit sebesar 50,8828%. Hasil biotransformasi minyak jagung belum bisa disimpulkan membentuk suatu biosurfaktan.
Kapasitas penyerapan logam Cd2+ oleh supernatan hasil biotransformasi minyak jagung memberikan hasil lebih besar dibanding penyerapan menggunakan hasil biotransformasi minyak jagung dari ekstrak kloroform dan waktu kontak 10 menit juga memberikan kapasitas penyerapan yang lebih besar dibanding menggunakan waktu kontak 5 menit. Kapasitas penyerapan menggunakan supernatan untuk waktu kontak 10 menit adalah 1,8235 mg/g dan kapasitas penyerapan menggunakan hasil dari ekstrak kloroform untuk waktu kontak 10 menit adalah 1,3445 mg/g.
ABSTRACT
DWI PUJIASTUTI. 2007. BIOTRANSFORMATION OF CORN OIL BY
Rhodococcus rhodochrous AND APLICATION FOR REMOVING CADMIUM METAL ION.
The biotransformation of corn oil by Rhodococcus rhodochrous and their application for removing cadmium metal ion had been carried out. The purpose of this research was to find out the optimum condition of biotransformation of corn oil, the group of product from biotransformation of corn oil, the properties of product from biotransformation of corn oil as a biosurfactant and the adsorbtion capacity of cadmium adsorbtion.
The determination of optimum condition has been done at the of concentration corn oil of 0%, 5%, 10% and 20% (v/v) in fermentation medium during 12 days fermentation, at room temperature and gyratory shaking at 150 rpm. The samples in this research are observed on the optical density, surface tension and emulsification index. Recovery of product was done by extraction using increasing polarity of solvent, that were hexane, chloroform, ethyl acetate, and buthanol. The product was then identified using FT-IR, and characterized. The product from biotransformation of corn oil was apllied for cadmium removing at room temperature, pH 6 and contact time at 5 and 10 minutes.
Seven days fermentation and 20% (v/v) of corn oil in fermentation medium were the optimum condition for biotransformation of corn oil. The product which resulted from chloroform extract had the lowest surface tension of 0,048 N/m and the biggest emulsification index of 96%. Identified using FT-IR showed that the product had hydroxyl, keton group and aliphatic long chain of hydrocarbon. The result of biotransformation of corn oil could form emulsion among water and olive oil was 97%. and it could to decrease olive oil surface tension was 50,8828%. The result of biotransformation of corn oil has not be concluded a biosurfactant.
The crude of biotransformation of corn oil gives higher adsorbtion capacity then that of the result of biotransformation of corn oil from chloroform extract. When the contact time of 10 minutes was applied the adsorbtion capacity of crude of biotransformation of corn oil was 1,8235 mg/g, whereas the adsorbtion capacity of the result of biotransformation of corn oil from chloroform extract was 1,3445 mg/g.
MOTTO
Sesungguhnya sesudah kesulitan ada kemudahan, dan hanya kepada
Tuhan-mulah hendaknya kamu berharap.
(Q.S. Al Insyirah : 5)
Allah akan selalu menolong hambaNya selama ia mau menolong
temannya.
PERSEMBAHAN
Karya ini aku persembahkan untuk :
Alm Ebes, Mama dan Ibu’ tercinta
“Rabigh Firlii Waliwaalidayya Warhamhumaa
Kamaa Rabbayaanii Shoghiriraa”
Mas Andhy, Mbak Dian dan Izzah ‘bos kecil’
“Terima kasih untuk dukungan dan do’anya buatku”
Dek asri
“Jangan pernah menyerah, hidup adalah perjuangan”
Mas ‘Wahyu’ ku
KATA PENGANTAR
Alhamdulillahirabbil ‘alamin, puji syukur penulis panjatkan kehadirat Allah Yang Maha Kuasa, karena hanya atas berkah dan karunia-Nya penulis dapat menyelesaikan Laporan Skripsi guna memenuhi persyaratn untuk memperoleh gelar sarjan di Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret Surakarta.
Laporan ini tidak akan selesai tanpa adanya bantuan dari banyak pihak. Oleh karena itu, penulis mengucapkan terima kasih kepada :
1. Bapak Prof. Drs. Sutarno, Msc. PhD, Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret, Surakarta.
2. Bapak Drs Sentot Budi Raharjo, PhD, Ketua Jurusan Kimia Fakultas
Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret, Surakarta.
3. Ibu Venty Suryanti, M.Phil, Dosen Pembimbing Akademik dan Pembimbing I, yang selalu memberikan bantuan, arahan dan kesabaran dalam membimbing penyusunan skripsi ini.
4. Ibu Hastuti, M.Si, Pembimbing II atas bantuan, arahan dan kesabaran dalam membimbing penyusunan skripsi ini.
5. Para laboran di laboratorium Biologi Pusat, laboratorium Kimia Dasar FMIPA, dan Laboratorium Kimia Pusat, atas bantuan dan kerjasama selama penelitian.
6. Rekan-rekan kerja (Dewi, Rona, Widya, Sinug, Mbak Wiwin) terima kasih kerjasamanya. Sukses ya!
7. Sobat-sobatku (Jepit, Ayu’ dan Widhi) bersama kalian hidup terasa lebih berwarna.
Semoga Tugas Akhir ini dapat bermanfaat bagi penulis dan semua pihak yang membutuhkan. Akhir kata, semoga Allh SWT membalas semua kebaikan yang telah penulis terima.
Surakarta, Agustus 2007
DAFTAR ISI
Hal
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN ... ii
HALAMAN PERNYATAAN ... iii
ABSTRAK ... iv
ABSTRACT... v
MOTTO ... vi
PERSEMBAHAN ... vii
KATA PENGANTAR ... viii
DAFTAR ISI ... x
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN... xiv
BAB I. PENDAHULUAN ... 1
A. Latar Belakang Masalah ... 1
B. Perumusan Masalah ... 2
1. Identifikasi Masalah ... 2
2. Batasan Masalah ... 3 3. Rumusan Masalah ... 4
C. Tujuan Penelitian ... 5
D. Manfaat Penelitian ... 5
BAB II. LANDASAN TEORI ... 6
A. Tinjauan Pustaka ... 6
1. Minyak Jagung ... 6
2. Rhodoccocus rhodochrous ... 8
3. Mikroorganisme ... 9
4. Biotransformasi ... 14
5. Surfaktan ... 15
7. Spektrofotometer UV-Vis ... 21
8. Fourier Transform Infra Red ... 22
9. Pengambilan Ion Logam Berat ... 24
10. Spektrofotometer Serapan Atom... 25
B. Kerangka Pemikiran ... 25
C. Hipotesis ... 27
BAB III. METODOLOGI PENELITIAN ... 28
A. Metode Penelitian ... 28
B. Tempat dan Waktu Penelitian ... 29
C. Alat dan Bahan ... 29
D. Prosedur Penelitian ... 30
E. Tehnik Pengumpulan dan Analisa Data ... 34
BAB IV. HASIL PENELITIAN DAN PEMBAHASAN ... 37
A. Produksi dan Optimasi Kondisi Biotransformasi Minyak Jagung 37 1. Kurva Pertumbuhan Rhodococcus rhodochrous... 37
2. Optimasi Kondisi Biotransformasi Minyak Jagung... 39
B. Recovery Hasil Biotransformasi Minyak Jagung ... 44
C. Karakteristik Hasil Biotransformasi Minyak Jagung... 45
1. Identifikasi Gugus Fungsi dengan Spektrofotometer FT-IR.. 45
2. Penentuan Indeks Emulsi ... 51
3. Penentuan Tegangan Permukaan ... 52
D. Aplikasi Hasil Biotransformasi Minyak Jagung ... 53
BAB V. PENUTUP ... 57
DAFTAR TABEL
Hal Tabel 1. Komposisi Minyak Jagung ... 6 Tabel 2. Jenis-jenis Asam Lemak Jenuh dan Asam Lemak Tidak Jenuh ... 6
Tabel 3. Komponen-komponen Bahan yang Tidak Tersabunkan dalam Minyak Jagung ... 7 Tabel 4. Komposisi Minyak Jagung Sebagai Bahan Penelitian pada Label . 7 Tabel 5. Komposisi Minyak Jagung Berdasarkan Analisis GC MS ... 8 Tabel 6. Hasil Recovery Supernatan Hasil Biotransformasi Minyak Jagung
200 ml ... 44 Tabel 7. Perubahan Gugus Fungsi Minyak Jagung dan Hasil Biotransformasi
Minyak Jagung dari Ekstrak kloroform ... 47
Tabel 8. Indeks Emulsi Antara Air dan Minyak Sawit Dengan Penambahan Hasil Biotransformasi Minyak Jagung dari Ekstrak Kloroform .... 51 Tabel 9. Penurunan Tegangan Permukaan Minyak Sawit Sebelum dan
DAFTAR GAMBAR
Hal Gambar 1. Kurva Pertumbuhan Bakteri... 13 Gambar 2. Biotransformasi Asam Lemak... 14 Gambar 3. Kurva Pertumbuhan Bakteri R. rhodochrous... 38 Gambar 4. Grafik Kepadatan Sel (Optical Density) pada Optimasi
Kondisi ... 40 Gambar 5 Grafik Tegangan Permukaan Media Fermentasi pada
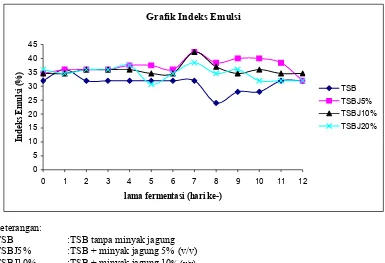
Optimasi Kondisi……… ... 41 Gambar6. Grafik Indeks Emulsi Media Fermentasi pada Optimasi
Kondisi……… ... 43 Gambar 7. Biotransformasi Asam Lemak Dalam Bentuk Trigliserida Menjadi
Asam Lemak Bebas ... 46 Gambar 8. Analisis FT IR Minyak Jagung (A) dan Hasil Ekstrak
Kloroform (B) ... 48 Gambar 9. Perkiraan Reaksi Biotransformasi Asam Oleat Menjadi
Monohidroksi Stearat dan Keto Stearat ... 49 Gambar 10. Perkiraan Reaksi biotransformasi Asam Linoleat Menjadi
Monohidroksi Oktadekanoat dan Keto Oktadekanoat ... 50 Gambar 11. Perkiraan Struktur Hasil Biotransformasi Minyak Jagung Jika
DAFTAR LAMPIRAN
Hal Lampiran 1. Diagram Alir Cara Kerja ... 61 Lampiran 2. Tabel Pengukuran Penentuan Panjang Gelombang Maksimal
Media Cair TSB Menggunakan Spektrofotometer UV-Vis... 67
Lampiran 3. Data Kurva Pertumbuhan ... 68 Lampiran 4. Data Optimasi Kondis Biotransformasi Minyak Jagung ... 69 Lampiran 5. Uji Statistik Duncan Optial Density, Tegangan Permukaan dan
Indeks Emulsi... 72 Lampiran 6. Data Tegangan Permukaan Recovery Supernatan Hasil
Biotransformasi Minyak Jagung ... 82 Lampiran 7. Data Analisa FT IR... 83
Lampiran 8. Data Indeks Emulsi pada Karakterisasi Hasil Biotrnasformasi
Minyak Jagung dari Ekstrak Kloroform ... 86 Lampiran 9. Data Tegangan Permukaan Minyak Sawit pada Karakterisasi Hasil
BAB I PENDAHULUAN
A. Latar Belakang Masalah
Biotransformasi adalah proses mengubah bahan mentah menjadi produk yang lebih berharga, melalui reaksi kimia yang melibatkan organisme. Organisme
ini berfungsi sebagai katalis dalam proses biotransformasi
(http://www.eoearth.org/article.Biotransformation-fig-13-gif). Bahan mentah yang murah seperti glukosa, kompleks karbohidrat seperti pati, gula cair atau bahkan air buangan merupakan substrat yang biasa digunakan untuk biotransformasi. Penggunaan biokatalis dalam biotransformasi dapat berasal dari enzim yang
diisolasi atau seluruh sel mikroorganisme (Kian et al, 1997).
Dalam proses biotransformasi oleh suatu mikroorganisme hasil biotransformasi tergantung dari jenis mikroorganisme dan kondisi pertumbuhan seperti sumber karbon, sumber nitrogen, pH, suhu dan aerasi yang digunakan. Struktur hasil biotransformasi merupakan turunan subtrat yang ada dalam media. Beberapa produk berharga baru dihasilkan dari biotransformasi minyak dan lemak oleh aktivitas bakteri, contohnya adalah biosurfaktan (surfaktan yang dihasilkan oleh mikroorganisme ketika ditumbuhkan dalam media dan kondisi tertentu), dimana produk ini dapat menjadi aplikasi industri baru. Aplikasi biosurfaktan dalam dunia industri diantaranya sebagai zat pengemulsi, wetting agent, detergen, adsorben logam. Beberapa contoh biotransformasi minyak nabati oleh aktivitas bakteri adalah minyak zaitun yang mengandung asam lemak tak jenuh yang terdiri dari asam oleat (64-80%), asam linoleat (8-16.5%) dan asam linolenat (1-2%) dapat mengalami biotransformasi oleh aktivitas bakteri Pseudomonas, sp
menghasilkan biosurfaktan asam dihidroksi oktadekanoat (Desai and Banat,
1997). Biotransformasi minyak kelapa sawit oleh Candida bambicola
dengan lama fermentasi 4 hari (Assadi, et al, 2000, dalam Kresnadipayana, 2006).
Biotransformasi minyak kedelai oleh Pseudomonas aeruginosa dengan
konsentrasi minyak kedelai 10% (v/v) dan lama fermentasi 6 hari diperkirakan menghasilkan biosurfaktan asam hidroksi alkanoat (Muliawati, D.I., 2006).
Rhodoccocus rhodochrous dapat digunakan untuk biotransformasi asam lemak tak jenuh pada substrat asam oleat yang menghasilkan asam 10-hidroksistearat 55,1% dan asam 10-ketostearat dan jika menggunakan asam linoleat sebagai substrat menghasilkan asam 10-hidroksi-12-oktadekanoat dan asam 10-keto-12-oktadekanoat (Litchfield and pierce,1986 dalam Kian et al, 1997). Minyak jagung adalah salah satu minyak nabati yang mempunyai kandungan asam lemak tak jenuh yang besar yaitu 86-87,6%. Berdasarkan hal ini, maka minyak jagung dapat mengalami biotransformasi karena aktivitas R.
rhodochrous dan kemungkinan produk hasil biotransformasi minyak jagung adalah biosurfaktan.
B. Perumusan Masalah
1. Identifikasi Masalah
Biotransformasi minyak jagung oleh suatu mikroorganisme kemungkinan dapat menghasilkan biosurfaktan dimana dalam produksinya dipengaruhi oleh kondisi tertentu, meliputi konsentrasi sumber karbon dalam media, lama fermentasi dan kondisi lingkungan. Minyak jagung mempunyai kandungan asam lemak tidak jenuh yang cukup besar sehingga dapat juga berfungsi sebagai sumber karbon tambahan dan dapat mengalami biotransformasi. Variasi konsentrasi minyak jagung dalam media fermentasi diperlukan untuk mengetahui pengaruh sumber karbon tambahan dan konsentrasi optimal dalam proses produksi. Lama fermentasi mempengaruhi pertumbuhan bakteri, karena dalam pertumbuhannya
bakteri mengalami kecepatan membelah maksimum pada waktu tertentu dan akan mengalami penurunan kecepatan membelah, pada akhirnya bakteri tersebut akan mati. Kondisi lingkungan meliputi pH, temperatur, kecepatan putar (agitasi) dan konsentrasi garam dalam media fermentasi.
Recovery produk hasil biotransformasi diperlukan untuk mengetahui dan mengambil produk hasil biotransformasi minyak jagung yang kemungkinan dapat bersifat sebagai biosurfaktan. Recovery dapat dilakukan dengan cara ekstraksi menggunakan pelarut dengan tingkat kepolaran yang meningkat.
Produk hasil biotransformasi minyak jagung merupakan turunan substrat dalam media yang mempunyai gugus fungsi yang hampir sama dengan struktur substrat, untuk mengetahui gugus-gugus dan jumlah senyawa yang dihasilkan dari biotransformasi minyak jagung dapat dilakukan dengan identifikasi menggunakan
beberapa macam alat, antara lain GC MS (Gas Chromatography-Mass
Spectroscophy), HPLC (High Performance Liquid Chromatography), KLT (Kromatografi Lapis Tipis), FT-IR (Fourier Transform-Infra Red), dan NMR (
Nuclear Magnetic Resonance).
Produk hasil biotransformasi minyak nabati oleh aktivitas mikroorganisme dapat diaplikasikan untuk pengambilan logam berat. Proses pengambilan logam berat dipengaruhi oleh beberapa faktor, antara lain pH larutan, waktu kontak, konsentrasi awal larutan, temperatur dan ukuran adsorben.
2. Batasan Masalah
Berdasarkan identifikasi masalah tersebut maka dibuat batasan masalah sebagai berikut:
a. Pengoptimalan kondisi dilakukan dengan variasi minyak jagung dalam media fermentasi , yaitu 0%, 5%, 10%, 20% (v/v) dan variasi lama fermentasi, yaitu dilakukan pengamatan setiap hari dari hari ke-0 sampai hari ke-12 yaitu pengamatan tegangan permukaan (metode
kenaikkan pipa kapiler), indeks emulsi dan kepadatan sel bakteri (Optical Density /OD) menggunakan spektrofotometer UV-Vis
b. Recovery dilakukan dengan cara ekstraksi menggunakan pelarut dengan tingkat kepolaran yang meningkat, berturut-turut yaitu n-heksana, kloroform, etil asetat dan butanol.
c. Identifikasi gugus fungsi produk hasil biotransformasi minyak jagung oleh aktivitas R. rhodochrous dianalisa menggunakan FT-IR.
d. Karakterisasi produk hasil biotransformasi minyak jagung sebagai biosurfaktan dilakukan dengan penentuan indeks emulsi dan pengukuran tegangan permukaan minyak sawit.
e. Aplikasi hasil biotransformasi minyak jagung oleh aktivitas R. rhodochrous untuk pengambilan logam berat menggunakan ion logam Cd2+ pada kondisi pH 6, temperatur kamar, waktu kontak 5 dan 10 menit dan identifikasi konsentrasi Cd2+ yang terambil menggunakan Spektrofotometer Serapan Atom (SSA).
3. Rumusan Masalah
a. Berapa konsentrasi minyak jagung (% v/v) dan lama fermentasi yang optimum dalam biotransformasi minyak jagung oleh R. rhodochrous ? b. Gugus fungsi apa saja yang terdapat dalam hasil biotransformasi
minyak jagung oleh R. rhodochrous ?
c. Apakah produk hasil bioransformasi minyak jagung oleh R.
rhodochrous merupakan biosurfaktan?
d. Berapa kapasitas penyerapan hasil biotransformasi minyak jagung terhadap logam Cd pada kondisi pH 6, temperatur kamar dan waktu kontak 5 dan 10 menit?
C. Tujuan Penelitian
Tujuan dari penelitian ini adalah :
1. Mendapatkan produk hasil biotransformasi minyak jagung oleh R.
rhodochrous
2. Mengetahui gugus fungsi produk hasil biotransformasi minyak jagung oleh R. rhodochrous.
3. Mengetahui produk hasil biotransformasi minyak jagung oleh R. rhodochrous
apakah suatu biosurfaktan.
4. Mengetahui berapa kapasitas penyerapan logam Cd2+ pada kondisi pH 6, temperatur kamar dan waktu kontak 5 dan 10 menit.
D. Manfaat Penelitian
Manfaat dari penelitian ini adalah :
1. Memberikan informasi tentang biotransformasi minyak jagung oleh aktivitas
R. rhodochrous.
2. Memanfaatkan nilai lebih minyak jagung sebagai substrat dalam biotransformasi minyak jagung oleh R.rhodochrous.
BAB II
LANDASAN TEORI
A. Tinjauan Pustaka
1. Minyak jagung
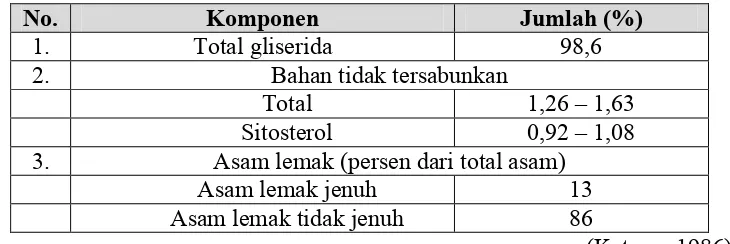
Minyak jagung merupakan trigliserida yang disusun oleh gliserol dan asam-asam lemak. Persentase trigliserida sekitar 98,6 persen, sedangkan sisanya merupakan bahan non minyak, seperti abu, zat warna atau lilin. Komponen-komponen yang terdapat dalam minyak jagung dapat dilihat dalam tabel 1.
Tabel 1. Komposisi minyak Jagung
No. Komponen Jumlah (%)
1. Total gliserida 98,6
2. Bahan tidak tersabunkan
Total 1,26 – 1,63
Sitosterol 0,92 – 1,08
3. Asam lemak (persen dari total asam)
Asam lemak jenuh 13
Asam lemak tidak jenuh 86
(Ketaren,1986)
Tabel 2. jenis-jenis asam lemak jenuh dan asam lemak tidak jenuh.
Asam Lemak Jenuh Sifat Rumus Bangun
1. Asam palmitat Mempunyai atom C sebanyak 16,
titik cair 62,90C, dan jumlahnya H3C(CH2)13CH2COOH kurang lebih 10% dari berat
minyak
2. Asam stearat mempunyai atom C sebanyak 18,
titik cair 69,90C, dan jumlahnya H3C(CH2)15CH2COOH sekitar 3% dari berat minyak
Asam Lemak Tidak Jenuh Sifat Rumus Bangun
1. Asam oleat titik cair 16,30C
(cis 9-oktadekanoat) jumlahnya kurang lebih 30% dari CH3(CH2)7CH=CH(CH2)7COOH berat minyak
2. Asam linoleat titik cair –5oC
(cis-oktadekadienoat) jumlahnya 56% dari berat minyak CH3(CH2)4CH=CH-CH=CH(CH2)7COOH
Tabel 3. Komponen-komponen bahan yang tidak tersabunkan dalam minyak jagung.
Komponen Jenis Keterangan
1. Sitosterol campesterol (8-12%) dari sterol yang ada dan pada proses stigmasterol (0,7-1,4%) pemurnian kadar sterol akan turun
menjadi 11-12%
2. Lilin mirisil tetrakosanate salah satu fraksi berupa kristal yang dapat mirisil isobehenate dipisahkan pada waktu pemurnian minyak
menggunakan suhu rendah
3. Tokoferol 7 metil tokol, 7,8-dimetil tokokrena tokoferol yang paling penting adalah alfa 5,7,8 trimetil tokoferol dan beta tokoferol yang jumlahnya 0,078% alfa tokoferol, 7,8 dimetil tokol
4. Karotenoid xantophyl jumlahnya xantophyl dan karoten akan karoten menurun pada saat proses pemurnian
(Ketaren,1986) Asam lemak yang menyusun minyak jagung terdiri dari asam lemak jenuh dan asam lemak tidak jenuh. Jenis-jenis asam lemak jenuh dan asam lemak tidak jenuh disertai sifat-sifatnya dapat dilihat dalam Tabel 2.
Selain komponen-komponen tersebut diatas, minyak jagung juga mengandung bahan yang tidak tersabunkan. Komponen-komponen bahan yang tidak tersabunkan dalam minyak jagung dapat dilihat dalam Tabel 3.
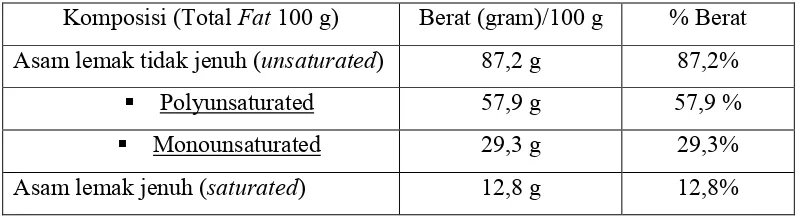
Minyak jagung bermerk dagang Sunbeam mempunyai kandungan asam lemak jenuh sebesar 12,8% dan asam lemak tak jenuh sebesar 87,2%. Komposisi minyak jagung berdasarkan pada label terlihat pada Tabel 4, sedangkan
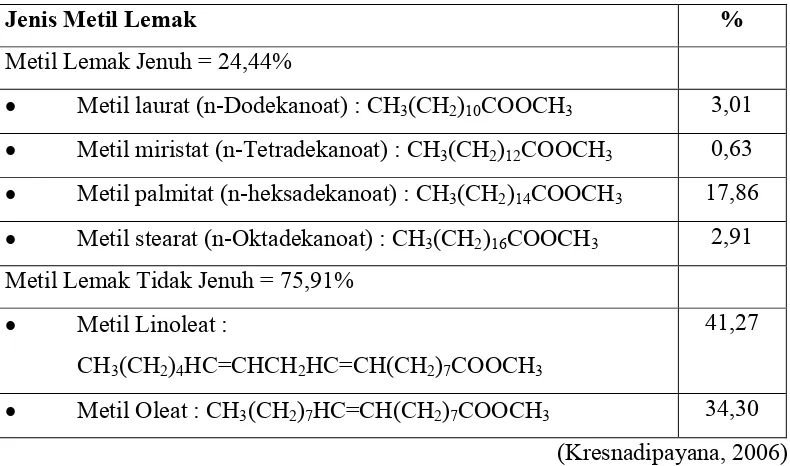
berdasarkan analisis GC MS minyak jagung mengandung asam lemah jenuh sebesar 24,44% dan asam lemak tak jenuh sebesar 75,91%. Komposisi minyak
jagung Sunbeam berdasarkan analisis GC MS terlihat dalam tabel 5
(Kresnadipayana, 2006).
Tabel 4. Komposisi Minyak Jagung Sebagai Bahan Penelitian pada Label
Komposisi (Total Fat 100 g) Berat (gram)/100 g % Berat
Asam lemak tidak jenuh (unsaturated) 87,2 g 87,2%
Polyunsaturated 57,9 g 57,9 %
Monounsaturated 29,3 g 29,3%
Tabel 5. Komposisi Minyak Jagung Berdasarkan Analisis GC-MS
Jenis Metil Lemak %
Metil Lemak Jenuh = 24,44%
Metil laurat (n-Dodekanoat) : CH3(CH2)10COOCH3 3,01
Metil miristat (n-Tetradekanoat) : CH3(CH2)12COOCH3 0,63
Metil palmitat (n-heksadekanoat) : CH3(CH2)14COOCH3 17,86
Metil stearat (n-Oktadekanoat) : CH3(CH2)16COOCH3 2,91
Metil Lemak Tidak Jenuh = 75,91%
Metil Linoleat :
CH3(CH2)4HC=CHCH2HC=CH(CH2)7COOCH3
41,27
Metil Oleat : CH3(CH2)7HC=CH(CH2)7COOCH3 34,30
(Kresnadipayana, 2006)
2. Rhodococcus rhodochrouss
Rhodococcus sp adalah bakteri yang mempunyai aktivitas metabolik yang mampu mendegradasi komponen organik. Rhodococcus sp secara langsung diisolasi dari Quinte danau Ontario Canada. Rhodococcus rhodochrous dapat tumbuh pada media Trypticase Soy Broth dan Trypticase Soy Agar pada suhu 240C (Van Hamme, J.D dan Ward, O.P, 2001)
R. rhodochrous adalah suatu bakteri aerob, gram positif, non motil berbentuk batang atau coccus. R. rhodochrous dapat diisolasi dari bermacam-macam sumber, misalnya tanah, batuan, kotoran hewan, dan tubuh serangga (K.S Bell et al, 1998). Ciri-ciri bakteri gram positif adalah
a. Struktur dinding selnya tebal (15-80 nm) dan berlapis tunggal.
b. Komposisi dinding selnya terdiri dari kandungan lipid yang rendah (1-4%).
c. Pertumbuhanya dihambat oleh zat warna.
d. Persyaratan nutrisinya relatif rumit, misalnya dalam kaldu infuse jantung. e. Resisten terhadap gangguan fisik.
R. rhodochrous telah digunakan oleh Nitto Chemistry Industry Company Ltd (Jepang) untuk memproduksi lebih dari 30 ribu ton akrilamida setiap tahunnya. Dalam R. rhodochrous terdapat enzim nitrilase yang berfungsi dalam transformasi untuk produksi akrilamida, serta produk lain seperti asam akrilik, vitamin nikotinamida dan asam p-aminobenzoat (K.S Bell, et al, 1998).
Rhodococcus sp dapat menghasilkan molekul biosurfaktan hasil degradasi alkana. Telah diketahui jenis biosurfaktan yang dihasilkan adalah glikolipid (Iwabuchi, et al, 2004). R rhodochrous dapat mengkonversi asam lemak tak jenuh pada substrat asam oleat menghasilkan asam 10-hidroksistearat 55,1% dan asam 10-ketostearat dan jika menggunakan asam inoleat sebagai substrat akan dihasilkan 22,2% asam 10-hidroksi-12-oktadekanoat dan asam 10-keto-12-oktadekanoat (Litchfield and pierce,1986 dalam Kian et al, 1997).
3. Mikroorganisme
Faktor-faktor yang mempengaruhi pertumbuhan atau perkembangbiakan mikroorganisme umumnya dibagi ke dalam lima bahasan yaitu a) waktu generasi;
b) faktor intrinsik; c) faktor ekstrinsik; d) faktor proses dan e) faktor implisit.
a. Waktu Generasi
Waktu generasi adalah waktu yang diperlukan oleh mikroorganisme untuk meningkatkan jumlah sel menjadi dua kali lipat jumlah semula. Kurva pertumbuhan mikroorganisme terdiri atas lima fase yaitu:
1) Tahap ancang-ancang.
Tahap ancang-ancang mencakup interval waktu antara saat penanaman dan saat tercapainya kecepatan pembelahan maksimum. Lamanya tahap ancang-ancang ini terutama tergantung dari biak awal, umur bahan yang ditanam, dan juga dari sifat larutan biak.
2) Tahap eksponensial.
pembelahan diri sepanjang tahap log bersifat spesifik untukk tiap jenis bakteri dan tergantung lingkungan.
3) Tahap stasioner.
Tahap stasioner dimulai jika sel-sel sudah tidak tumbuh lagi. Kecepatan pertumbuhan menurun ketika kadar substrat berkurang sebelum substrat habis terpakai. Dengan demikian pengalihan dari tahap eksponensial ke tahap stasioner terjadi berangsur-angsur. Selain karena keterbatasan substrat, juga kepadatan populasi yang tinggi, tekanan parsial oksigen yang rendah dan timbunan produk metabolisme yang toksik, dapat menurunkan kecepatan pertumbuhan dan mengintroduksi tahap stasioner.
4) Tahap kematian.
Tahap kematian dan sebab-sebab kematian sel bakteri dalam media biakan normal
masih kurang diteliti. Relatif lebih jelas keadaan dimana terjadi penimbunan asam (Eschericia, lactobacillus). Jumlah sel hidup dapat berkurang secara eksponensial. Ada kemungkinan bahwa sel-sel dihancurkan oleh pengaruh enzim asal sel sendiri (otolisis) (Schlegel, 1994)
b. Faktor intrinsik
Faktor intrinsik meliputi pH, aktivitas air (activity of water, aw),
kemampuan mengoksidasi-reduksi (redoxpotential, Eh), kandungan nutrien, bahan antimikroba dan struktur bahan makanan. Lazimnya bakteri tumbuh pada
pH sekitar netral (6,5 – 7,5). Aktivitas air (aw) adalah perbandingan antara tekanan
uap larutan dengan tekanan uap air solven murni pada temperatur yang sama ( aw
= p/po ). Ini merupakan jumlah air yang tersedia untuk pertumbuhan mikroba dalam pangan dan bukan berarti jumlah total air yang terkandung dalam bahan makanan sebab adanya adsorpsi pada konstituen tak larut dan absorpsi oleh konstituen larut (misalnya gula, garam). Air murni mempunyai aw 1,0 dan bahan
makanan yang sepenuhnya terdehidrasi memiliki aw = 0. Batas aw minimum
Kemampuan mengoksidasi-reduksi (redoxpotential, Eh) adalah perbandingan total daya mengoksidasi (menerima elektron) dengan daya mereduksi (memberi elektron). Berdasarkan Eh, mikroorganisme dibagi menjadi aerob, anaerob, fakultatif anaerob dan mikroaerofilik. Mikroorganisme aerob memerlukan keadaan Eh positif, mikroorganisme anaerob memerlukan Eh negatif, mikroorganisme fakultatif anaerob memerlukan keadaan Eh positif atau negatif dan mikroorganisme mikroaerofilik memerlukan Eh sedikit tereduksi.
Pertumbuhan mikroorganisme memerlukan air, energi, nitrogen, vitamin dan faktor pertumbuhan, mineral. Air yang tersedia untuk pertumbuhan
mikroorganisme ditentukan oleh aw bahan makanan. Sebagai sumber energi,
mikroorganisme memanfaatkan karbohidrat, alkohol dan asam amino yang terdapat dalam bahan makanan. Faktor pertumbuhan yang diperlukan adalah asam amino, purin dan pirimidin, serta vitamin (Yudhabuntara, 2003).
c. Faktor Ekstrinsik
Faktor ekstrinsik yang mempengaruhi pertumbuhan mikroorganisme adalah suhu penyimpanan dan faktor luar lainnya yang pada prinsipnya berhubungan dengan pengaruh atmosferik seperti kelembaban, tekanan gas/keberadaan gas, juga cahaya dan pengaruh sinar ultraviolet.
Berdasarkan suhu optimumnya, mikroorganisme dibagi menjadi psikrofil dengan suhu optimum kurang dari + 20 °C, mesofil (+20° s/d + 40 °C) dan
termofil (lebih dari +40 °C). Pada suhu minimum terjadi perubahan membran sel sehingga tidak terjadi transpor zat hara. Sebaliknya pada suhu maksimum terjadi denaturasi enzim, kerusakan protein dan lipida pada membran sel yang menyebabkan lisisnya mikroorganisme. Mikroorganisme patogen biasanya termasuk ke dalam kelompok mesofil. Pengaruh suhu rendah pada mesofil adalah inaktivasi dan perubahan struktur protein permease (Yudhabuntara, 2003).
Kelembaban lingkungan (relatif humidity, RH) penting bagi aw bahan
makanan dan pertumbuhan mikroorganisme pada permukaan bahan makanan. Ruang penyimpanan yang memiliki RH rendah akan menyebabkan bahan
dengan demikian mengubah nilai aktivitas airnya.Produk bahan makanan yang kering ini bila dibawa ke lingkungan yang lembab (RH tinggi) akan menyerap kelembaban sehingga permukaannya dapat ditumbuhi jamur. Hal yang sama akan terjadi bila bahan makanan yang telah didinginkan dibawa ke lingkungan yang lebih hangat. Hal ini akan menyebabkan kondensasi air di bagian permukaannya. Proses ini penting untuk diperhatikan pada pengepakan produk yang dapat membusuk, karena biasanya ruang pengepakan lebih hangat dibandingkan dengan ruang pendingin, sehingga akan terbentuk lapisan tipis air kondensasi. Hal ini akan menyebabkan peningkatan aktivitas air yang pada gilirannya dapat mempermudah pertumbuhan mikroorganisme (Yudhabuntara, 2003).
Penyimpanan bahan makanan di ruang terbuka meningkatkan kadar CO2
sampai 10% yang dapat dicapai dengan menambahkan es kering (CO2) padat.
Penghambatan oleh CO2 meningkat sejalan dengan menurunnya suhu karena
solubilitas CO2 meningkat pada suhu rendah. Bakteri Gram negatif lebih rentan
terhadap CO2 dibandingkan bakteri Gram positif. Adanya cahaya dan sinar ultra
violet dapat mempengaruhi pertumbuhan mikroorganisme dan kerusakan toxin yang dihasilkannya (Yudhabuntara, 2003).
d. Faktor Proses
Semua proses teknologi pengolahan bahan makanan mengubah lingkungan mikro bahan makanan tersebut. Proses tersebut dapat berupa pemanasan, pengeringan, modifikasi pH, penggaraman, curing, pengasapan, iradiasi, tekanan tinggi, pemakaian medan listrik dan pemberian bahan imbuhan pangan (Yudhabuntara, 2003).
e. Faktor implisit
Gambar 1. Kurva Pertumbuhan bakteri
antara mikroorganisme yang berbeda. Interaksi ini dapat saling mendukung maupun saling menghambat (terjadi sinergisme atau antagonisme).
(Yudhabuntara, 2003).
f. Kurva Pertumbuhan Bakteri
Jika bakteri ditanam dalam suatu larutan biak, maka bakteri akan terus tumbuh sampai salah satu faktor mencapai minimum dan pertumbuhan menjadi terbatas. Kalau sepanjang peristiwa ini tidak diadakan penambahan nutrien atau penyaluran keluar produk-produk metabolisme, maka pertumbuhan dalam lingkungan seperti ini disebut kultur statik. Pertumbuhan dalam “sistem tertutup” seperti ini mematuhi hukum-hukum, yang tidak hanya berlaku untuk organisme bersel tunggal saja, tetapi juga untuk organisme bersel banyak dengan pertumbuahan
yang dibatasi secara genetik.
Pertumbuhan biak bakteri dengan mudah dapat dinyatakan secara grafik dengan logaritma jumlah sel terhadap waktu. Suatu kurva pertumbuhan (Gambar 1) khas mempunyai bentuk sigmoid dan dapat dibedakan dalam beberapa tahap pertumbuhan yang muncul secara teratur, sangat atau kurang menonjol: tahap ancang-ancang (lag-phase), tahap eksponensial (logaritmik), tahap stasioner dan tahap menuju kematian.
4. Biotransformasi
Biotransformasi merupakan salah satu aspek dari bioteknologi yang dapat diartikan penggunaan biokatalis untuk mengubah bahan mentah menjadi produk yang lebih berharga. Biokatalis yang digunakan dapat berupa enzim yang diisolasi atau seluruh sel mikroba. Pada kasus dimana biotransformasi merupakan satu tahap reaksi dan enzim tanpa kofaktor tersedia, maka enzim yang diisolasi menjadi tidak bergerak merupakan biokatalis yang efisien, contoh yang menarik yaitu penggunaan lipase untuk sintetis ester. Biotransformasi dapat juga diartikan sebagai reaksi multi tahap dan relatif kompleks, khususnya dimana tahap enzimatik membutuhkan kofaktor, dan kemungkinan menggunakan biokatalis yang berupa sel mikroba. Bahan mentah yang murah seperti glukosa, kompleks karbohidrat seperti pati, gula cair atau bahkan air buangan merupakan substrat
favorit untuk biotransformasi, tetapi sejumlah produk berharga baru dapat diturunkan dari minyak dan lemak. Produk ini mungkin dapat menjadi aplikasi industri yang baru (Kian, et al., 1997)
Gambar 2. Biotransformasi Asam Lemak
(Kian, et al., 1997)
Reaksi biotransformasi pada asam lemak mempunyai banyak
Kemungkinan biotransformasi asam lemak disajikan pada gambar 2, dimana reaksi tidak terbatas pada suatu reaksi dan posisinya (Kian, et al 1997 :3). Suatu garam lemak jenuh, natrium oktanoat mengalami biotransformasi menjadi monomer-monomer asam (R)-(-)-3hidroksi heksanoat, asam (R)-(-)-3-hidroksi oktanoat, asam (R)-(-)-3-hidroksi dekaonat, dan asam (R)-(-)-3-hidroksi dodekanoat (Wang,et al, 1999). Suatu asam lemak tidak jenuh, asam linoleat mengalami biotransformasi menjadi asam 12,13,17-trihidroksi-(Z)-oktadekanoat dan asam resinoleat menjadi 7,10,12-trihidroksi-8(E)-oktadekanoat.
(Kim, et al., 2000 dalam Kresnadipayana, 2006)
5. Surfaktan
Substansi surface-active atau surfaktan adalah molekul yang mempunyai karakteristik ampifilik, yaitu sifat hidrofilik dan hidrofobik (Hutchinson dkk,
1967; Van Dyke dkk, 1991 dalam Ghazali dan Ahmad, 1997). Karena keberadaan gugus hidrofilik dan hidrofobik dalam molekul yang sama, surfaktan membagi pada antarpermukaan antara fase cair dari derajat polaritas dan ikatan hidrogen.
Surfaktan cenderung untuk berakumulasi pada antarmuka. Hal ini dapat menurunkan tegangan muka antara dua fasa sehingga akan mengakibatkan perubahan pada energi sistem. Dan sistem akan lebih stabil dengan energi bebas yang lebih rendah. Kelarutan surfaktan dalam air dipengaruhi oleh panjang rantai-rantai karbon. Semakin panjang rantai-rantai karbon maka kelarutannya dalam air akan berkurang dan kelarutan dalam hidrokarbon makin besar.
Berdasarkan sifat-sifat gugus hidrofilik yaitu gugus yang bersifat polar, surfaktan dikelompokkan sebagai berikut :
a. Surfaktan ionik
surfaktan ionik adalah surfaktan yang bagian hidrofiliknya bermuatan
1) Anionik yaitu molekul aktif permukaannya mempunyai muatan negatif. Contoh : sabun (RCOO-Na+)
2) Kationik yaitu bagian molekul aktif permukaannya mempunyai muatan positif. Contoh : garam ammonium rantai panjang R+NH3Cl- dan ammonium klorida kuartener R+N(CH3)3Cl
b. Surfaktan non ionik
Surfaktan nonionik merupakan surfaktan yang bagian hidrofiliknya tidak bermuatan atau netral.
(Moroy, 1992)
6. Biosurfaktan
Surfaktan yang dihasilkan oleh mikroorganisme tertentu ketika ditumbuhkan dalam media dan kondisi tertentu disebut biosurfaktan. Banyak organisme menghasilkan surface-active saat tumbuh dalam media yang terdiri dari sumber karbon. Biosurfaktan, terdiri dari lemak kompleks atau sederhana atau turunannya. Bagian hidrofobik biasanya merupakan rantai karbon asam karboksilat yang secara kovalen disambung oleh ester atau ikatan amida pada bagian hidrofilik yang ditarik dari range yang luas dari gugus fungsi organik
(nonionik, bermuatan positif, bermuatan negatif atau amfoter) (Ghazali dan Ahmad, 1997).
Biosurfaktan disintesis secara ekstraseluler atau bersamaan dengan dinding selnya (Zajic dkk, 1984, dalam Ghazali dan Ahmad, 1997). Jika ekstraseluler maka akan menyebabkan emulsifikasi dari sumber karbon, dan jika bersamaan dengan dinding sel maka akan memfasilitasi penembusan sumber karbon ke ruang perplasmik dengan merubah struktur dari dinding sel (Lang dkk, 1987 dalam
Ghazali dan Ahmad, 1997). a. Pengelompokan biosurfaktan
Berdasarkan struktur dari bagian hidrofilik, biosurfaktan diklasifikasikan ke dalam lima tipe, yaitu : lipopeptida, glikolipid, lipopolisakarida, lipid netral dan asam lemak atau fosfolipida. Indikasi keberadaan dari biosurfaktan adalah penentuan tegangan permukaan, tegangan antar muka dan konsentrasi kritis missel (Ghazali dan Ahmad,1997:35).
b. Karakterisasi biosurfaktan 1) Tegangan Permukaan
sebanyak satu satuan luas. dinyatakan dalam Nm-1 atau dyne cm-1 dimana 1 dyne cm-1 = 10-3 Nm-1.
Molekul-molekul cairan yang berada dibagian dalam fase cair seluruhnya akan dikelilingi oleh molekul-molekul dengan tarik-menarik sama ke segala arah, lain halnya dengan molekul-molekul cairan pada permukaan. Molekul-molekul itu disebelah bawah dikelilingi oleh molekul-molekul cairan, sedang dibagian atas oleh fase uap, sehingga gaya tarik ke bawah lebih besar dari gaya tarik ke atas. Hal ini menimbulkan sifat kecenderungan untuk memperkecil luas permukaan. Besar gaya yang bekerja tegak lurus pada satu satuan panjang permukaan disebut
tegangan permukaan yang dapat dinyatakan dengan satuan dyne per cm dalam sistem cgs.
Tegangan muka dapat ditentukan dengan beberapa metode antara lain : a) Metode kenaikkan kapiler
b) Metode tetes (Drop Weight)
c) Metode tekanan maksimum gelembung d) Metode cinicin du Nuoy
a) Metode kenaikkan kapiler
Bila suatu pipa kapiler dimasukkan ke dalam cairan yang membasahi dinding, maka cairan akan masuk ke dalam kapiler karena adanya tegangan muka. Energi paling rendah didapat saat lapisan tipis menutupi sebanyak mungkin kaca tersebut. Ketika lapiasan tipis ini merembet ke atas dinding bagian dalam, lapisan tipis itu mempunyai efek melengkungkan permukaan cairan ke dalam pipa. Kenaikan cairan sampai pada suatu tinggi tertentu terjadi keseimbangan antara gaya ke atas dan ke bawah. Gaya ke bawah adalah π r2 h d g
Dimana h = tinggi permukaan d = berat jenis g = percepatan gravitasi r = jari – jari kapiler sedang gaya ke atas adalah 2 π r γ cos θ
dengan γ adalah tegangan muka dan θ adalah suatu sudut kontak. Pada kesimpulannya, gaya ke bawah = gaya ke atas, sehingga jika diambil pendekatan θ = 0 (karena pada umumnya θ sangat kecil mendekati nol), didapatkan :
γ =
2
rhdg
………..(1)
percobaan di atas digunakan untuk membandingkan cairan yang ditentukan tegangan mukanya dengan cairan yang sudah diketahui misal air, sehingga diperoleh persamaan:
γx = tegangan permukaan zat cair yang ditentukan γair = tegangan permukaan air
dair = berat jenis air dx = berat jenis zat cair hair = tinggi permukaan air hx = tinggi permukaan zat cair (Rosen,1978)
b) Metode tetes
Bila cairan tepat akan menetes maka gaya tegangan permukaan sama dengan gaya yang disebabkan oleh massa cairan sebagai gaya berat itu sendiri.
Gaya berat cairan = m.g
Gaya tegangan permukaan = 2 r
diambil volume tertentu yang sama dan dihitung jumlah tetesan yang terjadi. Misal : volume = V
berat jenis = d
massa satu tetes zat cair = m jumlah tetes dalam volume V = n
maka m=
n Vd
=
c) Metode tekanan maksimum gelembung
Prinsipnya adalah tegangan permukaan dari tekanan maksimum yang dibentuk untuk mengeluarkan gelembung pada ujung pipa kapiler.
= r/2 (P0 + h1 g –h2 d g)...(4)
= tegangan permukaan (N/m)
Po = tekanan 1 atm
d) Metode cincin de Nuoy
Jika cincin berada pada permukaan ciran maka untuk melepaskan cincin
dari permukaan cairan diperlukan suatu gaya permukanan yang besarnya 4 R
Gaya pada permukaan dalam dirumuskan = 2 r
Gaya pada permukaan luar dirumuskan = 2 R
Gaya keatas dirumuskan = f F
Gaya kebawah dirumuskan = 2 r - 2 R
Jika tebal cincin sangat tipis maka r = R, sehingga gaya keatas sama dengan gaya kebawah. Maka persamaannya menjadi :
=f F/(4 R)...(5)
F = gaya yang terukur pada alat (N) R = jari-jari cincin (cm)
= tegangan permukaan (dyne/cm, N/cm)
2) Kestabilan emulsi
Emulsi adalah dispersi suatu campuran, yang molekul – molekul kedua campuran tersebut tidak saling bercampur atau bercampur sebagian. Pada suatu emulsi terdapat tiga bagian utama yaitu fase terdispersi, terdiri dari butir –butir yang biasanya terdiri dari minyak. Bagian kedua adalah zat pendispersi yang biasanya
air dan bagian ketiga adalah zat pengemulsi yang menjaga agar butiran minyak tetap terdispersi dalam air (Shaw, J.D, 1992).
Pengurangan daerah antarmuka dengan pengumpulan mengurangi energi sistem dan proses ini secara termodinamika lebih disukai, karena alasan ini Garret mendefinisikan emulsi stabil sebagai emulsi yang akan menjaga sejumlah ukuran partikel yang sama dari fase terdispersi per satuan volume dari fase pendispersi. Energi antar muka total harus tidak bervariasi dengan waktu untuk memenuhi definisi ini.
Kestabilan kinetik suatu emulsi adalah keadaan dimana sifat-sifat fisika kimia dari suatu emulsi tidak berubah secara berarti selama satu periode waktu yang cukup lama.
Surfaktan sebagai zat pengemulsi berfungsi untuk memudahkan pembentukan emulsi dengan mekanisme sebagai berikut :
1. Mengurangi tegangan antarmuka
Pengurangan tegangan antarmuka menurunkan energi bebas yang dihasilkan pada dispersi, karena sistem dengan energi bebas yang lebih rendah akan lebih stabil.
2. Pembentukan suatu lapisan antarmuka
berkumpul pada antarmuka sebagai lapisan monomolekular. Jika konsentrasi zat pengemulsi cukup tinggi, pengemulsi membentuk suatu lapisan yang kaku antara fase yang tidak bercampur tersebut, yang bertindak sebagai suatu penghalang mekanik untuk bergabungnya partikel terdispersi. Emulsi yang stabil adalah emulsi yang molekul – molekul surfaktannya terkemas rapat (berdekatan) dan membentuk suatu lapisan antarmuka yang kuat.
3. Pembentukan lapisan rangkap listrik
Berfungsi sebagai penghalang elektrik untuk mendekatnya partikel terdispersi potensial yang dihasilkan oleh lapisan rangkap tersebut, menciptakan suatu pengaruh tolak menolak antara tetesan – tetesan minyak, sehingga mencegah penggabungan.
(Shaw, J.D, 1992)
7. Spektrofotometri UV-Vis
Spektrofotometri UV-Vis adalah salah satu teknik analisis spektroskopik yang memakai sumber radiasi elektromagnetik ultra violet dekat (190 – 380 nm) dan sinar tampak (380 – 180 nm). Radiasi ultraviolet jauh (100 – 190 nm) tidak dipakai sebab pada daerah radiasi tersebut diabsorbsi oleh udara. Suatu molekul sederhana apabila dikenakan radiasi elektromegnetik akan mengabsorbsi radiasi alektromegnetik yang energinya sesuai. Interaksi tersebut akan meningkatkan energi potensial elektron pada tingkat keadaan eksitasi. Apabila molekul yang sederhana tadi hanya terjadi transisi elektronik pada satu macam gugus, maka akan terjadi satu absorbsi yang merupakan garis spektrum.
Analisis dengan spektrofotometer UV-Vis selalu melibatkan pembacaan absorbansi radiasi elektromegnetik oleh molekul atau radiasi elektromagnetik yang diteruskan. Apabila suatu radiasi elektromagnetik dikenakan kepada suatu larutan dengan intensitas mula-mula (I0), maka sebagian radiasi tersebut akan diteruskan (It) dan sebagian akan diabsorbsi (Ia), sehingga :
Bouger, Lambert dan Beer membuat formula secara matematik hubungan antara transmitan atau absorban terhadap intensitas radiasi atau konsentrasi zat yang dianalisi dan tebal larutan yang mengabsorbsi sebagai :
T = t cb
Dimana T = persen transmitan
I0 = intensitas radiasi yang dating It = intensitas radiasi yang diteruskan = absorbansi molar (L. mol-1cm-1) c = konsentrasi (mol. L-1)
b = tebal larutan (cm)
A = absorbansi (Sastrohamidjojo, 1991)
8. Fourier Transform Infrared (FT-IR)
Suatu molekul dapat menyerap energi sinar inframerah (IR) apabila gerakan vibrasi dan rotasi dari molekul tersebut menghasilkan perubahan netto momen dwikutubnya, sehingga medan listrik bolak-balik dari sinar inframerah sama
dengan fekruensi vibrasi alamiah dari molekul tersebut, maka sinar inframerah akan terserap molekul. Daerah sinar infra merah (IR) yang terpenting dalam
pennetuan struktur suatu senyawa berkisar antara 4000 cm-1 – 300 cm-1 (Silverstein, et al, 1986). Ada dua macam gerakan vibrasi suatu molekul, yaitu vibrasi ulur dan vibrasi tekuk. Vibrasi ulur terdiri dari vibrasi simetri dan vibrasi asimetri sedangkan vibrasi tekuk terdiri dari vibrasi gunting (scissoring), goyang (rocking), kibas (wagging) dan putar (twisting). Fekruensi vibrasi ulur antara 2 atom dan ikatan yang menghubungkan dapat dihitung berdasarkan hokum Hooke (Sastrohamidjojo, 1991), dinyatakan dengan persamaan 5.
C = Kecepatan cahaya (3 x 1010 cm/det) K = Tetapan gaya untuk ikatan (Nm-1) μ = Massa dua atom (g)
Interpretasi serapan inframerah (IR) dari beberapa vibrasi gugus – gugus fungsi senyawa organik (Sastrohamidjojo, 1991) :
a. daerah ulur hidrogen (3700 – 2700 cm-1)
Puncak terjadi karena vibrasi ulur dari atom hidrogen dengan atom lainnya. Frekuensi jauh lebih besar sehingga interaksi dapat terabaikan. Puncak absorbsi timbul pada daerah 3700 – 3100 cm-1 karena vibrasi ulur dari OH atau NH. Ikatan hidrogen menyebabkan puncak melebar dan terjadi pergeseran kearah bilangan gelombang yang lebih pendek, sedangkan vibrasi CH alifatik timbul pada 3000 – 2850 cm-1. Perubahan struktur dari ikatan CH akan menyebabkan puncak bergeser kearah yang maksimum.
Rentangan NH muncul pada kisaran 3500 -3300 cm-1. Amin primer mempunyai dua serapan sedangkan amin sekunder mempunyai satu serapan. Amin tersier tidak memiliki rentang NH. Vibrasi bengkok NH pada amin primer menghasilkan serapan melebar pada kisaran 1640 – 1560 cm-1. Amin sekunder menyerap dekat 1600 cm-1. Rentang CN muncul pada daerah 1350 – 1000 cm-1.
b. daerah ikatan rangkap dua (1950 – 1550 cm-1)
vibrasi ulur dari gugus karbonil dapat dikarakterisasi seperti keton, aldehid asam, semuanya mempunyai puncak pada 1700 cm-1. Ester, halida–halida asam, anhidrida–anhidrida asama mengabsorbsi pada 1770 – 1725 cm-1 konjugasi menyebabkan puncak absorbsi menjadi lebih rendah sampai 1700 cm-1. Puncak yang disebabkan oleh vibrasi ulur dari –C=C- dan C=N terletak pada 1690 – 1600 cm-1. Cincin aromatik menunjukkan puncak dalam daerah 1650 – 1450 cm-1, yang dengan derajad substitusi rendah menunjukkan puncak pada 1600, 1580, 1500, dan 1450 cm-1.
c. daerah sidik jari terletak pada 1500 – 1700 cm-1
memastikan senyawa organik adalah dengan cara membandingkan dengan pembandingnya. Pita absorbsi dalam daerah ini disebabkan karena bermacam-macam interaksi, sehingga tidak mungkin dapat menginterpretasikan dengan tepat, walaupun kadang–kadang puncak yang kompleks ini dapat bermanfaat untuk identifikasi seperti C-O-C dalam eter dan ester yang mengabsorbsi pada 1200 cm-1, C-Cl pada 700 – 800 cm-1, SO42-, PO43-, NO3-, CO32- menunjukkan absorbsi kuat di bawah 1200 cm-1.
9. Pengambilan Ion Logam berat
Logam berat sangat banyak digunakan dalam kehidupan manusia, contohnya sebagai bahan pewarna industri plastik dan elektroplating. Keberadaan logam berat dapat menimbulkan dampak yang berbahaya bagi kesehatan. Ada beberapa
metode yang dapat digunakan untuk mengambil logam berat dari sumber pencemaran, antara lain adsorpsi, biosorpsi, ekstraksi cair-cair, transport membran cair, dan pertukaran ion (Palar, 1994).
Metode adsorpsi telah berhasil digunakan oleh Kisworo (2004) untuk mengambil ion logam cadmium (Cd) dalam limbah cair industri cat menggunakan alofan alam dengan prosentase penyerapan 82,1326%. Susilowati (2005) telah berhasil menggunakan metode biosorpsi dalam pengambilan logam seng (II). Susilowati menggunakan biomassa Aspergillus oryzae pada kondisi pH 5-7 dan waktu kontak 60 menit, dengan kapasitas penyerapan 217,0329 mg/g.
Metode ekstraksi telah digunakan Ariwibowo (2004) untuk mengambil ion logam Pb. Ekstraksi menggunakan Dibenzo-18-crown-6 dan metil orange sebagai
10. Spektrofotometer Serapan Atom (SSA)
SSA merupakan teknik spektrofotometer yang didasarkan absorbansi energi oleh atom. Untuk dapat terjadi proses absorpsi atom hal yang diperlukan adalah sumber radiasi monokromatik dan alat untuk menguapkan sampel dan memperoleh atom ground state dari unsur yang diharapkan. Metode ini sangat tepat untuk analisis zat pada konsentrasi rendah. Sekitar 70 unsur dapat ditentukan dengan SSA dengan besarnya konsentrsi sekitar 10 ppm untuk beberapa bahan yang sulit dan jarang, sampai dengan dibawah 1 ppb untuk mercuri.
Metode SSA berprinsip pada adsorbsi cahaya oleh atom. Atom-atom menyerap cahaya tersebut pada gelombag cahaya tertentu, tergantung pada sifat
unsurnya, misalkan natrium menyerap pada 589 nm, uranium menyerap pada 358,5 nm, sedangkan kalium pada 766,5 nm (Khopkar, S.M, 1990).
Sumber sinar pada SSA disebut hollow chatode lamp, setiap logam membutuhkan sumber sinar untuk memanaskannya. Hanya satu logam yang dapat dianalisa dalam satu pengukuran. Sebagai contoh, untuk menganalisa sampel perak maka harus digunakan lampu perak. Jika digunakan lampu multi unsur harus diset monokromator pada panjang gelombang logam (Shugar,1996)
B. Kerangka Pemikiran
Biotransformasi adalah proses mengubah bahan mentah menjadi produk yang lebih berharga melalui reaksi kimia yang melibatkan organisme. Minyak jagung yang mempunyai kandungan asam lemak jenuh dan asam lemak tidak jenuh dapat mengalami biotransformasi oleh aktivitas bakteri dan diperkirakan membentuk biosurfaktan, karena beberapa produk biotransformasi minyak dan lemak menghasilkan biosurfaktan, contohnya minyak zaitun mengalami
biotransformasi oleh Pseudomonas, sp menghasilkan biosurfaktan asam
Media berperan penting dalam biotransformasi minyak jagung oleh aktivitas bakteri, karena media adalah tempat tumbuh bakteri dan sumber nutrisi bagi bakteri. Media cair yang digunakan untuk biotransformasi minyak jagung adalah Tripticase Soy Broth (TSB), karena mengandung pepton, glukosa dan garam-garaman. Media fermentasi dilakukan penambahan minyak jagung ke dalam media cair, karena minyak jagung mempunyai kandungan asam lemak jenuh dan asam lemak tidak jenuh, maka minyak jagung dapat berfungsi sebagai substrat yang akan mengalami biotransformasi dan diperkirakan membentuk biosurfaktan. Asam lemak tak jenuh dalam minyak jagung cukup besar, maka kemungkinan besar ikatan rangkap pada asam lemak tak jenuh akan mengalami biotransformasi menjadi gugus hidroksil dan gugus keton.. Mikroorganisme yang
digunakan untuk biotransformasi minyak jagung adalah Rhodoccocus
rhodochrous karena sudah terbukti dapat melakukan biotransformasi beberapa asam lemak tidak jenuh menjadi suatu asam hidroksi alkanoat dan asam keto alkanoat.
Pada biotransformasi minyak jagung oleh aktivitas bakteri mempunyai kondisi optimal, karena dalam biotransformasi minyak jagung dipengaruhi oleh banyaknya sumber karbon dalam media fermentasi, lama fermentasi dan kondisi lingkungan. Pada penelitian ini, variasi konsentrasi minyak jagung dalam media fermentasi (v/v) dan lamanya fermentasi digunakan untuk memperoleh hasil biotransformasi minyak jagung yang optimal. Biotransformasi minyak jagung oleh R. rhodochrous kemungkinan dapat menghasilkan suatu biosurfaktan, maka untuk mengetahui kondisi optimal dalam biotransformasi minyak jagung oleh R. rhodochrous dilakukan pengamatan kepadatan sel bakteri (Optical Density/OD), tegangan permukaan dan indeks emulsi setiap harinya
Hasil dari biotransformasi minyak jagung oleh R. rhodochrous
penentuan indeks emulsi antara air dengan minyak sawit dan pengukuran tegangan permukaan minyak sawit.
Biosurfaktan dapat diaplikasikan sebagai adsorben logam, contohnya biosurfaktan jenis rhamnolipid telah digunakan untuk pengambilan logam Cd, Pb, dan Zn dari dalam tanah. Penggunaan rhamnolipid sebagai adsorben logam berdasarkan pada gugus hidroksil yang dimiliki rhamnolipid mampu berikatan dengan ion logam berat.(Herman, et al, 1995 dalam Erawati. S, 2007). Hasil biotransformasi minyak jagung diperkirakan membentuk biosurfaktan dan mempunyai gugus hidroksil dalam gugus karboksilat yang beasal dari asam lemak tidak jenuh, sehingga dapat diaplikasikan untuk pengambilan logam berat, misalnya Cd2+.
C. Hipotesis
1. Minyak jagung dapat mengalami biotransformasi oleh aktivitas R.
rhodochrous
2. Hasil biotransformasi minyak jagung mempunyai gugus hidroksil, gugus keton dan rantai panjang hidrokarbon.
3. Hasil biotransformasi minyak jagung oleh aktivitas R. rhodochrous
merupakan suatu biosurfaktan.
BAB III
METODOLOGI PENELITIAN
A. Metode penelitian
Penelitian ini dilakukan dengan metode eksperimental. Minyak jagung yang digunakan dianalisa menggunakan FT-IR untuk mengetahui gugus fungsi pada senyawa yang terkandung dalam minyak jagung. Kurva pertumbuhan
Rhodococcus rhodochrous ditentukan dengan kepadatan sel bakteri (Optical Density/OD) pada media inokulum menggunakan spektrofotometer UV-Vis.
Optimasi kondisi biotransformasi minyak jagung oleh Rhodoccocus rhodochrous dilakukan dengan variasi konsentrasi minyak jagung dalam media fermentasi, yaitu 0, 5%, 10%, dan 20% (v/v) dan lama fermentasi selama 12 hari.
Parameter optimasi kondisi adalah pengukuran OD menggunakan
spektrofotometer UV-Vis, pengukuran tegangan permukaan menggunakan metode kenaikan kapiler dengan zat pembanding air, penentuan indeks emulsi dengan cara membandingkan ketinggian terbentuknya emulsi dengan ketinggian total sistem emulsi.
Recovery hasil biotransformasi minyak jagung dilakukan dengan cara sentrifugasi dengan kecepatan 12500 rpm selama 20 menit, kemudian supernatan diekstraksi menggunakan pelarut dengan tingkat kepolaran meningkat yaitu n-heksana, kloroform, etil asetat dan butanol. Senyawa yang terekstrak pada masing-masing pelarut dilakukan uji tegangan permukaan dan indeks emulsi..
B. Tempat dan Waktu Penelitian
Penelitian dilakukan pada bulan Februari 2006 sampai Februari 2007. Produksi biosurfaktan dilakukan di Sub Laboratorium Biologi Pusat UNS. Identifikasi biosurfaktan dilakukan di Laboratorium Kimia FMIPA UGM. Karakterisis biosurfaktan yang diperoleh dan pengukuran konsentrasi logam Cd2+ yang terambil biosurfaktan dilakukan di Sub Laboratoriun Pusat UNS.
C. Alat dan Bahan
1. Alat yang dipergunakan adalah : a. Autocalave, Ogawa Seiki Co, LTD b. Sentrifuge, Sorvall Super T21
c. Vortex Mixer, Gemmy Industrial, Corp
d. Neraca Analitis, Mettler Toledo AT400 e. Peralatan gelas pyrek, Merck
f. Spektrofotometer UV VIS, Shimadzu UV-160 IPC
g. Seperangkat alat FT-IR h. PH meter, Corning
i. Seperangkat alat metode kenaikkan kapiler j. Seperangkat alat pengukuran indeks emulsifier k. Spektrofotometer AAS
l. Shaker, IKA labortechnik m. Hot Plate
n. Magnetic strirer o. Bunsen
p. Kawat ose
2. Bahan – bahan yang diperlukan adalah : a. Minyak jagung, Sunbeam
e. Kloroform, Merck
f. Butanol , Merck
g. Inokulum R. rhodochrous FNCC 0066 dibeli dari PAU UGM
h. Heksana , Merck i. Etil asetat , Merck j. Natrium sulfat, Merck
k. Kertas saring, whatman no 42 l. Cd(NO3)2, Merck
m. HNO3, Merck
n. Akuades o. Kapas steril p. Alumunium foil
q. Alkohol 96%
D. Prosedur Penelitian
Dalam prosedur penelitian ini dilakukan dengan urut. Setiap tahap yang dilakukan bertujuan untuk menentukan tahap penelitian selanjutnya. Diagram alir cara kerja tercantum dalam lampiran 1.
1. Analisa komposisi minyak jagung a. Analisa dengan menggunakan FT-IR
Minyak jagung dioleskan pada preparat dan diukur transmisinya pada bilangan gelombang 4000 cm-1 sampai 500 cm-1.
2. Produksi dan Optimasi Kondisi Biotransformasi Minyak Jagung a. Penyiapan Inokulum
R. rhodochrous disimpan dalam lemari pendingin (40C) sebagai biakan stok (stock culture) pada TSA (Trypticase Soy Agar). R. rhodochrous
b. Kurva Pertumbuhan Bakteri
1) Fermentasi dilakukan pada suhu kamar dengan kecepatan 150 rpm dalam tabung reaksi dengan volume 3 ml media cair selama 24 jam,
kemudian diambil 200 l dipindah ke 25 ml media fermentasi dishaker
150 rpm selama 24 jam, kemudian diambil 5 ml dipindah ke 125 ml media fermentasi dishaker 150 rpm selama 24 jam.
2) Bakteri yang telah ditumbuhkan ke dalam media dilakukan pengukuran absorbansi dengan menggunakan spektrofotometer UV-Vis setiap jam selama 18 jam selanjutnya setiap 3 jam sampai 24 jam.
c. Kultur Fermentasi
Media fermentasi dibuat dengan komposisi 30 g/Liter Triptic Soy Broth
dan minyak jagung, dengan variasi konsentrasi 0%, 5%, 10%, dan 20% (v/v). Fermentasi dilakukan pada suhu kamar dengan kecepatan 150 rpm dalam tabung reaksi dengan volume 3 ml media cair TSB selama 10 jam, kemudian diambil 200 µl dipindahkan kedalam 5 ml media fermentasi dengan konsentrasi minyak jagung 5% (v/v) dan dishaker selama 10 jam dengan kecepatan 150 rpm, kemudian diambil 200 µl dipindah kedalam 25 ml media fermentasi dishaker selama 10 jam dengan kecepatan 150 rpm. Setelah 10 jam, diambil 5 ml dipindah kedalam 125 ml media fermentasi. d. Optimasi Kondisi
Untuk optimasi kondisi akan dilakukan produksi biotransformasi minyak jagung dengan :
1) Variasi minyak jagung dalam media fermentasi, yaitu 0%, 5%, 10% dan 20% (v/v).
2) Variasi lama fermentasi, yaitu akan dilakukan pengamatan tiap hari dari 0-12 hari
a) Absorbansi
Sampel (media fermentasi) diukur absorbansi dengan
spektrofotometer UV-Vis pada panjang gelombang maksimum media TSB.
b) Tegangan permukaan
Pipa kapiler dicelupkan ke dalam media fermentasi dan diukur kenaikan larutan dalam pipa kapiler.
c) Indeks emulsi
Media fermentasi diambil 1 ml ditambah dengan minyak sawit 1 ml kemudian divortex selama 2 menit. Emulsi dibiarkan selama 24 jam. Tinggi emulsi yang masih tersisa dibagi tinggi total larutan merupakan indeks emulsi.
3. Recovery Hasil Biotransformasi Minyak Jagung
a. Media fermentasi disentrifugasi 12500 rpm, pada suhu 270C selama 20 menit diperoleh supernatan yang akan diekstraksi.
diperoleh senyawa dalam etil asetat. Fase air diekstraksi lagi dengan butanol, fase butanol diambil ditambah dengan 25 g Na2SO4 dan dibiarkan semalam kemudian dievaporasi pada suhu 90oC sampai tidak menetes lagi, diperoleh senyawa dalam butanol. Sisa fase air dievaporasi pada suhu 100oC sampai tidak menetes lagi , diperoleh senyawa dari sisa fase air. Hasil evaporasi masing-masing diukur tegangan permukaannya dan indeks emulsi. Pengukuran tegangan permukaan jika hasilnya berupa padatan, maka 0,2 gram dilarutkan dengan 2 ml aquades dan diukur kenaikan zat cairnya dalam pipa kapiler, jika hasilnya berupa cairan maka langsung diukur kenaikan zat cairnya dalam pipa kapiler. Penentuan indeks emulsi, jika hasilnya berupa padatan maka 0,2 gram dilarutkan dalam 1 ml aquades dan ditambah dengan minyak sawit sebanyak 1 ml kemudian
divortex selama 2 menit dan dibiarkan selama 24 jam, jika hasilnya berupa cairan, maka emulsi dibentuk dengan perbandingan sampel : minyak sawit : air = 1:2:2. Sampel dengan indeks emulsi terbesar dan mempunyai kemampuan menurunkan tegangan muka terbesar dianalisa dengan FT-IR yang selanjutnya dikarakterisasi.
4. Karakterisasi Hasil Biotrnasformasi Minyak Jagung dari Ekstrak Kloroform a. Identifikasi gugus fungsi dengan spektrofotometer FT-IR
Sampel ditambah dengan nujol dan dioleskan pada preparat kemudian dianalisa dengan FT-IR untuk mengetahui gugus-gugus fungsi yang ada. b. Penentuan indeks emulsi
c. Penentuan tegangan permukaan
Penentuan tegangan permukaan akan dilakukan dengan metode kenaikan kapiler dengan pembanding air. Hasil biotransformasi minyak jagung dari ekstrak kloroform yang ditambahkan ke dalam hidrokarbon (minyak sawit) sebesar 9 mg.
5. Aplikasi Hasil Biotransformasi Minyak Jagung
a. Supernatan hasil biotransformasi minyak jagung digunakan untuk pengambilan logam berat Cd2+.
Supernatan hasil biotransformasi minyak jagung sebanyak 2 ml ditambah larutan logam Cd2+ 2,5 ppm 8 ml, pada kondisi pH 6 waktu kontak 5 dan 10 menit, kemudian disaring dengan kertas saring Whatman 42. Filtrat yang diperoleh dianalisa dengan spektrofotometer serapan atom (SSA).
b. Hasil biotransformasi minyak jagung dari ekstrak kloroform digunakan untuk pengambilan logam berat Cd2+.
Hasil biotransformasi minyak jagung dari ekstrak kloroform sebanyak 0,01 g ditambahkan ke dalam larutan logam Cd2+ 2 ppm 10 ml, pada kondisi pH 6, waktu kontak 5 dan 10 menit, kemudian disaring dengan
kertas saring Whatman 42. Filtrat yang diperoleh dianalisa dengan SSA.
E. Teknik Pengumpulan Data dan Analisa Data
1. Optimasi kondisi
a. Spektrofotometer UV-Vis
gelombang maksimum dari media cair. Kemudian masing-masing sampel dianalisa dengan spektrofotometer UV-Vis, kondisi optimal diperoleh pada saat absorbansi mulai konstan.
b. Tegangan Permukaan
Tegangan permukaan diukur dengan metode kenaikkan kapiler. Besarnya tegangan permukaan dapat diketahui dengan persamaan:
air
dimana: γx = tegangan permukaan zat cair yang ditentukan γair = tegangan permukaan air
dair = berat jenis air dx = berat jenis zat cair hair = tinggi permukaan air hx = tinggi permukaan zat cair
Surfaktan bekerja untuk menurunkan tegangan permukaan suatu cairan karena surfaktan akan terakumulasi di permukaan dengan menurunkan energi bebas, sehingga pada optimasi kondisi biotransformasi minyak jagung dipilih kondisi yang mempunyai penurunan tegangan permukaan yang besar.
c. Indeks emulsi
Dua zat yang tidak saling terlarut dapat bercampur dengan adanya surfaktan karena surfaktan mempunyai sifat sebagai pengemulsi, sehingga pada optimasi kondisi dipilih kondisi yang mempunyai indeks emulsi terbesar.
Indeks emulsi dapat ditentukan dengan mencampur larutan media fermentasi dengan suatu senyawa hidro karbon dengan perbandingan volume 1:1. larutan tersebut kemudian dikocok dengan menggunakan vortex selama 2 menit dan dibiarkan selama 24 jam. Tinggi emulsi dibagi tinggi total adalah indeks emulsi yang diperoleh.
2. Karakterisasi Hasil Biotransformasi Minyak Jagung
Identifikasi dengan FT-IR akan menghasilkan puncak-puncak kromatogram yang akan memberikan informasi gugus fungsi yang ada dalam sampel. Dengan data tersebut dapat diperkirakan struktur dan gugus fungsi hasil biotransformasi minyak jagung dari ekstrak kloroform.
b. Indeks emulsi
Emulsi yang terbentuk antara air dan minyak sawit sebelum dan sesudah penambahan hasil biotransformasi minyak jagung dari ekstrak kloroform digunakan untuk penentuan indeks emulsi. Stabilitas emulsi diperoleh dengan mengukur emulsi yang masih tersisa selama 14 hari.
c. Penentuan tegangan permukaan
Penentuan tegangan permukaan minyak sawit dilakukan dengan menghitung tegangan permukaan minyak sawit sebelum dan sesudah
penambahan hasil biotransformasi minyak jagung dari ekstrak kloroform.
3. Aplikasi Hasil Biotransformasi Minyak Jagung a. Spektrofotometer Serapan Atom