SINTESIS BASA SCHIFF DARI HASIL KONDENSASI
ETILENDIAMIN DAN ANILINA DENGAN SENYAWA
ALDEHIDA HASIL OZONOLISIS METIL OLEAT
SERTA PEMANFAATANNYA SEBAGAI INHIBITOR
KOROSI PADA LOGAM SENG
SKRIPSI
SOPHIA FEBRIANY
NIM :100802020
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
SINTESIS BASA SCHIFF DARI HASIL KONDENSASI ETILENDIAMIN DAN ANILINA DENGAN SENYAWA ALDEHIDA HASIL OZONOLISIS
METIL OLEAT SERTA PEMANFAATANNYA SEBAGAI INHIBITOR KOROSI PADA LOGAM SENG
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
SOPHIA FEBRIANY
100802020
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
PERSETUJUAN
Judul : Sintesis Basa Schiff Dari Hasil Kondensasi Etilendiamin Dan Anilina Dengan Senyawa Aldehida Hasil Ozonolisis Metil Oleat Serta Pemanfaatannya Sebagai inhibitor Korosi Pada Logam Seng
Kategori : Skripsi
Nama : Sophia Febriany
Nomor Induk Mahasiswa : 100802020
Program : Sarjana (S1) Kimia
Departemen : Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui di
Medan, September 2014
Komisi Pembimbing :
Pembimbing II Pembimbing I
Drs. Darwis Surbakti,MS Dr. Mimpin Ginting, MS NIP:195307071983031001 NIP:195510131986011001
Diketahui/ Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
SINTESIS BASA SCHIFF DARI HASIL KONDENSASI ETILENDIAMIN
DAN ANILINA DENGAN SENYAWA ALDEHIDA HASIL OZONOLISIS METIL OLEAT SERTA PEMANFAATANNYA SEBAGAI
INHIBITOR KOROSI PADA LOGAM SENG
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, September 2014
PENGHARGAAN
Segala puji dan syukur penulis ucapkan kepada Tuhan Yang Maha Esa atas berkat dan rahmatNya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini sesuai dengan rencana dan kehendakNya. Banyak hal sebagai pembelajaran dan pembentukan diri dalam setiap diri penulis rasakan sehingga semakin melihat dan merasakan kebaikan dan kebesaranNya. Dalam pelaksanaan penelitian ini hingga penyelesaian skripsi ini, penulis menyadari banyak mendapat bantuan, dukungan maupun motivasi dari berbagai pihak. Untuk itu pada kesempatan ini penulis mengucapkan terima kasih kepada :
1. Bapak Dr.Mimpin Ginting, M.S sebagai pembimbing I dan Bapak Drs. Darwis Surbakti,MS sebagai pembimbing II dengan sabar telah memberikan bimbingan dan saran sehingga skripsi ini dapat selesai.
2. Ibu Dr. rumondang Bulan, M.S dan Bapak Drs. Albert Pasaribu, M.Sc sebagai Ketua dan Sekretaris Departemen Kimia FMIPA USU.
3. Bapak Prof. Dr. Jamaran Kaban, M.Sc selaku Ketua bidang Kimia Organik FMIPA USU.
4. Kepala laboratorium Kimia Organik FMIPA USU Medan Bapak Dr.Mimpin Ginting, M.S beserta Dosen dan Staff Laboratorium Kimia organik FMIPA USU.
5. Seluruh Dosen Departemen Kimia FMIPA USU yang telah memberikan waktunya untuk memberi bimbingan selama penulis mengikuti kuliah di Departemen Kimia FMIPA USU, terkhusus kepada bapak Dr. Minto Supeno,M.S sebagai dosen wali penulis.
6. Teman-teman Asisten Laboratorium Kimia Organik FMIPA USU (k’Sion, Bg Egi, K’Naomi, K’Menda, K’Despita, Dian, Yabes, Adek-adek 2011) 7. Teman-teman satu stambuk Kimia 2010 yang tidak dapat disebutkan
namanya satu persatu.
8. Pihak yang tidak disebutkan namun dengan tulus membantu penulis dalam menyelesaikan skripsi ini.
Akhirnya saya mengucapkan terima kasih yang sebesar-besarnya kepada orang tua saya (I. Ginting dan R. br Sembiring) yang dengan doa dan cintanya mengorbankan banyak hal untuk membesarkan, mendidik saya, dan mengajarkan banyak hal dengan penuh kesabaran dalam kehidupan saya serta selalu ada memberikan dukungan dalam segala hal. Terima kasih kepada adik-adikku (Imas Agusnedi Ginting dan Brema Krisbastanta Ginting) atas doa dan dukungannya.Semoga Tuhan memberkati kita semua.
SINTESIS BASA SCHIFF DARI HASIL KONDENSASI ETILENDIAMIN
DAN ANILINA DENGAN SENYAWA ALDEHIDA HASIL OZONOLISIS METIL OLEAT SERTA PEMANFAATANNYA SEBAGAI
INHIBITOR KOROSI PADA LOGAM SENG
ABSTRAK
Telah dilakukan sintesis Basa Schiff melalui kondensasi senyawa aldehida campuran hasil ozonolisis dari metil oleat campuran dengan dua sumber amina yaitu etilendiamin (Basa Schiff I) dan anilina (Basa Schiff II), dilanjutkan uji aktivitasnya sebagai inhibitor korosi terhadap logam seng dalam media HCl 0,1 N. Ozonolisis terhadap metil oleat campuran dilakukan pada suhu sekitar -5 sampai 5oC dalam pelarut metanol dan KI 5% selama 20 jam dengan menggunakan ozonisator dilanjutkan reduksi dengan Zn dalam larutan asam asetat. Kondensasi aldehida campuran dengan etilendiamina dan anilina dilakukan dengan cara refluks pada suhu 115-120oC dalam pelarut toluena selama 4 jam. Dari 200 ml metil oleat campuran yang diozononolis diperoleh 137 ml campuran aldehida. Selanjutnya dari 10 g campuran aldehida yang dikondensaikan dengan etilendiamina dihasilkan 9,3 g Basa Schiff yang kemudian dianalisa melalui Spektroskopi FT-IR menunjukkan adanya uluran C=N pada puncak spektrum daerah bilangan gelombang 1635,64 cm-1. Reaksi lainnya 10g campuran aldehida yang dikondensaikan dengan anilina dihasilkan 9 g Basa Schiff yang kemudian dianalisa melalui Spektroskopi FT-IR menunjukkan adanya uluran C=N pada puncak spektrum daerah bilangan gelombang 1651,07 cm-1. Uji aktivitas Basa Schiff sebagai inhibitor korosi pada konsentrasi 1000 ppm hingga 7000 ppm memberikan nilai efisiensi rata-rata yang lebih besar dimana nilai efisiensi rata-rata yang paling besar adalah Basa Schiff hasil reaksi aldehida dengan anilina (Basa Schiff II) pada konsentrasi 7000 ppm yaitu sebesar 80,094 % sedangkan Basa Schiff hasil reaksi aldehida dengan etilendiamina (Basa Schiff I) hanya sebesar 73,301 %.
SYNTHESIS OF SCHIFF BASES FROM CONDENSATION REACTION OF ETHYLENEDIAMINE AND ANILINE WITH ALDEHYDES
WHICH RESULT BY OZONOLYSIS OF METHYL OLEIC AND THE ACTIVITY TEST AS AN INHIBITOR OF
CORROSION ON METAL ZINK.
ABSTRACT
Schiff Bases have been synthesized through the condensation of mixture of aldehydes which results by ozonolysis of methyl oleic with two source of amine that is ethylenediamine (Schiff Bases I) and aniline (Schiff Bases II), continued its activity test as an inhibitor of corrosion on zinc metal in the medium of HCl 0.1 N. Ozonolysis of methyl oleic has done at a temperature of about -5 to 5° C in methanol and 5% KI for 20 hours by using the ozonisator and then reduced with Zn in acetic acid solution. Condensation reaction of mixture aldehydes with ethylenediamine and aniline has done by reflux at a temperature of 115-120oC in the toluene solvent for 4 hours. From 200 ml of methyl oleic which have been ozonolysis can be obtained 137 ml mixture of aldehydes. Furthermore, from 10g mixture of aldehydes which have been condensation with ethylenediamine can be obtained 9.3 g of Schiff Bases and the analysis by FT-IR spectroscopy showed the presence of C=N stretch at peak spectral wave number region 1635,64 cm-1. The other reaction that 10g mixture of aldehydes which have been condensation with aniline can be obtained 9 g of Schiff Bases and the analysis by FT-IR spectroscopy showed the presence of C=N stretch at peak spectral wave number region 1651,07 cm-1. Activity test Schiff bases as corrosion inhibitor at a concentration of 1000 ppm to 7000 ppm gave values greater efficiency where the greatest efficiency is Schiff Bases of reaction aldehyde with aniline (Schiff Bases II) at a concentration of 7000 ppm is equal to 80.094%, while Schiff Bases of reaction aldehyde with ethylenediamine (Schiff Bases I) respective each only 73,301 %.
DAFTAR ISI
Daftar Lampiran xii
BAB 1. Pendahuluan
1.1. Latar Belakang 1
1.2. Permasalahan 4
1.3. Pembatasan Masalah 4
1.4. Tujuan Penelitian 5
1.5. Manfaat Penelitian 5
1.6. Lokasi Penelitian 6
1.7. Metodologi Penelitian 6
BAB 2. Tinjauan Pustaka
2.1. Oleokimia 8
2.7. Etilendiamin 21
2.8. Anilina 22
2.9. Basa Schiff 23
2.10. Logam Seng 25
2.11. Korosi 26
2.11.1. Pencegahan Korosi 27
2.11.2. Inhibitor Korosi 28
2.11.3. Teknik Penentuan Efisiensi Inhibitor 29 BAB 3. Metode Penelitian
3.1. Alat-alat 31
3.2. Bahan-bahan 32
3.3. Prosedur Penelitian 33
3.3.1.Pembuatan Reagen 33
3.3.1.1. Pembuatan larutan KI 5% 33
3.3.1.3. Pembuatan larutan Na2S2O3 0,1 N 33
3.3.6. Analisa Bilangan Iodin 36
3.3.7.Penentuan Efisiensi Inhibitor 37
3.3.7.1. Persiapan Spesimen 37
3.3.7.2. Pembuatan Larutan Induk Korosif 37 3.3.7.3. Pembuatan Larutan Induk Inhibitor 37
3.3.7.4. Uji Efisiensi Inhibitor 37
3.3.8. Analisa dengan Spektroskopi FT-IR 38
3.4. Bagan Penelitian 39
3.4.1. Pembuatan Metil Oleat Campuran 39
3.4.2. Ozonolisis Metil Oleat Campuran membentuk
Campuran Aldehida Turunan Metil Oleat 40
3.4.3. Sintesis Basa Schiff dari Campuran Aldehida BAB 4. Hasil dan Pembahasan
4.1. Hasil Penelitian 45
4.1.1. Pembuatan Metil Oleat Campuran melalui Reaksi
Esterifikasi 45
4.1.2. Ozonolisis Metil Oleat Campuran 46 4.1.3. Sintesis Basa Schiff dari Campuran Aldehida
Turunan Metil Oleat dengan Etilendiamin
(Basa Schiff I). 47
4.1.4. Sintesis Basa Schiff dari Campuran Aldehida Turunan Metil Oleat dengan Anilina (Basa Schiff II) 48 4.1.5. Penentuan Bilangan Iodin 49
4.1.6. Penentuan Efisiensi Inhibitor Korosi 50
4.2.1. Pembuatan Metil Oleat Campuran melalui Reaksi
Esterifikasi 52 4.2.2. Ozonolisis Metil Oleat Campuran membentuk
Campuran Aldehida Turunan Metil Oleat 53 4.2.3. Hasil Sintesis Basa Schiff melalui Reaksi Kondensasi
Campuran Aldehida turunan Metil Oleat Campuran dengan Etilendiamina (Basa Schiff I) 55
4.2.4. Hasil Sintesis Basa Schiff melalui Reaksi Kondensasi Campuran Aldehida turunan Metil Oleat Campuran
dengan Anilina (Basa Schiff II) 56
4.2.5. Hasil Penentuan Efisiensi Inhibitor Korosi 58
BAB 5. Kesimpulan dan Saran
5.1. Kesimpulan 64
5.2. Saran 64
DAFTAR TABEL
Nomor Judul Halaman Tabel
Tabel 2.1. Diagram Alur Proses Oleokimia dari Bahan Dasar Minyak
atau Lemak Menjadi Oleokimia dan Turunan Oleokimia 9 Tabel 2.2. Asam Lemak Jenuh Yang Terdapat di Dalam Lemak dan
Minyak 11
Tabel 2.3. Asam Lemak Tak Jenuh Yang Terdapat di Dalam Lemak
dan Minyak 12
Tabel 4.1. Komposisi Asam Lemak Pada Asam Oleat 46
Tabel 4.2. Hasil Uji Bilangan Iodin 50
Tabel 4.3. Nilai Efisiensi Inhibitor Rata-Rata dari Asam Oleat Campuran, Metil Oleat Campuran, Aldehida Turunan Metil Oleat Campuran, Etilendiamin, Anilina, Basa Schiff I, Basa Schiff II dalam Larutan Media Korosif
HCl 0,1 N 51
DAFTAR GAMBAR
Nomor Judul Halaman Gambar
Gambar 2.1. Struktur Asam Lemak Jenuh 10
Gambar 2.2. Struktur Asam Lemak Tak Jenuh 10
Gambar 2.3. Struktur Cis dan Trans Asam Oleat 13
Gambar 2.4. Reaksi Oksidasi Alkena oleh Ozon 16
Gambar 2.5. Reaksi Reduksi Ozonida menjadi Aldehida 17 Gambar 2.6. Reaksi Oksidasi Ozonida menjadi Aldehida 17
Gambar 2.7. Struktur Aldehida 17
Gambar 2.8. Mekanisme Reaksi Adisi Nukleofilik pada Aldehida atau Keton 20
Gambar 2.9. Struktur Kimia Etilendiamina 22
Gambar 2.10. contoh reaksi pembentukan N-(1,1-dimetil etil)-2-metil
propilimina 23
Gambar 4.1. Spektrum FT-IR Metil Oleat Campuran 45 Gambar 4.2. Spektrum FT-IR Spektrum FT-IR campuran aldehida
turunan Metil Oleat Campuran 47
Gambar 4.3. Spektrum FT-IR Basa Schiff I 48
Gambar 4.4. Spektrum FT-IR Basa Schiff II 49
Gambar 4.5. Reaksi Pembentukan Metil Oleat Campuran 52 Gambar 4.6. Reaksi Ozonolisis Metil Oleat Campuran membentuk
Campuran Aldehida Turunan Metil Oleat 54
Gambar 4.7. Reaksi Pembentukan Basa Schiff I 56
Gambar 4.8. Reaksi Pembentukan Basa Schiff II 57
Gambar 4.9. Grafik Pengaruh Waktu Perendaman dan Variasi Konsentrasi Inhibitor Korosi terhadap Kehilangan
Berat Lempeng Seng. 61
Gambar 4.10. Grafik Pengaruh Waktu Perendaman dan Variasi Konsentrasi Inhibitor Korosi terhadap efisiensi inhibitor. 62 Gambar 4.11. Grafik pengaruh konsentrasi inhibitor terhadap rata-rata
DAFTAR LAMPIRAN
Nomor Judul Halaman
Lampiran
Lampiran 1. Kromatogram GC Komposisi Asam Oleat Campuran 71
Lampiran 2. Perhitungan Pembuatan Larutan Standar 73 Lampiran 3. Data dan hasil perhitungan nilai bilangan iodin asam oleat
campuran, metil oleat campuran, campuran aldehida metil oleat, Basa Schiff I dan Basa Schiff II. 75 Lampiran 3. Data dan Hasil Perhitungan nilai Efisiensi Inhibitor Korosi 86 Lampiran 4. Uji Pereaksi Fehling dan Tollens Terhadap Campuran
Aldehida Turunan Metil Oleat 90
SINTESIS BASA SCHIFF DARI HASIL KONDENSASI ETILENDIAMIN
DAN ANILINA DENGAN SENYAWA ALDEHIDA HASIL OZONOLISIS METIL OLEAT SERTA PEMANFAATANNYA SEBAGAI
INHIBITOR KOROSI PADA LOGAM SENG
ABSTRAK
Telah dilakukan sintesis Basa Schiff melalui kondensasi senyawa aldehida campuran hasil ozonolisis dari metil oleat campuran dengan dua sumber amina yaitu etilendiamin (Basa Schiff I) dan anilina (Basa Schiff II), dilanjutkan uji aktivitasnya sebagai inhibitor korosi terhadap logam seng dalam media HCl 0,1 N. Ozonolisis terhadap metil oleat campuran dilakukan pada suhu sekitar -5 sampai 5oC dalam pelarut metanol dan KI 5% selama 20 jam dengan menggunakan ozonisator dilanjutkan reduksi dengan Zn dalam larutan asam asetat. Kondensasi aldehida campuran dengan etilendiamina dan anilina dilakukan dengan cara refluks pada suhu 115-120oC dalam pelarut toluena selama 4 jam. Dari 200 ml metil oleat campuran yang diozononolis diperoleh 137 ml campuran aldehida. Selanjutnya dari 10 g campuran aldehida yang dikondensaikan dengan etilendiamina dihasilkan 9,3 g Basa Schiff yang kemudian dianalisa melalui Spektroskopi FT-IR menunjukkan adanya uluran C=N pada puncak spektrum daerah bilangan gelombang 1635,64 cm-1. Reaksi lainnya 10g campuran aldehida yang dikondensaikan dengan anilina dihasilkan 9 g Basa Schiff yang kemudian dianalisa melalui Spektroskopi FT-IR menunjukkan adanya uluran C=N pada puncak spektrum daerah bilangan gelombang 1651,07 cm-1. Uji aktivitas Basa Schiff sebagai inhibitor korosi pada konsentrasi 1000 ppm hingga 7000 ppm memberikan nilai efisiensi rata-rata yang lebih besar dimana nilai efisiensi rata-rata yang paling besar adalah Basa Schiff hasil reaksi aldehida dengan anilina (Basa Schiff II) pada konsentrasi 7000 ppm yaitu sebesar 80,094 % sedangkan Basa Schiff hasil reaksi aldehida dengan etilendiamina (Basa Schiff I) hanya sebesar 73,301 %.
SYNTHESIS OF SCHIFF BASES FROM CONDENSATION REACTION OF ETHYLENEDIAMINE AND ANILINE WITH ALDEHYDES
WHICH RESULT BY OZONOLYSIS OF METHYL OLEIC AND THE ACTIVITY TEST AS AN INHIBITOR OF
CORROSION ON METAL ZINK.
ABSTRACT
Schiff Bases have been synthesized through the condensation of mixture of aldehydes which results by ozonolysis of methyl oleic with two source of amine that is ethylenediamine (Schiff Bases I) and aniline (Schiff Bases II), continued its activity test as an inhibitor of corrosion on zinc metal in the medium of HCl 0.1 N. Ozonolysis of methyl oleic has done at a temperature of about -5 to 5° C in methanol and 5% KI for 20 hours by using the ozonisator and then reduced with Zn in acetic acid solution. Condensation reaction of mixture aldehydes with ethylenediamine and aniline has done by reflux at a temperature of 115-120oC in the toluene solvent for 4 hours. From 200 ml of methyl oleic which have been ozonolysis can be obtained 137 ml mixture of aldehydes. Furthermore, from 10g mixture of aldehydes which have been condensation with ethylenediamine can be obtained 9.3 g of Schiff Bases and the analysis by FT-IR spectroscopy showed the presence of C=N stretch at peak spectral wave number region 1635,64 cm-1. The other reaction that 10g mixture of aldehydes which have been condensation with aniline can be obtained 9 g of Schiff Bases and the analysis by FT-IR spectroscopy showed the presence of C=N stretch at peak spectral wave number region 1651,07 cm-1. Activity test Schiff bases as corrosion inhibitor at a concentration of 1000 ppm to 7000 ppm gave values greater efficiency where the greatest efficiency is Schiff Bases of reaction aldehyde with aniline (Schiff Bases II) at a concentration of 7000 ppm is equal to 80.094%, while Schiff Bases of reaction aldehyde with ethylenediamine (Schiff Bases I) respective each only 73,301 %.
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Korosi adalah penurunan mutu logam akibat reaksi elektrokimia dengan lingkungan (Trethewey dan Chamberlain, 1991). Korosi merupakan masalah besar bagi peralatan yang menggunakan material dasar logam seperti mobil, jembatan, mesin kapal dan lain sebagainya (Riegher, 1992). Bahan logam ini mudah mengalami kerusakan dan kehilangan fungsi karena terjadi korosi, dimana terjadinya korosi pada peralatan ini tidak dapat dicegah tetapi lajunya dapat dikurangi (Callister, 1991).
Pada kondisi alam, korosi logam kebanyakan disebabkan oleh uap air, lingkungan yang bersifat asam, garam dan suhu lingkungan yang sangat tinggi. Lingkungan dengan kadar garam tinggi seperti air laut akan menyebabkan korosi lebih cepat, karena air yang mengandung garam mempunyai sifat elektrolit, yang akan memberikan suasana yang mendukung terjadinya reaksi oksidasi-reduksi (Sulaiman, 1978).
Basa Schiff merupakan senyawa organik produk kondensasi dari amina primer dengan senyawa karbonil. Basa Schiff dilaporkan pertama kali oleh seorang bernama Hugo Schiff pada tahun 1986. Basa Schiff tersebut memperlihatkan karakteristik berupa gugus imin (-HC=N-) dalam strukturnya (Cimerman et al, 1997).
Beberapa hasil penelitian sebelumnya telah mengkaji bahwa Basa Schiff yakni senyawa yang mengandung gugus RCH=NR’ sebagai inhibitor korosi diantaranya Basa Schiff hasil kondensasi sinamaldehid dengan 2-aminofenol dan mengujikan Basa Schiff terhadap logam besi dalam media HCl 0,5N dan diperoleh nilai efisiensi inhibitor sebesar 92% (Qasim, 2011) .Singh and Quraishi (2012) menguji efisiensi inhibitor korosi Basa Schiff etilendiamin bis-isatin terhadap logam lunak dalam HCl 1N dan diperoleh nilai efisiensi inhibitor sebesar 93%.
Menurut (Munir,1985) , terdapat perbedaan hasil pada pengggunaan amina primer alifatis dan amina primer aromatis dalam pembuatan Basa Schiff. Basa Schiff yang memiliki cincin aromatis dalam strukturnya memiliki sistem konjugasi yang lebih efektif karena bersifat lebih stabil dibandingkan menggunakan senyawa rantai alifatis.
Peneliti lainnya juga telah memanfaatkan asam lemak tidak jenuh dari minyak nabati sebagai sumber aldehida melalui reaksi ozonolisis yang selanjutnya dikondensasikan dengan amina primer, diantaranya Basa Schiff hasil kondensasi antara aldehida turunan minyak kelapa sawit dengan kitosan sebagai sumber amina primer dimana pengujiannya digunakan sebagai inhibitor korosi terhadap logam seng dalam media HCl 0,5N memberikan nilai efisiensi inhibisi korosi sebesar 76% pada konsentrasi 20.000 ppm (Parry, 2013). Demikian juga Basa Schiff hasil kondensasi anilina dengan aldehida turunan minyak kemiri dimana pengujian digunakan sebagai inhibitor korosi terhadap logam seng dalam media H2SO4 0,1N memberikan nilai efisiensi inhibisi korosi sebesar 69,57% pada konsentrasi 5.000 ppm (Ginting, 2013). Penelitian lainnya yaitu Basa Schiff hasil kondensasi aldehida turunan minyak jarak dengan etilendiamin sebagai sumber amina primer dimana pengujian digunakan sebagai inhibitor korosi terhadap logam seng dalam media HCl 0,1N memberikan nilai efisiensi inhibisi korosi sebesar 77,37% pada konsentrasi 7.000 ppm (Sinulingga, 2013).
Dari uraian yang dikemukaan diatas peneliti tertarik untuk mensintesis Basa Schiff dengan memanfaatkan asam lemak tak jenuh yaitu asam oleat campuran dimana asam oleat campuran diesterkan terlebih dahulu membentuk metil oleat campuran. Metil oleat campuran kemudian diozonolisis dan diikuti reaksi kondensasi dengan membandingkan dua jenis senyawa sumber amina yaitu etilendiamin dan anilina diikuti uji efisiensi Basa Schiff yang diperoleh sebagai inhibitor korosi terhadap logam seng dalam media HCl 0,1N.
1.2.Permasalahan
1. Apakah Basa Schiff dapat disintesis melalui kondensasi anilina dan etilendiamin dengan senyawa aldehida yang diperoleh dari hasil ozonolisis metil oleat campuran.
2. Bagaimanakah nilai efisiensi inhibitor korosi kedua jenis Basa Schiff yang dihasilkan sebagai inhibitor korosi terhadap logam seng dibandingkan dengan bahan baku sintesa yaitu:
a. asam oleat campuran b. metil oleat campuran
c. campuran aldehida turunan metil oleat d. etilendiamin dan
e. anilina.
dan pemilihan Basa Schiff yang paling efisien digunakan sebagai inhibitor pada logam seng.
1.3. Pembatasan Masalah
1. Sampel yang digunakan adalah asam oleat campuran.
3. Material yang digunakan adalah plat seng yang dibeli dipasaran dan dibentuk dengan ukuran 5 x 1,5 cm.
4. Inhibitor korosi yang digunakan diaplikasikan pada larutan HCl 0,1 N. 5. Metode penentuan effisiensi inhibitor yang digunakan adalah metode
kehilangan berat.
6. Konsentrasi inhibisi korosi yang digunakan dengan beda penambahan masing-masing yaitu 0 ppm, 1000 ppm, 3000 ppm, 5000 ppm, 7000 ppm. 7. Waktu perendaman yang digunakan adalah 24 jam, 48 jam, 72 jam, 96
jam, 120 jam pada temperatur ruangan.
1.4. Tujuan Penelitian
1. Untuk mensintesis Basa Schiff campuran yang diperoleh melalui ozonolisis metil oleat campuran yang diikuti kondensasi dengan etilendiamin dan anilina.
2. Untuk mengetahui Basa Schiff campuran yang dihasilkan berpotensi sebagai efisiensi inhibitor korosi terhadap logam seng dibandingkan dengan asam oleat campuran, metil oleat campuran, campuran aldehida turunan metil oleat, etilendiamin dan anilina dan pemilihan Basa Schiff yang paling efisien digunakan sebagai inhibitor pada logam seng.
1.5. Manfaat Penelitian
1.6. Lokasi Penelitian
Penelitian untuk pembuatan metil oleat campuran, ozonolisis metil oleat campuran, pembuatan Basa Schiff dan penimbangan berat spesimen seng dilakukan di Laboratorium Kimia Organik FMIPA USU Medan, analisis Kromatografi Gas dan uji bilangan iodin dilakukan di salah satu Laboratorium perusahaan swasta di Medan, analisa Spektroskopi FT-IR dilakukan di laboratorium Kimia Organik FMIPA UGM Yogyakarta.
1.7. Metodologi Penelitian
Penelitian yang dilakukan bersifat eksperimen laboratorium. Asam oleat campuran diesterifikasi dengan metanol absolut membentuk metil oleat campuran. Metil oleat campuran kemudian diozonolisis dengan menggunakan ozonisator selama 20 jam dimana hasil reaksi direduksi dengan serbuk Zn dan asam asetat encer dan diaduk hingga merata. Campuran disaring untuk memisahkan endapan Zn(CH3COO)2, selanjutnya dicuci dengan aquadest dan didestilasi vakum untuk memisahkan sisa asam asetat dan air. Aldehida dari metil oleat campuran kemudian dipisahkan menjadi dua bagian. Bagian pertama direaksikan dengan etilendiamin dengan cara direfluks selama 4 jam pada suhu 115-120⁰C dalam pelarut toluena. Hasilnya kemudian didestilasi vakum untuk menguapkan sisa etilendiamin dan pelarut toluena sehingga diperoleh Basa Schiff I. Bagian kedua direaksikan dengan anilina dengan cara direfluks selama 4 jam pada suhu 115-120⁰C dalam pelarut toluena. Hasilnya kemudian didestilasi vakum untuk menguapkan sisa anilina dan pelarut toluena sehingga diperoleh Basa Schiff II. Kedua Basa Schiff tersebut kemudian diuji efisiensi inhibitor korosinya terhadap logam seng dalam media HCl 0,1 N.
Adapun variabel-variabel untuk penentuan effisiensi inhibitor korosi dalam penelitian ini adalah
1. Variabel terikat
a. Kehilangan berat seng akibat korosi. 2. Variabel tetap
a. Volume campuran (50 mL) b. Temperatur (temperatur ruangan) c. Berat seng tanpa inhibitor (HCl 0,1 N) 3. Variabel bebas
BAB 2
TINJAUAN PUSTAKA
2.1. Oleokimia
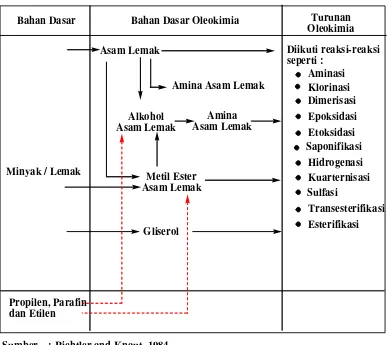
Tabel 2.1. Diagram Alur Proses Oleokimia dari Bahan Dasar Minyak atau
Lemak menjadi Oleokimia dan Turunan Oleokimia
Bahan Dasar Bahan Dasar Oleokimia Turunan
Oleokimia
Minyak / Lemak
Asam Lemak Diikuti reaksi-reaksi
seperti :
Sumber : Richtler and Knaut, 1984 : Alami
: Sintesis
Gliserol
2.2.Asam lemak
Asam lemak merupakan asam karboksilat alifatis berantai panjang (Sastrohamidjojo, 2005). Jenis asam lemak menjadi penentu perbedaan sifat dari trigliserida namun komponen gliserol bersifat identik untuk setiap trigliserida. Beberapa aspek yang membedakan jenis asam lemak yaitu:
d. Konfigurasi dari atom hidrogen yang berikatan dengan karbon berikatan rangkap, posisi cis atau trans dan
e. Posisi dari ikatan asam lemak dengan gliserol
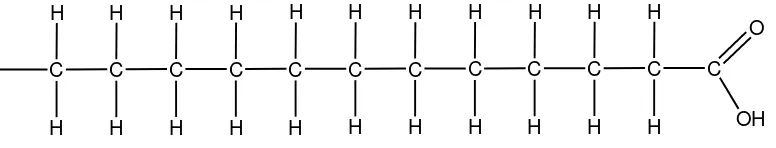
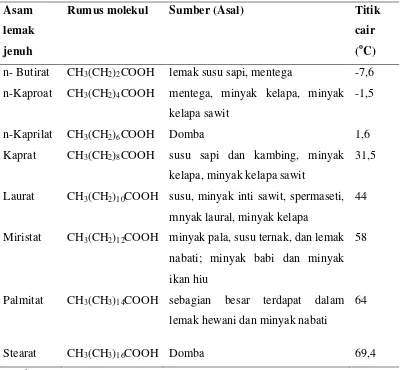
Asam lemak ditemukan dalam lemak makanan pada panjang rantai karbon 4-24 atom karbon (O’brien, 2009). Asam lemak sebagai penyusun lemak ini dapat dibedakan antara asam lemak jenuh dan tak jenuh. Asam lemak disebut jenuh bila semua atom karbon dalam rantainya diikat tidak kurang daripada dua atom hidrogen, sehingga dengan demikian tidak ada ikatan rangkap. Asam-asam lemak jenuh yang telah dapat diidentifikasi sebagai bagian dari lemak mempunyai atom C4 hingga C26. Jenis-jenis asam lemak jenuh dijelaskan pada tabel 2.2.
Adapun struktur umum rantai karbon dari asam lemak jenuh adalah sebagai berikut:
Gambar 2.1. Struktur asam lemak jenuh
Asam-asam lemak yang didalam rantai karbonnya mengandung ikatan rangkap dinamakan sebagai asam lemak tak jenuh. Derajat ketidakjenuhan dari minyak tergantung pada jumlah rata-rata dari ikatan rangkap didalam asam lemak. Jenis-jenis asam lemak tak jenuh dijelaskan pada tabel 2.3.
H2
C (CH2)4 C
H CH (CH2)7 C OH
O
Gambar 2.2. Struktur asam lemak tak jenuh
Rantai karbon dari asam lemak tak jenuh (Sastrohamidjojo, 2005).
alkohol daripada garam dari asam lemak yang mempunyai berat molekul tinggi dan jenuh (Winarno, 1984). Asam oleat mempunyai rantai karbon yang sangat panjang dengan asam stearat, tetapi pada suhu kamar, asam oleat berupa bentuk cairan. Disamping itu, makin banyak jumlah ikatan rangkap pada suatu asam lemak maka makin rendah titik leburnya (Poedjiadi, 1994).
Tabel 2.2. Asam Lemak Jenuh yang Terdapat dalam Lemak dan Minyak
Sumber : Ketaren, 2008 Asam
lemak
jenuh
Rumus molekul Sumber (Asal) Titik
cair
(oC)
n- Butirat CH3(CH2)2COOH lemak susu sapi, mentega -7,6 n-Kaproat CH3(CH2)4COOH mentega, minyak kelapa, minyak
kelapa sawit
-1,5
n-Kaprilat CH3(CH2)6COOH Domba 1,6
Kaprat CH3(CH2)8COOH susu sapi dan kambing, minyak kelapa, minyak kelapa sawit
31,5
Laurat CH3(CH2)10COOH susu, minyak inti sawit, spermaseti, mnyak laural, minyak kelapa
44
Miristat CH3(CH2)12COOH minyak pala, susu ternak, dan lemak nabati; minyak babi dan minyak ikan hiu
58
Palmitat CH3(CH3)14COOH sebagian besar terdapat dalam lemak hewani dan minyak nabati
64
Tabel 2.3. Asam Lemak Tidak Jenuh yang Terdapat dalam Lemak dan
Minyak
Sumber: Ketaren, 2008
Hampir semua asam lemak yang terdapat dalam alam mempunyai jumlah atom karbon yang genap karena asam ini dibiosintesis dari gugus asetil berkarbon dua dalam asetil koenzim A (Fessenden dan Fessenden, 1992).
2.3.Asam Oleat
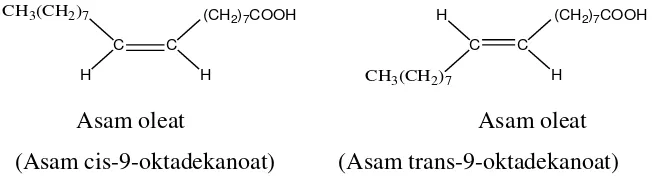
Asam oleat merupakan penyusun dari lemak-lemak tanaman atau hewan. Asam oleat dapat dipisahkan dari zat tersebut dengan cara hidrolisis, sebagian asam oleat berada bersama-sama dengan asam stearat dan asam palmitat. Struktur asam oleat adalah CH3(CH2)7CH=CH(CH2)7COOH. Asam lemak yang tidak jenuh ini masing-masing mempunyai bentuk cis yaitu asam oleat dan trans dari asam oleat sering juga disebut asam allooleat. Asam oleat membentuk cis karena mempunyai titik lebur yang rendah dan pembakaran yang tinggi.
Asam lemak tak jenuh
Rumus molekul Sumber (asal) Titik cair(o
Bentuk struktur asam oleat dalam bentuk cis dan trans yakni sebagai berikut:
C C
H
(CH2)7COOH
H CH3(CH2)7
C C
H (CH2)7COOH
H CH3(CH2)7
Asam oleat Asam oleat (Asam cis-9-oktadekanoat) (Asam trans-9-oktadekanoat)
Gambar 2.3. Struktur cis dan trans asam oleat.
(Sastrohamidjojo, 2005).
Asam oleat, asam linoleat dan asam linolenat biasanya terdapat bersama dengan asam lemak lain seperti asam laurat, asam miristat, asam palmitat, asam stearat dan asam lemak lainnya. Asam lemak tidak jenuh tersebut dapat diubah ke berbagai bentuk turunannya antara lain dalam pembentukan ester asam lemak dengan poliol seperti sorbitol, manitol dan sebagainya untuk membentuk surfaktan. Ester asam lemak dengan poliol tersebut memiliki sifat surfaktan karena disamping memiliki gugus ester juga masih memiliki gugus hidroksil sehingga terjadi keseimbangan antara gugus yang bersifat lipofil dengan gugus yang bersifat hidrofil (Tarigan, 2005). Penelitian tentang asam oleat telah banyak dikembangkan, misalnya dalam pembuatan bahan bakar alternatif (biodiesel). Asam oleat dikonversi menjadi produk biodiesel di unit reaksi dengan penambahan alkohol dan katalis, kemudian dimurnikan di unit pemisahan (Kusmiyati, 2008)
2.4.Ester Asam Lemak
dibentuk melalui reaksi langsung antara suatu asam karboksilat dengan alkohol yang disebut dengan reaksi esterifikasi (Shreve, 1 956). Yang dikelompokkan sebagai ester asam lemak meliputi:
a. Ester karboksilat tunggal dengan panjang rantai karbon mulai dari C6 sampai C20.
b. Ester asam lemak yang hanya mengandung karbon, hidrogen dan oksigen c. Ester alkohol dari asam lemak tersebut diatas termasuk juga dalam
kelompok ester asam lemak
Ester yang paling sederhana adalah metil ester asam lemak yang dapat dihasilkan melalui reaksi esterifikasi antara asam lemak dengan metanol. Ester asam lemak sering dimodifikasi untuk digunakan sebagai bahan makanan, surfaktan, polimer, sintesis, zat aditif, bahan kosmetik, dan kebutuhan lain (Meffert,1984). Metil ester asam lemak yang merupakan bagian dari pada ester asam lemak mono alkohol merupakan zat antara dalam industri oleokimia disamping dapat digunakan sebagai bahan bakar diesel (Ozgul, l993).
Ester asam lemak terdapat dalam bentuk ester antara gliserol dengan asam lemak ataupun dengan phospat seperti phospolipid. Disamping itu ada juga ester antara asam lemak dengan alkoholnya yang membentuk monoester terdapat pada minyak jojoba. Ester asam lemak sering dimodifikasi baik untuk bahan makanan maupun untuk bahan surfaktan, aditif, detergen dan lain sebagainya (Endo et al, 1997).
Esterifikasi adalah suatu reaksi ionik yang merupakan gabungan dari reaksi adisi dan reaksi penataan ulang eliminasi (Davidek, 1990). Esterifikasi juga dapat didefenisikan sebagai reaksi antara asam karboksilat dan alkohol (Gandhi, 1997). Esterifikasi dapat dilakukan dengan menggunakan katalis enzim (lipase) dan asam anorganik (asam sulfat dan asam klorida), dengan berbagai variasi alkohol biasanya metanol, etanol, l-propanol, 1-butanol, amyl alkohol, dan lain-lain (Ozgulsun, 2008). Asam anorganik yang digunakan sebagai katalis akan menyebabkan asam karboksilat mengalami konjugasi sehingga asam konjugat dari asam karboksilat tersebutlah yang akan berperan sebagai substrat.
Cara lain dalam pembentukan ester adalah dengan melewatkan HCI kedalam campuran reaksi tersebut dan direfluks. Cara ini dikenal dengan nama metode Fischer-Spieser. Esterifikasi tanpa katalis dapat juga dilakukan dengan satu molekul asam karboksilat dan satu pereaksi secara berlebih. Pertambahan hasil juga dipengaruhi oleh dehidrasi yang artinya menarik air yang terbentuk sebagai hasil samping reaksi. Air dapat dipisahkan dengan cara menambahkan pelarut yang bersifat non polar seperti misalnya benzena dan kloroform sehingga air yang terbentuk akan segera terikat pada pelarut yang digunakan atau dengan manambahkan molekular sieves (Yan, 2001).
2.5.Ozonolisis
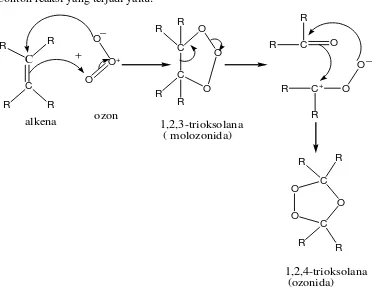
Ozonolisis (pemaksapisahan oleh ozon) telah banyak digunakan untuk menetapkan struktur senyawa tak jenuh karena reaksi ini menyebabkan degradasi molekul besar menjadi molekul yang lebih kecil yang dapat diidentifikasi. Ozonolisis terdiri dari dua reaksi yang terpisah :
Oksidasi alkena oleh ozon menjadi ozonida, dimana dengan mengalirkan ozon
kedalam larutan alkena akan ikatan π untuk menghasilkan zat antara tak stabil
yang disebut 1,2,3-triosolana (ozonida) yang jarang diisolasi (Fessenden dan Fessenden, 1986).
Contoh reaksi yang terjadi yaitu:
C
Gambar 2.4. Reaksi Oksidasi Alkena oleh Ozon (Tedder,J.M. 1987)
O O
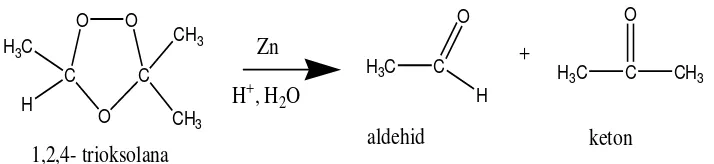
Gambar 2.5. Reaksi Reduksi Ozonida menjadi Aldehida.
Jika diikuti penyelesaian oksidatif, maka karbon monosubstitusi akan menghasilkan asam karboksilat. Dalam kasus kedua ini, karbon disubstitusi alkena kan menghasilkan keton.
O O
Gambar 2.6. Reaksi Oksidasi Ozonida menjadi Aldehida
( Fessenden dan Fessenden, 1986).
2.6.Aldehida
Aldehida mempunyai paling sedikit satu atom hidrogen pada gugus karbonilnya. Sedangkan gugus lainnya boleh berupa atom hidrogen, gugus alkil ataupun gugus aril.
R C
O
H
Gambar 2.7. struktur aldehida
Aldehida bereaksi dengan beberapa zat pengoksidasi yaitu pereaksi Tollens (Ag+ dalam larutan NH3), pereaksi Benedict (Cu2+ dalam larutan natrium sitrat) dan pereaksi Fehling (Cu2+ dalam larutan kalium natrium tartrat). Pereaksi ini mengoksidasi aldehida menjadi asam karboksilat dan ditandai dengan perubahan warna. Aldehida akan mereduksi pereaksi Fehling dan Benedict sedangkan ia sendiri akan teroksidasi dan ditandai dengan terbentuknya endapan merah bata Cu2O (Sarker andLutfun, 2007).
Adanya gugus karbonil menyebabkan aldehida bersifat polar dan mempunyai gaya intermolekul dan titik didih yang lebih besar daripada alkana yang bersesuaian. Atom oksigen pada senyawa karbonil dapat membentuk ikatan hidrogen yang cukup kuat dengan molekul air. Senyawa karbonil dengan berat molekul yang rendah dapat larut di dalam air, sedangkan aseton dan asetaldehida larut dalam air dalam segala perbandingan (Riswiyanto, 2009).
Adapun metode-metode pembuatan aldehida adalah sebagai berikut: 1. Oksidasi alkohol primer
Alkohol primer memiliki dua hidrogen alfa yang salah satu atau keduanya dilepas, sehingga alkohol primer berubah menjadi aldehida atau asam karboksilat tetapi dalam oksidasinya harus memperhatikan pemilihan pereaksi dan kondisi reaksinya.
(Riswiyanto, 2009) 2. Oksidasi metilbenzena
RCH2OH R CH
O K2Cr2O7 / H+
1o alkohol aldehida
ArCH3
Cl2, panas
CrO3, anidrida asetat
ArCHCl2
ArCH(OOCCH3)2
ArCHO H2O
Jika turunan toluena direaksikan dengan CrO3 dalam anhidrida asetat diikuti dengan hidrolisis akan dihasilkan senyawa aldehida.
3. Reduksi asil klorida
(Morrison, 2002). Jika asam karboksilat direaksikan dengan SOCl2 dan asil klorida yang dihasilkan direaksikan dengan tri-t-bubutoksialuminium hidrida pada suhu -78oC akan terbentuk senyawa aldehida.
4. Ozonolisis alkena
Alkena yang mempunyai paling tidak satu hidrogen vinilik akan mengalami pemecahan reaksi oksidasi dengan ozon menghasilkan aldehida. Jika ozonolisis dilakukan pada alkena siklik, maka dihasilkan senyawa dikarbonil. Metode yang paling baik dan telah lama diketahui untuk mensintesis senyawa aldehida adalah oksidasi alkohol primer dan oksidasi pemutusan alkena seperti ozonolisis senyawa alkena (Riswiyanto, 2009).
Aldehida dapat dioksidasi dengan permanganat dan dikromat, namun dapat juga dioksidasi dengan zat pengoksidasi yang sangat lembut, seperti Ag+ dan Cu2+. Reagen Tollens digunakan sebagai reagensia uji untuk aldehida dimana uji positif ditandai dengan terbentuknya cermin perak pada dinding dalam tabung reaksi. Tetapi dengan meluasnya penggunaan spektroskopi , uji ini tidak dipilih lagi untuk identifikasi aldehida, namun kadang-kadang cermin tersebut masih dibuat (Fessenden dan Fessenden, 1992).
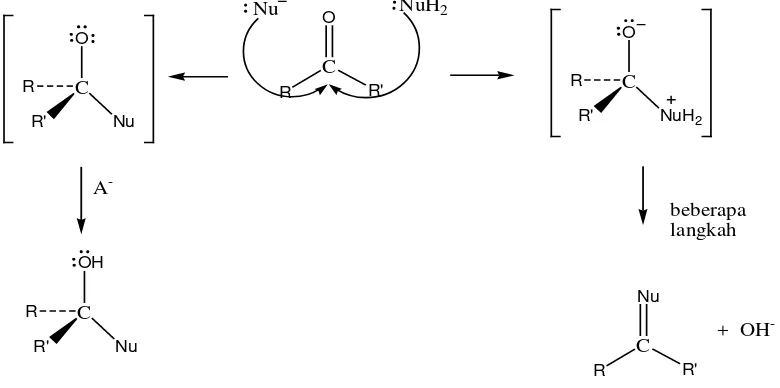
Reaksi dari senyawa aldehida paling banyak yang terjadi adalah reaksi adisi nukleofilik. Dimana pada adisi nukleofilik dapat menghasilkan dua kemungkinan hasil reaksi , yaitu:
i. Intermediet tetrahedral yang dapat diprotonasi dengan asam atau air menghasilkan alkohol.
ii. Atom oksigen karbonil dapat dieliminasi sebagai OH atau H2O menghasilkan ikatan C=Nu.
Adapun mekanisme reaksinya adalah sebagai berikut (Riswiyanto, 2009):
Gambar 2.8. Mekanisme Reaksi Adisi Nukleofilik pada Aldehida atau Keton
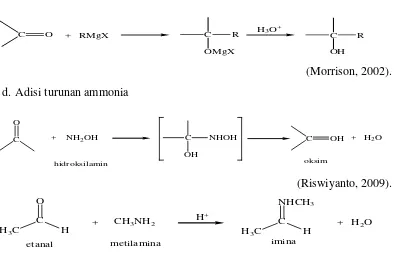
Contoh-contoh reaksi aldehida dengan senyawa lain : a. Oksidasi dengan Reagen Tollens
b. Reduksi menjadi alkohol
Dua pola reaksi adisi nukleofilik yang dapat terjadi pada senyawa aldehida atau keton
c. Adisi Nukleofilik pereaksi Grignard
(Morrison, 2002). d. Adisi turunan ammonia
(Riswiyanto, 2009).
(Patrick, 2003). Salah satu jalan untuk membuat aldehida adalah dengan jalan ozonolisis alkena. Atom karbon yang terlibat dengan ikatan rangkap yang mempunyai atom hidrogen akan membentuk aldehida (Siregar, 1988).
2.7.Etilendiamina
Etilendiamina (1,2- diamino etana) dibuat dari etilen diklorida dan amonia, sifatnya adalah tidak berwarna,jernih, mempunyai bau amonia, densitasnya 0,898 g/cm-3, titik didihnya 116-117°C, titik lebur 8,5, sedikit larut dalam eter, tidak larut dalam benzena, bersifat sangat basa sehingga mudah mengadsorbsi CO2 dari udara membentuk karbonat yang tak mudah menguap. Etilendiamina digunakan sebagai pelarut untuk kasein, albumin dan sulfur, juga digunakan sebagai emulsifier, penstabil lateks serta sebagai penghambat atau inhibitor dalam larutan anti beku (Anonimous, 1976).
H2N C C NH2
H H
H H
Gambar 2.9. Struktur Kimia Etilendiamina
Etilendiamina merupakan poliamina primer yang larut dalam air dan sangat higroskopis. Etilendiamina harus dilindungi dari kelembaban atmosfer dan CO2 selama pemurnian dan pemakaiannya karena akan menyebabkan banyak kesalahan dalam hasil yang diperoleh.(Roberts, 1982).
2.8.Anilina
Anilina memiliki bentuk cairan berminyak berwarna jernih sampai kecoklatan dan berbau amis. Berat molekul anilina yaitu 93,13, dengan rumus molekul C6H5NH2. Anilina memiliki nama lain aminobenzena atau benzenamin.
Adapun sifat-sifat anilina yaitu: Titik didih : 184o C
Titik beku : -6o C Titik nyala : 228o C Berat jenis : 1,0217 gr/ml
Kelarutan : larut dalam air sebesar 3,5%, larut dalam metanol, eter, aseton, benzena, kloroform, pelarut organik, air dingin dan air panas.
Anilina banyak digunakan sebagai bahan antioksidan, akselerator, dan vulkanisir dalam industri karet,digunakan dalam pembuatan analgin, isopropil antipirin, obat sulfa, oksifen butazon, dan vitamin B2 dalam industri farmasi, digunakan dalam industri pembuatan pestisida, digunakan dalam industri pembuatan bahan peledak, digunakan sebagai zat antara dalam industri pembuatan bahan kimia dan bahan pewarna sintetis, digunakan dalam pembuatan parfum, digunakan dalam industri resin dan pernis. (sumber bahan BPOM RI)
2.9. Basa Schiff
Seperti pada persamaan dibawah ini:
R-NH2 + R-CHO R-N=CH-R + H2O
Dimana R dapat dimisalkan sebagai senyawa alifatik maupun senyawa aromatik. Basa Schiff yang berasal dari senyawa aldehida aromatik memiliki keefektifan sistem konjugasi yang lebih stabil. (Munir,C., 1985).
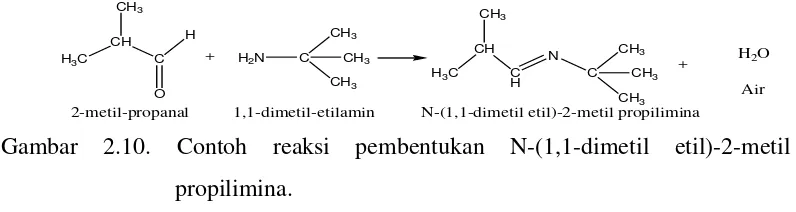
Contoh reaksi pembentukan Basa Schiff yaitu pembuatan N-(1,1-dimetil etil)-2-metil propilimina.
2-metil-propanal 1,1-dimetil-etilamin N-(1,1-dimetil etil)-2-metil propilimina
+ H2O Air
Gambar 2.10. Contoh reaksi pembentukan N-(1,1-dimetil etil)-2-metil propilimina.
(Vogel, 1989)
Sesuatu yang menarik dari Basa Schiff bahwa penggunaannya sebagai suatu inhibitor korosi yang efektif, dimana didasarkan pada kemampuan secara spontan membentuk suatu lapisan pada permukaan agar terlindungi. Banyak inhibitor komersial termasuk aldehida atau amina, tetapi adanya ikatan C=N pada Basa Schiff lebih effisien didalam banyak kasus. Prinsip interaksi antara inhibitor dengan permukaan logam adalah adsorpsi kimia (Ashraf, dkk, 2011).
Penelitian terlebih dahulu telah menunjukkan progres penggunaan dari kompleks logam sebagai obat-obatan untuk penyembuhan beberapa penyakit manusia seperti karsinoma, limphoma, kontrol infeksi, anti inflamasi, diabeter dan neurologi (Rafique et al, 2010). Salah satu penelitian terhadap kegunaan Basa Schiff yaitu penelitian yang dilakukan oleh Kusmin et al. Kusmin et al pada tahun 2000 telah melakukan penelitian hubungan pada aktivitas anti kanker dari Basa Schiff makrosiklik dari 2,6-bis (formilariloksimetil) piridin dengan metode topologi. Persamaan korelasi menjelaskan hubungan antara aktivitas anti kanker dan parameter struktural dari molekul yang dipelajari dan karakteristik deskripsi struktur senyawa tersebut yang mengandung dasar dari in vitro data skrining. Pada tahun 2005, dilakukan penelitian pada aktivitas anti kanker dari makrosiklik Basa Schiff yang didasarkan pada representasi simpleks dari struktur molekular. Pada penelitian ini dijelaskan bahwa kenaikan dan penurunan jumlah fragmen molekul mengindikasikan aktivitas antikanker dapat dilihat pada perubahan panjang fragmen molekul .
Chaviara et al pada tahun 2005 mensintesis jenis baru dari senyawa kompleks tipe [Cu(dien)(2a-2tzn)Y(2)] and [Cu(dienXX)(2a-2tzn)Y(2)] dan struktur senyawa tersebut diidentifikasi dengan IR dan elektronik spektra, magnetik suspensibiliti, dan konduktivitas molar. Atom bromin yang kedua berlaku sebagai suatu anion diskret dan bersifat responsif terhadap kation alam dari senyawa kompleks. Penelitian ini mengindikasikan bahwa senyawa tersebut dapat bekerja sebagai anti tumor.
2.10. Logam Seng
seng adalah bersifat lunak dan sangat reaktif misalnya bereaksi dengan asam encer menghasilkan ion dipositif, seperti pada reaksi berikut ini:
Zn (s) + 2 H3O+ (aq) Zn2+ (aq) + H2 (g) + 2 H2O (l)
Dan jika dipanaskan secara perlahan dalam gas klorin akan menghasilkan ZnCl2. Sumber utama logam seng adalah bijih seng sulfida, ZnS, namun cara memperoleh logam ini tidaklah mudah dimana menggunakan pemanggangan pada suhu 800oC kemudian mereduksi oksidanya dengan kokas berlebih pada suhu 1400oC. Reaksi pembuatan Zink murni yaitu:
ZnS(s) + 3O2(g) 2ZnO(s) + 2SO2(g)
ZnO(s) + C(s) Zn
(l) + CO(g) (Atkins, 1989)
Salah satu penggunaan logam seng adalah untuk perlindungan logam besi terhadap korosi. Besi dicelupkan kedalam seng cair atau dengan proses pelapisan elektrolisis. Meskipun begitu, seng akan tetap bereaksi dengan air. Dimana reaksi yang terjadi yaitu seng melindungi logam dari ion karbonat dan oksida.
Zn + H2O ZnO + H2
Secara komersial serbuk seng memiliki kemurnian 90% dan penambahan asam untuk menghilangkan oksida dipermukaan yang mengurangi keaktifannya. Seng ini diaktifkan dengan pengadukan dengan asam klorida selama 2 menit, disaring dan dicuci dengan air dan diikuti aseton (Vogel, 1989).
2.11. Korosi
Korosi adalah proses kerusakan/degradasi pada material akibat berinteraksi dengan lingkungannya. Terkorosinya suatu logam dalam lingkungan elektrolit (air) adalah suatu proses elektrokimia. Proses ini terjadi bila ada reaksi setengah sel yang melepaskan elektron (reaksi oksidasi pada anodik) dan reaksi setengah sel yang menerima elektron tersebut (reaksi reduksi pada katodik). Kedua reaksi ini akan terus berlangsung sampai terjadi kesetimbangan dinamis dimana jumlah elektron yang dilepas sama dengan jumlah elektron yang diterima. Suatu logam yang dicelupkan pada suatu larutan elektrolit, maka akan terbentuk dua lokasi yang disebut anoda dan katoda. Pada anoda terjadi reaksi oksidasi dan pada katoda terjadi reaksi reduksi seperti dinyatakan dalam persamaan di bawah ini. Pada anoda, tempat terjadinya reaksi oksidasi dan biasanya terkorosi
M → Mz+ + ze- (1)
Pada katoda, tempat terjadinya reaksi reduksi dan tidak mengalami korosi. Dua reaksi penting yang umum terjadi pada katoda, tergantung pH larutan bersangkutan, adalah:
pH < 7 : 2H+ + 2e-→H2 (2)
Salah satu logam yang sering mengalami korosi yaitu logam besi (Fe). Reaksi yang terjadi yaitu :
Anoda :
Katoda : Fe(s)
O2(g) + 4 H+
(aq) + 4 e
-Fe2+(aq) + 2e
-2 H2O (l)
2 Fe + O2(g) + 4 H+(aq) 2 H
2O(l) + 2 Fe2+(aq)
x 2
Ion Fe2+ umumnya membentuk FeO kemudian mengalami oksidasi lanjut menjadi Fe2O3 dan menyerap air menjadi Fe2O3.xH2O (Adriana et al, 2000 dan Firmansyah, 2011)
Faktor-faktor yang menyebabkan korosi dibagi menjadi 2 jenis yaitu: a. Faktor internal
Faktor yang menyebabkan korosi berasal dari struktur bahan itu sendiri. Faktor dari bahan meliputi kemurnian bahan, struktur bahan, bentuk kristal, unsur-unsur yang ada dalam bahan, teknik pencampuran bahan dan sebagainya.
b. Faktor eksternal
Faktor yang menyebabkan korosi berasal dari lingkungan. Faktor ini meliputi pencemaran udara, suhu, kelembaban, keberadaan zat kimia bersifat korosif dan sebagainya (Akhadi, 2000)
2.11.1.Pencegahan Korosi
Pencegahan korosi dapat dilakukan dengan beberapa cara, yaitu: 1. Pelapisan/Coating
2. Aliasi logam
Aliasi logam dibuat dengan cara mencampurkan suatu logam dengan logam yang lain. Unsur yang biasa ditambahkan dalam pencampuran logam adalah krom (Cr). Aliasi logam ini bertujuan agar mutu suatu logam akan meningkat (Djaprie, 1995).
3. Proteksi katodik
Proteksi katodik dilakukan dengan membuat suatu sel elektrokimia yang bersifat katodik dengan cara menghubungkan logam yang mempunyai potensial tinggi sebagai katoda (logam yang ingin diproteksi) ke struktur logam yang berpotensial rendah sebagai anoda (terkorosi) (Fahrurrozie, 2009).
4. Penambahan inhibitor
Inhibitor adalah senyawa tertentu yang ditambahkan pada larutan elektrolit untuk mengurangi korosi logam. Inhibitor terdiri dari anion atom-ganda yang dapat masuk ke permukaan logam, dengan demikian dapat menghasilkan selaput lapisan tunggal yang kaya oksigen (Djaprie, 1995).
2.11.2. Inhibitor korosi
Cara inhibitor mereduksi laju korosi adalah sebagai berikut: a) Memodifikasi polarisasi katodik dan anodik (Slope Tafel) b) Mengurangi pergerakan ion ke permukaan logam
c) Menambah hambatan listrik dipermukaan logam
d) Menangkap atau menjebak zat korosif dalam larutan melalui pembentukan senyawa yang tidak agresif.
Mekanisme kerja inhibitor dapat dibedakan sebagai berikut :
1. Inhibitor teradsorpsi pada permukaan logam, dan membentuk suatu lapisan tipis dengan ketebalan beberapa molekul inhibitor. Lapisan ini tidak dapat dilihat oleh mata biasa, namun dapat menghambat penyerangan lingkungan terhadap logamnya.
2. Melalui pengaruh lingkungan (misal pH) menyebabkan inhibitor dapat mengendap dan selanjutnya teradsopsi pada permukaan logam serta melidunginya terhadap korosi. Endapan yang terjadi cukup banyak, sehingga lapisan yang terjadi dapat teramati oleh mata.
3. Inhibitor lebih dulu mengkorosi logamnya, dan menghasilkan suatu zat kimia yang kemudian melalui peristiwa adsorpsi dari produk korosi tersebut membentuk suatu lapisan pasif pada permukaan logam.
4. Inhibitor menghilangkan konstituen yang agresif dari lingkungannya (Tredhwey, Chamberlain,1991).
2.11.3.Teknik Penentuan Efisiensi Inhibitor
Ada beberapa cara untuk menguji atau mengevaluasi efisiensi suatu inhibitor adalah dengan teknik kehilangan berat, teknik gasometrik, teknik elektrokimia, spektroskopi impedansi elektrokimia, dan pengukuran polarisasi.
1. Teknik Kehilangan Berat
Keterangan:
EI = efisiensi inhibitor
W0 = berat kehilangan tanpa inhibitor
W1 = berat kehilangan menggunakan inhibitor
2. Teknik Gasometri
Untuk penentuan efisiensi inhibitor dengan teknik ini didasarkan pada volume gas hidrogen yang dibebaskan, dimana dihitung dengan cara berikut ini.
Keterangan:
VB = volume gas hidrogen yang bertambah didalam tidak adanya inhibitor VI = volume gas hidrogen yang bertambah didalam adanya inhibitor
3. Teknik elektrokimia
Pengukuran efisiensi inhibitor dengan teknik ini menggunakan suatu anoda dan katoda pada permukaan suatu logam, dimana pengaruh inhibitor akan mereduksi arus.
4. Spektroskopi impedansi elektrokimia
Pada teknik ini dilakukan dengan bantuan komputer dengan mengukur perpindahan muatan resistansi pada logam.
Keterangan:
Rt(inh) = perpindahan muatan resistansi dengan adanya inhibitor
Rt(blank) = perpindahan muatan resistansi tanpa adanya inhibitor (Chitra et al, 2010)
EI (%) =
W0 - W1 W0
x 100 %
EI (%) =
VB - VI VB
x 100
EI (%) = Rt(inh) - Rt(blank) Rt(inh)
BAB 3
METODE PENELITIAN
3.1. Alat-Alat
Alat-alat yang digunakan dalam penelitian ini adalah :
- Ozonisator AOSN
- Gelas Erlenmeyer 1000 ml Pyrex
- Labu leher tiga 1000 ml Pyrex
- Labu leher tiga 250 ml Pyrex
- Gelas ukur 100 ml Pyrex
- Gelas ukur 10 ml Pyrex
- Labu takar1000 ml Pyrex
- Labu takar 250 ml Pyrex
- Labu takar 50 ml Pyrex
- Kondensor bola Pyrex
- Alat vakum Fison
- Botol Akuades - Statif dan klem
- Neraca analitis Shimadzu
- Hotplate stirrer Fisons
- Spektrofotometer FT-IR Shimadzu
- Rotarievaporator Heidolph
- Tabung reaksi Pyrex
- Termometer 210oC Fisons
- Corong Pyrex
- Corong Penetes Pyrex
- Stopper Pyrex
- Tabung CaCl2 Pyrex
- Pipet tetes - Desikator - Kertas saring - Teflon - Bola karet
3.2. Bahan-Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah :
- Asam oleat Teknis
- N-heksana p.a E’merck
- Na2SO4 anhidrous p.a E’merck
- Benzena p.a E’merck
- Asam Sulfat p.a E’merck
- Kalium Iodida p.a E’merck
- Metanol p.a E’merck
- Etilendiamina p.a E’merck
- Anilina p.a E’merck
- Serbuk Zn
- Asam Asetat p.a E’merck
- Asam Klorida p.a E’merck
- CaCl2Anhidrous p.aE’merck
- Akuades
- Asam Klorida p.aE’merck
- Es Batu
3.3. Prosedur Penelitian
3.3.1. Pembuatan Reagen
3.3.1.1. Pembuatan Larutan KI 5 %
Ditimbang KI sebanyak 5 gram dan dilarutkan dengan akuades dalam labu takar 100 ml sampai garis batas.
3.3.1.2.Pembuatan Larutan K2Cr2O7 0,1 N
Ditimbang 14,7 gram kristal K2Cr2O7 dilarutkan dengan akuades dan diencerkan dalam labu takar 500 ml sampai garis batas.
3.3.1.3. Pembuatan Larutan Na2S2O3 0,1 N
Ditimbang 6,25 gram kristal Na2S2O3.5H2O dilarutkan dengan akuades dan diencerkan dalam labu takar 250 ml sampai garis tanda lalu distandarisasi dengan larutan K2Cr2O7 0,1 N menggunakan indikator amilum mengikuti titrasi iodometri.
3.3.1.4. Pembuatan CH3COOH 20%
3.3.1.5. Pembuatan Indikator Amilum
Ditimbang 1 gram serbuk amilum dan dilarutkan dengan 100 ml akuades dan dipanaskan sambil diaduk diatas pemanas hingga mendidih dan disaring dalam keadaan panas.
3.3.2. Pembuatan Metil Oleat Campuran dari Asam Oleat Campuran
Sebanyak 100 ml asam oleat campuran dimasukkan kedalam labu leher dua 1000 ml, kemudian ditambahkan 120 ml metanol absolut dan 120 ml benzena. Dirangkai alat refluks yang dilengkapi dengan tabung CaCl2. Kemudian sambil diaduk diteteskan 2 ml H2SO4(p) secara perlahan-lahan melalui corong penetes dalam keadaan dingin, campuran direfluks pada suhu 80-90⁰C selama 5 jam. Kemudian didinginkan hingga mencapai suhu kamar. Kemudian diuapkan kelebihan metanol dan pelarut melalui rotarievaporator. Residunya diekstraksi dengan 100 ml n-heksan, dicuci dengan 10 ml aquadest sebanyak 2 kali. Lapisan atas dikeringkan dengan CaCl2 anhidrous selama 1 jam kemudian disaring, filtrat dilanjutkan pengeringan dengan Na2SO4 anhidrous kemudian disaring. Filtrat yang diperoleh diuapkan dengan menggunakan rotarievaporator. Metil ester yang diperoleh dianalisis melalui Kromatografi Gas, spektrofotometer FT-IR dan penentuan nilai bilangan iodin.
3.3.3. Ozonolisis Metil Oleat Campuran membentuk Campuran Aldehida
Turunan Metil Oleat.
encer , kemudian diaduk selama ±15 menit. Dipisahkan Zn dengan cara penyaringan dan asam asetat dicuci dengan akuades kemudian diuapkan dengan destilasi vakum sehingga diperoleh aldehida turunan metil oleat, kemudian diuji dengan pereaksi Fehling, pereaksi Tollens, dan dilanjutkan dianalisis dengan Spektroskopi FT-IR serta penentuan nilai bilangan iodin.
3.3.4. Sintesis Basa Schiff dari Campuran Aldehida Turunan Metil Oleat
yang diikuti Kondensasi dengan Etilendiamin (Basa Schiff I)
Basa Schiff dipersiapkan dengan kondensasi campuran aldehida turunan metil oleat sebanyak 10 g (0,0838 mol) dilarutkan dengan 20 ml toulena, dimasukkan kedalam labu leher dua ukuran 250 ml. Dirangkai alat refluks yang dilengkapi dengan magnetik bar, termometer, dan perangkap air. Selanjutnya diteteskan etilendiamin sebanyak 4 g (0,0666 mol) melalui corong penetes secara perlahan-lahan kedalam campuran tersebut. Kemudian direfluks pada suhu 115-120oC selama 4 jam sambil diaduk. Selanjutnya pelarut dan kelebihan etilendiamin diuapkan dengan destilasi vakum. Hasil yang diperoleh dianalisis dengan menggunakan Spektroskopi FT-IR dan penentuan nilai bilangan iodin.
3.3.5. Sintesis Basa Schiff dari Campuran Aldehida Turunan Metil Oleat
yang diikuti Kondensasi dengan Anilina (Basa Schiff II)
3.3.6. Analisa Bilangan Iodin
Analisis ini dilakukan terhadap asam oleat campuran, metil oleat campuran, campuran aldehida turunan metil oleat , Basa Schiff hasil kondensasi campuran aldehida turunan metil oleat dengan etilendiamin (Basa Schiff I), dan Basa Schiff hasil kondensasi campuran aldehida turunan metil oleat dengan anilina (Basa Schiff II).Ditimbang sampel sebanyak ± 0,2 gram kedalam gelas Erlenmeyer 250 ml yang bertutup lalu ditambahkan 20 ml sikloheksana kemudian dikocok/diguncang untuk memastikan sampel telah benar-benar larut. Ditambahkan larutan Wijs kedalam gelas Erlenmeyer sebanyak 25 ml kemudian ditutup dan dikocok agar campuran telah benar-benar bercampur dan disimpan bahan tersebut dalam ruang gelap selama ± 30 menit. Diambil bahan tersebut dari tempat penyimpanan dan ditambahkan 25 ml larutan KI 10% dan 150 ml air suling. Dititrasi dengan larutan Na2S2O3 0,1 N sampai warna kuning hampir hilang (kuning pucat). Ditambahkan 1-2 ml indikator amilum kedalamnya dan dititrasi kembali sampai warna biru hilang.
Dilakukan hal yang sama terhadap larutan blanko dan dihitung dengan :
Bilangan iodin =
(B-S) x N x 12,69
Massa sampel (gram)
Dimana :
3.3.7. Penentuan Efisiensi Inhibitor
3.3.7.1. Persiapan Spesimen
Spesimen atau sampel seng dibuat dengan panjang 5 cm dan lebar 1,5 cm dihaluskan permukaannya dengan menggunakan ampelas besi. Permukaaan yang telah halus ini dicuci dengan akuades dan dikeringkan kemudian ditimbang beratnya.
3.3.7.2. Pembuatan Larutan Induk Media Korosif
Larutan media korosi HCl 0,1 N dibuat dengan cara mengencerkan 8,3 mL HCl 37 % dalam labu takar ukuran 1000 mL sampai tanda batas dengan aquadest.
3.3.7.3. Pembuatan Larutan Induk Inhibitor
Larutan inhibitor korosi Basa Schiff 10.000 ppm dengan pelarut larutan HCl 0,1 M. Larutan tersebut dibuat dengan cara melarutkan 1 g Basa Schiff turunan etilendiamin dengan HCl 0,1 M dalam labu takar 100 ml sampai garis batas. Larutan inhibitor yang diinginkan dibuat dengan cara mengencerkan larutan induk 10.000 ppm menggunakan larutan HCl 0,1M dengan variasi larutan inhibitor 1000 ppm, 3000 ppm, 5000 ppm, dan 7000 ppm.
3.3.7.4.Uji Efisiensi Inhibitor
dari media korosi, dicuci secara hati-hati dengan menggunakan sikat halus dan lembut, kemudian dibiarkan kering selama 5 menit dan ditimbang berat akhirnya.
Dan efisiensi inhibitor dihitung dengan persamaan :
% EI =W0 – W1
W0 X 100%
Dimana,
EI = Efisiensi Inhibitor
W0 = kehilangan berat tanpa menggunakan inhibitor W1 = Kehilangan berat menggunakan inhibitor
Sebagai pembanding (kontrol) digunakan larutan tanpa penambahan inhibitor. Dengan prosedur yang sama seperti diatas dilakukan untuk variasi konsentrasi larutan 3000 ppm, 5000 ppm dan 7000 ppm dan waktu perendaman 48, 72, 96, dan 120 jam demikian juga uji effisiensi inhibitor untuk asam oleat campuran, metil oleat campuran, campuran aldehida turunan metil oleat, etilendiamin, anilina, Basa Schiff I dan Basa Schiff II.
3.3.8. Analisis dengan Spektroskopi FT- IR
3.4. Bagan Penelitian
3.4.1. Pembuatan Metil Oleat Campuran
100 ml asam oleat campuran
Dimasukkan kedalam labu leher dua ukuran 1000 ml Ditambahkan 120 ml Metanol absolut
Ditambahkan 120 ml benzena
Dirangkai alat refluks yang dilengkapi dengan tabung CaCl2
Ditambahkan 1,5 ml H2SO4(p) secara perlahan-lahan melalui
corong penetes
Direfluks selama 5 jam sambil diaduk
Campuran
Didinginkan pada suhu kamar
Diuapkan kelebihan metanol dan pelarut dengan rotarievavorator
Residu
Diekstraksi dengan 100 ml n-Heksan
Dicuci dengan akuades sebanyak dua kali masing-masing 10 ml
Lapisan n-Heksan
Dikeringkan dengan CaCl2 anhidrous /selama 1 jam
Disaring
Lapisan n-Heksan
Dikeringkan dengan Na2SO4 anhidrous / selama 1 jam
Disaring
Lapisan n-Heksan
Dirotarievavorasi hingga pelarutnya habis
Analisa FT-IR
Residu
Residu Destilat
Residu
Metil oleat campuran
Penentuan nilai bilangan iodin Analisis Kromatografi Gas diukur volume akhir
3.4.2. Ozonolisis Metil Oleat Campuran Membentuk Campuran Aldehida
Turunan Metil Oleat
200 mL metil oleat campuran
dimasukkan kedalam gelas Erlenmeyer 500 mL
ditambahkan 100 mL KI 5% diaduk hingga merata
dimasukkan selang alat Ozonolisis kedalam gelas Erlenmeyer tersebut
ditutup sampai rapat
diozonolisis pada suhu ± 10oC selama 20 jam
Campuran
ditambahkan 5 g serbuk Zn
ditambahkan 200 mL asam asetat encer diaduk selama ±15 menit
disaring dengan corong vakum
Filtrat Residu
diuapkan asam asetat dengan destilasi vakum
Hasil
diuji
Pereaksi Fehling Pereaksi Tollens Analisa FT-IR
dicuci dengan akuades
bilangan iodin ditambahkan 50 ml metanol
diukur volume
endapan merah bata (+)
3.4.3. Sintesis Basa Schiff dari Campuran Aldehida Turunan Metil Oleat
yang diikuti Kondensasi dengan Etilendiamin (Basa Schiff I)
10 g (0,0838 mol) campuran aldehida turunan metil oleat
dilarutkan dengan 20 ml toluena
dimasukkan kedalam labu leher dua ukuran 250 ml
dirangkai alat refluks yang dilengkapi dengan magnetik bar, termometer, tabung CaCl2, dan perangkap air ditambahakan 4 g (0,0666 mol) etilendiamin melalui corong penetes secara perlahan-lahan sambil diaduk direfluks selama 4 jam pada suhu 115-120oC
Campuran
diuapkan pelarut dan kelebihan etilendiamin dengan destilasi vakum
Residu Destilat
FT-IR efisiensi inhibitor korosi uji bilangan iodin ditimbang hasil
3.4.4. Sintesis Basa Schiff dari Campuran aldehida metil oleat yang diikuti
kondensasi dengan anilina (Basa Schiff II)
10 g (0,0838 mol) campuran aldehida turunan metil oleat
dilarutkan dengan 20 ml toluena
dimasukkan kedalam labu leher dua ukuran 250 ml
dirangkai alat refluks yang dilengkapi dengan magnetik bar, termometer, tabung CaCl2, dan perangkap air ditambahakan 11 g (0,1182 mol) anilina melalui corong penetes secara perlahan-lahan sambil diaduk
direfluks selama 4 jam pada suhu 115-120oC
Campuran
diuapkan pelarut dan kelebihan anilina dengan destilasi vakum
Residu Destilat
FT-IR efisiensi inhibitor korosi uji bilangan iodin ditimbang hasil
3.4.5. Pembuatan variasi konsentrasi campuran larutan induk inhibitor dan
larutan korosif sebagai media perendaman
1 g Basa Schiff
dimasukkan kedalam labu takar 100 ml ditambahkan HCl 0,1 N sampai tanda batas dihomogenkan
Basa Schiff 10.000 ppm
diencerkan kembali dengan HCl 0,1 N dalam labu takar 50 ml untuk membuat variasi konsentrasi
1.000 ppm (gelas I)
3.000 ppm
(gelas II) 5.000 ppm(gelas III)
3.4.6. Penentuan Effisiensi Inhibitor korosi
Lempeng Seng ukuran 5 cm x 1,5 cm
dihaluskan permukaannya dengan ampelas besi
dicuci dengan akuades dan dikeringkan pada suhu kamar ditimbang beratnya (berat awal)
dimasukkan kedalam wadah yang berisi media perendaman Basa Schiff 1000 ppm
dibiarkan lempeng seng terendam selama 24 jam diangkat dan dicuci secara hati-hati dengan menggunakan sikat halus dan lembut
dikeringkan pada suhu kamar ditimbang berat akhirnya
dihitung efisiensi inhibitor korosinya
Hasil
Sebagai kontrol (pembanding) dilakukan juga perendaman lempengan seng dalam larutan korosif tanpa penambahan larutan inhibitor dengan variasi waktu yang sama yaitu 24, 48, 72, 96 dan 120 jam.
BAB 4
HASIL DAN PEMBAHASAN
4.1.Hasil Penelitian
4.1.1. Pembuatan Metil Oleat Campuran melalui Reaksi Esterifikasi
Metil oleat campuran diperoleh dari hasil esterifikasi antara asam oleat campuran dengan metanol absolut dalam pelarut benzena menggunakan katalis asam sulfat pekat pada suhu 80-90oC. Volume rata-rata metil oleat campuran yang diperoleh yaitu 93,2 ml. Spektrum FT-IR dari campuran metil oleat campuran memberikan puncak-puncak serapan kimia pada bilangan gelombang 3010 cm-1, 2924,09 cm-1, 2854,65 cm-1, 2681,91 cm-1, 2345,44 cm-1, 1743,65 cm-1, 1651,07 cm-1, 1442,75 cm-1, 1365,6 cm-1, 1242,16 cm-1, 1172,72 cm-1, 1018,41 cm-1, 848,68 cm-1, 725,23 cm-1, 617,22 cm-1 (Gambar 4.1).
Asam oleat yang digunakan masih tercampur dengan asam lemak lainnya dengan komposisi kemurnian berdasarkan hasil analisis kromatografi gas terhadap metil oleat campuran memberikan kromatogram (Lampiran 1) kandungan asam lemak seperti pada Tabel 4.1.
Tabel 4.1. Komposisi asam lemak pada asam oleatcampuran.
Asam lemak Rantai karbon Kandungan (%) Asam lemak jenuh
Asam heptanoat C8:0 0.0272
Asam dekanoat C10:0 1.3361
Asam laurat C12:0 1.2191
Asam miristat C14:0 0.5739
Asam pentadekanoat C15:0 0.0126
Asam palmitat C16:0 4.8758
Asam heptadekanoat C17:0 0.0361
Asam stearat C18:0 2.3515
Asam eikosanoat C20:0 0.1913
Asam dokosanoat C22:0 0.0362
Asam tetrakosanoat C24:0 0.1841
Asam lemak tak jenuh
Asam palmitoleat C16:1 0.3523
Asam cis-10-heptadekanoat C17:1 0.0270
Asam oleat C18:1 74.4861
Asam linoleat C18:2 13.5787
Asam linolenat C18:3 0.8428
Asam -9-eikosenoat C20:1 0.3767
Asam erukat C22:1 0.1499
4.1.2. Ozonolisis Metil Oleat Campuran membentuk Campuran Adehida
Turunan Metil Oleat
≤ 10o
C kemudian dihidrolisis dengan menggunakan serbuk Zn dalam asam asetat. Dari 200 ml metil oleat campuran yang digunakan diperoleh aldehida turunan metil oleat sebanyak 137 ml. Hasil aldehida kemudian diuji dengan pereaksi Fehling yang akan menghasilkan endapan berwarna merah bata (Cu2O(s)). Uji lainnya terhadap senyawa aldehida yaitu uji dengan pereaksi Tollens yang akan menghasilkan endapan berupa cermin perak (Ag(s)). Spektrum FT-IR dari campuran aldehida turunan metil oleat memberikan puncak-puncak serapan kimia pada bilangan gelombang 3464,15 cm-1, 2924,09 cm-1, 2854,65 cm-1, 2677,2 cm-1, 2337,72 cm-1, 2090,84 cm-1, 1975,11 cm-1, 1743,65 cm-1, 1604,77 cm-1, 1442,75 cm-1, 1365,6 cm-1, 1172,72 cm-1, 1111 cm-1, 1018,41 cm-1, 840,96 cm-1, 725,23 cm-1, 370,33 cm-1, 339,47 cm-1, 308,61 cm-1 (Gambar 4.2)
Gambar 4.2. Spektrum FT-IR Campuran Aldehida Turunan Metil Oleat
Campuran
4.1.3. Sintesis Basa Schiff dari Campuran Aldehida Turunan Metil Oleat
dengan Etilendiamin (Basa Schiff I).
campuran. Dari hasil analisa Basa Schiff menggunakan Spektroskopi FT-IR diperoleh spektrum dengan puncak-puncak daerah serapan pada bilangan gelombang 3302,13 cm-1, 3070,68 cm-1, 2924,09 cm-1, 2854,65 cm-1, 2684,91 cm -1
, 2337,72 cm-1, 2175,7 cm-1, 2075,41 cm-1, 1743,65 cm-1, 1635,64 cm-1, 1442,75 cm-1, 1242,16 cm-1, 1172,72 cm-1, 1111 cm-1, 1018,41 cm-1, 848,68 cm-1, 725,23 cm-1, 594,08 cm-1 (Gambar 4.3.).
Gambar 4.3. Spektrum FT-IR Basa Schiff I.
4.1.4. Sintesis Basa Schiff dari Campuran Aldehida Turunan Metil Oleat
dengan Anilina (Basa Schiff II).
Basa Schiff ini dihasilkan dari reaksi kondensasi antara campuran aldehida turunan metil oleat dengan anilina sebagai sumber amina primer dalam pelarut toluena yang direfluks pada suhu 115- 120o C selama 4 jam. Hasil dari reaksi ini kemudian dimurnikan dengan cara pemisahan kelebihan anilina dan pelarut yang berlebih melalui destilasi vakum sehingga diperoleh Basa Schiff campuran. Dari hasil analisa Basa Schiff menggunakan Spektroskopi FT-IR diperoleh spektrum dengan puncak-puncak daerah serapan pada bilangan gelombang 3379,29 cm-1, 2924,09 cm-1, 2854,65 cm-1, 2731,2 cm-1, 2677,2 cm-1, 2337,72 cm-1, 2175,7 cm -1
Gambar 4.4. Spektrum FT-IR Basa Schiff II.
4.1.5. Penentuan Bilangan Iodin.
Tabel 4.2. Hasil uji bilangan iodin pada asam oleat campuran, metil oleat
campuran, campuran aldehida turunan metil oleat, Basa Schiff I
dan Basa Schiff II.
Sampel Bilangan Iodin
Asam oleat campuran 115,78
Metil oleat campuran 110,85
Campuran aldehida turunan metil oleat 88.03
Basa Schiff I 109.98
Basa Schiff II 168.71
4.1.6. Penentuaan Efisiensi Inhibitor Korosi.