2
ABSTRAK
DIAN SEPTIANI. Sintesis 1-(2-Hidroksifenil)-3-fenilpropana-1,3-dion dari
o
-Hidroksiasetofenon dan Benzoil Klorida. Dibimbing oleh SUMINAR S.
ACHMADI dan BUDI ARIFIN.
Flavonoid merupakan kelompok senyawa polifenolik terbesar yang
ditemukan di alam dengan kerangka karbon C6-C3-C6. Salah satu kelompok
flavonoid yang telah dilaporkan memiliki bioaktivitas yang luas ialah flavon.
Flavon tersebar luas dalam tanaman berpembuluh. Bioaktivitas flavon antara lain
sebagai antioksidan, inhibitor proteinase HIV-1, penginduksi apoptosis yang kuat
dan selektif dalam sel usus besar manusia, dan ligan untuk reseptor BDZ-R. Salah
satu rute sintesis flavon yang penting dan digunakan secara luas ialah siklisasi
oksidatif 1-(2-hidroksifenil)-3-fenilpropana-1,3-dion (1,3-diketon) dengan katalis
asam. Dalam penelitian ini, 1,3-diketon telah berhasil disintesis. Sintesis
dilakukan dalam empat-tahap, yang melibatkan penataan ulang
Baker-Venkataraman, dari bahan awal fenol. Fenol diasetilasi menghasilkan fenil asetat
dengan rendemen 74–95%. Penataan-ulang Fries berkataliskan-AlCl
3mengubah
fenil asetat menjadi
o
-hidroksiasetofenon (
o
-HAP) dengan rendemen 34%.
Benzoilasi
o
-HAP dan penataan ulang Baker-Venkataraman produk ester dengan
KOH dalam piridina menghasilkan 1,3-diketon. Rendemen kedua tahap ini
berturut-turut 27–44% dan 82–85%. Semua produk sintesis dalam penelitian ini
telah dicirikan secara spektroskopi dan, untuk produk padatan, juga dicirikan titik
lelehnya.
ABSTRACT
DIAN SEPTIANI. Synthesis of 1-(2-Hydroxyphenyl)-3-phenylpropane-1,3-dione
from
o
-Hydroxyacetophenone and Benzoyl Chloride. Supervised by SUMINAR
S. ACHMADI and BUDI ARIFIN.
1
PENDAHULUAN
Flavonoid merupakan kelompok senyawa polifenolik terbesar yang ditemukan di alam dengan kerangka karbon berupa dua cincin fenil yang dihubungkan oleh rantai alifatik
tiga karbon (C6−C3−C6). Beberapa senyawa
ini merupakan zat warna merah, ungu, biru, dan kuning yang ditemukan dalam tumbuh-tumbuhan. Senyawa flavonoid memiliki berbagai bioaktivitas, seperti antiradang, antivirus, antimalaria, antibakteri, antidia-betes, dan yang paling luas digunakan ialah sebagai antioksidan alami. Aneka bioaktivitas senyawa flavonoid ini menarik minat para peneliti untuk dikaji lebih lanjut. Senyawa flavonoid lazim diisolasi dari tumbuhan, tetapi kandungannya yang terbatas di alam menjadi salah satu kendala utama. Untuk itu,
diperlukan upaya menyintesis senyawa
tersebut.
Salah satu kelompok flavonoid yang telah dilaporkan memiliki bioaktivitas sebagai antikanker ialah flavon atau 2-fenilkromon.
Flavon tersebar luas dalam tanaman
berpembuluh. Bioaktivitas flavon, antara lain sebagai antioksidan, inhibitor proteinase HIV-1, dan sebagai penginduksi apoptosis yang kuat dan selektif dalam sel karsinoma usus besar manusia, membuat sintesis senyawa ini
telah banyak dipelajari (Lee et al. 2004). Inti
flavon juga telah dilaporkan sebagai ligan untuk reseptor benzodiazepina pusat (BDZ-R), salah satunya ialah nitroflavon yang
memiliki aktivitas anksiolitik in vivo dengan
efek sedatif dan miorelaksan yang lemah (Barros dan Silva 2006).
Salah satu metode umum untuk
memperoleh flavon ialah dengan siklisasi
oksidatif
1-(2-hidroksifenil)-3-fenilpropana-1,3-dion atau 2’-hidroksikalkon, yang
disiapkan dari 2’-hidroksiasetofenon dan
berturut-turut pereaksi benzoilasi atau
benzaldehida. Metode lainnya ialah kopling
2-iodofenol dengan fenilasetilena dalam
keberadaan amina sekunder dan PdCl2(dppf),
tetapi hanya sedikit flavon dilaporkan dengan teknik ini. Reaksi Wittig intramolekul 2-asetoksifenasil bromida dan benzoil klorida juga menghasilkan flavon, suatu proses
4-tahap dari 2’-hidroksiasetofenon (Lee et al.
2004).
Penelitian ini bertujuan menyintesis
senyawa
1-(2-hidroksifenil)-3-fenilpropana-1,3-dion (1,3-diketon) dengan penataan-ulang
Baker-Venkataraman dari o
-hidroksiaseto-fenon (o-HAP) dan benzoil klorida.
1,3-Diketon merupakan senyawa antara yang
penting dalam sintesis flavon. Berbagai jenis flavon dapat disintesis dari senyawa ini melalui siklisasi oksidatif.
Penataan-ulang Baker-Venkataraman telah digunakan antara lain oleh Barros dan Silva
(2006) dalam menyintesis sejumlah
nitroflavon dari
2’-(nitrobenzoiloksi)aseto-fenon. Göker et al. (2005) melaporkan sintesis
6,4‘-dibromoflavon sebagai zat antara menuju turunan amidina dikationik serta sintesis
7-metoksi-4-metilflavon. Furuta et al. (2004)
juga melakukan benzoilasi o-HAP dengan
1,3-disikloheksilkarbodiimida (DCC) dan
dimetilaminopiridina (DMAP) dalam
diklorometana pada suhu kamar, dengan
rendemen 82%. Merefluks ester yang
terbentuk dalam piridina dengan K2CO3
menghasilkan 2 isomer flavon, dengan rendemen 17 dan 15%. Berbagai modifikasi
metode Baker-Venkataraman juga telah
dilakukan. Kabalka dan Mereddy (2005) melakukan siklisasi dehidratif 1,3-diketon
dalam etanol, dengan CuCl2 (0.1 ekuivalen)
dan penyinaran mikrogelombang (MW) pada 80 ˚C. Hanya diperlukan waktu 5 menit dengan rendemen flavon 98%.
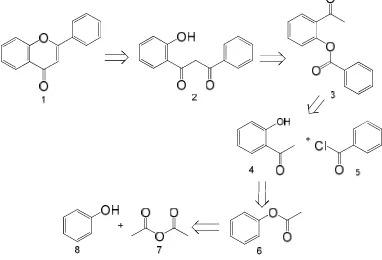
Gambar 1 menampilkan diagram umum
analisis retrosintesis flavon. Senyawa 1 dapat
dihasilkan melalui siklisasi zat antara
1,3-diketon (2) dalam suasana asam. Senyawa 2
yang menjadi target penelitian ini diperoleh
dari penataan-ulang Baker-Venkataraman o
-BAP (3) menggunakan KOH dalam pelarut
piridin. Tahap pertama dari reaksi ini adalah pembentukan ester benzoat yang kemudian mengalami siklisasi melalui reaksi antara enolat dari asetofenon dan karbon karbonil
ester. Senyawa3 dihasilkan dari benzoilasi o
-HAP (4) dengan benzoil klorida (5) komersial.
Senyawa 4 diperoleh dari penataan-ulang
Fries terhadap fenil asetat (6) yang diperoleh
dari esterifikasi antara anhidrida asetat (6) dan
fenol (7) dengan katalis CuSO4 anhidrat.
Diagram alir penelitian ini dapat dilihat di Lampiran 1.
2
BAHAN DAN METODE
Bahan dan Alat
D
igunakan bahan-bahan untuk analisis(p.a). Pelarut teknis didistilasi 2 kali sebelum dipakai. Kromatografi lapis tipis (KLT) menggunakan pelat aluminium berlapis silika
gel 60 F254. Kromatografi cair vakum (KCV)
menggunakan silika gel 60G untuk KLT dan untuk impregnasi contoh, digunakan silika gel 60 (0.2–0.5 mm) untuk kromatografi kolom.
Titik leleh ditetapkan dengan radas
Mel-Temp Model 1202D Barnstead® (tanpa
koreksi). Spektroskopi UV-Vis diukur dengan spektrometer Varian Cary 100 Cone di Laboratorium Kimia Organik Bahan Alam (KOBA) ITB. Spektroskopi FTIR diukur dengan spektrometer FTIR Perkin Elmer
Spectrum One (resolusi 4 cm-1) di
Laboratorium Bidang Pangan, Gedung Pusat Laboratorium Terpadu, Universitas Islam
Negeri Syarif Hidayatullah Jakarta.
Spektroskopi NMR diukur dengan
spektrometer JEOL ECA 500 yang bekerja
pada frekuensi 500 MHz (1H) dan 125 MHz
(13C) di Pusat Penelitian Kimia LIPI,
Puspiptek Serpong. Spektroskopi massa dengan ESI-MS diukur dengan spektrometer Waters LCT Premier XE di Gedung Basic Science A ITB. Alat lainnya ialah radas distilasi bertingkat dengan kolom fraksionasi Vigreux, radas distilasi uap, dan alat-alat kaca yang lazim di laboratorium.
Lingkup Penelitian
Tahapan penelitian ini terdiri atas sintesis fenil asetat dari fenol dan anhidrida asetat,
lalu fenil asetat diubah menjadi o-HAP
melalui penataan ulang Fries. o-HAP
dibenzoilasi, dan ester o-BAP yang dihasilkan
direaksikan dengan KOH dalam piridina sehingga terjadi migrasi asil membentuk
1,3-diketon
.
Produk yang diperoleh dicirikan darititik lelehnya dan dari pengukuran
spektroskopi dengan spektrometer
massa-ionisasi semprotan elektron (ESI-MS),
ultraviolet-tampak (UV-Vis), inframerah
transformasi-Fourier (FTIR), serta resonans
magnetik inti proton dan karbon (1H dan 13
C-NMR).
Sintesis Fenil Asetat
Sintesis fenil asetat dilakukan dengan
memodifikasi prosedur dalam Heravi et al.
(2006). Sebanyak 0.25 mol fenol dicampurkan dengan 0.375 mol anhidrida asetat dalam gelas piala. Campuran ini larut sempurna.
Sebanyak 0.008 mol CuSO4 anhidrat
ditambahkan ke dalam campuran tersebut lalu diaduk selama 1.5 jam. Selama pengadukan, warna katalis berangsur-angsur berubah dari putih menjadi biru. Setelah itu, campuran
di-work-up dengan menambahkan 750 mL
larutan NaHCO3 10%, dan produk fenil asetat
diekstraksi menggunakan MTC. Proses
ekstraksi dikendalikan menggunakan KLT
dengan eluen MTC. Ekstrak MTC
dikeringkan dengan MgSO4 anhidrat, lalu
dipekatkan. Produk fenil asetat (Rf ~ 0.74)
dipisahkan dari sisa reaktan fenol (Rf ~ 0.41)
dengan KCV (Lampiran 2a). Silika KCV
dikemas dengan n-heksana. Contoh yang
terimpregnasi dikemas ke dalam kolom dan
dibilas menggunakan n-heksana, lalu dielusi
dengan MTC.
Sintesis o-Hidroksiasetofenon
Sintesis o-HAP dilakukan dengan
mengadaptasi prosedur dalam Hocking
(1980). Sebanyak 10 mmol AlCl3 anhidrat
dimasukkan ke dalam labu leher dua yang telah dirangkai dengan pendingin dan aliran
gas N2. Ke dalam labu tersebut ditambahkan
10 mmol fenil asetat tetes demi tetes sambil diaduk dengan pengaduk magnet pada suhu kamar. Reaksi berlangsung eksoterm dan melepas banyak gas HCl. Setelah itu, campuran dipanaskan selama 1.5 jam dari suhu 65 ke 170 °C sambil terus diaduk.
Selama pemanasan, campuran berubah
menjadi adonan kental berwarna merah tua sampai akhirnya melengket di dinding labu. Campuran dibiarkan mendingin ke suhu
kamar, lalu di-work-up dengan menambahkan
campuran es-HCl 1:1 sedikit demi sedikit hingga suhu tidak naik lagi. Campuran isomer
o- dan p-HAP yang terdapat dalam produk
dipisahkan dengan distilasi uap (Lampiran 2b).
Produk o-HAP terbawa dalam distilat
sebagai fase organik berwarna kuning yang
juga mengandung sedikit p-HAP, sisa fenil
asetat, dan pengotor. Fase organik ini dibasakan menggunakan NaOH 5% (pH diperiksa dengan indikator universal), lalu
diekstraksi dengan MTC. Produk o-HAP
ternyata terbawa ke fase MTC bersama sisa
fenil asetat, sedangkan p-HAP dan 2 noda
pengotor berada di fase air. Untuk
memisahkan o-HAP dengan sisa fenil asetat
3
NaOH 5% terhadap fase MTC. Garam o-HAP
akan terbawa ke fase air dan diasamkan dengan HCl 5% (pH diperiksa dengan indikator universal) lalu diekstraksi dengan
MTC sampai seluruh o-HAP terambil
(dipantau dengan KLT). Fase MTC kemudian
dikeringkan menggunakan MgSO4 anhidrat,
dipekatkan, dan ditimbang. o-HAP diperoleh
sebagai cairan berwarna kuning muda dengan
Rf ~ 0.74 menggunakan eluen MTC. Karena
fenil asetat juga berupa cairan berwarna
kuning dengan nilai Rf yang identik,
pembedaan kedua senyawa ini dilakukan
dengan menambahkan FeCl3. o-HAP akan
menunjukkan hasil positif karena gugus fenol
pada o-HAP akan membentuk kompleks ungu
dengan Fe3+, sementara fenil asetat
memberikan hasil uji negatif. Air yang terbawa bersama distilat yang berwarna putih yang masih menunjukkan keberadaan noda
lemah o-HAP juga mendapatkan perlakuan
work-up yang sama seperti dijelaskan di atas.
p-HAP takatsiri oleh uap dan tertinggal
sebagai residu. Residu p-HAP ini direfluks
dengan beberapa porsi air mendidih untuk
memisahkan p-HAP dari tar yang juga
terbentuk. Ekstrak air kemudian didekantasi, dibiarkan mendingin ke suhu kamar, lalu didinginkan di lemari es semalaman untuk
mengkristalkan p-HAP. Kristal p-HAP yang
terbentuk disaring. Ekstrak air yang tersisa
diekstraksi dengan MTC sampai seluruh
p-HAP terambil (dipantau dengan KLT).
Ekstrak MTC dikeringkan dengan MgSO4
anhidrat, dipekatkan, dan seluruh kristal yang
terbentuk digabung dan ditimbang. Kristal
p-HAP berwarna merah dengan titik leleh 108– 110 ˚C.
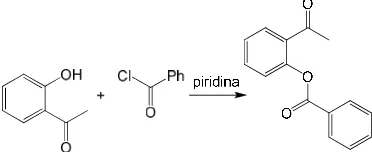
Sintesis o-Benzoiloksiasetofenon
Sebanyak 20 mmol o-HAP dalam labu
bulat 50 mL ditambahkan 4 mL piridina, lalu ditambahkan 30 mmol benzoil klorida tetes demi tetes. Reaksi berlangsung eksoterm, dan setelah tidak terbentuk kalor lagi ditambahkan 120 mL HCl 3% dan sekitar 40 g es batu, sambil diaduk kuat dengan pengaduk magnet. Campuran ini membentuk lapisan organik
seperti-minyak yang berwarna putih.
Campuran diekstraksi dengan MTC,
dipekatkan, lalu dilarutkan kembali dalam
metanol dan didinginkan semalam di 0 oC
agar terbentuk kristal. Setelah cukup kering oleh pengisapan, padatan dikering-udarakan di suhu kamar. Produk ester kasar meleleh pada 79–87 ˚C, lalu ester kasar direkristalisasi dengan metanol dan menghasilkan kristal
putih o-BAP dengan titik leleh sekitar 87–88
˚C. Titik leleh ini hampir sama dengan yang dilaporkan pada prosedur asli (Wheeler 1963): 81–87 ˚C sebelum rekristalisasi dan 87–88 ˚C
setelah rekristalisasi
.
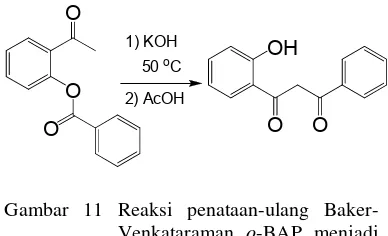
Sintesis 1,3-Diketon
Gelas piala yang berisi 7.5 mmol o-BAP
dalam 7 mL piridina dipanaskan ke 50 ˚C. Sementara itu, 11 mmol (1.5 ekuivalen) KOH 85% digerus dalam mortar yang sebelumnya dipanaskan terlebih dahulu ke 100 ˚C, dan
segera ditambahkan panas-panas dalam
larutan. Campuran diaduk dengan batang pengaduk kaca selama 15 menit. Selama pengadukan, larutan akan berwarna kuning dan mengental sampai akhirnya menempel di dinding gelas piala. Campuran dibiarkan ke suhu kamar, lalu diasamkan dengan 10 mL asam asetat 10%. Produk 1,3-diketon akan memisah sebagai endapan kuning-muda, kemudian disaring dengan corong Büchner, dikering-udarakan, dan ditimbang. Titik leleh
1,3-diketon kasar ialah 115–118 ˚C,
mendekati yang dilaporkan dalam prosedur asli (Wheeler 1963), yaitu 117–120 ˚C.
HASIL
Sintesis Fenil Asetat
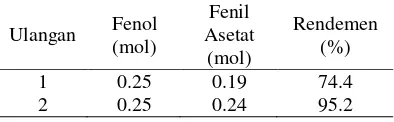
Fenil asetat diperoleh sebagai cairan kuning dengan rendemen 74.4–95.2% (Tabel
1) dan Rf~ 0.74 (Gambar 2). Spektrum FTIR
(Lampiran 3a) menunjukkan pita-pita serapan khas fenil asetat dengan bilangan gelombang 3064, 3044, 1761, 1594, 1493, 1371, 1188,
1163, 749, dan 692 cm-1. Spektrum 1H-NMR
fenil asetat (Lampiran 3b) menunjukkan 1 sinyal singlet di 2.28 ppm dan 3 sinyal di daerah aromatik (7.12, 7.24, dan 7.40 ppm).
Spektrum 13C-NMR (Lampiran 3c)
menunjukkan 1 sinyal karbon-sp3 (21.0 ppm),
4 sinyal karbon-sp2 bukan karbonil (121.6,
125.8, 129.4, dan 150.7 ppm), dan 1 sinyal
karbon-sp2 karbonil (169.4 ppm).
Tabel 1 Rendemen sintesis fenil asetat
Ulangan Fenol
3
NaOH 5% terhadap fase MTC. Garam o-HAP
akan terbawa ke fase air dan diasamkan dengan HCl 5% (pH diperiksa dengan indikator universal) lalu diekstraksi dengan
MTC sampai seluruh o-HAP terambil
(dipantau dengan KLT). Fase MTC kemudian
dikeringkan menggunakan MgSO4 anhidrat,
dipekatkan, dan ditimbang. o-HAP diperoleh
sebagai cairan berwarna kuning muda dengan
Rf ~ 0.74 menggunakan eluen MTC. Karena
fenil asetat juga berupa cairan berwarna
kuning dengan nilai Rf yang identik,
pembedaan kedua senyawa ini dilakukan
dengan menambahkan FeCl3. o-HAP akan
menunjukkan hasil positif karena gugus fenol
pada o-HAP akan membentuk kompleks ungu
dengan Fe3+, sementara fenil asetat
memberikan hasil uji negatif. Air yang terbawa bersama distilat yang berwarna putih yang masih menunjukkan keberadaan noda
lemah o-HAP juga mendapatkan perlakuan
work-up yang sama seperti dijelaskan di atas.
p-HAP takatsiri oleh uap dan tertinggal
sebagai residu. Residu p-HAP ini direfluks
dengan beberapa porsi air mendidih untuk
memisahkan p-HAP dari tar yang juga
terbentuk. Ekstrak air kemudian didekantasi, dibiarkan mendingin ke suhu kamar, lalu didinginkan di lemari es semalaman untuk
mengkristalkan p-HAP. Kristal p-HAP yang
terbentuk disaring. Ekstrak air yang tersisa
diekstraksi dengan MTC sampai seluruh
p-HAP terambil (dipantau dengan KLT).
Ekstrak MTC dikeringkan dengan MgSO4
anhidrat, dipekatkan, dan seluruh kristal yang
terbentuk digabung dan ditimbang. Kristal
p-HAP berwarna merah dengan titik leleh 108– 110 ˚C.
Sintesis o-Benzoiloksiasetofenon
Sebanyak 20 mmol o-HAP dalam labu
bulat 50 mL ditambahkan 4 mL piridina, lalu ditambahkan 30 mmol benzoil klorida tetes demi tetes. Reaksi berlangsung eksoterm, dan setelah tidak terbentuk kalor lagi ditambahkan 120 mL HCl 3% dan sekitar 40 g es batu, sambil diaduk kuat dengan pengaduk magnet. Campuran ini membentuk lapisan organik
seperti-minyak yang berwarna putih.
Campuran diekstraksi dengan MTC,
dipekatkan, lalu dilarutkan kembali dalam
metanol dan didinginkan semalam di 0 oC
agar terbentuk kristal. Setelah cukup kering oleh pengisapan, padatan dikering-udarakan di suhu kamar. Produk ester kasar meleleh pada 79–87 ˚C, lalu ester kasar direkristalisasi dengan metanol dan menghasilkan kristal
putih o-BAP dengan titik leleh sekitar 87–88
˚C. Titik leleh ini hampir sama dengan yang dilaporkan pada prosedur asli (Wheeler 1963): 81–87 ˚C sebelum rekristalisasi dan 87–88 ˚C
setelah rekristalisasi
.
Sintesis 1,3-Diketon
Gelas piala yang berisi 7.5 mmol o-BAP
dalam 7 mL piridina dipanaskan ke 50 ˚C. Sementara itu, 11 mmol (1.5 ekuivalen) KOH 85% digerus dalam mortar yang sebelumnya dipanaskan terlebih dahulu ke 100 ˚C, dan
segera ditambahkan panas-panas dalam
larutan. Campuran diaduk dengan batang pengaduk kaca selama 15 menit. Selama pengadukan, larutan akan berwarna kuning dan mengental sampai akhirnya menempel di dinding gelas piala. Campuran dibiarkan ke suhu kamar, lalu diasamkan dengan 10 mL asam asetat 10%. Produk 1,3-diketon akan memisah sebagai endapan kuning-muda, kemudian disaring dengan corong Büchner, dikering-udarakan, dan ditimbang. Titik leleh
1,3-diketon kasar ialah 115–118 ˚C,
mendekati yang dilaporkan dalam prosedur asli (Wheeler 1963), yaitu 117–120 ˚C.
HASIL
Sintesis Fenil Asetat
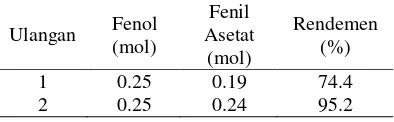
Fenil asetat diperoleh sebagai cairan kuning dengan rendemen 74.4–95.2% (Tabel
1) dan Rf~ 0.74 (Gambar 2). Spektrum FTIR
(Lampiran 3a) menunjukkan pita-pita serapan khas fenil asetat dengan bilangan gelombang 3064, 3044, 1761, 1594, 1493, 1371, 1188,
1163, 749, dan 692 cm-1. Spektrum 1H-NMR
fenil asetat (Lampiran 3b) menunjukkan 1 sinyal singlet di 2.28 ppm dan 3 sinyal di daerah aromatik (7.12, 7.24, dan 7.40 ppm).
Spektrum 13C-NMR (Lampiran 3c)
menunjukkan 1 sinyal karbon-sp3 (21.0 ppm),
4 sinyal karbon-sp2 bukan karbonil (121.6,
125.8, 129.4, dan 150.7 ppm), dan 1 sinyal
karbon-sp2 karbonil (169.4 ppm).
Tabel 1 Rendemen sintesis fenil asetat
Ulangan Fenol
4
Gambar 2 Kromatogram fenil asetat
sebelum dan sesudah KCV
(eluen: MTC).
Sintesis o-Hidroksiasetofenon
o-Hidroksiasetofenon diperoleh dengan
mengadaptasi proedur Hocking (1980).
Rendemen o-HAP (Lampiran 4a) kira-kira
33% dari 2 ulangan. Rf o-HAP (Gambar 2)
identik dengan fenil asetat, yaitu 0.74. Produk
o-HAP dicirikan dengan spektroskopi
UV-Vis, FTIR, dan NMR. Seperti ditunjukkan
pada Lampiran 4b, spektrum UV-Vis o-HAP
menunjukkan 3 puncak serapan di 211, 251, dan 323 nm. Setelah penambahan 2 tetes
NaOH, pita ΙΙ (251 nm) berubah menjadi bahu
di 254 nm dan pita ΙΙΙ (323 nm) bergeser ke
362 nm. Penambahan AlCl3 menggeser
puncak di 251 dan 323 nm berturut-turut sebesar 20 dan 55 nm ke 271 dan 378 nm.
Gambar 3 Kromatogram lapis tipis fenil
asetat (kiri) dan o-HAP (kanan)
(eluen: MTC).
Spektrum FTIR o-HAP menunjukkan
serapan di 3049, 1643, 1617, 1488, 1245, 755
cm-1 (Lampiran 4c). Spektrum 1H-NMR
o-HAP (Lampiran 4d) menunjukkan 1 sinyal singlet di 12.26 ppm, sinyal-sinyal aromatik di 6.86, 6.94, 7.43, dan 7.69 ppm, serta 1 sinyal
proton asetil di 2.59 ppm. Spektrum 13C-NMR
o-HAP (Lampiran 4e) menunjukkan 1 sinyal
karbon-sp3 metil di 26.6 ppm, 6 sinyal
karbon-sp2 benzena di 118.4–162.4 ppm, dan 1 sinyal
karbon karbonil keton di 204.6 ppm.
Sintesis o-Benzoiloksiasetofenon
Kristal o-BAP yang dihasilkan berwarna
putih (Gambar 3) dengan titik leleh sebelum dan sesudah rekristalisasi berturut-turut 79–87
dan 87–88 °C. Rendemen o-BAP pada
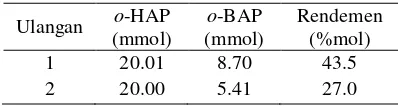
penelitian ini sangat rendah dibandingkan dengan prosedur asli (Wheeler 1963), yaitu sebesar 27.0 dan 43.5 % (Tabel 2). Pencirian
produk o-BAP dilakukan dengan spektroskopi
ESI-MS, FTIR, serta 1H- dan 13C-NMR.
Spektrum ESI-MS modus kation (Lampiran
5a) menghasilkan m/z 241.0870, sesuai
dengan rumus molekul o-BAP terprotonasi,
C15H13O3. Spektrum FTIR o-BAP (Lampiran
5b) tidak lagi menunjukkan serapan ulur –OH fenolik yang mengindikasikan bahwa reaksi
benzoilasi o-HAP telah berlangsung.
Gambar 4 Kristal o-BAP.
Tabel 2 Rendemen sintesis o-BAP
Ulangan o-HAP
(mmol)
o-BAP
(mmol)
Rendemen (%mol) 1
2
20.01 20.00
8.70 5.41
43.5 27.0
Spektrum 1H-NMR o-BAP (Lampiran 5c)
juga tidak lagi menunjukkan sinyal proton fenolik di sekitar 12 ppm. Sinyal singlet proton asetil terdapat di 2.54 ppm dan sinyal-sinyal aromatik di 7.2–8.2 ppm menunjukkan
2 cincin benzena. Spektrum 13C-NMR
(Lampiran 5d) menunjukkan 1 sinyal karbon metil di 30.0 ppm, sinyal karbon karbonil ester di 165.3 ppm, dan sinyal karbon karbonil keton terkonjugasi di 197.7 ppm. Selain itu,
5
Sintesis 1,3-Diketon
1,3-Diketon dihasilkan sebagai padatan kuning (Gambar 4) dengan titik leleh dan
rendemen (Tabel 3) berturut-turut 115–118 °C
dan 82.0–85.4%. Spektrum ESI-MS modus
kation (Lampiran 6a) menghasilkan m/z
241.0871, sesuai dengan rumus molekul
1,3-diketon terprotonasi, C15H13O3. Spektrum
UV-Vis 1,3-diketon (Lampiran 6b) menunjukkan puncak serapan di daerah tampak, yaitu di 368 nm. Spektrum FTIR produk menunjukkan bentuk enol dari 1,3-diketon, dengan ciri khas
pita ulur lebar di daerah 1607 cm-1 dan
menunjukkan kemiripan dari spektrum FTIR
produk komersial (Lampiran 6d).
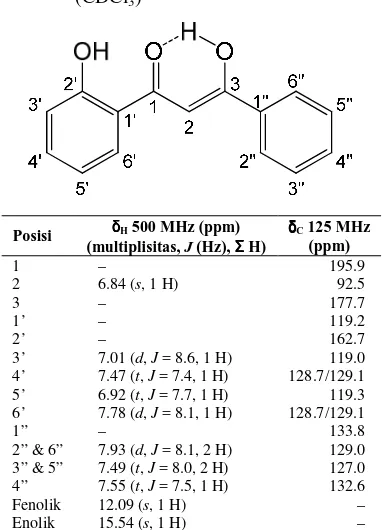
Sinyal-sinyal dalam spektrum 1H-NMR
(Lampiran 6e) menunjukkan 2 sinyal proton khas yang sangat ke medan bawah, yaitu di 12.09 dan 15.54 ppm. Selain itu terdapat 9 sinyal aromatik dan 1 sinyal vinilik di 6.84
ppm. Spektrum 13C-NMR (Lampiran 6f)
menunjukkan 1 sinyal keton terkonjugasi di 195.9 ppm, 1 sinyal karbon oksiaril di 162.7
ppm, sinyal karbon-α dalam sistem keton
takjenuh-α,β sangat ke medan atas (92.5
ppm), serta 9 sinyal lain dari atom-atom
karbon-sp2 cincin benzena.
Gambar 5 Padatan 1,3-diketon.
Tabel 3 Rendemen sintesis 1,3-diketon
Ulangan o-BAP
(mmol) 1,3-diketon (mmol) Rendemen (%mol) 1 2 7.50 5.13 6.41 4.21 85.4 82.0
PEMBAHASAN
Sintesis Fenil Asetat
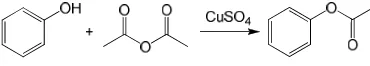
Fenil asetat disintesis melalui asetilasi fenol dengan pereaksi anhidrida asetat dan
katalis CuSO4 anhidrat. Secara umum, reaksi
asetilasi lazim menggunakan pereaksi
anhidrida asetat dengan katalis asam atau
basa. Berbagai garam logam seperti CoCl2,
TiCl4-AgClO4, Me3SiCl, LiClO4, Mg(ClO4)2,
dan beberapa triflat-logam seperti Se(OTf)3,
MeSiOTf, In(OTf)3, Cu(OTf)2, dan Bi(OTf)3
juga dapat digunakan sebagai katalis dan telah banyak diteliti untuk memenuhi kebutuhan asetilasi yang lebih efisien dan selektif.
CuSO4 merupakan katalis asam Lewis yang
murah, mudah didapat, dan sangat aman
digunakan dalam berbagai transformasi
organik. Heravi et al. (2006) telah
menunjuk-kan bahwa senyawa ini dapat digunamenunjuk-kan sebagai katalis yang efisien dalam asetilasi bebas-pelarut berbagai alkohol dan fenol dengan anhidrida asetat pada suhu kamar. Reaksinya ditunjukkan pada Gambar 6.
Gambar 6 Reaksi asetilasi fenol.
Dalam prosedur asli (Heravi et al. 2006),
rendemen fenil asetat ialah 92%, sedangkan rendemen tertinggi hasil sintesis dalam penelitian ini mencapai 95.2%. Kenaikan ini
mungkin akibat penggunaan CuSO4 anhidrat
sebagai katalis menggantikan CuSO4·5H2O,
tetapi kondisi ini belum optimal.
Kromatogram lapis tipis menunjukkan bahwa
selain noda fenil asetat (Rf ~ 0.74), masih
terdapat sisa fenol dengan Rf sebesar 0.41,
sehingga dilakukan pemurnian menggunakan KCV dengan eluen MTC. Keterulangan rendemen sintesis ini juga belum terlalu baik (Tabel 1).
Spektrum FTIR produk asetilasi fenol
(Lampiran 3a) menunjukkan ciri-ciri
struktural fenil asetat. Pita serapan di 1761
cm-1 menunjukkan serapan ulur C=O ester.
Konjugasi atom oksigen alkohol dengan gugus fenil menggeser serapan tersebut ke bilangan gelombang yang lebih tinggi
daripada ulur C=O ester normal (1740 cm-1).
Gugus fenil dicirikan oleh serapan vibrasi ulur
=C-H aromatik di 3064 dan 3044 cm-1, ulur
C=C aromatik di 1594 cm-1, dan tekuk C-H
tak-sebidang benzena monosubstitusi di 692
dan 749 cm-1.
Spektrum 1H-NMR fenil asetat (Lampiran
6
sinyal menunjukkan 2 H di posisi orto
terhadap gugus asetil, satu sinyal berasal dari
2 H di posisi meta, dan satu sinyal lainnya
berasal dari 1 H di posisi para. Analisis
dengan perangkat lunak ACD/NMR Processor Academic Edition versi 12.01 menunjukkan
bahwa sinyal-sinyal di posisi meta dan para
berturut-turut memiliki pola pembelahan
doblet dari doblet dari doblet (ddd) dan triplet
dari triplet (tt). Pola pembelahan ini tidak jelas
terlihat pada spektrum 1H-NMR fenil asetat.
Kedua sinyal tersebut mengalami tumpang tindih pada bagian tengah dari masing-masing
multiplet. Sinyal H di posisi orto dan para
lebih ke medan atas (upfield) daripada H di
posisi meta karena pengaruh dorongan
elektron dari substituen oksigen fenolik.
Posisi sinyal-sinyal 1H dan 13C-NMR fenil
asetat dirangkum pada Tabel 4.
Tabel 4 Posisi sinyal-sinyal NMR fenil asetat
(CDCl3)
Posisi
δδδδH 500 MHz (ppm)
(multiplisitas, J dalam Hz, jumlah H)
δδδδC 125
MHz (ppm) 1 2 1’ 2’& 6’ 3’& 5’ 4’ –
2.29 (s,3 H) –
7.12 (dd, J = 8.59, 1.15, 2 H) 7.40 (ddd, J = 7.45, 6.30, 2.30, 2 H)
7.24 (tt, J = 7.40, 1.10, 1 H)
169.4 21.0 150.7 121.6 129.4 125.8
Spektrum 13C-NMR fenil asetat (Lampiran
3c) menunjukkan 1 sinyal karbon-sp3 yang
lebih ke medan bawah (downfield) di 21.0
ppm. Sinyal tersebut berasal dari satu-satunya gugus metil yang mengalami tarikan elektron dari gugus karbonil ester. Keberadaan gugus karbonil ester ditunjukkan oleh sinyal di 169.4 ppm. Spektrum ini juga menunjukkan 4 sinyal aromatik di daerah 90–160 ppm. Sinyal
karbon orto (121.6 ppm) dan meta (129.4
ppm) memiliki intensitas dua kali lebih tinggi
daripada sinyal karbon para (125.8 ppm).
Sinyal karbon orto dan para berada lebih ke
medan atas daripada sinyal karbon meta
karena resonans pasangan elektron bebas dari substituen oksigen. Karbon aril yang mengikat substituen oksigen menghasilkan sinyal di 150.7 ppm karena pengaruh tarikan elektron dari atom oksigen ester.
Sintesis o-Hidroksiasetofenon
Prosedur sintesis o-HAP diadaptasi dari
Hocking (1980) sementara tahap work-up
diadaptasi dari Furniss et al. (1989).
Keberhasilan sintesis ini sulit dipantau dengan
KLT karena Rf o-HAP (Rf ~ 0.74) identik
dengan fenil asetat. Oleh karena itu, pada
tahap work-up dilakukan ekstraksi dengan
pengaturan pH untuk memisahkan keduanya.
o-HAP memiliki H-fenolik sehingga dapat
diekstraksi dengan basa, sementara fenil asetat
tidak. Uji kualitatif menggunakan FeCl3 5%
akan memberikan hasil positif (warna ungu)
terhadap o-HAP.
Penataan ulang Fries fenil asetat (Gambar
7) dengan AlCl3 dan suhu penangas yang
berangsur-angsur dinaikkan dari 65 ke 170 oC
dalam 1.5 jam memberikan rendemen sekitar 33% (Lampiran 4a). Hasil ini sedikit lebih besar daripada yang dilaporkan dalam prosedur asli, yaitu 30% dari 0.50 mol fenil asetat. Namun, regioselektivitas reaksi ini
masih rendah: isomer p-HAP dihasilkan
dengan rendemen yang juga tinggi.
Gambar 7 Penataan ulang Fries fenil asetat.
Spektrum UV-Vis o-HAP (Gambar 8 dan
Lampiran 4b) menunjukkan 3 puncak serapan di 211, 251, dan 323 nm. Penambahan 2 tetes NaOH menggeser puncak di 251 dan 323 nm masing-masing ke 254 dan 362 nm yang menunjukkan keberadaan –OH fenolik. Basa kuat mendeprotonasi gugus ini sehingga memperlancar delokalisasi elektron ke dalam cincin aromatik, dan menimbulkan efek
batokromik. Penambahan AlCl3 menggeser
puncak di 251 nm ke 271 nm dan 323 nm ke
378 nm. Pergeseran ini tidak dapat
dikembalikan ke panjang gelombang semula
dengan penambahan HCl. Hal ini
menunjukkan bahwa pergeseran batokromik tersebut terjadi akibat terbentuknya kompleks
dengan AlCl3 yang kuat antara oksigen
karbonil dan ion fenoksida di posisi orto
Gambar 8 Spektrum UV penambahan O HO AlCl3 O AlO Cl C kompl
Gambar 9 Pembentukan
dengan AlCl3
Serapan ulur –OH pad
HAP (3049 cm-1) agak leb
ikatan hidrogen intram Serapan tajam di 755
identitas dari cincin
terdisubstitusi orto (Pa
Spektrum o-HAP juga m
serapan khas senyawa kar C=O terkonjugasi, C=C (Lampiran 4c).
Satu sinyal singlet yan fenolik yang berikatan hi dengan gugus karbonil d di 12.26 ppm pada spektr (Lampiran 4d). Sinyal pro 2.59 ppm. Proton-proton HAP terbagi menjadi 4 doblet dari doblet di 6 masing-masing dihasilka
berposisi orto terhadap
asetil. Proton yang berpos lebih ke medan atas ak pasangan elektron bebas Sebaliknya, tarikan elektr menggeser sinyal proton medan bawah. Sinyal do doblet di 6.86 dan 7. berturut-turut dari proton terhadap substituen OH
sinyal 1H-NMR o-HAP
Tabel 5. Panjang gelom A b so rb an s
V-Vis o-HAP dengan
n pereaksi geser.
O HCl Cl O AlO Cl Cl leks tetap bertahan
an kompleks o-HAP
3.
ada spektrum FTIR
o-lebar dan lemah akibat molekul yang kuat.
55 cm-1 merupakan
in aromatik yang
Pavia et al. 2009).
menunjukkan serapan-karbonil aromatik (ulur C aromatik, dan C–O)
ang khas untuk proton hidrogen intramolekul
di posisi orto muncul
trum 1H-NMR o-HAP
proton asetil muncul di
ton aromatik pada
o-4 jenis. Sinyal-sinyal 6.94 dan 7.69 ppm kan dari proton yang p substituen OH dan
sisi orto terhadap OH
akibat efek resonans as dari atom oksigen. ktron dari gugus asetil
n dari H orto-nya ke
doblet dari doblet dari .43 ppm dihasilkan
on yang berposisi para
H dan asetil. Sinyal-P dirangkum dalam
Tabel 5 Posisi sinyal-sin
(CDCl3)
4' 5' 6' 1' 2' 3'
Posisi δδδδH 500 MHz (p
(multiplisitas, J (Hz)
1 2 1’ 2’ 3’ 4’ –
2.59 (s, 3H) –
–
6.94 (dd, J = 7.9, 1.3, 1 7.43 (td, J = 7.9, 1.5, 1 5’ 6.86 (td, J = 7.6, 1.2, 1 6’ 7.69 (dd, J = 8.0, 1.3, 1
Spektrum 13C-NMR o-H
menghasilkan 8 jenis sinya
karbon-sp3 metil di 26.6 pp
sp2 benzena di 118.4–162.4
karbon karbonil keton di 2
halnya pada spektrum 1H-N
karbon aromatik pada po terhadap gugus OH juga atas karena adanya re elektron bebas dari substitu karbon yang berposisi merasakan lebih besar p elektron daripada karbon y (119.0 ppm). Intensitas si yang lebih rendah ber
kuaterner orto. Pergeseran
dialami oleh sinyal karbon
dan para terhadap gugus as
dan 136.5 ppm, karena tarikan elektron. Karbon muncul di 204.6 ppm yan bawah daripada posisi bi
tarikan elektron oleh
intramolekul. Hal yang s pada karbon oksiaril (16
sinyal-sinyal 13C-NMR o
pada Tabel 5.
Sintesis o-Benzoilok
Sintesis 1,3-diketon [1-fenilpropana-1,3-dion] dil
tahap. Pertama-tama,
o-menjadi o-BAP. Penataan
BAP menghasilkan 1,3-1963). Benzoil klorida pereaksi benzoilasi. Piri untuk menggaramkan HC
mbang (nm)
7
sinyal NMR o-HAP
OH
1 2
O
(ppm) ), jumlah H)
δδδδC 125
MHz (ppm)
, 1 H) , 1 H)
204.6 26.6 119.7 162.4 118.4 136.5 , 1 H) 119.0 , 1 H) 130.8
HAP (Lampiran 4e) nyal karbon (1 sinyal ppm, 6 sinyal
karbon-4 ppm, dan 1 sinyal i 204.6 ppm). Seperti NMR, sinyal-sinyal
posisi orto dan para
a bergeser ke medan resonans pasangan tituen oksigen. Sinyal
orto (118.4 ppm)
pengaruh dorongan
yang berposisi para
sinyal di 119.7 ppm erasal dari karbon an ke medan bawah
n yang berposisi orto
asetil, yakni di 130.8 a adanya pengaruh n keton terkonjugasi ang lebih ke medan biasanya akibat dari
ikatan hidrogen
serupa juga terjadi (162.4 ppm). Posisi
o-HAP dirangkum
loksiasetofenon
-(2-hidroksifenil)-3-dilakukan dalam 2
-HAP dibenzoilasi
an ulang terhadap
8
selama reaksi menjadi garam piridiniumklorida. Reaksinya ditunjukkan pada Gambar 10.
Gambar 10 Reaksi benzoilasi o-HAP.
Dalam penelitian ini, campuran reaksi hasil benzoilasi ketika dituang ke dalam HCl 3% dingin tidak langsung membentuk kristal seperti dalam prosedur asli. Campuran ini membentuk lapisan organik seperti-minyak yang berwarna putih kekuningan. Setelah dipisahkan dari fase air, fase organik (minyak)
ini diekstraksi MTC, dipekatkan, lalu
dilarutkan kembali dalam metanol,
didinginkan, dan kristal putih yang terbentuk direkristalisasi dengan metanol. Rendemen produk tertinggi dihasilkan pada ulangan 1, yakni mencapai 43.5%. Namun, hasil ini jauh lebih rendah bila dibandingkan dengan prosedur asli (Wheeler 1963) yang mencapai 79–83%. Rendahnya rendemen produk dalam penelitian ini masih perlu dipelajari lebih lanjut dengan menambah ekuivalen benzoil klorida atau mengatur waktu reaksi dan lamanya penambahan pereaksi. Pemantauan dengan KLT tidak menunjukkan tertinggalnya produk dalam air dan metanol. Meskipun demikian, kemurnian produk yang didapat
cukup baik. Titik lelehnya 79–87 oC sebelum
direkristalisasi dan 87–88 oC setelah
direkristalisasi, hampir sama dengan yang dilaporkan Wheeler (1963), yaitu
berturut-turut 81–87 dan 87–88 °C.
Spektrum ESI-MS modus kation
(Lampiran 5a) menghasilkan m/z 241.0870,
sesuai dengan rumus molekul o-BAP
terprotonasi, C15H13O3. Galat massa eksaknya
kecil, hanya 2.1 ppm. Keberhasilan reaksi
benzoilasi o-HAP pada penelitian ini
ditunjukkan oleh spektrum FTIR o-BAP
(Lampiran 5b) yang tidak lagi menunjukkan serapan ulur OH fenolik. Serapan-serapan ulur
C=O di 1687 cm-1 berasal dari gugus keton
terkonjugasi dan di 1737 cm-1 dari gugus ester.
Tidak seperti pada fenil asetat (Lampiran 3a), gugus fenoksi tidak menggeser serapan C=O ester ke frekuensi lebih tinggi, agaknya karena
faktor sterik menghalangi delokalisasi
elektron dari atom oksigen hidroksil ester ke cincin fenil. Sebaliknya, delokalisasi elektron
dari cincin fenil melemahkan sifat ikatan rangkap C=O keton terkonjugasi sehingga bilangan gelombangnya lebih rendah daripada
keton normal (sekitar 1710 cm-1) (Silverstein
et al. 2005). Serapan kuat di daerah sidik jari
(705 dan 766.5 cm-1) menunjukkan pola
monosubstitusi pada cincin aromatik. Pola
disubstitusi-orto agaknya tertutupi oleh
serapan di 766.5 cm-1.
Sinyal proton fenolik di sekitar 12 ppm
tidak ditemukan lagi dalam spektrum 1
H-NMR o-BAP (Lampiran 5c) yang
memberikan bukti lebih kuat bahwa o-HAP
telah terbenzoilasi. Sinyal singlet proton asetil terdapat di 2.54 ppm. Sinyal-sinyal proton aromatik di 7.2–8.2 ppm menunjukkan 2 cincin benzena. Cincin monosubstitusi dengan substituen karbonil mempunyai 3 jenis sinyal
proton. Sinyal yang berposisi orto (8.21 ppm)
dan para (7.65 ppm) terhadap substituen
karbonil lebih ke medan bawah dibandingkan
dengan sinyal di posisi meta (7.52 ppm). Hal
ini diakibatkan oleh sifat tarikan elektron dari substituen karbonil. Sinyal di 7.52 ppm seharusnya terbelah menjadi doblet dari doblet
dari doblet akibat 2 proton yang berposisi orto
terhadap proton tersebut tidak setara secara magnetik. Selain akibat resolusi instrumen yang kurang, hal ini mungkin juga akibat
gangguan dari sinyal td di 7.58 ppm yang
berasal dari proton cincin aromatik tetangga.
Sinyal di posisi orto terhadap substituen
oksigen memiliki multiplisitas doblet dari doblet di 7.23 ppm yang lebih ke medan atas karena dipengaruhi dorongan elektron dari gugus oksigen. Hal serupa juga dialami oleh
proton di posisi para (7.37 ppm). Dua sinyal
di medan bawah berasal dari atom hidrogen
yang orto (7.86 ppm) dan para (7.58 ppm)
terhadap substituen karbonil. Resolusi
instrumen yang kurang peka mengakibatkan sinyal di 7.37 dan 7.58 ppm, yang seharusnya
terbelah menjadi ddd, hanya tampak sebagai
td.
Spektrum 13C-NMR o-BAP (Lampiran 5d)
menunjukkan 1 sinyal karbon metil di 30.0 ppm yang mengalami tarikan elektron oleh
gugus karbonil. Sinyal-sinyal aromatik
tersubstitusi karbonil menunjukkan 4 jenis
sinyal. Seperti halnya pada spektrum 1
H-NMR, sinyal-sinyal karbon di posisi orto dan
para (130.5 dan 133.6/134.0 ppm) terhadap
substituen karbonil lebih ke medan bawah
dibandingkan dengan yang di posisi meta
(128.9 ppm). Intensitas sinyal karbon orto dan
meta lebih tinggi daripada karbon para. Sinyal
9
substituen karbonil. Posisi sinyal-sinyal 1H
dan 13C-NMR o-BAP dirangkum pada Tabel
6.
Tabel 6 Posisi sinyal-sinyal NMR o-BAP
(CDCl3)
Posisi δδδδH 500 MHz (ppm)
(multiplisitas, J (Hz), ΣΣΣΣ H)
δδδδC 125
MHz (ppm)
1 1’ 2’ & 6’ 3’ & 5’ 4’ 1”
– –
8.21 (dd, J = 8.31, 1.43, 2H) 7.52 (t, J = 8.0, 2 H) 7.65 (tt, J = 7.40, 1.10, 1H) – 165.3 129.4 130.5 128.9 133.6/134.0 197.8
2” 2.54 (s, 3H) 30.0
1”’ – 131.4
2”’ – 149.5
3”’ 7.23 (dd, J = 8.02, 1.15, 1H) 124.1 4”’ 7.58 (td, J = 7.7, 1.7, 1H) 133.6/134.0 5”’ 7.37 (td, J = 7.73, 1.15, 1H) 126.3 6”’ 7.86 (dd, J = 8.02, 1.72, 1H) 130.5 Sinyal C-kuaterner lainnya juga dijumpai pada cincin aromatik yang terdisubstitusi oleh oksigen dan gugus karbonil (131.4 dan 149.5 ppm). Sinyal di 149.5 ppm lebih ke medan bawah karena tarikan elektron dari karbon oksiaril. Sinyal di 131.4 ppm juga lebih ke medan bawah dibandingkan dengan sinyal di 129.4 ppm, karena gugus keton merupakan penarik elektron yang lebih kuat daripada gugus ester. Dua sinyal yang agak ke medan
atas berasal dari karbon metina orto (124.1
ppm) dan para (126.3 ppm) terhadap
substituen oksigen pendorong-elektron. Dua sinyal di 133.6 dan 134.0 ppm berasal dari
dua karbon metina para terhadap substituen
karbonil, namun identitasnya belum dapat dipastikan karena selisih geseran kimia yang
sangat kecil. Penetapan secara pasti
memerlukan spektroskopi korelasi
dua-dimensi. Sinyal karbon sp2 lainnya yang
belum teridentifikasi ialah karbon metina orto
terhadap substituen asetil. Sinyal ini
diperkirakan bertumpang tindih dengan sinyal di 130.5 ppm, sinyal yang intensitasnya paling
tinggi. Sinyal di 165.3 ppm menunjukkan karbon karbonil ester, dan sinyal di 197.8 ppm
menunjukkan karbon karbonil keton
terkonjugasi.
Sintesis 1,3-Diketon
1,3-Diketon dihasilkan dari penataan ulang
Baker-Venkataraman terhadap produk o-BAP
dengan basa KOH dalam pelarut piridina. Berbagai jenis basa lain juga dapat digunakan
dalam penataan ulang ini, seperti K2CO3
(Furuta et al. 2004), KOH (Muller et al.
2000), NaH (Kalinin et al. 1998), LDA (Lee
et al. 2004). Penambahan basa ini akan
memicu terjadinya kondensasi Claisen
intramolekul membentuk 1,3-diketon. Dalam penataan ulang ini, basa mendeprotonasi
hidrogen α dari gugus asetil, lalu enolat yang
terbentuk akan melakukan reaksi adisi-eliminasi terhadap ester benzoil, membentuk 1,3-diketon setelah diasamkan dengan AcOH 10% (Gambar 11).
Gambar 11 Reaksi penataan-ulang
Baker-Venkataraman o-BAP menjadi
1,3-diketon.
Rendemen dan kemurnian produk 1,3-diketon dalam penelitian ini cukup tinggi, yaitu 82.0–85.4% (Tabel 3) dengan titik leleh
115–118 oC, tidak jauh berbeda dengan
prosedur asli Wheeler (1963) yang
melaporkan rendemen sebesar 80–85%
dengan titik leleh 117–120 oC. Hasil
spektroskopi ESI-MS menghasilkan bobot
molekul m/z 241.0871 (Lampiran 5a), sesuai
dengan rumus molekul 1,3-diketon
ter-protonasi, C15H13O3, dengan galat massa eksak
yang kecil, yaitu 2.5 ppm. Spektrum UV-Vis 1,3-diketon (Lampiran 6b) menunjukkan puncak serapan di daerah tampak, yakni di 368 nm. Pergeseran batokromik yang sangat besar terjadi karena pemanjangan sistem ikatan rangkap terkonjugasi. Ikatan hidrogen intramolekul pada 1,3-diketon akan lebih menstabilkan bentuk enol dibandingkan keto sehingga lebih dominan. Pada bentuk enol ini, konjugasi dalam 2 cincin benzena akan
10
Spektrum FTIR 1,3-diketon (Lampiran 6c)juga menunjukkan bentuk enolnya, dengan
ciri khas pita lebar di daerah 1607 cm-1.
Intensitas serapan ini lebih kuat dan frekuensinya lebih rendah daripada keton normal yang terkonjugasi dengan gugus
alkenil atau fenil (1685–1666 cm-1).
Penyebabnya ialah resonans pada bentuk enol yang berikatan hidrogen intramolekul sangat melemahkan sifat ikatan rangkap C=O keton
(Silverstein et al. 2005). Hasil FTIR dalam
sintesis ini mirip dengan spektrum FTIR
produk komersial dari Sigma-Aldrich
(Lampiran 6d).
Spektrum 1H-NMR 1,3-diketon (Lampiran
6e) menunjukkan 2 sinyal proton yang sangat ke medan bawah, yakni di 12.09 dan 15.54 ppm yang memperkuat adanya kesetimbangan tautomerisasi keto-enol. Sinyal di 12.09 ppm berasal dari proton fenolik yang berikatan hidrogen intramolekul dengan atom oksigen
karbonil di posisi orto. Sinyal serupa dijumpai
pada spektrum 1H-NMR o-HAP (Lampiran
4d). Sinyal kedua khas untuk proton enolik dalam bentuk enol dari 1,3-diketon. Ikatan hidrogen intramolekul dalam bentuk enol ini sangat kuat sehingga proton enolik lebih terawaperisai daripada proton pertama. Tidak
tampak sinyal CH2 keto dalam spektrum
tersebut, yang apabila ada letaknya di 3.0–4.0
ppm. Hal ini menunjukkan bahwa
kesetimbangan 1,3-diketon sangat mengarah ke bentuk enol. Sangat sedikit, jika ada, bentuk keto yang terisolasi. Dua cincin fenil pada struktur 1,3-diketon membuat bentuk enol ini sangat terkonjugasi dan terstabilkan.
Posisi sinyal-sinyal NMR 1,3-diketon
ditunjukkan oleh Tabel 7.
Sinyal di 6.84 ppm merupakan sinyal proton vinilik dari 1,3-diketon yang lebih ke
medan bawah dibandingkan dengan
kelaziman sinyal proton ini di 5.0–6.0 ppm. Hal ini diakibatkan tarikan elektron yang sangat kuat dari gugus-gugus di sekitarnya. Sinyal dengan tinggi integrasi 3.162 di 7.44– 7.52 ppm diidentifikasi sebagai tumpang tindih 2 sinyal dari 2 cincin fenil yang berbeda. Salah satu sinyal dihasilkan oleh 1 proton metina di 7.47 ppm yang berposisi
para terhadap gugus karbonil dan sinyal yang
lain berasal dari 2 proton metina di cincin monosubstitusi dengan substituen enol (7.49
ppm). Selain itu, sinyal di cincin
monosubstitusi menghasilkan sinyal 2 H yang
berasal dari atom-atom hidrogen orto dengan
multiplisitas doblet dari doblet di 7.93 ppm.
Sinyal di 7.55 ppm berasal dari 1 H para
terhadap substituen enol. Proton di posisi meta
lebih terawaperisai dari pengaruh dorongan elektron atom oksigen sehingga lebih ke medan bawah dibandingkan proton di posisi
orto dan para. Cincin yang terdisubstitusi oleh
oksigen dan gugus karbonil menghasilkan 2 kelompok sinyal. Dua sinyal di medan atas
berasal dari atom hidrogen yang orto (7.01
ppm) dan para (6.92 ppm) terhadap substituen
oksigen pendorong-elektron. Dua sinyal di medan bawah berasal dari atom hidrogen yang
orto (7.78 ppm) dan para (7.47 ppm) terhadap
substituen karbonil. Posisi sinyal-sinyal NMR 1,3-diketon dirangkum pada Tabel 7.
Tabel 7 Posisi sinyal-sinyal NMR 1,3-diketon
(CDCl3)
Posisi δδδδH 500 MHz (ppm)
(multiplisitas, J (Hz), ΣΣΣΣ H)
δδδδC 125 MHz
(ppm) 1 2 3 1’ 2’ 3’ –
6.84 (s, 1 H) –
– –
7.01 (d, J = 8.6, 1 H)
195.9 92.5 177.7 119.2 162.7 119.0 4’ 7.47 (t, J = 7.4, 1 H) 128.7/129.1 5’ 6.92 (t, J = 7.7, 1 H) 119.3 6’ 7.78 (d, J = 8.1, 1 H) 128.7/129.1
1” – 133.8
2” & 6” 7.93 (d, J = 8.1, 2 H) 129.0 3” & 5” 7.49 (t, J = 8.0, 2 H) 127.0 4” 7.55 (t, J = 7.5, 1 H) 132.6 Fenolik 12.09 (s, 1 H) – Enolik 15.54 (s, 1 H) –
Spektrum 13C-NMR 1,3-diketon
(Lampir-an 6f) memperlihatk(Lampir-an ciri-ciri tautomer enol. Puncak di 195.9 ppm dimiliki oleh satu karbon keton terkonjugasi (180–200 ppm). Karbon enol menghasilkan sinyal yang lebih ke medan bawah (177.7 ppm) dibandingkan dengan karbon oksiaril, akibat tarikan elektron dari ikatan hidrogen intramolekul yang kuat. Satu-satunya karbon oksiaril pada diketon diperlihatkan oleh sinyal di 162.7 ppm.
Muatan negatif akibat resonans pada karbon-α
sistem keton takjenuh-α,β menggeser sinyal
karbon tersebut lebih ke medan atas (92.5 ppm).
Atom-atom karbon-sp2 cincin benzena
11
ppm. Sinyal di 119.2 ppm berasal dariC-kuaterner yang berposisi orto terhadap
substituen oksigen karena letaknya lebih ke medan atas. Dengan demikian, sinyal di 133.8 ppm berasal dari C-kuaterner cincin benzena monosubstitusi.
Sinyal di 127.0 dan 129.0 ppm memiliki intensitas dua kali lebih tinggi karena masing-masing berasal dari dua C-metina yang ekuivalen. Efek pemerisaian akan semakin besar seiring dengan semakin jauhnya posisi suatu atom dari gugus penarik elektron. Berdasarkan fakta tersebut, sinyal di 129.0
ppm berasal dari karbon orto dan sinyal di
127.0 ppm dari karbon meta. Sementara itu,
sinyal karbon orto dan para terhadap
substituen oksigen pendorong elektron lebih ke medan atas (119.0 dan 119.3 ppm). Gugus (C=O)Me menimbulkan pergeseran –0.4 ppm
pada karbon orto dan 2.8 ppm pada karbon
para (Silverstein et al. 2005). Berdasarkan hal
tersebut, sinyal di 132.6 ppm diidentifikasi
berasal dari karbon para terhadap gugus enol.
Dua sinyal di 128.7 dan 129.1 ppm berasal
dari dua karbon metina, orto dan para
terhadap gugus keton, namun identitasnya belum dapat dipastikan karena selisih geseran kimia yang sangat kecil. Penetapan secara pasti memerlukan spektroskopi korelasi dua-dimensi.
SIMPULAN DAN SARAN
Simpulan
Senyawa
1-(2-hidroksifenil)-3-fenilpropa-na-1,3-dion (1,3-diketon) telah berhasil
disintesis sebagai zat antara untuk menyintesis flavon. Reaksi dilakukan dalam empat-tahap dari bahan awal fenol dengan rendemen asetilasi fenol 74–95%, penataan-ulang Fries
fenil asetat membentuk o- dan p-
hidroksi-asetofenon (HAP) berturut-turut 33.7 dan
33.6%, lalu benzoilasi o-HAP dan
penataan-ulang Baker-Venkataraman ester yang
dihasilkan memberikan rendemen
masing-masing 27–44% dan 82–85%. Secara
keseluruhan rendemen empat-tahap reaksi ini ialah 5.5 %.
Saran
Produk 1,3-diketon dapat disiklisasi men-jadi flavon dengan berbagai katalis asam. Selain itu, gugus baru seperti prenil dapat ditambahkan untuk mendapatkan flavon dengan aktivitas yang lebih beragam. Flavon
sintetik yang dapat dihasilkan dari zat antara ini diharapkan memiliki aktivitas yang sama
atau lebih baik dari flavon alami.
Regioselektivitas reaksi penataan-ulang Fries mungkin dapat diperbaiki dengan
memper-banyak jumlah katalis AlCl3, atau dengan
mencobakan katalis asam Lewis lain.
DAFTAR PUSTAKA
Barros A, Silva AMS. 2006. Efficient
synthesis of nitroflavones by
cyclodehydrogenation of
2’-hydroxychalcones and by the
Baker-Venkataraman method. Monatshefte für
Chemie 137:1505-1528.
Furniss BS, Hannaford AJ, Smith PWG,
Tatchell AR, editor. 1989. Vogel’s
Textbook of Practical Organic Chemistry. Ed ke-5. Essex: Longman Scientific and Technical.
Furuta T et al. 2004. Concise total synthesis
of flavone C-glycoside having potent
anti-inflammatory activity. Tetrahedron
60:9375-9379.
Göker H, Boykin DW, Yildiz S. 2005. Synthesis and potent antimicrobial activity of some novel 2-phenyl or
methyl-4H-1-benzopyran-4-ones
carry-ing amidinobenzimidazoles. Bioorg Med
Chem 13:1707-1714.
Heravi M, Behbahani FK, Zadsirjan F, Oskooie H. 2006. Copper(II) sulfate
pentahydrate (CuSO4·5H2O) a green
catalyst for solventless acetylation of alcohols and phenols with acetic
anhydride. J Braz Chem Soc
17:1045-1047.
Hocking MB. 1980. 2-Hydroxyacetophenone via fries rearrangement and related
reactions, a comparative applied study. J
Chem Tech Biotechnol 30:626-641.
Kabalka GW, Mereddy AR. 2005.
Microwave-assisted synthesis of
functionalized flavones and chromones.
Tetrahedron Lett 46:6315-6317.
Kalinin AV, da Silva AJM, Lopes CC, Lopes RS, Snieckus V. 1998. Palladium-catalyzed synthesis of flavones and chromones via carbonylative coupling of
α-iodophenols with terminal acetylenes.
Tetrahedron Lett 39:4995-4998.
Lee JI, Son HS, Park H. 2004. An efficient
2-11
ppm. Sinyal di 119.2 ppm berasal dariC-kuaterner yang berposisi orto terhadap
substituen oksigen karena letaknya lebih ke medan atas. Dengan demikian, sinyal di 133.8 ppm berasal dari C-kuaterner cincin benzena monosubstitusi.
Sinyal di 127.0 dan 129.0 ppm memiliki intensitas dua kali lebih tinggi karena masing-masing berasal dari dua C-metina yang ekuivalen. Efek pemerisaian akan semakin besar seiring dengan semakin jauhnya posisi suatu atom dari gugus penarik elektron. Berdasarkan fakta tersebut, sinyal di 129.0
ppm berasal dari karbon orto dan sinyal di
127.0 ppm dari karbon meta. Sementara itu,
sinyal karbon orto dan para terhadap
substituen oksigen pendorong elektron lebih ke medan atas (119.0 dan 119.3 ppm). Gugus (C=O)Me menimbulkan pergeseran –0.4 ppm
pada karbon orto dan 2.8 ppm pada karbon
para (Silverstein et al. 2005). Berdasarkan hal
tersebut, sinyal di 132.6 ppm diidentifikasi
berasal dari karbon para terhadap gugus enol.
Dua sinyal di 128.7 dan 129.1 ppm berasal
dari dua karbon metina, orto dan para
terhadap gugus keton, namun identitasnya belum dapat dipastikan karena selisih geseran kimia yang sangat kecil. Penetapan secara pasti memerlukan spektroskopi korelasi dua-dimensi.
SIMPULAN DAN SARAN
Simpulan
Senyawa
1-(2-hidroksifenil)-3-fenilpropa-na-1,3-dion (1,3-diketon) telah berhasil
disintesis sebagai zat antara untuk menyintesis flavon. Reaksi dilakukan dalam empat-tahap dari bahan awal fenol dengan rendemen asetilasi fenol 74–95%, penataan-ulang Fries
fenil asetat membentuk o- dan p-
hidroksi-asetofenon (HAP) berturut-turut 33.7 dan
33.6%, lalu benzoilasi o-HAP dan
penataan-ulang Baker-Venkataraman ester yang
dihasilkan memberikan rendemen
masing-masing 27–44% dan 82–85%. Secara
keseluruhan rendemen empat-tahap reaksi ini ialah 5.5 %.
Saran
Produk 1,3-diketon dapat disiklisasi men-jadi flavon dengan berbagai katalis asam. Selain itu, gugus baru seperti prenil dapat ditambahkan untuk mendapatkan flavon dengan aktivitas yang lebih beragam. Flavon
sintetik yang dapat dihasilkan dari zat antara ini diharapkan memiliki aktivitas yang sama
atau lebih baik dari flavon alami.
Regioselektivitas reaksi penataan-ulang Fries mungkin dapat diperbaiki dengan
memper-banyak jumlah katalis AlCl3, atau dengan
mencobakan katalis asam Lewis lain.
DAFTAR PUSTAKA
Barros A, Silva AMS. 2006. Efficient
synthesis of nitroflavones by
cyclodehydrogenation of
2’-hydroxychalcones and by the
Baker-Venkataraman method. Monatshefte für
Chemie 137:1505-1528.
Furniss BS, Hannaford AJ, Smith PWG,
Tatchell AR, editor. 1989. Vogel’s
Textbook of Practical Organic Chemistry. Ed ke-5. Essex: Longman Scientific and Technical.
Furuta T et al. 2004. Concise total synthesis
of flavone C-glycoside having potent
anti-inflammatory activity. Tetrahedron
60:9375-9379.
Göker H, Boykin DW, Yildiz S. 2005. Synthesis and potent antimicrobial activity of some novel 2-phenyl or
methyl-4H-1-benzopyran-4-ones
carry-ing amidinobenzimidazoles. Bioorg Med
Chem 13:1707-1714.
Heravi M, Behbahani FK, Zadsirjan F, Oskooie H. 2006. Copper(II) sulfate
pentahydrate (CuSO4·5H2O) a green
catalyst for solventless acetylation of alcohols and phenols with acetic
anhydride. J Braz Chem Soc
17:1045-1047.
Hocking MB. 1980. 2-Hydroxyacetophenone via fries rearrangement and related
reactions, a comparative applied study. J
Chem Tech Biotechnol 30:626-641.
Kabalka GW, Mereddy AR. 2005.
Microwave-assisted synthesis of
functionalized flavones and chromones.
Tetrahedron Lett 46:6315-6317.
Kalinin AV, da Silva AJM, Lopes CC, Lopes RS, Snieckus V. 1998. Palladium-catalyzed synthesis of flavones and chromones via carbonylative coupling of
α-iodophenols with terminal acetylenes.
Tetrahedron Lett 39:4995-4998.
Lee JI, Son HS, Park H. 2004. An efficient
2-SINTESIS 1-(2
1,3-DION DA
FAKULTAS MATE
IN
(2-HIDROKSIFENIL)-3-FENILP
DARI o-HIDROKSIASETOFENO
BENZOIL KLORIDA
DIAN SEPTIANI
DEPARTEMEN KIMIA
ATEMATIKA DAN ILMU PENGETAH
INSTITUT PERTANIAN BOGOR
BOGOR
2011
1
LPROPANA-NON DAN
11
ppm. Sinyal di 119.2 ppm berasal dariC-kuaterner yang berposisi orto terhadap
substituen oksigen karena letaknya lebih ke medan atas. Dengan demikian, sinyal di 133.8 ppm berasal dari C-kuaterner cincin benzena monosubstitusi.
Sinyal di 127.0 dan 129.0 ppm memiliki intensitas dua kali lebih tinggi karena masing-masing berasal dari dua C-metina yang ekuivalen. Efek pemerisaian akan semakin besar seiring dengan semakin jauhnya posisi suatu atom dari gugus penarik elektron. Berdasarkan fakta tersebut, sinyal di 129.0
ppm berasal dari karbon orto dan sinyal di
127.0 ppm dari karbon meta. Sementara itu,
sinyal karbon orto dan para terhadap
substituen oksigen pendorong elektron lebih ke medan atas (119.0 dan 119.3 ppm). Gugus (C=O)Me menimbulkan pergeseran –0.4 ppm
pada karbon orto dan 2.8 ppm pada karbon
para (Silverstein et al. 2005). Berdasarkan hal
tersebut, sinyal di 132.6 ppm diidentifikasi
berasal dari karbon para terhadap gugus enol.
Dua sinyal di 128.7 dan 129.1 ppm berasal
dari dua karbon metina, orto dan para
terhadap gugus keton, namun identitasnya belum dapat dipastikan karena selisih geseran kimia yang sangat kecil. Penetapan secara pasti memerlukan spektroskopi korelasi dua-dimensi.
SIMPULAN DAN SARAN
Simpulan
Senyawa
1-(2-hidroksifenil)-3-fenilpropa-na-1,3-dion (1,3-diketon) telah berhasil
disintesis sebagai zat antara untuk menyintesis flavon. Reaksi dilakukan dalam empat-tahap dari bahan awal fenol dengan rendemen asetilasi fenol 74–95%, penataan-ulang Fries
fenil asetat membentuk o- dan p-
hidroksi-asetofenon (HAP) berturut-turut 33.7 dan
33.6%, lalu benzoilasi o-HAP dan
penataan-ulang Baker-Venkataraman ester yang
dihasilkan memberikan rendemen
masing-masing 27–44% dan 82–85%. Secara
keseluruhan rendemen empat-tahap reaksi ini ialah 5.5 %.
Saran
Produk 1,3-diketon dapat disiklisasi men-jadi flavon dengan berbagai katalis asam. Selain itu, gugus baru seperti prenil dapat ditambahkan untuk mendapatkan flavon dengan aktivitas yang lebih beragam. Flavon
sintetik yang dapat dihasilkan dari zat antara ini diharapkan memiliki aktivitas yang sama
atau lebih baik dari flavon alami.
Regioselektivitas reaksi penataan-ulang Fries mungkin dapat diperbaiki dengan
memper-banyak jumlah katalis AlCl3, atau dengan
mencobakan katalis asam Lewis lain.
DAFTAR PUSTAKA
Barros A, Silva AMS. 2006. Efficient
synthesis of nitroflavones by
cyclodehydrogenation of
2’-hydroxychalcones and by the
Baker-Venkataraman method. Monatshefte für
Chemie 137:1505-1528.
Furniss BS, Hannaford AJ, Smith PWG,
Tatchell AR, editor. 1989. Vogel’s
Textbook of Practical Organic Chemistry. Ed ke-5. Essex: Longman Scientific and Technical.
Furuta T et al. 2004. Concise total synthesis
of flavone C-glycoside having potent
anti-inflammatory activity. Tetrahedron
60:9375-9379.
Göker H, Boykin DW, Yildiz S. 2005. Synthesis and potent antimicrobial activity of some novel 2-phenyl or
methyl-4H-1-benzopyran-4-ones
carry-ing amidinobenzimidazoles. Bioorg Med
Chem 13:1707-1714.
Heravi M, Behbahani FK, Zadsirjan F, Oskooie H. 2006. Copper(II) sulfate
pentahydrate (CuSO4·5H2O) a green
catalyst for solventless acetylation of alcohols and phenols with acetic
anhydride. J Braz Chem Soc
17:1045-1047.
Hocking MB. 1980. 2-Hydroxyacetophenone via fries rearrangement and related
reactions, a comparative applied study. J
Chem Tech Biotechnol 30:626-641.
Kabalka GW, Mereddy AR. 2005.
Microwave-assisted synthesis of
functionalized flavones and chromones.
Tetrahedron Lett 46:6315-6317.
Kalinin AV, da Silva AJM, Lopes CC, Lopes RS, Snieckus V. 1998. Palladium-catalyzed synthesis of flavones and chromones via carbonylative coupling of
α-iodophenols with terminal acetylenes.
Tetrahedron Lett 39:4995-4998.
Lee JI, Son HS, Park H. 2004. An efficient
2-12
hydroxybenzoic acids. Bull Korean
Chem Soc 25:1945-1947.
Markham KR. 1988. Cara Mengidentifikasi
Flavonoid. Padmawinata K,
penerjemah.Bandung: ITB Pr.
Terjemahan dari: Techniques of
Flavonoid Identification.
Muller E, Kalai T, Jeko J, Hideg K. 2000. Synthesis of spin labelled chromones.
Synthesis 10:1415-1420.
Pavia DL, Lampman GM, Kriz GS, Vyvyan
JR. 2009. Introduction to Spectroscopy.
Ed ke-4. Belmont: Brooks/Cole.
Silverstein RM, Webster FX, Kiemle DJ,
2005. Spectrometric Identification of
Organic Compounds. Ed ke-7. Hoboken: Wiley.
Wheeler TS. 1963. Flavone. Org Synth Coll
4:478.
SINTESIS 1-(2
1,3-DION DA
FAKULTAS MATE
IN
(2-HIDROKSIFENIL)-3-FENILP
DARI o-HIDROKSIASETOFENO
BENZOIL KLORIDA
DIAN SEPTIANI
DEPARTEMEN KIMIA
ATEMATIKA DAN ILMU PENGETAH
INSTITUT PERTANIAN BOGOR
BOGOR
2011
1
LPROPANA-NON DAN
2
ABSTRAK
DIAN SEPTIANI. Sintesis 1-(2-Hidroksifenil)-3-fenilpropana-1,3-dion dari
o
-Hidroksiasetofenon dan Benzoil Klorida. Dibimbing oleh SUMINAR S.
ACHMADI dan BUDI ARIFIN.
Flavonoid merupakan kelompok senyawa polifenolik terbesar yang
ditemukan di alam dengan kerangka karbon C6-C3-C6. Salah satu kelompok
flavonoid yang telah dilaporkan memiliki bioaktivitas yang luas ialah flavon.
Flavon tersebar luas dalam tanaman berpembuluh. Bioaktivitas flavon antara lain
sebagai antioksidan, inhibitor proteinase HIV-1, penginduksi apoptosis yang kuat
dan selektif dalam sel usus besar manusia, dan ligan untuk reseptor BDZ-R. Salah
satu rute sintesis flavon yang penting dan digunakan secara luas ialah siklisasi
oksidatif 1-(2-hidroksifenil)-3-fenilpropana-1,3-dion (1,3-diketon) dengan katalis
asam. Dalam penelitian ini, 1,3-diketon telah berhasil disintesis. Sintesis
dilakukan dalam empat-tahap, yang melibatkan penataan ulang
Baker-Venkataraman, dari bahan awal fenol. Fenol diasetilasi menghasilkan fenil asetat
dengan rendemen 74–95%. Penataan-ulang Fries berkataliskan-AlCl
3mengubah
fenil asetat menjadi
o
-hidroksiasetofenon (
o
-HAP) dengan rendemen 34%.
Benzoilasi
o
-HAP dan penataan ulang Baker-Venkataraman produk ester dengan
KOH dalam piridina menghasilkan 1,3-diketon. Rendemen kedua tahap ini
berturut-turut 27–44% dan 82–85%. Semua produk sintesis dalam penelitian ini
telah dicirikan secara spektroskopi dan, untuk produk padatan, juga dicirikan titik
lelehnya.
ABSTRACT
DIAN SEPTIANI. Synthesis of 1-(2-Hydroxyphenyl)-3-phenylpropane-1,3-dione
from
o
-Hydroxyacetophenone and Benzoyl Chloride. Supervised by SUMINAR
S. ACHMADI and BUDI ARIFIN.
3
SINTESIS
1-(2-HIDROKSIFENIL)-3-FENILPROPANA-1,3-DION DARI o-HIDROKSIASETOFENON DAN
BENZOIL KLORIDA
DIAN SEPTIANI
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
4
Judul
: Sintesis 1-(2-Hidroksifenil)-3-fenilpropana-1,3-dion dari
o
-Hidroksi-asetofenon dan Benzoil Klorida
Nama
: Dian Septiani
NIM
: G44050563
Menyetujui
Pembimbing I,
Prof. Dr. Ir. Suminar S. Achmadi
NIP 19480427 197412 2 001
Pembimbing II,
Budi Arifin, M.Si
NIP 19830109 200604 1 004
Mengetahui
Ketua Departemen Kimia
Prof. Dr. Ir. Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
5
PRAKATA
Bismillahirrahmaanirrahiim...
Alhamdulillah
, puji syukur penulis panjatkan kepada Allah SWT atas segala
berkah, rahmat, hidayah serta karunia yang diberikan kepada penulis sehingga
dapat menyelesaikan karya ilmiah dengan judul Sintesis
1-(2-Hidroksifenil)-3-fenilpropan-1,3-dion dari
o
-Hidroksiasetofenon dan Benzoil Klorida. Shalawat
serta salam semoga selalu tercurahkan kepada Nabi Muhammad SAW,
keluarganya, dan semoga kita semua menjadi pengikutnya hingga akhir zaman.
Penulis mengucapkan terima kasih kepada Ibu Suminar Setiati Achmadi dan
Bapak Budi Arifin selaku pembimbing yang telah memberikan bimbingan,
arahan, dan waktu. Terima kasih yang tak terhingga kepada Papa, Mama, dan
adik-adikku tercinta atas nasihat, semangat, bantuan materi, kesabaran, dan
doa-doanya.
Penulis juga mengucapkan terima kasih kepada Bapak Muhammad Farid,
Bapak Sabur, Ibu Yenni, Ibu Siti Robiah, Kak Tuti, Mbak Sofa, dan Bapak
Ahmad (LIPI Kimia Serpong) atas fasilitas, bantuan, serta masukan yang
diberikan. Tak lupa, ungkapan terima kasih penulis sampaikan kepada Luthfan
Irfana, Malia, Aulia, Fauzi, Diah, Vanny, serta semua rekan peneliti di
Laboratorium Kimia Organik Kimia FMIPA IPB atas diskusi dan kebersamaan
selama penulis menempuh studi dan menjalankan penelitian.
Penulis berharap karya ilmiah ini dapat bermanfaat bagi perkembangan ilmu
pengetahuan.
Bogor, Desember 2010
6
RIWAYAT HIDUP
Penulis dilahirkan di Ciamis pada tanggal 7 September 1987 dari pasangan
Irianto Riady Hartono dan Yeyen Heryanti. Penulis merupakan putri pertama dari
tiga bersaudara.
Tahun 2005 penulis lulus dari SMA Negeri 1 Pandeglang dan pada tahun