SUPLEMENTASI SODIUM DODECYL SULPHATE PADA PENGENCER
TRIS DAN SITRAT KUNING TELUR UNTUK MENINGKATKAN
KUALITAS SEMEN KAMBING PERANAKAN ETTAWA
NUR HIDAYATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Suplementasi Sodium Dodecyl Sulphate pada Pengencer Tris dan Sitrat Kuning Telur untuk Meningkatkan Kualitas Semen Kambing Peranakan Ettawa adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ii
RINGKASAN
NUR HIDAYATI. Suplementasi Sodium Dodecyl Sulphate pada Pengencer Tris dan Sitrat Kuning Telur untuk Meningkatkan Kualitas Semen Kambing Peranakan Ettawa. Dibimbing oleh R IIS ARIFIANTINI dan DONDIN SAJUTHI.
Semen kambing mengandung enzim phospholipase A atau disebut juga egg yolk coagulating enzyme yang dihasilkan kelenjar bulbouretralis atau bulbourethral gland secretion (BUS). Enzim phospholipase A tersebut dapat menghidrolisis fosfolipid dari kuning telur menjadi lysophospholipid seperti lysolecithin yang toksik pada spermatozoa. Fosfolipid dalam kuning telur dibutuhkan pada saat pendinginan dan pembekuan semen untuk melindungi membran plasma spermatozoa.
Penambahan sodium dodecyl sulphate (SDS) ke dalam pengencer tris kuning telur gliserol telah terbukti meningkatkan dispersi dari kuning telur dalam pengencer sehingga meningkatkan kontak antara kuning telur dan membran sel spermatozoa. Meningkatnya perlindungan dari kuning telur dapat memperbaiki motilitas setelah preservasi dan kriopreservasi. Terdispersinya molekul kuning telur menjadi lebih kecil diharapkan mengurangi efek negatif dari enzim phospholipase A. Sodium dodecyl sulphate adalah surfaktan (detergen), sehingga dalam konsentrasi yang tinggi juga bersifat toksik, sehingga perlu dicari konsentrasi terbaik untuk preservasi dan kriopreservasi semen kambing PE.
Penelitian ini dilakukan dengan tujuan untuk mencari konsentrasi SDS terbaik pada pengencer tris dan membandingkan penambahan SDS ke dalam pengencer semen cair dan semen beku kambing ettawa. Penelitian dilakukan dalam tiga tahap. Tahap pertama adalah menentukan konsentrasi SDS pada pengencer tris kuning telur. Semen dikoleksi dari tiga ekor kambing PE menggunakan vagina buatan. Semen segera dievaluasi secara makroskopis dan mikroskopis. Hanya semen yang menunjukkan motilitas spermatozoa lebih dari 70%, konsentrasi spermatozoa lebih dari 2000x106dengan abnormalitasnya kurang dari 15% digunakan dalam penelitian ini. Semen yang memenuhi syarat diencerkan dalam pengencer Tris kuning telur dengan penambahan 0.00% SDS (TKT0), 0.025% SDS (TKT0.025), 0.05% SDS (TKT0.05) dan 0.075% SDS (TKT0.075). Semen yang telah diencerkan disimpan pada suhu 5 oC. Motilitas dan viabilitas spermatozoa dinilai setiap 12 jam selama 72 jam.
Tahap kedua adalah menguji konsentrasi SDS terbaik 0.05% yang didapatkan dari tahap pertama ke dalam dua pengencer yaitu pengencer tris kuning telur dan sitrat kuning telur. Semen dikoleksi dan dievaluasi dengan perlakuan yang sama, kemudian dibagi ke dalam empat pengencer, yaitu tris kuning telur tanpa SDS (TKT0), tris kuning telur dengan 0.05% SDS (TKTS), sitrat kuning telur tanpa SDS (SKT0) dan sitrat kuning telur dengan SDS 0.05% (SKTS), teknik penyimpanan dan pengamatan sama dengan yang dilakukan pada tahap I.
Tahap ketiga, membandingkan kualitas semen beku antara TKT0, TKTS, SKT0, SKTS keempatnya ditambah 5% gliserol, kemudian dibandingkan dengan pengencer paten Andromed®. Semen dikoleksi dan dievaluasi sama dengan yang dilakukan pada tahap I dan II. Kemudian diencerkan dengan tiga bahan pengencer semen beku, dikemas dalam straw 0.25 ml, diekuilibrasi pada suhu 5 o
empat jam kemudian dibekukan di atas uap nitrogen cair selama 10 menit, selanjutnya disimpan dalam kontainer nitrogen cair (-196 oC) untuk pengujian lebih lanjut. Keberhasilan pembekuan dievaluasi 24 jam setelah penyimpanan dengan cara melakukan thawing semen beku pada suhu 37 oC. Kualitas semen dievaluasi selain pada semen segar, juga dilakukan pada semen setelah pengenceran, setelah ekuilibrasi dan setelah pembekuan. Seluruh penelitian dirancang menggunakan rancangan acak lengkap (RAL) pengamatan berulang untuk semen cair dan semen beku menggunakan pengamatan tunggal. Dianalisis menggunakan ANOVA disajikan dalam bentuk rataan dan standar deviasi dengan program SAS 9.1.
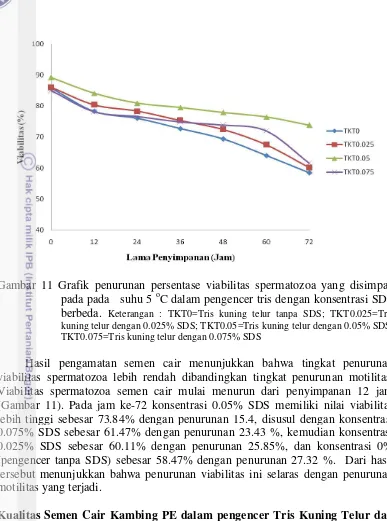
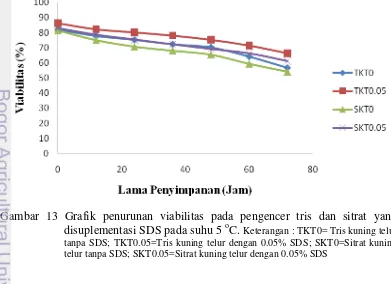
Hasil penelitian menunjukkan konsentrasi SDS terbaik (P<0.05) pada semen cair dengan pengencer Tris kuning telur adalah 0.05% SDS (TKT0.05). Penambahan SDS pada dua buffer Tris (TKTS) dan Sitrat kuning telur (SKTS) yang diberi SDS 0.05% lebih baik dibandingkan tanpa SDS. Motilitas dan viabilitas spermatozoa pada jam ke-72 penyimpanan dalam pengencer TKTS (59.58±0.72%; 66.35±3.30%) lebih tinggi (P<0.05) dibandingkan dengan SKTS (47.5±3.31%; 61.31±5.55%). Motilitas, viabilitas, dan membran plasma utuh spermatozoa setelah thawing dalam pengencer TKTS adalah 50.83±7.97; 64.98±9.11%; 66.36±8.57% sama baiknya (P>0.05) dengan pengencer paten Andromed yaitu 50.42±8.97; 63.20±11.94%; 65.89±8.70% keduanya lebih tinggi dibandingkan dengan tiga pengencer lainnya.
Kesimpulan dari penelitian ini adalah konsentrasi SDS terbaik pada pengencer Tris kuning telur adalah 0.05%. Pengencer tris dan sitrat yang diberi SDS lebih baik daripada kontrol dan kualitas semen beku pada pengencer Tris kuning telur yang diberi SDS sama baiknya dengan Andromed®.
iv
SUMMARY
NUR HIDAYATI. Supplementation Sodium Dodecyl Sulphate in Tris and Citrate Egg Yolk Diluent to Improve Quality of Ettawa Grade Buck Semen. Supervised by R IIS ARIFIANTINI and DONDIN SAJUTHI.
Buck semen contains enzyme phospholipase A also called egg yolk coagulating enzyme produced by bulbourethral gland secretion (BUS). Enzyme phospholipase A can hydrolyze the phospholipids from egg yolk into a lysophospholipid such as lysolecithin which is toxic on the spermatozoa. Egg yolk phospholipids needed during chilling and freezing to protect the plasma membrane of spermatozoa from cold shock.
Suplementation of sodium dodecyl sulphate (SDS) into diluent contains tris egg yolk has been reported to increased the dispersion of egg yolk and improved the contact with spermatozoa membrane. By increasing the protection capability of egg yolk may improve motility after preservation and cryopreservation. Dispersion of yolk into smaller moleculls is expected to reduce the negative effects of the phospholipase A enzyme. Sodium dodecyl sulphate is a surfactant (detergent), if high concentrations can be toxic to the spermatozoa. Exploration for the best concentration of SDS on the preservation and cryopreservation of buck semen need to be done.
Aims of the research was to elucidate the best SDS concentration in Tris egg yolk (TEY) diluent and to compare the suplementation of SDS in TEY and Citrate egg yolk (CEY) on the quality of chilled and frozen ettawa grade buck semen. Research carried out in three steps. The first steps was to determine the concentration of SDS in TEY. Semen was collected from three ettawa grade bucks, using artificial vagina. Immediately after collection the semen than evaluated micro and microscopycally. Only semen showed more than 70% spermatozoa motility and more than 2000x106 spermatozoa concentration with less than 15% spermatozoa abnormality diluted with TEY suplemented with 0.00% SDS (TEY0), 0.025% SDS (TEY 0.025), 0.05% SDS (TEY0.05) and 0.075% SDS (TEY0.075). Diluted semen was stored at 5 oC. Motility and viability of spermatozoa assessed every 12 hours for 72 hours observation.
The second steps was aim to compare the supplemention of the best SDS concentration in experiment I (0.05% SDS) in TEY and Citrate egg yolk (CEY). Semen collected and evaluated similar to that carried out in first experiment. Good quality semen then divided into four tubes, each of them were diluted with TEY without SDS (TEY0), Tris egg yolks with 0.05% SDS (TEYS), Citrate egg yolk without SDS (CEY0) and Citric egg yolk with 0.05% SDS (CEYS), the diluted semen than stored and observed similar to those made in experiment I.
asses after 24 hours storage. The frozen semen thawed at 37 oC for 30 seconds. Semen quality performed after dilution, equilibrate and after freezing. Research was design with completely randomized design (CRD), with repeated observations for liquid semen and a single observation for frozen semen. Analyzed using ANOVA Data presented as means ± standard deviation using SAS 9.1 program.
The results showed that the best SDS concentration (P<0.05) in TEY diluent was 0.05% (TEY0.05). Addition of 0.05% SDS in Tris (TEYS) and Citrate egg yolk (CEYS) were significantly higher (P<0.05) than Tris and Citrate without SDS. Motility and viability of spermatozoa at 72 hour storage in TEYS (59.58±0.72%; 66.35±3.30%) were higher (P<0.05) compared with CEYS (47.5±3.31%; 61.31±5.55%). The semen quality after thawing demonstrated motility, viability, and plasma membrane integrity of spermatozoa in TEYS were 50.83±7.97; 64.98±9.11%; 66.36±8.57%, not differ (P>0.05) with Andromed 50.42±8.97; 63.20±11.94%; 65.89±8.70% both were higher than three other diluent.
The result conclude that the best SDS concentration in Tris egg yolk diluent was 0.05%. Suplementation 0.05% SDS in Tris and citrate egg yolk preserve better than those without SDS. The quality of frozen semen in Tris egg yolk with 0.05% SDS was not different with Andromed®
vi
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Reproduksi
SUPLEMENTASI SODIUM DODECYL SULPHATE PADA PENGENCER
TRIS DAN SITRAT KUNING TELUR UNTUK MENINGKATKAN
KUALITAS SEMEN KAMBING PERANAKAN ETTAWA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
ii
iv
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan November 2013 dengan judul Suplementasi Sodium Dodecyl Sulphate pada Pengencer Tris dan Sitrat Kuning Telur untuk Meningkatkan Kualitas Semen Kambing Peranakan Ettawa.
Selama penelitian hingga selesainya tesis ini penulis banyak mendapat bantuan dari berbagai pihak, untuk ini penulis sampaikan terima kasih. Terutama, penulis menyampaikan terima kasih yang tulus kepada Komisi Pembimbing kepada Prof Dr Dra Raden Iis Arifiantini, MSi dan Prof drh Dondin Sajuthi, MST PhD atas bimbingan yang telah diberikan. Terima kasih juga kepada Prof Dr drh Tuty Laswardi Yusuf, MS sebagai penguji dari luar komisi atas masukan untuk perbaikan tesis ini. Terima kasih kepada manajemen Koperasi Kambing Perah, Cikarawang, Bogor yang telah mengijinkan pemakaian kambing Peranakan Ettawa (PE). Tak lupa penulis berterima kasih kepada seluruh staf dan pegawai di Bagian Reproduksi dan Kebidanan, Bondan Ahmadi SE, drh Dedi Setiadi Msi, ade. Terima kasih juga saya ucapkan kepada rekan seperjuangan pak Langgeng, bu Eros dan rekan-rekan Biologi Reproduksi 2012.
Rasa hormat dan terima kasih penulis persembahkan kepada kedua orang tua bapak H. Hasan Basori, ibu Hj. Umi Salamah, Kakak-kakak tersayang (H. Muhammad Wahid Hasyim SE, MM, H. Muhammad Wahib Wahab S.Sos, Hj. Tri Mulyani SHi), dan Adi Wibowo yang senantiasa memberikan doa, semangat dan dukungan kepada penulis selama ini, serta semua pihak yang tidak bisa disebutkan satu per satu.
Penulis menyadari bahwa tesis ini masih jauh dari sempurna. Namun demikian, penulis berharap tesis ini bermanfaat bagi para pembaca dan perkembangan ilmu pengetahuan dan teknologi pada umumnya.
DAFTAR ISI
Faktor-Faktor Penyebab Kerusakan Sel Spermatozoa selama Kriopreservasi 13
3 MATERI DAN METODE PENELITIAN 17 Tempat dan Waktu Penelitian 17 Materi Penelitian 17 Tahap Penelitian 17 Tahap I Menentukan Konsentrasi SDS Terbaik pada Pengencer Tris Kuning Telur 17
Tahap II Membandingkan Kualitas Semen Cair Terbaik Menggunakan TKT dan SKT 19
Tahap III Membandingkan Kualitas Semen Beku Menggunakan TKT, SKT, Andromed 20
Rancangan Penelitian dan Analisis Data 21
vi
Kualitas Semen Cair Kambing PE dalam Pengencer Tris Kuning Telur
dengan berbagai konsentrasi SDS 26
Pengaruh Berbagai Konsentrasi SDS terhadap Persentase Motilitas
Spermatozoa 27
Pengaruh Berbagai Konsentrasi SDS terhadap Persentase Viabilitas
Spermatozoa 29
Kualitas Semen Cair Kambing PE dalam Pengencer Tris Kuning Telur Dan Sitrat Kuning Telur yang Disuplementasi SDS 30 Pengaruh SDS 0.05% pada Pengencer Tris dan Sitrat terhadap Motilitas
Spermatozoa 31
Pengaruh SDS 0.05% pada Pengencer Tris dan Sitrat terhadap Viabilitas
Spermatozoa 31
Kualitas Semen Beku 34
5 SIMPULAN DAN SARAN 37
Simpulan 37
Saran 37
DAFTAR PUSTAKA 38
LAMPIRAN 44
DAFTAR TABEL
9 Persentase motilitas spermatozoa kambing pada suhu 5 oC dalam pengencer tris dengan konsentrasi SDS berbeda 27
10 Persentase viabilitas spermatozoa kambing pada suhu 5 oC dalam pengencer tris dengan konsentrasi SDS berbeda 29
11 Persentase motilitas spermatozoa kambing pada pengencer tris dan sitrat yang disuplementasi SDS pada suhu 5 oC 31
12 Persentase viabilitas spermatozoa kambing pada pengencer tris dan sitrat yang disuplementasi SDS pada suhu 5 oC 33
13 Motilitas dan viabilitas spermatozoa setelah pengenceran 34
14 Motilitas dan viabilitas spermatozoa setelah equilibrasi 34
6 Spermatozoa hidup dan mati dengan pewarnaan eosin nigrosin (a) spermatozoa hidup dan (b) spermatozoa mati 23
7 Membran plasma utuh menggunakan HOS test (a) membran plasma utuh dan (b) membran plasma yang rusak 24
8 Abnormalitas spermatozoa bersifat primer (a) abaxial, (b) detached head, (c) double head, (d) round head, (e) microcephalus, (f) undeveloped, (g) knobbed acrosome, (h) pearshaped 25
9 Abnormalitas spermatozoa bersifat sekunder (a) double folded, (b) coiled under the head, (c) simple bent, (d) bow midpiece, (e) bent mid piece, dan (f) cytoplasmic droplet. 26
viii
11 Grafik penurunan persentase viabilitas spermatozoa yang disimpan
pada suhu 5oC dalam pengencer tris dengan konsentrasi SDS berbeda 30
12 Grafik penurunan persentase motilitas spermatozoa pada pengencer tris dan sitrat yang disuplementasi SDS pada suhu 5 oC 32
13 Grafik penurunan persentase viabilitas spermatozoa pada pengencer tris dan sitrat yang disuplementasi SDS pada suhu 5 oC 33
DAFTAR LAMPIRAN
1 Larutan formol saline 452 Larutan HOS Test 45
3 Larutan pewarna eosin-nigrosin 45
1
1 PENDAHULUAN
Latar Belakang
Inseminasi buatan (IB) merupakan salah satu teknologi reproduksi yang dapat dilakukan untuk perbaikan mutu genetik ternak kambing di Indonesia. Namun teknologi ini pada ternak kambing masih kurang diaplikasikan secara luas karena mengembangbiakannya masih dilakukan secara alami. Hal ini terkait berbagai kendala, di antaranya ketepatan waktu dan teknik inseminasi, betina, sumber daya manusia, teknik pengawetan semen dan kualitas semen cair dan beku yang dihasilkan. Kualitas semen cair ditentukan oleh suhu penyimpanan, jenis pengencer serta dosis inseminasi yang digunakan (Yusuf et al. 2005). Suhu semen cair pada ternak umumnya adalah 5 oC. Pada suhu tersebut spermatozoa masih melakukan metabolisme sehingga daya tahan hidupnya terbatas. Kualitas semen beku tersebut ditentukan oleh berbagai faktor diantaranya teknik pembekuan, jenis pengencer, jenis dan konsentrasi krioprotektan yang digunakan. Saat ini semen beku kambing telah diproduksi oleh beberapa balai inseminasi buatan (BIB), menggunakan pengencer paten andromed® (Minitub Germany)
Pada proses pembekuan semen (kriopreservasi) suhu diturunkan secara bertahap sampai suhu -196 oC di dalam nitrogen cair, menyebabkan sekitar 30% spermatozoa mati (Triwulaningsih 2003). Selama proses kriopreservasi ini selain perubahan suhu juga terjadi perubahan tekanan osmotik yang ekstrim sehingga dapat merusak komposisi lipid membran plasma, dan berdampak pada menurunnya motilitas dan fertilitas dari spermatozoa tersebut. Membran dianggap target utama pada pendinginan atau pembekuan kerusakan sel (Aboagla dan Terada 2004b). Sehingga menjaga integritas membran untuk menghasilkan spermatozoa fungsional setelah pembekuan sangat penting.
Semen kambing dalam bentuk cair atau beku jika menggunakan bahan pengencer yang mengandung kuning telur ataupun susu dilaporkan memiliki kualitas yang rendah (Sias et al. 2005). Rendahnya kualitas semen tersebut diduga akibat bulbourethral gland secretion (BUS) yang terkandung dalam plasma semen kambing. Di dalam BUS terdapat enzim phospholipase A yang disebut juga egg yolk coagulating enzyme. Enzim ini dapat menghidrolisis fosfolipid dari kuning telur menjadi lysophospholipid seperti lysolecithin yang tosik pada spermatozoa (Amirat et al. 2007), dan merupakan faktor yang dapat merusak akrosom sebelum dan sesudah pembekuan (Julian et al. 2006; Ariantie et al. 2014).
2
1979), tikus (Dewit et al. 2000), kucing (Axner et al. 2004), anjing (Ponglowhapan dan Chatdarong 2008), kambing (Julian et al. 2006; El-Kon et al. 2010), dan domba (El-alamy et al. 2001).
Penambahan SDS dalam bahan pengencer yang mengandung kuning telur dapat melarutkan dan meningkatkan dispersi dari molekul-molekul kuning telur sehingga meningkatkan kontak antara fosfolipid kuning telur dan membran sel spermatozoa (El-Kon et al. 2010). Ponglowhapan dan Chatdarong (2008) melaporkan penambahan SDS pada pengencer semen anjing dapat meningkatkan motilitas, integritas akrosom dan fertilitas yang tinggi. Hal yang sama juga dilaporkan oleh El-Kon et al. (2010) bahwa penambahan SDS ke dalam pengencer tris kuning telur gliserol pada kambing damascus juga memperbaiki motilitas individu, integritas akrosom, viabilitas post thawing dan meningkatkan kidding rate sampai 90%, dengan konsentrasi SDS terbaik 0.05% (w/v). Mengingat SDS adalah bahan yang toksik dan kuning telur juga dibutuhkan saat preservasi dan kriopreservasi semen maka perlu diteliti berbagai konsentasi SDS terbaik dalam dua bahan pengencer untuk preservasi dan kriopreservasi semen kambing PE.
Kerangka Pemikiran
Semen kambing mengandung enzim phospholipase A atau disebut juga egg yolk coagulating enzyme yang dihasilkan oleh kelenjar bulbouretralis atau bulbourethral gland secretion (BUS). Enzim phospholipase A tersebut dapat menghidrolisis fosfolipid dari kuning telur menjadi lysophospholipid antara lain lysolecithin yang tosik pada spermatozoa. Fosfolipid dalam kuning telur dibutuhkan pada saat pembekuan semen untuk melindungi membran plasma spermatozoa. Penambahan Sodium Dodecyl Sulphate (SDS) ke dalam pengencer tris kuning telur gliserol telah terbukti meningkatkan dispersi dari kuning telur dalam pengencer sehingga meningkatkan kontak antara kuning telur dan membran sel spermatozoa. Sehingga daya krioprotektif dari kuning telur meningkat dan memperbaiki motilitas setelah preservasi dan kriopreservasi. Dengan terdispersinya molekul kuning telur menjadi lebih kecil diharapkan mengurangi efek negatif dari enzim phospholipase A. Sodium dodecyl sulphate adalah surfaktan (detergen), sehingga dalam konsentrasi yang tinggi juga bersifat toksik, sehingga perlu dicari konsentrasi terbaik untuk preservasi dan kriopreservasi semen kambing PE.
Tujuan
1. Menentukan konsentrasi SDS yang paling tepat dalam pengencer tris kuning telur.
2. Membandingkan kualitas semen cair terbaik menggunakan tris kuning telur (TKT) dan Sitrat Kuning Telur (SKT) yang ditambahkan SDS.
3
Manfaat Penelitian
Hasil penelitian diharapkan dapat memberikan manfaat sebagai berikut: 1. Diperoleh alternatif pengencer yang lebih baik dengan kualitas yang
diharapkan sama dengan pengencer andromed dalam mempertahankan kualitas semen kambing.
2. Dapat memberi masukan kepada balai inseminasi buatan mengenai manfaat suplementasi SDS dengan konsentrasi yang optimum untuk mempertahankan kualitas semen beku kambing.
Hipotesis
1. Sumplementasi SDS akan mempertahankan kualitas semen cair dalam pengencer Tris kuning telur
2. Suplementasi SDS ke dalam pengencer Tris kuning telur dan Sitrat Kuning Telur sama baiknya dalam mempertahankan kualitas semen cair.
4
2 TINJAUAN PUSTAKA
Kambing Peranakan Ettawa
Kambing peranakan ettawa (PE) merupakan kambing unggul asal Indonesia, yang merupakan hasil persilangan antara kambing Ettawa (asal India) dengan kambing Kacang, yang penampilannya mirip Ettawa tetapi lebih kecil. Kambing PE merupakan tipe dwiguna yaitu penghasil daging dan susu. Kambing PE memiliki kemampuan memproduksi susu 0.99 kg per ekor per hari dan lama laktasi 170.07 hari (Attabany et al. 2001). Dengan kemampuan produksi susu tersebut maka kambing perah PE cukup signifikan untuk dikembangkan sebagai ternak penghasil susu yang sangat potensial. Selain itu, kambing PE pun sangat adaptif dengan topografi Indonesia, tidak memerlukan lahan luas dan pembudidayaannya relatif mudah.
Ciri fisik kambing PE di antaranya warna bulu kombinasi dari warna putih dan hitam/ putih dan coklat (Pamungkas et al. 2009). Dimana bagian kepala hingga leher berwarna coklat atau hitam, dengan bentuk telingga panjang dan menggantung. Garis muka cembung dengan bulu rewos/surai menggantung terkulai. Berat kambing jantan mencapai 90 kg dan kambing betina mencapai 60 kg. Jantan dan betina memiliki tanduk kecil rataan produksi susu mencapai 754 g/hari dengan kisaran 585 – 970 g/ekor/hari (Novita et al. 2006).
Semen Kambing
Semen kambing terdiri atas spermatozoa dan plasma semen. Seluruh permukaan spermatozoa dilapisi oleh membran plasma berupa dua lapis fosfolipid (fosfolipid bilayer) yang bersifat selektif semi permeabel. Bagian kepala spermatozoa membawa materi genetik dan enzim yang berfungsi pada saat spermatozoa menembus ovum dan lapisan-lapisan sel yang melindunginya. Pada bagian ekor terdapat mitokondria yang berfungsi untuk merombak adenosin triphosphate (ATP) menjadi adenosin diphosphate (ADP). ADP kemudian dirombak menjadi adenosin monophosphate (AMP) yang kemudian energinya digunakan dalam proses pergerakan spermatozoa (Garner dan Hafez 2000), pengubahan ATP menjadi ADP menghasilkan energi sebanyak 7000 kalori/mol (Bearden dan Fuquay 2004).
Ukuran kepala spermatozoa pada kambing bervariasi antar jenis, namun secara normal panjang 8 sampai 10 µ m, lebar 4 µm dan tebal 1 µm (Evan dan Maxwell 1987). Sedangkan pada kambing Osmanabadi (India) dilaporkan panjang dan lebar kepala spermatozoa adalah 8.96 µm dan 4.45 µm, panjang dan lebar bagian tengah ekor spermatozoa masing-masing 12.70 µm dan 0.75 µm, dan panjang ekor spermatozoa 36.37 µm.
5
Keberadaan plasma semen kambing merugikan bagi kelangsungan hidup spermatozoa semen beku atau cair dalam media yang mengandung kuning telur atau susu (Paulenz et al. 2005). Hal tersebut akibat sekresi kelenjar Cowper (BUS) yang mengandung phospholipase A (egg yolk caogulating enzyme). Menurut Ari dan Daskin (2010) enzim tersebut menghidrolisis fosfolipid dari kuning ke lysophospholipid seperti lysolecithin, yang bersifat racun untuk spermatozoa. Enzim koagulasi kuning telur menginduksi koagulasi pada pengencer kuning telur dan mengkatalis pelepasan asam lemak dari kuning telur, yang mengarah ke penurunan pH, fraksi protein dari BUS yang bertanggungjawab merusak viabilitas spermatozoa pada pengencer yang mengandung kuning telur dan susu adalah pada 40- 60-kDa.
Bahan Pengencer Semen Kambing
Pengencer semen merupakan medium spermatozoa selama preservasi. Kandungan bahan pengencer semen akan secara langsung memengaruhi kualitas spermatozoa yang terdapat di dalamnya. Untuk menghasilkan semen beku yang berkualitas tinggi dibutuhkan bahan pengencer semen yang mampu mempertahankan kualitas spermatozoa selama proses pendinginan, pembekuan, maupun pada saat thawing (Aboagla dan Terada 2004a; Aboagla dan Terada 2004b). Gazali dan Tambing (2002) menjelaskan bahwa beberapa jenis bahan pengencer yang sering digunakan dalam pembekuan semen antara lain adalah glukosa, laktosa, sukrosa, sitrat, susu skim, dan tris. Glukosa, laktosa, dan sukrosa merupakan sumber energi sehinga spermatozoa tetap bertahan hidup selama proses pembekuan. Sitrat berperan sebagai komponen penyangga sehingga dapat mempertahankan pH semen secara fisiologis.
Larutan yang digunakan sebagai bahan pengencer harus memenuhi beberapa syarat, yaitu (1) tidak bersifat racun; (2) mempertahankan dan tidak membatasi daya fertilitas spermatozoa; (3) murah, sederhana dan praktis dibuat, tetapi spermatozoa yang diencerkan mempunyai daya fertilitas yang tinggi; (4) menjamin kehidupan spermatozoa setelah pengenceran; dan (5) dapat memelihara kehidupan spermatozoa, tetapi tidak menyebabkan spermatozoa aktif selama penyimpanan (Lutfi et al. 2011). Pengencer harus berisikan beberapa agen protektif untuk melindungi spermatozoa selama proses kriopreservasi, antara lain kuning telur untuk melindungi membran sel selam pendinginan sampai suhu 5 oC dan krioprotektan yang melindungi spermatozoa terhadap kerusakan membran selama pembekuan (Khalifa dan El-Saidy 2006).
Pengencer Tris
Bahan yang dapat digunakan sebagai media pengencer antara lain Tris hydroxymethyl aminomethane kuning telur (Tris kuning telur). Pengencer ini memiliki bahan atau zat yang diperlukan oleh spermatozoa yang merupakan sumber makanan baginya, antara lain yaitu seperti fruktosa, laktosa, rafinosa, asam-asam amino dan vitamin dalam kuning telur sehingga spermatozoa dapat memperoleh sumber energi dalam jumlah yang cukup untuk motilitasnya (Susilawati 2011).
6
sebagai komponen utama dalam pengencer untuk pengolahan semen sapi dan kambing, dalam keadaan semen cair maupun semen beku yang memiliki kapasitas penyangga yang baik dan toksisitas yang rendah pada konsentrasi tinggi. Hasil penelitian Paulenz et al. (2002) menunjukkan bahwa pengencer dasar tris dapat mempertahankan daya hidup spermatozoa lebih baik daripada pengencer sitrat maupun susu skim pada semen cair domba pada suhu 5 dan 20 oC. Ax et al. (2000) yang menyatakan bahwa pengencer tris mempunyai beberapa kelebihan antara lain dapat mempertahankan pH, mempertahankan tekanan osmotik dan menjaga keseimbangan elektrolit.
Pengencer Sitrat
Selain pengencer yang mengandung Tris, juga dikenal pengencer sitrat. Pengencer natrium sitrat telah banyak digunakan untuk pengenceran semen ruminansia kecil. Natrium sitrat merupakan penyangga yang mampu mempertahankan kestabilan pH pengencer, sehingga menguntungkan untuk memelihara kelangsungan hidup spermatozoa. Pengencer sitrat menurut Salisbury dan Van Demark (1985) memiliki struktur melingkar dan mengikat kalsium atau logam berat dan memisahkan butir-butir lemak kuning telur sehingga spermatozoa dapat mudah dilihat di bawah mikroskop.
Pengencer sitrat juga telah diteliti olah Arifiantini dan Purwantara (2010) pada semen cair sapi friesian holstein (FH) hasilnya menunjukkan pengencer sitrat yang ditambahkan dengan fruktosa mempunyai kualitas yang sama dengan Tris kuning telur. Dari segi ekonomi, penggunaan buffer sitrat lebih murah dibandingkan Tris. Dalam beberapa penelitian menunjukkan bahwa penggunaan pengncer sitrat 20%, kuning telur 20%, gliserol 8% untuk pembekuan semen rusa fallow (Dama dama) maupun rusa merah (Cervus elaphus spp.) menunjukkan hasil post thawing motility (PTM) lebih dari 70 % (Asher et al. 1993, diacu dalam Asher et al. 2000).
Pengencer Andromed
Andromed® merupakan suatu medium tanpa kuning telur untuk semen beku dan cair mempunyai angka fertilitas tinggi walaupun tanpa kandungan dari hewan aslinya. Selain itu juga tidak mempunyai resiko kontaminasi mikroorganisme serta mudah dalam penanganan dan waktu penyimpanan. Bahan pengencer instant ini berupa cairan tersusun atas aquabidest, fruktosa, gliserol, asam sitrat, buffer, fosfolipid, streptomycine, lincomycine 15 mg, tylocine 5 mg, gentamycine 25 mg (Susilawati 2011).
Kuning Telur
Kuning telur umumnya ditambahkan ke dalam bahan pengencer semen karena mempunyai peran penting yaitu sebagai sumber energi dan agen protektif. Kuning telur mengandung lipoprotein dan lesitin yang dapat melapisi membran plasma sel, sehingga mampu mempertahankan dan melindungi integritas selubung lipoprotein spermatozoa dan melindunginya dari cekaman dingin selama proses pengolahan dan penyiapan semen pada suhu dingin (Aku et al. 2007).
7
lipoprotein (LDL). Komponen LDL ini mempunyai inti lipid (trigliserida non polar dan ester kolesterol) yang dikelilingi oleh lapisan fosfolipid dan protein dimana bagian ujung polarnya kontak dengan aquos phase (Moussa et al. 2002). Botham dan Mayes (2009) menyatakan bahwa low density lipoprotein (LDL) tersusun atas 79 % lipid (dengan komponen utama kolesterol) dan 21 % protein, protein utama yang membentuk LDL adalah Apo-B (Apolipoprotein-B). Di dalam lipoprotein terdapat empat kelas utama lipid terdiri dari 16% triasilgliserol, 30% fosfolipid, 14 kolesterol, 36 ester kolesteril serta 4% asam lemak rantai panjang teresterifikasi (asam lemak bebas). Komposisi fosfolipid kuning telur menurut Juneja et al. (1994) dan Dong et al. (2006) tersaji pada tabel 1.
Komposisi membran spermatozoa berhubungan dengan tingkat kerentanan spermatozoa terhadap cekaman dingin, terutama kandungan lipid. Spermatozoa dari spesies yang mempunyai rasio asam lemak tak jenuh : asam lemak jenuh yang tinggi fosfolipid membran cenderung lebih sensitif terhadap cekaman dingin. Kerentanan terhadap cekaman dingin juga berhubungan dengan rasio kolesterol : fosfolipid. Semakin rendahnya rasionya, maka semakin rentan (Feradis 1999)
Tabel 1 Komposisi fosfolipid kuning telur
No Komposisi Kuning Telur Jumlah (%)
(Juneja et al. 1994) (Dong et al. 2006)
1 Fosfatidil kolin (lesitin) 80.80% 77%
2 Fosfatidil etanolamin 11.70% 18%
3 Glikolipid - -
4 Fosfolipid lainnya - -
5 Trigliserida - -
6 Lisofosfatidil kolin 1.90% -
7 Sphingomyelin 1.90% 3%
8 Lemak netral 3.70% -
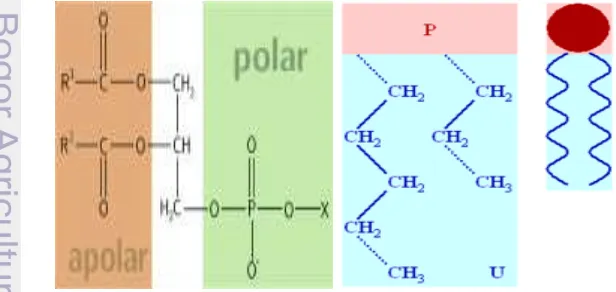
Molekul fosfolipid dapat dipandang terdiri dari dua bagian, yaitu kepala dan ekor (Gambar 1). Bagian kepala memiliki muatan positif dan negatif serta bagian ekor tanpa muatan. Bagian kepala karena bermuatan bersifat hidrofilik atau larut dalam air, sedangkan bagian ekor bersifat hidrofobik atau tidak larut dalam air. Fosfolipid digolongkan sebagai lipid amfipatik.
8
Fosfolipid yang terdapat dalam kuning telur dapat menjaga spermatozoa dari cekaman dingin, tetapi aksi protektif lipid ini belum jelas. Beberapa penjelasan yaitu: pertama, fusi butiran fosfolipid dengan membran spermatozoa atau interpolasi/penyisipan fosfolipid ke dalam membran sehingga merubah rasio asam lemak tak jenuh ganda : asam lemak jenuh pada membran sel; kedua, struktur lipid eksogen dapat mengekstrak kolesterol dari membran sel, dengan demikian merubah rasio kolesterol terhadap fosfolipid pada membran sel; ketiga, struktur fosfolipid dapat berikatan secara sedehana dengan membran sel, menyebabkan pengaturan kembali komponen membran (unsur pokok) (Feradis 1999).
Karbohidrat
Karbohidrat merupakan sumber energi bagi spermatozoa. Karbohidrat yang ditambahkan ke dalam pengencer semen memiliki beberapa fungsi yakni: menyediakan sumber energi yang mendukung motilitas spermatozoa selama inkubasi, mempertahankan tekanan osmotik cairan dan bertindak sebagai krioprotektan. Kemampuan jenis karbohidrat dalam melindungi sel spermatozoa berbeda tergantung pada suhu penyimpanan semen, berat molekul dari jenis karbohidrat dan tipe dari penyangga yang digunakan dalam pengencer (Siswanto 2006). Beberapa yang biasa ditambahkan adalah monosakarida (glukosa dan fruktosa), disakarida (laktosa, sukrosa, dan trehalosa) dan oligosakarida (rafinosa). Menurut Molinia et al. (1994) yang dikutip dalam Yildiz et al. (2000) jenis karbohidrat monosakarida yang ditambahkan dalam pengencer tis lebih cocok dibandingkan dengan disakarida dalam mempertahankan motilitas spermatozoa semen cair domba. Trisakarida tidak efektif dibandingkan dengan monosakarida dan disakarida dalam mempertahankan motilitas semen cair maupun motilitas pasca thawing spermatozoa sapi. Meskipun disakarida khususnya trehalosa, sukrosa dan maltosa dapat menurunkan kematian spermatozoa dan atau menurunkan kerusakan rata-rata akrosom akan tetapi monosakarida (galaktosa dan glukosa) lebih tinggi dalam mempertahankan motilitas sperma, viabilitas dan intak akrosom rata-rata dalam waktu yang lebih lama.
9
Gambar 2 Struktur Kimia Fruktosa
Ponglowhapan et al. (2004) melaporkan bahwa penggunaan glukosa 70 mM yang ditambahkan ke dalam pengencer tris kuning telur pada proses preservasi semen kucing mampu mempertahankan motilitas 59.10%, sedangkan jika menggunakan fruktosa 70 mM mampu mempertahankan motilitas 60.90% setelah disimpan selama 10 hari pada suhu 5oC.
Sodium Dodecyl Sulphate (SDS) sebagai Surfaktan Anionik
Surfaktan atau surface active agent merupakan suatu molekul amphipatic atau amphiphilic yang mengandung gugus hidrofilik dan hidrofobik dalam satu molekul yang sama (Gambar 3). Aktifitas surfaktan diperoleh karena sifat ganda dari molekulnya. Molekul surfaktan memiliki bagian polar yang suka akan air (hidrofilik) dan bagian non polar yang suka akan minyak/lemak (hidrofobik). Bagian polar molekul surfaktan dapat bermuatan positif, negatif atau netral. Sifat rangkap ini yang menyebabkan surfaktan dapat diadsorbsi pada antar muka udara-air, minyak-air dan zat padat-udara-air, membentuk lapisan tunggal dimana gugus hidrofilik berada pada fase air dan rantai hidrokarbon ke udara, dalam kontak dengan zat padat ataupun terendam dalam fase minyak. Umumnya bagian non polar (hidrofobik) adalah merupakan rantai alkil yang panjang ”ekor”, sementara bagian yang polar (hidrofilik) mengandung gugus hidroksil dan nampak sebagai
“kepala” surfaktan. Secara umum kegunaan surfaktan adalah untuk menurunkan
tegangan permukaan, tegangan antarmuka, meningkatkan kestabilan partikel yang terdispersi dan mengontrol jenis formasi emulsi, yaitu misalnya oil in water atau water in oil (Buana 2013).
10
Apabila surfaktan terlarut dalam suatu pelarut, adanya bagian liofobik di bagian dalam pelarut tersebut menyebabkan terjadinya distorsi struktur cairan pelarut tersebut, yaitu menaikkan energi bebas dari sistem tersebut. Di dalam larutan air surfaktan distorsi air disebabkan oleh bagian hidrofilik surfaktan, dan menghasilkan kenaikan energi bebas sistem. Hal ini berarti kerja yang dibutuhkan untuk membawa molekul surfaktan ke permukaan lebih kecil dari pada kerja yang dibutuhkan untuk membawa molekul air ke permukaan. Hal inilah yang menyebabkan senyawa surfaktan pada suatu sistem cairan cenderung terkonsentrasi pada permukaan. Karena kerja yang diperlukan untuk membawa molekul surfaktan ke permukaan lebih kecil, berarti adanya surfaktan menurunkan kerja yang diperlukan untuk membawa unit luas permukaan (energi bebas permukaan atau tegangan permukaan). Adanya gugus hidrofobik mencegah keluarnya surfaktan secara sempurna dari pelarut sebagai fasa terpisah (Salager 2002).
Surfaktan dibagi menjadi empat bagian penting dan digunakan secara meluas pada hampir semua sektor industri modern. Jenis-jenis surfaktan tersebut adalah surfaktan anionik, surfaktan kationik, surfaktan nonionik dan surfaktan amfoterik (Porter 2000 diacu dalam Buana 2013).
a. Surfaktan anionik adalah senyawa yang bermuatan negatif dalam bagian aktif permukaan (surface-active) atau pusat hidrofobiknya (misalnya RCOO-Na, R adalah fatty hydrophobe).
b. Surfaktan kationik adalah senyawa yang bermuatan positif pada bagian aktif permukaan (surface-active) atau gugus antar muka hidrofobiknya (hydrophobic surface-active).
c. Surfaktan nonionik adalah surfaktan yang tidak bermuatan atau tidak terjadi ionisasi molekul.
d. Surfaktan amfoterik adalah surfaktan yang mengandung gugus anionik dan kationik, dimana muatannya bergantung kepada pH, pada pH tinggi dapat menunjukkan sifat anionik dan pada pH rendah dapat menunjukkan sifat kationik.
Sodium dodecyl sulphate (SDS atau NaDS) atau Sodium lauryl sulphate (NaC12H25SO4) adalah surfaktan anionik biasanya digunakan dalam produk industri seperti produk pembersih lantai, sabun pencuci mobil, dan beberapa kebutuhan rumah tangga seperti sabun, pasta gigi, shampo, dan lain-lain (Buana 2013). Molekul SDS terdapat dalam bentuk serbuk putih yang mempunyai berat molekul 288.38 g mol−1 (Tabel 2). Molekul ini mempunyai bagian hidrofobik yang mengandung 12 atom karbon dan yang mengikat gugus sulfat yang menjadikannya sebagai senyawa ampifilik (Gambar 4). Struktur senyawa ini adalah:
11
Tabel 2 Sifat fisik Sodium Dodecyl Sulphate (SDS) Rumus molekul NaC12H25SO4
Sifat Fisik Serbuk putih Berat Molekul 288.38 g mol−1 Massa Jenis 1.01 g/cm³ Titik Leleh 204-207 °C Kelarutan dalam air 150 (g/l)
pH 9 - 10 (1% Aq.Sol)
Sumber: Salager (2002) Sodium dodecyl sulphate (SDS), yang diperoleh dari proses sulfasi lauryl alkohol dan reaksi netralisasi dengan natrium karbonat, adalah surfaktan yang bersifat ampifilik karena memiliki rantai C12 (lipofilik) dan gugus sulfat (hidrofilik). Dengan adanya dua gugus fungsi dalam satu molekul, SDS sangat bermanfaat sebagai pembersih, deterjen, dan pendispersi yang baik. SDS juga digunakan sebagai suatu agen pembasah di dalam produk tekstil, pembuatan sabun, pengemulsi kosmetika, dan pasta gigi. Selain banyak kegunaannya di bidang industri, penggunaan SDS ini dilaporkan juga bermanfaat dalam media penyimpanan semen terkait fungsinya yang mampu larut di dalam larutan lemak-air (Annakul et al. 2011). Pemberian SDS ke dalam media pengencer semen yang mengandung kuning telur dapat melarutkan dan meningkatkan dispersi dari molekul kuning telur sehingga kontak antara fosfolipid kuning telur dengan membran spermatozoa optimal (El-Kon et al. 2010).
Sodium Dodecyl Sulphate (SDS) adalah detergen yang merupakan bahan dasar dari Equex STM Paste. Penambahan Equex STM Paste pada pengencer semen dilaporkan efektif untuk melindungi motilitas spermatozoa, integritas membran plasma dan akrosom dan mempertahankan longivitas spermatozoa anjing setelah thawing (Pena et al. 2003; Alhaider et al. 2006). Mekanisme Equex STM Paste dalam bahan pengencer adalah untuk melarutkan dan meningkatkan dispersi dari butiran kuning telur dalam pengencer sehingga meningkatkan kontak antara kuning telur dan membran sel spermatozoa (Tsutsui et al. 2000). Senyawa tersebut telah berhasil digunakan dalam pengencer semen untuk mempertahankan motilitas spermatozoa dan integritas akrosom semen dari berbagai jenis, yaitu rusa (Cheng et al. 2004), anjing (Ponglowhapan dan Chatdarong 2008) dan pada kambing (El-Kon et al. 2010). Menurut Ponglowhapan dan Chatdarong (2008) Equex STM Paste meningkatkan kelangsungan hidup spermatozoa pasca-thawing dengan cara menstabilkan membran sel, untuk melindungi spermatozoa selama proses pembekuan dan thawing
Dewit et al. (2000) menemukan bahwa integritas spermatozoa tikus secara signifikan berkurang ketika SDS ditambahkan lebih dari 0.05% ke dalam pengencer extender. Ketika SDS digunakan pada konsentrasi tinggi dalam pengencer, molekul SDS meningkat dan dapat mengikat secara langsung ke membrane spermatozoa dengan hasil yang menghancurkan (Julian et al. 2006).
12
pada konsentrasi 0.05% dihasilkan motilitas individu, integritas akrosom, viabilitas dan fertilitas terbaik.
Mekanisme SDS dalam meningkatkan kualitas semen belum jelas. Hal ini dikarenakan kerja dari SDS tersebut secara tidak langsung yaitu tidak bekerja langsung terhadap spermatozoa, namun akan bekerja secara optimal jika terdapat kuning telur di dalam media pengencer semen. Efek perlindungan dari SDS ini dikarenakan mempunyai dua gugus di dalam satu molekul yaitu gugus hidrofilik dan hidrofobik (Buana 2013). Mengingat SDS merupakan surfaktan anionik yang mempunyai bagian hidrofilik (kepala) bermuatan negatif, sehingga akan dengan mudah bagian hidrofilik ini mengikat fosfolipid kuning telur yang bermuatan ion dan mudah juga berikatan dengan air yang terkandung dalam media pengencer semen. Sedangkan bagian hidrofobik dari SDS akan dengan mudah berikatan dengan lipid. Dengan demikian kehadiran SDS dalam pengencer semen, membantu melarutkan dan mendispersikan lipoprotein molekul kuning telur dalam pengencer semen, sehingga kontak antara kuning telur dengan membran spermatozoa lebih optimal dan meningkatkan kualitas semen.
Gliserol sebagai Krioprotektan
Krioprotektan adalah zat kimia non elektrolit yang berfungsi mereduksi pengaruh letal proses pemaparan kriopreservasi sel diantaranya baik yang berupa efek larutan maupun pembentukan kristal es ekstra maupun intraseluler sehingga dapat menjaga viabilitas sel setelah kriopreservasi (Purdy 2006). Fungsi krioprotektan adalah mencegah terbentuknya kristal-kristal es akibat dehidrasi sel yang berlebihan dari dalam sel dan menstabilkan membran plasma sel sehingga dapat melindungi kerusakan fisik maupun fungsional spermatozoa selama proses pembekuan dan memodifikasi struktur kristal sehingga tidak merusak organel-organel sel (Ariantie et al. 2013).
Krioprotektan gliserol (C3H5(OH)3) merupakan jenis krioprotektan intraseluler diamana mempunyai sifat yang larut dalam lemak, sehingga dapat langsung masuk ke dalam sel menembus membran plasma dengan keuntungan sebagai berikut: akan menggantikan air yang keluar dari dalam sel pada saat proses pembekuan berlangsung, sehingga konsentrasi elektrolit intra dan ekstraseluler tetapn terjaga; menurunkan titik beku larutan, sehingga memberikan kesempatan kepada sel mengeluarkan air dan memperpanjang aklimatisasi sel terhadap perubahan suhu yang drastis sehingga memperkecil jumlah air yang membeku intraseluler; mengubah secara fisik kristal-kristal es yang terbentuk menjadi lebih lembut, dan juga ikut melindungi membran plasma sel (Supriatna dan Pasaribu 1992).
13
Beberapa penelitian melaporkan bahwa kriopreservasi spermatozoa telah berhasil dilakukan dengan konsentrasi gliserol berkisar 3-9% (Leboeuf et al. 2000; Ariantie et al. 2013). Penambahan gliserol ke dalam pengencer dapat mengurangi tingkat kerusakan akibat pembekuan. Gliserol merupakan bahan osmotik aktif yang menyebabkan penambahan secara temporer dikarenakan perubahan volume sel dan berkurangnya kadar air di dalam sel. Manfaat utama dari gliserol adalah secara intraseluler memberikan efek langsung terhadap membran plasma. Gliserol mengubah sifat koligatif air untuk menurunkan titik beku, sehingga memberikan waktu yang lebih lama bagi air untuk keluar sel dari sebelum pembekuan dan pembekuan kristal es yang dapat merusak organel intraseluler (Leboeuf et al. 2000).
Antibiotik
Penambahan antibiotik ke dalam bahan pengencer umum dilakukan hal ini dimaksudkan untuk mengurangi atau mengendalikan pertumbuhan mikroba. Penggunaan antibiotik ini sangat penting untuk mencegah penyebaran penyakit reproduksi dan meningkatkan efisiensi reproduksi. Komponen bahan pengencer seperti kuning telur dapat meningkatkan pertumbuhan mikroba, sehingga diperlukan adanya antibiotik dalam bahan pengencer semen.
Antibiotik perlu ditambahkan pada pengencer saat komponen bahan pengencer dan semen pada temperatur 15-16 oC yang mendorong pertumbuhan bakteri gram negatif seperti Escherichia coli dan Salmonella. Kontaminasi bakteri terutama menyebabkan menurunnya motilitas, aglutinasi, perubahan akrosom, dan penurunan pH (Althouse et al. 2004). Dosis antibiotik yang dianjurkan untuk semen kambing adalah berkisar antara 500-1000 IU penisilin dan 0.5-1 mg streptomysin (Ariantie et al. 2014).
Prinsip-Prinsip Pembekuan Semen
Prinsip yang terpenting dari pembekuan semen adalah pengeluaran air dari dalam sel spermatozoa (dehidrasi) sebelum membeku secara intraseluler. Bila tidak terjadi dehidrasi akan terbentuk kristal-kristal es yang besar di dalam sel yang dapat merusak sel dengan hebat, dan bila terjadi dehidrasi yang berlebihan maka sel akan mengalami kekeringan sehingga akan merusak pada sel dan bersifat letal. Oleh karena itu yang harus diperhatikan dalam pembekuan semen adalah perpindahan air keluar masuk membran, baik dehidrasi sebelum deep freezing maupun rehidrasi pasca thawing (Supriatna dan Pasaribu 1992).
Faktor-Faktor Penyebab Kerusakan Sel Spermatozoa Selama Kriopreservasi
14
ekstraseluler, dan (3) perubahan fisik-kimiawi diantaranya presipitasi, denaturasi, koagulasi dari protein, disosiasi ion dan kehilangan sifat-sifat absorpsi atau sifat pengikatan air (Supriatna dan Pasaribu 1992).
Pembentukan Kristal-Kristal Es
Pembentukan kristal-kristal es selama proses pembekuan semen menyebabkan terjadinya penumpukan elektrolit di dalam sel spermatozoa. Elektrolit yang menumpuk ini akan merusak dinding sel sehingga pada waktu thawing permeabilitas membran akan berubah dan sel akan mati. Pembentukan kristal-kristal es kemungkinan berkaitan dengan perubahan tekanan osmotik dalam fraksi titik beku (Watson 2000).
Berdasarkan adanya pembentukan kristal es di dalam sel, maka kecepatan pembekuan (cooling rate) dibedakan atas pembekuan lambat dan pembekuan cepat. Prinsip utama dari cooling rate adalah kecepatan optimal yang dapat memberikan kesempatan air keluar dari dalam sel secara kontinyu bertahap sebagai respon sel terhadap kenaikan konsentrasi larutan ekstraseluler yang semakin tinggi di antara kristal-kristal es yang terbentuk (Supriatna dan Pasaribu 1992). Pada pembekuan lambat, kristal-kristal es hanya terbentuk hanya di luar sel dan akan meningkatkan tekanan osmotik sehingga air akan keluar dari sel dan menambah pembentukan kristal-kristal es di dalam sel. Pada pembekuan cepat, kristal-kristal es terbentuk tidak hanya di luar sel tetapi juuga di dalam sel. Kerusakan sel spermatozoa pada pembekuan cepat diakibatkan adanya tekanan mekanik dari kristal-kristal es yang terbentuk dalam sel dan denaturasi (Watson 2000).
Efek yang ditimbulkan pada spermatozoa akibat pembentukan kristal-kristal es adalah penurunan motilitas, viabilitas spermatozoa, peningkatan pengeluaran enzim-enzim intraseluler ke dalam ekstraseluler, dan kerusakan pada organel-organel sel, seperti lisosom dan mitokondria. Jika lisosom pecah akan mengeluarkan asam hidrolase sehingga akan mencerna bagian sel yang lain, sedangkan mitokondria rusak menyebabkan rantai oksida terputus. Organel mitokondria mempunyai peranan sebagai sumber energi yang akan mengertak mikrotubuli sehingga terjadi pergesekan diantara mikrotubuli dan akibatnya spermatozoa dapat bergerak progresif (Siswanto 2006).
Cold Shock
Cold shock atau cekaman dingin dapat terjadi karena adanya penurunan temperatur secara mendadak dari temperatur tubuh ke temperatur rendah (di bawah 0 oC) sehingga akan merubah struktur susunan membran dari konfigurasi normal menjadi konfigurasi hexagonal. Perubahan struktur membran ini akan berpengaruh terhadap motilitas, viabilitas, dan membran plasma utuh spermatozoa. Fenomena cekaman dingin kemungkinan berkaitan dengan fase transisi dari membran lipid yang menyebabkan terjadinya fase pemisahan dan penurunan sifat-sifat permeabilitas secara selektif dari membran biologik sel hidup (Watson 2000).
15
keusakan sel akibat kejutan dingin, yaitu kerusakan langsung dan kerusakan laten (Gazali dan Tambing 2002). Kerusakan langsung akan mempengaruhi struktur dan fungsi seluler dari spermatozoa, sedangkan kerusakan laten sulit untuk diamati dan baru terlihat setelah proses pencairan kembali.
Osmotic Shock
Osmotic shock atau cekaman osmotik ini terjadi apabila tekanan osmotik di dalam sel dan di luar sel tidak isotonik. Apabila spermatozoa dipaparkan dalam larutan yang hipertonik maupun hipotonik maka akan timbul gejala cekaman osmotik pada spermatozoa. Gejala cekaman osmotik ini mempunyai peranan sangat penting terhadap kerusakan membran sel spermatozoa selama proses pembekuan semen. Tanda-tanda adanya cekaman osmotik adalah peningkatan kejadian spermatozoa dengan ekor melingkar, kerusakan pada organel-organel intraseluler sehingga dapat menyebabkan penurunan motilitas, viabilitas, dan integritas membran plasma spermatozoa (Tambing et al. 2003).
Radikal Bebas
Radikal bebas atau Reactive Oxygen Species (ROS) adalah suatu senyawa atau molekul oksidan yang sangat reaktif dengan derajat kekuatan yang berbeda-beda karena memiliki satu atau lebih elektron yang tidak berpasangan dalam orbital luarnya, sehingga dapat bereaksi dengan molekul sel dengan cara mengikat elektron dari molekul sel tersebut, yang mengakibatkan reaksi berantai yang menghasilkan radikal bebas. Dalam konsentrasi normal ROS diperlukan sebagai mediator penting terhadap fungsi spermatozoa dan terlibat dalam induksi hiperaktivasi, kapasitasi dan reaksi akrosom serta fusi spermatozoa dan dengan sel telur namun bila produksi ROS berlebih dapat menyebabkan kerusakan asam lemak khususnya asam lemak tak jenuh yang merupakan komponen penting dari fosfolipid penyusun membran spermatozoa (Sanocka dan Kurpisz 2004)
Radikal-radikal bebas antara lain dapat berupa superoksida (O2-), hidroksil (OH-) dan peroksil (ROO-). Radikal bebas bersifat sangat reaktif dan bila bereaksi dengan asam lemak tak jenuh akan membentuk peroksidasi lipid (Agarwal et al. 2008). Peroksidasi lipid disebabkan oleh kandungan asam lemak tak jenuh dalam fosfolipid membran plasma yang sangat tinggi dan sangat rentan terhadap serangan radikal bebas sehingga akan merangsang terjadinya reaksi autokatalitik dan akan merusak ikatan ganda membran plasma tersebut (Sanocka dan Kurpisz 2004). Efek peroksidasi pada spermatozoa beberapa mamalia berupa hilangnya motilitas secara permanen, penghambatan fruktolisis dan respirasi, pengikatan enzim intraseluler dan kerusakan struktur membran plasma, terutama pada bagian akrosom sehingga juga menurunkan fertilitasnya (Anghel et al. 2009).
16
Equilibrasi, Pembekuan, dan Thawing
Equilibrasi adalah periode adaptasi spermatozoa untuk mengurangi metabolisme dengan cara menempatkan straw yang berisi semen pada suhu 5 oC selama empat jam. Leboeuf et al. (2000) menyatakan bahwa equilibrasi dilakukan selama 1.5-4 jam pada temperatur 4-5 oC. Secara tradisional, ekulibrasi dianggap sebagai total waktu spermatozoa tetap kontak dengan gliserol sebelum pembekuan. Selama itu terjadi penetrasi gliserol ke dalam spermatozoa untuk menciptakan keseimbangan konsentrasi intraseluler dan ekstraseluler. Equilibrasi tidak saja untuk keseimbangan konsentrasi gliserol, tetapi juga untuk komponen pengencer yang lain yang aktif untuk keseimbangan osmotik (Salamon dan Maxwell 1995).
Pembekuan semen dilakukan dengan menempatkan straw pada uap nitrogen cair dan kecepatan pendinginan diatur dengan mengontrol jarak straw dengan permukaan nitrogen cair. Straw di letakkan dengan jarak 5 cm di atas permukaan N2 cair selama 10 menit dengan menggunakan box styrofoam. Semen beku disimpan pada suhu -196oC pada kontainer N2 cair sampai dilakukan evaluasi (Purdy 2006).
17
3 MATERI DAN METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian dilakukan di Koperasi Kambing Perah, Cikarawang, Bogor dan Laboratorium Unit Rehabilitasi Reproduksi (URR), Bagian Reproduksi dan Kebidanan, Fakultas Kedokteran Hewan, Institut Pertanian Bogor, Penelitian ini dilakukan pada bulan November 2013 – Mei 2014.
Materi Penelitian
Sumber Semen
Sebagai sumber semen, digunakan tiga ekor kambing Peranakan Ettawa (PE) jantan dewasa kelamin dengan umur berkisar antara 4-5 tahun dengan bobot badan 50-60 kg yang ditempatkan dalam kandang individu yang dilengkapi dengan tempat pakan dan minum. Pakan yang diberikan berupa hijauan rumput gajah segar 20% per bobot badan dan konsentrat 10% dari pakan rumput, serta air minum diberikan secara ad libitum.
Tahap Pernelitian
Penelitian ini dilaksanakan dalam tiga tahap, yaitu :
1. Menentukan konsentrasi SDS terbaik pada pengencer Tris KT
2. Membandingkan kualitas semen cair terbaik menggunakan TKT dan SKT yang ditambahkan SDS
3. Membandingkan kualitas semen beku terbaik menggunakan TKT, SKT dan Andromed
Tahap I. Menentukan Konsentrasi SDS Terbaik pada Pengencer Tris KT
a. Penyiapan bahan pengencer
Pengencer yang digunakan pada tahap ini adalah pengencer Tris kuning telur mengadopsi buffer Tris (Ariantie et al. 2014) dapat dilihat (Tabel 3) dengan konsentrasi SDS yang akan digunakan adalah 0, 0.025, 0.05 dan 0.075 (Tabel 4).
Tabel 3 Komposisi buffer tris
Bahan Jumlah
18
Tabel 4 Komposisi bahan pengencer semen cair
b. Koleksi dan Evaluasi Semen
Semen dikoleksi satu minggu dua kali masing-masing satu ejakulat, menggunakan vagina buatan (Arifiantini 2012). Semen yang diperoleh dievaluasi secara makroskopis dan mikroskopis. Evaluasi secara makroskopis meliputi volume, warna, konsistensi, dan pH, sedangkan evaluasi mikroskopis yang dilakukan adalah gerakan massa, gerakan individu, konsentrasi, spermatozoa hidup, morfologi, dan keutuhan membran plasma (MPU).
Volume semen segar diukur langsung dengan menggunakan pipet ukur. Derajat keasamaan (pH) semen segar diukur menggunakan pH special indikator paper (Merck scala 6.4-8). Warna diidentifikasi secara visual, konsistensi atau kekentalan semen diuji dengan cara memiringkan dan mengembalikan tabung pada posisi semula dengan kriteria encer, sedang, kental dan sangat kental.
Penilaian mikroskopis dilakukan menggunakan mikroskop binokuler (Olympus CH21). Penilaian gerakan massa dibedakan berdasarkan gelombang gerakan spermatozoa secara massal cepat berpindah dari satu posisi ke posisi lainnya, dengan klasifikasi dengan sangat baik (+++), baik (++), cukup (+) dan buruk (0). Persentase motilitas spermatozoa dibedakan dengan melihat perbandingan gerakan spermatozoa yang progresif maju ke depan dengan gerakan spermatozoa yang tidak progresif seperti gerakan mundur/reverse, berputar/circuler, bergerak ditempat/vibrator, dan tidak bergerak/mati. Motilitas diklasifikasikan dengan sangat baik (≥ 90%), baik (70-85%), cukup (40-65%).
Pemeriksaan konsentrasi dihitung dengan menggunakan kotak hitung neubauer dengan pengenceran 500 kali menggunakan formolsaline. Sedangkan pemeriksaan persentase spermatozoa hidup dengan membuat preparat ulasan dengan pewarna eosin nigrosin, dihitung dari 10 lapang pandang yang berbeda atau 200 spermatozoa. Spermatozoa yang hidup akan tidak menyerap warna dan yang mati menyerap warna pada bagian kepala.
Morfologi spermatozoa menggunakan pewarna carbolfuchsin (Williams) mengadopsi teknik Arifiantini (2012). Morfologi diklasifikasikan berdasarkan kelainannya pada bagian kepala (abnormalitas primer), leher dan ekor (abnormalitas sekunder). Spermatozoa yang diamati minimal sebanyak 200 sel atau 10 lapang pandang. Pemeriksaan keutuhan membran plasma spermatozoa menggunakan larutan hypoosmotic swelling test (HOS-Test). Larutan hipoosmotik yang dikembangkan oleh Fonseca et al. (2005)
19
sebanyak 1 ml larutan hipoosmotik (7.35 g Na sitrat, 13.52 g fruktosa dilarutkan dalam 1000 ml aquades) ditambah dengan 5 µl spermatozoa, kemudian diinkubasi pada suhu 37 oC selama 30 menit. Spermatozoa dengan membran plasma utuh ditandai dengan ekor spermatozoa yang melingkar, karena membran plasma spermatozoa masih berfungsi dengan baik dalam menyerap air pada lingkungan yang bersifat hipotonik (Fonseca et al. 2005). Spermatozoa yang membrannya rusak ditandai dengan ekor yang lurus. Spermatozoa yang diamati sebanyak 200 sel atau 10 lapang pandang.
Hanya semen dengan motilitas lebih dari 70%, konsentrasi lebih dari 2500 juta, dan abnormalitas kurang dari 15% digunakan dalam penelitian ini. Penelitian dilakukan dalam beberapa tahap.
c. Pengolahan Semen
Semen yang memenuhi kualitas dibagi menjadi 4 tabung masing-masing diencerkan dengan TKT SDS 0 (TKT0), TKT SDS 0.025 (TKT0.025), TKT SDS 0.050 (TKT0.050), TKT SDS 0.075 (TKT0.075), dengan konsentrasi 50 juta dalam 0.2 ml. Semen cair selanjutnya disimpan dalam kulkas (4 oC), dan diamati setiap 12 jam sekali. Pengamatan dilakukan terhadap motilitas dan viabilitas.
Jumlah pengencer yang digunakan dihitung menggunakan rumus sebagai berikut:
Keterangan:
V = Volume semen M = Motilitas semen K = Konsentrasi semen
Tahap II. Membandingkan Kualitas Semen Cair Terbaik Menggunakan TKT dan SKT yang Ditambahkan SDS
a. Penyiapan bahan Pengencer
Pengencer yang digunakan pada tahap ini adalah Pengencer Tris kuning telur sama dengan tahap I dan Pengencer Sitrat Kuning Telur. Komposisi Buffer sitrat (Tabel 5) mengadopsi Arifiantini dan Purwantara (2010).
Tabel 5 Komposisi buffer sitrat
Bahan Jumlah
20
Tabel 6 Komposisi bahan pengencer tris dan sitrat yang disuplementasi SDS
b. Pengolahan Semen
Koleksi dan evaluasi semen sama dengan yang dilakukan pada tahap I. Semen yang diperoleh masing-masing dibagi ke dalam 4 tabung dan diencerkan masing-masing dengan TKT0, TKT0.05, SKT0 atau SKT0.05, dengan konsentrasi sama dengan Tahap I. Penyimpanan dan pengamatan semen sama seperti yang dilakukan pada Tahap I.
Tahap III. Membandingkan Kualitas Semen Beku Menggunakan TKT, SKT dan Andromed
a. Penyiapan bahan pengencer semen beku
Bahan pengencer yang digunakan adalah sama dengan yang digunakan pada tahap II, yaitu menggunakan dua buah buffer dan satu pengencer Paten (Tabel 7).
Tabel 7 Komposisi bahan pengencer semen beku
Bahan Pengencer
21
bagian, masing-masing diencerkan menggunakan bahan pengencer sesuai perlakuan, dengan konsentrasi 2000 juta per mL atau 100 juta per 0.25 mL.
Jumlah pengencer yang digunakan dihitung dengan menggunakan persamaan sebagai berikut:
Setelah diencerkan semen dikemas dalam ministraw (0.25 mL), kemudian disusun dalam rak pembekuan dan diekuilibrasi pada suhu 4oC selama 4 Jam (Leboeuf et al. 2000). Setelah equilibrasi semen dibekukan 5-6 cm diatas uap nitrogen pada Styrofoam selama 10 menit, selanjutnya disimpan pada container nitrogen cair (-196oC) untuk evaluasi lebih lanjut.
c. Pengujian Semen
Untuk mempelajari penurunan kualitas selama proses pembekuan semen dievaluasi setiap tahap mulai semen segar, setelah diencerkan, setelah equilibrasi dan setelah pembekuan. Evaluasi dilakukan terhadap motilitas, viabilitas dan keutuhan membran plasma spermatozoa.
Rancangan Penelitian dan Analisis Data
22
4 HASIL DAN PEMBAHASAN
Kualitas Semen Segar
Salah satu tujuan pemeriksaan karakteristik semen segar kambing PE dilakukan untuk menentukan tingkat pengenceran yang akan digunakan. Hasil pemeriksaan memperlihatkan kualitas semen segar kambing PE yang diperoleh selama penelitian cukup baik dan memenuhi persyaratan untuk dibekukan (Tabel 8). Syarat semen segar yang akan dibekukan yaitu minimal persentase motilitas 70%, konsentrasi 2x109 sel/ml, gerakan massa ++/+++, persentase hidup minimal 80% dan morfologi spermatozoa abnormal kurang dari 15% (Tambing et al. 2000).
Pemeriksaan makroskopis menunjukkan volume semen adalah 1.2±0.11 ml, berwarna krem dengan konsistensi kental. Warna krem dengan konsistensi semen yang kental tersebut menunjukkan tinggi konsentrasi spermatozoa kambing. Secara mikroskopis menunjukkan motilitas yang dihasilkan cukup baik sebesar
77.78±0.02%, hasil ini sama dengan laporan Ariantie et al. (2013) sebesar 77.78±2.56% dan El-kon et al. (2010) sebesar 79.58±0.64%.Viabilitas spermatozoa semen segar sebesar 84.38±0.03% hampir sama dengan laporan Tambing et al. (2000) yaitu sebesar 83.43±4.92% dan lebih tinggi dibandingkan dengan Annakul et al. (2011) yaitu 79.96±10.13%.
Konsentrasi spermatozoa yang didapat adalah 3672.92±68.12x106/mL. Hasil ini sesuai dengan laporan Dorado et al. (2009; 2010) masing-masing sebesar 3690±80x106 dan 3720±100x106 spermatozoa/mL tetapi lebih tinggi daripada hasil El-kon et al. (2010) dan Tambing et al. (2000) yaitu 2718±32.60x106dan 2801.43±438.79x106 spermatozoa/mL.
Tabel 8 Karakteristik semen segar kambing PE pada tiga tahap penelitian Karakteristik
a. Motilitas progresif (%) 80.42±0.01 75.83±0.01 77.08±0,03 77.78±0.02 b. Scoring (Velosity) (1-5) 5 5 5 5
Spermatozoa hidup (%) 87.96±0.02 81.62±0.01 83.55±0,02 84.38±0.03 Konsentrasi Spermatozoa (106) 3620.83±76.38 3750±131.70 3647.92±116,15 3672.92±68.12 Morfologi Abnormal (%) 5.50±0.01 4.93±0 5.18±0,01 5.20±0
23
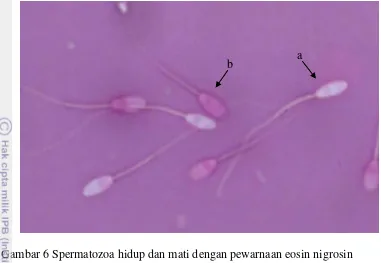
Gambar 6 Spermatozoa hidup dan mati dengan pewarnaan eosin nigrosin (a) spermatozoa hidup dan (b) spermatozoa mati
Viabilitas atau pengujian spermatozoa hidup menurut Graham (2001) mempunyai prinsip yang sama dengan pemeriksaan keutuhan membran plasma, yaitu berdasarkan pompa ion ke dalam dan ke luar sel spermatozoa. Spermatozoa yang mati mempunyai permeabilitas membran yang tinggi, sehingga akan menyerap warna yang dipaparkan. Sebaliknya, spermatozoa yang hidup tidak akan menyerap warna (Gambar 6). Pewarnaan semen yang dilakukan ini menggunakan pewarna eosin nigrosin untuk melihat rasio spermatozoa yang hidup dan mati.
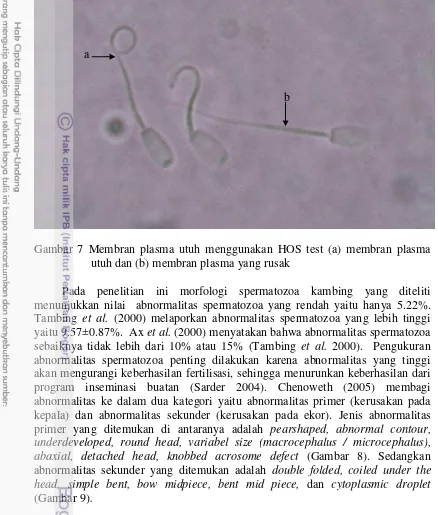
Pemeriksaan membran plasma utuh merupakan salah satu parameter yang penting dalam penentuan kualitas spermatozoa. Metabolisme berlangsung dengan baik jika membran plasma sel dalam keadaan utuh sehingga fertilitas spermatozoa dapat berlangsung dengan baik. Hasil pemeriksaan membran plasma utuh (MPU) yang didapatkan adalah 84.92%±0.02 %, nilai tersebut hampir sama dengan laporan Tambing et al. (2000) yaitu 81.45±4.45%. Pemeriksaan keutuhan membran plasma dilakukan menggunakan teknik metode osmotic resistance test (ORT) atau Hypoosmotic swelling (HOS) test (Fonseca et al. 2005). Spermatozoa yang memiliki membran plasma utuh ditandai ekor yang melingkar atau menggelembung, sedangkan yang rusak ditandai dengan ekor lurus (Gambar 7)
24
Gambar 7 Membran plasma utuh menggunakan HOS test (a) membran plasma utuh dan (b) membran plasma yang rusak
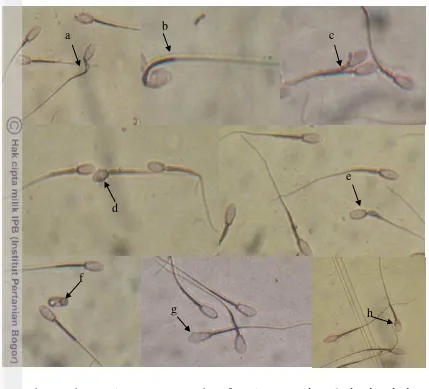
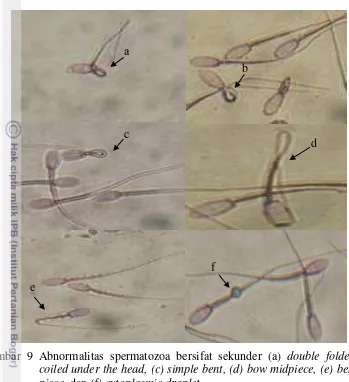
Pada penelitian ini morfologi spermatozoa kambing yang diteliti menunjukkan nilai abnormalitas spermatozoa yang rendah yaitu hanya 5.22%. Tambing et al. (2000) melaporkan abnormalitas spermatozoa yang lebih tinggi yaitu 9.57±0.87%. Ax et al. (2000) menyatakan bahwa abnormalitas spermatozoa sebaiknya tidak lebih dari 10% atau 15% (Tambing et al. 2000). Pengukuran abnormalitas spermatozoa penting dilakukan karena abnormalitas yang tinggi akan mengurangi keberhasilan fertilisasi, sehingga menurunkan keberhasilan dari program inseminasi buatan (Sarder 2004). Chenoweth (2005) membagi abnormalitas ke dalam dua kategori yaitu abnormalitas primer (kerusakan pada kepala) dan abnormalitas sekunder (kerusakan pada ekor). Jenis abnormalitas primer yang ditemukan di antaranya adalah pearshaped, abnormal contour, underdeveloped, round head, variabel size (macrocephalus / microcephalus), abaxial, detached head, knobbed acrosome defect (Gambar 8). Sedangkan abnormalitas sekunder yang ditemukan adalah double folded, coiled under the head, simple bent, bow midpiece, bent mid piece, dan cytoplasmic droplet (Gambar 9).
a a
25
Gambar 8 Abnormalitas spermatozoa bersifat primer (a) abaxial, (b) detached head, (c) double head, (d) round head (e) microcephalus, (f) undeveloped, (g) knobbed acrosome, (h) pearshaped
Menurut Barth dan Oko (1989) Kejadian abnormalitas morfologi spermatozoa disebabkan oleh beberapa faktor, antara lain penyakit, stres panas, musim, gangguan pematangan (spermatogenesis akhir), teknik koleksi, penanganan semen, ras hewan, kualitas hewan, manajemen pemeliharaan, frekuensi kontak lawan jenis dan faktor hormonal. Abnormalitas primer spermatozoa pada banyak kasus terjadi akibat gangguan termoregulasi dan hormonal di dalam testis yang disebabkan oleh lingkungan tidak cocok (Yudi et al. 2008). Spermatozoa dengan abnormalitas bagian kepala akan menghasilkan embrio berkualitas rendah dan mudah berdegenerasi, atau tidak mampu memfertilisasi ovum (Saacken 2008). Abnormalitas yang tinggi dapat mempengaruhi fertilitas. Morrel et al. (2008) melaporkan bahwa angka kebuntingan berkorelasi kuat dengan morfologi normal spermatozoa (r=0.79).
e
g h
f
d
b