AKTIVITAS ANTIBIOFILM EKSTRAK AIR DAUN MELINJO,
DAUN SINGKONG DAN DAUN PEPAYA TERHADAP BAKTERI
Pseudomonas aeruginosa
SECARA
IN VITRO
EKAJAYANTI KINING
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Aktivitas Antibiofilm Ekstrak Air Daun Melinjo, Daun Singkong, dan Daun Pepaya terhadap Bakteri Pseudomonas aeruginosa secara In Vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
EKAJAYANTI KINING. Aktivitas Antibiofilm Ekstrak Air Daun Melinjo, Daun Singkong, dan Daun Pepaya terhadap Bakteri Pseudomonas aeruginosa secara In Vitro Dibimbing oleh SYAMSUL FALAH dan NOVIK NURHIDAYAT.
P. aeruginosa merupakan pathogen oportunistik yang cenderung membentuk biofilm untuk mempertahankan kelangsungan hidupnya. Biofilm terbentuk sebagai hasil dari penempelan mikroorganisme pada berbagai permukaan dengan memproduksi polimer ekstraseluler (polisakarida dan protein). Biofilm menyebabkan masalah serius pada industri kimia, kesehatan dan farmasi. Penemuan terbaru menyatakan bahwa beberapa senyawa fenolik alam yang ditemukan pada beberapa tanaman memiliki efek terhadap pembentukan biofilm bakteri Gram negatif. Biofilm mampu menetralkan pengaruh buruk lingkungan seperti pH, tekanan dan suhu yang ekstrim.
Penelitian ini bertujuan untuk mengetahui potensi senyawa fitokimia yang terkandung dalam ekstrak air daun pepaya, daun singkong dan daun melinjo dalam penghambatan perlekatan, penghambatan pertumbuhan maupun degradasi biofilm dengan metode microtiter-plate. Uji ini termasuk pewarnaan dengan menggunakan Kristal violet kemudian dilarutkan menggunakan etanol absolut. Optical density (OD) dari larutan diukur menggunakan microplate reader
Hasil penelitian menunjukkan bahwa ekstrak daun papaya dan daun singkong secara kualitatif mengandung alkaloid, tanin, flavonoid dan steroid. Daun melinjo secara kulitatif mengandung alkaloid, tanin, saponin dan steroid. Ketiga ekstrak tersebut menunjukkan aktivitas antibakteri dan antibiofilm bakteri P. aeruginosa. Ekstrak yang paling baik dalam menghambat pencegahan perlekatan dan kemampuan degradasi adalah ekstrak daun papaya, sedangkan ekstrak melinjo merupakan ekstrak yang paling baik dalam menghambat pertumbuhan biofilm. Selanjutnya dilakukan optimasi antibiofilm. Tujuan dari optimasi ini adalah menentukan kondisi optimal untuk meningkatkan respon penghambatan dan pendegradasian biofilm. Variabel yang akan dioptimasi adalah konsentrasi ekstrak (A), suhu (B), dan waktu kontak (C). Variabel tersebut dioptimasi menggunakan Response Surface Methodology (RSM) dengan rancangan Central Composite Design (CCD). Kondisi optimal untuk penghambatan perlekatan sel berdasarkan RSM adalah ekstrak daun papaya pada konsentrasi 25%, suhu 37.5 °C dengan waktu kontak 45 menit. Kondisi optimal untuk penghambatan pertumbuhan adalah ekstrak daun melinjo pada konsentrasi 25%, suhu 50 °C dengan waktu kontak 3 hari kemudian kondisi optimal untuk degradasi biofilm adalah ekstrak daun papaya pada konsentrasi 25% (v/v), suhu 37.5 °C, waktu kontak 45 menit.
SUMMARY
EKAJAYANTI KINING. Antibiofilm Activity of Papaya, Cassava and Gnetum Leaf Water Extracts against Pseudomonas aeruginosa In Vitro. Supervised by SYAMSUL FALAH and NOVIK NURHIDAYAT
P. aeruginosa is opportunistic pathogen that form biofilm to maintain its survival. A biofilm is formed as a result of adhesion of microorganisms to various surfaces with the production of extracellular polymers (polysaccharides and proteins). Biofilms cause serious problems in the chemical, medical and pharmaceutical industries. Biofilm resists extreme ph, temperatures and pressure. Recent findings indicate that some natural phenolic compounds found in plants have an antibiofilm effect on biofilm formation by Gram-negative bacteria.
The research aimed to study the potential of papaya, cassava and gnetum leaf on biofilm inhibition and degradation using a microtiter-plate. This assay involved staining with crystal violet dye and then releasing the bound dye with ethanol absolute. The optical density (OD) of the solution was measured at 595 nm by using microplate reader.
The results showed that papaya and cassava leaf extract contained alkaloids, tannins, flavonoids and steroids, while gnetum leaf contained alkaloids, tannins, saponins and steroid. All of these extract showed antibacterial and antibiofilm activity againts P. aeruginosa. The best extract to inhibited of adhesion prevention was papaya leaf extracts, while the extracts of gnetum leaf was the best to inhibited the growth of biofilm. Further optimization of antibiofilm. The aims of this study was to select the optimal condition to improve biofilm inhibition and degradation. The variables involved in this study were concentration of the extract (A), temperature (B), and contact time (C). These variables would be optimazed by central composite design (CCD) matrix of response surface methodology (RSM). The optimal condition for inhibition of attachment obtained with response surface methodology were papaya leaf extract at concentrations of 25%, a temperature of 37.5 °C with a contact time of 45 minutes, while optimal condition for inhibition of the growth were gnetum leaf extract at concentration of 25%, temperature 50 ° C with a time of 3 days of contact, then optimal condition for degradation were papaya leaf extract at concentration of 25%, a temperature of 37.5 °C with contact time of 45 minutes.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
AKTIVITAS ANTIBIOFILM EKSTRAK AIR DAUN MELINJO
,DAUN SINGKONG, DAN DAUN PEPAYA TERHADAP BAKTERI
Pseudomonas aeruginosa
SECARA
IN VITRO
EKAJAYANTI KINING
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biokimia
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penulis dapat menyelesaikan tesis dengan judul
“Aktivitas Antibiofilm Ekstrak Air Daun Melinjo, Daun Singkong, dan Daun Pepaya terhadap Bakteri Pseudomonas aeruginosa secara In Vitro“. Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam menyelesaikan tesis ini, terutama kepada:
1. Dr Syamsul Falah, S.Hut, M.Si sebagai pembimbing utama dan Novik Nurhidayat, Ph.D sebagai pembimbing kedua dalam penelitian ini yang senantiasa memberikan arahan dan bmbingan, nasehat, saran motivasi, waktu konsultasi, serta solusi dari setiap permasalahan yang dihadapi penulis selama menyelesaikan tesis ini.
2. Prof Dr drh Maria Bintang, MS sebagai penguji tesis dan Dr Mega Safithri, S.Si, M.Si sebagai wakil Program Studi yang telah memberikan masukan dan saran pada saat ujian tesis
3. Prof. Dr. drh. Maria Bintang, MS sebagai ketua program studi Biokimia yang senantiasa memberikan motivasi dan arahan selama menyelesaikan tesis ini. 4. Kedua orang tua, serta adik-adik yang senantiasa mendoakan dan memberikan
semangat selama menyelesaikan tesis ini.
5. Keluarga besar mahasiswa pascasarjana program studi Biokiimia dan teman mahasiswa penelitian di Lab. Mikrobiolog LIPI atas kebersamaan dan dorongan semangat baik selama penelitian maupun penyusunan tesis ini.
6. Teman-teman dan semua pihak yang tidak bisa disebutkan satu persatu.
Penyusunan tesis ini tentunya tidak terlepas dari kekurangan. Penulis sangat mengharapkan adanya saran dan kritik yang bermanfaat. Semoga karya ilmiah ini membawa manfaat.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR GAMBAR viii
DAFTAR TABEL viii
DAFTAR LAMPIRAN viii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Hipotesis 3
Ruang Lingkup Penelitian 3
2 METODOLOGI 4
Waktu dan Tempat Penelitian 4
Alat 4
Bahan 4
Prosedur Penelitian 4
3 HASIL 9
Peremajaan Bakteri Uji 9
Senyawa Fitokimia 9
Aktivitas Antibakteri 9
Aktivitas Antibiofilm Ekstrak Daun Melinjo, Pepaya dan Singkong 10 Optimasi Penghambatan Perlekatan Sel Ekstrak Daun Pepaya 12 Optimasi Penghambatan Pertumbuhan Biofilm Ekstrak Daun Melinjo 13
Optimasi Degradasi Biofilm Ekstrak Daun Pepaya 15
Visualisasi dengan Scanning Electron Microscopy 17
4 PEMBAHASAN 18
Peremajaan Bakteri Uji 18
Senyawa Fitokimia 18
Aktivitas Antibakteri 19
Optimasi Agen Antibiofilm Ekstrak Terpilih 20
Penghambatan Perlekatan Sel Ekstrak Daun pepaya 21 Penghambatan Pertumbuhan Biofilm Ekstrak Daun melinjo 22
Degradasi Biofilm Ekstrak Daun pepaya 23
5 SIMPULAN DAN SARAN 25
Simpulan 25
Saran 25
DAFTAR PUSTAKA 26
LAMPIRAN 29
DAFTAR GAMBAR
1 P. aeruginosa pada media PIA dan hasil pewarnaan Gram 9 2 Efek ekstrak tanaman terhadap pencegahan perlekatan sel bakteri P.
aeruginosa 11
3 Efek ekstrak tanaman terhadap pencegahan pertumbuhan biofilm bakteri P.
aeruginosa 11
4 Efek ekstrak tanaman terhadap kemampuan degradasi biofilm bakteri P.
aeruginosa 11
5 Contour plot hubungan suhu dan waktu kontak terhadap respon
pencegahan perlekatan sel 13
6 Optimalisasi pencegahan perlekatan sel menggunakan response optimizer 13 7 Contour plot hubungan suhu dan waktu terhadap respon penghambatan
pertumbuhan biofilm 14
8 Optimalisasi penghambatan pertumbuhan menggunakan response
optimizer 14
9 Contour plot hubungan suhu dan waktu kontak terhadap respon
kemampuan degradasi biofilm 16
10 Optimalisasi kemampuan degradasi menggunakan response optimizer 16 11 Visualisasi menggunakan SEM kemampuan ekstrak papaya dalam
menghancurkan EPS biofilm P. aeruginosa 17
DAFTAR TABEL
1 Klasifikasi respon hambatan 6
2 Hasil uji kualitatif fitokimia 9
3 Diameter zona bening pertumbuhan bakteri Pseudomonas aeruginosa pada
inkubasi 24 jam 10
4 Estimasi koefisien regresi untuk pencegahan perlekatan sel 12 5 Estimasi koefisien regresi untuk penghambatan pertumbuhan biofilml 14 6 Estimasi koefisien regresi untuk kemampuan degradasi biofilm 15
DAFTAR LAMPIRAN
1 Diagram alir penelitian 31
2 Output Minitab 16 untuk Uji Potensi Ekstrak sebagai Anitibiofilm 32 3 Output Minitab 16 untuk Respon Surface Methodology 36
4 Jadwal penelitian 41
1
PENDAHULUAN
Latar Belakang
Pseudomonas aeruginosa merupakan patogen oportunistik, yaitu bakteri yang memulai infeksinya dengan memanfaatkan kerusakan pada mekanisme pertahanan inang (Mansouri et al. 2013). Bakteri P. aeruginosa termasuk bakteri Multi drug resistant yang sulit untuk dikendalikan karena bakteri ini membentuk biofilm tebal resisten terhadap antibiotik yang juga menjaga dari pertahanan kekebalan tubuh, menurunkan prognosis jangka panjang pasien terinfeksi.
Biofilm merupakan kumpulan dari sel-sel mikroba yang melekat secara irreversible pada suatu permukaan dan terbungkus dalam matriks Extracellular Polymeric Substances (EPS) yang dihasilkannya sendiri serta memperlihatkan adanya perubahan fenotip seperti perubahan tingkat pertumbuhan dari sel planktonik atau sel bebasnya (Donlan 2002). Biofilm P. aeruginosa yang telah matang dikelilingi oleh matriks eksopolisakarida, faktor pelekatan (adhesion) seperti flagel dan fimbrial, fimbrial non adhesin (Power dan Jennings, 2003). Kuorum penginderaan (QS) atau komunikasi sel-sel bakteri yang mengatur banyaknya produksi faktor virulensi termasuk pembentukan biofilm P. aeruginosa (Adonizio et al. 2008). Hal ini menjadi mikrolingkungan yang unik dimana mikroorganisme dalam biofilm berbeda secara struktural maupun fungsional dengan yang hidup bebas atau planktonik. Biofilm juga mampu menetralkan pengaruh buruk lingkungan seperti pH ekstrim, tipisnya kandungan oksigen serta tekanan dan suhu yang ekstrim. Sel-sel biofilm dapat saling memisahkan diri dan bergabung dengan sistem matriks lainnya. Tahap ini merupakan salah satu tahapan penting siklus hidup biofilm yang berkontribusi pada penyebaran biologis, kelangsungan hidup bakteri dan penularan penyakit. (Karatan dan Watnick. 2009). Oleh karena itu, sel-sel penyusun biofilm sulit untuk ditekan populasinya dibandingkan dengan bakteri non biofilm.
Saat ini upaya pencarian alternatif pengendalian bakteri biofilm yang lebih efektif, murah, aman, dan ramah lingkungan menjadi prioritas utama untuk menekan dampak negatif dari penggunaan antibiofilm berbahan dasar kimia sintetik. Pemanfaatan antibiofilm alami dengan memanfaatkan bahan-bahan tanaman yang mudah ditemukan di alam, mudah dibuat dan mudah diaplikasikan serta tidak meninggalkan residu kimia yang berbahaya menjadi salah satu pilihan.
2
yang dapat mencegah perlekatan sel, pertumbuhan dan dapat mendegradasi biofilm yang telah terbentuk.
Optimasi perlakuan perlu dilakukan untuk memaksimalkan respon. Optimasi dengan metode konvensional membutuhkan waktu yang lama dan relatif mahal. Metode konvensional dalam sekali percobaan, hanya satu variabel yang divariasikan sehingga variabel yang satu dengan variabel yang lain tidak diketahui dengan jelas. Tiap variabel diasumsikan independen satu sama lainnya sehingga perlu dilakukan banyak uji secara bertahap. Oleh karena itu, prosedur optimasi dengan jumlah percobaan yang banyak dapat dilakukan dengan mudah mengunakan response surface methodology (RSM) (Saravanakumar et al. 2010).
Response surface methodology merupakan suatu model untuk mempelajari faktor yang mempengaruhi respon secara bersamaan tanpa banyak percobaan yang dilakukan. Teknik optimasi dengan menggunakan RSM dilakukan untuk mendapatkan solusi terbaik dari kombinasi variabel seperti konsentrasi ekstrak, suhu, serta waktu kontak. Kelebihan teknik RSM ialah untuk meminimalkan waktu, tenaga dan biaya (Adinarayana dan Ellaiah. 2002).
Perumusan Masalah
Upaya pencarian alternatif pengendalian bakteri biofilm khususnya untuk bakteri P. aeruginosa sampai saat ini mengalami perkembangan, baik itu agen bakterisidal atau bakteriostatik. Selama ini yang digunakan adalah antibiofilm berbahan sintetik yang dapat memberi dampak negatif pada manusia, sehingga perlu dilakukan upaya mencari alternatif dengan menggunakan bahan berupa tanaman yang diharapkan efektif, murah, aman, tidak berkompetisi pangan dan ramah lingkungan.
Tujuan Penelitian
Tujuan dari penelitian ini adalah mengetahui kandungan senyawa fitokimia dan aktivitas antibakteri dari ekstrak daun papaya, daun melinjo dan daun singkong. Selain itu, untuk mendapatkan agen antibiofilm yang memiliki potensi dalam pencegahan perlekatan sel, pertumbuhan dan degradasi biofilm bakteri P. aeruginosa yang ramah lingkungan dan tidak memberi dampak negatif pada manusia dan mengetahui kondisi optimum penghambatannya dengan menggunakan response surface methodology (RSM).
Manfaat Penelitian
3 Hipotesis
Ekstrak air daun melinjo, daun singkong dan daun pepaya memiliki aktivitas antibakteri dan mengandung senyawa fitokimia yang berpotensi sebagai antibiofilm P. aeruginosa yaitu mampu mencegah perlekatan sel pada substrat, mencegah pertumbuhan biofilm, dan mampu mendegradasi biofilm yang telah terbentuk.
Ruang Lingkup Penelitian
4
2
METODOLOGI
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan mulai pada bulan Desember 2014 sampai dengan dan Mei 2015 di Laboratorium Bidang Mikrobiologi Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong.
Alat
Alat yang digunakan adalah autoklaf, inkubator, laminar air flow, cawan petri, jarum ose, lemari es, spektrofotometer UV-Vis UV-1700 PharmaSpec Shimidzu, Microplate reader BioRad-iMark, Microplate Flat-bottom Polystyrene 96-wells, kuvet, sentrifuge, mikropipet, mistar, timbangan elektrik, Elenmeyer, aluminium foil, tabung biakan, rak tabung reaksi, vortek, kertas saring, lampu spiritus, tisu, pinset, kantong plastik, kaca preparat, gunting, mikroskop, tabung reaksi, isolatip, gelas beaker, gelas ukur, JEOL JSM 5310LV scanning microscope.
Bahan
Bahan utama yang digunakan dalam penelitian ini adalah ekstrak air dari daun melinjo, daun singkong dan daun pepaya yang diperoleh dari sekitaran kampus IPB Dramaga. Untuk mikroba uji digunakan bakteri P. aeruginosa. Bahan pendukung medium Heterotrof (HTR), medium Pseudomonas Isolation Agar (PIA), aquades steril, kristal violet, alkohol 96%, alkohol 70%, lugol, safranin, dan pereaksi yang digunakan pada saat uji fitokimia.
Prosedur Penelitian
Persiapan Sampel (Modifikasi Gomashe et al. 2014)
Sampel yang digunakan dalam penelitian ini adalah daun melinjo (Gnetum gnemon), daun singkong (Manihot utilissima Pohl) dan daun pepaya (Carica papaya L.) yang diambil di sekitar kampus IPB dan telah dideterminasi di Pusat Konservasi Tumbuhan Kebun Raya LIPI. Sampel daun dicuci dengan air mengalir untuk membersihkan dari tanah atau kerikil kemudian ditiriskan. Selanjutnya dilakukan proses pengeringan dengan cara diangin-anginkan selama kurang lebih 3 hari, selanjutnya dioven selama 24 jam dengan suhu 40 °C. Daun yang telah kering kemudian dihancurkan secara aseptik menggunakan blender. Sebanyak 5g sampel kering daun melinjo dan daun singkong dimaserasi menggunakan akuades panas sebanyak 100 ml (daun pepaya menggunakan air steril dingin) dan dishaker pada suhu 70°C (daun pepaya suhu ruang) selama 18-24 jam, kemudian hasil larutan disaring kemudian disentrifugasi dengan kecepatan 10000 rpm selama 5 menit, supernatan kemudian disaring menggunakan CN membran filter 0.2 µm. Peremajaan Bakteri Uji (Modifikasi Didik 2010)
5 media HTR cair kemudian diinkubasi selama 24 jam pada suhu 37 °C. Pada hari kedua, suspensi bakteri diinokulasikan ke dalam media padat HTR dengan metode sebar kemudian diinkubasi pada suhu 37 °C selama 24 jam. Koloni tunggal kemudian diinokulasi kedalam media selektif PIA menggunakan ose bulat secara goresan dengan aseptis, kemudian diinkubasi pada suhu 37°C selama 24 jam. Untuk meyakinkan isolate yang digunakan adalah benar P. aeruginosa maka dilakukan pewarnaan Gram.
Analisis Fitokimia (Harborne 1987)
Analisis fitokimia adalah analisis kualitatif untuk melihat komponen bioaktif yang terdapat pada ekstrak tanaman yang memiliki aktivitas sebagai antibiofilm. Analisis fitokimia yang dilakukan terdiri dari uji alkaloid, saponin, flavonoid, tanin dan uji triterpenoid dan steroid menggunakan metode Harborne (1987) dalam Ristiyana (2013).
Alkaloid. Uji alkaloid dilakukan dengan menambahkan beberapa tetes asam sulfat 2 N kedalam sampel kemudian diuji dengan pereaksi alkaloid yaitu pereaksi dragendorff dan pereaksi meyer. Hasil uji positif diperoleh bila terbentuk endapan merah hingga jingga dengan pereaksi dragendorff dan endapan putih kekuningan dengan pereaksi meyer.
Triterpenoid dan steroid. Sejumlah sampel ditambahkan 2 ml kloroform lalu ditambahkan 10 tetes asam asetat anhidrat dan 3 tetes asam sulfat pekat. Reaksi positif ditunjukkan dengan terbentuknya larutan ungu sampai berwarna merah untuk triterpenoid, dan biru/hijau untuk steroid.
Saponin. Saponin dapat dideteksi dengan uji busa dalam air panas. Busa yang stabil akan terus terlihat selama 5 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N menunjukkan adanya saponin.
Tanin. 1-2 mL sampel ditambahkan 2 tetes FeCl3 1%. Reaksi positif menunjukkan perubahan warna menjadi hijau kehitaman.
Flavanoid. 1-2 mL Sampel dipanaskan kemudian ditambahkan serbuk Mg kemudian ditambahkan 4-5 tetes HCl dan etanol 95% kemudian dikocok. Uji positif diyunjukkan oleh terbentuknya warna jingga.
Uji Aktivitas Antibakteri (Modifikasi Mulyadi et al. 2013)
6
Tabel 1 Klasifikasi respon hambatan (Greenwod 1995)
Diameter zona bening Respon hambatan pertumbuhan
≤ 10 mm Tidak ada
11 – 15 mm Lemah
16 – 20 mm Sedang
> 20 mm Kuat
Sumber : Harmely et al. 2014
Uji Penghambatan Perlekatan Sel (Modifikasi Sandasi et al. 2009)
Pengujian dilakukan dengan menggunakan Microplate Flat-bottom Polystyrene 96-well. Tahap awal yang dilakukan adalah melapisi sumur dengan sampel. Sebanyak 200 μL sampel dengan seri konsentrasi 25, 50, 75, dan 100% (v/v) dimasukkan kedalam sumuran, sumur tanpa penambahan sampel digunakan sebagai kontrol negatif. Mikroplate kemudian diinkubasi pada suhu 37 °C selama 1 jam. Mikroplate dicuci dengan air steril sebanyak 3 kali untuk mengeluarkan sisa sampel. Selanjutnya dilakukan pembentukan biofilm dengan cara memasukkan suspensi bakteri 60 μL dan media sebanyak 120 μL pada microplate dan inkubasi pada suhu 37°C dengan waktu inkubasi selama 3 hari. Microplate dicuci dengan air steril sebanyak 3 kali untuk mengeluarkan suspensi bakteri yang tidak membentuk biofilm. Penambahan 200 μL kristal violet 1% inkubasi pada suhu ruang selama 15 menit. Microplate dicuci dengan air steril. Ditambahkan
etanol absolut 200 μL dan inkubasi pada suhu ruang selama 15 menit. Pengamatan dilakukan dengan iMark Bio-Rad microplate reader pada panjang gelombang 595 nm. Pengujian ini dilakukan dengan 3 kali ulangan.
% Penghambatan = �� � � −�� � � �
�� � � � %
Uji Penghambatan Pertumbuhan Biofilm (Modifikasi Yosephine et al. 2013) Sama dengan pengujian sebelumnya, ke dalam masing-masing sumuran dimasukkan sebanyak 80 μL larutan sampel dengan seri konsentrasi 25, 50, 75 dan 100% (v/v), 80μL media HTR, serta 40 μL suspensi bakteri lalu mikroplate diinkubasi pada 37 °C selama 3 hari. Kemudian mikroplate dicuci dengan air steril dan langkah selanjutnya seperti pada uji penghambatan perlekatan sel. Pengujian ini dilakukan dengan 3 kali ulangan.
% penghambatan = �� � � −�� � � �
�� � � � %
Uji Degradasi Biofilm (Modifikasi Yosephine et al. 2013)
7 selama 1 jam. Kemudian mikroplate dicuci kembali dengan air steril dan langkah selanjutnya seperti pada uji penghambatan perlekatan sel. Pengujian ini dilakukan dengan 3 kali ulangan.
% degradasi = �� � � −�� � � �
�� � � � %
Visualisasi menggunakan Scanning Electron Microscope (SEM)
Bahan polystyrene yang sama dengan bahan mikroplate yang digunakan pada uji sebelumnya dipotong persegi dengan ukuran 0.5 mm x 0.5 mm dan ditempatkan di dalam mikroplate dengan 80 µL suspensi sel P. aeruginosa yang telah ditumbuhkan semalam dan media HTR 120 µL. Sel-sel dan potongan polystyrene diinkubasi bersama-sama untuk membentuk biofilm pada 37 °C selama 3 hari. Setelah biofilm terbentuk, mikroplate dicuci dengan air steril sebanyak 3 kali untuk mengeluarkan suspensi bakteri yang tidak membentuk
biofilm. Larutan uji 200 μL dengan konsentrasi 25% (v/v) dimasukkan ke dalam sumur berisi potongan polystyrene. Potongan polystyrene tanpa penambahan larutan uji digunakan sebagai kontrol negatif. Selanjutnya diinkubasi pada suhu 37.5 °C selama 45 menit (perlakuan terbaik pada saat optimasi). Setelah itu potongan polystyrene tersebut dipreparasi setelah itu diamati menggunakan JEOL JSM 5310LV scanning microscope di Laboratorium Zoology LIPI Cibinong.
Desain Penelitian dan Analisis Statistik
Uji pendahuluan untuk menentukan ekstrak yang paling berpotensi untuk masing-masing respon (pencegahan perlekatan dan pertumbuhan serta kemampuan mendegradasi) dianalisis menggunakan ANOVA apabila sebaran data (distribusi data) normal dan varians data sama. Jika syarat terpenuhi dilanjutkan dengan Tukey Post Hoc Test. Jika sebaran data tidak normal dan atau varians data tidak sama maka digunakan uji alternatif yaitu uji Kurskal Wallis,
yang kemudian dilanjutkan dengan uji Mood’s Median menggunakan MINITAB 16.
Setelah diperoleh ekstrak terbaik, dilanjutkan dengan tahapan optimasi untuk menentukan kondisi optimumnya dalam meningkatkan respon pencegahan perlekatan, penghambatan pembentukan biofilm dan kemampuan mendegradasi biofilm. Faktor yang dioptimasi adalah konsentrasi ekstrak terpilih (A), suhu (B), dan waktu kontak (C). Pada tahap optimasi ini akan diperoleh titik-titik optimum. Untuk memperoleh titik-titik optimum tersebut, digunakan metode permukaan respon Response Surface Methodology (RSM) dengan bantuan software MINITAB 16.
8
9
3
HASIL
Peremajaan Bakteri Uji
.
Gambar 1 adalah bakteri P. aeruginosa pada media selektif Pseudomonas Isolation Agar (PIA) dan hasil pewarnaan Gram. Pada media agar, P. aeruginosa dapat menyebar di permukaan seperti selaput gel licin yg berbau seperti anggur. Koloni P. aeruginosa pada media PIA berwarna hijau kebiruan. Berdasarkan hasil pewarnaan Gram, bakteri uji terlihat berbentuk batang, dan menjadi warna merah akibat pewarnaan kontras safranin, yang menunjukkan bakteri uji merupakan bakteri Gram negatif.
Senyawa Fitokimia
Hasil uji kualitatif fitokimia ekstrak air daun pepaya dan daun singkong (Tabel 2) menunjukkan positif senyawa alkaloid, tanin, steroid dan flavonoid sedangkan untuk senyawa triterpenoid dan saponin hasilnya negatif. Daun melinjo positif alkaloid, steroid, tanin dan saponin, tapi negatif triterpenoid dan flavonoid.
Tabel 2 Hasil uji kualitatif fitokimia
No Uji Fitokimia
Hasil Uji Daun
Pepaya
Daun Melinjo
Daun Singkong 1 Alkaloid + + + 2 Triterpenoid - - - 3 Steroid + + +
4 Tanin + + +
5 Saponin - + - 6 Flavanoid + - +
Aktivitas Antibakteri
Zona bening yang terbentuk pada aktivitas antibakteri dengan metode difusi cakram menunjukkan adanya pengaruh ekstrak air daun pepaya, daun singkong
10
Tabel 3 Diameter zona bening pertumbuhan bakteri P. aeruginosa pada inkubasi 24 jam
Tipe ekstrak Diameter zona
bening
Respon hambatan pertumbuhan
Kontrol negatif (aquades) 0 mm Tidak ada
Daun pepaya 25 mm Kuat
Daun melinjo 11 mm Lemah
Daun singkong 10 mm Lemah Kontrol positif (ampisilin) 40 mm Kuat
dan daun melinjo pada konsentrasi 100% terhadap pertumbuhan bakteri P. aeruginosa. Tabel 3 menunjukkan bahwa respon hambat yang paling kuat adalah kontrol positif (ampisilin), diikuti daun pepaya, sedangkan untuk daun melinjo dan daun singkong respon hambatannya termasuk kategori lemah.
Aktivitas Antibiofilm Ekstrak Daun Melinjo, Pepaya dan Singkong
Berdasarkan hasil penelitian, terlihat bahwa secara umum ketiga ekstrak memiliki aktivitas sebagai antibiofilm meskipun tidak menghambat secara keseluruhan. Tahapan awal yang perlu diperiksa sebelum analisis ragam dilakukan adalah apakah asumsi tentang kehomogenan ragam, sebagai syarat sahnya ANOVA, terpenuhi. Untuk itu diperlukan uji Bartlett. Analisis statistik menunjukkan data respon pencegahan perlekatan, pencegahan pertumbuhan dan kemampuan mendegradasi biofilm adalah homogen (Lampiran 2). Kesimpulan ini didasarkan pada p-value (p>0.05). Dengan demikian analisis dapat dilanjutkan ke ANOVA untuk membandingkan perbedaan rata-rata lebih dari dua kelompok dilanjutkan uji Tukey untuk membandingkan perbedaan rata-rata antar kelompok menggunakan program MINITAB 16.
Berdasarkan uji statistik semua data penelitian baik itu respon pencegahan perlekatan, pencegahan pertumbuhan maupun kemampuan degradasi menunjukkan nilai signifikan (p<0.05). Jadi paling tidak terdapat dua perlakuan yang memiliki perbedaan bermakna. Kemudian untuk mengetahui kelompok mana saja yang memiliki perbedaan yang bermakna dilakukan uji lanjut.
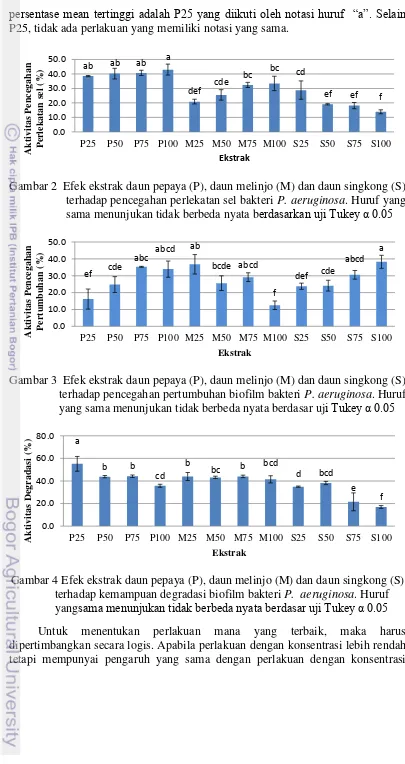
Pada aktivitas pencegahan perlekatan sel, ekstrak pepaya dengan konsentrasi 100% memiliki presentase penghambatan tertinggi yaitu 42.989% (Gambar 2). Aktivitas penghambatan pertumbuhan tertinggi ditunjukkan oleh ekstrak singkong dengan konsentrasi 100% yaitu sebesar 38.291% (Gambar 3). Sedangkan pada aktivitas kemampuan degradasi ekstrak melinjo dengan konsentrasi 75% memiliki persen degradasi tertinggi yaitu sebesar 53.376% (Gambar 4).
Untuk menentukan perlakuan mana yang terbaik, dapat dilihat persentase mean tertinggi untuk masing-masing aktivitas. Aktivitas penghambatan perlekatan dengan nilai persentase mean tertinggi adalah P100 yang diikuti oleh notasi huruf
“a”. Selain P100, perlakuan yang juga diikuti notasi “a” adalah P50 dan P25 yang
artinya perlakuan tersebut tidak berbeda nyata. Untuk aktivitas penghambatan pertumbuhan, nilai persentase mean tertinggi adalah S100 yang diikuti notasi “a”.
Selain S100, perlakuan yang diikuti notasi “a” antara lain M25, P75, P100, S75,
11
persentase mean tertinggi adalah P25 yang diikuti oleh notasi huruf “a”. Selain
P25, tidak ada perlakuan yang memiliki notasi yang sama.
Gambar 2 Efek ekstrak daun pepaya (P), daun melinjo (M) dan daun singkong (S) terhadap pencegahan perlekatan sel bakteri P. aeruginosa. Huruf yang sama menunjukan tidak berbeda nyata berdasarkan uji Tukey α 0.05
Gambar 3 Efek ekstrak daun pepaya (P), daun melinjo (M) dan daun singkong (S) terhadap pencegahan pertumbuhan biofilm bakteri P. aeruginosa. Huruf yang sama menunjukan tidak berbeda nyata berdasar uji Tukey α 0.05
Gambar 4 Efek ekstrak daun pepaya (P), daun melinjo (M) dan daun singkong (S) terhadap kemampuan degradasi biofilm bakteri P. aeruginosa. Huruf yangsama menunjukan tidak berbeda nyata berdasar uji Tukey α 0.05 Untuk menentukan perlakuan mana yang terbaik, maka harus dipertimbangkan secara logis. Apabila perlakuan dengan konsentrasi lebih rendah tetapi mempunyai pengaruh yang sama dengan perlakuan dengan konsentrasi
ab ab ab
P25 P50 P75 P100 M25 M50 M75 M100 S25 S50 S75 S100
Ak
P25 P50 P75 P100 M25 M50 M75 M100 S25 S50 S75 S100
Ak
P25 P50 P75 P100 M25 M50 M75 M100 S25 S50 S75 S100
12
yang lebih tinggi dalam meningkatkan persentase aktivitas, maka perlakuan konsentrasi yang lebih rendah tersebut lebih baik daripada perlakuan konsentrasi yang lebih tinggi di atasnya. Dalam penelitian ini dapat disimpulkan bahwa perlakuan terbaik pada aktivitas pencegahan perlekatan dan kemampuan degradasi adalah P25 atau perlakuan dengan pemberian ekstrak pepaya dengan konsentrasi 25% (v/v), sedangkan untuk aktivitas penghambatan pertumbuhan, yang terbaik adalah M25 atau perlakuan dengan pemberian ekstrak melinjo dengan konsentrasi 25% (v/v). Berdasarkan hasil analisis diatas, maka ekstrak terbaik yang akan diuji lanjut dan dioptimasi adalah daun melinjo pada penghambatan pertumbuhan, dan daun pepaya pada pencegahan perlekatan dan degradasi biofilm.
Optimasi Penghambatan Perlekatan Sel Ekstrak Daun Pepaya
Tujuan utama dari tahapan optimasi ini adalah untuk menentukan seberapa besar pengaruh konsentrasi ekstrak, suhu dan waktu kontak terhadap penghambatan perlekatan sel bakteri pada permukaan bahan (microplate). Berdasarkan hasil analisis ANOVA (Tabel 4), semua faktor menunjukkan adanya pengaruh secara signifikan (P < 0.05) kecuali interaksi konsentrasi dan waktu (P = 0.113). Nilai koefisien determinan R2 sebesar 93.76% yang berarti bahwa pengaruh variabel A, B dan C terhadap respon sebesar 93.76% sedangkan sisanya 6.24% dipengaruhi variable-variabel yang tidak diketahui.
Persamaan RSM untuk optimasi konsentrasi (A), suhu (B) dan waktu kontak (C) terhadap respon penghambatan perlekatan sel (Y) adalah :
Y = 27.649 + 4.695A + 12.760B - 9.066C + 13.328A2 - 19.234B2 - 20.802C2 - 4.082AB - 6.080BC
Tabel 4 Estimasi koefisien regresi untuk pencegahan perlekatan sel
Term Coef SE Coef T P
Constant 27.649 1.0903 25.358 0.000
Block 2.612 0.7980 3.273 0.002
Konsentrasi 4.695 1.0095 4.650 0.000
Suhu 12.760 1.0095 12.640 0.000
Waktu -9.066 1.0095 -8.981 0.000
Konsentrasi*konsentrasi 13.328 1.8759 7.105 0.000
Suhu*suhu -19.234 1.8759 -10.253 0.000
Waktu*waktu -20.802 1.8759 -11.089 0.000
Konsentrasi*suhu -4.082 1.1500 -3.549 0.001
Konsentrasi *waktu 1.860 1.1500 1.617 0.113
Suhu*waktu -6.080 1.1500 -5.287 0.000
S = 5.31234 PRESS = 2194.06
13
Gambar 5 Contour plot hubungan suhu dan waktu kontak terhadap respon
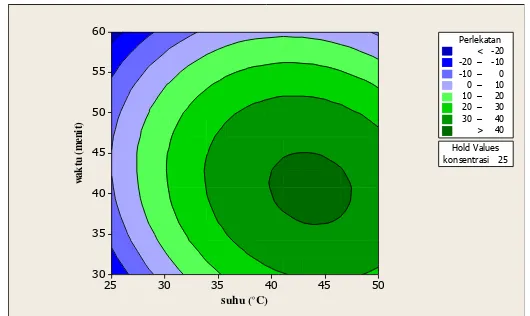
Gambar 6 Optimalisasi pencegahan perlekatan menggunakan response optimizer Untuk mengetahui korelasi antar faktor dalam model ini terhadap respon dapat dilihat melalui contour plot (Gambar 5). Melalui Contour plot dapat diketahui bahwa respon terbaik (>40%) berada pada suhu diantara 35 dan 50 °C dan waktu kontak antara 35 dan 50 menit. Berdasarkan data hasil penelitian persen penghambatan perlekatan yang paling besar yaitu sebesar 41.176% pada konsentrasi 25%, suhu 37.5 °C dengan waktu kontak 45 menit.
Dari hasil output program Respon Optimizer didapatkan optimal setting untuk respon pencegahan perlekatan sesuai dengan range yang dipilih seperti pada Gambar 6 terlihat bahwa optimal setting untuk kombinasi perlakuan konsentrasi ekstrak, suhu dan waktu kontak berdasarkan range yang kita pilih menghasilkan optimal desirability sebesar 1. Dengan kombinasi variabel baru yang disarankan yaitu konsentrasi ekstrak 100% (v/v) dengan suhu 40.6566 °C dan waktu kontak 41.8182 menit, respon pencegahan perlekatan dapat ditingkatkan semaksimal mungkin yaitu sebesar 47.5547%.
Optimasi Penghambatan Pertumbuhan Biofilm Ekstrak Daun Melinjo
Berdasarkan hasil analisis ANOVA, faktor yang menunjukkan adanya pengaruh secara signifikan (P < 0.05) adalah suhu (P = 0.000), waktu kontak (P = 0.000) dan interaksi antara suhu dengan waktu kontak (P = 0.000) sedangakan faktor konsentrasi ekstrak tidak berpengaruh secara signifikan (Tabel 5). Nilai
14
koefisien determinan R2 ialah 89.95 % yang berarti bahwa 89.95% variabel respon dipengaruhi oleh variabel independen, sedangkan sisanya 10.05% dipengaruhi oleh variable yang tidak diketahui.
Persamaan RSM untuk optimasi konsentrasi (A), suhu (B) dan waktu kontak (C) terhadap respon penghambatan pertumbuhan (Y) adalah :
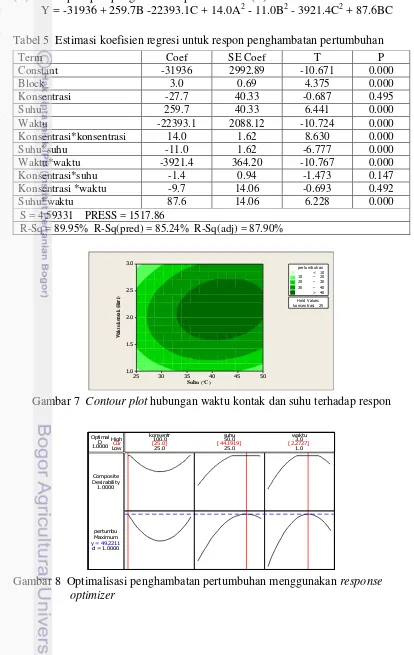
Y = -31936 + 259.7B -22393.1C + 14.0A2 - 11.0B2 - 3921.4C2 + 87.6BC Tabel 5 Estimasi koefisien regresi untuk respon penghambatan pertumbuhan
Term Coef SE Coef T P Konsentrasi*konsentrasi 14.0 1.62 8.630 0.000 Suhu*suhu -11.0 1.62 -6.777 0.000
Gambar 7 Contour plot hubungan waktu kontak dan suhu terhadap respon
15 Untuk mengetahui korelasi antar faktor dalam model ini terhadap respon dapat dilihat melalui contour plot (Gambar 7). Melalui Contour plot diatas dapat diketahui bahwa untuk menghasilkan respon >40% berada pada suhu antara 30 °C dan 50 °C dan waktu kontak antara 1.5 hari dan 3 hari. Berdasarkan data hasil penelitian persen penghambatan pertumbuhan yang paling besar yaitu sebesar 47.154% pada konsentrasi 25%, suhu 50 °C dengan waktu kontak 3 hari.
Dari hasil output program Respon Optimizer didapatkan optimal setting untuk respon pencegahan perlekatan sesuai dengan range yang dipilih seperti pada Gambar 8. Dari gambar diatas, terlihat bahwa optimal setting untuk kombinasi perlakuan konsentrasi ekstrak, suhu dan waktu kontak berdasarkan range yang kita pilih hanya menghasilkan optimal desirability sebesar 1.0. Dengan kombinasi variabel baru yang disarankan yaitu konsentrasi ekstrak 25% (v/v) dengan suhu 44.19 °C dan waktu kontak 2.27 hari, respon pencegahan perlekatan dapat ditingkatkan semaksimal mungkin yaitu sebesar 49.22%.
Optimasi Degradasi Biofilm Ekstrak Daun Pepaya
Berdasarkan hasil analisis ANOVA, faktor yang menunjukkan adanya pengaruh secara signifikan (P < 0.05) adalah suhu (P = 0.000), waktu kontak (P = 0.001), interaksi suhu dan waktu kontak (P = 0.001), sedangakan faktor konsentrasi ekstrak (P=0.240) dan interaksi konsentrasi dan suhu (P = 0.325) tidak berpengaruh secara signifikan. Nilai koefisien determinan R2 ialah 86.23%. Artinya 86.23% variabel respon dipengaruhi oleh variabel independen.
Persamaan RSM untuk optimasi konsentrasi (A), suhu (B) dan waktu kontak (C) terhadap respon pendegradasian (Y) adalah :
Y = 31.6640 + 6.2446B + 3.1426C + 16.7179A2 - 12.0016B2 - 19.6269C2 + 3.5153BC
Tabel 6 Estimasi koefisien regresi untuk respon kemampuan degradasi
Term Coef SE Coef T P
Constant 31.6640 1.0548 30.018 0.000
Block 2.6771 0.7708 3.473 0.001
Konsentrasi -1.1062 0.9389 -1.178 0.244
Suhu 6.2446 0.9389 6.651 0.000
Waktu 3.1426 0.9389 3.347 0.002
Konsentrasi*konsentrasi 16.7179 1.8122 9.225 0.000
Suhu*suhu -12.0016 1.8122 -6.623 0.000
Waktu*waktu -19.6269 1.8122 -10.831 0.000
Konsentrasi*suhu -1.0341 1.0497 -0.985 0.329
Konsentrasi *waktu -0.3624 1.0497 -0.345 0.731
Suhu*waktu 3.5153 1.0497 3.349 0.002
S = 5.14244 PRESS = 1781.31
16
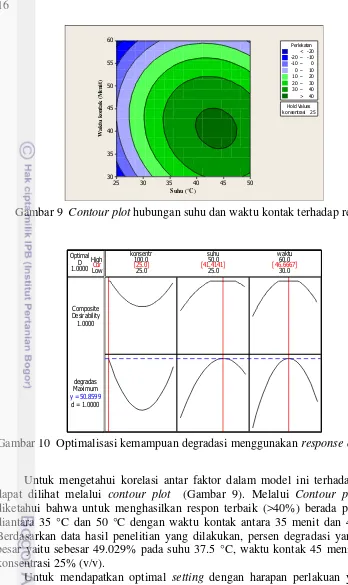
Gambar 9 Contour plot hubungan suhu dan waktu kontak terhadap respon
Gambar 10 Optimalisasi kemampuan degradasi menggunakan response optimizer
Untuk mengetahui korelasi antar faktor dalam model ini terhadap respon dapat dilihat melalui contour plot (Gambar 9). Melalui Contour plot dapat diketahui bahwa untuk menghasilkan respon terbaik (>40%) berada pada suhu diantara 35 °C dan 50 °C dengan waktu kontak antara 35 menit dan 45 menit. Berdasarkan data hasil penelitian yang dilakukan, persen degradasi yang paling besar yaitu sebesar 49.029% pada suhu 37.5 °C, waktu kontak 45 menit dengan konsentrasi 25% (v/v).
17 Visualisasi Menggunakan Scanning Electron Microscopy
Hasil visualisasi perlakuan degradasi ekstrak daun pepaya konsentrasi 25% menggunakan SEM ditunjukkan pada Gambar 11. Perbedaan antara EPS pada biofilm yang telah diberikan perlakuan ekstrak daun pepaya dengan biofilm tanpa perlakuan ekstrak terlihat dari hasil SEM diatas. Biofilm yang mendapat perlakuan ekstrak pepaya lebih bersih atau dalam hal ini EPS-nya lebih sedikit bahkan tidak ada sama sekali bila dibandingkan dengan biofilm tanpa perlakuan. Hal ini menunjukkan bahwa ekstrak pepaya terbukti dapat mendegradasi EPS.
Gambar 11 Visualisasi menggunakan SEM kemampuan ekstrak pepaya dalam menghancurkan EPS biofilm P. aeruginosa (a) tanpa perlakuan (b) pemberian ekstrak pepaya 25% (v/v)
MAG 5000x MAG 5000x
18
4
PEMBAHASAN
Peremajaan Bakteri Uji
Berdasarkan hasil pewarnaan Gram, bakteri uji termasuk bakteri Gram negatif ditandai dengan warna merah pada saat penambahan safranin. Hal tersebut terjadi karena pada gram negatif lemak terekstraksi dari dinding sel sehingga pori membesar dan kompleks violet kristal-iodin keluar sel, sedangkan pada gram positif dinding sel dehidrasi, pori berkerut dan permeabilitas rendah sehingga kompleks violet kristal-iodin terperangkap antara dinding sel dan membran sitoplasma sehingga sel tetap ungu sehingga dengan pewarnaan safranin, bakteri Gram negatif mengikatnya sedangkan Gram positif melewatkannya Selain berwarna merah, bentuk selnya terlihat berbentuk batang. Hal ini sesuai dengan ciri-ciri P. aeruginosa. P. aeruginosa adalah bakteri berbentuk batang Gram negatif, dengan ukuran sekitar 0,6 x 2 μm termasuk kedalam Familia Pseudomonadaceae. Bakteri ini terlihat sebagai bakteri tunggal, berpasangan, dan terkadang membentuk rantai yang pendek. P. aeruginosa bersifat aerob, katalase positif, oksidase positif, tidak mampu memfermentasi tetapi dapat mengoksidasi glukosa/karbohidrat lain, tidak berspora, tidak mempunyai selubung (sheat) dan mempunyai flagel monotrika (flagel tunggal pada kutub) sehingga selalu bergerak (Todar 2008).
Media selektif yang digunakan adalah media PIA. Pseudomonas isolation Agar merupakan media yang sangat berguna untuk mengisolasi Pseudomonas spp. Media ini selektif dan diformulasi untuk meningkatkan pembentukan pigmen biru atau biru-hijau pyocyanin oleh Pseudomonas aeruginosa. Pigmen berdifusi ke dalam medium pertumbuhan di sekitarnya. Dalam bahasa latin kata Pseudo berarti palsu, monas artinya unit single , sedangkan aeruginosa artinya membetuk warna hijau kebiruan. Pada saat pembiakan didalam laboratorium, bakteri ini diinkubasi pada suhu 37 °C, sebab lingkungan alami P. aeruginosa adalah pada suhu 4 – 36 ºC, tetapi mereka bisa tahan sampai suhu 42 ºC. Salah satu tempat favorit P. aeruginosa adalah Mineral Water atau Air Minum Dalam kemasan terutama yang menggunakan dispenser.
Senyawa Fitokimia
Hasil uji kualitatif fitokimia daun pepaya dan daun singkong (Tabel 2) menunjukkan uji positif senyawa alkaloid, tanin, flavanoid dan steroid. Daun melinjo positif saponin, alkaloid, tanin dan steroid. Hasil penelitian ini berbeda dengan uji fitokimia yang dilakukan oleh Yusha’u et al. (2009) yang menyatakan bahwa ekstrak air daun pepaya hanya positif mengandung saponin dan tanin. Begitu juga pada penelitian yang dilakukan Lestari (2013) yang menyatakan bahwa daun melinjo positif flavanoid dan Ervina (2014) yang menyatakan bahwa daun singkong positif saponin. Hal ini menunjukkan bahwa faktor lingkungan seperti iklim, cahaya matahari, suhu udara, lingkungan atmosfer (CO2, O2, dan kelembaban), lingkungan perakaran (sifat kimia dan fisika tanah), dan ketersediaan air di dalam tanah memiliki pengaruh terhadap hasil metabolisme sekunder tanaman (Nitisapto dan Siradz 2005).
19 warna hijau kehitaman karena adanya reaksi penambahan FeCl3 dengan salah satu gugus hidroksil pada tanin. Ketiga ekstrak menunjukkan uji positif pada uji alkaloid. Pada uji alkaloid diperkirakan nitrogen pada alkaloid akan membentuk ikatan kovalen koordinat dengan ion logam K+ dari kalium tetraiodomerkurat (II) membentuk kompleks kalium-alkaloid yang mengendap (Marlina 2005). Alkaloid pada pepaya merupakan alkaloid karpain (Milind dan Gurdita. 2011). Uji flavonoid menunjukkan uji positif (merah) untuk ekstrak daun pepaya dan daun singkong, tetapi negatif untuk daun melinjo. Jenis flavonoid yang terkandung dalam ekstrak, kemungkinan adalah jenis quercetin. Senyawa quercetin merupakan golongan flavonol yang paling banyak terdapat dalam tanaman dan merupakan senyawa yang paling aktif dibandingkan senyawa lain dari golongan flavonol. Hasil positif steroid ditunjukkan dengan terjadinya perubahan warna menjadi hijau biru. Reaksi yang terjadi antara steroid dengan asam asetat adalah reaksi asetilasi gugus –OH pada steroid yang akan menghasilkan kompleks asetil steroid. Penambahan asam sulfat pekat bertujuan untuk mendestruksi kompleks asetil steroid. Uji saponin hanya positif pada ekstrak daun melinjo. Saponin adalah senyawa aktif permukaan yang dapat menimbulkan busa jika dikocok dalam air. Hal tersebut terjadi karena saponin memiliki gugus polar dan non polar yang akan membentuk misel. Pada saat misel terbentuk maka gugus polar akan menghadap ke luar dan gugus nonpolar menghadap ke dalam dan keadaan inilah yang tampak seperti busa (Sangi et al. 2008)
Aktivitas Antibakteri
Hasil pengujian aktivitas antibakteri dari ketiga ekstrak (Tabel 4), menunjukkan bahwa daun pepaya positif memiliki aktivitas antibakteri dengan respon hambat yang kuat (25 mm) terhadap bakteri P. aeruginosa. Ekstrak daun melinjo dan daun singkong juga memiliki aktivitas antibakteri terhadap bakteri P. aeruginosa meskipun dengan respon hambat yang lemah (11 mm) bila dibandingkan dengan ekstrak daun pepaya dan kontrol positif berupa antibiotik ampisilin yang respon hambatnya kuat (40 mm).
Kontrol positif yang digunakan adalah antibiotik ampisilin yaitu derivat penisilin semi sintetik yang bersifat bakterisida. Menurut Volk dan Wheeler (1993) dalam Saputra (2012), mekanisme kerja penisilin adalah dengan mengganggu sintesis dinding sel, khususnya ketika proses transpeptidasi pada sintesis peptidoglikan dinding sel. Pada proses ini, penisilin memiliki struktur yang sama dengan struktur D-alanil-D-alanin terminal pada peptidoglikan, sehingga enzim transpeptidase bereaksi dengan penisilin. Hal ini membuat struktur peptidoglikan yang dibentuk menjadi tidak sempurna dan melemahkan kekuatan dinding sel pada bakteri.
20
terdapat gugus basa yang menggandung nitrogen akan bereaksi dengan senyawa asam amino yang menyusun dinding sel bakteri dan DNA bakteri. Reaksi ini mengakibatkan terjadinya perubahan struktur dan susunan asam amino yang akan menimbulkan perubahan keseimbangan genetik pada rantai DNA sehingga mengalami kerusakan yang mendorong terjadinya lisis sel bakteri dan menyebabkan kematian sel. Selain itu, kandungan senyawa steroid dapat menghambat pertumbuhan bakteri dengan mekanisme penghambatan terhadap sintesis protein karena terakumulasi dan menyebabkan perubahan komponen-komponen penyusun sel bakteri itu sendiri (Rosyidah et al. 2010). Saponin memiliki molekul yang dapat menarik air atau hidrofilik dan molekul yang dapat melarutkan lemak atau lipofilik sehingga menurunkan tegangan permukaan sel yang akhirnya menyebabkan kehancuran suatu mikroba. Saponin dapat meningkatkan permeabilitas membran sel bakteri sehingga dapat mengubah struktur dan fungsi membran menyebabkan denaturasi protein membran sehingga membran sel akan rusak dan lisis (Masniari 2010). Volk dan Wheeler (1988) dalam Retnowati (2011) menjelaskan bahwa senyawa flavonoid dapat merusak membran sitoplasma yang dapat menyebabkan bocornya metabolit penting dan menginaktifkan sistem enzim bakteri. Kerusakan ini memungkinkan nukleotida dan asam amino merembes keluar dan mencegah masuknya bahan-bahan aktif ke dalam sel, keadaan ini dapat menyebabkan kematian bakteri. Pada perusakan membran sitoplasma, ion H+ dari senyawa fenol dan turunannya (flavonoid) akan menyerang gugus polar (gugus fosfat) sehingga molekul fosfolipida akan terurai menjadi gliserol, asam karboksilat dan asam fosfat. Hal ini mengakibatkan fosfolipida tidak mampu mempertahankan bentuk membran sitoplasma akibatnya membran sitoplasma akan bocor dan bakteri akan mengalami hambatan pertumbuhan dan bahkan kematian. Senyawa tanin dapat menyebabkan pengkerutan dinding sel sehingga pertumbuhannya terhambat, dan pada dosis tertentu menyebabkan kematian bakteri (Juliantina 2008).
Optimasi Agen Antibiofilm Ekstrak Terpilih
Tujuan utama dalam penelitian ini adalah menentukan kondisi optimum ektrak terpilih dalam pengambatan perlekatan sel dan pertumbuhan biofilm serta kemampuan degradasi biofilm. Rancangan penelitian yang digunakan adalah Central Composite Design (CCD). Metode ini dipilih karena memiliki kualitas prediksi yang lebih besar dari metode Box-Behnken dengan selisih pengerjaan yang sedikit. Dalam metode ini tiap variabel yang dicari nilai optimumnya sementara variabel lainnya diatur pada nilai yang tetap. Variabel yang akan diuji adalah konsentrasi ekstrak, suhu inkubasi dan waktu kontak. Variabel tersebut dipilih karena memiliki peran penting pada saat pengaplikasiannya terutama jika sudah masuk ke dalam program pembersihan CIP (Cleaning In Place). CIP merupakan proses pembersihan tanpa membongkar. CIP Banyak diterapkan untuk proses pembersihan pipa dan storage tank. Prinsip dalam proses CIP antara lain yaitu time (waktu total yang dibutuhkan untuk CIP), temperature (suhu), titration (konsentrasi larutan asam dan basa).
21 yang digunakan pada saat uji pendahuluan. Untuk variabel suhu, dipilih nilai batas bawah dan batas atasnya masing-masing 25 °C dan 50 °C. hal ini dikarenakan, dalam pengaplikasian antibiofilm sebagian besar suhu yang digunakan berada dalam rentang tersebut. Misalkan untuk pengaplikasian pada biofilm di gigi atau jadi bahan tambahan pembuatan shampo atau sabun, maka suhu yang digunakan adalah suhu tubuh manusia. Begitupula ketika pengaplikasian dalam pembersihan CIP industri, suhu yang digunakan adalah suhu diatas 45°C. Untuk variabel waktu kontak dipilih nilai batas bawah dan batas atasnya masing-masing 30 menit dan 60 menit karena peda pengaplikasiannya, proses sanitasi tidak menggunakan waktu yang lama. Sekali pembersihan membutuhkan waktu tidak lebih dari satu jam.
Tahap optimasi selanjutnya adalah analisis pendekatan dengan desirability function. Metode optimasi yang digunakan adalah pendekatan desirability function dengan MINITAB 16. Kriteria desirability function yang digunakan adalah Maximize. Kriteria ini dilakukan untuk mengetahui respon terhadap perlakuan ekstrak dengan konsentrasi, waktu, dan suhu yang berbeda-beda. Hasil akhir dari tahap analisis berupa kombinasi baru yang ditetapkan berdasarkan sasaran yang telah ditetapkan sebelumnya. Program akan menetapkan beberapa solusi dengan nilai desirability yang berbeda. Semakin tinggi nilai desirability (mendekati 1) berarti semakin optimal kombinasi tersebut.
Penghambatan Perlekatan Sel Ekstrak Daun pepaya
Proses penempelan sel pada permukaan merupakan tahapan pembentukan biofilm yang sangat penting, karena merupakan awal mula dari pembentukan biofilm dan merupakan faktor penting dalam memulai aktivitas pathogenesis. Pada tahap ini, proses perlekatan sel masih bersifat sementara. Bakteri menggunakan berbagai organel ekstraseluler dan protein untuk penginderaan dan menempel ke permukaan, termasuk flagel pili, fimbriae, serat curli, dan protein luar membran (Thomas et al. 2004). Sel melekat pada substrat yang mengalami kontak langsung dengan cairan yang mengandung elektrolit dan makromolekul (misalnya, DNA, protein, dan humic acid, yang dibentuk oleh degradasi biomolekul).
Ada beberapa cara yang dapat ditempuh untuk menghambat proses penempelan sel. Salah satunya, tahapan awal dari proses penempelan sel biofilm tergantung pada kondisi permukaan yang menciptakan lingkungan yang menguntungkan bagi penempelan sel (Sandasi et al. 2009). Kondisi permukaan dicapai dengan adsorpsi zat termasuk nutrisi, molekul organik dan anorganik yang penting untuk pertumbuhan sel-sel, yang pada akhirnya mempercepat penempelan sel. Oleh karena itu dapat dikendalikan melalui pretreatment permukaan dengan antimikroba yang tidak menguntungkan bagi sel dengan demikian mengurangi penempelan sel pada permukaan. Pada umumnya untuk mencegah perlekatan sel, maka alat-alat implant biasanya dilapisi dengan chlorhexidine-silver sulfadiazine dan kombinasi minocycline dan rifampicin. Tetapi perlu perhatian khusus pada pasien yang hipersensitivitas. Selain itu penggunaan antibiotik secara terus menerus dapat menyebabkan resisten.
22
Sandasi et al (2010) menggunakan ekstrak methanol dari beberapa tanaman Rosmarinus officinalis, Echinacea angustifolia dan Thymus vulgargaris dengan konsentrasi 1 mg/ml mampu menghambat perlekatan L. monocyte genes pada PVC sebesar masing-masing 78%, 77% dan 77%. Persentase tersebut lebih besar daripada daya hambat ciprofloxacin yang hanya 75%. Kitosan juga dilaporkan dapat menghambat perlekatan sel (Ofek et al. 2003). Beberapa penelitian juga menunjukkan keberhasilan dalam mengurangi perlekatan mikroba dengan melapisi peralatan medis menggunakan perak (Hashimoto 2001). Selain itu, ekstrak air dari sabuk kelapa mampu menghambat perlekatan sel Pseudomonas sp secara signifikan, dan hasil uji FTIR menunjukkan keberadaan gugus alkohol dalam ekstrak tersebut (Viju et al. 2013). Oleh karena itu, bisa disimpulkan bahwa ekstrak yang mengandung gugus alkohol memiliki potensi sebagai antibiofilm dalam hal ini mencegah perlekatan sel.
Tanin dan flavonoid merupakan senyawa polifenol yang terkandung dalam daun pepaya. Berdasarkan penelitian Agnol et al (2003) dan Jagani et al (2009) tanin dan flavanoid bekerja dengan mengikat salah satu protein adhesin bakteri yang dipakai sebagai reseptor permukaan bakteri, sehingga terjadi penurunan daya perlekatan bakteri, baik perlekatan bakteri dengan permukaan substrat maupun perlekatan antar bakteri dimana adhesi merupakan faktor utama dalam pembentukan biofilm. Daya hambat pembentukan biofilm oleh zat aktif tanin dan flavonoid juga ditunjukkan pada penelitian Sunanto (2012), dimana zat ini terkandung dalam ekstrak daun dewandaru dan mempunyai MBIC sebesar 0.015 g/dL.
Penghambatan Pertumbuhan Biofilm Ekstrak Daun melinjo
Tahap pembentukan biofilm berikutnya setelah tahap perlekatan sel adalah sel-sel bakteri telah menempel secara permanen akibat terbentuknya material eksopolimer yang terdiri dari DNA, protein, lemak, dan lipopolisakarida memfasilitasi adhesi antara sel dan permukaan yang merupakan suatu senyawa perekat yang lebih kuat. Tahap ini ditandai dengan terbentuknya mikrokoloni dan biofilm mulai terbentuk. Sel-sel teradsorbsi pada permukaan mereplikasi dan tumbuh menjadi mikrokoloni. Bakteri mengeluarkan Extracelluler Polymeric Substance (EPS) dan menjadi selubung dalam lapisan hydrogel, yang membentuk pelindung antara koloni dari pengaruh lingkungan ekstraseluler. Komposisi EPS bervariasi antara spesies dan kondisi pertumbuhan, serta komunikasi antara sel-sel dalam komunitas merangsang pembentukan dan sekresi quorum sensing (QS) atau atau komunikasi antara sel bakteri. QS adalah bagian terpenting dalam pembentukan biofilm dan suatu mekanisme yang digunakan oleh sel untuk mengetahui kondisi lingkungannya ekstraseluler mereka. QS memodulasi berbagai fungsi selular, termasuk patogenesis, akuisisi nutrisi, konjugasi, motilitas usus dan produksi metabolit sekunder (Borlee et al. 2010). Oleh sebab itu, yang menjadi perhatian untuk mencegah pertumbuhan biofilm adalah menghambat atau bahkan mematikan sel agar tidak bertambah, mengganggu sekresi QS, dan mencegah pembentukan EPS.
23 menghambat pertumbuhan sebesar 80.59%. Penghambatan ini diduga berasal dari natrium benzoat dan peppermint oil yang digunakan dalam formula Mouthwash. Ekstrak daun melinjo seperti yang telah di paparkan sebelumnya positif mengandung senyawa yang memiliki potensi sebagai antibakteri yaitu alkaloid, steroid, saponin dan tanin. Lee et al (2013) menyatakan bahwa tanin dan flavanoid berpotensi menghambat pertumbuhan biofilm karena dapat menghambat intercellular adhesion genes icaA dan icaD. Gen ini dapat mensintesis Polysaccharide Intercellular Adhesion (PIA) yang mempunyai peranan penting dalam agregasi sel dan pembentukan EPS dalam pembentukan biofilm pada bakteri Staphylococcus Aureus (Archer et al. 2011). Ekstrak metanol dari Terminalia catappa yang kaya akan tanin dan kemungkinan tercampur dengan senyawa polifenol terdeteksi mampu menghambat QS dengan mengontrol produksi pigmen violacein pada Chromobacterium violaceum (Taganna et al. 2011). Oleh sebab itu dengan adanya kandungan tanin dan flavonoid dalam ekstrak melinjo diduga dapat menghambat pertumbuhan biofilm melalui aktivitasnya sebagai antibakteri, mengontrol QS dan kemampuannya menghambat pembentukan EPS dengan menghambat pembentukan gen penyandi PIA. Shafei et al (2014) menunjukkan bahwa penggunaan ekstrak n-butanol Cyclamen coum yang mengandung saponin sebesar 156µg/mL mampu menghambat QS P. aeruginosa yang menyebabkan biofilm terdispersi atau terlepas dari biofilm menjadi sel planktonik dan antimikroba Ciprofloxacin bekerja menghilangkan sel bebas tersebut. Meskipun hasil ini berdasarkan pada analisis menggunakan ekstrak tanpa fraksinasi, tetapi dapat menjadi langkah awal pengembangan antibiofilm baru yang mengkombinasikan senyawa metabolit sekunder dengan antibiotik konvensional.
Degradasi Biofilm Ekstrak Daun pepaya
Ketika tahap perkembangan biofilm tidak dihambat, maka biofilm yang terbentuk semakin banyak dan membentuk struktur tiga dimensi yang mengandung sel-sel terselubung dalam beberapa kelompok yang saling terhubung satu sama lainnya. Sel-sel dalam biofilm "dilem" oleh EPS, yang menolak stres mekanik dan pelepasan koloni dari permukaan substrat (Renner and Weibel 2011). Perkembangan struktur biofilm mengakibatkan terjadinya dispersi sel sehingga sel-sel tersebut berpindah dan membentuk biofilm yang baru. Pada tahapan inilah yang diduga menjadi awal mula dari infeksi oleh bakteri biofilm. Oleh sebab itu, sebelum terjadinya dispersi sel, maka biofilm tersebut harus dikendalikan. Salah satunya adalah dengan mendegradasi struktur EPS yang menyelubungi biofilm tersebut.
Kemampuan degradasi biofilm terkait dengan kemampuan penetrasi senyawa ke dalam biofilm yang terbentuk, yakni mampu berpenetrasi pada lapisan EPS atau lapisan lendir yang menyelubungi bakteri. Banyak agen-agen antimikroba gagal menembus biofilm karena EPS yang bertindak sebagai penghalang melindungi sel-sel bakteri yang ada di dalam. Oleh sebab itu, yang menjadi alternatif adalah senyawa yang mampu mendegradasi biofim dengan menghilangkan EPS pada biofilm yang sudah terbentuk (Ardani et al. 2010).
24
biofilm disperant yang merusak matriks ekstraseluler, kemudian berpenetrasi kedalam biofilm. NaOCl memiliki aktivitas antimikroba dengan waktu kontak singkat. semakin tinggi konsentrasi NaOCl sifat antibakterinya makin efektif, akan tetapi bersifat iritan terhadap jaringan (Walton dan Torabinejad. 2009).
Enzim telah terbukti efektif untuk degradasi EPS biofilm. Enzim menghapus biofilm langsung dengan mekanisme menghancurkan integritas fisik EPS dengan cara melemahkan struktur protein, karbohidrat dan lemak yakni mengikat dan terjadinya hidrolisis molekul protein dan mengubahnya menjadi unit yang lebih kecil yang dapat diangkut melalui sel membran dan kemudian dapat dimetabolisme.
Dari hasil penelitian, ekstrak daun pepaya mampu mendegradasi biofilm sebesar 49.029% pada konsentrasi 25% pada suhu 37.5 °C dengan waktu kontak 45 menit. Batang, daun, dan buah pepaya muda mengandung getah berwarna putih. Getah ini mengandung suatu enzim pemecah protein atau enzim proteolitik yang disebut papain (Moehd 1999) dalam Hutabarat (2015). Papain merupakan enzim proteolitik, yaitu enzim yang dapat mengurai dan memecah protein (Nurhidayati 2003). Enzim yang terkandung dalam daun pepaya inilah yang diduga berperan penting dalam mendegradasi lapisan EPS pada biofilm yang terbentuk.
Penggunaan enzim protease sebagai agen pendegradasi biofilm juga diteliti oleh Vineeta et al (2015). Pada penelitian tersebut, enzim protease, amylase dan pectinase yang dihasilkan dari fermentasi Aspergillus clavatus MTCC1323 terbukti memiliki potensi sebagai antibiofilm dalam hal ini mendegradasi biofilm bakteri Pseudomonas aeruginosa, Bacillus subtilis dan Staphylococcus aureus. Aktivitas spesifik enzim maksimum yang diperoleh sampai 10.0, 8.0, dan 10.086 U/mg berturut-turut untuk protease, amylase dan pectinase setelah 7 hari inkubasi pada suhu 27°C. penelitian tentang aktivitas enzim protease dalam mendegradasi lapisan EPS juga telah diteliti oleh Molobela et al. (2010) terhadap Pseudomonas fluorescens. Ledder et al. (2008) juga menemukan protease efektif untuk menghilangkan biofilm A. naeslundii dan F. nucleatum.
25
5
SIMPULAN DAN SARAN
Simpulan
Ekstrak daun pepaya dan daun singkong yang secara kualitatif mengandung alkaloid, tanin, steroid, dan flavonoid. Ekstrak daun melinjo mengandung saponin, alkaloid tanin dan steroid. Ekstrak daun pepaya menunjukkan aktivitas antibakteri dengan respon hambatan yang kuat, sedangkan ekstrak daun singkong dan daun pepaya respon hambatannya lemah. Ekstrak daun pepaya lebih efektif dalam menghambat perlekatan sel dan mendegradasi biofilm yang telah terbentuk. Daun melinjo lebih efektif dalam menghambat pertumbuhan biofilm. Persen penghambatan perlekatan yang paling besar yaitu sebesar 41.176% pada konsentrasi 25%, suhu 37.5 °C dengan waktu kontak 45 menit. Persen penghambatan pertumbuhan yang paling besar yaitu sebesar 47.154% pada konsentrasi 25%, suhu 50 °C dengan waktu kontak 3 hari. Persen degradasi yang paling besar yaitu sebesar 49.02% pada suhu 37.5 °C, waktu kontak 45 menit dengan konsentrasi 25% (v/v).
Saran
26
DAFTAR PUSTAKA
Adinarayana K, Ellaiah P. 2002. Response surface optimization of the critical medium components for the production of alkaline protease by a newly isolated Bacillus sp. J Pharm Sci Tech. 5(3) : 272-278.
Adonizio A, Kong KF, Mathee K. 2008. Inhibition of quorum sensing-controlled virulence factor production in Pseudomonas aeruginosa by South Florida plant extracts. Antimicrobial Agents and Chemotherapy 52(1) : 198-203. Agnol RD, Ferraz A, Bernardi AP, Albring D, Nor C, Sarmento L, Lamb L. 2003.
Antimicrobial Activity of Some Hypericum species. Brazil: TANAC SA. Archer NK, MazaitisMK, Costerton JW, Leid JG, Powers ME, Shirtliff ME.
2011. Staphylococcus aureus biofilms: Properties, regulation, and roles in human disease. Virulence 2: 445–459
Ardani M, Pratiwi, SUT, Hertiani T. 2010. Efek Campuran Minyak Atsiri Daun Cengkeh dan Kulit Batang Kayu Manis sebagai Antiplak Gigi, Majalah Farmasi Indonesia. 21(3) : 191-201.
Borlee BR, Goldman AD, Murakami K, Samudrala R, Wozniak DJ, Parsek MR. 2010. Mol Microbiol. 75(4) : 827
Didik Wahyudi. 2010. Penghambatan Quorum Sensing pada Pseudomonas aeruginosa oleh Ekstrak Alpinia galanga l [Tesis]. Surakarta (ID). Universitas Sebelas Maret
Donlan RM, Costeron JW. 2002. Survival mechanism of clinically relevant microorganism. Clin Mikroba Rev 15:167-193.
Ervina N. 2014. Uji aktivitas ekstrak etanol daun singkong (Manihot utilissima Pohl) sebagai larvasida Aedes aegypti. Naskah publikasi Universitas Tanjungpura
Gunawan, IWA. 2009. Potensi buah pare (Momordica charantia l) sebagai antibakteri salmonella typhimurium. Universitas Mahasaraswati Denpasar Gomashe AV, Sharma AA, Kasukar A. 2014. Investigation of biofilm inhibition
activity and antibacterial activity of Psidium guajava plant ekstrak against streptococcus mutans causing dental plaque. Int J Microbiol App Sci 3(9):335-35
Harmely F, Wilda, Aldi Y. 2014. Formulasi gel ekstrak propolis dari sarang lebah trigona itama (cockrell) dan aktivitas antibakteri terhadap Staphylococcus epidermidis. Prosiding Seminar Nasional dan Workshop “Perkembangan Terkini Sains Farmasi dan Klinik IV”.
Hashimoto H. 2001. Evaluation of the anti-biofilm effect of a new antibacterial
silver citrate ⁄ lecithin coating in an in vitro experimental system using a modified robins device. Kansenshogaku Zasshi 75: 678–685.
Hutabarat GM, Rachmawati D, Pinandoyo. 2015. Performa pertumbuhan benih lobster air tawar (cherax quadricarinatus) melalui penambahan enzim papain dalam pakan buatan. J Aquacul Man Tech. 4 (1): 10-18
Jagani S, Chelikani R, Kim D. 2009. Effect of phenol and natural phenolic compounds on biofilm formation by Pseudomonas aeuginosa. Biofouling 25 (4): 321-324
27 Karatan E, Watnick P. 2009. Signals, regulatory networks, and materials that
build and break bacterial biofilms. Microbiol Molec Biol Rev. 73: 310-347 Ledder RG, Timperley AS, Friswell MK, MacFarlane S, McBain AJ. 2008.
Coaggregation between and among human intestinal and oral bacteria. FEMS Microb Ecol. 66: 630-636.
Lee, JH, Park JH, Cho HS, Joo SW, Cho MH, Lee J. 2013. Anti-biofilm activities of quercetin and tannic acid against Staphylococcus aureus. Biofouling. 29(5): 491-499.
Lestari. 2013. Pengawetan telur dengan perendaman ekstrak daun melinjo (Gnetum gnemon linn) [Tesis]. Makassar (ID): Universitas Hasanuddin.. Mansouri S, Safa A, Najar SG, Najar AG. 2013. Inhibitory activity of Iranian
plant extracts on growth and biofilm formation by Pseudomonas aeruginosa. Malay J Microbiol. 9(2). 176-183
Marlina. 2005. Skrinning Fitokimia dan Analisis Kromatografi Lapis Tipis Komponen Kimia Buah Labu Siam (Sechium Edule Jacq.Swartz.) dalam Ekstrak Etanol. Biofarmasi 3(1): 26-31
Masniari P, Praptiwi. 2010. Uji aktivitas antibakteri ekstrak kulit buah manggis (Gardnia mangostana Linn). Media Litbang Kes. 20(2): 65-69
Milind P, Gurditta. 2011. Basketful Benefits of Papaya. IRJP, 2(7): 6-12.
Molobela IP, Cloete TE, Beukes M. 2010. Protease and amylase enzymes for biofilm removal and degradation of extracellular polymeric substances (EPS) produced by Pseudomonas fluorescens bacteria. Afr J Microbiol Res 4(14) : 1515-1524
Mulyadi M, Wuryanti, Purbowatiningrum RS. 2013. Konsentrasi hambat minimum (KHM) kadar sampel Alang-alang (Imperata cylindrical) dalam etanol melalui metode difusi cakram. Chem Info. 1(1): 35-42
Nitisapto M., Siradz SA. 2005. Evaluasi Kesesuaian Lahan untuk Pengembangan Jahe pada Beberapa Daerah di Jawa Tengah dan Jawa Timur. J Tanah Lingk, 5(2): 15-19.
Nurhidayati, Tutik. Pengaruh konsentrasi enzim papain dan suhu fermentasi terhadap kualitas keju cottage. KAPPA 4 (1): 13-17.
Ofek I, Hasty DL, Sharon N. 2003. Anti-adhesion therapy of bacterial diseases: prospects and problems. FEMS Immunol Med Microbiol 38: 181–191. Power PM and Jennings MP. 2003. The genetics of glycosylation in
Gram-negative bacteria. FEMS Microbiol Lett. 218(2): 211-222.
Raissi, S., and Farzani, R.E. 2009. Statistical process optimization through multi-response surface methodology. WAS Engin Tech. 3: 267–271.
Renner LD, Weibel, Douglas B. 2011. Physicochemical regulation of biofilm formation. MRS Bull. 36(5): 347–355
Retnowati Y, Bialangi N , Posangi NW. 2011. Pertumbuhan bakteri staphylococcus aureus pada media yang diekspos dengan infus daun sambiloto (Andrographis paniculata). Saintek. 6(2):1-9.
Ristyana IP. 2013. Skrining fitokimia dan aktivitas antioksidan ekstrak rumput laut sargassum duplicatum dan turbinaria ornata dari jepara [Tesis]. Semarang (ID). Universitas Diponegoro Semarang.