DETEKSI RESIDU TETRASIKLIN PADA KEJU
YANG DIIMPOR MELALUI PELABUHAN
TANJUNG PRIOK, JAKARTA
AI SRIMULYATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Deteksi Residu Tetrasiklin pada Keju yang Diimpor melalui Pelabuhan Tanjung Priok, Jakarta adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
AI SRIMULYATI. Deteksi Residu Tetrasiklin pada Keju yang Diimpor melalui Pelabuhan Tanjung Priok, Jakarta. Dibimbing oleh TRIOSO PURNAWARMAN dan HADRI LATIF.
Tetrasiklin banyak digunakan di peternakan baik untuk pencegahan dan pengobatan penyakit maupun sebagai pemacu pertumbuhan. Administrasi yang tidak benar dapat mengakibatkan residu antibiotik pada susu dan produknya termasuk keju serta dapat berkontribusi terhadap perkembangan resistensi mikroba terhadap obat, penyebaran bakteri resisten, serta berdampak serius terhadap kesehatan konsumen. Penelitian ini bertujuan mendeteksi keberadaan residu tetrasiklin pada keju yang diimpor melalui Pelabuhan Tanjung Priok, Jakarta selama bulan Januari sampai Maret 2015.
Kajian yang digunakan pada penelitian ini adalah kajian lintas seksional.
Besaran sampel sebanyak 51 dihitung dengan menggunakan formula n = [1-(1-a)1/D] [N-(D-1)/2] dengan keterangan N = jumlah populasi, n = ukuran
sampel, a = tingkat kepercayaan (95%) dan D = nilai dugaan populasi positif (13.33%). Deteksi residu tetrasiklin pada keju impor dilaksanakan dengan menggunakan dua metode uji yakni competitive enzyme-linked immunosorbent assay (ELISA) dan bioassay. Kedua pengujian tersebut dilakukan secara pararel. Data dari penelitian ini dianalisa secara deskriptif.
Hasil analisis dengan metode ELISA kompetitif menunjukkan tujuh dari 51 (13.7%) sampel yang diuji mengandung residu tetrasiklin dengan konsentrasi 2.47-11.99 ppb. Hasil analisis dengan metode bioassay menunjukkan 11 dari 51 (21.6%) sampel yang diuji mengandung residu tetrasiklin. Kisaran konsentrasi yang didapat dari hasil pengujian ELISA menunjukkan bahwa konsentrasi residu dalam sampel keju impor berada jauh di bawah BMR yang ditetapkan oleh Standar Nasional Indonesia 01-6366-2000 (50 ppb) dan Codex Alimentarius Commission (100 ppb). Hasil penelitian menunjukkan bahwa surveilans terhadap berbagai residu antibiotik pada keju impor perlu dilakukan secara rutin demi menjamin perlindungan kesehatan konsumen.
SUMMARY
AI SRIMULYATI. Tetracycline Residue Detection on Cheese Imported through Tanjung Priok Seaport, Jakarta. Supervised by TRIOSO PURNAWARMAN and HADRI LATIF.
Tetracyclines is widely used in animal husbandry for both of prevention and treatment of diseases and as growth promotion. Improper administration can result antibiotic residues in milk and dairy products such as cheese and can contribute to the development of microbial drug resistance and the spread of the resistant bacteria, including those with serious health consequences in consumer. The aim of this study is to determine the presence of tetracycline in imported cheese. A total of 51 imported cheese samples was collected at Tanjung Priok Seaport, Jakarta from January to March of 2015.
The study used in this research was a cross-sectional study. To determine the presence of tetracycline residues in the imported cheese, a total of 51 imported cheese samples were calculated using the formula of n = [1-(1-a)1/D] [N-(D-1)/2] with a description of N = total population, n = size sample, a = level of confidence (95%) and D = the estimated value of the positive population (13.33%). Competitive enzyme-linked immunosorbent assay (ELISA) and bioassay methods used parallelly for tetracycline determination. Datas regarding the proportion of antibiotic positive samples were analyzed descriptively.
The result showed that 7 out of 51 (13.7%) samples analyzed by competitive ELISA contained tetracycline residue. The result also showed that 11 out of 51 (21.6%) samples analyzed by bioassay contained tetracycline residue. The concentration of tetracycline residues in samples were found in the range of 2.47-11.99 ppb. None of the samples analyzed showed the presence of tetracycline residues above the maximum residue limits (MRLs) established by National Standardization Agency of Indonesia and Codex Alimentarius Commission (CAC).
The results demonstrate that the regularly surveillance study of various antimicrobial residues in cheeses need to be done to ensure safety, quality, and to protect the health of the Indonesian consumer.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Kesehatan Masyarakat Veteriner
DETEKSI RESIDU TETRASIKLIN PADA KEJU
YANG DIIMPOR MELALUI PELABUHAN
TANJUNG PRIOK, JAKARTA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Deteksi Residu Tetrasiklin pada Keju yang Diimpor melalui Pelabuhan Tanjung Priok, Jakarta
Nama : Ai Srimulyati NIM : B251130031
Disetujui oleh Komisi Pembimbing
Dr Drh Trioso Purnawarman, MSi Ketua
Dr med vet Drh Hadri Latif, MSi Anggota
Diketahui oleh
Ketua Program Studi
Kesehatan Masyarakat Veteriner
Dr med vet Drh Denny Widaya Lukman, MSi
Dekan Sekolah Pascasarjana IPB
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan November 2014 ini ialah residu antibiotik pada keju sebagai produk susu olahan, dengan judul Deteksi Residu Tetrasiklin pada Keju yang Diimpor melalui Pelabuhan Tanjung Priok, Jakarta.
Terima kasih penulis ucapkan kepada Bapak Dr Drh Trioso Purnawarman, MSi dan Bapak Dr med vet Drh Hadri Latif, MSi selaku dosen pembimbing serta Prof Dr Drh Mirnawati B. Sudarwanto sebagai dosen penguji luar komisi. Ucapan terima kasih dan penghargaan juga penulis sampaikan kepada Dr Drh Yusuf Ridwan, MSi selaku Ketua Departemen Ilmu Penyakit Hewan dan Kesmavet FKH-IPB dan Dr med vet Drh Denny Widaya Lukman, MSi sebagai Ketua Program Studi Kesehatan Masyarakat Veteriner FKH-IPB beserta seluruh staf.
Selanjutnya, penghargaan juga penulis sampaikan kepada Badan Penyuluhan dan Pengembangan Sumberdaya Manusia (BP2SDM) Kementerian Pertanian yang telah memberikan beasiswa serta kepada Bapak Drh Sriyanto, MSi PhD sebagai Kepala Bidang Karantina Hewan beserta seluruh staf Laboratorium Karantina Hewan Balai Besar Karantina Pertanian Tanjung Priok yang telah membantu selama pengumpulan data dan sampel serta pengujian laboratorium. Ucapan terima kasih juga penulis haturkan untuk rekan-rekan mahasiswa pascasarjana S2 dan S3 KMV angkatan 2012, 2013 dan 2014 baik program khusus maupun reguler yang telah bersama-sama dalam menempuh pendidikan di kampus FKH IPB tercinta.
Ungkapan terima kasih juga disampaikan kepada ayahanda H. Aminin, SPdI dan ibunda Hj. Ade Suhaebah, suami terkasih H. Suharyanto, ST, ananda Muhammad Alvaro Calief, serta kakak-kakak dan adik-adik tersayang atas segala do’a, kasih sayang dan dorongannya.
Semoga karya ilmiah ini bermanfaat. Aamiin.
DAFTAR ISI
Tetrasiklin dan Penggunaannya di Peternakan
Residu Tetrasiklin dan Dampaknya terhadap Kesehatan Masyarakat Metode Pengujian Residu Tetrasiklin pada Pangan
ELISA
4 HASIL DAN PEMBAHASAN 11
DAFTAR TABEL
1 Drug withdrawal times untuk tetrasiklin 5 2 Jenis dan besaran sampel keju impor yang diambil sebagai obyek
penelitian 11
3 Hasil pengujian residu tetrasiklin pada keju impor dengan metode
ELISA kompetitif 12
4 Hasil pengujian residu tetrasiklin pada keju impor dengan metode
bioassay 13
5 Hasil pengujian residu tetrasiklin pada keju impor dengan metode ELISA
kompetitif dan bioassay 14
DAFTAR GAMBAR
1 Contoh hasil pengujian residu antibiotik pada sampel keju impor 10 2 Kurva standar ELISA untuk residu tetrasiklin 12 3 Kurva baku bioassay untuk residu tetrasiklin 13
DAFTAR LAMPIRAN
1 Hasil pengujian terhadap seluruh sampel keju impor dengan metode
1
PENDAHULUAN
Latar Belakang
Susu merupakan pangan asal hewan yang memiliki aktivitas air yang tinggi sehingga mudah rusak jika tidak diawetkan (Zanella et al. 2010; MacDonald et al. 2011; Jeppu et al. 2015). Pembuatan keju ditujukan untuk memperpanjang umur simpan dan melestarikan komponen bergizi susu (Samelis et al. 2009; MacDonald et al. 2011). Keju mulai dibuat sekitar 80000 tahun yang lalu. Hingga kini ada lebih dari 1 000 varietas keju di seluruh dunia. Pengolahan keju melibatkan kombinasi empat bahan utama yakni susu, rennet, mikroorganisme dan garam (Beresford et al. 2001; Yang 2001; Mari et al. 2014).
Keju diproses melalui beberapa langkah umum seperti pembentukan gel, pemisahan whey, produksi asam dan penambahan garam, diikuti dengan periode pematangan. Variasi campuran bahan dan pengolahan menyebabkan evolusi varietas keju. Variasi parameter pengolahan seperti suhu pemasakan dan teknik penanganan dadih berperan dalam menentukan karakteristik setiap jenis keju, sedangkan mikroflora keju berperan penting dalam pengembangan karakteristik unik masing-masing varietas keju (Beresford et al. 2001; Morandi & Brasca 2012; Aydemir et al. 2015).
Kapasitas produksi keju dalam negeri yang tidak sebanding dengan peningkatan kebutuhan konsumsi masyarakat mendorong pemerintah untuk melakukan kebijakan importasi keju. Indonesia melakukan importasi keju dari berbagai negara di antaranya Selandia Baru, Australia, Amerika Serikat, Filipina, Belanda, Perancis, Argentina, Singapura, Denmark, Italia, Belgia, Malaysia, dan Jerman (BBKPTP 2014).
Besarnya volume dan tingginya frekuensi impor keju memerlukan pengawasan terhadap keberadaan residu antibiotik sebagai bahan berbahaya bagi konsumen. Penggunaan antibiotik tanpa memperhatikan waktu henti obat atau farmakokinetika obat kemungkinan besar akan mengakibatkan hadirnya residu antibiotik tersebut pada pangan asal hewan dan juga produk olahannya (Latif 2004; Agwuh & MacGowan 2006; Nagel et al. 2009).
Salah satu golongan antibiotik yang sering digunakan pada peternakan sapi perah adalah tetrasiklin (Adetunji 2011; Abou-Raya et al. 2013, Kellnerová et al. 2014). Selama pertengahan tahun 1990-an, perkiraan jumlah penggunaan tetrasiklin pada peternakan di Selandia Baru, Amerika Serikat, dan Australia berturut-turut sebesar 2 311, 77 619, dan 3 488 000 kg/tahun (sebagai agen terapeutik dan subterapeutik), sedangkan di Eropa sebesar 2 294 000 kg/tahun sebagai agen terapeutik saja (Chopra & Roberts 2001).
2
Menurut Adetunji (2011), residu tetrasiklin hadir dengan konsentrasi berbeda pada berbagai tahap pengolahan keju, dan tahap pengolahan keju tidak sepenuhnya menghilangkan residu tetrasiklin meskipun telah mengalami berbagai perlakuan. Hadirnya residu tetrasiklin pada pangan asal hewan berbahaya bagi konsumen karena dapat menimbulkan masalah kesehatan (Kellnerová et al. 2014; Ahmed et al. 2015).
Belum ada laporan mengenai konsentrasi residu tetrasiklin pada keju impor di Indonesia sehingga penelitian ini merupakan yang pertama kalinya dilakukan. Pengujian residu tetrasiklin padakeju impor perlu dilaksanakan dalam rangka pengawasan keamanan bahan pangan sebagaimana termaktub pada Undang-undang Nomor 18 Tahun 2012 tentang Pangan, karena berpotensi menyebabkan gangguan kesehatan bagi konsumen.
Tujuan Penelitian
Penelitian ini bertujuan mendeteksi keberadaan residu tetrasiklin padakeju yang diimpor melalui Pelabuhan Tanjung Priok, Jakarta serta untuk menyediakan data dan informasi ilmiah untuk Badan Karantina Pertanian dalam rangka menetapkan kebijakan pengujian residu tetrasiklin pada keju impor.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan data dan informasi mengenai keberadaan residu tetrasiklin pada keju impor sehingga dapat menjadi bahan pertimbangan dalam perumusan maupun penyempurnaan regulasi yang berkaitan dengan importasi keju.
2
TINJAUAN PUSTAKA
Keju
Keju adalah produk olahan susu yang dimatangkan atau tidak dimatangkan; bertekstur lembut, semi-keras, keras atau ekstra-keras; yang dapat dilapisi oleh pelapis lilin. Keju dapat diperoleh dengan cara mengentalkan seluruhnya atau sebagian protein susu, susu skim, sebagian susu skim, krim, whey krim atau buttermilk atau kombinasi dari bahan ini, melalui aksi rennet atau agen koagulasi lain yang sesuai dan dengan cara mengeringkan sebagian whey yang dihasilkan dari koagulasi. Keju juga dapat dihasilkan dengan teknik pengolahan yang melibatkan koagulasi protein susu dan/atau produk yang dihasilkan dari susu yang memberikan produk akhir dengan fisik, kimia dan organoleptik yang diinginkan (Beresford et al. 2001; FAO & WHO 2010).
3 berikut ini: a) proteolisis terbatas menggunakan enzim (rennet); b) pengasaman dengan menambahkan asam atau kultur starter; dan c) pengasaman dikombinasikan dengan pemanasan sampai dengan suhu sekitar 90 °C (Fox & McSweeney 2004; Henning et al. 2006). Mayoritas keju yang diproduksi dengan koagulasi enzimatik, secara tradisional menggunakan rennet dari perut sapi muda, anak sapi, domba, dan kerbau (Fox & McSweeney 2004; Marie et al. 2014).
Tetrasiklin dan Penggunaannya di Peternakan
Menurut Blasco et al. (2009), grup tetrasiklin beranggotakan beberapa antibiotik spektrum luas dengan fitur antimikroba yang sama, tetapi agak berbeda satu sama lain dalam hal spektrum dan disposisi farmakokinetik. Ada 3 tetrasiklin alami (oksitetrasiklin, klortetrasiklin dan dimetilklortetrasiklin) dan beberapa merupakan semisintetis (tetrasiklin, rolitetrasiklin, metasiklin, minosiklin, doksisiklin, limesiklin) (Agwuh & MacGowan 2006; Bogialli et al. 2007). Waktu eliminasi menghasilkan klasifikasi sebagai short-acting (tetrasiklin, oksitetrasiklin, klortetrasiklin), intermediate-acting (dimetilklortetrasiklin dan metasiklin) dan long-acting (minosiklin dan doksisiklin) (Chopra & Roberts 2001).
Seluruh turunan tetrasiklin berbentuk kristal dan berwarna kekuningan. Tetrasiklin merupakan zat amfoterik yang dalam larutan air membentuk garam baik dengan asam maupun basa. Karakteristik tetrasiklin berpendar bila terkena sinar ultraviolet. Bentuk garam yang paling umum adalah hidroklorida, kecuali doksisiklin yang tersedia sebagai doksisiklin hiklat. Tetrasiklin stabil sebagai bubuk kering namun tidak stabil sebagai larutan air, terutama pada rentang pH yang lebih tinggi (7.0-8.5). Tetrasiklin membentuk ikatan yang larut dengan kation bivalen dan trivalen terutama kalsium, magnesium, aluminium dan besi. Doksisiklin dan minosiklin menunjukkan kelarutan terhadap lemak terbesar dan penetrasi yang lebih baik terhadap bakteri seperti Staphylococcus aureus daripada kelompok tetrasiklin yang lain (Grenier et al. 2000; Chopra & Roberts 2001; TMVM 2012).
Tetrasiklin merupakan antibiotik spektrum luas yang efektif melawan bakteri aerobik, anaerobik, Gram positif, Gram negatif, mikoplasma, riketsia, klamidia dan bahkan beberapa protozoa (amoeba) (Bogialli et al. 2007; Mohammed-Ali 2012). Beberapa strain yang resisten terhadap tetrasiklin diantaranya Pseudomonas aeruginosa, Proteus, Serratia, Klebsiella, Arcanobacterium spp, dan Escherichia coli patogen (Chopra & Roberts 2001; Flórez et al. 2008). Pada umumnya terdapat resistensi silang antara anggota tetrasiklin, namun doksisiklin dan minosiklin biasanya lebih efektif terhadap stafilokokus (Blasco et al. 2009).
4
secara umum bermanfaat karena secara tidak langsung berpengaruh terhadap pertumbuhan mikroorganisme perusak zat-zat gizi dalam pakan dan merangsang pertumbuhan mikroorganisme pembentuk asam amino (Yuningsih 2005; Fernandes et al. 2014).
Ada beberapa hal yang menjadi perhatian berkaitan dengan penggunaan antibiotik pada produksi ternak. Pertama, residu antibiotik pada pangan asal hewan dapat terjadi pada tingkat yang tidak dapat diterima sehingga menimbulkan potensi efek toksik bagi individu yang rentan. Kedua, antibiotik yang digunakan secara luas dalam industri peternakan dapat berkontribusi terhadap berkembangnya resistensi bakteri terhadap obat (O’Keefe et al. 2001; Fernandes et al. 2014). Ketiga, hadirnya residu tetrasiklin pada susu sebagai bahan baku pengolahan keju dapat mengganggu proses fermentasi oleh kultur starter yang digunakan (Beltran et al. 2014). Dilaporkan bahwa 0.3 mg/ml tetrasiklin telah terbukti mampu memodifikasi sifat organoleptik keju Edam dan 0.7 mg/ml tetrasiklin telah terbukti mampu memodifikasi sifat organoleptik keju Emmenthal (Nagel et al. 2009).
Residu Tetrasiklin dan Dampaknya terhadap Kesehatan Masyarakat
Residu antibiotik didefinisikan sebagai seluruh bahan aktif atau metabolitnya yang tetap hadir dalam bahan makanan yang bersumber dari hewan yang telah diberikan produk obat. Peraturan Dewan dan Parlemen Eropa Nomor 470/2009 mendefinisikan residu antibiotik sebagai seluruh zat farmakologi aktif, baik bahan aktif, bahan pembantu maupun produk turunan dan metabolitnya, yang tetap hadir dalam makanan asal hewan (EC 1981). Menurut O’Keefe et al. (2001), ditemukannya residu antibiotik pada pangan asal hewan dengan kadar di atas batas maksimum residu mengindikasikan diperlukannya praktek yang baik di dalam penggunaan obat hewan.
Masalah kesehatan masyarakat yang mungkin timbul akibat asupan tetrasiklin secara terus-menerus termasuk reaksi alergi pada individu sensitif, toksisitas dan efek karsinogenik. Gagalnya pengobatan akibat resistensi, gangguan jumlah mikroba saluran pencernaan, superinfeksi oleh patogen tidak rentan seperti kapang, khamir dan bakteri resisten mungkin terjadi ketika tetrasiklin digunakan. Hal ini dapat menyebabkan gangguan gastrointestin setelah administrasi baik per oral atau parenteral atau infeksi persisten ketika tetrasiklin digunakan secara topikal (Bogialli et al. 2007; Blasco et al. 2009).
5 Codex Alimentarius Comission (CAC 2011) menetapkan batas maksimum residu untuk tetrasiklin pada susu adalah 100 ppb sedangkan menurut Standar Nasional Indonesia (SNI) 01-6366-2000 batas maksimum residu untuk tetrasiklin pada susu adalah 50 ppb (BSN 2000). Regulasi mengenai waktu henti obat (drug withdrawal times) tetrasiklin untuk pangan asal hewan atau waktu penyingkiran susu (milk discard times) disajikan pada Tabel 1.
Tabel 1 Drug withdrawal times untuk tetrasiklin (TMVM 2012)
Jenis tetrasiklin Spesies Withdrawal times (hari) Oksitetrasiklina
Bukan untuk digunakan pada sapi perah laktasi
Metode Pengujian Residu Tetrasiklin pada Pangan
Metode pengujian residu antibiotik dapat dikelompokkan menjadi empat kategori utama: pendekatan mikrobiologi berdasarkan hambatan pertumbuhan bakteri (tube test, single-plate assay dan multi-plate assay); biosensor (imunosensor berdasarkan penggunaan elemen transduksi yang berbeda termasuk transduksi elektrokimia, transduksi optik dan transduksi massa); teknik imunokimia (enzyme-based immunoassay/EIA misalnya enzyme-linked immunosorbent assay/ELISA, fluorescence-polarization immunoassay/FPIA); dan kromatografi (kertas, gas, cair, lapis tipis). Metode-metode tersebut memiliki variasi dalam kehandalan, kecepatan dalam memperoleh hasil dan biaya analisis (Bogialli et al. 2007; Kantiani et al. 2009; Mohammed-Ali 2012).
ELISA
ELISA adalah uji biokimiawi yang menggunakan antibodi dan perubahan warna berperantara enzim untuk mendeteksi kehadiran baik antigen (protein, peptida, hormon) maupun antibodi dalam sampel yang diberikan. ELISA memungkinkan deteksi antigen atau antibodi dengan konsentrasi yang sangat rendah. Metode ELISA kompetitif dapat mendeteksi perbedaan komposisi dalam campuran antigen kompleks dengan sensitivitas tinggi, serta dapat mendeteksi antibodi tertentu yang hadir dalam jumlah yang relatif kecil. ELISA merupakan kit yang murah dan ideal digunakan untuk skrining terhadap populasi yang besar dan dengan sumber daya yang terbatas (Zhang et al. 2007; Kantiani et al. 2009; Gan & Patel 2013).
Bioassay
6
hewan dengan konsentrasi sama atau di bawah batas maksimum residu, meskipun beberapa antibiotik terdeteksi pada tingkat yang lebih tinggi dari batas maksimum residu (Gaudin et al. 2010; Myllyniemi 2004).
3
METODE PENELITIAN
Tempat dan Waktu Penelitian
Pengambilan sampel dilaksanakan di tempat pemasukan Pelabuhan Tanjung Priok, Jakarta mulai bulan Januari sampai Maret 2015. Pengujian dilaksanakan pada bulan April 2015 di laboratorium Karantina Hewan Balai Besar Karantina Pertanian Tanjung Priok, Jakarta.
Alat dan Bahan
Alat dan bahan yang digunakan dalam pengujian ELISA adalah kit ELISA untuk tetrasiklin (Ridascreen® Tetracyclin Art. No R3505), trichloacetic acid (TCA) 3%, natrium hidroksida (NaOH), larutan substrat kromagen, microplate well polystyrene, sentrifus, vortex, pipet pasteur, pipet graduate, mikropipet 20-200 µl dan 200-1000 µl serta ELISA reader (RIDA® SOFT Win Art. No Z9999).
Bahan yang digunakan dalam pengujian bioassay adalah mikroorganisme (spora Bacillus cereus ATCC 11778), peptone (Difco 211677), yeast extract (Difco 212750), bacto agar (Difco 214010), beef extract, Oksitetrasiklin hidroklorida, KH2PO4 (Kalium dihidrogen fosfat, Merck 1.047831.000), Na2HPO4
(Dinatrium fosfat, Merck 1.065860.500), aquadest, dan kertas cakram steril (diameter 6 mm). Peralatan yang diperlukan adalah cawan petri, tabung reaksi, tabung sentrifus, labu ukur, gelas ukur, pipet pasteur, pengocok tabung, magnet pengaduk, pH meter, mikro pipet, jangka sorong, ose dan pinset.
Rancangan Penelitian
Kajian yang digunakan pada penelitian ini adalah kajian lintas seksional. Pengambilan sampel dilakukan dengan cara mengumpulkan sampel keju secara acak sederhana di tempat pemasukan Pelabuhan Tanjung Priok, Jakarta. Sampel yang diambil adalah seluruh jenis keju yang masuk pada saat dilakukan pengambilan sampel. Volume impor keju dari berbagai negara melalui Pelabuhan Tanjung Priok pada tahun 2014 sebesar 21 177 494 kg dengan frekuensi kedatangan 751 kali. Untuk mengetahui keberadaan residu tetrasiklin pada keju
impor, besaran sampel dihitung dengan menggunakan formula n = [1-(1-a)1/D] [N-(D-1)/2] dengan keterangan N = jumlah populasi, n = ukuran
7 Besaran sampel yang didapat dengan menggunakan perangkat Win Episcope 2.0 adalah sebesar 51 sampel. Nilai dugaan populasi positif didapat dari hasil penelitian Ady (2012) yang menyebutkan bahwa 13.33% sampel susu bubuk yang diimpor melalui Pelabuhan Tanjung Priok mengandung residu tetrasiklin. Unit pengambilan sampel dipilih berdasarkan boks kemasan. Setiap sampel diambil sebanyak 500 g, kemudian dimasukkan ke dalam kantong plastik steril yang telah diberi label kode sampel, negara asal, jenis keju dan tanggal pengambilan.
Deteksi residu tetrasiklin pada keju impor dilaksanakan dengan menggunakan uji tapis (screening test) berupa metode bioassay berdasarkan Standar Nasional Indonesia (SNI) 7424:2008 yang dimodifikasi dalam hal persiapan contohnya, dikombinasikan secara paralel dengan metode enzyme-linked immunosorbent assay (ELISA) kompetitif merujuk pada metode yang dipublikasikan oleh Gaurav et al. (2014). ELISA untuk pengujian residu antibiotik merupakan metode uji tapis kualitatif/kuantitatif yang telah divalidasi dan sesuai dengan kriteria Keputusan Komisi Eropa Nomor 2002/657/EC (Wang et al. 2009).
Metode Pengujian ELISA
Prinsip dasar uji ini adalah reaksi antigen-antibodi. Sumur microtiter terlebih dahulu dilapisi dengan tetrasiklin-protein-konjugat (antigen yang telah dikenal) kemudian ditambahkan standar tetrasiklin atau larutan sampel (antigen yang tidak dikenal/tetrasiklin bebas) dan antibodi anti-tetrasiklin (antibodi primer). Tetrasiklin bebas dan tetrasiklin-protein-konjugat bersaing untuk mengikat antibodi anti-tetrasiklin (kompetitif). Setiap antibodi yang tidak berikatan kemudian dihilangkan. Selanjutnya, antibodi sekunder berlabel enzim ditambahkan ke dalam sumur agar berikatan dengan antibodi primer. Setelah menghilangkan antibodi sekunder yang tidak berikatan, larutan substrat kromagen ditambahkan ke dalam sumur lalu diinkubasi. Ikatan konjugat enzim akan mengubah warna kromagen menjadi biru.
Persiapan Sampel
Sebanyak 15 g keju dimasukkan ke dalam 30 ml metanol 10% kemudian dihomogenkan menggunakan stomacher. Sampel yang telah homogen kemudian dipindahkan ke dalam vial sentrifus 50 ml dan diinkubasi di dalam waterbath bersuhu 40 °C selama 10 menit. Selanjutnya sampel disentrifugasi selama 15 menit dengan kecepatan 3 000 rpm. Sebanyak 1 ml sampel dipindahkan ke dalam vial 1.5 ml kemudian disentrifugasi selama 5 menit dengan kecepatan 2 000 rpm. Bagian supernatan diencerkan 1:10 dalam larutan buffer.
Pengujian Sampel
8
pada tahap pencucian yakni ke dalam sumur dimasukkan 250 µl washing buffer untuk membuang seluruh ikatan molekul padatan yang tidak diperlukan (antibodi primer yang tidak berikatan). Selanjutnya ke dalam sumur dimasukkan enzyme conjugate (antibodi sekunder berlabel enzim) sebanyak 100 µl dan diinkubasi selama 15 menit pada temperatur ruangan agar berikatan dengan antibodi primer. Dilanjutkan pada tahap pencucian yakni ke dalam sumur dimasukkan 250 µl washing buffer untuk membuang seluruh antibodi sekunder yang tidak berikatan. Aktivitas ikatan enzim ditentukan dengan penambahan larutan substrat kromagen (100 µl) lalu diinkubasi selama 15 menit pada temperatur ruangan dalam kondisi gelap. Selama inkubasi enzim mengubah larutan kromagen yang tidak berwarna menjadi berwarna biru, lalu ditambahkan stop reagen (100 µl) untuk menghentikan reaksi.
Pembacaan Hasil
Kandungan tetrasiklin dalam sampel dibaca dengan ELISA Reader. Data diperoleh berdasarkan pembacaan absorbansi sampel atau standar pada ELISA Reader dengan panjang gelombang 450 nm.
Metode Pengujian Bioassay
Prinsip pengujian ini adalah residu antibiotik akan menghambat pertumbuhan mikroorganisme yang ada pada media agar (BSN 2008). Penghambatan dapat dilihat dengan terbentuknya daerah hambatan di sekitar kertas cakram. Pelaksanaan pengujian bioassay terdiri dari beberapa tahap, yaitu: Pembuatan Larutan Dapar
Sebanyak 6.4 g KH2PO4 dan 18.9 g Na2HPO4 ditimbang dan dilarutkan dalam akuabides sampai 1 000 ml. pH larutan diatur hingga menjadi 7.0±0.1 kemudian disterilisasi dengan autoklaf pada suhu 121±1 ºC dengan tekanan 15 pressure square inche/psi selama 15 menit.
Pembuatan Media
Media biakan Bacillus cereus dibuat dengan menimbang peptone 6 g, beef extract 1.5 g, yeast extract 3 g, KH2PO4 1.35 g, bacto agar 15 g dan akuabides 10000 ml. Peptone, beef extract, yeast extract dan KH2PO4 dilarutkan dalam sebagian akuabides, kemudian ditambahkan bacto agar, selanjutnya ditambahkan akuabides hingga volume menjadi 1 000 ml. pH larutan disesuaikan pada 5.7±0.1 selanjutnya dididihkan sampai bacto agar terlarut. Semua media biakan disterilisasi dalam autoklaf pada suhu 121±1 ºC, dengan tekanan 15 psi selama 15 menit.
9 Pembuatan Larutan Stok Baku Pembanding
Sejumlah baku pembanding oksitetrasiklin hidroklorida dilarutkan dalam akuabides hingga diperoleh konsentrasi 1 000 µg/ml.
Pembuatan Larutan Baku Kerja
Sebanyak 2 ml larutan stok baku pembanding diencerkan dengan larutan dapar sampai dengan 20 ml untuk memperoleh larutan baku kerja 100 µg/ml. Selanjutnya dilakukan pengenceran serial hingga diperoleh konsentrasi 1 µ g/ml. Pembuatan Kurva Baku
Sebanyak 1 ml biakan spora dimasukkan ke dalam 100 ml kultur media yang telah dicairkan dengan penangas air hingga temperaturnya mencapai 55±1 ºC. Media yang telah mengandung spora dituang sebanyak 8 ml ke dalam cawan petri steril berukuran 100x12 mm yang telah diberi kode kemudian didiamkan pada suhu kamar hingga membeku. Larutan baku kerja disiapkan dengan variasi konsentrasi 10 µg/ml, 4 µg/ml, 2 µg/ml, 1 µg/ml, 0.5 µg/ml, dan 0.25 µg/ml. Konsentrasi yang digunakan sebagai larutan kurva baku adalah konsentrasi 4 µ g/ml, 2 µ g/ml, 1 µ g/ml, 0.5 µ g/ml, dan 0.25 µg/ml. Masing-masing larutan baku kerja diteteskan pada kertas cakram dan dibiarkan hingga menyerap seluruhnya sebelum diletakkan pada media cawan petri. Diteteskan juga larutan dapar fosfat masing-masing pelarut dari baku kerja sebagai kontrol negatif. Selanjutnya cawan petri ditempatkan pada bidang datar pada suhu kamar selama 1 sampai 2 jam sebelum diinkubasi pada suhu 30±1 ºC selama 16-18 jam.
Diameter daerah hambat diukur dengan menggunakan jangka sorong. Dari luas daerah hambat dibuat kurva yang menyatakan hubungan (linier regresi) antara konsentrasi antibiotik dengan daerah hambatan. Kurva baku digunakan sebagai dasar pengujian untuk memperkirakan konsentrasi residu yang terkandung dalam sampel yang diuji jika terbentuk daerah hambatan.
Persiapan Sampel
Keju sebanyak 10 g dipotong kecil-kecil, kemudian pelarut dapar fosfat ditambahkan sebanyak 20 ml. Larutan tersebut dihomogenkan menggunakan homogenizer, kemudian disentrifus 3 000 rpm selama 10 menit. Supernatan diambil dan siap untuk digunakan sebagai larutan contoh uji.
Pembuatan Spora
Bakteri Bacillus cereus ATCC 11778 ditumbuhkan pada media agar miring dalam botol media (roux’s bottle) sebanyak 100 ml. Bakteri Bacillus cereus ATCC 11778 diinokulasikan ke dalam botol-botol tersebut dengan cara melakukan goresan dengan menggunakan ose, diinkubasi selama satu minggu pada suhu 30 ºC dan diamati pertumbuhannya setiap hari.
10
Suspensi tersebut kemudian dipanaskan kembali dalam penangas air pada suhu 65 ºC selama 30 menit. Kemudian disentrifus dengan kecepatan 1 000 rpm selama 5 menit dan diambil supernatannya. Hasilnya disimpan sebagai suspensi spora dalam refrigerator dengan suhu maksimal 10 ºC.
Pelaksanaan Pengujian
Sebanyak 1 ml suspensi spora dimasukkan ke dalam 100 ml kultur media yang telah dicairkan dengan penangas air hingga temperaturnya mencapai 55±1 ºC. Media yang telah mengandung kuman uji dituang sebanyak 8 ml ke dalam cawan petri steril berukuran 100x12 mm yang telah diberi kode sampel kemudian didiamkan pada suhu kamar hingga membeku.
Tiap cawan petri berisi lima kertas cakram, yang terdiri dari tiga kertas cakram masing-masing ditetesi 75 µl sampel yang akan dianalisa, satu kertas ditetesi 75 µl larutan baku pembanding (tetrasiklin konsentrasi 1 µg/ml) sebagai kontrol positif, dan satu kertas ditetesi larutan dapar fosfat sebagai kontrol negatif (Gambar 1). Kertas cakram dibiarkan menyerap larutan seluruhnya sebelum diletakkan di atas media dalam cawan petri. Cawan petri ditutup dan diinkubasi pada suhu 30±1 ºC selama 16-18 jam. Pengujian sampel dilakukan dengan tiga kali pengulangan untuk mendapatkan data yang akurat sehingga setiap sampel menggunakan tiga cawan petri.
Gambar 1 Contoh hasil pengujian residu antibiotik pada sampel keju impor. A: sampel no 28, B: sampel no 29, C: sampel no 30, K-: kontrol negatif, K+: kontrol positif.
Hasil uji ditentukan dengan mengamati dan mengukur diameter zona hambatan yang terbentuk di sekeliling kertas cakram menggunakan jangka sorong. Untuk memperkirakan konsentrasi residu, luas daerah hambat dimasukkan dalam kurva standar yang dibuat. Konsentrasi antibiotik dalam sampel dapat
A
B
C
K+ K-
11 ditentukan secara semi kuantitatif. Semakin luas zona hambatan di sekitar kertas cakram maka semakin tinggi konsentrasi residu antibiotik dalam sampel.
Analisis Data
Analisis data yang digunakan pada penelitian ini adalah analisis deskriptif dengan menyajikan data dalam bentuk tabel dan gambar untuk menggambarkan residu tetrasiklin. Analisis deskriptif adalah bidang statistik yang membicarakan cara atau metode pengumpulan, penyederhanaan dan penyajian data sehingga dapat memberikan informasi (Mattjik & Sumertajaya 2006).
4
HASIL DAN PEMBAHASAN
Sebanyak 51 sampel keju telah dikoleksi dari lima negara yang melakukan eksportasi keju ke Indonesia melalui Pelabuhan Tanjung Priok, Jakarta selama bulan Januari sampai Maret 2015 (Tabel 2). Lima negara eksportir tersebut yakni Selandia Baru, Amerika Serikat, Australia, Filipina, dan Belanda.
Tabel 2 Jenis dan besaran sampel keju impor yang diambil sebagai obyek penelitian
No Jenis keju Besaran sampel (n)
1. 2. 3.
Cheddar Mozzarella Edam
26 24 1
Jumlah sampel 51
12
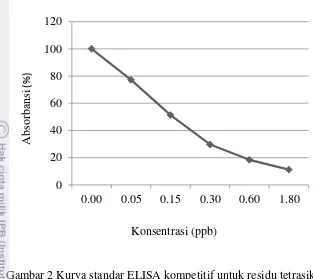
Gambar 2 Kurva standar ELISA kompetitif untuk residu tetrasiklin.
Hasil pengujian residu tetrasiklin pada keju impor dengan menggunakan metode ELISA kompetitif disajikan pada Tabel 3. Terdapat tujuh dari 51 (13.7%) sampel keju impor yang diperiksa mengandung residu tetrasiklin dengan konsentrasi antara 2.47 ppb sampai 11.99 ppb. Nilai tersebut tidak melebihi batas maksimum residu yang ditetapkan oleh SNI 01-6366-2000 yakni 50 ppb dan Codex Alimentarius Commission yakni 100 ppb.
Tabel 3 Hasil pengujian residu tetrasiklin pada keju impor dengan metode ELISA kompetitif
No Jenis keju Besaran sampel (n) n positif Konsentrasi (ppb) 1.
Limit deteksi ELISA kompetitif yang digunakan untuk mendeteksi residu tetrasiklin pada keju dalam penelitian ini adalah 2 ppb, dengan 50% inhibisi sebesar 0.156. Limit deteksi merupakan konsentrasi paling rendah yang dapat terdeteksi dari suatu substansi.
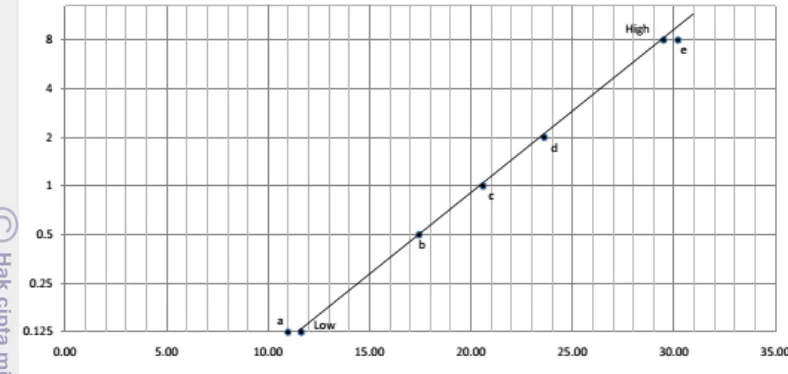
Hasil pengujian bioassay pada sampel keju impor dilakukan dengan mengkalkulasikan hasil uji sampel dengan kurva baku bioassay (Gambar 3). Kurva baku memiliki peranan penting sebagai acuan dalam akurasi penetapan besarnya residu tetrasiklin secara semikuantitatif.
0
0.00 0.05 0.15 0.30 0.60 1.80
13
Gambar 3 Kurva baku bioassay untuk residu tetrasiklin.
Hasil pengujian dengan metode bioassay menunjukkan bahwa 11 dari 51 (21.6%) sampel keju impor yang diperiksa mengandung residu tetrasiklin. Hasil pengujian bioassay selengkapnya ditampilkan pada Tabel 4.
Tabel 4 Hasil pengujian residu tetrasiklin pada keju impor dengan metode bioassay
No Jenis keju Besaran sampel (n) n positif 1.
2. 3.
Cheddar Mozzarella Edam
26 24 1
5 6 0
Jumlah sampel 51 11 (21.6%)
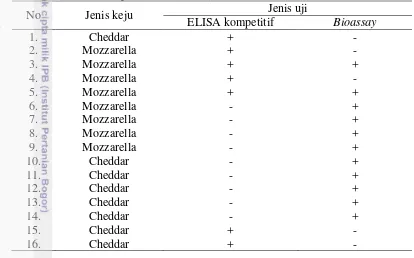
Pengujian residu tetrasiklin pada keju dengan menggunakan ELISA kompetitif dan bioassay menunjukkan hasil yang berbeda. Hasil positif lebih banyak diperoleh dengan menggunakan metode bioassay dibandingkan dengan metode ELISA kompetitif. Hal tersebutmungkinterjadi karena ELISAkompetitif merupakanalat uji yang memilikispesifisitas 100% terhadap jenis tetrasiklin saja sedangkan sensitivitas ELISA kompetitif terhadap anggota grup tetrasiklin lainnya bervariasi kurang dari 70% (klortetrasiklin ±70%, rolitetrasiklin ±34%, demeklosiklin ±26%, oksitetrasiklin ±13%, minosiklin ±3%, dan doksisiklin ±2%). Akibatnya, jika di dalam sampel terdapat kandungan antibiotik selain jenis tetrasiklin, khususnya dengan konsentrasi yang cukup rendah, ELISA kompetitif membacanya sebagai hasil negatif.
14
mengandung residu tetrasiklin. Terdapat dua sampel yang terbaca mengandung residu tetrasiklin oleh kedua metode uji dan terdapat 35 sampel yang terbaca tidak mengandung residu tetrasiklin oleh kedua metode uji. Terdapat lima sampel yang menunjukkan hasil positif dengan metode ELISA kompetitif namun menunjukkan hasil negatif dengan metode bioassay. Terdapat sembilan sampel yang menunjukkan hasil negatif dengan metode ELISA kompetitif namun positif dengan metode bioassay.
Tabel 5 Hasil pengujian residu tetrasiklin pada keju impor dengan metode
Sampel yang terbaca mengandung residu tetrasiklin dengan kedua metode uji membuktikan bahwa di dalam sampel terdapat gabungan residu anggota grup tetrasiklin yang cukup untuk terdeteksi oleh ELISA kompetitif dan terdapat kandungan residu oksitetrasiklin hidroklorida yang sama dengan atau lebih besar dari limit deteksi bioassay. Sebaliknya, sampel yang terbaca tidak mengandung residu tetrasiklin dengan kedua metode uji dapat diartikan sebagai sampel yang tidak mengandung residu tetrasiklin sama sekali atau konsentrasi residu tetrasiklin di dalam sampel lebih rendah dibandingkan dengan limit deteksi kedua uji.
15 beberapa anggota grup tetrasiklin selain oksitetrasiklin hidroklorida dengan konsentrasi yang cukup untuk terdeteksi oleh ELISA kompetitif, namun karena ketiadaan oksitetrasiklin hidroklorida di dalam sampel tersebut, bioassay menunjukkan hasil negatif.
Terdapat sembilan sampel yang menunjukkan hasil negatif dengan metode ELISA kompetitif namun positif dengan metode bioassay. Hal ini diduga karena sembilan sampel tersebut mengandung akumulasi dari beberapa anggota grup tetrasiklin dengan konsentrasi yang lebih kecil dari limit deteksi ELISA kompetitif namun mengandung oksitetrasiklin hidroklorida yang sama dengan atau lebih besar dibandingkan dengan limit deteksi bioassay. Faktor inilah yang kemungkinan dapat menyebabkan uji menunjukkan hasil negatif oleh ELISA kompetitif namun terbaca positif oleh bioassay.
Adanya sampel keju yang mengandung residu tetrasiklin dengan konsentrasi sangat rendah pada penelitian ini menunjukkan digunakannya tetrasiklin sebagai agen terapeutik/subterapeutik pada sapi perah di negara asal tetapi penggunaannya masih memperhatikan waktu henti obat (withdrawal time). Menurut Loksuwan (2002) dan Kellnerová et al. (2014), saat ini tetrasiklin banyak digunakan dalam produksi ternak, khususnya pada pemeliharaan hewan intensif seperti peternakan sapi, babi, domba, dan unggas. Tetrasiklin digunakan secara luas untuk mengobati dan mencegah penyakit hewan, meningkatkan efisiensi pakan dan memacu pertumbuhan ternak (Fernandes et al. 2014; Hopkins & Blaney 2014). Menurut Chopra & Roberts (2001) dan TMVM (2012), tetrasiklin secara luas diterapkan pada bidang kedokteran hewan untuk pengobatan infeksi lokal dan sistemik; infeksi berbagai organ seperti bronkopnemonia, enteritis akibat bakteri, infeksi saluran urin, metritis, mastitis, prostatitis, dan pyodermatitis; serta kondisi khusus seperti keratokonjungtivitis, klamidiosis, anaplasmosis, aktinomikosis, dan sebagainya.
Berbagai literatur menunjukkan bahwa tetrasiklin menduduki peringkat kedua dalam produksi dan penggunaan antibiotik di seluruh dunia (Berendsen et al. 2011). Setiap tahun, produksi tetrasiklin di seluruh dunia diperkirakan mencapai ribuan ton dan volume penggunaan tetrasiklin tahunan secara global diperkirakan antara 100 000 sampai 200 000 ton (Loksuwan 2002). Amerika Serikat merupakan konsumen tetrasiklin tahunan terbesar dunia (3 200 ton/tahun) diikuti oleh Uni Eropa (2 575 ton/tahun) dan Korea (723 ton/tahun). Tetrasiklin di bidang kedokteran hewan secara signifikan lebih tinggi penggunaannya di negara Amerika Serikat dan Korea dibandingkan beberapa negara Eropa seperti Swedia, Denmark, dan Perancis, antara lain karena tingginya jumlah ternak di Amerika Serikat dan Korea serta di kedua negara tersebut tetrasiklin masih umum digunakan sebagai suplemen dalam pakan untuk mempromosikan pertumbuhan hewan (Chopra & Roberts 2001).
16
pangan dengan angka penjualan tertinggi di Amerika Serikat (Daghrir & Drogui 2013).
Eropa merupakan pengguna tetrasiklin tahunan terbesar kedua di dunia setelah Amerika Serikat (2 575 ton/tahun). Penggunaan tetrasiklin pada pakan sebagai pemacu pertumbuhan dilarang di Uni Eropa namun menurut Abou-Raya et al. (2013), dari sekian banyak antibiotik, tetrasiklin merupakan antibiotik yang paling sering digunakan pada bidang kedokteran hewan. Hal senada juga disebutkan oleh Myllyniemi (2004) yang menyebutkan bahwa 65% antibiotik yang digunakan sebagai agen terapeutik pada hewan penghasil pangan di Uni Eropa adalah tetrasiklin.
Penelitian terbaru menunjukkan bahwa tetrasiklin menduduki peringkat pertama dalam hal produksi dan penggunaan antibiotik di Cina. Tetrasiklin dianggap sebagai kelas antibiotik termurah yang tersedia saat ini sehingga menarik untuk digunakan di negara-negara berkembang yang memiliki anggaran kesehatan terbatas (Chopra & Roberts 2001).
Dugaan lain yang dapat menyebabkan hadirnya residu tetrasiklin dengan konsentrasi sangat rendah pada sampel adalah adanya residu tetrasiklin pada susu sebagai bahan mentah tetapi seiring berbagai tahap di dalam proses pengolahan keju konsentrasinya menurun. Javadi et al. (2009), Kellnerová et al. (2014) dan Heshmati (2015) menyebutkan bahwa residu tetrasiklin pada pangan asal hewan dapat menurun karena pemasakan dan pemanasan. Hal tersebut senada dengan laporan Loksuwan (2002) yang menyebutkan bahwa prosedur pasteurisasi normal (63 °C selama 30 menit) menyebabkan penurunan residu tetrasiklin, klortetrasiklin dan oksitetrasiklin pada susu tetapi tidak dapat menghilangkan residu seluruhnya. Disebutkan oleh Loksuwan, stabilitas obat terhadap panas bergantung pada jenisnya. Oksitetrasiklin paling mudah mengalami penurunan akibat pemanasan. Residu oksitetrasiklin secara signifikan (p<0.05) berkurang 19.36-86.17%. Residu tetrasiklin secara signifikan (p<0.05) berkurang 22.97-54.15%. Tidak ditemukan pengurangan konsentrasi residu secara signifikan (p>0.5) pada klortetrasiklin.
Hasil penelitian Hsieh et al. (2011) juga menyebutkan bahwa konsentrasi residu antibiotik grup tetrasiklin (tetrasiklin, klortetrasiklin, oksitetrasiklin, doksisiklin) berkurang setelah diuji dengan perlakuan panas. Ditemukan fakta bahwa meskipun terdapat kesamaan struktur, stabilitas tiap anggota grup tetrasiklin terhadap perlakuan panas ternyata berbeda. Oleh karena itu, tidak tepat memprediksi stabilitas terhadap perlakuan panas hanya berdasarkan grup antibiotik. Hal senada disebutkan oleh Kellnerová et al. (2014) yang mencatat bahwa stabilitas tiap individu obat bervariasi signifikan dalam grup antibiotik. Residu tetrasiklin menurun 5.4% tidak signifikan (p>0.05) dan residu oksitetrasiklin menurun signifikan 15.3% (p≤0.01) dengan perlakuan pasteurisasi suhu tinggi (85 °C selama 3 detik). Ringkasnya menurut Kellnerová, perlakuan panas dapat mengurangi konsentrasi residu tetrasiklin dalam makanan sehingga efek toksik tetrasiklin juga dapat diturunkan.
17 pemasakan, lama pemasakan dan tipe antibiotik. Pemanasan dengan microwave lebih efektif menurunkan residu tetrasiklin daripada perebusan dan pemanggangan. Penurunan residu tetrasiklin meningkat seiring waktu memasak yang lebih lama. Doksisiklin merupakan anggota grup tetrasiklin yang paling stabil terhadap panas, sementara oksitetrasiklin merupakan anggota grup tetrasiklin yang paling labil terhadap panas. Waktu yang dibutuhkan untuk menghancurkan 90% dari konsentrasi tetrasiklin awal adalah 23.9, 53.2, dan 101.6 menit masing-masing untuk pemanasan dengan microwave, perebusan dan pemanggangan.
Senada dengan hasil penelitian Loksuwan (2002) dan Kellnerová et al. (2014), hasil pengujian dengan kedua metode pada penelitian ini menunjukkan bahwa 8 dari 26 sampel keju cheddar impor dan 8 dari 24 sampel keju mozzarella impor yang diperiksa mengandung residu tetrasiklin (Tabel 6) tetapi konsentrasi residu tetrasiklin pada sampel keju cheddar lebih rendah (2.47-2.71 ppb) dibandingkan konsentrasi residu tetrasiklin pada sampel keju mozzarella (8.06-11.99 ppb). Perbedaan konsentrasi ini diduga karena pada pembuatan keju cheddar terdapat tahap pemanasan susu mentah sebagai bahan dasar keju sedangkan pada pembuatan keju mozzarella tidak terdapat tahap pemanasan susu mentah terlebih dahulu.
Selain perlakuan panas, stabilitas tetrasiklin juga dapat dipengaruhi oleh pH (Lendhanie 2000). Lendhanie (2000) mengungkapkan bahwa pH turut berpengaruh signifikan (p<0.05) terhadap penurunan konsentrasi residu tetrasiklin dan klortetrasiklin, serta berpengaruh sangat signifikan (p≤0.01) terhadap penurunan konsentrasi residu oksitetrasiklin. Konsentrasi residu yang hilang dari sampel daging dada ayam broiler setelah diberikan perlakuan pH 7, pH 5, dan pH 3 berturut-turut adalah tetrasiklin 30%, 31%, dan 46%, oksitetrasiklin 47%, 54%, dan 64%, serta klortetrasiklin 32%, 39%, dan 52%. Rataan pengurangan residu tiap penurunan pH sebesar satu adalah tetrasiklin 79.8 ppb, oksitetrasiklin 117.6 ppb, dan klortetrasiklin 306.8 ppb.
Selain proses pemanasan dan perubahan pH, stabilitas tetrasiklin juga dapat dipengaruhi oleh proses fermentasi. Penelitian mengenai pengaruh fermentasi terhadap konsentrasi residu tetrasiklin pernah dilakukan oleh Motoyama et al. (2011). Residu tetrasiklin pada pupuk organik daur ulang menurun efektif sebesar 85-92% setelah 30 hari dimasukkan ke dalam putaran fermentor skala laboratorium. Menurutnya, produk farmasi yang dapat terurai oleh proses fermentasi sehingga menyisakan konsentrasi antibiotik terendah dapat dianggap sebagai obat yang ramah lingkungan. Hal senada diungkapkan oleh Spielmeyer et al. (2014) yang menyebutkan bahwa selama proses fermentasi, terjadi eliminasi residu tetrasiklin.
18
metode ELISA kompetitif konsentrasi residu tetrasiklin cukup rendah dan ketika diuji dengan metode bioassay tidak menunjukkan hambatan kuman.
5
SIMPULAN DAN SARAN
Simpulan
Metode ELISA kompetitif telah digunakan untuk mendeteksi residu tetrasiklin pada keju yang diimpor melalui Pelabuhan Tanjung Priok, Jakarta mulai bulan Januari sampai Maret 2015. Hasil analisis menunjukkan bahwa sebelas dari 51 (21.6%) sampel yang diperiksa dengan metode bioassay dan tujuh dari 51 (13.7%) sampel yang diperiksa dengan metode ELISA kompetitif mengandung residu tetrasiklin. Konsentrasi residu tetrasiklin pada sampel yang diperiksa dengan metode ELISA kompetitif berkisar antara 2.47-11.99 ppb. Hasil analisis menunjukkan sampel yang diperiksa mengandung residu tetrasiklin dengan konsentrasi jauh di bawah BMR yang ditetapkan oleh SNI 01-6366-2000 (50 ppb) dan CAC (100 ppb).
Saran
Surveilans deteksi residu antibiotik perlu dilakukan secara rutin demi menjamin keamanan keju impor. Selain itu, diperlukan suatu pedoman dan standar pengujian baku yang akan digunakan dalam pemeriksaan keju sebagai bagian dari tindakan karantina produk hewan impor.
DAFTAR PUSTAKA
Adetunji VO. 2011. Effects of processing on antibiotik residues (streptomycin, penicillin-g and tetracycline) in soft cheese and yoghurt processing lines. Pak J Nutr. 10(8):792-795.
Abou-Raya SH, Shalaby AR, Salama NA, Emam WH, Mehaya FM. Effect of ordinary cooking procedures on tetracycline residues in chicken meat. J Food Drug Anal. 21(1):80-86.
Ady HY. 2012. Analisis residu tetrasiklin pada susu bubuk yang diimpor melalui Pelabuhan Laut Tanjung Priok [tesis]. Bogor (ID): Institut Pertanian Bogor. Agwuh KN, MacGowan A. 2006. Pharmacokinetics and pharmacodynamics of
the tetracyclines including glycylcyclines. J Antimicrob Chemother. 58:256-265.
19 Aydemir O, Harth H, Weckx S, Dervis M, De Vuyst L. 2015. Microbial communities involved in Kasar cheese ripening. Food Microbiol. 46:587-595. [BBKPTP] Balai Besar Karantina Pertanian Tanjung Priok. 2014. Laporan
Tahunan BBKP Tanjung Priok 2013. Jakarta (ID): BBKP Tanjung Priok. Beltran MC, Borras NM, Nagel O, Althaus RL, Molina AP. 2014. Validation of
receptor-binding assays to detect antibiotics in goat’s milk. J Food Prot. 77(2):308-313.
Berendsen BJA, Elbers IJW, Stolker AAM. 2011. Determination of the stability of antibiotics in matrix and reference solutions using a straightforward procedure applying mass spectrometric detection. Food Addit Contam. 28(12):1657-1666.
Beresford TP, Fitzsimons NA, Brennan NL, Cogan TM. 2001. Recent advances in cheese microbiology. Int Dairy J. 11:259-274.
Blasco C, Di Corcia A, Picó Y. 2009. Determination of tetracyclines in multi-species animal tissues by pressurized liquid extraction and liquid chromatography–tandem mass spectrometry. Food Chem. 116:1005-1012. Bogialli S, Coradazzi C, Dicorcia A, Lagana A. 2007. A rapid method based on
hot water extraction and liquid chromatography-tandem mass spectrometry for analyzing tetracycline antibiotic residues in cheese. J AOAC Int. 90(3):864-871.
[BSN] Badan Standardisasi Nasional. 2000. SNI No. 01-6366-2000 tentang batas maksimum cemaran mikroba dan batas maksimun residu dalam bahan makanan asal hewan. Jakarta (ID): BSN.
[BSN] Badan Standardisasi Nasional. 2008. SNI No 7424:2008 tentang Metode Uji Tapis (Screening Test) Residu Antibiotik pada Daging, Telur dan Susu secara Bioassay. Jakarta (ID): BSN.
Butaye P, van Duijkeren E, Prescott JF, Schwarz S. 2014. Antimicrobial resistance in bacteria from animals and the environment. Vet Microbiol. 171:269-272.
[CAC] Codex Alimentarius Comision. 2011. Veterinary Drugs Residues in Food [internet]. Tersedia pada: http://www.codexalimentarius.net/vetdrugs/data/ index.html [21 Januari 2015].
Chopra I, Roberts M. 2001. Tetracycline antibiotics: mode of action, applications, molecular biology, and epidemiology of bacterial resistance. Microbiol Mol Biol Rev. 65(2):232-260.
Daghrir R, Drogui P. 2013. Tetracycline antibiotics in the environment: a review. Environ Chem Lett. 11:209-227.
Darwish WS, Eldaly EA, El-Abbasy MT, Ikenaka Y, Nakayama S, Ishizuka M. 2013. Antibiotic residues in food: the African scenario. Jpn J Vet Res. 61(Supplement):S13-S22.
[EC] European Commission. 1981. Council Directive 81/852/EEC of 28 September 1981 on the approximation of the laws of the Member States relating to analytical, pharmaco-toxicological and clinical standards and protocols in respect of the testing of veterinary medicinal products. Off J Eur Comm. 317:16-28.
20
Tersedia pada: http://www.codexalimentarius.org/download/standards/175/ CxS_283e.pdf. [diunduh 14 Desember 2014].
Fernandes SAA, Magnavita APA, Ferrao SPB, Gualberto SA, Faleiro AS, Figueiredo AJ, Matarazzo SV. 2014. Daily ingestion of tetracycline residue present in pasteurized milk: a public health problem. Environ Sci Pollut Res. 21:3427-3434.
Flórez AB, Ammor MS, Mayo M. 2008. Identification of tet(M) in two Lactococcus lactis strains isolated from a Spanish traditional starter-free cheese made of raw milk and conjugatif transfer of tetracycline resistance to lactococci and enterococci. Int J Food Microbiol. 121:189-194.
Fox PF, McSweeney PLH. 2004. Cheese: an overview. London (UK): Academic Pr.
Gan SD, Patel KR. 2013. Enzyme Immunoassay and Enzyme-Linked Immunosorbent Assay. J Invest Dermatol. 133:1-3.
Gaudin V, Hedou C, Rault A, Verdon E. 2010. Validation of a five plate test, the STAR protocol, for the screening of antibiotic residues in muscle from different animal species according to the European decision 2002/657/EC. Food Addit Contam. 27(7):935-952.
Gaurav A, Gill JPS, Aulakh RS, Bedi JS. 2014. ELISA based monitoring and analysis of tetracycline residues in cattle milk in various districts of Punjab. Vet World. 7(1):26-29.
Grenier D, Huot MP, Mayrand A. 2000. Iron-chelating activity of tetracyclines and its impact on the susceptibility of Actinobacillus actinomycetemcomitans to these antibiotics. Antimicrob Agents Chemother. 44(3):763-766.
Henning DR, Baer RJ, Hassan AN, Dave R. 2006. Major advances in concentrated and dry milk products, cheese, and milk fat-based spreads. J Dairy Sci. 89(4):1179-1188.
Heshmati A. 2015. Impact of cooking procedures on antibacterial drug residues in food: a review. J Food Qual Hazards Control. 2:33-37.
Hoeben D, Burvenich C, Heyneman R. 1998. Antibiotics commonly used to treat mastitis and respiratory burst of bovine polymorphonuclear leukocytes. J Dairy Sci. 81:403-410.
Hopkins ZR, Blaney L. 2014. A novel approach to modeling the reaction kinetics
of tetracycline antibiotics with aqueous ozone. Sci Total Environ. 468-469:337-344.
Hsieh MK, Shyu CL, Liao JW, Franje CA, Huang YJ, Chang SK, Shih PY, Chou CC. 2011. Correlation analysis of heat stability of veterinary antibiotics by structural degradation, changes in antimicrobial activity and genotoxicity. Vet Med. 56(6):274-285.
Javadi A, Mirzaei H, Khatibi SA. 2009. Effect of roasting process on antibiotic residue in edible tissues of poultry by FPT method. J Anim Vet Adv. 8(12):2468-2472.
Jeppu J, Jayaram N, Satya S, Purayil AK. Microbiological evaluation of ultra-high temperature (UHT)-treated milk close to expiry date and routine home practices for preservation of milk. Indian J Community Med. 40(3):174-176. Kantiani L, Farre M, Barcelo D. 2009. Analytical methodologies for the detection
21 Kellnerová E, Navrátilová P, Borkovcová I. 2014. Effect of pasteurization on the
residues of tetracyclines in milk. Acta Vet Brno. 83:S21-S26.
Kemper N. 2008. Veterinary antibiotics in the aquatic and terrestrial environment. Ecol Indic. 8:1-13.
Latif H. 2004. Analisis residu antibiotik pada susu bubuk dengan menggunakan beberapa metode pengujian. [tesis]. Bogor (ID): Sekolah Pascasarjana, Institut Pertanian Bogor.
Lendhanie UU. 2000. Penurunan residu tetrasiklin oksitetrasiklin dan klortetrasiklin oleh pemanasan dan pH larutan pada daging dada ayam broiler [tesis]. Bogor (ID): Sekolah Pascasarjana, Institut Pertanian Bogor.
Loksuwan J. 2002. The effect of heating on multiple residues of tetracyclines in milk. Thammasat Int J Sc Tech. 7(3):17-21.
MacDonald LE, Brett J, Kelton D, Majowicz SE, Snedeker K, Sargeanta JM. 2011. Systematic review and meta-analysis of the effects of pasteurization on milk vitamins, and evidence for raw milk consumption and other health-related outcomes. J Food Prot. 74(11):1814-1832.
Mari GM, Khaskheli M, Jatoi AS, Qazi IH, Samina M, Talpur A, Majeed S, Soomro AH, Rukhsana L, Samad A. 2014. Compositional and rheological properties of mozzarella cheese prepared from buffalo milk. Pak J Nutr. 13(9):533-536.
Mattjik AA, Sumertajaya IM. 2006. Perancangan Percobaan dengan Aplikasi SAS dan Minitab Jilid I. Bogor (ID): IPB Pr.
Mohammed-Ali MA. 2012. Stability study of tetracycline drug in acidic and alkaline solutions by colorimetric method. J Chem Pharm Res. 4(2):1319-1326. Morandi S, Brasca M. 2012. Safety aspects, genetic diversity and technological characterisation of wild-type Streptococcus thermophilus strains isolated from north Italian traditional cheeses. Food Control. 23:203-209.
Motoyama M, Nakagawa S, Tanoue R, Sato Y, Nomiyama K, Shinohara R. 2011. Residues of pharmaceutical products in recycled organic manure produced from sewage sludge and solid waste from livestock and relationship to their fermentation level. Chemosphere. 84(4):432-438.
Myllyniemi AL. 2004. Development of microbiological methods for the detection and identification of antimicrobial residues in meat [academic dissertation]. Finlandia (FI): University of Helsinki.
Nagel O, Zapata M, Basílico JC, Bertero J, Molina MP, Althaus R. 2009. Effect of chloramphenicol on a bioassay response for the detection of tetracycline residues in milk. J Food Drug Anal. 17(1):36-42.
NaVrátiloVá P, BorkoVCoVá I, DračkoVá M, JaNštoVá B, VorloVá L. 2009. Occurrence of tetracycline, chlortetracyclin, and oxytetracycline residues in raw cow’s milk.Czech J Food Sci. 27(5):379-385.
O’Keeffe M et al. 2001. Food residue database. Irish J Agric Food Res. 40(1):117.
Samelis J, Lianou A, Kakouri A, Delbes C, Rogelj I, Bogovic-Matijasic B, Montel MC. 2009. Changes in the microbial composition of raw milk induced by thermization treatments applied prior to traditional greek hard cheese processing. J Food Prot. 72(4):783-790.
22
liquid chromatography tandem mass spectrometry. Anal Bioanal Chem. 406:2513-2524.
[TMVM] The Merck Veterinary Manual. 2012. Tetracyclines [internet]. Tersedia pada: http://www.The Merck Veterinary Manual.com/vet/pharmacology/ antibacterial_agents/tetracyclines.html [diunduh 17 Januari 2015].
Trushfield M. 2005. Veterinary Epidemiology 3rd Ed. Blackwell (UK): Blackwell Scientific.
Tusevljak N. 2011. Evaluating the importance of zoonotic bacteria, antimicrobial use and resistance in aquaculture and seafood [thesis]. Ontario (US): The University of Guelph.
Wang S, xu B, Zhang Y, He Jx. 2009. Development of enzyme-linked immunosorbent assay (ELISA) for the detection of neomycin residues in pig muscle, chicken muscle, egg, fish, milk and kidney. Meat Sci. 82:53-58.
Yang B. 2001. Sensory Evaluation of Taste Components of Cheddar Cheese [thesis]. Minneapolis (US): University of Minnesota.
Yuningsih. 2005. Keberadaan Residu Antibiotik dalam Produk Peternakan (Susu dan Daging). Bogor (ID): Balai Penelitian Veteriner.
Zanella GN, Mikcha JMG, Bando E, Siqueira VLD, Machinski M. 2010. Occurrence and antibiotic resistance of coliform bacteria and antimicrobial residues in pasteurized cow’s milk from Brazil.J Food Prot. 73(9):1684-1687. Zhang H, Wang L, Zhang Y, Fang G, Zheng W, Wang A. 2007. Development of
23 Lampiran 1 Hasil pengujian terhadap seluruh sampel keju impor dengan metode
24
Lampiran 1 Hasil pengujian terhadap seluruh sampel keju impor dengan metode ELISA kompetitif dan bioassay (lanjutan)
No Jenis keju Jenis uji
ELISA kompetitif Bioassay 44.
45. 46. 47. 48. 49. 50. 51.
Cheddar Cheddar Cheddar Cheddar Cheddar Edam Cheddar Cheddar
- - - + + - - -
+ + - - - - - -
25
RIWAYAT HIDUP
Penulis dilahirkan di Garut pada tanggal 30 Agustus 1984 sebagai anak ketiga dari lima bersaudara dari pasangan H. Aminin, SPdI dan Hj. Ade Suhaebah. Penulis menyelesaikan pendidikan menengah di MAN 1 Garut, Jawa Barat pada tahun 2001 dan melanjutkan pendidikan pada Fakultas Kedokteran Hewan, Institut Pertanian Bogor pada tahun yang sama. Penulis lulus program Sarjana Kedokteran Hewan tahun 2006 dan melanjutkan ke Program Profesi Dokter Hewan pada tempat dan tahun yang sama. Penulis lulus dan memperoleh gelar Dokter Hewan pada tahun 2007. Penulis masuk Sekolah Pascasarjana, Institut Pertanian Bogor tahun 2013 pada Program Studi Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan melalui jalur beasiswa dari Badan Penyuluhan dan Pengembangan Sumberdaya Manusia (BP2SDM), Kementerian Pertanian Republik Indonesia.
Penulis adalah Dokter Hewan Karantina yang bertugas di Balai Karantina Pertanian Kelas II Tarakan sejak tahun 2008 dan mendapatkan mutasi ke Balai Besar Karantina Pertanian Tanjung Priok, Jakarta sejak tahun 2013 hingga saat ini.