JEROAN IKAN CAKALANG (Katsuwonus pelamis, Lin)
RAHMATIA GARWAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis ” Perkembangan Histamin selama Proses Fermentasi dan Penyimpanan Produk Bakasang Jeroan Ikan Cakalang (Katsuwonus pelamis, Lin) ” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Mei 2009
Rahmatia Garwan
RAHMATIA GARWAN. The Histamine Growth during Fermentation Process and Storaging of Bakasang Produced from Viscera of Skipjack (Katsuwonus pelamis, Lin). Supervised by JOKO SANTOSO and SRI PURWANINGSIH.
Bakasang is a fermented fish product, produced from viscera of skipjack which belongs to scombroid group. Those kinds of fish contains a lot of free histidin on their muscle tissue and easy to change become histamine due to decarboxylation reaction and activity of bacteria. These experiments were carried out to study the histamine growth during fermentation processed and storaging at room temperature of bakasang produced from viscera of skipjack. The viscera of skipjack were obtained from fish auction place at Muara Angke - North Jakarta. There were two main steps of experiment, i.e. fermentation processed of viscera
for 8 days (0, 2, 4, 6, 8) and continued by storaging at room temperature for 90 days (0, 30, 60, 90). During fermentation processed, moisture content significance decreased from 75.87 % to71.57 % and the numbers of total microbe (TPC) increased significantly from 104 to 105 Cfu/g; however, the protein content, pH values and histamine content were not affected significantly. There was positive correlation between the numbers of total microbe (TPC) and histamine content of bakasang during storaging. Both of values increased 103 to 106 Cfu/g and from 18.59 to 64.20 ppm respectively; however, the histamine were still under the maximum limit established by Ditjen P2HP DKP (2007). The moisture
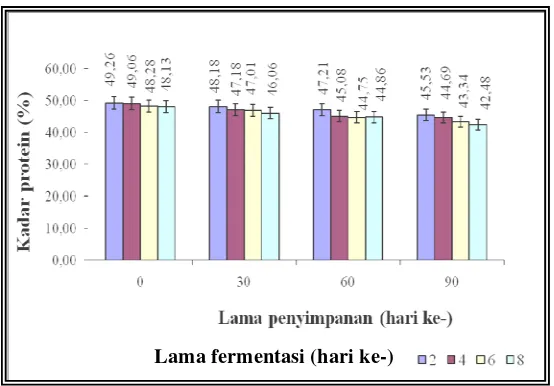
content of bakasang increased significantly during fermentation and storaging, with values were from 75.93 % to 77.58 %. In opposite, protein contents significance decreased during fermentation and storaging from 49.26 % to 42.48 %. The pH values of bakasang only affected by the storaging and increased from 5.73 to 6.23. Based on organoleptic test, storaging until 90 days at room temperature still produced bakasang in good average level. Combination treatments between fermentation for 4 and 8 days without storaging (0 days) produced the high average values of color, odor, taste and texture; and they also had the higher values of odor and taste in comparison to commercial product. Both of combination treatments also had the highest protein contents and the lowest histamine values.
RINGKASAN
RAHMATIA GARWAN. Perkembangan Histamin selama Proses Fermentasi dan Penyimpanan Produk Bakasang Jeroan Ikan Cakalang (Katsuwonus pelamis, Lin). Dibimbing oleh JOKO SANTOSO dan SRI PURWANINGSIH.
Bakasang adalah produk fermentasi jeroan ikan berupa larutan kental, dibuat dari jeroan ikan melalui fermentasi dengan penambahan garam, yang rasanya asam dan biasanya disajikan untuk pelengkap lauk dengan dibumbuhi cabe dan gula. Bakasang umumnya berasal dari jeroan ikan cakalang yang termasuk golongan ikan scombroid dari famili scombroidae. Jenis ikan tersebut mengandung banyak histidin bebas dalam jaringan dagingnya. Proses penanganan dan pengolahan dilakukan dengan tidak benar menyebabkan histidin bebas tersebut dapat berubah menjadi histamin karena dekarboksilasi dan aktivitas bakteri pembentuk histamin.
Penelitian ini dilakukan untuk mempelajari perkembangan histamin selama proses fermentasi jeroan dan penyimpanan bakasang pada suhu ruang. Jeroan diperoleh dari Tempat Pelelangan Ikan Muara Angke, Jakarta Utara. Tahapan yang dilakukan dalam penelitian ini adalah proses fermentasi jeroan selama 8 hari (0, 2, 4, 6, 8) dan dilanjutkan dengan proses penyimpanan pada suhu ruang selama 90 hari (0, 30, 60, 90). Selama proses fermentasi terjadi penurunan kadar air secara nyata dari 75,87 % menjadi 71,57 % dan peningkatan total mikroba dari 104 menjadi 105 Cfu/g, sedangkan kadar protein, nilai pH dan histamin tidak berpengaruh nyata. Selama penyimpanan bakasang terjadi korelasi positif antara peningkatan total mikroba dari 103 menjadi 106 Cfu/g dengan jumlah histamin dari 18,59 menjadi 64,20 ppm, meskipun demikian nilainya masih di bawah batas maksimum yang ditetapkan oleh Ditjen P2HP DKP (2007).
Kadar air bakasang mengalami peningkatan secara nyata oleh lama fermentasi dan lama penyimpanan dari 75,93 % menjadi 77,58 %, sedangkan kadar protein mengalami penurunan secara nyata oleh lama fermentasi dan lama penyimpanan dari 49,26 % menjadi 42,48 %.
Berdasarkan uji organoleptik, penyimpanan bakasang sampai dengan hari terakhir (90 hari) masih menunjukkan karakteristik baik walaupun terjadi penurunan nilai. Dua produk terbaik hasil penilaian panelis didapatkan pada perlakuan lama fermentasi 4 hari pada penyimpanan 0 hari (F4P0) dan perlakuan
lama fermentasi 8 hari pada penyimpanan 0 hari (F8P0) yang memberikan nilai
rata-rata tertinggi terhadap parameter bau dan rasa dibandingkan dengan produk komersial. Kedua kombinasi perlakuan tersebut juga mempunyai kandungan protein tertinggi dan kadar histamin terendah.
© Hak cipta milik IPB, tahun 2009 Hak cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
PERKEMBANGAN HISTAMIN SELAMA PROSES
FERMENTASI DAN PENYIMPANAN PRODUK BAKASANG
JEROAN IKAN CAKALANG (Katsuwonus pelamis, Lin)
RAHMATIA GARWAN
Tesis
sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Perkembangan Histamin selama Proses Fermentasi dan Penyimpanan Produk Bakasang Jeroan Ikan Cakalang (Katsuwonus pelamis, Lin)
Nama : Rahmatia Garwan
NIM : C351060041
Disetujui Komisi Pembimbing
Dr. Ir. Joko Santoso, M.Si Dr. Ir. Sri Purwaningsih, M.Si Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Teknologi Hasil Perairan
Dr. Ir. Sri Purwaningsih, M.Si Prof. Dr. Ir. Khairil A. Notodiputro, MS
Puji dan syukur penulis panjatkan ke hadirat Allah SWT, karena berkat rahmat dan nikmat-Nya terutama nikmat kesehatan dan kesempatan sehingga penulisan tesis dengan judul ” Perkembangan Histamin selama Proses Fermentasi
dan Penyimpanan Produk Bakasang Jeroan Ikan Cakalang (Katsuwonus pelamis, Lin) ” dapat terselesaikan.
Ucapan terima kasih yang tak terhingga penulis sampaikan secara khusus
kepada Dr. Ir. Joko Santoso, M.Si sebagai ketua komisi pembimbing dan Dr. Ir. Sri Purwaningsih, M.Si sebagai anggota komisi pembimbing atas segala
bimbingan dan arahan, kesabaran dan kebijaksanaan, serta masukan kepada penulis sejak rencana penelitian hingga penulisan tesis ini.
Penulis menyadari bahwa dalam penulisan tesis ini tidak lepas dari bantuan berbagai pihak, untuk itu tak lupa penulis sampaikan terima kasih kepada:
1). Rektor Universitas Muhammadiyah Maluku Utara Ternate (UMMU) yang telah memberikan rekomendasi dan ijin belajar kepada penulis untuk melanjutkan studi pada Sekolah Pascasarjana IPB.
2). Sekda Provinsi Maluku Utara Ternate yang telah memberikan ijin belajar kepada penulis untuk melanjutkan studi pada Sekolah Pascasarjana IPB. 3). Kepala Dinas Perikanan dan Kelautan Provinsi Maluku Utara Ternate yang
telah memberikan ijin belajar kepada penulis untuk melanjutkan studi pada Sekolah Pascasarjana IPB.
4). Ir. Iriani Setyaningsih, M.S, selaku dosen penguji yang telah memberikan banyak masukan guna penyempurnaan tesis ini.
6). Imran Pattisahusiwa; terima kasih atas perhatian, bantuan dan dukungannya selama ini, semoga Allah SWT membalas kebaikan dan keikhlasanmu.
7). Pa Ikram Sangadji, Pa Hi. Saiful Latif, Pa Hi. Ruslan, Ibu Hj. Ifo; terima kasih atas bantuan dan dukungannya. Semoga Allah SWT membalas kebaikan dan keiikhlasannya.
8). Teman-teman S2 THP Angkatan ’06 (Mb Nik, Mb Uci, Mb Poe, Pa Aim, Pa Mad, Pa Max, Mas Candra dan Pa Dani); terima kasih atas bantuan, motivasi, perhatian, semangat, kebersamaan dan kekompakannya yang terjalin sampai saat ini.
9). Teman-teman S2 THP Angkatan ’05 dan ’07 (Mb Chairita, Mb Vita, Pa Adri, Pa Celcius dan Pa Dani); Te Rita, Fitah, Pa Sit, Bu Juhli, Mb Elin, Mb Taty, Krisan, Sevry dan Ulina); terima kasih atas kerjasamanya.
10). Teman-teman S1 THP (Astari, Rijan, Alim, Santy, Agnes, Dede, Juhli, Diaz, Nujul), dan teman-teman Laboratorium Pluit Jakarta (Ayu, Bu Sri, Bu Helma, Bu Yuli, Pa Wahyu, Mas Kur, Mas Adi, Mas Pur, Mas Agung, Mas Kukuh, Mas Woko dan Mas Iyong; terima kasih atas kerjasamanya.
11). Prof. Frans G. Ijong, Prof. Berhimpon dan Nci Henny Dien; terima kasih atas arahan, motivasi dan semangatnya kepada penulis.
12). Teman-teman Dinas DKP Ternate; Ci Waty, Ci Ija, Esti, Ci Marni, Acid, Mad Kaplale, Kris, Jakir, Neni, Ci Mei, Ci Ina, Ci Mila, Ci Anti, Ci Nita, Pa Ismail, Pa Ama Duwila, Ko Buyung, Aba Dullah, Pa Muhlis Baay, Ko Jevo gendut, Pa Ota, Aslun, Su, Ratna, Udin Turuy, Upu, Aisten, Muja, Cahyadi, Pa Ekan dan seluruh staf DKP; terima kasih atas perhatian dan dukungannya. 13). Mas Ismail dan Bu Ema; terima kasih atas bantuan dan kerjasamanya yang
terjalin selama ini. Mas Roes, Mb Endang PAU; terima kasih atas kesabaran dan semangatnya dalam membantu dan memotivasi penulis.
14). Yani (mama Dillah) yang selalu setia mengerti, mendorong dan menguatkan penulis dalam masalah pribadi. Semoga Allah SWT membalas kebaikan dan keikhlasanmu.
16). Teman-teman kozan Dwi Regina B (Astari, Pritha, Sri, Miaw, Winny, Rara, Lele, Lilik, Ulfa, Sita, Rini, Winda, Pipit, Fira, Vully, Dara, Riri, Tari imoet, dan teh Dede); terima kasih atas semangat, dukungan dan kekeluargaannya yang terjalin selama ini. Semoga jalinan silaturahmi kita selalu terjaga dan kita selalu dalam lindungan Yang Maha Kuasa, amin.
Penulis menyadari bahwa dalam penulisan tesis ini masih ada kekurangannya, meskipun demikian diharapkan semoga tesis ini dapat bermanfaat bagi semua pihak yang membutuhkannya.
Bogor, Mei 2009
Rahmatia Garwan
RIWAYAT HIDUP
Penulis dilahirkan di Ternate pada Tanggal 22 November 1980 dari orang tua Hi. Mursjid M. Garwan dan Hj. Nurchalifah Faroek. Penulis merupakan anak ketiga dari enam bersaudara.
Penulis lulus dari SMA N 1 Ternate pada tahun 1998 dan pada tahun yang sama penulis lulus seleksi masuk Universitas Sam Ratulangi Manado melalui jalur Ujian Masuk Perguruan Tinggi Negeri (UMPTN) dan memilih Jurusan Pengolahan Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan.
xii
Halaman
DAFTAR TABEL ... xv
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN ... xvii
1. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Tujuan dan Manfaat Penelitian ... 4
1.4 Hipotesis ... 4
1.5 Kerangka Pemikiran ... 5
2. TINJAUAN PUSTAKA ... 7
2.1 Deskripsi dan Komposisi Kimia Ikan Cakalang (Katsuwonus pelamis, Lin). 7 2.2 Kesegaran Ikan dan Proses Kemunduran Mutunya ... 9
2.3 Mikrobiologi Ikan Segar ... 11
2.4 Protein Ikan ... 12
2.5 Histidin dan Histamin ... 14
2.5.1 Kandungan histamin dan pembentukannya pada ikan ... 15
2.5.2 Reaksi fisiologis histamin ... 18
2.6 Fermentasi ... 19
2.6.1 Fermentasi dengan garam ... 20
2.6.2 Fermentasi bakasang ... 21
3. METODOLOGI PENELITIAN ... 24
3.1 Waktu dan Tempat ... 24
3.2 Bahan dan Alat ... 24
3.2.1 Bahan ... 24
3.2.2 Alat ... 25
3.3 Tahapan Penelitian ... 25
3.4.1 Preparasi jeroan ... 25
3.4.2 Proses fermentasi jeroan ... 26
xiii
xiv
4.4.2 Bau ... 69
4.4.3 Rasa ... 70
4.4.4 Tekstur ... 72
4.5 Karakteristik Organoleptik Bakasang dengan Uji Perbandingan Pasangan ... 73
4.6 Karakteristik Kimia dan Mikrobiologi Bakasang Terpilih dan Bakasang Komersial ... 75
4.6.1 Kadar air ... 76
4.6.2 Kadar protein ... 77
4.6.3 Nilai pH ... 77
4.6.4 Kadar histamin ... 78
4.6.5 Total mikroba/Total Plate Count (TPC)) ... 79
4.6.6 Total kapang ... 80
4.7 Penentuan Kombinasi Perlakuan Terbaik Bakasang dari Aspek Kimia.. 81
4.7.1 Kadar protein ... 82
4.7.2 Kadar histamin ... 82
4.8. Uji Pendugaan Umur Simpan Bakasang terhadap Kadar Histamin ... 83
5. KESIMPULAN DAN SARAN ... 85
5.1 Kesimpulan ... 85
5.2 Saran ... 86
DAFTAR PUSTAKA ... 87
xv
DAFTAR TABEL
Halaman 1. Tahapan kemunduran mutu ikan ... .... 10 2. Kandungan asam amino dalam protein daging ikan laut, ikan air tawar dan
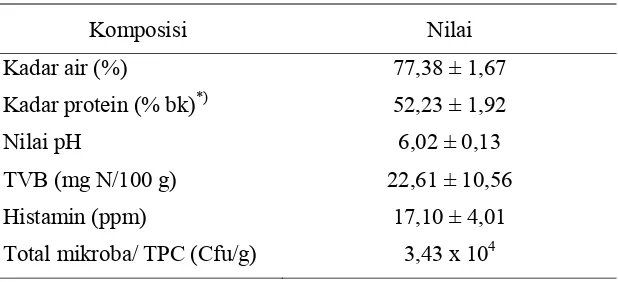
daging sapi ... 13 3. Bakteri-bakteri yang mendekarboksilasi histidin ... 17 4. Karakteristik kimia dan mikrobiologi jeroan ikan cakalang
(Katsuwonus pelamis, Lin) ... 42 5. Karakteristik kimia dan mikrobiologi bakasang terpilih dan bakasang
xvi
1. Kerangka pemikiran penelitian perkembangan histamin selama proses fermentasi dan penyimpanan produk bakasang jeroan ikan cakalang
(Katsuwonus pelamis, Lin) ... 6
2. Ikan cakalang (Katsuwonus pelamis, Lin) (www.google.image.com) ... 8
3. Reaksi pembentukan histamin (Cheffel et al. 1986) ... 15
4. Tahapan preparasi jeroan ikan cakalang (Katsuwonus pelamis, Lin) ... 26
5. Tahapan proses fermentasi jeroan ikan cakalang (Katsuwonus pelamis, Lin) .... 27
6. Proses penyimpanan bakasang jeroan ikan cakalang (Katsuwonus pelamis, Lin). 28 7. Histogram rata-rata kadar air jeroan selama proses fermentasi ... 45
8. Histogram rata-rata kadar protein jeroan selama proses fermentasi ... 47
9. Histogram rata-rata nilai pH jeroan selama proses fermentasi ... 48
10. Histogram rata-rata kadar histamin jeroan selama proses fermentasi ... 50
11. Histogram rata-rata log total mikroba jeroan selama proses fermentasi ... 52
12. Histogram rata-rata kadar air bakasang selama penyimpanan ... 56
13. Histogram rata-rata kadar protein bakasang selama penyimpanan ... 57
14. Histogram rata-rata nilai pH bakasang selama penyimpanan ... 59
15. Histogram rata-rata kadar histamin bakasang selama penyimpanan ... 61
16. Histogram rata-rata log total mikroba bakasang selama penyimpanan ... 64
17. Histogram rata-rata log total kapang bakasang selama penyimpanan ... 66
18. Histogram rata-rata nilai penampakan bakasang selama penyimpanan ... 68
19. Histogram rata-rata nilai bau bakasang selama penyimpanan ... 70
20. Histogram rata-rata nilai rasa bakasang selama penyimpanan ... 71
21. Histogram rata-rata nilai tekstur bakasang selama penyimpanan ... 73
22. Histogram rata-rata uji organoleptik perbandingan pasangan ... 75
xvii
DAFTAR LAMPIRAN
Halaman
1. Lembar isian organoleptik bakasang jeroan ikan cakalang
(Katsuwonus pelamis, Lin) (SNI 01-2718-1996) ... 101
2. Lembar isian organoleptik bakasang hasil penelitian terbaik dan bakasang komersial ... 103
3. Jeroan ikan cakalang (Katsuwonus pelamis, Lin) yang digunakan dalam penelitian ... 104
4a. Analisis ragam kadar air jeroan selama proses fermentasi ... 104
4b. Uji lanjut Duncan kadar air jeroan selama proses fermentasi ... 104
5. Analisis ragam kadar protein jeroan selama proses fermentasi ... 105
6. Analisis ragam nilai pH jeroan selama proses fermentasi ... 105
7. Analisis ragam kadar histamin jeroan selama proses fermentasi ... 105
8a. Analisisi ragam log total mikroba jeroan selama proses fermentasi ... 105
8b. Uji lanjut Duncan log total mikroba jeroan selama proses fermentasi ... 106
9. Produk bakasang jeroan ikan cakalang (Katsuwonus pelamis, Lin) selama kombinasi perlakuan lama fermentasi dan lama penyimpanan ... 106
10a. Analisis ragam kadar air bakasang ... 107
10b. Uji lanjut Duncan kadar air pada lama fermentasi ... 108
10c. Uji lanjut Duncan kadar air pada lama penyimpanan ... 108
11a. Analisis ragam kadar protein bakasang . ... 108
11b. Uji lanjut Duncan kadar protein pada lama fermentasi ... 108
11c. Uji lanjut Duncan kadar protein pada lama penyimpanan ... 109
12a. Analisis ragam nilai pH bakasang ... 109
12b. Uji lanjut Duncan nilai pH bakasang pada lama penyimpanan ... 109
13a. Analisis ragam kadar histamin bakasang ... 109
13b. Uji lanjut Duncan kadar histamin selama interaksi ... 110
14a. Analisis ragam log total mikroba bakasang... 110
14b. Uji lanjut Duncan log total mikroba pada lama fermentasi ... 111
14c. Uji lanjut Duncan log total mikroba pada lama penyimpanan ... 111
15a. Analisis ragam log total kapang bakasang ... 111
xviii
17. Data uji penilaian organoleptik penampakan bakasang kombinasi lama
fermentasi dan lama penyimpanan (penyimpanan 30 hari) ... 114 18. Data uji penilaian organoleptik penampakan bakasang kombinasi lama
fermentasi dan lama penyimpanan (penyimpanan 60 hari) ... 115 19. Data uji penilaian organoleptik penampakan bakasang kombinasi lama
fermentasi dan lama penyimpanan (penyimpanan 90 hari) ... 116 20a. Hasil uji Kruskal-Wallis organoleptik bakasang ... 117 20b. Uji lanjut Multiple Comparisson penampakan bakasang ... 117 21. Data uji penilaian organoleptik bau bakasang kombinasi lama
fermentasi dan lama penyimpanan (penyimpanan 0 hari) ... 118 22. Data uji penilaian organoleptik bau bakasang kombinasi lama
fermentasi dan lama penyimpanan (penyimpanan 30 hari) ... 119 23. Data uji penilaian organoleptik bau bakasang kombinasi lama
fermentasi dan lama penyimpanan (penyimpanan 60 hari) ... 120 24. Data uji penilaian organoleptik bau bakasang kombinasi lama
fermentasi dan lama penyimpanan (penyimpanan 90 hari) ... 121 25a. Hasil uji Kruskal-Wallis organoleptik bakasang ... 122 25b. Uji lanjut Multiple Comparisson bau bakasang ... 122 26. Data uji penilaian organoleptik rasa bakasang kombinasi lama
fermentasi dan lama penyimpanan (penyimpanan 0 hari) ... 123 27. Data uji penilaian organoleptik rasa bakasang kombinasi lama
fermentasi dan lama penyimpanan (penyimpanan 30 hari) ... 124 28. Data uji penilaian organoleptik rasa bakasang kombinasi lama
fermentasi dan lama penyimpanan (penyimpanan 60 hari) ... 125 29. Data uji penilaian organoleptik penampakan bakasang kombinasi lama
fermentasi dan lama penyimpanan (penyimpanan 90 hari) ... 126 30a. Hasil uji Kruskal-Wallis organoleptik bakasang ... 127 30b. Uji lanjut Multiple Comparisson rasa bakasang ... 127 31. Data uji penilaian organoleptik tekstur bakasang kombinasi lama
fermentasi dan lama penyimpanan (penyimpanan 0 hari) ... 128 32. Data uji penilaian organoleptik tekstur bakasang kombinasi lama
fermentasi dan lama penyimpanan (penyimpanan 30 hari) ... 129 33. Data uji penilaian organoleptik tekstur bakasang kombinasi lama
fermentasi dan lama penyimpanan (penyimpanan 60 hari) ... 130 34. Data uji penilaian organoleptik tekstur bakasang kombinasi lama
xix
35. Data organoleptik uji perbandingan pasangan bakasang F4P0 ... 132
36. Data organoleptik uji perbandingan pasangan bakasang F8P0 ... 133
37a. Hasil uji Kruskal-Wallis bakasang terpilih dan bakasang komersial ... 134
37b. Uji lanjut Multiple Comparisson terhadap bau bakasang terpilih dan bakasang komersial ... 134
38. Analisis ragam kadar air bakasang terpilih dan bakasang komersial ... 134
39. Analisis ragam kadar protein bakasang terpilih dan bakasang komersial ... 134
40a. Analisis ragam nilai pH bakasang terpilih dan bakasang komersial ... 135
40b. Uji lanjut Duncan nilai pH bakasang terpilih dan bakasang komersial ... 135
41a. Analisis ragam kadar histamin bakasang terpilih dan bakasang komersial ... 135
41b. Uji lanjut Duncan kadar histamin bakasang terpilih dan bakasang komersial .. 135
42a. Analisis ragam log total mikroba bakasang terpilih dan bakasang komersial .... 136
42b. Uji lanjut Duncan log total mikroba bakasang terpilih dan bakasang komersial.. 136
43a. Analisis ragam log total kapang bakasang terpilih dan bakasang komersial ... 136
43b. Uji lanjut Duncan log total kapang bakasang terpilih dan bakasang komersial.. 136
44. Analisis ragam kadar protein bakasang terpilih berdasarkan aspek kimia ... 137
45a. Analisis ragam kadar histamin bakasang terpilih berdasarkan aspek kimia ... 137
45b. Uji lanjut Duncan kadar histamin bakasang terpilih berdasarkan aspek kimia .. 137
46. Data uji pendugaan masa simpan bakasang terhadap kadar histamin ... 138
47. Rekapitulasi data preparasi jeroan ikan cakalang ... 138
48. Rekapitulasi data lama fermentasi jeroan ikan cakalang ... 139
49. Rekapitulasi data lama penyimpanan bakasang hasil penelitian ... 140
50. Rekapitulasi data bakasang komersial pada penyimpanan 1 bulan (30 hari) ... 142
1.1. Latar Belakang
Salah satu potensi hasil perikanan Kota Ternate Provinsi Maluku Utara
yang cukup besar untuk dikembangkan adalah ikan cakalang (Katsuwonus pelamis, Lin). Data Statistik Perikanan Tangkap Dinas Perikanan
dan Kelautan Provinsi Maluku Utara (2007) menunjukkan bahwa jumlah produksi ikan yang ada di Kota Ternate terdiri atas cakalang 40.591,60 ton/tahun, teri 12.687,72 ton/tahun, tuna 7.979,99 ton/tahun, tongkol 7.795,10 ton/tahun dan kakap 541,40 ton/tahun.
Ikan cakalang selain sebagai komoditas dalam bentuk ekspor beku juga dimanfaatkan secara tradisional oleh masyarakat Kota Ternate. Pengolahan tradisional yang sudah umum dikenal adalah ikan asin, ikan asap dan produk fermentasi seperti kecap ikan, terasi dan bakasang. Pada umumya proses pengolahan ikan cakalang seperti pengasapan dan penggaraman hanya memanfaatkan bagian dagingnya saja, sedangkan bagian lainnya seperti jeroan (usus, lambung, hati, jantung, paru dan telur) umumnya dibuang dan sebagiannya dimanfaatkan sebagai produk sampingan.
Jeroan ikan merupakan limbah perikanan sumber enzim proteolitik yang cukup tinggi terutama pada bagian pilorikaeka dan usus. Pada pilorikaeka terdapat enzim tripsin dan kimotripsin, sedangkan pada usus terdapat enzim protease (Poernomo 1992), selain itu pada bagian lambung juga terdapat enzim proteolitik seperti pepsin, lipase dan esterase (Hidayat 1994). Jeroan ikan juga merupakan depot penyimpanan lemak dan sumber protein. Terdapat 17 jenis asam amino dalam jeroan ikan yaitu asam aspartat, treonin, serin, asam glutamat, leusin, glisin, alanin, sistein, valin, metionin, isoleusin, tirosin, fenilalanin, histidin, lisin dan arginin (Poernomo 1992).
2
relatif sederhana dan mudah diterapkan turun temurun, proses pengolahannnya secara tradisional berdasarkan kebiasaan masyarakat setempat, tidak membutuhkan biaya yang tinggi (mahal), menghasilkan bahan buangan (limbah) dalam jumlah kecil, produk fermentasi mempunyai daya simpan yang lama dan produk dapat diterima oleh semua lapisan masyarakat (Rahayu et al. 1992). Menurut Brink et al. (1990); Ijong dan Ohta (1995); McLauchlin et al.
(2005); Jiang et al. (2007), bakasang merupakan salah satu produk fermentasi oleh mikroba fermentatif golongan bakteri asam laktat. Bakasang umumnya dibuat dari jeroan ikan cakalang yang merupakan golongan scombroid yang berasal dari famili Scombroidae. Jenis ikan tersebut mengandung banyak histidin bebas di dalam jaringan daging dan bagian isi perutnya (jeroan) yang dapat diubah menjadi histamin melalui reaksi dekarboksilasi dan aktivitas bakteri penghasil histamin.
menunjukkan penyimpangan atau kerusakan dari sisi organoleptik seperti warna, bau, rasa dan tekstur sehingga masih dapat diterima oleh masyarakat1.
Sebagai upaya meningkatkan mutu sekaligus menyediakan makanan yang berbasis ikan dan produk olahannya yang aman dan bergizi perlu dilakukan suatu upaya perbaikan dalam pengolahan ikan seperti menjaga sanitasi dan higiene serta menerapkan proses pengolahan yang baik (good processing practices) dalam menghasilkan produk yang aman dikonsumsi. Terbatasnya informasi tentang perkembangan histamin pada produk bakasang dalam kaitannya dengan proses fermentasi dan penyimpanan menjadikan alasan pentingnya dilakukannya penelitian ini. Perkembangan histamin dapat dipengaruhi oleh beberapa faktor diantaranya adalah lama fermentasi, lama penyimpanan, suhu dan aktivitas mikroorganisme pembentuk histamin. Pada penelitian ini dipelajari pengaruh lama fermentasi dan lama penyimpanan terhadap perkembangan histamin pada bakasang jeroan ikan cakalang termasuk karakteristik organoleptik, kimia dan mikrobiologi.
1.2. Perumusan Masalah
Proses fermentasi dalam pembuatan bakasang terjadi secara spontan dimana dalam pembuatannya hanya menambahkan garam tanpa penambahan mikroba starter maupun karbohidrat (nasi dan pati), sehingga pertumbuhan dan aktivitas mikroba dapat terangsang karena adanya penambahan garam tersebut. Penambahan garam dalam pembuatan bakasang mengakibatkan hanya mikroba tertentu saja yang dapat tumbuh.
Penanganan dan pengolahan bahan baku jeroan (fermentasi) sampai menjadi bakasang yang dilakukan di Kota Ternate belum memenuhi persyaratan sanitasi higiene dan tidak diterapkannya sistem rantai dingin. Kondisi tersebut menyebabkan pembentukan senyawa biogenik amin sebagai hasil dekarboksilasi asam amino bebas seperti histidin menjadi histamin dapat meningkat pada jeroan ikan yang difermentasi sehingga bisa menyebabkan keracunan atau alergi pada manusia. Berkaitan dengan keberadaan histamin yang belum pernah dilakukan
1
4
uji keamanannya pada pada produk bakasang, maka diperlukan penelitian yang dapat memberikan informasi tentang kandungan histamin dan mutu bakasang terbaik yang dihasilkan pengolah tradisional di Kota Ternate, dalam kaitannya dalam penanganan dan pengolahan bakasang selama proses fermentasi dan selama penyimpanan.
1.3. Tujuan dan Manfaat Penelitian
Penelitian ini secara umum bertujuan untuk membuat produk bakasang dengan cara fermentasi garam dari jeroan ikan cakalang, sedangkan tujuan khususnya adalah:
1) Mempelajari pengaruh lama fermentasi terhadap perkembangan histamin pada jeroan ikan cakalang (Katsuwonus pelamis, Lin).
2) Mempelajari pengaruh lama penyimpanan terhadap perkembangan histamin pada bakasang jeroan ikan cakalang (Katsuwonus pelamis, Lin).
3) Mempelajari interaksi antara pengaruh lama fermentasi dan lama penyimpanan terhadap perkembangan histamin pada bakasang jeroan ikan cakalang (Katsuwonus pelamis, Lin).
Manfaat penelitian ini diharapkan sebagai sumber informasi tentang perkembangan histamin selama proses fermentasi dan selama penyimpanan terhadap produk bakasang yang diproduksi pengolah tradisional di Kota Ternate Provinsi Maluku Utara.
1.4 Hipotesis
1) Lama fermentasi diduga berpengaruh terhadap perkembangan histamin pada jeroan ikan cakalang (Katsuwonus pelamis, Lin).
2) Lama penyimpanan diduga berpengaruh terhadap perkembangan histamin bakasang jeroan ikan cakalang (Katsuwonus pelamis, Lin).
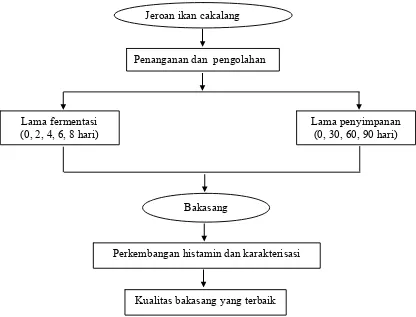
1.5 Kerangka Pemikiran
Jeroan merupakan limbah perikanan yang perlu mendapat perhatian, mengingat jeroan merupakan bagian yang digunakan dalam proses pengolahan produk bakasang sehingga perlunya penanganan dan pengolahan sesuai persyaratan dalam sanitasi dan higiene. Jeroan ikan merupakan salah satu limbah perikanan yang memiliki kandungan histamin dalam jumlah tinggi. Keberadaan histamin dalam ikan dan produk perikanan merupakan masalah besar karena dapat menyebabkan alergi dan efek keracunan bagi kesehatan manusia jika kadarnya melebihi 100 ppm.
6
Gambar 1. Kerangka pemikiran penelitian perkembangan histamin selama proses fermentasi dan penyimpanan produk bakasang jeroan
ikan cakalang (Katsuwonus pelamis, Lin) Kualitas bakasang yang terbaik Penanganan dan pengolahan
Lama fermentasi (0, 2, 4, 6, 8 hari)
Jeroan ikan cakalang
Bakasang
Perkembangan histamin dan karakterisasi
2.1. Deskripsi dan Komposisi Kimia Ikan Cakalang (Katsuwonus pelamis, Lin)
Cakalang adalah ikan pelagis perenang cepat (good swimmer) dan mempunyai sifat rakus (varacious). Ikan ini melakukan migrasi jarak jauh dan hidup bergerombol dalam ukuran besar. Bentuk tubuhnya digolongkan dalam bentuk torpedo yaitu badan fusiform, bagian kepala sangat tebal, ramping dan kuat ke arah ekor dan sedikit pipih pada bagian samping. Penangkapan ikan
cakalang dapat menggunakan pole and line, hand line dan tonda. Cakalang memiliki tubuh fusarium, memanjang dan agak bulat, tapis insang (gill
net) berjumlah 53-65 pada helai pertama. Mempunyai 2 sirip punggung yang terpisah. Pada sirip punggung pertama terdapat 14-16 finlet dan sirip punggung kedua terdapat 7-9 finlet. Badan tidak bersisik kecuali pada badan dan lateral line
terdapat titik-titik kecil. Bagian punggung berwarna gelap disisi bawah dan perut keperakan dengan 4-6 buah garis-garis berwarna kehitaman (gelap) yang memanjang pada bagian sepenjang badan (Matsumoto et al. 1984).
Cakalang mempunyai ukuran panjang 50-70 cm dan berat 1500-5000 g, dengan perbandingan rata-rata untuk setiap bagian tubuh adalah sebagai berikut : daging putih 1-2 %, daging merah 10 %, kepala 11-26 %, insang 3,3 %, isi perut 6,6 %, hati 0,9-3,5 %, ekor dan sirip 1,5-2,5 %, tulang 8,1-11,1 % dan kulit 3,8-6,6 % (Kizevetter 1993). Klasifikasi ikan cakalang menurut Matsumoto et al.
(1984) adalah sebagai berikut:
Kingdom : Animalia Subfilum : Craniata Superkelas : Gnastomata Series : Pisces
8
Subfamili : Scombrina
Tribe : Thunnini Genus : Katsuwonus
Spesies : Katsuwonus pelamis, Lin
Daerah penyebaran ikan cakalang adalah perairan tropis dan subtropis pada lautan Atlantik, Hindia dan Pasifik kecuali laut Mediterania. Penyebaran ini dibedakan menjadi dua macam yaitu penyebaran horizontal atau penyebaran menurut letak geografis perairan dan penyebaran vertikal atau penyebaran menurut kedalaman perairan (Matsumoto et al. 1984). Morfologi ikan cakalang dapat dilihat pada Gambar 2.
Gambar 2. Ikan cakalang (Katsuwonus pelamis, Lin) (www.google.image.com)
2.2. Kesegaran Ikan dan Proses Kemunduran Mutunya
Ikan merupakan bahan pangan yang mudah mengalami kerusakan biologis oleh enzim atau mikroorganisme pembusuk, sehingga memerlukan penanganan yang khusus untuk mempertahankan mutunya. Ikan sebagai bahan mentah yang cepat mengalami pembusukan, maka perlu diterapkan teknik
penanganan yang baik meliputi waktu penanganan, temperatur dan kebersihan (Astawan et al. 1993; Soenardi 2005).
Mutu kesegaran ikan dinilai berdasarkan sejauh mana ikan tersebut masih segar (Syah 2004). Ikan segar merupakan ikan yang baru saja ditangkap belum disimpan atau diawetkan dan mempunyai mutu tidak berubah serta tidak mengalami kerusakan (SNI 01-2729-1992). Nilai kesegaran ikan ditentukan oleh kondisi tempat penangkapan, metode penangkapan dan penanganan yang dilakukan terhadap ikan. Nilai kesegaran ikan menunjukkan mutu ikan tersebut. Tingkat mutu ikan ditentukan oleh kenormalan semua variabel sensori yang meliputi penampakan, tekstur dan bau. Semua variabel sensori ini memiliki hubungan dengan sifat fisiko-kimia ikan (Botta 1994).
Menurut Yunizal dan Wibowo (1998) untuk mengenali segar tidaknya ikan dapat dilakukan pengamatan visual terhadap penampilan ikan secara menyeluruh terutama penampilan fisik, mata, insang dan adanya lendir, meraba adanya lendir dan kelenturan ikan, menekan daging ikan untuk melihat teksturnya dan mencium bau ikan.
Setelah ikan mati, berbagai proses perubahan fisiko-kimia dan mikrobiologi terjadi dengan cepat. Semua proses perubahan ini akhirnya bermuara pada pembusukan. Tahap-tahap kemunduran kesegaran ikan adalah
pre-rigor, rigormortis, autolisis dan penyerangan bakteri. Fase yang terjadi pada ikan yang baru mengalami kematian disebut fase pre-rigor. Perubahan pada fase ini ditandai terlepasnya lendir dari kelenjar di bawah permukaan kulit ikan yang membentuk lapisan bening tebal di sekeliling tubuh. Lendir yang dilepaskan tersebut sebagian besar terdiri dari glukomukoprotein (Rahayu et al. 1992).
Keadaan ini secara biokimia ditandai dengan menurunnya kadar
10
ditandai dengan mengejangnya tubuh ikan setelah mati sebagai hasil perubahan biokimia yang kompleks dalam tubuh ikan (FAO 1995). Hilangnya kelenturan ikan berhubungan dengan terbentuknya aktomiosin yang berlangsung lambat pada tahap awal dan menjadi cepat pada tahap selanjutnya. Setelah itu, ikan memasuki tahap post-rigor yang ditandai dengan mulai melunaknya otot ikan secara bertahap. Lamanya tingkat rigor dipengaruhi oleh kandungan glikogen dalam tubuh ikan dan suhu lingkungan. Kandungan glikogen yang tinggi dapat menunda datangnya proses rigor. Fase rigormortis dianggap penting, karena pada fase ini belum terjadi proses pembusukan dan dikenal sebagai petunjuk bahwa ikan masih dalam keadaan segar (Eskin 1990).
Rigormortis merupakan salah satu perubahan yang terjadi pada daging ikan segera setelah ikan mati, ditunjukkan oleh perubahan kreatin fosfat menjadi ATP dan dimulai pada saat kandungan ATP mulai berkurang. Senyawa ATP terus terdegradasi dan tingkat rigormortis sempurna terjadi pada saat konsentrasinya mencapai 1 µmol/g (Mazzarano-Manzano et al. 2000). Serabut otot daging ikan hidup mengandung protein dalam gel lunak. Selama rigor, gel menjadi kaku dan bila rigor telah berlalu, otot daging menjadi lunak dan lentur kembali. Keadaan ini berlangsung selama 1–7 jam sesaat setelah ikan mati. Nilai pH ikan pada fase ini sekitar 6–7 (Eskin 1990). Tahapan kemunduran mutu ikan Sakaguchi (1990) disajikan pada Tabel 1.
Tabel 1. Tahapan kemunduran mutu ikan
Parameter Tahapan kemunduran mutu ikan
Pre-rigor Rigormortis Post-rigor Pembusukan
Warna insang Merah cerah atau merah segar
daging Semi transparan Keruh
Marioka et al. (1999) menjelaskan bahwa kondisi post-rigor merupakan permulaan dari proses pembusukan yang meliputi autolisis dan pembusukan oleh bakteri. Proses autolisis adalah terjadinya penguraian daging ikan sebagai akibat dari aktivitas enzim dalam tubuh ikan. Hal ini terjadi terutama pada ikan yang disimpan tanpa dibuang isi perutnya.
Proses autolisis akan menyebabkan penguraian protein menjadi senyawa yang lebih sederhana yaitu peptida, asam amino dan amonia yang akan meningkatkan nilai pH daging ikan. Autolisis ditandai dengan adanya senyawa amonia, yang pada tahap sebelumnya tidak dihasilkan pada jaringan tubuh ikan (FAO 1995). Kemunduran mutu ikan setelah mati disebabkan oleh aktivitas enzimatis dan mikrobiologis yang sudah ada secara alami pada tubuh ikan ketika hidup. Pada suhu di bawah 4 ºC proses kemunduran mutu ikan dapat dihambat, sebab pada suhu tersebut penguraian tubuh ikan oleh mikroorganisme dan enzim berlangsung dengan lambat. Kemunduran mutu ikan akan menyebabkan perubahan mutu terhadap flavor, aroma, warna dan penampakan daging ikan yang dapat mempengaruhi daya terima menjadi rendah (Clucas dan Ward 1996).
2.3. Mikrobiologi Ikan Segar
Keberadaan mikroba pada ikan dipengaruhi oleh beberapa faktor yaitu spesies ikan, lingkungan air, habitat, cuaca dan cara penangkapan. Pengaruh spesies ikan terhadap populasi mikroorganisme terutama disebabkan oleh perbedaan kandungan lendir pada kulit ikan antara satu spesies dengan spesies lainnya. Lendir yang menutupi ikan mengandung bakteri jenis Pseudomonas, Sarcina, Serattia, Micrococcus, Vibrio dan Bacillus (Kimata 1961).
Bakteri yang berhasil diisolasi dari saluran usus ikan segar meliputi
Achromobacter, Acinetobacter, Alcaligenes, Enterobacter, Flavobacterium, Pseudomonas dan Xanthomonas. Bakteri yang terdapat pada insang, usus dan lendir ikan sebanyak 60 % terdiri dari jenis Pseudomonas dan Achromobacter, 20 % terdiri dari jenis Corynebacterium, Flavobacterium dan Micrococcus. sedangkan sisanya adalah Alcaligenes, Bacillus, Proteus, Seratia, Graffkya dan
12
Lingkungan air mempengaruhi mikroorganisme pada ikan. Ikan yang hidup di laut utara membawa banyak bakteri psikrofilik, sedangkan ikan yang hidup di laut tropis lebih banyak membawa bakteri mesofilik. Ikan yang hidup di air tawar membawa bakteri jenis Brevibacterium, Alcaligenes, Streptococcus, dan
Lactobacillus. Ikan banyak mengandung bakteri apabila dibiarkan dalam waktu 2-3 jam pada suhu kamar akan cepat mengalami pembusukan. Bakteri yang berperan dalam kebusukan ikan adalah bakteri Gram-negatif berbentuk batang
terutama dari jenis Pseudomonas, Achromobacter dan Alcaligenes (Rahayu et al. 1992).
Kepadatan bakteri pada ketiga lokasi insang, kulit, dan usus tidak sama. Kepadatan bakteri masing-masing pada insang berkisar 103-105 Cfu/g, kulit berkisar 102-106 Cfu/g dan pada usus berkisar 103-107 Cfu/g. Bakteri-bakteri tersebut menyerang tubuh ikan mulai dari insang atau luka-luka yang terdapat pada kulit menuju jaringan tubuh bagian dalam, dari saluran pencernaan menuju jaringan daging dan dari permukaan kulit menuju ke jaringan tubuh bagian dalam dan cara ketiga yang paling sedikit (Hadiwiyoto 1993).
Proses pengawetan dan pengolahan ikan ditujukan untuk membunuh atau menghambat pertumbuhan bakteri. Banyak cara yang telah dilakukan untuk mencegah atau menghambat proses perubahan yang disebabkan oleh bakteri, antara lain dengan menyiangi ikan, merendam ikan dalam zat kimia, menggunakan es batu yang telah diberi zat antibakteri atau melalui proses pembekuan (Clucas dan Ward 1996).
2.4. Protein Ikan
Ikan mengandung protein yang cukup tinggi dan komposisi asam aminonya tidak sama dengan hewan-hewan darat. Ditinjau dari kandungan asam aminonya, maka protein ikan diklasifikasikan sebagai sumber protein yang
bermutu tinggi sebab mengandung asam amino esensial yang lengkap (Zaitsev et al. 1969; Suzuki 1981). Protein adalah senyawa yang mempunyai
adalah daging (sapi, kerbau, kambing, dan ayam), telur (ayam dan bebek), susu dari hasil-hasil perikanan seperti ikan, udang dan kerang (Zaitsev et al. 1969; Winarno et al. 1993).
Protein hewani disebut juga protein yang lengkap dan bermutu tinggi karena mempunyai asam amino esensial yang lengkap dan susunannya mendekati apa yang diperlukan oleh tubuh dan daya cernanya tinggi sehingga jumlah yang dapat diserap oleh tubuh juga tinggi (Sakaguchi 1990). Komponen asam amino ikan laut, ikan air tawar dan daging sapi dapat dilihat pada Tabel 2.
Tabel 2. Komposisi asam amino dalam protein daging ikan laut, ikan air tawar dan daging sapi
Sumber: a) Zaitsev et al. (1969)
b) Mahmud et al. (1990)
c) Slamet dan Purawisastra (1979)
14
2.5. Histidin dan Histamin
Histidin secara alami ditemukan pada kebanyakan hewan dan tumbuhan terutama yang tinggi proteinnya seperti ikan, unggas, keju dan biji gandum. Histidin adalah salah satu asam amino yang merupakan prekursor histamin (Tjay dan Rahardja 2007). Pada umumnya histidin bebas merupakan histidin yang dihasilkan dari degradasi protein pada saat ikan tersebut mengalami pembusukan (Brink et al. 1990; Stratton et al. 1991; Lehane dan Olley 2000).
Ada dua macam histidin dalam daging ikan yaitu histidin bebas dan histidin terikat dalam protein. Hanya histidin bebas yang dapat mengalami dekarboksilasi menjadi histamin. Histidin bebas yang terdapat pada daging ikan erat sekali hubungannya dengan terbentuknya histamin dalam daging. Semua daging ikan yang berwarna merah seperti cakalang, marlin dan sardin, tinggi kandungan histidin bebasnya (Pan 1984).
Rossi et al. (2003); Kung et al. 2005; McLauchlin et al. 2005; Veciana et al. (1996); Kuda et al. (2007) menjelaskan bahwa histidin bebas
banyak terdapat pada ikan scombroid yang berasal dari famili scombroidae dan jaringan lainnya seperti pada jeroan khususnya pilorikaeka dan usus. Lehane dan Olley (2000); Tsai et al. (2007) menambahkan bahwa histamin adalah senyawa yang terdapat di dalam daging ikan yang menyebabkan keracunan scombroid.
2.5.1. Kandungan histamin dan pembentukannya pada ikan
Histamin merupakan senyawa amin biogenik hasil dekarboksilasi asam amino histidin (ά-amino ß-inidosal asam propionat) (Keer et al. 2002; Tjay dan Rahardja 2007). Kandungan histamin pada ikan segar adalah rendah tetapi pada ikan busuk, kandungannya menjadi tinggi (Tsai et al. 2007). Nigous et al.
(1990) menyatakan bahwa penyebab reaksi dekarboksilasi adalah berupa enzim,
panas ataupun suasana basa. Reaksi pembentukan histamin menurut Cheffel et al. (1986) disajikan pada Gambar 3.
Gambar 3. Reaksi pembentukan histamin (Cheffel et al. 1986)
McLauchlin et al. (2005); Suryanti et al. (2006) melaporkan kandungan histamin pada ikan scombroid yang sudah rendah mutunya bervariasi antara 10-100 ppm bahkan kadang-kadang sampai 700-1000 ppm. Kadar histamin jika melebihi 25 ppm sudah mulai terbentuk kerusakan, kadar >50 ppm sudah berbahaya untuk kesehatan dan kadar >100 ppm sudah bersifat racun pada manusia (SNI 01-2360-1991). Standar yang ditetapkan oleh Ditjen P2HP
DKP (2007) kadar histamin untuk hasil dan produk perikanan adalah 100 ppm. Brink et al. (1990) melaporkan kandungan histamin 100-800 ppm sudah toksik,
kadar 500 ppm sudah berbahaya bagi kesehatan manusia (Askar dan Treptow 1993), sedangkan kadar histamin produk perikanan yang masih aman
16
Pada tahun 1998 di New Zaeland, dilaporkan terjadi keracunan histamin pada pengunjung restoran yang memakan steak tuna yang mengandung histamin >50 ppm (Mah et al. 2002). Jumlah histamin yang terbentuk bervariasi pada setiap spesies ikan tergantung pada jumlah histidinnya, tipe dan banyaknya bakteri yang menunjang pertumbuhan dan aktivitas mikroba dan dipengaruhi oleh suhu
penyimpanan dan pH (Pan 1984; Fardiaz 1993; Kushner 1998; Lehane dan Olley 2000; Kim et al. 2000).
Autolisis pada daging ikan mulai berlangsung secara biokimia segera setelah ikan mati terutama pada daging sekitar rongga perut. Setelah fase
rigormortis, enzim di dalam perut ikan aktif menguraikan komponen ikan yang menyebabkan terjadinya perubahan pada rasa, warna tekstur, bau dan penampakan ikan (Hidayat et al. 2006). Menurut Sillasantos et al. (1996); Lehane dan Olley (2000); Tsai et al. (2007) bahwa jumlah histamin yang dihasilkan dari aktivitas bakteri lebih banyak daripada hasil reaksi autolisis. Jumlah histamin yang dikandung oleh ikan dipengaruhi oleh jumlah mikroba atau bakteri yang terdapat pada ikan tersebut.
Kandungan histamin pada ikan yang berukuran kecil jauh lebih banyak dibandingkan dengan ikan yang berukuran besar (Syah 2004). Bakteri pembentuk histamin lebih banyak dijumpai pada insang dan jeroan ikan daripada kulit karena insang dan jeroan merupakan sumber bakteri (Shewan dan Hobbs 1997). Hasil penelitian Keer et al. (2002); Kim et al. (2000) menyatakan bahwa terdapat hubungan atau korelasi positif antara jumlah bakteri dan kadar histamin yang dihasilkan. Pada jaringan ikan beku yang dithawing, produksi histaminnya dapat terhambat. Hal ini disebabkan oleh rusaknya bakteri penghasil histamin dalam proses pembekuan (freezing) dan thawing sehingga mencegah pembentukan senyawa tersebut.
Kim et al. (2004); Tsai et al. (2007) menjelaskan bahwa aktivitas bakteri dan pembentukan histamin dipengaruhi oleh suhu dan waktu inkubasi. Tiap-tiap spesies mempunyai suhu dan waktu optimum yang berbeda. Bakteri pembentuk histamin dapat dikelompokkan menjadi spesies yang mampu memproduksi histamin dalam jumlah besar (>100 ppm) pada suhu di atas 15 0C dengan lama
(< 25 ppm) setelah diinkubasi pada temperatur 30 0C selama > 48 jam.
Bakteri-bakteri yang dapat mendekarboksilasi histidin disajikan pada Tabel 3.
Tabel 3. Bakteri-bakteri yang mendekarboksilasi histidin
Bakteri Morfologi
Hafnia spp., Hafnia alvei
Klebsiella spp., Klebsiella pneumonia, Escherichia coli
Clostridium spp., C. perfringens Lactobacillus spp., Lactobacillus 30a
Enterobacter spp.
Hasil penelitian Taylor dan Behling (1982); Tsai et al. (2007) menunjukkan bahwa bakteri Proteus morganii, Klebsiella pneumonia dan
Enterobacter aerogenes termasuk penghasil histamin yang paling banyak, sedangkan Hafnia alvei, E. coli dan Clostridium freundii menghasilkan histamin sedikit. Keer et al. (2002); Setiyono (2006) menyatakan bahwa histamin merupakan komponen biogenik amin yaitu bahan aktif yang diproduksi secara biologis melalui proses dekarboksilasi dari asam amino bebas serta terdapat pada berbagai bahan pangan seperti ikan, daging merah, keju dan makanan fermentasi.
Menurut Orejana (1984) bahwa adanya histamin pada daging ikan berkaitan dengan ”Scombroid poisoning” sehingga histamin dapat digunakan sebagai indikator adanya suatu toksin dalam tuna, mackerel (kembung) dan ikan-ikan sejenis lainnya. Istilah ”Scombroid poisoning” merupakan istilah yang umum digunakan untuk menyebutkan ikan yang secara alami telah mengandung senyawa toksin. Ditambahkan lebih lanjut oleh Veciana et al. (1996); Rossi et al.
(2003) bahwa ikan-ikan yang termasuk dalam kelompok ini adalah ikan tongkol, kembung, cakalang, tuna dan bonito.
Yatsunami et al. (1994) melaporkan bahwa bakteri pembentuk histamin yang diisolasi dari produk fermentasi ikan sardin adalah Staphylococcus,
18
menyatakan bahwa kadar histamin pada ikan mackerel dan ikan sardin berkisar 12,6-30,5 ppm, sedangkan bakteri pembentuk histamin yang paling
dominan adalah bakteri asam laktat berbentuk kokus Tetragenococcus. Kobayashi et al. (2004) melaporkan bakteri pembentuk histamin yang berhasil
diidentifikasi dari fermentasi ikan mackerel dan ikan sardin adalah T. mutiaticus.
Dapkevicius et al. (2000) melaporkan juga bahwa ditemukan strain
Lactobacillus sake yang mendegradasi histidin menjadi histamin dalam pasta ikan sardin yang difermentasi. Mah et al. (2002) melaporkan bahwa peningkatan histamin pada sardin dan mackerel setelah penyimpanan pada suhu 4 0C selama
fermentasi 10 hari berkisar 521-751 ppm.
2.5.2. Reaksi fisiologis histamin
Histamin mempunyai fungsi penting dalam tubuh yaitu dihubungkan dengan fenomena fisiologis, patologis terutama dengan pelepasan pada reaksi anafilaksis dan alergi. Alergi berarti masuknya suatu bahan asing yang menyebabkan reaksi tidak menyenangkan di dalam jaringan tubuh, namun tidak terjadi pada setiap orang. Keracunan adalah efek dari mengkonsumsi pangan tertentu yang melebihi dari yang ditetapkan berlaku pada setiap orang. Secara garis besar reaksi alergi dapat dibagi atas 3 golongan yaitu reaksi pertama terjadi sangat cepat, reaksi ini terjadi sedemikian rupa sehingga bibir, lidah dan tenggorokan langsung membengkak dan menghalangi masuknya makanan. Manifestasi alerginya cepat sehingga mudah diketahui makanan yang mengandung alergen. Reaksi kedua terjadi lebih lambat perlu waktu berjam-jam lamanya dengan demikian lebih sukar untuk mengetahui makanan mana yang bertanggung jawab atas manifestasi alergi pada seorang penderita. Reaksi ketiga lebih lama lagi, manifestasi klinis dari reaksi ketiga ini biasanya berupa kemerahan pada kulit (Rengganis 2007).
walaupun tidak berolah raga. Reaksi antigen-antibodi menyebabkan pelepasan histamin sehingga terjadi fase dilatasi, gatal dan edema (Mumby 1995).
Pelepasan histamin selama terjadi reaksi antigen-antibodi telah dilaporkan oleh para peneliti. Histamin telah diketahui merupakan perantara terjadinya fenomena hipersensitivitas (Syamsudin 1990). Keracunan histamin jarang terjadi dan biasanya terjadi karena overdosis. Gejala utama yang timbul yaitu sakit kepala, diare, muntah-muntah, bibir bengkak dan rasa terbakar di tenggorokan (Rice et al. 1976; Ronald et al. 1999). Menurut Lehane dan Olley (2000) keracunan histamin dapat dibagi dalam tiga kelompok yaitu keracunan tingkat lemah apabila mengkonsumsi 8 - 40 ppm, keracunan sedang apabila
mengkonsumsi 70 - 100 ppm dan keracunan kuat apabila mengkonsumsi 150 - 400 ppm histamin.
2.6. Fermentasi
Proses fermentasi adalah pemecahan karbohidrat menjadi alkohol dan karbondioksida (CO2), tetapi banyak proses yang disebut fermentasi tidak selalu
menggunakan substrat karbohidrat sebagai media fermentasi yang menghasilkan alkohol dan CO2 saja. Selain karbohidrat, protein dan lemak dapat juga dipecah
oleh mikroba atau enzim tertentu untuk menghasilkan asam amino, asam lemak dan zat-zat lainnya (Rahayu et al. 1992).
Fukami et al. (2002); Syah (2004) menjelaskan bahwa pada prinsipnya fermentasi adalah proses perubahan substrat organik yang kompleks menjadi komponen yang lebih sederhana dengan adanya aktivitas enzim dan mikroba dalam keadaan terkontrol, dimana bahan-bahan atau komponen yang dihasilkan dapat menghambat kegiatan mikroba pembusuk. Selain menghambat pertumbuhan mikroorganisme yang tidak diinginkan, perubahan yang terjadi dapat memperbaiki nilai gizi produk.
20
tergantung pada jenis bahan pangan (substrat), jenis mikroba dan kondisi di sekelilingnya yang mempengaruhi pertumbuhan dan metabolisme mikroba tersebut.
Berdasarkan sumber mikroba yang berpengaruh dalam fermentasi, maka fermentasi makanan dapat dibedakan atas dua kelompok yaitu fermentasi spontan dan fermentasi tidak spontan. Fermentasi spontan terjadi pada makanan yang dalam pembuatannya tidak ditambahkan mikroba dalam bentuk starter, tetapi mikroba yang berperan aktif dalam proses fermentasi berkembang biak secara spontan karena lingkungan hidupnya yang dibuat sesuai untuk pertumbuhannya. Fermentasi tidak spontan terjadi pada makanan yang dalam pembuatannya ditambahkan mikroba dalam bentuk kultur atau starter, dimana mikroba tersebut akan berkembang biak dan aktif dalam mengubah bahan yang difermentasi menjadi produk yang diinginkan (Fardiaz 1993; Ruddle dan Ishige 2005).
2.6.1. Fermentasi dengan garam
Peranan garam dalam fermentasi adalah sebagai penyeleksi mikroorganisme yang diperlukan. Jumlah garam yang ditambahkan berpengaruh pada populasi mikroorganisme dan jenis mikroorganisme yang tumbuh. Oleh karena itu kadar garam dapat digunakan untuk mengendalikan aktivitas fermentasi apabila faktor-faktor lainnya sama (Winarno et al. 1993; Hermansyah 1999).
Penambahan garam dalam fermentasi ikan mempunyai beberapa fungsi yaitu meningkatkan rasa ikan, membentuk tekstur yang diinginkan, mengontrol pertumbuhan mikroorganisme yang diinginkan dalam fermentasi dan menghambat pertumbuhan mikroorgansime pembusuk dan patogen (Rahayu et al. 1992; Winarno et al. 1993; Ijong dan Ohta 1995).
Garam dapat berfungsi sebagai penghambat pertumbuhan mikroorgansime pembusuk dan patogen karenanya mempunyai sifat-sifat antimikroba yaitu: garam akan meningkatkan tekanan osmotik substrat; garam menyebabkan terjadinya penarikan air dalam bahan pangan, sehingga aw bahan
menghasilkan ion klor yang beracun terhadap mikroorganisme dan dapat mengganggu kerja enzim proteolitik karena dapat mengakibatkan terjadinya dena turasi protein (Heruwati 2000; Rahayu et al.1992).
Fermentasi menggunakan garam sangat berperan dalam penguraian senyawa-senyawa seperti enzim dari ikannya sendiri, terutama enzim dari isi perut
dan mikroorganisme yang berasal dari ikan maupun garam yang digunakan (Rahayu et al. 1992). Ijong dan Ohta (1995) menambahkan bahwa pada proses
pembuatan bakasang ikan sardin, garam yang digunakan selain berfungsi untuk mengikat air dan pemberi rasa sedap juga dapat menghambat pertumbuhan mikroorganisme yang tidak dikehendaki.
2.6.2. Fermentasi bakasang
Proses fermentasi yang terjadi pada ikan merupakan proses penguraian secara biologis atau semibiologis terhadap senyawa-senyawa kompleks terutama protein menjadi senyawa-senyawa yang lebih sederhana dalam keadaan terkontrol. Selama proses fermentasi, protein ikan akan terhidrolisis menjadi asam-asam amino dan peptida yang berperan dalam pembentukan cita rasa produk. Jika ke dalam bahan mentahnya ditambahkan sumber karbohidrat, misalnya pati atau nasi, maka selama fermentasi akan terjadi pemecahan pati menjadi komponen-komponen yang lebih sederhana seperti asam dan alkohol (Rahayu et al. 1992; Winarno et al. 1993).
Produk akhir fermentasi ikan dapat berupa ikan utuh, pasta atau saus. Prinsip pengawetan pada produk fermentasi ikan disebabkan oleh beberapa faktor diantaranya penurunan aktivitas air oleh garam, gula, pengeringan dan
dikombinasikan dengan penurunan pH oleh bakteri pembentuk asam (Rahayu et al. 1992). Bakasang adalah suatu produk fermentasi ikan berupa
larutan kental (semisolid) dan dibuat melalui fermentasi dengan medium garam yang rasanya asam dan biasanya disajikan sebagai pelengkap lauk yang sebelumnya dibumbuhi cabe dan gula. Bakasang merupakan salah satu produk
fermentasi oleh mikroba fermentatif yang disebut bakteri asam laktat (Gunena 2000; Ijong dan Ohta 1995).
-22
Bakasang digolongkan dalam fermentasi spontan, karena dalam pembuatannya dilakukan penambahan garam dan tidak menambahkan starter mikroba maupun karbohidrat. Produk fermentasi yang dibuat menggunakan kadar garam tinggi tidak dapat digunakan sebagai makanan sumber protein karena rasanya yang terlalu asin, sehingga jumlah yang dapat dikonsumsi juga terbatas. Produk-produk semacam ini biasanya hanya digunakan sebagai bahan perangsang makan, penyedap makanan atau bumbu. Proses fermentasi ikan merupakan proses biologis atau semi-biologis yang pada prinsipnya dapat dibedakan atas empat golongan (Rahayu et al. 1992) yaitu:
1). Fermentasi menggunakan kadar garam tinggi, misalnya dalam pembuatan peda, kecap ikan dan bakasang.
2). Fermentasi menggunakan asam-asam organik, misalnya dalam pembuatan silase ikan dengan cara menambahkan asam-asam propionat dan format. 3). Fermentasi menggunakan asam-asam mineral, misalnya dalam pembuatan
silase ikan menggunakan asam-asam kuat.
4). Fermentasi menggunakan bakteri asam laktat, misalnya dalam pembuatan bakasang.
Daengsubha (1998) melaporkan bahwa dari produk Plaa-ra (produk sejenis bakasang yang berasal dari ikan air tawar di Thailand) dengan waktu fermentasi selama 6 bulan telah ditemukan mikroba seperti Bacillus, Pediococcus halophilus, Micrococcus sp. dan Staphylococcus epidermis dengan komposisi terdiri dari 7,95-20,28 % protein, 11,61-23,82 % garam, pH 4,0-6,90 serta terdapat 0,71-1,94 % asam laktat. Sumanti (1998) berhasil melakukan isolasi dan identifikasi bakteri halofilik selama fermentasi jeroan ikan cakalang, ditemukan bakteri seperti Micrococcus, Halobacterium salinarum, Staphylococcus sp dan
Bacillus sp. Pada fermentasi bakasang ikan sardin yang diteliti oleh Ijong dan Ohta (1995) ditemukan bakteri asam laktat Lactobacillus pada pH 5,5-5,9 menggunakan kadar garam 20 % dan lama fermentasi 14 hari.
Mikroba yang berhasil diisolasi dari bakasang ikan mujair ditemukan
mikroflora yang diisolasi dari produk fermentasi Plaa-som (salah satu produk fermentasi ikan laut (Channas triatus) selama 12 hari fermentasi ditemukan
Lactobacillus plantarum, Lalimentarius, Lactococcus garviae, Pediococcus pentosaceus, Staphylococcus dan Zygossacharomycez sp. Komposisi kimia silase jeroan ikan cakalang (produk sejenis bakasang dari Sulawesi Utara) terdiri dari protein 14,82-15,91 %, lemak 0,91-1,37 %, air 69,13-75,38 % dan kadar abu 13,12-15,07 % (Kaseger 1986).
3. METODOLOGI PENELITIAN
3.1. Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan April sampai dengan September 2008. Kegiatan preparasi, fermentasi jeroan, perebusan, penyimpanan bakasang, pengujian Total Volatile Bases (TVB), pengujian kadar histamin, pengujian
Salmonella dan Escherichia coli dilakukan di Laboratorium Pengujian Mutu Hasil
Perikanan (LPMHP) DKI Pluit, Jakarta Utara. Pengujian total mikroba/
Total Plate Count (TPC) dan total kapang dilakukan di Laboratorium Mikrobiologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan IPB. Laboratorium Biokimia Pangan, Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian IPB untuk pengujian kadar air, kadar protein dan nilai pH.
3.2. Bahan dan Alat
3.2.1. Bahan
Bahan baku yang digunakan pada penelitian ini adalah jeroan (usus, hati, jantung, paru dan telur) ikan cakalang (Katsuwonus pelamis, Lin) yang diperoleh dari Tempat Pelelangan Ikan (TPI) Muara Angke, Jakarta Utara. Bahan pembantu yang digunakan adalah garam yodium cap Jempol yang diperoleh dari pasar tradisional Jakarta Utara.
Bahan-bahan kimia yang digunakan untuk analisis TVB meliputi TCA 5 %, larutan K2CO3 dan HCl 0,01 N. Bahan-bahan kimia untuk analisis
kadar protein meliputi NaOH, Na2S2O3, NaSO4, CuSO4, K2SO4, H3BO3, H2SO4
dan HCl 0,1 N. Bahan untuk analisis pH yaitu akuades, sedangkan bahan-bahan kimia untuk analisis histamin terdiri atas NaOH 2 N, HCl 0,1 N, HCl 2 N, H3PO4
3,75 N, metanol, resin amberlite, Orto-ptalatdikarboksildehid (OPT) 1 %. Bahan untuk analisis total mikroba dan total kapang adalah NaCl 0,89 %. Media untuk uji total mikroba (TPC) dan total kapang terdiri atas Plate Count Agar (PCA) dan
Agar (XLDA), Tetrathionate Broth (TTB), Lactose Broth (LB), Rappaport Vassiliadis (RV). Media untuk uji Escherichia coli terdiri atas Escherichia coli Broth (ECB), Lauryl Tryptose Broth (LTB), larutan Butterfield’s Phosphate Buffered (BPB), sedangkan bahan-bahan lain yang digunakan adalah kapas, tissue dan alkohol 70 %.
3.2.2. Alat
Alat-alat yang digunakan dalam penelitian ini adalah alat preparasi jeroan, alat untuk fermentasi, alat untuk penyimpanan bakasang dan alat-alat untuk analisis kimia dan organoleptik. Alat-alat yang digunakan dalam preparasi jeroan meliputi coolbox, pisau, talenan, gunting, pinset, wadah plastik, wajan (untuk perebusan jeroan), saringan, gelas ukur dan timbangan analitik. Alat-alat yang digunakan untuk proses fermentasi jeroan adalah plastik polyethylene steril dan wadah plastik. Alat yang digunakan untuk penyimpanan bakasang adalah botol pyrex 250 ml. Alat-alat yang digunakan dalam analisis kimia meliputi spektrofotometer, kolom resin, inkubator, waterbath, glasswoll, homogenizer,
cawan Conway, cawan porselin, destilasi protein, kompor gas, lampu bunsen, labu ukur, erlenmeyer, labu Kjeldhal, kertas saring Whatman No.01, gelas ukur, gelas piala, pipet, spatula, erlenmeyer, pH meter, vortex, batu stirer dan tabung reaksi, sedangkan alat-alat untuk uji organoleptik terdiri atas lembaran score sheet dan piring stearoform untuk menyajikan bakasang.
3.3. Tahapan Penelitian
Penelitian ini dilakukan dalam tiga tahap yaitu tahap preparasi jeroan ikan cakalang, tahap fermentasi jeroan dan tahap penyimpanan bakasang.
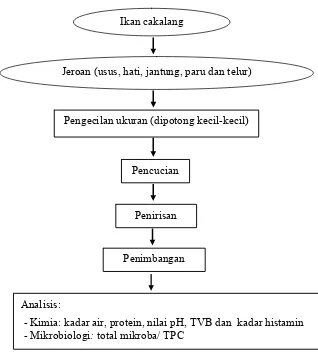
3.3.1. Preparasi jeroan
26
histamin dan uji total mikroba/ TPC. Diagram alir proses preparasi jeroan ikan cakalang disajikan pada Gambar 4.
Gambar 4. Tahapan preparasi jeroan ikan cakalang (Katsuwonus pelamis, Lin)
3.3.2. Proses fermentasi jeroan
Jeroan yang telah dilakukan penimbangan kemudian ditambahkan garam 25 % (fermentasi 0 hari) dan dilakukan pengujian. Jeroan tersebut selanjutnya dibagi dalam 4 wadah dan ditutup dengan plastik polyethylene yang sudah disterilkan untuk proses fermentasi pada suhu kamar. Pengamatan dilakukan pada 2, 4, 6 dan 8 hari dan analisis yang dilakukan meliputi kadar air, kadar protein, nilai pH, kadar histamin, total mikroba/ TPC, Salmonella dan
Escherichiacoli. Tahapan proses fermentasi jeroan disajikan pada Gambar 5. Analisis:
- Kimia: kadar air, protein, nilai pH, TVB dan kadar histamin
- Mikrobiologi: total mikroba/ TPC
Pengecilan ukuran (dipotong kecil-kecil)
Pencucian
Penirisan
Penimbangan Ikan cakalang
Gambar 5. Tahapan proses fermentasi jeroan ikan cakalang (Katsuwonus pelamis, Lin)
3.3.3. Penyimpanan bakasang
Jeroan yang sudah difermentasi kemudian dimasak (dalam keadaan mendidih) dan dibiarkan sampai hangat kemudian dilakukan penyaringan. Hasil
saringan yang berwarna coklatnya selanjutnya dimasukkan dalam botol steril (bakasang) 250 ml dan dilanjutkan dengan proses penyimpanan pada suhu kamar
selama 90 hari. Pengamatan dilakukan pada 0, 30, 60 dan 90 hari untuk setiap lama fermentasi dan analisis yang dilakukan meliputi kadar air, protein, nilai pH, kadar histamin, total mikroba/ TPC, total kapang dan uji organoleptik (uji skoring dan uji perbandingan pasangan). Diagram alir proses penyimpanan bakasang disajikan pada Gambar 6.
Analisis:
- Kimia: kadar air, protein, nilai pH dan kadar histamin
- Mikrobiologi: total mikroba/ TPC, Salmonella dan Escherichia coli
Pemisahan dalam wadah plastik dan ditutup dengan plastik steril
Penambahan garam 25 % Penimbangan
Proses fermentasi pada suhu kamar (0, 2, 4, 6, 8 hari)
28
Gambar 6. Proses penyimpanan bakasang jeroan ikan cakalang (Katsuwonus pelamis, Lin)
Filtrat (larutan coklatnya)
Penyimpanan 3 bulan pada suhu kamar (0, 30, 60, 90 hari)
Pengisian dalam botol steril Pemasakan 30 menit
(sampai hancur)
Penyaringan
Bakasang
Analisis:
- Kimia: kadar air, protein, nilai pH dan kadar histamin - Mikrobiologi: total mikroba dan total kapang
- Organoleptik: uji skoring dan uji perbandingan pasangan (penampakan, bau, rasa dan tekstur)
Biarkan sampai hangat Proses fermentasi
3.4. Prosedur Analisis
Analisis yang dilakukan dalam penelitian ini meliputi analisis kimia, analisis mikrobiologi dan uji organoleptik (uji skoring dan uji perbandingan pasangan).
3.4.1. Analisis kimia
(a) Kadar air (AOAC 1995)
Prinsip kerja penentuan kadar air adalah mengeringkan bahan dalam oven pada suhu 105-110 0C selama 12 jam atau sampai didapatkan berat konstan.
Selisih berat sebelum dan sesudah pengeringan adalah banyaknya air yang diuapkan. Prosedur penentuan kadar air adalah sebagai berikut: cawan porselin kosong dikeringkan pada suhu 105-110 0C selama 15 menit, didinginkan dalam
desikator kemudian ditimbang. Sampel ditimbang sebanyak 3 g dimasukan ke dalam cawan kosong yang sudah ditimbang beratnya, selanjutnya cawan dan sampel dikeringkan dalam oven bersuhu 105 0C selama 12 jam. Cawan yang
sudah didinginkan dalam desikator selama 30 menit kemudian ditimbang hingga diperoleh bobot konstan. Perhitungan nilai kadar air dihitung menggunakan rumus sebagai berikut:
B = berat sampel setelah dikeringkan (g)
(b) Kadar protein (Apriyantono et al. 1989)
Prinsip analisis protein adalah pengukuran kadar nitrogen (N) dari sampel
dengan menggunakan Metode Kjeldahl. Cara Kjeldahl digunakan untuk
menganalisis kadar protein kasar dalam bahan makanan secara tidak langsung
dengan mengalikan hasil analisis tersebut dengan angka konversi 6,25 diperoleh
nilai protein dalam bahan makanan. Prosedur kerjanya adalah sebagai berikut:
Sampel ditimbang sebanyak 1-2 g dan dimasukkan ke dalam labu Kjeldahl.
30
dimasukkan batu didih. Sampel dididihkan selama 1-1,5 jam sampai cairan
menjadi jernih dan didinginkan. Air sebanyak 5-10 ml ditambahkan secara
perlahan-lahan melalui dinding labu Kjeldahl dan didinginkan kembali. Isi labu
dipindahkan ke dalam destilasi kemudian dicuci dan dibilas sebanyak 5-6 kali
dengan 1-2 ml air. Air cucian dipindahkan ke dalam alat destilasi. Erlenmeyer
yang berisi 5 ml H3BO3 dan 2-4 tetes indikator (campuran metil merah 0,2 %
dalam alkohol dan metil biru 0,2 % dalam alkohol) diletakkan di bawah
kondensor. Ujung tabung kondensor direndam dalam larutan H3BO3 dan
ditambahkan 8-10 ml larutan NaOH-Na2S2O3, kemudian dilakukan destilasi
sampai tertampung kurang lebih 15 ml destilat dalam erlenmeyer. Tabung
kondensor dibilas dengan air dan bilasan ditampung dalam labu yang sama. Isi
labu erlenmeyer diencerkan sampai 50 ml kemudian dititrasi dengan HCl 0,02 N
sampai terjadi perubahan warna menjadi abu-abu. Kadar protein dihitung dengan
rumus:
Sampel ditimbang seberat 2 g, dihancurkan dengan blender lalu didispersikan kedalam 20 ml akuades dan diaduk selama 2 menit. Alat pH meter dikalibrasi dengan menggunakan buffer pH standar (pH 4 dan pH 7) dan selanjutnya elektroda yang telah dibersihkan dicelupkan ke dalam sampel yang akan diperiksa. Nilai pH merupakan hasil pembacaan jarum penunjuk pada pH meter selama 1 menit atau sampai angka digital tidak berubah.
(d) Total Volatile Bases (TVB) (AOAC 1995)
Prinsip penetapan TVB adalah menguapkan senyawa-senyawa volatil yang terbentuk karena penguraian asam-asam amino yang terdapat pada daging ikan. Komponen-komponen utama TVB adalah amine (NH3), Trimethyl amine
jernih. Larutan asam borat sebanyak 1 ml dimasukkan kedalam cawan conway
pada bagian inner chamber kemudian 1 ml sampel yang dianalisis dimasukkan ke dalam outer chamber. Larutan K2CO3 dimasukkan dalam sisi outer chamber
yang berlainan, lalu ditutup rapat (pada bagian tepi cawan sebelumnya diolesi dengan vaselin).
Blanko dibuat dengan prosedur yang sama, tetapi sebagai filtrat sampel diganti dengan TCA 3 %. Cawan ditutup, digoyang selama 1 menit agar tercampur selanjutnya diinkubasi selama 2 jam. Setelah diinkubasi, larutan asam borat pada bagian inner chamber dititrasi dengan HCl 0,01 N hingga berwarna merah muda. Kadar TVB ditentukan dengan rumus sebagai berikut :
15
(e) Kadar histamin (SNI 01-2360-1996)
Kadar histamin dianalisis menggunakan alat spektrofotometer. Prinsip pengujian ini adalah histamin diekstrak dari jaringan daging contoh menggunakan metanol dan sekaligus mengkonversi histamin dalam bentuk OH. Zat-zat histamin selanjutnya dimurnikan melalui resin penukar ion dan diubah ke bentuk derivatnya dengan senyawa Orto-ptalatdikarboksildehid (OPT). Besarnya histamin diukur secara fluorometri pada panjang gelombang eksitasi 350 nm dan emisi 444 nm. Pengukuran kadar histamin secara fluorometri terdiri atas beberapa tahapan sebagai berikut:
1). Tahap ekstraksi (preparasi sampel)
Sampel sebanyak 10 g ditimbang kemudian ditambahkan dengan metanol sebanyak 50 ml lalu dihomogenkan dengan homogenizer kurang lebih 1-2 menit. Sampel yang sudah dihomogenkan dipanaskan dalam waterbath pada suhu 60 0C