PEMANFAATAN HIDROLISAT TANDAN KOSONG KELAPA
SAWIT (TKKS) UNTUK PRODUKSI ETANOL
DENGAN Pichia stipitis
DEDE ROPIAH
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
PEMANFAATAN HIDROLISAT TANDAN KOSONG KELAPA
SAWIT (TKKS) UNTUK PRODUKSI ETANOL
DENGAN Pichia stipitis
DEDE ROPIAH
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
PEMANFAATAN HIDROLISAT TANDAN KOSONG KELAPA
SAWIT (TKKS) UNTUK PRODUKSI ETANOL
DENGAN Pichia stipitis
Skripsi
Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Oleh :
DEDE ROPIAH 105096003159
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
PEMANFAATAN HIDROLISAT TANDAN KOSONG KELAPA
SAWIT (TKKS) UNTUK PRODUKSI ETANOL
DENGAN Pichia stipitis
Skripsi
Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif HidayatullahJakarta
Oleh :
DEDE ROPIAH 105096003159
Menyetujui,
Pembimbing I, Pembimbing II,
Dr. Yanni Sudiyani, M.Agr. Sandra Hermanto, M.Si NIP. 19580526 198 403 2 003 NIP. 19750810 200501 1 005
Mengetahui,
Ketua Program Studi Kimia
Skripsi berjudul ”Pemanfaatan Hidrolisat Tandan Kosong Kelapa Sawit (TKKS) Untuk Produksi Etanol Dengan Pichia stipitis” yang ditulis oleh Dede Ropiah, NIM 105096003159 telah diuji dan dinyatakan.”Lulus” dalam sidang Munaqosyah Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta pada tanggal “07 April 2010” Skripsi ini telah diterima sebagai salah satu syarat untuk memperoleh gelar Sarjana Strata Satu (S1) Program Studi Kimia.
Menyetujui,
Penguji I, Penguji II,
Sri Yadial Chalid, M.Si La Ode Sumarlin, M.Si NIP. 19680313 200312 2 001 NIP. 150 408 693
Pembimbing I, Pembimbing II,
Dr. Yanni Sudiyani, M.Agr. Sandra Hermanto, M.Si NIP. 19580526 198 403 2 003 NIP. 19750810 200501 1 005
Mengetahui,
Dekan Fakultas Sains dan Teknologi Ketua Program Studi Kimia
PERNYATAAN
DENGAN INI SAYA MENYATAKAN BAHWA SKRIPSI INI ADALAH
HASIL KARYA SENDIRI YANG BELUM PERNAH DIAJUKAN SEBAGAI
SKRIPSI ATAU KARYA TULIS ILMIAH PADA PERGURUAN TINGGI
ATAU LEMBAGA MANAPUN
Yakarta, April 2010
ABSTRAK
DEDE ROPIAH. Pemanfaatan Hidrolisat Tandan Kosong Kelapa Sawit (TKKS) untuk Produksi Etanol Dengan Pichia stipitis. Dibawah bimbingan Dr. Yanni Sudiyani, M.Agr. dan Sandra Hermanto, M.Si.
Limbah padat industri kelapa sawit berupa tandan kosong kelapa sawit (TKKS) yang mengandung hemiselulosa belum banyak dimanfaaatkan. Hidrolisis hemiselulosa TKKS menghasilkan hidrolisat sebagai sumber karbon dalam fermentasi etanol. Tujuan penelitian ini adalah untuk memanfaatkan hidrolisat TKKS untuk memproduksi etanol menggunakan Pichia stipitis. Hidrolisat didetoksifikasi dengan penguapan 80% dan 85% (v/v) dan penambahan NaOH 10% (b/v). Fermentasi dilakukan pada pH 5 dan substrat media fermentasi A (3% xilosa tanpa hidrolisat TKKS), media fermentasi B (campuran 2,4% xilosa dan 0,6% hidrolisat TKKS), media fermentasi C (campuran 3% xilosa murni dan 2% glukosa tanpa hidrolisat TKKS), dan media fermentasi D (campuran 2,4% xilosa; 1,6% glukosa; dan 1% hidrolisat TKKS). Untuk memperoleh yield etanol yang tinggi selama proses fermentasi dilakukan optimasi pH pertumbuhan Pichia stipitis dengan metode turbidimetri pada panjang gelombang 600 nm, analisa kadar gula pereduksi sebelum dan sesudah fermentasi (metode Nelson-Somogyi), total karbon dioksida (gravimetri), perubahan pH dan analisa kadar etanol menggunakan kromatografi gas setelah fermentasi. Hasil penelitian menunjukkan konsentrasi etanol tertinggi dihasilkan pada media tanpa hidrolisat TKKS yaitu media C (11,99 g/l) pada jam ke-148, sedangkan pada media yang mengandung hidrolisat TKKS (B dan D) hanya dihasilkan kadar etanol sebesar (7,73 g/l dan 6,15 g/l). Hasil analisis CO2 menunjukkan total CO2 yang dihasilkan pada media
tanpa hidrolisat TKKS yaitu media fermentasi C jauh lebih besar (54,13 mg/ml) jika dibandingkan dengan media fermentasi yang mengandung hidrolisat yaitu media fermentasi B dan D (8,6 mg/ml dan 12,43 mg/ml). Hal ini menunjukan bahwa konversi gula pada media fermentasi B dan D belum cukup optimal untuk menghasilkan yield etanol yang cukup besar.
ABSTRACT
DEDE ROPIAH. The Utilization of Hidrolysate Palm Oil Empty Fruit Bunch (POEFB) for Ethanol Production by Pichia stipitis. Advisors Dr. Yanni Sudiyani, M.Agr and Sandra Hermanto, M.Si
Palm Oil solid industrial waste as palm oil empty fruit bunch (POEFB) which content of hemicellulose had not been utilization. Hydrolysis of POEFB hemisellulose enriche of hydrolysate as carbon source in fermentation ethanol. This research had been done POEFB hydrolysate to produce ethanol by using Pichia stipitis. Hydrolysate had been detoxified with evaporation volum of hydrolisate (80% and 85% (v/v)) and NaOH 10% (w/v) addition. Fermentation conducted on pH 5 and medium fermentation A (3% pure xilosa without POEFB hidrolysate), B (mixture 2,4% pure xylose and 0,6% POEFB hidrolysate), C (mixture 3% pure xylose and 2% pure glucose without POEFB hidrolysate), and D (mixture 2,4% pure xilosa; 1,6% pure glucose and 1% POEFB hidrolysate). Subtarget high yield of etanol fermentation process conducted by optimation of pH growth Pichia stipitis by methode turbydymetry at wavelength 600nm and analyse of sugar utilization before and after fermentation (methode Nelson-Somogyi), total of carbon dioxide (gravimetry) and analyse ethanol by using gas chromatography after fermentation. The result show that the higher ethanol concentration got from medium without POEFB hydrolysate as medium C (11,99 g/l) was achieved after 148 hours, compared to medium fermentation containing POEB hydrolysate (B and D) was (7,73 g/l and 6,15 g /l). Result of analyse total CO2 at medium without POEFB hydrolysate as medium fermentation C was
higher (54,13 mg/ml) than medium containing POEFB hydrolysate (B dan D) was (8,6 mg/ml and 12,43 mg/ml). It was conducted that sugar conversion from medium of fermentation (B dan D) still not optimum yet to obtain higher yield ethanol.
KATA PENGANTAR
Assalamu’alaikum Warahmatullahi Wabarakatuh
Segala puji bagi Allah SWT yang Maha Esa lagi Maha Perkasa yang
mengatur hidup dan kehidupan manusia serta makhluk-Nya yang lain. Atas berkat
rahmat dan karunia serta ridho-Nya, akhirnya penulis dapat menyelesaikan skripsi
yang berjudul “Pemanfaatan Hidrolisat Tandan Kosong Kelapa Sawit (TKKS)
untuk Produksi Etanol Dengan Pichia stipitis” Shalawat serta salam semoga
tetap tercurah kepada junjungan kita Rasulullah Muhammad SAW, kepada
keluarga dan para sahabatnya serta seluruh muslimin dan muslimat selaku
ummatnya. Amin.
Skripsi ini disusun untuk memenuhi salah satu syarat menempuh ujian
Sarjana Sains pada Program Studi Kimia, Fakultas Sains dan Teknologi,
Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
Dalam penyusunan skripsi ini, penulis mendapat bimbingan dan bantuan
dari berbagai pihak. Oleh karena itu pada kesempatan ini penulis mengucapkan
terimakasih kepada :
1. Ibu Dr. Yanni Sudiyani, M.Agr., selaku pembimbing I yang berkenan
meluangkan waktu di tengah jadwalnya yang begitu padat, untuk menuntun
dan membimbing penulis dalam pelaksanaan penelitian dan penulisan serta
pemahaman mengenai skripsi yang penuh dengan tantangan ini.
2. Bapak Sandra Hermanto, M.Si., selaku Pembimbing II yang telah menuntun
3. Bapak (Endun) dan Ibu (Alm. Rusiti) serta kakak-kakak dan adiku tercinta (aa
Curyo, aa Pudin, aa Abu, aa Komar, Nur) dan juga enam keponakan tercinta
(Opa, Jejen, Fajar, Syifa, Daffa, dan Fikri) yang telah memberikan cinta dan
kasih sayangnya baik secara moril maupun materil dalam pelaksanaan dan
penyusunan skripsi.
4. Ibu Dra. Tami, M.Sc dan Bapak Teuku Beuna Bardan, S.T., selaku peneliti di
P2 Kimia LIPI Serpong yang telah membantu dan memberikan masukan
kepada penulis ketika pelaksanaan penelitian.
5. Seluruh Dosen dan karyawan Program Studi Kimia, terimakasih atas
pengajaran dan ilmunya yang bermanfaat bagi penulis.
6. Analis Laboratorium Bidang Teknologi Lingkungan (Ibu Irni, Ibu Ai, Bapak
Hendris) yang telah membantu penulis selama penelitian.
7. Analis Laboratorium Afiliasi Universitas Indonesia (mas Roy, pa Sunardi, dan
pa Puji) yang telah membantu dan menghibur penulis selama analisa etanol.
8. Susti, Wardah, Rezka, Hilda, Iman, Eli, Tina, dan Lia yang sama-sama
merasakan suka dan duka selama penelitian, serta selalu mendengarkan keluh
kesah dan berbagi ilmu kepada penulis.
9. Sahabat-sahabat terbaikku, Afit, Erna, Mamat, Udin, Andi, Rini, Sutarsih,
Nunung, Sita dan Nurhalimah terimakasih atas semua ketulusan, semangat
dan perhatian yang kalian berikan selama ini. Semoga persahabatan kita selalu
kekal abadi.
10.Bapak Irawan Sugoro, M.Si, yang telah membantu dan memberikan masukkan
kepada penulis dan yang telah menjadi ispirasi penulis dalam mengambil tema
11.Teman-teman seperjuangan Kimia 2005 yang tidak disebutkan satu persatu,
selama ini telah memberikan dukungan dan perhatiannya serta doa dan
semangatnya kepada penulis. Maju terus pantang mundur!!.
12.Kakak angkatku (dr. Rifki), yang telah memberikan bantuan baik moril
maupun materil semoga kebaikanmu di balas Allah SWT.
13.Mahasiswa S-2 Teknik Kimia Univesitas Indonesia (Goza), yang telah
menolong penulis ketika terakhir analisa. Sukses ya mas tesisnya!!!.
Akhir kata semoga skripsi ini bermanfaat bagi penulis khususnya dan bagi
pembaca umumnya. Dengan segenap kerendahan hati penulis menyadari bahwa
skripsi ini masih jauh dari kesempurnaan. Saran dan kritik yang konstruktif dari
pembaca sangat penulis harapkan.
Wassalamu’alaikum Warahmatullahi Wabarakatuh
Jakarta, April 2010
DAFTAR ISI
Halaman
KATA PENGANTAR... viii
DAFTAR ISI... xi
DAFTAR TABEL... xiv
DAFTAR GAMBAR... xv
DAFTAR LAMPIRAN... xvii
BAB I PENDAHULUAN... 1
1.1. Latar belakang... 1
1.2. Rumusan masalah ... 2
1.3. Tujuan penelitian... 3
1.4. Manfaat penelitian... 3
1.5. BAB II TINJAUAN PUSTAKA... 4
2.1. Morfologi kelapa sawit... 4
2.1.1. Komponen kimia tandan kosong kelapa sawit (TKKS) ... 6
2.1.1.1. Selulosa ... 8
2.1.1.2. Hemiselulosa... 9
2.1.1.3. Lignin ... 10
2.1.2. Hidrolisis hemiselulosa TKKS... 11
2.2. Pichia stipitis... 13
2.3. Fermentasi etanol ... 16
2.5. Spektrofotometer UV-Visible... 23
2.5.1. Prinsip dasar spektrofotometer UV-Vis ... 23
2.5.2. Sistem instrumentasi spektrofotometer UV-Vis ... 25
2.5.3. Analisa gula pereduksi metode Nelson-Somogyi ... 26
2.6. Kromatografi gas... 27
2.6.1. Prinsip dasar kromatografi gas... 27
2.6.2. Instrumentasi kromatografi gas... 28
BAB III METODOLOGI PENELITIAN... 30
3.1. Tempat dan waktu penelitian... 30
3.2. Bahan dan alat... 30
3.2.1. Bahan-bahan... 30
3.2.2. Alat-alat... 31
3.3. Desain Penelitian... 32
3.4. Cara Kerja... 33
3.4.1. Pembuatan kurva tumbuh Pichia stipitis... 33
3.4.1.1. Penyiapan kultur murni Pichia stipitis... 33
3.4.1.2. Peremajaan Pichia stipitis pada media agar miring YPMX.. 33
3.4.1.3. Penanaman Pichia stipitis pada media cair YPMX... 34
3.4.1.4. Penentuan kurva tumbuh Pichia stipitis ... 34
3.4.2. Detoksifikasi penguapan dan penambahan alkali pada hidrolisat TKKS ... 35
3.4.3. Fermentasi oleh Pichia stipitis ... 36
3.4.3.1. Persiapan starter inokulum Pichia stipitis... 36
3.4.4. Prosedur Analisis ... 38
3.4.4.1. Pengukuran konsentrasi gas CO2... 38
3.4.4.2. Pengukuran kadar gula pereduksi (metode Nelson-Somogyi) 38 3.4.4.3. Pengukuran konsentrasi etanol ... 39
BAB IV HASIL DAN PEMBAHASAN... 42
4.1. pH optimum pertumbuhan Pichia stipitis dalam media cair YPMX .. 42
4.2. Pengaruh detoksifikasi penguapan dan penambahan alkali terhadap kadar gula pereduksi... 43
4.3. Konversi gula pereduksi, kadar etanol dan yield etanol hasil fermentasi 49 4.4. Kadar gas CO2 yang dihasilkan... 56
4.5. Perubahan pH yang terjadi selama proses fermentasi... 58
BAB V KESIMPULAN DAN SARAN... 62
5.1. Kesimpulan ... 62
5.2. Saran... 62
DAFTAR PUSTAKA... 64
DAFTAR TABEL
Halaman
Tabel 1. Data komposisi kimia TKKS .. ... 7
Tabel 2. Sifat fisik xilosa... 12
Tabel 3. Sifat fisik etanol ... 20
Tabel 4. Kebutuhan etanol nasional... 21
Tabel 5. Kondisi alat kromatografi ... 40
Tabel 6. Kadar furfural (g/l) pada hidrolisat TKKS sebelum dan setelah diuapkan.... ... 46
Tabel 7. Pengaruh detoksifikasi penguapan dan penambahan alkali terhadap kadar gula pereduksi... 48
Tabel 8. Konversi gula pereduksi (%), kadar etanol (g/l) dan kadar yield etanol (%) selama proses fermentasi... 52
Tabel 9. Konversi optimum substrat oleh Pichia stipitis menjadi etanol... 55
DAFTAR GAMBAR
Gambar 11. Hubungan antara konsentrasi dengan %T dan A... 25
Gambar 12. Skema spektrofotometer ... 26
Gambar 13. Skema peralatan kromatografi gas... 29
Gambar 14. Desain penelitian ... 33
Gambar 15. Grafik peningkatan Optical Density (O) Pichia stipitis dalam media cair YPMX... 42 fermentasi B (2,4% xilosa dan 0,6% hidrolisat TKKS) selama proses fermentasi... ... 50
Gambar 19. Grafik kadar gula pereduksi dan etanol pada media fermentasi C (3% xilosa, 2% glukosa, dan 0% hidrolisat TKKS) selama
proses fermentasi... 51
Gambar 20. Grafik kadar gula pereduksi dan etanol pada media fermentasi D(2,4% xilosa; 1,6% glukosa dan 1% hidrolisat TKKS) selama proses fermentasi... 51
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Kurva standar gula pereduksi. ... 69
Lampiran 2. Kurva standar etanol... 70
Lampiran 3. Pembuatan Kurva tumbuh Pichia stipitis... 71
Lampiran 4. Pengaruh penguapan dan penambahan alkali terhadap kadar gula pereduksi... 72
Lampiran 5. Kadar gula pereduksi pada media fermentasi A, B, C, dan D selama proses fermentasi... 73
Lampiran 6. Perubahan pH pada media fermentasi A, B, C, dan D selama proses fermentasi. ... 75
Lampiran 7. Kadar gas CO2. pada media fermentasi A, B, C, dan D selama proses fermentasi……….. 76
Lampiran 8. Kadar etanol pada media fermentasi A, B, C, dan D selama proses fermentasi……….. 78
Lampiran 9. Kadar yield etanol (%) pada media fermentasi A, B, C, dan D selama proses fermentasi... 80
Lampiran 10. Konversi optimum gula pereduksi (%)... 82
Lampiran 11. Kromatogram hasil analisis kromatografi gas... 83
Lampiran 12. Pembuatan reagen kimia... 94
Lampiran 13. Diagram alir pembuatan kurva tumbuh Pichia stipitis... 96
Lampiran 14. Foto-foto penelitian... 97
Lampiran 15 Surat keterangan penelitian... 100
BAB I PENDAHULUAN
1.1. Latar Belakang
Indonesia merupakan salah satu negara yang sedang mengalami krisis
energi, sebagai akibat ketergantungan bahan bakar fosil. Sementara
pengembangan bioenergi sebagai bahan pengganti alternatif masih kurang
mendapatkan perhatian, sehingga pemerintah mentargetkan kebijakan energi
nasional (National Energy Policy) (Jenie, 2007).
Solusi untuk mengurangi ketergantungan pada bahan bakar fosil adalah
dengan melakukan diversifikasi energi. Diversifikasi energi dilakukan dengan
cara mengembangkan sumber energi baru dan mencari sumber bahan baku yang
ketersediannya lebih terjamin yaitu sumber daya yang mampu diperbaharui
(renewable resources) dan berkesinambungan (suistanable resources). Salah satu
sumber daya tersebut adalah bioetanol yaitu senyawa biofuel hasil fermentasi
(Hermawan dan Sudiyani, 2009). Bioetanol dapat mengurangi emisi gas karbon
dioksida yang dihasilkan dari pembakaran bahan bakar fosil. Gas karbon dioksida
yang dihasilkan akan diserap lagi pada saat fotosintesis produksi biomassa. Selain
itu diharapkan mampu menjadi solusi untuk mengurangi masalah-masalah
lingkungan, seperti hujan asam, dan pemanasan global (Iksan, et al., 2009).
Salah satu limbah pertanian di Indonesia yang belum banyak dimanfaatkan
adalah limbah Tandan Kosong Kelapa Sawit (TKKS). TKKS merupakan limbah
industri Crude Palm Oil (CPO) yang cukup melimpah. Namun sampai saat ini
cukup tinggi yaitu selulosa (41-46,5%), hemiselulosa (25,3-33,8 %), dan lignin
(27,6-32,5%) (Sudiyani, 2006).
Hidrolisis hemiselulosa TKKS akan menghasilkan hidrolisat yang kaya
akan gula pentosa (Susanto dan Achmad, 2003). Salah satu mikroba yang mampu
mengkonversi gula pentosa menjadi etanol adalah Pichia stipitis (Rouhollah, et
al., 2007).
Berdasarkan penelitian Susanto dan Achmad (2003) kurva tumbuh Pichia
stipitis optimum pada media cair Yeast extract, Pepton, Malt extract, dan Xilosa
(YPMX) pH 4,5 dengan konsentrasi xilosa 3% (b/v). Dalam penelitian ini
dilakukan proses pengamatan kurva tumbuh Pichia stipitis pada media YPMX pH
4,5 dan 5 dan fermentasi anaerob dengan media fermentasi A (3% xilosa dan 0%
hidrolisat), media fermentasi B (2,4% xilosa dan 0,6% hidrolisat TKKS), media
fermentasi C (3% xilosa, 2% glukosa, dan 0% hidrolisat TKKS), dan media D
(2,4% xilosa; 1,6% glukosa; dan 1% hidrolisat TKKS).
Berdasarkan latar belakang di atas, penelitian ini bertujuan untuk
mengetahui pH pertumbuhan Pichia stipitis pada media cair YPMX, pengaruh
detoksifikasi penguapan dan penambahan NaOH 10% (b/v) pada hidrolisat TKKS
terhadap kadar gula pereduksi, perubahan pH, kadar gas karbon dioksida, dan
konversi gula pereduksi menjadi etanol yang dihasilkan selama proses fermentasi.
1.2. Rumusan Masalah
Rumusan masalah dari penelitian ini adalah :
1. Berapa pH pertumbuhan Pichia stipitis pada media cair Yeast Extract, Pepton,
2. Bagaimana pengaruh detoksifikasi penguapan dan penambahan NaOH 10%
(b/v) terhadap kadar gula pereduksi hidrolisat TKKS?
3. Bagaimana kadar gas CO2, perubahan pH, dan konversi gula pereduksi selama
proses fermentasi?
4. Berapa kadar etanol optimum yang diperoleh pada masing-masing media
fermentasi?
1.3. Tujuan Penelitian
1. Mengetahui kadar gula pereduksi pada hidrolisat TKKS hasil detoksifikasi
dengan metode penguapan dan penambahan alkali.
2. Mengetahui pH pertumbuhan Pichia stipitis pada media cair YMPX.
3. Mengetahui % konversi gula pereduksi menjadi etanol, % yield etanol dan gas
karbon dioksida, serta perubahan pH selama proses fermentasi.
1.4. Manfaat Penelitian
Manfaat dari penelitian ini yaitu :
1. Meningkatkan nilai tambah limbah TKKS menjadi produk yang bernilai tinggi
dan mengurangi pencemaran lingkungan dari hasil limbah pertanian dan
perhutanan.
2. Memberikan informasi pemanfaatan limbah TKKS sebagai bahan energi
BAB II
TINJAUAN PUSTAKA
2.1. Morfologi Kelapa Sawit
Pohon kelapa sawit terdiri dari 2 spesies yaitu Elaeis guineensis dan Elaeis
oleifera. Spesies pertama adalah Elaeis guineensis yang berasal dari Angola dan
Gambia dan merupakan spesies yang pertama kali dan terbanyak dibudidayakan
orang. Spesies Elaeis oleifera berasal dari Amerika Tengah dan Amerika Selatan
dan sekarang mulai banyak dibudidayakan untuk menambah kekurangan sumber
genetik. Kelapa sawit termasuk tumbuhan pohon, tingginya mencapai 24 meter,
bunga dan buahnya berupa tandan, serta bercabang banyak. Buahnya kecil dan
apabila masak, berwarna merah kehitaman, dan daging buahnya padat, daging dan
kulit buahnya mengandung minyak. Minyak ini digunakan sebagai bahan minyak
goreng, sabun, dan lilin. Ampas dimanfaatkan untuk makanan ternak, khususnya
sebagai salah satu bahan pembuatan makanan ayam. Tempurungnya digunakan
sebagai bahan bakar dan arang (Pusat Data dan Informasi, 2007).
Di Indonesia penyebarannya di daerah Aceh, pantai timur Sumatra, Jawa
dan Sulawesi. Gambar dan morfologi kelapa sawit dapat dilihat pada gambar
Gambar 1. Kelapa sawit (www.wordpress.com) Taksonomi Tanaman kelapa sawit yaitu :
Kingdom : Plantae
Divisi : Magnoliophyta
Kelas : Liliopsida
Ordo : Arecales
Familia : Arecaceae
Genus : Elaeis
Spesies : Elaeis guineensis
Sumber : (www.wikipedia.com)
Limbah kelapa sawit kaya selulosa dan hemiselulosa. TKKS mengandung
45% selulosa dan 26% hemiselulosa. Tingginya kadar selulosa pada polisakarida
itu dapat dihidrolisis menjadi gula sederhana dan selanjutnya difermentasikan
menjadi etanol. Sebuah Pabrik Kelapa Sawit (PKS) dengan kapasitas 60 ton/jam
dapat menghasilkan limbah kira-kira 100 ton/hari. Produksi limbah dapat
diolah. Jika seluruh TKKS ini diolah menjadi etanol (fuel grade ethanol) maka
potensinya diperkirakan sebesar 8,254 liter/hari (Isroi, 2009).
2.1.1. Komponen Kimia Tandan Kosong Kelapa Sawit (TKKS)
Sampai saat ini bahan baku fermentasi etanol adalah bahan-bahan yang
mengandung karbohidrat (pati) atau bahan-bahan yang mengandung glukosa.
Kecenderungan baru bahan baku bioetanol adalah bahan berpati. Bahan berpati
yang sering digunakan adalah biji-bijian seperti padi, jagung, sorgum, singkong,
ubi jalar, dan gandum serta kentang. Sedangkan untuk bahan baku yang
mengandung selulosa dan hemiselulosa seperti bagas (limbah tebu), jerami,
batang padi, batang gandum, limbah jagung, dan limbah pertanian lainnya belum
banyak digunakan (Dermibas, 2005).
Penggunaan bahan pangan akan menimbulkan masalah baru yaitu
kompetisi antara kebutuhan pangan dengan kebutuhan energi. Salah satu alternatif
lain bahan baku pembuatan bioetanol adalah biomassa. Biomassa merupakan
sumber daya alam yang berlimpah dan murah yang memiliki potensi mendukung
produksi komersial industri bahan bakar seperti etanol dan butanol (Judoamidjojo,
et al., 1989).
Biomassa lignoselulosa dapat diperoleh dari limbah pertanian, limbah
perkebunan, limbah kehutanan, dan tersebar luas di Indonesia. Salah satu limbah
pertanian di Indonesia yang belum banyak dimanfaatkan adalah limbah Tandan
Kosong Kelapa Sawit (TKKS). Data komposisi kimia TKKS dapat dilihat seperti
pada tabel 1, yaitu :
Tabel 1. Data komposisi kimia TKKS Komposisi Kadar (%)
Lignin 25,83
Holoselulosa 56,49
-selulosa 33,25
Hemiselulosa 23,24
Zat ekstraktif 4,19
Sumber : (Sudiyani, 2009)
Adanya lignin pada TKKS menyebabkan bahan berlignoselulosa sulit
untuk dihidrolisis. Oleh sebab itu, diperlukan proses pretreatment fisika untuk
memperkecil ukuran dan meningkatkan luas bidang kontak serta pretreatment
kimia untuk mendapatkan selulosa dan hemiselulosa yang setinggi-tingginya.
Pretreatment kimia dengan asam sulfat 4% dan NaOH 6% pada penelitian
Hermawan (2008) dan Firmansyah (2009) telah menghasilkan selulosa yang bebas
dari lignin lalu dihidrolisis dengan menggunakan enzim selulase menjadi
gula-gula sederhana yang dimanfaatkan oleh Saccharomyces cerevisiae untuk produksi
etanol dalam satu tahapan. Berdasarkan penelitian tersebut pemanfaatan selulosa
terbukti telah menghasilkan yield etanol yang tinggi.
Hemiselulosa TKKS belum bayak dimanfaatkan, sehingga dalam
penelitian ini dilakukan upaya lain untuk memanfaatkan hemiselulosa yang ada
pada TKKS untuk produksi etanol. Untuk mendapatkan gula-gula sederhana yang
akan difermentasikan oleh mikroba maka diperlukan proses hidrolisis. Proses
hidrolisis tersebut dapat dilakukan dengan asam atau dengan enzim. Hidrolisis
secara enzimatik memberikan yield etanol yang lebih tinggi dibandingkan dengan
metode hidrolisis asam. Namum proses enzimatik ini merupakan proses yang
paling mahal dan rumit (Purwadi, 2006).
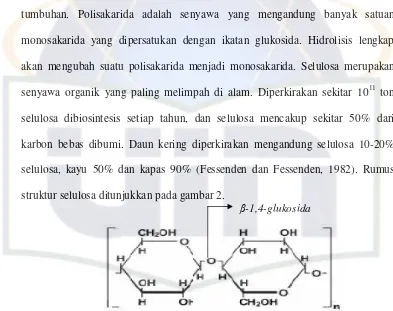
Selulosa adalah homopolimer linear dari D-anhidroglukosa (glukosa
anhidrida) dengan ikatan -1,4-glukosida dan memiliki rumus empiris (C6H12O5)n,
dimana n adalah jumlah satuan glukosa yang berikatan atau menyatakan derajat
polimerasi selulosa yang berkisar antara 15-1400 (Janes, et al., 1996 ;
Judoamidjojo, et al., 1989; Sjostrom, 1981; Fessenden dan Fessenden, 1982).
Selulosa merupakan salah satu bentuk karbohidrat yang termasuk
polisakarida arsitektural, yang memberikan kekuatan pada kayu dan dahan bagi
tumbuhan. Polisakarida adalah senyawa yang mengandung banyak satuan
monosakarida yang dipersatukan dengan ikatan glukosida. Hidrolisis lengkap
akan mengubah suatu polisakarida menjadi monosakarida. Selulosa merupakan
senyawa organik yang paling melimpah di alam. Diperkirakan sekitar 1011 ton
selulosa dibiosintesis setiap tahun, dan selulosa mencakup sekitar 50% dari
karbon bebas dibumi. Daun kering diperkirakan mengandung selulosa 10-20%
selulosa, kayu 50% dan kapas 90% (Fessenden dan Fessenden, 1982). Rumus
struktur selulosa ditunjukkan pada gambar 2.
Gambar 2. Struktur molekul selulosa (www.scientificpsychic.com)
Selulosa terdapat pada semua tanaman baik pohon tingkat tinggi hingga
organisme primitif seperti rumput laut. Isolasi selulosa sangat dipengaruhi oleh
lilin, protein, dan pektin dapat dihilangkan dengan cara ekstraksi dengan pelarut
organik atau alkali encer (Sastrohamidjojo dan Prawirohatmojo, 1995).
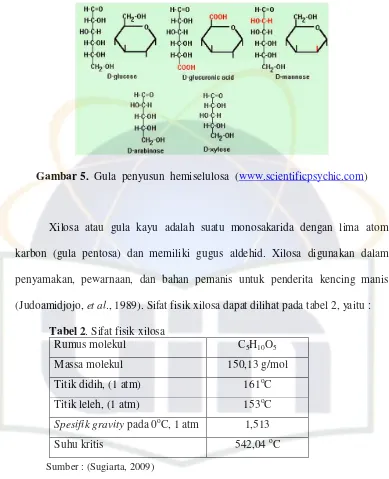
2.1.1.2. Hemiselulosa
Hemiselulosa termasuk dalam kelompok polisakarida heterogen yang
dibentuk melalui biosintesis yang berbeda dari selulosa. Berbeda dengan selulosa
yang merupakan homopolisakarida, hemiselulosa merupakan heteropolisakarida.
Hemiselulosa relatif mudah dihidrolisis dengan asam menjadi
komponen-komponen monomernya yang terdiri dari glukosa, manosa, galaktosa,
xilosa, L-arabinosa, dan sejumlah kecil L-ramnosa disamping menjadi asam
D-glukuronat, asam 4-O-metil-glukuronat dan asam D-galakturonat. Derajat
polimerasi hemiselulosa dapat mencapai 200 (Sastrohamidjojo dan
Prawirohatmojo, 1995).
Hemiselulosa merupakan polisakarida dengan bobot molekul lebih kecil
dibandingkan selulosa. Molekul hemiselulosa lebih mudah menyerap air, bersifat
plastis, dan mempunyai permukaan kontak antar molekul lebih luas dibandingkan
dengan selulosa (Judoamidjojo, et al., 1989; Winarno, 1997). Ikatan di dalam
rantai hemiselulosa banyak bercabang karena gugus -glukosida di dalam molekul
yang satu berikatan dengan gugus hidroksil C2, C3, dan C4 dari molekul yang lain.
Berbeda dengan selulosa, hemiselulosa berbentuk amorf, mempunyai derajat
polimerasi lebih rendah dan mudah larut dalam alkali tetapi sukar larut dalam
asam, sedangkan selulosa sebaliknya (Tjokroadikoesoemo, 1986). Struktur
Gambar 3. Struktur hemiselulosa (www.wikipedia.com)
2.1.1.3. Lignin
Aselme Payen (1838) mengamati bahwa apabila kayu ditambah dengan
asam nitrat pekat akan kehilangan sebagian zatnya, meninggalkan sisa padatan
dan berserat yang dinamakan selulosa. Selain itu, serat tersebut juga mengandung
senyawa lain yang mempunyai kandungan karbon yang tinggi dan disebut lignin
(Sastrohamidjojo dan Prawirohatmojo, 1995). Lignin adalah polimer aromatik
kompleks yang terbentuk melalui polimerasi tiga dimensi dari sinamil alkohol
dengan bobot molekul 11.000 (Krisnawati, 2008). Lignin terbentuk dari fenil
propana, unit-unit fenil propana terikat satu dengan lainnya dengan ikatan eter
(C-O-C) maupun ikatan karbon-karbon (Sjostrom, 1981).
Lignin bersifat hidrofobik dan melindungi selulosa sehingga strukturnya
bersifat kaku (rigid). Adanya ikatan aril alkil dan ikatan eter di dalamnya
menyebabkan lignin menjadi tahan terhadap proses hidrolisis dari asam-asam
universal. Lignin dapat dioksidasi oleh larutan alkali dan oksidator lain. Pada suhu
asetat, aseton dan vanilin (Judoamidjojo, et al., 1989). Rumus struktur molekul
lignin dapat dilihat seperti pada gambar 4, yaitu :
Gambar 4. Struktur molekul lignin (www.scientificpsychic.com)
2.1.2. Hidrolisis Hemiselulosa TKKS
Hidrolisis hemiselulosa dengan asam kuat encer akan menghasilkan gula
heksosa dan pentosa seperti xilosa dan arabinosa. Hidrolisis lebih lanjut akan
menghasilkan furfural dan produk terdekomposisi lainnya (Gong, 1981).
Hidrolisis hemiselulosa menghasilkan tiga jenis monosakarida yaitu, xilosa,
arabinosa dan glukosa dalam jumlah sedikit (Gonzales, et al., 1985; Klinke, et al.,
2004).
Ikatan glikosida hemiselulosa lebih stabil terhadap hidrolisis asam
daripada ikatan glikosida selulosa. Jika hidrolisis terus berlanjut, bagian-bagian
hemiselulosa yang terdepolimerasi atau terdegradasi dalam pelarut dan lambat
laun terhidrolisis menjadi monosakarida-monosakarida (Sjostrom, 1981). Gula
Gambar 5. Gula penyusun hemiselulosa (www.scientificpsychic.com)
Xilosa atau gula kayu adalah suatu monosakarida dengan lima atom
karbon (gula pentosa) dan memiliki gugus aldehid. Xilosa digunakan dalam
penyamakan, pewarnaan, dan bahan pemanis untuk penderita kencing manis
(Judoamidjojo, et al., 1989). Sifat fisik xilosa dapat dilihat pada tabel 2, yaitu :
Tabel 2. Sifat fisik xilosa
Sumber : (Sugiarta, 2009)
Xilosa merupakan gula pereduksi disebabkan karena adanya gugus aldehid
dan gugus keton yang bebas, sehingga dapat mereduksi io-ion logam seperti
tembaga (Cu) dan perak (Ag). Gambar struktur molekul xilosa dapat dilihat pada
gambar 6, yaitu :
Rumus molekul C5H10O5
Massa molekul 150,13 g/mol
Titik didih, (1 atm) 161oC
Titik leleh, (1 atm) 153oC
Spesifik gravity pada0oC, 1 atm 1,513
Gambar 6. Struktur molekul xilosa
2.2. Pichia stipitis
Pichia stipitis adalah jamur yang potensial mengkonversi xilosa,
mendegradasi lignin dan selulosa menjadi etanol. Pichia stipitis Pignal (1967)
adalah suatu haploid, homothallik, ragi hemiascomyceta yang mempunyai
kapasitas konversi xilosa menjadi etanol sebesar 50 g/l etanol dengan yield 0,35
sampai 0,44 g etanol/g xilosa (Jeffries, et al., 2007). Gambar khamir Pichia
stipitis dapat dilihat pada gambar di bawah ini, yaitu :
Gambar 7. Khamir Pichia stipitis (Jeffries, et al., 2007) Taksonomi Pichia stipitis, yaitu :
Kingdom : Fungi
Divisi : Ascomycotina
Kelas : Saccharomycotina
Famili : Saccharomycotaceae
Genus : Pichia
Spesies : Pichia stipitis
Sumber : (www.wikipedia.com)
Pichia stipitis mempunyai bentuk spora yaitu bulat angular, oval,
setengah bulat, atau berbentuk topi dengan banyaknya spora peraskus yang biasa
adalah 1-4 (Judoamidjojo, 1992), bentuk sel membentuk silinder atau
pseudomiselium, reproduksi vegetatif, pertumbuhannya dalam media cair
berbentuk pelikel (Fardiaz, 1992). Suhu optimum untuk pertumbuhan Pichia
stipitis adalah pada suhu 27-30oC dan pH sekitar 3-5,5 (Susanto dan Achmad,
2003), dan umumnya yeast hidup optimal pada pH 4,5-5,5 dengan pH minimum
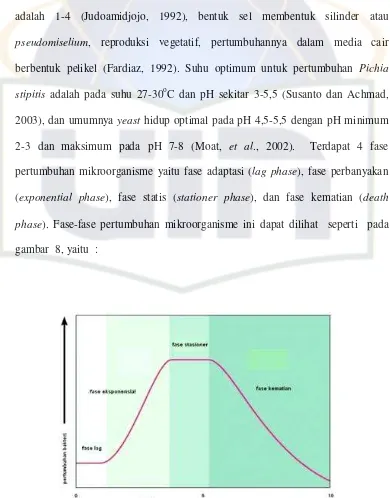
2-3 dan maksimum pada pH 7-8 (Moat, et al., 2002). Terdapat 4 fase
pertumbuhan mikroorganisme yaitu fase adaptasi (lag phase), fase perbanyakan
(exponential phase), fase statis (stationer phase), dan fase kematian (death
phase). Fase-fase pertumbuhan mikroorganisme ini dapat dilihat seperti pada
Gambar 8. Fase pertumbuhan mikroorganisme
Sumber (www.biobakteri.wordpress.com/2009/06/pertumbuhan-bakteri/)
Adapun penjelasan dari fase-fase pada gambar di atas adalah :
1. Fase adaptasi (lag phase)
Ketika sel dipindahkan dalam media baru maka sel akan mengalami proses
adaptasi. Pada fase ini tidak dijumpai pertambahan jumlah sel, tetapi terjadi
penambahan volum sel (pengecilan sel).
2. Fase perbanyakan (exponential phase)
Pada fase ini sel melakukan pembelahan dan populasi meningkat sampai batas
waktu tertentu secara eksponensial. Jumlah sel dipengaruhi oleh beberapa
faktor antara lain, kandungan sumber nutrien, temperatur, kadar cahaya, dan
oksigen.
3. Fase stasioner (stationer phase)
Fase ini laju pembelahan sel sebanding dengan laju kematian sel, sehingga
jumlah sel hidup konstan. Fase ini terjadi akibat adanya kekurangan nutrien,
akumulasi metabolit toksik, penurunan kadar oksigen, dan penurunan
ketersediaan air.
3. Fase kematian (death phase)
Fase ini tidak terjadi pembelahan sel dan sel lama kelamaan akan mati apabila
tidak dipindahkan pada media baru. Penyebab utama kematian ini adalah
Sumber : (Purwoko, 2007)
2.3. Fermentasi Etanol
Istilah “Fermentasi“ (fermentation dalam bahasa inggris) berasal dari kata
lain ferfere yang artinya mendidihkan. Ini dianggap sebagai suatu peninggalan
pada waktu ilmu kimia masih sangat muda sehingga terbentuknya gas dari
suatu cairan hanya dapat dibandingkan dengan keadaan seperti air mendidih atau
mulai mendidih (Judoamidjojo, 1992).
Fermentasi klasik yaitu upaya penguraian senyawa-senyawa organik
komplek dengan bantuan mikroorganisme pada kondisi anaerob untuk
menghasilkan produk. Sedangkan fermentasi modern adalah upaya pengubahan
substrat dengan bantuan mikroorganisme dalam kondisi terkontrol sehingga
menghasilkan bahan yang lebih berguna (Pujaningsih, 2005).
Fermentasi mempunyai pengertian aplikasi metabolisme mikroba untuk
mengubah bahan baku menjadi produk bernilai tinggi, seperti asam-asam organik,
protein sel tunggal, antibiotik dan biopolimer. Pada dasarnya substrat yang
digunakan pada fermentasi skala industri adalah substrat sebagai sumber karbon.
Sumber karbon yang biasa digunakan adalah karbohidrat yang dapat diperoleh
dari berbagai jenis pati seperti serealia, jagung, kentang, singkong dan sagu
(Hartoto, 1992). Sedangkan menurut Muchtadi (1997) fermentasi secara teknik
dapat didefinisikan sebagai suatu proses oksidasi anaerobik atau parsial anaerobik
Gambar 9. Siklus metabolisme etanol (Ida, 2009)
Salah satu pemanfaatan khamir yang paling penting dan terkenal ialah
produksi etil alkohol dari karbohidrat. Proses fermentasi ini dimanfaatkan oleh
para pembuat bir, roti, anggur, bahan kimia, para ibu rumah tangga, dan lain-lain
(Pelczar dan Chan, 2005). Fermentasi etanol terjadi pada kondisi anaerob dengan
khamir tertentu yang dapat mengkonversi glukosa jadi etanol melalui
Embden-Meyerhoff-Parras (EMP) pathway (Pelczar dan Chan, 2005; Lehninger, 1982).
Dari satu molekul glukosa akan terbentuk dua molekul etanol dan 2
molekul CO2 sehingga berdasarkan bobotnya secara teoritis satu gram glukosa
menghasilkan 0,51 gram etanol (Judoamidjojo, 1992). Proses perubahan gula
yang dilakukan khamir sebagai berikut :
C6H12O6 + Khamir → 2 C2H5OH + 2 CO2
3C5H10O5 + Khamir → 5C2H5OH + 5CO2
Hasil fermentasi biasanya hanya terbentuk larutan alkohol encer, karena
sel-sel khamir akan mati pada kadar alkohol yang lebih pekat. Larutan tersebut
harus disuling secara bertingkat. Dengan penyulingan bertingkat akan diperoleh
alkohol yang kadarnya mencapai 95%. Jika disuling lagi akan diperoleh alkohol
murni, akan tetapi kadarnya tidak lebih dari 95,5%. Hal ini disebabkan karena
garis didih dari susunan H2O-C2H5OH mempunyai harga minimum pada 4,5% air
dan 95,5% alkohol. Sehingga larutan 95,5% mempunyai titik didih tetap dan tidak
dapat ditetapkan lagi dengan penyulingan biasa (Budiyanto, 2003).
Untuk mendapatkan hasil fermentasi yang optimum, menurut Budiyanto
(2003) perlu diperhatikan hal-hal berikut, yaitu :
1. Kadar gula yang terlalu tinggi akan menghambat aktivitas khamir.
Konsentrasi gula yang optimum adalah 14-28 %.
2. Suhu yang baik untuk fermentasi di bawah 30oC. Semakin rendah suhu
fermentasi, maka akan semakin tinggi alkohol yang dihasilkan. Hal ini
dikarenakan pada suhu rendah CO2 lebih sedikit terbentuk.
3. Derajat keasaman akan mempengaruhi kecepatan fermentasi pH yang
optimum untuk pembentukan khamir adalah 4-4,5 untuk pengaturan pH dapat
pH. Pada pH 3,5 atau sedikit lebih rendah fermentasi masih dapat
berlangsung dengan baik dan bakteri pembusuk akan terhambat.
Sedangkan menurut Tjokroadikoesoemo (1986) bahan baku fermentasi
etanol dapat digunakan :
1. Bahan-bahan yang mengandung gula, misalnya legen, nira dan sebagainya.
Dari bahan baku jenis ini tetes hasil samping pabrik gula merupakan bahan
baku yang paling banyak digunakan.
2. Bahan-bahan berpati, misalnya biji-bijian (jagung, beras, sorgum dan
lain-lain) dan umbi-umbian (kentang, ubi jalar, ubi kayu dan lain-lain-lain).
3. Bahan-bahan berserat (kayu dan limbah pertanian lainnya).
Bahan-bahan yang mengandung monosakarida langsung dapat
difermentasikan, akan tetapi disakarida, pati maupun karbohidrat kompleks harus
dihidrolisis terlebih dahulu menjadi komponen yang lebih sederhana yaitu
monosakarida. Oleh karena itu agar proses fermentasi berjalan optimal maka
bahan-bahan tersebut harus mengalami perlakuan pendahuluan sebelum masuk
ke dalam proses fermentasi (Budiyanto, 2003).
Etanol mungkin sudah dikenal orang sejak awal peradaban manusia.
Secara tidak sengaja bahan ini dihasilkan dari peragian spontan bahan-bahan
yang mengandung gula, dan berangsur-angsur orang berusaha mengendalikan
peragian tersebut sehingga diperoleh minuman beralkohol. Meskipun pengetahuan
tentang alkohol dan bagaimana cara memisahkannya sudah lama sekali
berkembang, namun baru tahun 1808 untuk pertama kalinya dibangun pabrik
penyulingan dengan sistem kontinyu di Prancis oleh Cellier dan Blumenthal
Etanol yang diperoleh dari peragian, pada prosesnya berkataliskan enzim.
Suatu tipe enzim mengubah karbohidrat menjadi glukosa kemudian menjadi
etanol. Peragian buah-buahan, sayuran, biji-bijian berhenti bila kadar alkohol
mencapai 14-16%. Jika digunakan kadar yang lebih tinggi campuran itu harus
disuling (Fessenden dan Fessenden, 1982).
Etanol merupakan produk fermentasi yang dapat dibuat dari substrat yang
mengandung karbohidrat (gula, pati dan selulosa). Etanol merupakan kependekan
dari etil alkohol (C2H5OH), sering juga disebut sebagai “grain alcohol” atau
alkohol saja. Bentuknya berupa cairan yang tak berwarna dan mempunyai bau
khas yang menusuk hidung, mudah menguap dan larut dalam air dan eter.
Penggunaan etanol yang terbanyak adalah sebagai pelarut sebesar 40%, untuk
membuat asetaldehid sebesar 36%, untuk penggunaan secara kimiawi yang lain
sebesar 15%, serta eter, glikol eter, etil asetat dan khoral sebesar 9%
(Judoamidjojo, 1992). Sifat fisik etanol dapat dilihat pada tabel 3, yaitu :
Tabel 3. Sifat fisik etanol
Massa molekul relatif 46,07 g/mol
Titik beku -114,1°C
Titik didih normal 78,32°C
Dentitas pada 20° 0,7893 g/ml
Kelarutan dalam air sangat larut
Viskositas pada 20°C 1,17 cP
Kalor spesifik, 20°C 0,579 kal/g°C Kalor pembakaran, 25°C 7092,1 kal/g Kalor penguapan 78,32°C 200,6 kal/g
Sumber : (Ristiani, 2008; Sari, 2009)
Gambar 10. Struktur etanol (Mardoni dan Yetty, 2007)
Kebutuhan etanol di dunia semakin meningkat, hal ini dapat dilihat dari
kebutuhan etanol nasional pada tabel 4, yaitu :
Tabel 4. Kebutuhan etanol nasional
Tahun Kebutuhan Etanol (Liter)
2001 25.251.852
2002 21.076.317
2003 34.063.193
2004 230.613.100
Sumber : (Sari, 2009)
Karena sifatnya yang tidak beracun etanol banyak dipakai sebagai pelarut
dalam dunia farmasi dan industri makanan dan minuman.Di dalam perdagangan
alkohol dikenal dalam berbagai tingkat kemurnian (Tjokroadikoesoemo, 1986),
yaitu :
1. Alkohol teknis, larutan yang digunakan untuk keperluan industri dan pelarut
bahan bakar ataupun diolah kembali menjadi bahan lain. Umumnya alkohol
industri didenaturasi dari ½ -1% jenuh dan diberi warna dengan metil
violet.
2. Spirtus, bahan ini merupakan alkohol tedenaturasi dan diberi warna
umumnya digunakan untuk pemanasan dan penerangan.
3. Alkohol murni, alkohol yang lebih murni digunakan terutama untuk
kepentingan farmasi, minuman keras dan kosmetik.
4. Alkohol absolut atau alkohol anhidrat tidak mengandung air sama sekali.
2.4. Detoksifikasi Senyawa Inhibitor
Detoksifikasi adalah tahap penghilangan senyawa-senyawa yang dapat
menghambat fermentasi. Pada fermentasi hidrolisat biomassa lignoselulosa,
proses detoksifikasi digunakan untuk menghilangkan asam dan senyawa fenol
serta senyawa beracun lainnya seperti furfural dan 5-hidroksimetilfurfural
(Larsson, et al., 1999; Sitorus, et al., 2009). Furfural merupakan senyawa hasil
hidrolisis bagas yang menjadi inhibitor terhadap pertumbuhan sel dan fermentasi
alkohol. Enzim alkohol dehidrogenase akan mereduksi furfural menjadi furfuril
alkohol yang mengakibatkan gangguan respirasi sel dan akhirnya menghambat
pertumbuhan. Menurut Palmqvist (2000) dalam Sitorus, et al. (2009) furfural
dengan konsentrasi 1,3-3,2 g/L dapat menghambat pertumbuhan sel. Detoksifikasi
mampu menurunkan konsentrasi furfural maupun 5-hidroksimetilfurfural
(Larsson, et al., 1999). Penurunan kadar furfural dan HMF berlangsung cepat,
dengan penambahan Ca(OH)2 diatas pH 7,5 (Martinez, et al., 2000).
C5H4O2 (Furfural) + O2 → C5H4OCOOH (Asam furoat)
C6H6O3 (hidroksimetil furfural) + O2→ C6H6OCOOH
C5H4OCOOH (Asam furoat) + NaOH → C5H4OCOONa (Natrium furoat)+ H2O
C6H6OCOOH (Asam furoat) + NaOH → C6H6OCOONa + H2O
Sumber : (Sugiarta, 2009)
Selain pengurangan konsentrasi furfural, pada tahap detoksifikasi juga
dilakukan pengurangan kandungan asam sulfat (katalis reaksi hidrolisis) dengan
penambahan Ca(OH)2 sampai pH hidrolisat mencapai 12 (Purwadi, et al., 2004).
dan lignin terlarut (baik monomer maupun polimer aromatik yang bersifat toksik
terhadap proses fermentasi) (Sitorus, et al., 2009).
2.5. Spektrofotometer UV-Visible
2.5.1. Prinsip Dasar Spektrofotometer UV-Vis
Spektrofotometer UV-Visible merupakan suatu instrument yang dapat
mengukur energi radiasi elektomagnetik didaerah UV (200-400 nm)-Visible
(400-700 nm) yang diserap oleh molekul atau ion berdasarkan pada hukum
Lambert Beer. Spektrofotometer digunakan untuk mengukur jumlah cahaya yang
diabsorpsi atau ditransmisikan oleh molekul-molekul di dalam larutan. Ketika
panjang gelombang cahaya ditransmisikan melalui larutan, sebagian energi cahaya
tersebut akan diserap. Besarnya kemampuan molekul-molekul zat terlarut untuk
mengabsorpsi cahaya pada panjang gelombang tertentu dikenal dengan istilah
Absorbansi (A), yang setara dengan nilai konsentrasi larutan tersebut dan panjang
berkas cahaya yang dilalui (biasanya 1 cm dalam spektrofotometer) ke suatu point
dimana persentase cahaya yang ditransmisikan atau diabsorpsi diukur dengan
phototube (Khopkar, 2003)
Ketika cahaya dari panjang gelombang melalui larutan kimia yang
diujikan, sebagian cahaya tersebut akan diabsorpsi oleh larutan. Hukum Lambert
Beer’s yang dikembangkan pada tahun 1852 oleh J. Beer dan Lambert
menyatakan secara kuantitatif absorpsi ini sebagai :
Log I0/It = .L.C
Keterangan :
It = Intensitas cahaya setelah melewati sampel
= Koefesien ekstingsi, yaitu konstanta yang tergantung pada sifat alami
dari senyawa substansi dan panjang gelombang yang digunakan untuk
analisis.
L = Panjang atau jarak cahaya yang melewati sampel
C = Konsentrasi dari larutan yang dianalisa
Hubungan I0/It akan lebih cepat dipahami dengan melihat kebalikan dari
perbandingan tersebut yakni I0/It sebagai transmisi (T) dari larutan. Sedangkan log
(I0/It) dikenal sebagai absorbansi (A) larutan (Khopkar, 2003).
Pernyataan ini menghasilkan persamaan A = - Log T dengan A = .L.C.
hal yang perlu diperhatikan disini adalah bahwa persamaan ini menyerupai atau
setipe dengan persamaan garis lurus y = mx + b. Absorbansi cahaya dari larutan
secara langsung berbanding lurus dengan konsentrasi larutan (Khopkar, 2003).
Gambar di bawah menunjukkan hubungan antara %T dengan konsentrasi.
dan A dengan konsentrasi.
Gambar 11. Hubungan antara konsentrasi dengan %T dan A Sumber: (www.sentrabd.com)
Beberapa aspek yang perlu diperhatikan berkaitan dengan satuan-satuan
1. T (transmittance), T tidak memiliki satuan karena ini merupakan rasio
intensitas cahaya. It dan I0 memiliki satuan yang sama oleh karenanya saling
meniadakan.
2. A (absorbance), A juga tidak memiliki satuan karena hubungannya dengan T.
3. L (pathlength), L biasanya memiliki satuan cm. lebar cuvet yang biasa
digunakan adalah 1,0 cm.
4. C (concentration), C memiliki satuan konsentrasi seperti m (molaritas)
memiliki satuan mg/mL atau ppm (parts per million).
5. , (the extinction coefficient), memiliki satuan yang berkebalikan denan C
dan L, sebagai contoh cm-1 dan M-1 (Khopkar, 2003).
2.5.2. Sistem Instrumentasi Spektrofotometer UV-Vis
Sebuah spektrofotometer mempunyai 5 bagian penting yaitu :
1) Sumber cahaya
Untuk UV umumnya digunakan lampu deuterium (D2O), untuk visible
digunakan lampu tungsten xenon.
2) Monokromator
Yaitu suatu alat untuk mengubah cahaya polikromatik menjadi cahaya
monokromatik.
3) Sel penyerap atau wadah pada sampel
Sel penyerap (cell) dalam spektrofotometer disebut juga dengan kuvet yang
berfungsi sebagai wadah sampel pada saat pengukuran dengan alat
spektrofotometer.
4) Photodetektor
listrik
5) Analyzer (pengolah data)
Bagian yang berfungsi untuk mengolah data. Untuk spektrofotometer modern
biasanya dilengkapi dengan komputer (Nur dan Hendra, 1989). Instrumentasi
spektrofotometer UV-Vis dapat dilihat pada gambar 12, yaitu :
larutan alkalis (Nur, et al., 1989). Gula pereduksi adalah gula yang dapat
dioksidasi oleh oleh zat pengoksidasi lembut (Fesenden dan Fesenden, 1986).
Salah satu metode analisa kuantitatif gula pereduksi dengan menggunakan
metode Nelson-Somogyi, dimana analisa diukur dengan menggunakan
spektrofotometer UV-Vis.
Metode Nelson-Somogyi yaitu dengan memanaskan gula dengan larutan
alkali kuper tartrat dan dihasilkan kupro oksida, yang selanjutnya bereaksi
dengan senyawa arsenomolibdat dengan hasil molibdenum yang berwarna
biru. Intensitas warna biru inilah yang diukur dengan metode kolorimeter Gambar 12. Skema spektrofotometer
2.5.3. Analisa Gula Pereduksi dengan Metode Nelson-Somogyi
Karbohidrat dengan gugus aldehid atau keton bebas atau secara potensial (pada
menggunakan spektrofotometer UV-Vis pada panjang gelombang tertentu
(Nur, et al., 1989).
2.6. Kromatografi Gas
2.6.1. Prinsip Dasar Kromatografi Gas
Kromatografi adalah pemisahan senyawa kimia berdasarkan proses partisi
antara dua media. Media atau fasa yang pertama yaitu fasa stasioner dan fasa yang
kedua yaitu fasa gerak. Fasa yang pertama (stationary phase) biasanya berupa
padatan atau cairan, dan fasa yang kedua biasanya berupa cairan atau gas.
Substansi yang akan dipisahkan terdistribusi diantara fasa gerak dan fasa diam
(Khopkar, 2003; Widada, 2000).
Kromatografi gas adalah suatu alat yang dapat digunakan dalam suatu
analisa pemisahan dan pemurnian senyawa-senyawa yang mudah menguap atau
yang mudah diuapkan. Prinsip kerja kromatografi gas didasarkan pada perbedaan
interaksi analit dalam fase gerak dan fase diam. Mekanisme kromatografi gas
adalah sampel diinjeksikan ke dalam injektor yang dipanaskan kemudian
sampel tersebut dibawa oleh aliran gas yang konstan yang selanjutnya
dipisah-pisahkan di dalam kolom. Di dalam kolom terjadi interaksi di antara komponen
dari sampel yang telah berubah menjadi uap. Setiap komponen yang keluar dari
dalam kolom dideteksi oleh detektor dan dicatat oleh sistem pengolah data
sebagai kromatogram (Sudarmadji, et al., 1997).
2.6.2. Instrumentasi Kromatografi Gas
Bagian-bagian instrumentasi seperti pada gambar 13 adalah sebagai
1. Pengatur aliran gas (gas flow controller)
Berfungsi untuk mengatur aliran gas dalam kromatografi gas. Gas pembawa
yang umum digunakan adalah He, N2, H2, Ar, akan tetapi untuk detektor
konduktivitas termal, He lebih disukai karena konduktivitas termalnya
tinggi.
2. Tempat injeksi sampel (injektor)
Digunakan sebagai tempat injeksi sampel, adapun fungsi secara mendetail
adalah untuk menguapkan sampel (pelarut dan analit), mencampurkan sampel
dengan gas pembawa, dan menyalurkan campuran gas tersebut ke dalam
kolom.
3. Kolom
Kolom adalah bagian terpenting dalam kromatografi, yang berfungsi untuk
tempat pemisahan komponen dari sampel yang diinjeksikan.
4. Detektor
Detektor merupakan alat untuk mendeteksi dan mengukur zat terlarut yang
terpisahkan di dalam kolom. Detektor ini peka terhadap komponen-komponen
yang terpisahkan di dalam kolom, yang mengubah kepekaannya menjadi
sinyal listrik.
5. Rekorder atau Sistem Data
Rekorder adalah penampil data setelah sinyal analitik yang dihasilkan oleh
detektor, yang diperkuat oleh suatu rangkaian elektronik. Hasil rekorder
adalah sebuah kromatogram yang akan digunakan untuk analisis kualitatif dan
kuantitatif (Khopkar, 2003). Instrumentasi kromatografi gas dapat dilihat
Gambar 13. Skema peralatan kromatografi gas
BAB III
METODOLOGI PENELITIAN
3.1. Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Mikrobiologi Bidang Teknologi
Lingkungan Pusat Penelitian Kimia Lembaga Ilmu Pengetahuan Indonesia (P2K
LIPI) Serpong Tangerang dan Laboratorium Afiliasi Kimia UI Depok dari Bulan
Juli sampai Desember 2009.
3.2. Bahan dan Alat 3.2.1. Bahan-Bahan
Bahan yang digunakan adalah hidrolisat TKKS hasil hidrolisis dengan
asam sulfat. Hidrolisis dilakukan di Laboratorium Bioproses Teknik Kimia
Iinstitut Teknologi Bandung (ITB).
Bahan kimia yang digunakan untuk detoksifikasi hidrolisat adalah NaOH
10%, H2SO4 98%, dan kertas saring Wathman No.14.
Bahan untuk pereaksi gula pereduksi (pereaksi Nelson dan peraksi
molibdat) adalah H2SO4 pekat, NaCO3.5H2O, Kalium Na-Tartrat, NaHCO3,
Na2SO4, CuSO4.5H2O, (NH4)6Mo7O24.4H2O, Na2HAsO4, dan etanol pro analis
buatan Merck dengan kemurnian 99,9% untuk standar etanol.
Bahan yang digunakan untuk fermentasi antara lain : yeast extract, malt
extract, bacto pepton, xilosa pro analis buatan Sigma, bacto agar, glukosa pro
untuk fermentasi yang digunakan adalah Pichia stipitis yang berasal dari kultur
murni Laboratorium Mikrobiologi Institut Teknologi Bandung (ITB).
3.2.2. Alat-Alat
Peralatan yang digunakan dalam penelitian ini adalah Spektrofotometer
U-2000 Hitachi Jepang, kromatografi gas GC-9A Shimadzu dengan kolom PEG,
SE 30 Chromosorb W80-100 mesh, pH meter (HI 931400 micropocessor),
autoklaf merk Meiji buatan Jepang, laminar flow, bunsen, kawat ose, korek api,
kapas, kain kasa, tissue, batang pengaduk, spatula, kaca arloji, kertas saring,
corong, erlemeyer 250 ml dan 300 ml, oven, beker glass 500 ml, vortex, tabung
reaksi, rak tabung reaksi, neraca analitik tipe AB204 merk Mettler Toledo,
neraca biasa, botol reagent, gelas ukur 500 ml dan 100 ml, labu ukur 10 ml, 100
ml dan 200 ml, pipet volumetrik 10 ml, bulp, shaker, hot plate, kelereng, panci,
kelereng, pipet mikro, magnetik stirer, inkubator, mikropipet 1.0-5.0 mL, 40-200
µL, 100-1000 µ L, pipet ukur 1 dan 2 ml, penyaring Gelman Acrodisc LC
PVDF 0,45 µm, syringe 10 µl, blower laminer transfer box, kulkas, cool box
buatan lion star, sentrifuse merk kokusan, suntikan 25 ml, dan alat-alat gelas lain
3.3. Desain Penelitian
Desain penelitian ini ditunjukkan pada gambar 14.
3.4.1. Pembuatan Kurva Tumbuh Pichia stipitis
3.4.1.1. Penyiapan Kultur Murni Pichia stipitis
Kultur murni Pichia stipitis dari ITB dibiakan terlebih dahulu pada media
glukosa, yeast extract, pepton, dan bacto agar(GYPA) sebagai stock kultur Pichia
stipitis. Media agar miring tersebut dibuat dengan cara menimbang 2 gram
glukosa; 0,5 gram yeast extract; 1 gram pepton; dan 2 gram bacto agar, kemudian
dilarutkan dengan 100 ml aquadest dan diaduk sambil dipanaskan sampai semua
bahan larut. Medium dimasukan ke dalam tabung reaksi lalu disterilisasi dengan
autoklaf selama ±20 menit. Medium yang telah steril didinginkan dengan cara
tabung dimiringkan. Lampu UV dan blower laminar transfer box dinyalakan
selama ±20 menit. Sebanyak 1 ose Pichia stipitis diinokulasikan dengan kawat
ose secara aseptis pada media agar miring GYPA. Agar miring tersebut kemudian
diinkubasikan selama ±48 jam di dalam inkubator pada suhu 27oC. Pichia stipitis
dalam GYPA ini disimpan di kulkas sebagai stock kultur Pichia stipitis.
3.4.1.2. Peremajaan Pichia stipitis pada Media Agar Miring YPMXA
Komposisi media agar miring YPMXA (yeast extract, pepton, malt
extract, xilosa, dan bacto agar) dibuat dengan komposisi 3 g/l, 5 g/l, 3 g/l, 30 g/l dan 20 g/l seperti pada penelitian Susanto dan Achmad (2003). Prosedur
pembuatan agar miring steril dibuat seperti pada pembuatan media agar miring
GYPA. Sebanyak 1 ose isolat Pichia stipitis dari media stock kultur
diinokulasikan pada media agar miring YPMXA steril, kemudian dinkubasikan
pada suhu 27oC selama ±48 jam.
Komposisi media cair YPMX yaitu 3 g/l, 5 g/l, 3 g/l, dan 30 g/l (Susanto
dan Achmad, 2003). Medium dibuat dengan cara menimbang 3 gram yeast
extract; 5 gram pepton; 3 gram malt extract; 30 gram xilosa dan dilarutkan dengan
aquadest sampai 1000 ml dan diatur derajat keasamannya dengan NaOH 0,1 N
dan HCl 0,1 N pada kondisi pH 4,5 dan 5. Media tersebut disterilisasi
menggunakan autoklaf pada temperatur 121oC selama ±20 menit. Sebanyak
masing-masing 2,5 ml larutan biakan Pichia stipitis berumur ±48 jam
diinokulasikan kedalam 2 buah erlemeyer 100 ml yang masing-masing berisi 22,5
ml medium cair YPMX steril pH 4,5 dan 5, kemudian diinkubasikan pada suhu
27oC dan diagitasi dengan rotary shaker pada 120 rpm selama 24 jam. Sebanyak
15 ml biakan tersebut kemudian diinokulasikan lagi kedalam erlemeyer 300 ml
yang berisi 135 ml media cair YPMX steril dan diinkubasikan pada suhu 27oC
dan diagitasi dengan rotary shaker pada 120 rpm. Selanjutnya setiap 2 jam sekali
sampel biakan Pichia stipis diambil sebanyak 2 ml dan diukur absorbansinya
dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang 600 nm
(Susanto dan Achmad, 2003). Prosedur dilakukan dengan 3 kali ulangan.
3.4.1.4. Penentuan Kurva Tumbuh Pichia stipitis
Hasil sampling sampel biakan Pichia stipitis pada jam ke-0 sampai jam
ke-26 divortex sampai bercampur rata. Selanjutnya spektrofotometer dinyalakan
dan diset panjang gelombangnya pada 600 nm dan dibiarkan selama 15 menit.
Cuvette diisi dengan media cair YPMX steril (blanko) kemudian bagian luar
cuvette dibersihkan bagian luarnya dengan tissue sampai jernih. Selanjutnya
cuvette dimasukan kedalam tube holder spektrofotometer ditutup dan ditekan
dimasukan ke dalam cuvvette dan dibersihkan bagian luarnya dengan tissue
sampai jernih. Cuvette dimasukan ke dalam tube holder spektrofotometer dan
ditekan tombol start pada alat. Hasil pengukuran dicatat dan dibuat kurva
hubungan antara absorbansi dengan waktu sampling. Sampel yang telah diukur
absorbansinya kemudian diukur pH akhirnya dan dibuat hubungan antara
perubahan pH media dengan waktu sampling. Replikasi dilakukan sebanyak 3
kali. Diagram alir pembuatan kurva tumbuh ini dapat dilihat pada lampiran 13.
3.4.2. Detoksifikasi Penguapan dan Penambahan Alkali pada Hidrolisat TKKS
Detoksifikasi penguapan hidrolisat TKKS 50%, 80%, 85%, dan gabungan
penguapan dan penambahan alkali dilakukan berdasarkan penelitian Susanto dan
Achmad (2003).
Masing-masing sebanyak 500 ml hidrolisat TKKS hasil detoksifikasi
penguapan 50% diuapkan lagi dengan menggunakan oven pada suhu 50oC
sampai terjadi pengurangan volum hidrolisat sebanyak 300 ml (80%) dan 350
ml (85%). Hidrolisat tersebut diuji kadar gula pereduksinya dengan metode
Nelson-Somogyi (Sudarmadji, et al., 1997). Hidrolisat TKKS hasil detoksifikasi
penguapan dengan kadar gula tertinggi ditambahkan NaOH 10% (b/v) sampai pH
10 dan didiamkan selama 1 jam. Selanjutnya sampel disaring menggunakan kertas
saring dan ditambahkan asam sulfat 98% sampai pH 5 dan didiamkan selama 1
jam. Sampel disaring dan diuji kadar gula pereduksi dengan metode
3.4.3. Fermentasi Oleh Pichia stipitis
3.4.3.1. Persiapan Starter Inokulum Pichia stipitis
Media cair YPMX steril dibuat sebanyak 300 ml, dimana komposisi media
dan pengerjaannya dilakukan seperti pada pengerjaan sebelumnya. Satu ose isolat
Pichia stipitis dari kultur stock diinokulasikan ke dalam agar miring YPMXA
steril kemudian diinkubasi selama ±48 jam dalam inkubator pada suhu 27oC.
Kemudian sebanyak 7,5 ml larutan biakan isolat Pichia stipitis dari media agar
miring YPMXA yang berumur ±48 jam diinokulasikan kedalam 2 buah erlemeyer
250 ml yang masing-masing berisi 67,5 ml media cair YPMX steril dan
diinkubasi pada suhu 27oC serta diagitasi dengan menggunakan rotary shaker
pada 120 rpm selama 24 jam. Kedua larutan media isolat tersebut kemudian
ditanam dan dimasukan ke dalam 2 buah erlemeyer 250 ml yang masing-masing
berisi 75 ml media cair YPMX steril dan diinkubasi dengan kondisi yang sama
selama ±16 jam. Larutan media tersebut digunakan sebagar starter inokulum pada
proses fermentasi.
3.4.3.2. Proses Fermentasi
Proses fermentasi berlangsung secara anaerob pada suhu ruang dan pH
media 5. Media fermentasi dalam percobaan terdiri dari :
1. Fermentasi media A (3% xilosa (b/v) tanpa hidrolisat). Media dibuat dengan
cara 7,5 gram xilosa ditimbang dan dilarutkan dengan aquadest sampai 250
ml.
2. Fermentasi media B (campuran 0,6% hidrolisat TKKS dan 2,4% xilosa (b/v)).
penguapan 85% dan penambahan álkali) diencerkan dengan aquadest sampai
250 ml dan ditambahkan 6 gram xilosa.
3. Fermentasi media C (campuran 3% xilosa dan 2% glukosa (b/v) tanpa
hidrolisat). Medium dibuat dengan cara 7,5 gram xilosa dan 5 gram glukosa
ditimbang dan dilarutkan dengan aquadest sampai 250 ml.
4. Fermentasi media D (campuran 1% hidrolisat TKKS; 2,4% xilosa; dan 1,6%
glukosa (b/v)). Medium dibuat dengan cara 33,95 ml hidrolisat TKKS (hasil
detoksifikasi penguapan 85% dan penambahan álkali) diencerkan dengan
aquadest sampai 250 ml kemudian ditambahkan 6 gram xilosa dan 4 gram
glukosa.
Semua larutan media fermentasi dikondisikan pada pH 5, dan ditambahkan
media nutrisi yeast extract, pepton, dan malt extract (YPM) dengan komposisi
0,3%; 5%; dan 3% (b/v) yaitu dengan cara menimbang 0,75 gram yeast extract;
0,75 gram malt extract; dan 1,25 gram pepton dan dimasukan kedalam
masing-masing media fermentasi di atas. Setelah itu, masing-masing-masing-masing larutan media
fermentasi dipindahkan sebanyak 20 ml dan dimasukan ke dalam botol fermentasi
kemudian disterilisasi selama ±20 menit. Sebanyak 5 ml larutan starter inokulum
Pichia stipitis hasil inkubasi ±16 jam diinokulasikan ke dalam media di dalam
botol fermentasi yang telah didinginkan dan ditutup rapat. Sampel media
fermentasi tersebut kemudian difermentasikan pada suhu ruang selama 148 jam.
Sampling dilakukan pada jam ke-24, ke-48, ke-72, ke-96, ke-120, dan ke-148.
Analisa kadar gas karbon dioksida dan etanol yang terbentuk dilakukan
dengan metode gravimetri dan kromatografi gas. Sisa media fermentasi
untuk penetapan kadar gula dan pH sebelum dan setelah fermentasi. Replikasi
dilakukan sebanyak 2 kali.
3.4.4. Prosedur Analisis
3.4.4.1. Pengukuran Konsentrasi Gas CO2
Metode pengukuran gas karbon dioksida dengan cara gravimetri
berdasarkan penelitian Susanto dan Achmad (2003). Botol-botol sampel media
fermentasi ditimbang pada jam ke-0, 24, 48, 96, 120, 148 kemudian dicatat
massanya. Replikasi sebanyak 2 kali. Konsentrasi gas karbon dioksida dihitung
dengan rumus di bawah ini, yaitu :
Konsentrasi gas CO2 (mg/ml ) = w0-w1
V
Keterangan : w0 = berat botol sampel media fermentasi sebelum inkubasi
w1 = berat botol sampel media fermentasi setelah inkubasi
V = volum total fermentasi (ml)
3.4.4.2. Pengukuran Kadar Gula Pereduksi (Metode Nelson-Somogyi) Pembuatan kurva standar gula pereduksi dibuat dengan cara 1 gram xilosa
dilarutkan dengan aquadest sampai volum labu ukur ±100 ml sehingga larutan ini
memiliki konsentrasi 10 mg/ml (larutan A). Sebanyak 2 ml larutan A diambil dan
diencerkan dengan aquadest sampai volum labu ukur ±100 ml (konsentrasi 0,2
mg/ml). Larutan B diencerkan dengan aquadest sampai 1 ml sehingga
konsentrasinya menjadi 0,04 mg/ml; 0,08 mg/ml: 0,12 mg/ml; 0,16 mg/ml; dan
0,2 mg/ml serta dibuat pula larutan blanko (1 ml aquadest). Masing-masing