Tabel 1. Data Pengukuran Ketebalan Selulosa Bakterial dengan Penambahan
Vitamin C (cm)
Selulosa Bakterial (g
vit.C yang
ditambahkan)
Ulangan Analisa(cm) Total
(cm)
Rata-rata
I II III
Selulosa Bakterial (0g) 0,703 0,708 0,705 2,115 0,705 Selulosa Bakterial (0,5g) 0,811 0,805 0,801 2,415 0,805 Selulosa Bakterial (1,0g) 0,909 0,945 0,950 2,805 0,935 Selulosa Bakterial (1,5g) 0,633 0,645 0,613 1,890 0,630 Selulosa Bakterial (2,0g) 0,534 0,520 0,519 1,572 0,524
∑
3,590 3,623 3,588 10,797 3,599Tabel 2. Sidik Ragam Pengukuran Ketebalan Selulosa Bakterial dengan
Penambahan Vitamin C
Sumber
Keragaman
DB JK KT F Hitung F Tabel
5% 1%
Perlakuan 4 0,3000 0,07500 111,94** 3,48 5,99 Galat 10 0,0067 0,00067
Umum 14 0,3090
Keterangan : * = Nyata **
Tabel 3. Data Pengukuran Kadar Serat (%) Selulosa Bakterial dengan Penambahan
Vitamin C
Selulosa Bakterial (g
Vit.C yang
ditambahkan)
Ulangan Analisa Total
Rata-rata
I II III
Selulosa Bakterial (0g) 3,00 3,12 3,08 9,2 3,06 Selulosa Bakterial (0,5g) 3,21 3,24 3,25 9,7 3,23 Selulosa Bakterial (1,0g) 3,55 3,61 3,50 10,65 3,55 Selulosa Bakterial (1,5g) 2,81 2,79 2,87 8,47 2,82 Selulosa Bakterial (2,0g) 1,90 1,8 1,85 5,55 1,85
∑
14,47 14,18 14,55 43,57 14,51Tabel 4. Sidik Ragam Pengukuran Kadar Serat Selulosa Bakterial dengan
Penambahan Vitamin C
Sumber
Keragaman
DB JK KT F Hitung F Tabel
5% 1%
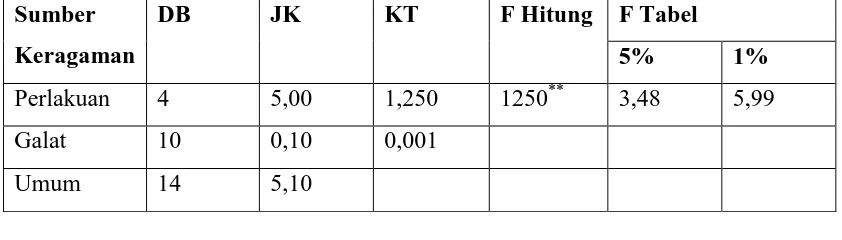
Perlakuan 4 5,00 1,250 1250** 3,48 5,99
Galat 10 0,10 0,001
Umum 14 5,10
Keterangan : * = Nyata **
Tabel 5. Data Pengukuran Kandungan Selulosa Bakterial pada Penambahan
Vitamin C sebanyak 1,0 g
Perlakuan Ulangan Analisa Rata-rata
I II III
Ketebalan (cm) 0,909 0,945 0,950 0,935
Kadar Serat (%) 3,55 3,61 3,50 3,55
Kadar Air (%) 86,70 86,93 86,54 86,00
Kadar Abu (%) 1,55 1,57 1,56 1,56
Tabel 6. Data Pengukuran Uji Tarik Selulosa Bakterial dengan Penambahan
Vitamin C sebanyak 1,0g
Perlakuan Kekuatan geser
(kgf/cm2)
Regangan
(%)
Selulosa
Bakterial (1,0g)
Tabel 7. Data Hasil Uji Organoleptik Selulosa Bakterial dengan Penambahan
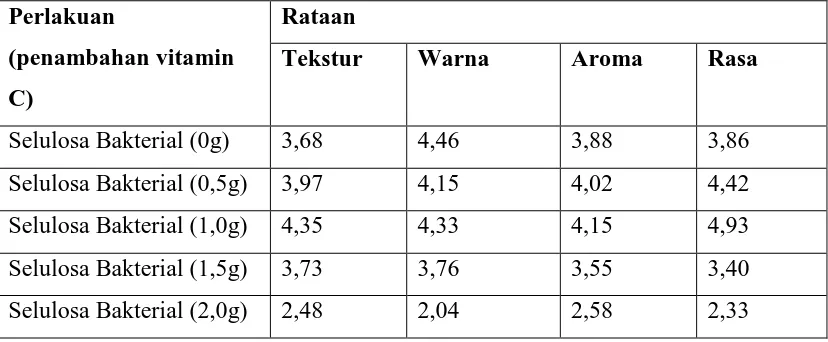
Vitamin C
Perlakuan
(penambahan vitamin
C)
Rataan
Tekstur Warna Aroma Rasa
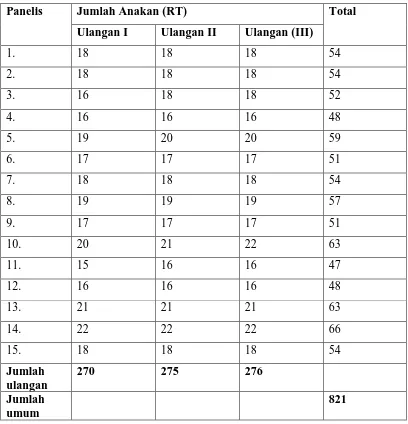
Tabel 8. Data hasil Uji Organoleptik terhadap Tekstur Selulosa Bakterial dengan
Penambahan Vitamin C
Panelis Jumlah Anakan (RT) Total
Ulangan I Ulangan II Ulangan (III)
1. 18 18 18 54
2. 18 18 18 54
3. 16 18 18 52
4. 16 16 16 48
5. 19 20 20 59
6. 17 17 17 51
7. 18 18 18 54
8. 19 19 19 57
9. 17 17 17 51
10. 20 21 22 63
11. 15 16 16 47
12. 16 16 16 48
13. 21 21 21 63
14. 22 22 22 66
15. 18 18 18 54
Jumlah ulangan
270 275 276
Jumlah umum
Tabel 9. Sidik Ragam Hasil Uji Organoleptik terhadap Tekstur Selulosa Bakterial
dengan Penambahan Vitamin C
Sumber Keragaman DB JK KT F Hitung F Tabel
5% 1%
Ulangan 2 0,27 0,135
Perlakuan 14 31,66 2,26 75,33** 2,06 2,8
Galat Percobaan 28 0,93 0,03 Galat penarikan contoh 28 136,4 0,76
Umum 14 169,26
Keterangan : * = Nyata
Tabel 10. Data hasil Uji Organoleptik terhadap Warna Selulosa Bakterial dengan
Penambahan Vitamin C
Panelis Jumlah Anakan (RT) Total
Ulangan I Ulangan II Ulangan (III)
1. 19 19 19 57
2. 19 19 19 57
3. 16 17 16 49
4. 15 15 15 45
5. 20 20 20 60
6. 20 23 20 63
7. 20 20 20 60
8. 19 19 19 57
9. 21 21 21 63
10. 22 22 22 66
11. 18 18 16 52
12. 17 17 17 51
13. 18 18 17 53
14. 19 21 19 59
15. 21 21 20 62
Jumlah ulangan
284 290 280
Jumlah umum
Tabel 11. Sidik Ragam Hasil Uji Organoleptik terhadap Warna Selulosa Bakterial
dengan Penambahan Vitamin C
Sumber Keragaman DB JK KT F Hitung F Tabel
5% 1%
Ulangan 2 30,98 15,49
Perlakuan 14 62,63 4,47 -0,36tn 2,06 2,8
Galat Percobaan 28 -382,51 13,66 Galat penarikan contoh 28 557,8 557,8
Umum 14 268,9
Keterangan : * = Nyata
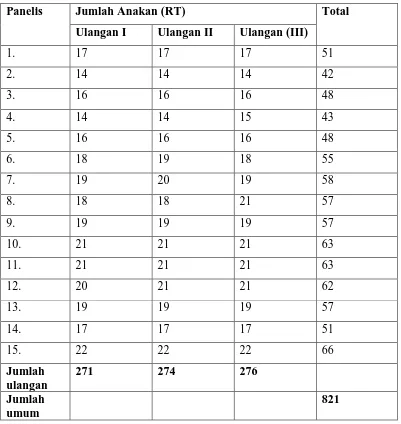
Tabel 12. Data hasil Uji Organoleptik terhadap Aroma Selulosa Bakterial dengan
Penambahan Vitamin C
Panelis Jumlah Anakan (RT) Total
Ulangan I Ulangan II Ulangan (III)
1. 17 17 17 51
2. 14 14 14 42
3. 16 16 16 48
4. 14 14 15 43
5. 16 16 16 48
6. 18 19 18 55
7. 19 20 19 58
8. 18 18 21 57
9. 19 19 19 57
10. 21 21 21 63
11. 21 21 21 63
12. 20 21 21 62
13. 19 19 19 57
14. 17 17 17 51
15. 22 22 22 66
Jumlah ulangan
271 274 276
Jumlah umum
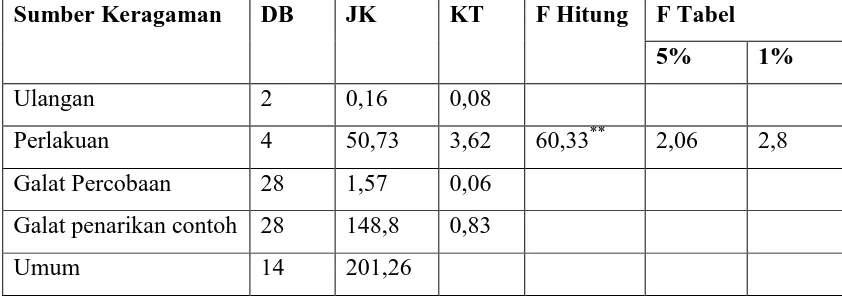
Tabel 13. Sidik Ragam Hasil Uji Organoleptik terhadap Aroma Selulosa Bakterial
dengan Penambahan Vitamin C
Sumber Keragaman DB JK KT F Hitung F Tabel
5% 1%
Ulangan 2 0,16 0,08
Perlakuan 4 50,73 3,62 60,33** 2,06 2,8
Galat Percobaan 28 1,57 0,06 Galat penarikan contoh 28 148,8 0,83
Umum 14 201,26
Keterangan : * = Nyata
Tabel 14. Data hasil Uji Organoleptik terhadap Rasa Selulosa Bakterial dengan
Penambahan Vitamin C
Panelis Jumlah Anakan (RT) Total
Ulangan I Ulangan II Ulangan (III)
1. 17 17 17 51
2. 18 18 18 54
3. 20 20 20 60
4. 22 22 22 66
5. 17 17 17 51
6. 18 18 18 54
7. 17 17 17 51
8. 21 20 21 62
9. 18 17 18 53
10. 20 20 20 60
11. 22 20 22 64
12. 23 20 23 66
13. 21 21 21 63
14. 15 15 15 45
15. 18 18 21 57
Jumlah ulangan
287 280 290
Jumlah umum
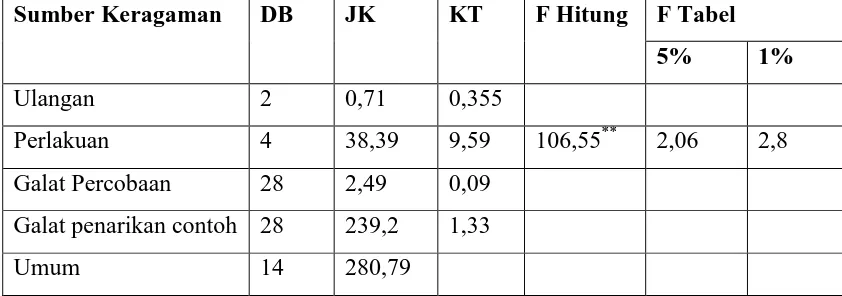
Tabel 15. Sidik Ragam Hasil Uji Organoleptik terhadap Rasa Selulosa Bakterial
dengan Penambahan Vitamin C
Sumber Keragaman DB JK KT F Hitung F Tabel
5% 1%
Ulangan 2 0,71 0,355
Perlakuan 4 38,39 9,59 106,55** 2,06 2,8
Galat Percobaan 28 2,49 0,09 Galat penarikan contoh 28 239,2 1,33
Umum 14 280,79
Keterangan : * = Nyata
0
Gambar 1. Grafik Hasil Pengukuran Ketebalan Selulosa Bakterial dengan Variasi
Penambahan Vitamin C
0
Penambahan Vitamin C (g)
K
Gambar 2. Grafik Hasil Pengukuran Kadar Serat (%) Selulosa Bakterial dengan
Gambar 4. Selulosa Bakterial Dengan Penambahan Vitamin C
DAFTAR PUSTAKA
Almatsier.S. 2001. Prinsip Dasar Ilmu Gizi. Gramedia Pustaka Utama. Jakarta.
Atih. S.H. 1979. “Pengolahan Air kelapa”, Buletin Perhimpunan Ahli Teknologi pangan Indonesia. Penelitian Kimia Bogor. Bogor.
Banwart. G.K. 1981. Basic food Microbiology. New york : Van Nostrand Reinhold company.
Bergonia. H.A. 1982. Reverse Osmosis of Coconut Water through Cellulose acetat Membrane. Proocedings of the second ASEAN workshop Membrane Technology. Ciechanska. D. 2004. Multifunctional Bacterial Cellulose/Chitosan Composite Materials for Medical Applications. Fibres & Textiles in Eastern Europe. Volume 12
no.4(48).
Darwis .A. Aziz. 1990 . Teknologi Mikrobial . Institut Pertanian Bogor Press. Bogor . Daulay. 2003. Studi Pengaruh Penambahan Starter dan Lama Fermentasi terhadap
Pembuatan Nata de Aloe vera (Lidah Buaya), FMIPA. Universitas Sumatera
Utara Press. Medan.
Dimagulla. L.A.. 1967. Nata de Coco 2. Chemical Nature and Properties of Nata. Philipine agriculture.
Fessenden. J.R. Fessenden. J.S. 1986. Kimia Organik. Edisi ketiga. Jilid 2. Erlangga. Jakarta.
Hart . H. Craine. L.E. and Hart. D.J. 2003. Kimia Organik. Edisi Kesebelas. Erlangga. Jakarta.
Hoenich, N. 2006. Cellulose for Medical Applications. Bioresources. Volume 1(2): hal 270 – 278.
. http://www.gizi.net/cgibin/berita/fullnews.cgi?newsid. Diakses pada tanggal 7 juni 2008
Diakses pada tanggal 13 Mei 2008
Krystynowicz. 2001. Biosynthesis of Bacterial Celulose and It’s Potential Application in The Different industries.
http://www.biotecnology .pl.com/science/krystynomcz.htm
Moss,. M.O .et el . 1995. Food Microbiology. Royal Society of Chemistry . Crambridge. Onifade. A.K. Jeff-Agboola, Y.A. 2003. Effect of Fungal Infectionon Proximate nutrient
Composition of Coconut (Cocos Nucifera Linn) fruit. Food, Agriculture &
Environment. Volume 1(2).
Pambayun. R. 2002. Teknologi Pengolahan Nata de Coco. Kanisius. Yogyakarta.
Philip. G.O. and Williams. P.A. 2000. Handbook of Hydrocolloids. Woodhead Publishing limited. Cambridge.
Poedjiadi. A. 1996. Dasar-dasar Biokimia. UI Press. Jakarta.
Salunkhe. D.K. dan Desai. B.B. 1984. Postharvest Biotechnology of Fruits. Volume II. CRC Press Inc. Florida.
Silalahi. J. 2006. Makanan Fungsional . Kanisius. Yogyakarta.
Sudarmadji . S. . dkk. 1984. Prosedur Analisa untuk Bahan Makanan dan Pertanian. Edisi Ketiga. Penerbit Liberty. Yogyakarta.
Warisno. 2004. Mudah & praktis membuat Nata de Coco. Cetakan Kedua. Agromedia Pustaka. Depok.
Widia. I.W. 1984. Mempelajari Pengaruh Penambahan Skim Milk Kelapa, Jenis Gula dan Mineral dengan berbagai Konsentrasi pada Pembuatan Nata de Coco.
Skripsi. Fakultas Teknologi Pertanian IPB. Bogor.
BAB 2
TINJAUAN PUSTAKA
2.1Kelapa
Kelapa (cocos nucifera L.) termasuk termasuk ke dalam famili Palmae (palem), yang merupakan salah satu famili utama yang tergolong tumbuhan monokotiledon. Famili palmae mencakup beberapa jenis tumbuhan yang bermamfaat bagi manusia, seperti kurma, kelapa, kelapa sawit, pinang, sagu, tebu, pohon ara, dan lainnya. Semuanya dibedakan berdasarkan batangnya yang tidak bercabang yang dimahkotai oleh daun menjarum yang bentuknya menyerupai kipas.
Kelapa termasuk ke dalam suku “Cocoideae”, yang mempunyai lebih dari dua puluh genera. Genus cocos dikenal hanya memiliki satu anggota yaitu Cocos nucifera. (Salunkhe, D.K. dan Desai,B.B., 1984).
Air kelapa mengandung air 91,27%; protein 0,29%, lemak 0,15 %; karbohidrat 7,27%; serta abu 1,06%. Selain itu, air kelapa mengandung nutrisi seperti sukrosa, dekstrosa, fruktosa serta vitamin B kompleks yang terdiri dari asam nikotinat, asam pantotenat, biotin, riboflavin, dan asam folat. Nutrisi itu sangat berguna untuk pertumbuhan Acetobacter xylinum. (Warisno, 2004).
tersebut sangat mendukung baik bagi pertumbuhan maupun aktivitas A.xylinum pada saat fermentasi air kelapa hingga menjadi nata de coco.
Protein dalam air kelapa tersusun dari asam-asam amino yang lengkap, yaitu sebanyak 17 macam asam amino. Bahkan persentase beberapa macam asam amino yang meliputi arginin,alanin, sistin, dan serin, ternyata lebih tinggi dari pada asam-asam amino yang sama dalam susu sapi. Kelengkapan asam-asam amino dalam air kelapa ini sangat mendukung pertumbuhan, perkembangan, dan aktivitas bibit nata Acetobacter xylinum.
Nata de coco adalah salah satu jenis minuman yang mengandung senyawa selulosa (dietary fiber), dan dihasilkan dari air kelapa melalui proses fermentasi, yang melibatkan jasad renik (mikrobia), yang selanjutnya dikenal sebagai bibit nata. Bibit nata sebenarnya merupakan golongan bakteri dengan nama Acetobacter xylinum. (Pambayu.R.,2002).
Nata berasal dari bahasa Spanyol “natare” berarti terapung-apung, yaitu suatu produk fermentasi oleh bakteri Acetobacter xylinum pada media yang mengandung gula, menyukai lingkungan yang asam dan membutuhkan sumber nitrogen untuk aktivitasnya. (Atih,1979)
Buah kelapa yang terlalu muda belum memiliki daging buah. Air kelapa muda ini rasanya manis, mengandung mineral 4%, gula 2%, abu, dan air. Bila buah makin tua maka rasa manisnya akan semakin berkurang. Perbandingan komposisi air kelapa muda dengan air kelapa tua dapat dilihat pada tabel 2.1.
Tabel 2.1. komposisi Kimia Air Buah Kelapa
Sumber air kelapa (dalam 100 g)
Air Kelapa Muda
(%)
Air Kelapa Tua (%)
Protein 0,2 g 0,14 g
Lemak 1,0 g 1,50
Karbohidrat 3,8 g 4,60
Kalsium 15,0 mg -
Fosfor 8,0 mg 0,5
Besi 0,2 mg -
Aktivis vitamin A 0,0 IU -
Asam askorbat 1,0 mg -
Air 95,5 mg 91,5
Bagian yang dapat dimakan 100 g -
Sumber : Palungkun.1992.
2.2Acetobacter xylinum
Acetobacter mempunyai sel-sel yang berbentuk elips atau tongkat yang melengkung. Acetobacter merupakan bakteri aerob, yang memerlukan respirasi dalam metabolisme. Acetobacter dapat mengoksidasi etanol menjadi asam asetat, juga dapat mengoksidasi asetat dan laktat menjadi CO2 dan H2O.
Berbagai spesies Acetobacter dapat ditemukan pada buah-buahan dan sayur-sayuran. Bakteri inilah yang menyebabkan pengasaman jus buah-buahan dan minuman beralkohol (bir dan anggur). (Banwart, G.J., 1981).
Spesies Acetobacter yang telah dikenal antara lain: A.aceti, A.orleanensis, A.liquefasiensis, dan A. xylinum. Meskipun ciri-ciri yang dimiliki hampir sama dengan
Sifat inilah yang umumnya mempunyai sifat “under oxydizer”, yaitu hanya mengubah alkohol menjadi asam asetat.
Dalam medium cair Acetobacter xylinum mampu membentuk suatu lapisan yang dapat mencapai ketebalan beberapa sentimeter. Bakteri terperangkap dalam massa benang-benang yang dibuatnya. Untuk menghasilkan massa yang kokoh, kenyal, tebal, putih, dan tembus pandang perlu diperhatikan suhu fermentasi (inkubasi), komposisi medium dan pH medium.
Menurut Warisno, biakan murni Acetobacter xylinum digunakan sebagai starter yang bisa menggumpalkan air kelapa hingga menjadi nata de coco. Biakan murni ini bisa diperbanyak menjadi bibit atau starter. Bibit atau starter berisi mikroba dengan jumlah dan kondisi fisiologis yang siap diinokulasi ke dalam media fermentasi(Daulay, 2003).
2.2.1 Sifat-Sifat Acetobacter xylinum
1. Sifat Morfologi
Acetobacter xylinum merupakan bakteri berbentuk batang pendek, yang mempunyai
panjang 2 mikron dan lebar 0,6 mikron, dengan permukaan dinding yang berlendir. Bakteri ini bisa membentuk rantai pendek dengan satuan 6-8 sel. Bersifat nonmotil dan dengan pewarnaan Gram menunjukkan Gram negatif. (Pambayun.R.,2002).
Berikut ini adalah taksonomi Acetobacter xylinum : Domain : Bacteria
Phylum : Prateobacteria Kelas : Alpha protobacteria Ordo : Rhodospirillales Famili : Acetobacter
2. Sifat Fisiologi
Bakteri ini dapat membentuk asam dari glukosa, etil alkohol, dan propil alkohol, tidak membentuk indol dan mempunyai kemampuan mengoksidasi asam asetat menjadi CO2 dan H2O. Sifat yang paling menonjol dari bakteri ini adalah memiliki kemampuan untuk mempolimerisasi glukosa hingga menjadi selulosa. Selanjutnya selulosa tersebut membentuk matrik yang dikenal sebagai nata.
2.2.2 Faktor-Faktor yang Mempengaruhi Pertumbuhan Acetobacter xylinum
Adapun beberapa faktor yang berkaitan dengan kondisi nutrisi, adalah sebagai berikut:
a. Sumber Karbon
Senyawa karbon yang dapat digunakan dalam fermentasi selulosa bakterial adalah senyawa karbohidrat yang paling banyak digunakan berdasarkan pada pertimbangan ekonomis adalah sukrosa atau gula pasir. Sukrosa mempunyai kelebihan apabila dibandingkan dengan gula sederhana lain, yakni selain sebagai sumber energi dan bahan pembentuk nata , gula ini berfungsi sebagai bahan induser yang berperan dalam pembentukan enzim ekstraseluler polimerase yang bekerja menyusun benang-benang selulosa sehingga pembentukannya dapat maksimal.
b. Sumber Nitrogen
Mg2+, Ca2+ dan lainnya sangat diperlukan untuk mengontrol kerja enzim ekstraselluler danmembentuk ikatan polisakarida tersebut.
c. Tingkat Keasaman
Pengukuran pH merupakan parameter yang mempengaruhi pertumbuhan dan pembentukan produk. Karena sangat pentingnya pH maka sebagian besar proses fermentasi dikendalikan dengan cara buffer atau sistem pengendali pH. Aktivitas pembentukan nata hanya terjadi pada kisaran pH antara 3,5-7,5. Asam asetat glasial ditambahkan ke dalam medium untuk menurunkan pH medium yang optimum yaitu 4. Meskipun bisa tumbuh pada kisaran pH 3,5-7,5, bakteri A.xylinum sangat cocok tumbuh pada suasana asam pH 4,3. Jika kondisi lingkungan dalam suasana basa, bakteri ini akan mengalami gangguan metabolisme selnya.
d. Udara (Oksigen)
Bakteri A.xylinum merupakan mikrobia aerobik. Dalam pertumbuhan, perkembangan, dan aktivitasnya, bakteri ini sangat memerlukan oksigen. Bila kekurangan oksigen, bakteri ini akan mengalami gangguan atau hambatan dalam pertumbuhannya dan bahkan akan segera mengalami kematian. Untuk mencukupi kebutuhan oksigen, pada ruang fermentasi harus tersedia cukup ventilasi. Namun demikian, harus diusahakan agar aliran udara tidak kontak langsung dengan selulosa bakterial dan tidak terlalu kencang masuk ke dalam ruangan . Aliran yang terlalu kencang dan langsung mengenai produk, akan dapat menyebabkan kegagalan dalam proses pembuatan nata.
e. Temperatur
Suhu ideal (optimal) bagi pertumbuhan Acetobacter xylinum adalah 28- 31oC. kisaran tersebut merupakan suhu kamar pada umumnya di Indonesia. Pada suhu di bawah 28oC, pertumbuhan bakteri akan terhambat. Demikian juga pada suhu di atas 31oC bibit nata akan mengalami kerusakan dan bahkan pada suhu ± 40oC bakteri Acetobacter xylinum akan mati, meskipun enzim ekstraseluler yang telah dihasilkan
2.2.3 Aktivitas Acetobacter xylinum pada Fermentasi Nata
Apabila ditumbuhkan pada media yang kaya akan sukrosa, Acetobacter xylinum akan memecah sukrosa ekstraseluler menjadi glukosa dan fruktosa. Senyawa-senyawa glukosa dan fruktosa tersebut baru dikonsumsi sebagai bahan bagi metabolisme sel. Bakteri Acetobacter xylinum merombak gula untuk memperoleh energi yang diperlukan bagi
metabolisme sel. Selain itu, bakteri ini juga mengeluarkan enzim yang mampu menyusun (mempolimerisasi) senyawa glukosa menjadi polisakarida yang dikenal dengan selulosa ekstraseluler. Fruktosa, selain digunakan sebagai sumber energi, juga berperan sebagai induser bagi sintesis enzim ekstraseluler polimerase. Hal ini merupakan salah satu alasan, bahwa sukrosa mempunyai kelebihan dibanding gula sederhana lain dalam fungsinya sebagai substrat pembuat nata.
Berdasarkan pada pengamatan morfologi, pembentukan nata oleh bakteri Acetobacter xylinum diawali dengan pembentukan lembaran benang-benang selulosa.
Selanjutnya, bakteri ini membentuk mikrofibril selulosa disekitar permukaan tubuhnya hingga membentuk serabut selulosa yang sangat banyak dan dapat mencapai ketebalan tertentu. Pada akhirnya, susunan selulosa tersebut akan tampak seperti lembaran putih transparan dengan permukaan licin dan halus yang disebut nata.
Pembentukan selulosa Acetobacter xylinum dipengaruhi oleh ketersediaan oksigen dan glukosa.(Hestrin, S., and M.Schramm., 1954). Pada ruang gelap pembentukan struktur nata relatif lebih cepat dan diperoleh lapisan yang lebih tebal. (Widia, 1984).
Alat-alat kotor bisa mengambat bahkan mematikan pertumbuhan Acetobacter xylinum. Alat-alat bersih dan steril bisa memacu pertumbuhan bakteri Acetobacter
xylinum. Karena itu, semua peralatan harus disterilkan dulu. Semua peralatan disterilkan
dengan cara dikukus dalam dandang atau memakai autoklaf.
dengan air akan menurunkan hasil nata de coco yang terbentuk. Jika air kelapa bercampur dengan garam tidak akan terbentuk microbial cellulose sehingga tidak akan dihasilkan nata de coco. Air kelapa yang disimpan lebih dari 1 bulan akan menghasilkan nata de coco yang kurang baik. Jika tetap menggunakan air kelapa yang sudah lama disimpan, sebelum digunakan harus ditambah dengan gula pasir.(Warisno,2004).
2.3 Fermentasi
Fermentasi dapat terjadi karena adanya aktivitas mikroba penyebab fermentasi pada substrat organik yang sesuai. Terjadinya fermentasi ini menyebabkan perubahan sifat pangan , sebagai akibat dari pemecahan kandungan-kandungan bahan pangan tersebut. Hasil-hasil fermentasi terutama tergantung pada jenis bahan pangan (substrat), macam mikroba dan kondisi sekelilingnya yang mempengaruhi pertumbuhan dan metabolisme mikroba tersebut. (Winarno, F.G.dkk,1997).
Tujuan dari proses terakhir ini adalah memproduksi produk seoptimal mungkin, berupa biomassa sel atau metabolit. Proses ini dilakukan dalam fermentor yang berisi medium dengan kandungan gizi yang cukup dan kondisi medium (misalnya suhu, pH, nutrient, medium dan homogenitas) yang optimal.
2.3.1 Faktor-Faktor yang Mempengaruhi Keberhasilan Fermentasi
1. Medium
Medium harus dapat menyediakan seluruh kebutuhan nutrisi mikroorganisme. Kebutuhan itu meliputi senyawa sumber karbon, nitrogen, mineral, vitamin dan air.
2. Nutrien
tersedia dan murah.Senyawa mengandung nitrogen umumnya dibutuhkan untuk pembentukan sel dan metabolit yang mengandung nitrogen.Nutrisi lain yang dibutuhkan adalah mineral yang diperlukan untuk berbagai proses metabolisme sel. Air juga nerupakan salah satu nutrien bagi mikroorganisme. Nutrien ini umumnya sudah tersedia melimpah di medium.
3. Suhu
Fermentasi dilakukan pada suhu dimana pertumbuhan sel atau produksi metabolit tertinggi. Berdasarkan suhu pertumbuhan optimum, umumnya mikroorganisme yang digunakan dalam fermentasi tergolong mesofil dengan suhu optimum 20 - 45°C dan termofil dengan suhu optimum 45°C.
4. pH
Selama fermentasi berlangsung, umumnya pH medium berubah. Perubahan pH ini dapat mengganggu pertumbuhan sel dan produksi metabolit. Karena itu selama fermentasi berlangsung, pH dipertahankan tetap pada pH optimum. Untuk itu dapat dilakukan dengan penambahan buffer yang tidak dapat dirombak oleh mikroorganisme atau dengan larutan asam atau basa dari luar jika pH berubah. (Darwis, 1990)
Fermentasi dilakukan pada media cair yang telah diinokulasi dengan starter. Fermentasi berlangsung pada kondisi aerob (membutuhkan oksigen). Mikroba tumbuh terutama pada permukaan media. Fermentasi dilangsungkan sampai nata yang terbentuk cukup tebal (1,0 – 1,5 cm). Biasanya ukuran tersebut tercapai setelah 10 hari (semenjak diinokulasi dengan starter), dan fermentasi diakhiri pada hari ke 15. Jika fermentasi tetap diteruskan , kemungkinan permukaan nata mengalami kerusakan oleh mikroba pencemar. Nata berupa lapisan putih seperti agar. Lapisan ini adalah massa mikroba berkapsul dari selulosa. Lapisan nata mengandung sisa media yang sangat masam. Rasa dan bau masam tersebut dapat dihilangkan dengan perendaman dan perebusan dengan air bersih.
2.3.2 Tahap-Tahap Fermentasi Nata
Adapun tahap-tahap yang dilakukan pada fermentasi Nata adalah sebagai berikut :
a. Pemeliharaan Biakan Murni Acetobacter xylinum
Fermentasi nata memerlukan biakan murni Acetobacter xylinum. Biakan murni ini harus dipelihara sehingga dapat digunakan setiap saat diperlukan . pemeliharaan tersebut meliputi :
1. Proses penyimpanan sehingga dalam jangka waktu yang cukup lama viabilitas (kemampuan hidup) mikroba tetap dipertahankan, dan
2. Penyegaran kembali mikroba yang telah disimpan sehingga terjadi pemulihan viabilitas dan mikroba dapat dapat disiapkan sebagai inokulum fermentasi.
b. Penyiapan Starter
Starter adalah populasi mikroba dalam keadaan murni dalam jumlah dan kondisi fisiologis yang siap diinokulasi pada media fermentasi. Mikroba pada starter tumbuh dengan cepat dan fermentasi segera terjadi. Media starter biasanya identik dengan media fermentasi. Media ini diinokulasi dengan biakan murni dari agar miring yang masih segar. Pada permukaan starter akan tumbuh mikroba membentuk lapisan yang disebut nata. Volume starter disesuaikan dengan volume media fermentasi yang akan disiapkan. Pemakaian yang terlalu banyak tidak dianjurkan karena tidak ekonomis.
c. Fermentasi Nata
2.4Selulosa
Selulosa merupaka material yang secara alamiah terdapat di kayu, kapas, serta tumbuhan lainnya. Selulosa pertama kali diisolasi dari kayu pada tahun 1885 oleh Charles F. Cross dan Edward Bevan di Jodrell laboratory of Royal Botanic Gardens, Kew, London. Proses untuk menghasilkan film selulosa dari bubur ditemukan oleh tiga ahli kimia berkebangsaan Inggris, Charles Frederik Cross, edwar John Bevan dan Clayton Beadle pada tahun 1898. Tetapi pada tahun 1913, Dr Jacques Brandanberger yang mengembangkan film tipis selulosa transparan sebagai prodil komersilo di pabrik ‘La Cellophane SA, Bezons, Prancis(Hoenich, N., 2006).
Selulosa membentuk komponen serat dari dinding sel tumbuhan . Molekul selulosa merupakan rantai-rantai atau mikrofibril dari D-glukosa sampai sebanyak 14.000 satuan yang terdapat sebagai berkas-beras terpuntir mirip tali yang terikat satu sama lain oleh ikatan hidrogen.Suatu molekul tunggal selulosa merupakan polimer lurus dari
1,4’-β-D-glukosa. (Fessenden J.R., and Fessenden J.S., 1986).
Gambar 2.1 Struktur selulosa (http://www.lsbu.ac.uk)
glukosa, beragregasi menghasilkan fibril yang terikat bersama oleh ikatan hidrogen diantara hidroksil-hidroksil pada rantai yang bersebelahan. (Hart,H.,dkk.,2003).
Polimer karbohidrat dalam bentuk ikatan beta tidak dapat dicerna oleh enzim pencernaan manusia. Selulosa merupakan struktur kristal yang sangat stabil. Selulosa yang berasal dari makanan nabati akan melewati saluran cerna secara utuh. Selulosa melunakkan dan memberi bentuk pada feses karena mampu menyerap air, sehingga membantu gerakan peristaltik usus, dengan demikian membantu defekasi dan mencegah konstipasi. (Almatsier. S., 2001).
2.5Selulosa Bakterial
Selulosa yang diperoleh dari proses fermentasi adalah sejenis polisakarida mikrobial yang tersusun oleh serat selulosa yang dihasilkan oleh strain Acetobacter xylinum, subspesies dari Acetobacter aceti, bakteri nonpatogen, yang dinamakan sebagai selulosa bakterial atau selulosa yang diperoleh dari fermentasi.
2.5.1 Karakterisasi Selulosa Bakterial
Selulosa bakterial mempunyai struktur kimia yang sama seperti selulosa yang berasal dari tumbuhan, dan merupakan polisakarida berantai lurus yang tersusun oleh molekul D-glukosa melalui ikatan β-1,4. (Phillips, G.O., and Williams, P.A,2000).
Menurut Lairon et el (1985) selulosa dapat mengikat lipase (0,93 ± 0,6 % ), garam empedu ( 1,2 ± 0,5%), fosfolipid (4,3 ± 0,2 %) , dan kolesterol (0,9 ± 0,6%). Menurut Brody (1994) selulosa, lignin, dan hemiselulosa mempunyai efek menurunkan waktu transit isi usus yang dapat menyebabkan semakin singkat dan rendahnya penyerapan nutrien, termasuk lemak dan glukosa. Dengan demikian serat yang terdapat dalam nata potensial dijadikan obat hiperlipidemia dan hiperglikemia.
Serat yang kaya selulosa merangsang pemindahan bahan makanan dalam saluran cerna. Ada korelasi langsung antara kadar serat diet (selulosa dan hemiselulosa) dan gerak laju makanan melalui saluran cerna. Diet yang mengandung selulosa, serat akan lebih cepat karena meningkatnya volume feses. Meningkatnya serat kasar juga menguntungkan karbohidrat penyebab diabetes terutama gula-gula sederhana. Pektin dalam buah-buahan memperlambat gerak laju gula dari lambung ke usus kecil, atau melawan peningkatan konsentrasi glukosa darah yang cepat setelah makan gula.
2.5.2 Aplikasi Selulosa Bakterial
Selulosa bakterial yang bentuknya mirip kolang-kaling bisa dijadikan alternatif penggantinya. Selulosa bakterial bisa di jadikan bahan campuran dalam berbagai minuman. Di Jepang, selulosa bakterial atau yang dikenal dengan nata de coco digunakan sebagai bahan makanan yang biasa dicampur dengan mi. (Warisno,2004).
Berdasarkan hasil penelitian yang dilakukan orang, ternyata nata de coco bisa dijadikan sebagai bahan baku untuk membuat sound system. Hasilnya, loudspeaker yang menggunakan membran sound system dari nata de coco memiliki suara yang lebih bersih. (Warisno,2004).
pada tahapan preparasi sampel dalam analisa HPLC sebagai membran millipore. Dengan demikian, selulosa nata berpeluang untuk dikembangkan sebagai biomembran.
Penelitian yang mengarah pada pengembangan selulosa bakterial sebagai material bernilai tambah sudah banyak dilakukan. Beberapa diantaranya adalah penggunaan selulosa bakterial sebagai bahan diafragma tranduser, bahan pencampur dalam industri kertas, karakterisasi sifat listrik dan magnetnya, sebagai support untuk sensor glukosa dan sebagai membran dialisis. (Iguchi, 2000).
Mikrokristal selulosa digunakan dalam pembuatan tablet karena mempunyai daya ikat tablet yang sangat baik dan waktu hancur tablet relatif singkat. Mikrokristalin yang diperoleh dari pasaran adalah produk impor sehingga berakibat mahalnya produk tablet. Untuk menghasilkan mikrokristal selulosa dengan harga murah, maka dilakukan dengan pemamfaatan selulosa bakterial dari hasil fermentasi Acetobacter xylinum dalam substrat air kelapa menjadi menjadi mikrokristal selulosa untuk bahan pembantu pembuatan tablet.(Yanuar,A.,dkk,2003).
Selulosa bakterial merupakan polimer alam yang sifatnya menyerupai hidrogel yang diperoleh dari polimer sintetik; selulosa bakterial menunjukkan kandungan air yang tinggi (98-99%), daya serap yang baik terhadap cairan, bersifat non allergenik dan dapat disterilisasi tanpa mempengaruhi karakteristik dari bahan tersebut. Karena karakteristiknya mirip seperti kulit manusia, selulosa bakterial dapat digunakan sebagai pengganti kulit untuk merawat luka bakar yang serius. (Ciechanska,D., 2004).
2.6 Vitamin
vitamin adalah zat organik maka vitamin dapat rusak karena penyimpanan dan pengolahan. (Almatsier. S., 2001).
Hampir semua vitamin yang kita kenal sekarang telah berhasil diidentifikasi sejak tahun 1930. vitamin tersebut pada umumnya telah dikelompokkan ke dalam 2 golongan utama yaitu:
1. vitamin yang larut dalam lemak yang meliputi vitamin A, D, E, dan K 2. vitamin yang larut dalam air yaitu vitamin B dan C.(Winarno, 1995)
Vitamin berperan dalam beberapa tahap reaksi metabolisme energi, pertumbuhan dan pemeliharaan tubuh, pada umumnya sebagai koenzim. (Almatsier. S., 2001). Peranan vitamin dalam tubuh dapat pula dipengaruhi oleh zat-zat tertentu yang ada di dalam pangan yang mempunyai struktur hampir sama dengan vitamin. Zat tersebut adalah zat antivitamin atau vitamin antagonis. Sebagai contoh misalnya pada ikan mentah terdapat thiaminase yang menghambat kerjanya vitamin B6.
Pada tahap pemprosesan dan pemasakan banyak vitamin yang hilang bila menggunakan suhu tinggi, air perebusan dibuang, permukaan makanan bersentuhan dengan udara dan menggunakan alkali. (Almatsier. S., 2001). Pencucian sayuran setelah dipotong-potong terlebih dahulu, membuka tempat berisi vitamin C sebab oleh udara akan terjadi oksidasi yang tidak reversibel. (Poedjiadi, A., 1996).
2.7 Vitamin C
Gambar 2.2 Vitamin C (http://www.wikimedia.org.)
Vitamin C adalah kristal putih yang mudah larut dalam air. Dalam keadaan kering vitamin C cukup stabil, tetapi dalam keadaan larut, vitamin C mudah rusak karena bersentuhan dengan udara (oksidasi) terutama bila terkena panas. Oksidasi dipercepat dengan kehadiran tembaga dan besi. Vitamin C tidak stabil dalam larutan alkali, tetapi cukup stabil dalam larutan asam . Vitamin C adalah vitamin yang paling labil.
Asam askorbat (vitamin C) adalah suatu turunan heksosa dan diklasifikasikan sebagai karbohidarat yang erat berkaitan degan monosakarida. Vitamin C dapat disintesa dari D-glukosa dan D-galaktosa dalam tumbuhh-tumbuhan dan sebagian besar hewan. Vitamin C terdapat dalam 2 bentuk di alam, yaitu L-asam askorbat (bentuk reduksi) dan L-asam dehidro askorbat (bentuk oksidasi).
2.8 Parameter-parameter yang diamati
2.8.1 Kadar Air
Air berperan sebagai pembawa zat-zat makanan dan sisa metabolisme, sebagai media reaksi yang menstabilkan pembentukan biopolimer dan sebagai bahan yang dapat mendispersikan berbagai senyawa yang ada dalam bahan makanan. Untuk beberapa bahan malah berfungsi sebagai pelarut yang dapat melarutkan bahan seperti garam, vitamin yang larut dalam air, mineral, dan senyawa-senyawa cita rasa seperti yang terkandung dalam teh dan kopi.
Penetapan kandungan air dapat dilakukan dengan beberapa cara. Hal ini tergantung pada sifat bahannya. Pada umumnya penentuan kadar air dilakukan dengan mengeringkan bahan dalam oven pada suhu 105-110oC selama 3 jam atau sampai diperoleh berat yang konstan. (Winarno, F.G.,1995).
2.8.2 Kadar Abu
Abu adalah zat anoganik sisa hasil pembakaran suatu bahan organik. Kandungan abu dan komposisinya tergantung pada macam bahan dan cara pengabuannya. Salah satu cara penentuan abu total yaitu dengan metode gravimetri. Penentuan kadar abunya yaitu dengan mengoksidasi semua zat organik pada suhu tinggi, yaitu sekitar 500-600oC dan kemudian melakukan penimbangan zat yang tertinggal setelah proses pembakaran tersebut.
Bahan dengan kadar air yang tinggi sebelum pengabuan harus dikeringkan terlebih dahulu. Lamanya pengabuan tiap bahan berbeda-beda dan berkisar antara 2-8 jam. Penagabuan dianggap selesai apabila diperoleh sisa pengabuan yang umumnya berwarna putih abu-abu dan beratnya konstan dengan selang waktu pengabuan 30 menit.
2.8.3 Kadar Serat Kasar
Serat-serat yang terdapat dalam bahan pangan yang tidak tercerna mempunyai sifat positif bagi gizi dan metabolisme. Nama atau istilah yang digunakan untuk serat tersebut untuk serat adalah dietary fiber. Walaupun demikian serat kasar tidaklah identik dengan dietary fiber. Menurut Scala(1975) kira-kira hanya sekitar seperlima sampai setengah dari
seluruh serat kasar yang benar-benar berfungsi sebagai dietary fiber.(Winarno,F.G.,1995)
Serat kasar mengandung senyawa selulosa, lignin, dan zat lain yang belum dapat diidentifikasi dengan pasti. Di dalam analisis penentuan serat kasar diperhitungkan banyaknya zat-zat yang tidak larut dalam asam encer ataupun basa encer dengan kondisi tertentu.
Langkah-langkah yang dilakukan dalam analisisnya adalah :
1. defatting, yaitu menghilangkan lemak yang terkandung dalam sampel menggunakan pelarut lemak.
2. digestion, terdiri dari dua tahapan yaitu pelarutan dengan asam dan pelarutan dengan basa. Kedua macam proses digesti ini dilakukan dalam keadaan tertutup pada suhu terkontrol (mendidih) dan sedapat mungkin dihilangkan dari pengaruh luar. Langkah terakhir dari analisis serat kasar yaitu dengan mengabukan sampel dalam tanur.
Serat kasar sangat penting dalam penilaian kualitas bahan makanan karena angka ini merupakan indeks dan menentukan nilai gizi bahan makanan tersebut. Menurut SNI kadar serat dalam nata mencapai 4,5%. (Sudarmadji, S.,dkk,1989
Pengujian Kekuatan Tarik
satuan Mpa dan regangan dalam satuan mm, dapat dilihat dalam lampiran. Sifat mekanik seperti kekuatan tegangan dapat dihitung dengan menggunakan persamaan 1.1.
Kekuatan tegangan =
BR x WI
BL
(1.1)
Dengan BL adalah beban putus, WI adalah lebar sampel dan BR adalah ketebalan sampel. Dan untuk menentukan persen regangan dengan persamaan (1.2)
% Regangan = x100%
LE BE
(1.2)
Dengan BE adalah perpanjangan saat putus dan LE adalah perpanjangan awal. Hasil yang diperoleh digunakan untuk menentukan sifat mekanik. (Hepburn,C.,1991).
Uji Organoleptik
Uji organoleptik adalah penilaian menggunakan indera, penilaian menggunakan kemampuan sensorik, tidak dapat diturunkan pada orang lain. Salah satu cara pengujian organoleptik adalah dengan metode penyicipan. Uji penyicipan menyangkut penilaian seseorang akan suatu sifat atau kualitas suatu bahan yang menyebabkan orang menyenangi. Pada uji penyicipan dapat dilakukan menggunakan panelis yang belum berpengalaman. Dalam kelompok ini uji penyicipan termasuk uji kesukaan(hedonik).
Pembuatan Buffer Asetat 0,2 M pH 4
Adapun perhitungan dalam pembuatan buffer asetat 0,2 M dengan pH 4 adalah sebagai berikut :
Massa garam (CH3COONa) = % garam x [garam] x BM
= 14,8066 % x 0,2 M x 82,03481 g/mol = 2,4293 g/L
Massa asam (CH3COOH) = % asam x [asam] x BM
= 85,1934 % x 0,2 M x 60,05298 g/mol = 10,2322 g/L
Cara pembuatan buffer asetat 0,2 M pH 4 adalah sebagai berikut :
- Ditimbang 2,4293 g Na-asetat p.a dan 10,2322 g asam asetat glasial lalu dimasukkan ke dalam labu takar 1000 mL.
BAB 3
METODOLOGI PENELITIAN
3.1Alat dan Bahan
3.1.1 Alat-alat
1. Gelas beaker Pyrex
2. Gelas ukur Pyrex
3. Gelas erlenmeyer Pyrex
4. Neraca analitik Ohaus
5. Indikator universal Merck
6. Autoklaf Webecco
7. Oven Gallenkamp
8. Tabung reaksi Pyrex
9. Inkubator Fisher Cientific
10.Hot plate Thermolyne
11.Termometer
12.Labu takar Pyrex
13.Cawan Petri 14.Jangka sorong
15.Labu alas Pyrex
16.Bunsen 17.Botol akuades
18.Statif dan klem Pyrex
19.Tanur Gallen Kamp
20.Indikator Universal Fisher
21.Scanning Microscope Electron
3.1.2 Bahan-Bahan
1. Air kelapa 2. Akuades
3. Starter Acetobacyter xylinum 4. Gula pasir
5. Urea (s) p.a.(E.Merck)
6. Asam askorbat (s) p.a.(E.Merck)
7. CH3COOH glasial p.a.(E.Merck)
8. CH3COONa (s) p.a.(E.Merck)
9. H2SO4 (p) p.a.(E.Merck)
10.K2SO4 (s) p.a.(E.Merck)
11.Alkohol 96% Teknis 96% (Bratachem)
12.N-heksan p.a.(E.Merck)
13.NaOH (s) p.a.(E.Merck)
3.2 Prosedur Penelitian
3.2.1 Pembuatan Larutan Pereaksi
3.2.1.1 Pembuatan larutan H2SO4 1,25%
Dipipet 3,22 mL larutan Asam sulfat, kemudian dimasukkan ke dalam labu takar 250mL,diencerkan dengan akuades sampai garis tanda.
3.2.1.2 Pembuatan Buffer Asetat 0,2 M pH 4
Ditimbang 2,429 g Na asetat p.a dan 10,232 gram asetat glasial dan dimasukkan ke dalam labu takar 1000 mL dan dilarutkan dengan akuades sampai garis tanda.
3.2.1.3 Pembuatan Larutan NaOH 1,25%
3.2.1.4 Pembuatan Larutan K2SO4 10%
Sejumlah 10g K2SO4 dimasukkan ke dalam labu takar 100mL, dilarutkan dengan akuades sampai garis tanda lalu dihomogenkan.
3.2.2 Sterilisasi Alat
Dicuci alat-alat yang akan digunakan sampai bersih, kemudian dikeringkan dan ditutup rapat dengan kapas kemudian dengan kertas. Setelah itu dimasukkan ke dalam autoklaf dan ditutup rapat. Disterilisasi sampai suhu 121oC selama lebih kurang 15 menit.
3.2.3 Pembuatan Starter Air Kelapa
500 mL air kelapa disaring dengan menggunakan kain kasa. Ditambahkan 20% gula pasir, 0,5% urea. Dipanaskan sampai mendidih sambil diaduk hingga larut. Kemudian diasamkan dengan menambahkan buffer asetat 0,2M sebanyak 5mL untuk mempertahankan pH 4 ke dalam air kelapa. Kemudian dimasukkan ke dalam botol kaca yang telah disterilkan dan ditutup. Setelah dingin diinokulasi dengan 20% A.xylinum, selanjutnya difermentasi selama 1 minggu hingga terbentuk lapisan nata putih diatasnya.
3.2.4 Pembuatan Selulosa Bakterial
Sebanyak 100mL air kelapa hasil penyaringan dituangkan ke dalam gelas beaker, ditambahkan 10% gula pasir , 0,5% urea dan diaduk hingga larut. Dipanaskan sampai mendidih sambil diaduk hingga larut. Kemudian diasamkan dengan menambahkan buffer asetat 0,2M sebanyak 1mL untuk mempertahankan pH 4. Kemudian diangkat dan ditutup dengan kertas koran yang bersih. Dibiarkan hingga suhu kamar, lalu ditambahkan 10% starter A.xylinum. Difermentasi selama 15 hari pada suhu kamar.
3.2.5 Pembuatan Selulosa Bakterial dengan penambahan asam askorbat
diaduk hingga larut. Kemudian diasamkan dengan menambahkan buffer asetat 0,2M pH 4. Kemudian diangkat dan ditutup dengan kertas koran yang bersih. Dibiarkan hingga suhu kamar, lalu ditambahkan 0,5 g asam askorbat, ditambahkan 10% starter A.Xylinum. Difermentasi selama 15 hari pada suhu kamar.
Diulangi perlakuan yang sama untuk masing-masing penambahan asam askorbat 1,0g, 1,5g, dan 2,0g asam askorbat.
3.3 Parameter yang Diamati
3.3.1 Pengukuran Ketebalan Nata
Dilakukan pengukuran ketebalan selulosa bakterial dengan menggunakan jangka sorong pada empat tempat yang berbeda selanjutnya dihitung ketebalan rata-rata.
3.3.2 Penentuan Kadar Air
Selulosa bakterial ditimbang sebanyak 2 g dalam cawan porselin yang telah diketahui beratnya. Dikeringkan dalam oven pada suhu 105oC selama 5 jam. Didinginkan dalam desikator selama 20 menit, kemudian ditimbang hingga berat konstan. Dihitung berat air yang menguap dengan rumus :
%
Kadar = − (Sudarmadji,1984)
3.3.3 Penentuan Kadar abu
Selulosa bakterial ditimbang sebanyak 2 g dalam cawan porselin yang telah diketahui beratnya. Dibakar dalam tanur pengabuan pada suhu 600oC selama 5 jam sampai diperoleh abu berwarna putih abu-abu. Didinginkan dalam desikator kemudian ditimbang hingga berat konstan. Dihitung kadar abunya dengan rumus :
3.3.4 Penentuan kadar serat
Sebanyak 2g selulosa bakterial yang telah dikeringkan pada suhu 110oC dihaluskan. Kemudian dilarutkan dalam 50ml alkohol 96% dan diuapkan, selanjutnya ditambahkan 50ml n-heksan kemudian direfluks selama 30 menit dan disaring. Dipindahkan selulosa bakterial tersebut ke dalam erlenmeyer 600ml dan ditambahkan dengan 200ml H2SO41,25%. Gelas erlenmeyer dipasang pada pendingin liebig lalu didihkan selama 30 menit. Kemudian disaring dengan kertas saring, residunya dicuci dengan akuades panas. Dipindahkan residu secara ke dalam gelas elenmeyer, sisanya dicuci dengan 200ml NaOH 1,25% sampai semua residu masuk ke dalam erlenmeyer. Dididihkan selama 30 menit. Disaring dengan kertas saring yang telah diketahui beratnya. Dicuci residu dengan K2SO4 10%, lalu dicuci lagi dengan akuades panas kemudian dengan alkohol 96%. Kertas saring tersebut diletakkan dalam cawan porselen yang telah diketahui beratnya kemudian dikeringkan kertas saring dalam oven pada suhu 110oC dan didinginkan di dalam desikator. Diabukan dalam tanur pada suhu 600oC selama 5 jam kemudian didinginkan dalam desikator. Ditimbang sampai diperoleh berat yang konstan. Dihitung kadar seratnya dengan menggunakan rumus berikut :
%
3.3.5 Uji Organoleptis terhadap selulosa bakterial dengan penambahan asam
askorbat
Selulosa bakteri dengan penambahan asam askorbat hasil fermentasi, kemudian dipanen dan harus mengalami perlakuan sebelum dikonsumsi yaitu penghilangan asam dan pemasakan. Proses penghilangan asam bertujuan untuk menghilangkan asam asetat yang terjebak dalam tekstur selulosa yang dapat mempengaruhi rasa dan aroma selulosa bakteri menjadi asam.
dilakukan dengan metode kesukaan memakai angka hedonik dan numerik dengan 15 orang panelis dengan kondisi yang baik, tidak merokok, sebelum mencicipinya meminum air putih terlebih dahulu dan berasal dari lingkungan yang sama. Dalam penentuan organoleptis dilakukan dengan skala yang terdapat pada tabel berikut:
Tabel 3.1 Pengukuran Nilai Organoleptis Terhadap Selulosa Bakteri dengan
penambahan Asam Askorbat
Skala Hedonik Skala Numerik
Amat Sangat Suka 5
Sangat Suka 4
Suka 3
Agak Suka 2
Netral 1
Tidak Suka 0
3.3.6 Uji Tarik
3.4 Skema Penelitian
3.4.1 Skema Pembuatan Starter Air Kelapa
Disaring
Ditambahkan 20% gula pasir Ditambahkan 0,5% urea Dipanaskan sambil diaduk hingga larut
Ditambahkan buffer asetat 0,2M sebanyak 5mL untuk mempertahankan pH 4
Dituangkan ke dalam wadah fermentasi yang telah
disterilkan dalam keadaan panas
Didinginkan
Ditambahkan 20% starter Acetobacter xylinum
Diinkubasi pada suhu kamar selama 1 minggu
500 ml air kelapa
Residu/kotoran filtrat
Larutan asam bergula
3.4.2 Skema Pembuatan Selulosa Bakterial dengan penambahan asam askorbat
Disaring
Ditambahkan 10% gula pasir
Ditambahkan 0,5% urea Dipanaskan hingga mendidih sambil diaduk hingga larut Ditambahkan buffer asetat 0,2M sebanyak 1mL untuk mempertahankan pH 4
Didinginkan
Ditambahkan dengan asam askorbat dengan variasi 0 g, 0,5 g, 1,0g, 1,5g, 2,0g
Ditambahkan 10% starter Acetobacter xylinum
Difermentasi selama 15 hari
Dianalisa
Residu/kotoran filtrat
3.4.3 Skema Penentuan Kadar Air
Dimasukkan ke dalam cawan porselin yang telah diketahui beratnya
Dikeringkan dalam oven pada suhu 100-105oC selama 5 jam
Didinginkan di dalam desikator selama 20 menit
Ditimbang sampai berat konstan Dihitung kadar airnya
3.4.4 Skema Penentuan Kadar Abu
Dimasukkan ke dalam cawan porselin yang telah diketahui beratnya
Dibakar dalam tanur pada suhu 600oC selama 5 jam
Didinginkan di dalam desikator selama 20 menit
Ditimbang sampai berat konstan Dihitung kadar abunya
2g sampel
Hasil
2g sampel
3.4.5 Skema Penentuan Kadar Serat
Dikeringkan pada suhu 110oC Dihaluskan
Ditambahkan 50mL alkohol 96% dan diuapkan Ditambahkan 50mL n-heksan dan direfluks selama 30 menit
Disaring
Ditambahkan 200mL H2SO4 1,25%
Dipasang gelas erlenmeyer pada pendingin liebig Dididihkan selama 30 menit
Disaring
Dicuci dengan akuades
Dipindahkan ke dalam gelas erlenmeyer
Dicuci dengan 200mL NaOH 1,25% sampai semua residu masuk ke dalam erlenmeyer
Dididihkan kembali selama 30 menit Disaring
Dicuci dengan K2SO4 10%
Dicuci lagi dengan akuades panas
Dicuci kembali dengan alkohol 96% dan diletakkan dalam cawan porselen yang telah diketahui beratnya
Diabukan dalam tanur pada suhu 6000C Didinginkan dalam desikator
Ditimbang sampai berat konstan Dihitung kadar seratnya
2,5 g sampel
Residu Filtrat
Residu Filtrat
Residu
Filtrat
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
Untuk mengetahui adanya pengaruh variasi penambahan vitamin C terhadap selulosa bakterial yang terbentuk yaitu pada ketebalan, kadar air, kadar abu, kadar serat, kadar vitamin C, uji organoleptik dan uji tarik. Untuk ketebalan dan kadar serat dilakukan analisis secara statistik dengan menggunakan analisis varians (ANAVA). Analisis ini diuji dengan menggunakan statistik F dengan taraf signifikan 5% dan 1%.
Hipotesa :
Ho = Apabila tidak ada pengaruh variasi penambahan vitamin C terhadap ketebalan,dan kadar serat pada selulosa bakterial yang dihasilkan.
Ha = Apabila ada pengaruh variasi penambahan vitamin C terhadap ketebalan,dan kadar serat pada selulosa bakterial yang dihasilkan.
Kriteria keputusan :
4.2 Pengolahan Data
4.2.1 Kadar Air
Penentuan kadar air pada selulosa bakterial dapat dihitung dengan cara sebagai berikut
Berat cawan = 0,6681 g
Berat sampel = 2,0321 g
Berat cawan + sampel basah = 2,7002 g Berat cawan + sampel setelah pengeringan = 2,4800 g
Berat uap air = 1,7619 g
Penentuan kadar abu pada selulosa bakterial dapat dihitung dengan cara sebagai berikut :
Berat cawan = 14,5720 g
Berat sampel = 2,0321 g
Berat cawan + sampel basah = 16,6041 g Berat cawan + sampel setelah pengeringan = 14,7634 g
4.2.3 Kadar Serat
Penentuan kadar serat pada selulosa bakterial dengan penambahan vitamin C dapat dihitung dengan cara sebagai berikut :
Berat kertas saring = 0,8009 g
Berat sampel = 2,0322 g
Berat kertas saring + sampel = 2,8331 g Berat kertas saring + sampel setelah pengeringan = 2,7610 g
Berat serat = 0,0721 g
Contoh : Sampel spesimen uji mempunyai panjang 5,2 cm dan nilai stroke 18,62 mm, untuk penambahan vitamin C sebesar 1,0 g, maka diperoleh persen regangan :
Regangan = 100%
2. Harga Tegangan Tegangan =
permukaan Luas
Contoh : Sampel spesimen uji mempunyai panjang 5,2 cm dan lebar 1,01 cm. Bila harga Load 5,4 kgf, untuk penambahan vitamin C sebanyak 1,0 g, maka nilai tegangan diperoleh :
4.3 Analisis data
a. Ketebalan selulosa bakterial
Ketebalan selulosa bakterial dengan penambahan vitamin C dianalisis dengan menggunakan Rancangan Acak Lengkap (RAL), yaitu sebagai berikut.
Harga F pada tabel adalah : F0,05 = 3,48 F0,001 = 5,99
F hitung > F tabel, maka Ho ditolak dan Ha diterima, dengan arti bahwa terdapat perbedaan ketebalan yang sangat nyata pada tiap selulosa bakterial dengan penambahan vitamin C. Data hasil perhitungan ketebalan dan kadar serat selengkapnya dapat dilihat pada lampiran (halaman 52-53).
b. Uji Organoleptik
Uji organoleptik terhadap tekstur, warna, aroma, dan rasa selulosa bakterial dengan penambahan vitamin C dianalisis dengan menggunakan Rancangan Kelompok Lengkap Teracak (RKLT), yaitu sebaga berikut :
4. JK perlakuan = FK
9. KT galat percobaan =
Harga F pada tabel adalah : F 0,05 = 2,06 F 0,01 = 2,8
4.4 Pembahasan
4.4.1 Ketebalan Selulosa Bakterial
Perbandingan ketebalan dari selulosa bakterial yang dihasilkan dengan variasi penambahan vitamin C menunjukkan perbedaan yang sangat nyata yaitu:
111,94 > 3,48 untuk taraf 5% 111,94 > 5,99 untuk taraf 1%
Pada gambar 1. dapat dilihat bahwasanya terjadi peningkatan ketebalan pada selulosa bakteri dengan adanya variasi penambahan vitamin C 0g; 0,5g; 1,0g; 1,5g; dan 2,0g. Ketebalan maksimum selulosa bakteri diperoleh dengan penambahan vitamin C sebanyak 1,0 g.
Selulosa bakterial adalah slime (menyerupai kapsul) dari sel bakteri yang kaya akan selulosa yang diproduksi oleh bakteri Acetobacter xylinum. Bakteri ini akan membentuk selulosa bakterial pada permukaan medium yang mengandung gula (Budiyanto,2004). Vitamin C juga mempengaruhi aktivitas Acetobacter xylinum pada saat fermentasi air kelapa untuk menghasilkan enzim ekstraseluler yang berfungsi untuk mengubah gula menjadi selulosa.
4.4.2 Kadar Serat Selulosa Bakterial
Perbandingan kadar serat dari selulosa bakterial yang dihasilkan dengan variasi penambahan vitamin C menunjukkan perbedaan yang sangat nyata yaitu :
Pada gambar 2. dapat dilihat bahwasanya pada selulosa bakteri dengan adanya variasi penambahan vitamin C 0g; 0,5g; 1,0g; 1,5g dan 2,0g kadar serat maksimum selulosa bakteri diperoleh dengan penambahan vitamin C sebanyak 1,0g.
Hal ini disebabkan karena Acetobacter xylinum membutuhkan vitamin C untuk mendukung pertumbuhan maupun aktivitas Acetobacter xylinum pada saat fermentasi air kelapa untuk menghasilkan enzim ekstraseluler yang dapat menyusun (mempolimerisasi) zat gula (glukosa) menjadi ribuan rantai (homopolimer) serat atau selulosa.(Rindit Pambayu,2002). Sehingga dengan penambahan vitamin C maka kadar serat selulosa bakteri yang dihasilkan akan semakin meningkat. Penurunan kadar serat selulosa bakteri pada penambahan vitamin C 2,0g disebabkan karena pH dari air kelapa terlalu rendah atau terlalu asam sehingga menghambat pertumbuhan bakteri, dimana pH optimum Acetobacter xylium untuk bekerja secara maksimum adalah sekitar pH 4-3.
4.4.3 Kadar Air Selulosa Bakterial
Kadar air yang diperoleh pada selulosa bakterial dengan penambahan vitamin C sebanyak 1,0 g adalah 86,82%. Adanya aktivitas kerja mikroba Acetobacter xylinum selama proses fermentasi air kelapa berlangsung, dimana menurut Wahyudin, bakteri Acetobacter xylinum apabila ditambahkan pada medium gula, membentuk polisakarida yang dikenal
dengan selulosa ekstraselluler dan dapat mengalami oksidasi lanjutan, yaitu mampu mengoksidasi asam asetat menjadi CO2 dan H2O. Sehingga semakin tingginya kadar gula yang ditambahkan maka, semakin tinggi pula kadar air yang dihasilkan.
4.4.4 Kadar Abu Selulosa Bakterial
bahan yang dihasilkan. Selain itu, pengaruh suhu, pH, dan bahan kimia lainnya juga dapat mempengaruhi kadar abu suatu bahan.
4.4.5 Uji Organoleptik
Uji organoleptik terhadap tekstur, warna, rasa dan aroma selulosa bakterial dilakukan oleh panelis. Pada tabel dapat dilihat bahwa untuk uji organoleptik terhadap tekstur selulosa bakterial , para panelis lebih menyukai selulosa bakterial dengan penambahan vitamin C sebanyak 1,0g. Hal ini disebakan karena teksturnya lebih halus dan kenyal. Untuk uji organoleptik terhadap warna selulosa bakterial, para panelis lebih menyukai selulosa bakterial dengan penambahan vitamin C sebanyak 0g. Hal ini disebabkan karena warnanya lebih menarik. Untuk uji organoleptik terhadap rasa selulosa bakterial, para panelis lebih menyukai selulosa bakterial dengan penambahan vitamin C sebanyak 1,0g. Hal ini disebabkan karena rasanya lebih enak. Untuk uji organoleptik terhadap aroma selulosa bakterial, para panelis lebih menyukai selulosa bakterial dengan penambahan vitamin C sebanyak 1,0g. Hal ini disebabkan karena aromanya lebih harum.
4.4.6 Uji Tarik Selulosa Bakterial
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Dari hasil penelitian dapat disimpulkan bahwa terjadi peningkatan ketebalan, kadar serat dan kadar nutrien dengan bertambahnya konsentrasi vitamin C. Pada penambahan vitamin C sebanyak 1,0g diperoleh ketebalan sebesar 0,95 cm, kadar serat sebesar 3,55%, kadar air sebesar 86,7%, dan kadar abu sebesar 1,57%. 2. Pada penambahan vitamin C sebanyak 1,0g diperoleh tegangan sebesar 1,028
kgf/cm2 dan regangan sebesar 358,07%.
5.2 Saran
BAB 1
PENDAHULUAN
1.1Latar Belakang
Sebagai negara kepulauan, umumnya daerah sepanjang pesisir pantai di Indonesia banyak ditumbuhi pohon kelapa. Kelapa memberikan banyak hasil bagi manusia, misalnya produk kopra yang selanjutnya diolah menjadi minyak, sedangkan air kelapa terbuang percuma sebagai limbah yang dapat mencemari lingkungan terutama berhubungan dengan kesuburan tanah. Menurut Atih (1979) melaporkan bahwa air kelapa yang dihasilkan di Indonesia mencapai lebih dari 900 juta liter/tahun.
Air kelapa mengandung air 91,27%; protein 0,29%, lemak 0,15 %; karbohidrat 7,27%; serta abu 1,06%. Selain itu, air kelapa mengandung nutrisi seperti sukrosa, dekstrosa, fruktosa serta vitamin B kompleks. Kandungan garam dan albumin yang tinggi dalam air kelapa, maka dapat digunakan untuk mencegah dan mengobati kolera, menyembuhkan radang usus dan menghilangkan rasa sakit pada bagian perut. (Onifade, A.K., Jeff-Agboola, Y.A.,2003).
Vitamin C dan beberapa vitamin lainnya seperti asam nikotinat, asam pantotenat, biotin, riboflavin, asam folat, tiamin dan piridoksin yang terkandung dalam air kelapa masing-masing dalam konsentrasi rendah sangat mendukung pertumbuhan maupun aktivitas Acetobacter xylinum pada saat terjadinya fermentasi air kelapa menjadi nata de coco. Peran vitamin-vitamin ini adalah sebagai koenzim. (Rindit pambayu,2002)
menggunakan Acetobacter xylinum. Kandungan utama nata de coco adalah selulosa. Selulosa ini disebut juga dengan selulosa bakterial. (Bergonia,1982).
Pada kondisi yang sesuai, bakteri Acetobacter Xylinum dapat memecah larutan gula dalam substrat menjadi suatu polisakarida. Serat ini berupa selulosa yang memiliki sifat kimia yang hampir sama dengan sellulosa yang dihasilkan oleh tanaman. (Dimaguilla,1967).
Dilihat dari sudut gizinya, nata de coco adalah produk yang rendah nilai gizinya. Karena kandungan gizi (khususnya energi) yang sangat rendah, produk ini aman untuk dimakan oleh siapa saja. Produk ini tidak akan menyebabkan kegemukan sehingga dianjurkan bagi mereka yang sedang diet rendah kalori untuk menurunkan berat badan. Keunggulan lain dari nata de coco adalah kandungan seratnya (dietary fiber) yang cukup tinggi terutama selulosa.
meningkatkan gerakan peristaltik. Gerak peristaltik merupakan gerakan bergelombang yang disebabkan oleh kontraksi otot pada dinding saluran pencernaan untuk mendorong makanan keluar. Serat makanan mencegah kegemukan, konstipasi, kanker tuberkolosis, kanker usus besar, penyakit diabetes mellitus, dan jantung koroner yang berkaitan dengan kadar kolesterol tinggi. (Almatsier. S., 2006).
Dari penelitian sebelumnya telah dibuktikan bahwa selulosa bakterial dapat dibuat dari limbah-limbah organik dengan menggunakan bakteri Acetobacter xylinum seperti pembuatan nata de soya menggunakan limbah tahu, nata de pina,dan nata de banana skin menggunakan limbah kulit pisang. Oleh karena itu, peneliti tertarik untuk memodifikasi selulosa bakterial dari limbah air kelapa dengan penambahan variasi massa suplemen yaitu berupa vitamin C melalui fermentasi dengan menggunakan bakteri Acetobacter xylinum untuk mendapatkan selulosa yang digunakan sebagai bahan makanan tambahan
1.2 Permasalahan
Vitamin C mempunyai struktur yang mirip dengan glukosa yang berperan sebagai nutrisi. Oleh karena itu penulis ingin mengetahui pengaruh vitamin C yang ditambahkan ke dalam media terhadap kualitas dan kandungan selulosa bakterial. Bakteri Acetobacter xylinum yang digunakan apakah dapat berfungsi untuk memetabolisme bahan baku air
kelapa menjadi selulosa bakterial.
1.3 Pembatasan Masalah
Dalam penelitian ini objek masalah dibatasi sebagai berikut :
1. Air kelapa yang digunakan diperoleh dari Pasar Sore Padang Bulan Medan.
2. Vitamin C yang digunakan diperoleh dari laboratorium Biokimia FMIPA Universitas Sumatera Utara.
3. Waktu fermentasi pembuatan Selulosa bakteri dengan penambahan asam askorbat adalah 15 hari.
4. Variasi penambahan vitamin C (asam askorbat) yang ditambahkan pada media fermentasi adalah 0g, 0,5g, 1,0g, 1,5g, dan 2,0g
5. Parameter yang diamati adalah ketebalan, kadar serat, kadar air, uji organoleptis terhadap tekstur, warna, rasa dan aroma selulosa bakterial, dan uji
tarik.
1.4 Tujuan Penelitian
Tujuan dari penelitian ini adalah sebagai berikut:
1. Untuk mengetahui pengaruh massa vitamin C yang ditambahkan terhadap kandungan selulosa bakterial yang dihasilkan.
1.5 Manfaat Penelitian
Dari hasil penelitian diharapkan dapat memberikan sumbangan informasi ilmiah pada bidang Biokimia/KBM (Kimia Bahan Makanan) dimana air kelapa dapat dimanfaatkan sebagai bahan makanan dan dengan penambahan vitamin C mampu meningkatkan kandungan gizi selulosa bakterial yang dihasilkan.
1.6 Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Biokimia FMIPA-USU, Medan dan di Laboratorium Sentral Fakultas Pertanian USU, Medan. Uji tarik dilakukan di laboratorim Penelitian FMIPA USU, Medan.
1.7 Metodologi Penelitian
Penelitian ini adalah eksperimental laboratorium, dengan menggunakan sampel berupa air limbah air kelapa yang diperoleh dari Pasar Sore Padang bulan Medan dengan adanya penambahan Asam askorbat (vitamin C), dimana langkah-langkah analisisnya adalah sebagai berikut :
1. Penambahan asam askorbat dengan variasi konsentrasi 0g, 0,5g, 1,0g, 1,5g,dan 2,0g yang difermentasi selama 15 hari hingga membentuk suatu lapisan putih dengan ketebalan tertentu yang disebut selulosa bakterial.
2. Penentuan kadar air dilakukan dengan metode termogravimetri, yaitu pengeringan di dalam oven pada suhu 100-1050C.
3. Penentuan kadar abu dilakukan dengan metode gravimetri, yaitu pengabuan di dalam tanur pada suhu 6000C
4. Penentuan kadar serat dilakukan dengan metode defatting dan digestion kemudian diabukan dalam tanur pada suhu 6000C.
5. Penetuan uji organoleptik dilakukan dengan metode uji penerimaan yaitu dengan skala hedonik terhadap tekstur, warna, rasa, dan aroma selulosa bakteri.
Dalam penelitian ini digunakan tiga variabel yaitu variabel tetap, variabel bebas dan variabel terikat.
1. Variabel tetap meliputi :
Jenis sampel, penambahan starter, nutrien, temperatur, pH, tempat fermentasi, dan lama fermentasi.
2. Variabel bebas meliputi : konsentrasi asam askorbat 3. Variabel terikat meliputi :
ABSTRAK
THE INFLUENCE OF ASCORBIC ACID CONCENTRATION TO BACTERIAL CELLULOSE CONTENTS THAT RESULT OF COCONUT WATER
FERMENTATION BY Acetobacter xylinum
ABSTRACT
Bahan Seminar Hasil Departemen Kimia
PENGARUH PENAMBAHAN VITAMIN C TERHADAP KANDUNGAN
SELULOSA BAKTERIAL HASIL FERMENTASI AIR KELAPA OLEH
BAKTERI
Acetobacter xylinum
SKRIPSI
AFRINI YANTI RITONGA
040802035
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
PERSETUJUAN
Judul : PENGARUH PENAMBAHAN VITAMIN C
TERHADAP KANDUNGAN SELULOSA
BAKTERIAL HASIL FERMENTASI AIR KELAPA OLEH BAKTERI Acetobacter xylinum
Kategori : SKRIPSI
Nama : AFRINI YANTI RITONGA
Nomor Induk Mahasiswa : 040802035
Program Studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA)UNIVERSITAS SUMATERA UTARA
Disetujui di Medan, September 2008 Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dra. Yuniarti Yusak, M.S. Dra. Emma Zaidar, M.Si.
NIP.130 809 726 NIP. 131 653 985
Diketahui/Disetujui oleh :
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
PENGARUH VITAMIN C TERHADAP KANDUNGAN SELULOSA BAKTERIAL HASIL FERMENTASI AIR KELAPA OLEH BAKTERI Acetobacter xylinum
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, September 2008
AFRINI YANTI RITONGA 040802035
ABSTRAK
THE INFLUENCE OF ASCORBIC ACID CONCENTRATION TO BACTERIAL CELLULOSE CONTENTS THAT RESULT OF COCONUT WATER
FERMENTATION BY Acetobacter xylinum
ABSTRACT
DAFTAR ISI
Halaman
Persetujuan ii
Pernyataan iii
Penghargaan iv
Abstrak v
Abstract vi
Daftar Isi vii
Daftar Tabel x
Daftar Gambar xi
Bab 1 Pendahuluan
1.1 Latar Belakang 1
1.2 Permasalahan 3
1.3 Pembatasan Masalah 3
1.4 Tujuan Penelitian 3
1.5 Manfaat Penelitian 4
1.6 Lokasi penelitian 4
1.7 Metodologi Penelitian 4
Bab 2 Tinjauan Pustaka
2.1 Kelapa 6
2.2 Acetobacter xylinum 8
2.2.1 Sifat-Sifat Acetobacter xylinum 9
2.2.2 Faktor-faktor yang Mempengaruhi Pertumbuhan
Acetobacter xylinum 10
2.2.3 Aktivitas Acetobacter xylinum pada Fermentasi Nata 12
2.3 Fermentasi 13
2.3.2 Tahap-Tahap Fermentasi Nata 15
2.4 Selulosa 16
2.5 Selulosa Bakterial 17
2.5.1 Karakteristik Selulosa Bakterial 18
2.5.2 Aplikasi Selulosa Bakterial 18
2.6 Vitamin 20
2.7 Vitamin C 21
2.8 Parameter-Parameter yang Diamati 22
2.8.1 Kadar Air 22
2.8.2 Kadar Abu 22
2.8.3 Kadar Serat 23
2.8.4 Pengujian Kekuatan Tarik 24
2.8.5 Uji Organoleptik 24
2.9 Pembuatan Buffer Asetat 0,2M pH4 25
Bab 3 Metodologi Penelitian
3.1 Alat dan Bahan 27
3.1.1 Alat-Alat 27
3.1.2 Bahan-Bahan 28
3.2 Prosedur Penelitian 28
3.2.1 Pembuatan larutan 28
3.2.2 Sterilisasi Alat 29
3.2.3 Pembuatan Starter Air Kelapa 29
3.2.4 Pembuatan Selulosa Bakterial 29
3.2.5 Pembuatan Selulosa Bakterial dengan
Penambahan Asam Askorbat 29
3.3 Parameter yang Diamati 30
3.3.1 Pengukuran Ketebalan Nata 30
3.3.2 Penentuan Kadar Air 30
3.3.3 Penentuan Kadar abu 30
3.3.5 Uji Organoleptis Selulosa Bakterial dengan
Penambahan Asam Askorbat 31
3.3.6 Uji Tarik 32
3.4 Skema Penelitian 33
3.4.1 Skema Pembuatan Starter Air Kelapa 33 3.4.2 Skema Pembuatan Selulosa Bakterial dengan
Penambahan Asam Askorbat 34
3.4.3 Skema Penentuan Kadar Air 35
3.4.4 Skema Penentuan Kadar Abu 35
3.4.5 Skema Penentuan Kadar Serat 36
Bab 4 Hasil dan Pembahasan
4.1 Hasil penelitian 37
4.2 Pengolahan Data 38
4.2.1 Kadar Air 38
4.2.2 Kadar abu 38
4.2.3 Kadar Serat 39
4.2.4 Uji Tarik 39
4.3 Analisa Data 40
4.4 Pembahasan 45
4.4.1 Ketebalan Selulosa bakterial 45
4.4.2 Kadar Serat Selulosa Bakterial 45
4.4.3 Kadar Air Selulosa Bakterial 46
4.4.4 Kadar Abu Selulosa Bakterial 46
4.4.5 Uji Organoleptik 47
4.4.6 Uji Tarik Selulosa Bakterial 47
Bab 5 Kesimpulan dan Saran
5.1 Kesimpulan 48
Daftar Pustaka 49