Lampiran 4. Sediaan gel dengan variasi konsentrasi ekstrak etanol daun gulma
siam
F1 F2 F3 F4 F5 F6
Lampiran 5. Gambar homogenitas sediaan gel ekstrak etanol daun gulma siam
F1
F2
F3
F4
F5
F6
Lampiran 6. Bagan pembuatan ekstrak gulma siam
dicuci sampai bersih ditiriskan
ditimbang
dikeringkan di lemari pengering
dihaluskan
dimaserasi dengan etanol 80%
dimaserasi 2 hari
di rotary
evaporator
di freeze dryer Daun gulma siam
Simplisia
Simplisia serbuk
Ampas Maserat 1
Ampas Maserat 2
Lampiran 7. Bagan pembuatan sediaan gel ekstrak etanol daun gulma siam Ekstrak etanol daun gulma siam HPMC
Dasar gel
Lampiran 8. Bagan alur penelitian
di freeze dryer
- Stabilitas fisik sediaan Analisis
- Homogenitas data dengan
- pH SPSS
- Viskositas
Serbuk simplisia
Skrining fitokimia dan karakterisasi
Hasil
Ekstrak Pembuatan ekstrak
Hasil
Pengujian luka sayat Sediaan gel EEDGS 0,125, 0,25, 0,50,
0,75, dan 1%
Hasil Ekstrak kental
Evaluasi sediaan
Lampiran 9: Data perubahan diameter luka sayat hari ke-0 sampai hari ke-25 menggunakan sediaan gel EEDGS
Hari ke
19 0,56 0,58 0,60 0,02 0,20 0,24 0,22 0,02 0,30 0,30 0,33 0,02 0,20 0,24 0,22 0,02 0 0 0 0 0,38 0,37 0,37 0,01 0,55 0,50 0,57 0,03
20 0,47 0,47 0,42 0,02 0 0 0 0 0,25 0,25 0,27 0,02 0 0 0 0 0,35 0,32 0,34 0,02 0,47 0,43 0,45 0,02
21 0,41 0,40 0,38 0,02 0,42 0,45 0,43 0,02 0 0 0 0 0,.26 0,25 0,25 0,01 0,35 0,38 0,40 0,03
22 0,35 0,30 0,27 0,05 0,37 0,38 0,40 0,02 0 0 0 0 0,25 0,25 0,27 0,02
23 0,20 0,22 0,20 0,02 0,32 0,38 0,33 0,04 0 0 0 0
24 0 0 0 0,23 0,20 0,22 0,02
Lampiran 10. Data perubahan diameter rata-rata luka sayat sediaan gel EEDGS
Keterangan: F1: basis gel (kontrol negatif), F 2 s/d F 6 berturut-turut konsentrasi 0,125%, 0,25%, 0,50%, 0,75% dan 1%, F7: Betadin, F8: Tanpa
0 2,00±0,00 2,00±0,00 2,00±0,00 2,00±0,00 2,00±0,00 2,00±0,00 2,00±0,00 2,00±0,00
1 2,00±0,00 1,97±0,01 1,98±0,01 1,94±0,02 1,98±0,01 1,97±0,01 1,98±0,01 2,00±0,00
2 1,98±0,01 1,94±0,01 1,84±0,01 1,87±0,02 1,87±0,02 1,94±0,01 1,96±0,01 2,00±0,00
3 1,84±0,01 1,91±0,02 1,74±0,02 1,85±0,01 1,85±0,01 1,91±0,02 1,80±0,00 2,00±0,00 4 1,74±0,02 1,88±0,02 1,64±0,02 1,77±0,01 1,80±0,01 1,88±0,02 1,74±0,01 2,00±0,00
5 1,65±0,01 1,87±0,02 1,53±0,02 1,67±0,01 1,75±0,01 1,87±0,02 1,64±0,01 1,97±0,01
6 1,53±0,02 1,79±0,01 1,46±0,01 1,50±0,02 1,73±0,01 1,79±0,01 1,59±0,01 1,93±0,02
7 1,49±0,01 1,71±0,02 1,34±0,02 1,34±0,01 1,71±0,01 1,71±0,02 1,46±0,02 1,85±0,01 8 1,46±0,01 1,67±0,02 1,24±0,02 1,05±0,03 1,70±0,01 1,67±0,02 1,40±0,02 1,80±0,01
9 1,42±0,03 1,55±0,02 1,12±0,03 0,91±0,01 1,56±0,02 1,55±0,02 1,36±0,01 1,77±0,01 10 1,34±0,02 1,49±0,02 1,07±0,02 0,84±0,01 1,41±0,02 1,49±0,02 1,21±0,01 1,64±0,01
11 1,24±0,02 1,27±0,03 0,96±0,02 0,75±0,02 1,34±0,02 1,40±0,02 1,03±0,02 1,50±0,01 12 1,12±0,03 0,98±0,02 0,92±0,03 0,63±0,01 1,15±0,10 1,33±0,02 0,85±0,01 1,45±0,01
13 1,07±0,03 0,82±0,03 0,84±0,03 0,60±0,01 0,96±0,02 1,30±0,03 0,72±0,01 1,22±0,08
14 0,92±0,02 0,78±0,01 0,72±0,02 0,56±0,02 0,81±0,02 1,27±0,03 0,60±0,00 1,01±0,01 15 0,89±0,03 0,67±0,01 0,61±0,01 0,46±0,02 0,73±0,01 0,98±0,02 0,44±0,01 0,96±0,02
16 0,84±0,03 0,54±0,03 0,52±0,03 0,40±0,01 0,69±0,01 0,83±0,02 0,31±0,01 0,90±0,01
17 0,77±0,03 0,45±0,02 0,42±0,03 0,34±0,01 0,47±0,01 0,78±0,01 0,26±0,01 0,87±0,02
Lampiran 11. Gambar perubahan diameter luka sayat
1.Kontrol positif (betadin)
Hari ke-0 Hari ke -1 Hari ke-2
Hari ke-3 Hari ke-4 Hari ke-5
Hari ke-6 Hari ke-7 Hari ke-8
Lampiran 11. (Lanjutan)
Hari ke-12 Hari ke-13 Hari ke-14
Hari ke-15 Hari ke-16 Hari ke-17
Lampiran 11. (Lanjutan)
2.Kontrol negatif ( Basis gel)
Hari ke-0 Hari ke-1 Hari ke-2
Hari ke-3 Hari ke-4 Hari ke-5
Hari ke-6 Hari ke-7 Hari ke-8
Lampiran 11. (Lanjutan)
Hari ke-12 Hari ke-13 Hari ke-14
Hari ke-15 Hari ke-16 Hari ke-17
Hari ke-18 Hari ke-19 Hari ke-20
Lampiran 11. (Lanjutan)
Lampiran 11. (Lanjutan)
3.Gel ekstrak 0,125 %
Hari ke-0 Hari ke -1 Hari ke-2
Hari ke-3 Hari ke-4 Hari ke-5
Hari ke-6 Hari ke-7 Hari ke-8
Lampiran 11. (Lanjutan)
Hari ke-12 Hari ke-13 Hari ke-14
Hari ke-15 Hari ke-16 Hari ke-17
Hari ke-18 Hari ke-19 Hari ke-20
Lampiran 11. (Lanjutan)
4. Gel ekstrak 0,25 %
Hari ke-0 Hari ke-1 Hari ke-2
Hari ke-3 Hari ke-4 Hari ke-5
Hari ke-6 Hari ke-7 Hari ke-8
Lampiran 11. (Lanjutan)
Hari ke-12 Hari ke-13 Hari ke-14
Hari ke-15 Hari ke-16 Hari ke-17
Lampiran 11. (Lanjutan)
5. Gel ekstrak konsentrasi 0,50%
Hari ke-0 Hari ke-1 Hari ke-2
Hari ke-3 Hari ke-4 Hari ke-5
Hari ke-6 Hari ke-7 Hari ke-8
Lampiran 11. (Lanjutan)
Hari ke-12 Hari ke-13 Hari ke-14
Hari ke-15 Hari ke-16 Hari ke-17
Lampiran 11. (Lanjutan)
6. Konsentrasi 0,75%
Hari ke-0 Hari ke-1 Hari ke-2
Hari ke-3 Hari ke-4 Hari ke-5
Hari ke-6 Hari ke-7 Hari ke-8
Lampiran 11. (Lanjutan)
Hari ke-12 Hari ke-13 Hari ke-14
Hari ke-15 Hari ke-16 Hari ke-17
Hari ke-18 Hari ke-19 Hari ke-20
Lampiran 11. (Lanjutan)
7. Konsentrasi 1%
Harike-0 Hari ke-1 Hari ke-2
Hari ke-3 Hari ke-4 Hari ke-5
Hari ke-6 Hari ke-7 Hari ke-8
Lampiran 11. (Lanjutan)
Hari ke-12 Hari ke-13 Hari ke-14
Hari ke-15 Hari ke-16 Hari ke-17
Hari ke-18 Hari ke-19 Hari ke-20
Lampiran 11. (Lanjutan)
8. Tanpa Perlakuan
Hari ke-0 Hari ke-1 Hari ke-2
Hari ke-3 Hari ke-4 Hari ke-5
Hari ke-6 Hari ke-7 Hari ke-8
Hari ke-9 Hari ke-10 Hari ke-11
Lampiran 11. (Lanjutan)
Hari ke-12 Hari ke-13 Hari ke-14
Hari ke-15 Hari ke-16 Hari ke-17
Hari ke-18 Hari ke-19 Hari ke-20
Lampiran 11. (Lanjutan)
Lampiran 12. Hasil karakterisasi simplisia daun gulma siam
a. Berat sampel = 5,024 g Volume I = 0,85 ml Volume II = 1,25 ml
Kadar air = 1,25-0,85
5,024 x 100 % = 7,9%
b. Berat sampel = 5,043 g Volume I = 1,6 ml Volume II = 1,95 ml
Kadar air = 1,95-1,6
5,043 x 100% = 6,9%
c. Berat sampel = 5,038 g Volume I = 1,95 ml Volume II = 2,40 ml
Kadar air = 2,40-1,95
5,038 x 100% = 8,9%
Kadar air rata-rata = 7,9 6,9 8,9
Lampiran 12. (Lanjutan)
a. Berat sampel = 5,0247 g Berat sari = 0,25 g
Kadar sari 0,25 5,0247
x
100
20
x
100% = 24,87%b. Berat sampel = 5,0478 g Berat sari = 0,22 g
Kadar sari = 0,22 5,0478
x
100
20
x
100% = 21,79%c. Berat sampel = 5,0032 g Berat sari = 0,24 g
Kadar sari = 0,24 5,0032
x
100
20
x
100% = 23,98%Kadar sari rata-rata = (24,87 21,79 23,98)
3 = 23,54%
Lampiran 12. (Lanjutan)
a. Berat sampel = 5,0233 g Berat sari = 0,10 g
Kadar sari = 0,10 5,0233
x
100
20
x
100% = 9,95%b. Berat sampel = 5,0063 g Berat sari = 0,12 g
Kadar sari = 0,12 5,0063
x
100
20
x
100% = 11,98% c. Berat sampel = 5,0164 gBerat sari = 0,1820 g Kadar sari = 0,14
5,0164
x
10020
100% = 13,95%
Kadar sari rata-rata = % = 11,96%
Lampiran 12. (Lanjutan)
a. Berat sampel = 2,0160 g Berat abu = 0,0990 g
Kadar abu =
100 % = 4,91 % b. Berat sampel = 2,0850 g
Berat abu = 0,1040 g Kadar abu =
100% = 4,98% c. Berat sampel = 2,0900 g
Berat abu = 0,1050 g Kadar abu =
100% = 5,02%
Kadar abu total rata-rata = 4,91 4,98 5,02
Lampiran 12. (Lanjutan)
Sampel I Berat sampel = 2,0160 g Berat abu = 0,0105 g
Kadar abu = 0,0105
2,0160
x 100% = 0,74 %
Sampel II Berat sampel = 2,0850 g Berat abu = 0,0095 g
Kadar abu = 0,0095
2,0850 x 100% = 0,45%
Sampel III Berat sampel = 2,0900 g Berat abu = 0,0080 g
Kadar abu = 0,0080
2,0900
x
100%= 0,38 %Kadar abu yang tidak larut dalam asam rata-rata = 0,74 0,45 0,38
3 = 0,52%
Kadar abu yang tidak larut dalam asam Berat Abu
Lampiran 13. Contoh perhitungan viskositas sediaan gel ekstrak etanol daun
gulma siam
Perhitungan viskositas = faktor koreksi x skala = cp = :1000 = p Nomor spindel : 64
Nomor spedd : 30 Faktor koreksi : 200
1. F1 : 200 x 18,5 = 3700 cp = 3,7 poise 2. F2 : 200 x 17 = 3400 cp = 3,4 poise 3. F3 : 200 x 16,5 = 3300 cp = 3,3 poise 4. F4 : 200 x 16 = 3200 cp = 3,2 poise 5. F5 : 200 x 15 = 3000 cp = 3,0 poise 6. F6 : 200 x 14,5 = 2900 cp = 2,9 poise
Lampiran 14. Hasil uji statistik menggunakan metode oneway ANOVA diameter
luka sayat menggunakan gel EEDGS
1
Squares df Mean Square F Sig.
ANOVA
Squares df Mean Square F Sig.
ANOVA
Squares df Mean Square F Sig.
ANOVA
Squares df Mean Square F Sig.
Lampiran 14. (Lanjutan)
Squares df Mean Square F Sig.
ANOVA
Squares df Mean Square F Sig.
ANOVA
Squares df Mean Square F Sig.
ANOVA
Squares df Mean Square F Sig.
ANOVA
Lampiran 14. (Lanjutan)
Squares df Mean Square F Sig.
ANOVA
Squares df Mean Square F Sig.
ANOVA
Squares df Mean Square F Sig.
ANOVA
Squares df Mean Square F Sig.
ANOVA Perlakuan
Lampiran 14. (Lanjutan)
Squares df Mean Square F Sig.
ANOVA
Squares df Mean Square F Sig.
ANOVA
Squares df Mean Square F Sig.
ANOVA
Squares df Mean Square F Sig.
ANOVA
Lampiran 14. (Lanjutan)
Squares df Mean Square F Sig.
ANOVA
Squares df Mean Square F Sig.
ANOVA
Squares df Mean Square F Sig.
ANOVA
Lampiran 15. Hasil uji Tukey terhadap perubahan diameter luka sayat dengan
Means f or groups in homogeneous subsets are display ed. Uses Harmonic Mean Sample Size = 3, 000.
a.
Means f or groups in homogeneous subsets are display ed. Uses Harmonic Mean Sample Size = 3,000.
Lampiran 15. (Lanjutan)
Means f or groups in homogeneous subset s are display ed. Uses Harmonic Mean Sample Size = 3,000.
a.
Means f or groups in homogeneous subset s are display ed. Uses Harmonic Mean Sample Size = 3,000.
Lampiran 15. (Lanjutan)
Means f or groups in homogeneous subset s are display ed. Uses Harm onic Mean Sample Size = 3,000.
a.
1,000 ,349 1,000 1,000 1,000 1,000 Perlakuan
Lampiran 15. (Lanjutan)
Means f or groups in homogeneous subset s are display ed. Uses Harmonic Mean Sample Size = 3,000.
a.
1,000 1,000 1,000 1,000 ,658 1,000 Perlakuan
Lampiran 15. (Lanjutan)
1,000 1,000 1,000 1,000 ,997 1,000 Perlakuan
Means for groups in homogeneous subsets are display ed. Uses Harmonic Mean Sample Size = 3,000. a.
1,000 1,000 1,000 1,000 1,000 1,000 1,000 Perlakuan
Lampiran 15. (Lanjutan)
1,000 1,000 1,000 ,331 1,000 1,000 1,000 Perlakuan
Means for groups in homogeneous subsets are display ed. Uses Harmonic Mean Sample Size = 3,000. a.
1,000 ,264 ,499 ,975 1,000 1,000 Perlakuan
Lampiran 15. (Lanjutan)
1,000 1,000 ,998 1,000 1,000 ,904 Perlakuan
Means for groups in homogeneous subsets are display ed. Uses Harmonic Mean Sample Size = 3,000. a.
,120 1,000 ,383 1,000 1,000 1,000 Perlakuan
Lampiran 15. (Lanjutan)
,401 1,000 1,000 1,000 1,000 ,948 Perlakuan
Means for groups in homogeneous subsets are display ed. Uses Harmonic Mean Sample Size = 3,000. a.
1,000 1,000 ,982 1,000 ,982 ,076 Perlakuan
Lampiran 15. (Lanjutan)
Means f or groups in homogeneous subset s are display ed. Uses Harmonic Mean Sample Size = 3,000.
a.
1,000 1,000 1,000 ,322 ,810 1,000 Perlakuan
Lampiran 15. (Lanjutan)
1,000 1,000 1,000 1,000 ,181 1,000 Perlakuan
Means for groups in homogeneous subsets are display ed. Uses Harmonic Mean Sample Size = 3,000. a.
Means f or groups in homogeneous subset s are display ed. Uses Harmonic Mean Sample Size = 3,000.
Lampiran 15. (Lanjutan)
Means f or groups in homogeneous subset s are display ed. Uses Harmonic Mean Sample Size = 3,000.
a.
Means f or groups in homogeneous subset s are display ed. Uses Harmonic Mean Sample Size = 3,000.
Lampiran 15. (Lanjutan)
Means f or groups in homogeneous subsets are display ed. Uses Harmonic Mean Sample Size = 3,000.
a.
Means f or groups in homogeneous subsets are display ed. Uses Harmonic Mean Sample Size = 3, 000.
DAFTAR PUSTAKA
Abdassah, M., Rusdiana, T., Subghan, A., Hidayati, G., (2009). Formulasi Gel Pengelupas Kulit Mati yang Mengandung Etil Vitamin C dalam Sistem Penghantaran Macrobead. Universitas Padjadjaran. Jurnal Ilmu Kefarmasian Indonesia. 7(2): 105-111.
Ansel, H. C. (1998). Pengantar Bentuk Sediaan Farmasi. Edisi 4. Penerjemah: Farida Ibrahim. Jakarta: UI Press. Halaman 390-397.
Arikumalasari, J,. Dewantara, I G.N.A., Wijayanti, N.P.A.D. (2013). Optimasi HPMC sebagai Gelling Agent dalam Formula Gel Ekstrak Kulit Buah Manggis (Garcia mangosta L). Universitas Udayana. Halaman 147.
Arisanty, I.P. (2013). Konsep Dasar Manajemen Perawatan Luka. Jakarta: Penerbit Buku Kedokteran EGC. Halaman 1-7, 29.
Arun, M., Satish, S., Anima, P. (2013). Herbal Boon for Wounds. International
Journal of Pharmacy and Pharmaceutical Science. 5(2): 1-12.
Aulton, M.E. (2007). Aulton’s Pharmaceutics: The Design and Manufactures of
Medicine. Third Edition. New York: Churcill Livingstone Elsevier.
Halaman 70-72.
Barku, V. Y. A., dan Ayaba, S. (2013). Phytochemical Screening and Assessment of Wound Healing Activity of The Leaves of Anogeissus leiocarpus.
European Journal of Experimental Biology. 3(4): 25
Baroroh, D.B. (2011). Konsep Luka. Malang: Basic Nursing Department PSIK FIKES UMM. Halaman 2.
Boyle, M. (2009). Wound Healing in Midwifery. Abingdon: Radcliffe Publishing Ltd. Halaman 14.
Burns. (2006). Vogt PM PVP Iodine in Hydrosome and Hydrogel-a Novel Concept in Wound Therapy Leads TO Enhanced Epithelialization and Reduced Loss of Skin Grafis. 32(6): 698-705.
Chakarboty, A.K., Harikrishna, R., dan Shailaja, B. (2010). Evaluation of Antioxidant Activity of The Leaves of Eupatorim odoratum Linn. Int. J.
Of Pharmacy and Pharmaceutical Sc. 2(4): 77-79.
Choudhary, G.P. (2011). Wound Healing Activity Of The Ethanolic Extract Of
Terminalia chebula Retz. International Journal of Pharma and Bio Sciences. 2(1): 48-52
DepKes RI. (1979). Farmakope Indonesia. Edisi III. Jakarta: Departemen Kesehatan RI. Halaman 7
Direktorat Jendral POM. (2000). Parameter Standar Umum Ekstrak Tumbuhan
Obat. Cetakan Pertama. Jakarta: Depertemen Kesehatan RI. Halaman
10-17.
Dewi, I.A.L.P., Damriyasa, I.M., dan Dada, I.K.A. (2013). Bioaktivitas Ekstrak Daun Tapak Dara (Catharanthus roseus) Terhadap Periode Epitelisasi Dalam Proses Penyembuhan Luka Pada Tikus Wistar. Indonesia Medicus
Veterinus. 2(1): 71-72.
Farnsworth, N.R. (1966). Biological and Phytochemical Screening of Plants. J.
Pharm. Sci. 55(3): 264.
Felicien. A., Alitonou, Djenontin, Tchobo, Yehouenou, Menut, Sohounhloue. (2012). Chemical composition and Biological activities of the Essential oil extracted from the Fresh leaves of Chromolaena odorata (L. Robinson) growing in Benin. ISCA Journal of Biological Science. 1(3): 7-13.
Fulviana, Indrayudha, P., Sulaiman, T.N.S. (2013). Formulasi Sediaan Gel Antibakteri Ekstrak Etanol Herba Patikan Kebo (Euphorbia hirta L.) dan Uji Aktivitas secara In Vitro terhadap Pseudomonas aeruginosa. Naskah
Publikasi. Fakultas Farmasi Universitas Muhammadiyah Surakarta.
Halaman 1-15.
Gal, P., Kilik, R., Mokry, M., Vidinsky, B. (2008). Simple Method of Open Skin Wound Healing Model in Corticosteroid- Treated and Diabetic Rats: Standardization of Semi Quantitative and Quantitative Histological Assessments. Veterinari Medecina. 53(12): 652-659.
Gennaro, R.A. (2000). Remington: The Science an Practice of Pharmacy. Edition 20th. New York: Lippincot Williams and Wilkins. Halaman 1629.
Gibson, M. (2001) Pharmaceutical Preformulation and Formulation. CRC Press, United States of America. Halaman 546-550.
Goci, E., Haloci, E., Xhulaj, S., Malaj, L. (2014). Formulation and In Vitro Evaluation of Diclofenac Sodium Gel. International Journal of Pharmacy
and Pharmaceutical Sciences. 6(6): 259-261.
Hadiroseyani, H., Hafifuddin, Alifuddin, M., dan Supriyadi, H. (2005). Potensi Daun Kirinyuh (Chromolaena odorata) untuk Pengobatan Penyakit Cacar pada Ikan Gurame (Osphronemus gouramy) yang Disebabkan Aeromonas
hydrophilla S26. Jurnal Akuakultur Indonesia. 4(2): 139-144.
Harbone, J.B. (1987). Metode Fitokimia, Penuntun Cara Modern Menganalisa
Tumbuhan. Terjemahan Kosasih Padmawinata. Edisi II. Bandung: ITB
Press. Halaman 35.
Hernani dan Endjo, D. (2004). Gulma Berkhasiat Obat. Jakarta: Penebar Swadaya. Halaman 2-3.
Hunter, J. (2003). Infections. In: Clinical Dermatology. 3rd edition. Massachusetts, USA: Blackwell Science. Halaman 208-209.
Ida, N., dan Noer, S.F. (2012). Uji Stabilitas Fisik Gel Ekstrak Lidah Buaya (Aloe Vera L.) Majalah Farmasi Dan Farmakologi. 16(2): 82.
Ikewuchi, J.C., Ikewuchi, C.C. (2011). Anti Cholesterolemic Effect of Awueous Extract of The Leaves of Chromolaena odorata (L) Kingand Robinson (Asteraceae): Potential for the Reduction OF Cardiovascular Risk. The
Pacific Journal of Science and Technology. 12(2): 385-391.
Indonesia Enterostomal Theraphy Nurse Association (InETNA) & Tim Perawatan Luka dan Stoma Rumah Sakit Dharmais. (2004). Perawatan Luka. Jakarta: Makalah Mandiri.
Jawetz, E., J.L. Melnick., E.A. Adelberg., G.F. Brooks., J.S. Butel., dan L.N. Ornston.(1995). Mikrobiologi Kedokteran. Edisi ke-20 (Alih bahasa : Nugroho & R.F.Maulany). Jakarta: Penerbit Buku Kedokteran EGC. Halaman 211,213,215
Johari, S.A., Kiong, L., S., Mohtar, M., Isa, M.M., Man, S., Mustafa, S., dan Ali, A.,M. (2012). Efflux Inhibitory activity of flavanoids from Chromolaena odorata againts selected methicillin-resistant Staphylococcus aureus (MRSA) isolates. Afr. Journal Microbiol. 6: 5631-5635
Karim, A. Z,. Ernawati, N,. Ikka, N.S,. (2013). (Pachyrrizus erosus) Urban sebagai Tabir Surya pada Mencit dan Pengaruh Kenaikkan Kadarnya terhadap Viskositas Sediaan. Traditional Medicine Journal. 18(1): 6. Kuncari, S.E., Iskandarsyah, Praptiwi. (2014). Evaluasi Uji Stabilitas Fisik Dan
Sineresis Sediaan Gel yang Mengandung Minoksidil, Apigenin, dan Perasan Herba Seledri (Apium graviolens L,.). Buletin Penelitian
Kesehatan. 42(4): 213-222.
Kusumawati, G.D., Mufrod, Setiyadi, G. (2012). Formulasi Sediaan Gel Ekstrak Etanol Daun Lidah Buaya (Aloe Vera (L.) Webb) dengan Gelling Agent
Hydroxyprophyl Methylcellulose (Hpmc) 4000 SM dan Aktivitas
Antibakterinya terhadap Staphylococcus Epidermidis. Naskah Publikasi. Fakultas Farmasi Universitas Muhammadiyah Surakarta. Halaman 1-14. Lachman, L., Herbet, A.L and Joseph, L.K. (1994). Teori Dan Praktek Farmasi
Industri . Terjemahan Siti Suyatmi. Edisi Ketiga. Jakarta: Penerbit
Le, T. T. (1995). The European Tissue Repair Society Annual Meeting, Pavoda, Italy.
Lieberman, Rieger, M.M and Banker. (1998). Pharmaceutical Dosage: Disperse
System. Volume 2. New York: Marcell dekker Inc. 495-508
Mappa, T., Edy, H.J., dan Kojong, N. (2013). Formulasi Gel Ekstrak Daun Sasaladahan (Peperomia Pellucida (L) H.B.K) Dan Uji Efektivitasnya Terhadap Luka Bakar Pada Kelinci. Pharmacon: Jurnal Ilmiah
Farmasi.2(2): 52
Marianne, Dwi,L.P, Elin,Y.S, Neng,F.K, Rosnani,N. (2014). Antidiabetic Activity of Leaves Ethanol Ekstrak Chromolaena odorata L. R. M. King on Induced Male Mice with Alloxan Monohydrate. Jurnal Ilmiah. 1(14): 1-4.
Marison, M.J. (2003). Manajemen Luka. Jakarta: Penerbut Buku Kedokteran EGC. Halaman 4.
Martin, A., Swarbrick, J., dan Cammarata, A. (1993). Farmasi Fisik: Dasar dasar
Farmasi Fisik dalam Ilmu Farmasetik. Edisi Ketiga. Penerjemah: Yoshita.
Jakarta: UI Press. Halaman 1176-1182
Mun’im, A,. Azizahwati, dan Fimani,A. (2010). Pengaruh Pemberian Infusa Daun Sirih Merah (Piperr CF.Fragile, Benth) Secara Topikal Terhadap Penyembuhan Luka Pada Tikus Putih Diabet. Depok: Laboratorium
Farmakognosi- Fitokimia, Depertemen Farmasi FMIPA UI, Kampus UI dan Laboratorium Farmakologi – Toksikologi, Depertemen Farmasi FMIPA UI Kampus UI. Halaman 81.
Mursito. (2001). Ramuan Tradisional untuk Kesehatan Anak. Jakarta: Penebar Swadaya. Halaman. 2.
Nasution, U.(1986). Gulma dan Pengendaliannya di Perkebunan Karet Sumatera Utara dan Aceh, Tanjung Morawa: Pusat Penelitian dan Pengembangan
Perkebunan Tanjung Morawa (P4TM). Halaman 155-157.
Omokhua, A.G., Lyndy, J.M.G., Jeffrey, F.F., dan Johannes, V.S. (2015). Chromolaena odorata (L) R.M.King & H.Rob (Asteraceae) in Sub-Saharan Africa: A Synthesis and Review of its Medical Potential. Journal
of Etnopharmacology. Halaman 1-11.
Paju, N., Yamlean, P. V. Y., dan Kojong N. (2013). Uji Efektivitas Salep Ekstrak Daun Binahong (Anredera cordifolia (Ten.) Steenis) pada Kelinci (Oryctolagus cuniculus) yang Terinfeksi Bakteri Staphylococcus aureus.
Prajitno, A,. Eddy,S, Happy,N. (2013). The Identification of Chemical Compound and Antibacterial Activity Test of Kopasanda (Chromolaena odorata L.) Leaf Extract Against Vibriosis_Causing Vibrio harveyi (MR 275 Rif) on Tiger Shrimp. Aquatic Science and Technology. Page 15-29.
Prawiradiputra, B.R., (2007). Kirinyu (Chromolaena odorata (L) R. M. King dan
H. Robinson): Gulma Padang Rumput yang Merugikan. Bulletin Ilmu Peternakan Indonesia. (WARTAZOA). 17(1): 46-52.
Pusponegoro AD. (2005). Luka. Dalam: Sjamsuhidajat R, De Jong W, penyunting. Buku Ajar Ilmu Bedah. Edisi ke-2. Jakarta; ECG. Halaman 66-88.
Quinonens, D., Ghaly, S.E., (2008). Formulation and Characterization of Nystain
Gel. PRHSJ (San Juan, PR). 27(1).
Rahmawanty, D,. Anwar, E,. Bahtiar, A,. (2014). Formulasi Gel Menggunakan Serbuk Daging Ikan Haruan (Channa striatus) sebagai Penyembuh Luka.
Media Farmasi. 11(1): 36-37.
Reynold, J.E.F. (1989). Martindale: The Extra Pharmacopeia. Twenty-seventh Edition. London: The Pharmaceutical Press. Halaman 925, 1285.
Robbins, L.S. dan Kumar, V. (1992). Buku Ajar Patologi I. Edisi IV. Jakarta: Penerbit Buku Kedokteran EGC. Halaman 28.
Robinson, T. (1995). Kandungan Organik Tumbuhan Tinggi. Edisi VI. Bandung: Penerbit ITB. Halaman 193.
Rowe, R.C., Sheskey, P.J., AND Owen, S.C. (2005). Handbook of
Pharmaceutical Exipiens. Pharmaceutical Association. 5rd edition.
Halman 346,466 and 624.
Rowe, R.C., Sheskey, P.J., Weller, P.J. (2009). Handbook of Pharmaceutical
Excipients. 6th edition. London: Pharmaceutical Press. Halaman 442.
Sanna, V., Peana, A.T., Moretti, M.D. (2010). Development of New Topical Formulations of Diphenhydramine Hydrochloride: In Vitro Diffusion and In Vivo Preliminary Studies. International Journal of PharmTech
Research. 2(1): 863-867
Setiadi. (2007). Anatomi dan Fisiologi Tubuh Manusia. Edisi pertama. Yogyakarta: Graha Ilmu. Halaman 24-28.
Singh, S., Parhi, R., Garg, A. (2011). Formulation of Topical Bioadhesive Gel of Aceclofenac Using 3-Level Factorial Design. Iranian Journal of
Pharmaceutical Research. 10(3): 435-445.
Sipayung, A., R.D. de Chenon, Sudharto, P.S., (1991). Observations on
Chromolaena odorata (L) R.M King and H. Robinson in Indonesia.
Second International Workshop on The Biological Control and Menagement of Chromolaena odorata. Briotop: Bogor.
Soerarti, W. (2004). Pengaruh Penambahan Asam Glikolat Terhadap Efektivitas Sediaan Tabir Surya Kombinasi Anti UV-A dan Anti UV-B Dalam Basis Gel. Surabaya: Majalah Farmasi Airlangga. 4(3): 76.
Soni M.G. (20020. Evaluation of The Health Aspects of Methyl Paraben: a review of the Published Literature. Food Chem. Toxicol. 40(10): 1335
Sreenivasan, S., Rajoo Nilawatyi, Rathinam, Lachimanan dan Rajoo. (2010). Wound Healing Potential of Elaeis guineensis Jacq Leaves in an Infected Albino Rat Model. Molecules. 1(5). 3186-3199.
Steinberg, D.C. (2005). Presevatives Use: Frequency Report and Registration,
Cosmetics & Toiletries. 121(7): 65-69.
Suardi, M., Armenia, dan Murhayati, A. (2008). Formulasi dan Uji Klinik Gel Anti Jerawat BenzoilPeroksida-HPMC. Jurnal. Padang: Fakultas Farmasi FMIPA UNAND
Sukmawati, A. & Suprapto., (2009). Efek Berbagai Peningkat Penetrasi Terhadap Penetrasi Perkutan Gel Natrium Diklofenak Secara In Vitro. Jurnal
Penetian Sains & Teknolog. 11(2): 117-120.
Syamsuni, H.A. (2006). Ilmu Resep, editor, Ella E., Winny R., Syarief. Jakarta: Penerbit Buku Kedokteran EGC. Halaman 270. Tambe, R., Kulkarni, M., Joice, A., Gilani, I. (2009). Formulation and Evaluation of Aloe vera gels.
Journal of Pharmacy Research. 2(10): 1588-1590.
Tambe, R., Kulkarni, M., Joice, A., Gilani, I. (2009). Formulation and Evaluation of Aloe vera gels. Journal of Pharmacy Research. 2(10): 1588-1590. Thang P., T., Wang L., See P., Jacqueline G., R., Yung S., C., Teik L., S., (2001).
Phenolic Compound OF Chromolaena odorata Protect Cultured Skin Cells From Oxidative Damage: Implication for Cutaneous Wound Healing. 24 (12): 1373-1379.
Thamrin, M., Asikin, S., Mukhlis, Budiman, A., (2007). Potensi Ekstrak Flora Lahan Rawa Sebagai Peptisida Nabati. Balai Besar Penelitian dan
Pengembangan Sumberdaya Lahan Pertanian Bogor. Halaman 23-31.
Voigt, R. (1995). Buku Pelajaran Teknologi Farmasi. Cetakan Kedua. Penerjemah: Soendani Noerono S. Yogyakarta: UGM Press. Halaman 565,568,335.
Wade, A. And Weller, P.J. (1994). Handbook of Pharmaceutical Excipients. 2nd ED. Washington D. C.: American Pharmaceutical Association Publ. Halaman 13, 89, 257, 390, 526, 663.
Wijaya, B.A., Citraningtyas, G., Wehantouw, F. (2014). Potensi Ekstrak Etanol Tangkai Daun Talas (Colocasia esculenta [L]) sebagai Alternatif Obat Luka pada Kulit Kelinci (Oryctolagus cuniculus). Pharmacon Jurnal
Ilmiah Farmasi. 3(3): 211-219
World Health Organization. (1992). Quality Control Methods For Medical Plant Materils. Journal of WHO.92(4): 25-28.
Yenti, R., Afrianti R., dan Afriani, L. (2011). Formulasi Krim Ekstrak Etanol Daun Kirinyuh (Euphatorium odoratum. L) untuk Penyembuhan Luka.
Majalah Kesehatan Pharma Medika. 3(1): 1,227.
BAB III
METODE PENELITIAN
Penelitian ini menggunakan metode eksperimental meliputi: pengumpulan dan pengolahan sampel, identifikasi sampel, pembuatan simplisia, skrining fitokimia dan karakterisasi simplisia, pembuatan ekstrak, pembuatan sediaan gel, evaluasi sediaan gel, pengujian sediaan gel terhadap penyembuhan luka sayat.
3.1 Alat dan Bahan
3.1.1 Alat
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas laboratorium, blender, neraca analitik, mortir, stamfer, pH meter, gunting bedah, pinset bedah, pisau cukur, pisau bedah, pot plastik, rotary evaporator, spatula, sudip, termometer dan viskometer Brookfiled.
3.1.2 Bahan
Bahan yang digunakan dalam penelitian ini adalah daun gulma siam, etanol, kloralhidrat, toluen (p.a), akuades, kalium iodida, merkuri (II) klorida, bismut nitrat, asam nitrat, iodium, alpha naftol, asam asetat anhidrat, asam sulfat pekat, kloroform, besi (III) klorida, timbal (II) asetat, natrium hidroksida, asam klorida pekat, metanol (teknis), eter minyak tanah (teknis), etil asetat (teknis), serbuk seng, serbuk magnesium, isopropanol, HPMC, propilenglikol, metil paraben, propil paraben, akuades, Lidokain HCl, Larutan dapar pH 4,0 dan 7,0.
larutan 1,358 g raksa (II) klorida dalam 60 ml air suling. Larutan dikocok dan ditambahkan air suling hingga 100 ml (DepKes, RI.,1995).
3.2.2 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida dilarutkan dalam 20 ml air suling, lalu ditambahkan 2 g iodium sambil diaduk sampai larut, lalu cukupkan dengan air suling hingga 100 ml (DepKes, RI., 1995).
3.2.3 Pereaksi Dragendorff
Campur 20 ml larutan bismuth (III) nitrat dalam asam nitrat lalu tambahkan dengan 50 ml larutan kalium iodida diamkan sampai memisah sempurna. Ambil larutan jernih dan encerkan dengan air secukupnya hingga 100 ml (DepKes, RI., 1995).
3.2.4 Pereaksi Molich
Sebanyak 3 g α-naftol ditimbang, kemudian dilarutkan dalam asam nitrat 0,5 N hingga diperoleh larutan 100 ml (DepKes, RI., 1995).
3.2.5 Pereaksi Lieberman Bouchard
Sebanyak 1 g bagian asam asetat anhidrat dicampurkan dengan 1 bagian asam sulfat pekat.
3.2.6 Pereaksi besi (III) klorida 1% (b/v)
Sebanyak 1 g besi (III) klorida ditimbang, kemudian dilarutkan dalam air secukupnya hingga diperoleh larutan 100 ml (DepKes, RI., 1995).
3.2.7 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam air hingga 100 ml (DepKes, RI., 1995).
Sebanyak 5,5 ml asam sulfat pekat diencerkan dengan air sulinghingga 100 ml (DepKes, RI., 1995).
3.2.9 Pereaksi asam klorida 2 N
Sebanyak 17 ml larutan asam klorida pekat ditambahkan air suling hingga diperoleh larutan 100 ml (DepKes, RI., 1995).
3.2.10 Pereaksi kloralhidrat
Larutkan 50 g kloralhidrat jenuh dalam 20 ml air (DepKes, RI., 1995).
3.3 Hewan Percobaan
Hewan yang digunakan pada penelitian ini adalah 6 ekor kelinci jantan dengan berat 1,5 kg sampai 2 kg. Kelinci ini sebelumnya telah diaklimasi selama seminggu.
3.4 Pengumpulan dan Pengolahan Sampel
3.4.1 Pengumpulan sampel
Pengambilan sampel dilakukan secara purposif. Bahan tumbuhan yang digunakan adalah daun gulma siam yang diambil di Desa Suayan Tinggi, Kabupaten Lima puluh kota, Provinsi Sumatera Barat.
3.4.2 Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Laboratorium Herbarium Medanense, Depertemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara.
(ditandai bila diremas rapuh). Simplisia yang telah kering (rapuh) diserbuk dengan blender dan disimpan dalam wadah tertutup rapat dan disimpan pada suhu kamar.
3.5 Pembuatan Ekstrak Etanol Daun Gulma Siam
Pembuatan ekstrak dilakukan dengan cara maserasi menggunakan pelarut etanol 80%. Sebanyak 500 g serbuk simplisia dimasukkan dalam bejana, dituangi dengan 3,5 L (75 bagian) etanol 80%, ditutup, dibiarkan selama 5 hari terlindung dari cahaya sambil sesekali diaduk, kemudian disaring sehingga didapat maserat. Ampas dimaserasi kembali dengan etanol 80% hingga diperoleh 5 L (100 bagian). Pindahkan maserat ke dalam bejana tertutup, dibiarkan di tempat sejuk terlindung dari cahaya selama 2 hari, enap tuangkan. Pemekatan ekstrak dilakukan dengan alat rotary evaporator pada suhu ±50oC sampai diperoleh ekstrak kental, selanjutnya di freeze dryer pada suhu -400C selama ± 24 jam. (DepKes, RI., 1979).
3.6 Skrining Fitokimia
Skrining fitokimia terhadap serbuk simplisia dan ekstrak etanol gulma siam meliputi: pemeriksaan senyawa alkaloid, glikosida, saponin, flavonoid, tanin dan steroid/triterpenoid.
3.6.1 Pemeriksaan alkaloida
Sebanyak 0,5 g sampel ditimbang, kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan dan disaring. Filtrat dipakai untuk percobaan berikut:
b. Filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereaksi Bouchardat akan terbentuk endapan berwarna coklat kehitaman
c. Filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereaksi Dragendorff akan terbentuk endapan berwarna merah atau jingga.
Alkaloid dinyatakan positif jika dua atau tiga reaksi di atas memberikan reaksi positif (DepKes, RI., 1995).
3.6.2 Pemeriksaan flavonoida
Larutan Percobaan:
Sebanyak 0,5 g sampel disari dengan 10 ml metanol lalu direfluks selama 10 menit, disaring panas-panas melalui kertas saring berlipat, filtrat diencerkan dengan 10 ml air suling. Setelah dingin ditambah 5 ml eter minyak tanah, dikocok hati-hati, didiamkan. Lapisan metanol diambil, diuapkan pada temperatur 40oC.Sisa dilarutkan dalam 5 ml etil asetat, disaring.
Cara Percobaan:
Satu ml larutan percobaan diuapkan hingga kering, sisanya dilarutkan dalam 1 ml etanol 96%, ditambahkan 0,1 g magnesium dan 10 ml asam klorida pekat, terjadi warna merah jingga sampai merah ungu menunjukkan adanya flavonoida (DepKes, RI., 1995).
3.6.3 Pemeriksaan tanin
Sebanyak 3 g sampel ditimbang, kemudian disari dengan 30 ml campuran 7 bagian volume etanol 96% dan 3 bagian volume air suling, selanjutnya ditambahkan 10 ml HCl 2 N, direfluks selama 10 menit, didinginkan dan disaring. Pada 30 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok, didiamkan selama 5 menit lalu disaring. Filtrat disari sebanyak 3 kali, tiap kali dengan 20 ml campuran 3 bagian volume kloroform dan 2 bagian volume isopropanol. Diambil lapisan air kemudian ditambahkan 2 ml air dan 5 tetes pereaksi Molisch, ditambahkan hati-hati 2 ml asam sulfat pekat terbentuk cincin warna ungu pada batas kedua cairan menunjukkan adanya ikatan gula (DepKes, RI., 1995).
3.6.5 Pemeriksaan saponin
Sebanyak 0,5 g sampel dimasukkan ke dalam tabung reaksi dan ditambahkan 10 ml air suling panas, didinginkan kemudian dikocok kuat-kuat selama 10 detik, timbul busa yang mantap tidak kurang dari 10 menit setinggi 1-10 cm. Ditambahkan 1 tetes larutan asam klorida 2 N, bila buih tidak hilang menunjukkan adanya saponin (DepKes RI., 1995).
3.6.6 Pemeriksaan steroida/triterpenoida
Sebanyak 1 g sampel dimaserasi dengan 20 ml eter selama 2 jam, laliu disaring. Filtrat diuapkan dalam cawan penguap. Pada sisa dalam cawan penguap ditambahkan 2 tetes asam asetat anhidrat dan 1 tetes asam sulfat pekat. Timbul warna ungu atau merah kemudian berubah menjadi hijau biru menunjukkan adanya steroida triterpenoida (Harborne, 1987).
3.7 Karakteristik Simplisia dan Ekstrak Etanol Gulma Siam
Penetapan kadar air dilakukan menurut metode Azeotropi (destilasi toluena). Alat terdiri dari labu alas bulat 500 ml, pendingin, tabung penyambung,tabung penerima 5 ml berskala 0,05 ml, alat penampung dan pemanas listrik.
Cara kerja :
Ke dalam labu alas bulat dimasukkan 200 ml toluena dan 2 ml air suling, lalu didestilasi selama 2 jam. Setelah itu, toluena dibiarkan mendingin selama 30 menit, dan dibaca volume air pada tabung penerima dengan ketelitian 0,05 ml. Kemudian ke dalam labu tersebut dimasukkan 5 g sampel yang telah ditimbang seksama, labu dipanaskan hati-hati selama 15 menit. Setelah toluena mendidih, kecepatan tetesan diatur lebih kurang 2 tetes tiap detik sampai sebagian besar air terdestilasi, kemudian kecepatan tetesan dinaikkan hingga 4 tetes tiap detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluena. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluena memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (WHO, 1992; DepKes, RI., 1995).
3.7.2 Penetapan kadar sari larut air
105oC sampai bobot tetap. Kadar dalam persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (WHO, 1992; DepKes, RI., 1995).
3.7.3 Penetapan kadar sari larut etanol
Sebanyak 5 g sampel, dimaserasi selama 24 jam dalam 100 ml etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Kemudian disaring cepat untuk menghindari penguapan etanol. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam persen sari yang larut dalam etanol 96% dihitung terhadap bahan yang telah dikeringkan (WHO, 1992; DepKes RI., 1995).
3.7.4 Penetapan kadar abu total
Sebanyak 2 g serbuk simplisia dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, jika arang masih tidak dapat dihilangkan, ditambahkan air panas, saring melalui kertas saring bebas abu. Pijarkan sisa dan kertas saring dalam krus yang sama. Masukkan filtrat ke dalam krus, uapkan, pijarkan hingga bobot tetap, timbang. Kadar abu dihitung terhadap bahan yang telah dikeringkan (WHO, 1992; DepKes, RI., 1995).
3.7.5 Penetapan kadar abu tidak larut asam
3.8 Pembuatan Formula Sediaan
3.8.1 Pembuatan basis gel
Formulasi basis gel dibuat menurut: Tambe, dkk., 2009; Suardi, dkk., 2008: Hidropropilmetilselulosa (HPMC) 4000 3 %
Propilen glikol 15 %
Metil paraben 0,18 %
Propil paraben 0,02 %
Air suling ad 100 g
Cara pembuatan : Akuades sebanyak 20 kali berat HPMC dipanaskan, kemudian dikembangkan HPMC di dalamnya. Metil paraben dan propil paraben dilarutkan dalam propilen glikol (Campuran I). Campuran I yang diperoleh ditambahkan sedikt demi sedikit ke dalam HPMC yang telah terdispersi dengan baik sambil digerus, kemudian ditambahkan sisa akuades dan digerus homogen (Soerartri, 2004).
3.8.2 Komposisi formula gel ekstrak etanol daun gulma siam (EEDGS)
Sediaan gel dibuat dalam 6 formula dengan jumlah masing-masing 200 g yang terlihat pada Tabel 3.1. Cara pembuatan sediaan gel EEDGS: ke dalam lumpang dimasukkan EEDGS masing-masing dengan konsetrasi 0,125%, 0,25%, 0,50%, 0,75%, dan 1,00%, ditambahkan sedikit demi sedikit basis gel lalu gerus sampai homogen.
2. F2 199,75 g 0,25 g
3.9 Evaluasi Formula Gel Ekstrak Etanol Daun Gulma Siam
Evaluasi formula meliputi evaluasi fisik dan biologi. Evaluasi fisik mencakup pemeriksaan stabilitas sediaan, homogenitas, pemeriksaan pH dan viskositas selama 90 hari, yaitu pada hari ke 0, 7, 14, 21, 28 dan 90 hari.
3.9.1 Pemeriksaan stabilitas fisik sediaan gel EEDGS
Pemeriksaan stabilitas fisik sediaan meliputi bentuk, warna dan bau yang diamati secara visual. Sediaan dinyatakan stabil apabila warna, bau dan penampilan tidak berubah secara visual selama penyimpanan. Pengamatan dilakukan pada suhu kamar pada hari ke-0, 7, 14, 21, 28 dan 90.
3.9.2 Pemeriksaan homogenitas sediaan
Cara: Sejumlah tertentu sediaan diletakkan di atas kaca, kemudian ditutup dengan kaca yang lain lalu diratakan. Sediaan yang memenuhi persyaratan homogenitas harus menunjukkan susunan yang homogen dan tidak terlihat adanya butir-butir yang kasar (DepKes RI., 1979). Pengamatan dilakukan pada suhu kamar pada hari ke-0, 7, 14, 21, 28 dan 90.
Pemeriksaan pH dilakukan dengan alat pH meter. Alat dikalibrasi dengan larutan dapar standar pH 4,0 dan pH 7,0. Kemudian pH meter dicuci dengan air suling dan dikeringkan dengan kertas tisu. Pengukuran pH sediaan dengan mencelupkan pH meter ke dalam larutan sediaan. Dicatat nilai pH yang ditunjukkan pada pH meter.
3.9.4 Penentuan viskositas sediaan
Penentuan viskositas sediaan menggunakan viskometer Brookfield.
Cara: sediaan dimasukkan kedalam pot plastik sampai mencapai volume 100 ml, lalu spindel diturunkan hingga spindel tercelup kedalam formulasi. Selanjutnya alat dihidupkan dengan menekan tombol ON. Kecepatan spindel diatur, kemudian dibaca skalanya (dial reading) dimana jarum merah yang bergerak stabil. Nilai viskositas dalam sentipoise (cps) diperoleh dari hasil perkalian skala baca (dial reading) dengan faktor koreksi (f) khusus untuk masing-masing kecepatan spindel. Pengamatan dilakukan pada suhu kamar pada hari ke-0, 7, 14, 21, 28 dan 90.
3.10 Pengujian Sediaan Gel terhadap Penyembuhan Luka Sayat
Kelinci sebelum pengujian dicukur bulu bagian punggungnya, dibuat pola berbentuk lingkaran diameter 2 cm, didesinfeksi kulitnya dengan alkohol 70%, lalu dianestesi lokal dengan 1 ml lidokain HCl (2%, 100mg/5ml). Kemudian dibuat luka dengan ukuran tanda yang telah dibuat bentuk lingkaran pada bagian punggung dengan cara mengangkat kulit hewan uji dengan pinset lalu digunting dengan gunting bedah. Luka dibuat sedalam 2 mm (Hajiaghaalipour, dkk., 2013; Gal, dkk., 2008). Setelah itu, pada kulit yang telah disayat dioleskan 0,5 g sediaan gel yang telah disediakan sesuai dengan kelompok masing-masing. Pemberian sediaan gel dilakukan secara topikal dengan cara mengoleskannya di bagian luka sebanyak 1 kali sehari. Pengamatan luka dilakukan setiap hari secara visual dengan mengukur diameter luka dan hari kesembuhan. Luka dianggap sembuh jika diameter luka sama dengan nol.
Diameter luka dihitung dengan rumus:
Keterangan : d : diameter rata-rata d1 : diameter pertama d2 : diameter kedua d3 : diameter ketiga d4 : diameter keempat
3.11 Analisis Data
Data hasil penelitian dianalisis menggunakan program SPSS (Statistical
Product and Service Solution) 18, metode one way ANAVA untuk melihat apakah
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian dapat disimpulkan sebagai berikut: 1. Ekstrak etanol daun gulma siam dapat di formulasi sebagai gel anti luka
2. Ekstrak etanol daun gulma siam memiliki efektivitas dalam penyembuhan luka sayat, konsentrasi terbaik dalam penyembuhan luka adalah 0,50%, sembuh pada hari ke 18 dan daya penyembuhannya lebih lama dibandingkan betadine yang sembuh pada hari ke 17
5.2 Saran
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Uraian tumbuhan meliputi habitat, sistematika tumbuhan, nama daerah, morfologi tumbuhan, khasiat tumbuhan dan kandungan kimia.
2.1.1 Habitat
Kirinyuh adalah gulma yang awalnya berasal dari Amerika Selatan dan Tengah, menyebar ke daerah tropis Asia, Afrika dan Pasifik, digolongkan sebagai gulma invasif, semak berkayu yang berkembang cepat, juga dikenal sebagai gulma siam, berdiri membentuk padat yang dapat mencegah pertumbuhan jenis tumbuhan lainnya serta memiliki efek allelopati (Prawiradiputra, 2007).
Gulma ini diperkirakan sudah tersebar di Indonesia sejak tahun 1910-an (Sipayung, dkk., 1991), tidak hanya terdapat di lahan kering atau pegunungan tetapi juga banyak terdapat dilahan rawa dan lahan basah lainnya (Thamrin, dkk., 2007)
2.1.2 Morfologi
2.1.3 Nama daerah
Nama daerah, Sumatera Utara: lenga-lenga; Sunda: kirinyuh, babanjaran, darismin; Makassar: laruna, lahuna, kopasanda. Istilah dalam bahasa Inggris dikenal sebagai Siam Weed, Christmas Bush, dan Common Floss Flower (Chakraborty, dkk., 2010).
Chromolaena odorata (L.) King & H. E. Robins memiliki nama lain: Eupatorium odoratum L., Eupatorium affine Hook & Arn., Eupatorium brachiatum Wikstrom, Osmiaodorata (L.) Schultz-Bip, Osmia floribunda (Kunth)
Schultz-Bip (Chakraborty, dkk., 2010).
2.1.4 Sistematika tumbuhan (Herbarium Medanense)
Sistematika tumbuhan gulma siam adalah sebagai berikut: Kingdom : Plantae
Divisi : Spermatophyta Kelas : Dicotyledonae Ordo : Asterales Famili : Asteraceae Genus : Chromolaena
Spesies : Chromolaena odorata (L.) King & H.E. Robins Nama Lokal : Gulma Siam
2.1.5 Kandungan kimia
kardiak, tanin, terpenoid, saponin avenacin, senyawa fenol seperti protocatechuin, p-coumarin, ferulic, p-hidroksibenzoat, asam vanilik, flavonoid jenis quercetagetin, naringenin, kaempferol, sinensetin, skutelareintetrametil eter, scutellarein, luteolin, eriodiktiol, aromadendrin, apigenin, scutellarein, taxifolin,
quercetagetin, minyak essensial seperti α-pinen, β-pinen, germakren D, β -copaen-4-alpha-ol, β-caryopilen, geigeren, pregeijeren, cadinen, camphor, dan limonene (Omokhua, dkk., 2015).
2.1.6 Khasiat tumbuhan
Khasiat dari daun gulma siam adalah untuk menangani gigitan lintah, luka jaringan lunak, luka bakar, infeksi kulit. Daun gulma siam secara tradisional digunakan sebagai obat dalam penyembuhan luka, obat kumur untuk pengobatan sakit pada tenggorokan, obat batuk, obat malaria, antimikroba, sakit kepala, antidiare, astringent, antispasmodik, antihipertensi, antiinflamasi, mengobati diabetes, antikolesterol, antioksidan dan diueretik (Vital dan Rivera, 2009; Ikewuchi dan Ikewuchi, 2011; Yenti, dkk., 2011).
Daun gulma siam juga telah diaplikasikan pada manusia untuk membantu pembekuan darah akibat luka bisul atau borok (Hadiroseyani, 2005).
2.2 Ekstraksi
diserbuk sampai halus (DirJen, POM., 2000: DepKes, RI., 1979).
Ada beberapa metode ekstraksi yang sering digunakan antara lain yaitu: 1. Maserasi
Maserasi berasal dari kata “macerare” artinya melunakkan. Maserat adalah hasil penarikkan simplisia dengan cara maserasi. Maserasi adalah cara penarikkan simplisia dengan merendam simplisia tersebut dalam cairan penyari (Syamsuni, 2006). Dengan kata lain maserasi merupakan proses pengekstrakan dengan menggunakan pelarut dengan beberapa kali pengocokkan atau pengadukkan pada temperatur ruangan. Remaserasi pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama dan seterusnya (DirJen, POM., 2000; DepKes, RI., 1979).
2. Perkolasi
Perkolasi berasal dari kata “percolare” yang artinya penetesan (Voigt, 1995). Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna yang umumnya dilakukan pada temperatur ruangan. Serbuk simplisia yang akan diperkolasi tidak langsung dimasukkan kedalam bejana perkolator, tetapi dibasahi atau dimaserasi terlebih dahulu dengan cairan penyari sekurang-kurangnya selama 3 jam (DepKes, RI., 1979; DirJen, POM., 2000).
2.3 Gel
Sediaan gel merupakan sistem semipadat terdiri dari suspensi yang dibuat dari partikel anorganik yang kecil atau molekul organik yang besar, terpenetrasi oleh suatu cairan (DepKes, RI., 1995). Gel dapat diklasifikasikan sebagai gel anorganik dan gel organik, contoh bahan anorganik pembentuk gel adalah bentonit sedangkan tragakan, hidroksipropilmetilselulosa, metilselulosa adalah bahan organik (Voigt, 1995). Gel mempunyai kekakuan yang disebabkan oleh jaringan yang saling menganyam dari fase terdispersi yang mengurung dan memegang medium pendispersi (Ansel, 1998).
Proses pembuatan gel meliputi proses peleburan atau diperlukan suatu posedur khusus berkenaan dengan sifat mengembang dari gel (Lachman, dkk., 1994). Jika masa gel terdiri dari kelompok-kelompok partikel kecil yang berbeda, maka gel ini dikelompokkan dalam sistem dua fase. Makromolekul pada sediaan gel disebarkan keseluruh cairan sampai tidak terlihat ada batas diantaranya, disebut dengan gel satu fase (Ansel, 1998)
Polimer-polimer yang biasa digunakan untuk membuat gel meliputi gom alam, tragakan, pektin, karagen, agar, asam alginat, serta bahan-bahan sintesis dan semisintetis seperti metil selulosa, hidroksietilselulosa, karboksimetilselulosa, dan karbopol (Aulton, 2007).
Gel dalam pembuatannya memerlukan suatu basis untuk mendapatkan suatu gel yang homogen dengan konsistensi yang baik. Basis yang sering digunakan dalam pembuatan gel adalah HPMC dan karbopol karena sifatnya yang mudah didispersikan oleh air dengan konsentrasi kecil dan dapat memberikan kekentalan yang cukup sebagai dasar gel, bersifat inert tidak mengiritasi kulit dan tidak dimetabolisme oleh tubuh (Quinones dan Ghaly, 2008).
tidak lengket, gel mempunyai aliran tiksotropik dan pseudoplastik yaitu gel berbentuk padat apabila disimpan dan akan mengalir apabila dikocok, konsentrasi bahan pembentuk gel yang dibutuhkan hanya sedikit untuk membentuk masa gel yang baik, viskositas gel tidak mengalami perubahan yang berarti pada suhu penyimpanan (Lieberman, dkk., 1998).
Beberapa keuntungan sediaan gel menurut Voigt, 1995 adalah: 1. Kemampuan penyebaran baik pada kulit
2. Efek dingin, yang dijelaskan melalui penguapan lambat dari kulit 3. Tidak ada penghambatan fungsi rambut secara fisiologis
4. Kemudahan pencuciannya dengan air yang baik 5. Pelepasan obatnya baik
Tingginya kandungan air dalam sediaan gel dapat menyebabkan terjadinya kontaminasi mikroba, yang secara efektif dapat dihindari dengan penambahan bahan pengawet seperti metil dan propil paraben. Upaya lain yang diperlukan adalah perlindungan terhadap penguapan yaitu untuk menghindari masalah pengeringan (Voigt, 1995; Aulton, 2007).
2.3.1 Hidroksi propil metil selulose (HPMC)
kompatibel dengan bahan-bahan lain, kecuali bahan-bahan yang oksidatif (Gibson, 2001). Hidroxy methyl cellulose (HPMC) merupakan gelling agent semi sintetik yang tahan terhadap fenol dan stabil pada pH 3-11. HPMC dapat membentuk gel yang jernih dan bersifat netral serta memiliki viskositas yang stabil pada penyimpanan jangka panjang (Rowe, dkk., 2005). Selain itu HPMC mengembang terbatas dalam air sehingga merupakan bahan pembentuk hidrogel yang baik. Hidrogel sangat cocok digunakan sebagai sediaan topikal dengan fungsi kelenjer sebaseus berlebih, dimana hal ini merupakan salah satu faktor penyebab jerawat (Voigt, 1995). Rumus bangun HPMC dapat dilihat pada Gambar 2.1.
Gambar 2.1 Rumus bangun HPMC
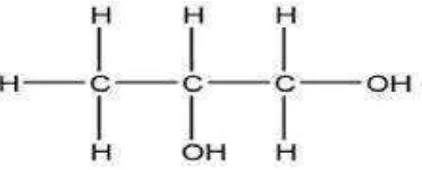
2.3.2 Propilen glikol
Propilen glikol berfungsi sebagai humektan yang menjaga kestabilan sediaan dengan cara mengabsorpsi lembab dari lingkungan dan mengurangi penguapan air dari sediaan dan mampu mempertahankan kandungan air dari suatu sediaan (Arikumalasari dkk, ; Kuncari dkk, 2014). Propilen glikol juga berfungsi meningkatkan penetrasi dengan cara merusak susunan lapisan lipid stratum korneum dan dengan denaturasi keratin atau melarutkan lapisan lipid pada stratum korneum sehingga mengurangi resistensi difusional dan meningkatkan permeabilitas kulit (Sinko, 2006; Sukmawati dkk, 2009). Rumus bangun propilen glikol dapat dilihat pada Gambar 2.2
Gambar 2.2 Rumus bangun propilen glikol
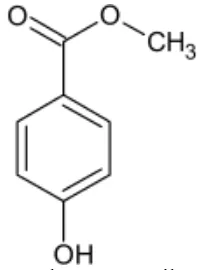
2.3.3 Metil paraben
Metil paraben memiliki ciri-ciri serbuk halus, berwarna putih, hampir tidak berbau dan tidak mempunyai rasa kemudian agak membakar diikuti rasa tebal (Depkes, RI., 1979; Rowe, dkk., 2005)
Metil paraben banyak digunakan sebagai pengawet dan antimikroba dalam kosmetik, produk makanan dan formulasi farmasi, kemampuan pengawet metil paraben ditingkatkan dengan penambahan propilen glikol (Soni, 2002).
Gambar 2.3 Rumus bangun metil paraben
2.3.4 Propil paraben
Propil paraben merupakan serbuk kristal putih, tidak berbau, dan tidak berasa, berfungsi sebagai pengawet (Steinberg, 2005). Konsentrasi propil paraben yang digunakan pada sediaan topikal adalah 0,01-0,6%. Propil paraben efektif sebagai pengawet pada pH 4-8, peningkatan pH dapat menurunkan aktivitas antimikrobanya. Propil paraben sangat larut dalam aseton dan etanol, larut dalam 250 bagian gliserin dan sukar larut di dalam air (Wade, 1994; Reynold, 1989). Rumus bangun propil paraben dapat dilihat pada Gambar 2.4
Gambar 2.4 Rumus bangun propil paraben
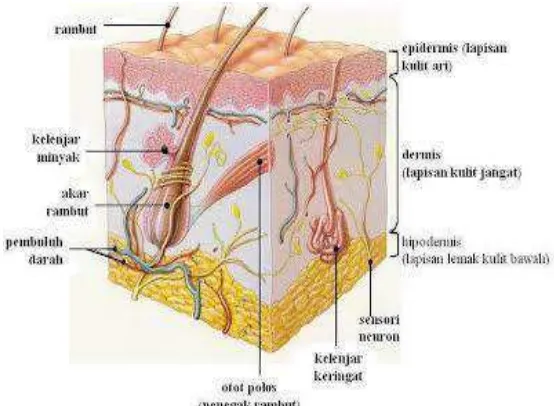
2.4 Kulit
Kulit merupakan organ terbesar dari tubuh manusia, 15% dari berat badan dewasa adalah kulit. Kulit memiliki bagian pelengkap seperti rambut, kuku dan kelenjar keringat/sebasea (Arisanty, 2013).
sensasi, eskresi dan metabolisme. Fungsi proteksi kulit adalah melindungi dari kehilangan cairan dari elektrolit, trauma mekanik, ultraviolet dan sebagai barier dari invasi mikroorganisme patogen (Perdanakusuma, 2007). Struktur kulit dapat dilihat pada Gambar 2.5.
3. 4. 5.
Gambar 2.5 Struktur kulit
Gambar 2.5 Struktur kulit
Kulit mempunyai daya regenerasi yang besar, misalnya pada saat kulit terluka, maka sel-sel dalam dermis melawan infeksi lokal kapiler dan jaringan ikat akan mengalami regenerasi sehingga terbentuk jaringan parut pada mulanya berwarna kemerahan karena meningkatnya jumlah kapiler dan akhirnya berubah menjadi serabut kolagen keputihan yang terlihat melalui epitel (Setiadi, 2007).
Epdermis merupakan bagian terluar kulit, sebagian besar terdiri dari yang mengalami skuamosa yang bertingkat yang mengalami kreatinisasi yang tidak memiliki pembuluh darah. Sel-sel yang menyusun epidermis secara terus menerus terbentuk dari jaringan germinal dalam epitelium kolumnar (Setiadi, 2007).
Menurut Setiadi 2007, lapisan epidermis terdiri atas :
1. Stratum korneum merupakan lapisan tanduk terdiri dari sel gepeng yang mati, mengandung kreatin / sel tanduk.
2. Stratum lusidum merupakan sel gepeng tanpa inti, yang jelas terlihat pada telapak tangan dan kaki dengan ketebalan empat sampai tujuh lapisan sel 3. Stratum granulosum mengandung sel granular dan kreatin, pada lapisan ini sel
berinti mulai mati dan terus terdorong keatas.
4. Stratum spinosum merupakan lapisan paling tebal yang memiliki banyak kolagen
5. Stratum basale bentuknya slindris dengan inti yang lonjong, didalamnya terdapat butir-butir halus yang disebut butir melanin warna, disini terjadi pembelahan yang cepat dan sel baru didorong masuk kelapisan berikutnya.
2.4.2 Dermis
Dermis merupakan lapisan kedua kulit, batas dengan epidermis dilapisi oleh membran basalis dan disebelah bawah berbatasan dengan subkutis. Didalam lapisan ini mengandung pembuluh darah, pembuluh limfe dan saraf, lapisan nya elastik, fibrosanya padat dan terdapat folikel rambut (Setiadi, 2007).
Dermis terdiri atas dua lapisan :
Dermis terdiri atas jaringan ikat, protein kologen dan elastin, fibrolast, sistem imun dan sistem saraf. Fungsi dermis adalah sebagai struktur penunjang, suplai nutrisi, menahan shearing force dan respon inflamasi (Perdanakusuma, 2007; Hunter, 2003).
2.4.3 Hipodermis
Merupakan kumpulan-kumpulan sel lemak, lapisan paling tebal dari kulit, terdiri atas jaringan lemak, jaringan ikat, fibrolast dan pembuluh darah. Hipodermis berfungsi sebagai penyimpan lemak, kontrol temperatur, penyangga organ disekitarnya dan menunjang suplai darah ke dermis untuk regenerasi (Boyle, 2009)
2.5 Luka
Luka adalah rusak atau hilangnya bagian jaringan tubuh karena adanya suatu faktor yang mengganggu sistem perlindungan tubuh. Faktor tersebut seperti trauma, zat kimia, ledakan, sengatan lstrik atau gigitan hewan (Pusponegoro, 2005). Salah satu jenis luka adalah luka sayat yang dapat dibagi menjadi dua yaitu 1. Luka insisi adalah luka yang disebabkan karena teriris benda tajam dimana
terdapat robekan linier pada kulit dan lapisan dibawahnya. Luka ini terjadi tanpa kehilangan jaringan kulit dan memerlukan penyembuhan luka secara premier.
2. Stadium II, luka pastial thickness: yaitu hilangnya lapisan kulit pada lapisan epidermis dan bagian atas dari dermis.
3. Stadium III, luka full thickness: yaitu hilangnya ulit keseluruhan meliputi kerusakan jaringan subkutan yang dapat meluas sampai bawah tetapi tidak melewati jaringan yang mendasarinya. Lukanya sampai pada lapisan epidermis, dermis dan fasia tetapi tidak mengenai otot
4. Stdium IV, luka full thickness ; yang telah mencapai lapisan otot, tendon dan tulang dengan adanya destruksi/ kerusakan yang luas.
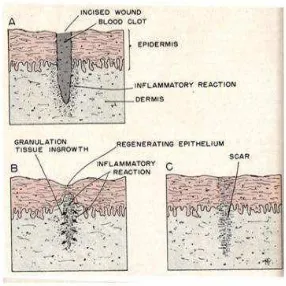
Penyembuhan luka adalah proses pengganti dan perbaikan fungsi jaringan yang rusak. Proses penyembuhan luka dibagi menjadi tiga fase penyembuhan luka yaitu fase inflamasi, fase proliferasi dan fase remodeling (Boyle, 2009; Arisanty, 2013). Gambar penyembuhan luka secara primer dapat dilihat pada Gambar 2.6.
Gambar 2.6 Penyembuhan primer
C:regenerasi epidermis sempurna dan terbentuk jaringan parut (Robbins dan Kumar, 1992)
Penyembuhan luka secara primer dengan menyatukan kedua tepi luka
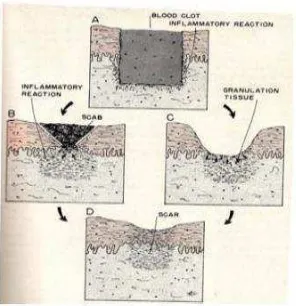
B: penyembuhan di bawah keropeng C: luka terbuka dengan jaringan granulasi
D:terbentuk jaringan parut atau daerah epidermis (Robbins dan kumar, 1992).
Penyembuhan luka secara sekunder adalah proses penyembuhan luka yang memerlukan terbentuknya jaringan granulasi yang banyak dimana jaringan granulasi tubuh dibawah keropeng dan terjadi regenerasi epitel dibawah keropeng kemudian keropeng akan lepas setelah terjadi epitelisasi sempurna. Prosesnya: proses granulasi (pertumbuhan sel), kontraksi (proses dimana daerah permukaan luka mengecil), epitelisasi (penutupan epidermis) untuk menutup luka (Morison, 2003; Arisanty, 2013)
Komponen utama dalam proses penyembuhan luka adalah kolagen disamping sel epitel. Fibroblas adalah sel yang bertanggung jawab untuk sintesis kolagen. Fisiologi penyembuhan luka secara alami akan mengalami fase-fase seperti dibawah ini :
a. Fase inflamasi
Fase ini dimulai sejak terjadinya luka sampai hari kelima. Segera setelah terjadinya luka, pembuluh darah yang putus mengalami konstriksi dan retraksi disertai reaksi hemostasis karena agregasi trombosit yang bersama jala fibrin membekukan darah.
b. Fase proliferasi atau fibroplasi
Fase ini merupakan fase yang terakhir dan terpanjang pada proses penyembuhan luka. Terjadi proses yang dinamis berupa remodelling kolagen, kontraksi luka dan pematangan parut. Aktivitas sintesis dan degradasi kolagen berada dalam keseimbangan. Fase ini berlangsung mulai 3 minggu sampai 2 tahun. Akhir dari penyembuhan ini didapatkan parut luka yang matang yang mempunyai kekuatan 80% dari kulit normal (Perdanakusuma, 2007).
2.6 Senyawa Kimia Tumbuhan Berkhasiat Penyembuh Luka
Senyawa kimia tumbuhan yang dapat berkhasiat terhadap penyembuhan luka antara lain alkaloid, flavanoid, tanin, saponin, dan steroid / triterpenoid.
2.6.1 Alkaloid
Alkaloid memiliki kemampuan sebagai antibakteri dengan mekanisme mengganggu komponen penyusun peptidoglikan pada sel bakteri, sehingga dinding sel tidak terbentuk secara utuh dan menyebabkan kematian sel (Paju, dkk., 2013).
2.6.2 Flavanoid
pendarahan dan mengurangi peradangan (Mun’im, dkk., 2010; Wijaya, dkk.,
2014). Selain itu juga dapat meningkatkan pembentukan fibroblas dan pembuluh darah baru yang berfungsi sebagai transportasi untuk pasokan makanan dan oksigen yang dibutuhkan oleh sel-sel yang sedang dalam perbaikan sehingga dapat mempercepat penyembuhan luka (Choudhary, 2011).
2.6.4 Saponin
Saponin yang terdapat dalam tumbuhan dapat memacu pembentukan kolagen yang berperan dalam proses penyembuhan luka, saponin juga memiliki kemampuan sebagai pembersih dan antiseptik yang berfungsi membunuh dan mencegah pertumbuhan mikroorganisme yang biasa timbul pada luka sehingga luka tidak mengalami infeksi. (Mappa, dkk., 2013; Yenti, dkk., 2011).
2.6.5 Steroid / Triterpenoid
BAB I
PENDAHULUAN
1.1Latar Belakang
Indonesia merupakan salah satu negara penghasil tumbuhan obat yang potensial dengan keanekaragaman hayati menempati urutan ketiga terbesar di dunia setelah Brazil dan Zaire, dan mempunyai jenis tumbuhan yang cukup banyak sehingga dapat dimanfaatkan sebagai obat (Hernani dan Endjo, 2004).
Penggunaan obat tradisional semakin disukai dari pada obat kimia karena mahalnya sehingga masyarakat beralih ke tumbuhan. Di masyarakat tumbuhan terutama digunakan untuk mencegah berbagai penyakit sehingga dapat menjaga kesegaran tubuh maupun mengobati penyakit (Mursito, 2001).
Gulma siam (Chromolaena odorata) merupakan sinonim dari Eupatorium
odoratum L, para pekebun menyebutnya kirinyuh atau gulma putihan. Daunnya
mengandung beberapa senyawa utama seperti fenol, tanin, steroid, saponin, flavonoid, dan alkaloid (Prajitno, dkk., 2013). Minyak essensial dari daun gulma siam memiliki kandungan α-pinen, β-pinen, geijeren, pregeijeren, germakren D dan trans-β kariopilen (Felicien, dkk., 2012).
suatu faktor yang mengganggu sistem perlindungan tubuh. Faktor tersebut seperti trauma, perubahan suhu, zat kimia, ledakan, sengatan listrik, atau gigitan hewan (Pusponegoro, 2005). Menurut Indonesia Enterostomal Therapy Nurse
Association (InETNA) (2004), luka merupakan kerusakan pada jaringan yang
mengganggu kehidupan normal sel.
Dipasaran obat luka telah banyak beredar dalam bentuk gel, salep, dan krim, tapi sediaan gel lebih banyak digunakan karena rasa dingin di kulit, mudah mengering membentuk lapisan tipis sehingga mudah dibersihkan (Suardi, dkk., 2008). Bahan pembawa yang digunakan untuk sediaan topikal berpengaruh terhadap absorbsi obat dan memiliki keuntungan jika dipilih dengan tepat (Lachman, dkk., 1994). Pemilihan hidroksi propil metil selulosa (HPMC) sebagai dasar gel karena tidak berbau, tidak berasa, mudah larut dalam air panas dan berfungsi sebagai penstabil pada sediaan topikal sedangkan propilenglikol digunakan sebagai pelarut dan pengawet (Rowe, dkk., 2005).
Penelitian sebelumnya dilakukan oleh Yuliani (2013), yaitu efek ekstrak etanol daun Chromolaena odorata L terhadap kesembuhan luka insisi pada tikus sprague dawley terlihat bahwa ekstrak Chromolaena odorata L efektif untuk kesembuhan luka. Penelitian Marianne, dkk., 2014 ekstrak ini pada dosis 5, 25, 125, dan 250 mg/kg bb mampu menurunkan kadar gula darah.
Berdasarkan uraian diatas peneliti ingin menguji efektivitas sedian gel ekstrak etanol daun gulma siam terhadap penyembuhan luka sayat (luka eksisi).
1.2Perumusan Masalah