PRODUKSI ANTIBODI MONOKLONAL MENGGUNAKAN
KONJUGAT FUMONISIN B
1-OVALBUMIN SEBAGAI
ANTIGEN UNTUK DETEKSI FUMONISIN
SECARA IMUNOASAI
ROMSYAH MARYAM
,
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
DAN SUMBER INFORMASI
Dengan ini saya menyatakan dengan sebenar-benarnya bahwa disertasi yang berjudul:
PRODUKSI ANTIBODI MONOKLONAL MENGGUNAKAN KONJUGAT FUMONISIN B1-OVALBUMIN SEBAGAI ANTIGEN UNTUK DETEKSI
FUMONISIN SECARA IMUNOASAI
adalah karya saya sendiri dan belum pernah diajukan dalam bentuk apapun kepada
perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang
diterbitkan maupun tidak diterbitkan oleh penulis lain telah disebutkan dalam teks dan
dicantumkan dalam Daftar Pustaka.
Bogor, Agustus 2007
ROMSYAH MARYAM. Production of Monoclonal Antibodies using Fumonisin B1-Ovalbumin Conjugate as the Antigen for the Detection of Fumonisin by
Immunoassay. Under supervision of ANTON APRIYANTONO as the chairman, RIZAL SYARIEF, FRANSISKA R. ZAKARIA and LIES PAREDE as the advisory committee members.
Fumonisins are mycotoxins produced by Fusarium spp. mainly F. verticillioides and F. proliferatum which are commonly found in grains such as corn, rice dan wheat. Fumonisin B1 (FB1) the most abundant and most toxic, is classified as a
possible carcinogen for humans (Group 2B) and one of the five important mycotoxins in the world. The toxicity of FB1 for humans and animals, as well as its economic
impact have been reported worldwide. In order to minimize the risks of FB1
contamination some countries have set the maximum levels of fumonisin in foods and feeds. Although there is no report on mycotoxicoses related to FB1 contamination in
Indonesia, some findings indicated high concentration of fumonisin contamination in agricultural products could affect the national income.
Analytical methods play crucial roles in the detection of fumonisin contamination in foods and feeds. Immunoassay is one of the most reliable, rapid, sensitive, specific, and economical method. This assay based on polyclonal or monoclonal antibodies. The objective of this study was to produce monoclonal antibodies (MAb) against FB1 and to generate direct competitive enzyme-linked
immunosorbent assay (dc-ELISA) for fumonisin analysis. This study includes several activities: (1) Synthesis of fumonisin B1-Ovalbumin antigen (FB1-Ova) and the
enzyme conjugate fumonisin B1-horseraddish peroxidase (FB1-HRP), (2) Production
and characterization of monoclonal antibodies against FB1, (3) Optimization and
validation of the dc-ELISA, (4) Application of dc-ELISA for the detection of fumonisin in foods or feeds.
FB1 used for the synthesis of FB1-Ova and FB1-HRP was isolated from F.
verticillioides and F. nygamai culture in corn which produced FB1 1.54 g/kg and 0.87
g/kg, respectively. The average of protein concentration of the antigen produced from the conjugation of FB1 and Ova via glutaraldehyde reaction was 0.0933 ± 0.0178
mg/ml (n=5). The antigen was proven to be immunogenic to BALB/c mice and could be used for the antibody sreening using indirect competitive ELISA (ic-ELISA). The reaction of FB1 and HRP resulted in the formation of FB1-HRP enzyme conjugate
which could be used as a label in the analysis of FB1 by dc-ELISA.
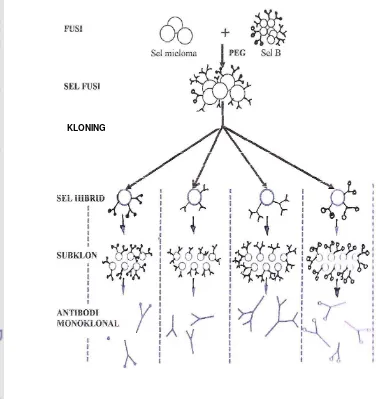
Monoclonal antibodies were produced by fusion of the splenic lymphocytes from the FB1-Ova immunized BALB/c mice with Sp2/0-Ag 14 myeloma cells using
polyethylene glycol (PEG 4000). Antibodies produced by the hybridoma cells were screened, and eight clones of the hybridomas with high antibody titers were selected for cell cloning. The highest antibody-producing hybridoma (2B2F6) was clonned by
limited dilution. The secreted antibodies from
subclone 2B1F6F7 belonged to the immunoglobulin G1 (IgG1) subclass. The
(FB2) of 49%. The method sensitivity was 0,5 ng/ml with IC50 of 2,9 ng/ml. The
dc-ELISA of spiked corn samples (40 ng FB1/g) showed good precision (SD=1.5%) and
accuracy (SD=7.7%) with FB1 recovery ranging from 88.2 to 103.1%. FB1 standards in
the concentration range of 1-50 ng/ml gave a linear response (R2= 0.9949) with regression equation Y= 7.1862 Ln(x) + 68.35. However, the linearity was reduced by the corn matrices (R2= 0.9841) at the same concentration range of FB1 standards. The
ELISA method developed in this research had a good agreement with high performance liquid chromatographic method (HPLC) which indicated by the analytical results of FB1 in corn detected by the two methods (R2 = 0.9898).
Analysis of commercial broiler dan layer feeds (n=10) using dc-ELISA revealed the presence of FB1 in the feeds ranging between 46.1 – 482.8 ng/g for the
broiler feeds and 20.7 – 85.5 ng/g for the layer feeds. These levels were lower compared to the FB1 levels in poultry feeds in general. During storage at ambient
temperature for six weeks, the concentration of FB1 in commercial chicken feeds
gradually increased. This indicated that the production of FB1 by Fusarium spp.
continued during the storage. However, the concentration of FB1 in both broiler and
layer feeds were still low to cause mycotoxicoses in poultry.
Direct competitive ELISA (dc-ELISA) is the most common immunoassay method used for the analysis of mycotoxins such as fumonisin. The dc-ELISA developed in this study using monoclonal antibodies showed a good performance when applied for the analysis of FB1 contaminated foods and feeds. The method is suitable
for laboratories in the developing countries such as Indonesia in terms of support for food safety programs and global trade.
Keywords: monoclonal antibody, fumonisin B1-ovalbumin conjugate, fumonisin
ROMSYAH MARYAM. Produksi Antibodi Monoklonal Menggunakan Konjugat Fumonisin B1-Ovalbumin Sebagai Antigen untuk Deteksi Fumonisin
Secara Imunoasai. Di bawah bimbingan ANTON APRIYANTONO sebagai ketua komisi pembimbing, RIZAL SYARIEF, FRANSISKA R. ZAKARIA dan LIES PAREDE sebagai anggota.
Fumonisin adalah mikotoksin yang dihasilkan oleh kapang Fusarium spp. terutama F. verticillioides dan F. proliferatum yang banyak dijumpai pada komoditas pertanian seperti jagung, beras dan gandum. Fumonisin B 1 (FB1) merupakan jenis
fumonisin yang paling banyak ditemui di alam dan paling toksik, diklasifikasikan sebagai senyawa karsinogen (Grup 2B). FB1 termasuk dalam lima mikotoksin penting
yang menjadi perhatian dunia. Toksisitas FB1 pada manusia dan hewan, serta dampak
ekonomi yang disebabkan mikotoksin ini telah banyak dilaporkan. Oleh karenanya, untuk mengurangi risiko yang disebabkan karena kontaminasi FB1 beberapa negara
telah menetapkan batas maksimum kandungan fumonisin ini dalam bahan pangan dan pakan. Meskipun di Indonesia belum ada laporan mengenai mikotoksikosis yang disebabkan oleh fumonisin dan belum ada laporan mengenai kerugian ekonomi, namun dari beberapa laporan yang mengindikasikan kontaminasi FB1 pada bahan pangan dan
pakan yang cukup tinggi dapat mempengaruhi perekonomian nasional.
Metode analisis memegang peranan penting dalam mendeteksi kontaminasi fumonisin pada bahan pangan dan pakan. Imunoasai adalah salah satu metode yang paling dapat diandalkan karena dengan metode ini proses analisis dapat dilakukan secara cepat dan mudah dengan sensitivitas dan spesifitas yang tinggi, serta ekonomis. Teknik ini menggunakan antibodi poliklonal atau monoklonal. Tujuan dari penelitian ini yaitu memproduksi antibodi monoklonal (AbMk) spesifik terhadap FB1 dan
mengembangkan metode enzyme-linked immunosorbent assay (ELISA) kompetitif langsung untuk analisis fumonisin. Penelitian ini terdiri dari beberapa kegiatan: (1) Sintesis antigen fumonisin B1-ovalbumin (FB1-Ova) dan konjugat enzim fumonisin B1
-horse raddish peroxidase (FB1-HRP), (2) Produksi dan karakterisasi antibodi
monoklonal spesifik terhadap FB1, (3) Optimisasi dan validasi ELISA kompetitif
langsung, (4) Aplikasi ELISA kompetitif langsung untuk mendeteksi fumonisin pada bahan pangan atau pakan.
FB1 yang digunakan untuk sintesis antigen FB1-Ova dan FB1-HRP diisolasi
dari biakan kapang F. moniliforme dan F. nygamai pada media jagung yang masing-masing menghasilkan FB1 1,54 g/kg dan 0,87 g/kg. Rataan konsentrasi protein dari
antigen yang dihasilkan dari konjugasi FB1 dengan Ova melalui reaksi dengan
glutaraldehida yaitu 0,0933 ± 0,00178 mg/ml (n=5). FB1-Ova yang terbentuk dari
reaksi tersebut bersifat imunogenik, terlihat dengan adanya respon antibodi pada mencit BALB/c yang diimunisasi dengan antigen tersebut, dan dapat digunakan sebagai pereaksi untuk pengujian antibodi secara ELISA kompetitif tidak langsung. Reaksi antara FB1 dan enzim horseraddish peroxidase (HRP) menghasilkan FB1-HRP
enzim konjugat yang dapat digunakan sebagai label pada analisis FB1 secara ELISA
kompetitif langsung.
Antibodi monoklonal dihasilkan melalui fusi sel limfosit mencit yang diimunisasi FB1-Ova dengan sel mieloma Sp2/0-Ag14 menggunakan polietilen glikol
imunoglobulin G1 (IgG1). Konsentrasi antibodi dari supernatan dan cairan asites
setelah pengendapan dengan ammonium sulfat dan pemurnian melalui kolom HiTrap Protein A HP masing-masing 2,81 mg/ml dan 1,62 mg/ml.
Kondisi optimum ELISA tak langsung untuk mendeteksi 50 ng/ml FB1
memerlukan pengenceran antibodi 1:10.000 dan konjugat enzim FB1-HRP 1:400.
Antibodi tersebut memberikan reaksi yang spesifik terhadap FB1 dengan reaksi silang
terhadap fumonisin B2 (FB2) sebesar 49%. Sensitivitas metode ini yaitu 0,5 ng/ml
dengan IC50 2,9 ng/ml. Analisis sampel jagung yang diberi standar FB1 (40 ng/g)
secara ELISA kompetitif langsung menunjukkan presisi (SD=1,5%) dan akurasi (SD=7,7%) yang baik dengan rekoveri berkisar antara 88,2-103,1%. FB1 standar pada
kisaran konsentrasi 1-50 ng/ml menunjukkan garis linear (R2=0,9949) dengan persamaan regresi Y=7,1862 Ln(x) + 68,35. Namun, linearitas menurun dengan adanya matriks jagung (R2= 0,9841) pada kisaran konsentrasi standar FB1 yang sama.
Perbandingan analisis FB1 dalam jagung (n=10) secara ELISA kompetitif langsung
dengan metode KCKT menunjukkan korelasi yang baik di antara kedua metode tersedbut (R2=0,9898).
Analisis pakan ayam komersial (n=10) secara ELISA kompetitif langsung menunjukkan adanya kontaminasi FB1 pada kisaran 46,1–482,8 ng/g untuk pakan
ayam pedaging dan 20,7–85,5 ng/g untuk pakan ayam petelur. Konsentrasi tersebut lebih rendih dibandingkan dengan konsentrasi FB1 pada pakan ayam pada umumnya.
Perlakuan penyimpanan kedua jenis pakan pakan tersebut pada temperatur kamar selama enam minggu menunjukkan adanya peningkatan konsentrasi FB1. Hal ini
menunjukkan bahwa produksi FB1 oleh Fusarium spp. terus berlangsung selama
penyimpanan.
ELISA kompetitif langsung adalah metode imunoasai yang paling banyak digunakan untuk analisis mikotoksin termasuk fumonisin. Metode ELISA kompetitif langsung yang dikembangkan pada penelitian ini dengan menggunakan antibodi monoklonal menunjukkan performan yang baik ketika diaplikasikan untuk menganalisis bahan pangan dan pakan yang terkontaminasi FB1. Metode ini sesuai
untuk digunakan pada laboratorium-laboratorium di negara berkembang seperti Indonesia guna mendukung program keamanan pangan dan perdagangan global.
©Hak Cipta Milik Institut Pertanian Bogor, Tahun 2007
Hak Cipta Dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari IPB, sebagian atau seluruhnya dalam bentuk apapun, baik cetakan, fotokopi, mikrofilm
PRODUKSI ANTIBODI MONOKLONAL MENGGUNAKAN
KONJUGAT FUMONISIN B
1-OVALBUMIN SEBAGAI
ANTIGEN UNTUK DETEKSI FUMONISIN
SECARA IMUNOASAI
ROMSYAH MARYAM
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor
pada Sekolah Pascasarjana Institut Pertanian Bogor
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Penguji Luar Komisi pada Ujian Tertutup: Dr. drh. Retno D. Soejoedono, MS
Penguji Luar Komisi pada Ujian Terbuka: 1. Dr. drh. Agustin Indrawati, M.Biomed
Nama Mahasiswa : Romsyah Maryam
Nomor Pokok : F226014011
Progam Studi : Ilmu Pangan
Disetujui:
Komisi Pembimbing
Dr.Ir. Anton Apriyantono, MS Ketua
Prof.Dr.Ir. Rizal Syarief, DESS Prof.Dr. Ir.Fransiska R. Zakaria, MSc
Anggota Anggota
Drh. Lies Parede, MSc, PhD Anggota
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Betty Sri Laksmi Jenie, MS Prof. Dr. Ir. Chairil Anwar Notodiputro, MS
NIP. 130 516 873 NIP. 130 891 386
taufik dan hidayahNya penulisan disertasi ini dapat diselesaikan. Disertasi berjudul
“Produksi Antibodi Monoklonal Menggunakan Konjugat Fumonisin B1
-Ovalbumin Sebagai Antigen untuk Deteksi Fumonisin Secara Imunoasai” ini merupakan salah satu syarat untuk memperoleh gelar doktor pada Program Studi Ilmu Pangan, Sekolah Pasca Sarjana Institut Pertanian Bogor.
Pada kesempatan ini penulis sampaikan ucapan terima kasih yang tulus serta penghargaan yang setinggi-tingginya kepada Bapak Dr. Ir. Anton Apriyantono, MS selaku Ketua Komisi Pembimbing atas segala bimbingan dan arahannya selama pendidikan dan penyelesaian studi. Ucapan terima kasih juga penulis sampaikan kepada Bapak Prof. Dr. Ir. Rizal Syarief, DESS., Ibu Prof. Dr. Ir. Fransiska R. Zakaria, MSc., serta Ibu Drh. Lies Parede, MSc.PhD selaku Anggota Komisi Pembimbing yang telah memberikan bimbingan dan masukan kepada penulis selama penelitian hingga selesainya penulisan disertasi ini. Terima kasih kepada Dr. drh. Retno D. Soejoedono, MS selaku penguji luar komisi yang bersedia menguji pada ujian tertutup, serta Dr. drh. Agustin Indrawati, M.Biomed dan Dr. Tri Budhi Murdiati, MSc. selaku penguji luar komisi pada ujian terbuka Program Studi Doktor di Institut Pertanian Bogor.
Ucapan terima kasih disampaikan kepada Rektor dan Pembantu Rektor IPB, Dekan Sekolah Pasca Sarjana, Dekan dan Wakil Dekan Fakultas Teknologi Pertanian IPB, Ketua Departemen Ilmu dan Teknologi Pangan IPB, Ketua Program Studi Ilmu Pangan IPB untuk kesempatan yang telah diberikan kepada penulis untuk mengikuti pendidikan S3 di IPB. Kepada Kepala Balai Besar Penelitian Veteriner (BBALITVET), Ketua Kelti Toksikologi dan Virologi, yang telah memberikan kesempatan dan fasilitas, serta dukungan moril bagi penulis untuk melaksanakan penelitian hingga selesainya masa studi. Terima kasih kepada Badan Litbang Pertanian Departemen Pertanian atas bantuan beasiswa melalui Proyek PAATP.
Terima kasih disertai rasa hormat penulis sampaikan kepada Ibunda tercinta dan Ayahanda (almarhum) atas segala do’a restu, serta dukungannya sehingga penulis dapat menyelesaikan studi ini. Kepada Kakak dan adik tercinta, terima kasih atas segala cinta kasih dan dorongan semangat yang diberikan selama ini.
Terima kasih kepada Prof. DR. drh. Sjamsul Bahri, MS., drh. Indraningsih, DR. R. Widiastuti, Sri Rachmawati, MSc, drh. Adin Priadi, Dra. Helmy Hamid, MSc. Dra. Masniari,MS., drh. Andriani, MSi. atas segala saran dan dorongan semangatnya, dan Zakiah Muhajan, SS,M.Hum dan seluruh staf perpustakaan BBALITVET dan IPB yang telah membantu penelusuran literatur untuk penulisan disertasi ini. Terima kasih kepada Siti Djuariah dan rekan-rekan di lab. Toksikologi,Virologi dan Bioteknologi BBALITVET atas segala bantuannya selama masa penelitian. Kepada Tati Ariyanti terima kasih atas kesediaannya menjadi proof reader pada penulisan disertasi ini. Kepada rekan-rekan program studi IPN Mbak Mar, Rahma, Ria, Rifda,Yuyun, Bu Asriani dan Mbak Susi, terima kasih untuk persahabatan yang tulus dan kerjasama yang baik selama ini. Terima kasih kepada semua pihak yang telah membantu kelancaran penelitian hingga selesainya penulisan ini.
Menyadari akan segala kekurangan yang terdapat pada penulisan disertasi ini, dimohon saran dan masukannya untuk perbaikan. Semoga disertasi ini bermanfaat khususnya bagi perkembangan IPTEK dan masyarakat pada umumnya.
Bogor, Agustus 2007
Penulis dilahirkan pada tanggal 18 Juni 1964 di Bogor sebagai putri ke enam
dari pasangan Bapak Madhari dan Ibu Rosmah. Penulis menempuh pendidikan sarjana
pada Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas
Pakuan di Bogor dan lulus pada tahun 1990. Pada tahun 1997 penulis mendapat
beasiswa AusAID untuk mengikuti pendidikan program master di School of Medicine Queensland University, Australia dan lulus pada tahun 1999. Selanjutnya, penulis berkesempatan untuk melanjutkan studi Progam Doktor pada Program Studi Ilmu
Pangan, Sekolah Pasca Sarjana Institut Pertanian Bogor pada tahun 2002 dengan
beasiswa PAATP Badan Litbang Pertanian, Departemen Pertanian.
Sejak tahun 1983 penulis bekerja sebagai teknisi di Kelti Toksikologi dan tahun
1991 mendapat promosi menjadi staf peneliti di Kelti yang sama pada Balai Besar
Penelitian Veteriner hingga saat ini. Penelitian yang dilakukan oleh penulis yaitu
bidang toksikologi, khususnya penelitian penanggulangan masalah mikotoksin dan
pengembangan metode deteksi. Sealin melaksanakan penelitian, penulis juga menjadi
anggota Perhimpunan Mikologi Kedokteran Indonesia dan Ikatan Sarjana Wanita
Indonesia. Selama masa pendidikan program S3 telah dipublikasi 2 karya ilmiah yang
berjudul “ Metode deteksi mikotoksin” dan Produksi fumonisin oleh kapang Fusarium moniliforme dan Fusarium nygamai pada medium jagung” pada jurnal Mikologi Kedokteran Indonesia tahun 2006. Karya-karya ilmiah tersebut merupakan bagian dari
disertasi yang disusun oleh penulis.
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
Latar Belakang ... 1
Perumusan Masalah ... 3
Tujuan Penelitian ... 4
Manfaat Penelitian ... 5
Hipotesis ... 5
TINJAUAN PUSTAKA ... 6
Fumonisin ... 6
Kapang Penghasil Fumonisin ... 6
Sifat Kimia Fisika ... 8
Biosintesis Fumonisin... 9
Jenis-jenis Fumonisin ... 10
Kontaminasi pada pangan/ dan pakan ... 13
Metode analisis fumonisin... 16
Imunoasai ... 19
Peran sistem imun dan antibodi ... 20
Prinsip Imunoasai ... 22
Antigen ... 23
Antibodi ... 24
Produksi Antibodi oleh Sel Limfosit B ... 25
Produksi Antibodi Monoklonal ... 29
Imunisasi ... 29
Produksi dan kultur hibridoma ... 30
Skrining antibodi ... 33
Karakterisasi dan purifikasi antibodi ... 33
Visualisasi Imunoasai ... 34
Halaman
Enzyme-Linked Immunosorbent Assay (ELISA) ... 36
Disain dan Konfigurasi ELISA ... 37
ELISA kompetitif langsung ... 37
ELISA kompetitif tak langsung ... 38
ELISA penangkap antibodi ... 40
ELISA sandwich antibodi ganda ... 40
Aplikasi ELISA untuk deteki fumonisin ... 40
Daftar Pustaka ... 42
PRODUKSI DAN ISOLASI FUMONISINB1 DARI BIAKAN KAPANG FUSARIUM VERTICILLIOIDES DAN FUSARIUM NYGAMAI PADA MEDIUM JAGUNG Abstrak ... 51
Abstract ... 51
Pendahuluan ... 52
Materi dan Metode ... 53
Hasil dan Pembahasan ... 56
Kesimpulan ... 62
Daftar Pustaka ... 62
SINTESIS ANTIGEN FUMONISIN B1-OVALBUMIN DAN FUMONISIN B1-HORSERADDISH PEROXIDASE ENZIM KONJUGAT Abstrak ... 65
Abstract ... 66
Pendahuluan ... 66
Materi dan Metode ... 68
Hasil dan Pembahasan ... 73
Kesimpulan ... 82
Halaman
PRODUKSI DAN KARAKTERISASI ANTIBODI MONOKLONAL TERHADAP FUMONSIN
Abstrak ... 86
Abstract ... 86
Pendahuluan ... 87
Materi dan Metode ... 88
Hasil dan Pembahasan ... 96
Kesimpulan ... 107
Daftar Pustaka ... 108
STANDARDISASI DAN APLIKASI METODE ELISA BERBASIS ANTIBODIMONOKLONAL UNTUK DETEKSI FUMONISIN PADA PANGAN DAN PAKAN Abstrak ... 110
Abstract ... 111
Pendahuluan ... 111
Materi dan Metode ... 112
Hasil dan Pembahasan ... 115
Kesimpulan ... 123
Daftar Pustaka ... 123
PEMBAHASAN UMUM Produksi dan Isolasi Fumonisin ... 127
Sintesis antigen FB1-Ova dan FB1-HRP enzim konjugat ... 128
Produksi hibridoma melalui fusi menggunakan polietilen glikol ... 129
Produksi dan karakterisasi antibodi monoklonal ... 130
Standardisasi dan aplikasi ELISA berbasis antibodi monoklonal untuk untuk deteksi fumonisin pada bahan pangan dan pakan ... 130
Halaman
KESIMPULAN DAN SARAN
Kesimpulan ... 134
Saran ... 135
DAFTAR PUSTAKA ... 137
DAFTAR TABEL
Halaman
1 Spesies Fusarium spp. penghasil fumonisin dan pengelompokannya……. 7
2 Jenis-jenis fumonsin dan gugus fungsinya ………... 10
3 Kontaminasi fumonisin pada berbagai jenis komoditas pertanian
yang digunakan sebagai bahan pangan maupun pakan di Indonesia ... 15
4 Perbedaan sifat antara sistem imun no spesifik dan spesifik ... 21
5 Perbedaaan sifat antara antibodi poliklonal dan monoklonal ... 29
6 Galur-galur mieloma dan limfoblastoid yang dapat digunakan untuk
produksi hibridoma ... 31
7 Perlakuan pada produksi fumonisin dengan menggunakan media jagung . 55
8 Jadual imunisasi mencit BALB/c untuk pembuatan antiserum ... 70
9 Komposisi gel elektroforesis yang digunakan untuk konfirmasi
pembentukan antigen FB1-Ova dan FB1-HRP enzim konjugat... 72
10 Pengukuran protein dari antigen FB1-Ova dengan spektrofotometer ... 78
11 Pengukuran protein dari FB1-HRP enzim konjugat dengan
spektrofotometer... ... 81
12 Program imunisasi mencit BALB/c dangan FB1-Ova secara intra vena .. 90
13 Respon antibodi yang terdeteksi pada serum mencit yang diimunisasi
Dengan FB1-Ova pada pengenceran 1:5.000 ... 97
14 Pengukuran protein dari antibodi dalam supernatan setelah pemurnian
melalui kolom HiTrap Protein A HP dengan spektrofotometer ... 102
15 Pengukuran protein dari antibodi dalam cairan asites mencit
setelah pemurnian melalui kolom HiTrap Protein A HP pada
spektrofotometer ... 103
16 Rekoveri FB1 pada sampel jagung yang dideteksi menggunakan
metode ELISA kompetitif langsung berbasis antibodi monoklonal ... 116
17 Analisis FB1 pada jagung dengan ELISA kompetitif langsung dan
KCKT ... 126
18 Konsentrasi FB1 dalam pakan ayam pedaging selama penyimpanan …… 121
DAFTAR GAMBAR
Halaman
1 Kontaminasi kapang Fusarium spp. pada jagung hibrida lokal,
morfologi F. verticillioides dan F. nygamai koleksi Bbalitvet
Culture Collection (BCC) ... 8
2. Struktur dasar fumonisin (Rheeder et al. 2002) ... 8
3 Bosintesis fumonisin (Abbas et a.l 1996) ... 9
4 Struktur kimia fumonisin B1 (EHC 2000) ... 10
5 Perbandingan struktur fumonisin dan sfingosin ... 12
6 Struktur dasar imunoglobulin (Ig) ... 25
7 Kinetika respons antibodi: Pembentukan IgM sebagai respon primer dan pembentukan IgG pada respon sekunder ... 26
8 Antigen dengan berbagai epitop ... 26
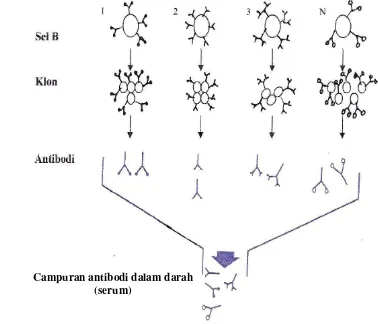
9 Produksi antibodi poliklonal oleh sel B ... 27
10 Produksi antibodi monoklonal oleh sel B ... 28
11 Struktur kimia polietilen glikol (PEG) ... 32
12 Sistem seleksi dengan medium HAT ... 33
13 Tahapan pada ELISA kompetitif langsung (Rittenberg 1990) ... 38
14 Tahapan pada ELISA kompetitif tidak langsung (Rittenberg 1990)... 39
15 Kontaminasi alami kapang Fusarium spp. pada jagung lokal ... 54
16 Pertumbuhan kapang F. moniliforme dan F. nygamai pada media PDA setelah inkubasi 7 hari pada suhu 25oC dan 37oC ... 57
17 Pertumbuhan kapang F. moniliforme dan F. nygamai pada media jagung setelah inkubasi 7 hari ... 57
18 Pola produksi FB1 oleh F. Moniliforme dan F. nygamai pada media jagung dengan suhu penyimpanan 25oC dan 37oC ... 59
19 Konsentrasi FB1 pada tiap fraksi ekstrak biakan F. verticillioides ... 60
20 Fumonisin B1 pada ekstrak biakan F. moniliforme setelah pemurnian melalui XAD-2 dan deteksi dengan HPLC ... 61
Halaman
22 Konfigurasi antigen FB1-Ova, antiserum, goat anti-mouse IgG-HRP enzim
konjugat pada dot blot immunoassay dan ELISA tidak langsung ... 76 23 Konfirmasi hasil sintesis antigen FB1-Ova ............... 77
24 Konfirmasi pembentukan FB1-HRP dan ELISA kompetitif langsung ... 79
25 Konfigurasi antibodi/antiserum, antigen, FB1-HRP enzim konjugat
pada ELISA kompetitif langsung ... 80
26 Konfirmasi pembentukan FB1-Ova dan FB1-HRP dengan
SDS-PAGE ... 82
27 Pertumbuhan sel mieloma Sp2/0-Ag14 pada fasa logaritmik dalam
medium RPMI mengandung 10% FBS ... 98
28 Proses fusi antara sel mieloma dengan sel limfosit ... 99
29 Klon-klon dari sel hibridoma yang tumbuh 6 minggu setelah fusi ... 99
30 Proses kloning dari sel hibridoma dan kultur sel dari klon 2B1F6
dalam medium RPMI mengandung 10% FBS ... 100
31 Grafik pertumbuhan sel hibridoma klon 2B1F6 yang dikultur kembali
dalam medium RPMI setelah penyimpanan dalam nitrogen cair selama
satu bulan ... 101
32 Pola grafik fraksinasi imunoglobulin G (IgG) dari supernatan pada
kolom HiTrap Protein A HP ... 102
33 Pola grafik fraksinasi imunoglobulin G1 (IgGi) dari cairan asites
pada kolom HiTrap Protein A HP ... 104
34 Uji sub kelas imunoglobulin (Ig) yang disekresikan sel hibridoma
subklon 2B1F6F7 pada supernatan dengan ELISA penangkap
menggunakan kit identifikasi subkelas imunoglobulin (Sigma) ... 105
35 Konfigurasi ELISA pada pengujian subkelas imunoglubulin dari
Antibodi monoklonal (AbMk) yang dihasilkan oleh sel hibridoma subklon
2B1F6F7 ... 105
36 Analisis imunoglobulin dalam supernatan dan asites mencit setelah
Halaman
37 Performan standar FB1 dan FB2 yang dideteksi secara ELISA
kompetitif lansung menggunakan antibodi monoklonal (supernatan)
dari subklon 2B1F6F7 ... 118
38 Pola grafik ELISA kompetitif langsung dan linearitas FB1
menggunakan antibodi monoklonal (supernatan) dari klon 2B1F6 ... 118
39 Kurva kalibrasi standar FB1 dalam matriks jagung pada pengujian
FB1 secara ELISA kompetitif langsung ... 119
40 Korelasi metode ELISA kompetitif langsung dengan menggunakan
AbMk dari klon 2B1F6 dan kromatografi cair kinerja tinggi
(KCKT) ... 120
41 Pengaruh penyimapanan terhadap konsentrasi FB1 pada pakan
DAFTAR LAMPIRAN
Halaman
1 Pembuatan pereaksi ... 150
2 Medium dan pereaksi yang digunakan untuk pembiakan sel ... 153
3 Prosedur ELISA tidak langsung untuk uji antibodi pada serum, supernatan
atau cairan asites ... 154
4 Prosedur ELISA kompetitif langsung untuk mendeteksi fumonisin... 155
5 Titer antibodi serum (antiserum) dari mencit yang diimunisasi dengan
antigen FB1-Ova ... 156
6 Pengujian antibodi yang disekresikan oleh sel hibridoma ... 157
7 Pengujian antibodi yang dihailkan oleh subklon 2B1F6F7 dalam
supernatan dan cairan asites ... 158
8 Penentuan kondisi optimum antigen, antibodi dan enzim konjugat untuk
pengujian antibodi secara ELISA tidak langsung ... 159
9 Skrining antibodi dari kultur sel hibridoma ... 160
10 Uji linieritas, sensitivitas dan IC50 secara ELISA kompetiti langsung .... 162
11 Analisis FB1 dalam pakan ayam pedaging secara ELISA kompetitif
langsung ... 163
12 Analisis FB1 dalam pakan ayam petelur secara\ ELISA kompetitif
langsung .. ... 164
13 Analisis varian (ANOVA) perlakuan penyimpanan pakan ayam pedaging
Latar Belakang
Kondisi iklim di Indonesia dengan suhu, kelembaban, dan curah hujan
yang tinggi sangat kondusif bagi pertumbuhan kapang penghasil mikotoksin.
Kontaminasi mikotoksin seringkali dijumpai pada bahan pangan dan pakan
terutama yang berasal dari produk pertanian. Hal ini perlu mendapat perhatian
karena selain berbahaya bagi kesehatan manusia dan hewan, kontaminasi
mikotoksin juga menurunkan kualitas dan kuantitas produk pertanian sehingga
berdampak bagi perekonomian.
Fumonisin merupakan salah satu mikotoksin yang ditemukan di sebagian
besar negara-negara di dunia, terutama di negara beriklim tropis dan subtropis.
Fumonisin dihasilkan oleh kapang Fusarium spp. terutama F. verticillioides (= F. moniliforme) dan F. proliferatum. Fumonisin semakin menjadi perhatian dunia dan termasuk lima mikotoksin penting yang dijadikan persyaratan mutu produk
pertanian dan hasil olahannya pada perdagangan dunia.
Fumonisin B1 (FB1) adalah jenis fumonisin yang paling toksik dan banyak
ditemukan di alam. IARC (1993) mengklasifikasikan FB1 sebagai karsinogen
golongan 2B, yaitu senyawa yang mungkin dapat menyebabkan kanker pada
manusia. Berbagai penyakit seperti kanker esofagus dan kerusakan ginjal
dilaporkan berkaitan erat dengan konsumsi bahan pangan yang terkontaminasi
FB1.
FB1 ditemukan pada berbagai komoditi pertanian, seperti jagung, beras,
gandum, sorgum, dan hasil olahannya. Selain itu, FB1 juga ditemukan pada
komoditi lainnya seperti tanaman obat dan teh hitam. Kontaminasi FB1 pada
pakan ternak menimbulkan sindroma yang disebut ”leukoencephalomalacia” (LEM) pada kuda, pembengkakan paru-paru pada babi, kanker hati dan ginjal
pada tikus, serta imunosupresi pada ayam. Selain itu juga menyebabkan adanya
residu pada daging, hati dan ginjal (Smith & Thakur 1996), serta susu (Spotti et al. 2001).
Pada umumnya konsentrasi FB1 yang terdeteksi pada jagung di atas 300
Afrika Selatan konsentrasi FB1 tertinggi 118 mg/kg pada jagung, sedangkan di
Cina berkisar antara 0,5-16 mg/kg. Ali et al. (1998) mendeteksi FB1 pada jagung
asal Jawa Tengah pada kisaran konsentrasi 0,02-2,44 mg/kg. Sedangkan
Yamashita et al. (1995) melaporkan bahwa kontaminasi FB1 pada jagung di
provinsi yang sama berkisaran antara 0,05-1,8 mg/kg. Sementara itu, rataan FB1
pada jagung yang digunakan sebagai bahan baku pakan di Jawa Barat sebesar 12,9
mg/kg (Maryam et al. 2000b).
FB1 stabil terhadap panas dan tidak rusak selama proses produksi, oleh
karena itu pemaparannya pada manusia cukup tinggi. Menurut laporan EHC
(2000) pemaparan FB1 di Kanada berkisar antara 0,017-0,089 µg/kg BB/hari,
USA 0,08 µg/kg BB/hari, Eropa 0,006-7,1 µg/kg BB/hari, dan tertinggi di Afrika
Selatan yaitu 14-440 µg/kg BB/hari. Berdasarkan data tersebut pada pertemuan
Joint FAO/WHO Expert committe on Food Additives (JECFA) tahun 2001 ditentukan batas konsumsi FB1 yaitu 2 µg/kg BB/hari.
Selain efeknya pada kesehatan manusia dan hewan, kontaminasi fumonisin
berdampak terhadap perekonomian suatu negara. Kerugian ekonomi yang dialami
Amerika mencapai US $40 juta, sedangkan kerugian yang lebih besar dilaporkan
di alami Cina, Argentina, dan negara-negara di Afrika. Hal ini disebabkan karena
semakin ketatnya standar yang diterapkan oleh negara-negara di dunia (Wu 2006).
Meskipun di Indonesia belum ada laporan mengenai kerugian ekonomi dan
mikotoksikosis pada manusia dan hewan yang disebabkan oleh fumonisin, namun
data penelitian yang mengindikasikan adanya kontaminasi FB1 pada produk
pertanian dengan konsentrasi yang tinggi akan berdampak terhadap perekonomian
nasional.
Untuk mengetahui adanya kontaminasi fumonisin pada suatu komoditi
dibutuhkan metode analisis yang dapat diandalkan. Metode analisis memiliki
peranan penting dalam menentukan kualitas produk pertanian dan hasil
olahannya. Analisis fumonisin umumnya menggunakan metode khromatografi,
seperti khromatografi cair kinerja tinggi (KCKT) atau khromatografi gas / cair
-spektroskopi massa (GC/LC-MS) yang membutuhkan peralatan dan pereaksi
yang mahal, serta waktu analisis yang lama. Metode lain seperti biosensor,
PCR-ELISA juga telah dikembangkan untuk deteksi fumonisin dan kapang Fusarium
spp. penghasil fumonisin, namun metode-metode tersebut masih jarang digunakan
karena membutuhkan ketrampilan yang tinggi.
Di antara metode analisis, imunoasai merupakan metode yang paling
mudah diaplikasikan, cepat, sensitif, spesifik dan tidak membutuhkan pereaksi
atau peralatan yang mahal (Chu 1996). Salah satu metode imunoasai yang banyak
dikembangkan yaitu enzyme-linked immunoassay (ELISA) dengan menggunakan antibodi poliklonal atau monoklonal. Penggunaan antibodi poliklonal tidak
spesifik karena dapat bereaksi positif dengan senyawa yang memiliki struktur
mirip fumonisin sehingga menyebabkan kesalahan dalam pengukuran dan kurang
sensitif. Untuk mengatasi permasalahan tersebut dikembangkan teknik ELISA
dengan menggunakan antibodi monoklonal.
Produksi antibodi monoklonal untuk deteksi fumonisin dikembangkan
dengan menggunakan imunogen FB1-KLH (Barna-Vetro et al. 2000), fumonisin
B1-cholera toxin (FB1-CT) dan anti-idiotipe. Namun, untuk proses konjugasi
dengan KLH dibutuhkan FB1 yang banyak (>700 molar). Konjugasi FB1 dengan
CT menghasilkan titer antibodi dengan sensitivitas yang rendah sehingga perlu
ditingkatkan melalui kompleks avidin dan streptavidin (Yeung & Newsome,
1995), begitu pula dengan FB1-BSA (Azcona-Olivera et al. 1992a). Oleh
karenanya diperlukan suatu protein pembawa yang dapat berkonjugasi dengan
FB1 secara mudah, aman dan ekonomis. Ovalbumin (Ova) dapat dijadikan sebagai
protein pembawa untuk membuat antigen.. Sejauh ini, FB1-Ova umumnya
digunakan sebagai antigen pelapis pada pelat ELISA (Azcona-Olivera et al. 1992) sehingga dapat diasumsikan bahwa FB1-Ova dapat menstimulasi respon imun
untuk memproduksi antibodi. Berdasarkan pertimbangan tersebut maka pada
penelitian ini digunakan FB1-Ova sebagai antigen untuk menghasilkan antibodi
monoklonal melalui produksi sel hibridoma.
Perumusan Masalah
Teknik deteksi yang cepat, sensitif dan spesifik mempunyai peranan
penting dalam mencegah dan mengurangi efek fumonisin terhadap kesehatan
yang memenuhi kriteria tersebut. Dengan deteksi cepat, kerugian dan bahaya yang
ditimbulkan oleh adanya fumonisin pada bahan pangan dan pakan dapat dimonitor
sehingga mutu dan keamanannya dapat terjaga. Pengembangan imunoasai untuk
deteksi fumonisin dapat dilakukan dengan menggunakan antibodi poliklonal
maupun monoklonal, namun ditinjau dari spesifitas dan sensitivitasnya antibodi
monoklonal lebih baik daripada antibodi poliklonal.
Untuk menghasilkan antibodi monoklonal dibutuhkan imunogen. Oleh
karena fumonisin merupakan senyawa dengan bobot molekul rendah, maka
dibutuhkan suatu protein pembawa untuk menjadikannya senyawa imunogenik
yang dapat menstimulasi pembentukan antibodi. Protein pembawa yang sering
digunakan adalah KLH dan CT. Meskipun kedua protein tersebut memberikan
respon antibodi yang baik, namun KLH sulit diperoleh dan harganya mahal
sedangkan CT bersifat toksik dan berbahaya. Ovalbumin (Ova) mempunyai
prospek yang baik untuk digunakan sebagai protein pembawa alternatif karena
dapat dikonjugasikan dengan FB1 secara mudah, ekonomis dan aman.
Tujuan Penelitian
Tujuan umum dari penelitian ini yaitu produksi antibodi monoklonal
dengan menggunakan FB1-Ova sebagai imunogen untuk mendeteksi fumonisin
pada bahan pangan atau pakan secara ELISA.
Untuk deteksi fumonisin secara ELISA tak langsung dibutuhkan antibodi
spesifik dan FB1-HRP enzim konjugat, maka tujuan khusus dari penelitian ini
adalah: (1) Sintesis antigen FB1-Ova dan FB1-HRP enzim konjugat, (2) Produksi
antibodi monoklonal menggunakan FB1-Ova sebagai antigen, (3) Penentuan
kondisi optimum dan standardisasi ELISA kompetitif langsung yang
dikembangkan untuk mendeteksi fumonisin melalui pengukuran presisi, akurasi,
sensitivitas, spesifitas, linieritas, pengaruh matriks sampel dan perbandingan
Manfaat Penelitian
Diharapkan metode imunoasai yang dikembangkan pada penelitian ini
dapat diaplikasikan untuk deteksi kontaminasi fumonisin pada bahan pangan dan
pakan. Hasil penelitian ini juga dapat dimanfaatkan oleh
laboratorium-laboratorium pengujian, para peneliti, produsen pangan dan pakan.
Hipotesis
FB1-Ova dapat digunakan sebagai antigen untuk memproduksi sel
hibridoma penghasil antibodi monoklonal yang digunakan sebagai pereaksi
Fumonisin
Fumonisin adalah kelompok mikotoksin yang dihasilkan oleh kapang
Fusarium spp. yang pertama kali diisolasi oleh Gelderbloom et al. pada tahun 1988 dari biakan F. verticillioides (F.moniliforme). Kontaminasi fumonisin tersebar luas di berbagai negara di dunia, terutama negara beriklim tropis dan sub
tropis. Fumonisin terdiri dari 4 kelompok utama, yaitu grup A, B, C, dan P. Grup
B paling banyak ditemukan di alam dan paling beracun dibandingkan kelompok
lainnya (Rheeder et al. 2002).
Kapang Penghasil Fumonisin
Fumonisin umumnya dihasilkan oleh kapang Fusarium spp. terutama F. verticillioides dan F. proliferatum. Selain Fusarium spp. kapang lainnya seperti
Alternaria alternata juga dilaporkan dapat memproduksi fumonisin selama proses metabolismenya (Abbas & Riley 1996, Mirocha et al. 1996).
Fusarium spp. merupakan kapang tidak sempurna yang hidup sebagai saprofit atau parasit terhadap inangnya. Sebagai saprofit, spora kapang ini dapat
bertahan di dalam tanah selama bertahun-tahun (soil born pathogen), membentuk konidia berwarna putih, kuning, orange, atau merah sebagai ciri dari
masing-masing spesiesnya (Pitt dan Hocking, 1997).
Infeksi Fusarium spp. biasanya dimulai sejak masa tanam (field fungi) dan menghasilkan fumonisin serta mikotoksin fusarium lainnya. Produksi
fumonisin ini terus berlanjut hingga masa penyimpanan terutama jika manajemen
pada pra-panen dan pasca-panen kurang baik. Sebagai contoh, pengendalian
kapang dan proses pengeringan yang kurang memadai merupakan faktor utama
penyebab kontaminasi fumonisin. Infeksi F. verticillioides menyebabkan busuk batang dan tongkol pada jagung (Kommedahl & Windells 1989, De Leon &
terlihat bahwa F. verticillioides, F. proliferatum, dan F. nygamai menghasilkan empat kelompok utama fumonisin, yaitu grup A, B, C, dan P.
Tabel 1 Spesies Fusarium spp. penghasil fumonisin dan pengelompokannya
Kelompok Fusarium spp. Fumonisin yang dihasilkan
Liseola
F. verticolloides FA1-3, FB1-5, iso-FB1, FAK1, FBK1, FC1,4,
FP1-3, PH1a-b
F. sacchari FB1
F. fujikoroi FB1
F. proliferatum FA1-3, FB1-5, FAK1, FBK1, FC1, FP1-3,
PH1a-b
F. subglutinans FB1
F. thapsinum FB1-3
F. anthophilum FB1-2
F. globosum FB1-3
Dlaminia
F. nygamai FA1-3, FB1-5, FAK1, FBK1, FC1, FP1,
PH1a-b
F. dlamini FB1
F. napiforme FB1
F. pseudonygamai FB1-2
F. andiyazi FB1
Elogans
F. oxysporum FA1,3-4, N-asetil- FC1, iso-FC1,
N-asetil-iso-PC1, OH-FC1, N-asetil-OH-FC1
F. oxysporum var.
redulens
FB1-j
Arthrosporiella F. polyphialidicum FB1
Sumber: Rheeder et al. 2002
Spesies kapang Fusarium yang sering ditemukan di Indonesia adalah F. verticillioides yang berpotensi menghasilkan fumonisin (Miller et al. 1993, 1996, Dharmaputera et al. 1996, Ali et al. 1998, Trisiwi 1996). Kapang F. verticillioides
dan F. nygamai yang diisolasi dari jagung asal Jawa Barat dan dibiakan pada medium jagung dapat menghasilkan fumonisin B1 masing-masing sebesar 12,80
tersebut merupakan kapang yang sangat potensil sebagai penghasil FB1, sehingga
baik untuk digunakan untuk produksi FB1. Kontaminasi kapang Fusarium spp.
pada jagung hibrida lokal, morfologi kapang F. verticillioides dan F. nygamai
terlihat pada Gambar 1.
Gambar 1 Kontaminasi kapang Fusarium spp. pada jagung lokal, morfologi
F. verticillioides dan F. nygamai dari BBALITVET Culture Collection (BCC)
Sifat Kimia Fisika
Fumonisin merupakan senyawa yang memiliki struktur kimia serupa
dengan sfingosin, yaitu senyawa yang berperan penting dalam proses metabolisme
sel. Karena kemiripan struktur keduanya, sintesis fumonisin dianalogikan melalui
jalur yang sama dengan sfingosin. Struktur inti dari senyawa fumonisin terlihat
pada Gambar 2. Senyawa-senyawa fumonisin bersifat polar, sehingga mudah larut
dalam air dan pelarut organik polar seperti metanol dan campuran asetonitril-air
(EHC 2000).
CH3 R 2 R 1
CH3 R 3
R 4
R 6 R 5
OH
[image:31.612.162.457.153.378.2]R 7
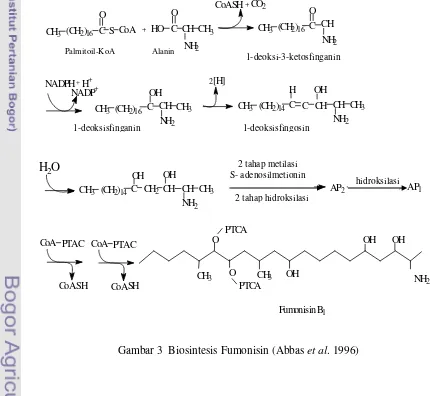
Biosintesis Fumonisin
Biosintesis fumonisin terjadi melalui proses kondensasi
heksadekanoil-koenzim A (palmitat KoA, C16) dengan serin atau alanin. Karena adanya
kemiripan struktur yang dimiliki fumonisin dan sfingosine, biosintesis fumonisin
pada tanaman terjadi melalui proses yang sama dengan sfingolipid yang terbentuk
melalui proses kondensasi heksadekanoil-koenzim A (palmitat, C16) dengan serin
atau alanin menghasilkan 1-hidroksi-2D-amino-3-okso oktadekana. Reduksi
gugus keton menghasilkan dihidrosfinganin dan sfinganin yang merupakan analog
fumonisin. Kemudian gugus amino terasetilasi dan membentuk ikatan rangkap
[image:32.612.81.511.301.697.2]pada karbon yang mengikat gugus hidroksil (Gambar 3).
Gambar 3 Biosintesis Fumonisin (Abbas et al. 1996)
CH3 (CH2)16 C
O S CoA
Stearoyl CoA
+ HO C CH3
O CH
NH2
Alanine
CoASH+CO2
(CH2)16
CH3 C
O
NH2
CH
1deoxy 3 ketosphinganine
NADPH+H+
NADP+
CH NH2
C CH3 (CH2)16
OH CH3
1deoxysphinganine
2[H]
CH3
CH3 C
NH2
CH (CH2)14
H CH OH
1 deoxysphingosine
H
2O
OH CH (CH2)14 CH
NH2
C
CH3 CH3
OH
C
CH2
methylation steps S adenosylmethionine and2hydroxylation steps
2
AP2
hydroxylation AP
1
CoA PTAC
CoASH CoASH PTAC CoA
CH3
O PTCA
PTCA
O CH3 OH
OH OH
NH2
Fumonisin B1
Palmitoil-KoA
hidroksilasi 2 tahap metilasi
S- adenosilmetionin
2 tahap hidroksilasi
1-deoksisfinganin 1-deoksisfingosin
1-deoksi-3-ketosfinganin
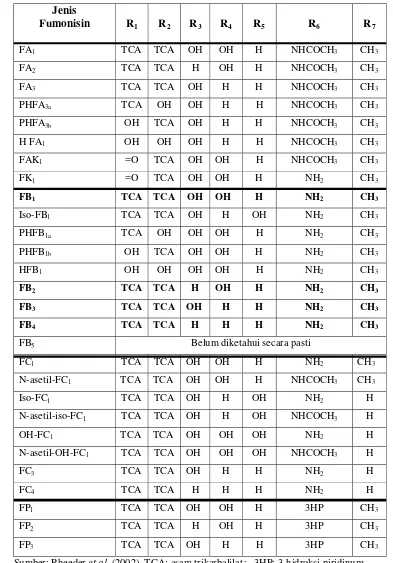
Jenis-jenis fumonisin
Hingga saat ini telah diketahui 28 jenis fumonisin yang terbagi dalam 4
kelompok utama, yaitu fumonisin group A, B, C dan P (Rheeder et al. 2002). Tabel 2 menunjukkan jenis-jenis fumonisin yang telah diketahui dengan gugus
fungsinya. Setiap jenis fumonisin memiliki gugus fungsi dan aktivitas biologis
yang berbeda. Fumonisin grup B terdiri dari fumonisin B1 (FB1), B2 (FB2), B3
(FB3), dan B4 (FB4) yang memiliki gugus amina dan paling banyak ditemukan di
alam.
Fumonisin B1
FB1 merupakan senyawa diester dari propana-1,2,3-asam trikarboksilat
dengan gugus 2-amino-12,16-dimetil-3,5,10,14,15-pentahidroksi ikosana dimana
gugus hidroksil pada C14 dan C15 teresterifikasi oleh gugus terminal dari asam
karboksilat. FB1 mempunyai bobot molekul 721 dengan rumus molekul
C34H59NO15 (Gambar 4). Di antara grup B, FB1 adalah senyawa yang paling
beracun dan dikenal dengan nama makrofusin. Hal ini disebabkan oleh gugus
hidroksil pada FB1 lebih banyak dari grup B lainnya.
OH
CH3 O
O
CH3
CCH2CHCH2COOH
O COOH
CCH2CHCH2COOH
O COOH
OH
OH
NH2
Gambar 4 Struktur kimia fumonisin B1 (EHC 2000)
FB1 merupakan serbuk higroskopik, mudah larut dalam air, campuran
metanol-air atau asetonitril-air. Kelarutannya dalam pelarut polar ini disebabkan
oleh adanya 4 gugus karboksil bebas, gugus hidroksil dan gugus amino. Dua
gugus hidroksil teresterifikasi menjadi asam propane-1,2,3-trikarboksilat. FB1 dan
FB2 stabil dalam metanol pada penyimpanan –18oC, namun mudah terdegradasi
pada suhu 25oC atau lebih. Penyimpanan yang lebih lama pada suhu 25oC dapat
Tabel 2 Jenis-jenis fumonisin dan gugus fungsinya
Jenis
Fumonisin R1 R2 R3 R4 R5 R6 R7
FA1 TCA TCA OH OH H NHCOCH3 CH3
FA2 TCA TCA H OH H NHCOCH3 CH3
FA3 TCA TCA OH H H NHCOCH3 CH3
PHFA3a TCA OH OH H H NHCOCH3 CH3
PHFA3b OH TCA OH H H NHCOCH3 CH3
H FA1 OH OH OH H H NHCOCH3 CH3
FAK1 =O TCA OH OH H NHCOCH3 CH3
FK1 =O TCA OH OH H NH2 CH3
FB1 TCA TCA OH OH H NH2 CH3
Iso-FB1 TCA TCA OH H OH NH2 CH3
PHFB1a TCA OH OH OH H NH2 CH3
PHFB1b OH TCA OH OH H NH2 CH3
HFB1 OH OH OH OH H NH2 CH3
FB2 TCA TCA H OH H NH2 CH3
FB3 TCA TCA OH H H NH2 CH3
FB4 TCA TCA H H H NH2 CH3
FB5 Belum diketahui secara pasti
FC1 TCA TCA OH OH H NH2 CH3
N-asetil-FC1 TCA TCA OH OH H NHCOCH3 CH3
Iso-FC1 TCA TCA OH H OH NH2 H
N-asetil-iso-FC1 TCA TCA OH H OH NHCOCH3 H
OH-FC1 TCA TCA OH OH OH NH2 H
N-asetil-OH-FC1 TCA TCA OH OH OH NHCOCH3 H
FC3 TCA TCA OH H H NH2 H
FC4 TCA TCA H H H NH2 H
FP1 TCA TCA OH OH H 3HP CH3
FP2 TCA TCA H OH H 3HP CH3
FP3 TCA TCA OH H H 3HP CH3
Toksisitas Fumonisin B1
Informasi mengenai toksikokinetik FB1 pada hewan masih sangat terbatas
dan belum jelas. Pada tubuh hewan penyerapan FB1 sangat rendah, namun
distribusi dan elminasinya pada beberapa spesies sangat cepat seperti pada ayam
petelur, babi, sapi, tikus dan primata (EHC 2000). Toksisitas fumonisin
disebabkan oleh struktur kimianya yang menyerupai sfingosin, yaitu enzim yang
berperanan penting dalam proses metabolisme sel. Gambar 5 memperlihatkan
persamaan struktur inti antara fumonisin dan sfingosin.
OH
CH3 O
O
CH3
CCH2CHCH2COOH
O COOH
CCH2CHCH2COOH
O COOH
R1
R2
NHR3
Fumonisin
Gambar 5 Perbandingan Struktur Fumonisin dan Sfingosin
Karena kemiripan struktur tersebut, fumonisin berkompetisi dengan
sfingosin dan mempengaruhi pembentukan sfingolipid melalui penghambatan
kerja sfinganin-N-asiltransferase (seramid sintase). Sfingolipid merupakan
senyawa pemberi sinyal yang dapat dikenali oleh sel-sel imun dan tempat
menempelnya mikroba penyebab penyakit dan racun-racun mikroba (Schroeder et al. 1994, Merril et al. 1997b).
Dengan terhambatnya pembentukan sfingolipid menakibatkan terjadinya
penurunan kekebalan terhadap penyakit infeksius dan penimbunan sfingosin yang
mengakibatkan berbagai penyakit diantaranya kanker esofagus dan radang ginjal
pada manusia seperti di Afrika Selatan dan Cina (Marasas 1995, Zhang et al. NH2
OH OH
1997). Penyakit pada hewan yang ditimbulkan oleh fumonisin diantaranya
leukoencephalomalacia (LEM) pada kuda (Uhlinger 1997), pembengkakan paru-paru pada babi (porcine pulmonary edema, PPE) (Smith et al. 1999), kanker hati pada tikus (Gelderblom 1996b), dan penurunan sistem kekebalan pada ayam
(Merril et al. 1997b; Martinova et al. 1998; Eriksen & Alexander, 1998). Oleh karena itu peningkatan rasio sfinganin / sfingosin (Sa/So) dalam serum dan
jaringan dapat dijadikan sebagai bioindikator mikotoksikosis yang disebabkan
oleh FB1 (Tang et al. 2005).
Toksisitas FB1 dapat terjadi karena adanya pemaparan dosis tunggal
maupun atau dengan pemaparan berulang karena adanya kontaminasi pada bahan
pangan/pakan. Dosis tunggal FB1 1,25 mg/kg yang diberikan secara intra vena
pada tikus jantan (Sprague-Dowley) menunjukkan adanya lesi yang parah pada
ginjal, peningkatan proliferasi sel esofagus, dan peningkatan mitosis baik pada
esofagus maupun pada hati (Lim et al. 1996).
Pada pemaparan berulang, kerusakan pada organ hati (hepatotoksik) dan
ginjal (nefrotoksik) terlihat pada tikus yang diberi FB1 50 mg/kg bobot badan
selama lebih dari 11 hari (Gelderblom et al. 1994). Sementara itu, efek imunosupresi terlihat pada ayam pedaging yang diberi ransum dari biakan F. verticillioides (MRC 826) mengandung FB1 30-300 mg/kg, dimana terjadi
penurunan bobot limpa dan bursa, serta meningkatnya parameter-parameter
hematologi (Espada et al. 1997). Pada babi, efek imunosupresi juga terjadi setelah pemberian ransum terdiri dari biakan kapang yang sama dengan konsentrasi FB1
sebanyak 1 mg/kg, dimana terlihat penurunan kemampuan eliminasi
Pseudomonas aeruginosa dan penghambatan fungsi sel-sel makrofag pada intravaskuler paru-paru (Rotter et al. 1996, Smith et al. 1996). Penghambatan fungsi sel-sel makrofag ini dapat meningkatkan kepekaan terhadap penyakit
mikrobial (Smith et al. 1996c).
Kontaminasi Fumonisin pada Bahan Pangan dan Pakan
Kontaminasi FB1 banyak dijumpai pada jagung (Gutema et al. 2000,
Hennigen et al. 2000, Shephard et al. 2000), beras (Desjardin et al. 2000, Abbas
2000), serta hasil olahannya (Sugita-Konishi et al. 2006). Selain itu, FB1 juga
ditemukan pada tanaman obat, teh hitam (Martins et al. 2001), dan bir yang dihasilkan dari fermentasi gandum terkontaminasi FB1 (Torres et al. 1998).
Kontaminasi FB1 juga terdapat pada pakan (Labuda et al., 2005). Sebagai akibat
dari pemberian pakan yang terkontaminasi fumonisin ditemukan adanya residu
pada produk peternakan seperti susu (Spotti et al. 2001) dan daging, hati dan ginjal (Smith & Thakur 1996). Umumnya residu FB1 pada produk peternakan
rendah, namun hasil hidrolisisnya yaitu HFB1 memiliki toksisitas yang lebih
tinggi sehingga perlu diwaspadai pengaruhnya terhadap kesehatan (Maragos et al. 1996).
Kontaminasi fumonisin pada jagung dan produk olahannya telah
dilaporkan di berbagai negara di dunia. Di USA, konsentrasi FB1 pada produk
pangan asal jagung (corn-based products) berkisar antara 0,075-5,916 mg/kg (Castelo et al. 1998), Amerika Latin 0,07-38,5 mg/kg, dan Amerika Utara 0,004-330 mg/kg. Sedangkan di Asia kontaminasi FB1 berkisar 0,01-153 mg/kg dan
Eropa 0,007-250 mg/kg (EHC 2000). Di Australia, cemaran fumonisin pada
jagung berkisar antara 1–40 mg/kg dan hasil olahannya 0,85-5,8 (Maryam 1999),
sedangkan jagung dari kasus ELEM di New South Wales konserntrasi FB1
mencapai 164 mg/kg (Bryden et al. 1995).
Diperkirakan pemaparan FB1 di USA 0,08 µg/kg BB/hari, Kanada berkisar
antara 0,017-0,089 µg/kg BB/hari, Eropa 0,006-7,1 µg/kg BB/hari, dan yang
tertinggi di Afrika Selatan yaitu 14-440 µg/kg BB/hari (EHC 2000).
Di Indonesia meskipun belum ada laporan mengenai mikotoksikosis pada
manusia dan hewan yang disebabkan oleh fumonisin, namun Ali et al. (1998) telah berhasil mengisolasi kapang F. verticillioides dan mendeteksi FB1 pada
jagung asal Yogyakarta, Purworejo, dan Surakarta dengan konsentrasi FB1
0,016-2,44 mg/kg. Demikian pula Yamashita et al. (1995) telah mendeteksi FB1 pada
jagung dari Jawa Tengah dengan kisaran konsentrasi 0,05-1,8 mg/kg. Secara
umum, kontaminasi fumonisin pada berbagai bahan pangan dan pakan di Pulau
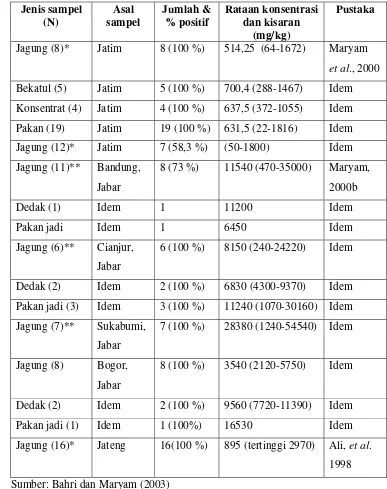
Jawa dapat dilihat pada Tabel 3. Pada tabel tersebut terlihat bahwa FB1 tertinggi
ditemukan pada jagung asal Jawa Barat (54,54 g/kg) yang digunakan sebagai
Fusarium sp. berwarna merah muda keunguan (Maryam et al. 2000). Sedangkan konsentrasi tertinggi FB1 pada jagung yang digunakan sebagai bahan dasar pangan
[image:38.612.122.509.195.684.2]sebesar 2,97 g/kg (Ali et al. 1998).
Tabel 3 Kontaminasi Fumonisin pada berbagai komoditas pertanian yang digunakan sebagai bahan pangan maupun pakan di Indonesia
Jenis sampel (N) Asal sampel Jumlah & % positif Rataan konsentrasi dan kisaran (mg/kg) Pustaka
Jagung (8)* Jatim 8 (100 %) 514,25 (64-1672) Maryam
et al., 2000
Bekatul (5) Jatim 5 (100 %) 700,4 (288-1467) Idem
Konsentrat (4) Jatim 4 (100 %) 637,5 (372-1055) Idem
Pakan (19) Jatim 19 (100 %) 631,5 (22-1816) Idem
Jagung (12)* Jatim 7 (58,3 %) (50-1800) Idem
Jagung (11)** Bandung,
Jabar
8 (73 %) 11540 (470-35000) Maryam,
2000b
Dedak (1) Idem 1 11200 Idem
Pakan jadi Idem 1 6450 Idem
Jagung (6)** Cianjur,
Jabar
6 (100 %) 8150 (240-24220) Idem
Dedak (2) Idem 2 (100 %) 6830 (4300-9370) Idem
Pakan jadi (3) Idem 3 (100 %) 11240 (1070-30160) Idem
Jagung (7)** Sukabumi,
Jabar
7 (100 %) 28380 (1240-54540) Idem
Jagung (8) Bogor,
Jabar
8 (100 %) 3540 (2120-5750) Idem
Dedak (2) Idem 2 (100 %) 9560 (7720-11390) Idem
Pakan jadi (1) Idem 1 (100%) 16530 Idem
Jagung (16)* Jateng 16(100 %) 895 (tertinggi 2970) Ali, et al. 1998
Sumber: Bahri dan Maryam (2003)
Kontaminasi fumonisin seringkali ditemukan bersama-sama dengan
aflatoksin (Johansson dan Whitaker, 2006; Abbas et al. 2002, Li et al. 2001, Maryam et al. 2000) dan mikotoksin lain seperti okratoksin, zearalenon, dan deoksinivalenol (Sugita-Konishi et al. 2006, Park et al. 2002). Hal ini sangat mengkhawatirkan, karena adanya beberapa mikotoksin secara bersamaan dalam
suatu komoditi dapat saling bersinergi sehingga memperkuat efek toksik.
Metode Analisis Fumonisin
Metode analisis mempunyai peranan yang penting untuk mengetahui
secara kualitatif dan kuantitatif adanya kontaminasi fumonisin dalam bahan
pangan dan pakan, serta membantu diagnosis penyakit yang ditimbulkannya.
Secara umum metode analisis meliputi ekstraksi dan deteksi dengan menggunakan
instrumen atau peralatan tertentu.
Ekstraksi
Karena tingkat polaritasnya yang tinggi, ekstraksi fumonisin umumnya
dilakukan dengan menggunakan campuran metanol-air atau asetonitril-air
terutama untuk analisis secara khromatografi. Gutema et al. (2000) dan Desjardin
et al. (2000) menggunakan campuran pelarut asetonitril-air (1:1) untuk mengekstrak fumonisin dari jagung yang diikuti pemurnian melalui kolom solid phase extraction (SPE) C18. Sedangkan Shephard et al. (2000), Martins et al.
(2001), dan Sugita-Konishi et al. (2006) menggunakan campuran methanol-air (3:1) yang diikuti dengan pemurnian melalui kolom SPE penukar anion kuat
(SAX).
Deteksi
Deteksi fumonisin umumnya dilakukan dengan menggunakan teknik
khromatografi seperti kromatografi lapis tipis (KLT), khromatografi cair kinerja
tinggi (KCKT) dan khromatografi gas/cair yang dihubungkan dengan
spektroskopi massa (GC/LC-MS). Selain untuk analisis kuantitatif LC-MS dapat
Teknik khromatografi ini merupakan metode yang umum digunakan untuk
mendeteksi fumonisin. Meskipun metode ini dapat memberikan hasil secara
kualitatif dan kuantitatif dari tiap jenis fumonisin, namun membutuhkan pereaksi
dan peralatan yang mahal, serta waktu analisis yang lama.
Metode lain seperti biosensor (van der Gaag et al. 2003), imunosensor (Maragos & Thompson 1999), imunohistokimia (Buim et al. 1999), polymerase chain reaction (PCR)(Bluhm et al. 2002, Patino et al. 2004) atau PCR-ELISA (Grimm & Geisen 1998) telah dikembangkan untuk deteksi fumonisin dan kapang
Fusarium spp. penghasil fumonisin, namun metode tersebut jarang digunakan karena membutuhkan ketrampilan dan pengalaman yang tinggi.
Di antara metode analisis, imunoasai merupakan metode yang paling
menguntungkan karena mudah diaplikasikan, cepat, sensitif, spesifik, dan tidak
membutuhkan pereaksi atau peralatan yang mahal (Chu 1996). Salah satu metode
imunoasai yang banyak dikembangkan yaitu enzyme-linked immunoassay
(ELISA) dengan menggunakan antibodi poliloklonal atau monoklonal.
Kromatografi Lapis Tipis (KLT)
KLT merupakan teknik kromatografi yang paling mudah diaplikasikan
untuk mendeteksi fumonisin. Teknik ini umumnya digunakan untuk analisis
kualitatif dan semi kuantitatif. Pemisahan pada KLT didasarkan pada distribusi
komponen pada lempeng KLT dengan pelarut, yang diindikasikan dengan faktor
hambatan (Rf). Lempeng KLT yang digunakan dapat berupa lempeng KLT fasa
normal (Silika gel 60) atau fasa terbalik (C18). Untuk visualisasi, digunakan
p-anisaldehida (Sydenham et al. 1990) jika menggunakan KLT fasa normal, atau fluoresamin untuk menambah fluoresensi pada pengamatan di bawah sinar ultra
violet jika menggunakan lempeng KLT fasa terbalik (Shephard & Sewram 2004).
Khromatografi gas
Deteksi fumonisin dengan kromatografi gas dilakukan menggunakan
kolom fused-silica capillary yang melibatkan hidrolisis asam dari fumonisin untuk melepas ikatan esternya yang dilanjutkan dengan deteksi TCA yang
mendeteksi fumonisin dengan melakukan isolasi inti fumonisin (aminopoliol)
yang diperoleh melalui hidrolisis alkalis pada resin XAD-2, dan kemudian
mengubahnya menjadi derivatif trimetilsilil untuk dianalisis dengan kromatografi
gas. Metode ini tidak dapat digunakan untuk mendeteksi inti FB2 dan FB3 sebagai
derivatif sililnya.
Khromatografi cair kinerj tinggi (KCKT)
KCKT atau yang lebih dikenal dengan high performance liquid
chromatography (HPLC) merupakan metode analisis yang berdasarkan pada perbedaan distribusi senyawa yang disebabkan oleh adanya interaksi senyawa
pada fasa gerak (mobile phase) dan fasa diam (stationary phase). Deteksi fumonisin dengan KCKT meskipun dapat memberikan hasil yang sangat
memuaskan, namun teknik ini membutuhkan proses preparasi yang panjang
dengan pereaksi dan peralatan yang mahal. Karena fumonisin tidak memiliki
serapan pada gelombang ultra violet, deteksinya dengan KCKT dilakukan melalui
proses derivatisasi menggunakan fluorescamine (Shephard et al. 1990, Sydenham
et al. 1990) atau o-ftaldialdehida (Hopmans & Murphy 1993) untuk meningkatkan daya fluoresensi pada detektor fluoresensi. Dengan menggunakan
naftalen-2,3-dikarboksaldehida dengan KCN sebagai bahan penderivatisasi sensitivitas dapat
ditingkatkan hingga 50 pg (Shephard et al. 1990), namun reaksi menggunakan KCN tidak dianjurkan karena bersifat sangat toksik. Selain menggunakan detektor
fluoresensi, deteksi fumonisin dapat juga dilakukan dengan menggunakan
detektor ultraviolet (UV) melalui proses derivatisasi yang melibatkan reaksi
amina primer sebelum dipisahkan dalam kolom. Derivat maleil yang terbentuk
dideteksi dan dikuantifikasi pada detektor UV dengan limit deteksi 10 μg/kg.
Metode ini kurang sensitif sehingga tidak dapat digunakan untuk analisis
fumonisin pada sampel yang terkontaminasi fumonisin secara alami (Gelderblom
et al. 1988).
Khromatografi cair-spektroskopi massa
Pada umumnya, deteksi fumonisin dengan menggunakan KLT dan KCKT
menggunakan interface MS pada KCKT, deteksi fumonisin dapat dilakukan tanpa derivatisasi (Shephard 1998, Masayo et al. 2006). Selain untuk analisis kuantitatif, LC-MS juga digunakan untuk konfirmasi struktur fumonisin.
Salah satu metode LC-MS yang digunakan untuk analisis fumonisin
adalah fast atom bombardment (FAB-MS). Dengan menggunakan metode ini limit deteksi fumonisin pada jagung yang terkontaminasi secara alami melalui
SAX clean up sekitar 100 ng/g (Plattner & Branham 1994). Korfmacher et al. (1991) membandingkan teknik thermospray (TS) dan electronspray (ES) untuk mendeteksi fumonisin. Berdasarkan studi tersebut terlihat bahwa ES-MS dapat
mendeteksi FB1 hingga level nanogram dengan memberikan sinyal ion molekul
dan fragmentasi yang sedikit. Sebaliknya, dengan TS-MS terbentuk fragmen yang
banyak dan sensitifitasnya hanya mencapai level sub-mikrogram. Namun dengan
menggunakan mode ion negatif dan campuran ammonium asetat-asetonitril
sebagai fasa bergerak, limit deteksi TS-MS dapat diperkecil menjadi 2 ng (Thakur
& Smith 1994). Metode ES-MS yang telah divalidasi mampu mendeteksi
fumonisin hingga level nanogram dan juga dapat mengkonfirmasi identitas
fumonisin yang terdeteksi dalam sampel yang dianalisis (Musser et al. 2002). Pada proses produksi pangan asal jagung, fumonisin bereaksi dengan
komponen pangan seperti gula dan protein sehingga tidak dapat terdeteksi dengan
metode KCKT. Dall’Asta et al. (2006) mengembangkan metode LC/ESI/MS/MS untuk mendeteksi fumonisin dalam produk pangan asal jagung seperti corn-flakes, tortilla chips dan corn chips.
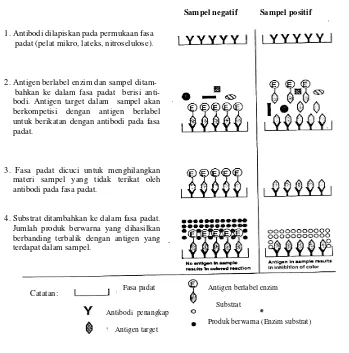
Imunoasai
Imunoasai yaitu teknik analisis dengan menggunakan pereaksi yang
dihasilkan oleh sistem imun, yaitu antibodi. Aplikasi imunoasai sangat luas
terutama di bidang kedokteran, baik untuk diagnosis maupun terapi suatu
penyakit. Namun, selama dua dekade terakhir teknik imunoasai telah
dikembangkan untuk analisis forensik, veteriner, cemaran pangan, dan produk
pertanian (Rittenburg 1990, Grothaus et al. 2006).
Dibandingkan dengan metode analisis lainnya, imunoasai memiliki
memiliki spesifitas dan sensitifitas yang tinggi. Metode imunoasai dikembangkan
dengan menggunakan antibodi poliklonal atau monoklonal.
Peran Sistem Imun dan Produksi Antibodi
Sistem imun adalah suatu sistem pertahanan yang terdiri dari sel, molekul,
dan jaringan yang berperan untuk melawan infeksi yang ditimbulkan oleh
berbagai bahan dalam lingkungan hidup. Sistem imun terbagi atas sistem imun
nonspesifik (natural/innate/native) dan spesifik (adaptive/acquired). Sistem imun nonspesifik merupakan sistem pertahanan tubuh terdepan yang dapat memberi
respon secara langsung terhadap masuknya molekul asing atau mikroorganisme.
Sedangkan sistem imun spesifik terbentuk karena proses adaptasi molekuler oleh
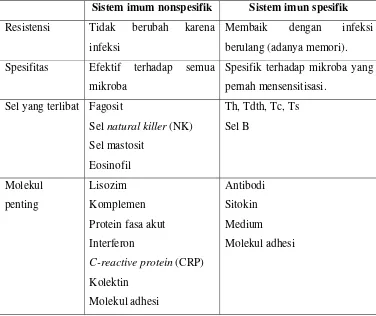
sel-sel imun terhadap bahan asing yang masuk (Baratawidjaja 2004). Tabel 4
menunjukkan perbedaan sifat antara sistem imun nonspesifik dengan sistem imun
spesifik.
Di dalam tubuh terdapat tiga jenis sel yang berperan penting dalam sistem
imun yaitu limfosit, sel plasma dan makrofag yang berasal dari sel progeni dalam
sumsum tulang, bersirkulasi dalam darah dan masuk ke dalam organ ketika
diperlukan. Limfosit memiliki kemampuan mengenali setiap antigen melalui
permukaan reseptornya yang spesifik. Ada dua jenis limfosit, yaitu limfosit B
yang dapat mensekresi antibodi spesifik dan limfosit T yang tidak menghasilkan
antibodi namun dapat berproliferasi dan berdiferensiasi jika ada antigen dengan
melepas senyawa yang disebut limfokin. Dalam hal ini, fungsi sel T adalah
membantu sel B untuk mensintesis antibodi dengan mengatur respon imun.
Sementara itu, peran makrofag sangat penting dalam sistem imun spesifik. Sel ini
menelan antigen dan mentransfer materi antigen tersebut pada sel T sehingga
terjadi aktivasi sel T yang kemudian diteruskan dengan aktivasi sel B
Tabel 4 Perbedaan sifat antara sistem imun nonspesifik dan spesifik
Sistem imum nonspesifik Sistem imun spesifik
Resistensi Tidak berubah karena
infeksi
Membaik dengan infeksi
berulang (adanya memori).
Spesifitas Efektif terhadap semua
mikroba
Spesifik terhadap mikroba yang
pernah mensensitisasi.
Sel yang terlibat Fagosit
Sel natural killer (NK) Sel mastosit
Eosinofil
Th, Tdth, Tc, Ts
Sel B
Molekul
penting
Lisozim
Komplemen
Protein fasa akut
Interferon
C-reactive protein (CRP) Kolektin
Molekul adhesi
Antibodi
Sitokin
Medium
Molekul adhesi
Sumber: Baratawidjaja (2004)
Sistem imun spesifik terdiri atas humoral dan seluler. Sistem imun spesifik
humoral dihasilkan oleh sel B yang berproliferasi jika bertemu dengan antigen dan
berkembang menjadi sel plasma penghasil antibodi yang banyak dijumpai dalam
serum. Antibodi ini berperan penting dalam sistem pertahanan terhadap virus,
bakteri ekstraseluler dan menetralisir toksin yang dihasilkannya. Sistem imun
spesifik seluler diperankan oleh sel T yang dihasilkan oleh sel asal di dalam
sumsum tulang yang berproliferasi dan berdiferensiasi di dalam kelenjar timus.
Sel T yang telah dewasa ke luar dari timus dan masuk ke dalam peredaran darah.
Jika bertemu dengan antigen, sel T akan tersensitisasi, berproliferasi dan memberi
sinyal pada sel B untuk memproduksi antibodi. Sistem imun spesifik seluler ini
berfungsi sebagai pertahanan terhadap bakteri intraseluler, virus, jamur dan parasit
Prinsip Imunoasai
Sifat antibodi yang dapat mengikat antigen spesifik di dalam tubuh
merupakan dasar dari metode analisis secara imunoasai karena reaksi ini juga
dapat terjadi di luar tubuh. Dalam hal ini, antigen dapat merupakan agen penyakit,
cemaran mikroba, senyawa kimia atau kontaminan alami seperti mikotoksin.
Antibodi yang digunakan dapat berupa antibodi poliklonal atau monoklonal.
Prinsip analisis secara imunoasai berdasarkan reaksi antigen dengan
antibodi spesifik terhadap antigen tersebut yang membentuk kompleks
antigen-antibodi (Barna-Vetro 2002). Dinamika reaksi pengikatan antigen-antibodi-antigen pada
antigen sederhana yang hanya mempunyai satu determinan antigen mengikuti
persamaan reaksi sebagai berikut:
[Ab] + [Ag] [AbAg]
dimana [Ab] adalah konsentrasi antibodi bebas (mol/L), [Ag] adalah konsentrasi
antigen antigen bebas, dan [AbAg] merupakan konsentrasi kompleks
antibodi-antigen, sedangkan Ka dan Kd adalah konstanta asosiasi dan disosiasi. Rasio
Ka/Kd merupakan konstanta keseimbangan atau konstanta affinitas (K) dengan nilai yang diturunkan melalui persamaan:
Ka [AbAg]
Kd [Ab][Ag]
Nilai K berkisar antara 103-107 liter/mol dan konstanta antibodi yang baik untuk
pengukuran secara imunoasai berkisar antara 106-108 liter/mol. Konstanta affinitas ini berhubungan langsung dengan spesifitas dan sensitivitas (Roitt 1991,
Rittenburg 1990). Ikatan antigen-antibodi dalam imunoasai terjadi karena adanya
kekuatan intermolekuler seperti elektrostatik, ikatan hidrogen, sifat hidrofobik,
dan gaya Van der Waals (Roitt 1991).
Berdasarkan interaksi antigen-antibodi, imunoasai dapat dibagi menjadi
dua kategori yaitu berdasarkan interaksi primer dan interaksi sekunder.
Pengukuran imunoasai berdasarkan interaksi primer dapat dilakukan secara
langsung, sedangkan yang berdasar pada interaksi sekunder, dilakukan secara
tidak langsung. Pada umumnya, pengukuran imunoasai berdasarkan interaksi Ka
Kd
primer, contohnya pengukuran melalui presipitasi, aglutinasi, radioimunoasai
(RIA) dan ELISA (Rittenburg 1990).
Antigen
Antigen atau imunogen adalah bahan yang dapat memicu pembentukan
respon imun atau bahan yang dapat bereaksi dengan antibodi. Secara fungsional,
antigen dibedakan menjadi imunogen dan hapten. Imunogen umumnya
merupakan suatu protein yang memiliki ukuran molekul yang besar, sedangkan
hapten merupakan senyawa kimia dengan ukuran kecil, tidak bersifat imunogenik
sehingga tidak dapat mengaktifkan sel B untuk memproduksi antibodi. Agar dapat
memicu pembentukan antibodi, suatu hapten harus dikonjugasikan dengan
molekul besar yang disebut molekul pembawa. Molekul pembawa umumnya
protein yang bersifat multivalen dan imunogenik, contohnya keyhole limpet hemocyanin (KLH), tiroglobulin, ovalbumin dan imunoglobulin ayam (Rittenburg 1990). Hapten dikenal oleh sel B sedangkan molekul pembawa oleh sel T. Hapten
membentuk epitop pada permukaan molekul pembawa yang dikenali oleh sistem
imun sehingga merangsang pembentukan antibodi. Daerah ini dapat bereaksi
secara spesifik dengan reseptor antigen (Baratawidjaja 2004). Di antara senyawa
hapten yaitu kontaminan pada bahan pangan dan pakan seperti mikotoksin,
pestisida, antibiotik dan senyawa lain dengan bobot molekul rendah.
Berdasarkan epitopnya antigen terbagi atas empat jenis, yaitu (1)
Unideterminan univalen, antigen yang hanya memiliki satu jenis epitop pada tiap
molekulnya (hapten); (2) Unideterminan multivalen, antigen yang memiliki lebih
dari dua epitop yang sama pada satu molekulnya ; (3) Multideterminan univalen:
antigen yang memiliki beberapa epitop yang berbeda, tetapi masing-masing hanya
satu pada tiap molekul