KARAKTERISASI DAN UJI EFEK EKSTRAK ETANOL
TERIPANG JENIS
Pearsonothuria graeffei (
Semper)
TERHADAP PENURUNAN KADAR GLUKOSA
DARAH MENCIT YANG DIINDUKSI
ALOKSAN
SKRIPSI
OLEH:
CLAUDIA NATASYA TOBING
NIM 131524005
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KARAKTERISASI DAN UJI EFEK EKSTRAK ETANOL
TERIPANG JENIS
Pearsonothuria graeffei (
Semper)
TERHADAP PENURUNAN KADAR GLUKOSA
DARAH MENCIT YANG DIINDUKSI
ALOKSAN
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
CLAUDIA NATASYA TOBING
NIM 131524005
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
KARAKTERISASI DAN UJI EFEK EKSTRAK ETANOL
TERIPANG JENIS
Pearsonothuria graeffei (
Semper)
TERHADAP PENURUNAN KADAR GLUKOSA
DARAH MENCIT YANG DIINDUKSI
ALOKSAN
OLEH:
CLAUDIA NATASYA TOBING NIM 131524005
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada tanggal: 31 Agustus 2015
Pembimbing I, Panitia Penguji,
Dra. Suwarti Aris, M.Si., Apt. Prof. Dr. Urip Harahap, Apt. NIP 195107231982032001 NIP 195301011983031004
Dra. Suwarti Aris, M.Si., Apt.
Pembimbing II, NIP 195107231982032001
Prof. Dr. Rosidah, M.Si., Apt. Dr. Poppy Anjelisa Z. Hasibuan, M.Si., Apt NIP 195103261978022001 NIP 197506102005012003
Drs. Suryadi Achmad, M.Sc., Apt. NIP 195109081985031002
Medan, Oktober 2015 Fakultas Farmasi
Universitas Sumatera Utara Pejabat Dekan,
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa yang telah memberikan
karunia yang berlimpah sehingga penulis dapat menyelesaikan penyusunan skripsi
yang berjudul Karakterisasi dan Uji Efek Ekstrak Etanol Teripang Jenis
Pearsonothuria graeffei (Semper) terhadap Penurunan Kadar Glukosa Darah
Mencit yang Diinduksi Aloksan. Skripsi ini diajukan sebagai salah satu syarat
untuk memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas
Sumatera Utara.
Pada kesempatan ini, dengan segala kerendahan hati penulis mengucapkan
terima kasih yang sebesar-besarnya kepada Ibu Dr. Masfria, M.S., Apt. selaku
Pejabat Dekan Fakultas Farmasi yang telah menyediakan fasilitas kepada penulis
selama perkuliahan di Fakultas Farmasi. Penulis juga mengucapkan terima kasih
kepada Ibu Dra. Suwarti Aris, M.Si., Apt., dan Prof. Dr. Rosidah, M.Si., Apt.,
yang telah meluangkan waktu dan tenaga dalam membimbing penulis dengan
penuh kesabaran dan tanggung jawab, memberikan petunjuk dan saran-saran
selama penelitian hingga selesainya skripsi ini. Ucapan terima kasih juga penulis
sampaikan kepada Bapak Prof. Dr. Urip Harahap, Apt. selaku ketua penguji, Ibu
Dr. Poppy Anjelisa Z. Hasibuan, M.Si., Apt. dan Bapak Drs, Suryadi Achmad,
M.Sc., Apt. selaku anggota penguji yang telah memberikan saran untuk
menyempurnakan skripsi ini, dan Bapak Dadang Irfan Husori, S.Si.,M.Sc., Apt.
selaku dosen pembimbing akademik serta Bapak dan Ibu staf pengajar Fakultas
Farmasi USU yang telah banyak membimbing penulis selama masa perkuliahan
Penulis juga mempersembahkan rasa terima kasih yang tak terhingga
kepada keluarga tercinta almarhum Ayahanda Junias Rosihar Lumban Tobing,
Ibunda Clementina Sidabutar, S.Pd., M.M., kedua adikku Tommy Julio Lumban
Tobing, dan Prita Uli Tobing, serta Inangtua Esther Sonmeavanti Sidabutar
sekeluarga, Tante Silvia Sidabutar sekeluarga, Opungku P.L.Tobing br Sitompul,
Opungku K. Sidabutar br Manik dan Namboru Shelly Farida Tobing sekeluarga
atas limpahan kasih sayang, semangat dan doa yang tak ternilai dengan apa pun.
Penulis juga mengucapkan terima kasih kepada keluarga besar Palembang dan
teman-teman mahasiswa/i Farmasi Ekstensi Stambuk 2013 yang selalu memberi
dukungan dan canda tawa.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini masih belum
sempurna, oleh karena itu penulis mengharapkan saran dan kritik yang
membangun demi kesempurnaan skripsi ini. Akhir kata penulis berharap semoga
skripsi ini bermanfaat bagi ilmu pengetahuan khususnya di bidang farmasi.
Medan, 31 Agustus 2015
Penulis,
Claudia Natasya Tobing
KARAKTERISASI DAN UJI EFEK EKSTRAK ETANOL TERIPANG JENIS Pearsonothuria graeffei (Semper) TERHADAP PENURUNAN
KADAR GLUKOSA DARAH MENCIT YANG DIINDUKSI ALOKSAN
ABSTRAK
Teripang banyak ditemukan di perairan Indonesia, salah satunya jenis Pearsonothuria graeffei. Masyarakat mengkonsumsi teripang sebagai bahan pangan dan belum digunakan sebagai bahan obat. Kandungannya adalah triterpenoid saponin, glikolipid dan kondroitin sulfat. Tujuan Penelitian ini adalah mengetahui karakterisasi simplisia, pemeriksaan golongan senyawa kimia, pembuatan ekstrak etanol dan uji efek antidiabetes teripang Pearsonothuria graeffei.
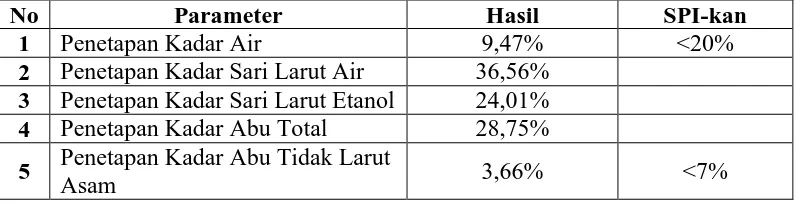
Hasil karakterisasi simplisia teripang terhadap kadar air 9,47 %, kadar sari larut air 36,56 %, kadar sari larut etanol 24,01 %, kadar abu total 28,75 %, dan kadar abu tidak larut asam 3,66 %. Mikroskopik serbuk simplisia yakni spikula bentuk kancing (buttons), spikula dari tentakel dan spikula bentuk meja semu (pseudo-tables). Hasil pemeriksaan golongan senyawa kimia simplisia teripang mengandung glikosida, saponin dan triterpenoid/steroid.
Pada uji toleransi glukosa sebagai pembandingnya glibenklamid 0,65 mg/kg BB. Hewan uji dibagi menjadi 5 kelompok, terdiri dari 25 ekor. Dengan pemberian dosis ekstrak etanol teripang 200, 400, 600 mg/kg BB, kontrol negatifnya adalah natrium carboxyl metyl cellulosa 0,5% b/v dosis 1% BB. Pengukuran kadar gula darah mencit pada menit ke-30, 60, 90 dan 120. Pada uji aloksan sebagai penginduksi, pembandingnya adalah metformin 65 mg/kg BB. Pengelompokan hewan uji, dosis ekstrak etanol teripang dan kontrol negatif sama dengan uji toleransi glukosa. Mencit diinduksi aloksan dengan dosis 150 mg/kg BB secara peritoneal. Setiap kelompok uji diberikan sediaan uji secara per oral selama 15 hari berturut-turut dan dilakukan pengukuran kadar glukosa darah pada hari ke-3, 6, 9, 12, 15.
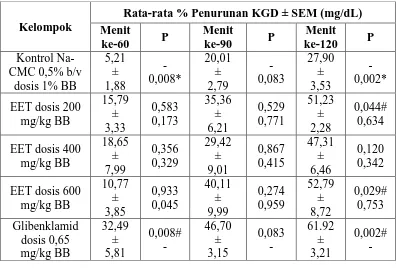
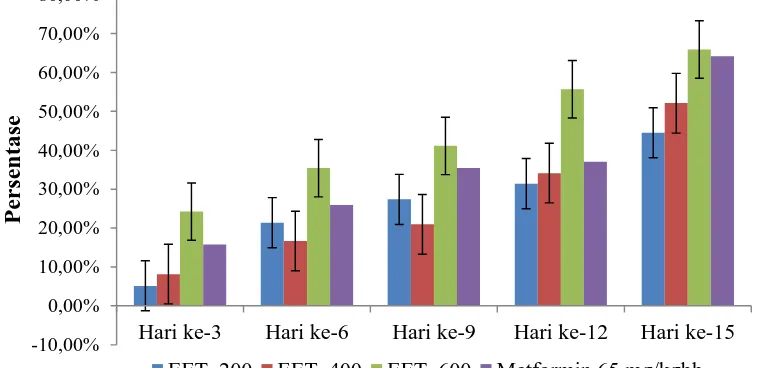
Hasil analisis ANOVA uji Tukey HSD pemberian ekstrak etanol teripang dosis 200, 400, 600 mg/kg BB memberikan persentase penurunan kadar glukosa darah yang sama secara signifikan dengan pembanding glibenklamid 0,65 mg/kg BB pada uji toleransi glukosa. Pada uji induksi aloksan, pemberian ekstrak etanol teripang dengan dosis 200, 400 dan 600 mg/kg BB memberikan persentase penurunan yang sama secara signifikan dengan metformin dosis 65 mg/kg BB. Berdasarkan hasil di atas, dapat disimpulkan bahwa ekstrak etanol teripang Pearsonothuria graeffei memberikan penurunan kadar glukosa darah mencit yang diinduksi aloksan.
CHARACTERIZATION AND EXAMINING EFFECT OF ETHANOL EXTRACT OF SEA CUCUMBER Pearsonothuria graeffei (Semper)
DECREASING MICE BLOOD GLUCOSE LEVELS BY ALLOXAN INDUCTION
ABSTRACT
Sea cucumbers are mostly found in the ocean of Indonesia, one of them is Pearsonothuria graeffei. Indonesia people commonly consume sea cucumber but unfamiliar using for medication. Chemical compounds of this sea cucumber are triterpenoid saponin, glycolipid, and chondroitin sulfates. The purpose of this research was characterizing, screening chemical compounds, extracting simplisia and examining the effect of ethanol extract of Pearsonothuria graeffei (Semper,1868).
Th f ch c c f c c ’ n content 9.47%, water soluble extract concentration 36.56%, ethanol soluble extract concentration 24.01%, total ash content 28.75%, insoluble ash content in acid 3.66%. The result of microscopic simplicia sea cucumber has spicules button type, spicules from tentacles, and pseudo-tables of body wall. The result of simplisia screening presents glycosides, saponin and triterpenoid/steroid.
The oral glucose tolerance test was using glibenclamid 0.65 mg/kg BW as a positive control. 25 mice were alienated into 5 groups that are ethanol extract of sea cucumber dose 200; 400; 600 mg/kg BW, natrium carboxyl metil cellulosa 0.5% b/v dose 1% BW as a control negative then the measurement of the blood glucose level on ’; ’; ’ nd ’ The research continues with diabetic mice that induced by alloxan dose 150 mg/kg BW intraperitoneal. Metformin dose 50 mg/kg BW as a positive control. The diabetic mice were randomly divided into five treatment groups correspond to the oral glucose tolerance test then all mice in the groups were measured the blood glucose level on day 3; 6; 9; 12; and 15.
The result of ANOVA analysis Tukey HSD test, ethanol extract of sea cucumber dose 200; 400; 600 mg/kg BW increase the percentage blood glucose level significantly compared with glibenclamid 0.65 mg/kg BW. On alloxan induction test, ethanol extract of sea cucumber 200; 400 and 600 mg/kg BW increase the percentage blood glucose level significantly compared with metformin dose 65 mg/kg BW. The result of this research was ethanol extract of sea cucumber Pearsonothuria graeffei (Semper,1868) able to decrease mice blood level induced by alloxan.
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Pikir Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Uraian Hewan ... 6
2.1.1 Sistematika hewan ... 7
2.1.2 Habitat ... 7
2.1.5 Kandungan senyawa kimia teripang ... 10
2.2 Ekstraksi ... 11
2.3 Diabetes Melitus ... 13
2.3.1 Jenis-jenis diabetes melitus ... 14
2.3.2 Insulin ... 15
2.3.3 Antidiabetika oral ... 16
2.3.4 Aloksan ... 19
2.3.5 Mekanisme aloksan ... 19
BAB III METODE PENELITIAN ... 21
3.1 Alat dan Bahan ... 21
3.1.1 Alat-alat ... 21
3.1.2 Bahan-bahan ... 22
3.2 Penyiapan Sampel ... 22
3.2.1 Pengumpulan sampel ... 22
3.2.2 Identifikasi sampel ... 22
3.2.3 Pengolahan sampel ... 22
3.3 Pembuatan Pereaksi ... 23
3.3.1 Pereaksi Molisch ... 23
3.3.2 Larutan asam klorida 2 N ... 23
3.3.3 Larutan asam sulfat 2 N ... 23
3.3.4 Larutan asam nitrat 0,5 N ... 23
3.3.5 Larutan timbal (II) asetat 0,4 M ... 23
3.3.6 Larutan kloralhidrat ... 24
3.4.1 Pemeriksaan makroskopik ... 24
3.4.2 Pemeriksaan mikroskopik ... 24
3.4.3 Penetapan kadar air ... 25
3.4.4 Penetapan kadar sari larut air ... 25
3.4.5 Penetapan kadar sari larut etanol ... 26
3.4.6 Penetapan kadar abu Total ... 26
3.4.7 Penetapan kadar abu tidak larut asam ... 26
3.5 Pemeriksaan Golongan Senyawa Kimia Simplisia ... 27
3.5.1 Pemeriksaan glikosida ... 27
3.5.2 Pemeriksaan saponin ... 27
3.5.3 Pemeriksaan steroid/triterpenoid ... 27
3.6 Pembuatan Ekstrak Teripang ... 28
3.7 Penyiapan Hewan Percobaan ... 29
3.8 Pengujian Aktivitas Antidiabetes ... 29
3.8.1 Pembuatan suspensi Na-CMC 0,5% ... 29
3.8.2 Pembuatan aloksan 150 mg/kg BB ... 29
3.8.3 Pembuatan suspensi ekstrak etanol teripang (EET) 29 3.8.4 Pembuatan suspensi metformin dosis 65 mg/kg BB 29
3.8.5 Pembuatan suspensi glibenklamid 0,65 mg/kg BB .. 30
3.8.6 Penyiapan hewan uji yang hiperglikemia ... 30
3.8.7 Penggunaan alat glukometer ... 30
3.8.8 Penentuan kadar glukosa darah (KGD) ... 30
3.8.9 Uji aktivitas antidiabetes dengan metode toleransi glukosa ... 31
3.9 Analisis Data ... 32
BAB IV HASIL DAN PEMBAHASAN ... 33
4.1 Hasil Identifikasi Sampel ... 33
4.2 Hasil Karakterisasi Simplisia ... 33
4.3 Hasil Pemeriksaan Golongan Senyawa Kimia ... 35
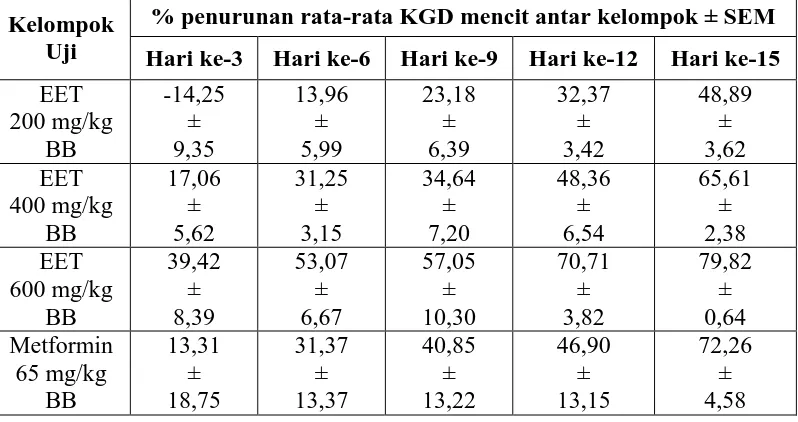
4.4 Hasil Uji Aktivitas Antidiabetes ... 35
4.4.1 Aktivitas antidiabetes dengan metode uji toleransi gl u k o s a ... 36
4.4.2 Aktivitas antidiabetes ekstrak etanol teripang (EET ) dengan metode induksi aloksan ... 37
BAB V KESIMPULAN DAN SARAN ... 44
5.1 Kesimpulan ... 44
5.2 Saran ... 44
DAFTAR TABEL
Tabel Halaman
4.1 Hasil karakterisasi simplisia teripang ... 34
4.2 Hasil pemeriksaan golongan senyawa kimia serbuk simplisi a
teripang Pearsonothuria Graeffei ... 35
4.3 Data persentase penurunan KGD mencit pada uji toleransi glukosa 36
4.4 Hasil persentase penurunan KGD rata-rata mencit antar individu
setelah diberi perlakuan ... 38
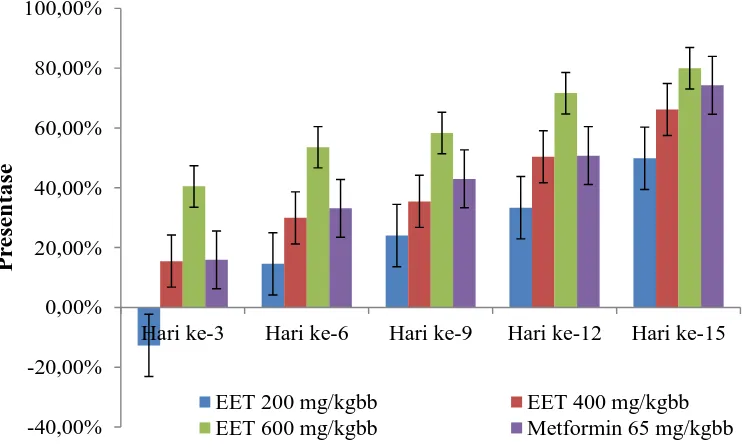
4.5 Hasil persentase penurunan KGD rata-rata mencit antar kelompok
setelah diberi perlakuan ... 39
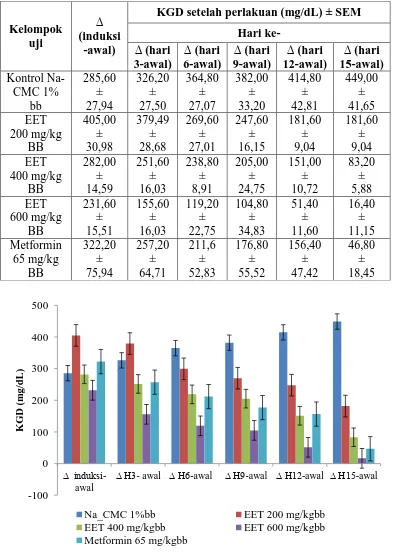
4.6 Hasil selisih (delta) KGD rata -rata mencit setelah diber i
DAFTAR GAMBAR
Gambar Halaman
1.1 Skema kerangka pikir penelitian ... 5
2.1 Teripang Pearsonothuria Graeffei ... 6
4.1 Grafik hasil persentase penurunan KGD rata-rata mencit antar individu
setelah diberi perlakuan ... 38
4.2 Grafik hasil persentase penurunan KGD rata-rata mencit antar kelompok
setelah diberi perlakuan ... 40
4.3 Grafik hasil selisih (delta) KGD rata-rata mencit setelah
DAFTAR LAMPIRAN
Lampiran Halaman
1. Identifikasi sampel ... 48
2. Karakteristik teripang pearsonothuria graeffei ... 49
3. Hasil pemeriksaan mikroskopik serbuk simplisia teripang ... 51
4. Bagan alur pembuatan ekstrak teripang ... 52
5. Bagan alur pengukuran KGD mencit ... 53
6. Bagan alur pengujian efek penurunan KGD mencit diinduksi aloksan ... 54
7. Alat pengukur glukosa darah ... 55
8. Perhitungan hasil penetapan kadar air serbuk simplisi a teripang ... 56
9. Perhitungan hasil penetapan kadar sari larut air serbu k simplisia teripang ... 57
10. Perhitungan hasil penetapan kadar sari larut etanol serbuk simplisia teripang ... 58
11. Perhitungan hasil penetapan kadar abu total serbuk simplisia teripang ... 59
12. Perhitungan hasil penetapan kadar abu tidak larut asam serbuk simplisia teripang ... 60
13. Contoh perhitungan dosis ... 61
14. Data pengukuran KGD mencit metode induksi aloksan ... 64
15. Data persen penurunan KGD mencit antar individu ... 69
16. Data persen penurunan KGD mencit antar kelompok ... 74
17. Data hasil selisih (delta) KGD rata -rata m encit yan g diinduksialoksan ... 76
19. Signifikansi persentase penurunan rata-rata mencit antar
individu setelah diinduksi aloksan ... 82
20. Signifikansi persentase penurunan rata-rata mencit antar
i n d i v i d u setelah diinduksi aloksan ... 83
21. Signifikansi selisih (delta) KGD rata-rata mencit yang diinduksi
aloksan ... 84
KARAKTERISASI DAN UJI EFEK EKSTRAK ETANOL TERIPANG JENIS Pearsonothuria graeffei (Semper) TERHADAP PENURUNAN
KADAR GLUKOSA DARAH MENCIT YANG DIINDUKSI ALOKSAN
ABSTRAK
Teripang banyak ditemukan di perairan Indonesia, salah satunya jenis Pearsonothuria graeffei. Masyarakat mengkonsumsi teripang sebagai bahan pangan dan belum digunakan sebagai bahan obat. Kandungannya adalah triterpenoid saponin, glikolipid dan kondroitin sulfat. Tujuan Penelitian ini adalah mengetahui karakterisasi simplisia, pemeriksaan golongan senyawa kimia, pembuatan ekstrak etanol dan uji efek antidiabetes teripang Pearsonothuria graeffei.
Hasil karakterisasi simplisia teripang terhadap kadar air 9,47 %, kadar sari larut air 36,56 %, kadar sari larut etanol 24,01 %, kadar abu total 28,75 %, dan kadar abu tidak larut asam 3,66 %. Mikroskopik serbuk simplisia yakni spikula bentuk kancing (buttons), spikula dari tentakel dan spikula bentuk meja semu (pseudo-tables). Hasil pemeriksaan golongan senyawa kimia simplisia teripang mengandung glikosida, saponin dan triterpenoid/steroid.
Pada uji toleransi glukosa sebagai pembandingnya glibenklamid 0,65 mg/kg BB. Hewan uji dibagi menjadi 5 kelompok, terdiri dari 25 ekor. Dengan pemberian dosis ekstrak etanol teripang 200, 400, 600 mg/kg BB, kontrol negatifnya adalah natrium carboxyl metyl cellulosa 0,5% b/v dosis 1% BB. Pengukuran kadar gula darah mencit pada menit ke-30, 60, 90 dan 120. Pada uji aloksan sebagai penginduksi, pembandingnya adalah metformin 65 mg/kg BB. Pengelompokan hewan uji, dosis ekstrak etanol teripang dan kontrol negatif sama dengan uji toleransi glukosa. Mencit diinduksi aloksan dengan dosis 150 mg/kg BB secara peritoneal. Setiap kelompok uji diberikan sediaan uji secara per oral selama 15 hari berturut-turut dan dilakukan pengukuran kadar glukosa darah pada hari ke-3, 6, 9, 12, 15.
Hasil analisis ANOVA uji Tukey HSD pemberian ekstrak etanol teripang dosis 200, 400, 600 mg/kg BB memberikan persentase penurunan kadar glukosa darah yang sama secara signifikan dengan pembanding glibenklamid 0,65 mg/kg BB pada uji toleransi glukosa. Pada uji induksi aloksan, pemberian ekstrak etanol teripang dengan dosis 200, 400 dan 600 mg/kg BB memberikan persentase penurunan yang sama secara signifikan dengan metformin dosis 65 mg/kg BB. Berdasarkan hasil di atas, dapat disimpulkan bahwa ekstrak etanol teripang Pearsonothuria graeffei memberikan penurunan kadar glukosa darah mencit yang diinduksi aloksan.
CHARACTERIZATION AND EXAMINING EFFECT OF ETHANOL EXTRACT OF SEA CUCUMBER Pearsonothuria graeffei (Semper)
DECREASING MICE BLOOD GLUCOSE LEVELS BY ALLOXAN INDUCTION
ABSTRACT
Sea cucumbers are mostly found in the ocean of Indonesia, one of them is Pearsonothuria graeffei. Indonesia people commonly consume sea cucumber but unfamiliar using for medication. Chemical compounds of this sea cucumber are triterpenoid saponin, glycolipid, and chondroitin sulfates. The purpose of this research was characterizing, screening chemical compounds, extracting simplisia and examining the effect of ethanol extract of Pearsonothuria graeffei (Semper,1868).
Th f ch c c f c c ’ n content 9.47%, water soluble extract concentration 36.56%, ethanol soluble extract concentration 24.01%, total ash content 28.75%, insoluble ash content in acid 3.66%. The result of microscopic simplicia sea cucumber has spicules button type, spicules from tentacles, and pseudo-tables of body wall. The result of simplisia screening presents glycosides, saponin and triterpenoid/steroid.
The oral glucose tolerance test was using glibenclamid 0.65 mg/kg BW as a positive control. 25 mice were alienated into 5 groups that are ethanol extract of sea cucumber dose 200; 400; 600 mg/kg BW, natrium carboxyl metil cellulosa 0.5% b/v dose 1% BW as a control negative then the measurement of the blood glucose level on ’; ’; ’ nd ’ The research continues with diabetic mice that induced by alloxan dose 150 mg/kg BW intraperitoneal. Metformin dose 50 mg/kg BW as a positive control. The diabetic mice were randomly divided into five treatment groups correspond to the oral glucose tolerance test then all mice in the groups were measured the blood glucose level on day 3; 6; 9; 12; and 15.
The result of ANOVA analysis Tukey HSD test, ethanol extract of sea cucumber dose 200; 400; 600 mg/kg BW increase the percentage blood glucose level significantly compared with glibenclamid 0.65 mg/kg BW. On alloxan induction test, ethanol extract of sea cucumber 200; 400 and 600 mg/kg BW increase the percentage blood glucose level significantly compared with metformin dose 65 mg/kg BW. The result of this research was ethanol extract of sea cucumber Pearsonothuria graeffei (Semper,1868) able to decrease mice blood level induced by alloxan.
BAB I PENDAHULUAN
1.1 Latar Belakang
Teripang atau timun laut (Sea Cucumber) termasuk dalam filum
Echinodermata yang merupakan salah satu biota laut yang banyak ditemukan di
perairan Indonesia, sebab secara geografis perairan Indonesia terletak di antara
Samudera Pasifik dan Samudera Hindia merupakan habitat terbaik untuk hewan
teripang (Conand dan Byrne, 1993). Teripang adalah hewan tidak bertulang
dengan tubuh berbentuk silinder memanjang dengan mulut dan anus terletak di
ujung poros berlawanan yaitu mulut di anterior dan anus di posterior, di sekitar
mulut teripang terdapat tentakel yang digunakan sebagai penangkap makanan
(Wibowo, et al., 1997).
Pada tahun 2004, Indonesia mengekspor teripang ke Malaysia dan juga ke
Cina untuk memenuhi 37% kebutuhan teripang di sana. Hal ini dikarenakan
potensi teripang yang sangat memungkinkan untuk dikembangkan sebagai produk
makanan kesehatan yang mengandung kandungan protein dan kolagen yang
sangat tinggi. Selain itu, penggunaan teripang sudah dikenal sejak 300 tahun lalu
pada masyarakat pulau Langkawi di Semenanjung Malaya digunakan sebagai
antiseptik tradisional. Biasanya air sari teripang diminumkan kepada wanita
sehabis melahirkan untuk menghentikan pendarahan dan mempercepat proses
penyembuhan luka khitan pada anak laki-laki masyarakat tersebut (Karnila,
Daerah Sulawesi Selatan (Makassar) yang merupakan salah satu penghasil
dan pengekspor teripang utama di Indonesia. Macam-macam teripang yang
terdapat di Makassar adalah Actinopyga echinites, Actinopyga mauritiana,
Bohadschia argus, Holothuria scabra, Stichopus hermanni, Thelenota ananas dan
Pearsonothuria graeffei. Penggunaan teripang di Indonesia adalah untuk komoditi
ekspor sub sektor perikanan yang cukup potensial dan bahan pangan oleh
masyarakat setempat. Padahal, teripang tidak semata-mata untuk bahan makanan
tetapi telah diteliti memiliki aktifitas farmakologi yang digunakan untuk
pengobatan. Salah satu teripang yang memiliki manfaat untuk pengobatan adalah
Pearsonothuria graeffei (Lovatelli, et al., 2004).
Pearsonothuria graeffei atau disebut juga teripang bintik hitam yang
dibudidayakan di Sulawesi Selatan (Makassar) berkhasiat sebagai antikanker
karena memiliki kandungan glikosida triterpene sulfat yaitu holothurin A (HA)
dan 24-dehydroechinoside A (DHEA). Selain HA dan DHEA, kandungan lain
dari teripang ini yaitu triterpenoid saponin, glikolipid, dan kondroitin sulfat
(Bordbar, et al., 2011). Menurut penelitian, senyawa triterpenoid saponin
memiliki efek hipoglikemik (Burdi, et al., 2014) serta saponin yang mampu
mencegah komplikasi diabetes (Elekofehintini, et al., 2013). Hal ini diperkuat
dengan penelitian yang menyatakan bahwa pemberian serbuk teripang (Stichopus
variegatus) dapat menurunkan kadar glukosa darah dari tikus putih jantan yang
telah diinduksi aloksan (Fitriah, et al., 2013).
Berdasarkan uraian-uraian di atas, peneliti tertarik untuk menguji
pengaruh ekstrak etanol dari teripang Pearsonothuria graeffei terhadap penurunan
1.2 Perumusan Masalah
Berdasarkan latar belakang di atas maka perumusan masalah dari penelitian
ini adalah:
a. apakah karakteristik simplisia teripang Pearsonothuria graeffei (Semper,
1868) yang diteliti memenuhi persyaratan mutu simplisia secara umum?
b. apakah golongan senyawa kimia yang terkandung dari simplisia teripang
Pearsonothuria graeffei (Semper, 1868)?
c. apakah ekstrak etanol teripang Pearsonothuria graeffei (Semper, 1868)
memberikan efek penurunan kadar glukosa darah mencit dengan
menggunakan metode induksi aloksan?
1.3Hipotesis
Berdasarkan latar belakang di atas maka hipotesis dari penelitian ini adalah:
a. karakteristik simplisia teripang Pearsonothuria graeffei (Semper, 1868)
memenuhi persyaratan mutu simplisia secara umum.
b. kandungan yang terdapat dalam simplisia etanol teripang Pearsonothuria
graeffei (Semper,1868) adalah glikosida, saponin dan triterpenoid/steroid.
c. ekstrak etanol teripang Pearsonothuria graeffei (Semper, 1868)
memberikan efek penurunan kadar glukosa darah mencit dengan
1.4Tujuan Penelitian
Berdasarkan latar belakang di atas maka tujuan dari penelitian ini adalah:
a. mengetahui karakteristik simplisia teripang Pearsonothuria graeffei
(Semper, 1868) yang diteliti memenuhi persyaratan mutu simplisia secara
umum.
b. mengetahui golongan senyawa kimia yang terdapat dalam simplisia
teripang Pearsonothuria graeffei (Semper, 1868).
c. mengetahui efek ekstrak etanol teripang Pearsonothuria graeffei (Semper,
1868) secara ilmiah terhadap penurunan kadar glukosa darah mencit
dengan menggunakan metode induksi aloksan.
1.5Manfaat Penelitian
Berdasarkan latar belakang di atas maka manfaat dari penelitian ini adalah:
a. memberi informasi bagi masyarakat tentang manfaat dari teripang jenis
Pearsonothuria graeffei (Semper, 1868).
b. meningkatkan pemanfaatan biota laut terutama teripang.
1.6Kerangka Pikir Penelitian
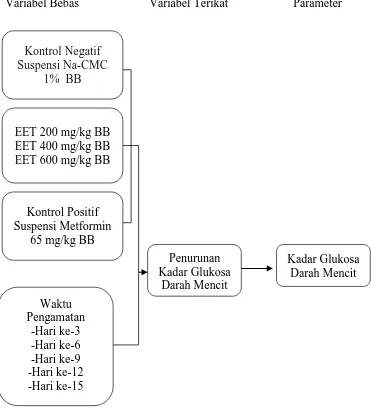
Pada penelitian ini terdapat dua variabel yaitu variabel bebas dan variabel
terikat. Sebagai variabel bebas yaitu suspensi Na-CMC dosis 1% BB, EET
Pearsonothuria graeffei dosis 200, 400, 600 mg/kg BB, suspensi metformin 65
mg/kg BB, waktu pengamatan dan sebagai variabel terikat adalah penurunan
kadar glukosa darah mencit seperti yang di tunjukkan pada Gambar 1.1.
Variabel Bebas Variabel Terikat Parameter
Gambar 1.1 Skema Kerangka Pikir Penelitian
EET 200 mg/kg BB EET 400 mg/kg BB EET 600 mg/kg BB
Penurunan Kadar Glukosa
Darah Mencit
Kadar Glukosa Darah Mencit Kontrol Negatif
Suspensi Na-CMC 1% BB
Kontrol Positif Suspensi Metformin
65 mg/kg BB
Waktu Pengamatan
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Hewan
Teripang atau timun laut (Sea Cucumber) termasuk dalam filum
Echinodermata yang merupakan salah satu biota laut yang banyak ditemukan di
perairan Indonesia, sebab secara geografis perairan Indonesia terletak di antara
Samudera Pasifik dan Samudera Hindia merupakan habitat terbaik untuk hewan
teripang (Conand dan Byrne, 1993). Teripang adalah hewan tidak bertulang
belakang dengan tubuh berbentuk silinder. Bentuk tersebut menyerupai mentimun
sehingga teripang dikenal dengan nama mentimun laut (sea cucumber) (Martoyo,
et al., 2006). Teripang Pearsonothuria graeffei berwarna krim sampai cokelat
dengan banyak bintik berwarna hitam. Tubuhnya memanjang dibagian perut
dengan lipatan melintang. Terdapat 23-28 tentakel pada mulut bagian depan.
Permukaan anus tidak terdapat gigi ataupun papila. Permukaan punggung (dorsal)
dan perut (ventral) tampak kasar (Conand, et al., 2012). Gambar teripang
Pearsonothuria graeffei dapat dilihat pada Gambar 2.1.
2.1.1 Sistematika hewan
Determinasi/identifikasi sampel teripang di Pusat Penelitian Oseanografi
LIPI, dengan hasil sebagai berikut:
Filum : Echinodermata
Kelas : Holothuroidea
Ordo : Aspidochirotida
Famili : Holothuriidae
Genus : Pearsonothuria
Spesies : Pearsonothuria graeffei (Semper, 1868).
2.1.2 Habitat
Teripang dapat ditemukan hampir di seluruh perairan pantai di Indonesia,
mulai dari daerah pasang-surut yang dangkal sampai perairan yang lebih dalam.
Teripang lebih menyukai perairan yang jernih dan airnya relatif tenang.
Umumnya, masing-masing jenis teripang mempunyai habitat yang spesifik, ada
jenis teripang yang hidup berkelompok dan ada pula yang hidup soliter (sendiri).
Teripang umumnya menempati ekosistem terumbu karang yang jernih, bebas dari
polusi, air relatif tenang dengan kualitas air cukup baik. Habitat ideal bagi
teripang adalah air laut dengan salinitas 29-33 % yang memiliki kisaran pH
6,5-8,5; kecerahan air 50-150 cm; kandungan oksigen terlarut 4-8 ppm dan suhu air
laut 20-25O C (Widodo, 2012).
Penyebaran teripang di Indonesia sangat luas. Beberapa daerah penyebaran
antara lain meliputi perairan pantai Madura, Bali, Lombok, Aceh, Bengkulu,
Bangka, Riau, Belitung, Kalimantan (Barat, Timur dan Selatan), Maluku, Timor,
(Makassar) yang merupakan salah satu penghasil dan pengekspor teripang utama
di Indonesia. Macam-macam teripang yang terdapat di Makassar adalah
Actinopyga echinites, Actinopyga mauritiana, Bohadschia argus, Holothuria
scabra, Stichopus hermanni, Thelenota ananas dan Pearsonothuria graeffei
(Lovatelli, et al., 2004). Habitat dari Pearsonothuria graeffei yaitu terumbu
karang, lereng terumbu, di perairan dangkal pada kedalaman 0 dan 25 meter
(Conand, et.al., 2012).
2.1.3 Morfologi
Teripang memiliki mulut dan anus yang terletak di ujung poros
berlawanan, yaitu mulut di anterior dan anus di posterior, disekitar mulut teripang
terdapat tentakel yang dapat dijulurkan dan ditarik dengan cepat (Karnila, 2011).
Teripang merupakan salah satu anggota hewan berkulit duri (Echinodermata).
Namun, tidak semua jenis teripang mempunyai duri kulitnya. Ada beberapa jenis
teripang yang tidak berduri. Duri-duri pada teripang tersebut sebenarnya
merupakan rangka atau skelet yang tersusun dari zat kapur dan terletak di dalam
kulitnya. Rangka dari zat kapur tersebut tidak dapat dilihat dengan mata biasa.
Oleh karena sangat kecil, rangka baru bisa dilihat dengan bantuan mikroskop
(Martoyo, et al., 2006).
Ukuran teripang Pearsonothuria graeffei kering adalah sekitar 15 cm.
Duri-duri pada teripang Pearsonothuria graeffei dapat dilihat menggunakan
mikroskop dengan bentuk batang, rossete (20-90 µm), pseudo-tables (30-50 µm)
2.1.4 Manfaat teripang
Penggunaan teripang sudah dikenal sejak 300 tahun lalu pada masyarakat
pulau Langkawi di Semenanjung Malaya digunakan sebagai antiseptik tradisional.
Biasanya air sari teripang diminumkan kepada wanita sehabis melahirkan untuk
menghentikan pendarahan dan mempercepat proses penyembuhan luka khitan
pada anak laki-laki masyarakat tersebut (Karnila, 2011). Masyarakat umumnya
masih melakukan pengolahan tradisional, yaitu teripang dimanfaatkan sebagai
bahan pangan baik dalam bentuk basah maupun dalam bentuk makanan olahan
seperti bakso dan capcay. Sejarah bangsa Cina diketahui penggunaan teripang
sebagai sumber nutrisi, untuk mengatasi gangguan ginjal, menjaga sistem
reproduksi, mengatasi kelelahan, impotensi dan konstipasi. Sejak tahun 1990,
teripang (sea cucumber) diketahui sebagai salah satu sumber kondroitin sulfat
atau disebut juga sea chondroitin yang berguna untuk mengurangi nyeri akibat
rematik saperti rhematoid arthritis atau osteoathirits (Sendih dan Gunawan, 2006).
Pearsonothuria graeffei atau disebut juga teripang bintik hitam yang
dibudidayakan di Sulawesi Selatan (Makassar) berkhasiat sebagai antikanker
karena memiliki kandungan glikosida triterpene sulfat yaitu holothurin A (HA)
dan 24-dehydroechinoside A (DHEA). Selain HA dan DHEA, kandungan lain
dari teripang ini yaitu triterpenoid saponin, glikolipid, dan kondroitin sulfat
(Bordbar, et al., 2011). Pemberian serbuk teripang Stichopus variegatus diteliti
memiliki aktivitas antidiabetik dan meningkatkan superoxide dismutase yang
mampu menurunkan kadar gula darah tikus hiperglikemik yang diinduksi aloksan
(Fitriah, et al., 2013) karena teripang Stichopus variegatus memiliki senyawa
2.1.5 Kandungan senyawa kimia teripang
a. Saponin
Saponin merupakan senyawa glikosida triterpenoida dan glikosida steroida
yang merupakan senyawa aktif permukaan dan bersifat seperti sabun serta dapat
dideteksi berdasarkan kemampuannya membentuk busa dan menghemolisa sel
darah merah. Pola glikosida saponin kadang-kadang rumit, banyak saponin yang
mempunyai satuan gula sampai lima dan komponen yang umum ialah asam
glukuronat (Harborne, 1987).
Larutan yang sangat encer dari saponin sangat beracun untuk ikan, dan
tumbuhan yang mengandung saponin telah digunakan sebagai racun ikan dan
beberapa saponin bekerja sebagai antimikroba. Dikenal dua jenis saponin yaitu
glikosida triterpenoid alkohol dan glikosida struktur steroid tertentu yang
mempunyai rantai samping spirorektal. Kedua jenis saponin ini larut dalam air
dan etanol tetapi tidak larut dalam eter. Aglikonnya disebut sapogenin diperoleh
dengan hidrolisis dalam suasan asam atau hidrolisis memakai enzim, dan tanpa
bagian gula ciri kelarutannya sama dengan ciri sterol lain (Robinson, 1995).
Hasil laporan akhir-akhir ini menunjukkan bahwa saponin merupakan
komponen bioaktif yang memberikan manfaat seperti antidiabetes,
antihiperlipidemia, dan menghambat lipid peroxida. Jadi saponin dapat
menghambat aktivitas radikal bebas dengan memberikan elektron atau atom
hidrogen untuk menginaktifasi radikal bebas. Saponin juga dapat meningkatkan
antioksidan enzim seperti superoxide dismutase (SOD) dan catalase (CAT).
Dimana SOD merupakan enzim antioksidan yang memberikan pertahanan pada
H2O2 dan molekul oksigen. Peningkatan aktivitas SOD menunjukkan aktivitas
katalase dimana katalase mengkatalisis hidrogen peroksida dan melindungi
jaringan dari radikal hidrogen. ROS merupakan penyebab utama diabetes dengan
mengambil elektron dari tubuh. Dengan meningkatnya SOD dan CAT, regulasi
ROS akan meningkat pula sehingga mengurangi resiko penyakit kronis seperti
diabetes (Elekofehintini, et al., 2013).
b. Triterpenoid
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam
satuan isoprene dan secara biosintesis diturunkan dari hidrokarbon C-30 asiklik
yaitu skualena. Triterpenoid dapat dibagi atas empat golongan yaitu triterpenoid
sebenarnya, steroid, saponin dan glikosida jantung. Triterpena atau steroid yang
terutama terdapat sebagai glikosida. Triterpenoid merupakan senyawa yang tidak
berwarna, berbentuk kristal, bertitik leleh tinggi dan optik aktif yang umumnya
sukar dicirikan karena tidak mempunyai kereaktifan kimia (Harborne, 1987).
Menurut Farnswoth (1966), penambahan pereaksi Liebermann-Burchard
memberikan warna biru atau biru hijau untuk steroid saponin dan memberikan
warna merah, pink, atau ungu jika pada sampel yang memiliki senyawa
triterpenoid saponin.
2.2 Ekstraksi
Ekstraksi adalah suatu cara untuk menarik satu atau lebih zat dari bahan
asal dengan menggunakan pelarut. Umumnya zat berkhasiat tersebut dapat ditarik,
namun khasiatnya tidak berubah. Tujuan utama ekstraksi adalah mendapatkan
dari zat-zat yang tidak dibutuhkan, agar lebih mudah digunakan (kemudahan
diabsorpsi, rasa dan pemakaian) dan disimpan dibandingkan simplisia asal dan
tujuan pengobatannya terjamin. Hasil ekstraksi disebut dengan ekstrak yaitu
sediaan pekat yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati
atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau
hampir semua pelarut diuapkan (Depkes RI, 1995).
Ekstraksi dengan menggunakan pelarut dapat dilakukan dengan beberapa
cara yaitu:
a. Cara dingin
1. Maserasi
Maserasi adalah cara penarikan simplisia dengan merendam
simplisia tersebut dalam cairan penyari dengan beberapa kali pengocokkan
atau pengadukkan pada temperatur kamar sedangkan remaserasi
merupakan pengulangan penambahan pelarut setelah dilakukan
penyaringan maserat pertama dan seterusnya (Ditjen POM, 2000).
2. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai
terjadi penyarian sempurna (exhaustive extraction) yang umumnya
dilakukan pada temperatur kamar (Ditjen POM, 2000). Cara panas
1. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik
didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif
2. Sokletasi
Sokletasi adalah ekstraksi kontinu menggunakan alat soklet,
dimana pelarut akan terdestilasi dari labu menuju pendingin, kemudian
jatuh membasahi dan merendam sampel dalam tabung soklet dan setelah
pelarut mencapai tinggi tertentu maka akan turun ke labu destilasi setelah
melewati pipa sifon, demikian berulang-ulang (Ditjen POM, 2000).
3. Digesti
Digesti adalah maserasi dengan pengadukan kontinu pada
temperatur yang lebih tinggi dari temperatur ruangan yaitu secara umum
dilakukan pada temperatur 40-50o C (Ditjen POM, 2000).
4. Infus
Infus adalah sediaan cair yang dibuat dengan menyari simplisa
nabati dengan air pada suhu 90o C selama 15 menit (Depkes RI, 1979).
5. Dekok
Dekok adalah sediaan cair yang dibuat dengan menyari simplisia
nabati dengan air pada waktu yang lebih lama ± 30 menit dengan
temperatur sampai titik didih air (Ditjen POM, 2000).
2.3 Diabetes melitus
Diabetes melitus adalah sekelompok sindrom yang ditandai dengan
hiperglikemia; perubahan metabolisme lipid, karbohidrat dan protein; peningkatan
penyakit pembuluh darah. Hampir semua bentuk diabetes melitus disebabkan oleh
menurunnya konsentrasi insulin dalam sirkulasi (defisiensi insulin) dan
Diabetes Melitus ditandai oleh poliuri, polidipsi, dan polifagi disertai
n n k n k d k d h h k k ≥ /dL
atau postpandial ≥ /dL k w k ≥ /dL
Hiperglikemia timbul akibat berkurangnya insulin sehingga glukosa darah tidak
dapat masuk ke sel-sel otot, jaringan adiposa atau hepar dan metabolismenya juga
terganggu. Dalam keadaan normal, kira-kira 50% glukosa yang dimakan
mengalami metabolisme sempurna menjadi CO2 dan air, 5% diubah menjadi
glikogen dan kira-kira 30-40% diubah menjadi lemak. Sebenarnya hiperglikemia
sendiri relatif tidak berbahaya, kecuali bila hebat sekali hingga darah menjadi
hiperosmotik terhadap cairan intrasel. Yang berbahaya ialah glikosuria yang
timbul karena glukosa bersifat diuretik osmotik sehingga diuresis sangat
meningkat disertai kehilangan elektrolit. Hal inilah yang menyebabkan terjadinya
dehidrasi dan hilangnya elektrolit pada pasien DM yang tidak diobati. Karena
adanya dehidrasi, maka badan berusaha mengatasinya dengan banyak minum
(polidipsia). Badan kehilangan 4 kalori untuk setiap gram glukosa yang dieksresi.
Polifagia timbul karena perangsangan pusat nafsu makan di hipotalamus oleh
kurangnya pemakaian glukosa di kelenjar itu (Suherman dan Nafrialdi, 1995).
2.3.1 Jenis-jenis diabetes melitus
a. Diabetes tipe 1
Diabetes tipe 1 merupakan bentuk diabetes parah yang berhubungan
dengan terjadinya ketosis apabila tidak diobati. Diabetes tipe 1 tersebut sangat
lazim terjadi pada anak remaja tetapi kadang-kadang juga terjadi pada orang
dewasa, khususnya yang non-obesitas dan mereka yang berusia lanjut ketika
katabolisme yang disebabkan karena hampir tidak terdapat insulin dalam sirkulasi,
glukagon plasma meningkat dan sel-sel beta pankreas gagal merespons semua
stimulus insulinogenik. Oleh karena itu, diperlukan pemberian insulin eksogen
untuk memperbaiki katabolisme, mencegah ketosis dan menurunkan
hiperglukagonemia dan peningkatan kadar glukosa darah (Katzung, 2002).
b. Diabetes tipe 2
Diabetes tipe 2 merupakan suatu kelompok heterogen yang terdiri dari
bentuk diabetes yang lebih ringan yang terutama terjadi pada orang dewasa tetapi
kadang-kadang juga terjadi pada remaja. Sirkulasi insulin endogen cukup untuk
mencegah terjadinya ketoasidosis tetapi insulin tersebut sering dalam kadar
kurang dari normal atau secara relatif tidak mencukupi karena kurang pekanya
jaringan. Obesitas, yang pada umumnya menyebabkan gangguan pada kerja
insulin merupakan faktor resiko yang biasa tejadi pada diabetes tipe ini, dan
sebagian besar pasien dengan diabetes tipe 2 bertubuh gemuk.
Selain terjadinya penurunan kepekaan jaringan pada insulin, yang telah
terbukti terjadi pada sebagian besar pasien dengan diabetes tipe 2 telepas dari
berat badan, adalah terjadi pula suatu defisiensi respons sel beta pankreas terhadap
glukosa. Baik resistensi jaringan terhadap insulin maupun kerusakan respons sel
beta terhadap glukosa dapat lebih diperparah dengan meningkatnya hiperglikemia,
dan kedua kerusakan tersebut dapat diperbaiki melalui manuver-manuver terapik
yang mengurangi hiperglikemia tersebut (Katzung, 2002).
2.3.2 Insulin
Insulin merupakan suatu protein berukuran kecil dengan berat molekul
rantai (A dan B) yang dihubungkan dengan jembatan disulfida. Insulin dirilis dari
sel beta pankreas, pada keadaan basal dengan kecepatan rendah dan pada keadaan
stimulasi sebagai respon terhadap berbagai stimulus, khususnya glukosa dengan
suatu kecepatan yang jauh lebih tinggi. Mekanisme stimulasi rilis insulin adalah
hiperglikemia menyebabkan peningkatan kadar ATP intraseluler, sehingga
menutup kanal kalium yang tergantung pada ATP. Penurunan arus ke luar dari
kalium melalui kanal tersebut menyebabkan depolarisasi sel beta dan terbukanya
kanal kalsium yang tergantung voltase (voltage-gated). Hasil peningkatan
kalsium intraseluler memicu sekresi hormon tersebut (Katzung, 2002).
Kerja insulin mempengaruhi metabolisme karbohidrat, protein dan lemak.
Insulin menaikkan pengambilan glukosa ke dalam sel-sel sebagian besar jaringan;
menaikkan penguraian glukosa secara oksidatif; menaikkan pembentukkan
glikogen dalam hati dan juga dalam otot dan mencegah penguraian glikogen;
menstimulasi pembentukkan protein dan lemak dari glukosa. Semua proses ini
menyebabkan kadar glukosa darah menurun akibat pengaruh insulin. Dalam
jaringan lemak dan hati insulin merangsang pengambilan asam lemak bebas yang
selanjutnya disimpan dalam bentuk trigliserida (lemak cadangan). Selain itu
insulin sebaliknya bekerja memobilisasi lemak dan penguraian lemak (lipolisis).
Kerja insulin lainnya ialah menaikkan pengambilan ion kalium ke dalam sel dan
menurunkan kerja katabolik glukokortikoid dan hormon kelenjar tiroid
(Mutschler, 1991).
2.3.3 Antidiabetika oral
Insulin sebagai polipeptida hanya dapat diberikan secara parenteral.
penderita diabetes. Sehubungan dengan itu, kemajuan yang berarti diperoleh, pada
saat turunan sulfonilurea dan turunan biguanida yag dapat dipakai secara oral
telah digunakan untuk mengobati diabetes mellitus. Walaupun demikian,
berdasarkan pengalaman sampai saat ini, dan sebagian karena efek samping yang
serius maka seharusnya pemakaian antidiabetika oral pada pokoknya lebih
dikurangi daripada sebelumnya. Obat-obat ini hanya diindikasi jika tidak terdapat
diabetes tipe 1; tindakan diet tidak cukup; tidak perlu diberikan insulin sebagai
pengganti antidiabetika oral.
a. Sulfonilurea
Mekanisme kerjanya membebaskan insulin yang dapat dimobilisasi dari
sel beta pankreas dan pada saat yang sama memperbaiki tanggapan terhadap
rangsang glukosa fisiologik. Ini berarti bahwa obat ini hanya berkhasiat jika
produksi insulin tubuh sendiri paling kurang sebagian masih bertahan atau dengan
kata lain obat ini tidak berkhasiat jika tidak ada produksi insulin. (Mutschler,
1991). Contoh antidiabetika oral kelompok sulfonamida adalah golongan pertama
adalah tolbutamid, asetoheksamida, tolazamida dan klorpropamida. Generasi
kedua adalah gliburida (glibenklamida), glipizida, gliklazida dan glimepirid yang
lebih kuat dibandingkan senyawa sebelumnya (Goodman dan Gilman, 2006).
Kontraindikasi, sulfonilura tidak dapat diberikan pada diabetes tipe 1, pada
asetonuria parah, pada prakoma dan koma diabetik, pada gangguan fungsi ginjal
yang parah dan semua dekompensasi metabolisme dalam penyakit infeksi, operasi
dan tekanan-tekanan lain. Demikian juga pada saat kehamilan dianjurkan untuk
b. Biguanide
Metformin, fenformin dan buformin merupakan obat antidiabetes
golongan ini. Metformin jarang menyebabkan komplikasi asidosis laktat sehingga
masih bisa diresepkan namun dengan tindakan hati-hati. Metformin bersifat
antihiperglikemia bukan hipoglikemia yang tidak menyebabkan pelepasan insulin
dari pankreas dan tidak menyebabkan hipoglikemia bahkan dalam dosis besar
(Goodman dan Gillman, 2006). Biguanida paling sering diresepkan pada pasien
dengan obesitas yang hipeglikemianya disebabkan oleh kerja insulin yang tidak
efektif. Oleh karena metformin merupakan agen hemat-insulin dan tidak
meningkatkan berat badan atau menyebabkan hipoglikemia. Maka, metformin
menawarkan keuntungan yang melebihi insulin dan sulfonilurea untuk mengobati
hiperglikemia pada pasien (Katzung, 2002).
Mekanisme kerja dari metformin yaitu berpindahnya metformin menuju ke
sel hati melalui transporter OCT1 yang akan menghambat respirasi mitokondria
(complex 1) dan menyebabkan kurangnya energi di dalam sel sehingga
menghambat glukoneogenesis di hati. Hal ini terjadi dengan 2 cara yaitu pertama,
dengan bekurangnya ATP menyebabkan meningkatkan konsentrasi AMP yang
diduga berkontribusi menghambat proses glukoneogenesis (karena berkurangnya
ATP). Kedua, peningkatan AMP ini merupakan mediator kunci signal yang
bertujuan menghambat signal cAMP-PKA melalui adenilat siklase, menghambat
FBPase (kunci dari enzim glukoneogenesis), dan menghambat sintesis kolesterol
c. Penghambat alfa-glucosidase
Penghambat glucosidase merupakan penghambat kompetitif
alfa-glucosidase usus yang dapat memecah oligosakarida atau disakarida menjadi
monosakarida dan diserap duodenum dan jejenum menuju ke dalam aliran darah.
Akibat klinis hambatan enzim adalah untuk meminimalkan pencernaan pada usus
bagian atas dan menunda pencernaan (dan juga absorpsi) zat tepung dan
disakarida yang masuk pada usus kecil bagian distal, sehingga menurunkan
glikemik setelah makan sebanyak 45-60 mg/dL dan menciptakan suatu efek
hemat-insulin. Contoh agen penghambat alfa-glukosidase adalah miglitol dan
akarbose (Katzung, 2002).
2.3.4 Aloksan
Aloksan (2, 4, 5, 6-tetraoxypyrimidine; 5,6-dioxyuracil) disintesis dengan
oksidasi asam urat yang dimana efeknya pada kelinci terjadi nekrosis tertentu dari
pulau pankreas. Sehingga aloksan digunakan untuk hewan model insulin
dependen diabetes mellitus. Aloksan diberikan secara parenteral: intravena,
intraperitonial atau subkutan. Dosis intravena Aloksan untuk menjadikan tikus
diabetes adalah 65 mg/kg BB (Gruppuso, et al., 1990, Boylan, et al., 1992).
Ketika aloksan diberikan intraperitonial dan subkutan dosis efektif harus 2-3 kali
lebih tinggi. Dosis intraperitoneal dibawah 150 mg/kg BB mungkin ticak cukup
untuk mendorong diabetes pada tikus (Katsumata, et al., 1992, 1993).
2.3.5 Mekanisme aloksan
Aloksan meningkatkan pengeluaran insulin tiba-tiba, pelepasan insulin
akibat aloksan dikarenakan respon dari penekanan pulau Langerhans. Penyerapan
Selain itu, aloksan dapat mereduksi dan mengurangi kerja dari gluthathione
(GSH) dan protein bound sulfhydryl (-SH) grup. Aloksan tereduksi menjadi asam
dialurik dan kemudian teroksidasi membentuk reactive oxygen species (ROS) dan
superoxide radicals dan dengan adanya H2O2 yang berasal dari superoxide
dismutase (SOD) dan besi sehingga menghasilkan radikal hidroksil yang reaktif.
ROS diperbaiki oleh ADP-ribosylation. ROS dapat merusak DNA pankreas dan
menginaktivasi kerja dari enzim antioksidan seperti superoxide dismutase,
catalase. Selain itu, aloksan meningkatkan konsentrasi ion Ca2+ bebas di sel beta.
Masuknya kalsium ke dalam sel beta dikarenakan oleh aloksan untuk
mendepolarisasi pankreas sel beta yang lebih terbuka tergantung saluran kalsium
dan meningkatkan masuknya kalsium ke dalam sel pankreas. Peningkatan ion
Ca2+ disertai ROS dapat menyebabkan kerusakan sel beta pulau pankreas (Rohilla
BAB III
METODE PENELITIAN
Metode yang digunakan adalah metode eksperimental meliputi
pengumpulan sampel, identifikasi sampel, pengolahan sampel, pemeriksaan
karakteristik simplisia, pemeriksaan golongan senyawa kimia simplisia,
pembuatan ekstrak etanol teripang, penyiapan hewan percobaan, pengujian efek
ekstrak teripang Pearsonothuria graeffei terhadap penurunan kadar glukosa darah
(KGD) mencit dengan metode induksi aloksan. Data hasil penelitian dianalisis
dengan metode analisis variasi (ANOVA) dengan tingkat kepercayaan 95%
dilanjutkan dengan uji Tukey HSD untuk melihat perbedaan nyata antar perlakuan
menggunakan program SPSS (Statistical Product and Service Solution).
Penelitian dilakukan di Laboratorium Farmakognosi dan Laboratorium
Farmakologi Fakultas Farmasi Universitas Sumatera Utara pada bulan Februari
sampai Mei 2015.
3.1 Alat dan Bahan 3.1.1 Alat - alat
Alat-alat yang digunakan pada penelitian ini meliputi lemari pengering,
blender (Philip), oven (Memmert), neraca listrik (Mettler Toledo), neraca hewan
(GW-1500), mikroskop, desikator, penangas air, rotary evaporator (Heidolph WB
2000), Glucometer (GlucoDrTM) dan Glucotest strip (GlucoDrTM strip test),
magnetic stirer, spuit, oral sonde, mortir dan stamfer, alat-alat gelas dan alat
3.1.2 Bahan-bahan
Bahan yang digunakan pada penelitian ini adalah teripang (Pearsonothuria
graeffei). Bahan kimia yang digunakan berkualitas pro analisa kecuali dinyatakan
lain adalah kloral hidrat, toluen, kalium iodida, bismuth nitrat, asam nitrat,
d α-naftol, besi (III) klorida, timbal (II) asetat, serbuk seng, serbuk
magnesium, asam asetat anhidrida, isopropanol, natrium hidroksida, asam klorida
pekat, asam sulfat pekat, kloroform, n-heksan, metanol, etanol 96% (teknis),
larutan fisiologis NaCl 0,9%, aloksan (Sigma Aldrich), metformin, glibenklamid,
Na-CMC dan air suling (teknis).
3.2 Penyiapan Sampel 3.2.1 Pengumpulan sampel
Pengumpulan sampel dilakukan secara purposif yaitu tanpa
membandingkan dengan sampel dari daerah lain. Bahan penelitian adalah teripang
Pearsonothuria graeffei yang diperoleh dari pantai di pulau Barang Lompo
kecamatan ujung tanah sebelah barat kota Makassar.
3.2.2 Identifikasi sampel
Identifikasi sampel dilakukan di Pusat Penelitian Oseanografi Lembaga
Ilmu Pengetahuan Indonesia (LIPI) Jakarta, Jl. Pasir Putih I, Ancol Timur,
Jakarta. Hasil identifikasi sampel dapat dilihat pada Lampiran 1 halaman 48.
3.2.3 Pengolahan sampel
Teripang dibersihkan dari kotoran dengan cara mencuci di bawah air
mengalir hingga bersih, kemudian dipisahkan dari bagian dalam perut dan
atas wadah. Sampel dikeringkan di lemari pengering. Teripang yang sudah kering
ini disebut simplisia hewan. Kemudian simplisia itu diblender sampai menjadi
serbuk, ditimbang beratnya. Selanjutnya, simplisia disimpan dalam wadah plastik
di tempat yang terlindung dari cahaya.
3.3 Pembuatan Pereaksi 3.3.1 Pereaksi Molisch
Sebanyak 3 g α-naftol P, dilarutkan dalam asam nitrat 0,5 N hingga
diperoleh larutan 100 ml (Depkes RI, 1995).
3.3.2 Larutan asam klorida 2 N
Larutan asam klorida pekat sebanyak 17 ml ditambahkan air suling
sampai 100 ml (Depkes RI, 1995).
3.3.3 Larutan asam sulfat 2 N
Larutan asam sulfat pekat sebanyak 9,8 ml ditambahkan air suling sampai
100 ml (Depkes RI, 1995).
3.3.4 Larutan asam nitrat 0,5 N
Sebanyak 3,4 ml asam nitrat pekat diencerkan dengan air suling hingga
volume 100 ml (Depkes RI, 1995).
3.3.5 Larutan timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat P dilarutkan dalam air bebas karbon
3.3.6 Larutan pereaksi kloralhidrat
Sebanyak 50 g kristal kloralhidrat ditimbang lalu dilarutkan dalam 71,43
ml air suling (Depkes RI, 1995).
3.3.7 Larutan pereaksi Liebermann-Burchard
Asam sulfat pekat sebanyak 5 ml dicampurkan dalam 50 ml etanol 96%,
lalu ditambahkan 5 ml asam asetat anhidrida ke dalam campuran tersebut (Depkes
RI, 1995).
3.4 Pemeriksaan Karakteristik Simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik,
pemeriksaan mikroskopik, penetapan kadar air, penetapan kadar sari larut air,
penetapan kadar sari larut etanol, penetapan kadar abu total dan penetapan kadar
abu yang tidak larut dalam asam. Gambar karakteristik teripang dapat dilihat pada
Lampiran 2 halaman 49.
3.4.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk, warna,
panjang, dan lebar dari teripang segar dan simplisia teripang Pearsonothuria
graeffei.
3.4.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik terhadap serbuk simplisia teripang
Pearsonothuria graeffei dilakukan dengan cara sampel diletakkan di atas kaca
objek yang telah diteteskan dengan larutan kloralhidrat dan ditutup dengan kaca
penutup kemudian diamati di bawah mikroskop. Gambar pemeriksaan
3.4.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen).
Prosedur kerja:
1. Penjenuhan toluen
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan ke dalam labu
alas bulat, didestilasi selama 2 jam, kemudiaan toluen didinginkan selama 30
menit dan volume air pada tabung penerima dibaca dengan ketelitian 0,05 ml
(WHO, 1998).
2. Penetapan kadar air simplisia
Sebanyak 5 g simplisia yang telah ditimbang seksama dimasukkan
kedalam labu alas bulat berisi toluen tersebut, lalu dipanaskan hati-hati selama 15
menit, setelah toluen mendidih kecepatan tetesan diatur lebih kurang 2 tetes
perdetik sampai bagian air terdestilasi, bagian dalam pendingin dibilas dengan
toluen. Destilasi dilanjutkan selama 5 menit kemudian tabung penerima dibiarkan
dingin sampai suhu kamar, setelah air dan toluen memisah sempurna volume air
dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa.
Kadar air dihitung dalam persen (WHO, 1998).
3.4.4 Penetapan kadar sari larut air
Sebanyak 5 gram serbuk yang telah dikeringkan di udara, dimaserasi
selama 24 jam dalam 100 ml air kloroform (2,5 ml kloroform dalam air suling
1000 ml) dalam labu bersumbat sambil sesekali dikocok selama 6 jam pertama,
dibiarkan selama 18 jam, kemudian disaring. Diuapkan 20 ml filtrat sampai kering
dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa
larut dalam air dihitung terhadap bahan yang telah dikeringkan diudara (Depkes
RI, 1995).
3.4.5 Penetapan kadar sari larut etanol
Sebanyak 5 gram serbuk yang telah dikeringkan diudara, dimaserasi
selama 24 jam dalam 100 ml etanol (95%) dalam labu bersumbat sambil sesekali
dikocok selama 6 jam pertama, dibiarkan selama 18 jam, kemudian disaring.
Diuapkan 20 ml filtrat sampai kering dalam cawan penguap yang berdasar rata
yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105°C sampai bobot
tetap. Kadar dalam persen sari yang larut dalam etanol (95%) dihitung terhadap
bahan yang telah dikeringkan di udara (Depkes RI, 1995).
3.4.6 Penetapan kadar abu total
Sebanyak 2 gram serbuk yang telah digerus dan ditimbang seksama
dimasukkan dalam krus platina atau krus silikat yang telah dipijar dan ditara,
kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, pemijaran
dilakukan pada suhu 600°C. Kemudian didinginkan dan ditimbang sampai
diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan
diudara (WHO, 1998).
3.4.7 Penetapan kadar abu tidak larut asam
Abu yang telah diperoleh dalam penetapan abu dididihkan dengan 25 ml
asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring dengan kertas masir atau kertas saring bebas abu, cuci
dengan air panas, dipijarkan sampai bobot tetap, kemudian didinginkan dan
ditimbang. Kadar abu tidak larut dalam asam dihitung terhadap bobot yang
3.5 Pemeriksaan Golongan Senyawa Kimia Simplisia 3.5.1 Pemeriksaan glikosida
Serbuk simplisia ditimbang sebanyak 3 g kemudian disari dengan 30 ml
campuran 7 bagian volume etanol 96% dan 3 bagian volume air suling (7:3),
direfluk selama 10 menit didinginkan dan disaring, pada 20 ml filtrat tambahkan
25 ml air dan 25 ml timbal (II) asetat 0,4 M, dikocok, diamkan selama 5 menit
lalu disaring. Filtrat disari sebanyak 3 kali, setiap kali dengan 20 ml campuran 3
bagian volume kloroform P dan 2 bagian volume isopropanolol P, pada sari yang
dikumpukan tambahkan natrium sulfat anhidrida P, disaring dan uapkan pada
suhu tidak lebih dari 50℃. Larutkan sisa dengan 2 ml metanol P, dimasukkan 0,1
ml larutan dalam tabung reaksi, uapkan di atas penangas air, pada sisa tambahkan
2 ml air dan 5 tetes Molisch, ditambahkan hati-hati 2 ml asam sulfat P, bila
terbentuk cincin berwarna ungu pada batas cairan, menunjukkan adanya ikatan
gula (reaksi Molisch) (Depkes RI, 1995).
3.5.2 Pemeriksaan saponin
Sebanyak 0,5 g sampel dimasukan ke dalam tabung reaksi dan
ditambahkan 10 ml air suling panas, didinginkan kemudian dikocok kuat-kuat
selama 10 detik, terbentuk buih atau busa tidak kurang dari 10 menit setinggi 1-10
cm, pada penambahan 1 tetes larutan asam klorida 2 N apabila buih tidak hilang
menunjukkan adanya saponin (Depkes RI, 1995).
3.5.4 Pemeriksaan steroid/triterpenoid
Sebanyak 1 g sampel dimaserasi dengan 20 ml n-heksan selama 2 jam, lalu
disaring. Filtrat diuapkan dalam cawan penguap, pada sisa ditambahkan 2 tetes
kecokelatan hingga ungu maka positif triterpenoid dan dari warna ungu menjadi
biru atau hijau maka positif steroid (Farnsworth, 1966).
3.6 Pembuatan ekstrak teripang
Pembuatan ekstrak dilakukan secara perkolasi dengan pelarut etanol 96%.
Cara kerja: Sebanyak 550 g serbuk teripang Pearsonothuria graeffei dibasahi
dengan penyari, ditutup dan dibiarkan selama 3 jam, kemudian dimasukkan ke
dalam alat perkolator. Lalu dituang larutan penyari etanol 96% secukupnya
sampai semua simplisia terendam dan terdapat selapis cairan penyari diatasnya,
mulut tabung perkolator ditutup dengan aluminium foil dan dibiarkan selama 24
jam, kemudian kran dibuka dan dibiarkan tetesan ekstrak mengalir 1 ml tiap
menit. Perkolasi dihentikan setelah 500 mg perkolat terakhir diuapkan tidak
meninggalkan sisa (Ditjen POM, 1979). Selanjutnya ekstrak diuapkan dengan alat
rotary evaporator sampai diperoleh ekstrak kental kemudian ekstrak dikeringkan
dengan freezedryer. Bagan alur pembuatan ekstrak teripang dapat dilihat pada
Lampiran 4 halaman 52.
3.7 Penyiapan hewan percobaan
Hewan percobaan yang digunakan dalam penelitian adalah mencit
sebanyak 25 ekor , dikelompokkan dalam 5 kelompok, setiap kelompok terdiri
dari 5 ekor mencit. Sebelum pengujian, terlebih dahulu mencit dikondisikan
selama 1 minggu dalam kandang yang baik untuk menyesuaikan dengan
3.8. Pengujian Aktivitas Antidiabetes
3.8.1 Pembuatan suspensi Na-CMC 0,5% b/v
Sebanyak 0,5 g Na-CMC ditaburkan dalam lumpang yang berisi ± 10 ml
air suling panas. Didiamkan selama 15 menit lalu digerus hingga diperoleh massa
yang transparan, lalu digerus sampai homogen, diencerkan dengan air suling,
dihomogenkan dan dimasukkan ke labu tentukur 100 ml, dicukupkan volumenya
dengan air suling hingga garis tanda.
3.8.2 Pembuatan aloksan 150 mg/kg BB
Aloksan monohidrat 150 mg dilarutkan dalam larutan fisiologis NaCl
0,9% dalam labu tentukur 10 ml. Larutan selalu dibuat baru setiap pengujian.
Perhitungan aloksan dapat dilihat pada Lampiran 13 halaman 63.
3.8.3 Pembuatan suspensi ekstrak etanol teripang (EET)
Masing-masing ekstrak dibuat suspensi dengan Na-CMC 0,5% dengan
dosis yang berbeda, dosis 200 mg/kg BB, 400 mg/kg BB dan 600 mg/kg BB.
Masing-masing dosis ditimbang dan dicampurkan dengan Na-CMC 0,5% sampai
homogen hingga volume 10 ml. Perhitungan dosis suspensi EET dapat dilihat
pada Lampiran 13 halaman 63.
3.8.4 Pembuatan suspensi metformin dosis 65 mg/kg BB
Tablet Metformin digerus dan diambil sebanyak 70 mg, dimasukkan ke dalam
lumpang dan ditambahkan suspensi Na-CMC 0,5% b/v sedikit demi sedikit sambil
digerus sampai homogen, volume dicukupkan hingga 10 ml. Perhitungan dosis
3.8.5 Pembuatan suspensi glibenklamid dosis 0,65 mg/kg BB
Tablet Glibenklamid digerus dan diambil sebanyak 26 mg, dimasukkan ke
dalam lumpang dan ditambahkan suspensi Na-CMC 0,5% b/v sedikit demi sedikit
sambil digerus sampai homogen, volume dicukupkan hingga 10 ml. Perhitungan dosis
suspensi glibenklamid dapat dilihat pada Lampiran 13 halaman 62.
3.8.6 Penyiapan hewan uji yang hiperglikemia
Hewan yang digunakan pada penelitian ini adalah mencit yang sehat dan
dewasa sebanyak 25 ekor yang terlebih dahulu dikarantina selama 2 minggu untuk
menyesuaikan diri dengan lingkungannya. Ditimbang berat badan dan diukur
kadar gula darah puasa masing-masing mencit sebelum percobaan dilakukan.
3.8.7 Penggunaan alat glucometer
Alat yang digunakan untuk mengukur KGD adalah Glucometer Gluko
DrTM dengan menggunakan test strip yang bekerja secara enzimatis. Glucometer
ini secara otomatis akan hidup ketika test strip dimasukkan dan akan mati ketika
test strip dicabut. Kode nomor yang muncul pada layar dicocokkan dengan yang
ada pada vial Gluko DrTM test strip. Test strip yang dimasukkan pada glucometer
maka pada bagian layar akan tertera angka yang sesuai dengan kode test strip,
kemudian pada layar monitor glucometer muncul tanda akan siap diteteskan
darah. Dengan menyentuh setetes darah ke test strip melalui aksi kapiler. Ketika
wadah terisi penuh oleh darah, alat mulai mengukur KGD.
3.8.8 Penentuan kadar glukosa darah (KGD)
KGD mencit yang dipuasakan (tidak diberi makan tetapi tetap diberi
minum) selama 10-16 jam sebelum percobaan diukur menggunakan glukometer
pembuluh darah vena, setelah ekor mencit didesinfektan dengan etanol 70%,
ujung ekor dipotong secara aseptik tetesan darah pertama dibuang, tetesan darah
berikutnya diserapkan pada test strip yang terselip pada alat. Ketika wadah pada
test strip terisi penuh oleh darah, alat mulai mengukur KGD. Bagan alur
pengukuran KGD mencit dapat dilihat pada Lampiran 5 halaman 53.
3.8.9 Uji aktivitas antidiabetes dengan metode toleransi glukosa
Uji pendahuluan dilakukan dengan metode tes toleransi glukosa oral
(TTGO) yaitu pemberian glukosa 50% dengan dosis 3 g/kg BB. Mencit sehat
yang sudah diaklimatisasi dipuasakan selama 10-16 jam kemudian ditimbang
berat badan dan diukur KGD. Mencit dibagi 5 kelompok masing–masing
kelompok 5 ekor.
Kelompok I : suspensi Na-CMC 0,5% b/v dosis 1% kg BB
Kelompok II : suspensi EET dosis 200 mg/kg BB
Kelompok III : suspensi EET dosis 400 mg/kg BB
Kelompok IV : suspensi EET dosis 600 mg/kg BB
Kelompok V : suspensi Glibenklamid 0,65 mg/kg BB
Satu jam kemudian masing – masing kelompok diberi glukosa 50% dosis
3 g/kg BB, pada menit ke-30, 60, 90 dan menit ke 120 diukur KGD mencit.
Kemudian dari hasil KGD dianalisis.
3.8.10 Uji aktivitas antidiabetes dengan metode induksi aloksan
Mencit jantan sebanyak 25 ekor dengan berat badan 20-30 g yang telah
dipuasakan ditimbang berat badannya, ditentukan KGD puasa, kemudian
masing-masing mencit diinduksi dengan aloksan dosis 150 mg/kg BB secara