KAJIAN GINJAL MONYET EKOR PANJANG
SEBAGAI BAHAN BAKU
VAKSIN POLIO ORAL TRIVALEN
DI PT BIO FARMA (PERSERO) BANDCJNG
OLEH:
MAHARANI
PROGRAM PASCA SARJANA
INSTITUT PERTANIAN BOGOR
ABSTRACT
MAHARANI. Study of Long Tailed Monkeys for Production of Trivalent Oral Polio Vaccine at PT Bio Farma (Persero). Under the direction of DONDIN SAJUTHI, JOKO PAMUNGKAS, and HASBULLAH.
In order to eradicate Poliomyelitis, Bio Farma as the only vaccines and human biomedical producer in Indonesia is responsible for supplying Trivalent Oral Polio Vaccines (TOPV) demand for Indonesia and half of the world. TOPV is produced by inoculating Polio seed virus on monkey kidney cell culture. The cell culture could be contaminated by one or more extraneous agents like simian virus. Contamination of cell culture could be reduced by using monkeys fiom closed colony with periodical screening test.
In Bio Farma, there are three conditions of monkeys used: pregnant monkeys with positive Simian'Foamy Virus (SFV) that will supply foetus, monkeys below 2 kg captured fiom forest and monkeys below 2 kg that weaned in Bio Farma. They were tested with Fluorescense Antibody Technique (FAT) for Simian Immunodeficiency Virus (SIV) and SFV and neutralization test for Simian Virus 40 (SV40).
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa tesis yang berjudul :
KAJIAN GINJAL MONYET EKOR PANJANG
Sebagai BAHAN BAKU VAKSIN POLIO ORAL TRIVALEN
di PT BIO FARMA (PERSERO).
Adalah benar merupakan hasil karya saya sendiri dan belum pernah dipublikasikan. Semua sumber data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor, Februari 2002
MAHARANI
KAJIAN GINJAL MONYET EKOR PANJANG
SEBAGAI BAHAN BAKU
VAKSIN POLIO ORAL TRIVALEN
DI PT BIO FARMA (PERSERO) BANDUNG
MAHARANI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Primatologi
PROGRAM PASCA SARIANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Kajian Ginjal Monyet Ekor Panjang
Sebagai Bahan Baku Vaksin Polio Oral Trivalen di PT Bio Farma (Persero)
Nama : Maharani
NRP : PRM 99658
Program Studi : Primatologi
Menyetujui,
1. Komisi Pembimbing
Ketua
Drh. Joko Pamungkas MSc
Anggota Anggota
Mengetahui
Ketua Program Studi Primatolo
Penulis dilahirkan di Manokwari, Irian Jaya pada tanggal 3 Mei 1969 sebagai
anak kedua dari pasangan Soekardjono dan Saparijatoen. Pendidikan sarjana
ditempuh di Program Studi Kedokteran Hewan, Fakultas Kedokteran IPB, lulus tahun 1993. Kesempatan untuk melanjutkan ke program magister pada program studi Primatologi dan pada perguruan tinggi yang sama diperoleh pada tahun 1999.
Beasiswa pendidikan pascasarjana diperoleh dari PT Bio Farrna (Persero).
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga 'karya ilmiah ini berhasil diselesaikan. Terna yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2001 ini adalah Produksi Vaksin Polio, dengan judul Kajian Ginjal Monyet Ekor Panjang sebagai Bahan Baku Vaksin Polio Oral Trivalen di PT Bio Farma (Persero).
Terima kasih penulis ucapkan kepada Direktur Utama PT Bio Farma atas kesempatan pendidikan yang diberikan, Dr. Errnan Boedisetianto sebagai Kadiv Produksi Vaksin Virus yang telah memberikan dukungan yang sangat berarti, Drh. Dondin Sajuthi,PhD, Drh. Joko Pamungkas, MSc dan Drh. Hasbullah, MSc, PhD selaku pembimbing. Disamping itu penghargaan penulis sampaikan kepada Dra. Iin Susanti beserta Staf Pengawasan Mutu Vaksin Virus PT. Bio Farma yang telah membantu selama pengumpulan data, serta Said Syahputra ,ST atas segala dukungannya sehingga penulis tetap dapat melaksanakan tugas kedinasan selama penelitian berlangsung. Ungkapan terirna kasih juga disarnpaikan kepada Dori, Pradna Aqmaril Paramitha, bapak, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2002
DAFTAR IS1
Halaman
...
DAFTAR TABEL vii
...
...DAFTAR GAMBAR v i i ~
...
DAFTAR LAMPIRAN Ix
PENDAHULUAN ... 1
Latar Belakang ... 1
...
Perumusan Masalah 4
Tujuan Penelitian ... 5 Manfaat Penelitian ... 5 Waktu dan Tempat Penelitian ... 6 Hipotesis ... 6
...
TINJAUAN PUSTAKA 7
Poliomielitis ... 7
...
Virus Polio Strain Sabin 1 1
...
Vaksin Polio Oral Trivalen 12
...
Ginjal Monyet 14
Simian Foamy Virus (SFV) ... 15 Simian Immunodeficiency Virus (SIV) ... 17
...
Simian Virus 40 (SV40) 19
...
BAHAN dan METODE
...
Seksio Sesaria
... . Persiapan Anak Monyet Tanpa Identitas
...
Persiapan Terhadap Monyet Sapih dari Induk Beridentitas
...
Nefiektomi
...
Pembuatan Biakan Jaringan Ginjal Monyet
...
Pemeliharaan Biakan Jaringan Ginjal Monyet
Uji Fluorescence Antibody Technic (FAT) Indirect terhadap
...
SIV dan SFV
...
Uji Netralisasi terhadap Antibodi SV40
...
KO-kultifasi Limfosit pada Biakan Jaringan Ginjal Monyet
...
Pembuatan Preparat Histologi
HASIL ... 29
Fetus Seksio Sesaria ... 29
Monyet Anak Tanpa Identitas Induk ... 31 Monyet Sapih dengan Identitas Induk ... 32
PEMBAHASAN ... 37
KESIMPULAN ... 44
...
DAFTAR PUSTAKA 45
DAFTAR TABEL
Halaman
1 . Survailans PFA di Indonesia Tahun 1995- 1998 ... 2
...
2 . Isolat SFV pada Primata 16
3 . Persentase Hasil Uji Serologis Fetus Seksio ... 29 4 . Persentase Hasil Uji Serologis Anak Monyet Tanpa Induk dan
Anak Monyet Sapihan ... 33
DAFTAR GAMBAR
...
1 . Poliomielitis pada Anak-anak
...
2 . Pemberian VPOT pada Pekan Imunisasi Nasional
Halaman
10
DAFTAR LAMPIRAN
[image:97.535.29.457.44.747.2]1 . Tabel 6 . Hasil Uji Serologis Serum Fetus Seksio Sesaria
...
Periode Januari-April200 1
2 . Tabel 7 . Hasil Uji Serologis dan CPE Anak Monyet Tanpa Induk ...
Tabel 8 . Hasil Uji Serologis dan CPE Anak Monyet Sapihan ...
3 . Tabel 9 . Uji Statistik Korelasi Berat Badan terhadap Korteks Ginjal
...
Fetus Monyet
...
4 . Komposisi Medium
...
5 . Singkatan
...
6 . Foto Kegiatan Penelitian
PENDAHULUAN
LATAR BELAKANG
Paralisa akibat infeksi virus polio atau poliomielitis secara langsung menyebabkan cacat tubuh permanen sehingga menurunkan kernampuan sumber daya manusia yang pada akhirnya merusak generasi yang akan datang. Dengan demikian sangat diperlukan tindakan pencegahan terhadap poliomielitis.
Pencegahari terbdap poliomielitis dapat dilakukan secara aktif melalui imunisasi Vaksin Polio Oral Trivalen (VPOT) yang merupakan hasil inaktifasi virus polio yang ditumbuhkan pada biakan jaringan ginjal Monyet Ekor Panjang
(MEPI.
Strategi eradikasi poliomielitis adalah: Imunisasi rutin terhadap bayi dan anak-
anak yang merupakan imunisasi dasar dan Pekan Imunisasi Nasional (PIN).
Semua negara di dunia melakukan imunisasi terhadap polio, minimal terhadap 90% bayi dan anak-anak sesuai rekomendasi World Health Organization (WHO) Expanded Programme on Immunization (EPI) dalarn upaya melindungi bayi dan anak-anak dari kesakitan dan kematian akibat poliomielitis. Imunisasi rutin terbukti dapat menurunkan kejadian poliomielitis dan sekaligus merupakan persiapan dari tahap eradikasi. PIN merupakan kegiatan yang paling penting untuk memutus sirkulasi virus polio ganas di negara-negara endemik. Distribusi virus yang berasal dari vaksin polio yang digunakan di negara-negara berkembang akan
berusia di bawah 5 tahun (balita) di negara yang bersangkutan diberikan VPOT sebanyak 2 dosis, tanpa memperhitungkan status imunisasi sebelurnnya dan PIN hams diadakan minimal tiga kali berturut-turut untuk menghentikan transmisi virus polio (1).
Upaya eradikasi poliomielitis di Indonesia telah mengalami kemajuan yang sangat berarti sejak tahun 1995. Dalam tahun yang sama telah diselenggarakan sunailan terhadap Paralisa Flaksid Akut (PFA) dan setiap kejadian PFA sesegera mungkin dilaporkan -kepada dinasltenaga kesehatan. Pada tahun 1995, 1996 dan 1997 Indonesia sukses dalam penyelenggaraan PIN dan lebih dari 22 juta balita mendapat 2 dosis VPOT. Sejak dimulainya PIN pada tahun 1995, jurnlah kasus Poliomielitis menurun drastis seperti yang ditunjukkan tabel 1 di bawah ini (2).
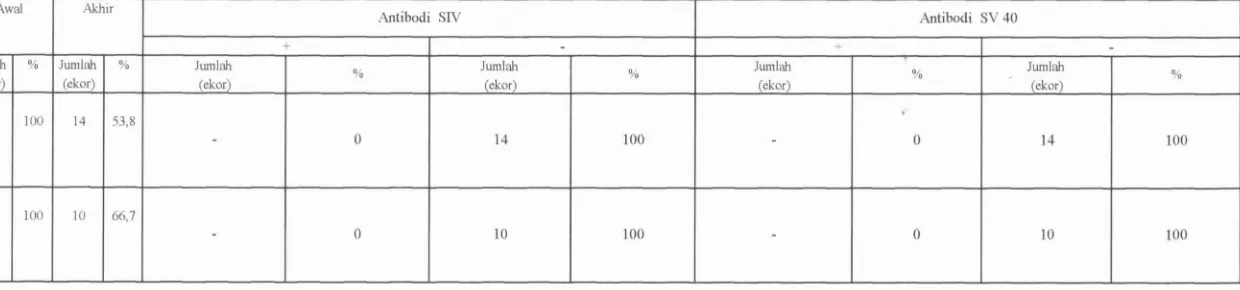
Tabel 1. Survailans PFA di Indonesia Tahun 1995-1998
Tahun
1995
Surnber : Epidemiological Bulletin, DepKes RI.tahun 1999.
1998
Sejalan dengan misi eradikasi terhadap poliomielitis, PT Bio Farma sebagai
Kejadian PFA
24
satu-satunya produsen vaksin dan bahan biomedis untuk manusia di Indonesia
*
:Klasifikasi Klinis810
mempunyai peranan strategik yang sangat penting artinya demi terlaksananya
Tingkat PFA
0,03
eradikasi virus Polio di Indonesia. PT Bio Farma bertanggung jawab terhadap 1,24
penyediaan vaksin Polio dalam ha1 ini VPOT. Untuk memenuhi kebutuhan dalam
Jumlah Spesimen 18 75,5 Kasus Polio yang kom- patibel 14 Kasus Virus Polio Ganas 7
[image:99.535.61.502.9.784.2]PERUMUSAN MASALAH
Pemenuhan kebutuhan ginjal MEP sebagai bahan baku pembuatan bulk vaksin polio menjadi ha1 yang sulit mengingat tingginya tingkat kontaminasi SFV, terutama pada MEP dewasa. Kontarninasi virus ini menyebabkan kerugian dalam jumlah besar karena biakan sel ginjal MEP rusak sehingga tidak dapat digunakan untuk produksi vaksin polio. Dengan demikian diperlukan ginjal MEP yang bebas dari virus SFV selain hams bebas pula terhadap agen penyakit lain yang dipersyaratkarroleh -WHO. Sebagai upaya dalam mengantisipasi kontaminasi virus tersebut, Bio Farma berupaya menggunakan ginjal fetus MEP yang fetusnya didapat melalui prosedur seksio sesaria. Walaupun secara nyata tindakan ini menurunkan tingkat kontaminasi SFV, tetapi prosedur ini masih dianggap kurang efisien karena: 1) Jumlah sel yang didapat relatif sedikit, 2) Kemungkinan kebuntingan pada monyet betina yang telah mengalami seksio sesaria akan menurun. Masalah yang akan dihadapi oleh PT Bio Farma pada masa yang akan datang adalah peningkatan produksi VPOT dalam jumlah besar sementara ketersediaan monyet bunting terbatas. Untuk mengatasi masalah tersebut telah dipertimbangkan adanya jalan keluar yaitu dengan menyiapkan koloni MEP yang bebas terhadap SV40, SIV dan SFV dengan cara menyeleksi monyet pada umur tertentu
.
yang digunakan akan berkurang dan 3) Volume VPOT dapat diramalkan sesuai berat badan MEP.
Dari hasil penangkaran monyet di Bio Farma, maka ada beberapa kelompok/kondisi MEP:
1. MEP bunting positif antibodi SFV yang dipelihara di Bio Farma untuk diambil fetusnya.
2. Anak MEP (<2kg) tanpa induk yang didapat dari luar Bio Farma.
3. Anak MEP- (<2 kg) dari induk yang diketahui sejarahnya dan lahir serta disapih di Bio Farma.
Berdasarkan kelompok tersebut direncanakan untuk mengoptimalisasikan produk ginjal dengan cara mendeteksi SV40, SIV dan SFV dalam berbagai kondisi MEP.
TUJUAN PENELITIAN
Penelitian dilakukan untuk mendapatkan informasi teknik pengurnpulan materi terbaik untuk bahan baku ginjal MEP yang bebas SV40, SIV dan SFV dalam rangka meningkatkan kapasitas dan kualitas VPOT.
MANFAAT PENELITIAN
WAKTU DAN TEMPAT PENELITIAN
Penelitian dilakukan di fasilitas penangkaran MEP dan laboratorium pengawasan mutu vaksin virus di PT Bio Farma (Persero) Bandung selama 12 bulan dari Januari sampai Desember 2001. Seluruh kegiatan penelitian dilakukan pada kondisi Bio Safety Level 2 dengan sistem Air Handling Unit yang senantiasa terkontrol.
HIPOTESIS
-
1. Berat badan fetus MEP berkorelasi positif dengan berat korteks ginjalnya. 2. Antibodi SFV pada fetus seksio merupakan antibodi maternal dan bukan
merupakan akibat infeksi pada fetus.
TINJAUAN PUSTAKA
Poliomielitis
Melalui catatan sejarah Mesir Kuno 1500 tahun sebelum Masehi telah diketahui adanya kejadian kelainan pada kaki dan deformitas tungkai yang menunjukkan karakteristik dari poliomielitis. Kejadian tersebut merupakan catatan pertama tentang paralisa yang kemudian diketahui dengan sebutan poliomielitis yang disebabkan oleh virus polio (4).
Agen penyebab poliomielitis adalah virus polio dari kelompok Picornavirus yang terdiri dari 3 tipe yaitu tipe 1 (Brunhilde), tipe 2 (Lansing) dan tipe 3 (Leon) dan bersifat patogen pada manusia dan primata. Virus ini tumbuh sangat baik pada biakan jaringan ginjal monyet (5). Poliomielitis tidak umum terjadi pada seluruh spesies, primata yang paling sering mengalami poliomielitis spontan adalah simpanse, gorila dan orangutan (6). Infeksi virus polio di alam terjadi pada simpanse (Pan troglodytes), gorila (Gorilla gorilla),orangutan (Pongo pygmaeus) dan rhesus macaque (Macaca mulatta) (7).
Sehingga dapat disimpulkan bahwa poliomielitis adalah infeksi bersifat enterik dan bukan infeksi olfaktori (8). Pada umurnnya virus polio ditularkan melalui rute oral-fekal, selain penfilaran dari nasofaring orang yang terinfeksi. Viremia yang berlangsung sementara dapat mengikuti terjadinya infeksi, tetapi perkembangan virus terutama terjadi di usus dirnana replikasi virus terjadi sekitar lima rninggu (4). Patogenesis poliomielitis terjadi melalui 3 tahap yaitu:
1. Virus polio memasuki tubuh melalui mulut dan memperbanyak diri di orofaring serta saluran peneernaan bagian bawah. Virus akan berada dalam sekresi faring dan feses selama masa inkubasi (5).
2. Tahap minor illness ditandai dengan kehadiran virus dalam darah, tenggorokan dan feses. Viremia timbul hanya beberapa hari yang kemudian diikuti oleh timbulnya antibodi. Virus di saluran pencernaan memasuki sistem limfatik dan aliran darah yang merupakan sarana penyebarannya (5).
3. Tahap akhir adalah invasi ke sistem syaraf. Diduga, virus masuk ke dalam sistem syaraf melalui pembuluh darah di medula oblongata atau masuk secara langsung dari pembuluh kapiler ke neuron. Bila virus sudah mencapai sistem syaraf, maka virus akan menyebar sepanjang serabut syaraf (5).
non-paralisa dapat timbul pada 1-2% dari semua kejadian infeksi dan dalam hubungannya dengan gejala poliomielitis abortif diikut i oleh invasi terhadap Central Nervous System (CNS) yang menyebabkan meningitis aseptik dan sering bersamaan dengan ketegangan otot punggung dan sakit punggung. Hal tersebut dapat berlangsung 2-10 hari dan dapat pulih total. Poliomielitis yang mengakibatkan paralisa terjadi 0,l-2% dari kejadian infeksi (Gambar 1). Paralisa terjadi 7-30 hari setelah infeksi dengan terlebih dahulu ditandai gejala poliomielitis abortif yang kemudian berkembang menjadi paralisa flaksid sebagai akibat terjadinya kerusakan syaraf motoris pada daerah spinal, bulbar atau bulbospinal dan ini tergantung dari daerah yang terinfeksi (4).
Poliomielitis yang berakibat paralisa, umurnnya disebabkan oleh virus polio yang menyerang daerah lumbar dari korda spinalis, sehingga menyebabkan kelemahan pada tungkai dan bagian bawah perut serta punggung (5). Virus polio yang berkembang pada sel syaraf, sebagian besar menyerang syaraf motoris, yaitu pada bagian anterior dari sel kordaspinalis dan pada kasus yang parah, daerah abu- abu ganglion dan posterior maupun dorsal ganglion dapat terinfeksi. Di otak besar, daerah yang terinfeksi dapat meliputi daerah retikulum,nukleus vestibular, vernis serebelum dan nukleus serebelum sebelah dalam.
yang baik,secara individu, bila penduduknya belum terimunisasi masih memiliki kemungkinan untuk tertular pada saat dewasa (9).
Virus Polio Strain Sabin
Virus polio strain Sabin memiliki tiga tipe yaitu tipe 1, 2 dan 3, sehingga virus yang digunakan untuk pembuatan VPOT juga harus terdiri dari ketiga tipe virus ini. Seed virus yang digunakan dalam pembuatan vaksin polio:
Tipe 1 LS-c,2ab/KP2 (Sabin Original Virus=SO), merupakan virus orisinil Mahoney yang diisolasi pada tahun 1941 oleh Drs. Francis dan Mack dari gabungan feses 3 orang anak sehat di Cleveland. Pada akhir tahun 1956, Merck, Sharp and Dohme Research Laboratories membuat 1 Lot bernomor 25 1 dengan melakukan satu kali pasase pada virus orisinil yang dibiakkan pada kultur jaringan ginjal monyet Rhesus. Hasil pasase virus orisinil tersebut merupakan LS- c,2ab/KP3 (MSD,SOM atau S0+1) dan digunakan untuk Jield trial di seluruh belahan dunia sebelum diakui sebagai Vaccine Origin (1 0).
Tipe 2 P71,Ch,2 ablKP2 (Sabin Original VirwSO), diisolasi oleh Drs. Fox dan Gelfand dari feses anak-anak sehat di Louisiana merupakan virus orisinil yang kemudian dijadikan strain P712 oleh Dr. Sabin. Seperti pada tipe 1, Merck, Sharp and Dohme Research Laboratories membuat Lot 23 1 melalui satu kali pasase dari Virus Origin Tipe 2 pada kultur jaringan monyet Rhesus. Hasil pasase virus orisinil tersebut merupakan P712,Ch,ab/KP3 (MSD,SDM atau S0+1) (10).
tahun 1961 dan Vaksin Polio Inaktifasi (VPI) yang dibuat oleh Salk pada tahun 1955 untuk negara-negara maju. VPOT berisi virus polio tipe 1,2 dan 3 yang rnasih hidup tetapi sudah dilemahkan dan dibuat dalam biakan jaringan ginjal monyet yang distabilkan oleh sukrosa. VPOT menyerupai infeksi alami dengan mengaktifkan imunitas humoral dan mensekresikannya ke usus. Selanjutnya akan terjadi pelipatgandaan jumlah virus dalam beberapa bulan sehingga terjadi penyebaran dari satu orang ke orang lain. VPI berisi virus polio tipe 1,2 dan 3
yang sudah diinaktifasi menggunakan 0,025% formalin selarna 12 hari pada suhu
37°C.
VPI tidak menyebabkan efek samping dan menghasilkan imunitas humoral yang tinggi setelah 2 atau 3 kali penyuntikan. VPI menghambat penyebaran virus polio ganas dari usus ke sistem syaraf Peningkatan kekebalan yang dihasilkan VPI secara nyata menunjukkan cukup baik untuk menghambat penyebaran virus polio di saluran pernafasan tetapi tidak cukup baik bekerja di saluran pencernaan. VPI bekerja baik di negara-negara dengan sanitasi yang tinggi dan tidak dapat digunakan untuk menghentikan transmisi virus polio ganas di negara-negara berkembang (9).
virus polio. Strain ini kemudian dikembangkan sebagai vaksin polio oral trivalen yang sekarang digunakan secara luas. Penelitian yang dilakukan oleh Salk dalam upaya menemukan vaksin polio yang lebih efektif, menunjukkan angka penggunaan monyet yang sangat tinggi yaitu 200.000 ekor. Menurut Lecornu dan Rowan, 1,2 juta spesies tunggal monyet rhesus telah digunakan untuk produksi d m uji bagi vaksin polio tersebut (8).
Vaksinasi polio secara rutin pernah dilakukan pada great apes dengan menggunakan dosis. anak-anak. Akan tetapi p e n m a n kejadian poliomielitis menyebabkan vaksinasi tersebut hanya dilakukan pada populasi yang berisiko tinggi saja (1 1). Vaksin polio oral trivalen buatan Sabin pernah digunakan untuk melindungi sirnpanse Gombe dan berbagai spesies great apes (7).
Ginjal Monyet
Kepekaan non human primates terhadap virus polio pertarna kali dilaporkan pada tahun 1909. Penggunaan ginjal monyet sebagai biakan jaringan dalam penelitian dan produksi vaksin polio menyebabkan penggunaan monyet dalam jumlah besar (12)
antara piramid medula yang berdampingan sebagai kolurnna renal atau biasa disebut kolumna Berth. Setiap piramid medula dengan jaringan korteks di dekatnya membentuk sebuah lobus. Dengan demikian ginjal bersifat multipiramidal atau multilobar (1 3).
Simian Foamy Virus (SFV)
Sejarah
SFV pertarna kali-ditemukan pada tahun 1950 sebagai virus kontaminan yang menyebabkan timbulnya efek sitopatik pada biakan jaringan ginjal monyet Rhesus. Sifat sitopatologik virus tersebut dalam menginfeksi biakan jaringan monolayer ditandai dengan adanya perluasan vakuola intraseluler dalam sel sinsisial multinukleat (14). Pembentukkan vakuola-vakuola ini menyebabkan biakan jaringan tidak dapat digunakan sebagai substrat penumbuh virus polio dan akan mengakibatkan kerugian ekonomi yang sangat besar. Biakan jaringan yang tidak menunjukkan vakuola tetap dapat digunakan dalam produksi vaksin polio.
Tabel 2. Isolat SFV pada Primata Serotipe No 1 Spesies 2 Prosimian 3 5 Rhesus 4
1,2, 3
Cercopithecus aetiops
I I
I I I I
Mergia A dan Lociw PA (1991)Replication and regulation of primate foaming viruses. Virology 184:475 dalam 18
1 , 2 , 3 Baboon
6
Taksonomi dan Klasifikasi
1,2, 3, 10
4,8,9
5
SFV diklasifikasikan ke dalam genus Spumavirus,satu dari tujuh genera famili New World Primates
' Simpanse
Retroviridae dengan spesies-spesies : chimpanzee foamy virus, bovine foamy virus, 6, 7
human foamy virus, feline foamy virus, simian foamy virus berbagai tipe dun equine foamy virus. Partikel virus ini bersifat sferik (diameter 100-140 nm) dan terdiri dari inti nukleoprotein berbentuk cincin dan diselaputi oleh dua lapisan seperti amplop (14)
Walaupun beberapa ciri-ciri SFV mirip dengan retrovirus lain, berdasarkan perbedaan sekuens nukleotidnya menunjukkan bahwa virus ini bersifat unik dan memiliki kelompok tersendiri dari retrovirus (14 ).
Replikasi
SFV bereplikasi melalui reserve transcription. Retrovirus memiliki dua gen
[image:113.535.44.481.50.790.2]yang diikuti masuknya deoksinukleosid trifosfat dari sitosol ke dalam nukleokapsid. Di tempat inilah viral reverse transcriptase dan protein lain menggandakan genom dari ssRNA virus menjadi dsDNA. DNA virus berpindah ke dalam nukleus dan bertugas sebagai provirus yang direkam oleh RNA polimerasi sel inang dan akan menghasilkan mRNAs serta molekul RNA genom
(15).
Satu siklus pertumbuhan dari SFV pada biakan jaringan nampak dalam 24 jam dan pertumbuhan maksimal tercapai dalam 72 jam setelah infeksi. Seperti halnya pada retrovirus lain, replikasi dari SFV berhubungan erat dengan proses pembelahan sel dari tubuh inangnya. Virus ini tumbuh secara optimal pada biakan jaringan yang berasal dari berbagai spesies dalam kondisi sedang aktif membelah
(14).
Simian Immunodeficiency Virus (SIV)
Sinonim: Simian lentivirus infections; Simian AIDS-like virus infecti0ns;Simian AIDS (16)
Sejarah
SIV pertarnakali diisolasi pada tahun 1984 dari M. mulatta di New England Regional Primate Research Centre. SIV memiliki morfologi, karakteristik pertumbuhan dan kelengkapan antigenik yang mirip dengan Human Immunodeficiency Virus (HIV). SIV juga pernah diisolasi dari M. fascicularis, M.
menyebabkan penurunan kemampuan daya tahan tubuh inang dengan gejala klinik utama diare dan penurunan berat badan hingga 60% dari berat semula. Gejala klinis ini diikuti oleh infeksi oportunistik lain yaitu Pneumocystis carinii, Cytomegalovirus, Clyptosporidium, Candih, adenovirus dan mikobakterium (1 7).
Taksonomi dan Klasifikasi
SIV termasuk ke dalam subfamili Lentivirus dari famili Retroviri&e.Spesies- spesies dari subfamili ini adalah Human Immunodeficiency Yirus
(My)
- I, Bovine Immunodeficiency Virus, Equine Infectious Anemia Virus, Feline Immunodeficiency Virus, African Green Monkey (AGM)-SIY, Chimpanzee-SIY, Mandrill-SIY, red- capped rnangabey SIY,sooty mangabey SIY, Rhesus SIY, pig tailed macaque SIV dan sykes monkey SIV. Partikel Lentivirus berukuran 80- 1 10 nm dan terdiri dari genom RNA dan enzim virus yang berada dalam inti di dalam amplop glikoprotein. SIV tidak bersifat onkogenik walaupun virus ini menyebabkan infeksi persisten dalam waktu lama yang seringkali menyebabkan penyakit kronik dan menimbulkan kelemahan bagi inang (17).Replikasi
SIV menyerang sel yang mengekspresikan molekul CD4. Virus tersebut menembus sel melalui interaksi antara glikoprotein amplop virus gp 120 dan molekul CD4 inang yang berperan sebagai reseptor. Pada saat virus berada dalam sel, RNA rantai tunggal virus menggandakan diri yang akhirnya berintegrasi ke dalam sel DNA inang (7) SIV mengandung genom RNA yang bereplikasi melalui DNA intermedia. Provirus DNA berintegrasi ke dalam kromosom sel host melalui integrasi viral encoded (1 7).
(1) Penumpukkan jumlah toksin dari asam nukleat virus dalam sitoplasma sel yang terinfeksi SIV (16).
(2) Penggabungan dari sel-sel yang terinfeksi sehingga menyebabkan kematian sel lainnya (1 6).
(3) Lisis dari limfosit T CD4+ yang terinfeksi (16).
Simian Virus 40 (SV 40)
Sejarah
SV 40 ditemukan-pada tahun 1960 sebagai kontaminan virus Polio. Pada saat itu SV40 tidak terdeteksi karena tidak menunjukkan efek sitopatik pada biakan jaringan. Pada tahun 1962, SV40 dinyatakan bersifat imunogenik pada bayi hamster dan ternyata memiliki kemampuan untuk berkembang dalam berbagai biakan jaringan (18). SV 40 juga pernah diisolasi dari biakan jaringan ginjal MEP dan Rhesus dengan penampakan kesehatan umum monyet yang normal selain ditemukan pada seed virus Polio dan vaksin lain untuk manusia. SV 40 dapat menyebabkan neoplasma pada manusia atau menginduksi berbagai jenis tumor seperti lymphocytic leukemia, lymphosarcoma, reticulum sell sarcoma dan osteogenic sarcoma. Antara tahun 1954 sampai 1961, ratusan orang tertular SV 40 melalui rute ingesti dari VPOT. VPOT ini terkontaminasi SV40 dari biakan jaringan ginjal monyet Rhesus yang digunakan. Virus ini berhasil diisolasi dari feses anak-anak yang tertular selama lima minggu pada saat anak-anak tersebut tidak menunjukkan gejala klinis. Berdasarkan laporan terakhir, SV40 ditemukan pada epen&domas dan choroidplexus tumor dari anak-anak tersebut (19)
Taksonomi dan Klasifikasi
Baboon polyomuvirus, Simian Virus 12 dan Simian Virus 40. Virus ini berbentuk
kapsid ikosahedral dengan diameter berukuran 45 nm (18). Replikasi
BAHAN dan
METODE
Pemeliharaan dan perawatan monyet dilakukan dengan mengindahkan kaidah yang mengatur hal-ha1 yang berkaitan dengan kesejahteran hewan maupun etika penggunaan hewan percobaan. Semua prosedur pemeliharaan, perawatan, maupun pemanfaatan fasilitas mengikuti protokol baku yang berlaku di PT BioFarma seperti yang tertulis dalam Dokurnen Nomor 115 K-Kera-01. Beberapa metode pelaksanaan penelitian ini dicantumkan di bawah.
Seksio Sesaria
Monyet bunting 130 hari disuntik dengan Atropin sulfas dosis 0,05 mgkg berat badan (bb) secara intra muscular (IM) dan kemudian dilakukan dengan pembiusan awal menggunakan Ketamine-HC1 10 mgkg bb IM. Selanjutnya persiapan dan pelaksanaan prosedur Seksio Sesaria mengikuti protokol baku yang berlaku di PT BioFarma dan didokumentasikan sebagai Dokumen No. 1 1 5K-Kera- 10 (20).
Persiapan Anak Monyet Tanpa Identitas
Anak monyet tanpa induk diseleksi berdasarkan atas berat badan, yaitu hanya
dipilih individu dengan berat badan kurang dari 1 kg, kelincahan dalam ha1 gerak maupun kondisi serta kesehatan umum yang baik (Gambar 27). Setelah anak monyet dibius, dilakukan penimbangan berat badan, anak monyet selanjutnya diberi identifikasi dengan cara ditato (Gambar 28), selanjutnya dilakukan uji tuberkulin secara penyuntikan melalui rute intra cutan pada kelopak mata atas (Gambar 29 dan 30), dilakukan deworming melalui pemberian ivermektin, diberi suntikan vitamin B kompleks, diberi antibiotika standar serta diambil darahnya untuk pemeriksaan status mikrobiologisnya (Gambar 3 1). Dua sampai 3 anak monyet dengan berat badan yang hampir sama dikandangkan dalam kandang stainless steel yang telah dialasi kain tebal supaya anak monyet tidak terperosok
(Gambar 32). Selanjutnya persiapan selengkapnya mengikuti protokol baku yang berlaku di PT BioFarma dan didokumentasikan sebagai Dokurnen Nomor 11 5K- Kera-06 (21).
Persiapan Terhadap Monyet Sapihan dari Induk Yang Beridentitas
Seperti yang dilakukan terhadap anak monyet tanpa identitas induk, maka anak monyet sapihan dengan induk yang diketahui identitasnya juga dipersiapkan selengkapnya dengan mengacu kepada protokol baku yang berlaku di PT BioFarma dan didokumentasikan sebagai Dokumen Nomor 1 1 5K-Kera-06 (2 1).
Nefrektomi
Pelaksanaan pengambilan ginjal (nefrektorni) dari monyet sepenuhnya mengikuti protokol baku yang berlaku di PT BioFarma dan didokumentasikan sebagai Dokurnen Nomor 1 15M-OPV-04 (22).
Pembuatan Biakan Jaringan Ginjal Monyet
Ginjal monyet dalam botol berisi media perendam ginjal (Trypsin Citrat Diluent, NaHCOs 7%, Erythromycin lo4 pglml, Kanamycin 5x10' pglml) diambil dari dalampass box dengan menggunakan towel yang telah dibasahi dengan larutan hibitane 0,5% dalam alkohol70% kemudian dibawa ke ruang tripsinisasi. Kondisi media perendam ginjal diperiksa secara makroskopis terhadap warna dan kekeruhan. Kualitas dan kuantitas ginjal diperiksa di bawah clean bench. Ginjal dicuci dengan medium pencuci dalam corong tanpa saringan dengan bantuan pinset. Ginjal dimasukkan ke dalam medium perendam.
ginjal, kemudian dimasukkan ke dalam medium perendam ginjal. Ginjal diletakkan dalam cawan petri beralas selembar kertas saring yang telah dibasahi medium larutan dispase (Hank's Buffer Saline Solution ,NaHC03 7%, Erythromycin lo4 pglml, Kanamycin 5x10~ pglml, Dispase lo%, Calf serum)
(Gambar 33). Medium perfusi (Trypsin Citrat Diluent, NaHC03 7%, Erythromycin
lo4 pglrnl, Kanamycin 5x10~ pglrnl, Tripsin 5% dalam Trypsin Diluent) disiapkan dalam syringe lOml dengan jarum nomor 26. Ginjal disuntik melalui arteri renalis sampai darah d k i dalam ginjal keluar semua (Gambar 34).
P e h s i dilakukan secara perlahan sampai kondisi ginjal menjadi agak lunak. Ginjal diletakkan dalam cawan petri diatas 2 lembar kertas saring yang telah dibasahi larutan dispase, kemudian dipotong menjadi ukuran kecil (3mm3 sld 5 mrn3) menggunakan pisau bedah nomor 22. Potongan ginjal dimasukkan ke dalam digestion jlask berisi larutan dispase menggunakan spatula. Sifon dipasang dan disambungkan ke botol Roux (LR) penampung. Magnetic stirrer dalam waterbath dipasang perlahan-lahan pada suhu 36,5OC. Suspensi sel ditampung dalam botol LR yang diletakkan dalam kotak berisi es, dan selanjutnya dihomogenkan. Sebanyak 50 ml larutan dispase dimasukkan ke dalam suspensi sel setiap kali pemutaran, selanjutnya suspensi diputar dan ditampung kembali ke dalam botol LR. Hal
ini
dilakukan sampai semua sel ginjal tersuspensikan (tergantung kondisi ginjal, rata-rata mencapai 5-7 kali pengulangan).dalam 1100 ml medium pertumbuhan (Dulbecco's Modified Eagle Medium,
NaHC03 7%, Erythromycin lo4 pglrnl, Kanamycin 5x10~ pglrnl, Dispase lo%,
Calf serum ) dengan menggunakan pipet. Suspensi sel disaring menggunakan mesh dan corong, dan ditampung ke dalam botol LR yang telah disediakan. Konsentrasi sel dihitung dengan menggunakan karnar hitung improved Neubauer. Sel ditanam dengan konsentrasi awal0,6 x lo5 sel/ml.
Volume suspensi sel akhir dihitung dengan rumus: Jumlah sel yang hidup per- ml dibagi jundah sel yang ditanam. Suspensi sel tersebut diencerkan dalam medium pertumbuhan sesuai volume perhitungan. Suspensi sel dibagikan ke dalam setiap tray masing-masing 200 rnllcell factory dengan sistem tertutup. Botol berisi biakan sel diletakkan dalam ruang inkubator bersuhu 36'5°C (Gambar 35). Semua barang kotor habis pakai dikumpulkan dan dikeluarkan melalui pass box ke ruangan desinfeksi untuk didesinfeksi dengan autoklaf. Semua barang bersih yang tidak terpakai dikembalikan kedalam ruang persiapan melalui pass room. Meja kerja dibersihkan dengan hibitane 0,2% dalam alkohol 70%. Lantai dibersihkan dengan vacuum cleaner dan dibersihkan menggunakan spons yang dibasahi larutan NaOCl0,05%.
Prosedur pembuatan biakan jaringan ginjal monyet didokumentasikan sebagai Dokurnen Nomor 1 15M-OPV-04 (22).
Pemeliharaan Biakan Jaringan Ginjal Monyet
Pemeliharaan sel dilakukan secara aseptis di bawah laminarflow vertikal. Sel yang akan dipasase diobservasi dibawah rnikroskop untuk melihat kondisi sel. Medium pemeliharaan dihangatkan pada suhu kira-kira 37°C. Cairan sel dibuang ke dalam wadah desinfeksi. Larutan tripsin 0'1% sebanyak 10 ml ditambahkan ke dalam botol sel. Botol sel dimiringkan agar seluruh perrnukaan sel terendam oleh
larutan tripsin.Larutan dibuang ke dalrn wadah desinfeksi (Gambar 36). 10 ml
tripsin ditambahkan kembali. Langkah sebelumnya dilakukan kembali
.
Botol sel ditutup dan diinkubasikan pada suhu kamar hingga sel hampir hampir terlepas dari dinding botol.Medium sebanyak 10 ml ditambahkan dengan cara menyemprotkan ke dinding botol yang ditempeli sel. Dengan cara isap-semprot, sel disuspensikan ke dalam medium sampai diperoleh suspensi homogen. Suspensi sel dimasukkan ke dalam botol sentrifuse; botol bekas sel dibilas dengan & 30 ml medium, dan disatukan dalam botol sentrifuse. Suspensi sel disentrifbgasi dengan kecepatan 240 x g ,selama 10 menit pada suhu kamar. Supernatan hasil sentrifuse dibuang.
Botol SR diisi dengan 210 ml medium pemeliharaan. Endapan hasil sentrifugasi disuspensikan dengan
+
10 ml medium dari botol SR hingga homogen. Suspensi sel dimasukkan ke dalam botol SR tersebut. Botol sentrifuse diisi dengan medium dari botol SR, kemudian bilasan tersebut disatukan ke dalam botol SR. Suspensi sel didistribusikan ke dalam 3 botol SR masing-masing 70 ml dengan pipet 40 ml.Botol SR ditutup dengan prop no.9. Botol SR diberi tanda berupa nama sel, nomor pasase dan tanggal kerja. Botol SR tersebut diinkubasi pada suhu 36°C dalam posisi horizontal.
Prosedur pemeliharaan biakan jaringan ginjal didokumentasikan dalam Dokumen Nomor 202K-Psel(23).
Uji Fluorescence Antibody Technic (FAT) indirect terhadap SIV dan SFV
diinkubasikan pada suhu 37°C selama 45 menit. Pencucian terhadap slide dilakukan dengan PBS sebanyak 3 kali selama 30 menit. FITC-conjugate yang mengandung anti-IgG manusia (anti human IgG) diencerkan menjadi 1 :20 (10 ul FITC-conjugate dengan 190 ul PBS). Conjugate yang telah diencerkan tersebut direaksikan dengan pereaksi sebelumnya dengan cara diteteskan pada slide sebanyak 8ul setiap sumurnya. Slide diinkubasikan kembali pada suhu 37°C selama 45 menit. Selanjutnya slide dicuci dengan PBS sebanyak 3 kali selama 10 menit. Mounting medium (-1:9 gliserin dalam larutan dapar karbonat) diaplikasikan ke permukaan slide sebelum slide ditutup dengan slide cover glass. Pembacaan hasil uji FAT dilakukan dengan observasi menggunakan mikroskop fluoresens. Protokol lengkap mengenai uji FAT didokumentasikan sebagai Dokumen Nomor 202T-FAT
(24).
Uji Netralisasi terhadap Antibodi SV40
Kultur sel ginjal monyet vervet (Cercopithecus aethiops) dipersiapkan sebagai indikator pertumbuhan virus. Setelah thawing dari tangki Nitrogen cair, sel dihitung jumlahnya dan dipastikan dalam kondisi baik. Serum monyet yang akan diuji kandungan antibodinya terhadap SV40 diencerkan 1:4 dengan cara melarutkan 0,3 ml serum ke 0,9 ml pelarut (M-199 H, Bovine albumin, NaHC03
dan Erythromycin lo4 pglml, Kanarnycin 5x10~ pglml ). Antiserum SV40 sebagai kontrol positifdiencerkan 1 : 10 dengan cara melarutkan 0,lml antiserum dengan 0,9 ml pelarut.
diinkubasikan dalam waterbath dengan suhu 36 "C selama 2 jam. Sel dicuci menggunakan larutan 1 ml HBSS, NAHC03 7% dan antibiotika per-tabung sebanyak 2 kali. Sebanyak 1 ml medium pemelihara ditambahkan pada setiap tabung. Inokulum (0,2 ml) ditambahkan ke dalam setiap tabung dan setiap pengenceran diaplikasikan sebanyak 5 tabung. Tabung berisi inokulum diinkubasikan selarna 14 hari dalam inkubator 36°C dengan observasi yang dilakukan setiap hari.
Prosedur lengkap uji netralisasi didokumentasikan dalam Dokumen Nomor 202T-SVT (25).
KO-kultifasi Limfosit pada Biakan Jaringan Ginjal Monyet
Darah perifer monyet diambil sebanyak 3 ml dan dimasukkan ke dalam tabung yang berisi EDTA dan dicampur dengan baik. Tabung berisi darah disentrifus dengan kecepatan 261 x g sampai sel darah mengendap. Bagian cairan plasma dan sedikit permukaan endapan sel diambil dan dimasukkan ke dalam tabung steril yang lain (Gambar 37).
Lymphocyte Separation Medium (LSM) dihomogenkan dengan baik sebelum digunakan. Sebanyak 3 ml LSM dimasukkan ke dalam tabung sentrifus 15 ml.
kemudian disentrihs dengan kecepatan 261 x g selama 10 menit. Limfosit dipisahkan kembali terhadap sisa LSM (Gambar 41).
Limfosit diko-kultifasi pada biakan jaringan sehingga menutupi seluruh permukaan. Lakukan rocking setiap 15 menit selama 1 jam (Gambar 42). Medium pemelihara ditambahkan ke dalam flask yang telah diko-kultifasi dengan limfosit (Gambar 43). Flask-flask tersebut diletakkan dalam inkubator. Biakan jaringan ginjal monyet diobservasi terhadap efek sitopatik menggunakan mikroskop setiap 24 jam (Gambar 44). -
Prosedur lengkap ko-kultivasi mengikuti prosedur isolasi limfosit secara in vitro dari CAPPEL ICN Biomedical, Inc.
Pembuatan Preparat Histopatologi
Ginjal direndam dalam larutan forrnalin 10% selama 5-7 hari. Ginjal dipotong sehingga daerah korteks terlihat dengan ketebalan 2-3 mm Potongan ginjal difiksasi dalam larutan formalin 10% selama 5 hari. Potongan ginjal dideformaldehida dan dehidrasi menggunakan mesin otomatis. Jaringan difiksasi dalam parafin cair yang kemudian dibekukan.
Jaringan diwarnai dengan Hematoxylin-Eosin (HE) dan mounting solution (rninyak "Eukitt") diaplikasikan sebelum ditutup dengan cover glass. Sampel histologi diperiksa di bawah mikroskop untuk observasi terhadap kemungkinan perubahan sel ginjal.
HASIL
Fetus Seksio Sesaria
Dari tabel 3 diketahui bahwa 102 induk MEP yang digunakan dalam penelitian ini tidak satupun menunjukkan adanya antibodi SIV dan SV40. Dernikian juga dengan fetus yang dihasilkan melalui seksio sesaria, seluruhnya tidak menunjukkan antibodi terhadap kedua virus tersebut.
Tabel 3. Persentase Hasil Uji Serologis Fetus Seksio
Dari 102 ekor induk monyet tersebut ternyata 33 ekor (32,3%) positif terhadap antibodi SFV 1. Fetus yang dihasilkannya 7 ekor (636%) negatif dan 26 ekor (25,5%) positif terhadap antibodi SFV 1. Enampuluh sembilan ekor induk lainnya (67,7%) positif terhadap antibodi SFV 3 dan fetus yang dihasilkan 25 ekor (24,5%) positif (gambar 4 ) dan 44 ekor (43,14%) negatif (gambar 1 ) terhadap antibodi SFV 3. Tidak satupun dari 102 fetus monyet tersebut menunjukkan efek sitopatik pada biakan jaringan ginjalnya (gambar 5 ).
Berdasarkan data berat badan fetus dan berat korteks ginjal yang dihasikan (lampiran l), didapatkan nilai p=1,6E-07 atau nilai p<0,05. Dengan asumsi HO
adalah tidak adanya korelasi antara berat badan fetus dengan berat korteks ginjal No b 1 2 Hewan Induk Bunting (n=102) Fetus (n=102) Antibodi SIV Jumlah (ekor)
-
% 0 0 Antibodi SV40 Jumlah (ekor)Positif Antibodi SFV
%
0
0
Negatif Antibodi SFV
SFV 1 SFV 1
Jumlah (ekor) 33 26 SFV 3 Jumlah (ekor)
-
7 % 32,3 25,5 Jumlah (ekor) 69 25 SFV 3 % 6,9 % 67,7 24,5 Jumlah (ekor)0 - 0
44
%
dan H1 adalah adanya korelasi antara berat badan fetus dengan berat korteks ginjal. Dengan nilai p<0,05 maka HO ditolak. Dengan demikian H1 diterima sehingga dapat dinyatakan bahwa berat badan fetus berkorelasi positif terhadap berat korteks ginjal. Persamaan yang didapat dari hubungan antara kedua peubah tersebut adalah: y = 1,4492 x
+
0,43 18.Gambar 3. FAT Negatif terhadap Antibodi SFV 3 (Perbesaran 20x 10)
Gambar 5 . Biakan Ginjal Fetus Monyet Ekor Panjang (Perbesaran 20x 10)
Monyet Anak Tanpa Identitas Induk
Tabel 4 menunjukkan bahwa dari 26 ekor an& MEP tanpa induk yang didapat dari hutan, 12 ekor (46,2%) mengalami kematian. Sehingga anak MEP yang digunakan sampai akhir penelitian sejumlah 14 ekor. Pada pengujian serologis ke 5 yaitu pada bulan ke 8 setelah kelompok tersebut dipelihara di fasilitas khusus, 2 ekor (14,3%) menunjukkan adanya antibodi terhadap SFV 3. Sebelumnya, semua an& monyet negatif terhadap antibodi SFV 3.
Melalui uji konfirmasi ko-kultivasi limfosit (gambar 6) ke 2 monyet tersebut pada biakan jaringan ginjal monyet, diketahui adanya efek sitopatik menyerupai gelembung busa sabun yang timbul kurang dari 24 jam (gambar 7). Sedangkan 12 ekor lainnya yang hingga akhir masa penelitian (16 bulan) tetap tidak menunjukkan adanya antibodi SFV 3, ternyata 10 ekor diantaranya menunjukkan efek sitopatik pada ko-kultivasi limfosit.
ekor (71,4%) menunjukkan efek sitopatik sebelum dilakukan pasase, 2 ekor (14,3%) sesudah pasase pertama dan 2 ekor (14,3%) tidak menunjukkan efek sitopatik setelah mengalami 4 kali pasase.
Monyet Sapih dengan Identitas Induk
Tabel 4 juga menunjukkan bahwa dari 15 ekor anak MEP sapihan, 5 ekor (33,3%) mengalami kematian. Sehingga anak MEP sapihan yang digunakan sampai
akhir
penelitian berjumlah 10 ekor. Kesepuluh ekor anak monyet tersebut, hingga akhir masa penelitian (bulan ke 7) tidak menunjukkan adanya antibodi SFV 3. Tetapi melalui uji konfirmasi diketahui bahwa 5 ekor (50%) menunjukkan efek sitopatik dengan perincian : 3 ekor (30%) menunjukkan efek sitopatik sebelum pasase dilakukan,
1 ekor (10%) sesudah pasase kedua dan 1 ekor (10%) sesudah pasase ketiga. Lima ekor lainnya (50%) tidak menunjukkan efek sitopatik setelah mengalami 4 kali pasase. [image:129.535.54.475.0.780.2]Tabel 4. Persentase Hasil Uji Serologis Anak Monvet Tanpa Induk dan Anak Monyet Sapihan
Lanjutan Tabel 4. Persentase Hasil Uji Serologis Anak Monyet Tanpa Induk dan Anak Monyet Sapihan
No Hewan
I A n A Monyet Tanpa Induk ?An& Monyet Sapthan No 1 ' Hewan Anak Monyet Tanpa Induk ?An& Monyet Sapihw Awal Jumlah (ekor) 26 15 O o 100 100 Akhir
Antihodi SFV 3 Jumlah
(ekor)
14
10
Efek sitopatik yang timhul pada inokulasi lirnfosit .4nt1bodi SIV
O o
5'4,s
66,7
+
Ant~hocli SV 40
Sehelum Pasase Jumlah (ekor) 2 - Jumlah (ekor) 12 10 + 14.3 0 Oh 85,7 100 Jumlah (ekor) Jumlah (ekor) 14 10 +
Sesudah Pasase I
+ O'o 0 0 ". 100 100 Jumlah (ekor) Tumlah (ekor) 14 10 Jumlah (ekor) 10 3 Jumlah (ekorj 4 7 O/o 0 0 O h 100 100
Sesudah Pasase II
90 71.4 30 "6 28,6 70 + Jumlah (ekor) 2 - Jumlah (ekor) 2 7
Sesudah Pasase IU
% 1 4 0 ' 4 14.3 70 + Jumlah (ekor) - 1 Jumlah (ekor) 2 6
Sesudah Pasase IV
[image:130.790.92.712.117.262.2]Gambat 6 . KO-kultivasi Limfosit pada Biakan Ginjal Monyet (Perbesaran 20x1 0)
Gambar 7. Efek Sitopatik SFV Timbul dalam 24 jam (Perbesaran 20x 1 0)
[image:131.535.135.406.44.229.2]Gambar 8. Efek Sitopatik SFV dalam 48 jam (Pabesaran 20x20)
Tanda panah: Efek Sitopatik Foamy
Gambar 9. Efek Sitopatik SFV dalam 72 jam
(Perbesaran 20x20)
[image:132.535.94.421.43.767.2] [image:132.535.135.426.44.245.2]Gambar 10. Efek Sitopatik SFV dalam 7 hari (Perbesaran 20x20)
Tanda panah: Efek Sitopatik Foamy
Gambar 1 1 . Efek Sitopatik SFV pada Biakan Ginjal Anak Monyet Sapih (Perbesaran 20x10)
[image:133.535.101.404.38.622.2] [image:133.535.134.405.45.255.2]Gambar 12. Sel Tidak Mengalami Perubahan pada
Gambaran Histopatologi Ginjal Anak Monyet Sapih
(Perbesaran 20x20)
PEMBAHASAN
Monyet yang berada pada fasilitas penangkaran PT Bio Farma baik yang digunakan sebagai bahan baku produksi rnaupun hewan penelitian tidak pernah menunjukkan adanya antibodi terhadap SIV dan SV40 pada monitoring yang dilakukan secara rutin. Monitoring SIV dilakukan melalui metode FAT dan sampel dinyatakan negatif bila tidak menarnpakkan pendaran cahaya hijau dan dinyatakan positif bila menampakkan pendaran cahaya hijau terang. Uji netralisasi terhadap SV40 pada biakan ginjal vervet dinyatakan positif bila virus tidak tumbuh dan dinyatakan negatif bila SV 40 tumbuh.
Berdasarkan survai yang dilakukan oleh Ohta (27) pada tahun 1988 terhadap 478 ekor monyet dari spesies-spesies Macaca arctoides, M. nemestrina, monyet ekor panjang (427 sampel), M. maura, Hylobates lar dan Pongo Pygrnaeus yang ditangkap dari negara-negara Asia seperti Malaysia, Indonesia ,Filipina dan Thailand ternyata tidak satupun yang menunjukkan seropositif terhadap SIV melalui uji Immunofluorescence Assay (IFA) dengan menggunakan sel MOLT-4 yang diinfeksi dengan SIV(AGM-1) yang kemudian dilakukan juga uji konfirmasi dengan Western Blotting. Sejauh hi, hanya African Green Monkey (AGM), sooty mangabey dan mandrill yang dapat terinfeksi SIV di habitat aslinya. Berdasarkan pemeriksaan serologis, diketahui 20-50% AGM di Kenya, Ethiopia, Afkika Selatan dan Senegal yang memiliki antibodi terhadap SIV. AGM yang dipelihara pada penangkaran di Karibia menunjukkan seronegatif terhadap SIV. MEP tidak pernah menunjukkan adanya SIV pada habitat asli di Asia
.
positif SFV kejadiannya 50% positif dan 50% negatif terhadap antibodi SFV. Antibodi yang dikandung oleh fetus sesungguhnya adalah antibodi maternal (Ig G) yang didapat oleh fetus melalui tembuni. Pada primata, tembuni bersifat trofoblas hemokorial dirnana darah induk berhubungan langsung dengan trofoblas melalui 3
lapisan jaringan pemisah antara sirkulasi induk dan fetus. Tembuni semacam ini hanya memungkinkan Ig G saja yang berpindah dari induk ke fetus, kecil kemungkinan bagi Ig M, Ig A atau Ig E untuk melewatinya. Dengan cara ini Ig G dapat rnasuk aliran darah fetus sehingga bayi yang baru lahir dapat memiliki tingkat Ig G sebanding dengan yang bersirkulasi dalam darah induk. Kandungan antibodi maternal paling tinggi terjadi pada beberapa waktu setelah lahir dan menurun dengan cepat sesudahnya, karena sel usus yang mampu menyerap imunoglobulin berganti dengan sel yang lebih dewasa. Absorpsi semua jenis imunoglobulin akan menurun ke tingkat yang paling rendah 24 jam setelah lahir. Pemindahan imunoglobulin melalui tembuni ini lebih tinggi daripada kolostrum (28). Dari nefiektomi 102 fetus hasil seksio diketahui tidak satupun biakan ginjal fetusnya menunjukkan efek sitopatik, ha1 ini menunjukkan bahwa fetus tidak mengandung SFV. Diduga bahwa antibodi yang dikandung oleh fetus sesungguhnya adalah antibodi maternal yang didapat dari induk dan bukan reaksi infeksi yang dialami fetus sendiri. Hal didukung oleh data yang berhasil dikumpulkan dari tahun 1992 hingga 2000 ternyata sernakin muda usia monyet maka kemungkinan terjadinya kontaminasi SFV semakin rendah (Tabel 5)
Tabel 5
.
Persentase Kontaminasi SFV pada Single Harvest BulkPolio
Kelompok anak MEP dari hutan tanpa induk yang telah dipelihara di fasilitas koloni bersih tidak satupun menunjukkan adanya antibodi SFV tipe 3.
Pada bulan ke 8 , 2 ekor anak menunjukkan adanya antibodi SFV tipe tersebut. Hal ini dimungkinkan oleh karakter SFV yang bersifat laten dan menetap, dirnana terjadi keseimbangan antara SFV dan inangnya. Diduga anak monyet dari hutan sudah mendapatkan infeksi SFV sebelum masuk ke fasilitas Bio Farrna, hanya saja virus ini berada dalam tubuh dalam kondisi tertekan yang kemudian menghancurkan hanya sekelompok kecil sel tanpa menyebarkan infeksi lebih luas. Dalam kondisi ini SFV akan sulit terdeteksi kehadirannya karena beberapa kemungkinan seperti:virus terikat oleh antibodi,virus berada dalam jurnlah sangat sedikit atau virus berada dalam bentuk tidak infeksius/infeksius inkomplet (29). No 1 2 3 4 5 6 7 8 9 Sumber: Tahun 1992 1993 1994 1995 1996 1997 1998 1999 2000 Bagian Kelornpok MEP Anak Dewasa Anak Dewasa Anak Anak Anak . Fetus
Anak (<2bln) Fetus
Anak (< 2bln) Fetus
Anak (< 2bln) Fetus
Anak (< 2bln) Produksi VPOT Jumlah (ekor) 3 75 25 37 77 94 49 33 18 42 51 119 17 168 6 PT Bio
SFV
hari 1-7
Pada pemeriksaan mikroskopis dari sediaan histopatologi ginjal monyet yang mengandung antibodi SFV, tidak ditemukan adanya kelainan pada sel-selnya. Sifat laten SFV bersifat asimpomatis dan bertoleransi selama bertahun-tahun bahkan dalam hitungan dekade. Aktikya SFV dari sifat laten dapat disebabkan oleh adanya gangguan sistem imun sehingga mernicu kembali terjadinya infeksi ulangan
(30).
Anak MEP yang menunjukkan antibodi negatif terhadap SFV tipe 3 belum tentu
bebas terhadap -SFV tipe 1 dan 2, karena antara ke 3 tipe virus ini tidak terjadi reaksi silang (14). Untuk mengetahui lebih lanjut kehadiran SFV yang menyebabkan efek sitopatik dirasa perlu untuk menggunakan metode konfirmasi selain FAT. Karena SFV dapat diisolasi dari dari Peripheral Blood Mononuclear Lymphocytes (PBMC) (30) rnaka uji yang dipilih adalah inokulasi limfosit dari PBMC monyet yang bersangkutan pada biakan jaringan ginjal fetus monyet
.
Dari hasil inokulasi limfosit pada biakan ginjal monyet diketahui bahwa ke 2 anakEfek sitopatik umumnya terjadi setelah pasase dilakukan. Hal ini terjadi karena adanya proses tripsinisasi pada biakan jaringan ginjal sehingga memberi kesempatan unmasking bagi SFV. Dari kelompok anak monyet dari hutan, hanya 2
ekor yang tidak menunjukkan adanya antibodi SFV 3 dan tidak menunjukkan efek sitopatik pada inokulasi limfosit. Dari ke 10 an& sapihan yang semuanya menunjukkan antibodi negatif terhadap SFV 3, lima ekor diantaranya menunjukkan adanya efek sitopatik pada inokulasi limfosit pada biakan jaringan ginjal fetus monyet: Kemungkinan yang terjadi adalah SFV didapat dari lingkungan pada saat anak masih menyusu pada induknya sebelum disapih, dimana terdapat monyet dewasa lain dalam satu ruangan. Setelah disapih, penularan yang terjadi antar ruang selama anak monyet dipelihara di fasilitas koloni bersih dapat dikatakan kecil kemungkinannya karena seluruh fasilitas menggunakan sistem Air Handling Unit Dengan sistem ini seluruh sirkulasi udara yang rnasuk dan keluar terkontrol sehingga tidak terjadi percampuran udara antar ruang.
Diduga anak monyet dari hutan sudah mendapatkan infeksi SFV sebelum masuk ke fasilitas PT Bio Farma, hanya saja virus ini berada dalam tubuh dalam kondisi tertekan yang kemudian menghancurkan hanya sekelompok kecil sel tanpa menyebarkan infeksi lebih luas. Dalam kondisi ini SFV
akan
sulit terdeteksi kehadirannya karena beberapa kemungkinan seperti:virus terikat oleh antibodi,virus berada dalam jumlah sangat sedikit atau virus berada dalam bentuk tidak infeksius/infeksius inkomplet (1 2).tingkat kematian yang timbul selama pemeliharaan yang pada umurnnya disebabkan oleh dime dan tidak mau makan disamping kecelakaan akibat desain kandang yang tidak tepat. Dengan demikian dirasa perlu untuk menekan tingkat stress, menentukan pakan yang tepat dan menyediakan fasilitas yang tepat untuk pemeliharaan fetus seksio di rnasa yang akan datang. Sehingga dianjurkan untuk membesarkan fetus hasil seksio, tanpa memberi kesempatan fetus tersebut untuk kontak dengan induk maupun monyet dewasa lain, dalam fasilitas khusus. Sebagai konsekwensinya, Bio -Farma hams menyediakan dana dalam jumlah sangat besar untuk membangun fasilitas tersebut bagi fetus seksio yang akan dibesarkan oleh teknisi yang terlatih.
Berdasarkan data nefi-ektomi fetus monyet, dapat diketahui bahwa semakin besar berat badan fetus maka korteks ginjalnya juga semakin besar. Dengan asumsi bahwa fetus akan memiliki berat badan maksimal pada saat mendekati kelahiran, maka sebaiknya seksio sesaria dilakukan sedekat mungkin dengan waktu kelahiran, yaitu pada saat kepala fetus sudah memasuki rongga panggul induk. Penggabungan sampai dengan 10 pasang ginjal fetus monyet dalam 1 batch produksi vaksin polio akan bersifat sangat efisien karena berat korteks yang dihasilkannya tidak mungkin disamai oleh satu ekor monyet dewasa yang berasal dari koloni bebas penyakit tertentu. Setiap 1 gram korteks ginjal akan menghasilkan volume awal sebanyak 3 liter. Penggabungan 10 pasang ginjal fetus dapat memberikan
2
5- 12 gram ginjal yang setara dengan 15 - 36 liter vaksin.Sedangkan ginjal yang tidak digabungkan akan menghasilkan volume yang lebih rendah.
tidak akan terhenti ditengah jalan. Sedangkan penggunaan ginjal monyet yang didapat tanpa melalui prosedur tersebut,seringkali terkontaminasi oleh agen penyakit yang menyebabkan tirnbulnya efek sitopatik sehingga proses produksi harus dihentikan sebelum berakhir dan menyebabkan terbuangnya medium yang telah digunakan. Penggabungan ginjal fetus MEP bernilai sangat ekonomis bagi produsen yang harus memproduksi VPOT dalam jumlah sangat besar.Sedangkan penggunaan monyet dewasa yang ginjalnya tidak dapat digabungkan dengan ginjal monyet dewasa- lain,- akan sangat efisien bagi negara-negara yang memproduksi VPOT dalam jumlah terbatas karena tidak memerlukan biaya yang diperlukan untuk seksio sesaria. Bagi PT Bio Farma,penggunaan ginjal fetus monyet akan menekan biaya produksi.
KESIMPULAN
1. Berat badan fetus monyet berkorelasi positif dengan berat korteks ginjalnya. 2. Antibodi SFV pada fetus seksio diduga merupakan antibodi maternal.
DAFTAR PUSTAKA
1 World Health Organization. 2000. Strategic Plan 2001-2005. Global Polio Eradication Initiative. Department of Vaccines and Biologicals. Page: iv-v. 2 Niprida Mardin, SKM. Thn 2000. Progress Toward Poliomyelitis Eradication
Indonesia 1995- 1998 Epidemiological Bulletin. Republik Indonesia. Depkes RI. Dirjen Pemberantasan Penyakit Menular dan Penyehatan Lingkungan Pemukiman. Hlrn: 1
-
1 0.3 World Health Organization. 1990. Technical Report Series, No. 800. Requirement for Poliomyelitis Vaccine (Oral). Annex 1.
4 Minor, P.D. 1994. Polioviruses. Encyclopedia of Virology Volume Three.Academic Press Inc. San Diego.Page: 11 15-1 132.
5 Weinstein, L. 1977. Poliomyelitis. Principles of Internal Medicine. Eight Edition. Mc Graw -Hill Kogakusha. Tokyo. Japan.Page: 999- 1005.
6 Cusick, P.K and Morgan S.J. 1998. Nervous System. Non Human Primates in Bio Medical Research: Diseases. Academic Press.USA. Page :473-474.
7 Mansfield, K and King, N. 1998. Viral Diseases. Non Human Primates in
Biomedical Research: Diseases. Academic Press. USA. Page: 46-47.
8 Johnsen, D.O. 1995. History. Non Human Primates in Bio Medical Research: Biology and Management. Academic Press. USA.Page: 3-4.
9 Hull, H.F, Ward N.A, Hull, B.P, Milstein J.B and Quadros C. 1994. Paralytic Poliomyelitis : seasoned strategies, dissapearing disease. The Lancet. Vol343. Page: 1331-1337.
10 Sabin, A.B and Boulger L.R. 1973. History of Sabin Attenuated Poliovirus Oral Live Vaccine Strains. Journal of Biological Standardization.
1 1 Swhweizer, M et al. 1997. Simian Foamy Virus Isolated from an Accidentally Infected Human Individual. Journal of Virology, Vo1.7 1 .No.6.
12 Adams, S.R, Muchrnore, E and Richardson, J. 1995. Bio Safety. Non Human Primates in Bio Medical Research: Biology and Management. Academy Press. USA. Page: 398-401.
13 Leeson, C.R, Leeson T.S and Paparo A.A. 1993. Atlas Berwarna HISTOLOGI. Binarupa Aksara. Jakarta. Hlm: 46-47.
15 Lodish, Harvey et al. 2000. Manipulating Cells and Viruses in Culture.
Molecular Cell Biology. 4'h edition. W.H. Freeman and Company. New York. 16 King, N. W. 1993. Simian Irnmunodefiency Virus Infections. Non Human
Primates I. Springer-Verlag. Berlin Heidelberg NY London Paris Tokyo Hongkong Barcelona Budapest. Page: 5- 1 8.
17 Morison, H.G and Desrosiers, R.C. 1994. Simian Immunodeficiency Viruses. Encyclopedia of Virology Volume Three. Academic Press Inc. San Diego. Page:1316-1321.
18 Butel, J,S. 1994. Simian Virus 40. Encyclopedia of Virology Volume Three. Academic Press Inc. San Diego. Page: 1322-1329.
19 King, N. W. 1993.
-
Simian Virus 40 (SV 40) Infections. Non Human Primates 1.Springer Verlag. Berlin Heidelberg NY London Paris Tokyo Hongkong Barcelona Budapest. Page: 37-42.20 Dok #: 115 K-Kera- 10. Prosedur Baku Seksio Sesaria. QA. Bio Farma. 2 1 Dok #: 1 1 5 K-Kera- 06. Prosedur Baku Karantina Monyet. QA Bio Farma. 22 Dok #: 115 M-OPV-04. Prosedur Baku Pembuatan Single Harvest Polio. QA.
Bio Farma.
23 Dok #: 202 K- Psel. Prosedur Baku Pemeliharaan dan Penyiapan Sel untuk Pengujian. QA. Bio Farma.
24 Dok #: 202 T - FAT. Prosedur Baku Fluoresensi Antibodi terhadap Virus
Simian.QA. Bio Farma.
25 Dok #:202T-SVT. Prosedur Baku Uji Serum Kera terhadap SV 40. QA. Bio Farma.
26 Dok #: 202 T- NVT. Prosedur Baku Pembuatan Preparat Histologi. QA. Bio Farrna.
27 Ohta, Y et al. 1988. Isolation of Simian Immunodeficiency Virus fiom Afiican Green Monkey and Seroepidemiologic Survey of the Virus in Various Non Human Primates. Alan R. Liss, Inc. Int.J.Cancer:41,11-122.
28 Tizard, Ian. 1 987. Veterinary Immunology. An Introduction. Third Edition. WE3 Saunders Company. Philadelphia London Toronto Sidney Tokyo
Hongkong. Page: 175- 176.
29 Hooks, J and Gibbs. 1975. The Foamy Viruses. Bacterological Reviews. Vo1.39, No.3. USA.
UmpiJn 1
TABEL 6 HkSU LTII SEIlOWC?lS SERUM FElllS SEKSIO SESARIA PEFSODE JANLTARI - APRIL uY)1 L m j l h TABn 6. HAS& Ull SEROLOCilS SERUM FETUS SEES10 SESARIA P W O D E JANLTARI . APRU ZCQl
No INDUK 1 FkTUS
NO Antihodr ~nhbodi ~ n t i b o d NO ~n Antihodi Antiho* Anhbodi Ffck S i t o p a t o p d V o b e
Lampran 2
Tabel 7 Has11 Uji Serologis 8: CPE Anak Monyet Tanpa Induk
Tnhel 8 H a d Ui! Saolopia& CPE Anak Move( Sap~han
'14 1 I I hl I I I 1 - I - I - 1 . 1 - 1 I - I - I - I - I - I - 1
-l l ? hl I I I
Lampiran 3. Tabel 9. Uji Statistik Korelasi Berat Badan terhadap Korteks Ginjal Fetus Monyet SUMMARY OUTPUT Regression Statistics Multiple R R Square
Adjusted R Square Standard Error Observations 0.429637636 0.184588498 0.176434383 0.167808452