PENGGUNAAN JAMUR ANTAGONIS Gliocladium virens Miller
UNTUK MENGHAMBAT PERTUMBUHAN PENYAKIT
Fusarium oxysporum f. sp. passiflora PADA
PEMBIBITAN MARKISA DI RUMAH KASSA
SKRIPSI
OLEH:
SULASTRY SIMANJUNTAK 060302008
HPT
DEPARTEMEN HAMA DAN PENYAKIT TUMBUHAN
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGGUNAAN JAMUR ANTAGONIS Gliocladium virens Miller
UNTUK MENGHAMBAT PERTUMBUHAN PENYAKIT
Fusarium oxysporum f. sp. passiflora PADA
PEMBIBITAN MARKISA DI RUMAH KASSA
SKRIPSI
OLEH:
SULASTRY SIMANJUNTAK 060302008
HPT
Skripsi Sebagai Salah Satu Syarat Untuk Dapat Memperoleh Gelar Sarjana di Fakultas Pertanian
Universitas Sumatera Utara
Disetujui Oleh: Komisi pembimbing
(Dr. Ir. Hasanuddin, MS)
MEDAN
(Dr. Lisnawita, SP., MSi)
Ketua Anggota
DEPARTEMEN HAMA DAN PENYAKIT TUMBUHAN
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
ABSTRACT
Sulastry Simanjuntak, “The Using of Antagonist Fungi Gliocladium virens Miller to Inhibiting Growth of Diseases Fusarium oxysporum f. sp. passiflora on Passion in nurseries at Greenhouse”,
supervisor by Hasanuddin and Lisnawita. Many control maesures have been done to suppress developing of Fusarium but have not succesful, so that one of alternative with biological control. Research aimed to observe the ability
Gliocladium virens to suppress developing of Fusarium oxysporum f. sp. passiflora in the nursery. This research was held in
screen house of experimental fruit and flower garden (KPTB) Tongkoh-Berastagi, Karo district. The research used method of Completely Randomized Design Factorial of two factors namely fungal factor antagonist (25, 37.5, 50 and 62.5 gr/1,5 gr soil) and factor compost (chicken and cow compost), with 10 combinations of treatment and three replications.
ABSTRAK
Sulastry Simanjuntak, “Penggunaan Jamur Antagonis Gliocladium virens Miller untuk Menghambat Pertumbuhan Penyakit Fusarium oxysporum f. sp. passiflora pada Pembibitan Markisa di Rumah Kassa” dibawah bimbingan Hasanuddin dan Lisnawita. Banyak cara pengendalian yang telah dilakukan untuk menekan perkembangan Fusarium pada markisa namun belum berhasil, sehingga alternatif pengendalian yang dapat dilakukan untuk menekan populasi jamur ini yaitu dengan mengembangkan pengendalian secara hayati. Penelitian yang bertujuan untuk mengetahui pengaruh penggunaan jamur
antagonis Gliocladium virens Miller dalam menghambat pertumbuhan penyakit F. oxysporum f.sp. passiflora pada markisa di pembibitan telah dilaksanakan di
Rumah Kasa Kebun Percobaan Buah dan Bunga (KPTB) Tongkoh – Berastagi Kabupaten Karo. Penelitian ini menggunakan Rancangan Acak Lengkap faktorial terdiri dari 2 faktor yakni faktor jamur antagonis (25, 37,5, 50, dan 62,5 gr/1,5 kg tanah) dan faktor kompos (ayam dan sapi) dengan 10 kombinasi perlakuan dan tiga ulangan.
RIWAYAT HIDUP
Penulis lahir di Sidikalang pada tanggal 15 Maret 1988. Anak kedua dari empat bersaudara dari Ayahanda M. Simanjuntak dan Ibunda R. Simamora. Tahun 2006 penulis lulus dari SMA Negeri 1 Porsea dan pada tahun 2006 lulus seleksi masuk USU melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB), penulis memilih program studi Hama dan penyakit Tumbuhan Jurusan Ilmu Hama dan Penyakit Tumbuhan, Fakultas Pertanian.
Selama mengikuti perkuliahan, penulis menjadi asisten laboratorium Dasar Perlindungan Tanaman (DPT) 2007 – 2010. Penulis juga mengikuti beberapa organisasi kemahasiswaan diantaranya Ikatan Mahasiswa Perlindungan Tanaman (IMAPTAN) 2006 – 2010, pernah mengikuti Seminar Ilmiah dengan tema “Dengan Pertanian Berkelanjutan Kita Wariskan Kehidupan Berwawasan Lingkungan”.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa karena berkat rahmat dan kasihNya sehingga penulis dapat menyelesaikan skripsi ini dengan baik.
Adapun judul dari skripsi ini adalah “Penggunaan Jamur Antagonis
Gliocladium virens Miller untuk Menghambat Pertumbuhan Penyakit
Fusarium oxysporum f. sp. passiflora pada Pembibitan Markisa di Rumah
Kassa”, disusun sebagai salah satu syarat untuk memperoleh gelar sarjana di Fakultas Pertanian Universitas Sumatera Utara, Medan.
Pada kesempatan ini penulis mengucapkan terimakasih kepada Dr. Ir. H. Hasanuddin, MS dan Dr. Lisnawita, SP., MSi sebagai komisi
pembimbing, Ir. Fritz Silalahi, MS, Mirasiska Tarigan, SP, dan Parlindungan Simamora, SP., sebagai pembimbing lapangan, juga kepada seluruh staf dan karyawan Kebun Percobaan Tanaman Buah (KPTB) Tongkoh yang telah membantu penulis selama penelitian.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna. Oleh karena itu, penulis mengharapkan saran dan kritik yang membangun demi kesempurnaan skripsi ini.
Akhir kata penulis mengucapkan terima kasih kepada semua pihak yang membantu. Semoga bermanfaat bagi pihak-pihak yang membutuhkan.
DAFTAR ISI
Kegunaan Penelitian ... 4
TINJAUAN PUSTAKA Biologi Penyebab Penyakit Fusarium oxysporum Schlecht ... 5
Gejala Serangan ... 7
Faktor – Faktor Yang Mempengaruhi Penyakit ... 9
Pengendalian Penyakit ... 9
Biologi Penyebab Penyakit Gliocladium virens Miller... 10
Manfaat Gliocladium virens Miller ... 12
Kompos... 13
Histologi Tanaman ... 15
BAHAN DAN METODE Tempat dan Waktu Penelitian ... 17
Bahan dan Alat ... 17
Pelaksaan Penelitian Penyediaan Sumber Inokulum Fusarium oxsysporum f.sp. passiflora ... 17
Gliocladium virens ... 18
Pengujian di Rumah Kasa ... 19
Perbanyakan G. virens... 19
Perbanyakan F.o. f.sp. passiflora... 20
Persiapan Benih ... 20
Persiapan Tempat Penyemaian ... 20
Penyemaian ... 21
Persiapan Media Tanam ... 21
Pengaplikasian G. virens ... 21
Penanaman ... 22
Inokulasi F.o. f.sp. passiflora ... 22
Pemeliharaan... 22
Metode Penelitian ... 22
Peubah Amatan ... 24
HASIL DAN PEMBAHASAN Persentase Serangan (%) F.o f. sp.passiflora ... 27
Intensitas serangan (%) F.o f. sp.passiflora ... 35
Histologi Tanaman ... 37
KESIMPULAN DAN SARAN Kesimpulan ... 41
Saran ... 41 DAFTAR PUSTAKA
DAFTAR TABEL
Tabel Halaman 1. Persentase Serangan (%) F.o. f.sp. passiflora yang diaplikasikan
dengan G. virens ... 28
2. Pengaruh Pemberian Kompos terhadap Persentase Serangan (%) F.o. f.sp. passiflora ... 31 3. Persentase Serangan (%) F.o. f.sp. passiflora pada berbagai kombinasi perlakuan G. virens dan Kompos ... 33
4. Intensitas Serangan (%) F.o. f.sp. passiflora yang diberi G. virens
DAFTAR GAMBAR
Gambar Halaman 1. Koloni F.o f.sp passiflora berwarna putih ... 6 2. Fusarium oxysporum f.sp passiflora (a. mikrokonidia, b. konidiofor ) ... 6 3. Gejala Serangan Fusarium (a. Tanaman layu, b. gejala pada akar
c. pada batang yang dibelah) ... 8 4. G. virens (a. konidia, b. phialid, c. konidiofor) ... 11 5. Uji Antagonisme G. virens terhadap Jamur F.o f sp.passiflora ... 18 6. Grafik hubungan antara penggunaan G.virens terhadap persentase
serangan F.o. f.sp. passiflorapada pengamatan16 hsa-54 hsa ... 29 7. Grafik hubungan antara penggunaan Kompos terhadap persentase serangan F.o. f.sp. passiflora pada pengamatan 16 hsa-54 hsa ... 32 8. Irisan melintang dari jaringan batang markisa dengan berbagai
DAFTAR LAMPIRAN
Lampiran Halaman
1. Bagan Penelitian ... 45
2. Data Rataan Persentase Serangan F.o. f.sp. passiflora 16 hsa ... 47
3. Data Rataan Persentase Serangan F.o. f.sp. passiflora 19 hsa ... 49
4. Data Rataan Persentase Serangan F.o. f.sp. passiflora 23 hsa ... 51
5. Data Rataan Persentase Serangan F.o. f.sp. passiflora 26 hsa ... 53
6. Data Rataan Persentase Serangan F.o. f.sp. passiflora 30 hsa ... 55
7. Data Rataan Persentase Serangan F.o. f.sp. passiflora 33 hsa ... 57
8. Data Rataan Persentase Serangan F.o. f.sp. passiflora 37 hsa ... 59
9. Data Rataan Persentase Serangan F.o. f.sp. passiflora 40 hsa ... 61
10. Data Rataan Persentase Serangan F.o. f.sp. passiflora 44 hsa ... 63
11. Data Rataan Persentase Serangan F.o. f.sp. passiflora 47 hsa ... 65
12. Data Rataan Persentase Serangan F.o. f.sp. passiflora 51 hsa ... 69
13. Data Rataan Persentase Serangan F.o. f.sp. passiflora 54 hsa ... 73
14. Data Rataan Intensitas Serangan F.o. f.sp. passiflora ... 77
15. Data Pengamatan Populasi Akhir dari Jamur G. virens di Media PDA ... 80
16. Foto Intensitas Serangan per Perlakuan ... 82
17. Foto Batang Tanaman Secara Melintang ... 92
18. Foto di Rumah Kassa ... 93
19. Foto Plank Penelitian ... 93
ABSTRACT
Sulastry Simanjuntak, “The Using of Antagonist Fungi Gliocladium virens Miller to Inhibiting Growth of Diseases Fusarium oxysporum f. sp. passiflora on Passion in nurseries at Greenhouse”,
supervisor by Hasanuddin and Lisnawita. Many control maesures have been done to suppress developing of Fusarium but have not succesful, so that one of alternative with biological control. Research aimed to observe the ability
Gliocladium virens to suppress developing of Fusarium oxysporum f. sp. passiflora in the nursery. This research was held in
screen house of experimental fruit and flower garden (KPTB) Tongkoh-Berastagi, Karo district. The research used method of Completely Randomized Design Factorial of two factors namely fungal factor antagonist (25, 37.5, 50 and 62.5 gr/1,5 gr soil) and factor compost (chicken and cow compost), with 10 combinations of treatment and three replications.
ABSTRAK
Sulastry Simanjuntak, “Penggunaan Jamur Antagonis Gliocladium virens Miller untuk Menghambat Pertumbuhan Penyakit Fusarium oxysporum f. sp. passiflora pada Pembibitan Markisa di Rumah Kassa” dibawah bimbingan Hasanuddin dan Lisnawita. Banyak cara pengendalian yang telah dilakukan untuk menekan perkembangan Fusarium pada markisa namun belum berhasil, sehingga alternatif pengendalian yang dapat dilakukan untuk menekan populasi jamur ini yaitu dengan mengembangkan pengendalian secara hayati. Penelitian yang bertujuan untuk mengetahui pengaruh penggunaan jamur
antagonis Gliocladium virens Miller dalam menghambat pertumbuhan penyakit F. oxysporum f.sp. passiflora pada markisa di pembibitan telah dilaksanakan di
Rumah Kasa Kebun Percobaan Buah dan Bunga (KPTB) Tongkoh – Berastagi Kabupaten Karo. Penelitian ini menggunakan Rancangan Acak Lengkap faktorial terdiri dari 2 faktor yakni faktor jamur antagonis (25, 37,5, 50, dan 62,5 gr/1,5 kg tanah) dan faktor kompos (ayam dan sapi) dengan 10 kombinasi perlakuan dan tiga ulangan.
PENDAHULUAN
Latar Belakang
Markisa atau passion fruit (Passiflora sp.) dan erbis (P.quadrangularis L.) berasal dari famili Passifloraceae merupakan dua spesies dalam satu genus yang ditemukan di Philippina. Markisa dalam bahasa lokal disebut sebagai passion, flor de passion di Spanyol, marflora di Iloko dan di Hawaii disebut sebagai lilikoi, sedangkan erbis sering disebut dengan kasaflora dan parola di Iloko (Coronel, 1983).
Ada dua bentuk markisa yaitu markisa ungu (Passiflora edulis) dan markisa kuning (Passiflora flavicarva). Buah markisa ungu berasal dari Brasil sedangkan buah markisa kuning diduga berasal dari Australia yang dimutasi dari Amerika tropis. Hal ini tidak diketahui saat markisa dan erbis diperkenalkan ke Philippina. Kedua jenis ini tumbuh dewasa di dataran rendah dan dataran tinggi tapi penyebarannya terbatas (Coronel, 1983).
khususnya Tanah Karo luas pertanaman tanaman markisa ini semakin sempit/ berkurang akibat para petani lebih tertarik menanam tanaman jeruk (Barus dan Syukri, 2008).
Produksi markisa asam (P. edulis) di daerah sentra produksi seperti Sumatera Utara dan Sulawasi Selatan masih cukup rendah dan cenderung semakin menurun. Hal ini antara lain disebabkan karena gangguan hama dan penyakit tanaman. Salah satu penyakit penting pada tanaman markisa adalah
penyakit layu fusarium yang disebabkan oleh Fusarium oxysporum f.sp passiflora. Patogen ini banyak menginfeksi dan
menyebabkan banyak tanaman mati muda. Di Sumatera Utara, penurunan tersebut dapat dilihat dari areal tanam yang berkurang dari 748 ha pada tahun 2003 menjadi 358 ha pada tahun 2004. Secara ekonomi, kerugian yang dialami mencapai Rp.4,68 milyar (Saragih et al., 2006).
Sampai saat ini markisa yang berbuah ungu tidak tahan terhadap F. oxysporum f.sp. passiflora. Sebaliknya, markisa kuning (P. flavicarpa), dan
spesies lain dari marga Passiflora ada yang tahan terhadap penyakit ini, sehingga jenis ini dapat dipakai sebagai batang bawah bagi markisa yang berbuah ungu (Semangun, 1996).
Pengendalian hayati adalah pemberian mikroba antagonis dan perlakuan tertentu untuk meningkatkan aktivitas mikroba tanah seperti pemberian bahan organik yang bertujuan agar mikroba antagonis menjadi tinggi aktivitasnya. Mikroba antagonis adalah mikroba yang aktivitasnya berdampak negatif terhadap kehidupan patogen (Abadi, 2003). Beberapa mikroba antagonis seperti Trichoderma hamatum, T. viride, T. koningi, Gliocladium virens, G. Roseum, Penicillium janthinellum, Epicocum purpureum, Pythium nunn (jamur); Bacillus subtilis, B. polymixa, Pseudomonas fluorescens. P. cepacia, Agrobacterium radiobacter (bakteri) dan Streptomyces spp. (aktinomiset) adalah agensia pengendali penyakit tanaman yang tidak asing lagi dalam dunia ‘pengendalian hayati’ (Aryantha, 2001).
Berdasarkan penjelasan di atas, suatu penelitian tentang efektifitas G. virens Miller sebagai jamur antagonis terhadap penyakit layu Fusarium oxysporum f.sp. passiflora pada tanaman markisa di pembibitan dilakukan untuk mendapatkan suatu metode pengendalian yang tepat dalam mengendalikan patogen ini.
Tujuan Penelitian
Untuk mengetahui pengaruh penggunaan jamur antagonis
Hipotesa Penelitian
Penyakit layu F.oxysporum f.sp. passiflora dapat dihambat pertumbuhannya dengan pemberian jamur antagonis G. virens.
Kegunaan Penelitian
- Sebagai sumber informasi bagi pihak yang membutuhkan.
TINJAUAN PUSTAKA
Biologi Penyebab Penyakit Fusarium oxysporum f.sp. passiflora
Genus Fusarium adalah salah satu genus jamur yang sangat penting secara ekonomi dan merupakan spesies patogenik yang menyebabkan penyakit layu pada berbagai tanaman. Banyak spesies fusarium yang berada dalam tanah bertahan sebagai klamidospora atau sebagai hipa pada sisa tanaman dan bahan organik lain (Saragih dan Silalahi, 2006).
Menurut Agrios (1996) klasifikasi jamur ini adalah sebagai berikut : Divisio : Mycota
Sub Divisi : Deuteromycotina Class : Hyphomycetes Ordo : Hyphales
Famili : Tuberculariaceae Genus : Fusarium
Species : Fusarium oxysporum f.sp. passiflora.
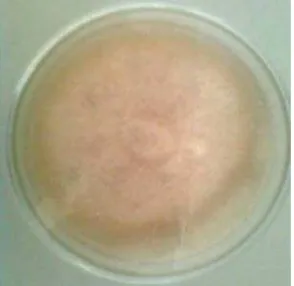
Miselia aerial tampak jarang atau banyak seperti kapas, kemudian menjadi seperti beludru, berwarna putih atau salem dan biasanya agak keunguan yang tampak lebih kuat dekat permukaan medium. Sporodokhia terbentuk hanya pada beberapa strain. Koloni berwarna putih kekuningan hingga keunguan (Gambar 1.).
Gambar. 1 Koloni F.o f.sp passiflora berwarna putih
Konidiofor dapat bercabang dapat tidak dan membawa monofialid (Gambar 2b). Mikrokonidia bersepta 0 hingga 2, terbentuk lateral, pada fialid yang sederhana, atau terbentuk pada fialid yang terdapat pada konidiofor bercabang pendek. Umumnya terdapat dalam jumlah banyak sekali, terdiri dari aneka bentuk dan ukuran. Berbentuk ovoid-elips sampai silindris, lurus atau sedikit membengkok, dan berukuran (5,0-12,0) x (2,2-3,5) µm (Gambar 2a).
Gambar. 2. Fusarium oxysporum f.sp passiflora (a. mikrokonidia, b. konidiofor ) Makrokonidia jarang terdapat pada beberapa strain, terbentuk pada fialid yang
terdapat pada konidiofor bercabang atau dalam sporodokhia, bersepta 3-5, berbentuk fusiform, sedikit membengkok, meruncing pada kedua ujungnya dengan sel kaki berbentuk pediselata, umumnya bersepta 3, dan berukuran (20)27-46(50) x 3,0-4,5(5) µm. Khlamidospora terdapat dalam hifa atau dalam konidia, berwarna hialin, berdinding halus atau agak kasar, berbentuk semibulat dengan diameter 5,0-15 µm, terletak terminal atau interkalar, dan berpasangan atau tunggal (Gandjar et al., 1999).
F. oxysporum f.sp. passiflora merupakan jamur yang mampu bertahan lama dalam tanah sebagai klamidospora, yang terdapat banyak dalam akar sakit. Jamur mengadakan infeksi melalui akar. Adanya luka pada akar akan meningkatkan infeksi. Setelah masuk ke dalam akar, jamur berkembang sepanjang akar menuju ke batang dan di sini jamur berkembang secara meluas dalam jaringan pembuluh sebelum masuk ke dalam batang palsu. Pada tingkat infeksi lanjut, miselium dapat meluas dari jaringan pembuluh ke parenkim. Jamur membentuk banyak spora dalam jaringan tanaman (Semangun, 2000).
Gejala Serangan
Fusarium menyebabkan layu pembuluh pada banyak tanaman sayuran, bunga, buah, dan serat. Kebanyakan jenis-jenisnya yang penting termasuk
kompleks Fusarium oxysporum. Ada banyak sekali forma khusus (formae speciales, f. sp.), yang masing-masing mempunyai kisaran inang yang
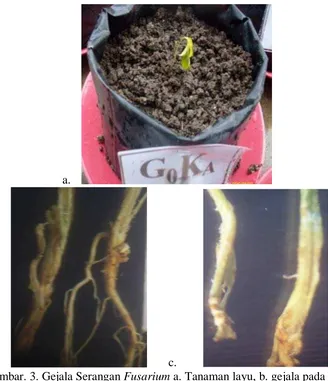
kuning pucat (Gambar 3a), dan bila batang dipotong akan terlihat jaringan berwarna coklat. Pada serangan berat akan menyebabkan tanaman markisa layu dan mati (Barus dan Syukri, 2008).
a.
b. c.
Gambar. 3. Gejala Serangan Fusarium a. Tanaman layu, b. gejala pada akar c. pada batang yang dibelah.
(Weber, 1973). Buah tidak bergejala, namun kualitas dan kuantitas buah menurun (Saragih et al., 2006).
Faktor – Faktor Yang Mempengaruhi Penyakit
Suhu optimum untuk pertumbuhan jamur adalah antara 25-30° C, dengan suhu maksimum pada atau di bawah 37° C dan minimum di atas 5° C. Suhu titik kematian jamur F. oxysporum antara 57,5-60° C selama 30 menit dalam tanah. Pada medium agar, pH berkisar antara 2,2-9,0 dengan pH optimum7,7. Potensi air minimum antara -125 dan -155 bar. Sumber C yang bagus untuk pensporaannya termasuk pati dan manitol. Pensporaan optimum jamur disarankan terjadi pada suhu 20-25° C selama 12:12 jam pergantian antara terang dan gelap. Pembentukan makrokonidium dipacu oleh lampu merkuri dan medium mengandung sukrosa. Laju respirasi dan pertumbuhan jamur yang meningkat terjadi pada glukosa dan galaktosa sedangkan peningkatan pengambilan oksigen pada L-prolin dan asam L-sisteat (Soesanto, 2008).
Pengendalian Penyakit
Pengendalian penyakit layu F. oxysporum f.sp. passiflora menurut Silalahi et al., (2005) dapat dilakukan dengan cara:
1. Menggunakan bibit sambung dengan batang bawah yang relatif toleran terhadap penyakit busuk akar (salah satu diantaranya yaitu merkisa konyal P.ligularis),
ditutup kembali dengan tanah. Aplikasi dilakukan 2 bulan sekali dengan dosis 200-250 g per tanaman,
3. Sanitasi dan pemeliharaan kebun dengan baik dan teratur, khususnya drainase yang optimal.
Mikroorganisme dalam tanah dapat dipengaruhi oleh bermacam-macam keadaan yang menarik. Pemberian pupuk melalui daun (foliar application) seperti pemberian urea pada daun menyebabkan berkurang serangan yang disebabkan oleh Fusarium. Beberapa penelitian melaporkan, pemberian urea dapat menstimulir perkembangan Actinomycetes disekitar rizosfer tanaman. Pemberian bahan organik yang mengandung kitin akan menyebabkan bakteri dan cendawan tanah yang dapat menghasilkan enzim kitinase akan berkembang. Dinding sel cendawan Fusarium, banyak mengandung kitin (Djafaruddin, 2000).
Oleh karena itu, adanya organisme yang mengandung enzim kitinase menyebabkan dan fusarium akan tertekan sehingga sukar didegradasi karena dinding selnya dilapisi oleh protein dan lipid, yang menghalangi aktivitas enzim hidrolitik (Sivan dan Chet, 1989).
Biologi Gliocladium virens Miller
Menurut Alexopoulus and Mims (1999), Gliocladium spp. diklasifikasikan:
Ordo : Hypocreales Famili : Hypocreaceae Genus : Gliocladium Species : Gliocladium spp.
Dalam penelitian ini yang digunakan adalah G. virens.
Koloni tumbuh sangat cepat dan mencapai diameter 5-8 cm dalam waktu lima hari pada suhu 20° C di medium PDA. Perbedaannya dengan T. viride adalah fialidanya seperti tertekan dan memunculkan satu tetes besar konidium berwarna hijau, yang membentuk massa lendir, pada setiap gulungan (Gambar 4). Konidiumnya berbentuk bulat telur pendek, berdinding halus, agak besar, dan kebanyakan berukuran (4,5-6) x (3,5-4) µm (Soesanto, 2008).
Gambar 4. G. virens.a. konidia, b. phialid, c. konidiofor.
G. virens merupakan jamur tanah yang umum dan tersebar di berbagai jenis tanah, misalnya tanah hutan, dan pada beragam rizosfer tanaman. Pertumbuhan optimum jamur antagonis terjadi pada suhu 25-32° C. Jamur parasit
a
b
nekrotof ini mampu tumbuh baik sebagai pesaing saprotof dari jamur lainnya (Soesanto, 2008).
Jamur sangat toleran terhadap CO2. Pada medium yang mengandung
NaCl 5%, jamur tampak mengalami penurunan pertumbuhan dan pensporaan. Kebutuhan nutrisi dari jamur antagonis nekrotof tidak berbeda dengan jamur saprotof. Pada stadium awal infeksi mikoparasit, tampak terjadi perubahan kelenturan plasmalema haustorium inang, yang memampukan glukosa dan nutrisi lain diserap dari sitoplasma inang. Jamur antagonis G. virens tidak berpengaruh antagonisme terhadap jamur mikoriza asbuskular (Soesanto, 2008).
Manfaat Gliocladium virens Miller
Pada pengendalian hayati, perkecambahan konidia atau klamidospora akan memudahkan agensia hayati seperti G. virens untuk menyerang miselium F. oxysporum. G. virens juga dapat menghambat penyebab penyakit lainnya seperti Rhizoctonia spp., Phytium spp., Sclerotium rolsfii penyebab damping off dan penyebab penyakit akar, diduga enzimnya beta glucanase. G. virens mampu menekan Sclerotium rolsfii sampai 85% secara in-vitro. G. virens dapat mengeluarkan antibiotik gliotoksin, glioviridin, dan viridin yang bersifat fungistatik. Gliotoksin dapat menghambat cendawan dan bakteri, sedangkan viridin dapat menghambat cendawan. G. virens dapat tumbuh baik pada substrat organik, media kering, dan kondisi asam sampai sedikit basa (Winarsih, 2007).
daerah perakaran tanaman. Gliocladium spp yang bersifat mikoparasit akan menekan populasi jamur patogen yang sebelumnya mendominasi. Interaksi diawali dengan melilitkan hifanya pada jamur patogen yang akan membentuk struktur seperti kait yang disebut haustorium dan memarasit jamur patogen. Bersamaan dengan penusukan hifa, jamur mikoparasit ini mengeluarkan enzim
seperti enzim kutinase dan β-1-3 glukanase yang akan menghancurkan dinding sel
jamur patogen. Akibatnya, hifa jamur patogen akan rusak, protoplasmanya keluar dan jamur akan mati. Secara bersamaan pula terjadi mekanisme antibiosis, keluarnya senyawa anti jamur golongan peptaibol dan senyawa furanon oleh Gliocladium spp. yang dapat menghambat pertumbuhan spora dan hifa jamur patogen (Mehrotra, 1980).
Kemasan Gliocladium dengan merek GL-21 pertama kali terdaftar sebagai fungisida pada tahun 1990 oleh WR Grace & Co (Columbia, MD) untuk mengendalikan penyakit damping-off, terutama yang disebabkan oleh Pythium dan Rhizoctonia sp. G. virens memiliki potensi besar sebagai agen pengendalian biologi untuk patogen tanah (Mahar, 2009).
Pengendalian penyakit secara hayati tidak dimaksudkan untuk memusnahkan suatu patogen dari suatu tempat, tetapi hanya mengurangi jumlah dan kemampuan patogen tersebut dalam menimbulkan suatu penyakit (Pinem, 2001).
Kompos
bagi tanaman akan meningkat dengan penambahan kompos. Aktivitas mikroba ini membantu tanaman untuk menyerap unsur hara dari tanah. Aktivitas mikroba tanah juga diketahui dapat membantu tanaman menghadapi serangan penyakit (Isroi, 2008).
Pemakaian kotoran baik yang segar maupun yang sudah difermentasikan telah banyak dilaporkan berhasil untuk menunjang pertumbuhan dan mengendalikan penyakit tanaman. Sebagai contoh, kotoran sapi dapat meningkatkan kesuburan tanah dan sekaligus dapat mengendalikan penyakit layu yang disebabkan oleh Fusarium. Aryantha (2001) melaporkan bahwa kotoran sapi dan ayam yang dikomposkan selama 5 minggu telah berhasil menyuburkan tanaman Lupinus albus sekaligus mengontrol penyakit layu oleh Fusarium oxysporum. Keberhasilan ini berkorelasi positif dengan aktivitas mikroba dan populasi mikroba antagonist (aktinomiset dan bakteri penghasil endospora) dalam tanah. Keragaman jenis mikroba juga tampak paling tinggi pada tanah yang diberi perlakuan dengan kotoran sapi.
Kompos ayam mempunyai unsur hara P yang relatif lebih tinggi dari pada pupuk kandang lainnya. Kadar hara ini sangat dipengaruhi oleh konsentrat yang diberikan. Selain itu, dalam kotoran ayam tersebut tercampur sisa-sisa makanan ayam serta sekam sebagai lapisan kandang yang dapat menyumbangkan hara ke dalam pupuk kandang (Dinas Pertanian, 2010).
terjadi karena mikroba dekomposer akan menggunakan N yang tersedia untuk mendekomposisi bahan tersebut sehingga tanaman utama akan kekurangan N (Yusuf, 2009).
Secara umum, pemberian pupuk organik dapat meningkatkan pertumbuhan aktivitas mikroorganisme karena bahan organik merupakan sumber energi dan bahan makanan bagi mikroorganisme yang hidup di dalam tanah. Kegiatan jasad mikro ini dengan sendirinya membantu peningkatan dekomposisi adalah bentuk senyawa yang lebih stabil yang disebut humus (Sutanto, 2002).
Histologi
BAHAN DAN METODE
Waktu dan Tempat Percobaan
Penelitian ini dilaksanakan di rumah kassa Kebun Percobaan Tanaman Buah Berastagi, Tongkoh Km. 60, Kab. Tanah Karo, Sumatera Utara, dengan ketinggian tempat 1.340 m dpl. Pelaksanaan dimulai bulan April 2010 sampai dengan Juni 2010.
Bahan dan Alat
Adapun bahan yang digunakan dalam penelitian ini adalah benih markisa asam, kompos ayam, kompos sapi, pupuk NPK, top soil, air, polibag, aquadest, G. virens, jamur F.o f sp.passiflora, PDA, clorox, alkohol, beras, dan jagung giling dan bahan pendukung lainnya.
Adapun alat yang dipergunakan adalah cangkul, pisau, timbangan, erlenmeyer, petridish, gelas ukur, mikroskop, pipet tetes, jarum ose, inkubator, meteran, objek glass, pinset, bunsen, aluminium foil, cling wrap, selotip, autoclave, kukusan tanah, ayakan tanah, handsprayer, alat tulis dan alat pendukung lainnya.
Pelaksanaan Penelitian
1. Penyediaan Sumber Inokulum
a. Fusarium oxysporum f. sp. passiflora
mengalir, dipotong-potong (0,5 cm), disterilkan dengan khlorox 1% selama 3 menit dan dibilas dengan aquadest 2-3 kali. Selanjutnya potongan akar dikeringkan di atas kertas steril dan ditanam dalam media PDA. Biakan disimpan
dalam inkubator pada temperatur ruang selama 3 hari. Miselium F.o f. sp. passiflora yang tumbuh, diisolasi kembali hingga diperoleh biakan
murni.
b. Gliocladium virens
Isolat G.virens yang digunakan diperoleh dari Balai Kebun Percobaan Tanaman Buah Berastagi (BKPTBB). Isolat G.virens kemudian disegarkan kembali pada media PDA.
2. Pengujian di Laboratorium
Uji Antagonisme G. virens terhadap Jamur F.o f sp.passiflora
Gambar. 5. Uji Antagonisme G. virens terhadap Jamur F.o f. sp. passiflora Uji antagonisme dilakukan dengan cara menanam koloni biakan murni G.virens dan F.o f. sp. passiflora dalam satu cawan petri yang berdiameter 9 cm. Petri diberi tanda dengan bulatan 0,5 cm pada dua tempat yang berhadapan,tanda untuk jamur X dibuat bulatan 1 cm dari pinggir di dasar petridish dan tanda jamur
r2 r1
X = jamur G. virens
Y dibuat bulatan tepat di tengah dasar petridish. Setelah itu diambil koloni jamur dengan alat cork borer diameter 5 mm dan ditanam tepat pada bulatan yang diberi tanda dengan spidol (Gambar 5). Biakan diinokulasi pada temperatur ruang. Pengamatan pertumbuhan jamur dilakukan pada 24, 48, dan 72 jam setelah inokulasi (Syahnen, 2006).
Penghambatan pertumbuhan F.o f. sp. passiflora oleh G. virens dihitung dengan menggunakan rumus :
Keterangan :
P = Kemampuan menghambat jamur G. virens
r1 = jari-jari pertumbuhan F.o f. sp. passiflora yang menjauhi G. virens
r2 = jari-jari pertumbuhan F.o f. sp. passiflora yang mendekati G. virens.
Fokkema (2000) dalam Nurbailis (1992).
3. Pengujian di Rumah Kassa ( Bioassay Test)
Perbanyakan G.virens
siap untuk diaplikasikan (Syahnen, 2006).
Perbanyakan F.o. f.sp. passiflora
Perbanyakan F.o. f.sp. passiflora dilakukan dengan menggunakan media
beras. Beras dibersihkan dengan cara dicuci, lalu dimasukkan ke dalam kantong
plastik, masing-masing kantong diisi 5 gram, lalu dimasukkan ke dalam autoclave
pada suhu 121°C selama 1 jam. Setelah dingin, media diinokulasi dengan
F.o. f.sp. passiflora 2-3 cork borer dan diinkubasi selama 14 hari. Setelah 14 hari, biakan jamur siap diaplikasikan (Ihsandan Octriana, 2009).
Persiapan Benih
Benih markisa diambil dari buah markisa pilihan. Buah dibelah dan diambil biji-bijinya. Biji bersama lendirnya ditampung dalam wadah kemudian dibersihkan dengan cara dicampur dengan abu dapur sambil diremas-remas dan dicuci dengan air bersih. Biji yang sudah bersih dikering-anginkan ditempat yang teduh selama beberapa hari agar kadar air dalam biji berkisar antara 12-14% (Rukmana, 2003).
Persiapan Tempat Persemaian
Persemaian
Benih yang sudah dipersiapkan dapat langsung disemai pada tempat penyemaian yang telah disediakan. Setelah berumur 2-3 minggu dipersemaian atau sudah berdaun dua dengan tinggi ± 5 cm, bibit dapat dipindahkan ke media tanam (Barus dan Syukri, 2008).
Persiapan Media Tanam
Tanah top soil dan pupuk kandang yang akan digunakan 3:1 diayak terlebih dahulu. Media campuran tersebut disterilkan dengan menggunakan uap panas untuk membunuh mikroorganisme pada media tanam. Sterilisasi dilakukan dengan menggunakan drum pengkukus pada suhu 1200 C dan tekanan 1,2 atm selama ± 1 jam. Media yang telah dipanaskan dikeluarkan dari kukusan, lalu dikering-anginkan di atas plastik di ruangan tertutup sampai dingin. Kemudian media tanam tersebut diberi pupuk TSP 3 gr/polibeg kemudian diaduk rata. Hal ini bertujuan agar unsur hara yang diberikan merata pada masing-masing polibeg.
Pengaplikasian G.virens
Penanaman
Bibit markisa yang telah disemai ditanam ke dalam polibeg dengan menggunakan tugal kecil. Bibit ditanam 1 bibit/polibeg. Jarak antar polibeg adalah 20 x 20 cm dan jarak antar perlakuan 50 cm.
Inokulasi F.o. f.sp. passiflora
Sebanyak 5 gram F.o. f.sp. passiflora diinokulasikan dengan cara menaburkannya di sekeliling pangkal batang dan ditutup kembali dengan tanah.
Sebelum F.o f. sp. passiflora diinokulasikan, terlebih dahulu akar tanaman
dilukai dengan cara memotong ujung-ujung akar menggunakan gunting. F.o f. sp. passiflora akan lebih cepat menginfeksi jika ada pelukaan.
Pemeliharaan
Pemeliharaan tanaman markisa meliputi aktifitas penyiraman dilakukan 2 kali sehari, penyiangan gulma, dan pemupukan (Barus dan Syukri, 2008).
Metode Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap yang terdiri dari 2 faktor, yaitu:
I.Faktor 1 adalah banyaknya Gliocladium virens G0 = Kontrol
G1 = Gliocladium virens dalam media jagung sebanyak 25 gr/1,5 kg tanah
G2 = Gliocladium virens dalam media jagung sebanyak 37.5 gr/1,5 kg tanah
G3 = Gliocladium virens dalam media jagung sebanyak 50 gr/1,5 kg tanah
II. Faktor 2 adalah kompos, perbandingan kompos dengan tanah yaitu: KA = Kompos ayam (1:3)
KS = Kompos sapi (1:3)
Sehingga diperoleh 10 kombinasi perlakuan yaitu:
G0KA G1KA G2KA G3KA G4KA
G0KS G1KS G2KS G3KS G4KS
Ulangan sebanyak 3 kali, diperoleh dari: (t-1) (r-1) > 15
Model linier dari rancangan yang digunakan adalah : Yij = µ + αi +βj + Σij Dimana :
Yij = nilai pengamatan pada perlakuan ke-i dan kelompok ke-j µ = Nilai tengah umum
αi = Pengaruh perlakuan ke-i
βj = pengaruh kelompok ke-j
Σij = galat percobaan dari perlakuan ke-i pada kelompok ke-j
Jumlah perlakuan = 10 perlakuan Jumlah ulangan = 3 ulangan Jumlah polibag per perlakuan = 5 polibag Jumlah perlakuan seluruhnya = 30 perlakuan Jumlah tanaman seluruhnya = 150 tanaman Jarak antar perlakuan = 50 cm Jarak antar polibag = 20 x 20 cm
Peubah Amatan
Persentase Serangan F.o. f.sp. passiflora
Pengamatan terhadap persentase serangan dilakukan pada saat tanaman berumur 10 hari sampai tanaman berumur 59 hari setelah tanam. Pengamatan dilakukan dua kali seminggu, yaitu dengan menghitung jumlah tanaman yang layu pada setiap perlakuan dengan menggunakan rumus sebagai berikut:
Dimana:
PS = persentase serangan
a = Jumlah tanaman yang terserang/perlakuan N = Jumlah tanaman/perlakuan
(Moekasan et al., 2000).
Intensitas Serangan F.o. f.sp. passiflora
menghitung tingginya tingkat kerusakan pangkal batang. Dapat dihitung dengan menggunakan rumus sebagai berikut:
Keterangan:
IS = Intensitas Serangan
n = Tingkat kerusakan pada pangkal batang V = Nilai skor dari kategori tiap serangan Z = Nilai tertinggi kategori kerusakan N = Jumlah tanaman
Skala serangan yang digunakan adalah sebagai berikut: Skor 0 = Tidak terdapat gejala serangan.
Skor 1 = > 1% - ≤ 25% panjang batang yang terserang Skor 2 = > 25% - ≤ 50% panjang batang yang terserang Skor 3 = > 50% - ≤ 75% panjang batang yang terserang Skor 4 = > 75% - ≤ 100% panjang batang yang terserang
Histologi
Pengamatan histologi dilakukan terhadap semua kombinasi perlakuan masing-masing satu tanaman. Metode histologi dilakukan menurut metode yang dideskripsikan oleh Wetter dan Constabel (1991) yaitu:
- Fiksasi
- Dehidrasi
Spesimen tersebut didehidrasi dengan merendamnya dalam konsentrasi etanol 80, 90, dan 95% (yang meningkat) pada suhu kamar. Kemudian larutan diganti dengan etanolabsolut.
- Pembenaman
Diatur letak spesimen dalam blok parafin dengan jarum panas (dibakar). Parafin akan memadat dalam waktu 2 jam (semalam).
- Pembuatan irisan
Dibuat irisan spesimen dengan tebal 15-10 µ m. Ditandai kaca objek (dengan pemotong gelas) dan dibersihkan dengan aseton. Kemudian diteteskan dengan air.
- Pengamatan
HASIL DAN PEMBAHASAN
Penggunaan Jamur Antagonis G.virens terhadap F.o. f.sp. passiflora
Banyaknya dosis G.virens dengan kompos ayam dan sapi pada setiap perlakuan yang diaplikasikan dalam penelitian ini berpengaruh nyata terhadap persentase serangan maupun intensitas serangan. F.o. f.sp. passiflora.
1. Persentase Serangan (%) F.o. f.sp. passiflora
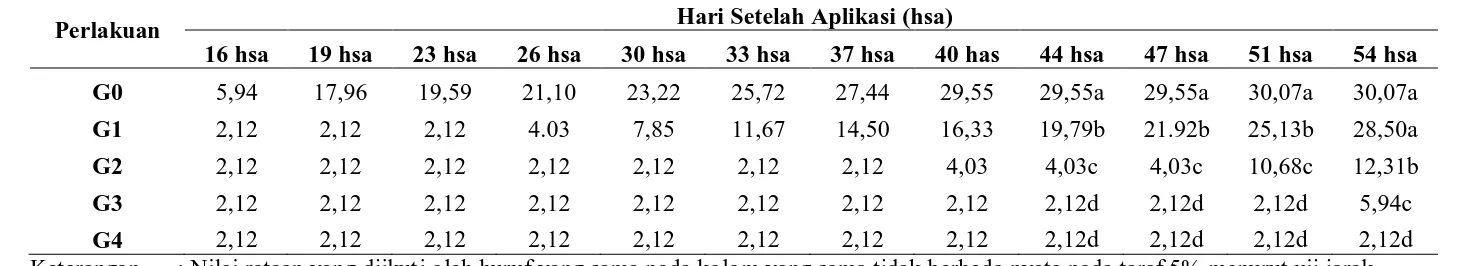
Data pengamatan persentase serangan F.o. f.sp. passiflora pada setiap pengamatan mulai 16-54 hsa dapat dilihat pada lampiran 2-13. Pengaruh G.virens terhadap persentase serangan (%) pada pengamatan 16 hsa-54 hsa dapat dilihat pada tabel 2.
Pemberian G. virens berpengaruh sangat nyata dalam menghambat pertumbuhan F.o. f.sp. passiflora terhadap perlakuan kontrol (tanpa pemberian G. virens). Penghambatan pertumbuhan F.o. f.sp. passiflora oleh G. virens relatif lebih rendah dibandingkan kontrol. Pada pengamatan 26 hsa, G1 (dosis 25 gram) mulai terserang oleh F.o. f.sp. passiflora. Hal ini mungkin disebabkan oleh perbedaan jumlah jamur antagonis tersebut lebih sedikit dibanding G2 (dosis 37,5 gram), G3 (dosis 50 gram), dan G4 (dosis 62,5 gram).
Tabel 1. Persentase Serangan (%) F.o. f.sp. passiflora yang diaplikasikan dengan G. virens
Perlakuan Hari Setelah Aplikasi (hsa)
16 hsa 19 hsa 23 hsa 26 hsa 30 hsa 33 hsa 37 hsa 40 has 44 hsa 47 hsa 51 hsa 54 hsa G0 5,94 17,96 19,59 21,10 23,22 25,72 27,44 29,55 29,55a 29,55a 30,07a 30,07a G1 2,12 2,12 2,12 4.03 7,85 11,67 14,50 16,33 19,79b 21.92b 25,13b 28,50a G2 2,12 2,12 2,12 2,12 2,12 2,12 2,12 4,03 4,03c 4,03c 10,68c 12,31b G3 2,12 2,12 2,12 2,12 2,12 2,12 2,12 2,12 2,12d 2,12d 2,12d 5,94c G4 2,12 2,12 2,12 2,12 2,12 2,12 2,12 2,12 2,12d 2,12d 2,12d 2,12d Keterangan : Nilai rataan yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf 5% menurut uji jarak
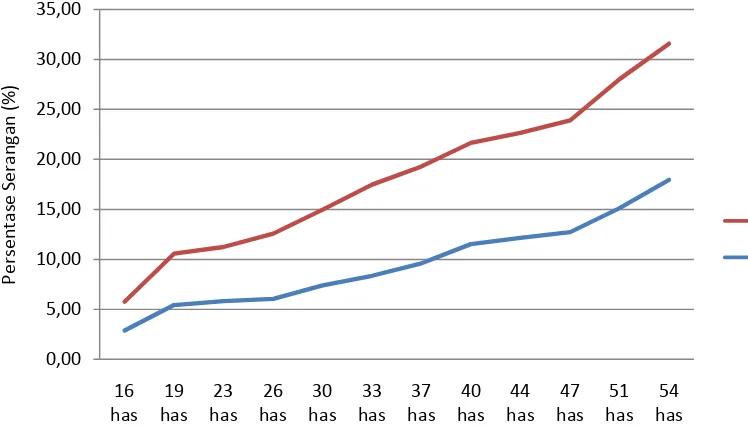
Untuk melihat hubungan antara penggunaan G.virens terhadap persentase serangan F.o. f.sp. passifloradapat dilihat pada grafik (Gambar 6.)
Gambar 6. Grafik hubungan antara penggunaan G.virens terhadap persentase serangan F.o. f.sp. passiflorapada pengamatan16 hsa-54 hsa.
Dari hasil analisis sidik ragam, jamur F.o. f.sp. passiflora terhadap perlakuan G.virens menunjukkan perbedaan yang sangat nyata dalam menghambat serangan jamur F.o. f.sp. passiflora. Hal ini karena G.virens merupakan jamur antagonis yang mampu memparasit miselium jamur patogen. Reaksi antagonistik dari G. virens terhadap F.o. f.sp. passiflora adalah hiperparasit, antibiosis dan kompetisi. Hal ini sesuai dengan pernyataan Mehrotra (1980) bahwa Gliocladium spp yang bersifat mikoparasit akan menekan populasi jamur patogen yang sebelumnya mendominasi. Interaksi diawali dengan melilitkan hifanya pada jamur patogen yang akan membentuk struktur seperti kait yang disebut haustorium dan memarasit jamur patogen. Bersamaan dengan penusukan hifa, jamur mikoparasit ini mengeluarkan enzim seperti enzim kutinase
0,00
Waktu pengamatan (Hari Setelah Aplikasi/ hsa)
G4
G3
G2
G1
dan β-1-3 glukanase yang akan menghancurkan dinding sel jamur patogen. Akibatnya, hifa jamur patogen akan rusak, protoplasmanya keluar dan jamur akan mati. Secara bersamaan pula terjadi mekanisme antibiosis, keluarnya senyawa anti jamur golongan peptaibol dan senyawa furanon oleh Gliocladium spp. yang dapat menghambat pertumbuhan spora dan hifa jamur pathogen.
Daya antagonisme dari G. virens terhadap F.o. f.sp. passiflora juga dipengaruhi oleh jenis bahan organik. Keberadaan kompos ternyata meningkatkan daya antagonis G. virens terhadap F.o. f.sp. passiflora sampai 17,93%. Hal ini disebabkan karena kompos selain bersifat menambah kandungan bahan organik untuk menyuburkan tanaman, aktivitas kompos dalam tanah juga mampu membantu tanaman menghadapi serangan penyakit. Isroi (2008) menyatakan bahwa kompos memperbaiki struktur tanah dengan meningkatkan kandungan bahan organik tanah dan akan meningkatkan kemampuan tanah untuk mempertahankan kandungan air tanah. Aktivitas mikroba tanah juga diketahui dapat membantu tanaman menghadapi serangan penyakit.
Tabel 2. Pengaruh Pemberian Kompos terhadap Persentase Serangan (%) F.o. f.sp. passiflora.
Perlakuan Hari Setelah Aplikasi (hsa)
16 hsa 19 hsa 23 hsa 26 hsa 30 hsa 33 hsa 37 hsa 40 has 44 hsa 47 hsa 51 hsa 54 hsa KA 2.89 5.43 5.80 6.04 7.37 8.37 9.58 11.50 12.15a 12.72a 15.09a 17.93a KS 2.89 5.15 5.43 6.56 7.61 9.13 9.74 10.16 10.53b 11.18b 12.96b 13.65b Keterangan : Nilai rataan yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf 5% menurut uji jarak
Untuk lebih jelas perbedaan antara penggunaan kompos ayam dan kompos sapi terhadap persentase serangan F.o. f.sp. passiflora dapat dilihat pada gambar 7.
Gambar 7. Grafik hubungan antara penggunaan Kompos (K) terhadap persentase serangan F.o. f.sp. passiflora pada pengamatan 16 hsa-54 hsa.
Pada tabel 3 dapat dilihat bahwa pengaruh kompos terhadap persentase serangan menunjukkan kompos sapi berpengaruh sangat nyata pada pengamatan 44-54 hsa. Kompos sapi terlihat lebih efektif dibanding dengan kompos ayam. Hasil ini sejalan dengan hasil yang didapat pada penelitian yang dilakukan oleh Aryantha (2001) diperoleh kompos sapi dan ayam yang dikomposkan selama 5 minggu telah berhasil menyuburkan tanaman Lupinus albus sekaligus mengontrol penyakit layu oleh Fusarium oxysporum. Keberhasilan ini berkorelasi positif dengan aktivitas mikroba dan populasi mikroba antagonist (aktinomiset dan bakteri penghasil endospora) dalam tanah. Keragaman jenis mikroba juga tampak paling tinggi pada tanah yang diberi perlakuan dengan kotoran sapi.
0,00
Waktu Pengamatan (Hari Setelah Aplikasi/ hsa)
KS
Tabel 3. Persentase Serangan (%) F.o. f.sp. passiflora pada berbagai kombinasi perlakuan G. virens dan Kompos.
Keterangan: Nilai rataan yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf 5% menurut uji jarak berganda Duncan
Perlakuan Hari Setelah Aplikasi (hsa)
16 hsa 19 hsa 23 hsa 26 hsa 30 hsa 33 hsa 37 hsa 40 has 44 hsa 47 hsa 51 hsa 54 hsa G0KA 1.98 6.22 6.84 7.23 8.18 8.57 9.32 10.02 10.02a 10.02a 10.02a 10.02a G0KS 1.98 5.75 6.22 6.84 7.31 8.57 8.97 9.67 9.67a 9.67a 10.02a 10.02a G1KA 0.71 0.71 0.71 1.98 3.25 4.53 5.14 5.75 6.84b 7.78b 8.57a 9.67a
Dari hasil analisis sidik ragam dapat dilihat bahwa interaksi antara G. virens dengan kompos pada pengamatan 16-40 hsa tidak berpengaruh nyata
terhadap persentase serangan, teteapi berpengaruh sangat nyata pada pengamatan 44 – 54 hsa. Persentase serangan F.o. f.sp. passiflora pada berbagai kombinasi perlakuan (G x K) dapat dilihat pada Tabel 4.
Hasil penelitian menunjukkan bahwa pengaruh penggunaan G. virens pada 16 - 40 hsa tidak berbeda nyata terhadap persentase serangan F.o. f.sp. passiflora. Namun pada umur 44 – 54 hsa interaksi kombinasi perlakuan menunjukkan pengaruh sangat nyata. Kombinasi perlakuan paling efektif dalam menekan serangan jamur F.o. f.sp. passiflora terdapat pada perlakuan G4 (dosis 62,5gr) sebesar 0,71 % sedangkan tertinggi pada perlakuan kontrol GOKA dan GOKS sebesar 10,02 %.
Hasil penelitian menunjukkan bahwa banyaknya G. virens yang paling efektif terdapat pada perlakuan G3KS, G4KA dan G4KS sebanyak 50-62,5 gram/ 1,5 kg tanah.
2. Intensitas Serangan (%) F.o. f.sp. passiflora
Hasil analisa sidik ragam menunjukkan bahwa pemberian G.virens berpengaruh sangat nyata dalam menghambat serangan F.o. f.sp. passiflora.
Pengaruh pemberian G.virens dan kompos terhadap intensitas serangan F.o. f.sp. passiflora dapat dilihat pada tabel 4.
Tabel 4. Intensitas Serangan (%) F.o. f.sp. passiflora yang diberi G.virens dan kompos.
Perlakuan Intensitas Serangan (%)
G0KA 10.02 a
Keterangan: Nilai rataan yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf 5% menurut uji jarak berganda Duncan
Dari tabel 4 dapat dilihat bahwa perlakuan pemberian G.virens dalam media jagung pada perlakuan G1 tidak berbeda nyata terhadap kontrol (G0).
intensitas serangan F.o. f.sp. passiflora. Ini karena semakin banyak populasi konidia dalam media jagung tersebut, akibatnya daya parasitasi G.virens terhadap semakin efektif. Sehingga dapat diprediksi bahwa dengan pemberian dosis G.virens yang lebih tinggi maka intensitas serangan F.o. f.sp. passiflora akan lebih rendah.
Dari tabel 4 dapat dilihat bahwa yang paling tahan terhadap serangan F.o. f.sp. passiflora adalah kompos sapi dengan intensitas serangan pada G3KS sebesar 3,72%, berbeda nyata dengan kompos ayam yang intensitas serangannya sebesar 5,07% pada G3KS.
3. Histologi
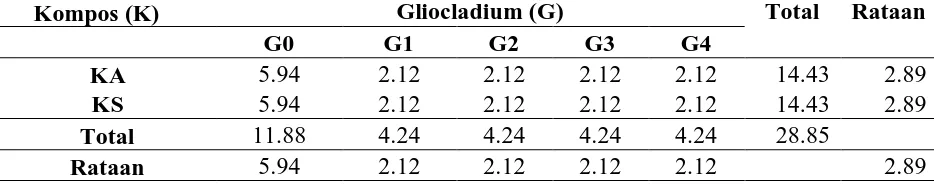
Histologi batang markisa diperoleh dari pengamatan secara mikroskopik. Tanaman pada pengamatan 54 hsa dicabut mewakili setiap perlakuan. Adapun perbandingan histologi batang markisa pada sampel yang mewakili semua perlakuan dapat dilihat pada gambar berikut:
Gambar 8. Irisan melintang dari jaringan batang markisa dengan berbagai kombinasi pemberian G.virens dan kompos 54 hsa (perbesaran 4 x 10 µm)
Pengamatan hasil sediaan histologis pada gambar menunjukkan adanya perbedaan tiap lapisan setiap irisan, baik pada kontrol maupun perlakuan. Perbedaan pada tingkat jaringan antara perlakuan dengan kontrol terlihat pada susunan ruang antar sel perlakuan yang lebih padat dibandingkan dengan kontrol. Perbedaan seperti itu diinterpretasikan sebagai akibat efek jamur antagonis yang mampu melilit perkembangan fusarium.
dan jamur akan mati. Secara bersamaan pula terjadi mekanisme antibiosis, keluarnya senyawa anti jamur golongan peptaibol dan senyawa furanon oleh Gliocladium spp. yang dapat menghambat pertumbuhan spora dan hifa jamur pathogen.
KESIMPULAN DAN SARAN
Kesimpulan
1. Pemberian G.virens dan kompos efektif dalam menghambat serangan jamur F.o. f.sp. passiflora.
2. Semakin tinggi dosis G. virens yang diberikan untuk menekan F.o. f.sp. passiflora maka semakin rendah intensitas serangan F.o. f.sp. passiflora.
3. Pemberian kompos sapi lebih efektif dibanding dengan kompos ayam.
4. Perbedaan gambar irisan histologi pada tingkat jaringan antara perlakuan dengan kontrol terlihat pada susunan ruang antar sel perlakuan yang lebih padat dibandingkan dengan kontrol. Perbedaan seperti itu diinterpretasikan sebagai akibat efek jamur antagonis yang mampu melilit perkembangan fusarium.
Saran
DAFTAR PUSTAKA
Abadi, A.L. 2003. Ilmu Panyakit Tumbuhan III. Bayumedia Publishing, Malang. Hal. 68-69.
Agrios, G. N., 1996. Ilmu Penyakit Tumbuhan. Edisi Ketiga. Gadjah Mada University Press, Yogyakarta. Hal. 45, 470-471.
Alexopoulus, C.J. and C.W. Mims. 1999. Introductory Mycology. Jhon wiley an Sons. New York. Hal. 355.
Aryantha, I.N.P. 2001. Membangun Sistem Pertanian BerkelanjutanKPP Ilmu Hayati LPPM-ITB, Dept. Biologi - FMIPA-ITB. Ganesha, Bandung.
Bangun, M.K., 1991. Rancangan Percobaan. Fakultas Pertanian. Universitas Sumatera Utara, Medan.
Barus, A dan Syukri, 2008. Agroekoteknologi Tanaman Buah-buahan. USU Press, Medan. Hal. 66.
Coronel, R.E. 1983. Promising Fruits of The Philippines. College of Agriculture University of The Philippines, Los Banos. Hal. 502-505.
Dinas Pertanian, 2010. Kompos September 2010.
Djafaruddin., 2000. Dasar-dasar Pengendalian Penyakit Tanaman. Penerbit Bumi Aksara, Jakarta. Hal. 118-120.
Gandjar,I., A. Samson, T. Vermeulen, S. Oetari, dan Santoso. 1999. Pengenalam Kapang Tropik Umum. Yayasan Obor Indonesia, Jakarta. Hal. 66-67. Ihsan, F. dan L. Octriana. 2009. Teknik Pengujian Efektivitas Jamur
Entomopatogen Beauveria bassiana pada Media Pembawa Substrat Beras dan Jagung Untuk Mengendalikan Lalat Bbuah Semilapang.
Buletin Teknik Pertanian 14 (2): 62-64.
Isroi. 2008. Kompos. Makalah. Balai Penelitian Bioteknologi Perkebunan Indonesia, Bogor.
Mahar, S. 2009. Gliocladium virens. http:www.entomology.wisc.edu.htm.
Maryani, M.M. 2010. Sitologi dan Histologi Tanaman. Fakultas Biologi UGM, Yogyakarta.
Diakses tanggal 15 Januari 2009.
Mehrotra, R.S. 1980. Plant Pathology. Tata McGraw Hill Publishing Co. Ltd. New Delhi.
Moekasan, T.K., L. Prabaningrum, dan Meitha L., 2000. Penerapan PHT pada Sistem Tanaman Tumpang Gilir. Pusat Penelitian dan Pengembangan Hortikultura . Balai Penelitian dan Pengembangan Pertanian. Jakarta. Nurbailis, D. 1992. Perbanyakan Jamur Gliocladium. Jurnal Litbang Pertanian.
25(3). Hal. 75-80.
Pinem, M. I., 2001. Peran Agens Antagonis dalam Pengendalian Hayati. Dalam Pelatihan Agens Hayati untuk Pengendalian Organisme Pengganggu Tanaman (OPT) Perkebunan Kakao. Medan, 20-25 Agustus 2001.
Rukmana, H.R. 2007. Usaha Tani Markisa. Penerbit Kanisius, Yogyakarta. Hal. 12-13.
Saragih, Y.S., F.H., Silalahi dan A. E., Marpaung, 2006. Uji Resistensi beberapa Kultivar Markisa Asam terhadap Penyakit Layu Fusarium. Jurnal Hortikultura (16). Hal: 321-326.
Saragih,Y.S dan F.H. Silalahi. 2006. Isolasi dan Identifikasi Spesies Fusarium Penyebab Penyakit Layu pada Tanaman Markisa Asam. Jurnal Hortikultura. 16 (4): 336-344.
Semangun, H.. 1996. Pengantar Ilmu Penyakit Tumbuhan. Gajah Mada University Press, Yogyakarta. Hal. 327-328.
_____________2000. Penyakit-Penyakit Tanaman Hortikultura di Indonesia. Gajah Mada University Press, Yogyakarta. Hal. 504-505.
Shivas, R dan D. Beasley. 2005. Pengelolaan Koleksi Patogen Tanaman. Diterjemahkan oleh Kramadibrata,K., N. Wulijarni dan M. Machmud. Queensland Department of Primary Industries and Fisheries, Australia. Hal. 57.
Singh, R. S., 2001. Plant Diseases. Seventh Edition. Oxford & IBH Publishing CO.PVT.LTD. New Delhi. Hal. 643.
Sivan, A and I. Chet. 1989. Degradation of Fungal Cell Walls by Lytic Enzymes of Trichoderma harzianum. J. Gen. Microbiol. 135 : 675 – 682.
Soesanto, L. 2008. Pengantar Pengendalian Hayati Penyakit Tanaman. PT. Raja Grafindo Persada, Jakarta. Hal. 259-271.
Sutanto, R. 2002. Penerapan Pertanian Organik, Pemasyarakatan dan Pengembangannya. Kanisius, Yoyakarta.
Syahnen. 2006. Teknik Perbanyakan Jamur Antagonis. Balai Pengembangan Proteksi Tanaman Perkebunan, Medan.
Weber, G.F. 1973. Bacterial and Fungal Diseases of Plants in The Tropics. University of Florida Press, Ganesville. Hal. 398-399.
Winarsih, S. 2007. Pengaruh Bahan Organik pada Pertumbuhan Gliocladium
virens dan Daya Antagonisnya Terhadap Fusarium oxisporum secara In-Vitro. Jurnal Ilmu-ilmu Pertanian Indonesia. Edisi Khusus(3): 386-390. Yusuf, T. 2009. Kandungan Hara Pupuk Kandang.
Lampiran 1. Bagan Perlakuan
Keterangan: U
G0 = Kontrol
G1 = Gliocladium virens dalam media jagung sebanyak 25 gr/1,5 kg tanah S
G2 = Gliocladium virens dalam media jagung sebanyak 37.5 gr/1,5 kg tanah
G3 = Gliocladium virens dalam media jagung sebanyak 50 gr/1,5 kg tanah
G4 = Gliocladium virens dalam media jagung sebanyak 62.5 gr/1,5 kg tanah
KA = Kompos ayam (1:3)
KS = Kompos sapi (1:3)
Lampiran 2. Data Rataan Persentase Serangan F.o. f.sp. passiflora 16 hsa
Transformasi Data Arc Sin √x+0.5
Perlakuan Ulangan Total Rataan
Kompos (K) Gliocladium (G) Total Rataan
G0 G1 G2 G3 G4
KA 5.94 2.12 2.12 2.12 2.12 14.43 2.89 KS 5.94 2.12 2.12 2.12 2.12 14.43 2.89
Total 11.88 4.24 4.24 4.24 4.24 28.85
Daftar Sidik Ragam
Sumber Keragaman db JK KT F.Hit F.05 F. 01
Perlakuan 9 7.79
Gliocladium 4 7.79 1.95 2.00 tn 2.67 4.43
Kompos 1 0.00 0.00 0.00 tn 4.35 8.10
G x K 4 0.00 0.00 0.00 tn 2.67 4.43
Error 20 19.46 0.97
Total 29 27.25
FK = 27.75
KK = 1.03 %
Ket : tn = tidak nyata * = nyata
Lampiran 3. Data Rataan Persentase Serangan F.o. f.sp. passiflora 19 hsa
Transformasi Data Arc Sin √x+0.5
Perlakuan Ulangan Total Rataan
Kompos (K) Gliocladium (G) Total Rataan
G0 G1 G2 G3 G4
KA 18.67 2.12 2.12 2.12 2.12 27.16 5.43 KS 17.26 2.12 2.12 2.12 2.12 25.74 5.15
Total 35.93 4.24 4.24 4.24 4.24 52.90
Daftar Sidik Ragam
Sumber Keragam db JK KT F.Hit F.05 F. 01
Perlakuan 9 134.17
Gliocladium 4 133.84 33.46 88.51 ** 2.87 4.43
Kompos 1 0.07 0.07 0.18 tn 4.35 3.10
G x K 4 0.27 0.07 0.18 tn 2.67 4.43
Error 20 7.56 0.38
Total 29 141.73
FK = 93.27
KK = 0.35 %
Ket : tn = tidak nyata * = nyata
** = sangat nyata Uji Jarak Duncan Faktor G
Sy 0.25
P 2 3 4 5 6
SSR 0,05 4.02 4.22 4.33 4.40 4.47
LSR 0,05 1.01 1.06 1.09 1.10 1.12
Perlakuan G2 G3 G4 G1 G0
Rataan 2.12 2.12 2.12 2.12 17.96
·a
Lampiran 4. Data Rataan Persentase Serangan F.o. f.sp. passiflora 23 hsa
Transformasi Data Arc Sin √x+0.5
Perlakuan Ulangan Total Rataan
I II III
Kompos (K) Gliocladium (G) Total Rataan
G0 G1 G2 G3 G4
KA 20.51 2.12 2.12 2.12 2.12 28.99 5.80 KS 18.67 2.12 2.12 2.12 2.12 27.16 5.43
Total 39.18 4.24 4.24 4.24 4.24 56.15
Daftar Sidik Raga
Sumber Keragama db JK KT F.Hit F.05 F. 01
Perlakuan 9 163.27
Jamur 4 162.71 40.68 122.42 ** 2.67 4.43
Gliocladium 1 0.11 0.11 0.34 tn 4.35 3.10
G x K 4 0.45 0.11 0.34 tn 2.67 4.43
Error 20 6.65 0.33
Total 29 169.92
FK = 105.08
KK = 0.31 %
Ket : tn = tidak nyata * = nyata
** = sangat nyata Uji Jarak Duncan Faktor G
Sy 0.24
P 2 3 4 5 6
SSR 0,05 4.02 4.22 4.33 4.40 4.47
LSR 0,05 0.95 0.99 1.02 1.04 1.05
Perlakuan G2 G3 G4 G1 G0
Rataan 2.12 2.12 2.12 2.12 19.59
·a
Lampiran 5. Data Rataan Persentase Serangan F.o. f.sp. passiflora26 hsa
Perlakuan Ulangan Total Rataan
I II III
Transformasi Data Arc Sin √x+0.5
Perlakuan Ulangan Total Rataan
Kompos (K) Gliocladium (G) Total Rataan
G0 G1 G2 G3 G4
KA 21.70 5.94 2.12 2.12 2.12 34.01 6.80 KS 20.51 2.12 2.12 2.12 2.12 28.99 5.80
Total 42.21 8.06 4.24 4.24 4.24 63.00
Daftar Sidik Ragam Uji Jarak Duncan Faktor G
Lampiran 6. Data Rataan Persentase Serangan F.o. f.sp. passiflora 30 hsa
Transformasi Data Arc Sin √x+0.5
Daftar Sidik Ragam Uji Jarak Duncan Faktor G
Lampiran 7. Data Rataan Persentase Serangan F.o. f.sp. passiflora 33 hsa
Perlakuan Ulangan Total Rataan
I II III
Transformasi Data Arc Sin √x+0.5
Perlakuan Ulangan Total Rataan
I II III
Kompos (K) Gliocladium (G) Total Rataan
G0 G1 G2 G3 G4
KA 25.72 13.58 2.12 2.12 2.12 45.67 9.13 KS 25.72 9.76 2.12 2.12 2.12 41.85 8.37
Total 51.45 23.35 4.24 4.24 4.24 87.52
Daftar Sidik Ragam Uji Jarak Duncan Faktor G
Lampiran 8. Data Rataan Persentase Serangan F.o. f.sp. passiflora 37 hsa
Perlakuan Ulangan Total Rataan
I II III Transformasi Data Arc Sin √x+0.5
Perlakuan Ulangan Total Rataan
Kompos (K) Gliocladium (G) Total Rataan
G0 G1 G2 G3 G4
KA 27.97 15.42 2.12 2.12 2.12 49.75 9.95 KS 26.92 13.58 2.12 2.12 2.12 46.86 9.37
Total 54.89 29.00 4.24 4.24 4.24 96.62
Daftar Sidik Ragam Uji Jarak Duncan Faktor G
Lampiran 9. Data Rataan Persentase Serangan F.o. f.sp. passiflora 40 hsa
Transformasi Data Arc Sin √x+0.5
Perlakuan Ulangan Total Rataan
Kompos (K) Gliocladium (G) Total Rataan
G0 G1 G2 G3 G4
KA 30.07 17.26 5.94 2.12 2.12 57.52 11.50 KS 29.02 15.42 2.12 2.12 2.12 50.81 10.16 Total 59.10 32.67 8.06 4.24 4.24 108.32
Daftar Sidik Ragam Uji Jarak Duncan Faktor G
Lampiran 10. Data Rataan Persentase Serangan F.o. f.sp. passiflora44 hsa
Transformasi Data Arc Sin √x+0.5
Perlakuan Ulangan Total Rataan
Kompos (K) Gliocladium (G) Total Rataan
G0 G1 G2 G3 G4
KA 30.07 20.51 5.94 2.12 2.12 60.77 12.15 KS 29.02 17.26 2.12 2.12 2.12 52.64 10.53
Total 59.10 37.76 8.06 4.24 4.24 113.41
Daftar Sidik Ragam Uji Jarak Duncan Faktor G
Sy 0.34
Tabel Dwi Kasta
Kompos (K) Gliocladium (G) Total Rataan
G0 G1 G2 G3 G4
KA 30.07 23.33 9.76 2.12 2.12 67.41 13.48 KS 29.02 20.51 2.12 2.12 2.12 55.89 11.18
Total 59.10 43.84 11.88 4.24 4.24 123.31
Rataan 29.55 21.92 5.94 2.12 2.12 12.33
Daftar Sidik Ragam
Sumber Keragaman db JK KT F.Hit F.05 F. 01
Perlakuan 9 436.38
Gliocladium 4 425.13 106.28 180.09 ** 2.67 4.43
Kompos 1 4.43 4.43 7.50 ** 4.35 3.10
G x K 4 6.82 1.71 2.89 * 2.67 4.33
Error 20 11.80 0.59
Total 29 448.18
FK = 506.82
KK = 0.19 %
Ket : tn = tidak nyata * = Nyata
Uji Jarak Duncan Faktor G
Sy 0.31
P 2 3 4 5 6
SSR 0,05 4.02 4.22 4.33 4.40 4.47
LSR 0,05 1.26 1.32 1.36 1.38 1.40
Perlakuan G4 G3 G2 G1 G0
Rataan 2.12 2.12 5.94 21.92 29.55
·a ·b
·c
d
Uji Jarak Duncan Faktor K
sy 0.15
P 2 3
SSR 0,05 4.02 4.22
LSR 0,05 0.61 0.64
Perlakuan KS KA
Rataan 11.18 13.48
Uji Jarak Duncan Faktor Interaksi Gliocladium dan Kompos
sy 0.34
P 2 3 4 5 6 7 8 9 10 11
SSR 0,05 4.02 4.22 4.38 4.40 4.47 4.53 4.58 4.61 4.65 4.69
LSR 0,05 1.37 1.44 1.49 1.50 1.52 1.54 1.56 1.57 1.58 1.60
Perlakuan G4KS G4KA G3KS G3KA G2KS G2KA G1KS G1KA G0KS G0KA
Rataan 0.71 0.71 0.71 0.71 0.71 3.25 6.84 7.78 9.67 10.02
a
b ·c
Lampiran 12. Data Rataan Persentase Serangan F.o. f.sp. passiflora 51 hsa
Transformasi Data Arc Sin √x+0.5
Tabel Dwi Kasta
Kompos (K) Gliocladium (G) Total Rataan
G0 G1 G2 G3 G4
KA 30.07 25.72 15.42 2.12 2.12 75.46 15.09 KS 30.07 24.53 5.94 2.12 2.12 64.79 12.96
Total 60.15 50.25 21.36 4.24 4.24 140.25
Rataan 30.07 25.13 10.68 2.12 2.12 14.02
Daftar Sidik Ragam
Sumber
Keragaman db JK KT F.Hit F.05 F. 01
Perlakuan 9 465.48
Gliocladium 4 450.27 112.57 162.20 ** 2.67 4.43
Kompos 1 3.80 3.80 5.47 ** 4.35 3.10
G x K 4 11.41 2.85 4.11 * 2.67 4.33
Error 20 13.88 0.69
Total 29 479.36
FK = 655.64
KK = 0.18 %
Uji Jarak Duncan Faktor Interaksi Gliocladium dan Kompos
sy 0.40
P 2 3 4 5 6 7 8 9 10 11
SSR 0,05 4.02 4.22 4.38 4.40 4.47 4.53 4.58 4.61 4.65 4.69
LSR 0,05 1.61 1.69 1.75 1.76 1.79 1.82 1.84 1.85 1.86 1.88
Perlakuan G4KS G4KA G3KS G3KA G2KS G2KA G1KS G1KA G0KS G0KA
Rataan 0.71 0.71 0.71 0.71 1.98 5.14 8.18 8.57 10.02 10.02
A ·b
·c
Lampiran 13. Data Rataan Persentase Serangan F.o. f.sp. passiflora 54 hsa
Transformasi Data Arc Sin √x+0.5
Tabel Dwi Kasta
Kompos (K) Gliocladium (G) Total Rataan
G0 G1 G2 G3 G4
KA 30.07 29.02 18.67 9.76 2.12 89.65 17.93 KS 30.07 27.97 5.94 2.12 2.12 68.23 13.65 Total 60.15 56.99 24.61 11.88 4.24 157.88
Rataan 30.07 28.50 12.31 5.94 2.12 15.79
Daftar Sidik Ragam
Sumber Keragaman db JK KT F.Hit F.05 F. 01
Perlakuan 9 477.88
Gliocladium 4 440.97 110.24 83.98 ** 2.67 4.43
Kompos 1 15.30 15.30 11.65 ** 4.35 3.10
G x K 4 21.62 5.40 4.12 * 2.67 4.33
Error 20 26.25 1.31
Total 29 504.14
FK = 830.86
KK = 0.22 %
Uji Jarak Duncan Faktor G
Uji Jarak Duncan Faktor K
Uji Jarak Duncan Faktor Interaksi Gliocladium dan Kompos
sy 0.76
P 2 3 4 5 6 7 8 9 10 11
SSR 0,05 4.02 4.22 4.38 4.40 4.47 4.53 4.58 4.61 4.65 4.69
LSR 0,05 3.05 3.20 3.32 3.33 3.39 3.43 3.47 3.49 3.52 3.55
Perlakuan G4KS G4KA G3KS G3KA G2KS G2KA G1KS G1KA G0KS G0KA
Rataan 0.71 0.71 0.71 1.98 3.25 6.22 9.32 9.67 10.02 10.02
a
b ·c
Lampiran 14. Data Intensitas Serangan F.o. f.sp. passiflora
Kompos Gliocladium Total Rataan
T0 T1 T2 T3 T4
KA 30.07 30.07 17.93 15.33 2.12 95.53 19.11 KS 30.07 29.56 15.20 11.16 2.12 88.12 17.62 Total 60.15 59.64 33.13 26.49 4.24 183.65
Daftar Sidik Ragam
Uji Jarak Duncan Faktor K