PERTUMBUHAN
FAKULTAS MA U
HAN BEBERAPA JAMUR PATOGEN
SKRIPSI
NORTON ADYANTO PANE 100805021
DEPARTEMEN BIOLOGI
MATEMATIKA DAN ILMU PENGETAHU UNIVERSITAS SUMATERA UTARA
MEDAN 2015
TOGEN TANAMAN
UJI KEMAMPUAN BAKTERI KITINOLITIK DARI
Nepenthes
tobaica
DAN
Nepenthes gracilis
DALAM MENGHAMBAT
PERTUMBUHAN BEBERAPA JAMUR PATOGEN TANAMAN
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
NORTON ADYANTO PANE 100805021
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : Uji Kemampuan Bakteri Kitinolitik dari
Nepenthes tobaica dan Nepenthes gracilis dalam Menghambat Pertumbuhan Beberapa Jamur Patogen Tanaman
Kategori : Skripsi
Nama : Norton Adyanto Pane
Nomor Induk Mahasiswa : 100805021
Program Studi : Sarjana (S1) Biologi
Departemen : Biologi
Fakultas : Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui di Medan, Juni 2015
Komisi Pembimbing : Pembimbing 2,
Prof. Dr. Dwi Suryanto, M.Sc NIP: 196404091994031003
Pembimbing 1,
Prof. Dr. Erman Munir, M.Sc NIP: 196511011991031002
Disetujui oleh
Departemen Biologi FMIPA USU Ketua,
PERNYATAAN
UJI KEMAMPUAN BAKTERI KITINOLITIK DARINepenthes tobaica DANNepenthes gracilisDALAM MENGHAMBAT PERTUMBUHAN
BEBERAPA JAMUR PATOGEN TANAMAN
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juni 2015
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Pengasih dan Maha Penyayang karena atas berkat, rahmat dan kemurahan-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul, ” Uji Kemampuan Bakteri Kitinolitik dari Nepenthes tobaica dan Nepenthes gracilis dalam Menghambat Pertumbuhan Beberapa Jamur Patogen Tanaman” dalam waktu yang ditetapkan.
Ucapan terima kasih penulis sampaikan kepada Bapak Prof. Dr. Erman Munir, M.Sc selaku Dosen Pembimbing I dan kepada Bapak Prof. Dr. Dwi Suryanto, M.Sc sebagai Dosen Pembimbing II yang telah banyak memberikan bimbingan dan arahan, waktu dan perhatiannya yang besar terutama saat memulai penulisan hingga penyusunan skripsi ini. Ucapan terima kasih juga penulis sampaikan kepada Ibu Dra. Nunuk Priyani, M.Sc dan Ibu Dra. Elimasni, M.Si sebagai Ketua dan Sekretaris Penguji yang telah banyak memberikan arahan dan saran dalam penyempurnaan penulisan skripsi ini.
Ucapan terima kasih juga penulis tunjukkan kepada Bapak Drs. Muhammad Zaidun Sofyan, M.Si selaku Dosen Pembimbing Akademik penulis dan juga kepada Ibu Dr. Nursahara Pasaribu, M.Sc. Ketua Departemen Biologi FMIPA USU dan Ibu Dr. Saleha Hanum M.Si selaku Sekretaris Departemen Biologi FMIPA USU. Dr. Sutarman, M.Sc. selaku Dekan FMIPA USU. Staf pengajar di Departemen Biologi FMIPA USU, Ibu Nurhasni Muluk, Ibu Roslina Ginting, dan Bang Erwin selaku Staf Pegawai Departemen BIOLOGI FMIPA USU.
Ucapan terima kasih juga penulis ucapkan kepada Yuli Gultom selaku rekan penelitian dan sahabat-sahabat sejak masuk perkuliahan (Edwarman, Doni, Tonis, Posma, Julu, Richard, Trisi, Juwita, Mei, Nova, Yantika, Chrestina, Siti, Elfrida, Tien, Anita, Nialusi) dan seluruh teman teman BIOREVOLUT10N. Kepada Bang Imam, Bang Aan, Bang Jekmal, Bang Albert dan Bang Frans terima kasih atas segala bantuan yang diberikan selama ini
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh karena itu penulis mengharapkan kritik dan saran yang bersifat membangun. Akhir kata semoga skripsi ini bermanfaat bagi kita semua.
Medan, Juni 2015
UJI KEMAMPUAN BAKTERI KITINOLITIK DARINepenthes tobaica DANNepenthes gracilisDALAM MENGHAMBAT PERTUMBUHAN
BEBERAPA JAMUR PATOGEN TANAMAN ABSTRAK
Uji Kemampuan Bakteri Kitinolitik Dari Nepenthes tobaica dan Nepenthes gracilis Dalam Menghambat Pertumbuhan Beberapa Jamur Patogen Tanaman telah dipelajari dengan metode uji tantang dan uji ekstrak kasar. Lima isolat bakteri kitinolitik yang sebelumnya telah diisolasi dari Nepenthes tobaica dan Nepenthes gracilis telah diujikan dan memiliki kemampuan bervariasi dalam menghambat pertumbuhan jamur Fusarium sp. dan Rhizoctonia solani. Isolat RH1 memiliki kemampuan tertinggi dalam menghambat pertumbuhan Fusarium sp.danRhizoctonia solani dengan zona hambat masing masing 2,00 cm dan 2,40 cm. Isolat AM1 juga menunjukkan daya hambat yang relatif sama yaitu masing-masing 2,05 cm dan 2,15 cm. Isolat CBH memiliki kemampuan terendah dengan zona hambat masing-masing 0,90 cm dan 1,60 cm. Ekstrak kasar enzim kitinase dari isolat yang memiliki kemampuan penghambatan tertinggi diujikan kembali terhadap kedua jamur uji. Ekstrak isolat RH1 menunjukkan penghambatan terhadap pertumbuhan Fusarium sp. dan Rhizoctonia solani dengan zona hambat masing-masing 0,91 cm dan 1,41 cm sedangkan ekstrak isolat AM1 menunjukan zona hambat masing-masing sebesar 1,35 cm dan 1,27 cm.
THE ABILITY OF CHITINOLYTIC BACTERIA ISOLATED FROM Nepenthes tobaicaANDNepenthes gracilisTO INHIBIT THE GROWTH OF
PLANT PATHOGEN FUNGI ABSTRACT
The ability of chitinolytic bacteria isolated fromNepenthes tobaicaandNepenthes gracilis to inhibit the growth of plant pathogen fungi has been studied through antagonistic and crude extract tests. Five chitinolytic bacterial isolates isolated from Nepenthes tobaicaand Nepenthes gracilishave been tested and showed the ability to inhibit the growth of Fusarium sp.and Rhizoctonia solani. RH1 isolate has the highest ability to inhibit the growth of Fusarium sp. and Rhizoctonia solani with diameter of inhibition zone of 2.00 cm and 2.40 cm, respectively. AM1 isolate showed relatively the same diameter of inhibition of 2.05 cm and 2.15 cm, respectively. CBH isolate showed the lowest inhibition zone of 0.90 cm and 1.60 cm respectively. The crude extract of the chitinase of isolates with the highest inhibitory ability was tested back against of both fungi. The crude extract of RH1 showed inhibition of the growth of Fusarium sp. and Rhizoctonia solani with inhibition zone of 0.91 cm and 1.41 cm, respectively while extract of AM1 showed inhibition zone of 1.35 cm and 1.27 cm, respectively.
DAFTAR ISI
3.3 Peremajaan dan Isolat Bakteri Kitinolitik dari Nepenthes tobaicadanNepenthes gracilis
12
3.4 Persiapan Uji Antagonis 13
3.5 Uji Antagonis Isolat Bakteri Kitinolitik Terhadap
Jamur Patogen Tanaman 13
3.6 Pengamatan Struktur Hifa Abnormal 14
3.7 Penentuan Kurva Pertumbuhan dan Produksi Enzim
15
3.8 Pengendapan Ammonium Sulfat dan Dialisis Ekstrak Kasar Enzim Kitinase
16
3.9 Uji Kemampuan Daya Hambat Ekstrak Kasar Enzim Kitinase Terhadap Jamur Patogen Tanaman
16
BAB 4 HASIL DAN PEMBAHASAN
Nepenthes tobaica, Nepenthes gracilisdan jamur patogen uji
4.2 Hasil Uji Antagonis Isolat Bakteri Kitinolitik dari Nepenthes tobaicadanNepenthes gracilis
Terhadap Jamur Patogen Tanaman
19
4.3 Pengamatan Struktur Hifa Abnormal Jamur Patogen Tanaman Setelah Uji Antagonisme
24
4.4 Produksi Ekstrak Kasar Enzim Kitinase dan Uji Antagonis Terhadap Jamur Patogen Tanaman
26
BAB 5 KESIMPULAN DAN SARAN
5.1 Kesimpulan 29
5.2 Saran 29
DAFTAR PUSTAKA 30
DAFTAR TABEL
Nomor Judul Halaman
4.2.1. Hasil penghambatan pertumbuhan jamur patogen tanaman oleh bakteri kitinolitik dengan jamur ditumbuhkan terlebih dahulu.
21
4.2.2. Hasil penghambatan pertumbuhan jamur patogen tanaman oleh bakteri kitinolitik dengan cara jamur dan bakteri ditumbuhkan bersamaan
21
4.4.1. Penghambatan ekstrak kasar enzim kitinase dari bakteri kitinolitik terhadap jamur patogen tanaman
DAFTAR GAMBAR
Nomor Judul Halaman
3.5.1 Metode pengukuran zona hambat bakteri kitinolitik terhadap koloni jamur patogen
14
4.1.1. Hasil peremajaan Bakteri Kitinolitik yang diisolasi dari Nepenthes tobaica dan Nepenthes gracilis dengan indeks kitinolitik terbesar
17
4.1.2. Biakan murni jamur patogen tanaman pada media PDA 18 4.2.1 Uji antagonisme bakteri kitinolitik yang diisolasi dari
Nepenthes tobaica dan Nepenthes gracilis terhadap jamur patogen tanaman
4.2.2. Diameter zona hambat dari masing-masing isolat bakteri kitinolitik terhadap jamur patogen tanaman dengan jamur ditumbuhkan terlebih dahulu
23
4.2.3. Diameter zona hambat dari masing-masing isolat bakteri kitinolitik terhadap jamur patogen tanaman dengan jamur dan bakteri ditumbuhkan bersamaan
23
4.3.1. Perubahan morfologi hifa jamurFusariumsp. setelah uji antagonisme dengan bakteri kitinolitik
25
4.3.2. Perubahan morfologi hifa jamur Rhizoctonia solani setelah uji antagonisme dengan bakteri kitinolitik
25
4.4.1. Kurva pertumbuhan bakteri kitinolitik dengan metode TPC
DAFTAR LAMPIRAN
Nomor Judul Halaman
1. Komposisi Medium MGMK Padat dan Cara Pembuatannya
35
2. Pembuatan Koloidal Kitin dengan cara Hidrolisis Parsial (Rodriquez-Kabanaet al.,1983)
36
3. Alur Kerja Isolat Bakteri Antagonis 37
4. Alur Kerja Uji Penghambatan Jamur Secarain vitro 38 5. Alur Kerja Produksi Ekstrak Kasar Enzim Kitinase
(Baehakiet al.,2012; Nurdebyandaru, 2008)
UJI KEMAMPUAN BAKTERI KITINOLITIK DARINepenthes tobaica DANNepenthes gracilisDALAM MENGHAMBAT PERTUMBUHAN
BEBERAPA JAMUR PATOGEN TANAMAN ABSTRAK
Uji Kemampuan Bakteri Kitinolitik Dari Nepenthes tobaica dan Nepenthes gracilis Dalam Menghambat Pertumbuhan Beberapa Jamur Patogen Tanaman telah dipelajari dengan metode uji tantang dan uji ekstrak kasar. Lima isolat bakteri kitinolitik yang sebelumnya telah diisolasi dari Nepenthes tobaica dan Nepenthes gracilis telah diujikan dan memiliki kemampuan bervariasi dalam menghambat pertumbuhan jamur Fusarium sp. dan Rhizoctonia solani. Isolat RH1 memiliki kemampuan tertinggi dalam menghambat pertumbuhan Fusarium sp.danRhizoctonia solani dengan zona hambat masing masing 2,00 cm dan 2,40 cm. Isolat AM1 juga menunjukkan daya hambat yang relatif sama yaitu masing-masing 2,05 cm dan 2,15 cm. Isolat CBH memiliki kemampuan terendah dengan zona hambat masing-masing 0,90 cm dan 1,60 cm. Ekstrak kasar enzim kitinase dari isolat yang memiliki kemampuan penghambatan tertinggi diujikan kembali terhadap kedua jamur uji. Ekstrak isolat RH1 menunjukkan penghambatan terhadap pertumbuhan Fusarium sp. dan Rhizoctonia solani dengan zona hambat masing-masing 0,91 cm dan 1,41 cm sedangkan ekstrak isolat AM1 menunjukan zona hambat masing-masing sebesar 1,35 cm dan 1,27 cm.
THE ABILITY OF CHITINOLYTIC BACTERIA ISOLATED FROM Nepenthes tobaicaANDNepenthes gracilisTO INHIBIT THE GROWTH OF
PLANT PATHOGEN FUNGI ABSTRACT
The ability of chitinolytic bacteria isolated fromNepenthes tobaicaandNepenthes gracilis to inhibit the growth of plant pathogen fungi has been studied through antagonistic and crude extract tests. Five chitinolytic bacterial isolates isolated from Nepenthes tobaicaand Nepenthes gracilishave been tested and showed the ability to inhibit the growth of Fusarium sp.and Rhizoctonia solani. RH1 isolate has the highest ability to inhibit the growth of Fusarium sp. and Rhizoctonia solani with diameter of inhibition zone of 2.00 cm and 2.40 cm, respectively. AM1 isolate showed relatively the same diameter of inhibition of 2.05 cm and 2.15 cm, respectively. CBH isolate showed the lowest inhibition zone of 0.90 cm and 1.60 cm respectively. The crude extract of the chitinase of isolates with the highest inhibitory ability was tested back against of both fungi. The crude extract of RH1 showed inhibition of the growth of Fusarium sp. and Rhizoctonia solani with inhibition zone of 0.91 cm and 1.41 cm, respectively while extract of AM1 showed inhibition zone of 1.35 cm and 1.27 cm, respectively.
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Pengendalian hayati penyakit tanaman dengan menggunakan mikroorganisme telah dimulai pada tahun 1920 sampai 1930. Percobaan yang pertama kali dilakukan adalah dengan menggunakan mikroorganisme tanah penghasil antibiotik, namun percobaan ini belum berhasil sehingga penelitian mengenai pengendalian hayati terhenti selama kurang lebih 20 tahun. Perhatian pakar penyakit tumbuhan terhadap metoda pengendalian hayati bangkit kembali di Barkley pada tahun 1963 melalui simposium internasional pengendalian hayati dengan tema "Ecology of Soilborne Plant Pathogen-Prelude to Biological Control" (Prihantoko, 2006). Saat pestisida sudah dianggap kurang efektif sebagai pembunuh organisme pengganggu tanaman maka pengendalian secara hayati merupakan suatu solusi yang menjanjikan. Pengendalian secara hayati memiliki beberapa keunggulan dibandingkan dengan sistem pengendalian yang lain (Lesmana, 2006).
Salah satu teknik pengendalian hayati yang potensial untuk dikembangkan adalah pemanfaatan bakteri antagonis (Purba, 2010). Bakteri kitinolitik atau enzim kitinase yang dihasilkannya dapat dimanfaatkan sebagai biokontrol hama dan penyakit. Sampai saat ini, aplikasi kitinase sebagai biokontrol sudah banyak diaplikasikan pada pengendalian jamur patogen (Nurdebyandaru, 2008). Kitin merupakan komponen utama penyusun dinding sel jamur dan dapat dihidrolisis oleh kitinase. Isolat bakteri yang menghasilkan kitinase dengan indeks kitinolitik paling tinggi merupakan isolat yang paling berpotensi sebagai agen pengendali hayati terhadap jamur patogen (Lesmana, 2006).
bakteri penghasil kitinase berpotensi sebagai agen pengendali hayati penyakit, misalnya pada saat pembenihan (Suryantoet al., 2010).
Bakteri-bakteri kitinolitik diperoleh melalui eksplorasi dari berbagai sumber seperti tanah (Prihantoko, 2006) dan limbah organik (Giyantoet al.,2009) selain itu dapat juga diperoleh dari berbagai jenis tanaman seperti tanaman pisang (Purba, 2010), tanaman cabai (Nurdebyandaru, 2008) dan kedelai (Artati, 2008). Salah satu sumber lain yang menarik untuk diteliti adalah tanaman kantung semar (Nepenthes spp.). Mikroba yang ada di dalam kantung semar diduga berpotensi dalam mengahasilkan enzim hidrolitik seperti enzim protease, kitinase, amilase dan fitase (Yogiara, 2004). Enzim kitinase yang dihasilkan oleh Nepenthes kemungkinan disintesis oleh tanaman itu sendiri atau oleh beberapa mikroorganisme yang bersimbiosis dengannya, dapat dilihat tanaman ini dapat mencerna secara hampir keseluruhan tubuh serangga (Amagaseet al., 1972).
Bohre et al. (2013) telah mengisolasi bakteri endofit dari 9 tanaman kantung semar (Nepenthes spp.), dan diperoleh 44 isolat, diantarana: Acinetobacter soli, Bacillus cibi, B. horneckiae, B. indicus, B. koreensis, B.
stratosphericus dan Serratia liquefaciens. Yogiara (2004) melaporkan di dalam kantung semar terbentuk suatu rantai makanan mikro yang melibatkan mikrob. Beberapa bakteri yang diisolasi dari Nepenthes memiliki kemampuan untuk menghidrolisis substrat uji yang digunakan untuk penapisan enzim hidrolitik yaitu koloidal kitin (enzim kitinase), susu skim (enzim protease), dan asam fitat (enzim fitase). Secara keseluruhan diperoleh 27 isolat bakteri yang menghasilkan enzim protease, 34 isolat menghasilkan enzim fitase, dan 10 isolat menghasilkan enzim kitinase.
1.2 Permasalahan
Pada saat ini pestisida sudah dianggap kurang efektif sebagai pembunuh organisme yang bersifat patogen pada tanaman, terkait dengan banyaknya efek negatif yang ditimbulkan pestisida. Untuk itu perlu ditemukan alternatif lain yaitu dengan pengendalian hayati, yaitu pengendalian secara biologis (biocontrol). Salah satu jenis pengendalian hayati adalah dengan menggunakan mikroorganisme. Mikroorganisme tersebut dapat berupa jamur ataupun bakteri yang telah diisolasi dari hasil eksplorasi terhadap berbagai macam substrat. Bakteri kitinolitik adalah salah satu mikroorganime yang sering digunakan sebagai agen pengendali biologis, terkhusus untuk jamur patogen pada tanaman. Bakteri kitinolitik dapat menghasilkan enzim kitinase yang digunakan untuk mendegradasi senyawa kitin yang merupakan salah satu senyawa penyusun dinding
sel dari jamur-jamur patogen tersebut. Proses degradasi tersebut dilakukan bakteri
kitinolitik untuk memperoleh karbon, nitrogen, dan energi. Oleh karena itu, bakteri
kitinolitik dianggap sebagai agen pengendali jamur yang cukup potensial. Sampai
saat ini penelitian tentang bakteri kitinolitik masih banyak dilakukan terkait dengan
sumber isolat dan keefektifan dalam menghambat jamur. Sumber isolat yang sering
digunakan adalah tanah, tumbuhan, dan serangga.
1.3 Tujuan
Penelitian ini bertujuan untuk :
1. Mengetahui kemampuan isolat bakteri kitinolitik dari tanaman Nepenthes tobaica dan Nepenthes gracilis dalam menghambat pertumbuhan beberapa jamur patogen tanaman secarain vitro.
2. Mengetahui kemampuan ekstrak kasar enzim kitinase isolat bakteri kitinolitik dari tanaman Nepenthes tobaica dan Nepenthes gracilis dalam menghambat pertumbuhan beberapa jamur patogen tanaman secarain vitro.
1.4 Hipotesis
1. Isolat bakteri kitinolitik pada tanaman Nepenthes tobaica dan Nepenthes gracilis mampu menghambat pertumbuhan beberapa jamur yang bersifat patogen tanaman secarain vitro.
2. Ekstrak kasar enzim kitinase bakteri kitinolitik dari tanamanNepenthes tobaica dan Nepenthes gracilis mampu menghambat pertumbuhan beberapa jamur yang bersifat patogen pada tanaman secarain vitro.
1.5 Manfaat
BAB 2
TINJAUAN PUSTAKA
2.1. Jamur Patogen Tanaman
Secara kolektif, jamur menyebabkan penyakit tanaman lebih banyak dari kelompok hama tanaman lainnya, yaitu lebih dari 8.000 spesies terbukti menyebabkan penyakit. Peran penting jamur dalam kehidupan manusia sebagai penyebab penyakit pada tanaman dan manusia, bahan baku produk industri dan farmakologi, dan dekomposer. Dampak negatif jamur terhadap kesehatan tanaman, persediaan makanan, dan gizi manusia sangat besar. Serangan jamur patogen tanaman dapat mengakibatkan penurunan hasil panen secara global. Sebagai contoh pada abad pertengahan tanaman gandum yang merupakan bahan makanan utama, hancur ketika bulir terinfeksi spora jamur Tilletia spp. sehingga menyebabkan terjadinya penurunan produksi gandum dunia. Pada umumnya serangan patogen terhadap tanaman dapat dicegah dengan sanitasi yang ketat. Selain itu pencegahan jamur patogen dapat dilakukan dengan menggunakan agen pengendali hayati (Elliset al., 2008).
Patogen menyesuaikan diri dalam kolonisasi sejumlah tanaman inang saja. Secara umum tanaman mencoba untuk melawan proses invasi patogen dan memiliki seluruh mekanisme pertahanan untuk mencegah patogen tersebut. Setiap patogen memiliki cara khas sendiri untuk mengatasi respon pertahanan tanaman tersebut, untuk masuk ke inangnya dan menggunakannya untuk kelangsungan hidupnya. Patogen telah mengembangkan penentu patogenitas disesuaikan dengan inang yang akan dimasukinyaa dan mekanisme untuk menghindari serta menekan respon pertahanan (Mes, 1999). Karima & Nadia (2012), menyebutkan bahwa jamur patogen Fusarium sp. dan Rhizoctonia solani menyebabkan penyakit tanaman diantaranya adalah penyakit pada tomat dan familiSolanaceaelainnya.
layu tanaman biasanya memasuki tanaman melalui akar muda dan berkembang sampai ke jaringan pengangkut dari akar tersebut hingga ke batang. Ketika jaringan pengangkut tersumbat dan rusak, pasokan air ke daun terhambat. Gejala layu biasanya muncul pertama kali pada bagian pucuk tanaman atau pada daun terendah. Proses akan terus berlangsung sampai tanaman betul betul layu dan akhirnya mati. Gejala layu Fusarium pada kentang dan tomat biasanya dimulai dengan kerdilnya batang tanaman pada bagian terluar pucuk, selanjutnya daun bagian terbawah akan layu, menguning dan mengakibatkan seluruh tanaman mati, biasanya sebelum tumbuhan tumbuh dewasa. Semua Fusarium penyebab layu biasanya memilki inang yang spesifik dan merupakan organisme yang bertahan pada cuaca panas. Fusarium yang menyerang tanaman Solanaceae antara lain F. oxysporum f. sp.lycopersici (menyerang tomat),F. oxysporum f. sp.melongenae (menyerang terung) and F. oxysporumvar. vasinfectum (menyerang lada) (Miller et al., 1986).
Penyakit Rhizoctonia pada kentang disebabkan oleh jamur Rhizoctonia
solani (Kühn) yang dapat ditemukan pada seluruh bagian bawah tanaman pada
berbagai waktu dan musim. Rhizoctonia solani menyebabkan berbagai macam
penyakit pada tanaman. Gejala yang ditimbulkan oleh Rhizoctonia adalah
rusaknya umbi pada kentang dengan munculnya bercak kecoklatan sampai hitam
pada saat pertumbuhan kentang. Suhu tanah adalah faktor kritis untuk proses
inisiasi Rhizoctonia dalam kentang, dengan demikian kekuatan serang suatu
penyakit berkorelasi positif dengan suhu. Rentang suhu untuk pertumbuhan R.
solaniadalah 41osampai 77oF, jadi tanaman sangat rentan terhadap infeksi ketika
suhu kritis tersebut. Suhu dingin, kelembapan tanah yang tinggi dan keasaman
tanah diduga sebagai pendukung perkembangan penyakit Rhizoctonia pada
kentang. (Wharthon et al., 2007). Perpaduan antara sifatnya sebagai saprob dan
sifat patogeniknya yang tidak hanya terbatas pada inang tertentu, menjadikan Rhizoctonia solani sebagai patogen yang memiliki pengaruh terhadap perekonomian, serta sulit dikendalikan di lapangan. Jamur R. solani cocok pada
kondisi panas dan lembap (Achmad et al., 1999). Jamur ini juga menyebabkan
busuk benih (seed rot) dan busuk bibit (seedling blight) pada tanaman jagung
2.2 Pengendalian Hayati
Penggunaan pupuk dan pestisida secara berlebihan dan terus-menerus dalam aktivitas pertanian modern telah menimbulkan dampak negatif terhadap kondisi tanah dan lingkungan. Penggunaan pestisida juga dapat menimbulkan resistensi hama dan penyakit tumbuhan terhadap bahan beracun tersebut. Permasalahan yang timbul pada bidang pertanian tersebut dan kesadaran akan lingkungan yang sehat, telah mendorong penggalian berbagai potensi alam yang ramah lingkungan. Perkembangan bioteknologi telah menunjukkan hasil yang menggembirakan, diantaranya penggunaan mikroorganisme, terutama bakteri dan jamur, yang sangat potensial sebagai pengendali hayati (biocontrol) (Artati, 2008).
Pestisida juga menyebabkan timbulnya strain hama dan penyakit tumbuhan yang resisten terhadap bahan beracun ini, sehingga setiap kali usaha pengendalian terhadap organisme pengganggu ini menemui kegagalannya dan setiap kali pula harus dihasilkan bahan kimia baru yang memerlukan biaya penelitian yang sangat mahal baik secara ekonomi maupun biaya pencemaran terhadap lingkungan yang tidak dapat dihitung secara pasti. Masalah-masalah yang yang muncul akibat aktivitas pertanian modern telah mendorong para peneliti untuk menggali berbagai potensi alam terutama terhadap mikroba dan serangga berguna bagi meningkatkan hasil pertanian (Prihantoko, 2006).
Pengendalian hayati terapan dapat dilakukan melalui beberapa cara yaitu: (1) introduksi, adalah usaha mendatangkan dan melepaskan musuh alami ke alam (2) augmentasi, yaitu usaha mempertinggi daya guna musuh alami yang telah ada misalnya dengan melakukan pembiakan secara massal dan menyebarkan kembali ke alam. Augmentasi dibagi menjadi dua yaitu inokulasi dan inundasi. Inokulasi adalah pelepasan musuh alami dalam jumlah terbatas untuk meningkatkan populasi, sedangkan inundasi adalah pelepasan musuh alami dalam jumlah besar (Lesmana, 2006).
Interaksi patogenik dapat terjadi antar mikroorganisme, seperti parasitisme antara satu jamur dengan jamur lainnya (mikoparasitisme) maupun produksi antibiotik oleh organisme yang menghambat atau membunuh mikroorganisme lainnya. Interaksi patogenik lainnya melibatkan mikroorganisme dan akar tanaman yang mengakibatkan penyakit tanaman. Penyakit tanaman yang bersumber dari tanah dapat disebabkan oleh nematoda, kutu, bakteri, virus, dan jamur. Beberapa jamur menyebabkan kerusakan lebih parah pada tanaman pertanian dan interaksinya dengan patogen tanaman lainnya umumnya mempunyai efek sinergis pada penyakit tanaman (Artati, 2008).
Saat ini banyak usaha yang dilakukan oleh para peneliti untuk menggunakan agen pengendali hayati seperti bakteri dan jamur, karena penggunaan bahan kimia dapat merusak lingkungan dan membahayakan organisme lain termasuk kesehatan manusia (Herreraet al., 1999).
2.3 Bakteri Kitinolitik
Mikroorganisme pendegradasi kitin dalam memperoleh nutrisi sebagai sumber karbon dan nitrogen menggunakan enzim kitinase untuk memecah senyawa kitin. Organisme yang dapat mendegradasi kitin tersebar luas di alam, termasuk organisme yang tidak memiliki kitin seperti sebagian bakteri, virus, tumbuhan tingkat tinggi dan hewan yang memiliki peran penting dalam fisiologi dan ekologi (Dewi, 2008).
Kitinase merupakan enzim yang mampu menghidrolisis polimer kitin menjadi monomer N-asetilglukosamin atau kitin oligosakarida. Degradasi kitin oleh prokariot dan eukariot terjadi dalam dua tahap yang prosesnya melibatkan hidrolisis ikatan β-1,4 glikosida yang menghubungkan sub unit GlcNAc. Pertama endokitinase mengikat tetramer dan polimer GlcNAc untuk menghasilkan disakarida kitobiose. Kitobiose menghidrolisis kitobiose menjadi monomer N-asetilglukosamin pada tahap kedua. Enzim pendegradasi kitin umumnya oleh beberapa organisme diinduksi oleh kitosan, kitobiose dan glukosamin (Connel et al., 1998).
filoplane tanaman dapat melindungi tanaman dari infeksi jamur. Kitin yang terdapat pada dinding sel jamur patogen dapat didegradasi atau dihidrolisis oleh mikroorganisme kitinolitik sehingga mengurangi terjadinya infeksi penyakit (Yurnalizaet al., 2010).
Kitin merupakan komponen utama penyusun dinding sel jamur dan dapat dihidrolisis oleh kitinase. Untuk melihat potensinya dapat dilakukan pengujian terhadap kemampuan isolat bakteri menghasilkan kitinase secara in vitro. Isolat bakteri yang menghasilkan kitinase dengan indeks kitinolitik paling besar merupakan isolat yang paling berpotensi sebagai agen pengendali hayati terhadap jamur patogen. Polimer kitin sangat mirip dengan selulosa, kecuali adanya residu gugus asetamido yang terikat pada C-2 monomernya (Lesmana, 2006).
Kitin merupakan biopolimer yang terdiri dari (1 4) N asetil D -Glukosamin (N – asetil – 2 – amino – 2 – deoksi - D - Glukopiranosa) dengan kuantitas/persediaan yang sangat berlimpah, dan merupakan biopolimer terbesar nomor dua di alam setelah selulosa Berbagai mikroorganisme penghasil enzim kitin telah berhasil diisolasi dari beberapa daerah di Indonesia. Beberapa mikroorganisme tersebut diambil dari sampel air dan tanah. Pada umumnya, mikroorganisme yang dapat menghasilkan enzim kitinase, merupakan jenis jamur (eukariot) dan bakteri (prokariot) (Hendarsyah, 2006).
Sihombing (2010) menyatakan bahwa kitinase merupakan sekelompok enzim yang umumnya dihasilkan oleh bakteri, disamping kitinase dalam sistem kitinolitik mikroorganisme terdapat protein yang memiliki kemampuan antifungal. Protein tersebut adalah protein pengikat kitin yang dihasilkan selama proses perombakan kitin. Hasil uji antagonis bakteri kitinolitik terhadap hifa Fusarium menunjukkan terjadinya abnormalitas. Hifa abnormal ditandai dengan, antara lain menggulung, melilit, keriting, dan lisis. Hal ini mungkin dikarenakan kemampuan enzim yang dimiliki oleh bakteri kitin sebagai agen biokontrol yang dapat menghidrolisis dinding sel jamur dan adanya kompetisi untuk memperoleh nutrisi.
2.4Nepenthes(Kantung Semar)
83 spesies famili di wilayah Malesia, dan 24 spesies diantaranya merupakan spesies endemik di pulau Kalimantan. Tanaman ini memiliki dua jenis kantung, yaitu kantung atas (upper pitcher) dan kantung bawah (lower pitcher). Kantung jenis upper pitcher memiliki tendril (tangkai kantung yang menghubungkan kantung dengan daun) yang menjuntai melewati bagian belakang kantung. Sedangkan kantung jenislower pitcher, memilikitendrilyang menjuntai di depan kantung. Kantung pada Nepenthes spp. berfungsi sebagai perangkap bagi mangsa berupa avertebrata, sedikit sekali vertebrata yang dapat terperangkap kedalamnya. Mangsa kemungkinan besarnya tertarik mendatangi kantung oleh kombinasi warna kantung dan adanya nektar yang disekresikan oleh kelanjar yang terletak di bagian bawah tudung kantung (Yogiara, 2004). Higashi et al. (1993) menyebutkan beberapa spesies kantung semar yaitu Nepenthes bicalcarata, Nepenthes ampullaria dan Nepenthes rafflesiana.
Sulistyaningsih (2008) menyatakan selain dikenal sebagai tanaman hias yang unik, cairan dalam kantung muda yang masih menutup juga digunakan sebagai obat tradisional. Klasifikasi lengkap Nepenthes spp. berdasarkan sistem klasifikasi tumbuhan berbunga yang adalah sebagai berikut:
Divisi :Magnoliophyta
Yogiara et al. (2006) mengumpulkan sampel cair dari beberapa tanaman kantung semar yang diambil dari berbagai lokasi dan ditemukan 18-39 kelompok bakteri yang hidup di dalam kantungnya. Profil komunitas bakteri berbeda antara spesimen satu dengan yang lainnya. Sebelumnya belum ada publikasi yang jelas yang menyatakan bahwa perkembangan komunitas dipengaruhi oleh lingkungan sekitarnya (habitat) atau cairan. Jumlah dari populasi mikroba di dalam cairan belum diketahui secara pasti. Yogiara et al. (2006) menyimpulkan bahwa pertumbuhan mikroorganisme bisa jadi bukan dipengaruhi oleh lingkungan dimana kantung semar tumbuh tetapi lebih dapat dipengaruhi oleh substansi kimia yang dihasilkan dalam cairan dan secara simultan berkembang seiring terbukanya kantung.
Yogiara (2004), menyatakan jumlah total bakteri dan jumlah ragam isolat bakteri yang relatif tinggi menggambarkan bahwa cairan kantung semar merupakan suatu reservoir bagi kehidupan bakteri. Nutrisi yang diperlukan bakteri untuk hidup dipenuhi dari eksudat tanaman yang disekresikan ke dalam cairan. Higashi et al. (1993) menyebutkan bahwa adanya perubahan pH, ion amonium dan keragaman dalam populasi bakteri berpengaruh terhadap proses penguraian dalam kantong. Eksresi sebuah proton (ion H+) dari ion NH4+akan menyebabkan
pH cairan menurun sampai pH optimum dari protease, lalu proses pencernaan makanan dalam kantung akan berlangsung.
3.1 Waktu dan Tempat
Penelitian ini akan dilaksanakan pada bulan Mei 2014 sampai dengan Februari 2015 di Laboratorium Mikrobiologi FMIPA dan Laboratorium Terpadu Fakultas Kedokteran Universitas Sumatera Utara Medan.
3.2 Alat dan Bahan
Alat yang digunakan adalah timbangan analitik, cawan petri, labu erlenmeyer, autoklaf, inkubator jamur, inkubator bakteri, spektrofotometer, shaker,sentrifuse, tabung Ependorf , gelas ukur, spatula, oven, propipet, bunsen, jarum ose bengkok, jarum ose lurus, pipet tetes, pinset, pipet serologi, tabung reaksi, rak tabung reaksi, mikroskop, handspray, cutton bud, object glass,cover glass, vortex,cork borer.
Bahan yang digunakan adalah isolat bakteri kitinolitik dari Nepenthes tobaica dan Nepenthes gracilis. Bahan pendukung yang digunakan adalah aquadest, spritus, membran dialisis, alkohol 70 %, alkohol 75 %, buffer fosfat, kertas cakram kosong, media Nutrient Agar (NA), media kitin, media Potato Dextrose Agar (PDA), zat warna laktofenol. Isolat jamur patogen uji yaitu Fusarium sp. dan Rhizoctonia solani. yang diperoleh dari koleksi Laboratorium Mikrobiologi FMIPA, Universitas Sumatera Utara, Medan.
3. 4 Persiapan Uji Antagonis
3.4.1 Penyiapan Jamur Patogen Uji
Kultur Fusarium sp. dan Rhizoctonia solani yang digunakan dalam penelitian ini merupakan koleksi dari Laboratorium Mikrobiologi FMIPA, Universitas Sumatera Utara, Medan yang telah disubkultur ke media PDA.
3.4.2 Penyiapan Isolat Bakteri Kitinolitik
Sebanyak 3 ml NaCl 0,9 % dimasukkan ke dalam masing-masing tabung reaksi secara aseptis. Isolat bakteri diinokulasikan ke dalam tabung reaksi dengan menggunakan jarum ose bengkok dan disamakan kekeruhannya dengan larutan Mc-Farlandyang setara dengan konsentrasi 108sel/ml.
3.5 Uji Antagonis Isolat Bakteri Kitinolitik Terhadap Jamur Patogen Tanaman
Uji antagonis isolat bakteri kitinolotik terhadap jamur patogen tanaman dilakukan dengan dua metode. Untuk metode yang pertama biakan jamur patogen diinokulasikan di tengah medium garam minimum kitin (MGMK) (komposisi dan metode pembuatan MGMK dapat dilihat pada Lampiran 1 dan Lampiran 2) dengan jarak 3,5 cm dari cakram tempat inokulum bakteri, biakan tersebut diinkubasi selama 72 jam pada suhu 28-30oC. Suspensi bakteri kitinolitik sebanyak 15 μ l dengan konsentrasi ≈ 108 sel/ml (0,5 standard McFarland) diinokulasikan pada cakram berdiameter 0,6 cm dan diletakkan di bagian tepi media (alur kerja pada Lampiran 4). Sedangkan untuk metode yang kedua biakan jamur patogen diinokulasikan di tengah medium garam minimum kitin dan tanpa proses inkubasi suspensi bakteri kitinolitik sebanyak 15 μ l dengan konsentrasi ≈ 108 sel/ml (0,5 standard McFarland) diinokulasikan pada cakram berdiameter 0,6 cm dan langsung diletakkan di bagian tepi media dan diinkubasi bersama. Akitivitas penghambatan ditentukan berdasarkan zona hambat yang terbentuk di sekitar koloni. Pengamatan dimulai dari hari ke-2 sampai hari ke-7 (Suryanto et al., 2011).
akhir pertumbuhan dari jamur patogen pada sumbu X dan batas akhir pertumbuhan jamur patogen pada sumbu Y (Gambar 3.5.1) dengan rumus :
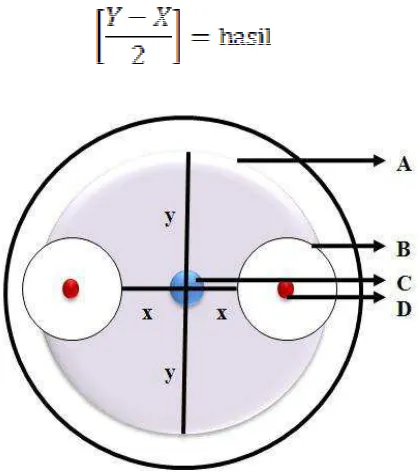
Gambar 3.5.1 Metode pengukuran zona hambat bakteri kitinolitik terhadap koloni jamur patogen: A. Koloni jamur; B. Zona hambat bakteri kitinolitik; C. Titik tengah jamur diletakkan; D. Koloni bakteri kitinolitik; X. Diameter koloni jamur yang terhambat pertumbuhannya; Y. Diameter koloni jamur normal
Dari hasil pengukuran akan diperoleh isolat bakteri kitinolitik dengan indeks kitinolitik tertinggi akan digunakan untuk produksi enzim kitinase.
3.6 Pengamatan Struktur Hifa Abnormal
ujung miselium, miselium pecah, miselium berbelah, miselium bercabang, miselium lisis, dan miselium tumbuh kerdil yang diamati di bawah mikroskop dengan perbesaran maksimum.
3.7 Penentuan Kurva Pertumbuhan dan Produksi Enzim Kitinase
Isolat bakteri kitinolitik terpilih dipersiapkan kultur cairnya dengan cara diinokulasikan sebanyak dua ose ke dalam dalam 5 ml media kitin cair. Media kitin cair dibuat dengan mencampurkan 125 ml koloidal kitin 0.3%, 0.65 gram Na2HPO4.2H2O, 1.5 gram KH2PO4, 0.25 gram NaCl, 0.5 gram NH4Cl, 0.12 gram
MgSO4.7H2O dan 0.005 gram CaCl2 dilarutkan dalam akuades hingga volume
satu liter (Lawati, 2013). Kultur cair digoyang dengan shaker pada suhu 37oC selama 24 jam dengan kecepatan penggoyangan 120 rpm. Untuk penentuan kurva pertumbuhan, kultur cair diinokulasikan sebanyak 1 ml ke dalam 20 ml media kitin cair. Kultur digoyang dengan shaker pada suhu 37oC dengan kecepatan penggoyangan 100 rpm. Setiap 24 jam dilakukan pengambilan kultur sel untuk pengukuran pertumbuhan sel dengan metode Total Plate Count (TPC). Dari hasil pengukuran petumbuhan sel akan diperoleh waktu optimum untuk produksi enzim.,
Untuk produksi enzim kitinase kultur cair diinokulasikan sebanyak 5 ml ke dalam 100 ml media kitin cair. Kultur digoyang dengan shaker pada suhu 37oC dengan kecepatan penggoyangan 100 rpm, lama penggoyangan dilakukan sampai pertumbuhan optimum untuk produksi enzim tercapai. Kultur kemudian disentrifugasi selama 10 menit dengan kecepatan 10.000 rpm. Supernatan yang diperoleh merupakan ekstrak kasar enzim yang akan diendapkan dengan amonium sulfat (Nurdebyandaru, 2008).
3.8 Pengendapan Ammonium Sulfat dan Dialisis Ekstrak Kasar Enzim Kitinase
fosfat 0,05 M pH 7 dengan perbandingan 1:2 (b/v). Enzim yang telah diresuspensi dimasukkan ke dalam membran dialisis dan diinkubasi dalam buffer fosfat 0,05 M pH 7 selama 12-16 jam pada suhu 4ºC ( alur kerja pada Lampiran 5). Ekstrak kasar enzim kitinase yang diperoleh akan diujikan kemampuan daya hambatnya terhadap jamur patogen tanaman dengan menggunakan kertas cakram (Baehakiet al.,2012).
3.9 Uji Kemampuan Daya Hambat Ekstrak Kasar Enzim Kitinase Terhadap Jamur Patogen Tanaman
BAB 4
HASIL DAN PEMBAHASAN
Dari kajian uji kemampuan isolat bakteri kitinolitik Nepenthes tobaica dan Nepenthes gracilis dalam menghambat pertumbuhan beberapa jamur patogen tanaman didapatkan hasil sebagai berikut :
4.1 Peremajaan Isolat Bakteri Kitinolitik dari Nepenthes tobaica, Nepenthes gracilisdan jamur patogen uji.
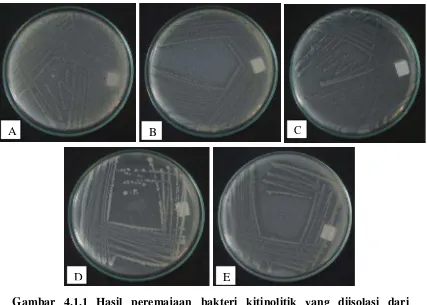
Dari isolasi dan seleksi bakteri kitinolitik yang telah dilakukan sebelumnya oleh Gultom (2015) dipilih 5 isolat dengan indeks kitinolitik terbesar. Isolat terpilih yaitu CBM, KM, AM1, RH1, CBH. Isolat dapat dilihat pada Gambar 4.1.1.
Gambar 4.1.1 Hasil peremajaan bakteri kitinolitik yang diisolasi dari Nepenthes spp. dengan indeks kitinolitik terbesar (A) CBM, (B) KM, (C) AM1, (D) RH1 dan (E) CBH pada media MGMK umur 3 hari.
A B C
Pertumbuhan isolat pada media yang mengandung kitin sebagai sumber karbon menunjukkan bahwa isolat memiliki aktivitas kitinolitik dan dapat menghasilkan enzim kitinase. Menurut Tjsujibo et al. (1999) suatu bakteri kitinolitik dapat diketahui memproduksi kitinase jika terjadi perubahan warna medium menjadi lebih transparan di sekitar koloni bakteri yang disebabkan oleh terdegradasinya kitin pada medium tumbuh karena adanya enzim kitinase yang dihasilkan bakteri ke medium. Kitinase merupakan enzim ekstraseluler yang dihasilkan bakteri kitinolik yang berperan penting dalam menghidrolisis kitin.
Enzim kitinase yang disekresikan keluar sel menghidrolisis kitin yang tidak larut air menjadi monomer yang larut dalam air sehingga menghasilkan zona bening di sekitar koloni. Menurut Wijaya (2002) enzim ekstraseluler adalah enzim yang dihasilkan di dalam sel tetapi dikeluarkan ke dalam medium tumbuhnya. Menurut Muharni (2009) zona bening terjadi karena adanya pemutusan ikatan β-1,4 homopolimer N-asetilglukosamin pada kitin oleh kitinase menjadi monomer N-asetilglukosamin. Purwani et al. (2002) menyatakan bahwa degradasi kitin secara enzimatis oleh kitinase berlangsung secara bertahap. Polimer kitin dipecah menjadi oligomer kitin dan selanjutnya akan diuraikan menjadi monomer N-asetilglukosamin oleh β-N-N-asetilglukosaminide.
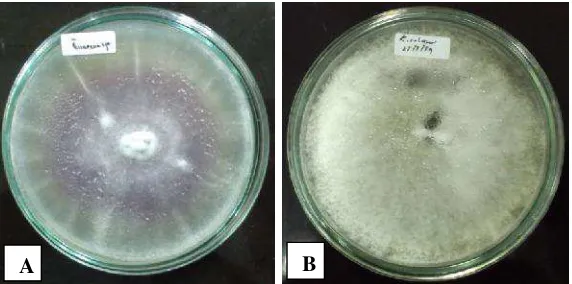
Isolat bakteri tersebut diujikan terhadap jamur patogen Fusarium sp. dan Rhizoctonia solani.Biakan murni jamur tersebut dapat dilihat pada Gambar 4.1.2.
Gambar 4.1.2 Biakan murni jamur patogen tanaman pada media PDA. (A) Fusarium sp. (B)Rhizoctonia solaniumur 6 hari.
Fusarium sp. dan Rhizoctonia solani merupakan jamur yang sering menjadi penyebab penyakit tanaman. Fusariumsp. merupakan patogen tular tanah (soil borne) yang bersifat penghuni tanah (soil inhabitant), memiliki ras fisiologi
yang berbeda dan dapat menimbulkan penyakit yang bersifat monosiklik sehingga strategi pengendalian yang efektif hingga kini belum ditemukan. Disamping itu patogen Fusarium sp. dapat bertahan dalam berbagai jenis tanah untuk puluhan tahun walaupun tanpa tanaman inang (Susana, 2000).
R. solani memiliki miselium tidak berwarna ketika masih muda tetapi menjadi coklat kekuningan ketika makin tua, diameternya 8-12 μ m, dengan septa jarang-jarang.R. solanimemiliki tiga tipe miselium: pertama hifa pendobrak lurus yang dapat tumbuh sewaktu-waktu, pendek, dan membengkak R. solani merupakan jamur penghuni tanah, dapat hidup sebagai saprofit pada jaringan tanaman yang sudah mati, dan bertahan dalam bentuk miselium atau sklerotia. Kelangsungan hidupnya dalam tanah dipengaruhi oleh faktor tanah dan mikroorganisme antagonis, seperti bakteri, jamur dan mikroba antagonis lainnya. Inokulum jamur dapat menyebar bersama partikel tanah yang terbawa bersama aliran air dan alat-alat pertanian atau bagian tanaman yang terkontaminasi (Rustam, 2012).
4.2 Hasil Uji Antagonis Isolat Bakteri Kitinolitik dariNepenthes tobaica dan Nepenthes gracilisTerhadap Jamur Patogen Tanaman
Hasil uji antagonisme secara in vitro menunjukkan bahwa kelima isolat bakteri kitinolitik terpilih dapat menghambat pertumbuhan dari kedua jamur patogen tanaman tersebut dengan kemampuan yang bervariasi. Penghambatan terhadap pertumbuhan jamur patogen tanaman dapat diamati dengan terjadinya zona bening di sekitar koloni bakteri yang tidak dapat ditumbuhi oleh hifa jamur.
Hasil uji antagonisme lima isolat bakteri kitinolitik dari N. tobaicadan N. gracilis terhadap jamur patogen tanaman Fusarium sp. dan Rhizoctonia solani yang dapat dilihat pada Tabel 4.2.1 dan 4.2.2, menunjukkan bahwa kelima isolat bakteri kitinolitik mampu menghambat pertumbuhan Fusarium sp. dan Rhizoctonia solani dengan kemampuan yang berbeda. Mekanisme penghambatan yang terjadi pada uji antagonisme dapat diamati dengan terbentuknya zona bening sebagai zona penghambatan pertumbuhan jamur oleh isolat bakteri kitinolitik.
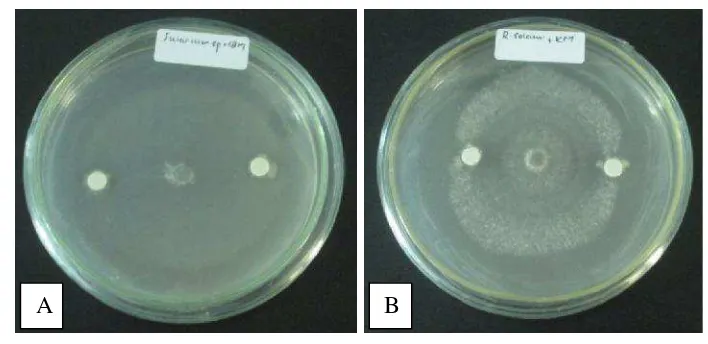
pertumbuhan jamur hasil isolasi yang ditandai dengan terbentuknya zona hambat. Zona hambat umumnya mulai teramati pada hari keempat karena interaksi antara bakteri dan jamur mulai terjadi. Hasil uji antagonisme terhadap jamur Fusarium sp. danRhizoctonia solanidapat dilihat pada Gambar 4.2.1.
Gambar 4.2.1 Uji antagonisme bakteri kitinolitik yang diisolasi dari Nepenthes tobaica dan Nepenthes gracilis (A) terhadap Fusariumsp., (B) terhadapRhizoctonia solani.
Wijaya (2002) menyatakan bahwa besarnya zona bening yang dihasilkan tergantung pada jumlah monomer N-Asetilglukosamin yang dihasilkan dari proses hidrolisis kitin dengan memutus ikatan β-1,4 homopolimer N-asetilglukosamin. Semakin besar jumlah monomer N-asetilglukosamin yang dihasilkan semakin besar zona bening yang terbentuk di sekitar koloni. Kitin sebagai substrat juga akan menginduksi aktivitas enzim kitinase.
Adanya penghambatan masing-masing isolat bakteri kitinolitik terhadap jamur dipengaruhi oleh adanya substrat kitin pada media sehingga kitinase pada kelima isolat bakteri tersebut lebih cepat disekresikan. Kitin pada media uji terurai oleh produksi kitinase isolat bakteri dan lama kelamaan akan terpacu untuk mendegradasi dinding sel jamur. Isolat bakteri akan menggunakan kitin sebagai sumber karbon untuk pertumbuhannya (Woo et al., 1996). Kemampuan mengkolonisasi lingkungan sekitar yang cepat menyebabkan isolat bakteri tersebut mengkolonisasi miselium jamur untuk menguraikan kitin yang ada pada dinding sel jamur. Penguraian kitin pada dinding sel jamur dapat menghambat pertumbuhan jamur Fusarium sp. dan Rhizoctonia solani yang mengalami kerusakan dinding sel. Perbedaan kemampuan bakteri kitinolitik dalam
menghambat pertumbuhan jamur Fusarium sp. dan Rhizoctonia solani dapat dilihat pada Tabel 4.21. dan Tabel 4.2.2.
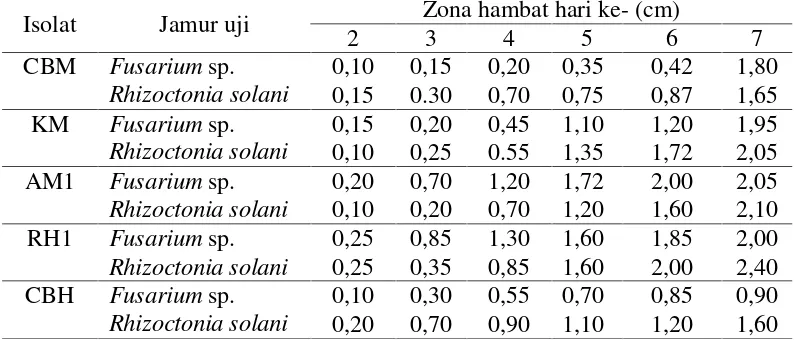
Tabel 4.2.1 Hasil penghambatan pertumbuhan jamur patogen tanaman oleh bakteri kitinolitik dengan jamur ditumbuhkan terlebih dahulu
Tabel 4.2.2. Hasil penghambatan pertumbuhan jamur patogen tanaman oleh bakteri kitinolitik dengan cara jamur dan bakteri ditumbuhkan bersamaan
Pada pengamatan hari ketujuh dari lima isolat bakteri kitinolitik tersebut isolat RH 1 merupakan isolat bakteri yang menunjukkan zona hambat yang paling tinggi dalam menghambat pertumbuhan jamur dengan diameter zona hambat sebesar 2,40 cm. Aktivitas yang paling rendah ditunjukkan oleh isolat bakteri CBH dengan diameter zona hambat 0,90 cm. Kelima isolat bakteri kitinolitik yang digunakan memiliki kemampuan daya hambat yang berbeda-beda. Perbedaan kemampuan ini kemungkinan disebabkan oleh berbagai faktor, antara lain jumlah enzim yang dihasilkan dan aktivitas enzimnya. Jumlah dan aktivitas enzim tiap isolat merupakan hasil penyandian gen-gen yang dimiliki oleh isolat tersebut.
Isolat Jamur uji Zona hambat hari ke- (cm)
2 3 4 5 6 7
CBM Fusariumsp. Rhizoctonia solani
0,20 0,10 1,10 1,30 1,35 1,72
0,25 0.62 0,90 1,20 1,30 1,65
KM Fusariumsp. Rhizoctonia solani
0,10 0,25 0,55 0,85 1,10 1,30
0,10 0,95 1,20 1,50 1,00 1,85
AM1 Fusariumsp. Rhizoctonia solani
0,15 0,35 0,70 1,20 1,30 1,50
0,15 0,30 0,85 1,30 1,60 2,00
RH1 Fusariumsp. 0,25 0,30 0,45 0,70 1,20 1,35
Rhizoctonia solani 0,70 0,75 1,35 1,50 1,85 2,15
CBH Fusariumsp. Rhizoctonia solani
0,10 0,20 0,55 0,85 1,20 1,35
0,15 0,30 0,70 1,20 1,50 1,80
Isolat Jamur uji Zona hambat hari ke- (cm)
2 3 4 5 6 7
CBM Fusariumsp. Rhizoctonia solani
0,10 0,15 0,20 0,35 0,42 1,80 0,15 0.30 0,70 0,75 0,87 1,65 KM Fusariumsp.
Rhizoctonia solani
0,15 0,20 0,45 1,10 1,20 1,95 0,10 0,25 0.55 1,35 1,72 2,05 AM1 Fusariumsp.
Rhizoctonia solani
0,20 0,70 1,20 1,72 2,00 2,05 0,10 0,20 0,70 1,20 1,60 2,10
RH1 Fusariumsp. 0,25 0,85 1,30 1,60 1,85 2,00
Rhizoctonia solani 0,25 0,35 0,85 1,60 2,00 2,40
CBH Fusariumsp. Rhizoctonia solani
Brurbeget al.(1996) melaporkanSerratia marcescenssebagai mikroba kitinolitik yang telah banyak dipelajari dapat menghasilkan 3 gen yang mengkode kitinase disebut sebagai gen ChiA (kitinase A), ChiB (kitinase B) dan ChiC (kitinase C) dan baru baru ini telah ditentukan struktur tiga dimensi dari ketiga gen tersebut. Hasil yang diperoleh menunjukkan sinergisme yang jelas pada saat menghidrolisis kitin terjadi kombinasi antara ChiA dan ChiB atau ChiC dan disebutkan bahwa sisi serangan substrat ChiA diduga berbeda dari ChiB dan ChiC.
Selain Serratia, bakteri genus Bacillus juga banyak dipelajari sebagai penghasil kitinase. Mitsutomi et al.(1994) telah melakukan analisis struktur tiga dimensi domain katalitik ChiA B.circulan WL-12 yang mempunyai sedikitnya 6 jenis kitinase. Kitinase A pada bakteri ini mempunyai kemampuan yang kuat dalam mendegradasi kitin dibandingkan lima kitinase yang lainnya. Gohel et al. (2006) meelaporkan bahwa selain kandungan kitin pada media uji yang digunakan, hal yang juga ikut mempengaruhi besarnya zona hambat adalah banyak sedikitnya kandungan kitin yang terdapat pada dinding sel jamur.
Variasi diameter zona hambat dari masing masing bakteri kitinolitik terhadap jamur patogen tanaman pada hari ketujuh dapat dilihat pada Gambar 4.2.2 dan Gambar 4.2.3. Dapat dilihat bahwa zona hambat terhadap jamur Rhizoctonia solani lebih besar dibandingkan dengan zona hambat terhadap Fusarium sp.. Menurut Sivan & Chet (1989), kandungan kitin pada dinding sel beberapa jenis Fusarium lebih banyak dari kandungan kitin pada dinding sel Rhizoctonia solani. Dinding sel Fusarium vasinfektum dan Fusarium melonis memiliki kandungan kitin masing-masing sebesar 25% dan 15% sedangkan dinding selRhizoctonia solanihanya memiliki 15 % kandungan kitin.
0 pada penentuan mekanisme antagonisme antara agensia pengendali hayati dengan patogen target
Gambar 4.2.2 Diameter zona hambat dari masing-masing isolat bakteri kitinolitik terhadap jamur patogen tanaman dengan jamur ditumbuhkan terlebih dahulu
Gambar 4.2.3 Diameter zona hambat dari masing-masing isolat bakteri kitinolitik terhadap jamur patogen tanaman dengan jamur dan bakteri ditumbuhkan bersamaan
dengan cara langsung menghidrolisis dinding miselia dan melalui pelepasan elisitor endogen oleh aktivitas kitinase yang kemudian memicu reaksi ketahanan sistemik pada inang. Menurut Ferniah et al. (2003) kitin merupakan induser bagi enzim kitinase. Enzim kitinase memecah kitin menjadi ketooligosakarida sampai dengan N-asetil D-glukosamin yang akan mengalami deasetiliasi dan deaminasi dan menghasilkan molekul-molekul glukosa.
Menurut El-Katatnyet al. (2000) satu kelompok organisme yang memiliki potensi sebagai agen pengendali hayati fungi berasal dari kelompok mikroba penghasil kitinase. Pengendalian hayati fungi dengan menggunakan mikroba kitinolitik didasarkan pada kemampuan mikroba menghasilkan kitinase dan β-1,3-glukanase yang dapat melisiskan sel fungi.
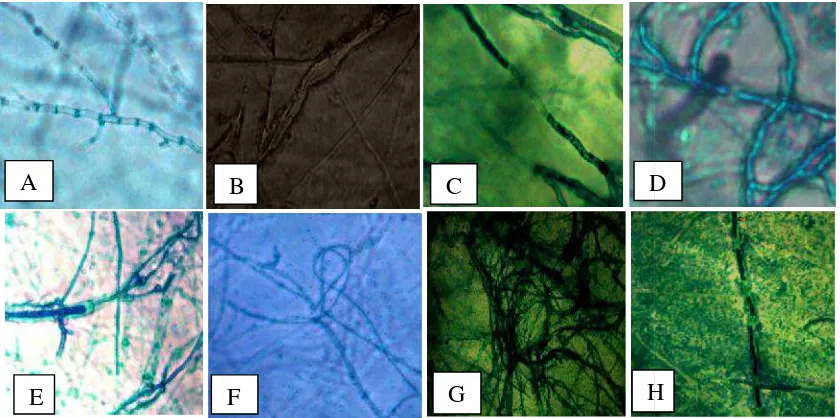
4.3 Pengamatan Struktur Hifa Abnormal Jamur Patogen Tanaman Setelah Uji Antagonisme
Pengamatan mikroskopis untuk melihat hifa abnormal jamur dilakukan pada hari ketujuh. Pengamatan dilakukan pada seluruh hasil uji antagonis yang dilakukan antara jamur patogen tanaman Fusarium sp. dan Rhizoctonia solani dengan kelima bakteri kitinolitik yang diisolasi dari N. tobaica dan N. gracilis. Mekanisme antagonis yang terjadi antara bakteri kitinolitik dengan jamur memiliki penghambatan yang bervariasi dan aktivitas antagonis yang ditandai dengan penghambatan pertumbuhan miselium. Efek aktivitas antagonis bakteri kitinolitik menyebabkan hifa jamur mengalami abnormalitas yaitu berupa hifa terputus, hifa melilit, hifa menggulung, hifa lisis pada dinding sel, hifa keriting dan lainnya. Perubahan strukur hifa menjadi abnormal dapat dilihat pada Gambar 4.3.1 dan 4.3.2.
matriks. Kandungan
rubahan morfologi hifa jamur Fusarium tagonisme dengan bakteri kitinolitik. (A) H . Normal, (B) Hifa Lisis, (C) Hifa Melilit, ( ) Hifa Menggulung, (F) Hifa Keriting, (G) H ifa Kerdil (perbesaran 400X)
ubahan morfologi hifa jamur Rhizoctonia so tagonisme dengan bakteri kitinolitik. (A) H solani Normal, (B) Hifa Bengkak, (C) Hifa L
tus, (E) Hifa Kerdil, (F) Hifa Melengk enggulung, (H) Hifa Patah (perbesaran 400X
0 Perubahan strukur hifa menjadi abnormal seperti yang dapat dilihat pada Gambar 4.3.1 dan Gambar 4.3.2 menunjukkan bahwa isolat bakteri kitinokitik dapat digunakan sebagai agen pengendali hayati. Pengendalian hayati jamur dengan menggunakan mikroorganisme kitinolitik didasarkan pada kemampuan mikroorganisme tersebut dalam menghasilkan kitinase dan β-1,3 glukanase yang dapat melisis dinding sel jamur (El-Katatnyet al.,2000).
4.4 Produksi Ekstrak Kasar Enzim Kitinase dan Uji Antagonis Terhadap Jamur Patogen Tanaman
Isolat bakteri kitinolitik dariNepenthesspp. AM1 dan RH1 merupakan isolat yang memiliki zona hambat tertinggi terhadap kelima isolat yang digunakan dan selanjutnya terpilih untuk produksi ekstrak kasar enzim kitinase. Waktu panen enzim didasarkan pada kurva pertumbuhan sel. Pengukuran kurva pertumbuhan sel dengan metode TPC (Total Plate Count) dapat dilihat pada Gambar 4.4.1.
Gambar 4.4.1 Kurva pertumbuhan bakteri kitinolitik dengan metode TPC Dari hasil pengukuran kurva pertumbuhan dengan metode TPC (Total Plate Count) maka diperoleh waktu inkubasi 48 jam sebagai waktu optimum untuk produksi enzim. Hal ini didukung oleh hasil penelitian Mitsutomi et al. (1994) yang menginkubasi Bacillus circulans WL-12 pada 37oC dan panen setelah 48 jam inkubasi. Nurdebyandaru (2008), menyatakan bahwa dalam pengukuran pertumbuhan dan pengujian aktivitas kitinase yang dilakukan setiap 12 jam selama 96 jam, isolat bakteri kitinolitik memiliki jumlah sel tertinggi pada jam ke-24 dengan aktivitas kitinase tertinggi pada jam ke-48.
sebagai produk metabolit sekunder diperkirakan diproduksi pada fase ini. Dengan meningkatnya jumlah sel maka ketersediaan nutrisi berkurang sehingga bakteri memenuhi kebutuhan nutrisinya dengan mendegradasi polimer kitin sebagai sumber karbon. Untuk dapat mendegradasi kitin tersebur maka bakteri akan mensekresikan enzim kitinase.
Selanjutnya dilakukan proses ekstraksi enzim dengan metode pemurnian parsial menggunakan ammonium sulfat 50% dan membran dialisis. Dari hasil pengujian yang dilakukan oleh Rahayu (2000), aktivitas enzim pada filtrat hasil pengendapan ammonium sulfat menunjukkan bahwa penggunaan ammonium sulfat yang optimal mengendapkan protein adalah 50%. Penggunaan ammonium sulfat 50 % dapat meningkatkan kemurnian enzim sebesar 6 kali.
Ekstrak kasar enzim kitinase yang diperoleh kemudian diujikan terhadap jamur patogen Fusariumsp. danRhizoctonia solani, dengan jumlah ekstrak kasar enzim yang digunakan sebanyak 10 uL. Variasi zona hambat dari ekstrak kasar enzim terhadap jamur patogen dapat dilihat pada Tabel 4.4.1.
Tabel 4.4.1 Hasil penghambatan ekstrak kasar enzim kitinase dari bakteri kitinolitik terhadap jamur patogen tanaman
Dari Tabel 4.4.1 di atas dapat dilihat dua zona hambat terbesar adalah zona hambat ekstrak kasar enzim kitinase dari isolat RH1 terhadap jamur Rhizoctonia solani pada hari ke-6 inkubasi yaitu sebesar 1,41 cm dan zona hambat ekstrak kasar enzim kitinase dari isolat AM1 terhadap jamur Fusarium sp. pada hari ke-7 inkubasi yaitu sebesar 1,27 cm. Meskipun jumlah ekstrak kasar enzim yang digunakan lebih sedikit dari jumlah bakteri yang digunakan pada uji antagonis awal, ekstrak kasar enzim kitinase telah mampu menghambat pertumbuhan jamur patogen tanaman.
Isolat Jamur Uji Zona hambat hari ke–(cm)
2 3 4 5 6 7
AM1 Fusarium sp. Rhizoctonia solani
0,44 0,45 0,53 0,66 0,97 1,35
0,61 0,82 1,00 0,92 1,14 1,27
RH1 Fusarium sp. Rhizoctonia solani
0,61 1,16 0,82 0,88 0,82 0,91
Terbentuknya zona hambat menunjukkan aktivitas kitinolitik ekstrak tersebut. Semakin besar zona hambat yang terbentuk menunjukkan tingginya efektivitas biokontrol kitinase suatu isolat. Ekstrak kasar kitinase memiliki penghambatan lebih baik daripada kultur sel terhadap dua jenis jamur patogen yang digunakan. Hal ini mungkin disebabkan kultur sel membutuhkan waktu yang lebih banyak untuk memproduksi kitinase, sedangkan pengujian kitinase langsung mampu segera menghidrolisis kitin yang terdapat pada dinding sel jamur patogen. Perbedaan kemampuan penghambatan terhadap jamur patogen tersebut disebabkan oleh konsentrasi enzim hidrolitik atau senyawa metabolik sekunder yang terdapat pada enzim kasar maupun enzim hasil pengendapan (Prapagdee et al., 2008). Enzim kitinase diutamakan dalam pengendalian hayati jamur patogen saat ini karena kemampuannya mendegradasi kitin pada dinding sel jamur (Ulhoa & Peberdy 1991).
Berbagai laporan tentang penggunaan ekstrak kasar maupun fraksi kitinase dalam mengendalikan jamur patogen telah banyak dilaporkan antara lain kitinase kasar dari Serratia marcescens SR1 yang menghambat Fusarium oxysporum, Sclerotium rolfsii, Rhizoctonia solanii dan Alternaria alternate (Parani & Saha 2011). Demikian pula fraksi kitinase Stenotrophomonas maltophilia juga mampu menghambat perkecambahan konidia Bipolaris sorokiniana (Zhang et al., 2001) dan ekstrak kasar enzim kitinase dari Bacillus licheniformis terhadapRhizoctonia solani, Macrophomina phasiolina, Fusarium culmorum, Pythium sp., Sclerotium rolfsii, dan Alternaria alternate (Kamil et al., 2007). Asril (2014) juga melaporkan bahwa ekstrak kasar enzim kitinase dari Bacillus thuringiensis SAHA 12.08 memiliki penghambatan terhadap Curvularia affinis dan Colletotrichum gloeosporioides yang merupakan penyebab penyakit bercak daun dan hawar daun pada pembibitan kelapa sawit.
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penelitian uji kemampuan bakteri kitinolitik dari Nepenthes tobaica dan Nepenthes gracilisdalam menghambat pertumbuhan beberapa jamur patogen tanaman diambil kesimpulan sebagai berikut:
1. Isolat bakteri kitinolitik dari Nepenthes tobaica dan Nepenthes gracilis dapat menghambat pertumbuhan jamur patogen tanaman Fusarium sp. dan Rhizoctonia solani dengan potensi penghambatan yang bervariasi. Isolat yang paling potensial adalah isolat AM1 dan RH1 dan isolat yang memiliki potensi terendah adalah isolat CBH.
2. Ekstrak kasar enzim kitinase dari isolat bakteri kitinolitik Nepenthes tobaica dan Nepenthes gracilis yaitu AM1 dan RH1 dapat menghambat pertumbuhan jamur patogen tanamanFusariumsp. danRhizoctonia solani.
5.2 Saran
Adapun saran dari hasil penelitian penelitian uji kemampuan bakteri kitinolitik dari Nepenthes tobaica dan Nepenthes gracilis dalam menghambat pertumbuhan beberapa jamur patogen tanaman adalah:
1. Sebaiknya dilakukan uji kemampuan terhadap jamur lain yang diketahui memiliki kandungan kitin yang cukup tinggi.
DAFTAR PUSTAKA
Achmad, Soetrisni, H., Herlinayana, M.N. & Setiawan, A. 2009. Patogenisitas Rhizoctonia solani Pada Semai Pinus merkusii dan Acacia mangium. Jurnal Manajemen Hutan Tropika.5(1) : 11-21.
Amagase, S., Mori, M. & Nakayama, S. 1972. Digestive enzyme in insectivorous plants. IV. Enzymatic digestion of insects by Nepenthes secretion and Dorosera peltata extract : Proteolytic and chitinolytic activity. Journal Biochem.72: 765-767.
Asril, M. 2014. Kitinase Bacillus thuringiensis SAHA 12.08 Sebagai Agens Biokontrol Penyakit Hawar Daun Pada Tanaman Kelapa Sawit. [Tesis]. Bogor: Institut Pertanian Bogor, Program Pascasarjana.
Artati, R. 2008. Penapisan Pseudomonas spp. Dari Rizosfer Tanaman Kedelai Yang Berpotensi Sebagai Rizobakteria Pemacu Pertumbuhan Tanaman Dan Biokontrol Fungi Patogen. [Skripsi]. Bogor: Institut Pertanian Bogor, Program Pascasarjana.
Baehaki, A., Suhartono, M.T., Sukarno, Syah, D. & Sitanggang, AB. 2012. Purifikasi dan Karakterisasi Kolagenase dariBacillus licheniformisF11.4 [Tesis]. Bogor (ID): Institut Pertanian Bogor.
Bohre, S.J., Vijayan, K. & Kodi, I.K. 2013. Diversity of Endophytic Bacteria in Medicinally Important Nepenthes Species. Journal of Natural Science, Biology and Medicine. 4: 1-3.
Brurberg, M.B., Nes, I.F. & Eijsink, V.G.H. 1996. Comparative studies of chitinases A and B fromSerratia marcescens.Microbiology.142: 1581-1 589.
Chang, W.T., Chen, Y.C. & Jao, C.L. 2007. Antifungal Activity and Enhancement of Plant Growth by Bacillus cereus Grown on Shellfish Chitin Wastes. Biores Technol. 98(6):1224–1230.
Chu S. B. & Alexander, M. 1972. Resistance and susceptibility of fungal spores to lysis. Transaclions of the British Mcologicat Society.58: 489-497.
Connel, T.D., Metzger, D.J., Lynch, J. & Folster, J.P. 1998. Endochitinase is Transported to the Extracellular milieu by the Eps-encoded General Secretory Pathway of Vibriocholerae.J Bacteriol. 180: 5591-5600.
El-Katatny, M.H., Smomitsch, W. & Robra, K.H., El-Katatny MS & Gilbitz GM. 2000. Production of Chitinase and β 1,3-Glukanase by Tricoderma harzianumfor Control of the Phytopathogenic FungusSclerotium rolfsii. Food Technol Biotecnol.38:173-180.
Ellis, S.D., Boehm, J.M. & Mitechell, T.K. 2008.Fungal and Fungal-like Diseases of Plants. Factsheet Agriculture and Natural Resources. PP401.07. The Ohio State University. Columbus. p 1-3.
Ferniah, R.S., Purwantisari, S. & Pujiyanto, S. 2003. Uji Potensi Bakteri Kitinolitik Sebagai Pengendali Hayati Patogen Kapang Penyebab Penyakit Tanaman Kentang (Solanum tuberosum). FMIPA. Laporan Penelitian. Semarang: Universitas Diponegoro.
Giyanto, Suhendar, A. & Rustam. 2009. Kajian Pembiakan Bakteri Kitinolitik Pseudomonas fluorescens Dan Bacillus sp. Pada Limbah Organik Dan Formulasinya Sebagai Pestisida Hayati (Bio-Pesticide). Prosiding Seminar Hasil-Hasil Penelitian IPB 2009. Bogor: Institut Pertanian Bogor.
Gohel, V., Singh, A. Vimal, M. Aswini, P. & Chhatpar, H.S. 2006. Bioprospecting and Antifungal Potential of Chitinolitic Microorganims. African Journal of Biotechnology.5: 54-72.
Gooday, G.W. 1990. The Ecology of Chitin Degradation. Advances in Microbial K. C. Marshall (ed.). 11: 387-430.
Gultom, Y.E. 2015. Isolasi dan Identifikasi Bakteri Kitinolitik dari Nepenthes tobaica dan Nepenthes gracilis. [Skripsi]. Medan: Universitas Sumatera Utara, Program Sarjana.
Hendarsyah, D. 2006. Karakterisasi Kitin Deasetilase Termostabil Isolat Bakteri Asal Pancuran Tujuh, Baturaden, Jawa Tengah. [Skripsi]. Bogor: Institut Pertanian Bogor, Program Sarjana.
Herrera, A.E. & Chet, I. 1999. Chitinase in Biological Control. In Chitin and Chitinase. PJ. and RAA. Muzarelli. editors. Basel, Switzerland: Birkhauser Verlag.
Higashi, S., Akinori, N., Hideki, O., Mikiko, A. & Toshiki, U. 1993. Analysis of Feeding Mechanism in a Pitcher of Nepenthes hybrid. Journal of Plant Research. 106: 52-56.
Kamil, K., Rizk, M., Saleh, M. & Moustafa, S. 2007. Isolation and identification of Rhizosphere Soil Chitinolytic Bacteria and Their Potential in Antifungal Biocontrol.Global J Mol Sci. 2(2):57-66.
Karima, H.E.H. & Nadia, G.E. 2012. In vitro Study on Fusarium solani and Rhizoctonia solani Isolates Causing the Damping Off and Root Rot Diseases in Tomatoes.Nature and Science.10(11) :16-25.
Lawati, N. 2013. Pemurnian Parsial Dan Karakterisasi Enzim Kitinase Dari Beauveria bassiana.. [Skripsi]. Bogor: Institut Pertanian Bogor, Program Sarjana.
Lesmana, D. 2006. Penapisan Isolat-Isolat Bakteri Sebagai Agen Pengendali Hayati Jamur Rhizoctonia solani. [Skripsi]. Bogor: Institut Pertanian Bogor, Program Sarjana.
Mardhiana, Yakup, P., Renih, H. & Dwi, P.P. 2012. Karakteristik dan Kemelimpahan Nepenthes di Habitat Miskin Unsur Hara. Jurnal Lahan Suboptimal. 1: 51-55.
Matsumoto, K.S. 2006. Fungal Chitinases. Advences in Agricultural and Food Biotecnology.Recearch Singpost. 2: 289-304.
Mes, J.J. 1999. Molecular aspects of the interaction between tomato and Fusarium oxysporum f.sp. lycopersici. [Phd Thesis]. Amsterdam: University Of Amsterdam, FNWI: Swammerdam Institute for Life Sciences (SILS).
Miller, A.S, Rowe, R.C & Riedel, R.M. 1986.Fusarium andVerticilliumwilts of
tomato, potato, pepper, and eggplant. Extention Factsheet. Hyg-3122-96. The Ohio State University. Columbus. p 3.
Mitsutomi, M., Kidoh, H., Tomita, H. & Watanabe, T. 1994. The action of Bacillus circulans WL-12 chitinases on partially N-acetylated chitosan. Biosci. Biochem. Biotech. 59 (3): 529-531.
Muharni. 2009. Isolasi dan Identifikasi Bakteri Penghasil Kitinase Dari Sumber Air Panas Danau Ranau Sumatera Selatan. Jurnal Sains Penelitian. 912: 72-75.
Muis, A. 2007. Pengelolaan Penyakit Busuk Pelepah (Rhizoctonia solani Kühn.)
Pada Tanaman Jagung. Jurnal Litbang Pertanian.26(3): 100-103.
Nurdebyandaru, N. 2008. Pemanpaatan Bakteri Kitinolitik Asal Perakaran Tanaman Cabai Sebagai Biokontrol Kutu Daun Aphis gossypii Glover [Skripsi]. Bogor: Institut Pertanian Bogor, Program Sarjana.
Parani, K., Shetty, G.P. & Saha, B.K. 2011. Isolation ofSerratia marcescensSR1 as a Source of Chitinase Having Potentiality of Using as a Biocontrol agent. Indian J Microbiol.51(3):247–250.
Prapagdee, B., Kuekulvong, C. & Mongkolsuk, S. 2008. Antifungal Potential of Extracellular Metabolites Produced by Streptomyces hygroscopicus Against Phytopathogenic Fungi.Int J Biol Sci. 4(5): 330-337.
Prihantoko, A. 2006. Penggunaan Isolat Bakteri Tanah Untuk Pengendalian Hayati Rhizoctonia solani Penyebab Busuk Kecambah Pada Tanaman Tomat. [Skripsi]. Bogor: Institut Pertanian Bogor, Program Sarjana.
Purba, F. 2010. Kelimpahan Bakteri Kitinolitik, Tahan Panas, dan Kelompok Fluoresen Pada Rizosfer Tanaman Pisang (Musa spp.) Serta Potensinya Dalam Menghambat Fusarium oxysporum F. sp. Cubense. [Skripsi]. Bogor: Institut Pertanian Bogor, Program Sarjana.
Purwani, E.Y., Toharisman, A., Chasanah, E., Laksmi, J.F., Welan, V., Suhartono, M.T., Purwadaria, T., Pyun & Hwang. 2002. Studi Pendahuluan Enzim Kitinase Ekstraseluler yang Dihasilkan oleh Isolat Bakteri Asal Manado. Jurnal teknol. dan Industri Pangan.13: 111-117.
Rahayu, S. 2000. Karakterisasi dan Pemurnian Enzim Kitinase dan Kitin Deasetilase Termostabil dariBacillussp. K29-14 Asal Kawah Kamojang, Jawa Barat. [Tesis]. Bogor: Institut Pertanian Bogor, Program Pascasarjana.
Rajarathnam, S., Shashrieka, M.N.J. & Bano, Z. 1998. Biodegradative and Biosynthetic Capacities of Mushrooms. Present and Future Strategies. Critical Reviews in Biotechnology.18: 91-236.
Rustam. 2012. Potensi Bakteri Penghasil Senyawa Bioaktif Antijamur Untuk
Pengendalian Penyakit Hawar Pelepah Padi. [Disertasi]. Bogor: Institut Pertanian Bogor, Program Pascasarjana.
Shin, K., Samkeun, L. & Byeongjin, C. 2007. Antifungal Activity of Plumbagin Purified from Leaves of Nepenthes ventricosa x maxima against Phytopathogenic Fungi. The Plant Pathology Journal. 23: 113.
Sihombing, S. 2010. Kemampuan Bakteri Kitinolitik Lokal Dalam Menghambat PertumbuhanFusariumsp. Tanaman Kopi. [Skripsi]. Medan: Universitas Sumatera Utara. Program Sarjana.
Sulistiyaningsih. 2008. Identifikasi Isolat Bakteri Penghasil Zat Antibakteri Dari Cairan Kantung Tanaman Kantung Semar (Nepenthes ampullaria, Jack). Bandung: Universitas Padjadjaran.
Suryanto, D., Patonah, S. & Munir, E. 2010. Control of Fusarium Wilt of Chili With Chitinolytic Bacteria.Hayati J Biosci17 (1) : 5-8.
Suryanto, D., Irawati, N. & Munir, E. 2011. Isolation and Characterization of Chitinolytic Bacteria and Their Potential to Inhibit Plant Pathogenic Fungi.Microbiol Indones5(2): 144-148.
Susana. 2000. Analisis Introduksi Antagonis Untuk Pengendalian Hayati Penyakit Layu (Fusarium oxysporum f.sp.cubense)Pada Pisang (Musa sapientum L.). [Tesis]. Bogor: Institut Pertanian Bogor, Program Pascasarjana.
Tjsujibo, H. Miyamoto, K. Nukui, E. Itoh, H. Sato, T., Kobayashi, T. Imada, C. Watanabe, E. & Inamori, Y. 2002. Molecular Analysis of the Gene Encoding A Novel Chitin-Binding Protease from Alteromonassp. Strain O-7 and Its Role in the Chitinolytic System. Journal of Bacteriology. 184: 1868-1872.
Ulhoa. C.J. & Peberdy, J.F. 1991. Regulation of Chitinase Synthesis in Trhichoderma harzianum. J Gen Microbiol. 137(9):2163–2169.
Wharton, O. Kirk, W., Berry, D. & Snapp, S. 2007.RhizoctoniaStem Cancer and Black Scurf Of Potato.Michigan Potato Diseases Extension Bulletin.
E-2994. The Michigan State University. Michigan. p 1-3.
Wijaya, S.K.S. 2002. Isolasi Kitinase dari Sleroderma columnare dan Trichoderma harzianum.Jurnal Ilmu Dasar. 3: 30-35.
Woo, Joo, C., Yun, U. & Park, H.D. 1996. Isolation of Chitin-utilizing Bacterium and Production of Its Extracellular Chitinase. Journal of Microbiology and Biotecnology.6: 439-444.
Yurnaliza, Sebastian, M. & Langkah, S. 2011. Kemampuan KitinaseStreptomyces RKt5 sebagai Antijamur terhadap Patogen Fusarium oxysporum.Jurnal Natur Indonesia. 14: 42-43.
Yogiara. 2004. Analisis Komunitas Bakteri Cairan Kantung Semar (Nepenthes spp) Menggunakan Teknik Terminal Restriction Fragment Lenght Polymorphism (T-RFLP) dan Amplified Ribosomal DNA Restriction Analysis (ARDRA). [Tesis]. Bogor: Institut Pertanian Bogor, Program Pascasarjana.