Lampiran 1. Gambar Alat
a. Gambar chamber yang berisi fase gerak
b. Gambar sampel yang telah dipekatkan
c. Gambar baku bahan pewarna
Lampiran 2. Hasil Kromatogram
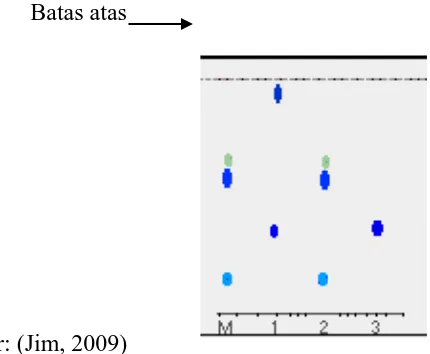
Batas atas
Jarak Pelarut 12 cm
Lampiran 3. Perhitungan Harga Rf
Harga Rf = Ja a ya yawa
Ja a ya a
Harga Rf Sampel 1 = , = 0,23
Harga Rf Allura Red = , = 0,47
Harga Rf Ponceau 4R = , = 0,35
Harga Rf Tartrazine = , = 0,27
Harga Rf Sunset Yellow = , = 0,51
Harga Rf Carmoisine = , = 0,61
DAFTAR PUSTAKA
Anggadiredja, T. Jana. 2009. Rumput Laut Pembudidayaan, Pengolahan, dan Pemasaran Komoditas Perikanan Potensial. Depok: Penebar Swadaya. 65.
Apriyantono, A. 1989. Analisis Pangan. Bogor : Departemen Pendidikan dan Kebudayaan. 228.
Badan POM. 2007. Instruksi Kerja Pengujian Bidang II Laboratorium Pangan dan Bahan Berbahaya. Jakarta: Departemen kesehatan RI. 3.
Cahyadi, W. 2008. Analisis dan Aspek Kesehatan Bahan Tambahan Pangan. Jakarta: PT Bumi Aksara. 53-56, 60, 63, 66.
Deman, J. M. 1980. Priciples of Food Chemistry. New York: Van Nostrand Reinhold Company. 189.
Gritter, R. J, Schawrting, A. E., dan Bobbitt, J. M. 1991. Pengantar Kromatografi. Bandung: Penerbit ITB Bandung. 101.
Jelen, P. 1985. Introduction to Food Processing. Virginia: Reston Publishing Company. 83-84.
Jim. C. 2009. Kromatografi Kertas. Jakarta. www.JimClark.html.
Koswara, S. 2006. Cara Sederhana Membuat Jam dan Jeli.www.ebookpangan.com
Socaciu, C. 2008. Food Colorants: Chemical and Functional Properties. New York: CRC Press. 534, 606. Aplikasi Praktis. Bogor: IPB Press. 3, 57-58, 71.
BAB 3
METODE PERCOBAAN 3.1. Alat
1. Gelas piala
2. Batang pengaduk kaca
3. Kertas saring
4. Bejana kromatografi
5. Penangas air
6. Benang wol bebas lemak
7. Kertas saring biasa
8. Kertas saring whatman no. 1
3.2. Bahan
1. Asam asetat glasial
2. Amonia 10 %
3. Larutan baku zat pewarna pangan
4. Larutan elusi: campuran isobutanol: etanol: air dengan perbandingan 3:2:2
3.3. Prosedur Kerja
3.3.1 Pembuatan Larutan Uji
1. Ditimbang sampel 30-50 gr.
2. Dimasukkan ke dalam erlenmeyer.
3. Dilarutkan dengan air.
4. Ditambahkan asam asetat glasial.
5. Dimasukkan benang wol secukupnya kedalam sampel yang telah
disiapkan.
6. Dipanaskan diatas api sambil diaduk-aduk selama 10 menit.
7. Diambil benang wol.
8. Dicuci secara berulang-ulang dengan air sampai terlihat bersih.
8. Dimasukkan benang wol ke dalam erlenmeyer.
9. Ditambahkan larutan amonia encer.
10.Dipanaskan diatas penangas air hingga zat warna pada benang wol
tersebut luntur.
11.Diambil benang wolnya.
3.3.2 Prosedur Kerja Metode Kromatografi Kertas
1. Metode yang digunakan sesuai dengan prosedur yang tercantum pada SNI
01-2895-1992 di Laboratorium Pangan dan Bahan Berbahaya Balai Besar
Pengawas Obat dan Makanan di Medan.
2. Kertas Kromatografi yang digunakan adalah kertas whatman no. 1 dengan
ukuran 20 x 20 cm.
3. Larutan uji dan zat warna pembanding, yaitu Alura Red CI 16035, Ponceau 4R CI
16255, Tartrazin CI 19140, Sunset Yellow CI 15985, Carmoisin CI 14720.
4. Ditotolkan pada kertas whatman no. 1 dengan menggunakan pipa kapiler pada
jarak 2 cm dari bagian bawah kertas dan jarak antar noda.
5. Dibiarkan beberapa saat hingga mengering.
6. Kertas whatman no. 1 yang telah mengandung cuplikan dimasukkan kedalam
chamber yang terlebih dahulu dijenuhkan dengan fasa gerak berupa campuran
isobutanol: etanol: air dengan perbandingan 3: 2: 2.
7. Dibiarkan fasa gerak naik sampai jarak rambat yang telah ditetapkan,
yakni 12 cm.
8. Kemudian kertas whatman no. 1 diangkat dan dibiarkan kering pada suhu
kamar.
9. Diamati noda yang diperoleh, kemudian dihitung harga Rf-nya.
10.Bandingkan harga Rf bercak larutan uji dengan Rf bercak zat warna
BAB 4
HASIL DAN PEMBAHASAN 4.1 Hasil
Kromatogram hasil identifikasi dapat dilihat pada lampiran 1. Hasil Identifikasi
Zat Pewarna Tambahan Pangan Pada Jeli Secara Kromatografi Kertas diperoleh
pewarna sintetik Ponceau 4R CI 16255 (tabel 4.1)
Tabel 4.1. Hasil Kromatogram Larutan Elusi: Campuran perbandingan volume
isobutanol: etanol: air = 3:2:2
4.2. Pe mb ahasan
Pemilihan metode kromatografi kertas pada identifikasi ini karena dari sekian
banyak metode pengujian kualitatif untuk zat pewarna sintetis, metode kromatografi
kertas yang paling sederhana dan memberikan hasil yang baik. (Walford, 1984).
Disamping itu, pada pengujian dilakukan dengan metode kromatografi kertas
karena acuan dari Laboratorium Pangan dan Bahan Berbahaya Balai Besar POM di
Medan adalah SNI 01-2895-1992, yang menyebutkan bahwa identifikasi zat pewarna
dilakukan dengan metode kromatografi kertas. (Badan POM, 2007).
Pemilihan larutan elusi isobutanol:etanol:air (3:2:2) sebagai eluen karena
petunjuk dari Metode Analisa Laboratorium Pangan dan Bahan Berbahaya Balai Besar Nama
Rf
Allura Red Ponceau 4R Tartrazin Sunset Yellow
Carmoisin
Baku 0.47 0.35 0.27 0.51 0.61
Dari hasil Identifikasi Zat Pewarna Pangan Pada Jeli Secara Kromatografi
Kertas diketahui bahwa zat pewarna yang digunakan pada jeli tersebut memenuhi Perka
BPOM No 37-2013, yakni Ponceau 4R CI 16255. (Badan POM, 2007).
Hasil ini diperoleh dengan cara membandingkan harga Rf dari pembanding
dengan harga Rf sampel yang ditotolkan. Oleh sebab itu harga Rf antara pembanding
dengan harga Rf sampel identik sama maka dapat dikatakan bahwa sampel tersebut
BAB 5
KESIMPULAN DAN SARAN 5.1 Kesimpulan
Dari hasil identifikasi zat pewarna tambahan pangan pada jeli secara
kromatografi kertas, diketahui bahwa zat pewarna tambahan pangan yang digunakan
dalam jeli tersebut sesuai dengan SNI 01-2895-1992.
5.2 Saran
Dari pihak BBPOM sendiri hendaknya terus melakukan pengujian terhadap
produk-produk makanan dan jajanan yang beredar di pasaran untuk menjaga
BAB 2
TINJAUAN PUSTAKA 2.1 Jeli
Jeli merupakan makanan yang dibuat dari karaginan, yaitu senyawa polisakarida rantai panjang yang diekstraksi dari rumput laut jenis-jenis karaginofit, seperti Eucheuma sp., Chondrus sp., Hypnea sp., dan Gigartina sp. Karaginan dibedakan menjadi tiga macam, yaitu Ioto-karaginan, Kappa-karaginan, dan Lambda-karaginan. Ketiganya berbeda dalam sifat gel yang dihasilkan. Kappa-karaginan dan Lambda-Karaginan menghasilkan gel yang kuat (rigid), sedangkan Ioto-karaginan membentuk gel yang halus (flaccid) dan mudah dibentuk. (Anggadiredja, 2009).
Komposisi jeli secara umum yakni 45 bagian buah dan 55 bagian gula, serta dibutuhkan sejumlah air (60-62 %) untuk melarutkannya hingga diperoleh produk akhir. Salah satu senyawa yang sangat berpengaruh dalam proses pembuatan jeli adalah pektin, sebab pektin mempengaruhi pembentukan gel dari jeli. Pektin merupakan senyawa yang berasal dari asam poligalakturonat. Kondisi pH optimum untuk pembentukan gel dari pektin adalah 2,8-3,2. Apabila pH diatas 3,5, maka gel tidak akan terbentuk. Sedangkan pH dibawah 2,5 gel yang terbentuk terlalu keras. (Jelen, 1985).
Secara umum pembuatan jeli cukup sederhana, yakni buah-buahan yang
akan dibuat jeli diperas dan diambil sarinya. Sejumlah gula kemudian
ditambahkan, sesuai dengan perbandingan, yakni 45 bagian buah dan 55 bagian
Pembuatan jeli yakni, pertama buah dipotong-potong kecil, lalu direbus
selama 5-10 menit. Kemudian dihaluskan dengan blender, kemudian disaring.
Cairan yang diperoleh didiamkan selama 1 jam sampai semua kotoran
mengendap, sehingga diperoleh cairan sari buah yang bening. Lalu masukkan 450
gr sari buah kedalam wajan, lalu ditambahkan 550 gr gula pasir dan dimasak
sampai kental dan matang. Tanda kematangannya ialah bila dituangkan jatuhnya
terputus-putus dan tercium aroma buah yang khas. (Koswara, 2006).
2.2 Bahan Tambahan Pangan
Pengertian Bahan Tambahan Pangan dalam Peraturan Menteri Kesehatan
RI No.772/Menkes/Per/IX/88 No.1168/Menkes/Per/X/1999 secara umum adalah
bahan yang biasanya tidak digunakan sebagai makanan dan biasanya bukan
merupakan komponen khas makanan, mempunyai atau tidak mempunyai nilai
gizi, yang sengaja ditambahkan kedalam makanan untuk maksud teknologi pada
pembuatan, pengolahan, penyiapan, perlakuan, pengepakan, pengemasan dan
penyimpanan. (Cahyadi, 2008).
Tujuan penggunaan Bahan Tambahan Pangan adalah untuk meningkatkan
atau mempertahankan nilai gizi dan kualitas daya simpan, membuat bahan pangan
lebih mudah dihidangkan, serta mempermudah preparasi bahan pangan. Bahan
Tambahan Pangan (BTP) yang diizinkan penggunaannya antara lain antioksidan,
antikempal, pengatur keasaman, pemanis buatan, pemutih, pengental, pengawet,
2.3 Pewarna Pangan
Warna merupakan salah satu aspek yang penting terhadap kualitas suatu
produk makanan. Kualitas warna dianggap menunjukkan kualitas rasa dan tekstur
dari suatu makanan agar makanan tersebut dapat diterima di masyarakat. Warna
juga mengindikasikan bahwa telah terjadi reaksi kimia pada makanan. (Deman,
1980).
Menurut International Food Information Council Foundation (1994),
pewarna pangan adalah zat yang digunakan untuk memberikan atau meningkatkan
warna suatu produk pangan, sehingga menciptakan tampilan tertentu dan
membuat produk lebih menarik. Definisi yang diberikan oleh Depkes (1999) lebih
sederhana, yaitu Bahan Tambahan Pangan (BTP) yang dapat memperbaiki atau
memberi warna pada pangan. (Wijaya, 2009).
Ada lima sebab yang dapat menyebabkan suatu bahan makanan berwarna,
yaitu :
1. Pigmen yang secara alami terdapat pada tanaman dan hewan. Misalnya klorofil
berwarna hijau, karoten berwarna jingga, dan mioglobin menyebabkan warna
merah pada daging.
2. Reaksi karamelisasi yang timbul bila gula dipanasknan membentuk warna
cokelat. Misalnya warna cokelat pada kembang gula karamel atau roti yang
dibakar.
3. Warna gelap yang timbul karena adanya reaksi Mailard, yaitu antara gugus
amino protein dengan gugus karbonil gula pereduksi. Misalnya susu bubuk
4. Reaksi antara senyawa organik dengan udara akan menghasilkan warna hitam
atau cokelat gelap. Reaksi oksidasi ini dipercepat oleh adanya logam serta
enzim, mislanya warna gelap permukaan apel atau kentang yang dipotong.
5. Penambahan zat warna, baik zat warna alami maupun zat warna sintetis, yang
termasuk dalam golongan bahan aditif makanan. (Winarno, 1992).
2.3.1 Tujuan Penggunaan Pewarna Pangan
Berdasarkan survey yang telah dilakukan Walford (1980), ada beberapa
tujuan penggunaan pewarna pangan, yaitu :
1. Untuk memberikan penampilan yang menarik dari produk makanan yang telah
berubah warna ketika proses pembuatan.
2. Untuk memberikan warna kepada produk makanan sesuai dengan sifat
makanan tersebut.
3. Untuk menguatkan warna suatu produk makanan yang memiliki warna yang
lemah.
4. Untuk memastikan keseragaman suatu bets dari sumber yang berbeda.
(Walford, 1980).
2.3.2 Klasifikasi Pewarna Pangan
Pewarna pangan dapat diklasifikasikan berdasarkan asalnya, yaitu pewarna
alami, dan pewarna sintetis. Pewarna pangan yang berasal dari bahan alam disebut
pewarna alami. Pewarna sintetis adalah pewarna yang dibuat melalui sintesis
2.3.2.1 Pewarna Alami
Banyak warna cemerlang yang dimiliki oleh tanaman dan hewan yang
dapat digunakan sebagai pewarna makanan. Beberapa pewarna alami ikut
menyumbangkan nilai nutrisi, memberikan bumbu atau pemberi rasa ke bahan
olahannya. Dewasa ini ada beberapa bahan pewarna alami yang digunakan untuk
menggantikan pewarna sintetis. Sebagai contohnya serbuk beet menggantikan
pewarna merah sintetis FD & C No. 2. Pewarna alami juga dapat memberikan
fungsi tambahan sebagai antioksidan, antimikroba, dan fungsi lainnya. Hal ini
menyebabkan pertumbuhan penggunaan pewarna alami cenderung menjadi dua
kali lipat bila dibandingkan dengan pewarna sintetis, terutama di negara-negara
maju. Meskipun pewarna alami ini jauh lebih aman untuk dikonsumsi, akan tetapi
penggunaan pewarna alami belum dapat dilakukan secara menyeluruh, sebab
beberapa kendala, seperti rasa yang kurang sedap, penggumpalan pada saat
penyimpanan, dan ketidakstabilan dalam penyimpanan. (Cahyadi, 2008 ; Wijaya,
2009).
Umumnya pewarna alami diperoleh dari ekstrak kasar dari suatu
tumbuhan yang pada dasarnya tidak stabil. Jelas terlihat stabilitas warna pada
beberapa makanan dari penggunaan pewarna alami ini. Sebagai contoh adalah
antosianin. Antosianin dapat digunakan pada beberapa produk, akan tetapi variasi
warna yang ada terlalu sempit penggunaannya. Hal ini disebabkan ketidakstabilan
antosianin terhadap pH tertentu, terutama pH asam. (Walford, 1984).
Pada umumnya pewarna alami rentan terhadap pH, sinar matahari, dan
suhu tinggi. Pewarna alami sebaiknya disimpan pada suhu 4–80C untuk
Pewarna alami berbentuk bubuk pada umumnya higroskopis. Beberapa
sifat dari pewarna alami ditunjukkan pada tabel 2.1. (Wijaya, 2009).
Tabel 2.1. Sifat-sifat Bahan Pewarna Alami
Kelompok Warna Sumber Kelarutan Stabilitas
Karotenoid kuning, merah tanaman/ hewan
Pewarna sintetis adalah pewarna yang dibuat melalui sintesis secara kimia.
Berdasarkan kelarutannya, dikenal dua macam pewarna sintetis, yaitu dyes dan
lakes. Dyes adalah zat pewarna yang umunya bersifat larut dalam air, sehingga
larutannya menjadi berwarna dan dapat digunakan untuk mewarnai bahan. Pelarut
yang dapat digunakan selain air adalah propilen glikol, gliserin, atau alkohol.
Sedangkan dalam semua jenis pelarut organik, dyes tidak dapat larut. (Cahyadi,
Dyes terdapat dalam bentuk bubuk, granula, cairan, campuran warna, dan
pasta. Lakes adalah zat pewarna yang dibuat melalui proses pengendapan dan
absorpsi dyes pada radikal (A atau Ca) yang dilapisi dengan alumina. Lapisan
alumina ini tidak larut dalam air, sehingga lakes ini tidak larut dalam air. Pada pH
3,5-9,5 stabil, dan di luar selang tersebut lapisan alumina pecah, sehingga dyes
yang dikandungnya akan terlepas. (Cahyadi, 2008).
Sedangkan zat pewarna lakes yang hanya terdiri dari satu warna, tidak
merupakan campuran, juga harus mendapat sertifikat. Dalam certified colour
terdapat spesifikasi yang mencantumkan keterangan yang penting mengenai zat
pewarna tertentu, misalnya bentuk garam, kelarutan, dan residu yang terdapat
didalamnya. Pada umumnya pewarna sintetis lebih stabil terhadap pH, cahaya,
dan faktor lainnya selama pengolahan dan penyimpanan (Tabel 2.2). (Wijaya,
2009).
Tabel 2.2. Kestabilan Beberapa Pewarna Sintetis
Pewarna
Pewarna sintetis juga dapat diklasifikasikan berdasarkan struktur kimia
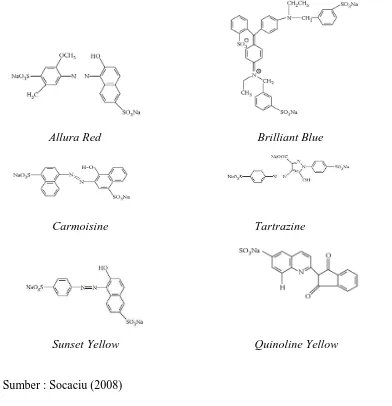
yang terdapat pada pewarna tersebut (Tabel 2.3), yakni Azo dyes, Triarylmethane
dyes, Quinophthalon dyes, Xanthene dyes, dan Indigo dyes. Struktur beberapa
Tabel 2.3. Golongan Pewarna Sintetis
Gambar 2.1. Struktur Beberapa Pewarna Sintetis
Azo Dyes Allura Red (Merah Allura), Amaranth,
Azorubin (Carmoisine), Briliant Black, Brown FK, Brown HT, Litol Rubin BK, Ponceau 4R, Merah 2G, Sunset Yellow, Tartrazine
Triarylmethane Dyes Briliant Blue FCF, Fast Green FCF, Green S, Patent Blue V
Quinophthalon Dyes Quinoline Yellow (Kuning Kuinelin)
Xanthene Dyes Erythrosine (Eritrosin)
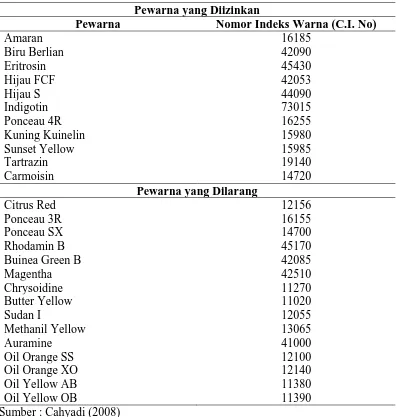
Di Indonesia, peraturan mengenai penggunaan zat pewarna yang diizinkan
dan pewarna yang dilarang (Tabel 2.4) diatur melalui SK Menteri Kesehatan RI No.
722/Menkes/Per/IX/88 mengenai Bahan Tambahan pangan (BTP). (Cahyadi, 2008).
2.4 Identifikasi Pewarna Sintetis
Identifikasi pewarna sintetis dapat dilakukan dengan beberapa metode. Umumnya
metode identifikasi yang digunakan adalah metode kromatografi maupun metode
spektrofotometri, ataupun gabungan kedua metode ini. Metode yang dapat digunakan
antara lain reaksi warna, kromatografi kertas, kromatografi lapis tipis, spektrofotometri,
dan kromatografi cair kinerja tinggi. (Cahyadi, 2008 ; Walford, 1984; Socaciu, 2008).
2.4.1 Cara Reaksi Warna
Identifikasi pewarna sintetis dengan cara reaksi warna biasanya dilakukan
sebagai identifikasi pendahuluan. Penggunaan cara reaksi kimia ini dilakukan dengan
penambahan HCl(p), H2SO4(p), NaOH 10%, dan NH4OH 12%. Kemudian warna yang
dihasilkan dengan penambahan pereaksi-pereaksi tersebut disesuaikan dengan tabel 2.5.
(Apriyantono, 1989).
Tabel 2.5. Perubahan Warna dengan Penambahan Pereaksi Pewarna
Perubahan Warna dengan Penambahan Pereaksi HCl(p) H2SO4(p) NaOH 10% NH4OH 12%
Carmoisin Sedikit berubah
Violet Merah Merah
Tartrazin Sedikit gelap Sedikit gelap Sedikit berubah
Sedikit berubah Sunset
Yellow
Kemerahan Kecoklatan Kecoklatan Tidak berubah
Briliant Blue
Kuning Kuning Tidak berubah Tidak berubah
2.4.2 Identifikasi Zat Pewarna dengan Kromatografi
Kromatografi digunakan untuk memisahkan campuran dari substansinya
menjadi komponen-komponennya. Seluruh bentuk kromatografi bekerja berdasarkan
prinsip yang sama seluruh bentuk kromatografi memiliki fase diam (berupa padatan
atau cairan yang didukung pada padatan) dan fase gerak (cairan atau gas). Fase gerak
mengalir melalui fase diam dan membawa komponen-komponen dari campuran
bersama-sama. Komponen-komponen yang berbeda akan bergerak pada laju yang
berbeda. (Gritter, 1991)
2.4.2.1 Kromatografi Kertas
Mekanisme pemisahan dengan kromatografi kertas prinsipnya sama dengan
mekanisme pada kromatografi kolom. Adsorben dalam kromatografi kertas adalah
kertas saring, yakni selulosa. Sampel yang akan dianalisis ditotolkan ke ujung kertas
yang kemudian digantung dalam wadah. Kemudian dasar kertas saring dicelupkan
kedalam pelarut yang mengisi dasar wadah. Fasa mobil (pelarut) dapat saja beragam.
Air, etanol, asam asetat atau campuran zat-zat ini dapat digunakan. (Jim, 2009)
Prosedur penyiapan sampel dari metode kromatografi ini yakni, sejumlah
cuplikan ditambahkan asam asetat encer kemudian masukkan benang wool bebas lemak
secukupnya, lalu dipanaskan diatas nyala api kecil selama 30 menit sambil diaduk.
Benang wool dicuci dengan air hingga bersih. Pewarna dilarutkan dari benang wool
dengan penambahan ammonia 10% diatas penangas air hingga sempurna. Totolkan
pada kertas kromatografi, juga totolkan baku pembanding. Elusi dengan eluen yang
Richard Laurence Millington Synge (1914-1994) adalah orang pertama yang
menggunakan metode identifikasi asam amino dengan kromatografi kertas. Saat
campuran asam amino menaiki lembaran kertas secara vertikal karena ada fenomena
kapiler, partisi asam amino antara fasa mobil dan fasa diam (air) yang teradsorbsi pada
selulosa berlangsung berulang-ulang. Ketiak pelarut mencapai ujung atas kertas proses
dihentikan. Setiap asam amino bergerak dari titik awal sepanjang jarak tertentu. Dari
nilai R, masing-masing asam amino diidentifikasi. (Jim, 2009)
Penelitian yang telah dilakukan Charles (1990) eluen yang baik digunakan untuk
identifikasi pewarna sintetis dengan metode kromatografi kertas adalah etil metil
keton:aseton:air (70:30:30). (Walford, 1984)
2.4.2.1.1 Jenis Kromatografi Kertas
2.4.2.1.1.1 Kromatografi Kertas Satu Arah
Dalam kromatografi kertas, fase diam adalah kertas serap yang sangat seragam.
Fase gerak adalah pelarut atau campuran pelarut yang sesuai. Sampel tinta diteteskan
pada garis dasar pinsil pada selembar kromatografi kertas. Beberapa pewarna larut
dalam jumlah yang minimum dalam pelarut yang sesuai, dan itu juga di teteskan pada
garis yang sama. Dalam gambar 2.2, pena ditandai 1,2 dan 3 serta tinta pada pesan
Gambar 2.2. Contoh Kromatografi Kertas
Sumber: (Jim, 2009)
Kertas digantungkan pada wadah yang berisi lapisan tipis pelarut atau campuran
pelarut yang sesuai didalamnya. Perlu diperhatikan bahwa batas pelarut berada dibawah
garis pada bercak diatasnya. Gambar berikutnya tidak menunjukkan terperinci
bagaimana kertas di gantungkan karena terlalu banyak kemungkinan untuk
mengerjakannnya dan dapat mengacaukan gambar. Kadang-kadang kertas hanya
digulungkan secara bebas pada silinder dan diikatkan dengan klip kertas pada bagian
atas dan bawah. Silinder kemudian ditempatkan dengan posisi berdiri pada bawah
wadah. Alasan untuk menutup wadah adalah untuk meyakinkan bahwa astmosfer dalam
gelas kimia terjenuhkan dengan uap pelarut. Penjenuhan udara dalam gelas kimia
dengan uap menghentikan penguapan pelarut sama halnya dengan pergerakan pelarut
pada kertas. (Jim, 2009)
Gambar 2.3. Kromatografi Kertas dengan eluen
Karena pelarut bergerak lambat pada kertas, komponen-komponen yang berbeda
dari campuran tinta akan bergerak pada laju yang berbeda dan campuran dipisahkan
berdasarkan pada perbedaan bercak warna. Gambar 2.4 menunjukkan apa yang tampak
setelah pelarut telah bergerak hampir seluruhnya ke atas. (Jim, 2009)
Gambar 2.3. Bergeraknya eluen
Batas atas
Sumber: (Jim, 2009)
Dengan sangat mudah dijelaskan melihat dari kromatogram akhir dari pena yang
ditulis pada pesan yang mengandung pewarna yang sama dengan pena 2. Anda juga
dapat melihat bahwa pena 1 mengandung dua campuran berwarna biru yang
kemungkinan salah satunya mengandung pewarna tunggal terdapat dalam pena 3. (Jim,
2009)
2.4.2.1.1.2. Kromatografi Kertas Dua Arah
Kromatografi kertas dua arah dapat digunakan dalam menyelesaikan masalah
pemisahan substansi yang memiliki nilai Rf yang sangat serupa.Waktu ini kromatogram
dibuat dari bercak tunggal dari campuran yang ditempatkan kedepan dari garis dasar.
Kromatogram ditempatkan dalam sebuah pelarut sebelum dan sesudah sampai
pelarut mendekati bagian atas kertas. Dalam gambar 2.4, posisi pelarut ditandai dengan
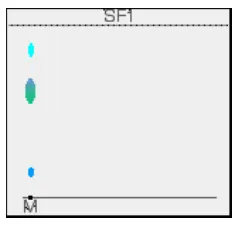
pinsil sebelum kertas kering. Posisi ini ditandai sebagai SF1 yaitu pelarut depan untuk
pelarut pertama. Kita akan menggunakan dua pelarut yang berbeda. (Jim, 2009)
Gambar 2.4. Kromatografi kertas dua arah
Sumber: (Jim, 2009)
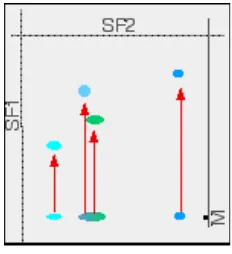
Jika anda melihatnya lebih dekat, anda dapat melihat bahwa bercak pusat besar
dalam kromatogram sebagian biru dan sebagian hijau. Dua pewarna dalam campuran
memiliki nilai Rf yang hampir sama. Tentunya, nilai-nilai ini bisa saja sama, keduanya
memiliki warna yang sama, kertas kering seluruhnya, dan putar 90o dan perlakukan
kromatogram kembali dengan pelarut yang berbeda. Hal yang sangat tidak dipercaya
bahwa dua bercak yang membingungkan akan memiliki nilai Rf dalam pelarut kedua
sama halnya dengan pelarut yang pertama, dengan demikian bercak-bercak akan
bergerak dengan jumlah yang berbeda.
Gambar 2.5. Bergeraknya eluen
Sumber: (Jim, 2009)
Gambar berikutnya menunjukkan apa yang mungkin terjadi pada berbagai bercak
pada kromatogram awal. Posisi pelarut kedua juga ditandai bercak-bercak yang telah
bergerak. Kromatogram akhir akan tampak seperti gambar 2.6.
Gambar 2.6. Kromatogram Kromatografi Kertas dua arah
Sumber: (Jim, 2009)
Kromatografi dua arah secara seluruhnya terpisah dari campuran menjadi empat
bercak yang berbeda. (Jim, 2009)
2.4.2.2 Menentukan Jarak Relatif (Rf)
Beberapa senyawa dalam campuran bergerak sejauh dengan jarak yang ditempuh
Sepanjang anda menjaga segala sesuatunya tetap sama, misalnya jenis kertas dan
komposisi pelarut yang tepat. Jarak relatif pada pelarut disebut sebagai nilai Rf. Untuk
setiap senyawa berlaku rumus sebagai berikut:
Rf = Ja a ya yawa
Ja a ya a
(Jim, 2009)
Misalnya, jika salah satu komponen dari campuran bergerak 9,6 cm dari garis
dasar, sedangkan pelarut bergerak sejauh 12,0 cm, jadi Rf untuk komponen itu:
Rf = , ,
= 0,90 cm
Dalam contoh tidak perlu menghitung nilai Rf karena anda akan membuat
perbandingan langsung dengan hanya melihat kromatogram. Ada dua bercak pada
kromatogram akhir dengan warna yang sama dan telah bergerak pada jarak yang sama
pada kertas, dua bercak tersebut merupakan senyawa yang hampir sama. Hal ini tidak
selalu benar, senyawa-senyawa berwarna yang sangat mirip dengan nilai Rf yang juga
BAB 1 PENDAHULUAN
1.1. Latar Belakang
Penentuan mutu bahan pangan pada umumnya sangat tergantung pada
beberapa faktor seperti cita rasa, tekstur, nilai gizi, dan sifat mikrobiologis. Tetapi
sebelum faktor-faktor lain dipertimbangkan, secara visual faktor warna tampil
lebih dahulu dan kadang-kadang sangat menentukan. Selain sebagai faktor yang
ikut menentukan mutu, warna juga dapat digunakan sebagai indikator kesegaran
atau kematangan. Baik tidaknya cara pencampuran atau cara pengolahan dapat
ditandai dengan adanya warna yang seragam dan merata. (Cahyadi, 2006).
Pewarna makanan digunakan untuk berbagai jenis makanan, terutama
berbagai produk jajan pasar dan berbagai makanan olahan yang dibuat oleh
industri kecil ataupun industri besar. Penggunaan pewarna diperbolehkan, selama
penggunaanya tidak melebihi kadar yang telah ditetapkan. Namun demikian,
apabila pewarna yang digunakan adalah pewarna non-makan, misalnya pewarna
tekstil atau kertas ataupun pewarna makanan tetapi dalam jumlah yang berlebihan,
tentulah dilarang penggunaannya, sebab akan membahayakan kesehatan
konsumen. (Yuliarti, 2007).
Jajanan pasar yang sering ditambahkan pewarna makanan adalah jeli. Jeli
merupakan makanan setengah padat yang terbuat dari buah-buahan dan gula
dengan kandungan total padatan minimal 65 persen. Komposisi bahan mentahnya
Penambahan pewarna makanan dengan warna yang bagus akan menambah
nilai estetika dari produk jeli tersebut, sehingga konsumen yang sebagian besar
anak-anak tertarik untuk membelinya. (Koswara, 2006).
Identifikasi dalam percobaan ini dilakukan dengan menggunakan metode
Kromatografi Kertas karena metode ini sangat sederhana sehingga zat pewarna
tambahan pangan dapat dengan mudah diketahui, selain itu dalam pengerjaannya
menggunakan alat dan bahan yang sederhana dan mudah untuk ditemui.
Disamping itu, pada pengujian dilakukan dengan metode kromatografi
kertas karena acuan dari Laboratorium Pangan dan Bahan Berbahaya Balai Besar
POM di Medan adalah SNI 01-2895-1992, yang menyebutkan bahwa identifikasi
zat pewarna dilakukan dengan metode kromatografi kertas. (Badan POM, 2007).
Oleh karena banyaknya produk jeli di pasaran yang sangat mungkin
mengandung pewarna makanan, maka penulis ingin sekali menulis Karya Ilmiah
yang berjudul “Identifikasi Zat Pewarna Tambahan Pangan Pada Jeli Secara
1.2. Tujuan
Adapun tujuan dari identifikasi zat pewarna makanan pada jeli adalah
untuk mengetahui apakah zat pewarna yang digunakan dalam jeli tersebut sesuai
dengan Perka BPOM No 37-2013.
1.3. Manfaat
Adapun manfaat dari identifikasi zat pewarna makanan pada jeli adalah
sebagai sumber informasi mengenai pewarna makanan yang digunakan pada jeli
IDENTIFIKASI ZAT PEWARNA TAMBAHAN PANGAN PADA JELI SECARA KROMATOGRAFI KERTAS
ABSTRAK
Telah dilakukan Identifikasi Zat Pewarna Tambahan Pangan Pada Jeli Secara Kromatografi Kertas. Pelarut yang digunakan adalah isobutanol:etanol:air dengan perbandingan 3:2:2 sebagai larutan elusi dan Allura Red, Ponceau 4R, Tartrazin, Sunset Yellow, dan Carmoisin sebagai larutan baku. Dari hasil identifikasi tersebut diperoleh zat pewarna tambahan pangan pada jeli adalah Ponceau 4R. Dari hasil identifikasi ini diketahui bahwa zat pewarna tambahan pangan Ponceau 4R adalah zat pewarna tambahan pangan yang diizinkan. Sehingga jeli tersebut telah memenuhi syarat untuk dikonsumsi.
IDENTIFICATION OF DYE ADDITIVE FOOD IN JELLY BY PAPER CHROMATOGRAPHI METHOD
ABSTRACT
Have been Identify of Dye Additive Food in Jelly by Paper Chromatographi Method. The solvent used is Isobuthanol:Ethanol:Water with a ratio 3:2:2 as solution solvent and Allura Red, Ponceau 4R, Tartrazine, Sunset Yellow, and Carmoisine as standart solution. The result of this identification is obtained dye additive food in jelly is Ponceau 4R. The results of this identification is known that the dye Ponceau 4R is permitted of food additives. So that the jelly have been qualified.
IDENTIFIKASI ZAT PEWARNA TAMBAHAN PANGAN
PADA JELI SECARA KROMATOGRAFI KERTAS
TUGAS AKHIR
MELVA EKA N. DAMANIK
132401083
PROGRAM STUDI D-3 KIMIA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
IDENTIFIKASI ZAT PEWARNA TAMBAHAN PANGAN
PADA JELI SECARA KROMATOGRAFI KERTAS
TUGAS AKHIR
Diajukan untuk melengkapi tugas dan memenuhi syarat memperoleh Ahli Madya
MELVA EKA N. DAMANIK
132401083
PROGRAM STUDI D-3 KIMIA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
ALAM
PERSETUJUAN
Judul : Identifikasi Zat Pewarna Tambahan Pangan Pada Jeli Secara Kromatografi Kertas
Kategori : Tugas Akhir
Nama : Melva Eka N. Damanik
Nomor Induk Mahasiswa : 132401083
Program Studi : Diploma 3 (D3) Kimia
Departemen : Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui di Medan, Juni 2016
Disetujui Oleh
Program Studi D3 Kimia FMIPA USU Pembimbing, Ketua,
Dra. Emma Zaidar Nst, M. Si Dr. Albert Pasaribu, M. Sc NIP. 195512181987012001 NIP. 196408101991031001
Disetujui Oleh
Departemen Kimia FMIPA USU Ketua,
PENGHARGAAN
Puji dan syukur penulis ucapkan kepada Tuhan Yesus Kristus atas kasih
karunia dan kesehatan yang dilimpahkan kepada penulis sehingga penulis dapat
menyelesaikan tugas akhir ini.
Adapun tujuan dari penulisan tugas akhir ini adalah untuk memenuhi
persyaratan akademik dalam menyelesaikan program studi D3 Kimia Fakultas
Matematika dan Ilmu Pengetahuan Alam di Universitas Sumatera Utara..
Dalam penulisan tugas akhir ini tidak terlepas dukungan dan doa dari
keluarga terutama kedua orangtua yang terkasih dari penulis yaitu Ayahanda
Anthoni Damanik dan Ibunda Rupina Siahaan yang telah mendidik, dan
memanjatkan doa yang tidak henti-hentinya kepada penulis dalam penyelesaian
tugas akhir ini.
Selain itu penulis juga mengucapkan terimakasih kepada pihak-pihak yang
telah membantu baik secara langsung maupun tidak langsung, antara lain:
1. Bapak Dr. Albert Pasaribu, M.Sc selaku Dosen pembimbing yang telah
memberikan arahan dan waktu kepada penulis dalam penulisan tugas akhir ini.
2. Ibu Dr. Rumondang Bulan, M. Sc selaku Ketua Jurusan Kimia Fakultas
Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
3. Ibu Dra. Emma Zaidar Nst, M. Si selaku Ketua Program Studi D3 Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
4. Sahabat terbaik Debby, Nico, Ernest, Elisabet, Citra, Yuca, Melva, Maria dan
Demikianlah tugas akhir ini penulis perbuat kiranya menjadi sumber
informasi yang positif bagi pembaca dan mohon maaf apabila ada kesalahan
dalam penulisan.
IDENTIFIKASI ZAT PEWARNA TAMBAHAN PANGAN PADA JELI SECARA KROMATOGRAFI KERTAS
ABSTRAK
Telah dilakukan Identifikasi Zat Pewarna Tambahan Pangan Pada Jeli Secara Kromatografi Kertas. Pelarut yang digunakan adalah isobutanol:etanol:air dengan perbandingan 3:2:2 sebagai larutan elusi dan Allura Red, Ponceau 4R, Tartrazin, Sunset Yellow, dan Carmoisin sebagai larutan baku. Dari hasil identifikasi tersebut diperoleh zat pewarna tambahan pangan pada jeli adalah Ponceau 4R. Dari hasil identifikasi ini diketahui bahwa zat pewarna tambahan pangan Ponceau 4R adalah zat pewarna tambahan pangan yang diizinkan. Sehingga jeli tersebut telah memenuhi syarat untuk dikonsumsi.
IDENTIFICATION OF DYE ADDITIVE FOOD IN JELLY BY PAPER CHROMATOGRAPHI METHOD
ABSTRACT
Have been Identify of Dye Additive Food in Jelly by Paper Chromatographi Method. The solvent used is Isobuthanol:Ethanol:Water with a ratio 3:2:2 as solution solvent and Allura Red, Ponceau 4R, Tartrazine, Sunset Yellow, and Carmoisine as standart solution. The result of this identification is obtained dye additive food in jelly is Ponceau 4R. The results of this identification is known that the dye Ponceau 4R is permitted of food additives. So that the jelly have been qualified.
DAFTAR ISI
Bab 4. Hasil dan Pembahasan
4.1 Hasil 24
4.2 Pembahasan 24
Bab 5. Kesimpulan dan Saran
5.1 Kesimpulan 26
5.2 Saran 26