Lampiran 3. Gambar Tumbuhan Daun Sembukan
Lampiran 4.Simplisiadan Serbuk Simplisia DaunSembukan
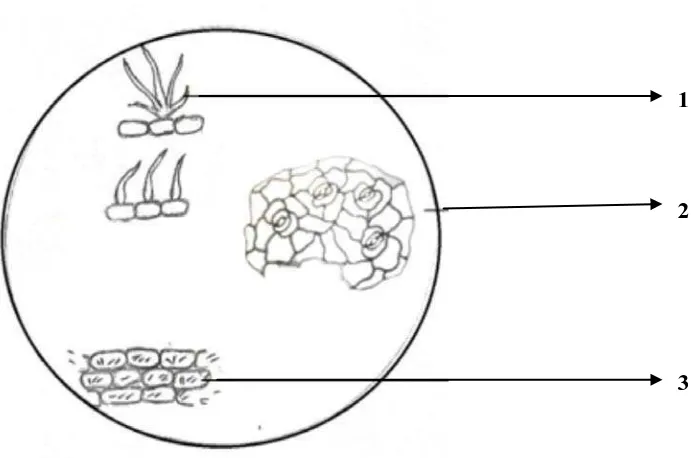
Lampiran 5. Hasil Mikroskopik Daun Sembukan
Gambar Mikroskopik daun segar dan simplisia daun sembukan perbesaran 10 x 40
Keterangan:
1. Rambutpenutupbentukbintang 2. Stomata tipeparasitik
3. Kristal kalsiumoksalatbentukjarum
1
2
Lampiran 6. Perhitungan Hasil Karakteristik Simplisia Daun Sembukan 1. PerhitunganPenetapan Kadar Air Simplisia
a. Sampel 1
2. Perhitungan Penetapan Kadar Sari Larut dalam Air Kadar air =volume air (mL)
berat sampel (g)
x
100%Kadar sari larut air
=
berat sariberat simplisia
x
100Lampiran 6. (lanjutan)
3. Kadar sari larutair III
Berat sampel = 5,021 g
Kadar sarilarut air rata-rata=13,28% +11,06%+12,17%
3 = 12,17 %
3. PerhitunganPenetapan Kadar Sari LarutdalamEtanol
a. Kadar sari yang larut dalam etanol I
Berat sampel = 5,002 g
Berat sari = 0,357 g
Kadar sari yang larutdalametanol = 0,57
5,002 x 100
20 x 100%
= 35,68% b. Kadar sari yang larutdalametanol II
Berat sampel = 5,010 g
Berat sari = 0,435 g
Kadar sariyang larutdalametanol = 0,435
5,010x 100
20 x 100%
= 43,41 % Kadar sari larut etanol
=
berat sariberat simplisia
x
100Lampiran 6. (lanjutan)
c. Kadar sari larut dalam etanol III
Beratsampel = 5,008 g
Berat sari = 0,374 g
Kadar sari yang larutdalametanol = 0,374
5,008x 100
20x 100%
= 37,34 %
Kadar sari yang larutdalametanol rata – rata = 35,68%+43,41%+37,34%
3 = 38,81%
4. PerhitunganPenetapan Kadar Abu Total
a. Sampel I
Berat sampel = 2,001 g
Berat abu = 0,194 g
Kadar abu = 0,194 g
2,001 gx 100% = 9,69 %
b. Sampel II
Berat sampel = 2,005 g
Berat abu = 0,149 g
Kadar abu = 0,149 g
2,005 gx 100% = 7,43 %
c. Sampel II
Kadar abu total = berat abu
Lampiran 6. (lanjutan)
Kadar abu total rata-rata = ����� ���� (������ �+������ ��+������ ���)
3
= 9,69 %+7,43 %+4,74 %
3 = 7,28 %
5. Penetapan Kadar Abu Tidak Larut Asam
a. Sampel I
Kadar abutidaklarutasam = Berat abu
Lampiran 7.Bagan Alur Uji Pendahuluan
Dibersihkan dari pengotor Dicuci dibawah air mengalir hinggabersih, tiriskan Ditimbang berat basah Dikeringkandalamlemari pengering
Ditimbangberatnya Dihaluskanmenjadiserbuk dengan blender
Ditimbangserbuknya Daun Sembukan segar
Simplisia Daun Sembukan
Serbuk Simplisia
Karakterisasi Simplisia Skrining Fitokimia
Pemeriksaan makroskopik, mikroskopik dan penetapan :
1. Kadar air
2. Kadar sari larut air
Pemeriksaan :
1. Glikosida 2. Saponin
Lampiran 8.Bagan Pembuatan Ekstrak Etanol Daun Sembukan
Dimasukkan kedalam sebuah bejana
Ditambahkan pelarut etanol 96% sebanyak 75 bagian
Direndam selama 5 hari terlindung dari cahaya, sambal sering diaduk
Disaring dengan kertas saring
Dicuci ampas dengan etanol 96 %
Disaring dengan kertas saring hingga diperoleh 100 bagian
Dipindahkan kedalam bejana tertutup
Dibiarkan ditempat sejuk dan terlindung dari
Cahaya selama 2 hari
Dienap tuangkan atau saring
Dipekatkan dengan rotary evaporator pada suhu 400 C dan dikeringkan dengan hairdryer
Maserat I Ampas
Serbuk simplisia Daun sembukan
Ekstrak kental
Maserat II
Lampiran 9. Bagan Kerja Antiinflamasi
Dipuasakanselama ± 18 jam,tetap
diberiminum
Dibagilimakelompokdanmasing-masingdiberiperlakuansecaraperoral
30 menitkemudianmasing-masing kaki tikusdarisetiapkelompokdiinduksidengan 0,1 ml karagenan 1% secara intraplantar
Diukur volume kaki
tikusdenganmencelupkan kaki tikussampaibatas yang
yangtelahditandaipadamata kaki kedalamalatpletismometer
Diukurpenambahan volume kaki tikusdengancara yang
samapadapengukuran kaki tikusmula-mula
HewanUji (tikus)
D II
Volume telapak kaki tikusmula-mula D I
D II : dosis 400 mg/kg bb D III : dosis 500 mg/kg bb
Lampiran 10. Alat Pletismometer
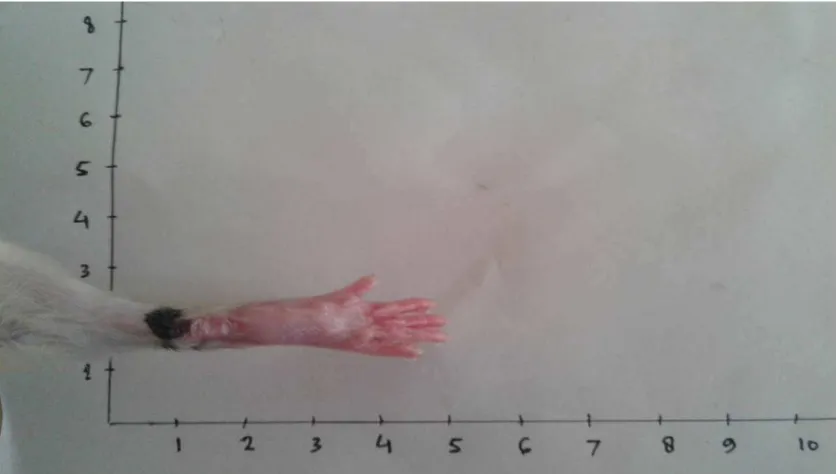
Lampiran 12. Telapak Kaki Tikus
Gambar Kaki tikus sebelum diinduksi λ-karagenan
Lampiran 13. Contoh Perhitungan Dosis
Tabel. Konversi Dosis Antara Jenis Hewan Dengan Manusia (Suhardjono, 1995) Mencit
- Dosis suspense ekstraketanol daun sembukan yang akandibuatadalah 300
mg/kg bb, 400 mg/kg bb dan 500 mg/kg bb. Berartidosis 300 mg, 400 mg dan
500 mg tersebutdiberikanuntukhewandengan 1 kg beratbadan. Karena 1
100 x 1 kg
= 1
100 x 1000 g = 10 mL. Maka tiap dosis dilarutkan dalam 10,0 ml suspensi Na-CMC.
- Volume suspensi ekstrak etanol daun sembukan yang diberikan kepada tikus
- Dosis maksimum untuk manusia dewasa = 25 – 50 mg
- Konversi dosis manusia (70 kg) kedosis hewan uji tikus dikali 0,018
Pemberianlarutannatriumdiklofenak
Konversidosisuntuktikus = 50 mg x 0,018 = 0,90 mg
Maka dosis natrium diklofenak yang digunakan adalah 0,90 mg untuk tikus 200
g, sehingga dosis dalam mg/kg bb adalah :
0,90 mg
200 g =
x 1 kg
x = 0,90 mg
200 g x 1000 g
x = 4,5 mg/kg bb
- Volume pemberian 1% dari bb tikus
Misal bb tikus = 200 g
Maka volume suspense natrium diklofenak yang diberikan 1
Lampiran 14.Contoh Perhitungan Persen Radang dan Persen Inhibisi Radang
1. Persen Radang
dimana: Vt = volume radang setelah waktu t Vo = volume awal kaki tikus
Misalnya: Ekstrak daun sembukan dosis 300 mg/kg bb pada menit ke-30
Diketahui : Vt = 04,59
Vo = 03,52
Persen Radang (%R)
=
04,59 - 03,5203,52
x
100 = 30,39 %2. Persen Inhibisi Radang
Dimana : a = Persen radang rata-rata kelompok kontrol
b = Persen radang rata-rata kelompok perlakuan yang mendapat bahan uji atau obat pembanding
Misalnya, diketahui a = 54,20 %, b = 20,60 %
Persen Inhibisi Radang (%IR)
=
54,20 - 20,6020,60
x
100% = 61,48 %Persen Radang (%R)
=
Vt-VoVo
x
100%Persen Inhibisi Radang (%IR)
=
a-bLampiran 15.Tabel Data Penelitian
Jumlah Hewan
Uji
Perlakuan
Volume Telapak Kaki Tikus
Lampiran 15. (lanjutan)
1
EEDS 500 mg/kg BB
03.27 03.71 03.83 03.90 03.99 04.25 04.28 04.19 04.18 04.10 04.10 04.00 03.90 2 02.89 03.34 03.45 03.56 03.66 03.79 03.80 03.72 03.65 03.51 03.51 03.40 03.34
3 03.93 04.35 04.51 04.68 04.80 04.90 04.92 04.80 04.75 04.70 04.70 04.52 04.46
4 03.60 04.10 04.26 04.46 04.68 04.79 04.78 04.60 04.62 04.51 04.51 04.37 04.15
Lampiran 16. (lanjutan)
1
EEDS 400 mg/kg BB
13.90 19.02 18.78 17.56 19.51 21.46 21.95 24.39 19.51 17.07 16.58 13.41
2 15.78 17.29 20.80 20.80 21.55 26.31 29.07 30.22 21.55 19.04 17.57 12.78
3 23.33 25.75 30.60 37.57 36.96 40.60 43.63 45.45 36.96 33.93 30.30 24.24
4 16.28 21.82 28.66 39.08 42.67 44.95 48.20 49.83 42.67 38.43 38.43 31.92
5 18.07 15.06 26.50 33.13 36.14 37.05 37.95 40.66 36.14 32.52 30.12 23.49
Rata – rata 17.57 19.78 25.06 29.62 31.36 34.07 36.16 38.13 31.36 28.20 26.60 21.11 SD ± 03.59 ± 04.14 ± 04.51 ± 04.80 ± 06.93 ± 07.73 ± 09.85 ± 09.86 ± 09.53 ± 10.23 ± 26.60 ± 21.16
1
EEDS 500 mg/kg BB
13.45 17.12 19.26 22.01 29.96 30.88 28.13 27.82 25.38 19.26 22.32 19.26
2 15.57 19.37 23.18 26.64 31.14 31.48 28.71 26.29 21.45 23.18 17.64 15.57
3 10.68 14.79 19.08 22.13 24.68 25.19 22.13 20.86 19.59 19.08 15.01 13.48
4 13.88 18.33 23.88 30.04 33.05 32.77 27.77 28.33 25.27 23.88 21.38 15.27
5 11.80 17.33 20.60 25.87 29.89 30.65 28.14 24.37 20.60 20.60 18.09 16.33
Rata – rata 13.07 17.36 21.20 25.33 29.74 30.19 26.97 25.53 22.45 21.20 18.88 15.98
Lampiran 17. Tabel Data Persen Inhibisi Radang
Jumlah
Hewan Uji Perlakuan
Lampiran 20. Hasil Uji Duncan
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 5,000.
Menit ke-60
Lampiran 20. (lanjutan)
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 5,000.
Lampiran 20. (lanjutan)
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 5,000.
Menit ke-180
Lampiran 20. (lanjutan)
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 5,000.
Menit ke-240
Lampiran 20. (lanjutan)
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 5,000.
Menit ke-300
Lampiran 20. (lanjutan)
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 5,000.
DAFTAR PUSTAKA
Abriyanto.(2012). Aktivitas Antifungi Ekstrak Etanol Daun Sembukan (Paederia foetida L).Jurnal Farmasi Indonesia: vol.09 (3).
Anief, M. (1995). Ilmu Meracik Obat, Teori Dan Praktik. Cetakan V. Yogyakarta: Gadjah Mada University Press. Halaman 107.
Carlo, D,C., Mascolo, N., dan Izzo, A.A. (1999). Flavonoid: Old and New Aspects of A Class of Natural Therapeutic Drugs. Life Sciences. 65 (4): 337-353.
Depkes RI. (1979). Farmakope Indonesia. Edisi III. Departemen Kesehatan Republik Indonesia. Halaman 33.
Depkes RI. (1986). Sediaan Galenika. Jakarta: Departemen Kesehatan RI.
Halaman 8-11.
Depkes RI. (1995).Farmakope Indonesia.Edisi IV. Jakarta: Departemen Kesehatan RI. Halaman 7.
Depkes RI. (1995). Materia Medika Indonesia. Jilid VI. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 297-326,300-304,306.
Depkes RI. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Direktorat Jenderal Pengawas Obat dan Makanan. Halaman 10-11.
Depkes RI. (2001). Inventaris Tanaman Obat Indonesia. Jilid II. Jakarta: Departemen Kesehatan dan Kesejahteraan Sosial RI Badan Penelitian dan Pengembangan Kesehatan. Halaman 255.
Dorlan, W.A.N. (200). Kamus Kedokteran Dorland. Edisi XXXIX. Jakarta: EGC. Halaman 68.
Farnsworth, N.R. (1966). Biologycal and Phytochemical Screening of Plants.Journal of pharmaceutical science.Volume 55. Halaman 262-264
Fitriyani, A., Winarti, L., Muslichah, S., dan Nuri.(2011). Uji Antiinflamasi Ekstrak Metanol Daun Sirih Merah (Piper crocatum Ruiz & Pav) Pada Tikus Putih.Majalah Obat Tradisional. 16(1): 35.
Ganiswarna, S.G. (1995). Farmakologi dan Terapi. Edisi IV. Jakarta: UI Press. Halaman 208-209.
Harborne, J.B. (1987). Metode Fitokimia. Bandung: Penerbit ITB Bandung. Halaman 4-7.
Hariana, A. (2011). Tumbuhan Obat dan Khasiatnya.Cetakan Ke-4.Jakarta
Juheini, F.W., Mariana, Y., dan Rusmawan, I. (1990). Efek Antiinflamasi Jahe
(Zingiber officinale. Rosc) Terhadap Radang Buatan Pada Tikus
Putih.Majalah Farmakologi dan Terapi Indonesia. 7 (1): 9-13.
Katzung, B.G. (2006). Farmakologi Dasar dan Klinik. Jakarta: EGC. Halaman 573.
Kusumaningsih, H. (2012). Uji Efek Antiinflamasi Fraksi Etil Asetat Ekstrak Etanol Daun Sembukan pada Tikus Putih.Jurnal farmasi Indonesia.10(1), Februari 2012.Halaman 2.
Linnon, B.L. (2009). Skrining Fitokimia Dan Uji Efek Antiinflamasi Ekstrak Etanol Daun Tempuyung (Sonchus arvensis L.) Terhadap Radang Pada Tikus.Skripsi. Jurusan Farmasi. USU. Medan. Halaman 53-55.
Mangoting, D., Imang, I., dan Said A. (2005).Tanaman Lalap Berkhasiat
Obat.Jakarta: Penebar Swadaya. Halaman 21.
Mansjoer, S. (2003).Mekanisme Obat Anti Radang.Media Farmasi Indonesia. 7(1): 35-36.
Mutschler, E. (1999). Dinamika Obat: Buku Ajar Farmakologi dan Toksikologi. Penerjemah: Mathilda Widianto dan Anna Setiadi Rianti. Edisi Ke V. Cetakan Ke III. Bandung : Penerbit ITB. Halaman 194, 208.
Nugroho, A.E. (2012). Farmakologi Obat-obat Penting Dalam Pembelajaran Ilmu
Farmasi dan Dunia Kesehatan. Yogyakarta: Pustaka Pelajar. Halaman 175,
179.
Parmar dan Prakash.(2006). Sceening Methods in Pharmacology. Ahmedabab: Alpha Science International Ltd. Halaman 213-214.
Price, S.A., dan Wilson, L.M. (2006). Patofisiologi Konsep Klinis Proses-Proses
Penyakit. Editor Huriawati Hartono, Natalia Susi, Pita Wulansari, Dewi
Asih Maha Nani. Edisi Keenam. Jakarta: EGC. Halaman 57-58.
Robbins, S.L., Kumar, V., dan Cotran, R.S. (2007). Buku Ajar Patologi. Jakarta: EGC. Halaman 35-37, 50-53.
Solikin, (2007). Potensi Jenis-jenis Herba Liar di Kebun Raya Purwodadi Sebagai Obat, Proseding: Seminar Nasional Pendidikan Biologi FKIP UNS, 21 Februari 2007, Pasuruan. Halaman 4.
Soenarto.(2007). Inflamasi. Dalam: Buku Ajar Ilmu Penyakit Dalam. Edisi Kelima. Editor: Aru W. Sudoyo, Bambang Setiyohadi, Idrus Alwi, Marcellus Simadibrata K dan Siti Setiati. Jakarta: Interna Publishing. Halaman 2414.
Suhardjono.(1995). Percobaan Hewan Laboratorium. Yogyakarta: UGM Press. Halaman 207.
Sularkar, A.A. (2008). In-Vivo Animal Models for Evaluation of Antiinlfamatory Activity.Article Review. 6(2):7.
Tjay, H.T., dan Rahardja, K. (2013). Obat-obat Penting (Khasiat, Penggunaan
dan Efek-efek Samping).Edisi ke VI. Jakarta: Elex Media Komputindo.
Halaman 327-330.
Trubus.(2013). 100 Plus Herbal Indonesia.Volum 11. Jakarta: PT. Niaga
Swadaya. Halaman: 182.
Vogel, H. (2008). Drug Discovery and Evaluation. Third Completely Revised Update and Enlarged Edition. Heidelberg: Springer. Halaman 1103-1104.
Wilmana, P.F., dan Gan, S. (2007). Analgesik-Antipiretik, Analgesik Antiinflamasi
non Steroid dan Obat Pirai. Dalam Editor: Sulistia Gan Ganiswara.
Farmakologi dan Terapi. Edisi Ke V. Jakarta: UI Press. Halaman 240.
Winarno, F.G. (1990). Teknologi Pengolahan Rumput Laut. Cetakan I. Jakarta: Pustaka Sinar Harapan. Halaman 73.
Winter, C.A., Risley, E.A., dan Nuss, G.W. (1962). Carrageenin-Induced Oedema In The Hind Paw of Rat as an Assay to Inflamatory Drugs. Proc Soc Exp
Biol Med. 111 : 544-547.
World Health Organization (WHO).(1998). Quality Control Methods For
BAB III
METODE PENELITIAN
Metode penelitian ini meliputi penyiapan daun sembukan, identifikasi daun
sembukan, pembuatan simplisia, pemeriksaan karakterisasi simplisia, pemeriksaan
skrining fitokimia, pembuatan ekstrak etanol daun sembukan dengan cara
maserasi, penyiapan hewan percobaan dan pengujian efek antiinflamasi dengan
metode paw edem. Data hasil penelitian dianalisis dengan one way ANOVA
(Analysis of Variance) dan dilanjutkan dengan uji Duncan untuk melihat
perbedaan nyata antar peelakuan menggunakan program SPSS (Statistic Product
and Service Solution) versi 17.0. Penelitian dilkukan di Laboratorium
Farmakognosi dan Laboratorium Farmakologi Fakultas Farmasi Universitas
Sumatera Utara.
3.1 Alat-alat dan Bahan 3.1.1 Alat-alat
Alat-alat yang digunakan pada penelitian ini meliputi lemari pengering,
blender (Panasonic), oven (Dynamica), pletismometer (Ugo Basile cat No. 7140),
neraca listrik (Vibra AJ), neraca hewan (GW-1500), mikroskop (Olympus),
diklofenak, karboksilmetilsellulosa (Na-CMC), λ-karagenan, larutan fisiologis
NaCl 0,9%, air suling, etanol 96%.
3.2 Penyiapan Sampel 3.2.1 Pengumpulansampel
Pengumpulan daun sembukandilakukan secara purposif yaitu tanpa
membandingkan dengan tumbuhan yang sama dari daerah lain. Daun sembukan
yang digunakan adalah daun sembukan yang masih segar.Daun sembukan diambil
dari Dusun Cinta Makmur, Kecamatan Bilah Hulu, Kabupaten Labuhan Batu,
Sumatera Utara.
3.2.2 Identifikasi sampel
Identifikasi daun sembukan dilakukan Herbarium Bogoriense Bidang
Botani Pusat Penelitian Biologi-LIPI Bogor. Tumbuhan yang diidentifikasi adalah
bagian daunnya. Hasil identifikasi dapat dilihat pada Lampiran 1 halaman 49.
3.2.3 Pembuatan simplisia daun sembukan
Tumbuhan yang digunakan pada penelitian ini adalah daun sembukanyang
masih segar. Daun sembukan yang telah dikumpulkan dibersihkan dari pengotor,
lalu dicuci dibawah air mengalir hingga bersih kemudian ditiriskan dan ditimbang.
Daun sembukan dikeringkan di lemari pengering sampai daun kering (ditandai bila
diremas rapuh).Simplisia yang telah kering diblender menjadi serbuk, lalu
ditimbang beratnya dan di simpan dalam wadah tertutup.
3.2.4 Pembuatan ekstrak etanol daun sembukan (EEDS)
Menurut Farmakope Indonesia edisi III, (1979) caranya adalah sebagai berikut:
Sebanyak 10 bagian (500g) serbuk simplisia dimasukkan ke dalam sebuah
bejana, dituangi dengan 75 bagian (3,75 liter) cairan penyari (etanol 96%), ditutup,
dibiarkan selama 5 hari terlindung dari cahaya sambil sesekali diaduk, kemudian
diserkai, diperas. Ampas diremaserasi dengan cairan penyari (etanol 96%)
secukupnya hingga diperoleh 5 liter (100 bagian). Pindahkan ke bejana tertutup,
dibiarkan ditempat sejuk, terlindung dari cahaya selama 2 hari. Enap tuangkan atau
saring. Pemekatan ekstrak dilakukan dengan alat rotary evaporatorpada suhu
400C. Bagan alur pembuatan ekstrak etanol daun sembukan dapat dilihat pada
Lampiran 8 halaman 59.
3.3Pemeriksaan Karakterisasi Simplisia Daun Sembukan
Pemeriksaan karakterisasi simplisia meliputi makroskopik, mikroskopik,
penetapan kadar air, penetapan kadar sari larut air, penetapan kadar sari larut
etanol, penetapan kadar abu total dan penetapan kadar abu tidak larut asam.
3.3.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk, ukuran,
diameter dan organoleptis dari daun sembukan segar dan simplisia daun
sembukan.
Pemeriksaan mikroskopik pada serbuk simplisia daun sembukan ditaburkan di atas
kaca objek yang telah ditetesi dengan larutan kloralhidrat dan ditutup dengan kaca
penutup, kemudian diamati di bawah mikroskop. Gambar mikroskopik dapat
dilihat pada Lampiran 5 halaman 53.
3.3.3 Penetapan kadar air
Alat terdiri dari labu alas bulat 500 mL, pendingin, tabung penyambung,
tabung penerima 5 mL berskala 0,05 mL, alat penampung dan pemanas listrik.
Cara kerja :
1. Penjenuhan toluen
Sebanyak 200 mL toluen dan 2 mL air suling dimasukkan ke dalam labu alas
bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2 jam.
Toluen dibiarkanmendingin selama 30 menit dan dibaca volum air pada tabung
penerima dengan ketelitin 0,05 mL (WHO, 1998).
2. Penetapan kadar air simplisia
Sebanyak 5 g serbuk simplisia yang telah ditimbang seksama dimasukkan ke
dalam labu yang berisi toluen yang telah dijenuhkan, kemudian labu dipanaskan
hati-hati selama 15 menit.Setelah toluen mendidih, kecepatan tetesan diatur 2 tetes
tiap detik sampai sebagian besar air terdestilasi, kemudian kecepatan tetesan
dinaikkan hingga 4 tetes tiap detik.Setelah semua air terdestilasi, bagian dalam
pendingin dibilas dengan toluen.Destilasi dilanjutkan selama 5 menit, kemudian
tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluena
memisah sempurna, volume air dibaca dengan ketelitian 0,05 mL. Selisih kedua
yang diperiksa.Kadar air dihitung dalam persen(WHO, 1998). Perhitungan kadar
air dapat dilihat pada Lampiran 6 halaman 54.
3.3.4 Penetapan kadar sari larut dalam air
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam 100 mL
air-klorofom ( 2,5 mL air-klorofom dalam air suling sampai 1 liter) dan labu bersumbat
dikocok sesekali sampai 6 jam pertama, kemudian dibiarkan selama 18 jam,
kemudian disaring. Sejumlah 20 mL filtrat pertama diuapkan sampai kering dalam
cawan peguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa
dipanaskan pada suhu 1050C sampai bobot tetap. Kadar sari larut etanol dihitung
dalam persen (Depkes, RI., 2000). Perhitungan kadar sari larut dalam air dapat
dilihat pada Lampiran 6 halaman 54.
3.3.5 Penetapan kadar sari larut etanol
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam 100 mL
etanol 96% dan labu bersumbat dikocok sesekali sampai 6 jam pertama, kemudian
dibiarkan selama 18 jam, kemudian disaring. Sejumlah 20 mL filtrat pertama
diuapkan sampai kering dalam cawan peguap yang berdasar rata yang telah
dipanaskan dan ditara. Sisa dipanaskan pada suhu 1050C sampai bobot tetap.
Kadar sari larut etanol dihitung dalam persen (Depkes RI, 2000). Perhitungan
kadar sari larut etanol dapat dilihat pada Lampiran 6 halaman 55.
abu total dihitung dalam persen (Depkes, RI., 2000). Perhitungan kadar abu total
dapat dilihat pada Lampiran 6 halaman 56.
3.3.7 Penetapan kadar abu tidak larut dalam asam
Abu yang diperoleh dalam penetapan kadar abu didihkan dalam 25 mL
asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring melalui kertas saring bebas abu lalu dipijar sampai bobot
tetap, kemudian didinginkan dan ditimbang . Kadar abu yang tidak larut dalam
asam dihitung dalam bentuk persen (Depkes, RI., 2000). Perhitungan kadar abu
tidak larut asam dapat dilihat pada Lampiran 6 halaman 57.
3.4 Skrining Fitokimia 3.4.1 Pemeriksaan alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 mL
asam klorida 2 N dan 9 mL air suling, dipanaskan di atas penangas air selama 2
menit, didinginkan lalu disaring. Filtrat dipakai untuk percobaan berikut:
a. filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereksi Mayer akan
terbentuk endapan berwarna putih atau kuning.
b. filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereksi Bouchardat akan
terbentuk endapan berwarna coklat-hitam.
c. filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereksi Dragendorff akan
terbentuk endapan berwarna merah atau jingga.
Alkaloida dinyatakan positif jika terjadi endapan atau paling sedikit dua
3.4.2 Pemeriksaan flavonoida
Sebanyak 10 g serbuk simplisia ditambahkan 10 mL air suling, dididihkan
selama 5 menit dan disaring dalam keaadaan panas. Filtrat yang diperoleh diambil
5 mL, ditambahkan 0,1 g serbuk magnesium, 1 mL asam klorida pekat dan 2 mL
amil alkohol, dikocok dan dibiarkan memisah. Flavonoid positif jika terjadi warna
merah kuning atau jingga pada lapisan amil alkohol (Farnsworth, 1996)
3.4.3 Pemeriksaan tanin
Sebanyak 0,5 g sampel disari dengan 10 mL air suling, disaring lalu
filtratnya diencerkan dengan air suling sampai tidak berwarna. Diambil 2 mL
larutan lalu ditambahkan 1 sampai 2 tetes pereaksi besi (III) klorida. Terjadi warna
biru atau hijau kehitaman menunjukkan adanya tanin (Farnsworth, 1996).
3.4.4 Pemeriksaan glikosida
Serbuk simplisia ditimbang sebanyak 3 g kemudian disari dengan 30 mL
campuran 7 bagian volume etanol 96% dan 3 bagian volume air suling, selanjutnya
ditambahkan 10 mL HCl 2 N, direfluks selama 10 menit, didinginkan dan disaring.
Pada 30 mL filtrat ditambahkan 25 mL air suling dan 25 mL timbal (II) asetat 0,4
M, dikocok, didiamkan selama 5 menit lalu disaring. Filtrat disari sebanyak 3 kali,
tiap kali dengan 20 mL campuran 3 bagian volume kloroform dan 2 bagian volume
isopropanol. Diambil lapisan air kemudian ditambahkan 2 mL air dan 5 tetes
3.4.5 Pemeriksaan saponin
Sebanyak 0,5 g sampel dimasukkan ke dalam tabung reaksi dan ditambahkan 10
mL air suling panas, didinginkan kemudian dikocok kuat-kuat selama 10 detik,
timbul busa yang mantap tidak kurang dari 10 menit setinggi 1-10 cm.
Ditambahkan 1 tetes larutan asam klorida 2 N, bila buih tidak hilang menunjukkan
adanya saponin (Depkes, RI., 1995).
3.4.6 Pemeriksaan steroida/triterpenoida
Sebanyak 1 g sampel dimaserasi dengan 20 mLn-heksan selama 2 jam, lalu
disaring. Filtrat diuapkan dalam cawan penguap. Pada sisa dalam cawan penguap
ditambahkan 2 tetes asam asetat glasial dan 1 tetes asam sulfat pekat. Timbulnya
warna biru atau biru hijau menunjukkan adanya steroid, sedangkan warna merah,
merah muda atau ungu menunjukkan adanya triterpenoid(Harborne, 1987).
3.5 Uji Efek Antiinflamasi
Pengujian efek antiinflamasi ini terdiri dari beberapa tahap, yaitu
penyiapan hewan percobaan, penyiapan bahan, dan pengujian efek antiinflamasi.
3.5.1 Pembuatan suspensi Na CMC 0,5 %
Sebanyak 500 mg Na CMC ditaburkan kedalam lumpang berisi air suling
panas sebanyak 10 mL, ditutup dan dibiarkan selama 15 menit, kemudian digerus
hingga diperoleh massa yang transparan, lalu diencekan dengan air suling
3.5.2 Pembuatan suspensi natrium diklofenak dosis 4,5 mg/kg bb
Sebanyak 4,5 mg serbuk natrium diklofenak digerus, kemudian ditambahkan
sedikit suspensi Na-CMC 0,5% digerus sampai homogen, dimasukkan ke dalam
labu tentukur 10 mL, dicukupkan sampai garis tanda dengan suspensi Na-CMC
0,5%.
3.5.3 Pembuatan suspensi ekstrak etanol daun sembukan (EEDS) dosis 300 mg/kg bb, 400 mg/kg bb dan 500 mg/kg bb
Ditimbang masing-masing 300 mg/kg bb, 400 mg/kg bb dan 500 mg/kg bb
ekstrak etanol daun sembukan, kemudian dimasukkan ke dalam lumpang
ditambahkan sedikit suspensi Na-CMC digerus sampai homogen. Dimasukkan ke
dalam labu tentukur 10 mL, dicukupkan sampai garis tanda. Perhitungan dosis
ekstrak etanol daun sembukan dapat dilihat pada lampiran 13 halaman 64.
3.5.4 Pembuatan larutan λ-karagenan 1%
Ditimbang sebanyak 100 mg λ-karagenan, digerus sampai homogen dengan
larutan NaCl 0,9%, kemudian dimasukkan ke dalam labu tentukur 10 mL,
dicukupkan dengan larutan NaCl 0,9% sampai garis tanda. Diinkubasi pada suhu
370C selama 24 jam (Linnon, 2009).
3.5.5Pembuatan larutan reservoir
Sebanyak 2 mL campuran senyawa pembasah (Ornano Imbente BBC. 97)
yang telah tersedia dalam kemasan standar dimasukkan ke dalam labu tentukur 1
3.5.6Penyiapan hewan percobaan
Hewan yang digunakan pada penelitian ini adalah tikus putih jantan yang
sehat sebanyak 25 ekor dengan berat badan 150-200 g. Sebelum pengujian terlebih
dahulu tikus dikondisikan selama 1 minggu dalam kandang yang baik untuk
menyesuaikan diri dengan lingkungannya. Hewan yang digunakan pada penelitian
ini telah disetujui penggunaanya oleh Ketua Komite Etik Penelitian Hewan
Fakultas Matematika dan Ilmu Pengetahuan Alam-Universitas Sumatera Utara
(Animal Research Ethics Commitees / EREC). Rekomendasi persetujuan dapat
dilihat pada Lampiran 2 halaman 50.
3.5.7 Pengujian efek antiinflamasi
Sebelum pengujian tikus dipuasakan selama 18 jam (tidak makan tetapi
masih tetap diberi minum). Hewan dikelompokkan kedalam 5 kelompok, yang
masing-masing kelompok terdiri dari 5 ekor tikus, yaitu kelompok kontrol negatif
(suspensi Na-CMC), kelompok kontrol positif (Natrium diklofenak), kelompok
bahan uji ekstrak etanol daun sembukan (dosis 300, 400 dan 500 mg/kg bb).
Pada hari pengujian masing-masing tikus diberi tanda pada bagian ekor dan
pada kaki kanan tikus lalu hewan ditimbang beratnya. Kemudian kaki kanan tikus
dimasukkan ke dalam sel yang berisi cairan khusus yang ada pada alat
pletismometer sampai cairan naik pada garis batas atas, kemudian pedal ditahan,
dicatat angka pada monitor sebagai volume awal (Vo) yaitu volume kaki sebelum
diberi obat dan diinduksi larutan λ- karagenan. Setelah itu masing-masing tikus
diberi suspensi bahan uji secara oral sesuai dengan kelompoknya. Satu jam
kemudian, masing-masing telapak kaki tikus disuntik secara intraplantar dengan
cara mencelupkan kaki tikus pada sel pletismometer yang berisi cairan khusus
sampai larutan mencapai garis batas atas, dan pedal dithan. Dicatat angkapada
monitor. Perubahan volume cairan yang terjadi dicatat sebagai volume telapak
kaki tikus (Vt). Pengukuran dilakukan setiap 30 menit selama 360 menit. Dan tiap
kali pengukuran larutan sel tetap dicukupkan sampai garis tanda atau garis merah
bagian atas sel dan pada menu utama ditekan tombol nol dan juga kaki tikus
dikeringkan sebelumnya (Parmar dan Prakash, 2006).
Volume radang adalah selisih volume telapak kaki tikus setelah dan sebelum
disuntikkan λ-karagenan. Pada waktu pengukuran, volume cairan pada sel
pletismometer sama setiap kali pengukuran dan tanda batas pada kaki tikus harus
jelas, kaki tikus harus tercelup sampai batas yang dibuat (Juheini, dkk., 1990).
Bagan kerja uji antiinflamasi dapat dilihat pada Lampiran 9 halaman 60.
3.6 Rumus Perhitungan Persentase Radang (% R) dan Persentase Inhibisi Radang (% IR)
3.6.1 Persen radang (% R)
%� =�� − ��
�� � 100%
Keterangan:
Vo = volume mula-mula
Vt = volume udem kaki pada waktu t
Contoh perhitungan persentase radang dapat dilihat pada Lampiran 16 halaman 69
dan persentase inhibisi radang dapat dilihat pada Lampiran 17 halaman 71.
3.7 Analisis Data
Data hasil penelitian dianalisis secara ststistik menggunakan analisis
variansi (ANOVA) dengan program SPSS dengan tingkat kepercayaan 95%
dilanjutkan dengan uji Duncan untuk mengetahui kelompok mana yang
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan dilakukan di Herbarium Bogoriense, Bidang
Botani, Pusat Penelitian Biologi-LIPI, menyebutkan bahwa tanaman yang
digunakan adalah tanaman daun sembukan Paederia foetida L, famili Rubiaceae.
hasil identifikasi dapat dilihat pada Lampiran 1 halaman 49.
4.2 Hasil Karakteristik Simplisia 4.2.1 Hasil pemeriksaan makroskopik
Hasil pemeriksaan makroskopik dari daun sembukan segar menunjukkan
bahwa daun sembukan memmiliki warna hijau, berbau kentut bila di remas,
panjang 9-12 cm, lebar 3-4 cm. Pemeriksaan makroskopik serbuk simplisia daun
sembukan dilakukan dengan melihat organoleptis simplisia berupa pemeriksaan
terhadap bau, rasa, warna dari serbuk simplisia daun sembukan. Hasil pemeriksaan
menunjukkan bahwa simplisia daun sembukan berwarna coklat kehitaman, rasa
pahit dan berbau khas.
4.2.2 Hasil pemeriksaan mikroskopik
Hasil pemeriksaan mikroskopik dari daun segar dan serbuk simplisia daun
4.2.3 Hasil pemeriksaan karakteristik simplisia
Hasil pemeriksaan kadar air, kadar sari larut air, kadar sari larut etanol, kadar
abu total dan kadar abu tidak larut asam dapat dilihat pada Tabel 3.1
Tabel 4.1Hasil pemeriksaan karakteristik simplisia daun sembukan
Penetapan kadar air bertujuan untuk memberikan batasan minimal atau
rentang besarnya kandungan air didalam bahan (Depkes, RI., 2000). Kelebihan air
dalam simplisia menyebabkan pertumbuhan mikroba, jamur atau serangga, serta
mendorong kerusakan bahan aktif (WHO, 1998). Hasil penetapan kadar air yang
diperoleh lebih kecil dari 10% yaitu 4,98%. Hal ini baik karena kelebihan air
dalam simplisia akan mendorong pertumbuhan mikroba dan jamur.
Kadar sari larut air simplisia daun sembukan 12,17% dan kadar sari larut
etanol simplisia daun sembukan 38,81%. Penetapan kadar sari larut air untuk
mengetahui senyawa-senyawa yang dapat larut dalam air. Senyawa-senyawa yng
dapat larut dalam air adalah glikosida, gula, gom, protein, enzim, zat warna, dan
asam organik. Penetapan kadar sari larut etanol untuk mengetahui kadar sari yang
larut dalam pelarut polar. Senyawa-senyawa yang dapat larut dalam etanol adalah
glikosida, antarkinon, steroid terikat, klorofil, dan dalam jumlah sedikit yang larut
yaitu lemak dan saponin (Depkes, RI., 1986).
Penetapan kadar abu total dilakukan untuk mengetahui kandungan mineral
internal (abu fisiologi) dan eksternal (abu non-fisiologi) yang (Depkes, RI., 2000).
No Parameter Hasil (%)
1 Kadar air 4,98
2 Kadar sari larut dalam air 12,17
3 Kadar sari larut dalam etanol 38,81
4 Kadar abu total 7,28
Kadar abu tidak larut asam untuk menunjukkan jumlah silikat, khususunya pasir
yang ada pada simplisia dengan cara melarutkan abu total dalam asam klorida
(WHO, 1998). Penetapan kadar abu pada simplisia daun sembukan menunjukkan
kadar abu total 7,28% dan kadar abu tidak larut asam 0,32%.
4.3 Hasil Skrining Fitokimia
Skrining fitokimia serbuk simplisia dan ekstrak etanol daun sembukan
dilakukan untuk manunjukkan golongan senyawa metabolit sekunder yang
terdapat didalamnya. Adapun pemeriksaan yang dilakukan terhadap simplisia dan
ekstrak etanol daun sembukan adalah pemeriksaan golongan senyawa alkaloid,
flavonoid, glikosida, saponin, tanin, dan steroid/triterpenoid. Hasil pemeriksaan
skrining fitokimia serbuk simplisia dan ekstrak etanol daun sembukan dapat dilihat
pada Tabel 4.2.
Tabel 4.2Hasil skrining fitokimia simplisia dan ekstrak etanol daun sembukan
No Skrining Hasil
Simplisia Ekstrak
1 Alkaloid - -
2 Flavonoid + +
3 Glikosida + +
4 Saponin + +
5 Tanin + +
6 Steroid/triterpenoid + +
Golongan flavonoid memberikan hasil yang positif ditandai dengan
penambahan serbuk magnesium dengan HCl pekat menjadi warna kuning atau
jingga. Uji identifikasi tanin menunjukkan hasil positif dengan penambahan
pereaksi FeCl3 1% terjadi warna biru kehitaman (Farnsworth, 1996). Adanya
glikosida ditandai dengan terbentuknya cincin ungu dengan pereaksi Molish. Pada
uji identifikasi saponin memberikan hasil positif dengan terbentuknya busa setelah
dikocok kuat-kuat selama 10 menit dan dengan penambahan 1 tetes HCl 2 N
buih/busa tidak hilang (Depkes, RI., 1995). Steroid/triterpenoid memberikan hasil
positif dengan terbentuknya warna hijau biru setelah ditambahkan pereaksi
Liebermann-Burchard (Harbone, 1987).
4.4 Hasil Pengujian Efek Antiinflamasi
Tikus uji dikelompokkan dalam 5 kelompok perlakuan, masing-masing
kelompok terdiri dari 5 ekor tikus yaitu kelompok kontrol yang diberikan suspensi
Na-CMC 0,5%, kelompok uji dengan 3 variasi dosis perlakuan suspensi EEDS
dosis 300 mg/kg bb, suspensi EEDS dosis 400 mg/kg bb, dan suspensi EEDS dosis
500 mg/kg bb dan kelompok pembanding yang diberikan natrium diklofenak dosis
4,5 mg/kg bb.
Tikus terlebih dahulu dipuasakan ±18 jam, kemudian tikus ditimbang
diberi tanda pada bagian ekor dan pergelangan kaki kanan tikus. Sebelum
masing-masing kelompok diberikan ekstrak etanol daun sembukan, volume kaki
tikusdiukur terlebih dahulu sebagai volume awal (Vo). Setelah itu masing-masing
kelompok diberikan ekstrak etanol daun sembukan yaitu kelompok I diberikan
mg/kg bb, III dan IV dan kelompok V masing-masing diberi suspensi EEDS dosis
300, 400, 500 mg/kg bb secara oral. Satu jam kemudian, masing-masing telapak
kaki tikus disuntikan secara intraplantar dengan 0,1 mL larutan λ-karagenan 1%.
Pengukuran dilakukan dengan menggunakan alat pletismometer dengn prinsip
pengukuran berdasarkan hukum Archhimedes, Setelah 30 menit, pengukuran
dilakukan dengan cara mencelupkan kaki tikus ke dalam sel pletismometer yang
berisi cairan khusus sampai larutan mencapai garis batas atas, dan pedal ditahan.
Dicatat angka pada monitor. Perubahan volume cairan yang terjadi dicatat sebagai
volume telapak kaki tikus (Vt). Pengukuran dilakukan setiap 30 menit selama 360
menit. Hasil pengukuran volume telapak kaki tikus dapat dilihat pada Lampiran 15
halaman 67 .
Perubahan volume kaki tikus, dapat dihitung persen radang pada kaki tikus.
Selanjutnya, dibuat grafik perubahan persen radang rata- rata kaki tikus.
Kelompok persen radang pada kaki tikus yang lebih kecil dari kelompok kontrol
menunjukkan bahwa bahan uji mampu menekan radang yang disebabkan oleh
karagenan. Hasil pengukuran persen radang yang terjadi dapat dilihat pada
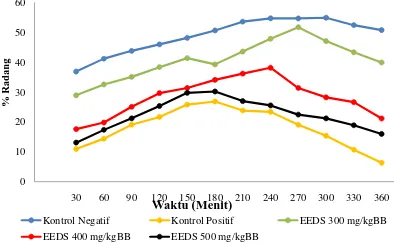
Gambar 4.1 Grafik persen radang rata-rata telapak kaki tikus tiap waktu pengamatan
Pada gambar 4.1 dapat dilihat bahwa suspensi natrium diklofenak 4,5 mg/kg bb
memiliki persen radang yang lebih kecil dari pada EEDS dosis 500, 400, dan 300
mg/kg bb, dan EEDS dosis 500 mg/kg bb mempunyai persen radang yang lebih
kecil daripada EEDS dosis 400 dan 300 mg/kg bb. Data persen radang dapat
dilihat pada Lampiran 16 halaman 69.
Pembentukan radang oleh karagenan menghasilkan peradangan akut, dan
tidak menyebabkan kerusakan jaringan, meskipun radang dapat bertahan selama
360 menit dan berangsur-angsur berkurang selama satu hari.Karagenan sebagai
penyebab radang dapat dipengaruhi oleh obat antiradang. Responnya terhadap obat
antiinflamasi lebih peka dibandingkan dengan iritan lainnya (Juheini, dkk., 1990).
Persentase radang kaki tikus yang lebih kecil dari kontrol menunjukkan
bahwa suspensi natrium diklofenak dan suspensi EEDS mampu menghambat
0
peradangan pada kaki tikus yang disebabkan karagenan. Kemampuan untuk
menghambat peradangan ini yang disebut dengan inhibisi radang dapat dilihat
pada Gambar 4.2
Gambar 4.2 Grafik persen inhibisi radang rata-rata telapak kaki tikus tiap waktu pengamatan
Pada gambar 4.2 dapat dilihat bahwa EEDS 300 mg/kg bb memiliki persen
hambatan radang yang lebih kecil dari EEDS 400, 500 mg/kg bb dan dengan
suspensi natrium diklofenak dosis 4,5 mg/kg bb, EEDS 400 mg/kg bb memiliki
persen hambatan radang yang lebih kecil dari EEDS 500 mg/kg bb dan dengan
suspensi natrium diklofenak 4,5 mg/kg bb, dan EEDS 500 mg/kg bb memiliki
persen hambatan radang yang lebih kecil dari suspensi natrium diklofenak dosis
4,5 mg/kg bb.
Data perubahan efek antiinflamasi yang diperoleh diolah dengan ANOVA
0
120 150 180 210 240 270 300 330 360
%
suspensi Na-CMC 0,5% sebagai pembanding negatif dan suspensi natrium
diklofenak sebagai pembanding positif. Analisis variansi secara SPPS pada menit
ke-30 sampai menit ke-360 menujukkan nilai signifikan atau taraf kepercayaan
0,000. Nilai ini menunjukkan perbedaan yang signifikan antara perlakuan karena
nilai tersebut lebih kecil dari 0,05 dengan tingkat kepercayaan 95%. Hasil dari uji
analisis variansi (ANOVA) persen radang dapat dilihat pada Lampiran 19 halaman
75.
Perhitungan selanjutnya yaitu dilakukan uji Duncan dengan menggunakan
program SPSS versi 18. Untuk melihat kelompok perlakuan mana yang memiliki
efek yang sama atau berbeda dan efek terkecil sampai efek yang terbesar antara
satu dengan yang lainnya sehingga diperoleh susunan kelompok yang berbeda
dilakukan uji Duncan. Pada uji Duncan ini, dilakukan untuk semua perlakuan dari
menit ke-30 sampai menit ke-360. Uji beda rata-rata > 0,05 menunjukkan bahwa
antara perlakuan tidak ada perbedaan yang signifikan dan sebaliknya bila uji beda
rata-rata < 0,05 menunjukkan terdapat perbedaan yang signifikan untuk semua
perlakuan dari menit ke-30 sampai menit ke-360. Hasil analisis metode Duncan
dapat dilihat pada Lampiran 20 halaman 79.
Analisis variansi terhadap perubahan volume radang digunakan untuk
melihat ada tidaknya perbedaan pengaruh obat uji yakni suspensi ekstrak daun
sembukan terhadap suspensi CMC 0,5% sebagai pembanding negatif dan suspensi
natrium diklofenak sebagai pembanding positif.
Berdasarkan hasil analisis variansi menunjukan perbedaan yang signifikan
(α < 0,05%) antar kelompok perlakuan pada menit ke-30 sampai menit ke-360
pengaruh yang berbeda nyata terhadap radang telapak kaki tikus yang disebabkan
oleh karagenan.
Untuk melihat kelompok perlakuan mana yang memiliki efek yang sama
atau berbeda dan efek terkecil sampai dengan yang terbesar antara yang satu
dengan yang lain sehingga diperoleh susunan kelompok yang berbeda dilakukan
dengan metode Duncan, uji beda rata-rata > 0,05 menunjukan bahwa atar
perlakuan tidak ada perbedaan yang bermakna dan sebaliknya bila uji beda
rata-rata < 0,05 nenunjukan terdapat perbedaan yang bermakna untuk semua perlakuan
dari menit ke-30 sampai menit ke-360.
Uji Duncan menit ke-30 menunjukan suspensi natrium diklofenak memiliki
perbedaan yang tidak signifikan dengan EEDS 500 mg/kg bb, tetapi memiliki
perbedaan yang signifikan dengan EEDS 300, 400 mg/kg bb dan dengan kontrol.
EEDS dosis 500 mg/kg bb memiliki perbedaan yang signifikan dengan EEDS
dosis 300, 400 mg/kg bb. EEDS 400 mg/kg bb memiliki perbedaan yang
signifikan dengan EEDS 300 mg/kg bb dengan kontrol. EEDS 300 mg/kg bb
memiliki perbedaan yang signifikan dengan kontrol.
Uji Duncan menit ke-60 menunjukan suspensi natrium diklofenak
menunjukan perbedaan yang tidak signifikan dengan EEDS 500 mg/kg bb tetapi
memiliki perbedaan yang signifikan dengan EEDS 400, 300 mg/kg bb. EEDS 500
Uji Duncan pada menit ke-90 sampai menit ke-210 menunjukan suspensi
natrium diklofenak memiliki perbedaan yang tidak signifikan dengan EEDS dosis
500, 400 mg/kg bb. EEDS dosis 500 mg/kg bb dan 400 mg/kg bb memiliki
perbedaan yang signifikan dengan EEDS dosis 300 mg/kg bb dan kontrol. EEDS
dosis 300 mg/kg bb memiliki perbedaan yang signifikan dengan kontrol.
Uji Duncan pada menit ke-240 menunjukan suspensi natrium diklofenak
memiliki perbedaan yang tidak signifikan dengan EEDS 500 mg/kg bb, tetapi
memiliki perbedaan yang signifikan dengan EEDS 400, 300 mg/kg bb dan dengan
kontrol. EEDS dosis 500 mg/kg bb memiliki perbedaan yang signifikan dengan
EEDS dosis 400,300 mg/kg bb. EEDS 400 mg/kg bb memiliki perbedaan yang
signifikan dengan EEDS 300 mg/kg bb dengan kontrol. EEDS 300 mg/kg bb
memiliki perbedaan yang signifikan dengan kontrol.
Uji Duncan pada menit ke-270 menunjukkan suspensi natrium diklofenak
memiliki perbedaan yang tidak signifikan dengan EEDS dosis 400 mg/kg bb, 500
mg/kg bb. EEDS dosis 500 mg/kg bb memiliki perbedaan yang tidak signifikan
dengan dosis 400 mg/kg bb tetapi memiliki perbedaan yang signifikan dengan
EEDS dosis 300 mg/kg bb dan kontrol. EEDS dosis 400 mg/ kg bb memiiki
perbedaan signifikan dengan EEDS dosis 300 mg/ kg bb dan kontrol. EEDS dosis
300 mg/kg bb memiliki perbedaan yang tidak signifikan dengan kontrol.
Uji Duncan pada menit ke-300 menunjukan suspensi natrium diklofenak
memiliki perbedaan yang tidak signifikan dengan EEDS dosis 500 mg/kg bb tetapi
memiliki perbedaan yang signifikan dengan EEDS dosiss 400, 300 mg/kg bb dan
kontrol. EEDS dosis 500 mg/kg bb memiliki perbedaan yang signifikan dengan
memimiliki perbedaan yang signifikan dengan EEDS dosis 300 mg/kg bb, EEDS
dosis 300 mg/kg bb memimiliki perbedaan yang tidak signifikan dengan kontrol.
Uji Duncan pada menit ke-330 sampai menit ke-360 menunjukan suspensi
natrium diklofenak menunjukan perbedaan yang tidak signifikan dengan EEDS
500 mg/kg bb tetapi memiliki perbedaan yang bermakna dengan EEDS 400 mg/kg
bb. EEDS 500 mg/kg bb memiliki perbedaan tidak signifikan dengan EEDS 400
mg/kg bb tetapi memiliki perbedaan yang signifikan dengan dosis 300 mg/kg bb
dan kontrol. EEDS 400 mg/kg bb memiliki perbedaan yang tidak signifikan
dengan EEDS 300 mg/kg bb dan kontrol. EEDS 300 mg/kg bb memiliki perbedaan
yang signifikan dengan kontrol.
Berdasarkan hasil pengujian tersebut maka dapat disimpulkan bahwa
EEDS dosis 500 mg/kg bb memiliki efek antiinflamasi yang bagus dan mendekati
obat pembanding natrium diklofenak 4,5 mg/kg bb jika dibandingkan dosis lainnya
baik dilihat dari nilai persen radang dan persen inhibisi radang antara individu
maupun secara kelompok. Terlepas pada dosis berapa EEDS yang memiliki efek
antiinflamasi, penelitian ini telah membuktikan secara farmakologis bahwa hewan
ini memiliki efek antiinflamasi.
Berdasarkan hasil skrining fitokimia yang telah dilakukan bahwa daun
sembukan mengandung metabolit sekunder yang dapat berkhasiat sebagai
pada lintasan siklooksigenase (Robinson, 1995). Flavonoid sebagai antiinflamasi
terjadi melalui efek penghambatan jalur metabolisme asam arakidonat, jalur
siklooksigenase, jalur lipooksigenase, pembentukan prostaglandin, pelepasan
histamin. Senyawa flavonoid yang dapat berfungsi sebagai antiinflamasi adalah
toksifolin, biazilin, haemaktosilin, gosipin, prosianonidin, nepritin (Carlo, dkk.,
1999), sedangkan aktivitas farmakologi saponin yang telah dilaporkan memiliki
aktifitas sebagai antiinflamasi, antibiotik, antifungi, antivirus, hepatoprotektor
serta antiulcer (Fitriyani, dkk., 2011), sehingga diduga flavonoid, dan saponin
yang memberikan efek antiinflamasi.
Berdasarkan uraian di atas dapat disimpulkan bahwa ekstrak etanol daun
sembukan cukup efektif menghambat radang. Hal ini memberikan gambaran atas
potensi ekstrak etanol daun sembukan yang dapat dikembangkan menjadi produk
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan dapat disimpulkan:
a. Hasil karakteristik serbuk simplisia daun sembukan diperoleh kadar air 4,98%,
kadar sari larut air 12,17%, kadar sari larut etanol 38,81%, kadar abu total
7,28%, kadar abu tidak larut asam 0,32%.
b. Hasil pemeriksaan golongan senyawa metabolit sekunder yang terdapat pada
simplisia daun sembukan dan ekstrak etanol daun sembukan adalah flavonoid,
glikosida, tanin, steroid/triterpenoid dan saponin.
c. Ekstrak etanol daun sembukan dosis 300 mg/kg bb, 400 mg/kg bb memiliki efek antiinflamasi dan dosis 500 mg/kg bb memiliki efek antiinflamasi yang
mirip dengan natrium diklofenak terhadap radang telapak kaki tikus yang
diinduksi dengan larutan λ-karagenan 1% secara intraplantar.
5.2 Saran
Disarankan kepada peneliti selanjutnya untuk menguji efek antiinflamasi
dengan menggunakan metode yang lain dari ekstrak etanol daun sembukan
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan 2.1.1 Morfologi tumbuhan
Daun sembukan (kentutan) termasuk herba tahunan berbatang memanjang,
berkayu pada bagian pangkal, tumbuh liar di lapangan terbuka atau tepi sungai,
dan melilit di pagar rumah. Daun sembukan memiliki daun tunggal, bertangkai
sekitar 1-5 cm, letaknya berhadapan, dan bentuknya bulat telur atau lonjong.
Pangkal daun berbentuk jantung, ujung runcing tetapi rata, panjang daun 3-12 cm
dan lebar 2-5 cm dan tulang daun menyirip (Mangoting, dkk., 2005). Tumbuhan
sembukan memiliki bunga yang tersusun dalam malai sepanjang 2-12 cm, bentuk
bunga corong, mahkota bunga putih hingga kuning pucat dengan semburat ungu
kemerahan gelap di bagian tengah, panjang mahkota 1 cm dan berbentuk silinder.
2.1.2Klasifikasitumbuhan
Klasifikasi tumbuhan sembukan adalah sebagai berikut:
Kerajaan : Planta
Subdivisi : Angiospermae
Divisi : Spermatophyta
Kelas : Dicotyledonae
Bangsa : Rubiales
Suku : Rubiaceae
Marga : Paederia
Nama daerah dari daun sembukan adalah sekentut, daun kentut, sembukan
(Jawa), dandang king, (Melayu), kahitutan, kasembukan (Madura), gumisiki
(Ternate) (Mangoting, dkk., 2005). Nama asing dari daun sembukan adalah
Chinese fevervine (Inggris), Ji shi Teng (Cina) (Hariana, 2011).
2.1.3 Kandungan kimia tumbuhan
Kandungan kimia dari tumbuhan sembukan adalah asperulosida,
skandosida, paederosida, deasetilasperulosida, asam paederosida, arbutin, asam
oleonik, dan gama sitosterol. Daun sembukan memiliki bau yang tidak enak dan
tidak bersifat permanen, karena apabila daun direbus atau dikukus aromanya akan
berkurang. Bau yang tidak enak dari daun sembukan disebabkan oleh kandungan
kimia metil merkaptan yang terdapat di daun dan batang (Trubus, 2013).
2.1.4 Kegunaan tumbuhan
Daun sembukan dapat digunakan sebagai obat tradisional yaitu digunakan
sebagai antispasmodik (pengurang kejang otot di usus), diare, rematik dan
antiradang. Daun sembukan selain digunakan sebagai obat tradisional digunakan
juga sebagai sayur, antara lain sebagai bahan untuk membuat pepes oncom, botok,
trancam, dan pelas (Trubus, 2013).
dan simplisia pelikan (mineral). Simplisia nabati adalah simplisia(Depkes, RI.,
2000).
2.2.2 Ekstrak
Ekstrak adalah sediaan yang dapat berupa sediaan kental, kering dan cair
yang diperoleh dengan mengekstraksi senyawa aktif dari simplisia nabati atau
simplisia hewani menggunakan pelarut yang sesuai (Depkes, RI., 2000).
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan menggunakan suatu
pelarut cair. Senyawa aktif yang terdapat dalam simplisia dapat digolongkan
kedalam golongan minyak atsiri, alkaloid, flavonoid dan lain-lain. Diketahui
senyawa aktif yang dikandung simplisia akan mempermudah pemilihan pelarut
dan cara ekstraksi yang tepat(Depkes, RI., 2000).
2.2.3 Metode ekstraksi
Metode ekstraksi dengan menggunakan pelarut dapat dibagi ke dalam dua
cara yaitu :
1. Cara dingin
a. Maserasi
Maserasi adalah proses pengekstraksian simplisia dengan menggunakan
pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur
ruangan (kamar). Secara teknologi termasuk ekstraksi dengan prinsip metode
pencapaian konsentrasi pada keseimbangan. Maserasi kinetik bearti dilakukan
pengadukan yang kontinu (terus-menerus). Remaserasi bearti dilakukan
pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama
b. Perkolasi
Perkolasi adalah proses pengekstraksian dengan pelarut yang selalu baru
sampai sempurna (exhaustive extraction) yang umumnya dilakukan pada
temperature ruangan. Proses terdiri dari tahapan pengembangan bahan, tahap
maserasi antara, tahap perkolasi sebenarnya (penetasan/penampungan ekstrak)
terus-menerus sampai diperoleh ekstrak (perkolat) yang jumlahnya 1-5 kali bahan
(Depkes, RI., 2000).
Cara panas
a. Refluks
Refluks adalah proses pengekstraksian dengan pelarut pada temperatur titik
didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan
dengan adanya pendingin balik. Umumnya dilakukan pengulangan proses pada
residu pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna
(Depkes, RI., 2000).
b. Soxletasi
Soxletasi adalah prosespengekstraksian menggunakan pelarut yang selalu
baru yang umumnya dilakukan dengan alat yang disebut Soxhlet sehingga terjadi
ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin
balik (Depkes, RI., 2000).
d. Infundasi
Infundasi adalah proses penyarian dengan pemanasaan menggunakan
pelarut air pada temperatur 900C selama 15 menit (Depkes, RI., 2000).
e. Dekoktasi
Dekoktasi adalah proses penyarian dengan pemanasan menggunakan
pelarut air pada temperatur 900C selama 30 menit (Depkes,RI., 2000).
2.3 Inflamasi
2.3.1 Definisi inflamasi
Inflamasi adalah respon protektif setempat yang ditimbulkan oleh cedera
atau kerusakan jaringan, yang berfungsi menghancurkan, mengurangi, atau
mengurung suatu agen pencedera maupun jaringan yang cedera itu. Pada bentuk
akut ditandai oleh tanda klasik yaitu: nyeri (dolor), panas (kalor), kemerahan
(rubor), bengkak (tumor), dan hilangnya fungsi (fungsiolesa). Secara histologis,
menyangkut rangkaian kejadian yang rumit, yaitu mencakup dilatasi arteri, kapiler
dan venula, disertai peningkatan permeabilitas aliran darah, eksudasi cairan,
termasuk protein plasma dan migrasi leukosit kedalam fokus peradangan. Respon
ini disebabkan oleh pembebasan mediator (histamin, serotonin, prostaglandin,
kinin) yang berperan mengatur, mengaktifkan sel-sel, baik dari darah maupun
jaringan dan kemudian dapat timbul gejala dari jaringan yang cidera (Soenarto,
2.3.2 Mediator inflamasi a. Histamin
Histamin merupakan mediator pertama yang dilepaskan dan segera muncul
dalam beberapa detik setelah diinduksi dan berperan meningkatkan permeabilitas
kapiler. Histamin merupakan produk dekarboksilase asam amino histidin yang
terdapat dalam semua jaringan tubuh. Konsentrasi tertinggi terdapat dalam paru,
kulit dan saluran cerna terutama pada sel mast, sedangkan leukosit dan basofil
adalah dalam bentuk tak aktif secara biologik tersimpan dan terikat pada heparin
dan protein basa. Histamin akan dibebaskan dari sel tersebut pada reaksi
hipersensitivitas, kerusakan sel (misalnya pada luka) serta akibat senyawa kimia
pembebas histamin (Mutschler, 1999).
b. Bradikinin
Bradikinin bekerja pada pembuluh darah dengan merangsang pelepasan
prostaksiklin, nitrit oksida ataupun faktor hiperpolarisasi turunan endothelium.
Bradikinin menyebabkan kontraksi otot polos, meningkatkan permeabilitas
vaskuler dan merupakan mediator penting dalam nyeri (Nugroho, 2012).
c. Serotonin
serotonin (5-hidroksitriptamin) berasal dari asam amino esensial triptamin
yang dihasilkan melalui reaksi hidroksilasi dan dekarboksilasi. Serotonin terdapat
d. Prostaglandin
Prostaglandin hanya berperan pada nyeri yang berkaitan dengan kerusakan
jaringan atau radang. Prostaglandin sebagai penyebab radang bekerja lemah,
namun berpotensi kuat setelah bergabung dengan mediator atau substansi lainnya
yang dibebaskan secara lokal, seperti histamin, serotonin dan leukotrin.
Prostaglandin dapat menimbulkan vasodilatasi dan meningkatkan aliran darah
lokal (Ganiswarna, 1995).
e. Leukotrien
Leukotrien dihasilkan dari subtrat asam arakidonat melalui jalur
lipoksigenase yang terdapat di paru-paru, sel mast platelet, dan sel darah putih
(Nugroho, 2012).
2.3.3 Gejala-gejala terjadinya respon inflamasi
a. Kemerahan (rubor)
Kemerahan (rubor) merupakan hal pertama yang terlihat di daerah yang
mengalami inflamasi akut. Waktu reaksi inflamasi mulai timbul maka arteri yang
mensuplai darah ke daerah tersebut bedilatasi, dengan demikian lebih banyak
darah mengalir ke dalam mikrosirkulasi lokal. Pembuluh-pembuluh darah yang
sebelumnya kosong atau sebagian saja meregang dengan cepat dan terisi penuh
oleh darah. Keadaan ini dinamakan hiperemia dan menyebabkan warna merah
lokal karena inflamasi akut. Timbulnya hiperemia pada permulaan reaksi inflamasi
diatur oleh tubuh melalui pengeluaran mediator, seperti histamin (Price dan
b. Panas (kalor)
Panas (kalor) terjadi karena aliran darah banyak tersuplai ke jaringan luka
pada proses peradangan bersama dengan kemerahan dari reaksi inflamasi akut.
Daerah inflamasi pada kulit menjadi lebih panas dari daerah sekitarnya, sebab
darah dengan suhu 370C yang disalurkan ke permukaan daerah yang terkena
inflamasi lebih banyak disalurkan daripada ke daerah normal (Price dan Wilson,
1995).
c. Rasa Nyeri (dolor)
Rasa nyeri (dolor) ditimbulkan karena adanya kerusakan jaringan yang
melepaskan mediator nyeri yang akan merangsang reseptor nyeri. Mediator
tersebut adalah histamin, serotonin, asetilkolin dan bradikinin (Nugroho, 2012).
d. Pembengkakan (tumor)
Pembengkakan (tumor) terjadi akibat adanya peningkatan permeabilitas
dinding kapiler serta pengiriman cairan dan sel-sel dari sirkulasi darah ke jaringan
yang cidera. Dinding kapiler tersebut menjadi lebih permeabel dan lebih mudah
dilalui oleh leukosit dan protein terutama albumin, yang diikuti oleh molekul yang
lebih besar sehingga plasma jaringan mengandung lebih banyak protein daripada
biasanya, yang kemudian meninggalkan kapiler dan masuk kedalam jaringan
sehingga menyebaban jaringan menjadi bengkak (Price dan Wilson, 1995).
yang hebat secara fisik mengakibatkan berkurangnya gerak jaringan (Price dan
Wilson, 1995).
2.3.4 Mekanisme terjadinya inflamasi
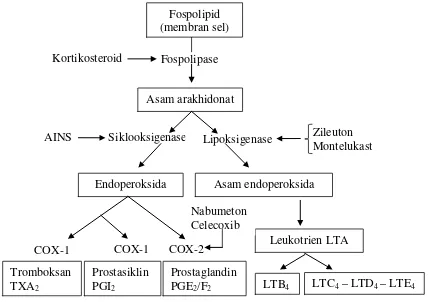
Proses inflamasi dimulai dari stimulus yang akan mengakibatkan
kerusakan sel, sebagai reaksi terhadap kerusakan sel maka sel tersebut akan
melepaskan beberapa fosfolipid salah satunya adalah asam arakidonat. Senyawa
ini merupakan mediator radang yang merupakan komponen utama lipid dan hanya
terdapat dalam keadaan bebas dengan jumlah kecil dan sebagian besar berada
dalam fosfolipid membran sel. Enzim fosfolipase diaktivasi untuk mengubah
fosfolipid menjadi asam arakidonat pada membran sel yang mengalami kerusakan
akibat suatu rangsangan. Asam arakidonat yang bebas akan diaktifkan oleh enzim
lipooksigenase dan siklooksigenase, kemudian enzim tersebut akan merubah asam
arakidonat ke dalam bentuk yang tidak stabil (hidroperoksida dan endoperoksida)
yang selanjutnya dimetabolisme menjadi leukotrien, prostaglandin, prostasiklin
dan tromboksan (Katzung, 2006).
Jalur siklooksigenase menghasilkan Tromboksan A2 (TXA2)sebagai
pengagregasi trombosit dan vasokontriktor yang merupakan produk utama
prostaglandin dalam trombosit serta prostaksiklin yang merupakan suatu
vasodilator dan inhibitor agregasi trombosit. Jalur siklooksigenase juga
menghasilkan PGD2 yang merupakan metabolit utama jalur siklooksigenase dalam
sel mast, bersama dengan prostaglandin E2 (PGE2) menyebabkan vasodilatasi dan
meningkatkan pembentukan edem. Prostaglandin juga berperan dalam patogenesis
nyeri terhadap berbagai rangsangan dan berinteraksi dengan sitokin yang
menyebabkan demam (Robbins, 2007).
Jalur lipoksigenase merupakan enzim yang memetabolisme asam
arakhidonat yang terdapat dalam neutrofil, selain itu enzim ini menghasilkan
leukotrien. Leukotrien pertama yang dihasilkan disebut leukotrien A4 (LTA4) yang
selanjutnya akan menjadi LTB4 melalui hidrolisis enzimatik. LTB4 merupakan
agen kemotaksis dan menyebabkan agregasi neutrofil. LTC4 selanjutnya akan
menjadi LTD4 dan LTE4 yang menyebabkan vasodilataasi dan menghambat
kemotaksis neotrofil (Robbins, 2007). Mekanisme terjadinya inflamasi dapat
dilihat pada Gambar 2.1
Fospolipid (membran sel)
Fospolipase
Asam arakhidonat
Siklooksigenase Lipoksigenase
Endoperoksida Asam endoperoksida
COX-1 COX-1 COX-2 Leukotrien LTA
AINS
Kortikosteroid
Zileuton Montelukast
2.4 Obat Antiinflamasi
Obat antiinflamasi adalah golongan obat yang memiliki aktivitas menekan
atau mengurangi peradangan. Berdasarkan mekanisme kerjanya obat antiinflamsi
terbagi menjadi dua golongan. Golongan pertama adalah golongan obat
antiinflamsi steroid dan golongan kedua yaitu golongan obat antiinflamasi
nonsteroid (AINS).
2.4.1 Obat antiinflamasi golongan steroid
Obat antiinflamasi steroid bekerja menghambat sintesis prostaglandin
dengan cara amenghambat enzim fosfolipase, sehingga fosfolipid yang berada
padamembran sel tidak dapat diubah menjadi asam arakhidonat, akibatnya
prostaglandin tidak akan terbentuk dan radang tidak ada (Tjay dan Rahardja,
2013).
2.4.2 Obat antiinflamasi golongan non steroid
Antiinflamasi nonsteroid merupakan obat antiinflamasi yang paling banyak
digunakan, memiliki tiga macam efek farmakologi yaitu antiinflamsi, analgetik
dan antipiretik. Obat ini bereaksi dengan menghambat enzim siklooksigenase,
selanjutnya terjadi penghambatan pada produksi prostaglandin dan tromboksan.
Obat AINS generasi awal menghambat baik pada COX-1 dan COX-2, bahkan
lebih dominan menghambat COX-1 yang dapat memberikan efek samping iritasi
lambung. Perkembangan berikutnya diarahkan obat AINS yang bekerja lebih
selektif terhadap COX-2 yang terfokus pada sel inflamasi (Nugroho, 2012).
Efek antiinflamasi berkaitan dengan penghambatan pada manifestasi
diperantarai oleh mediator-mediator yang merupakan produk dari aksi COX-2.
AINS menghambat COX dan menurunkan produksi vasodilator prostaglandin
(PGE2 dan PGI2) sehingga menurunkan vasodilatasi dan menurunkan edem yang
terjadi (Nugroho, 2012).
2.4.2.1 Natrium Diklofenak
Natrium diklofenak merupaka derivat fenilasetat yang termasuk NSAID
yang daya antiradangnya paling kuat dengan efek samping yang kurang
dibandingkan dengan oabt lainnya (seperti indometasin, piroksikam) (Tjay dan
Rahardja, 2013).
Absopsi obat ini melalui saluran cerna berlangsung cepat dan lengkap yang
terikat 99% pada protein plasma dan mengalami efek lintas awal (first-pass)
sebesar 40-50%, memiliki waktu paruh singkat yakni 1-3 jam, natrium diklofenak
diakumulasi dicairan sinovilia yang menjelaskan efek terapi di sendi jauh lebih
panjang waktu paruh obat tersebut. Efek samping yang lazim terjadi ialah
mual,gastritis, eritema kulit, dan sakit kepala. Dosis orang dewasa 100-150 mg
sehari terbagi 2 atau 3 dosis (Wilmana dan Gan, 2007).
2.5 Metode Uji Antiinflamasi
a. Metode pembentukan udem buatan
kaolin, ragi dan dekstran. Iritan yang umum digunakan dan memiliki kepekaan
yang tinggi adalah karagenan (Vogel, 2008).
b. Metode pembentukan eritema
Metode ini berdasarkan pengamatan secara visual terhadap eritema pada
kulit hewan yang dicukur bulunya. Marmot secara kimiawi dihilangkan bulunya
dengan suspensi barium sulfat, 20 menit kemudian dibersihkan dengan air hangat,
satu hari kemudian senyawa uji disuspensikan dan setengah dosisnya diberikan 30
menit sebelum pemaparan UV, setengahnya lagi setelah 2 menit berjalan
pemaparan UV. Eritema dibentuk akibat iritasi sinar UV berjarak 20 cm diatas
marmot. Eritema dinilai 2 dan 4 jam setelah pemaparan (Vogel, 2008).
c. Induksi asam asetat
Metode ini bertujuan untuk mengevaluasi aktivitas inhibisi obat terhadap
peningkatan permeabilitas vascular yang diinduksi oleh asam asetat secara
intraperitoneal. Sejumlah pewarna (Evan’s Blue 10%) disuntikkan secara
intravena. Aktivitas inhibisi obat uji terhadap peningkatan permeabilitas vaskular
ditunjukkan dengan kemampuan obat uji dalam mengurangi konsentrasi pewarna
yang menempel dalam ruang abdomen yang disuntikkan sesaat setelah induksi
asam asetat (Sularkar, 2008).
d. Induksi xylene pada udem daun telinga
Hewan uji diberikan obat, kemudian diinduksi xylene dengan mikropipet
pada kedua permukaan daun telinga kanannya dan telinga kiri digunakan sebagai
kontrol. Parameter yang diukur pada metode ini ada dua yaitu ketebalan dan bobot
dari daun telinga hewan uji. Ketebalan daun telinga hewan uji yang telah diinduksi
dengan telinga kiri. Jika menggunakan parameter bobot daun telinga, maka daun
telinga hewan uji dipitong dan ditimbang, kemudian dibandingkan beratnya
dengan telinga kiri (Sularkar, 2008).
e. Induksi asam arakhidonat pada udem daun telinga kiri.
Metode yang digunakan pada metode ini hampir sama dengan metode
induksi xylene, hanya saja penginduksi yang digunakan adalah asam arakhidonat
yang diberikan secara topikal pada kedua permukaan daun telinga kanan hewan uji
(Sularkar, 2008).
f. Induksi karagenan
Induksi udem dilakukan pada telapak kaki hewan uji. Dalam hal ini
disuntikan suspensi karagenan secara intraplantar dan obat uji diberikan secra oral.
Volume udem kaki diukur dengan alat pletismometer. Aktivitas inflamasi obat uji
ditunjukkan oleh kemampuan obat uji mengurangi udem yang diinduksi pada
telapak kaki hewan uji (Sularkar, 2008).
g. Induksi histamin
Metode yang digunakan hampir sama dengan metode induksi karagenan,
hanya saja penginduksi yang digunakan adalah larutan histamin 1% (Sularkar,
2008).