ABSTRACT
THE ADSORPTION STUDY OF DIVALENT METALS ION Ca2+, Cu2+, AND Cd2+ IN SOLUTIONS USING ALGAE BIOMASS Dunaliella sp
By
Widya Afriliani Wijaya
In this research, it has been performed adsorption process of Ca2+, Cu2+, and Cd2+ ions by the use of algae biomass Dunaliella sp. Several variables were evaluated, these include dosages of algae biomass as adsorbent, pHs, interaction times, and the initial concentration of ions which was interacted with adsorbent and the adsorption process used in this research was batch process. Algae biomass of Dunaliella sp was characterized by spectrophotometer infrared (IR) and concentration of ions was analyzed using absorption atomic spectrophotometer (AAS). Optimum condition from adsorption process of Ca2+, Cu2+, and Cd2+ ions using algae biomass Dunaliella sp was obtained at pH 4. Adsorption data of experiments were used to determine the adsorption kinetics and adsorption isotherm. Adsorption kinetics for Ca2+, Cu2+, and Cd2+ ions follows pseudo order 2 with rate constants (g mg-1 min-1) of 0.28, 1.25 and 2.10 for Ca2+, Cu2+ and Cd2+, respectively. Adsorption isotherm of Ca2+, Cu2+, and Cd2+ ions using Dunaliella sp obeys Langmuir adsorption isotherm with adsorption capacity (mg g-1) of 8.35, 16.76 and 43.23 for Ca2+, Cu2+ and Cd2+, respectively.
.
ABSTRAK
STUDI ADSORPSI ION-ION LOGAM DIVALEN Ca2+, Cu2+, DAN Cd2+ DALAM LARUTAN OLEH BIOMASSA ALGA Dunaliella sp
Oleh
Widya Afriliani Wijaya
Pada penelitian ini telah dilakukan uji adsorpsi ion Ca2+, Cu2+, dan Cd2+ pada biomassa alga Dunaliella sp. Variabel-variabel yang dikaji dalam penelitian ini meliputi dosis biomassa alga sebagai adsorben, pH, dan waktu interaksi optimum serta konsentrasi awal logam yang diinteraksikan dengan adsorben. Adsorpsi ion Ca2+, Cu2+, dan Cd2+ dengan biomassa alga dilakukan menggunakan metode batch. Biomassa alga Dunaliella dikarakterisasi menggunakan spektofotometer inframerah (IR) dan kadar ion logam yang terserap dianalisis dengan spektrofotometer serapan atom (SSA). Proses adsorpsi ion Ca2+, Cu2+, dan Cd2+ pada biomassa alga Dunaliella sp optimum pada pH 4. Data adsorpsi dianalisis untuk menentukan kinetika dan isoterm adsorpsi. Kinetika adsorpsi ion Ca2+, Cu2+, dan Cd2+ cenderung mengikuti model kinetika orde 2 dengan konstanta laju untuk ion Ca2+, Cu2+, dan Cd2+ masing-masing sebesar 0,28; 1,25; 2,10 g mg-1 menit-1. Isoterm adsorpsi ion Ca2+, Cu2+, dan Cd2+ dengan biomassa Dunaliella sp cenderung mengikuti model isoterm adsorpsi Langmuir dengan kapasitas adsorpsi ion Ca2+, Cu2+, dan Cd2+ masing-masing 8,35; 16,76; 43,23 mg g-1.
STUDI ADSORPSI ION-ION LOGAM DIVALEN Ca2+, Cu2+, DAN Cd2+ DALAM LARUTAN OLEH
BIOMASSA ALGA Dunaliella sp
Oleh
WIDYA AFRILIANI WIJAYA
Skripsi
Sebagai Salah Satu Syarat Untuk Mencapai Gelar SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
STUDI ADSORPSI ION-ION LOGAM DIVALEN Ca2+, Cu2+, DAN Cd2+ DALAM LARUTAN OLEH
BIOMASSA ALGA Dunaliella sp (Skripsi)
Oleh
WIDYA AFRILIANI WIJAYA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Lampung, pada tanggal 6 April
1991, sebagai anak kedua dari tiga bersaudara, putri dari
Turino dan Yulia Siswati.
Jenjang pendidikan diawali dari Sekolah Dasar (SD) di SD
Negeri 1 Beringin Raya diselesaikan pada tahun 2003. Sekolah
Menengah Pertama (SMP) di SMP Negeri 2 Bandar Lampung diselesaikan pada
tahun 2006, dan Sekolah Menengah Atas (SMA) di SMA Negeri 2 Bandar
Lampung diselesaikan pada tahun 2009. Tahun 2010, penulis terdaftar sebagai
Mahasiswa Jurusan Kimia FMIPA Unila melalui jalur SNMPTN (Seleksi
Nasional Masuk Perguruan Tinggi Negeri).
Pada tahun 2013 Penulis melakukan Praktek Kerja Lapangan di Laboratorium
Kimia Anorganik Fisik Jurusan Kimia FMIPA Unila di Bandar Lampung. Selama
menjadi mahasiswa penulis pernah menjadi asisten praktikum Kimia Dasar I,
Kimia Anorganik I, dan Kimia Anorganik II. Penulis juga aktif di Himpunan
Mahasiswa Kimia (HIMAKI) FMIPA Unila sebagai anggota Kader Muda Himaki
(KAMI) kepengurusan 2010/2011, anggota bidang Kaderisasi Dan Pengembangan
Organisasi (KPO) kepengurusan 2011/2012 dan sekretaris bidang Sosial
MOTO
Sesungguhnya Setelah Kesulitan Ada Kemudahan
(Q.S. Al-Insyirah:6)
Maka Nikmat Tuhanmu Yang Manakah Yang Kamu
Dustakan?
(Q.S. Ar-Rahman 77)
Tuhanmu Tidak Memberikan Beban Melebihi Batas
Kemampuanmu
(Q.S. Al-Baqarah:286)
Kupersembahkan karya sederhana ini kepada :
ALLAH S.W.T
Kedua orang tuaku,
Mama dan Papa yang selalu memberikan rasa cinta
dan kasih sayangnya serta yang selalu mendukungku
Kakak dan Adikku tersayang
Meriza Sastra Wijaya dan Devilia Sistantri Wijaya
Seluruh sahabat terbaikku
ix
SANWACANA
Assalamu’alaikum Wr. Wb.
Alhamdulillah puji dan syukur kehadirat Allah SWT karena atas segala rahmat dan karunia-Nya Penulis dapat menyelesaikan skripsi ini. Shalawat serta salam tidak lupa tercurah kepada Nabi Muhammad SAW beserta sahabat dan
keluarganya.
Skripsi dengan judul "STUDI ADSORPSI ION-ION LOGAM DIVALEN Ca2+, Cu2+, DAN Cd2+ DALAM LARUTAN OLEH BIOMASSA ALGA Dunaliella sp" adalah salah satu syarat untuk memperoleh gelar Sarjana Sains pada Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung.
Dalam pelaksanaan dan penulisan skripsi ini tidak lepas dari kesulitan dan rintangan, namun itu semua dapat penulis lalui berkat rahmat dan ridha Allah SWT serta bantuan dan dorongan semangat dari orang-orang yang hadir di kehidupan penulis. Dalam kesempatan ini, penulis menyampaikan terima kasih setulus-tulusnya kepada :
x
kesabaran dalam membimbing penulis dalam menyelesaikan skripsi ini dan selama menjadi mahasiswa.
2. Bapak Prof. Suharso, Ph.D., selaku pembimbing II penelitian dan selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam yang telah memberikan ilmu, kritik, saran dan arahan yang diberikan kepada penulis sehingga skripsi ini terselesaikan dengan baik.
3. Bapak Dr. Rudy T. M. Situmeang, M. Sc., selaku penguji penelitian dan pembimbing akademik yang telah memberikan ilmu, perhatian, motivasi, nasehat, kritik, serta saran kepada penulis sehingga skripsi ini terselesaikan dengan baik.
4. Bapak Dr. Eng. Suripto Dwi Yuwono, M.T., selaku ketua Jurusan Kimia FMIPA Unila.
5. Seluruh dosen FMIPA Unila yang telah mendidik dan memberikan ilmu pengetahuan yang sangat berguna kepada penulis selama kuliah.
6. Kedua orang tuaku yang sangat aku sayangi. Mamaku Yulia Siswati yang menjadi sahabatku. Mama yang selalu memberikan kasih sayang, cinta, semangat, harapan, dan doa yang tidak pernah kunjung henti agar anakmu selalu mendapatkan kesuksesan dan kebahagiaan. Papaku Turino yang tak pernah putus asa berjuang dan memberikan motivasi serta doa. Terima kasih untuk selama ini atas kebahagiaan, doa, dan semangat yang tak pernah putus yang Mama dan Papa berikan ke wiwid. Semoga Mama dan Papa selalu diberikan kebahagiaan. Kalian amat sangat wiwid sayangi.
xi
8. Seluruh keluarga besarku yang selalu mendukungku dan memberikan motivasi untukku.
9. Sahabat-sahabat terbaikku, Putri Heriyani Utami, Lailatul Hasanah, Indah Aprianti, dan Fauziyyah Mu’min Shiddiq. Terima kasih atas kebersamaan,
saran, motivasi, tawa, duka, dan segala hal yang selalu kita rasakan bersama. Semangat untuk kita semua guys, sukses untuk kita. Gomawoyo. Semoga Allah SWT selalu melindungi kita.
10. Teman seperjuangan penelitianku Sevina Silvi dan Agung Supriyanto, terima kasih atas segala bantuan dan dukungannya. Sukses untuk kita dan semoga Allah membalas segala bentuk kebaikan kalian.
11. Teman-teman seperjuangan Lab Anorganik, Silvana Maya Pratiwi, Wynda Dwi Anggraini, S. Si., Hapin Afriyani, S. Si., Rini Handayani Rotua P, Martha Selvina Gultom terima kasih untuk kebersamaan dan keceriaan kalian selama menjalankan penelitian dan perkuliahan. Tetap semangat kawan, sukses selalu untuk kita semua.
xii
dan jangan menyerah, perjuangan kita masih panjang, sukses selalu untuk kita semua.
13. Keluarga Besar Kimia FMIPA Unila 2008-2013, terima kasih atas segala dukungannya.
14. Mba Liza Apriliya S, S.Si selaku Laboran Laboratorium Kimia Anorganik Fisik yang telah banyak membantu penulis untuk mendapatkan zat dan bahan kimia, serta terima kasih juga kepada Mba Nora dan Pak Ghani, terimakasih atas segala bantuannya.
15. Semua pihak yang telah membantu dan mendukung penulis dalam penyusunan skripsi ini.
Akhir kata, Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Penulis berharap semoga skripsi yang sederhana ini dapat berguna dan bermanfaat bagi kita semua. Aamiin.
Bandar Lampung, 20 Agustus 2014 Penulis
DAFTAR ISI
Halaman
DAFTAR TABEL ... xv
DAFTAR GAMBAR ...xvii
I. PENDAHULUAN A. Latar Belakang ... 1
B. Tujuan Penelitian ... 3
C. Manfaat Penelitian ... 4
II. TINJAUAN PUSTAKA A. Logam ... 5
1. Kalsium (Ca) ... 8
2. Tembaga (Cu) ... 10
3. Kadmium (Cd) ... 12
B. Adsorpsi ... 13
1. Kinetika Adsorpsi ... 16
2. Kapasitas Adsorpsi ... 19
i. Model Adsorpsi Langmuir ... 19
ii. Model Adsorpsi Freundlich ... 20
C. Biomassa Alga Dunaliella sp ... 22
D. Karakterisasi ... 25
1. Spektrofotometer inframerah (IR) ... 25
xiv
III. METODOLOGI PENELITIAN
A. Waktu dan Tempat Penelitian ... 30
B. Alat dan Bahan Penelitian ... 30
C. Prosedur Penelitian ... 31
1. Penyiapan Biomassa Alga Dunaliella sp ... 31
2. Karakterisasi Material ... 31
3. Uji Adsorpsi ... 31
a. Penentuan Dosis Optimum Biomassa Alga ... 31
b. Penentuan pH Optimum ... 32
c. Penentuan Waktu Optimum ... 32
d. Penentuan Konsentrasi Logam Optimum ... 32
IV. HASIL DAN PEMBAHASAN A. Karakterisasi Material ... 34
B. Uji Adsorpsi ... 35
1. Penentuan Dosis Optimum Alga ... 35
2. Penentuan pH Optimum ... 37
3. Penentuan Waktu Optimum ... 39
4. Penentuan Konsentrasi Optimum ... 43
V. SIMPULAN DAN SARAN A. Simpulan ... 51
B. Saran ... 52
DAFTAR PUSTAKA ... 53
DAFTAR TABEL
Tabel Halaman
1. Klasifikasi asam dan basa ... 8 2. Serapan inframerah beberapa gugus fungsi senyawa organik ... 26 3. Parameter kinetika adsorpsi ion Ca2+, Cu2+, dan Cd2+ oleh biomassa alga
Dunaliella sp pada pH 4, konsentrasi ion logam 100 mg L-1, dan temperatur 27°C ... 41 4. Parameter isoterm adsorpsi ion Ca2+, Cu2+, dan Cd2+ terhadap biomassa alga
Dunaliella sp pada pH 4, waktu interaksi 45 menit, dan temperatur
27°C ... 44 waktu interaksi berbeda ... 63
8. Adsorpsi ion Ca2+, Cu2+, dan Cd2+ pada biomassa alga Dunaliella sp dengan konsentrasi berbeda ... 64
9. Data kinetika pseudo orde satu pada biomassa alga Dunaliella sp terhadap ion Ca2+ ... 65 10. Data kinetika pseudo orde dua pada biomassa alga Dunaliella sp terhadap
ion Ca2+ ... 65 11. Data kinetika pseudo orde satu pada biomassa alga Dunaliella sp terhadap
ion Cu2+ ... 67 12. Data kinetika pseudo orde dua pada biomassa alga Dunaliella sp terhadap
xvi
13. Data kinetika pseudo orde satu pada biomassa alga Dunaliella sp terhadap ion Cd2+ ... 68 14. Data kinetika pseudo orde dua pada biomassa alga Dunaliella sp terhadap
ion Cd2+ ... 68 15. Data perhitungan persamaan Langmuir ion Ca2+ terhadap biomasssa alga
Dunaliella sp ... 70
16. perhitungan persamaan Freundlich ion Ca2+ terhadap biomasssa alga
Dunaliella sp ... 71
17. Data perhitungan persamaan Langmuir ion Cu2+ terhadap biomasssa alga Dunaliella sp ... 72
18. Data perhitungan persamaan Freundlich ion Cu2+ terhadap biomasssa alga Dunaliella sp ... 74
19. Data perhitungan persamaan Langmuir ion Cd2+ terhadap biomasssa alga Dunaliella sp ... 75
DAFTAR GAMBAR
Gambar Halaman
1. Kurva isoterm adsorpsi Langmuir ... 18 2. Kurva isoterm adsorpsi Freundlich ... 20 3. Spektra IR alga Dunaliella sp ... 34 4. Adsorpsi ion Ca2+, Cu2+, dan Cd2+ pada biomassa Dunaliella sp dengan dosis
yang bervariasi ... 36
5. Adsorpsi ion logam Ca2+, Cu2+, dan Cd2+ dengan pH konsentrasi ion logam yang berbeda pada biomassa alga Dunaliella sp ... 37
6. Adsorpsi ion Ca2+, Cu2+, dan Cd2+ oleh biomassa alga Dunaliella sp pada waktu interaksi yang bervariasi ... 40 7. Kurva kinetika orde dua adsorpsi ion a) Ca2+, b) Cu2+, dan c) Cd2+ oleh
biomassa alga Dunaliella sp ... 42 8. Adsorpsi ion Ca2+, Cu2+, dan Cd2+ dengan konsentrasi ion logam yang
berbeda pada biomassa alga Dunaliella sp ... 43
9. Kurva model isoterm adsorpsi Langmuir biomassa alga Dunaliella sp
terhadap ion a) Ca2+, b) Cu2+, dan c) Cd2+ ... 46
10. Kurva model isoterm adsorpsi Freundlich biomassa alga Dunaliella sp terhadap ion a) Ca2+, b) Cu2+, dan c) Cd2+ ... 48
11. Grafik kinetika pseudo orde dua adsorpsi ion Ca2+ terhadap biomassa alga Dunaliella sp ... 66
12. Grafik kinetika pseudo orde dua adsorpsi ion Cu2+ terhadap biomassa alga Dunaliella sp ... 67
xviii
14. Kurva isoterm adsorpsi Langmuir biomassa alga Dunaliella sp terhadap ion Ca2+ ... 70 15. Kurva isoterm adsorpsi Freundlich biomassa alga Dunaliella sp terhadap ion
Ca2+ ... 72 16. Kurva isoterm adsorpsi Langmuir biomassa alga Dunaliella sp terhadap ion
Cu2+ ... 73 17. Kurva isoterm adsorpsi Freundlich biomassa alga Dunaliella sp terhadap ion
Cu2+ ... 74 18. Kurva isoterm adsorpsi Langmuir biomassa alga Dunaliella sp terhadap ion
Cd2+ ... 75 19. Kurva isoterm adsorpsi Freundlich biomassa alga Dunaliella sp terhadap ion
1
I.PENDAHULUAN
A.Latar Belakang
Dewasa ini pencemaran lingkungan semakin meningkat seiring dengan bertambahnya aktivitas kehidupan manusia. Pencemaran perairan merupakan salah satu pencemaran lingkungan akibat perkembangan industri. Limbah industri yang berasal dari industri tekstil, pertambangan, plastik, pewarnaan,
electroplating, dan proses metalurgi (Han et al., 2006; Lyer et al., 2005)
mengandung logam berat yang merupakan salah satu penyebab pencemaran air. Biasanya, limbah dari proses industri yang mengandung logam berat ini dibuang ke laut. Logam berat dalam kadar rendah umumnya sudah cukup beracun bagi tumbuhan dan hewan, termasuk manusia (Krauskopf, 1979). Pada konsentrasi tinggi, logam berat dapat terakumulasi pada organisme dan bersifat toksik. Akumulasi tersebut dapat mengganggu proses rantai makanan dan berdampak buruk bagi kesehatan manusia. Contoh dari logam berat yang terkandung dalam limbah tersebut adalah tembaga (Cu) dan kadmium (Cd) (Buhani et al., 2012).
2
metode, yaitu pengendapan kimia, koagulasi, kompleksasi, ekstraksi pelarut, pemisahan membran, dan pertukaran ion. Namun, metode-metode ini memiliki kekurangan, yaitu kurang efisien atau mahal ketika logam berat hanya terdapat pada konsentrasi yang rendah (Kuyucak and Volesky, 1988). Salah satu metode yang dapat dijadikan alternatif adalah metode adsorpsi menggunakan material alam sebagai adsorben. Metode adsorpsi memiliki keunggulan karena prosesnya yang mudah dan murah (Patel and Suresh, 2008; Gupta and Bhattacharyya, 2006) serta tidak memiliki efek samping zat beracun (Blais et al., 2000).
Metode adsorpsi biasanya menggunakan interaksi pembentukan kompleks antara logam dengan permukaan adsorben yang memiliki gugus fungsi, seperti hidroksil (–OH), amina (-NH), karboksil (–COOH), dan -SH (Stum and Morgan, 1996) yang memiliki pasangan elektron bebas dan berfungsi sebagai ligan. Keberhasilan proses adsorpsi ion logam sangat ditentukan oleh jenis adsorben yang digunakan. Beberapa contoh adsorben yang digunakan dalam penanganan limbah logam berat adalah kitosan (Veera et al., 2003), serbuk gergaji (Shukla et al., 2002), rumput laut (Indriani and Akira, 1998), dan alga (Cervantes et al.,2001).
3
al., 2007). Salah satu spesies alga hijau, yaitu Dunaliella sp melimpah dalam
perairan, mudah diperoleh, dan mudah dikembangbiakkan. Alga jenis ini belum banyak digunakan sebagai adsorben. Alga Dunaliella sp memiliki gugus fungsi – OH dan –NH dan kaya kandungan β-karoten serta gliserol yang dimilikinya (Karaca, 2008). Oleh karena itu, biomassa alga Dunaliella sp dipilih sebagai adsorben untuk ion-ion logam yang banyak ditemukan di perairan yang merupakan sisa pembuangan industri atau limbah.
Pada penelitian ini telah dilakukan kajian tentang faktor-faktor yang
mempengaruhi proses adsorpsi ion-ion logam divalen dengan biomassa alga Dunaliella sp sebagai adsorben yang digunakan untuk menentukan uji adsorpsi
ion Ca2+, Cu2+, dan Cd2+. Adsorben biomassa alga dikarakterisasi dengan alat spektrofotometer infrared (IR) untuk identifikasi gugus fungsional dan ion logam yang teradsorpsi dianalisis dengan spektrofotometer serapan atom (SSA).
B.Tujuan Penelitian
Berdasarkan latar belakang yang telah dijelaskan di atas, maka penelitian ini memiliki tujuan sebagai berikut:
1. mempelajari faktor-faktor yang berpengaruh terhadap proses-proses adsorpsi ion-ion Ca2+, Cu2+, dan Cd2+ oleh biomassa alga Dunaliella sp meliputi dosis alga sebagai adsorben, pH, waktu pengadukan, dan konsentrasi logam; 2. mempelajari kinetika dan isoterm adsorpsi ion Ca2+, Cu2+, dan Cd2+ oleh
4
C.Manfaat Penelitian
5
II. TINJAUAN PUSTAKA
A.Logam
Logam yang berada di alam merupakan material organik dan anorganik. Beberapa jenis logam ada yang dibutuhkan oleh makhluk hidup tetapi ada juga yang
memberikan kerugian. Logam yang berada di alam dapat berupa logam berat yang merupakan golongan transisi atau lantanida dan aktinida namun dapat juga berasal dari golongan utama seperti logam alkali dan alkali tanah.
Logam berat merupakan unsur yang memiliki nomor antara 63,5 dan 200,6 serta memiliki gaya tarik spesifik lebih besar dari 5,0 (Srivastava and Majumder, 2008). Logam berat merupakan elemen yang berbahaya di permukaan bumi dan
merupakan salah satu sumber polusi lingkungan. Logam berat dapat ditransfer dalam jangkauan yang sangat jauh di lingkungan, selanjutnya berpotensi mengganggu kehidupan biota lingkungan dan akhirnya berpengaruh terhadap kesehatan manusia walaupun dalam jangka waktu yang lama dan jauh dari sumber polusi utamanya (Suhendrayatna, 2001).
Logam berat tidak seperti material organik yang dapat terdegredasi tetapi
6
mempengaruhi aktivitas keracunan setiap jenis logam antara lain: bentuk senyawa dari logam tersebut, daya kelarutan dalam cairan, ukuran partikel, dan beberapa sifat kimia dan sifat fisikanya (Palar, 1994).
Di perairan, logam berat berada dalam bentuk ion-ion, baik sebagai pasangan ion ataupun bentuk ion-ion tunggal. Kadar logam berat akan meningkat bila limbah di perkotaan, pertambangan, pertanian, dan perindustrian masuk ke dalam lingkungan.
Adapun sifat-sifat logam berat (Sutamihardja et al., 1982) yaitu:
1. sulit didegradasi, sehingga mudah terakumulasi dalam lingkungan perairan dan keberadaanya secara alami sulit terurai (dihilangkan);
2. dapat terakumulasi oleh organisme termasuk kerang dan ikan, serta dapat membahayakan kesehatan manusia yang mengkonsumsi organisme tersebut; 3. mudah terakumulasi di sedimen, sehingga konsentrasinya akan lebih tinggi
dari konsentrasi logam dalam air. Selain itu, sedimen mudah tersuspensi karena pergerakan massa air yang akan melarutkan kembali logam yang dikandungnya di dalam air, sehingga sedimen menjadi sumber pencemar potensial dalam skala waktu tertentu.
Logam berat digolongkan menjadi dua jenis yaitu logam berat esensial dan non esensial. Logam berat esensial adalah logam yang keberadaannya dalam jumlah tertentu sangat dibutuhkan oleh organisme hidup, namun dalam jumlah yang berlebihan dapat menimbulkan efek racun. Contoh logam berat ini adalah Zn, Cu, Fe, Co, dan Mn sedangkan logam berat non esensial yaitu logam yang
7
bersifat racun, seperti Hg, Cd, Pb, dan Cr. Logam ini dapat menimbulkan efek kesehatan bagi manusia tergantung pada bagaimana logam berat tersebut terikat dalam tubuh. Daya racun yang dimiliki akan bekerja sebagai penghalang kerja enzim, selain itu logam berat ini akan bertidak sebagai penyebab alergi, mutagen atau karsinogen bagi manusia (Putra, 2006).
Bila ditinjau dari definisi asam-basa menurut Lewis , maka interaksi antara ion logam dengan adsorben dapat dipandang sebagai reaksi asam Lewis dengan basa Lewis, yang mana ion logam berperan sebagai asam Lewis yang menjadi akseptor pasangan elektron dan adsorben sebagai basa Lewis yang menjadi donor pasangan elektron. Dengan demikian, prinsip-prinsip yang berlaku dalam interaksi asam-basa Lewis dapat digunakan dalam adsorpsi ion logam (Keenan and Kleinfelter, 1984).
Prinsip yang digunakan secara luas dalam reaksi asam-basa Lewis adalah prinsip
Hard Soft Acid Base (HSAB) yang dikembangkan Pearson dalam Huheey et al.
(1993). Prinsip ini didasarkan pada polarisabilitas unsur yang dikaitkan dengan
kecenderungan unsur (asam atau basa) untuk berinteraksi dengan unsur lainnya.
Ion-ion logam yang berukuran kecil, bermuatan positif besar, elektron terluarnya
tidak mudah terdistorsi dan memberikan polarisabilitas kecil dikelompokkan
dalam asam keras. Ion-ion logam yang berukuran besar, bermuatan kecil atau nol,
elektron terluarnya mudah terdistorsi dan memberikan polarisabilitas yang besar
dikelompokkan dalam asam lunak. Ligan-ligan dengan atom yang sangat
8
dengan atom yang elektron terluarnya mudah terpolarisasi akibat pengaruh ion
dari luar merupakan basa lemah.
Menurut prinsip HSAB, asam keras akan berinteraksi dengan basa keras untuk
membentuk kompleks, begitu juga asam lunak dengan basa lunak. Interaksi asam
keras dengan basa keras merupakan interaksi ionik, sedangkan interaksi asam
lunak dengan basa lunak merupakan interaksi kovalen (Sukarta, 2008). Ion Ca2+
merupakan asam yang bersifat keras sehingga akan berinteraksi dengan basa
keras. Ion Cu2+ termasuk golongan asam menengah dan dapat berinteraksi dengan
basa yang bersifat menengah. Ion Cd2+ merupakan asam lunak yang akan
berinteraksi dengan basa lunak.
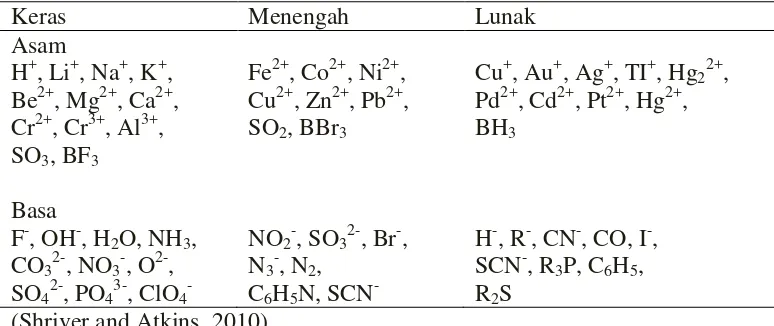
Tabel 1. Klasifikasi asam dan basa
Keras Menengah Lunak
Asam
(Shriver and Atkins, 2010).
1. Kalsium (Ca)
9
1,5-2% dari berat badan orang dewasa. Di dalam tubuh manusia terdapat kurang lebih 1 kg kalsium (Granner, 2003). Dari jumlah ini, 99% berada di dalam jaringan keras, yaitu tulang dan gigi terutama dalam bentuk hidroksiapatit
{(3Ca3(PO4)2·Ca(OH)2}. Kalsium tulang berada dalam keadaan seimbang dengan kalsium plasma pada konsentrasi kurang lebih 2,25-2,60 mmol/L
99-10,4mg/100mL). Densitas tulang berbeda menurut umur, meningkat pada bagian pertama kehidupan dan menurun secara berangsur setelah dewasa. Selebihnya kalsium tersebar luas di dalam tubuh. Di dalam cairan ekstraseluler dan intraseluler kalsium memegang peranan penting dalam mengatur fungsi sel, seperti untuk transmisi saraf, kontraksi otot, penggumpalan darah, dan menjaga permeabilitas membran sel. Kalsium juga mengatur pekerjaan hormon-hormon dan faktor pertumbuhan (Almatsier, 2004).
Kalsium adalah mineral yang amat penting bagi manusia, antara lain bagi metabolisme tubuh, penghubung antar saraf, kerja jantung dan pergerakan otot. Kalsium juga memiliki peranan penting dalam pertumbuhan, seperti pembentukan tulang dan gigi, pembekuan darah, kontraksi otot, mengaktifkan syaraf,
melancarkan peredaran darah, menormalkan tekanan darah, menyeimbangkan tingkat keasaman darah, mencegah osteoporosis, membantu mineralisasi (Syukri, 1999).
10
digunakan dalam bidang industri, seperti pencairan batu bara, untuk mengikat permukaan beraspal, pengeboran lumpur, pabrik kertas dan pulp, pengeboran beton dan semen, fungisisda/formulasi pestisida, pendingin udara, pemadam kebakaran, ban karet untuk traktor dan mobil serta sebagai desinfektan. Selain itu, dapat digunakan sebagai alat pengering dalam laboratorium dan dapat pula
digunakan sebagai pemisah dalam makanan, pembuatan gliserol, penstabil, dan filter (Handayani, 2013). Kalsium klorida yang dikombinasikan dengan NaCl digunakan untuk menghilangkan lapisan es pada jalan pada negara yang memiliki musim salju. Hal tersebut dikarenakan terjadinya reaksi eksotermik antara kalsium klorida dan air (Housecroft and Sharpe, 2005).
Kalsium klorida memiliki sifat higroskopis, dapat bertindak sebagai sumber untuk ion kalsium dalam suatu larutan, tidak seperti senyawa kalsium lainnya yang tidak dapat larut, kalsium klorida dapat berdisosiasi (Patnaik, 2003).
2. Tembaga (Cu)
Tembaga memiliki lambang Cu dengan nomor atom 29 dan massa relatif 65,37.
Tembaga dalam keadaan murni merupakan logam lunak dan lentur serta berwarna
kemereh-merahan. Logam ini memiliki titik leleh 1358 K dan titik didih 2840 K
(Housecroft and Sharpe, 2005). Tembaga memiliki elektron s tunggal di luar kulit
3d yang terisi. Hal ini kurang umum dengan golongan alkali kecuali stoikiometri
formal dalam tingkat oksidasi +1 (Cotton and Wilkinson, 2009). Tembaga
11
merupakan satu-satunya unsur dalam deret pertama blok d yang stabil dalam
keadaan oksidasi +1 (Housecroft and Sharpe, 2005).
Tembaga dapat diperoleh dari hasil pelapukan/pelarutan mineral-mineral yang
terkandung dalam bebatuan. Polusi yang disebabkan oleh logam tembaga berasal
dari industri-industri tembaga, pembakaran batu bara, pembakaran kayu, minyak
bumi, dan buangan di area pemukiman/perkotaan (Lahuddin, 2007). Tembaga
merupakan zat yang esensial bagi metabolisme hewan, tetapi kandungan yang
berlebihan dapat menimbulkan gangguan dan penyakit pada otak, kulit, hati,
pankreas, miokardium (Vijayaraghavan et al., 2006), gangguan pada usus,
kerusakan ginjal, dan anemia (Al-Rub et al., 2006). Selain itu, dapat
menyebabkan keracunan, seperti muntah, kejang, tegang, bahkan kematian
(Paulino et al., 2006).
Dalam penelitian ini digunakan senyawa CuSO4·5H2O yang berwarna biru merupakan senyawa yang tidak berbau, memiliki titik lebur 150°C, memiliki kelarutan dalam air sebesar 22,37% pada temperatur 0°C dan 117,95% pada temperatur 100°C, larut dalam metanol, gliserol, dan sedikit larut dalam etanol. Senyawa CuSO4.5H2O dengan segiempat planar [Cu(H2O)4]2+ dengan dua sulfat atom O melengkapi tempat yang tersisa dalam perpanjangan koordinasi
oktahedral. Dalam keadaan kristal, struktur ini mengandung satu kumpulan ikatan hidrogen yang bergabung dengan molekul H2O yang tak terkoordinasi.
Pentahidrat kehilangan air saat dipanaskan dan membentuk kristal putih,
12
dalam konsentrasi rendah sehingga tidak berbahaya dalam proses penyerapannya melalui kulit yang luka, tetapi jika senyawa ini masuk ke dalam tubuh melalui oral dapat mengakibatkan keracunan (Dirjen POM, 1985).
3. Kadmium (Cd)
Kadmium adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Cd dan nomor atom 48. Cd merupakan logam berwarna putih keperakan yang dapat ditempa, liat, dan memiliki titik lebur 321°C. Kadmium merupakan logam transisi golongan IIB yang digunakan sebagai pigmen pada keramik, penyepuhan listrik, pembuatan alloy, dan baterai alkali (Susilawati, 2009). Kadmium dalam tanah terkandung dalam bebatuan beku, metamorfik, sedimen dll (Lahuddin, 2007). Kadmium di alam tidak dijumpai dalam bentuk bebas. Hampir semua kadmium yang diproduksi dari hasil samping peleburan dan pemurnian biji seng (Zn) yang biasanya mengandung 0,2-0,4% kadmium (Darmono, 1995).
Kadmium merupakan salah satu jenis logam berat yang berbahaya karena elemen ini beresiko tinggi terdap pembuluh darah. Kadmium berpengaruh terhadap manusia dalam jangka waktu yang panjang dan dapat terakumulasi pada tubuh khususnya hati dan ginjal (Susilawati, 2009).
13
B. Adsorpsi
Adsorpsi merupakan fenomena yang terjadi pada permukaan. Fasa yang menyerap disebut adsorben dan fasa yang terserap disebut adsorbat. Adsorben biasanya merupakan bahan-bahan yang memiliki pori karena berlangsung terutama pada dinding-dinding pori atau letak-letak tertentu di dalam adsorben (Alberty and Daniel, 1987). Adsorpsi merupakan proses akumulasi adsorbat pada permukaan adsorben yang disebabkan oleh gaya tarik antar molekul atau suatu akibat dari medan gaya pada permukaan padatan (adsorben) yang menarik molekul-molekul gas, uap atau cairan. Gaya tarik-menarik dari suatu padatan dibedakan menjadi dua jenis gaya, yaitu gaya fisika dan gaya kimia yang masing-masing
menghasilkan adsorpsi fisika (physisorption) dan adsorpsi kimia (chemisorption) (Oscik, 1982).
Adsorpsi fisika adalah proses interaksi antara adsorben dengan adsorbat yang melibatkan gaya-gaya antar molekul seperti gaya Van der Waals sedangkan adsorpsi kimia terjadi jika interaksi adsorben dan adsorbat melibatkan
pembentukan ikatan kimia. Dalam proses adsorpsi melibatkan berbagai macam gaya yakni gaya Van der Waals, gaya elektrostatik, dan ikatan hidrogen serta ikatan kovalen (Martell and Hancock, 1996).
14
rendah berkisar antara 10 kJ/mol dan lebih rendah dari energi adsorpsi kimia (Adamson and Gast, 1997).
Pada adsorpsi kimia terjadi pembentukan dan pemutusan ikatan, sehingga energi adsorpsinya berada pada kisaran yang sama dengan reaksi kimia. Ikatan antara adsorben dan adsorbat cukup kuat sehingga tidak terjadi spesiasi, karena zat teradsorpsi menyatu dengan adsorben membentuk lapisan tunggal dan relatif reversibel. Batas minimal suatu adsorpsi dikategorikan sebagai kemisorpsi adalah memiliki harga energi adsorpsi sebasar 20,92 kJ/mol (Adamson and Gast, 1997).
Adapun interaksi antara ion logam (adsorbat) dengan adsorben pada proses adsorpsi dipengaruhi oleh beberapa faktor:
a. Sifat logam dan ligan
Sifat ion logam yakni: (1) ukuran ion logam, makin kecil ukuran ion logam maka kompleks yang terbentuk semakin stabil, (2) polarisabilitas ion logam, makin tinggi polarisabilitas ion logam maka kompleks yang terbentuk semakin stabil, dan (3) energi ionisasi, makin tinggi energi ionisasi suatu logam maka kompleks yang terbentuk semakin stabil.
15
b. Pengaruh pH sistem
Pada pH rendah, permukaan ligan cenderung terprotonasi sehingga kation logam juga berkompetisi dengan H+ untuk terikat pada ligan permukaan. Pada pH tinggi, dimana jumlah ion OH- besar menyebabkan ligan permukaan cenderung terdeprotonasi sehingga pada saat yang sama terjadi kompetisi antara ligan permukaan dengan ion OH- untuk berikatan dengan kation logam (Stum and Morgan, 1996).
c. Pelarut
Proses adsorpsi dapat ditinjau melalui sifat kepolaran baik dari adsorben, komponen terlarut maupun pelarutnya. Pada adsorpsi padat cair, mekanisme adsorpsi bergantung pada gaya interaksi antara molekul dari komponen larutan dengan lapisan permukaan adsorben dengan pori-porinya. Pelarut dapat ikut teradsorpsi atau sebaliknya dapat mendorong proses adsorpsi (Oscik, 1982).
Untuk menentukan jumlah logam teradsorpsi dan rasio distribusi pada proses adsorpsi ion logam terhadap adsorben dapat digunakan persamaan berikut:
Q = (Co-Ce)V/W (1)
D= Q/Ce (2) %A = (Co-Ce)/Co x 100 (3)
16
adalah massa adsorben (g), V adalah volume larutan ion logam (L), A (%) persentase teradsorpsi, D adalah rasio distribusi (mL g-1) (Buhani et al., 2009).
d. Konsentrasi adsorbat
Pada umumnya adsorpsi akan meningkat dengan kenaikan konsentrasi adsorbat tetapi tidak berbanding lurus. Adsorpsi akan konstan jika terjadi kesetimbangan antara konsentrasi adsorbat yang diserap dengan konsentrasi yang tersisa dalam larutan (Oscik, 1982).
e. Temperatur
Reaksi yang terjadi pada adsorpsi biasanya eksotermis, oleh sebab itu adsorpsi akan besar jika temperatur rendah (Oscik, 1982).
f. Waktu kontak dan pengocokan
Waktu kontak yang cukup diperlukan untuk mencapai kesetimbangan adsorpsi. Jika fase cairan yang berisi adsorben diam, maka difusi adsorbat melalui
permukaan adsorben akan lambat. Oleh karena itu diperlukan pengocokan untuk mempercepat proses adsorpsi (Oscik, 1982).
1. Kinetika adsorpsi
17
pada konsentrasi spesies yang bereaksi. Orde reaksi ditentukan secara empiris, tetapi tidak berkaitan dengan stoikiometri reaksi. Sebaliknya, kinetika diatur oleh proses mekanisme, yaitu dengan jumlah spesies yang bertabrakan untuk terjadinya reaksi. Selain itu, kinetika juga dapat digunakan untuk menentukan kecepatan adsorpsi yang berlangsung dan menentukan kapasitas keseimbangan yang dapat dimanfaatkan dalam situasi yang dinamis dan praktis. Tingkat adsorpsi
keseluruhan dipengaruhi oleh perubahan sifat dan komponen pelarut, serta ukuran partikel dan suhu. Kinetika reaksi adsorpsi juga tergantung pada gugus fungsional dan konsentrasi. Tingginya tingkat substitusi gugus fungsional pada polimer inert dapat meningkatkan laju reaksi keseluruhan (Allen et al., 2004).
Analisis kinetika didasarkan pada kinetika reaksi terutama pseudo orde pertama
atau mekanisme pseudo pertama bertingkat. Untuk meneliti mekanisme adsorpsi,
konstanta kecepatan reaksi sorpsi kimia untuk ion-ion logam,digunakan
persamaan sistem pseudo orde pertama oleh Lagergren dan mekanisme pseudo
orde kedua (Buhani et al., 2010). Persamaan ini digunakan untuk menguji data
percobaan dari konsentrasi awal, suhu dan berat ion-ion logam dalam larutan
(Zhang et al., 2003). Model kinetika (pseudo urutan pertama dan persamaan orde dua) dapat digunakan dengan asumsi bahwa konsentrasi diukur sama dengan konsentrasi permukaan adsorben. Tingkat persamaan urutan pertama Lagergren adalah salah satu yang paling banyak digunakan untuk adsorpsi zat terlarut dari larutan cair (Liu et al., 2004).
Untuk konstanta laju kinetika pseudo orde satu:
18
Dengan qeadalah jumlah ion logam divalen yang teradsorpsi (mg/g) pada waktu
keseimbangan, qt adalah jumlah ion logam divalen yang teradsorpsi pada waktu t
(menit), k1 adalah konstanta kecepatan adsorpsi (jam-1). Integrasi persamaan ini
dengan kondisi batas t =0 sampai t=t dan qt = qt, memberikan:
Dengan menggunakan regreasi linear dan mengalurkan ln(qe– qt ) terhadap t
diperoleh konstanta k1. Untuk konstanta kecepatan reaksi order kedua proses
kemisorpsi:
Dengan k2konstanta keseimbangan order kedua kemisorpsi (g/mg.jam). Model
kinetika order kedua dapat disusun untuk mendapatkan bentuk linear :
19
2. Kapasitas adsorpsi
Model kesetimbangan adsorpsi yang sering digunakan untuk menentukan
kesetimbangan adsorpsi adalah isotermal Langmuir dan Freundlich.
i. Model Adsorpsi Langmuir
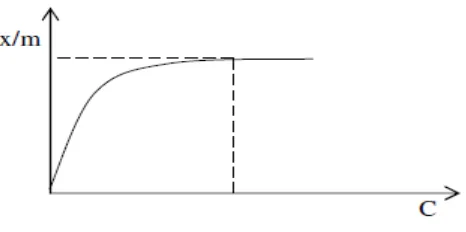
Menurut Oscik (1982), teori Langmuir menjelaskan bahwa pada permukaan adsorben terdapat sejumlah tertentu situs aktif yang sebanding dengan luas permukaan. Setiap situs aktif hanya satu molekul yang dapat diadsorpsi. Ikatan antara zat yang teradsorpsi dengan adsorben dapat terjadi secara fisika atau secara kimia. Ikatan tersebut harus cukup kuat untuk mencegah perpindahan molekul yang telah teradsorpsi sepanjang permukaan adsorben.
Model adsorpsi isoterm Langmuir dapat dinyatakan dalam persamaan:
� = 1
+1� (9)
dimana C adalah konsentrasi kesetimbangan, m adalah jumlah zat yang
20
∆� � =∆�0 =− � (10)
Dengan R adalah tetapan gas umum (8,314 J/mol K), T temperatur (K) dan K adalah tetapan kesetimbangan adsorpsi yang diperoleh dari persamaan Langmuir dan energi total adsorpsi adalah sama dengan energi bebas Gibbs (Oscik, 1982).
∆G sistem negatif artinya adsorpsi beralangsung spontan.
Kurva isoterm adsorpsi Langmuir dapat disajikan seperti pada Gambar 1.
Gambar 1. Kurva isoterm adsorpsi Langmuir (Oscik, 1982).
ii. Model Adsorpsi Freundlich
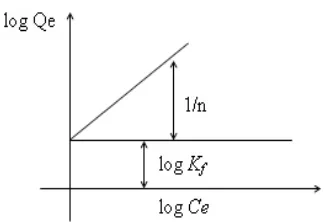
Model isoterm Freundlich menjelaskan bahwa proses adsorpsi pada bagian
permukaan adalah heterogen dimana tidak semua permukaan adsorben
mempunyai daya adsorpsi. Model isoterm Freundlich menunjukkan lapisan
adsorbat yang terbentuk pada permukaan adsorben adalah multilayer. Hal
tersebut berkaitan dengan ciri-ciri dari adsorpsi secara fisika dimana adsorpsi
dapat terjadi pada banyak lapisan (multilayer) (Husin and Rosnelly, 2005).
21
a. tidak ada asosiasi dan disosiasi molekul-molekul adsorbat setelah teradsorpsi pada permukaan padatan;
b. hanya berlangsung mekanisme adsorpsi secara fisis tanpa adanya adsorpsi kimia;
c. permukaan padat bersifat heterogen (Noll et al., 1992).
Bentuk persamaan Freundlich adalah sebagai berikut:
= �
1
(11)
Dimana:
Qe = Banyaknya zat yang terserap per satuan berat adsorben (mol/g)
Ce = Konsentrasi adsorbat pada saat kesetimbangan (mol/L)
n = Kapasitas adsorpsi maksimum (mol/g) Kf = Konstanta freundlich (L/mol)
Persamaan di atas dapat diubah kedalam bentuk linier dengan mengambil bentuk logaritmanya:
= + 1 � (12)
Sehingga dapat dibuat Gafik sebagai berikut:
22
Bentuk linear dapat digunakan untuk menentukan kelinearan data percobaan dengan cara mengeplotkan C/Q terhadap Ce. Konstanta Freundlich Kf dapat
diperoleh dari kemiringan garis lurusnya dan 1/n merupakan harga slop. Bila n diketahui Kf dapat dicari, semakin besar harga Kf maka daya adsorpsi akan
semakin baik dan dari harga Kf yang diperoleh, maka energi adsorpsi akan dapat
dihitung (Rousseau, 1987).
Selain itu, untuk menentukan jumlah logam teradsorpsi, rasio distribusi dan
koefisien selektivitas pada proses adsorpsi ion logam terhadap adsorben alga
Dunaliella sp dan adsorpsi optimum konsentrasi ion logam dapat digunakan
persamaan berikut:
Q = (Co-Ca)V/W (13)
Dimana Q menyatakan jumlah logam teradsorpsi (mg/g), Co dan Ca menyatakan
konsentrasi awal dan kesetimbangan dari ion logam (mmol/L), W adalah massa
adsorben (g), V adalah volume larutan ion logam (L) (Buhani et al., 2009).
C.Biomassa Alga Dunaliella sp
Alga merupakan mikroorganisme yang hidup di daerah perairan. Mikroorganisme ini memiliki bentuk dan ukuran yang beranekaragam, ada yang mikroskopis, bersel satu, berbentuk benang/pita atau berbentuk lembaran. Berdasarkan pigmen (zat warna) yang dikandung, alga dikelompokkan atas empat kelas, yaitu:
Rhodophyceae (alga merah), Phaeophyceae (alga coklat), Chlorophyceae (alga
23
Dari berbagai penelitian telah diketahui bahwa keempat alga golongan ini dalam keadaan hidup maupun dalam keadaan mati (biomassa) dan biomassa
terimmobilisasi telah mendapat perhatian untuk mengadsorpsi ion logam berat. Alga dalam keadaan hidup dimanfaatkan sebagai bioindikator tingkat pencemaran logam berat di lingkungan perairan, sedangkan alga dalam bentuk biomassa terimmobilisasi dimanfaatkan sebagai biosorben (material biologi penyerap logam berat) dalam pengolahan air limbah kronis (Harris and Ramelow, 1990).
Dunaliella sp merupakan salah satu jenis fitoplankton yang kaya dengan
kandungan β-karoten dan gliserol yang memiliki lebar 2-8 nm dan panjang 5-15 µm (Karaca, 2008). Merupakan fitoplankton bersel satu yang memiliki kloroplas sehingga selnya berwarna kuning kemerah-merahan hingga warna hijau,
mempunyai dua flagel yang sama panjang, dan tidak berdinding sel. Bentuk selnya bervariasi, seperti oval, elips, bulat telur, dan silindris. Variasi bentuk fitoplankton ini dipengaruhi oleh kondisi lingkungan seperti salinitas, intensitas cahaya yang diterima dan temperatur ruang selama masa kultur (Chen et al., 1991).
Warna yang dimiliki oleh Dunaliella sp dimanfaatkan sebagai kosmetik dan suplemen diet. Pada kondisi tertentu, alga ini melindungi diri dari cahaya
24
memiliki konsentrasi garam lebih dari 2M dan kandungan magnesium yang tinggi.
Menurut Bougis (1979) mengklasifikasikan Dunaliella sp sebagai berikut: Filum : Chlorophyta
Kelas : Chlorophyceae Ordo : Volvocales
Sub ordo : Chlamidomonacea Genus : Dunaliella
Spesies : Dunaliella sp
Secara umum, keuntungan pemanfaatan alga sebagai bioindikator dan biosorben adalah sebagai berikut :
1. alga mempunyai kemampuan yang cukup tinggi dalam mengadsorpsi logam berat karena di dalam alga terdapat gugus fungsi yang dapat melakukan pengikatan dengan ion logam. Gugus fungsi tersebut terutama gugus karboksil, hidroksil, amina, sulfudril, imadazol, sulfat, dan sulfonat yang terdapat dalam dinding sel dalam sitoplasma;
2. bahan bakunya mudah didapat dan tersedia dalam jumlah banyak; 3. biaya operasional yang rendah;
4. tidak perlu nutrisi tambahan.
Berbagai mekanisme pemanfaatan alga sebagai adsorben telah dilakukan untuk mengikat antara ion logam dengan alga/biomassa seperti pertukaran ion,
25
D.Karakterisasi
1. Spektrofotometer IR
Penentuan gugus fungsi suatu sampel dapat dilakukan analisis menggunakan
spektrofotometri IR yang merupakan salah satu analisis secara kulitatif dan
dengan spektrofotometri IR dapat diketahui gugus-gugus fungsi dari material alga
Dunaliella sp dengan cara membandingkannya dengan daerah sidik jarinya
(Silverstein et al., 2005). Spektrofotometeri IR adalah spektrofotometer yang
memanfaatkan sinar IR dekat, yakni sinar yang berada pada jangkauan panjang
gelombang 2,5 - 25 m atau jangkauan frekuensi 400 - 4000 cm-1. Sinar ini
muncul akibat vibrasi atom-atom pada posisi kesetimbangan dalam molekul dan
kombinasi vibrasi dengan rotasi menghasilkan spektrum vibrasi-rotasi (Khopkar, 2001).
Inti-inti atom yang terikat oleh ikatan kovalen mengalami getaran (vibrasi) atau osilasi (oscillation), dengan cara serupa dengan dua bola yang terikat oleh suatu pegas. Bila molekul meresap radiasi inframerah, energi yang diserap
26
vibrasi ulur (stretching vibration) ikatan O–H itu. Suatu ikatan O–H itu juga menyerap pada kira-kira 1250 cm-1. Energi pada panjang gelombang ini menyebabkan kenaikan vibrasi tekuk (bending vibration). Tipe vibrasi yang berlainan ini disebut cara fundamental vibrasi (fundamental mode of vibration) (Fessenden and Fessenden, 1982).
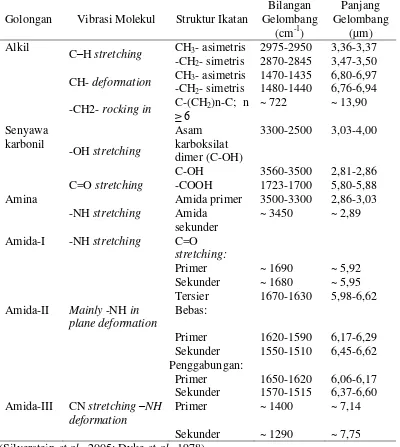
Tabel 2. Serapan inframerah beberapa gugus fungsi senyawa organik
Golongan Vibrasi Molekul Struktur Ikatan
Bilangan
C–H stretching CH3- asimetris 2975-2950 3,36-3,37 -CH2- simetris 2870-2845 3,47-3,50 CH- deformation CH3- asimetris 1470-1435 6,80-6,97 -CH2- simetris 1480-1440 6,76-6,94 -CH2- rocking in C-(CH≥ 6 2)n-C; n ~ 722 ~ 13,90
C=O stretching -COOH 1723-1700 5,80-5,88 Amina
-NH stretching
Amida primer 3500-3300 2,86-3,03 Amida
Tersier 1670-1630 5,98-6,62 Amida-II Mainly -NH in
plane deformation
Bebas:
Primer 1620-1590 6,17-6,29 Sekunder 1550-1510 6,45-6,62 Penggabungan:
Primer 1650-1620 6,06-6,17 Sekunder 1570-1515 6,37-6,60 Amida-III CN stretching –NH
deformation
Primer ~ 1400 ~ 7,14
Sekunder ~ 1290 ~ 7,75
27
2. Spektrofotometer Serapan Atom (SSA)
Spektrofotometer serapan atom (SSA) merupakan salah satu instrumen yang digunakan untuk analisis secara kuantitatif terhadap unsur-unsur logam. Alat ini memiliki sensitivitas yang sangat tinggi sehingga sering dijadikan sebagai pilihan utama dalam menganalisis unsur logam yang konsentrasinya sangat kecil (ppm bahkan ppb). Prinsip dasar pengukuran alat ini adalah penyerapan energi (sumber cahaya) oleh atom-atom dalam keadaan dasar menjadi atom-atom dalam keadaan tereksitasi. Pembentukan atom-atom dalam keadaan dasar atau proses atomisasi pada umumnya dilakukan dalam nyala. Cuplikan sampel yang mengandung logam M sebagai ion M+ dan A- akan melalui serangkaian proses dalam nyala, sebelum akhirnya menjadi atom logam dalam keadaan dasar (Mo). Atom-atom dalam keadaan dasar (Mo) akan menyerap energi sumber energi berupa lampu katode berongga, yang mana jumlah energi yang diserap adalah sebanding dengan konsentrasi atom-atom dalam sampel (Welz, 1985).
Apabila cahaya dengan panjang gelombang tertentu dilewatkan pada suatu sel yang mengandung atom-atom bebas yang bersangkutan maka sebagian cahaya tersebut akan diserap dan intensitas penyerapan akan berbanding lurus dengan banyaknya atom bebas logam yang berada dalam sel. Hubungan antara absorbansi dengan konsentrasi diturunkan dari:
a. Hukum Lambert
28
b. Hukum Beer
Intensitas sinar yang diteruskan berkurang secara eksponensial dengan bertambahnya konsentrasi spesi yang menyerap sinar tersebut.
Dari kedua hukum tersebut diperoleh persamaan sebagai berikut:
It = Io.e-(εbc), atau (14)
A = -log It/Io = εbc (15)
Dimana:
Io = Intensitas sumber sinar
It = Intensitas sinar yang diteruskan
ε = Abortivitas molar b = Panjang medium
c = Konsentrasi atom-atom yang menyerap sinar A = Absorbans
Dari persamaan (14) dan (15) dapat disimpulkan bahwa absorbansi cahaya berbanding lurus dengan konsentrasi atom (Day and Underwood, 1989).
Kadar ion logam yang teradsorpsi maupun yang terdapat dalam adsorben dapat diketahui dengan menggunakan SSA. Ion logam yang teradsorpsi dihitung secara kuantitatif berdasarkan selisih konsentrasi ion logam sebelum dan sesudah
adsorpsi (Yuliasari, 2003).
29
30
III. METODOLOGI PENELITIAN
A.Waktu dan Tempat
Penelitian ini telah dilaksanakan pada bulan Maret sampai Mei 2014 di
Laboratorium Kimia Anorganik Fisik dan Laboratorium Biokimia FMIPA
Universitas Lampung. Penyiapan alga Dunaliella sp di Balai Besar
Pengembangan Budidaya Laut Lampung (BBPBL). Identifikasi gugus fungsional menggunakan alat spektrofotometer IRdan kadar ion logam yang teradsorpsi
dilakukan análisis menggunakan SSA.
B.Alat dan Bahan
Peralatan yang digunakan pada penelitian ini antara lain alat-alat gelas yang biasa
digunakan di laboratorium, yaitu labu erlenmeyer, spatula, pengaduk, gelas
kimia, gelas ukur, pipet tetes, corong, neraca analitik, oven, labu ukur, pH
indikator universal, sentrifuse, spektrofotometer IR, dan SSA.
Bahan-bahan yang digunakan pada penelitian ini adalah biomassa alga Dunaliella
sp, akuades, larutan CaCl2·2H2O, larutan CuSO4·5H2O, larutan CdSO4·8H2O,
31
C.Prosedur Penelitian
1. Penyiapan Biomassa Alga
Alga dalam bentuk nata dipreparasi di BBPBL Lampung. Alga yang diperoleh kemudian dikeringkan selama 3 hari. Selanjutnya dioven pada suhu 40°C selama 2-3 jam. Setelah dioven alga digerus hingga berukuran 200 mesh.
2. Karakterisasi Material
Biomassa alga Dunaliella sp dikarakterisasi dengan IR untuk mengetahui gugus-gugus fungsional utama yang terkandung dalam alga tersebut.
3. Uji Adsorpsi
a. Penentuan Dosis Optimum Biomassa Alga
Alga Dunaliella sp sebanyak 0,1; 0,2; 0,3; 0,4; dan 0,5 gram masing-masing
dimasukkan ke dalam labu erlenmeyer dan ditambahkan 25 mL larutan
CaCl2·2H2O dengan konsentrasi ion Ca2+ 100 mg L-1 lalu diaduk dengan
pengaduk selama 1 jam kemudian disentrifugasi selama beberapa menit. Filtrat
yang diperoleh kemudian dianalisis dengan SSA. Prosedur ini diterapkan dengan
32
b. Penentuan pH Optimum
Dosis alga Dunaliella sp optimum (prosedur a) dimasukkan ke dalam 5 labu erlenmeyer. Kemudian sebanyak 25 mL larutan CaCl2·2H2Odengan konsentrasi ion Ca2+ 100 mg L-1 dengan pH berbeda, yaitu 3; 4; 5; 6; dan 7 (Buhani et al., 2012) ditambahkan ke dalam masing-masing labu erlenmeyer kemudian diaduk dengan pengaduk selama 1 jam lalu disentrifugasi selama beberapa menit. Filtrat yang diperoleh kemudian dianalisis dengan SSA. Prosedur ini diterapkan dengan larutan Cu2+ dan Cd2+ dengan konsentrasi masing-masing 100 mg L-1.
c. Penentuan Waktu Optimum
Dosis alga Dunaliella sp optimum (prosedur a) dimasukkan ke dalam 6 labu
erlenmeyer yang berbeda kemudian ditambahkan 25 mL CaCl2·2H2Odengan
konsentrasi ion Ca2+ 100 mg L-1 dan kondisi pH masing-masing labu erlenmeyer
dibuat optimum (prosedur b). Waktu pengadukan dibuat bervariasi, yaitu 0, 15,
30, 45, 60, dan 90 menit (Buhani et al., 2010). Setelah diaduk, larutan
disentrifugasi selama beberapa menit. Filtrat yang diperoleh kemudian dianalisis
dengan SSA. Prosedur ini diterapkan dengan larutan Cu2+ dan Cd2+ dengan
konsentrasi masing-masing 100 mg L-1.
d. Penentuan Konsentrasi Logam Optimum
Dosis alga Dunaliella sp optimum (prosedur a) dalam labu erlenmeyer
ditambahkan dengan larutan CaCl2·2H2O sebanyak 25 mL dengan konsentrasi ion
33
2010). Masing-masing labu erlenmeyer diaduk dengan waktu pengadukan
(prosedur c) dan pH optimum (prosedur b). Setelah pengadukan, larutan
disentrifugasi selama beberapa menit. Filtrat yang diperoleh kemudian dianalisis
dengan SSA. Prosedur ini diterapkan dengan larutan Cu2+ dan Cd2+ dengan
51
V. SIMPULAN DAN SARAN
A. Simpulan
Dari hasil yang diperoleh dari penelitian yang telah dilakukan, maka dapat diperoleh kesimpulan sebagai berikut:
1. Adsorpsi optimum dengan adsorben biomassa alga Dunaliella sp terjadi pada dosis biomassa alga sebesar 0,1 gram; pH 4; waktu interaksi 45 menit;
konsentrasi ion logam 300 mg L-1; dan temperatur 27°C.
2. Laju adsorpsi untuk ion Ca2+, Cu2+, dan Cd2+ cenderung mengikuti kinetika orde 2 dengan nilai k2 masing-masing adalah 0,28; 1,25; dan 2,10 g mg-1 menit-1.
3. Isoterm adsorpsi untuk ion Ca2+, Cu2+, dan Cd2+ cenderung mengikuti model isoterm adsorpsi Langmuir dengan nilai kapasitas adsorpsi masing-masing adalah 8,35; 16,76; dan 43,23 mg g-1.
4. Energi adsorpsi untuk ion logam Ca2+, Cu2+, dan Cd2+ masing-masing adalah 22,23; 22,07; dan 22,57 kJ mol-1. Energi adsorpsi yang diperoleh
52
B. Saran
54
DAFTAR PUSTAKA
Adamson, A. W. and A.P. Gast. 1997. Physical Chemistry of Surface. John Willy and Sons Inc. New York.
Aklil, A., M. Mouflih, and S. Sebti. 2004. Removal of heavy metal ions from water by using calcined phosphate as a new adsorbent. Journal of Hazardous Materials. 112 (3): 183-190.
Alberty, R.A. and F. Daniel. 1987. Physical Chemistry. John Willey and Sons Inc. New York.
Allen, S.J., G. Mckay, and J.F. Porter. 2004. Adsorption isotherm models for basic dye adsorption by peat in single and binary component systems. Journal of Colloid Interface Science. 280 (2): 322-333.
Almatsier, S. 2004. Prinsip Dasar Ilmu Gizi. PT Gramedia Pustaka Utama. Jakarta.
Al-Rub, F.A.A., M.H. El-Naas, I. Ashour, and M. Al-Marzouqi. 2006. Biosorption of copper on Chlorella vulgaris from single, binary and ternarymetal aqueous solutions. Process Biochemistry. 41 (2): 457–464.
Blais, J.F., B. Dufresne, and G. Mercier. 2000. State of the art of technologies for metal removal from industrial effluents. Revue des Sciences de l'Eau. 12 (4): 687-711.
55
Buhani, Suharso dan S.E. Putra. 2007. Isoterm Adsorpsi Ion Logam Pb(II), Cd(II) dan Cu(II) pada Biomassa Nannochloropsis sp. yang Diimobilisasi
Polietilamina-Glutaraldehida. Prosiding Seminar Ilmiah Hasil Penelitian di Universitas Lampung. Lampung.
Buhani, Narsito, Nuryono, and E.S. Kunarti. 2009. Amino and mercapto-silica hybrid for Cd(II) adsorption in aqueous aolution. Indonesian Journal of Chemistry. 9 (2): 170-176.
Buhani. 2010. Proses simultan sol gel dan imprinting ionik dalam pembuatan hibrida organo-silika untuk adsorben selektif logam transisi (Disertasi). Universitas Gadjah Mada. Yogyakarta.
Buhani, Suharso, and Sumadi. 2010. Adsorption kinetics and isotherm of Cd (II) ion on Nannochloropsis sp biomass imprinted ionic polymer. Desalination. 259 (1-3): 140-146.
Buhani, Suharso, and Sumadi. 2012. Production of ionic imprinted polymer from Nannochloropsis sp biomass its adsorption characteristic toward Cu(II) ion in solutions. Asian Journal of Chemistry. 24 (1): 133-140.
Buhani dan Suharso. 2012. Adsorpsi-desorpsi multi logam (Cd, Cu, Zn, Ni, Ag, dan Ca) pada adsorben Nannochloropsis sp-silika tercetak ion Cd(II). Prosiding Semirata BKS-PTN MIPA. Bandar Lampung.
Bulgariu, D. and L. Bulgariu. 2012. Equilibrium and kinetics studies of heavy metal ions biosorption on green algae waste biomass. Bioresource Technology. 103: 489-493.
Birlik, E., A. Ersoz, A. Denizli, and R. Say. 2006. Preconcentration of copper using double-imprinted polymer via solid phase extraction. Analytica Chimica Acta. 565 (2): 145-151.
Cervantes, C., J. Garcia, D. Silvia, F.G. Corona, H.L. Tavera, J. Gusman., and R.M. Sanchez. 2001. Interaction of chromium with microorganisms and plant. FEMS Microbiology Reviews, 25 (3): 335-347.
56
Cossich E.S., C.R.G. Tavares., and T.M.K. Ravagnani. 2002. Biosorption of chromium (III) by Sargassum sp biomass. Electronic Journal of Biotechnology. 5 (2): 1-6.
Cotton, F. A. and G. Wilkonson. 2009. Kimia Anorganik Dasar. UI-Press. Jakarta.
Darmono. 1995. Logam Dalam Sistem Biologi Makhluk Hidup. UI-Press. Jakarta.
Day, Jr. R. A. and A.L. Underwood. 1989. Analisis Kimia Kuantitatif. Erlangga. Jakarta
Dirjen POM Departemen Kesehatan Republik Indonesia. 1995. Farmakope Indonesia. Departemen Kesehatan Republik Indonesia. Jakarta.
Douglas, B., D. McDaniel, and J. Alexander. 1994. Concepts And Models of Inorganic Chemistry. John Wiley & Sons, Inc. New York.
Dyke, S. F., A. J. Floyd, M. Sainsbury, and R. S. Theobald. 1978. Organic Spectroscopy AN Introduction. Longman. London.
Elliot, H. A., M. R. Liberati, and C. P. Huang. 1986. Competitive adsorption of heavy metals by soil. Journal of Environmental Quality. 15 (3). 214-219.
Fessenden, R. J. and J. S. Fessenden. 1982. Kimia Organik. Erlangga. Jakarta.
Figueira, M.M., B. Volesky, and H. J. Mathieu. 1999. Instrumental analysis study of iron species biosorption by Sargassum biomass. Environmental Science and Technology. 33 (11): 1840-1846.
Fu, F. and Q. Wang. 2011. Removal of heavy metal ions from wastewater : A review. Journal of Environmental Management. 92 (3): 407-418.
Granner, D.K. 2003. Biokimia Harper. EGC. Jakarta.
57
Han, R., H. Li, J. Zhang, H. Xiao, and J. Shi. 2006. Biosorption of copper and lead ions by waste beer yeast. Journal of Hazardous Material. 137 (3): 1569-1576.
Handayani, C. D. Proses Kimia Terapan II Pembuatan CaCl2.2H2O. 16 September 2013.
https://www.academia.edu/6233170/Lap._Ca_Cl2_2H2O_ntin.
Harris, P. O. and G. J. Ramelow. 1990. Binding of Metal Ions by Particulate Quadricauda. Environmental Science and Technology. 24 (2): 220-227.
Ho, Y.S. and McKay, G. 2000. The kinetics of sorption of divalent metal ions onto sphagnum moss peat. Water Research. 34 (3): 735-742.
Housecroft, C. E. and A. G. Sharpe. 2005. Inorganic Chemistry. Prentice-Hall, Inc. New Jersey.
Huheey, J.E., E.A. Keiter, and R.L. Keiter. 1993. Inorganic Chemistry : Principles of Structure and Reactivity. Harpelcolling College Publisher. New York.
Husin, G. and C. M. Rosnelly. 2005. Studi kinetika adsorpsi larutan logam timbal menggunakan karbon aktif dari batang pisang. (Tesis). Fakultas Teknik Universitas Syiah Kuala Darrusalam. Banda Aceh.
Indriani, S.H. and S. Akira. 1998. Biosorption of Heavy Metal Ions to Brown Algae, Macrocystis pyrifera, Kjellmamiella crassiforia, and Undaria pinnatifida. Journal of Colloid Interface Science. 206 : 297-301.
Karaca, M. 2008. Biosorption of aqueous Pb2+, Cd2+, and Ni2+ ions by Dunaliella salina, Oocystis sp, Porphyridium cruentum, and Scenedesmus protuberans prior to atomic spectrometric determination. (Tesis). Izmir Institute of Technology. Turki.
58
Keenan, C.W. and W. Kleinfelter. 1984. Ilmu Kimia untuk Universitas. Erlangga. Jakarta.
Khasanah, E.N., 2006. Termodinamika adsorpsi Ag(I) dan Ni(II) pada hibrida amino-silika dari abu sekam padi. (Skripsi). FMIPA-UGM. Yogyakarta.
Khopkar, S.M. 2001. Konsep Dasar Kimia Analitik. UI Press. Jakarta.
Krauskopf, K. B. 1979. Introduction to geochemistry. International series in the earth and planetary scienes. McGraw-Hill. Tokyo.
Kuyucak, N. and B. Volesky. 1988. Biosorbent for recovery of metals from industrial solutions. Biotechnology Letters. 10 (2): 137-142.
Lahuddin, M. 2007. Aspek Unsur Mikro Dalam Kesuburan Tanah. USU Press. Medan.
Liu, Y., X. Chang, S. Wang, Y. Guo, B. Din, and S. Meng. 2004. Solid-phase extraction and preconcentration of cadmium(II) in aqueous solution with Cd(II)-imprinted resin (poly-Cd(II)-DAAB-VP) packed columns. Analytica Chimica Acta. 519 (2): 173-179.
Lyer, A., K. Mody, and B. Jha. 2005. Biosorption of heavy metals by a marine bacterium. Marine Pollution Bulletin. 50 (3): 175-179.
Martell, A. E. and R.D. Hancock. 1996. Metal Complexes in Aqueose Solution. Plenum Press. New York.
Mouflih, M., A. Aklil, N. Jahroud, M. Gourai, and S. Sebti. 2006. Removal of lead from aqueous solutions by natural phosphate. Hydrometallurgy. 81: 219-225.
59
Noll, K.E., V. Gournaris, and W.S. Hou. 1992. Adsorption Technology for Air and Water Polution Control. Lewish Publisher Inc. Michigan.
Oscik, J. 1982. Adsorption. Ellis Horwood Limited. England.
Palar, H. 1994, Pencernaan dan Toksikologi Logam Berat. PT Rineka Cipta. Jakarta.
Pang, Y., G. Zeng, L. Tang, Y. Zhang, Y. Liu, X. Lei, Z. Li, J. Zhang, and G. Xie. 2011. PEI-Grafted magnetic porous powder for highly effective adsorption of heavy metal ions. Desalination. 281: 278-284.
Patel, R. and S. Suresh. 2008. Kinetic and equilibrium studies on the biosorption of reactive black 5 dye by Aspergillus foetidus. Bioresource Technology. 99 (1): 51-58.
Patnaik, P. 2003 . Handbook of Inorganic Chemicals. McGraw-Hill Book Company. New York
Paulino, A.T., F. A. S. Minasse, M.R. Guilherme, A. V. Reis, E. C. Muniz, and J. Nozaki. 2006. Novel adsorbent based on silkworm chrysalides for removal of heavy metal from wastewaters. Journal of Colloid Interface Science. 301 (2): 479-487.
Putra, S.E. 2006. Tinjauan Kinetika dan Termodinamika Proses Adsorpsi Ion Logam Pb, Cd, dan Cu oleh Biomassa Alga Nannochloropsis sp yang Diimmobilisasi Polietilamina-Glutaraldehid. Laporan Penelitian. Universitas Lampung. Bandar Lampung.
Rome, L.D. and G.M. Gadd. 1987. Copper adsorption by Rhizopus arrhizus, Cladosporium resinae and Penicillium italicum. Applied Microbiology and Biotecnhology. 26 (1): 84-90.
Rousseau, R. W. 1987. Handbook Of Separation Process Technology. John Wiley and Sons Inc. United States.
60
Shukla, A., Y.H. Zhang, P. Dubey, J.L. Margravw, and S. Shukla. 2002. The role of sawdust in the removal of unwanted materials from water. Journal of Hazardous Material. 95 (1-2): 137-157.
Shamsipur, M., J. Fasihi, A. Khanchi, R. Hassani, K. Alizadeh, and H. Shamsipur. 2007. A stoichiometric imprinted chelating resin for selective recognition of copper(II) ions in aqueous media. Analytica Chimica Acta. 599 (2): 294-301.
Silverstein, R. M., F. X. Webster, and D. J. Kiemle. 2005. Spectrometric Identification of Organic Compounds. John Wiley and Sons. New York.
Srivastava, N.K. and C.B. Majumder. 2008. Novel biofiltration methods for the treatment of heavy metals from industrial wastewater. Journal of Hazardous Material. 151 (1): 1-8.
Stum, Z. and J.J. Morgan.1996. Aquatic Chemistry : Chemical Equilibria in Natural Water. John Willey and Sons Inc. New York.
Suhendrayatna. 2001. Bioremoval Logam Berat Dengan Menggunakan
Mikroorganisme: Suatu Kajian Kepustakaan. Seminar On-Air Bioteknologi untuk Indonesia Abad 21, 1-14 Februari 2001.
Sukarta, I.N. 2008. Adsorpsi ion Cr3+ oleh sebuk gergaji kayu albizia (Albizia falcata): studi pengembangan bahan alternatif penyerap limbah logam berat. (Tesis). IPB. Bogor.
Susilawati. 2009. Studi biosorpsi ion logam Cd(II) oleh biomassa alga hijau yang diimobilisasi pada silika gel. (Skripsi). FMIPA UI. Depok.
Sutamihardja, R.T.M., K. Adnan, and Sanusi. 1982. Perairan Teluik Jakarta Ditinjau dari Tingkat Pencemarannya. Fakultas Pascasarjana, Jurusan PSL. IPB. Bandung.
Syukri, S. 1999. Kimia Dasar 1. Penerbit ITB. Bandung.
61
Vijayaraghavan, K., K. Palanivelu, and M. Velan. 2006. Biosorption of copper(II) and cobalt(II) from aqueous solutions by crab shell particles. Bioresource Technology. 97 (12): 1411–1419.
Yang, J. and B. Volesky. 1999. Cadmium biosorption rate in protonated
Sargassum biomass. Environmental Science and Technology. 33 (5): 751-757.
Welz, B. 1985. Atomic Absorption Spectrometry. Verlagh Chemie Inc. Germany.
Yuliasari, L. 2003. Studi penentuan logam berat timbal (Pb) dan kadmium (Cd) dalam organ tubuh ayam broiler secara spektrofotometri serapan atom. (Skripsi). FMIPA Unila. Bandar Lampung.