HIDROKLORIDA DARI KITIN CANGKANG BELANGKAS
(
Tachypleus gigas
)
SKRIPSI
AURORA KHAIRANI NASUTION
110822008
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
(
Tachypleus gigas
)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat untuk mencapai gelar Sarjan Sains
AURORA KHAIRANI NASUTION
110822008
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : PEMBUATAN DAN KARAKTERISTIK
GLUKOSAMIN HIDROKLORIDA DARI KITIN CANGKANG BELANGKAS (Tachypleus gigas)
Kategori : SKRIPSI
Nama : AURORA KHAIRANI NASUTION
Nomor Induk Mahasiswa : 110822008
Program Studi : SARJANA (S1)KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di Medan, April 2013
Dosen Pembimbing II Dosen Pembimbing I
Prof.Dr.Zul Alfian,Msc Prof.Dr.Harry Agusnar,M. Sc,M.Phill NIP.195504051983031002 NIP.195308171983031002
Diketahui / Disetujui oleh:
Ketua Departemen Kimia FMIPA USU
PERNYATAAN
PEMBUATAN DAN KARAKTERISTIK GLUKOSAMIN HIDROKLORIDA DARI KITIN CANGKANG BELANGKAS (Tachypleus gigas)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, April 2013
PENGHARGAAN
Puji dan syukur ke hadirat Allah SWT, karena berkat rahmat dan karunia-Nya tugas akhir ini telah selesai disusun dalam rangka memenuhi kewajiban penulis sebagai salah satu syarat memperoleh gelar Sarjana Fakultas Matematika dan Ilmu Pengetahuan Alam di Universitas Sumatera Utara. Shalawat beriring salam penulis kirimkan kepada Nabi Muhammad SAW beserta keluarga dan para sahabat beliau..
Dalam penulisan tugas akhir ini penulis ingin mengucapkan rasa hormat dan terima kasih yang tak terhingga kepada ibunda dan ayahanda tercinta, Eny Herwanty dan Ir. H. Muhammad Faisal Nasution, buat adik-adikku Atikah Fattah Nasution, Mhd. Habib Burrahman Nasution, Aulia Zuhra Nasution, Ahmad Amir Saifullah, Radja Syahfurqon, atas cinta kasih, dukungan baik moril maupun materil, pengorbanan, serta doa tulus tiada hentinya demi kebaikan dan kebahagian penulis.
Selain itu penulis juga ingin megucapkan terima kasih yang sebesar-besarnya kepada:
1. Prof. Dr. Harry Agusnar,M.Sc, M.Phill selaku pembimbing 1 yang telah memberikan topik dan tunjuk ajar dalam penelitian ini dan banyak memberikan pengarahan dan bimbingan hingga terselesaikannya skripsi ini. 2. Prof. Dr.Zul Alfian.M.Sc. selaku dosen pembimbing 2 yang telah memberikan
saran hingga terselesaikannya penelitian ini.
3. Dr. Rumondang Bulan. MS dan Dr. Darwin Yunus, MS selaku Ketua dan Koordinator Departemen Kimia Ekstensi FMIPA USU.
4. Bapak dan Ibu Dosen yang telah memberikan ilmunya selama masa studi saya di FMIPA USU.
5. Dr. Eka Nuryanto M.Si staf di Lab Pusat Penelitian Kelapa Sawit (PPKS) yang banyak membantu dalam pengerjaan penelitian
6. Pak Aman Laboran di Lab Penelitian Kimia Analitik yang banyak meluangkan waktunya dan membantu penulis dalam pengerjaan penelitian
7. Teman seperjuangan saya Dina dan teman-teman satu stambuk 2010 yang tidaklah dapat saya sebutkan satu per satu namanya, namun sungguh sangat berkesan di hati saya. Terima kasih karena kalian telah menambah warna dalam hidup saya.
8. Serta segala pihak yang telah membantu saya menyelesaikan skripsi ini. Untuk itu semua, semoga Allah membalasnya dengan segala yang terbaik. Amin.
mengharapkan kritik dan saran yang membangun demi kesempurnaan skripsi ini, dan semoga skripsi ini bermanfaat bagi kita semua.
Medan, April 2013
ABSTRAK
Pembuatan glukosamin hiroklorida dari kitin cangkang belangkas dengan menggunakan metode hidrolisis kimia telah dilakukan dengan menggunakan perbandingan variasi konsentrasi HCl 20%, 25%, 30%, 37% dengan perbandingan 9:1 (v/w) selama 4 jam pada suhu 90oC. Penentuan karakteristik glukosamin hidroklorida dilakukan dengan menggunakan analisis Spektroskopi Fourier Transform Infra Red (FT-IR), dimana karakteristik glukosamin hidroklorida yang diperoleh pada gugus O-H glukosamin O-HCl 20% = 3446 cm-1 (s), 25% = 3448 cm-1 (s), 30% = 3450 cm-1 (s), 37% = 3448 cm-1 (s). Untuk gugus N-H pada glukosamin HCl 20% = 1557 cm-1 (s), 25% = 1559 cm-1 (s), 30% = 1556 cm-1 (s), 37% = 1560 cm-1 (s). Untuk gugus C-N pada glukosamin HCl 20% = 1379 cm-1 (m), 25% = 1379 cm-1 (m), 30% = 1379 cm-1 (m), 37% = 1379 cm-1 (m). Untuk ikatan glikosida pada glukosamin HCl 20% = 1073 cm-1 (w), 25% = 1074 cm-1 (w), 30% = 1074 cm-1 (w), 37% = 1074 cm-1 (w). Penentuan konsentrasi glukosamin hidroklorida dengan analisis Spektrofotometer UV-Visble pada panjang gelombang maksimum 197 nm dengan larutan standar N-asetilglukosamin dalam larutan asam fosfat 0,005%. Dimana diperoleh konsentrasi glukosamin hidroklorida 20% = 33,67 ppm, 25% = 36,35 ppm, 30% = 40,16 ppm, 37% = 43,97 ppm.
Determination and Characterization of Glucosamine Hydrochloride from Chitin Shells of Horseshoe Crab (Tachypleus gigas)
ABSTRACT
Preparation of glucosamine hydrochloride from chitin shells of horseshoe crab using chemical hydrolysis method has been done using HCl concentration variation ratio of 20%, 25%, 30%,37% with a ratio of 9:1 (v/w) for 4 hours at a temperature of 90oC. Determination of glucosamine hydrochloride characteristics using Spectroscopy Fourier Transform Infra Red (FT-IR), in which the characteristics of glucosamine hydrochloride obtained in the O-H group of glucosamine hydrochloride 20% = 3446 cm-1 (s), 25% = 3448 cm-1 (s), 30% = 3450 cm-1 (s), 37% = 3448 cm-1 (s). For N-H group of glucosamine hydrochloride 20% = 1557 cm-1 (s), 25% = 1559 cm-1 (s), 30% = 1556 cm-1 (s), 37% = 1560 cm-1 (s). For C-N group of glucosamine hydrochloride 20% = 1379 cm-1 (m), 25% = 1379 cm-1 (m), 30% = 1379 cm-1 (m), 37% = 1379 cm-1 (m). And for glycoside bond of glucosamine hydrochloride 20% = 1073 cm-1 (w), 25% = 1074 cm-1 (w), 30% = 1074 cm-1(w), 37% = 1074 cm-1 (w). Determination of the concentration of glucosamine hydrochloride with UV-Visble Spectrophotometer analysis at a maximum wavelength of 197 nm with standard solution of N-acetilglucosamine in a solution of phospat acid 0,005%. Where to obtained the concentration of glucosamine hydrochloride 20% = 33,67 ppm, 25% = 36,35 ppm, 30% = 40,16 ppm, 37% = 43,97 ppm.
DAFTAR ISI
Halaman
PERSETUJUAN i
PERNYATAAN ii
PENGHARGAAN iii
ABSTRAK v
ABSTRACT vi
DAFTAR ISI vii
DAFTAR TABEL x
DAFTAR LAMPIRAN xi
DAFTAR GAMBAR xii
BAB 1 PENDAHULUAN
1.1 Latar Belakang 1
1.2 Permasalahan 2
1.3 Pembatasan masalah 3
1.4 Tujuan Penelitian 3
1.5 Manfaat Penelitian 3
1.6 Lokasi Penelitian 3
1.7 Metodologi Penelitian 3
BAB 2 TINJAUAN PUSTAKA
2.1 Glukosamin 4
2.1.1 Penyediaan Glukosamin 5
2.2 Belangkas 6
2.3 Kitin 8
2.3.1 Sifat Kitin 10
2.4 Spektrofotometer Ultraviolet (UV) 11
2.4.1 Peralatan untuk Spektrofometer 12
2.5 Spektroskopi FTIR 13
2.5.1 Peralatan untuk Spektrofotometer Inframerah 14
2.5.2 Spektrum Inframerah untuk Glukosamin 16
BAB 3 BAHAN DAN METODOLOGI
3.1. Bahan - Bahan 17
3.2. Alat – alat 17
3.3. Prosedur Penelitian 18
3.3.1 Penyediaan Larutan Pereaksi 18
3.3.1.1 Pembuatan NaOH 0,5% 18
3.3.1.2 Pembuatan NaOH 5% 18
3.3.3 Proses Hidrolisis Glukosamin Hidroklorida 19 3.3.4 Analisis Glukosamin Hidroklorida dengan FTIR 19 3.3.5 Analisis Glukosamin Hidroklorida dengan Spektrofotometer
Ultraviolet 20
3.3.5.1 Untuk larutan Asam Fospat 20
3.3.5.2 Untuk N-asetilglukosamin 20
3.3.5.3 Untuk Glukosamin Hidroklorida 20
3.4. Bagan Penelitian 21
3.4.1 Proses Penyediaan Kitin (Agusnar,H. 2006) 21 3.4.2 Proses Hidrolisis Glukosamin Hidroklorida dengan HCl
(Mojarrad et al.2006) Yang Telah Dimodifikasi 22 3.4.3 Analisis Larutan Asam Fospat dengan Spektrofotometer
3.4.4 Analisis N-asetilglukosamin dengan Spektrofotometer
Ultraviolet (Muzzarelli,1978) Yang Telah Dimodifikasi 24 3.4.5 Analisis Larutan Glukosamin Hidroklorida dengan
Spektrofotometer Ultraviolet (Muzzarelli,1978) Yang
Telah Dimodifikasi 25
BAB 4 HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian 26
4.1.1 Penyediaan Kitin 26
4.1.2 Penentuan Karakteristik Glukosamin Hidroklorida dengan
FTIR 28
4.1.3 Penentuan Konsentrasi Glukosamin Hidroklorida dengan
Spektrofotometer Ultraviolet 28
4.1.4 Penentuan Persamaan Garis Regresi dengan Metode Least
Square 31
4.2. Pembahasan 35
BAB 5 KESIMPULAN DAN SARAN
5.1. Kesimpulan 39
5.2. Saran 39
DAFTAR TABEL
Halaman
Tabel 2.1. Kandungan kitin pada berbagai Crustacea 9
Tabel 4.1. Data Persen Hasil Kitin dari Cangkang Belangkas Metode
Agusnar,H. (2006) 26
Tabel 4.2. Data Karakteristik Glukosamin Hidroklorida dengan FTIR 28
Tabel 4.3. Data Pengukuran Absorbansi untuk Asam Fospat pada = 1λ7 nm 29
Tabel 4.4. Data Pengukuran Absorbansi untuk N-asetilglukosamin dalam
Asam Fospat 0,005% pada = 1λ7 nm 30
Tabel 4.5 Penurunan Persamaan Garis Regresi untuk Penentuan Konsentrasi Kadar Glukosamin Hidroklorida Berdasarkan Pengukuran Absorbansi
Standar N-asetilglukosamin 32
Tabel 4.6.Data Pengukuran Absorbansi untuk Sampel Glukosamin Hidroklorida
pada = 1λ7 nm 33
Tabel 4.7. Data Perhitungan Konsentrasi Sampel dengan Spektrofotometer
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Spektrum kitin hasil pengujian FTIR 39
Lampiran 2. Spektrum Glukosamin HCl hasil pengujian FTIR dan
DAFTAR GAMBAR
Halaman Gambar 2.1 (a) Struktur kimia glukosamin dan (b) glukosamin hidrklorida
(Mojarrad,et al. 2006) 5
Gambar 2.2 Belangkas 7
Gambar 2.3 Struktur kimia kitin 8
Gambar 2.4 Bagan Alat Spektrofotometer 13
Gambar 2.5 Bagan Alat Spektroskopi Inframerah 15
Gambar 4.1 Kurva Kalibrasi Asam Fospat 29
Gambar 4.2. Kurva Kalibrasi N-asetilglukosamin 31
Gambar a. Spektrum FTIR Kitin Belangkas 41
Gambar b. Spektrum FTIR Glukosamin HCl dari HCl 20% 42
Gambar c. Spektrum FTIR Glukosamin HCl dari HCl 25% 43
Gambar d. Spektrum FTIR Glukosamin HCl dari HCl 30% 44
Gambar e. Spektrum FTIR Glukosamin HCl dari HCl 37% 45
Gambar f. Spektrum FTIR Glukosamin perbandingan konsentrasi HCl 46
ABSTRAK
Pembuatan glukosamin hiroklorida dari kitin cangkang belangkas dengan menggunakan metode hidrolisis kimia telah dilakukan dengan menggunakan perbandingan variasi konsentrasi HCl 20%, 25%, 30%, 37% dengan perbandingan 9:1 (v/w) selama 4 jam pada suhu 90oC. Penentuan karakteristik glukosamin hidroklorida dilakukan dengan menggunakan analisis Spektroskopi Fourier Transform Infra Red (FT-IR), dimana karakteristik glukosamin hidroklorida yang diperoleh pada gugus O-H glukosamin O-HCl 20% = 3446 cm-1 (s), 25% = 3448 cm-1 (s), 30% = 3450 cm-1 (s), 37% = 3448 cm-1 (s). Untuk gugus N-H pada glukosamin HCl 20% = 1557 cm-1 (s), 25% = 1559 cm-1 (s), 30% = 1556 cm-1 (s), 37% = 1560 cm-1 (s). Untuk gugus C-N pada glukosamin HCl 20% = 1379 cm-1 (m), 25% = 1379 cm-1 (m), 30% = 1379 cm-1 (m), 37% = 1379 cm-1 (m). Untuk ikatan glikosida pada glukosamin HCl 20% = 1073 cm-1 (w), 25% = 1074 cm-1 (w), 30% = 1074 cm-1 (w), 37% = 1074 cm-1 (w). Penentuan konsentrasi glukosamin hidroklorida dengan analisis Spektrofotometer UV-Visble pada panjang gelombang maksimum 197 nm dengan larutan standar N-asetilglukosamin dalam larutan asam fosfat 0,005%. Dimana diperoleh konsentrasi glukosamin hidroklorida 20% = 33,67 ppm, 25% = 36,35 ppm, 30% = 40,16 ppm, 37% = 43,97 ppm.
Determination and Characterization of Glucosamine Hydrochloride from Chitin Shells of Horseshoe Crab (Tachypleus gigas)
ABSTRACT
Preparation of glucosamine hydrochloride from chitin shells of horseshoe crab using chemical hydrolysis method has been done using HCl concentration variation ratio of 20%, 25%, 30%,37% with a ratio of 9:1 (v/w) for 4 hours at a temperature of 90oC. Determination of glucosamine hydrochloride characteristics using Spectroscopy Fourier Transform Infra Red (FT-IR), in which the characteristics of glucosamine hydrochloride obtained in the O-H group of glucosamine hydrochloride 20% = 3446 cm-1 (s), 25% = 3448 cm-1 (s), 30% = 3450 cm-1 (s), 37% = 3448 cm-1 (s). For N-H group of glucosamine hydrochloride 20% = 1557 cm-1 (s), 25% = 1559 cm-1 (s), 30% = 1556 cm-1 (s), 37% = 1560 cm-1 (s). For C-N group of glucosamine hydrochloride 20% = 1379 cm-1 (m), 25% = 1379 cm-1 (m), 30% = 1379 cm-1 (m), 37% = 1379 cm-1 (m). And for glycoside bond of glucosamine hydrochloride 20% = 1073 cm-1 (w), 25% = 1074 cm-1 (w), 30% = 1074 cm-1(w), 37% = 1074 cm-1 (w). Determination of the concentration of glucosamine hydrochloride with UV-Visble Spectrophotometer analysis at a maximum wavelength of 197 nm with standard solution of N-acetilglucosamine in a solution of phospat acid 0,005%. Where to obtained the concentration of glucosamine hydrochloride 20% = 33,67 ppm, 25% = 36,35 ppm, 30% = 40,16 ppm, 37% = 43,97 ppm.
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Glukosamin merupakan senyawa pembangun penting untuk sendi tulang rawan yang berperan sebagai bantalan pada ujung tulang dan mencegah tulang dari keretakan saat bergerak. Glukosamin di dalam tubuh menjaga agar tulang rawan tidak mengalami pengapuran lebih cepat. Selain itu glukosamin juga bermanfaat untuk merangsang pembentukan dan pemulihan jaringan tulang rawan yang rusak dan membantu mengurangi rasa nyeri pada sendi. Tulang membutuhkan kalsium, sedangkan sendi membutuhkan glukosamin agar bebas bergerak dan terhindar dari nyeri sendi. Tulang rawan sangatlah berperan penting karena berfungsi sebagai pelumas, meredam benturan-benturan antartulang, dan menghambat kehancuran tulang. Tulang yang mengandung zat perekat dan sedikit zat kapur ini menjaga agar tulang-tulang keras tidak saling berbenturan sehingga dapat menimbulkan nyeri sendi.
Secara normal, rawan sendi memiliki permukaan yang licin. Biasanya terjadi robekan-robekan kecil yang kemudian dapat diperbaiki oleh tubuh sendiri. Tetapi seiring bertambahnya usia, robekan-robekan tersebut tidak bisa lagi diperbaiki oleh tubuh karena kemampuan mensintesa glukosamin berkurang. Selain itu, dengan bertambahnya usia maka sel-sel kolagen juga berkurang.
Kemampuan tubuh untuk mensintesa glukosamin akan berkurang seiring dengan bertambahnya usia dan ini dapat menyebabkan penyakit osteoarthritis dan menyebabkan nyeri sendi. Oleh sebab itu agar rawan sendi tetap terpelumas dengan baik dianjurkan agar menambah glukosamin dengan asupan dari luar. Hal ini menyebabkan konsumsi glukosamin di seluruh dunia meningkat dalam jumlah yang besar, sehingga metode handal dioptimalkan untuk mempersiapkan glukosamin dengan produk kualitas tinggi.
Glukosamin (2-amino-2-deoxyglucose, chitosamine) adalah gula amino yang diperoleh dari hidrolisis kitin. Kitin terutama dihasilkan dari kulit luar golongan
cara hidrolisis rangka luar golongan Crustacea seperti udang dan kepiting. Produk glukosamin untuk penderita penyakit arthritis biasanya dirumuskan sebagai garam hidroklorida atau glukosamin sulfat dan sering digabungkan dengan chondroitin sulfat. Dimana glukosamin memiliki peran penting dalam pembentukan dan perbaikan tulang rawan, sedangkan chondroitin berperan penting dalam membantu elastisitas tulang rawan.
Telah dilakukan beberapa penelitian mengenai hidrolisis glukosamin. Rotta Research Laboratorium (1978) melaporkan bahwa glukosamin sulfat telah berhasil dipreparasi dengan perendaman kitin dalam larutan asam sulfat, namun reaksi ini menghasilkan rendemen dalam jumlah yang kecil. Untuk menghindari masalah ini, Mojarrad, et al. (2006) menyampaikan bahwa glukosamin sulfat dapat dibuat terlebih dahulu dengan merefluks kitin dengan larutan asam klorida untuk menghasilkan glukosamin hidroklorida kemudian ditambahkan baik kalium sulfat atau natrium sulfat sehingga diperoleh glukosamin sulfat.
Penelitian mengenai hidrolisis glukosamin hidroklorida sebelumnya telah dilakukan oleh Mojarrad, et al. (2006) dengan menggunakan kitin dari kulit udang. Begitu juga Kralovec & Barrow (2008) telah melakukannya pada udang, kepiting, dan lobster. Dengan alasan tersebut, peneliti berkeinginan untuk membuat glukosamin hidroklorida dengan menggunakan hidrolisis kitin dari cangkang belangkas, sehingga kita dapat melihat perbandingan karakteristik glukosamin hidroklorida yang dihidrolisis dari kitin cangkang belangkas.
1.2 Permasalahan
1.3 Pembatasan Masalah
- Penelitian ini dibatasi dengan pengunaan kitin dari cangkang belangkas
- Penelitian ini hanya dibatasi pada penentuan glukosamin hidroklorida dari kitin dengan variasi konsentrasi HCl 20%, 25%, 30%, 37%, kemudian dianalisa karakteristisasi dengan FT-IR dan Spektrofotometer Ultraviolet
1.4 Tujuan Penelitian
Tujuan penelitian adalah untuk pembuatan glukosamin hidroklorida dari hidrolisis kitin cangkang belangkas dan mengetahui karakteristik serta konsentrasi glukosamin hidroklorida yang diperoleh.
1.5 Manfaat Penelitian
Hasil dari penelitian ini diharapkan dapat memberikan informasi tentang pembuatan glukosamin hidroklorida dari kitin cangkang belangkas.
1.6 Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Penelitian Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara, Analisa Spectroscopy FT-IR
(Fourier Transform-Infra Red) di Laboratorium Penelitian Pusat Penelitian Kelapa
Sawit (PPKS).
1.7 Metodologi Penelitian
BAB 2
TINJAUAN PUSTAKA
2.1 Glukosamin
Glukosamin (2-amino-2-deoxyglucose, chitosamine) adalah gula amino yang diperoleh dari hidrolisis kitin. Kitin terutama dihasilkan dari kulit luar golongan
Crustacea, Artropoda, dan cendawan. Dalam industri, glukosamin diproduksi dengan
cara hidrolisis rangka luar golongan Crustacea seperti udang dan kepiting. Glukosamin pertama kali diidentifikasi oleh Dr. Georg Ledderhose pada tahun 1876, tapi struktur stereokimia tidak sepenuhnya diketahui sampai ditemukan oleh Walter Haworth pada tahun 1939. Glukosamin dalam tubuh manusia bergabung dalam struktur tulang rawan dan bekerja untuk merangsang dan memperbaiki fungsi sendi. Telah terbukti keefektifan glukosamin dalam banyak uji ilmiah yang menyatakan bahwa glukosamin dapat mengurangi rasa sakit penyakit osteoarthritis, membantu dalam rehabilitasi tulang rawan, memperbaharui cairan sinovial, dan memperbaiki sendi yang telah rusak. (Mojarrad, et al. 2006)
Glukosamin telah dievaluasi sebagai sebuah agen terapi untuk penyakit radang sendi di German sejak 1969. Senyawa glukosamin sulfat dat diturunkan dari kitin. Dapat juga dihasilkan dengan cara sintetik. Di Eropa, glukosamin tersedia sebagai obat resep. Di UK atau Amerika Utara, glukosamin tersedia sebagai makanan suplemen diet.
sinovial, kulit, tulang, kuku, katup jantung, pembuluh darah, sekresi lendir dalam pencernaan, pernafasan, dan sistem kemih.
O
Gambar 2.1. (a) Struktur kimia glukosamin dan, (b) glukosamin hidroklorida
Dalam klinis, glukosamin dapat diberikan melalui intravena, intramuskular, intra artikular dan rute oral. Sekitar 70% oral glukosamin sulfat diserap melalui usus dan dikeluarkan melalui sistem ginjal. Sebagian besar uji klinis pada oral glukosamin digunakan glukosamin dosis standar, 500 mg diminum tiga kali sehari, dengan atau tanpa mengkonsumsi obat nyeri yang disarankan untuk pasien.
Penelitian laboratorium menunjukkan bahwa glukosamin dapat diserap melalui saluran pencernaan. Studi radioisotop telah menunjukkan bahwa distribusi glukosamin cepat ke seluruh tubuh dengan penyerapan selektif oleh artikular tulang rawan. Penelitian vitro menunjukkan bahwa glukosamin dapat menstimulasi glukosaminoglikan dan sintesis proteoglikan dalam gabungan jaringan. Dalam studi hewan, dosis tinggi glukosamin telah terbukti memiliki efek anti inflamasi ringan. (Martin, C.W. 2004)
2.1.1 Penyediaan Glukosamin
Glukosamin sulfat dapat dibuat dengan merefluks kitin dengan larutan asam sulfat, namun reaksi ini memiliki hasil yang rendah. larutan asam sulfat dapat mengoksidasi kelompok alkohol primer dan sekunder dalam kitin atau glukosamin. Glukosamin sulfat sangat higroskopis yang sangat cepat terdegradasi (dari putih menjadi putih kecokelatan) bila terkena uap air. Untuk menghindari masalah ini, glukosamin sulfat dibuat dari glukosamin hidroklorida dengan menambahkan baik kalium atau natrium sulfat dan hasil campurannya dikokristalisasi. Glukosamin sulfat, fosfat, dan garam hidroiodin juga disiapkan dengan melewatkan larutan glukosamin hidroklorida melalui resin penukar anion yang telah dikondisikan dengan asam sulfat, asam fosfor, asam hidroiodin, atau garam logam dari satu asam ini. Penyusunan glukosamin hidroklorida dari kitin merupakan reaksi hidrolisis sederhana. Selama reaksi ini, kitin dideasetilasi dan didepolimerisasi menjadi glukosamin hidroklorida dengan adanya larutan asam klorida.
Kamasastri dan Prabhu menyiapkan glukosamin dari kitin dengan perlakukan penambahan klorida pekat berlebih. Kocourek, et al. kitin dihidrolisis dengan asam klorida 37% dalam wadah air mendidih. Inoue mengusulkan 2,5 L asam klorida 20% untuk hidrolisis 594,7 g kitin, yang telah diperoleh dari kerangka luar udang. Alphan menggunakan asam klorida 37% pada suhu 100oC dengan larutan asam pada perbandingan larutan 5:1. Ingle, et al. menerapkan 3 bagian asam klorida 20% pada suhu 100oC selama 2 jam dengan pengadukan untuk hidrolisis kitin. (Mojarrad, et al. 2006).
2.2 Belangkas
bahasa Jawa untuk yang berkelamin jantan dan Mintuna adalah untuk yang berkelamin betina.
Belangkas di dalam tangga klasifikasi ilmiah termasuk ke dalam filum Arthropoda (hewan beruas-ruas) di mana hewan-hewan seperti kepiting, serangga, dan kelabang juga termasuk ke dalam filum ini. Dasar dari penggolongan tersebut adalah karena belangkas memiliki 6 pasang kaki dan tubuh yang beruas-ruas. Ada 4 spesies belangkas yang diketahui oleh manusia dan masih hidup di masa kini di mana keempat spesies tersebut digolongkan ke dalam famili Limulidae.
(Sumber : Abbas, 2012) Gambar 2.2. Belangkas
Klasifikasi Belangkas
Kingdom : Animalia
Filum : Arthropoda
Kelas : Merostomata
Ordo : Xiphosura
Jenis-jenis :
1. Genus Carcinoscorpius
Carcinoscorpius rotundicauda, hidup di perairan mangrove Asia Tenggara
2. Genus Limulus
Limulus polyphemus, menghuni pantai-pantai timur Amerika Utara
3. Genus Tachypleus
- Tachypleus gigas, menghuni pantai Asia Tenggara dan Asia Selatan
- Tachypleus tridentatus, menghuni pantai-pantai Asia Timur (Abbas, 2012)
2.3 Kitin
Kitin merupakan poli (2-asetamido-2-deoksi- -(1→4)-D-glukopiranosa) dengan rumus molekul (C8H13NO5)n yang tersusun atas 47% C, 6% H, 7% N, dan
40% O. struktur kitin menyerupai struktur selulosa dan hanya berbeda pada gugus yang terikat di posisi atom C-2 kitin adalah gugus N-asetil (-NHCOCH3, asetamida).
O
HOH2C
HO
O
NHCOCH3
*
*
n
jamur dari gugus Mucor, Phycomyces, dan Saccharomyces (Hirano, 1986; Knorr, 1991). Keberadaan kitin di alam umumnya terikat dengan protein, mineral, dan berbagai macam pigmen. Sebagai contoh, kulit udang mengandung 25-40% protein, 40-50% CaCO3, dan 15-20% kitin, tetapi besarnya komponen tersebut masih
bergantung pada jenis udangnya (Altschul, 1976). Sebagian besar kelompok
Crustacea, seperti kepiting, udang, dan lobster, merupakan sumber utama kitin
komersial. Di dunia, kitin yang diproduksi secara komersial 120 ribu ton per tahun. Kitin yang berasal dari kepiting dan udang besar 39 ribu ton (32,5%) dan dari jamur 32 ribu ton (26,7%)(Knorr, 1991).
Tabel 2.1. Kandungan kitin pada berbagai Crustacea
Sumber : Hirano, 1986
Jenis Organisme Kandungan Kitin (%)
Kepiting Cancer 72, 1c
Kepiting (Carcinus) 0,4-3,3
Kepiting Biru (Callinectes) 14a Kepiting Matsuba (Chionecetes) 25,9d
Kepiting (Erimacrus) 18,4d
Hemigraprapsus 10,6d
Kepiting Raja (Paralithodes) 35b 10,4a Kepiting Merah (Pleuroncodes) 1,3 1,8b
Udang Alaska 28d
Udang Crangon 5,8b 11,6d 69,1c
Metapenaeus 32,4d
Lobster (Nephrops) 69,8c
Lobster (Homarus) 60,8-77,0c
Penaeus 25d
Keterangan:
a
Berdasarkan bobot bahan basah
b
Berdasarkan bobot bahan kering
c
Berdasarkan bobot bahan organik pada kulit luar
d
Berdasarkan bobot kering total kulit luar
2.3.1 Sifat Kitin
Kitin merupakan bahan yang tidak beracun dan bahkan mudah terurai secara hayati (biodegradable). Bentuk fisiknya merupakan padatan amorf yang berwarna putih dengan kalor spesifik 0,373 ± 0,03 kal/g/oC (Knorr, 1984) dan derajat rotasi
spesifik [α]D18
+22o pada kosentrasi asam metanasulfonat 1,0%. Sebagai biopolymer
kristalin, kitin terdapat dalam γ bentuk Kristal di alam, yaitu α, , dan . Kitin- α berbentuk Kristal ortorombik dengan setiap unit selnya mengandung 4 cincin N
-asetil-D-glukosamina yang ditautkan dengan β ikatan glikosidik -(1→4) dan tertara secara
antiparalel, rapat, dan kompak. Kitin- berbentuk kristalin monoklin dan setiap unitnya terdiri atas 2 cincin N-asetil-D-glukosamina dan 2 molekul air yang tertara secara parallel. Sementara struktur kitin- diduga dalam β penataan, yaitu β rantai paralel dan 1 antiparalel. Ketiga bentuk kristalin tersebut dapat dibedakan dengan menggunakan spektroskopi IR pada bilangan gelombang 3160 dan 3190 cm-1.
Kitin hampir tidak larut dalam air, asam encer, dan basa, tetapi larut dalam asam formiat, asam metanasulfonat, N,N-dimetilasetalmida yang mengandung 5% litium klorida, heksafluoroisopropil alkohol, heksafluoroaseton dan campuran 1,2-dikloroetana-asam trikloroasetat dengan nisbah 35:65 (% [v/v])(Hirano, 1986). Asam mineral pekat seperti H2SO4, HNO3, dan H3PO4 dapat melarutkan kitin sekaligus
menyebabkan rantai panjang kitin terdegradasi menjadi satuan-satuan yang lebih kecil (Bastaman,1989).
2.3.2. Kegunaan Kitin dan Kitosan
mikroalga, pewarna, residu pestisida, lemak tanin, PCB (poliklorinasi bifenil), mineral dan asam organik, media kromatografi afinitas, gel dan pertukaran ion, penyalut berbagai serat alami dan sintetik, pembentukan film dan membran mulai terurai, meningkatkan kualitas kertas, pulp, dan produk tekstil. Sementara dibidang pertanian dan pangan kitin dan kitosan digunakan sebagai pencampur ransum pakan ternak, antimikrob, antijamur, serat bahan pangan, penstabil, pembentuk gel, pembentuk tekstur, pengental dan pengemulsi produk olahan pangan, pembawa zat aditif makanan, flavor, zat gizi, pestisida, herbisida, virusida tanaman, dan deasedifikasi buah-buahan, sayuran dan penjernih sari buah. Fungsinya sebagai antimikroba dan antijamur juga diterapkan dibidang kedokteran kitin dan kitosan dapat mencegah pertumbuhan Candida albican dan Staphvlacoccus aureus. Selain itu bipolimer tersebut juga berguna sebagai antikoagulan, antitumor, antivirus, pembuluh darah-kulit dan ginjal sintetik, bahan pembuat lensa kontak, aditif kosmetik, membran di alis, bahan shampoo dan kondisioner rambut, zat hemostatik, penstabil liposom,bahan ortoprdik, pembalut luka dan benang bedah yang mudah diserap, serta mempertinggi daya kekebalan, antiinfeksi. (Purwantiningsih,S. 2009).
2.4 Spektrofotometer Ultraviolet (UV)
telah kita lihat, absorpsi juga tergantung pada panjang gelombang radiasi dan tabiat jenis zat molekular dalam larutan.
Hubungan antara absorpsi radiasi dan panjang jalan melalui medium yang menyerap pertama kali dirumuskan oleh Bouguer (1729), meskipun kadang-kadang dianggap berasal dari Lambert (1768). Marilah kita membagi sebuah medium penyerap yang homogen, seperti suatu larutan kimia, menjadi lapisan-lapisan maya, masing-masing dengan ketebalan yang sama. Jika suatu sinar radiasi monokhromatik (yaitu radiasi dari satu panjang gelombang tunggal) diarahkan melewati medium, diketahui bahwa tiap lapisan menyerap bagian yang sama dari radiasi, atau tiap lapisan mengurangi tenaga radiasi sinar dengan bagian yang sama. Pernyataan persamaan ini dapat berbunyi: Tenaga radiasi yang ditransmisikan berkurang secara eksponensial jika tebal medium penyerap bertambah secara aritmatik.
Hubungan antara konsentrasi macam zat penyerap dan besarnya absorpsi dirumuskan oleh Beer dalam tahun 1859. Hukum beer analog dengan hukum Bouguer dalam menguraikan pengurangan eksponensial dalam tenaga transmisi dengan satuan peningkatan aritmatik dalam konsentrasi. Hukum Beer dapat digunakan dengan tepat hanya untuk radiasi monokhromatik dan sifat macam zat yang menyerap ditetapkan di atas jangkauan konsentrasi yang bersangkutan, maka disebut “penyimpangan” dari hukum Beer.
Hukum-hukum Baouguer dan Beer dengan mudah digabung menjadi pernyataan yang sesuai. Kita mengetahui bahwa dalam mempelajari akibat perubahan konsentrasi terhadap absorpsi, jarak jalan lewat larutan harus dibuat tetap, tetapi hasil-hasil yang diukur akan tergantung pada besarnya harga tetapan.
2.4.1 Peralatan untuk Spektrofotometer
(Sumber : Underwood,A.L. 1983) Gambar 2.4. Bagan Alat Spektrofotometer
Unsur-unsur terpenting suatu spektrofotometer yaitu:
1. Sumber energi radiasi yang kontiniu dan meliputi daerah spektrum, dimana alat ditujukan untuk dijalankan.
2. Monokhromator, yang merupakan suatu alat untuk mengisolasi suatu berkas sempit dari panjang gelombang-panjang gelombang dari spektrum yang luas yang disiarkan oleh sumber.
3. Wadah untuk contoh
4. Detektor yang merupakan suatu transducer yang mengubah energi radiasi menjadi isyarat listrik.
5. Penguat dan rangkaian yang bersangkutan yang membuat isyarat listrik cocok untuk diamati.
6. Sistem pembacaan yang dapat mempertunjukkan besarnya isyarat listrik. (Underwood,A.L. 1983)
2.5 Spektroskopi FTIR
Pancaran inframerah pada umumnya mengacu pada bagian spektrum elektromagnet yang terletak di antara daerah tampak dan daerah gelombang mikro. Bagi kimiawan organik, sebagian besar kegunaannya terbatas di antara 4000 cm-1 dan
Sumber Monokhromator Sampel Detektor
666 cm-1 (2,5 – 15,0 m). Sebuah molekul yang paling sederhana sekalipun dapat memberikan spektrum yang sangat rumit. Kimiawan organik mengambil keuntungan dari kerumitan spektrum itu dengan membandingkan spektrum senyawa yang tidak diketahui terhadap spektrum cuplikan yang asli. Suatu kesesuaian puncak demi puncak merupakan bukti yang kuat tentang identitasnya. Selain enantiomer, dua senyawa tidak mungkin memberikan spektrum inframerah yang sama.
Pancaran infra-merah terbatas di antara 4000 cm-1 dan 666 cm-1 (2,5 – 15,0
m), diserap oleh sebuah molekul organik dan diubah menjadi energi getaran molekul.
Penyerapan ini juga tercatu, namun spektrum getaran tampak bukan sebagai garis-garis melainkan berupa pita-pita. Letak pita dalam spektrum inframerah disajikan sebagai bilangan gelombang atau panjang gelombang. Satuan bilangan gelombang (cm-1, kebalikan sentimeter). Terdapat dua macam getaran molekul yaitu getaran ulur dan getaran tekuk. Getaran ulur adalah suatu gerakan berirama di sepanjang sumbu ikatan sehingga jarak antar atom bertambah atau berkurang. Getaran tekuk dapat terjadi karena perubahan sudut-sudut ikatan antara ikatan-ikatan pada sebuah atom. (Silverstein, R.M. 1986)
Spektroskopi IR juga digunakan untuk penentuan struktur, khususnya senyawa organik dan juga untuk analisa kuantitatif. Spektrum infra merah memberikan puncak maksimal yang jelas sebaik puncak minimumnya. Spektrum absorpsi dibuat dengan bilangan gelombang pada sumbu X dan persentase transmitan (T) pada sumbu Y. Bila dibandingkan dengan daerah UV-tampak, dimana energi dalam daerah ini dibutuhkan untuk transisi elektronik, maka radiasi infra merah hanya terbatas pada perubahan energi setingkat molekul. Untuk tingkat molekul, perbedaan dalam keadaan vibrasi dan rotasi digunakan untuk mengabsorpi sinar inframerah. Jadi, untuk dapat mengabsorpi, molekul harus memiliki perubahan momen dipole sebagai akibat dari vibrasi. Berarti radiasi medan listrik yang berubah-ubah akan berinteraksi dengan molekul dan akan menyebabkan perubahan amplitude salah satu gerakan molekul. (Khopkar,S.M.2008)
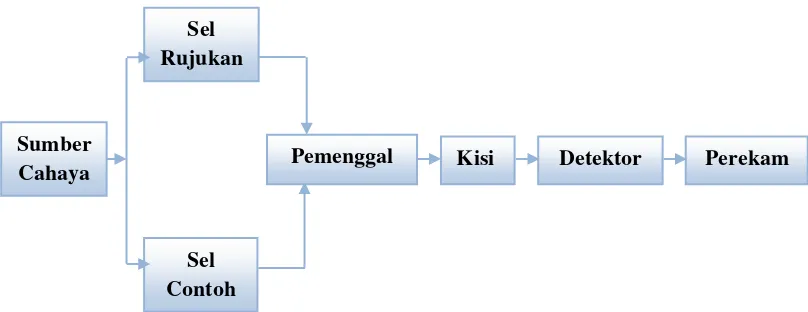
2.5.1 Peralatan untuk Spektrofotometer Inframerah
dilewatkan melalui sampel dan larutan pembanding, kemudian dilewatkan pada monokromator untuk menghilangkan sinar yang tidak diinginkan (stray radiation). Berkas ini kemudian didispersikan melalui prisma. Dengan melewatkannya melalui slit, sinar tersebut dapat difokuskan pada detektor. (Khopkar,S.M.2008)
(Sumber : Fessenden,R.J.1983)
Gambar 2.5. Bagan Alat Spektroskopi Inframerah
Instrumen yang digunakan untuk mengukur resapan radiasi inframerah pada berbagai panjang gelombang disebut spektrofotometer inframerah. Komponen alat yang khas adalah sumber cahaya yang memancarkan cahaya inframerah pada semua panjang gelombang. Cahaya dari sumber ini pecah oleh sistem cermin menjadi dua berkas cahaya, berkas rujukan (referensi) dan berkas contoh. Setelah masing-masing melewati sel rujukan (pelarut murni, jika pelarut itu digunakan dalam contoh, atau kosong jika contoh tak menggunakan pelarut) dan sel contoh, kedua berkas ini digabung kembali dalam pemenggal (chopper; suatu sistem cincin lain), menjadi suatu berkas yang berasal dari kedua berkas itu, yang selang-seling bergantian. Berkas selang-seling ini didifraksi oleh suatu kisi sehingga berkas itu terpecah menurut panjang gelombang. Detektor mengukur beda intensitas antara kedua macam berkas tadi pada tiap-tiap panjang gelombang dan meneruskan informasi ini ke perekam, yang menghasilkan spektrum. Pita-pita inframerah dalam sebuah spektrum dapat dikelompokkan menurut intensitasnya : kuat (s, strong), medium (m) dan lemah (w,
Sumber Cahaya
Sel Contoh
Sel Rujukan
weak). Suatu pita lemah yang bertumpang-tindih dengan suatu pita kuat disebut bahu (sh, shoulder). Banyaknya gugus identik dalam sebuah molekul mengubah kekuatan relatif pita absopsinya dalam suatu spektrum. (Fessenden,R.J.1983)
2.5.2 Spektrum Inframerah untuk Glukosamin
Karakterisasi glukosamin hidroklorida dapat ditentukan dengan menggunakan spektroskopi inframerah. Menurut Mojarrad et al. (2006) spektrum inframerah dari glukosamin dapat dilihat sebagai berikut:
FT-IR Kitin (KBr) : 532 (w), 565 (w), 952 (w), 1024 (m), 1074 (m), 1114 (m), 1157 (m), 1205 (w), 1261 (w), 1314 (m), 1379 (m), 1429 (m), 1559 (m), 1629 (m), 1658 (m), 2890 (m), 2930 (m), 3130 (m), 3254 (m), 3443 (s), 3471 (s) cm-1.
FT-IR Glukosamin HCl (KBr) : 570 (s), 597 (s), 698 (w), 773 (m), 854 (m), 889 (w), 912 (m), 1002 (s), 1034 (s), 1066 (s), 1095 (s), 1137 (s), 1183 (m), 1394 (m), 1421 (s), 1535 (s), 1583 (s), 1614 (s), 2943 (s), 3042 (s), 3105 (s), 3350 (s) cm-1.
Spektrum inframerah dari glukosamin hidroklorida yang diperoleh menunjukkan deasetilasi apabila bilangan gelombang ~1700 cm-1 untuk C=O, yang ada dalam spektrum inframerah kitin telah menghilang. Dimana gugus-gugus penting pada glukosamin hidroklorida adalah O-H, N-H, dan ikatan glikosida.
Menurut Silverstein, R.M. (1986) gugus O-H berada di antara 3500-3200 cm-1 untuk glukosamin 3350 cm-1. Gugus N-H berada di antara 1610-1481 cm-1, untuk glukosamin 1535 cm-1. Gugus C-N berada diantara 1342-1266 cm-1, untuk glukosamin 1334 cm-1. Dan Ikatan glukosida berada diantara 1150-1085 cm-1,untuk glukosamin 1034 cm-1.
BAB 3
METODOLOGI PENELITIAN
3.1. Bahan-Bahan
1. Cangkang Belangkas
2. Asam Klorida p.a( E Merck)
3. Natrium Hidroksida p.a( E Merck)
4. Asam Fosfat p.a( E Merck)
5. Asam Formiat p.a( E Merck)
6. Etanol p.a( E Merck)
7. N-asetilglukosamin p.a( E Merck)
8. Aquadest
7. Timbangan Elektrik sartorius
8. Waterbath
15.Spectroscopy Fourier Transform Infra-Red shimadzu
3.3. PROSEDUR
3.3.1. Penyediaan Larutan Pereaksi 3.3.1.1.Pembuatan NaOH 0,5%
Ditimbang sebanyak 5 g NaOH dimasukkan dalam beaker glass 1000 mL, diencerkan dengan aquadest sampai volumenya 1 L
3.3.1.2.Pembuatan NaOH 5%
Ditimbang sebanyak 50 g NaOH dimasukkan dalam beaker glass 1000 mL, diencerkan dengan aquadest sampai volumenya 1 L
3.3.1.3.Pembuatan HCl 5%
Diukur sebanyak 50 mL HCl p.a diencerkan dengan aquadest sampai volumenya 1 L
3.3.1.4.Pembuatan HCl 20%
Diukur sebanyak 10 mL HCl p.a dimasukkan dalam labu takar 50 mL, lalu diencerkan dengan aquadest sampai garis tanda.
3.3.1.5.Pembuatan HCl 25%
Diukur sebanyak 12,5 mL HCl p.a dimasukkan dalam labu takar 50 mL, lalu diencerkan dengan aquadest sampai garis tanda.
3.3.1.6.Pembuatan HCl 30%
Diukur sebanyak 15 mL HCl p.a dimasukkan dalam labu takar 50 mL, lalu diencerkan dengan aquadest sampai garis tanda.
3.3.1.7.Pembuatan HCl 37%
3.3.2. Proses Penyediaan Kitin
Proses penyediaan kitin dilakukan dengan menggunakan metode Agusnar,H. (2006). Teknik ini diawali dengan mencuci cangkang belangkas sampai bersih, kemudian direndam dalam larutan Natrium Hidroksida 0,5 % selama 24 jam, dicuci dengan H2O sampai bersih hingga pH 6,7. Kemudian dideproteinisasi dengan larutan
Natrium Hidroksida 5% selama 24 jam, dicuci dengan H2O sampai bersih hingga pH
6,7. Dilakukan uji kelarutan dengan Asam Fosfat 85%. Didemineralisasi dengan larutan Asam Klorida 5% selama 24 jam, dicuci dengan H2O hingga pH 6,7.
Dilakukan uji kelarutan dengan Asam Formiat 37%. Dikeringkan pada suhu kamar. Kemudian dihaluskan dan diayak dengan saringan 80 mesh.
3.3.3. Proses Hidrolisis Glukosamin Hidroklorida
Proses hidrolisis glukosamin hidroklorida dilakukan dengan menggunakan hidrolisis kimiawi yang dimodifikasi dari Mojarrad et al. (2006). Teknik ini diawali dengan perendaman serbuk kitin sebanyak 5 gram dalam larutan asam hidroklorida dengan perlakuan yang sama pada perbedaan konsentrasi yaitu 20%, 25%, 30%, 37%, dengan perbandingan 9:1 selama 4 jam pada suhu 90oC. Hidrolisis dilanjutkan dengan proses sentrifugasi bubur glukosamin hidroklorida dengan kecepatan 10.000 rpm selama 15 menit. Endapan yang diperoleh dicuci dengan etanol p.a, kemudian disentrifugasi kembali dengan kecepatan 10.000 rpm selama 15 menit. Selanjutnya endapan yang diperoleh dikeringkan dalam oven pada suhu 40oC selama 4 jam. Glukosamin hidroklorida yang telah dihasilkan kemudian dianalisis karakteristiknya, yaitu analisis Fourier Transform Infra Red (FT-IR) Spektrum. Kemudian ditentukan tingkat konsentrasinya dengan analisis Spectrophotometer Ultraviolet.
3.3.4. Analisis Glukosamin Hidroklorida dengan FTIR
Kepingan hasil pengepresan diukur absorbansinya melalui FTIR. Kisaran scanning yang digunakan antara 450 cm-1 sampai 4000 cm-1.
3.3.5. Analisis Glukosamin Hidroklorida dengan Spektrofotometer UV-Visible. 3.3.5.1.Untuk larutan Asam Fosfat
Dibuat larutan Asam Fosfat 0,002%; 0,005%; 0,008%; dan 0,012%, kemudian
diukur absorbansinya pada maksimum = 1λ7 nm. Dimana digunakan air suling
sebagai blanko.
3.3.5.2.Untuk N-asetilglukosamin
Dibuat larutan standar N-asetilglukosamin 10, 20, 30, 40, 50, 60, 70 mg/L
dalam larutan Asam Fosfat 0,005%, kemudian diukur absorbansinya pada
maksimum = 197 nm.
3.3.5.3.Untuk Glukosamin Hidroklorida
Dibuat larutan glukosamin hidroklorida (20%, 25%, 30%, 37%) dan glukosamin standar masing-masing dalam Asam Fosfat 0,005%, kemudian diukur
absorbansinya pada maksimum= 1λ7 nm.
3.4 Bagan Penelitian
3.4.1 Proses Penyediaan Kitin (Agusnar,H. 2006)
Direndam dengan NaOH 0,5% selama 24 jam Dicuci dengan air hingga pH 6,7
Dideproteinisasi dengan larutan NaOH 5% selama 24 jam
Dicuci dengan air hingga pH 6,7
Dilakukan uji kelarutan dengan Asam Fosfat 85%
Didemineralisasi dengan HCL 5% selama 24 jam
Dilakukan uji kelarutan dengan Asam Formiat 37%
Dicuci dengan air hingga pH 6,7 Dikeringkan pada suhu kamar Dihaluskan
Diayak dengan saringan 80 mesh Cangkang Blangkas
3.4.2 Proses Hidrolisis Glukosamin Hidroklorida dengan HCl (Mojarrad et al. 2006) Yang Telah Dimodifikasi
Ditimbang sebanyak 5 gram dan dimasukkan dalam labu leher tiga
Ditambahkan HCl 20% dengan perbandingan 9:1 (v/w)
Direfluks selama 4 jam pada suhu 90oC Didinginkan
Disentrifugasi dengan kecepatan 10.000 rpm selama 15 menit pada suhu 4oC
Disaring
Dicuci dengan etanol 100%
3.4.3 Analisis Larutan Asam Fosfat dengan Spektrofotometer Ultraviolet (Muzzarelli, 1978) Yang Telah Dimodifikasi
Diukur absorbansinya pada λ = 190 – 240 nm, air suling sebagai blanko
0.002% 0.005% 0.008% 0.012%
Asam Fosfat
max. 1λ7 nm
Kurva kalibrasi pada
3.4.4 Analisis N-asetilglukosamin dengan Spektrofotometer Ultraviolet (Muzzarelli, 1978) Yang Telah Dimodifikasi
Dibuat larutan standar dalam Asam Fosfat 0.005%
Diukur absorbansinya pada λ = 190 – 240 nm, air suling sebagai blanko. N-asetiglukosamin
10 ppm
Kurva kalibrasi pada
max. 1λ7 nm
3.4.5 Analisis Larutan Glukosamin Hidroklorida dengan Spektrofotometer Ultraviolet (Muzzarelli, 1978) Yang Telah Dimodifikasi
Ditimbang sebanyak 50 mg Dilarutkan dalam Asam Fosfat 0,005%
Diukur absorbansinya pada λ max = 197 nm
Serbuk Glukosamin Hidroklorida
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian 4.1.1 Penyediaan Kitin
Perhitungan Presentase Kadar Abu
� =w − ww x %
Dimana W = Bobot contoh sebelum diabukan (g) W1 = Bobot contoh + cawan sesudah diabukan W2 = Bobot cawan kosong (g)
� = , ,− , x %
= ,, x %
= 0,30 %
Perhitungan Presentase Kadar Air
� � =ww x %
Dimana W = Bobot contoh sebelum dikeringkan (g) W1 = Kehilangan bobot setelah dikeringkan (g)
� � �� �� = ,, x %
4.1.2. Penentuan Karakteristik Glukosamin Hidroklorida dengan FTIR
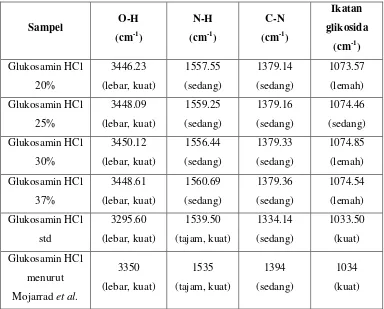
Karakteristik glukosamin hidroklorida dapat ditentukan dengan menggunakan analisis FTIR, yang didapat dilihat pada lampiran 2 dan pada Tabel 4.3.
Tabel 4.2. Data Karakteristik Glukosamin Hidroklorida dengan FTIR
Sampel O-H
4.1.3. Penentuan Konsentrasi Glukosamin Hidroklorida dengan Spektrofotometer Ultraviolet
Tabel 4.3. Data Pengukuran Absorbansi untuk Asam Fosfat pada λ = 197 nm
Gambar 4.1 Kurva Kalibrasi Asam Fosfat
y = 220.5x + 0.047
0 0,002 0,004 0,006 0,008 0,01 0,012 0,014
Tabel 4.4. Data Pengukuran Absorbansi untuk N-asetilglukosamin dalam Asam
Dari data pada Tabel 4.4 menujukkan konsentrasi asam fosfat yang digunakan adalah 0,005%. Menurut Muzzarelli (1978) kelarutan kitin baik digunakan pada konsentrasi asam fosfat 0,005%, sehingga digunakan konsentrasi asam fosfat 0,005% dalam penelitian ini.
Gambar 4.2. Kurva Kalibrasi N-asetilglukosamin
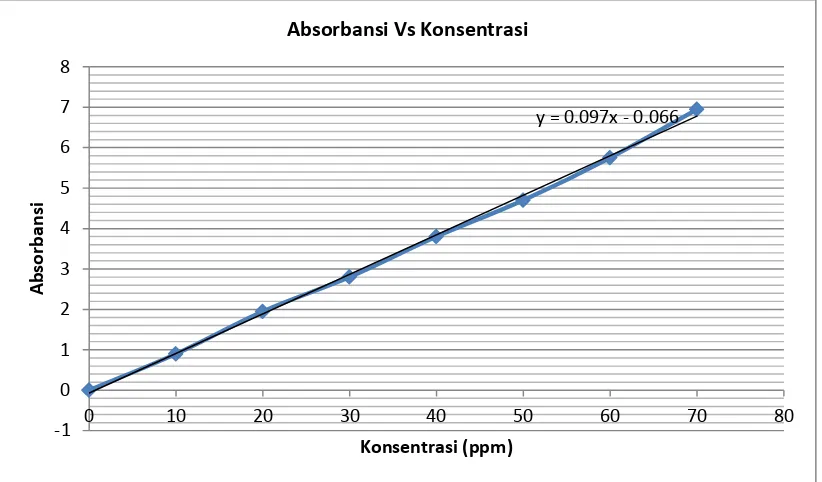
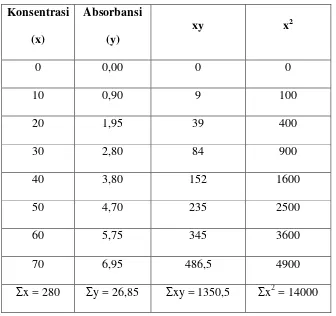
4.1.4. Penurunan Persamaan Garis Regresi dengan Metode Least Square
Hasil pengukuran absorbansi standar N-asetilglukosamin pada Tabel 4.4. diplotkan terhadap konsentrasi sehingga diperoleh kurva kalibrasi berupa garis linier. Persamaan garis regresi untuk kurva kalibrasi ini dapat diturunkan dengan metode least square dengan data pada Tabel 4.5.
y = 0.097x - 0.066
-1 0 1 2 3 4 5 6 7 8
0 10 20 30 40 50 60 70 80
A
b
sor
b
an
si
Tabel 4.5 Penurunan Persamaan Garis Regresi untuk Penentuan Konsentrasi Kadar Glukosamin Hidroklorida Berdasarkan Pengukuran Absorbansi Standar N-asetilglukosamin
Konsentrasi (x)
Absorbansi (y)
xy x2
0 0,00 0 0
10 0,90 9 100
20 1,95 39 400
30 2,80 84 900
40 3,80 152 1600
50 4,70 235 2500
60 5,75 345 3600
70 6,95 486,5 4900
Ʃx = 280 Ʃy = 26,85 Ʃxy = 1350,5 Ʃx2 = 14000
Selanjutnya harga slope dapat ditentukan dengan metode least square sebagai berikut :
=n Ʃxy − Ʃx Ʃyn Ʃx2 − Ʃx ²
= , − ,
− ²
= −−
=
= Ʃx2 Ʃy − Ʃxy Ʃx
n Ʃx2 − Ʃx ²
= , − − ,²
= −−
=−
= - 0,066
Maka persamaan garis yang diperoleh adalah : = +
= , + − ,
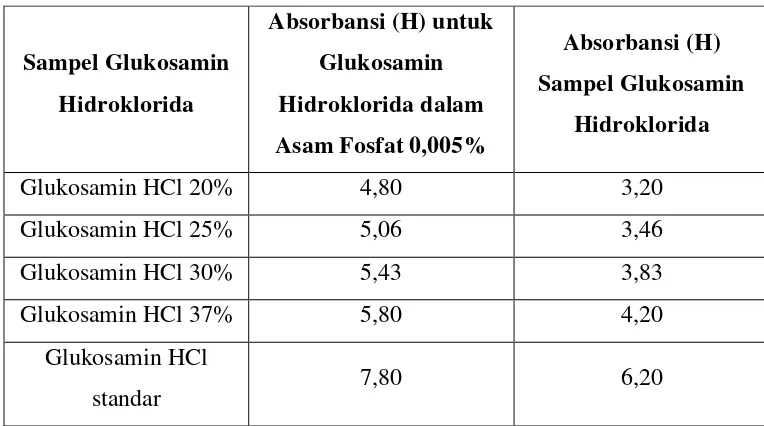
Tabel 4.6. Data Pengukuran Absorbansi untuk Sampel Glukosamin
Hidroklorida pada λ = 197 nm
Sampel Glukosamin Hidroklorida
Absorbansi (H) untuk Glukosamin Hidroklorida dalam Asam Fosfat 0,005%
Absorbansi (H) Sampel Glukosamin
Hidroklorida
Glukosamin HCl 20% 4,80 3,20
Glukosamin HCl 25% 5,06 3,46
Glukosamin HCl 30% 5,43 3,83
Glukosamin HCl 37% 5,80 4,20
Glukosamin HCl
Penentuan konsentrasi Glukosamin Hidroklorida dalam sampel
=y − b
- Glukosamin HCl 20%
= , − − ,,
= 33,67
- Glukosamin HCl 25%
= , − − ,,
= 36,35
- Glukosamin HCl 30%
= , − − ,,
= 40,16
- Glukosamin HCl 37%
= , − − ,,
= 43,97
- Glukosamin HCl standar
= , − − ,,
Tabel 4.7. Data Perhitungan Konsentrasi Sampel dengan Spektrofotometer Ultraviolet
Sampel Konsentrasi (ppm)
Glukosamin HCl 20% 33,67
Glukosamin HCl 25% 36,35
Glukosamin HCl 30% 40,16
Glukosamin HCl 37% 43,97
Glukosamin HCl standar 64,59
4.2 Pembahasan
Pembuatan dan karakteristik glukosamin hidroklorida dari kitin telah dilakukan dengan menggunakan metode hidrolisis kimia. Kitin dibuat dari cangkang belangkas, dimana belangkas yang digunakan diperoleh dari tepi pantai cermin Serdang Bedagai. Pembuatan kitin dilakukan dengan metode Agusnar,H. (2006). Belangkas dibersihkan, diambil cangkangnya dan ditimbang. Direndam cangkang belangkas dalam NaOH 0,5% selama 24 jam, dicuci dengan air sampai pH 6,7. Kemudian direndam kembali dengan NaOH 5% selama 24 jam dan dicuci dengan air sampai pH 6,7. Perendaman dengan NaOH dilakukan untuk penghilangan protein, dimana pada kerangka luar golangan Crustasea (seperti belangkas) mengandung kitin yang berikatan dengan kalsium karbonat (CaCO3) dan protein, terkadang juga dengan
Kemudian dilakukan demineralisasi dengan perendaman dalam HCl 5% selama 24 jam. Johnson dan Peniston (1982) melaporkan, bahwa kerangka luar
Crustasea umumnya mengandung 30-50% mineral berdasarkan bobot kering, dan
mineral terbanyak berupa CaCO3, selain itu terdapat pula Ca3(PO4)2 dengan kadar
8-10% dari total bahan organik. Kemudian dilakukan uji kelarutan dengan asam formiat 37% dan dicuci dengan air sampai pH 6,7. Kemudian dikeringkan pada temperatur kamar. Setelah kering dihaluskan haluskan dan diayak dengan saringan 80 mesh, maka dihasilkan serbuk kitin.
Serbuk kitin yang diperoleh dihitung persentase hasil kitinnya, dimana berat kitin yang diperoleh dibagi dengan berat cangkang dikali 100%, maka diperoleh persen hasil kitin sebanyak 30,8%. Kemudian dihitung persentase kadar abu dan diperoleh kadar abu sebanyak 0,30%. Kemudian dihitung persentase kadar air dan diperoleh kadar air sebanyak 12,20%.
Setelah diperoleh kitin, kemudian dilakukan hidrolisis untuk menghasilkan glukosamin hidroklorida. Proses hidrolisis dilakukan dengan perendaman serbuk kitin belangkas dalam asam klorida dengan variasi konsentrasi HCl 20%, 25%, 30%, dan 37%. Dilakukan dengan variasi konsentrasi HCl untuk melihat perbandingan karakteristik glukosamin HCl yang diperoleh, yang manakah yang paling sesuai dengan karakteristik glukosamin HCl standar. Serbuk kitin direndam dalam HCl (20%, 25%, 30%, 37%) dengan perbandingan 9:1 (v/w) dimana 5 g serbuk kitin direndam dengan HCl 45 ml. Kemudian direfluks selama 4 jam pada temperatur 90oC, lalu didinginkan. Kemudian disentrifugasi pada kecepatan 10.000 rpm selama 15 menit pada temperatur 4oC dan disaring. Residu yang diperoleh dicuci dengan etanol 100%, dan disentrifugasi kembali pada kecepatan 10.000 rpm selama 15 menit pada temperatur 4oC dan disaring. Residu yang diperoleh dikeringkan dalam oven pada temperatur 40oC selama 4 jam. Kemudian dianalisis karakteristiknya dengan uji FT-IR dan ditentukan konsentrasinya dengan uji Spektrofotometer UV.
yang digunakan antara 450 cm-1 sampai 4000 cm-1. Dari hasil pengukuran spektrum inframerah menunjukkan bahwa gugus O-H pada glukosamin HCl (20%, 25%, 30%, 37%) berturut-turut 3446; 3448; 3450; 3448 cm-1, yang masing-masing memperlihatkan garis lebar dan kuat. Sedangkan glukosamin HCl standar menunjukkan garis lebar dan kuat pada spektrum 3295 cm-1. Menurut Mojarrad et al. spektrum gugus O-H pada glukosamin HCl 3350 cm-1.
Untuk gugus N-H pada glukosamin HCl (20%, 25%, 30%, 37%) berturut-turut 1557; 1559; 1556; 1560 cm-1 yang masing-masing menunjukkan garis sedang. Sedangkan glukosamin HCl standar menunjukkan garis tajam dan kuat pada spektrum 1539 cm-1. Menurut Mojarrad et al. spektrum gugus N-H pada glukosamin HCl 1535 cm-1.
Untuk gugus C-N pada glukosamin HCl (20%, 25%, 30%, 37%) berturut-turut 1379 cm-1, 1379 cm-1, 1379 cm-1, 1379 cm-1 yang masing-masing menunjukkan garis sedang. Sedangkan glukosamin HCl standar menunjukkan garis sedang pada spektrum 1334 cm-1. Menurut Mojarrad et al. spektrum gugus C-N pada glukosamin HCl 1394 cm-1.
Untuk ikatan glikosida pada glukosamin HCl (20%, 25%, 30%, 37%) berturut-turut 1073; 1074; 1074; 1074 cm-1 yang menunjukkan garis lemah. Sedangkan pada glukosamin HCl standar menunjukkan garis kuat pada spektrum 1033 cm-1. Menurut Mojarrad et al. spektrum ikatan glikosida pada glukosamin HCl 1034 cm-1.
Dari hasil pengukuran di atas menunjukkan bahwa glukosamin HCl dari hidrolisis kitin cangkang belangkas dengan perbandingan variasi konsentrasi HCl 20%, 25%, 30%, 37%, menghasilkan pita serapan yang hampir sesuai dengan glukosamin HCl standar. Menurut Mojarrad et al. hal ini dapat dikarenakan pengaruh konsentrasi HCl, suhu, dan waktu hidrolisis, sehingga glukosamin hidroklorida yang terbentuk masih dalam konsentrasi yang kecil. Hal ini juga dapat dipengaruhi oleh perbedaan bahan baku kitin, karena bahan baku kitin yang digunakan berbeda sehingga menghasilkan kandungan kitin yang berbeda pula.
0.00β%, 0.005%, 0.008%, 0.01β%, kemudian diukur absorbansinya pada maksimum
197 nm, dimana digunakan air suling sebagai pembanding. Muzzarelli (1978) melaporkan, pelarut yang baik untuk kitin belangkas adalah asam fosfat 0.005% sehingga digunakan asam fosfat 0.005% dalam penelitian ini. Asam fosfat 0.005% menunjukkan nilai absorbansi sebesar 1,18. Kemudian dibuat N-asetilglukosamin
dengan konsentrasi 10,β0,γ0,40,50,60,70 mg/L dalam asam fosfat 0.005% pada
maksimum 197 nm. Pengukuran absorbansi N-asetilglukosamin dan sampel glukosamin hidroklorida yang dilarutkan dalam asam fosfat 0.005% harus dikurangi dengan 1,18 untuk memperoleh absorbansi yang sebenarnya dari kedua senyawa tersebut. Kemudian dibuat kurva kalibrasi N-asetilglukosamin sehingga diperoleh y=0.097x – 0.066, dan dibuat persamaan regresi dan diplotkan terhadap konsentrasi sehingga diperoleh.
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Glukosamin hidroklorida telah dibuat dari dihirolisis kitin cangkang belangkas. Glukosamin hidroklorida menunjukkan karakteristik yang hampir sama dengan glukosamin hidroklorida standar. Spektrum glukosamin hidroklorida yang diperoleh hampir sesuai dengan spektrum glukosamin hidroklorida standar. Tingkat konsentrasi glukosamin hidroklorida mengalami peningkatan seiring dengan meningkatnya konsentrasi HCl.
5.2 Saran
DAFTAR PUSTAKA
Abbas. 2012. Kandungan Ketam Ladam Belangkas.
http://fennamagazine.wordpress.com
Agusnar, H. 2006. Potensi Cangkang Belangkas (Tachypleus gigas) di Perairan
Sumatera Utara Sebagai Bahan Kitin dan Kitosan. Sains Kimia. Vol 8. PP
22-2.
Bastaman S. 1989. Studies on Degradation and Extraction of chitin and Chitosan
From Prawn Shell (Nephrops norvegicus) [Tesis]. Belfast: Faculty of
Engineering, The Quen’s University of Belfast.
Dr.Craig W. M. 2004. Glucosamine: Review of its Effectiveness in Treating Knee
Osteoarthritis. Worksafe Compentation and Rehabilitation Services
Division.
Fessenden,R.J & Fessenden, J.S. 1983. Kimia Organik. Edisi Kedua. Jilid 1. Jakarta: Erlangga
Hirano S. 1986.Chitin and Chitosan. In Ullmann’s Encyclopedia of Industrial
Chemistry.Completly revised edition.Weinheim,New 40ork.
Khopkar, SM. 2008. Konsep Dasar Kimia Analitik. Jakarta: Universitas Indonesia Press
Knorr D.1991.Recovery and Utilization of Chitin and Chitosan in Food processing
Waste Management.Food Tech.45 (1):114-122
Kralovec JA, Barrow CJ. 2008. Marine Nutraceutical and Functional Foods:
Glucosamine Production and Health Benefits. Canada: CRC Press.
Mojarrad JS, Mahboob N, Valizadeh H, ansarin M, Bourbour S. 2006. Preparation of Glucosamine from Exoskeleton of Shrimp and Predicting production Yield
by Response Surface Methodology. Journal of Agricultular and Chemistry
55:2264-2250
Muzzarelli, R.A.A. 1978. Chitin. Oxford : Pergamon Press
Purwantiningsih S, Wukirsari T, Sjahriza A, Wahyono D. 2009. Kitosan: Sumber
Biomaterial Masa Depan. Cetakan Pertama. Bogor: IPB Press
Rotta Research Laboratorium. 1987. Stable Compounds Of Glucosamine Sulphate. US Patent 4,642,340.
Silverstein, Robert M. 1986. Penyidikan Spektrometrik Senyawa Organik. Jakarta : Erlangga
Lampiran 1. Spektrum kitin hasil pengujian FTIR
Gambar a. Spektrum FTIR Kitin Belangkas
Lampiran 2. Spektrum Glukosamin HCl hasil pengujian FTIR dan Glukosamin HCl standar.
Gambar b. Spektrum FTIR Glukosamin HCl dari HCl 20%