Descriptives Interval for Mean
Minimu
kontrol 3 29.9567 1.4468 7
.83535 26.3624 33.5509 28.34 31.13
EEDA 0,025 mg
3 39.2533 3.2192 0
1.8586 0
31.2564 47.2503 35.62 41.75
EEDA 0,05 mg
3 80.1867 4.4306 5
2.5580 4
69.1803 91.1930 75.53 84.35
EEDA 0,1
3 71.4333 5.8026 7
3.3501 8
57.0187 85.8480 64.91 76.02
Digoksin 0,05 mg
3 60.8700 8.0983 8
4.6756 0
40.7525 80.9875 55.66 70.20
Digoksin 0,1 mg
3 83.5900 17.798 35
Total 21 75.7648 42.775 09
9.3342 9
56.2938 95.2358 28.34 182.19
Pe
kontrol 3 193.330 0
Post Hoc Tests
Total 21 451.345 7
Square F Sig.
Persen_pen ingkatan_ko ntraktilitas
Between Groups
35181.311 6 5863.552 58.102 .000
Within Groups 1412.863 14 100.919
Total 36594.174 20
Persen_pen ingkatan_de nyut
Between Groups
3034637.737 6 505772.956 2493.940 .000
Within Groups 2839.211 14 202.801
Total 3037476.948 20
Multiple Comparisons
Tukey HSD
0,025
kontrol 9.29667 8.202 39
Digoksin
.285 -8.6911 47.324 4
.020 4.1722 60.187 8
0,025
.151 -5.2878 50.727 8
0,025 mg
7 758 28.036
7
Homogeneous Subsets
Persen_peningkatan_kontraktilitas
Tukey HSDa Kelompok
N
Subset for alpha = 0.05
1 2 3 4
Control 3 29.9567
EEDA 0,025 mg 3 39.2533 39.2533
Digoksin 0,05 mg 3 60.8700 60.8700
Digoksin 0,025 mg 3 71.4333
EEDA 0,05 mg 3 80.1867
Digoksin 0,1 mg 3 83.5900
EEDA 0,1 mg 3 165.0633
Sig. .907 .187 .151 1.000
Persen_peningkatan_denyut
Tukey HSDa Kelompok
N
Subset for alpha = 0.05
1 2 3 4
Control 3 193.3300
EEDA 0,025 mg 3 221.6633
Levene Statistic df1 df2 Sig. Persen_peningkatan_kontrakti
litas
2.421 6 14 .081
Persen_peningkatan_denyut 2.042 6 14 .127
Digoksin 0,025 mg 3 296.1067
Digoksin 0,05 mg 3 297.2200
EEDA 0,05 mg 3 307.7733
EEDA 0,1 mg 3 484.9967
Digoksin 0,1 mg 3 1358.3300
2
3
4
Dipisahkan dari pengotor Dicuci, ditiriskan dan ditimbang, berat basah 2630 g
Dikeringkan dalam lemari pengering pada suhu ± 40-500C
Dihaluskan (di blender)
diperiksa diperiksa
direndam dengan etanol 96%
selama 3 jam
dipindahkan kedalam perkolator didiamkan selama 24 jam dibuka kran dan dibiarkan
perkolat menetes
diuapkan dengan rotary evaporator dikeringkan denganfreeze dryer
karakterisasi
skrining Daun Afrika
Karakteristik Simplisia
Skrining Fitokimia Serbuk Simplisia
Simplisia 512 g
Serbuk Simplisia 400 g
Makroskopik
Mikroskopik (serbuk) Pk air
Pk sari larut air Pk sari larut etanol Pk abu total
Pk abu tidak larut asam
Alkaloid Flavonoid Glikosida Saponin Tanin
Triterpenoid/Steroid Glikosida jantung
Perkolasi
Perkolat
Ekstrak Kental 175,37 g
Uji Efek inotropik dan kronotropik
Lampiran 7
Perhitungan penetapan kadar air simplisia daun Afrika
% Kadar air = 100%
No Berat sampel (g) Volume awal (ml) Volume akhir (ml)
1 5,012 1,9 2,3
2 5,005 2,3 2,7
Perhitungan penetapan kadar sari larut air simplisia daun Afrika
No Berat sampel (g) Berat cawan kosong (g) Berat cawan sari (g)
1 5,0007 43,0481 43,3020
2 5,0005 45,0780 45,3421
3 5,0006 43,0560 43,3151
Lampiran 9
Perhitungan penetapan kadar sari larut etanol simplisia daun Afrika
% Kadar sari larut etanol= 100%
20
% Kadar sari larut etanol rata-rata = 14,891% 3
No Berat sampel (g) Berat cawan kosong (g) Berat cawan sari (g)
1 5,0001 45,0862 45,2301
2 5,0005 43,2813 43,3552
Perhitungan penetapan kadar abu total simplisia daun Afrika
No Berat sampel (g) Berat abu (g)
1 2,0150 0,1870
2 2,0412 0,2155
3 2,0211 0,1899
Lampiran 11
Perhitungan penetapan kadar abu tidak larut asam simplisia daun Afrika
% Kadar abu tidak larut asam = 100%
% Kadar abu yang tidak larut asam rata-rata
= 0,705%
No Berat sampel (g) Berat abu (g)
1 2,0150 0,0137
2 2,0412 0,0153
Perhitungan penetapan kadar air EEDA
No Berat sampel (g) Volume awal (ml) Volume akhir (ml)
1 2,082 1,9 2,0
2 2,085 2,0 2,1
3 2,083 2,1 2,2
Lampiran 13
Perhitungan penetapan kadar sari larut air EEDA
% Kadar sari larut air = 100%
No Berat sampel (g) Berat cawan kosong (g) Berat cawan sari (g)
1 2,0102 44,2162 43,3632
2 2,0108 47,7312 47,8824
Perhitungan penetapan kadar sari larut etanol EEDA
% Kadar sari larut etanol= 100%
20
% Kadar sari larut etanol rata-rata
= 48,121%
No Berat sampel (g) Berat cawan kosong (g) Berat cawan sari (g)
1 2,0202 45,0564 45,2514
2 2,0151 47,9252 48,1202
3 2,0432 45,3682 45,5632
Lampiran 15
Perhitungan penetapan kadar abu total EEDA
% Kadar abu total = 100%
No Berat sampel (g) Berat abu (g)
1 1,0121 0,0549
2 1,0543 0,0570
Perhitungan penetapan kadar abu tidak larut asam EEDA
% Kadar abu yang tidak larut asam rata-rata
= 0,205%
No Berat sampel (g) Berat abu (g)
1 1,0121 0,0018
2 1,0543 0,0024
3 1,0385 0,0020
DAFTAR PUSTAKA
Agoes, G. (2007).Teknologi Bahan Alam. Bandung: ITB. Hal. 8, 38-39. Anief, M. (2000).Farmasetika. Yogyakarta: UGM Press. Hal. 182.
Anonim. (2010). The Alternative Cancer Treatment. Diakses Tanggal: 5 Oktober 2012. http://naturindonesia.com/diabetes-militus/daun-Afrika-selatan/1214.html.
Atangwho, I.J., Ebong, P.E., Egbung, G.E., dan Obi, A.U. (2010). Extract of Vernonia amygdalina Del. (African Bitter Leaf) Can Reverse Pancreatic Cellular Lesion after Alloxan Damage in the Rat. Australian Journal of Basic and Applied Sciences. 4(5): 711-716.
Chaidir, J., dan Munaf, S. (2008). Obat Gagal Jantung Dalam: Kumpulan Kuliah Farmakologi. Editor: Staf Pengajar Departemen Farmakologi Falkutas Kedokteran Universitas Sriwijaya. Edisi 2. Jakarta: EGC. Hal. 385-390.
Claus, P.E., Tyler, E.V., dan Brady, R.L. (1971). Pharmacognosy. Edisi VI. Philadelpia: Lea & Febiger. Hal. 81.
Depkes R.I. (1986).Sediaan Galenik. Jakarta: Departemen Kesehatan Republik Indonesia. Hal. 19.
Depkes RI. (1995). Materia Medika Indonesia. Jilid VI. Jakarta: Depkes RI. Hal. 297-303, 321-325, 333-337.
Ditjen POM. (1979). Farmakope Indonesia. Edisi Ketiga. Jakarta: Depkes. Hal. 9.
Ditjen POM. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Departemen Kesehatan RI. Hal. 1, 10-11.
Ejoh, R.A., Nkonga, D.V., Inocent, G., dan Moses, M.C. (2007). Nutritional Components of Some Non-Conventional Leafy Vegetables Consumed in Cameroon.Pak. J. Nutr. 6(1): 712-717.
Farnsworth, N.R. (1966). Biological and Phytochemical Screening of Plants. Journal of Pharmaceutical Sciences. 55(3): 263.
Antimutagenik Ekstrak Etanol Daun Afrika (Vernonia amygdalina Del.) pada Mencit Jantan menggunakan Metode Mikronukleus. Skripsi. Medan: Falkutas Farmasi USU.
Harbone, J.B. (1984).Metode Fitokimia, Penuntun Cara Modern Menganalisa Tumbuhan. Terjemahan Kosasih Padmawinata. Edisi II. Bandung: ITB Press. Hal. 147.
Harahap, U., dan Sumadio, H. (1995). Farmakologi II. Medan: Penerbit FMIPA USU. Hal. 100.
Harahap, U., dan Ernawaty, N. (2009). Terapi Gagal Jantung Kongestif (GJK) Dalam Perspektif Interaksi, Dampak Dan Solusinya. Prosiding Kongres Nasional ISFI XVIII & Kongres Ilmiah ISFI XVIII. Hal. 636-637. Ibrahim, G., Abdurahman, E.M., dan Katayal, U.A. (2004). Pharmacognostic
Studies On The Leaves Of Vernonia amygdalina Del. (Asteraceae). Nig. J. Nat. Orid. And Med.08(1): 8-10.
Ijeh, I.L., dan Ejike, C.E.C.C. (2010). Current Perspectives on The Medicinal Potentials of Vernonia amygdalina Del. Journal of Medicinal Plant Research. 5(7): 1051-1061.
Janardan, D., Ahirwar, D., Singh, M., dan Tiwari, P. (2011). Cardiotonic Activity of Petrolium Ether and Alcoholic Extract of Seeds of Cassia ToraLinn.Pharmacologyonline.3: 556-565.
Jamil, M., Ul Haq, I., dan Qayyum, M. (2012). Isolation of Antibacterial Compounds From Quercus Dilate L. Through Bioassay Guided Fractionation. Annals of Clinical Microbiology and Antimicrobials. 11: 11.
Kamadyaapa, D.R., Gondwe, M., Moodley, K., Ojewole, J.A., dan Musabayane, C.T. (2009). Cardiovascular Effect ofEkebergia capensis Sparrm (Meliaceae) Ethanolic Leaf Extract in Experimental Animal Paradigms.Cardiovascular Journal of Africa,20(3): 162-168.
Malero, P., Medarde, M., dan San, F.A. (2000). A Short Review on Cardiotonik Steroids and Their Aminoguanidine Analoues.Molecules.5: 51-81. Mehana, A.S. (2008). Cardiac Agent: Cardiac Glycosides, Antianginal, and
Antiarrhyhmic Drugs. Editor: Thomas L. Limke., David A. Williams., Victoria F. Roche., S. William Zito. Foye’s Principles of Medicinal
Chemistry Sixth Edition. Philadelpia: Lippincott Williams & Wilkins. Hal. 700-703.
Mycek, J.M., Harvey, A.R., dan Champe, C.P. (2001). Farmakologi Ulasan Bergambar. Edisi 2. Jakarta: Widya Medika. Hal. 157-163.
Niazmands, S. (2010). The Cronotropic and Inotropic Effects of Aqueous-Ethanolic Extract of Achillea Millefolium on Rat’s Isolated Heart.
Pharmacologyonline. 3: 791-798.
Njan, A.A., Adza, B., Agaba, A.G., Byamgaba, D., Diaz, S., dan Bansberg, D.R. (2008). The Analgesic and Antiplasmodial Activities and Toxicology ofVernonia amygdalina. J. Med. Food. 11: 574-581. Nwanjo, H.U., dan Nwokoro, E.A. (2004). Antidiabetic And Biochemical
Effects Of Aqueous Extract Of Vernonia amygdalina Leaf In Normoglycaemic And Diabetic Rats.J. Innov. Life Sci. (7): 6-10.
Ojowole, J., Kamadyaapa, D.R., Gondwe, M.M., Moodley, K., dan Musabayane, C.T. (2007). Cardiovascular Effect of Persea americana Mill (Lauraceae) (avocado) Aqueous Leaf Extract in Experimental Animal.Cardiovascular Journal of South Africa,18(2): 69-76.
Oyugi, D.A., Luo, X., Lee, K.S., Hill, B., dan Izevbigie, E.B. (2009). Activity Markers of The Anti-Breast Carcinoma Cell Growth Fractions of Vernonia amygdalina Extracts. Proc. Soc. Exp. Biol. Med. Doi. 10: 3181.
Pinem, A.F. (2012). Karakterisasi Simplisia dan Skrining Fitokimia serta Uji Aktivitas Antioksidan Ekstrak Etanol Daun Afrika (Vernonia amygdalinaDel.).Skripsi. Medan: Falkutas Farmasi USU.
Setiawan, A. (2012). Uji Aktivitas Antioksidan Ekstrak Etanol Daun Afrika (Vernonia amygdalina Del.) Terhadap Tikus Jantan Galur Wistar. Skripsi. Medan: Falkutas Farmasi USU.
Siswandono, dan Bambang, S. (2000). Kimia Medisinal 2. Surabaya: Penerbit Airlangga University Press. Hal. 309.
Syamsuni, H.A. (2006).Ilmu Resep. Jakarta: EGC. Hal 249-250, 270.
Trease, E. (1983). Pharmacognosy. Edisi keduabelas. London: Aldon Press. Hal. 135-136.
Receptor Interaction and Effectuation Mechanisms of Digoxin in Rat Heart. Elektronisches document: 1-7. http://nbn-resolving.
Wijayakusuma, H. (2009). Terapi Jus untuk Kesehatan. Jakarta: Sarang Pustaka Prima. Hal. 35.
Wilbraham, A.C., dan Matta, M.S. (1992). Pengantar Kimia Organik. Penerjemah Suminar Achmadi. Penyunting Sofia dan Nik Solihin. Bandung: ITB. Hal. 100-105.
World Health Organization. (1992). Quality Control Methods For Medicinal Plant Materials. Geneva: WHO. Hal. 33.
BAB III
METODE PENELITIAN
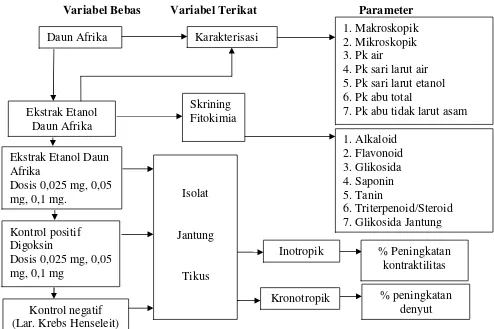
Metode yang digunakan dalam penelitian adalah metode eksperimental. Penelitian eksperimen (eksperimental) bertujuan untuk mengetahui pengaruh variabel bebas terhadap variabel terikat dalam kondisi yang terkontrol ketat. Penelitian ini meliputi pengumpulan dan penyiapan bahan, pemeriksaan karakteristik, skrining fitokimia, pembuatan ekstrak etanol dan pengujian efek inotropik dan kronotropik menggunakan alat Langendroff. Data hasil penelitian dianalisis menggunakan analisis variansi (ANOVA) dengan tingkat kepercayaan 95%.
3.1 Alat dan Bahan
3.1.1 Alat
Alat-alat yang digunakan dalam penelitian terdiri dari alat-alat gelas, alat bedah, alat Lagendorff, rotari evaporator, blender, seperangkat alat destilasi penetapan kadar air, tanur, oven, mikroskop, neraca analitis, penangas air, desikator, timbangan, objek gelas, gelas penutup, beaker gelas, cawan porselin, cawan petri, lemari pengering,freeze dryer,dan spuit.
3.1.2 Bahan
klorida; DMSO; NaCl 0,9%; larutan fisiologi Krebs-Henseleit (NaCl 6,9 g; KCl 0,35 g; NaHCO3, 2,1 g; MgSO4.7H2O 0,29 g; KH2SO40,16 g; CaCl20,28
g; glukosa 1 g; pH 7,4); Karbogen (campuran 95% O2+ 5% CO2); benang cut
gut; indikator pH; Digoxin injeksi; Heparin injeksi; Ketamin injeksi; dan akuades.
3.2 Penyiapan Bahan Tumbuhan
Penyiapan bahan tumbuhan meliputi pengumpulan, identifikasi dan pembuatan simplisia daun Afrika.
3.2.1 Pengambilan Bahan Tumbuhan
Sampel yang digunakan adalah daun Afrika (Vernonia amygdalina Del.) yang masih segar dan tua. Pengambilan sampel dilakukan secara purposif tanpa membandingkan dengan tumbuhan yang sama dari daerah lain. Sampel diambil dari Taman Tanaman Obat yang berada di Fakultas Farmasi Universitas Sumatera Utara, Pintu 4 Jl. Tridharma Universitas Sumatera Utara.
3.2.2 Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan di Herbarium Bogoriense, Bidang Botani Pusat Penelitian Biologi-LIPI Bogor.
3.2.3 Pembuatan Simplisia
Bahan baku daun Afrika tua yang masih segar dikumpulkan, dicuci bersih di bawah air mengalir, ditiriskan, dan ditimbang berat basahnya. Daun Afrika selanjutnya dikeringkan di lemari pengering hingga kering, kemudian
diblender sampai diperoleh serbuk simplisia, ditimbang berat keringnya dan disimpan dalam wadah plastik yang tertutup rapat.
3.3 Pembuatan Pereaksi
3.3.1 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, dilarutkan dalam air suling secukupnya, lalu ditambahkan 2 g iodium kemudian ditambahkan air suling hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.3.2 Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida dilarutkan dalam air suling hingga 60 ml, pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu dilarutkan dalam 10 ml air suling, kedua larutan dicampurkan dan ditambahkan air suling hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.3.3 Pereaksi Dragendorff
Sebanyak 0,8 g bismut (III) nitrat ditimbang, dilarutkan dalam 20 ml asam nitrat pekat, pada wadah lain ditimbang sebanyak 27,2 g kalium iodida, dilarutkan dalam 50 ml air suling, kemudian kedua larutan dicampurkan dan didiamkan sampai memisah sempurna. Larutan yang jernih diambil dan diencerkan dengan air suling hingga volume larutan 100 ml (Depkes RI, 1995).
3.3.4 Pereaksi Molish
Sebanyak 17 ml larutan asam klorida pekat ditambahkan air suling hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.3.6 Pereaksi asam sulfat 2 N
Sebanyak 5,4 ml larutan asam sulfat pekat ditambahkan air suling sampai 100 ml (Depkes RI, 1995).
3.3.7 Pereaksi natrium hidroksida 2 N
Sebanyak 8 g kristal natrium hidroksida dilarutkan dengan air suling sebanyak 100 ml (Depkes RI, 1995).
3.3.8 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam air suling bebas karbon dioksida sebanyak 100 ml (Depkes RI, 1995).
3.3.9 Pereaksi besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida ditimbang, kemudian dilarutkan dalam air secukupnya hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.3.10 Pereaksi kloralhidrat
Sebanyak 8 gram kristal kloralhidrat ditimbang lalu dilarutkan dalam 10 ml air suling (Depkes RI, 1995).
3.3.11 Pereaksi Liebermann-Burchard
Sebanyak 20 bagian asam asetat anhidrida dicampur dengan 1 bagian asam sulfat pekat. Larutan pereaksi ini harus dibuat baru (Harborne, 1984).
3.4 Pemeriksaan Karakteristik Simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari larut air, penetapan kadar sari larut etanol, penetapan kadar abu total, dan penetapan kadar abu tidak larut asam (WHO, 1992; Ditjen POM, 1995).
3.4.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan pada daun segar dan simplisia; meliputi pemeriksaan warna, bau, rasa, ukuran, dan bentuk daun Afrika.
3.4.2 Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia daun Afrika. Serbuk simplisia diletakkan di atas kaca objek yang telah ditetesi dengan larutan kloralhidrat dan ditutup dengan kaca penutup, selanjutnya diamati di bawah mikroskop.
3.4.3 Penetapan Kadar Air
Penetapan kadar air dilakukan menurut metode Azeotropi (destilasi toluena). Alat terdiri dari labu alas bulat 500 mL, pendingin, tabung penyambung, tabung penerima 5 mL berskala 0,05 mL; alat penampung dan pemanas listrik.
Cara kerja :
selama 15 menit. Setelah toluena mendidih, kecepatan tetesan diatur lebih kurang 2 tetes tiap detik sampai sebagian besar air terdestilasi, kemudian kecepatan tetesan dinaikkan hingga 4 tetes tiap detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluena. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluena memisah sempurna, volume air dibaca dengan ketelitian 0,05 mL. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (WHO, 1992).
3.4.4 Penetapan Kadar Sari Larut dalam Air
Sebanyak 5 g serbuk simplisia, dimaserasi selama 24 jam dalam 100 mL air-kloroform (2,5 mL kloroform dalam air suling sampai 1 liter) dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam, lalu disaring. Sejumlah 20 mL filtrat pertama diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah ditara dan sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.4.5 Penetapan Kadar Sari Larut dalam Etanol
Sebanyak 5 g serbuk simplisia, dimaserasi selama 24 jam dalam 100 mL etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Kemudian disaring cepat untuk
menghindari penguapan etanol. Sejumlah 20 mL filtrat diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam persen sari yang larut dalam etanol 96% dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.4.6 Penetapan Kadar Abu Total
Sebanyak 2 g serbuk simplisia dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, jika arang masih tidak dapat dihilangkan, ditambahkan air panas, saring melalui kertas saring bebas abu. Pijarkan sisa dan kertas saring dalam krus yang sama. Masukkan filtrat ke dalam krus, uapkan, pijarkan hingga bobot tetap, timbang. Kadar abu dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.4.7 Penetapan Kadar Abu Tidak Larut dalam Asam
Abu yang diperoleh dalam penetapan kadar abu dididihkan dalam 25 mL asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring bebas abu, cuci dengan air panas, dipijarkan, kemudian didinginkan dan ditimbang sampai bobot tetap. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.5 Pemeriksaan Karakteristik EEDA
larut dalam asam. Prosedur pemeriksaan ekstrak etanol daun afrika sama seperti prosedur karakterisasi simplisia daun afrika
3.6 Skrining Fitokimia Serbuk Simplisia
Skrining fitokimia serbuk simplisia meliputi pemeriksaan senyawa golongan flavoinoid, alkaloid, saponin, tanin, glikosida dan steroid/triterpenoid.
3.6.1 Pemeriksaan flavonoida
Sebanyak 10 g serbuk simplisia ditambahkan 10 ml air panas, dididhkan selama 5 menit dan disaring dalam keadaan panas, ke dalam 5 ml filtrat ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml amil alkohol, dikocok dan dibiarkan memisah. Flavonoida positif jika terjadi warna merah, kuning atau jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.6.2 Pemeriksaan alkaloid
Serbuk simplisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk tes alkaloid. Diambil 3 tabung reaksi, lalu ke dalamnya dimasukkan 0,5 ml filtrat. Pada masing-masing tabung reaksi :
a. Ditambahkan 2 tetes pereaksi Mayer b. Ditambahkan 2 tetes pereaksi Bouchardat c. Ditambahkan 2 tetes pereaksi Dragendorff
Alkaloid positif jika terjadi endapan atau kekeruhan pada dua dari tiga percobaan diatas (Depkes RI, 1995).
3.6.3 Pemeriksaan saponin
Serbuk simplisia ditimbang sebanyak 0,5 g dan dimasukkan ke dalam tabung reaksi, lalu ditambahkan 10 ml air panas, didinginkan, kemudian dikocok kuat-kuat selama 10 menit. Jika terbentuk busa setinggi 1-10 cm yang stabil tidak kurang dari 10 menit dan buih tidak hilang dengan penambahan 1 tetes asam klorida 2 N menunjukkan adanya saponin (Depkes RI,1995).
3.6.4 Pemeriksaan tannin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling lalu disaring, filtratnya diencerkan dengan air suling sampai tidak berwarna. Diambil 2 ml larutan dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%. Jika terjadi warna biru kehitaman atau hijau kehitaman menunjukkan adanya tanin (Farnsworth, 1966).
3.6.5 Pemeriksaan glikosida
cairan menunjukkan adanya ikatan gula (Depkes RI, 1995).
3.6.6 Pemeriksaan glikosida jantung ( Keller-Kiliani Test)
Serbuk simplisia sebanyak 1 g, dimaserasi dengan Etanol selama 1 jam, kemudian disaring. Filtrat diuapkan dalam cawan penguap sampai kering. Kemudian tambahkan 1-2 tetes pereaksi besi (III) klorida 1 %, asam asetat glasial dan asam sulfat pekat, terbentuk warna hijau biru menunjukkan adanya glikosida jantung (Jamil, et al, 2012).
3.6.7 Pemeriksaan steroid / triterpenoid
Serbuk simplisia ditimbang sebanyak 1 g, dimaserasi dengan 20 ml nheksan selama 2 jam, disaring. Filtrat diuapkan dalam cawan penguap dan pada sisanya ditambahkan pereaksi Liebermann-Burchard melalui dinding cawan. Apabila terbentuk warna ungu atau merah yang berubah menjadi biru ungu atau biru hijau menunjukkan adanya triterpenoid/steroid (Harborne, 1984).
3.7 Skrining Fitokimia EEDA
Skrining terhadap ekstrak etanol daun Afrika dilakukan untuk mengetahui senyawa kimia yang terkandung di dalam ekstrak. Prosedur pemeriksaan ekstrak etanol daun afrika sama seperti prosedur skrining fitokimia terhadap simplisia daun afrika
3.8 Pembuatan EEDA
Pembuatan ekstrak etanol daun Afrika dilakukan dengan metode perkolasi. Caranya 400 gram serbuk simplisia dimaserasi dengan etanol 96%
selama 3 jam. Selanjutnya dipindahkan massa tersebut sedikit demi sedikit ke dalam perkolator, tambahkan etanol 96% secukupnya hingga simplisia terendam dan terdapat cairan penyari di atasnya, perkolator ditutup dengan aluminium foil dan dibiarkan selama 24 jam. Kemudian kran perkolator dibuka dan dibiarkan cairan ekstrak menetes dengan kecepatan 20 tetes per menit dan ditambahkan etanol 96% berulang-ulang secukupnya dan diatur kecepatan penetesan cairan penyari sama dengan kecepatan tetesan perkolat,sehingga selalu terdapat selapis cairan penyari di atas simplisia. Perkolasi dihentikan jika 500 mg perkolat yang keluar terakhir diuapkan, tidak meninggalkan sisa. Perkolat kemudian disuling dan diuapkan dengan tekanan rendah pada suhu tidak lebih dari 50oC menggunakan rotary evaporator sehingga diperoleh ekstrak kental sebanyak 175,73 g (Ditjen POM, 1979; Depkes RI, 1995).
3.9 Uji Efek EEDA Terhadap Kontraktilitas dan Denyut pada Isolat Jantung Tikus.
Uji efek ekstrak etanol daun afrika terhadap isolat jantung tikus normal dan untuk mengetahui pengaruh pemberian ekstrak terhadap kontraktilitas jantung dan denyut jantung (Vogel, 2008). Tikus dianastesi terlebih dahulu dengan ketamin dosis 1mg/Kgbb secara intraperitonial, selanjutnya diberikan heparin dosis 5000 iu/Kgbb secara intraperitonial. Jantung tikus diisolasi dan diletakkan dalam cawan petri yang berisi larutan fisiologi Krebs-Henseleit beku (NaCl 6,9 g; KCl 0,35 g; NaHCO3, 2,1 g; MgSO4.7H2O 0,29 g; KH2SO4
0,16 g; CaCl20,28 g; glukosa 1 g; pH 7,4) dan dialiri karbogen (campuran 95%
O2 + 5% CO2). Jantung dibersihkan dari bagian lemak dan perikardium.
Bagian ventrikel jantung disambungkan dengan transduser yang akan merekam pergerakan otot jantung. Setelah dicapai kondisi stabil, isolat jantung diberikan EEDA dan diamati efek kontraksi dan denyut yang terjadi pada jantung melalui rekaman yang disampaikan transduser (Ojowole, 2007, Kamadyaapa, 2009). Perlakuan diulang sebanyak 3 (tiga kali).
3.9.1 Pembuatan larutan krebs-henseleit
Timbang sebanyak 6,9 g NaCl; 0,35 g KCl; 0,28 g CaCl2; 2,1 g
NaHCO3; 1 g glukosa; 0,29 g MgSO4.7H2O; 0,16 g KH2SO4, kemudian
dilarutkan dalam 1 liter aquades (Ads instrument).
3.9.2 Pembuatan larutan induk EEDA
Sebanyak 250 mg EEDA ditimbang, kemudian ditambahkan DMSO sedikit demi sedikit hingga larut. Kemudian dicukupkan volumenya hingga 250 ml dengan larutan krebs-henseleit dalam labu tentukur sampai garis tanda (konsentrasi 1 mg/ml).
3.9.3 Pembuatan larutan uji EEDA
Larutan induk EEDA dipipet sebanyak 25 ml; 50 ml; 100 ml kemudian dimasukkan ke dalam masing-masing labu tentukur 100 ml lalu volumenya dicukupkan dengan larutan krebs-henseleit sampai garis tanda (untuk mendapatkan konsentrasi 0,25 mg/ml, 0,5 mg/ml, 1 mg/ml) (Janardan, et al., 2011).
3.10 Analisis Hasil
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Tumbuhan yang telah diidentifikasi di Lembaga Ilmu Pengetahuan Indonesia (Indonesian Institute of Science) Pusat Penelitian Biologi (Research Center for Biology), Bogor adalah Vernonia amygdalina Delile. suku Asteraceae (Ginting, 2012).
4.2 Hasil Karakteristik Simplisia dan EEDA
Pemeriksaan makroskopik bertujuan untuk mengetahui ciri-ciri fisik simplisia suatu tumbuhan, seperti bentuk, bau dan rasa. Sedangkan pemeriksaan mikroskopik bertujuan untuk mengetahui struktur anatomi suatu simplisia tumbuhan. Hasil pemeriksaan makroskopik daun Afrika segar memiliki bentuk daun oval-elips, ujung dan pangkal daun meruncing, susunan tulang daun menyirip, tepi daun bergerigi dan kasar, permukaan berambut sangat halus, panjang 15 cm - 19 cm, lebar 5 cm - 8 cm, berwarna hijau muda dan rasanya pahit dan diikuti rasa manis.
Hasil pemeriksaan makroskopik simplisia daun Afrika dicirikan dengan daun berwarna hijau kecoklatan, panjang 12 cm - 16 cm, lebar 3,5 cm - 5 cm, rasa pahit, dan berbau khas. Serbuk simplisia berwarna hijau kecoklatan dan berbau khas.
Hasil pemeriksaan mikroskopik serbuk simplisia daun Afrika tampak fragmen berkas pembuluh yang berbentuk spiral, stomata anisositik, kristal kalsium oksalat bentuk prisma, dan rambut penutup.
Hasil pemeriksaan kadar air, kadar sari larut air, kadar sari larut etanol, kadar abu total dan kadar abu yang tidak larut asam pada serbuk simplisia dan ekstrak etanol daun Afrika dapat dilihat pada Tabel 4.1.
Tabel 4.1Hasil pemeriksaan karakteristik simplisia dan EEDA
No Parameter Hasil (%)
Simplisia Ekstrak 1.
2. 3 4 5
Penetapan kadar air
Penetapan kadar sari larut dalam air Penetapan kadar sari larut dalam etanol Penetapan kadar abu total
Penetapan kadar abu tidak larut dalam asam
7,98 25,89 14,89 9,74 0,70
4,79 37,24 48,12 5,60 0,20
Hasil karakterisasi simplisia daun Afrika menunjukkan hasil penetapan kadar air diperoleh lebih kecil dari 10% yaitu 7,98%. Persyaratan kadar air simplisia daun Afrika tidak ditetapkan Materia Medika Indonesia. Namun, kadar air yang melebihi 10% dapat menjadi media yang baik untuk pertumbuhan mikroba, keberadaan jamur atau serangga, serta mendorong kerusakan karena terjadi proses hidrolisis (Trease, 1983; WHO, 1992).
larut dalam air sebesar 25,89%; sedangkan kadar sari yang larut dalam etanol sebesar 14,89%. Kadar sari yang larut dalam air lebih besar dari kadar sari yang larut dalam etanol karena senyawa bersifat polar lebih banyak larut di dalam pelarut air dari etanol, dan senyawa yang tidak larut di pelarut air akan larut di dalam pelarut etanol. Air dapat melarutkan zat lain yang tidak diperlukan seperti gom, pati, protein, lemak, lendir dan lain-lain, hal ini yang menyebabkan tingginya kadar sari yang larut dalam air dari tanaman yang dilarutkan (Depkes, 1986).
Penetapan kadar abu dimaksudkan untuk mengetahui kandungan mineral internal (abu fisiologis) yang berasal dari jaringan tanaman itu sendiri, dan eksternal (abu non-fisiologis) yang merupakan residu dari luar seperti pasir dan tanah yang terdapat di dalam sampel (Ditjen POM 2000; WHO, 1992). Kadar abu tidak larut asam untuk menunjukkan jumlah silikat, khususnya pasir yang ada pada simplisia dengan cara melarutkan abu total dalam asam klorida (WHO, 1992). Penetapan kadar abu pada simplisia daun Afrika menunjukkan kadar abu total sebesar 9,74% dan kadar abu tidak larut dalam asam sebesar 0,70%. Kadar abu total pada umumnya untuk masing-masing simplisia tidak sama. Umumnya syarat kadar abu tidak larut dalam asam < 1%, dan memenuhi persyaratan.
Monografi simplisia daun Afrika tidak terdaftar di buku Materia Medika Indonesia (MMI), sehingga perlu dilakukan pembakuan secara nasional mengenai parameter karakterisasi simplisia daun Afrika.
Standar karakteristik ekstrak belum tercantum dalam monografi parameter ekstrak tumbuhan Indonesia, sehingga perlu pembakuan secara nasional mengenai parameter karakterisasi ekstrak etanol daun Afrika.
4.3 Hasil Skrining Fitokimia Simplisia dan EEDA
Penentuan golongan senyawa kimia simplisia dan ekstrak etanol daun Afrika dilakukan untuk mendapatkan informasi golongan senyawa metabolit sekunder yang terdapat di dalamnya. Adapun pemeriksaan yang dilakukan terhadap simplisia dan ekstrak etanol daun afrika adalah pemeriksaan golongan senyawa alkaloid, flavonoid, steroid/triterpenoid, tanin, saponin, glikosida dan glikosida jantung. Hasil pemeriksaan penentuan golongan senyawa kimia daun afrika dapat dilihat pada Tabel 4.2.
Tabel 4.2Hasil Skrining fitokimia simplisia dan EEDA
No Skrining Hasil Pengamatan
Simplisia Ekstrak etanol
1 Alkaloid (-) (-)
2 Flavonoid (+) (+)
3 Saponin (+) (+)
4 Tanin (+) (+)
5 Triterpenoid/Steroid (+) (+)
6 Glikosida (+) (+)
7 Glikosida Jantung (+) (+)
Keterangan : (+) = mengandung golongan senyawa (-) = tidak mengandung golongan senyawa
senyawa-saponin, aglikon dan glikosida (Filho, 2006)
4.4 Hasil Uji Efek Inotropik dan Kronotropik EEDA
4.4.1 Uji Inotropik
Uji inotropik adalah pengujian yang dilakukan untuk melihat peningkatan kontraktilitas isolat jantung. Hasil uji inotropik pada isolat jantung berupa adanya persen (%) peningkatan kontraktilitas (Niazmand dan Saberi, 2010).
Berdasarkan hasil penelitian ditemukan bahwa EEDA dan digoksin meningkatkan kontraktilitas jantung. Persen peningkatan kontraktilitas jantung yang diinduksi oleh EEDA 0,025 mg adalah (39,25% ± 3,21) ternyata tidak berbeda bermakna dengan kontrol negatif (29,95% ± 1,44). EEDA pada dosis 0,05 mg adalah (80,18% ± 4,43); 0,1 mg adalah (165,06% ± 16,07); dan digoksin 0,025 mg (71,43% ± 5,80); 0,05 mg (60,87% ± 8,09); 0,1 mg (83,59% ± 17,79) menunjukkan perbedaan yang bermakna jika dibandingkan dengan kontrol negatif (29,95% ± 1,44). EEDA 0,025 mg (39,25% ± 3,21) belum memperlihatkan peningkatan kontraktilitas isolat jantung (Tabel 4.3 dan Gambar 4.1).
No Kelompok Peningkatan Kontraktilitas (%)
Signifikansi Terhadap Kontrol
1 Kontrol negatif 29,95 ± 1,44
-2 EEDA 0,025 mg 39,25 ± 3,21 0,90
3 EEDA 0,05 mg 80,18 ± 4,43 0,00*
4 EEDA 0,1 mg 165,06 ± 16,07 0,00*
5 Digoksin 0,025 mg 71,43 ± 5,80 0,00* 6 Digoksin 0,05 mg 60,87 ± 8,09 0,02* 7 Digoksin 0,1 mg 83,59 ± 17,79 0,00*
0 20 40 60 80 100 120 140 160 180 200
P
en
in
gk
at
an
k
on
tr
ak
ti
li
tas
(
%
)
Kelompok
EEDA 0,1 mg (165,06% ± 16,07) menunjukkan perbedaan yang bermakna dengan digoksin 0,025 mg (71,43% ± 5,80); 0,05 mg (60,87% ± 8,09); dan 0,1 mg (83,59 ± 17,79).
Berdasarkan hasil perbandingan di atas, secara statistik EEDA 0,025 mg (39,25% ± 3,21) tidak menunjukkan peningkatan kontraktilitas isolat jantung dibanding kontrol (29,95% ± 1,44). EEDA 0,05 mg (80,18% ± 4,43) secara statistik menunjukkan efek yang hampir sama dengan yang diinduksi oleh digoksin pada dosis 0,025 mg (71,43% ± 5,80); 0,05 mg (60,87% ± 8,09); dan 0,1 mg (83,59% ± 17,79). Sementara EEDA 0,1 mg (165,06% ± 16,07) secara statistik menunjukkan peningkatan kontraksi jantung yang lebih tinggi dibandingkan digoksin dosis 0,025 mg (71,43% ± 5,80); 0,05 mg (60,87% ± 8,09); 0,1 mg (83,59% ± 17,79).
Dari hasil penelitian di atas dapat disimpulkan bahwa EEDA dosis 0,025 mg tidak meningkatkan kontraktilitas secara bermakna, tetapi EEDA dosis 0,05 mg dan 0,1 mg mampu meningkatkan kontraktilitas pada isolat jantung secara bermakna. Sementara, digoksin sebagai pembanding pada dosis 0,025 mg; 0,05 mg; dan 0,1 mg mampu meningkatkan kontraktilitas isolat jantung secara bermakna. Kemampuan EEDA meningkatkan kontraktilitas diduga disebabkan oleh adanya senyawa vernonioside yang terdapat dalam daun Afrika.
Vernonioside memiliki rumus struktur yang hampir sama dengan digoksin yang merupakan suatu glikosida jantung yang memiliki aktivitas
sebagai kardiotonik (obat yang dapat meningkatkan kekuatan kontraksi jantung).
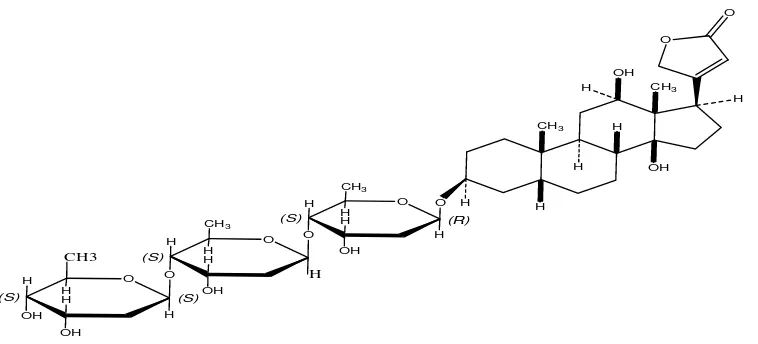
Pada struktur vernonioside (Gambar 4.2) terdapat α,β-lakton pada
posisi 17β, gugus 14β-hidroksi, konfigurasi cis diantara cincin A dan B serta C dan D dan gugus gula yang dapat mempengaruhi aktivitas senyawa tersebut. Sedangkan pada digoksin (Gambar 4.3) juga terdapat α,β-lakton pada posisi
17β, gugus 14β-hidroksi, konfigurasi cis di antara cincin A dan B serta C dan D dan gugus gula.
O
Gambar 4.2. Rumus struktur vernoniside dari daun Afrika (Ijeh dan Ejike, 2010)
siklopenantren, cincin lakton, dan gugus gula (glikon). Pada vernonioside
terdapat tiga cincin lakton yang terletak pada posisi 17β, sedangkan pada
digoksin hanya terdapat satu cincin lakton yang terletak pada posisi 17β. Vernonioside dapat memperlama kekuatan kontraksi dibandingkan dengan digoksin, karena lakton pada vernonioside lebih banyak dibanding lakton pada digoksin. Cincin lakton pada senyawa glikosida jantung berperan memperlama kekuatan kontraksi senyawa tersebut, karena cincin lakton tersebut bekerja dengan melakukan perubahan serta meningkatkan penghambatan enzim. Adanya cincin lakton pada atom dapat meningkatkan energi interaksi antara senyawa dengan reseptor (pompa ion) sehingga terjadi peningkatan penghambatan enzim dan oleh karena itu terjadilah perpanjangan lama kontraksi jantung karena pengaruh pemberian obat. Semakin banyak jumlah cincin lakton maka semakin panjang waktu kontraksi C17β (Melero, et al., 2000).
Pada vernonioside terdapat satu gugus gula β-D-glukosa, sedangkan
pada digoksin terdapat tiga gugus gula β-D-digitokse. Gugus gula pada senyawa glikosida jantung tidaklah penting, tetapi gugus gula tersebut dapat mengatur aktivitas gilkosida jantung (Melero, et al., 2000). Untuk aktivitas
kardiotonik, bagian struktur glikosida jantung yang berperan adalah α, β-lakton
tidak jenuh pada posisi 17β, gugus 14β-hidroksi, konfigurasi cis di antara cincin A dan B serta C dan D. Gugus gula meskipun kurang penting tetapi
berperan mengatur aktivitas glikosida jantung (Siswandono dan Bambang, 2000).
4.4.2 Uji Kronotropik
Uji kronotropik adalah pengujian yang dilakukan untuk melihat peningkatan denyut pada isolat jantung. Hasil uji kronotropik pada isolat jantung berupa persen (%) peningkatan denyut (Niazmand dan Saberi, 2010).
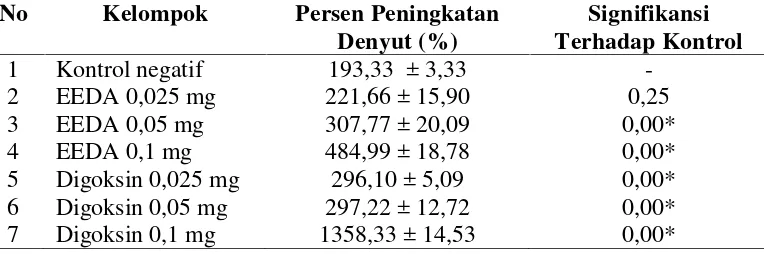
Berdasarkan hasil penelitian ditemukan bahwa EEDA dan digoksin meningkatkan denyut jantung. Secara statistik EEDA dosis 0,025 mg (221,66% ± 15,90) tidak berbeda bermakna dengan kontrol negatif (193,33% ± 3,33). Sedangkan EEDA 0.05 mg (307,77% ± 20,09); 0,1 mg (484,99% ± 18,78); digoksin dosis 0,025 mg (296,10% ± 5,09); 0,05 mg (297,22% ± 12,72); dan 0,1 mg (1358,33% ± 14,53) menunjukkan perbedaan yang bermakna dengan kontrol negatif. Sementara EEDA 0,025 mg (221,66% ± 15,90) belum meningkatkan denyut isolat jantung (Tabel 4.4 dan Gambar 4.4).
Tabel 4.4Persen peningkatan denyut
No Kelompok Persen Peningkatan
Denyut (%)
Signifikansi Terhadap Kontrol
1 Kontrol negatif 193,33 ± 3,33
-2 EEDA 0,025 mg 221,66 ± 15,90 0,25
3 EEDA 0,05 mg 307,77 ± 20,09 0,00*
4 EEDA 0,1 mg 484,99 ± 18,78 0,00*
5 Digoksin 0,025 mg 296,10 ± 5,09 0,00* 6 Digoksin 0,05 mg 297,22 ± 12,72 0,00* 7 Digoksin 0,1 mg 1358,33 ± 14,53 0,00*
0 200 400 600 800 1000 1200 1400
P
en
in
gk
at
an
d
en
yu
t (
%
)
Kelompok
kontrol negatif EEDA 0,025 mg EEDA 0,05 mg EEDA 0,1 mg Digoksin 0,025 mg Digoksin 0,05 mg Digoksin 0,1 mg
efek yang hampir sama dengan yang diinduksi digoksin dosis 0,025 mg (296,10% ± 5,09) dan 0,05 mg (297,22% ± 12,72). EEDA 0,1 mg (484,99% ± 18,78) secara statistik menunjukkan peningkatan denyut jantung yang lebih tinggi dibandingkan dengan digoksin dosis 0,025 mg (296,10% ± 5,09) dan 0,05 mg (297,22% ± 12,72), namun tidak mampu menyamai peningkatan denyut jantung yang diinduksi digoksin 0,1 mg (1358,33% ± 14,53).
Senyawa glikosida jantung adalah suatu senyawa spesifik yang bekerja pada otot jantung, dapat meningkatkan rangsangan denyut jantung dan kontraktilitas jantung. Aglikon dari glikosida terkadang disebut sebagai cardiak genin. Selama beberapa tahun lalu, aglikon dari glikosida tersebut menjadi subjek dari konstituen kimia yang dapat mempengaruhi aktivitas dari glikosida tersebut (Claus, et al., 1971).
Aglikon dari glikosida jantung adalah steroid. Inti steroid yang terdapat pada glikosida jantung merupakan turunan steroid berupa siklopenantren yang terdapat cincin lakton tak jenuh pada atom C17β. Kekuatan dari glikosida
jantung untuk menaikkan denyut jantung dan kontraksi jantung tergantung pada gugus gula dan cincin lakton yang terdapat pada komponen penyusun senyawa tersebut (Claus, et al., 1971).
Digoksin adalah salah satu senyawa glikosida jantung yang diisolasi dari Digitalis purpurea dari family schrophulariaceae. Digoksin memiliki rumus molekul C41H64O14.Digoksin mempunyai nama kima yaitu (3β,5β,12β)
-D-ribo-dihydroxy-card-20(22)-enolide. (Weis, et al., 2005).
Obat-obat yang bersifat kardiotonik digunakan untuk pengobatan payah jantung kongestif, fibrilasi dan denyut atrial. Glikosida kardiotonik dapat menghambat Na+/K+-ATPase, yaitu suatu enzim yang bertanggung jawab untuk memelihara ketidakseimbangan distribusi ion Na+ dan K+ dalam melewati membrane sel. Kadar ion Na+lebih besar di luar sel sedang kadar ion K+ lebih besar di dalam sel. Perubahan depolarisasi permeabilitas membrane sel miokardial diikuti pergerakan secara cepat ion Na+ ke dalam sel melalui difusi pasif dan pergerakan ion K+ ke luar sel. Pergerakan ini bersifat terpulihkan dan disebut proses pompa sodium, yang dikatalisis oleh enzim Na+/K+-ATPase dan membutuhkan energi yang diperoleh dari hidrolisis ATP menjadi ADP. Penghambatan enzim Na+/K+-ATPase menyebabkan efek inotropik positif sehingga kadar aktivator ion Ca2+meningkat (Siswandono dan Bambang, 2000).
Na+/K+-ATPase adalah suatu protein heteromerik yang terdiri dari sub
unit α dan β. Na+/K+-ATPase juga disebut pompa natrium, dan juga suatu protein yang berfungsi untuk membangun dan mempertahankan suatu gradient elektrokimia untuk ion natrium dan ion kalium dapat melintasi membrane plasma sel mamalia. Di dalam jantung Na+/K+-ATPase berfungsi sebagai target dari senyawa glikosida jantung yang digunakan dalam pengobatan gagal jantung dan fibrilasi atrium. Dengan menghalangi aktivitas katalitik enzim, glikosida jantung meningkatkan konsentrasi ion natrium di dalam sel, dimana
menunjukkan peningkatan ion kalsium melalui pertukaran ion natrium dengan kalsium, sehingga dapat meningkatkan kontraktilitas. Sedangkan sub unit α
dari Na+/K+-ATPase mengandung asam amino yang terlibat dalam fungsi
katalitik. Fungsi pada sub unit β tidak sepenuhnya diketahui, namun sub unit
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian dapat disimpulkan bahwa
a. hasil karakterisasi simplisia daun Afrika diperoleh kadar air 7,98%; kadar sari larut air 25,89%; kadar sari larut etanol 14,89%; kadar abu total 9,74%; dan kadar abu tidak larut asam 0,70%.
b. hasil karakterisasi EEDA diperoleh kadar air 4,79%; kadar sari larut air 37,24%; kadar sari larut etanol 48,12%; kadar abu total 5,60%; dan kadar abu tidak larut asam 0,20%.
c. hasil skrining fitokimia simplisia dan EEDA didapatkan senyawa golongan metabolit sekunder yaitu saponin, tannin, steroid/triterpenoid, flavonoid, glikosida dan glikosida jantung.
d. hasil uji inotropik EEDA isolat jantung ditemukan terjadi peningkatan persen kontraktilitas jantung. EEDA dosis 0,025 mg adalah 39,25% ± 3,21; EEDA 0,05 mg 80,18% ± 4,43; dan EEDA 0,1 mg 165,06% ± 16,07. Sedangkan digoksin dosis 0,025 mg sebagai pembanding adalah 71,43% ± 5,80; dan 0,05 mg 60,87% ± 8,09; dosis 0,1 mg adalah 83,59% ± 17,79.
e. hasil uji kronotropik EEDA pada isolat jantung diperoleh persen peningkatan denyut jantung. EEDA pada dosis 0,025 mg 221,66% ± 15,90; EEDA 0,05 mg 307,77% ± 20,09; dan EEDA 0,1 mg 484,99%
± 18,78. Sedangkan digoksin dosis 0,025 mg adalah 296,10% ± 5,09; dosis 0,05 mg 297,22% ± 12,72; dan 0,1 mg 1358,33 ± 14,53.
5.2 Saran
Berikut adalah sistematika tumbuhan (Ibrahim, et al., 2004). Kingdom : Plantae
Divisi : Spermatophyta Subdivisi : Angiospermae Kelas : Dicotyledoneae Bangsa : Asterales Suku : Asteraceae Marga :Vernonia
Spesies :Vernonia amygdalinaDel.
Daun Afrika mempunyai ciri-ciri morfologi sebagai berikut: Batang tegak, tinggi 1-3m, bulat, berkayu, berwarna coklat kotor; daun majemuk, anak daun berhadapan, panjang 15-25 cm, lebar 5-8 cm, tebal 7-10 mm, berbentuk seperti ujung tombak, tepi bergerigi, ujung runcing, pangkal membulat, pertulangan menyirip, berwarna hijau tua; akar tunggang, berwarna coklat kotor (Ibrahim, et al., 2004; Ijeh, 2010).
peptida, dan luteolin.
Daun Afrika telah banyak digunakan untuk obat-obatan dan telah banyak penelitian yang telah dilakukan untuk tumbuhan tersebut seperti antioksidan (Pinem, 2012) antimutagenik (Ginting, 2012), antikanker (Oyugi, 2009), antidiabetes (Atangwho, et al., 2007; Nwawnjo dan Nwokoro, 2004; Setiawan, 2012) dan analgetik (Njan, et al., 2008).
2.2 Ekstrak
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan (Ditjen POM, 1995).
Metode ekstraksi menurut Agoes (2007), Anief (2000), Ditjen POM (2000) dan Syamsuni (2006) ada beberapa cara, yaitu:
1. Maserasi
Maserasi adalah suatu cara penyarian simplisia dengan cara merendam simplisia tersebut dalam pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur kamar.
2. Perkolasi
Perkolasi adalah suatu cara penyarian simplisia menggunakan perkolator dimana simplisianya terendam dalam pelarut yang selalu baru dan umumnya dilakukan pada temperatur kamar. Prosesnya terdiri dari tahapan
pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya (penetesan dan penampungan ekstrak) terus-menerus sampai diperoleh ekstrak (perkolat).
3. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya dalam jangka waktu tertentu dimana pelarut akan terkondensasi menuju pendingin dan kembali ke labu.
4. Sokletasi
Sokletasi adalah ekstraksi kontinu menggunakan alat soklet, dimana pelarut akan terkondensasi dari labu menuju pendingin, kemudian jatuh membasahi sampel dan mengisi bagian tengah alat soklet. Tabung sifon juga terisi dengan larutan ekstraksi dan ketika mencapai bagian atas tabung sifon, larutan tersebut akan kembali ke dalam labu.
5. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur yang lebih tinggi dari temperatur kamar, umumnya dilakukan pada suhu 40-60oC.
6. Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur 90oC selama 15 menit.
7. Dekok
Gagal jantung kongestif (GJK) adalah keadaan di mana jantung tidak mampu memenuhi kebutuhan oksigen tubuh secara adekuat karena fungsi pompa sentral jantung mengalami gangguan. GJK bisa disebabkan berbagai penyakit, di antaranya penyakit yang menyebabkan lemahnya otot jantung, penyakit yang menyebabkan kaku otot jantung, dan dapat mempertinggi kebutuhan akan oksigen oleh jaringan tubuh yang melebihi kapabilitas jantung untuk memenuhinya. Jantung terdiri dari dua atria (kiri dan kanan) yang terletak dibagian atas jantung dan dua ventrikel (kiri dan kanan) yang terdapat pada bagian bawah jantung. Otot ventrikel bertindak memompa darah ke seluruh tubuh, sehingga disebut pompa sentral. Jika otot ventrikel berkontraksi disebut sistole. Jantung bagian kiri inilah secara langsung yang bertanggung jawab memenuhi kebutuhan tubuh akan oksigen. Banyak penyakit yang menggangu pompa ventrikel, misalnya, karena melemasnya otot ventrikel akibat serangan jantung atau infeksi (miokarditis). Rendahnya kemampuan pompa jantung oleh ventrikel akibat lemahnya otot ventrikel (disfungsi sistolik). Setiap kali setelah ventrikel berkontraksi (sistole) akan diikuti periode relaksasi agar darah dari atrium mengisi ventrikel, periode relaksasi itu disebut diastole (Harahap dan Nasution, 2009).
Gagal jantung berasal dari dalam miokardium yang terjadi akibat kemampuan tekanan otot jantung untuk mengembang secara adekuat terganggu (gagal miokardium). Di samping itu juga dapat disebabkan karena gangguan mekanis, yaitu kegagalan pengisian ventrikel atau kegagalan menyemburkan
darah dari jantung ke seluruh tubuh. Secara garis besar, ada tiga tipe gagal jantung. Pertama, gagal jantung ventrikel kiri. Kedua, gagal jantung ventrikel kanan, dan yang ketiga gagal jantung kongestif (kombinasi pertama dan kedua). Secara klinis, sindrom umum gagal jantung kongestif (GJK) berdasarkan hemodinamik ditandai dengan rendahnya keluaran jantung, kongestif venus (biasa pada pulmonary saja, sistemis atau keduanya sekaligus). Tanda-tanda ini sejak lama telah diakui para ahli. Manifestasi GJK yang sering kelihatan adalah letih, intoleransi eksesais, susah bernafas, orthopnea, edema dan asites (Harahap dan Hadisahputra, 1995).
2.4 Tipe Dan Penyebab Gagal Jantung
Penyebab khusus gagal jantung sering tidak dapat dipastikan dan diidentifikasi, meskipun dalam waktu yang lama seorang penderita mengalami hipertensi. Tetapi yang jelas, hipertensi mempunyai pravalensi yang tinggi untuk berkembang menjadi GJK. Akan tetapi GJK juga disebabkan abnormalitas pada bagian tertentu di jantung. Pertambahan umur, secara perlahan akan menurunkan fungsi dan performa jantung. Oleh karena itu, pada orang yang berusia lanjut gagal jantung merupakan suatu keadaan yang membahayakan. Pada jantung normal, gagal jantung biasa juga terjadi apabila dalam keadaan hipertiroidisme (Harahap dan Hadisahputra, 1995).
(cardiac output) = (HR x SV) = 72 x 80 ml = 5760 ml. Sejumlah inilah darah yang dipompakan dari jantung ke sirkulasi sistemik setiap menit. Isi kandungan ventrikel ± 130 ml darah. Jadi, dengan demikian setiap denyut jantung menyemburkan darah ± 60% dari kandungan ventrikel (± 60 ml sisa sebagai volume residu). Pada jantung yang lemah, isi sekuncup (SV) sangat rendah dan volume residu akan meningkat. Jadi pengisian rongga jantung cenderung berlebih (over fill) sebelum berlaku setiap denyutan berikutnya. Akibatnya serabut otot ventrikel akan meregang secara berlebihan (over stretching) sehingga fungsi jantung tidak efesien. Penampilan jantung dipengaruhi oleh tekanan terhadap otot jantung pada akhir pengisian dan selama pengosongan. Tekanan pada saat pengisian disebut preload, sedangkan tahanan atau rintangan pada saat pengosongan darah disebut afterload. Oleh karena itulah daya kekuatan yang terdapat pada sirkulasi arterial harus mampu ditentang oleh jantung oleh sistem pompanya agar penyaluran darah terjadi dengan baik (Harahap dan Hadisahputra, 1995).
2.5 Tanda-Tanda Dan Simptom Gagal Jantung
Simptom yang paling utama dalam keadaan ini adalah sesak nafas menyebabkan terjadinya pengurasan tenaga dan dapat menyebabkan ambruk (orthopnoea). Pasien sangat mudah lelah akibat rendahnya suplai darah ke otot-otot tubuh. Jika pasien mengalami edema disertai batuk dan sesak nafas, tidur pasien akan terganggu. Peningkatan produksi urin bisa terjadi dan pengosongan bladder umumnya terjadi pada malam hari (nocturia).
Orthopnoea dapat mempercepat serangan yang membuat pasien terengah-engah pada malam hari (paroxysmal nocturnal dyspnoea, PND). Simptom lain yang berhubungan erat dengan pengurangan suplai darah ke jaringan dan organ adalah kebingungan, gagal ginjal, hepatomegali, perut kembung, anoreksia, nausea, sakit pada abdominal. Kulit menjadi pucat, tangan dingin dan berkeringat juga termasuk simptom yang sering ditemukan (Harahap dan Hadisahputra, 1995).
2.6 Obat-Obat Yang Digunakan Untuk Mengobati Gagal Jantung Kongestif
Gagal jantung kongestif (GJK) dapat disebabkan oleh gangguan kemampuan otot jantung berkontraksi atau meningkatnya beban kerja dari jantung. Penyebab dasar gagal jantung kongestif antara lain penyakit jantung arteriosklerosis, penyakit hipertensi, penyakit katup jantung, kardiomiopati yang melebar. Tujuan terapi untuk gagal jantung kongestif adalah meningkatkan curah jantung. Tiga golongan obat menunjukkan efektivitas klinis dalam mengurangi gejala-gejala dan memperpanjang kehidupan: 1) vasodilator yang mengurangi beban miocard; 2) obat diuretik yang menurunkan cairan ekstraseluler dan; 3) obat-obat inotropik yang meningkatkan kekuatan kontraksi otot jantung (Mycek, et al., 2001; Chaidir dan Munaf, 2006).
2.6.1 Vasodilator
yang harus diatasi jantung ketika memompa darah ke sistem atrial. Peningkatan afterload menyebabkan jantung bekerja lebih kuat memompa darah ke sistem arterial. Vasodilatasi berguna untuk mengurangi preload dan afterload yang berlebihan. Dilatasi pembuluh darah vena menyebabkan berkurangnya preload jantung dengan meningkatkan kapasitas vena; dilator arterial menurunkan resistensi arteriol sistemik dan menurunkan afterload. Vasodilator akan memperbaiki keseimbangan kardiovaskular (Mycek, et al., 2001; Chaidir dan Munaf, 2006).
A. Inhibitor enzim pengkonversi angiotensin (ACE)
Inhibitor ACE merupakan obat pilihan untuk gagal jantung kongestif dan lebih baik dibandingkan vasodilator lain. Obat-obat ini menghambat enzim yang berasal dari angiotensin I membentuk vasokonstriksor kuat angiotensin II. Obat-obat ini juga menghilangkan kecepatan inaktivasi bradikinin. Vasodilatasi terjadi sebagai akibat efek bersama vasokonstriktor yang lebih rendah yang disebabkan berkurangnya angiotensin II dan efek vasodilator yang kuat dari peningkatan bradikinin. Dengan mengurangi kadar angiotensin II dalam sirkulasi, inhibitor ACE juga mengurangi sekresi aldosteron, menyebabkan penurunan retensi natrium dan garam. Inhibitor ACE bekerja pada jantung dengan menurunkan resistensi vaskular, vena dan tekanan darah, menyebabkan peningkatan curah jantung. Obat ini juga menghambat peningkatan epinerfrin akibat hipertensinogen II dan aldosteron dalam GJK (Mycek, et al., 2001; Chaidir dan Munaf, 2006).
B. Relaksan otot polos langsung
Dilatasi pembuluh vena menyebabkan penurunan preload jantung dengan meningkatan kapasitas vena; dilator arterial mengurangi retensi sistem arteriolar dan menurunkan afterload. Nitrat biasanya diberikan pada dilator vena untuk pasien GJK. Jika pasien intoleransi terhadap inhibitor ACE, biasanya digunakan kombinasi hidralzin dan isosorbit dinitrat. Amlodipin dan felodipin mempunyai efek inotropik negatif dibanding dengan penyekat kanal kalsium, dan tampaknya menurunkan aktivitas saraf simpatik (Mycek, et al., 2001; Chaidir dan Munaf, 2006).
2.6.2 Diuretik
Diuretik akan mengurangi kongesti pulmonal dan edema perifer. Obat-obat ini berguna mengurangi gejala volume berlebihan, termasuk ortopnea dan dispnea noktural paroksimal. Diuretik menurunkan volume plasma dan selanjutnya menurunkan venous return ke jantung (preload). Ini mengurangi beban kerja jantung dan kebutuhan oksigen. Diuretik juga menurunkan afterload dengan mengurangi volume plasma sehingga menurunkan tekanan darah (Mycek, et al., 2001; Chaidir dan Munaf, 2006).
makan buah-buahan (Chaidir dan Munaf, 2006).
2.6.3 Glikosida Jantung
Pada Tahun 1775 William Withering telah menangani dropsy dengan memberi infus dari berbagai tanaman. Di antara tanaman itu ialah Purple foxglove (Digitalis purpurea) yang termasuk familia Scropulariaceae. Beberapa tahun kemudian diisolasilah bahan kimia yang aktif dalam menangani GJK tersebut yang disebut glikosida jantung. Disebut demikian karena efeknya memperkuat otot jantung. Senyawa tersebut mampu mengubah ritme jantung sehingga memperpanjang kontraksi sistolik. Glikosida jantung juga dapat memperbaiki sirkulasi umum, mengurangi edema yang sering dihubungkan dengan GJK dan membantu sekresi renal (Harahap dan Hadisahputra, 1995).
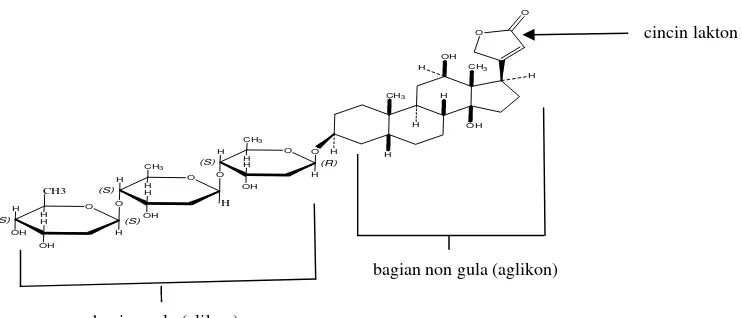
Struktur glikosida jantung terdiri dari dua bagian. Bagian gula (glikon) dan bagian non gula (aglikon) (Claus, et al., 1971; Mehana, 2008). Pada bagian aglikon terdapat inti steroid berupa siklopenantren dan cincin lakton. Sedangkan pada bagian glikon terdapat gugus gula seperti glucose, D-digitoxose, L-rhamnose, dan D-cymarose (Gambar 2.1) (Claus, et al., 1971; Melero, et al., 2000; Mehana, 2008; Weis, et al., 2005).
CH3
Gambar 2.2.Rumus struktur Glikosida jantung (Melero, et al., 2000)
Berbagai glikosida jantung telah digunakan sebagai obat selama berabad-abad. Dahulu, efek manfaatnya pada gagal jantung diyakini berasal dari efek inotropik positif untuk miokardium yang lemah dan khasiatnya dalam mengendalikan laju respons ventrikel terhadap fibrilasi atrium. Namun, sekarang disadari bahwa glikosida jantung juga memodulasi aktivasi sistem saraf simpatik, suatu mekanisme tambahan yang mungkin berperan penting terhadap khasiatnya untuk gagal jantung (Mehana, 2008).
2.6.3.1 Mekanisme Kerja Glikosida Jantung
Glikosida jantung mempunyai mekanisme kerja penghambatan Na+/K+ ATPase yang merupakan inhibitor transport aktif Na+ dan K+ yang kuat dan sangat selektif untuk melintasi membran sel, dengan cara berikatan pada suatu
tempat khusus pada sisi ekstrasitoplasma di sub unit α pada Na+/K+-ATPase,
sejenis enzim “pompa Na” dalam sel. Pengikatan glikosida jantung dengan
Na+/K+-ATPase dan penghambatan pompa ion dalam sel ini bersifat reversible dan dihantarkan secara entropik. Obat-obatan ini khususnya berikatan dengan
bagian gula (glikon)
bagian non gula (aglikon)
sub unit α dan menstabilkan konformasi ini. K+ eksternal menyebabkan defosforilasi enzim tersebut sebagai tahap awal translokasi aktif kation ini ke dalam sitosol, sehingga menurunkan afinitas enzim tersebut untuk mengikat glikosida jantung (Weis, et al., 2005; Melero, et al., 2000).
Inotropik positif (peningkatan daya kontraksi) yang diinduksikan oleh glikosida jantung adalah karena kemampuannya menghambat secara langsung ikatan antara membran dan Na+/K+-ATPase. Akibat hambatan tersebut terjadi peningkatan Ca2+ intrasel dan memperpanjang slow inward Ca2+ selama berlangsung potensial aksi. Digitalis pada konsentrasi terapeutik pengaruhnya tidak secara langsung terhadap protein kontraktil jantung. Begitu juga efek inotropik positif digitalis bukan disebabkan tindakannya terhadap mekanisme intraseluler yang menyediakan energi kimia untuk proses kontraksi tersebut. Hidrolisis ATP oleh enzim Na+/K+-ATPase adalah suatu pengaruh yang disebut Na+pump, yaitu sistem yang terdapat di dalam sarkolema serat jantung yang secara aktif mengekstrusi Na+ dan memindahkan K+ ke dalam serat jantung. Glikosida jantung secara spesifik berikatan dengan Na+/K+-ATPase untuk menghambat aktivitasnya. Dengan demikian tranpor aktif kedua kation monovalen tadi akan terganggu. Akibatnya secara perlahan-lahan terjadi peningkatan Na+intraseluler dan secara perlahan pula penurunan K+. Digitalis pada konsentrasi terapeutik, perubahan keluar masuk kedua kation tersebut sangat kecil. Peningkatan Na+ inilah yang secara krusial menghasilkan inotropik positif akibat pemberian digitalis. Hal ini adalah karena Ca2+ yang
terdapat di dalam intraseluler dipertukarkan dengan Na+ intraseluler oleh sistem transport yang dikendalikan oleh konsentrasi gradient dan potensial trans membran. Apabila Na+ meningkat akibat inhibisi pump oleh digitalis, maka pertukaran Na-ekstraseluler untuk Ca2+ intraseluler diperkecil, dan Ca2+ ditingkatkan (sebelum dan selama kontraksi). Akibat dari peristiwa itu terjadilah peningkatan simpanan Ca2+ di dalam retikulum sarkoplasma (RS), pada setiap potensial aksi pembebasan Ca2+ dalam jumlah besar akan terjadi untuk mengaktifkan alat-alat kontraktil yang terdapat di dalam serat otot jantung (Harahap dan Hadisahputra, 1995).
2.6.3.2 Agonisβ-adrenergik
Stimuli β-adrenergik memperbaiki kemampuan otot jantung dengan efek inotropik spesifik dalam fase dilatasi. Dobutamin adalah obat inotropik yang paling banyak digunakan selain digitalis. Dobutamin menyebabkan peningkatan siklik-AMP intrasel yang menyebabkan aktivasi protein kinase. Saluran kalsium lambat merupakan tempat penting fosforilasi protein kinase. Jika difosforilasi, masuknya ion kalsium ke dalam sel miokard meningkat, sehingga meningkatkan pula kontraksi (Mycek, et al., 2001).
-mempengaruhi reseptor dopamin (Chaidir dan Munaf, 2006).
2.6.3.3 Inhibitor fosfodiesterase
Obat yang termasuk dalam golongan ini adalah amiron dan miliron sebagai inhibitor fosfodiesterase yang memacu peningkatan konsentrasi siklik-AMP intrasel, dan meningkatkan kontraktilitas otot jantung atau bersifat inotropik positif. Akhir-akhir ini, hasil uji klinis menunjukkan bahwa obat-obat ini tidak dapat menurunkan angka kematian mendadak dan tidak dapat memperpanjang masa hidup penderita gagal jantung kongestif (Mycek, et al., 2001; Chaidir dan Munaf, 2006).
BAB I
PENDAHULUAN
1.1 Latar Belakang
Masyarakat Indonesia telah menggunakan tumbuhan obat atau bahan alam sejak dulu. Seiring dengan kemajuan ilmu pengetahuan dan teknologi, para ilmuwan terus melakukan penelitian tentang khasiat tumbuhan obat dan mengembangkan istilah kembali ke alam (back to nature) (Wijayakusuma, 2009).
Daun Afrika (Vernonia amygdalina Delile.) suku Asteraceae banyak tumbuh di benua Afrika bagian barat terutama di Nigeria (Ibrahim, et al., 2004). Di Cina daun Afrika telah dikenal sejak dahulu oleh masyarakat sebagai tanaman obat yang sangat mujarab. Mereka menyebutnya Nan Fei Shu, di sebagian daratan Cina ada yang menyebut Nan Hui Ye, tanaman ini dahulu digunakan oleh kalangan petinggi di lingkungan kekaisaran sebagai obat untuk berbagai penyakit (Anonim, 2010).
Pada tahun 2008 di Asia Tenggara, terutama di Malaysia dan Singapura daun Afrika sudah banyak digunakan. Sebagian masyarakat di Malaysia menyebutnya dengan daun kupu-kupu, kegunaan yang paling utama adalah untuk pengobatan diabetes, hipertensi, gout, dan kanker (Anonim, 2010).
yang mempunyai curah hujan cukup tinggi (Anonim, 2010).
Vernonia amygdalinaDelile, mengandung senyawa golongan saponin, flavonoid, sesquiterpen lakton dan glikosida steroid. Daun ini berguna sebagai bahan baku obat (Ijeh dan Ejike, 2010).
Penyakit kardiovaskular termasuk di dalamnya penyakit jantung adalah salah satu penyakit degeneratif yang paling berbahaya. Gagal Jantung Kongestif (GJK) (Congestive Heart Failure, CHF) adalah salah satu di antara penyakit jantung penyebab gagalnya sirkulasi darah sehingga menyebabkan retensi cairan tubuh dan edema (dropsy). GJK juga merupakan keadaan di mana jantung gagal memenuhi kebutuhan tubuh akan oksigen untuk melangsungkan metabolik tubuh karena jantung gagal memompa darah ke sistem sirkulasi sistemik secara adekuat (Harahap dan Hadisahputra, 1995).
Masih banyak masyarakat bahkan kalangan terdidik menafsirkan GJK sama dengan serangan jantung (heart attack) atau infarksi miokardium, meskipun kerusakan otot miokardium yang mendadak dan komplikasi infarksi miokardium bisa saja merupakan salah satu penyebab GJK. GJK lebih bersifat perlahan dan biasanya kambuhan (paroksismal), sangat tergantung pada kondisi fisik penderita. GJK mempengaruhi 1-2% populasi dan lebih umum terjadi pada orang lanjut usia dengan prevalensi yang lebih tinggi. Secara biokimia, keluaran jantung dapat ditingkatkan dengan memperkuat kontraksi otot jantung (tindakan inotropik positif). Strategi ini melibatkan obat-obatan yang mengontrol retensi garam dan air, mengurangi beban kerja jantung, dan
meningkatkan kekuatan daya kontraksi jantung (Harahap dan Hadisahputra, 1995).
Salah satu bahan alam yang kemungkinan memiliki efek inotropik dan kronotropik karena memiliki kandungan glikosida steroid adalah daun Afrika (Ijeh dan Ejike, 2010). Di Nigeria, Ijeh dan Ejike (2010) telah melakukan penelusuran pustaka dan memperoleh suatu senyawa vernonioside dari daun afrika yang memiliki kemiripan struktur dengan digoksin. Karena kemiripan struktur antara digoksin dan vernonioside, sehingga vernonioside diduga memiliki khasiat inotropik dan kronotropik. Pada vernonioside terdapat komponen gula dan steroid serta cincin lakton yang diduga berkhasiat inotropik dan kronotropik. Menurut Siswandono dan Bambang (2000), struktur glikosida jantung terdiri dari komponen karbohidrat (gula) yang mengandung tiga atau empat monosakarida dan steroid (genin atau aglikon) dengan cincin lakton yang terikat pada atom C-17. Berdasarkan hal tersebut, maka peneliti tertarik untuk menguji efek inotropik dan kronotropik ekstrak etanol daun Afrika.
1.2 Perumusan Masalah
Berdasarkan latar belakang yang dipaparkan di atas, maka rumusan masalah penelitian adalah sebagai berikut:
a. apakah karakteristik simplisia daun Afrika dapat diketahui dengan metode yang terdapat pada Materia Medika Indonesia?
simplisia dan ekstrak etanol daun Afrika (EEDA)?
d. apakah ekstrak etanol daun Afrika (EEDA) memiliki efek inotropik? e. apakah ekstrak etanol daun Afrika (EEDA) memiliki efek kronotropik?
1.3 Hipotesis
Berdasarkan rumusan masalah di atas, maka hipotesis penelitian ini adalah :
a. karakteristik simplisia daun Afrika dapat diketahui dengan metode yang terdapat pada Materia Medika Indonesia.
b. karakteristik ekstrak etanol daun Afrika (EEDA) dapat diketahui dengan metode yang terdapat pada Farmakope herbal.
c. golongan senyawa metabolit sekunder yang terdapat dalam simplisia dan ekstrak etanol daun Afrika (EEDA) adalah flavonoid, glikosida, glikosida jantung, saponin, steroid/triterpenoid, dan tanin.
d. ekstrak etanol daun Afrika (EEDA) memiliki efek inotropik. e. ekstrak etanol daun Afrika (EEDA) memiliki efek kronotropik.
1.4 Tujuan Penelitian
Penelitian ini bertujuan untuk :
a. mengetahui karakteristik simplisia daun Afrika.
b. mengetahui karakteristik ekstrak etanol daun Afrika (EEDA).
c. mengetahui golongan senyawa metabolit sekunder yang terkandung dalam simplisia dan ekstrak etanol daun Afrika (EEDA).