STUDI HISTOPATOLOGI RESPON ORGAN TESTIS
MENCIT (
Mus musculus
) TERHADAP POTENSI
RADIOPROTEKTIF TANAMAN ROSELA DALAM RADIASI
IONISASI RADIODIAGNOSTIK
WINDY DESTRI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi dengan judul Studi Histopatologi Respon Organ Testis Mencit (Mus Musculus) Terhadap Potensi Radioprotektif Tanaman Rosela dalam Radiasi Ionisasi Radiodiagnostik adalah karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Mei 2013 Windy Destri
ABSTRAK
WINDY DESTRI. Studi Histopatologi Respon Organ Testis Mencit (Mus musculus) Terhadap Potensi Radioprotektif Tanaman Rosela dalam Radiasi Ionisasi Radiodiagnostik. Dibimbing oleh SRI ESTUNINGSIH dan DENI NOVIANA.
Tujuan dari penelitian ini adalah untuk menentukan efek radioprotektif ekstrak rosela (Hibiscus sabdariffa L.) dalam radiasi ionisasi radiodiagnostik pada organ testis mencit (Mus musculus). Penelitian ini menggunakan 48 ekor mencit jantan dewasa dan dibagi menjadi 4 kelompok; kontrol (K), radiasi primer (P), rosela tanpa radiasi (R), dan rosela dengan radiasi (RP). Mencit diberi 50 mg/kg BB ekstrak rosela secara oral setiap 2 hari sekali sebelum diradiasi berulang selama 8 minggu. Mencit dinekropsi untuk pengambilan organ testis dari berbagai kelompok perlakuan pada berbagai titik waktu setelah radiasi. Hasil nekropsi diproses untuk pembuatan sediaan histopatologi dengan pewarnaan Haemotoxylin-Eosin. Perubahan pada testis dan kerusakan lainnya dilihat dengan menghitung jumlah sel-sel spermatogenesis, sel Sertoli, dan sel Leydig setelah radiasi pada seluruh tubuh menggunakan perangkat lunak image J. Data kuantitatif dianalisa menggunakan Uji Sidik Ragam (ANOVA) diikuti uji lanjut Duncan. Jumlah sel-sel yang diamati menunjukan respon baik terhadap pemberian radiasi maupun terhadap pemberian ekstrak rosela. Penurunan jumlah sel-sel yang diamati terlihat pada kelompok radiasi primer sedangkan pada kelompok rosela tidak terlihat adanya penurunan jumlah sel-sel yang diamati tersebut. Hasil ini menunjukan bahwa ekstrak rosela dapat melindungi dan mengurangi efek radiasi terhadap sel-sel yang diamati pada penelitian ini. Rosela dapat digunakan sebagai radioprotektor terhadap radiasi ionisasi pada organ testis mencit.
Kata kunci : radiasi ionisasi, radioprotektif, rosela, dan spermatogenesis testis mencit.
ABSTRACT
WINDY DESTRI. Histopathology Study on Mice (Mus musculus) Testicle with Radioprotective Potency of Hibiscus Sabdariffa in Radiodiagnostic Ionizing Radiation Supervised by SRI ESTUNINGSIH and DENI NOVIANA.
whole body irradiation counted using image J software. Quantitative data were analysed with ANOVA test and followed by Duncan post test. The number of cells observed showed a favorable response to the administration of radiation and the roselle extract. The number of cells were decreased in the primary radiation group while in the roselle were not seen. This result showed that Roselle extract was protect cells from radiation effect by recurrent radiodiagnostic ionizing radiation. Administration of roselle extract significantly reduced the bioeffects of radiation. The result suggested that roselle can be used as radioprotector to ionizing radiation on testicular organ.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
STUDI HISTOPATOLOGI RESPON ORGAN TESTIS
MENCIT (
Mus musculus
) TERHADAP POTENSI
RADIOPROTEKTIF TANAMAN ROSELA DALAM RADIASI
IONISASI RADIODIAGNOSTIK
WINDY DESTRI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
Judul Skripsi : Studi Histopatologi Respon Organ Testis Mencit (Mus musculus) Terhadap Potensi Radioprotektif Tanaman Rosela dalam Radiasi Ionisasi Radiodiagnostik.
Nama : Windy Destri
NIM : B04070192
Disetujui oleh
Dr drh Sri Estuningsih, M.Si APVet drh Deni Noviana, PhD Pembimbing I Pembimbing II
Diketahui oleh
drh Agus Setiyono, MS PhD APVet Wakil Dekan Fakultas Kedokteran Hewan
PRAKATA
Puji syukur kehadirat Allah SWT penulis panjatkan yang telah memberikan rahmat dan hidayah-Nya sehingga skripsi ini berhasil diselesaikan dengan baik. Shalawat serta salam penulis sampaikan kepada junjungan Nabi Muhammad SAW, keluarga, dan para sahabat.
Skripsi ini tidak dapat penulis selesaikan tanpa adanya dukungan beberapa pihak. Atas segala bantuan dari semua pihak, penulis menghaturkan terima kasih dan penghargaan setinggi-tingginya kepada:
1. Dr drh Sri Estuningsih, M.Si dan drh Deni Noviana, PhD selaku dosen pembimbing skripsi yang telah memberikan pengarahan, ilmu, bimbingan, dan motivasi kepada penulis.
2. drh Srihadi Agungpriyono, PhD selaku dosen pembimbing akademik atas ilmu, waktu, dukungan, motivasi, dan kesabaran yang diberikan selama ini. 3. Kedua orang tua Papa, Mama, dan Adik, beserta segenap keluarga penulis
atas doa, kasih sayang, perhatian, semangat, dan energi tidak henti-hentinya diberikan kepada penulis.
4. Seluruh staf dosen dan pegawai di Bagian Bedah dan Radiologi yang telah membantu kelancaran studi dan juga penyelesaian skripsi ini.
5. Seluruh staf dosen dan pegawai di Bagian Patologi yang telah membantu dan mendukung penulis dalam menyusun skripsi ini.
6. drh Sri Ardhiani yang senantiasa memberikan semangat, waktu, dan masukan yang sangat berguna dalam penyelesaian tulisan ini.
7. Teman-teman sepenelitian Abas, Bambang, Endah, Griv, dan drh Mohammad Fahrul Ulum, M.Si atas kebersamaan dan semangat yang diberikan kepada penulis.
8. Sahabat asrama Sri Junjungan Kabupaten Bengkalis atas dukungan dan semangat yang diberikan kepada penulis dalam menyelesaikan skripsi ini. 9. Seluruh keluarga besar Fakultas Kedokteran Hewan IPB dan berbagai pihak
yang tidak dapat disebutkan satu per satu yang telah membantu kelancaran studi penulis, baik selama kuliah maupun dalam penyelesaian skripsi ini. Semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan, saran dan kritik yang bersifat membangun sangat Penulis harapkan.
DAFTAR ISI
DAFTAR ISI
DAFTAR GAMBAR DAFTAR TABEL PENDAHULUAN
Latar Belakang 1
Tujuan 2
Manfaat 2
TINJAUAN PUSTAKA
Rosela 2
Hewan Percobaan 3
Sinar-X 4
Testis 4
Histologi Testis 5
Tubulus Seminiferus 5
Sel Sertoli 6
Jaringan Interstisial 6
METODE
Tempat dan Waktu Penelitian 7
Materi Penelitian 7
Prosedur Penelitian 8
HASIL DAN PEMBAHASAN
Uji Fitokimia Ekstrak Rosela 11
Total Dosis Radiasi Ionisasi dari Sinar-X 12 Gambaran Histopatologi organ Testis 12
Sel-sel Spermatogenik 13
Mekanisme Kerusakan Sel oleh Radikal Ionisasi 17
SIMPULAN DAN SARAN 19
DAFTAR PUSTAKA 19
DAFTAR TABEL
1 Kelompok perlakuan 9
2 Uji fitokimia Ekstrak rosela 11
3 Perbedaan jumlah sel yang mengalami degenerasi pada setiap kelompok perlakuan per satuan lapang pandang 20000 µm2 13 4 Rataan jumlah sel-sel spermatogenik, sel Sertoli, dan sel Leydig pada
setiap kelompok per satuan lapang pandang 20000 µm2 15
DAFTAR GAMBAR
1 Histopatologi sel-sel spermatogenik mencit pada organ testis
dengan pewarnaan HE 6
PENDAHULUAN
Latar Belakang
Radiasi merupakan proses dimana energi bergerak melalui media atau ruang. Berdasarkan kemampuan dalam ionisasi, radiasi terbagi dalam dua jenis, yaitu radiasi ionisasi dan radiasi non-ionisasi. Radiasi ionisasi didefinisikan sebagai suatu radiasi yang memiliki energi yang cukup untuk memindahkan elektron dari molekulnya serta mampu merusak ikatan kimia. Radiasi ionisasi merupakan radiasi elektromagnetik berupa sinar-X dan sinar-γ atau partikel sub-atom berupa, neutron, dan partikel-α (Thrall 2002).
Kerusakan yang disebabkan oleh radiasi ionisasi dapat terjadi secara langsung (direct effect) dan secara tidak langsung (indirect effect) pada sel terpapar. Kerusakan yang terjadi secara langsung disebabkan oleh radiasi ionisasi sendiri, sedangkan kerusakan secara tidak langsung disebabkan oleh radikal bebas yang terbentuk oleh ionisasi (Turner 2007).
Penyerapan radiasi dosis rendah dari sinar Roentgen oleh jaringan akan mengakibatkan perubahan dan kerusakan. Sinar-X membentuk radikal bebas yang berakibat kerusakan atau hilangnya elektron atom dari jaringan yang terpapar. Sebagian besar dari tubuh terdiri dari komponen air atau sekitar 70% sehingga radiasi ionisasi merubah susunan molekul air membentuk radikal bebas secara aktif. Jumlah radikal bebas yang terbentuk akan merusak jaringan. Daya sensitifitas dan regenerasi tiap jaringan berbeda-beda sehingga efek yang ditimbulkan akan berbeda sesuai dengan jenis jaringan dan dosis radiasi yang diterima. Efek yang ditimbulkan berupa abnormalitas jaringan hingga kematian. Jaringan yang sangat aktif membelah seperti usus dan sumsum tulang akan memperlihatkan efek yang sangat besar. Sebaliknya pada jaringan yang tidak aktif membelah seperti otot dan tulang akan menimbulkan sedikit efek (Thrall 2002).
Secara fisik perlindungan terhadap sumber radiasi eksternal dapat dilakukan dengan cara menggunakan perlengkapan proteksi radiasi berupa apron, pelindung tiroid, sarung tangan, dan kaca mata yang masing-masing telah dilapisi oleh pelapis Timbal (Pb) (Ulum dan Noviana 2008). Perlindungan biologis pada sumber radiasi internal dapat dilakukan dengan menggunakan sediaan herbal sebagai radioprotektor, untuk itu perlu dilakukan identifikasi terhadap sediaan herbal yang yang efektif dan dapat dijadikan radioprotektor bagi jaringan atau organ yang terkena efek radiasi ionisasi.
2
Tujuan
Penelitian ini bertujuan mengetahui efek radioprotektif tanaman Rosela (Hibiscus sabdariffa.L) pada gambaran histopatologi organ testis mencit (Mus Musculus) yang diradiasi sinar-X berulang.
Manfaat
Manfaat dari penelitian ini untuk referensi data mengenai kerusakan organ reproduksi mencit jantan yang diakibatkan oleh paparan radiasi ionisasi radiodiagnostik dosis rendah.
TINJAUAN PUSTAKA
Rosela (Hibiscus sabdariffa L)
Rosela merupakan tanaman asli Afrika dan mulai menyebar secara luas ke negara-negara tropik dan subtropik seperti Amerika Tengah dan India Barat (Morton 1987). Rosela mempunyai nama ilmiah Hibiscus sadbariffa Linn, merupakan anggota famili Malvaceae. Rosela dapat tumbuh baik di daerah beriklim tropis dan subtropis. (Widyanto dan Nelista 2009).
Klasifikasi rosela (Widyanto dan Nelista 2009) sebagai berikut: kelas : Dicotiedoniae
ordo : Malvales famili : Malvaceae genus : Hibiscus
spesies : H. Sabdariffa L.
Berbagai kandungan yang terdapat dalam tanaman rosela membuatnya populer sebagai tanaman obat tradisional. Kandungan vitamin dalam bunga rosela cukup lengkap, yaitu vitamin A,C,D,B1, dan B2. Kandungan vitamin C (asam askorbat) pada rosela diketahui 3 kali lebih banyak dari anggur hitam, 9 kali dari jeruk sitrus, 10 kali dari buah belimbing, dan 2,5 kali dari jambu biji. Hasil penelitian mengungkapkan bahwa kandungan antioksidan pada teh rosela sebanyak 1,7 mmol/prolox. Jumlah tersebut lebih tinggi daripada jumlah pada kumis kucing (Widyanto dan Nelista 2009).
3 oleh tubuh, contohnya glutationperoksidase, reduktase, katalase, dan superoksida dismutase (SOD). Antioksidan eksogen contohnya flavonoid, ascorbic acid (vitamin C), beta karoten, dan tocophenol (vitamin E) (Jacob 1995).
Bunga rosela mengandung alkaloid, citric acid, anthocyanin, i-ascorbic acid, dan flavonoid. (Hirunpanich et al. 2005). Kandungan vitamin C pada bunga rosela varietas merah sebesar 32,14 mg/100g sedangkan varietas hijau sebesar 27,5 mg/100g (Ogunlesi et al. 2010). Vitamin C memiliki aktifitas sebagai antioksidan dalam menetralkan kerusakan oleh radiasi (Noviana et al. 2010b). antioksidan yang dikandung bunga rosela dapat menetralkan radikal bebas dalam tubuh (Kijparkorn et al. 2009; Hirunpanich et al. 2005).
Tanaman Rosela (Hibiscus sabdariffa L.) banyak mengandung antosianin dan vitamin C. Pigmen antosianin ini membentuk warna ungu kemerahan yang menarik di kelopak bunga maupun teh hasil seduhan rosela. Antosianin berfungsi sebagai antioksidan yang diyakini dapat menyembuhkan penyakit degeneratif. Antosianin pada rosela berada dalam bentuk glukosida yang terdiri dari delfinidin-3-siloglukosida, delfinidin-3-glukosida, sianidin-delfinidin-3-siloglukosida, sedangkan flavonols terdiri dari gosipetin dan mucilago (Wang et al. 2000; BPOM RI 2010).
Sediaan kering dari ekstrak akar rosela mengandung flavonoid seperti gssypetin, hibiscetine, dan sabdaretine. Flavonoid diakui secara luas sebagai antioksidan yang memiliki beberapa khasiat kesehatan pada diet manusia (Pourcel et al. 2007). Sebagian besar pigmen dari bunga terdiri dari hibiscin yang telah diidentifikasi sebagai daphniphylline. Delphinidin monoglucoside, cyanidin 3-monoglucoside (chrysanthenin) dan delphnidin juga teridentifikasi dalam jumlah kecil (Chau JW. 2000; Pau et al. 2002).
Hewan Percobaan
Mencit (Mus musculus) adalah anggota Muridae yang berukuran kecil sering disebut dengan rodensia (latin = rodere, yang artinya mengerat). Hewan ini terdapat di seluruh penjuru dunia yang merupakan binatang asli Asia dan Eropa barat. Dalam hal genetika mencit merupakan kelompok mamalia yang dicirikan paling lengkap dan memiliki kemiripan secara homolog dengan manusia. Mencit juga mudah dipelihara dan memiliki siklus reproduksi yang cepat (Meredith dan Redrobe 2002).
Mencit memiliki tubuh yang kecil ditutupi rambut yang lembut dan sangat lebat, mencit memiliki kaki yang pendek dan ekor panjang ditutupi bulu tipis. Sama seperti rodensia lain pada umumnya. Mencit mempunyai rumus gigi 0 2 (1/1 incisors, 0/0 canines, 0/0 premolars, 3/3 molars) (Hrapkiewicz dan Medina 2007).
4
Sinar-X
Sejak pertama ditemukan sinar-X sudah berkembang sangat pesat sebagai sarana radiodiagnostik untuk menghasilkan gambaran medis. Dalam dunia kedokteran hewan sinar-X mulai dimanfaatkan pada tahun 1970. Ilmu yang mempelajari berbagai hal yang berkaitan dengan pemanfaatan energi radiasi disebut dengan radiologi. Pemanfaatan energi radiasi ini dapat sebagai radiodiagnostik sekaligus juga sebagai sarana radioterapi. Radiologi memanfaatkan sinar-X berupa gambaran diagnostik untuk mendeteksi berbagai kelainan baik pada jaringan lunak maupun jaringan keras seperti tulang (Thrall 2002; McCurnin dan Bassert 2006).
Röntgen atau Roentgen yang disimbolkan dengan R adalah sebuah satuan pengukuran radiasi ion di udara (berupa sinar-X atau sinar gamma), yang dinamai sesuai dengan nama fisikawan Jerman Wilhem Röntgen. Energi yang dihasilkan oleh sinar Rontgen merupakan energi radiasi ionisasi yang berbahaya bagi kesehatan. Sejak tahun 2005 pemerintah Amerika Serikat memasukan efek sinar-X dalam daftar penyebab terjadinya kanker. Di Indonesia penggunaan sarana radiodiagnostik sinar-X berada dalam pengawasan Badan Pengawas Tenaga Nuklir (BAPETEN) (Ulum dan Noviana 2008). Penggunaan sarana radiodiagnostik sebagai sarana penunjang diagnosa dalam dunia kedokteran sudah sangat berkembang dengan pesat. Energi radiasi ionisasi dari sarana ini dalam dosis besar sudah dilaporkan mampu menginisiasi terjadinya tumor dan kanker pada jaringan normal (Reynolds dan Schecker 1995).
Radiasi hamburan merupakan radiasi dengan energi yang sangat rendah jika dibandingkan dengan energi pada berkas sinar utama. Hamburan radiasi ini terbentuk pada saat berkas sinar utama berinteraksi dengan pasien radiografi. Paparan radiasi hambur diterima pekerja radiasi pada saat melakukan restrain pasien (hewan) yang akan menerima terapi. Besarnya tingkat radiasi tergantung pada 3 hal yaitu kilovoltase, ketebalan jaringan, serta luar daerah paparan (McCurnin dan Bassert 2006). Presentase besarnya dosis radiasi hambur terjadi sekitar 5% dari dosis berkas sinar utama yang diterima pasien (Thrall 2002).
Testis
Testis berada didalam scrotum yang berupa kantong terdiri atas kulit, tunica dartos dan sebagian funiculus spermaticus. Testis terletak menggantung di daerah prepubis dan digantung oleh funiculus spermaticus yang menggantung unsur-unsur yang terbawa oleh testis dalam perpindahannya dari cavum abdominalis melalui canalis inguinalis ke dalam scrotum (Toelihere 1985). Pada setiap hewan jantan terdapat sepasang testis yang berbentuk seperti telur atau peluru, testis terbungkus oleh tunica vaginalis propria yang akan membungkus ductus epidydimis dan ductus deferens. Pada bagian profundal tunica ini terdapat tunica albuginea yaitu suatu jaringan ikat padat berwarna putih yang terdiri atas serabut fibrosa dan serabut-serabut otot licin (Sukmaningsih 2009).
5 proliferasi, tahap meiosis dan spermiogenesis. Spermatogenesis dipengaruhi oleh faktor-faktor endogen dan eksogen. Faktor endogen meliputi hormonal, psikologis, dan genetik. Faktor eksogen dapat berupa bahan kimia dan obat-obatan, suhu, radiasi sinar-X, getaran ultrasonik, vitamin, gizi, trauma dan peradangan (Sukmaningsih 2009).
Histologi Testis
Testis terdiri dari kelenjar-kelenjar yang berbentuk tubulus, dibungkus oleh selaput tebal yang disebut tunika albugenia. Pada sudut posterior organ ini terbungkus oleh selaput atau kapsula yang disebut mediastinum testis. Septula testis merupakan selaput tipis yang meluas mengelilingi mediastinum sampai ke tunika albugenia dan membagi testis menjadi 250-270 bagian berbentuk piramid yang disebut lobuli testis. Isi dari lobulus adalah tubulus seminiferus, yang merupakan tabung kecil panjang dan berkelok-kelok memenuhi seluruh kerucut lobulus. Muara tubulus seminiferus terdapat pada ujung medial dari kerucut. Pada ujung apikal dari tiap-tiap lobulus akan terjadi penyempitan lumen dan akan membentuk segmen pendek pertama dari sistem saluran kelamin yang selanjutnya akan masuk ke rete testis (Partodiharjo 1980).
Dinding tubulus seminiferus terdiri dari tiga lapisan dari luar ke dalam yaitu tunika propria, lamina basalis dan lapisan epitelium. Tunika propria terdiri atas beberapa lapisan fibroblas, yang berfungsi sebagai alat transportasi sel spermatozoa dari tubulus seminiferus ke epididimis dengan jalan kontraksi. Lapisan epitel pada tubulus seminiferus terdiri dari dua jenis sel yaitu sel-sel penyokong yang disebut sebagai sel sertoli dan sel-sel spermatogonium. Sel-sel spermatogonium merupakan sel benih sejati, karena sel-sel inilah dihasilkan spermatozoa melalui pembelahan sel. Sel-sel spermatogonium tersusun dalam 4-8 lapisan yang menempati ruang antara membrana basalis dan lumen tubulus (Partodiharjo 1980).
Tubulus Seminiferus
Tubulus terdiri atas suatu lapisan jaringan ikat fibrosa, lamina basalis, dan suatu epitel germinal kompleks atau disebut seminiferus. Tubulus seminiferus dilapisi oleh tunika propria yang terdiri atas berbagai lapisan fibroblast. Tubulus seminiferus merupakan kelenjar tubulosa kompleks, bagian ini menghasilkan spermatozoa (Finn 1994). Epitel tubulus seminiferus terdiri atas dua jenis sel yaitu sel Sertoli atau sel penunjang dan sel-sel spermatogenik yang terdiri dari spermatogonia, spermatosit primer, spermatosit skunder, spermatid dan spermatozoa (Partodiharjo 1980). Tubulus rektus merupakan penghubung antara tubulus seminiferus dengan labirin saluran-saluran berlapis epitel berkesinambungan, yaitu rete testis. Rete testis ini kemudian akan dihubungkan dengan bagian kepala epididimis oleh duktus eferen (Guyton dan Hall 1997).
Sel Sertoli
6
Sel Sertoli memiliki empat fungsi utama, yaitu: (1) Menunjang, melindungi, dan mengatur nutrisi spermatozoa yang berkembang. Sel Sertoli mengatur pertukaran bahan makanan dan metabolit, serta sawar sel Sertoli melindungi sel sperma dari serangan imunologis. (2) Merombak dan memfagositosis keping sitoplasma yang berlebihan dan melepaskannya sebagai residu. (3) Sel Sertoli mensekresikan suatu cairan untuk transportasi sperma ke dalam tubulus seminiferus secara terus menerus. (4) Produksi hormon anti-Mullerian yang bekerja selama masa embrional untuk memudahkan regresi saluran Muller pada fetus jantan (Junqueira et al. 1997).
Sel Leydig
Jaringan interstisial merupakan jaringan yang terdapat diantara tubulus seminiferus. Sel-sel ini berbentuk poligonal teranyam bersama tenunan pengikat. Pada bagian ini terdapat sel Leydig yang berfungsi sebagai penghasil hormon jantan atau androgen terutama testosteron (Partodiharjo 1980). Sel Leydig memiliki inti sel dengan butir kromatin kasar dan anak inti yang jelas. Sel Leydig memiliki ciri sebagai sel pengekskresi steroid. Sel-sel ini menghasilkan hormon testosteron yang berfungsi dalam proses spermiogenesis dan perkembangan ciri kelamin jantan sekunder. Jumlah sel Leydig yang tinggi menyebabkan kenaikan hormon testosteron (Janqueira et al. 1997).
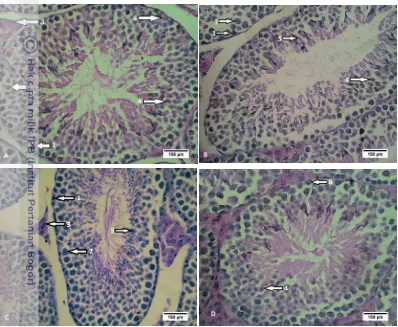
Gambar 1 Histologi sel-sel spermatogenik mencit pada organ testis dengan
7
METODE
Tempat dan waktu penelitian
Penelitian ini dilaksanakan di Bagian Bedah dan Radiologi, serta Bagian Patologi, Departemen Klinik Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor (IPB) pada bulan Maret sampai Juli 2011.
Materi Penelitian
Hewan coba
Penelitian ini bersifat eksperimental menggunakan hewan coba sebagai model. Penelitian ini menggunakan 48 ekor mencit jantan (Mus musculus) berumur 6 minggu dengan bobot awal 18-20 gram. Mencit jantan tersebut diperoleh dari pembiakan di Fakultas Kedokteran Hewan IPB.
Alat dan bahan
Bahan yang digunakan dalam penelitian ini, yaitu ekstrak rosela, hewan model mencit jantan (Mus musculus) sebanyak 48 ekor strain ddy yang memiliki kisaran umur 6 minggu dengan berat badan 18-20 gram sedangkan yang digunakan untuk histopatologi sebanyak 12 ekor. Bahan yang digunakan dalam pemeliharaan mencit pada penelitian ini adalah pakan berupa pelet pakan mencit komersial, air mineral isi ulang untuk minum mencit, obat-obatan pretreatment mencit (anticacing Prazyquantel® 10 mg/kg BB, antibiotik Clavamox® 250 mg/kg BB dan antifungal Metronidazole® 25 mg/kg BB), dan desinfektan. Bahan yang digunakan dalam pembuatan ekstrak rosela berupa simplisia kelopak bunga atau kaliks rosela kering lokal (Darmaga-Bogor), etanol 96%, dan akuades. Bahan yang digunakan dalam nekropsi adalah kapas, alkohol 70%, obat bius Ketamin HCl dan NaCl 0.9%, dan larutan Buffer Neutral Formalin (BNF) 10%. Bahan yang digunakan dalam pembuatan preparat histopatologi dan pewarnaan Hematoksilin Eosin (HE) adalah sampel organ testis, alkohol (70%, 80%, 90%, dan alkohol absolut), xylol, parafin, akuades, Mayer’s hematoksilin, eosin, lithium karbonat, perekat albumin, dan Mounting media.
8
mikrotom, pinset anatomis, gelas objek, gelas penutup, dan inkubator. Alat untuk pengamatan yaitu mikroskop cahaya (Olympus® CH-20), Digital Electronic Eyepiece Camera, satu set komputer, dan perangkat lunak Image J®.
Prosedur penelitian
Pre- treatment Mencit
Mencit jantan diberi pakan dan minum ad libitum. Pakan yang diberikan berbentuk pelet yang diperoleh secara komersial. Untuk menjaga kebersihan dan kesehatan mencit maka kandang dan alas sekam dibersihkan dan diganti setiap tiga hari sekali.
Mencit yang digunakan merupakan mencit strain ddy dan diberi pre-treatment sebelum penelitian dilaksanakan. Sebagai pre-treatment diberikan antihelmentik (Praziquantel®) dengan dosis tunggal 10 mg/Kg BB, antifungal (Metronidazol®) 50 mg/kg BB selama lima hari berturut-turut, antibiotik (Clavamox®) 250 mg/kg BB selama lima hari berturut-turut.
Ekstraksi Tanaman Rosela
Bunga dikeringkan di bawah sinar matahari dan dihaluskan. Tahapan selanjutnya, sebanyak 200 gram serbuk bunga diekstrak dengan 500 ml ethanol 96% pada suhu 40°C. Pembuatan ekstrak tanaman rosela meliputi proses maserasi dan evaporasi. Maserasi adalah proses perendaman simplisia menggunakan pelarut untuk memperoleh zat aktif dari simplisia tersebut dan untuk menghilangkan residu yang terjadi selama proses berlangsung (Daihiru et al. 2003; Olatunji et al. 2006; Fidan et al. 2008). Proses maserasi dilakukan menggunakan pelarut etanol. Maserat yang telah diperoleh dipisahkan kemudian di evaporasi. Evaporasi merupakan proses pemekatan dengan cara menguapkan pelarut tanpa menjadi kering. Maserasi dilakukan di Balitro (Balai Penelitian Tanaman Obat) Cimanggu Bogor, dan evaporasi dilakukan di Laboratorium Bioteknologi di Fakultas Perikanan IPB. Selanjutnya, dilakukan uji fitokimia yang dilakukan di Laboratorium Biofarmaka Bogor. Pemeriksaan fitokimia dilakukan pada kadar alkaloid, hidroquinon, tanin, flavonoid, saponin, saponin, steroid, dan triterpenoid. Sebelum digunakan, ekstrak rosela diencerkan dengan akuadest dengan perbandingan 1,5 gram ekstrak dalam 200 ml akuadest.
Perlakuan Radiasi
Penelitian ini bersifat eksperimental menggunakan 48 ekor mencit jantan yang berumur 6 minggu dengan bobot badan 18-20 gram kemudian mencit dibagi menjadi 4 kelompok.
9 Hewan coba akan dibagi dalam 4 kelompok perlakuan secara acak sebagai berikut:
1. Kelompok Kontrol (K): Mencit menerima perlakuan 0.2 ml NaCl
fisiologis peroral setiap 2 hari sekali tanpa radiasi.
2. Kelompok Primer (P): Mencit menerima perlakuan 0.2 ml NaCl
fisiologis peroral setiap 2 hari sekali dan paparan radiasi.
3. Kelompok Rosela (R): Mencit diberi ekstrak rosela dosis 50
mg/kg berat badan secara peroral setiap 2 hari sekali tanpa radiasi.
4. Kelompok Rosela Primer (RP): Mencit diberi Ekstrak rosela
dosis 50 mg/kg berat badan secara peroral setiap 2 hari sekali dan paparan radiasi.
Tabel 1 kelompok perlakuan
No Kelompok Perlakuan
Radiasi Ekstrak Rosela NaCl
1 Kontrol (K) - - +
2 Primer (P) + - +
3 Rosela (R) - + -
4 Rosela Primer (R) + + -
Keterangan : - (tanpa), + (dengan)
Radiasi ionisasi dosis rendah pada seluruh tubuh (Total Body Radiation/TBR) dilakukan dengan menggunakan mesin Diagnostic X-Ray (VR-1020, MA Medical Morp, Japan) dengan dosis 0.2 mili Sievert (mSv)/2 hari berselang. Monitoring dosis paparan dilakukan dengan menggunakan MYDOSE miniTM, ALOKA CO., Ltd Tokyo Japan. Faktor paparan mesin sinar-X menggunakan pengaturan kilo volt peak (kVp) 80 dan mili Ampere second (mAs) 12. Jarak sumber target (dasar kandang mencit) adalah 100 cm tegak lurus pada berkas sinar utama. Perlakuan radiasi dibagi menjadi 4 kelompok waktu yaitu radiasi selama 4 minggu, radiasi selama 8 minggu, masa pemulihan I atau Recovery I selama 4 minggu setelah menerima radiasi 4 minggu dan masa pemulihan II atau Recovery II selama 4 minggu setelah menerima radiasi 8 minggu.
Pemberian Ekstrak Rosela
Sebelum digunakan, ekstrak rosela dilarutkan dalam akuadest dengan komposisi 1.5 gram ekstrak dalam 200 ml akuadest, sehingga didapatkan konsentrasi 7.5 mg/ml. Dosis yang digunakan adalah 50 mg/kg berat badan dengan jumlah pemberian ekstrak kaliks rosela pada mencit adalah 0.2 ml (Akindahunsi dan Olelaye 2003; Ali et al. 2005)
10
Pembuatan Sediaan Histopatologi
Nekropsi dilakukan pada setiap kelompok secara acak pada minggu ke-4, 8 dan 12 untuk mengambil organ testis. Mencit sebelumnya di anasthesi dengan ketamin HCl (30 mg/kg BB) secara intra peritoneal untuk memudahkan euthanasi yang dilakukan dengan cara cervical dislocation (Hrapkiewicz dan Medina 2007). Tahap nekropsi dilakukan dengan menyayat bagian kulit abdomen dan fascia. Rongga abdomen dibuka sampai batas bawah diafragma. Organ yang diambil adalah organ testis kemudian difiksasi dalam larutan Buffered Neutral Formalin (BNF) 10% dan disimpan dalam pot plastik selama 2x24 jam. Organ testis yang sudah difiksasi dipotong dengan ukuran 0,5 x 1 cm dengan ketebalan 0.5 mm. Hasil trimming organ testis dimasukkan ke dalam tissue cassette serta diberi label dengan pensil. Selanjutnya, potongan organ testis didehidrasi dengan alkohol bertingkat (70 %, 80 %, 90 %, 95 %) masing-masing selama 2 jam dan alkohol absolut (I, II, dan III) masing-masing selama 2 jam. Selanjutnya dilakukan penjernihan (clearing) dalam larutan xylol I, II, III, masing-masing selama 1 jam. Tahap berikutnya adalah infiltrasi parafin, semua proses diatas secara otomatis menggunakan mesin Automatic Tissue Processor. Setelah itu dilakukan penanaman jaringan dalam blok parafin (embedding) dengan bantuan Tissue Embedding. Blok jaringan dipotong (sectioning) setebal 5 µm dengan mikrotom. Hasil potongan yang berbentuk pita (ribbon) diletakkan di atas permukaan air hangat (37oC) yang bertujuan untuk menghilangkan lipatan akibat pemotongan. Selanjutnya, potongan tipis jaringan diletakkan pada gelas objek yang telah dilapisi albumin, kemudian diberi label, dan dimasukkan ke dalam inkubator 60oC selama 24 jam.
Pewarnaan Hematoksilin-Eosin (HE)
Proses pewarnaan dilakukan melalui tahapan deparafinasi dan rehidrasi. Deparafinasi dilakukan dengan cara mencelupkan sediaan ke dalam xylol I dan II masing-masing selama 2 menit. Kemudian dilakukan rehidrasi dengan cara mencelupkan ke dalam alkohol absolut II, dan I, alkohol 95 %, 90 %, 80 %, dan 70 % masing-masing selama 2 menit. Selanjutnya sediaan dicuci dengan air kran mengalir dan dikeringkan. Sediaan yang sudah kering ditetesi Mayer’s hematoksilin dan di diamkan selama 8 menit kemudian dibilas dengan air mengalir dan dicuci dengan litium karbonat selama 15-30 detik, dibilas kembali dengan air mengalir dan dilanjutkan dengan pemberian eosin selama 2 menit. Sediaan yang telah terwarnai dimasukan ke dalam alkohol 90 % dan alkohol absolut I masing-masing sebanyak 10 kali celupan, alkohol absolut II selama 2 menit, xylol I selama 1 menit dan xylol II selama 2 menit dan dikeringkan. Sediaan yang telah kering ditetesi dengan perekat entellan secukupnya kemudian ditutup dengan gelas penutup (cover glass).
Pengamatan Preparat Histopatologi
11 terhadap jumlah sel-sel pada setiap tahapan spermatogenesis (spermatogenia, spermatosit primer, spermatosit sekunder dan spermatid). Penghitungan sel-sel spermatogenik dilakukan dengan cara pengambilan foto 10 buah lapang pandang dari tubulus seminiferus dengan menggunakan digital electronic eyepiece® camera pada perbesaran 40× lensa objektif. Jumlah diferensiasi sel spermatogenik, sel Sertoli, sel Leydig, dan luas lapang pandang dihitung dengan menggunakan perangkat lunak Image J. Hasil penghitungan jumlah sel-sel spermatogenik dikonversikan ke dalam luas daerah 20000 μm². Pengamatan ketiga dilakukan penghitungan terhadap jumlah sel Sertoli dengan cara yang sama seperti pada penghitungan jumlah sel-sel spermatogenik. Terakhir, dilakukan penghitungan jumlah sel Leydig dengan cara yang sama seperti pada penghitungan jumlah sel-sel spermatogenik. Hasil penghitungan jumlah sel-sel Leydig dikonversikan ke dalam luas daerah 20000 μm².
Analisis Data
Data pengamatan histopatologi terhadap seluruh parameter penelitian dicari rataan serta simpangan bakunya secara statistik dengan menggunakan Uji Sidik Ragam (ANOVA) dalam perangkat lunak SAS (Statistical Analysis System) produksi SAS Institute Inc. yang dilanjutkan dengan Uji Duncan untuk melihat ada tidaknya perbedaan yang nyata antara kelompok perlakuan dengan kelompok kontrol.
HASIL DAN PEMBAHASAN
Uji Fitokimia Ekstrak Rosela (Hibiscus sabdariffa L.)
Analisis fitokimia sudah digunakan oleh sejumlah ahli dalam pemeriksaan tanaman berkhasiat untuk pengobatan. Analisis ini dapat mengetahui beberapa senyawa yang terkandung pada tanaman seperti alkaloid, flavonoid, tannin, saponin, steroid, terpenoid, phenol, dan glikosida. Uji fitokimia ekstrak rosela dilakukan di Laboratorium Uji Biofarmaka LPPM-IPB sesuai dengan prosedur standar di Laboratorium tersebut.
Tabel 2 Uji fitokimia ekstrak Rosela (Hibiscus sabdariffa L.)
No Parameter Uji Hasil Teknik Analisis
1 Alkaloid Uji Wagner + Kualitatif
Alkaloid Uji Meyer + Kualitatif
Alkaloid Uji Dragendorf + Kualitatif
2 Hidroquinon - Kualitatif
3 Tanin + Kualitatif
4 Flavonoid + Kualitatif
5 Saponin + Kualitatif
6 Steroid - Kualitatif
7 Triterpenoid - Kualitatif
12
flavonoid juga memiliki khasiat anti-viral, anti peradangan, penanganan hipertensi, diabetes, reumatik, dan demam. Alkaloid dilaporkan memiliki manfaat sebagai antimalaria, antimikroba, dan memiliki aktivitas sitotoksik (Olayede et al. 2010). Saponin dan tanin memiliki sifat analgetik, anti radang dan memiliki kemampuan untuk mencegah kanker (Lai et al. 2010; Sur et al. 2001).
Flavonoid merupakan komponen utama yang terkandung dan terdistribusi secara menyeluruh pada senyawa fenol tanaman. Flavonoid dan komponen fenol lainnya dari tanaman secara khusus diperoleh dari daun, bunga, dan batang seperti akar dan kulit kayu. Flavonoid memiliki aktifitas antioksidan dan penetralisir radikal bebas, anti mutagenik dan anti karsinogenik (Meltzer dan Malterud 1997). Suplementasi antioksidan berlebih akan mengakibatkan terjadinya mutagenik atau aktifitas pro-oksidasi yang akan menghambat fungsi enzim-enzim penting pada proses metabolisme hormon (Skibola dan Smith 2000).
Total Dosis Radiasi Ionisasi dari Sinar-X
Total dosis radiasi didapatkan dengan cara menghitung jumlah akumulasi dosis radiasi dari mesin Sinar-X yang di ukur menggunakan dosimeter selama perlakuan radiasi. Perlakuan selama 4 minggu menghasilkan total dosis radiasi 2.9 mSv, sedangkan perlakuan selama 8 minggu menghasilkan total dosis radiasi 5.3 mSv. Masa pemulihan (recovery) merupakan waktu dimana mencit tidak mendapatkan perlakuan apapun, baik pencekokan maupun paparan radiasi. Masa pemulihan dilakukan 4 minggu setelah waktu perlakuan radiasi 4 dan 8 minggu.
Gambaran Histopatologi Organ Testis
13 Tabel 3 Perbedaan respon jumlah sel yang mengalami degenerasi pada setiap
kelompok perlakuan per satuan lapang pandang 20000 µm2
Lama perlakuan Kelompok
Kontrol Primer Rosela Rosela primer
4 minggu 1. – Keterangan : (-) tidak mengalami degenerasi sel; (+) mengalami sedikit degenerasi sel; (++)
mengalami banyak degenerasi sel; (+++) paling banyak mengalami degenerasi sel.
Berdasarkan tabel 3 terlihat degenerasi sel terjadi pada seluruh mencit kelompok primer hal ini disebabkan paparan radiasi langsung yang diterima oleh kelompok tersebut, penurunan jumlah sel yang mengalami degenerasi terjadi pada kelompok rosela primer hal ini membuktikan suplementasi rosela yang bisa mengurangi efek dari radiasi langsung yang diterima oleh kelompok tersebut.
Nekrosis merupakan kondisi dimana sel mengalami kematian dan bersifat irreversible atau tidak dapat kembali menjadi sel normal. Umumnya sel mengalami beberapa perubahan sebelum terjadi nekrosis. Tahapan awal nekrosis yaitu terjadi pembengkakan pada sel tersebut dimana sitoplasma menjadi lebih eosinofilik akibat pengikatan eosin yang berkaitan dengan denaturasi protein. Tahap selanjutnya yaitu kemunculan vakuola atau lubang pada sitoplasma. Ukuran vakuola bervariasi mulai dari yang kecil sampai besar dan begitu juga dengan jumlahnya. Tahapan tersebut merupakan tahapan awal sebelum sel mengalami kematian atau disebut juga dengan istilah onkosis. Berbeda dengan apoptosis, kejadian nekrosis umumnya disertai dengan infiltrasi sel-sel radang. (Haschek dan Rousseaux 1998).
Degenerasi hidropis merupakan respon sel terhadap gangguan endogen salah satunya akibat radikal bebas dan gangguan eksogen yang dalam hal ini adalah akibat radiasi ionisasi sinar-X. Menurut Haschek dan Rousseaux (1998), degenerasi hidropis ditandai dengan perubahan pada sel berupa pembengkakan dan perubahan warna sitoplasma menjadi lebih pucat, serta sitoplasma yang bervakuola mulai dari ukuran kecil hingga besar. Perubahan tersebut merupakan tahapan awal dari proses nekrosis yang disebut onkosis. Faktor lain terjadinya onkosis dapat disebabkan oleh menurunnya jumlah darah merah dalam tubuh yang menyebabkan penurunan asupan oksigen kemudian penurunan oxidative phosphorylation dan penurunan jumlah ATP (Haschek dan Rousseaux 1998).
Sel-sel spermatogenik
14
(recovery1) setelah dosis 2.9 mSv dan pada masa pemulihan (recovery 2) setelah pemberian dosis radiasi 5.3 mSv. Masa pemulihan masing-masing selama 4 minggu setelah perlakuan 4 mingggu dan 8 minggu. Perbedaan gambaran jumlah sel-sel spermatogenik pada tiap kelompok perlakuan dapat dilihat pada Gambar 2. Hasil pengamatan dan analisis statistik disajikan pada Tabel 4.
15 Tabel 4 Rataan jumlah sel-sel spermatogenik, sel Sertoli, dan sel Leydig pada
setiap kelompok perlakuan per satuan lapang pandang 20000 µm2
Sel yang diamati Kelompok
Kontrol Primer Rosela primer Rosela
4 minggu
Spermatogenia 49.867±16.665a 39.625±0.176a 36.667±10.119a 31.767±4.858a Spermatosit primer 47.067±1.474a 35.800±9.192a 47.200±0.208a 37.633±10.223a Spermatosit
sekunder
51.133±10.511a 49.400±5.091a 50.700±12.204a 45.967±5.750a
Spermatid 88.430±11.528a 60.700±25.031a 75.900±4.821a 69.370±15.215a
Spermatozoa 72.430±25.472a 52.150±23.970a 66.130±3.731a 48.570±6.357a
Sel Sertoli 10.530 ±2.608a 9.900±2.687a 10.167±1.285a 7.233±0.251a
Sel Leydig 14.067±1.415a 9.100±1.414a 15.633±5.404a 14.567±4.113a
8 minggu
Spermatogenia 39.500±6.221a 34.633±12.915a 48.600±10.153a 40.333± 9.154a Spermatosit primer 49.400±8.591ab 45.300 ±5.109b 64.467±13.261a 40.367 ±3.516b Spermatosit
sekunder
59.333±15.786a 34.400 ±6.085b 60.200±12.664a 41.867±5.472ab
Spermatid 96.97 ±23.450a 65.670 ±10.471b 85.630 ±8.168ba 73.130 ±9.375ab Spermatozoa 71.733±15.955a 42.600±11.518b 74.800 ±2.884a 57.667±7.276ab Sel sertoli 10.700±1.907ba 9.033 ±0.945b 12.833± 1.331a 9.700± 1.907b Sel Leydig 14.833±4.652ba 10.567± 2.400b 21.033± 6.971a 14.967±2.898ab
Rec 4 minggu
Spermatogenia 37.967±8.069a 35.333±8.977a 38.833±8.638a 33.433±2.402a Spermatosit primer 60.467±11.282a 40.367±7.356b 51.767±3.917ab 41.367±3.883b Spermatosit
skunder
59.067±3.842a 37.000±8.260c 55.967±8.792ab 43.800±3.160ab
Spermatid 89.533±8.113a 57.833±5.173c 73.300±7.696b 82.533±6.525ab
Spermatozoa 59.200±4.371a 38.667±9.505b 72.500±9.865a 71.500±6.750a
Sel Sertoli 7.867±1.950a 7.700±1.389a 10.367±2.250a 8.233±0.945a
Sel Leydig 17.033±6.451a 18.933±13.940a 15.200±0.200a 15.667±5.372a
Rec 8 minggu
Spermatogenia 40.733±13.851a 33.800±8.328a 38.567±10.131a 38.833±6.030a Spermatosit primer 54.533±4.392a 44.000±2.121a 47.533±9.450a 43.967±8.334a Spermatosit
skunder
63.367±3.200a 39.667±1.823b 41.633±16.839b 47.233±2.702ab
Spermatid 103.833±5.493a 49.467±8.158c 62.367±15.959bc 76.000± 6.700b Spermatozoa 54.530±0.602ba 37.830±3.356b 68.800±26.038a 68.030±4.221a Sel Sertoli 9.1667±1.550ba 6.9333±0.208b 10.000±1.473a 9.1667±0.873ab
Sel Leydig 10.367±1.184a 11.333±2.466a 19.133±10.830a 15.033±0.907a
Keterangan : Huruf superscript yang berbeda pada baris yang berbeda menyatakan adanya perbedaan yang nyata (p<0.05) antar kelompok
16
namun terjadi penurunan pada sel spermatosit primer dan sel sertoli hal ini disebabkan oleh fisiologis tubuh mencit yang menurun.
Jumlah sel-sel spermatogenik terlihat menunjukan respon baik terhadap pemberian radiasi maupun terhadap pemberian ekstrak rosela. Sel spermatogenik yaitu sel spermatogenia, spermatosit primer, spermatosit sekuder, spermatid dan spermatozoa terlihat sangat menurun pada kelompok perlakuan primer dimana mencit mendapatkan radiasi ionisasi. Sel-sel spermatogenik menunjukan peningkatan pada kelompok perlakuan rosela dan rosela primer. Respon ini membuktikan bahwa ekstrak rosela berkhasiat meningkatkan jumlah sel spermatogenik yang sudah terkena paparan radiasi ionisasi.
Jumlah sel-sel spermatogenik yang dapat dihasilkan oleh testis dipengaruhi oleh spermatogenesis. Gangguan pada spermatogenesis dapat menyebabkan terjadinya penurunan jumlah spermatozoa yang dapat dihasilkan. Gangguan spermatogenesis dapat terjadi pada individu yang mengalami hiperlipidemia, diabetes mellitus, dan gangguan pada hipofise anterior untuk menghasilkan LH dan FSH (Hafiz 2008; Sopia 2009).
Respon yang sama juga ditunjukan oleh sel Sertoli dan sel Leydig dimana sel tersebut mengalami penurunan pada kelompok perlakuan primer dan mengalami peningkatan pada kelompok rosela dan rosela primer. Perbedaan jumlah sel spermatogenik, sel Sertoli dan sel Leydig dapat dilihat pada Tabel 3.
Penurunan jumlah sel-sel yang diamati pada kelompok perlakuan primer dipicu oleh kerusakan sel karena adanya radikal bebas dari paparan radiasi ionisasi. Paparan radiasi menyebabkan kerusakan pada struktur seluler organ. Suplementasi ekstrak rosela dapat memperkecil kerusakan seluler pada organ yang disebabkan oleh radiasi ionisasi. Aktifitas antioksidan yang terkandung pada ekstrak rosela memperkecil kerusakan seluler pada organ testis. (Tsai et al. 2002; Essa et al. 2006).
Radikal bebas adalah sekelompok bahan kimia baik berupa atom maupun molekul yang memiliki elektron tidak berpasangan pada lapisan luarnya. Radikal bebas merupakan suatu kelompok bahan kimia dengan reaksi jangka pendek yang memiliki satu atau lebih elektron bebas (Droge 2002). Kerusakan sel yang diamati oleh faktor radikal bebas dapat diatasi dengan mengkonsumsi makanan yang mengandung antioksidan, kandungan antioksidan dalam ekstrak rosela juga berperan penting dalam melindungi organ-organ sistem reproduksi akibat efek radiasi ionisasi (Tsai et al. 2002; Essa et al. 2006)
Antioksidan yang terkandung dalam ekstrak rosela yaitu flavonoid yang mampu mencegah kerusakan yang diakibatkan oleh radikal bebas melalui berbagai cara dan salah satunya dengan direct scavenging. Flavonoid bekerja dengan cara teroksidasi oleh radikal sehingga menghasilkan senyawa radikal yang lebih stabil dan menjadi kurang reaktif. Akibat reaktivitas yang tinggi kelompok hidroksil dari flavonoid menyebabkan senyawa radikal bebas dirubah menjadi tidak aktif (Korkina dan Afanas’ev 1997).
17 kontrol. Hasil yang sama juga terlihat baik pada masa pemulihan 4 minggu maupun masa pemulihan 8 minggu. Efek proteksi ekstrak rosela terhadap radiasi ionisasi terlihat dengan tidak adanya perbedaan yang nyata pada kelompok perlakuan dan pemulihan rosela dan rosela primer.
Radiasi ionisasi menyebabkan efek yang merusak pada jaringan dan dapat berakhir dengan terbentuknya kanker. Paparan jangka panjang (kronis) radiasi ionisasi dapat menyebabkan kondisi negatif pada kesehatan (Gridley dan Pecaut 2006). Efek merusak akan menyebabkan peradangan pada jaringan terbentuknya radikal bebas dengan konsekuensi terjadinya oksidasi pada lemak dan protein, kerusakan DNA dan penekanan fungsi imunitas (Weill et al. 2011). paparan radiasi seluruh tubuh atau total-body exposure to ionizing radiation (TBI) pada tubuh dapat menyebabkan terjadinya kegagalan fungsi banyak organ. Paparan radiasi ionisasi menghasilkan radikal bebas yang dapat menyebabkan kerusakan biologis. Asam askorbat (vitamin C) dan antosianin yang terkandung dalam ekstrak rosela kemungkinan memiliki kemampuan dalam menetralkan radikal bebas yang terbentuk selama paparan radiasi ionisasi. Pemberian vitamin C sebagai bahan anti apoptosis mampu mengurangi berlangsungnya proses apoptosis (Tsai et al. 2002; Essa et al. 2006).
Sensitifitas organ berbeda-beda terhadap paparan radiasi. Radiosensitivity merupakan kondisi tingkat sensitifitas organ terhadap kerusakan yang disebabkan oleh adanya radiasi. Organ-organ pembentuk darah memiliki tingkat sensitifitas yang paling tinggi, disusul organ pencernaan dan organ reproduksi, kulit serta yang tidak sensitif yaitu otak dan otot. Istilah lain yang digunakan adalah Radioresistant yaitu kondisi daya tahan jaringan atau organ terhadap kerusakan yang disebabkan oleh radiasi. Radioresistant merupakan kebalikan dari Radiosensitivity (NRC 2006). Daya hidup setelah paparan radiasi merupakan hasil dari proses pemulihan organ terhadap paparan radiasi sedangkan kematian yang terjadi setelah paparan radiasi disebabkan adanya kerusakan pada organ tersebut akibat efek dari paparan radiasi (Widel et al. 2003; Chen et al. 2006).
Tingkat pembelahan atau proliferasi sel penyusun jaringan menentukan tingkat sensitifitas atau daya tahan organ. Jaringan yang aktif membelah memiliki sensitifitas yang sangat tinggi dibandingkan dengan jaringan yang tidak aktif membelah (Thrall 2002).
18
Mekanisme Kerusakan Sel oleh Radikal Ionisasi
Hasil penelitian ini menunjukkan bahwa sel-sel testis yang diamati mengalami degenerasi akibat radiasi ionisasi dan menjelaskan bahwa radikal bebas yang terbetuk mengakibatkan terjadinya proses degenerasi sel. Radikal bebas dalam level yang tinggi pada sel atau akibat stres oksidatif yang terjadi menyebabkan degenerasi sel dan tidak menimbulkan proses aktivasi caspase sehingga tidak terjadi apoptosis (Kass et al. 2000). Hasil penelitian ini juga memperkuat hasil tersebut dimana tidak ditemukan sel-sel testis yang diamati yang mengalami apoptosis.
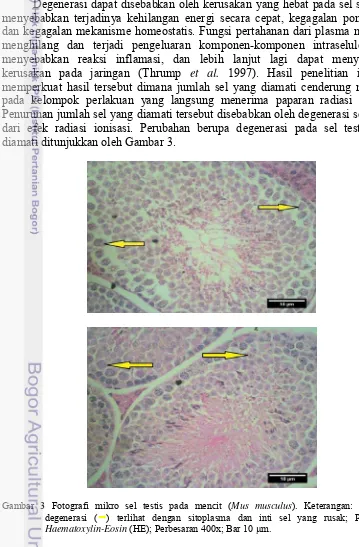
Degenerasi dapat disebabkan oleh kerusakan yang hebat pada sel sehingga menyebabkan terjadinya kehilangan energi secara cepat, kegagalan pompa ion, dan kegagalan mekanisme homeostatis. Fungsi pertahanan dari plasma membran menghilang dan terjadi pengeluaran komponen-komponen intraseluler yang menyebabkan reaksi inflamasi, dan lebih lanjut lagi dapat menyebabkan kerusakan pada jaringan (Thrump et al. 1997). Hasil penelitian ini juga memperkuat hasil tersebut dimana jumlah sel yang diamati cenderung menurun pada kelompok perlakuan yang langsung menerima paparan radiasi ionisasi. Penurunan jumlah sel yang diamati tersebut disebabkan oleh degenerasi sel akibat dari efek radiasi ionisasi. Perubahan berupa degenerasi pada sel testis yang diamati ditunjukkan oleh Gambar 3.
Gambar 3 Fotografi mikro sel testis pada mencit (Mus musculus). Keterangan: Sel testis degenerasi () terlihat dengan sitoplasma dan inti sel yang rusak; Pewarnaan
19 Rosela memiliki aktifitas antioksidan yang kuat (Essa et al. 2006) karena mengandung anthocyanin atau biasa disebut dengan zat warna merah (Tee et al. 2002). Anthocyanin memiliki aktifitas antioksidan yang lebih tinggi dari pada butylated hydroxyanisole (BHA) dan beta-karoten (Tee et al. 2002). Rosela mengandung berbagai macam bioflavonoid sehingga mampu untuk menangkal radikal bebas, menurunkan peroksidasi lemak dan kerusakan pada sel (Essa et al. 2006). Antioksidan yang berasal dari tanaman terbukti efektif dalam mengatasi perubahan terhadap jumlah sel spermatogetik. Hasil keseluruhan penelitian ini menunjukan rosela merupakan aktioksidan yang baik sebagai bahan anti radiasi (radioprotektor) berbahan herbal tanaman alam.
SIMPULAN DAN SARAN
Simpulan
Ekstrak rosela mengandung bahan antioksidan yang berpotensi sebagai bahan radioprotektif terhadap radiasi ionisasi. Pada organ testis pemberian ekstrak rosela dan masa recovery yang cukup terbukti dapat memberikan efek positif terhadap jumlah sel spermatogenetik setelah mendapatkan paparan radiasi ionisasi untuk meningkatkan proses spermatogenesis.
Saran
1. Diperlukan penelitian lebih lanjut untuk mengetahui besaran dosis pemberian rosela yang paling efektif sebagai radioprotektor biologis.
2. Dilakukan uji kuantitatif terhadap ekstrak yang akan digunakan agar dapat diketahui jumlah kandungan senyawa fitokimia.
3. Diperlukan penelitian lebih lanjut terhadap zat aktif yang terkandung pada ekstrak rosela agar diketahui zat aktif yang paling efektif untuk mengurangi efek dari radiasi ionisasi.
DAFTAR PUSTAKA
[BPOM RI] Badan Pengawas Obat dan Makanan Republik Indonesia, Direktorat Obat Asli Indonesia. 2010. Seri Data Ilmiah Terkini Tumbuhan Obat, Rosela (Hibiscus sabdariffa L.). Jakarta: BPOM RI.
[NRC] National Research Council. 2006. Health Risk from exposure to low levels of ionizing radiation: BEIR-VII phase 2. Washington, DC: National Academy Press.
20
Ali BH, Al Wabel N, Blunden G. 2005. Phytochemical, pharmacological and toxicological aspect of Hibiscus sabdariffa L. Phytother Res 19(5):369-75. Amin A, Hamza AA. 2005. Hepatoprotective effect of Hibiscus, Rosmarinus and
Salvia on azathioprine-induced toxicity in rats. Life Sc., 77 (3): 266-78.
Chau JW. 2000. Protective affect of Hibiscus anthocyanins agaisnt tert-butyl hydroperoxide-induced hepatic toxicity in rats. Food and Chemical Toxicology. 38(5): 411-416.
Chen YM, Lin SL, Chiang WC, Wu KD, Tsai TJ. 2006. Pentoxifylline ameliorates proteinuria through suppression of renal monocyte chemoattractant protein 1 in pattiens with proteinuric primary glomerular diseases. Kidney int. 69, 1410-1515.
Dahiru D, Obi OJ, Umaru H. 2003. Effect of Hibiscus sabdafiffa Calyx extract on carbon tetrachloride induced liver demage. BIOKEMISTRI 15(1): 27-33
Droge W. 2002. Free radicals in the physiological control of cell function. Physiol Rev 82:47-95.
Du CT, Francis FJ. 1973. Antochyanin of roselle (Hibiscus sabdariffa Linn). J Food Sci 38:818.
Essa MM, Subramanian P, Suthakar G, Manivasagam T, Dakshayani KB, Sivaperumal R, Subash S, Vinithini G. 2006. Influence of Hibiscus sabdariffa on the levels of circulatory lipid peroxidation products and liver marker ezymes in experimental hyperammonemia. J Appl Biomed, 4:53-58.
Fidan AF, Enginar H, Cigerci IH, Korcan SE, Ozdemir A. 2008. The radioprotective potential of Spinacia oleracia and Aesculuc hippocastanum against ionizing radiation with their antioxidant and antiomicrobial properties. J of animal and Veterinary Advances 7(12):1528-1536.
Finn G. 1994. Buku Teks Histologi. Ed ke-2. Gunawijaya A, penerjemah. Jakarta: Binapura Aksara. Terjemahan dari: Textbook Histology.
Gerber PA, Enderlain E, Homey B, Boelke E, Budach W. 2007. Radiation-Induced Prevention of Erlotinib-Radiation-Induced Skin Rash Is Transient: A New Aspect Toward the Understanding of Epidermal Growth Factor Reseptor Inhibitor-Associated Cutaneous Adverse Effects. J Clin Oncol, 25(29):4697-8 Gridley DS, Pecaut MJ. 2006. Whole–Body irradiation and long-term
21 Guyton AC, Hall EJ. 1997. Buku Ajar Fisiologi Kedokteran. Ed ke-9. Setiawan I,
Tengadi KA, Santoso A, penerjemah; Setiawan I, editor. Jakarta: EGC. Terjemahan dari: Textbook of Medical Physiology.
Hafez ESE. 1970. Reproduction and Breeding Techniques for Laboratory Animal. Philadelphia: Lea and Febiger.
Hafiz R. 2008. Pengaruh pemberian minyak jintan hitam (Nigella sativa) terhadap morfologi spermatozoa mencit diabetes mellitus yang diinduksi aloksan [skripsi]. Semarang: Fakultas Kedokteran, Universitas Diponegoro.
Haschek WM, Rousseaux CG. 1998. Fundamental of Toxicologic Pathology. USA: Academic Press. hlm 1-14.
Hill M. 2010. Spermatogenesis. Acknowledgements. [terhubung berkala]. http://embryology.med.unsw.edu.au/Notes/week1_3b.htm [1 Jan 2013].
Hirunpanich V, Utaipat A, Morales NP, Bunyapraphatsara N, Sato H, Herunsale A, Suthisisang C.. 2005. Hypocholesterolemic and antioxidant effects of aqueous extracts form the dried calyx of Hibiscus sabdariffa L. in hypercholesterolemic rats. J Ethno Pharmacology 103:252-260.
Hrapkiewicz K, Medina L. 2007.Clinical Laboratory Animal Medicine. United States of America. 3rd: Blackwell Publishing.
Jacob RA. 1995. The integrated antioxidant system. Nutrition Res 15:755-766. Jagetia CG. 2007. Radioprotective potential of plants and herbs against the effect
of ionizing radiation. recent advance in indian herbal drug research. J Clin Biochem Nutr 40:74-81.
Junqueira LC, Carneiro J, Kelley RO. 1997. Histologi Dasar. Ed ke-8. Tambayang J, penerjemah. Jakarta: EGC. Terjemahan dari: Basic Histology. Kass GEN, Juedes MJ, Orrenius S. 2000. Cyclosprorin A protects hepatocytes
against prooxidant-induceed cell killing. A study on the role of mitochondrial Ca2+ cycling in cytotoxicity. Biochem pharmacol 44:1995-2003.
Khosravi HM et al. 2009. The effects of sour tea (Hibiscus sabdariffa) on hypertension in patients with type II diabetes. Journal of Human Hypertensionin. 23, p48-54 www.nature.com/jhh.[22 desember 2010]
22
Korkina LG, Afanas'ev IB. 1997. Antioxidant and chelating properties of flavonoids. Adv Pharmacol 38:151-63.
Lai FR, Wen QB, Li L, Wu H Li XF. 2010. Antioxidant aktivities of water-soluble polysaccharide extracted from mung bean hull with ultrasonic assisted treatment. Carbhyd Polym, 81(2):323-329.
Meltzer HM, Malterud KE. 1997. Dietary flavanoids influence development of coronary heart disease. Scand. J. Nutr. 41(2); 50.57.
Meredith A, Redrobe S. 2002. BSAVA Manual of Exotic Pets. 4th Edition. British Small Veterinery Assosiation. Pp 13-25.
Morton J. 1987. Roselle, in: Fruits of Warm Climates. Florida. Pp 281-286. Noviana D, Estuningsih S, Ulum MF, Kurniawan A, Setiawan BT, Ningsih EM,
Shatilla GS, Destri W. 2010. Radioprotektif Suplement Vitamin C pada Gambaran Darah Tepi Mencit (Mus musculus) dengan Radiasi Ionisasi Radiodiagnostik Berulang: Studi Dasar Potensi Radioprotektif Tanaman Rosela (Hibiscus sabdariffa L.) Dalam Radiasi Ionisasi Sarana Radiodiagnostik. Makalah Poster Kumpulan Abstrak Konverensi Ilmiah Veteriner Nasional ke-11 tahun 2010 PB PDHI Semarang Indonesia, 10-13 Okt 2010. hlm 139.
Ogunlensi M, W. Okiei, L. Azeez, V. Obakachi, M. Osunsanmi, G. Nkenchor. 2010. Vitamin C Contents of Tropical Vegetables and Foods Determined by Voltammetric and Titrimetric Methods and Their Relevance to the Medicinal Uses of the Plants. Int J Electrochem Sci, 5:105-115.
Olaleye MT 2007. Cytotoxicity and Antibacterial Activity of Methanolic Extract of Hibiscus sabdariffa. J Med Plants Research, 1(1); 009-013.
Olatunji LA, Adebayo JO, Adesokan AA, Soladaye AO. 2006. Chronic Administration of Aqueous Extract of Hibiscus sabdariffa Enchances Na+-K+-ATPase and Ca2+-Mg2+-Na+-K+-ATPase Activities of Rat Heart. Pharmaceutical Biology, 3(44):213-216.
Olayede KG, Oke MJ, Raji Y, Olugbade AT. 2010. Antioxidant and Anticonvulsan Alkaloids in Crinum ornatum bulb extract. World journal of chemistry. 5 (1):26-31.
Partodiharjo S. 1980. Ilmu Reproduksi Hewan. Jakarta: Mutiara.
Pau LT, Salmah, Suhaila M. 2002. Antioxidative properties of roselle (Hibiscus sabdariffa Linn) in linoleic acid model system. Nutrition & Food Science 32(1):17-20.
23 Porter WP. 2000. Rats and Mice: Introduction And Use In Research Part I. USA:
American College of Laboratory Animal Medicine. Pp: 1-12.
Pourcel L, Routaboul JM, Lepinieg L, Debajon I. 2007. Flavanoid Oxidation in Plants: from biochemical properties to physiological fungtion. Trends in Plants Science. 12(1):29-36.
Reanmongkol W, Itharat A. 2007. Antipyretic activity of the extracts of Hibiscus sabdariffa calyces L. In experimental animal. Songklanakarin J, Sci. Technol. 29(1): 29-38.
Reynolds RJ, Shecker JA. 1995. Radiation, cell cycle, and cancer. Los Alamos Sci 23:51-89.
Sen S, Chakraborty R, Sridar C, Reddy YSR, De B. 2010. Free radicals, antioxidant, disease and phytomedicines: current status and future prospect. Int J Pharmaceutical Sci 3:91-100.
Sharma P, Parmar J, Sharma P, Verma P, Goyal P. K. 2011. Radiation-Induced Testicular Injury and Its Amelioration by Tinospora cordifolia (An IndianMedicinal Plant) Extract. Radiation & Cancer Biology Laboratory, Department of Zoology, University of Rajasthan, Jaipur 302 004, India.
Skibola CF, Smith MT. 2000. Potential health impacts of excessive flavonoid intake. Free Radiac. Biol. Med. 29 (3/4): 375.383.
Sopia S. 2009. Pengaruh pemberian minyak jintan hitam (Nigella sativa) terhadap motilitas spermatozoa tikus Wistar hiperlipidemia [skripsi]. Semarang: Fakultas Kedokteran, Universitas Diponegoro.
Sukmaningsih A. 2009. Penurunan jumlah spermatosit pakiten dan spermatid tubulus seminiferus testis pada mencit (Mus musculus) yang dipaparkan asap rokok. J Biol 2(13):31-35.
Sur P, Chaudhuri T, Vedasiromi JR, Gomes A, Ganguly DK. 2001. Antiinflamatory and antioxidant property of saponins of tea. Phytotherapy Research. 15:174-176.
Szkanderova S, Vávrová J, Rézacová M, Vokurková D, Pavlová S, Smardová J, Stulík J.. 2003. Gamma Irradiation Result in Phosphorylation of p53 at
Serine-392 in Human T-lymphocyte Leukaemia Cell Line MOLT-4. Folia Biologica (Praha) 49, 191-196
Tee P-L, Yusof S, Mohammed S. 2002. Antioxidative properties o roselle in linoleic acid model system, Nutrition & Food Science, 32(1): 17-20.
24
Toelihere MR. 1985. Fisiologi Reproduksi Pada Ternak. Bandung: Penerbit Angkasa.
Thrump BF, Berezesky IK, Chang SH, Phelp PC. 1997. The pathway of cell death: oncosis, apoptosis, and necrosis. Toxico pathol 25:82-88.
Tsai PJ, Mc Intosh J, Pearce P, Camden B, Jordan BR. 2002. Anthocyanin and antioxidant capacity in rosella extract. Food Res Int, 35:351-356.
Turner JE. 2007. Atoms, Radiation, and Radiation Protection. 3rd, Completely Revised and Enlarged Edition. Wiley-Vch Verlag Gmbh & Co. KgaA.
Ulum MF, Noviana D. 2008. Safety Utilization of Radiography as a Diagnostic Tools in Veterinary Medcine Field. Proceedings of KIVNAS 2008, IPB International Convention Center-Bogor, 19-22 Agu 2008. Bogor. hlm 1-2. Wang CJ, Wang JM, Lin WL, Chu CY, Tseng TH. 2000. Protective effects of
hibiscus antochyanin against tert-butyl hydroperoxide induced hepatic toxicity in rats. Food Chem Toxicol 38:411-416.
Weill FS, Cela EM, Ferrari A, Paz ML, Leoni J, Gonzalez Maglio DH. 2011. Skin exposure to chronic but not acute UV radiation effects peripheral T-cell function. J Toxicol Environ Health A 74(13):838-47.
Widel M, Jedrus S, Lukaszczyk B, Raczek-Zwierzyeka K, Swierniak A. 2003. Radiation induced micronucleus frequency in peripheral blood lymphocytes is correlated with normal tissue demage in patient with cervical carcinoma undergoing radiotherapy. Radiat Res. 159:713-721.
Widyanto P, Nelista A. 2009. Rosela Aneka Olahan, Khasiat dan Ramuan. Depok: Penebar Swadaya.
Wright EG, Coates PJ. 2006. Untargeted effects of ionizing radiation: Implications for radiation pathology. Mutation Research 597:119-132.
25
RIWAYAT HIDUP
Penulis dilahirkan di Lintau pada tanggal 4 April 1989 dari ayah Deswandi Ramli dan ibu Fitri Yasmi adalah putra pertama dari dua bersaudara. Tahun 2007 penulis lulus dari SMA Negeri 1 Bengkalis dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Beasiswa Utusan Daerah dan diterima di Fakultas Kedokteran Hewan.