AGUS MAULANA
SKRIPSI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Dengan ini, saya menyatakan bahwa skripsi saya yang berjudul :
AKTIVITAS ANTIOKSIDAN RUMPUT LAUT Euchema
spinosum
Adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan pada Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Januari 2012
AGUS MAULANA. Aktivitas Antioksidan Rumput Laut Euchema spinosum. Dibimbing oleh DEDI SOEDHARMA dan BEGINER SUBHAN.
Perkembangan industri pada saat ini menimbulkan dampak positif dan negatif. Salah satu dampak negatif yang ditimbulkan adalah pencemaran. Pencemaran dapat memicu terbentuknya radikal bebas yang masuk ke dalam tubuh melalui pernapasan dan makanan. Radikal bebas berbahaya bagi tubuh karena dapat menyebabkan berbagai macam penyakit antara lain penyakit jantung koroner, penuaan dini, kanker, dan penyakit lainnya. Radikal bebas dapat dicegah dengan senyawa antioksidan. Salah satu senyawa antioksidan adalah golongan karetonoid yang mana senyawa tersebut merupakan penyusun pigmen pada rumput laut.
Penelitian ini dilakukan selama dua bulan yaitu bulan September hingga Oktober 2011. Pengambilan sampel dilakukan di Pulau Panjang, Banten. Analisis laboratorium dilakukan di Laboratorium Biofarmaka, LPPM, IPB, Laboratorium Bahan Organik, Departemen Kimia, IPB, dan Laboratorium Mikrobiologi,
Departemen Teknologi Hasil Perairan, IPB. Analisis proksimat meliputi kadar air, kadar abu, kadar protein, kadar lemak, dan kadar karbohidrat. Ekstraksi
menggunakan ekstraksi tunggal dengan menggunakan pelarut yang berbeda tingkat kepolarannya. Heksana p.a untuk pelarut nonpolar, etil asetat p.a untuk pelarut semipolar, dan metanol p.a untuk pelarut polar. Uji aktivitas antioksidan menggunakan metode DPPH dan nilai IC50 dapat dihitung dengan menggunakan
persamaan regresi linear. Vitamin C digunakan sebagai pembanding.
Kadar air rumput laut Euchema spinosum sebesar 84,47%, kadar abu sebesar 6,12%, kadar protein sebesar 1,12%, kadar lemak sebesar 0,39% dan kadar karbohidrat sebesar 7,90%. Pelarut metanol p.a menghasilkan berat ekstrak yang tertinggi yaitu sebesar 1,2604 gram, kemudian pelarut etil asetat p.a sebesar 0,0405 gram dan pelarut heksana p.a sebesar 0,0180 gram. Rendemen tertinggi terdapat pada pelarut metanol p.a yaitu 1,2604%, kemudian pelarut etil asetat p.a sebesar 0,1622% dan pelarut heksana p.a sebesar 0,0072%. Pengenceran pelarut heksana p.a yaitu 1000 ppm, 500 ppm, 250 ppm, dan 125 ppm. Konsentrasi 1000 ppm memiliki persen inhibisi (%) tertinggi sebesar 14,55% dan terendah dengan konsentrasi 125 ppm sebesar 4,16%. Pengenceran pelarut etil asetat p.a yaitu 10000 ppm, 5000 ppm, 2500 ppm, dan 1250 ppm. Konsentrasi 10000 ppm memiliki persen inhibisi (%) tertinggi sebesar 49,22% dan terendah pada konsentrasi 1250 ppm sebesar 13,76%. Pengenceran pelarut metanol p.a yaitu 1000 ppm, 500 ppm, 250 ppm, dan 125 ppm. Konsentrasi 1000 ppm memiliki persen inhibisi (%) tertinggi sebesar 13,05% dan terendah pada konsentrasi 125 ppm sebesar 1,33%.
Nilai IC50 pada pelarut heksana p.a sebesar 4199,54 ppm, pelarut etil asetat
© Hak cipta milik Agus Maulana, tahun 2012
Hak cipta dilindungi
AGUS MAULANA
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan pada
Departemen Ilmu dan Teknologi Kelautan
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul Penelitian : AKTIVITAS ANTIOKSIDAN RUMPUT LAUT
Euchema spinosum
Nama Mahasiswa : Agus Maulana Nomor Pokok : C54070055
Departemen : Ilmu dan Teknologi Kelautan
Menyetujui, Dosen Pembimbing
Prof. Dr. Ir. Dedi Soedharma, DEA Beginer Subhan S.Pi, M.Si NIP. 19460218 197301 1 001 NIP. 19800118 200501 1 003
Mengetahui, Ketua Departemen ITK
Tanggal Ujian: 30 Desember 2011
Puji syukur kepada Allah SWT yang telah memberikan rahmat dan karunia kepada penulis sehingga skripsi hasil penelitian ini dapat diselesaikan. Skripsi
yang berjudul “AKTIVITAS ANTIOKSIDAN RUMPUT LAUT Euchema
spinosum” yang telah diajukan sebagai salah satu syarat untuk mendapatkan gelar sarjana ilmu kelautan.
Penulis mengucapkan terima kasih kepada :
1. Kedua orang tua penulis yang telah memberikan dukungan baik material dan moril serta doa hingga saat ini.
2. Bapak Prof. Dr. Ir. Dedi Soedharma, DEA selaku dosen pembimbing utama serta Bapak Beginer Subhan S.Pi, M.Si selaku dosen pembimbing anggota yang telah memberikan arahan serta bantuan kepada penulis dalam
menyelesaikan skripsi.
3. Bapak Dr. Ir. Agoes M. Jacoeb, DiplBiol selaku penguji tamu.
4. Seluruh dosen dan staf departemen Ilmu dan Teknologi Kelautan (ITK) yang telah memberikan ilmu kepada penulis.
5. Perhimpunan Orang Tua Mahasiswa (POM), Pertamina Foundation, Serta Die Brucke (madam Inge, madam Yulia, madam Ruth, dan madam Agnes) yang telah memberikan beasiswa kuliah kepada penulis hingga selesai. 6. Kornel Adhitia Warman, S.Ik, Norihiko Zikrie, Muchamad Gufron, Bunga
Anggraeni, Ega Putra, Amandangi W.H, Fitrie Hardyanti, Moh. Iqbal yang telah membantu dalam melakukan penelitian ini.
7. Seluruh warga ITK terutama ITK 44 yang telah memberikan motivasi, semangat, dan bantuannya.
Semoga skripsi yang penulis tulis dapat bermanfaat bagi semua pihak yang membutuhkan.
Bogor, Januari 2012
Penulis dilahirkan di Jakarta pada tanggal 8 Agustus 1989 dan merupakan anak pertama dari
keluarga Bapak Muhammad Ridho dan Ibu Murniasih. Tahun 2004 – 2007 Penulis menyelesaikan pendidikan di Sekolah Menengah Atas Negeri (SMAN) 4 Jakarta . Pada Tahun 2007 penulis di terima sebagai mahasiswa Institut Pertanian Bogor, Fakultas Perikanan dan Ilmu Kelautan, Departemen Ilmu dan Teknologi Kelautan melalui jalur USMI (Undangan Seleksi Masuk IPB).
Selama kuliah di Institut Pertanian Bogor, penulis menjadi asisten Metode Statistika 2008 – 2009, Metode Observasi Bawah Air 2009 – 2010, serta Biologi Laut 2009 – 2010 dan 2010 – 2011. Penulis aktif sebagai anggota pengurus Himpunan Mahasiswa Ilmu dan Teknologi Kelautan (HIMITEKA) divisi Kewirausahaan tahun 2008 – 2009 dan Hubungan Luar dan Komunikasi (HUBLUKOM) tahun 2009-2010. Penulis juga aktif dalam organisasi Badan Eksekutif Mahasiswa FPIK divisi Kewirausahaan tahun 2008 – 2009. Selain itu, penulis juga pernah mengikuti berbagai kepanitiaan yang digelar BEM- KM IPB.
b) Kadar Abu ... 30
c) Kadar Lemak ... 31
d) Kadar Protein ... 32
e) Kadar Karbohidrat ... 32
4.3. Berat Ekstrak ... 33
4.4. Rendemen ... 34
4.5. Aktivitas Antioksidan ... 36
5. KESIMPULAN DAN SARAN ... 44
5.1. Kesimpulan ... 44
5.2. Saran ... 44
DAFTAR PUSTAKA ... 45
DAFTAR TABEL
Halaman
1. Alat dan Bahan yang Digunakan dalam Penelitian ... 18 2. Nilai IC50 Biota Uji Lainnya ... .... 42
DAFTAR LAMPIRAN
Halaman
1. Perhitungan Analisis Proksimat ... 49 2. Perhitungan Persentase Rendemen ... 50 3. Pembuatan Larutan Stok Ekstrak Heksana p.a, Etil Asetat p.a, Metanol
p.a dan Vitamin C ... 51 4. Perhitungan Pengenceran Stok Heksana p.a, Etil Asetat p.a, dan
Metanol p.a ... 52 5. Perhitungan Persen Inhibisi dan IC50 ... 54
Halaman
1. Spesies Rumput Laut dari Masing-Masing Golongan a) Golongan Alga Coklat (Sargassum sp.), b) Golongan Alga Merah (Euchema sp.),
dan c) Golongan Alga Hijau (Caulerpa sp.) ... 5
2. Metode Dasar Budidaya Rumput Laut a) Metode Sebaran, dan b) Metode Budidaya Dasar Laut ... 10
3. Metode Lepas Dasar Budidaya Rumput Laut a) Metode Tali Tunggal, b) Metode Jaring Lepas Dasar, dan c) Metode Jaring Lepas Dasar Berbentuk Tabung ... 11
4. Budidaya Rumput Laut dengan Metode Apung ... 11
5. Reaksi Peroksidasi Lemak ... 15
6. Struktur DPPH (a) Radikal Bebas dan (b) yang Bereaksi dengan Antioksidan ... 17
7. Proses Ekstraksi Kasar Rumput Laut ... 25
8. Proses Uji Aktivitas Antioksidan dengan Metode DPPH ... 27
9. Rumput Laut Euchema spinosum dari Pulau Panjang, Banten ... 28
10.Hasil Analisis Proksimat Rumput Laut Jenis Euchema spinosum .. 29
11.Perbandingan Berat Ektrak yang Dihasilkan dari Pelarut Heksana p.a, Etil Asetat p.a, dan Metanol p.a ... 34
12.Persentase Rendemen dari Pelarut Heksana p.a, Etil Asetat p.a, dan Metanol p.a ... 35
13.Hubungan Antara Konsentrasi (ppm) dengan Persen (%) Inhibisi a) Pelarut Heksana p.a, b) Pelarut Etil Asetat p.a, dan c) Pelarut Metanol p.a ... 37
14.Konsentrasi Larutan Vitamin C dengan Persen (%) Inhibisi ... 39
22.Ekstark Etil Asetat p.a ... 60
23.Ekstrak Metanol p.a ... 60
24.Larutan Stok DPPH ... 60
1
1.1 Latar Belakang
Perkembangan industri pada saat ini semakin meningkat dan menimbulkan dampak negatif maupun positif. Salah satu dampak negatif dari perkembangan industri adalah pencemaran. Pencemaran adalah salah satu pemicu terbentuknya radikal bebas yang dapat masuk melalui pernapasan maupun makanan. Radikal bebas merupakan atom atau molekul yang kehilangan pasangan elektron
dipermukaan kulit luarnya (Kumalaningsih, 2006). Radikal bebas sangat reaktif dan mudah bereaksi dengan molekul-molekul lainnya antara lain protein, lemak, karbohidrat, dan DNA. Radikal bebas dapat menimbulkan berbagai macam penyakit antara lain penyakit jantung koroner, penyakit kanker, penyakit katarak, penyakit degeneratif dan proses penuaan. Radikal bebas dapat dicegah dengan senyawa antioksidan.
Fungsi antioksidan adalah menetralisir radikal bebas sehingga tubuh akan terlindung dari berbagai penyakit yang ditimbulkan oleh radikal bebas (Tapan, 2005). Antioksidan ada yang dihasilkan oleh tubuh sendiri (endogenous) berupa enzim ataupun yang berasal dari buah-buahan dan sayuran (eksogenous). Selain itu, terdapat antioksidan sintetik yang biasa digunakan dalam bahan pangan antara lain butylated hydroxyanisol (BHA), butylated hydroxytoluene (BHT) dan
darat maupun dari hewan-hewan yang berada di lautan. Namun, pengkajian senyawa antioksidan dari tumbuhan laut misalnya rumput laut masih jarang dilakukan. Penelitian mengenai kandungan senyawa antioksidan pada rumput laut pernah dilakukan oleh peneliti sebelumnya, misalnya yang dilakukan oleh
Amornlerdipson et al. (2007) mengekstrak dari rumput laut hijau (Padina minor
YAMADA), kemudian Suryaningrum et al. (2006) mengekstrak rumput laut
Halmenia harveyana dan Euchema cottonii dan Tamat (2007) mengekstrak kandungan senyawa antioksidan dari rumput laut jenis Ulva reticulata.
Rumput laut telah diketahui banyak digunakan sebagai obat-obatan
tradisional selain digunakan sebagai bahan makanan, karena rumput laut memiliki kandungan mineral, elemen makro dan mikro lainnya. Euchema spinosum
1.2 Tujuan Penelitian
4
2.1 Rumput Laut
Rumput laut merupakan tanaman tingkat rendah yang tidak mempunyai batang, daun dan akar sejati. Tubuhnya menyerupai batang yang disebut dengan
thallus dan hidupnya menempel pada substrat, misalnya karang, lumpur, pasir, batu, dan benda keras lainnya (Anggadierdja et al., 2006). Bentuk thallus pada rumput laut bermacam-macam antara lain ada yang berbentuk pipih, tabung, gepeng, bulat dan sebagainya. Pigmen yang terdapat pada thallus juga bermacam-macam sehingga dapat digunakan dalam membedakan berbagai kelas rumput laut, yaitu Chloropyceae, Phaeophyceae, Rhodophyceae, dan Cyanophyceae. Pigmen yang menentukan warna ini adalah klorofil, karoten, phycoerythin dan
phycocyanin merupakan pigmen-pigmen utama disamping pigmen-pigmen lainnya (Aslan, 1998).
Alga merah atau Rhodophyceae merupakan alga yang memiliki pigmen fikobilin, yang terdiri dari fikoeritrin (berwarna merah) serta fikosianin (berwarna biru). Alga merah dapat beradaptasi secara kromatis yaitu memberikan reaksi yang berbeda terhadap kualitas penyinaran sehingga komposisi pigmen bisa berubah dan memberikan warna thalli yang berbeda. Spesies ekonomis dari divisi ini adalah dari marga Gracilaria, Gelidium, Euchema, Hypnea, Gigartina, dan
Rhodymena. Alga coklat dengan nama lain Phaeopyceae merupakan alga yang memiliki pigmen klorofil a dan c, beta karoten, violasantin dan fukosantin. Alga ini umumnya berwarna cokelat. Spesies ekonomis pada divisi ini dari marga
santhofil. Alga ini pada umumnya berwarna hijau dan spesies yang benilai ekonomis pada divisi ini dari marga Ulva spp dan Enteromorpha spp (Aslan, 1998). Salah satu spesies rumput laut dari masing-masing golongan disajikan pada Gambar 1.
(a) (b)
(c)
Gambar 1. Spesies Rumput Laut dari Masing-Masing Golongan a) Golongan Alga Coklat (Sargassum sp.), b) Golongan Alga Merah (Euchema sp.), dan c) Golongan Alga Hijau (Caulerpa sp.) (Sumber : Koleksi Pribadi)
2.2 Reproduksi Rumput Laut
pada tanaman rumput laut, sedangkan pembiakan secara fragmentasi (stek) dilakukan dalam usaha budidaya rumput laut (Aslan, 1998).
Ada tiga tipe reproduksi seksual rumput laut yaitu haplobiontik, haplobiontik diploid, dan diplobiontik. Haplobiontik yaitu tipe reproduksi seksual dimana hanya ada satu individu kehidupan bebas (satu fase) yang terlibat dalam daur hidup. Dalam hal ini kromosom pada individu tersebut adalah haploid.
Pertumbuhan zygot sampai menjadi tanaman dewasa terbentuk pula dalam proses pembiakan tipe ini. Reproduksi semacam ini banyak terdapat pada alga hijau.
Haplobiontik diploid yaitu tipe reproduksi seksual dimana individu yang
melakukan daur hidup ini adalah diploid, dan untuk diplobiontik merupakan tipe reproduksi seksual yang melibatkan dua individu yang terlibat dalam daur hidup yaitu gametofit serta sporofit.
Reproduksi aseksual berupa pembentukan suatu individu baru melalui perkembangan spora, pembelahan sel, serta fragmentasi. Pada rumput laut bersel satu setiap individu mempunyai kemampuan untuk membelah diri dan
membentuk individu baru. Rumput laut multiseluler, potongan thallusnya mempunyai kemampuan berkembang meneruskan pertumbuhan (Aslan, 1998).
2.3 Faktor yang Mempengaruhi Pertumbuhan
yang terkandung didalamnya. Atmadja et al. (1996) menyatakan kisaran suhu yang baik untuk pertumbuhan rumput laut yaitu berkisar 27 0C – 30 0C.
Pertumbuhan rumput laut dapat dipengaruhi oleh kadar garam atau salinitas. Kisaran salinitas yang baik untuk pertumbuhan rumput laut yaitu 28 – 34 ppt (Atmadja, 1996). Mutu dan kuantitas cahaya berpengaruh terhadap produksi spora dan pertumbuhannya (Aslan, 1998). Intensitas cahaya juga mempengaruhi
kegiatan fotosintesis rumput laut. Rumput laut akan mengalami kerusakan jika terkena intensitas cahaya yang terlalu tinggi dan terkena udara secara langsung (Doti, 1987 dalam Anindia, 2010).
Pergerakan air dapat melindungi tubuh rumput laut dari berbagai epifit yang menempel pada thallus. Epifit yang menempel pada thallus dapat menghambat pertumbuhan rumput laut. Kecepatan air yang baik untuk rumput laut adalah 20 -40 cm/s, serta gelombang yang baik untuk pertumbuhan rumput laut yaitu 30 cm (Apriyani, 2006). Unsur hara seperti kadar nitrat dan fosfat mempengaruhi pertumbuhan rumput laut. Selain mempengaruhi pertumbuhan, unsur hara di perairan juga akan mempengaruhi kesuburan gametofit (Aslan, 1998).
2.4 Manfaat Rumput Laut
a) Industri pangan
Kemampuan alginat dan karaginan dalam membentuk busa dan kejernihan dimanfaatkan untuk membuat minuman bir. Kemampuan agar, karaginan
dimanfaatkan dalam pembuatan jelly atau agar-agar dan pelapis permen. Makanan yang disimpan dalam kaleng memerlukan bahan pengental, pembentuk gel, serta pensuspensi dengan memanfaatkan agar dan karaginan. Selain rumput laut diolah menjadi berbagai bahan makanan, rumput laut juga dapat dijadikan sebagai bahan makanan langsung seperti masyarakat pulau pramuka, kepulauan seribu
menjadikan rumput laut sebagai bahan dasar dalam pembuatan dodol. b) Farmasi
Rumput laut menghasilkan metabolit primer dan metabolit sekunder. Metabolit primer yang dihasilkan oleh rumput laut diantaranya adalah senyawa-senyawa agar, karaginan, serta alginat. Ketiga senyawa-senyawa ini jenis hidrokoloid yang digunakan untuk berbagai macam obat dan bidang kosmetika. Metabolit sekunder yang merupakan senyawa bioactive compounds dikembangkan melalui berbagai penelitian untuk dijadikan obat alternatif. Alga merah memiliki senyawa
terpenoid berhalogen dan senyawa asetogenin (senyawa yang dihasilkan melalui proses polimerisasi asetat) dengan unsur halogen utama yaitu bromine. Senyawa -senyawa tersebut dapat dijadikan sebagai antimikroba. Alga coklat terdapat senyawa komplek diterpenoid dan senyawa campuran terpenoid-aromatik yang berfungsi sebagai antibiotik. Alga hijau-biru memproduksi senyawa nonterpenoid
dan banyak diantaranya bersifat toksik dan mengandung halogen, terutama klorin. Senyawa tersebut memiliki nitrogen dalam bentuk amide atau indule yang
c) Kosmetik
Rumput laut menghasilkan agar, karaginan serta alginat yang dimanfaatkan dalam bidang kecantikan untuk dimanfaatkan sebagai sabun krim ataupun sabun cair. Alginat yang ditemukan pada rumput laut dimanfaatan untuk membuat
shampoo, lotions, pasta gigi, pewarna bibir, dan perawatan-perawatan kulit lainnya. Pada karaginan banyak dimanfaatkan untuk hand-body lotion dan alginat digunakan untuk hair lotion dan pencuci mulut (Anggadierdja et al., 2006). d) Bioteknologi
Penggunaan rumput laut untuk bidang bioteknologi diantaranya sebagai medium untuk menumbuhkan bakteri, jamur, dan mikroalga. Selain itu dijadikan sebagai medium dalam industri perbanyakan bibit secara kultur jaringan, dan rekombinasi DNA (Anggadierdja et al., 2006)
e) Industri nonpangan
Agar, karaginan, serta alginat yang dihasilkan oleh rumput laut juga dapat dimanfaatkan dalam bidang nonpangan. Bahan-bahan tersebut dimanfaatkan untuk makanan ternak, keramik, cat, tekstil, kertas dan pembuatan film fotografis (Anggadierdja et al., 2006).
2.5 Budidaya Rumput Laut
Budidaya rumput laut di Indonesia semakin berkembang, baik secara ekstensif maupun intensif, dengan menggunakan lahan yang ada. Saat ini,
Metode dasar merupakan metode pembudidayaan rumput laut menggunakan benih dengan berat tertentu, yang telah diikat kemudian ditebarkan ke dasar perairan, atau sebelum ditebarkan, benih diikat dengan batu karang. Metode dasar terdiri dari dua metode yaitu metode sebaran dan metode budidaya dasar laut (Gambar 2). Metode sebaran adalah suatu cara budidaya dimana bibit rumput laut yang akan ditanam dipotong terlebih dahulu dengan berat 25 hingga 30 gram, lalu diikat dengan tali rafia. Potongan-potongan bibit tersebut disebarkan di perairan yang diinginkan. Metode budidaya dasar merupakan metode budidaya dimana rumput laut yang telah diikat dengan batu karang kemudian diikat kembali dengan tali rafia, kemudian disusun rapi hingga berjalur-jalur.
(a) (b)
Gambar 2. Metode Dasar Budidaya Rumput Laut a) Metode Sebaran, dan b) Metode Budidaya Dasar Laut (Aslan, 1998)
(a) (b)
(c)
Gambar 3. Metode Lepas Dasar Budidaya Rumput Laut a) Metode Tali Tunggal Lepas Dasar, b) Metode Jaring Lepas Dasar, dan c) Metode Jaring Lepas Dasar Berbentuk Tabung (Aslan, 1998)
Metode apung merupakan rekayasa bentuk dari metode lepas dasar. Pada metode apung tidak digunakan kayu pancang melainkan menggunakan pelampung yang umumnya terbuat dari bambu, dan posisi tanaman dekat dengan permukaan air (Aslan, 1998) (Gambar 4). Metode ini terdiri dari metode tali tunggal apung dan metode jaring apung.
2.6 Radikal Bebas
Radikal bebas adalah atom atau molekul yang tidak memiliki pasangan elektron di permukaan kulit terluarnya (Kumalaningsih, 2006). Elektron yang tidak memiliki pasangan elektron pada permukaan kulitnya akan memenuhi elektronnya dengan cara menambah atau mengurangi elektron untuk mengisi maupun mengosongkan lapisan luarnya dan membagi elektron-elektronnya dengan cara bergabung bersama dengan atom lain untuk mengisi rangka luarnya.
Radikal bebas memiliki reaktivitas yang sangat tinggi dan mudah bereaksi dengan molekul lain yaitu DNA, protein, karbohidrat dan lainnya. Radikal bebas tidak dapat mempertahankan bentuk asli dalam waktu yang lama dan berusaha untuk berikatan dengan molekul yang bersifat stabil dan mengambil elektronnya. Namun, bila ada dua senyawa radikal bebas bertemu, elektron-elektron yang tidak berpasangan dari kedua senyawa tersebut akan bergabung dan membentuk ikatan kovalen yang stabil. Sebaliknya, bila senyawa radikal bebas bertemu dengan senyawa bukan radikal bebas, akan terjadi tiga kemungkinan (Winarsih, 2007) yaitu :
a) Radikal bebas akan memberikan elektron yang tidak berpasangan kepada senyawa bukan radikal.
b) Senyawa radikal bebas akan menerima elektron dari senyawa yang bukan radikal bebas.
kerusakan struktur sel, molekul termodifikasi yang tidak dapat dikenali oleh sistem imun, bahkan terjadi mutasi. Semua bentuk yang ditimbulkan oleh radikal bebas akan memicu terbentuknya berbagai macam penyakit.
2.7 Antioksidan
Antioksidan merupakan senyawa yang mempunyai struktur molekul yang dapat memberikan elektronnya dengan cuma-cuma kepada molekul radikal bebas tanpa terganggu fungsinya sama sekali dan dapat memutus reaksi berantai dari radikal bebas (Kumalaningsih, 2006). Senyawa ini memiliki berat molekul kecil, tetapi mampu menginaktivasi berkembangnya reaksi oksidasi, dengan cara mencegah terbentuknya radikal (Winarsih, 2007).
Antioksidan juga merupakan senyawa yang dapat menghambat reaksi oksidasi dengan mengikat radikal bebas dan molekul yang sangat reaktif. Akibatnya, kerusakan sel akan dihambat (Winarsih, 2007). Fungsi antioksidan adalah menetralisir radikal bebas, sehingga tubuh terlindungi dari berbagai macam penyakit degeneratif serta kanker. Fungsi lain dari antioksidan adalah mencegah penuaan atau antiaging.
2.7.1Sumber Antioksidan
Antioksidan berdasarkan sumbernya digolongkan menjadi tiga macam yaitu antioksidan yang dibuat oleh tubuh kita sendiri, antioksidan alami yang diperoleh dari tumbuhan, dan antioksidan sintetik yang terbuat dari bahan kimia.
adanya ion logam. Aktivitas superoksidase dismutase tergantung pada logam Fe, Cu, Zn, dan Mn. Enzim katalase bergantung pada ion logam Fe (besi), dan glutation peroksidase tergantung pada ion logam Se (selenium) (Winarsih, 2007).
Antioksidan alami dapat berupa senyawa nutrisi dan non-nutrisi. Senyawa antioksidan berupa senyawa nutrisi antara lain vitamin C, E, A, dan �-karoten, dan senyawa antioksidan berupa non-nutrisi antara lain glutation, asam urat, bilirubin, albumin, dan flavonoid. Antioksidan alami ini dapat diperoleh dari asupan bahan makanan. Antioksidan sintetik dibuat dari bahan-bahan kimia antara lain butylated hydroxyanisol (BHA), butylated hydroxytoluene (BHT), dan
propylgallate (PG).
2.7.2Mekanisme Antioksidan
Berdasarkan mekanisme kerjanya, antioksidan digolongkan menjadi tiga kelompok yaitu antioksidan primer, antioksidan sekunder, dan antioksidan tersier. Antioksidan primer disebut juga dengan antioksidan enzimatis yang terdiri dari enzim superoksidase dismutase (SOD), katalase, dan glutation peroksidase (GSH-Px). Suatu senyawa dikatakan enzimatis apabila dapat memberikan atom hidrogen secara cepat kepada senyawa radikal, kemudian radikal antioksidan yang
terbentuk segera menjadi senyawa yang lebih stabil. Antioksidan kelompok ini disebut juga chain-breaking-antioxidant.
kemudian mencegah reaktivitas amplifikasinya. Saat jumlah radikal bebas berlebihan, kadar antioksidan non-enzimatis yang dapat diamati dalam cairan biologi menurun (Winarsih, 2007).
Antioksidan tersier meliputi sistem enzim DNA-repair dan metionin sulfoksida reduktase. Enzim-enzim ini berfungsi dalam perbaikan biomolekuler yang rusak akibat reaktivitas radikal bebas.
Mekanisme dari antioksidan itu sendiri pada umumnya adalah menghambat oksidasi lemak. Oksidasi lemak terdiri dari tiga tahapan yaitu inisiasi, propagasi, dan yang terakhir adalah terminasi. Pada tahap inisiasi terjadi pembentukan asam lemak yaitu senyawa turunan asam lemak yang bersifat tidak stabil dan sangat reaktif akibat adanya kehilangan atom hidrogen. Tahap selanjutnya yaitu propagasi yaitu radikal asam lemak akan bereaksi dengan radikal oksigen membentuk radikal peroksi. Radikal peroksi akan menyerang asam lemak dan menghasilkan hidroperoksida dan radikal asam lemak baru. Hidroperoksida yang terbentuk bersifat tidak stabil dan akan terdegradasi lebih lanjut akan
menghasilkan senyawa-senyawa karbonil pendek seperti aldehida dan keton yang bertanggung jawab atas flavor makanan berlemak (Kumalaningsih, 2006). Mekanisme oksidasi lemak disajikan pada Gambar 5.
Inisiasi : RH – - R* + H* Propagasi : R* + O2 - - ROO*
ROO* + RH - - ROOH + R*
2.7.3Uji Aktivitas Antioksidan
Salah satu metode yang paling umum digunakan untuk menguji antioksidan dengan menggunakan radikal bebas diphenylpicrylhydrazyl (DPPH). Molekul DPPH dicirikan sebagai radikal bebas stabil dengan cara mendelokasi elektron bebas pada suatu molekul, sehingga molekul tersebut tidak reaktif sebagaimana radikal bebas yang lain. Proses delokasi ini ditunjukkan dengan adanya warna ungu (violet) pekat yang dapat dikarakterisasi pada pita absorbansi pada pelarut etanol dengan panjang gelombang 520 nm. (Molyneux, 2004 dalam Safitri, 2010).
Pengukuran aktivitas antioksidan dengan metode DPPH menggunakan prinsip spektrofotometri. Senyawa DPPH dalam metanol berwarna ungu tua terdeteksi pada panjang gelombang sinar tampak sekitar 517 nm. Parameter untuk menginterpretasikan hasil pengujian DPPH adalah dengan IC50 (inhibator
concentration). IC50 merupakan konsentrasi larutan substrat atau sampel yang
akan menyebabkan reduksi terhadap aktivitas DPPH sebesar 50%. Semakin kecil nilai IC50 berarti semakin tinggi aktivitas antioksidan (Molyneux, 2004). Secara
spesifik suatu senyawa dikatakan sebagai antioksidan sangat kuat jika nilai IC50
kurang dari 0,05 mg/ml, kuat untuk nilai IC50 antara 0,05-0,10 mg/ml, sedang jika
nilai IC50 0,10-0,15 mg/ml dan lemah jika nilai IC50 0,15-0,20 mg/ml. Strukur
(a) (b)
18
3.
BAHAN DAN METODE
3.1 Waktu dan Lokasi Penelitian
Penelitian ini dilakukan pada bulan September hingga Oktober 2011. Rumput laut jenis Euchema spinosum berasal dari Pulau Panjang, Banten.
Penelitian laboratorium dilakukan di laboratorium Pusat Studi Biofarmaka, LPPM IPB, laboratorium Bahan Organik Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam dan Laboratorium Mikrobiologi Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor .
3.2 Alat dan Bahan
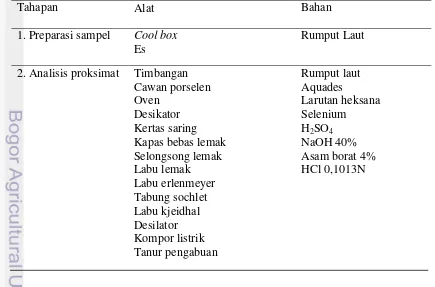
Alat dan bahan yang digunakan dalam penelitian ini, meliputi preparasi sampel, uji proksimat, ektraksi kasar, serta pengujian aktivitas antioksidan disajikan pada Tabel 1.
Tabel 1. Alat dan Bahan yang Digunakan Dalam Penelitian
Tahapan Alat Bahan
1. Preparasi sampel Cool box
Es
Rumput Laut
Tabel 1. Lanjutan
3.3 Metode penelitian
Penelitian ini dibagi menjadi empat tahap yaitu penanganan sampel, analisis proksimat, ekstraksi kasar, dan uji aktivitas antioksidan. Penanganan sampel rumput laut menggunakan es agar sampel tetap segar sampai laboratorium yang akan dimasukkan ke dalam freezer. Analisis proksimat meliputi analisis kadar air, kadar abu, kadar lemak serta kadar protein. Ekstrak kasar menggunakan metode tunggal dengan larutan yang berbeda tingkat kepolarannya yaitu heksana p.a yang bersifat nonpolar, etil asetat p.a (semipolar), serta metanol p.a ( polar) yang
kemudian hasil ekstrak diuji aktivitas antioksidan menggunakan metode 1,1 diphenyl 2-picryhydrazil (DPPH).
3.3.1Penanganan Sampel
kemudian dimasukkan ke dalam freezer. Rumput laut dalam keadaan segar selanjutnya dibagi menjadi dua yaitu untuk analisis proksimat dan uji aktivitas antioksidan.
3.3.2 Rendemen
Ekstraksi yang dilakukan menggunakan ekstraksi tunggal agar rendemen yang dihasilkan lebih besar. Menurut Sudirman (2011) ekstraksi tunggal memiliki nilai rendemen lebih besar dibandingkan dengan ekstraksi bertingkat. Nurhayati et al.(2009) dalam Romansyah (2011) menyatakan bahwa nilai rendemen yang tinggi menunjukkan banyaknya komponen bioaktif didalamnya. Persentase rendemen dari setiap masing-masing sampel dapat dihitung dengan menggunakan formula sebagai berikut :
% Rendemen = bobot ektrak
bobot sampel awal x 100%
3.3.3Analisis proksimat
Analisis proksimat merupakan suatu analisis yang digunakan untuk menduga kadar gizi. Sampel rumput laut yang digunakan dipotong hingga menjadi bagian yang kecil, kemudian dianalisis kandungan kadar air, kadar abu, kadar lemak serta kadar protein.
a) Kadar air (AOAC, 2005)
konstan dan kemudian ditimbang beratnya. Sampel rumput laut sebanyak 5 gram dimasukkan ke dalam cawan porselen tersebut dan kemudian dimasukkan kembali ke dalam oven selama 6 jam. Cawan poselen berisi sampel yang telah dioven kemudian dimasukkan ke dalam desikator selama 15 menit atau hingga beratnya konstan, selanjutnya ditimbang kembali. Perhitungan kadar air menggunakan formula :
Kadar air % = B−C
A x 100%
Keterangan : A = Berat sampel rumput laut (gram).
B = Berat cawan dan sampel rumput laut (gram).
C = Berat cawan dan sampel rumput laut yang telah dioven.
b) Kadar abu (AOAC, 2005)
Kadar abu % = B−C
A x 100%
Keterangan : A = Berat sampel rumput laut (gram). B = Berat cawan kosong (gram). C = Berat cawan dan abu (gram).
c) Kadar lemak (AOAC, 2005)
Rumput laut sebanyak 5 gram (W1) dimasukkan kedalam kertas saring kemudian kedua ujung tersebut ditutup dengan kapas bebas lemak. Sampel yang telah dibungkus dimasukkan ke dalam selongsong lemak kemudian dimasukkan ke dalam labu lemak yang sebelumnya telah ditimbang berat tetapnya (W2), selanjutnya disambungkan dengan tabung sochlet. Selongsong lemak tersebut kemudian dimasukkan ke dalam ruang ekstraktor tabung sochlet dan kemudian disiram dengan menggunakan larutan heksana dan direfluks selama 6 jam. Selanjutnya didestilasi hingga pelarut dalam labu lemak menguap. Labu lemak kemudian dikeringkan dalam oven pada suhu 105 0C, selanjutnya dimasukkan ke dalam desikator dan ditimbang kembali labu lemak tersebut (W3).
Persentase kadar lemak dapat dihitung dengan menggunakan formula :
Kadar lemak = W3−W2
W1 x 100%
Keterangan : W1 = Berat rumput laut (gram).
d) Kadar protein (AOAC, 2005)
Sampel rumput laut ditimbang kurang lebih 1,5 gram kemudian masukkan ke dalam labu kjeidhal 100 ml. Sebanyak 0,25 gram selenium dan 10 ml H2SO4
kemudian didestruksi (pemanasan hingga mendidih) sampai larutan menjadi jernih (kehijau-hijauan). Larutan tersebut didinginkan, sebanyak 10 ml ditambahkan 100 ml aquades. Destilasi dengan desilator dengan suhu 100 0C dengan menambahkan 10 ml NaOH 40%. Hasil desilasi dimasukkan ke dalam labu erlenmeyer yang telah berisi 100 ml asam borat 4%. Larutan yang telah didestilasi kemudian dititrasi dengan menggunakan HCl 0,1013 N sampai terjadi perubahan warna merah muda kembali. Perhitungan kadar protein dapat dihitung dengan menggunakan formula :
N % = ml HCl−ml blanko x N HCl x 14.000 x 10
gram sampel x 1000 x 100%
Kadar protein (%) = N(%) x 6.25
3.3.4 Ekstraksi Senyawa Bioaktif (Pramadhany, 2006 dalam Romansyah, 2010)
memperluas kontak dengan pelarut. Hal tersebut bertujuan untuk memaksimalkan proses ekstraksi komponen bioaktif (Sudirman, 2011). Sampel rumput laut yang telah dipotong kemudian dimasukkan ke dalam erlenmeyeruntuk diberi pelarut sebanyak 100 ml. Masing-masing sampel rumput laut diberi dengan pelarut yag berbeda. Perbandingan sampel rumput laut dengan pelarut adalah 1 : 4 (w/v).
Maserasi selama 1x24 jam campuran sampel dan pelarut dengan
menggunakan orbital shaker. Hasil maserasi kemudian disaring dengan kertas saring whatman 42 yang akan menghasilkan filtrat dan residu. Filtrat kemudian dievaporasi pada suhu 50 0C. Hasil dari evaporasi ini adalah tiga ekstrak kasar yang masing-masing dari pelarut berbeda yaitu ekstrak kasar heksana p.a, ekstrak kasar etil asetat p.a dan ekstrak kasar metanol p.a. Diagram alir proses ekstraksi bertingkat dapat dilihat pada Gambar 7.
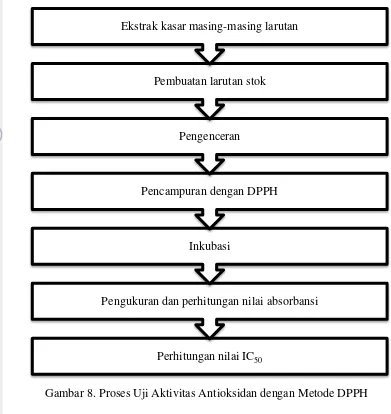
3.3.5Uji Aktivitas Antioksidan (Salazar-Aranda et al., 2009)
Gambar 7. Proses Ekstraksi Kasar Rumput Laut (Pramadhany, 2006 dalam Romansyah, 2010)
Rumput laut sebanyak 25 gram
Penambahan 100 ml heksana p.a
Penambahan 100 ml etil asetat p.a
Penambahan 100 ml metanol p.a
Filtrasi
Residu Filtrat
Evaporasi
Ekstrak kasar heksana p.a
Ekstrak kasar etil asetat p.a
Pembanding yang digunakan adalah vitamin C yang diencerkan dengan berbagai konsentrasi. Larutan blanko dibuat dengan menggunakan 100 µl etanol dan 100 µl larutan DPPH. Diagram alir uji aktivitas antioksidan disajikan pada Gambar 8. Aktivitas antioksidan masing-masing larutan pada setiap konsentrasi dan larutan Vitamin C dinyatakan dengan persentase penghambatan radikal bebas (persen inhibisi) yang dapat dihitung dengan menggunakan formula sebagai berikut :
% inhibisi = absorbansi blanko−absorbansi sampel
absorbansi blanko x 100%
Nilai konsentrasi sampel dari masing-masing larutan (heksana, etil asetat, dan metanol) dan pembanding (vitamin C) serta hambatan radikal bebas (% inhibisi) diplot masing-masing pada sumbu x dan y pada persamaan regresi linear. Persamaan regresi linear yang diperoleh dalam bentuk persamaan y = a +bx yang digunakan untuk mencari nilai IC50 (inhibator concentration 50%) dengan y
sebesar 50 dan x menyatakan nilai IC50. Nilai IC50 menyatakan bahwa konsentrasi
Gambar 8. Proses Uji Aktivitas Antioksidan dengan Metode DPPH
Perhitungan nilai IC50
Pengukuran dan perhitungan nilai absorbansi Inkubasi
Pencampuran dengan DPPH Pengenceran
28
4.1 Karakteristik Bahan Baku
Karakteristik bahan baku dilakukan untuk mengetahui sifat dari bahan baku yang digunakan. Euchema spinosum merupakan rumput laut yang tergolong dalam alga merah dan memiliki pigmen klorofil a, fikoeritin, fikosianin, dan karoten. Rumput laut Euchema spinosum yang diambil dari Pulau Panjang, Banten disajikan pada Gambar 9.
Gambar 9. Rumput Laut Euchema spinosum dari Pulau Panjang, Banten
Rumput laut yang digunakan dalam penelitian ini memiliki karakteristik
Rumput laut Euchema spinosum tumbuh tersebar di perairan Indonesia pada tempat-tempat yang sesuai dengan persyaratan tumbuhnya.
4.2 Analisis proksimat
Kandungan gizi dapat dilakukan dengan melakukan uji atau analisis proksimat. Analisis proksimat dilakukan untuk memperoleh data kasar tentang komposisi kimia bahan baku yang diuji (Sudirman, 2011). Uji proksimat meliputi kadar air, kadar abu, kadar lemak, dan kadar protein. Kadar karbohidrat diperoleh dengan perhitungan by difference (100% - (kadar air + kadar abu + kadar lemak +kadar protein). Sampel yang digunakan adalah rumput laut jenis Euchema spinosum yang termasuk kelas alga merah. Hasil uji proksimat rumput laut
Euchema spinosum disajikan pada Gambar 10 dan contoh perhitungan dapat dilihat pada Lampiran 1.
Gambar 10. Hasil Analisis Proksimat Rumput Laut Jenis Euchema spinosum
a. Kadar air
Penentuan kadar air merupakan salah satu parameter yang dapat
menggambarkan kualitas suatu bahan pangan. Winarno (1992) menyatakan kadar
air dalam bahan makanan ikut menentukan kesegaran dan daya awet bahan pangan tersebut. Kadar air juga dapat mempengaruhi sifat fisik, sifat-sifat fisik kimia serta perubahan-perubahan kimia (Dwihandita, 2009). Sifat fisik
diantaranya kekerasan dan kekeringan, sifat fisik kimia dan perubahan kimia merupakan pencoklatan enzimatis, kerusakan mikrobiologis, serta perubahan enzimatis terutama pada makanan yang belum diolah (Buckel et al., 1985 dalam
Dwihandita, 2009). Gambar 10 menunjukkan kadar air rumput laut jenis Euchema spinosum relatif tinggi yaitu sebesar 84,47%. Kandungan rumput laut segar sama seperti pada tanaman pada umumnya yaitu sekitar 80 – 90% (Ahdyanti, 2009). Hal ini sesuai dengan yang dilakukan oleh Dwihadiyanti (2009) dan Ahdyanti (2009) yang mendapatkan kadar air pada rumput laut Caulerpa racemosa sebesar 92,80% dan 93,48%. Menurut Astawan et al., (2001) dalam Ahdyanti (2009) menyatakan bahwa kandungan komposisi kimia berbeda-beda setiap individu, spesies, habitat, umur panen dan kondisi lingkungan.
b. Kadar abu
Abu merupakan zat-zat anorganik sisa hasil pembakaran dari zat-zat
organik. Bahan makanan memiliki sekitar 96% terdiri dari bahan organik dan air, sisanya merupakan zat anorganik atau kadar abu. Menurut Winarno (2008) dalam proses pembakaran suatu bahan makanan, komponen-komponen organik terbakar, namun komponen anorganik tidak dan selanjutnya disebut abu. Kadar abu pada rumput laut jenis Euchema spinosum sebesar 6,12% . Kadar abu rumput laut
Euchema spinosum relatif sedikit dibandingkan dengan kadar abu menurut Poncomulyo (2006) yaitu sebesar 14,21%. Namun, dibandingkan dengan lamun
spinosum lebih tinggi karena kedua jenis lamun tersebut memiliki kadar abu sebesar 2,35% dan 2,10% ( Rumiantin, 2011) (Anwariyah, 2011). Kadar abu pada setiap jenis makhluk hidup akuatik berbeda-beda tergantung pada habitat dan kondisi lingkungannya. Menurut Budiyanto (2002) dalam Azka (2010) kadar abu dan komposisinya dari suatu bahan makanan tergantung pada macam bahan yang dianalisis serta cara pengabuannya.
c. Kadar lemak
Lemak merupakan zat penting dan merupakan sumber energi yang efektif dibanding dengan karbohidrat dan protein. Hal tersebut karena 1 gram lemak dapat menghasilkan 9 kkal sedangkan karbohidrat dan protein menghasilkan kkal yang lebih kecil yaitu sebesar 4 kkal. Lemak memberikan cita rasa pada makanan dan memperbaiki tekstur pada makanan juga sebagai sumber pelarut bagi vitamin A, D, E, dan K (Winarno, 2008). Lemak berfungsi sebagai penghasil energi, penghasil asam lemak esensial , dan pemberi kepuasan cita rasa. Kadar lemak yang terdapat pada rumput laut jenis Euchema spinosum adalah 0,39%. Rumput laut Euchema spinosum memiliki kadar lemak yang relatif rendah. Hal ini sesuai dengan Pancamulyo (2006) yang mendapat kadar lemak pada rumput laut
Euchema spinosum sebesar 0,13%. Namun, kadar lemak pada lamun jenis
d. Kadar protein
Protein merupakan salah satu kelompok nutrien yang penting. Senyawa ini didapatkan dari dalam sitoplasma pada semua sel makhluk hidup (Gardjito, 1992). Protein adalah substansi organik-organik dan mereka mirip lemak maupun
karbohidrat dalam kandungan unsur karbon, hidrogen maupun oksigen. Protein berfungsi sebagai bahan bakar di dalam tubuh. Selain itu, protein dapat juga berfungsi sebagai zat pembangun serta pengatur. Gambar 10 menunjukkan protein yang terdapat pada rumput laut Euchema spinosum relatif rendah dibandingkan dengan kadar abu, air serta karbohidrat. Kandungan protein yang terdapat pada rumput laut jenis Euchema spinosum sebesar 1,12%. Kadar protein yang dimiliki lamun Enhalus acoroides dan Cymodocea rotundata tidak berbeda jauh dengan rumput laut Euchema spinosum yaitu sebesar 1,09% dan 1,13%.
e. Kadar karbohidrat
Karbohidrat adalah kelompok nutrien yang penting dalam susunan makanan serta sebagai sumber energi. Senyawa-senyawa karbohidrat mengandung unsur karbon, hidrogen, serta oksigen yang dihasilkan melalui fotosintesis (Gardjito, 1992). Kandungan karbohidrat dihitung dengan menggunakan by difference
(%Kadar karbohidrat = 100% - ( %kadar air + %kadar abu + %kadar protein + %kadar lemak). Kandungan karbohidrat yang terdapat pada rumput laut jenis
Euchema spinosum relatif rendah yaitu sebesar 7,9%. Namun, Pancamulyo (2006) mendapat kadar karbohidrat rumput laut Euchema spinosum lebih tinggi yaitu sebesar 13,38%. Perbedaan kadar karbohidrat yang terkandung tidak
serat melainkan dalam bentuk glikogen, fruktosa, sukro, monosakarida, disakarida lainnya.
4.3 Berat Ekstrak
Ekstrak kasar hasil evaporasi dari pelarut yang berbeda memiliki
karakteristik dan berat yang berbeda, hal ini karena setiap senyawa mempunyai kemampuan dalam melarutkan senyawa-senyawa yang tergantung tingkat kepolarannya (Apriandi, 2011). Pelarut yang digunakan adalah pelarut heksana p.a golongan nonpolar, etil asetat p.a golongan semipolar, serta metanol p.a golongan polar. Ekstrak kasar rumput larut jenis Euchema spinosum dari pelarut heksana p.a memiliki warna kuning dan berbentuk pasta dengan berat ekstrak rata-rata sebesar 0,0180 gram. Pelarut etil asetat p.a memiliki karakteristik warna ekstrak berwarna coklat dan berbentuk pasta dengan berat ekstrak rata-rata sebesar 0,0405 gram, sedangkan pada metanol p.a warna ekstrak yang dihasilkan berwarna hijau dan berbentuk serbuk dengan berat ekstrak rata-rata sebesar 1,2604 gram. Perbedaan berat ekstrak dari masing-masing pelarut disajikan pada Gambar 11 dan untuk melihat perbedaan warna yang dihasilkan dapat dilihat pada Lampiran 6.
Gambar 11. Perbandingan Berat Ekstrak yang Dihasilkan dari Pelarut Heksana p.a, Pelarut Etil Asetat p.a, dan Metanol p.a
Metanol p.a bersifat polar dan berberat molekul rendah yang dapat membentuk ikatan hidrogen sehingga mudah bercampur dan larut dengan air sampai kelarutan yang tak terhingga (Hart, 1987 dalam Romansyah, 2011). Ikatan hidrogen yang mudah terbentuk pada larutan metanol p.a maka komponen bioaktif yang terdapat didalamnya mudah larut (Romansyah, 2011). Hasil ekstrak yang dihasilkan dapat dipengaruhi oleh berbagai faktor antara lain kondisi
alamiah senyawa tersebut, metode ekstraksi yang digunakan, ukuran partikel sampel, kondisi dan waktu penyimpanan serta perbandingan antara jumlah pelarut dan sampel (Harborne, 1987, Darusman et al., 1995, Rita et al., 2009 dalam
Sudirman, 2011).
4.4 Rendemen
Rendemen merupakan persentase perbandingan antara berat ekstrak kasar dengan berat sampel awal rumput laut. Rendemen yang dihasilkan dari masing-masing pelarut berbeda-beda. Perbandingan rendemen yang dihasilkan dari
pelarut heksana p.a, etil asetat p.a serta metanol p.a disajikan pada Gambar 12 serta perhitungan rendemen disajikan pada Lampiran 2
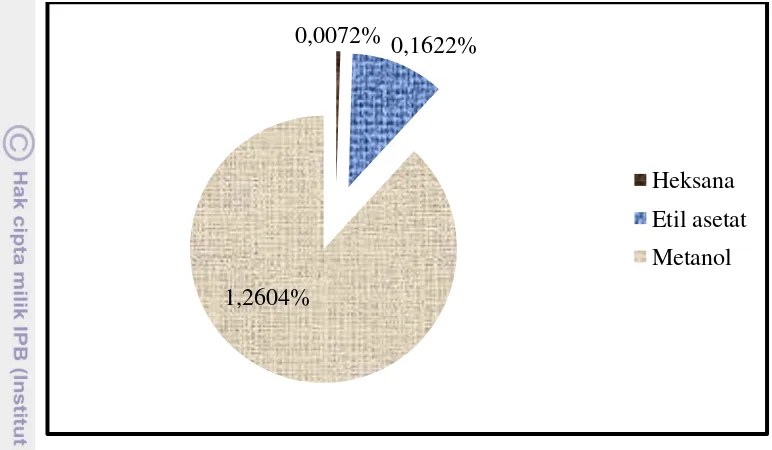
Gambar 12. Persentase Rendemen dari Pelarut Heksana p.a, Etil asetat p.a, dan Metanol p.a
Gambar 12 menunjukkan bahwa pelarut yang memiliki rendemen terbesar adalah pelarut metanol p.a, kemudian diikuti oleh etil asetat p.a, dan heksana p.a. Rendemen yang dihasilkan berkorelasi positif dengan berat ekstrak yang
dihasilkan oleh masing-masing pelarut. Semakin besar ekstrak yang dihasilkan maka rendemen yang dihasilkan juga akan semakin besar, sehingga komponen bioaktif yang dihasilkan juga semakin besar. Hal ini sesuai dengan penelitian yang dilakukan oleh Safitri (2010) dan Andriyanti (2009) yang menunjukkan bahwa berat ekstrak yang dihasilkan besar maka rendemen yang dihasilkan besar pula. Metanol p.a memiliki persentase rendemen rata-rata sebesar 1,2604%, etil asetat p.a sebesar 0,1622% dan heksana p.a sebesar 0,0072%. Nurhayati et al. (2009) menyatakan nilai rendemen yang tinggi menunjukkan komponen bioaktif yang terkandung didalamnya juga tinggi. Rendemen yang dihasilkan rumput laut relatif sedikit. Penelitian ini sejalan dengan penelitian yang dilakukan oleh
0,0072% 0,1622%
1,2604%
Suryaningrum et al. (2006) yang menyatakan bahwa rendemen yang dihasilkan oleh rumput laut relatif sedikit. Hal ini diduga dengan ketebalan thallus yang dimiliki oleh rumput laut.
4.5 Aktivitas Antioksidan
Antioksidan merupakan senyawa yang mempunyai struktur molekul yang dapat memberikan elektronnya dengan cuma-cuma kepada molekul radikal bebas tanpa terganggu fungsinya sama sekali dan dapat memutus reaksi berantai dari radikal bebas (Kumalaningsih, 2006). Uji aktivitas antioksidan dapat dilakukan dengan menggunakan metode DPPH. Metode ini dipilih karena sederhana, mudah, cepat dan peka serta hanya memerlukan sampel sedikit (Hanani et al.,
2005).
Larutan yang telah diencerkan dengan berbagai konsentrasi ditambahkan larutan DPPH. Aktivitas antioksidan dapat terlihat dari perubahan warna DPPH yaitu dari warna ungu berubah menjadi warna kuning pucat (Lampiran 6). Menurut Blois (1985) dalam Hanani et al. (2005) menyatakan bahwa senyawa antioksidan akan bereaksi dengan radikal DPPH melalui mekanisme donasi atom hidrogen dan menyebabkan terjadinya perubahan warna DPPH dari ungu menjadi ke kuning pucat yang telah diukur dengan panjang gelombang 517 nm.
Larutan yang telah diencerkan dengan berbagai konsentrasi menghasilkan nilai absorbansi yang berbeda sehingga menghasilkan persen inhibisi
(a)
(b)
(c)
Gambar 13. Hubungan Antara Konsentrasi (ppm) dengan Persen (%) Inhibisi a)Pelarut Heksana p.a, b) Pelarut Etil Asetat p.a, dan
Gambar 13 menunjukkan hubungan antara konsentrasi dengan persen (%) inhibisi yang dihasilkan. Gambar tersebut menunjukkan bahwa semakin besar konsentrasi maka akan semakin besar pula persen (%) inhibisi rata-rata yang dihasilkan. Hal ini sesuai dengan penelitian yang dilakukan oleh Hanani et al.
(2005) yang menyatakan bahwa persen (%) inhibisi akan meningkat seiring dengan konsentrasi. Larutan ekstrak heksana p.a yang diencerkan dengan berbagai konsentrasi yaitu 1000 ppm, 500 ppm, 250 ppm, serta 125 ppm. Persen (%) inhibisi rata-rata tertinggi terdapat pada larutan dengan konsentrasi 1000 ppm yaitu sebesar 14,55% dan terendah terdapat pada larutan yang berkonsentrasi 125 ppm yaitu sebesar 4,16%.
Pelarut etil asetat p.a dan metanol p.a menunjukkan hal yang serupa, yaitu persen (%) inhibisi rata-rata pelarut etil asetat p.a tertinggi terdapat pada larutan yang memiliki konsentrasi 10000 ppm yaitu sebesar 49,22% dan terendah pada larutan dengan konsentrasi 1250 ppm sebesar 13,76%. Pelarut metanol p.a larutan yang memiliki persen (%) inhibisi rata-rata tertinggi terdapat pada konsentrasi 1000 ppm yaitu sebesar 13,05% dan terendah pada larutan dengan konsentrasi 125 ppm yaitu sebesar 1,33 %.
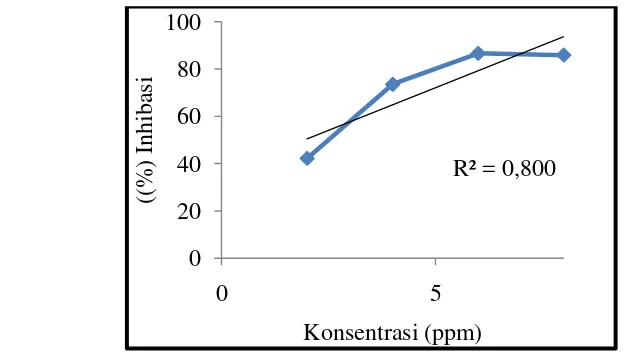
Gambar 14 dan perhitungan persen (%) inhibisi dapat dilihat pada Lampiran 5. Gambar 14 menunjukkan bahwa persentase inhibisi tertinggi terdapat pada konsentrasi pada 6 ppm sebesar 86,67% dan persen inhibisi terendah terdapat pada konsentrasi 2 ppm sebesar 42,22%.
Gambar 14. Konsentrasi Larutan Vitamin C dengan Persen (%) Inhibisi
Aktivitas antioksidan dengan menggunakan metode DPPH dapat
diinterpretasikan dengan nilai IC50. Nilai IC50 (Inhibition Concentration 50 value)
menurut Molyneux (2004) adalah konsentrasi ekstrak yang dapat menyebabkan berkurangnya 50% aktivitas DPPH. Nilai IC50 dapat dihitung dengan
menggunakan persamaan regresi linear y = a + bx. Nilai IC50 dari pelarut heksana
p.a, etil asetat p.a, dan metanol p.a berbeda-beda. Perbandingan nilai IC50
disajikan pada Gambar 15 dan perhitungan dapat dilihat pada Lampiran 5. R² = 0,800
0 20 40 60 80 100
0 5
((%)
Inhi
basi
Gambar 15. Perbandingan Nilai IC50 dari Pelarut Heksana p.a, Etil Asetat p.a,
dan Metanol p.a
Gambar 15 menunjukkan perbandingan nilai IC50 dari masing-masing jenis
pelarut dengan tingkat kepolaran yang berbeda-beda. Pelarut metanol p.a memberikan ekstrak dengan nilai IC50 yang paling kecil dibandingkan dengan
hasil dari pelarut lainnya yaitu sebesar 3351,60 ppm. Ekstrak dari pelarut heksana p.a mempunyai nilai IC50 sebesar 4199,54 ppm dan pelarut etil asetat p.a
mempunyai nilai IC50 yang terbesar yaitu 13153,33 ppm. Menurut Molyneux
(2004) nilai IC50 yang rendah mengindikasikan aktivitas antioksidan yang tinggi.
Perbandingan nilai IC50 pada ketiga jenis pelarut yang berbeda-beda menurut
tingkat kepolarannya menunjukkan bahwa pelarut metanol p.a memiliki aktivitas antioksidan yang tinggi dibandingkan dengan pelarut heksana p.a serta etil asetat p.a. Hal ini diduga karena radikal bebas DPPH dapat larut dan memberikan aborbansi maksimum pada pelarut polar yaitu metanol.
Blois (1985) dalam Molyneux (2004) menyatakan bahwa aktivitas antioksidan dapat dibagi menjadi beberapa kategori yaitu sangat kuat, kuat, sedang dan lemah. Antioksidan sangat kuat memiliki nilai IC50 kurang dari 0,05
4199,54
Heksana Etil asetat Metanol vit C
IC50
ppm
mg/ml ( <50 ppm ), antioksdian kuat memiliki nilai IC50 berada pada kisaran 0,05
– 0.1 mg/ml (50 ppm – 100 ppm) , antioksidan sedang memiliki nilai IC50 berkisar
antara 0,1 – 0,15 mg/ml (100 ppm – 150 ppm) dan antioksidan lemah memiliki kisaran 0,15 ppm hingga 0,2 ppm (150 ppm – 200 ppm). Aktivitas antioksidan yang dihasilkan oleh rumput laut segar jenis Euchema spinosum tergolong sangat lemah karena memiliki nilai IC50 lebih dari 0,2 ppm ( >200 ppm). Hal ini sesuai
dengan penelitian yang dilakukan oleh Maulida (2007) dengan melakukan uji aktivitas antioksidan dari rumput laut jenis Caulerpa lentilifera, didapat nilai IC50
sebesar 5090,39 ppm. Penelitian yang dilakukan oleh Suryaningrum et al., (2006) mendapatkan hasil yang sama yaitu aktivitas antioksidan pada rumput laut jenis
Euchema cotonii dan Halymenia harveyana tergolong lemah. Berbeda jauh dengan nilai IC50 yang dimiliki vitamin C yaitu sebesar 1,94 ppm. Nilai IC50
tersebut dalam kategori Blois (1985) dalam Molyneux (2004) termasuk dalam kategori sangat kuat karena nilai IC50 < 0,05 mg/ml (<50 ppm).
Vitamin C memiliki aktivitas antioksidan yang sangat kuat dibandingkan dengan larutan lainnya. Hal ini diduga karena dalam melakukan pengujian aktivitas antioksidan masih menggunakan ekstrak kasar. Ekstrak kasar yang digunakan masih mengandung senyawa-senyawa lain yang bukan merupakan senyawa antioksidan. Senyawa lain ikut terekstrak dalam pelarut selama proses maserasi. Senyawa-senyawa yang larut dalam pelarut dapat meningkatkan persentase rendemen ekstrak, namun hal tersebut tidak dapat meningkatkan aktivitas antioksidan. Vitamin C merupakan senyawa murni yang diduga memiliki aktivitas antioksidan yang tinggi (Safitri, 2010). Vitamin C merupakan fresh food
karena terbentuk dari glukosa (Sarfayani, 2007). Selain menggunakan vitamin C sebagai pembanding, perbandingan nilai IC50 biota uji lainnya dengan rumput laut Euchema spinosum disajikan pada Tabel 2.
Tabel 2. Nilai IC50 Biota Uji Lainnya
Biota Jenis Pelarut Sumber
Heksana p.a Etil asetat p.a Metanol p.a
Caulerpa lentilifera 91700 1015,92 356,12 Santoso (2010)
Cymodocea rotundata 5589,27 357,73 203,32
Anwariyah
Sarcophyton 4172 3952,88 2926,43
Romansyah (2010)
Euchema spinosum 4199,54 13153,33 3351,60
Tabel 2 menunjukkan bahwa masing-masing biota uji memiliki aktivitas antioksidan tertinggi pada pelarut metanol p.a. Namun, rumput laut jenis Euchema spinosum memiliki nilai IC50 pada pelarut metanol p.a lebih tinggi dibandingkan
dengan biota uji lainnya. Hal ini membuktikan aktivitas antioksidan rumput laut
Euchema spinosum sangat lemah dibandingkan dengan biota uji lainnya. Nilai IC50 pada pelarut heksana p.a rumput laut Euchema spinosum relatif rendah
dibandingkan dengan biota uji lainnya, sehingga pelarut heksana p.a memiliki aktivitas antioksidan relatif kuat. Namun, pada pelarut etil asetat p.a nilai IC50
rumput laut Euchema spinosum sangat tinggi. Aktivitas antioksidan rumput laut
Euchema spinosum pada pelarut etil asetat p.a tergolong sangat lemah jika dibandingkan dengan biota uji lainnya. Hal ini diduga kandungan senyawa alamiah dari masing-masing biota uji berbeda-beda.
yang terdapat di rumput laut Euchema spinosum didugabersifat polar. Hal ini sesuai dengan Harborne (1987) dalam Anwariyah (2011) yang menyatakan bahwa tumbuhan mngandung banyak fenol dan senyawa ini memiliki sifat yang
44
5.1 Kesimpulan
Rumput laut memiliki kandungan gizi yaitu kadar air sebesar 84,47%, kadar abu sebesar 6,12%, kadar lemak sebesar 0,39%, kadar protein 1,12% serta
karbohidrat sebesar 7,9%. Berat ekstrak dan rendemen tertinggi dihasilkan
pelarut metanol p.a. Berat ekstrak dan rendemen metanol p.a sebesar 1,2640% dan 1,2604%. Heksana p.a memiliki berat ekstrak dan rendemen sebesar 0,0180% dan 0,0072% sedangkan bobot ekstrak dan rendemen yang dihasilkan pelarut etil
asetat p.a sebesar 0,0405% dan 0,1622%.
Nilai IC50 masing-masing pelarut yaitu pelarut heksana p.a sebesar 4199,54
ppm, etil asetat 13153,33 ppm serta metanol p.a 3351,60 ppm. Aktivitas
antioksidantertinggi pada pelarut metanol p.a dan terendah pada pelarut etil asetat p.a. Aktivitas antioksidan pada rumput laut Euchema spinosum tergolong sangat lemah. Vitamin C memiliki nilai IC50 sebesar 1,94 ppm dan tergolong sangat kuat.
5.2 Saran
Saran yang dapat diberikan untuk penelitian selanjutnya adalah
45
Ahdyanti, S. 2009. Evaluasi Aktivitas Antioksidan Dengan Penentuan Bilangan Peroksida dan Analsisis Fitokimia Anggur Laut (Caulerpa racemosa) [Skripsi]. Departemen Teknologi Hasil Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor.
Amornlerdipson, D., Peerapornpisal, Y., Taesotikul, T., Jamjai, U., Nualchareo, M., dan Kanjanapothi, D. 2007. Antioxidant Activity of Padina minor
YAMADA. KMITL Sci. Tech. J. 7 (S1): 1-7.
Anggadierdja, J. T., Zatnika, A., Purwoto, H., dan Istini, S. 2006. Rumput Laut. Swadaya. Depok. Indonesia.
Anindia, I. H. 2010. Pengaruh Pengayaan Bahan Organik Terhadap Laju Pertumbuhan Rumput Laut Euchema denticulatum (Burman, 1978) [Skripsi]. Departemen Ilmu dan Teknologi Kelautan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor.
Anwariyah, S. 2011.Kandungan Fenol, Komponen Kimia, dan Aktivitas Antioksidan Lamun. Cymodocea rotundata [Skripsi]. Departemen Teknologi Hasil Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor.
Apriyani, D. 2006. Studi Hubungan Karakteristik Habitat Terhadap Kelayakan Pertumbuhan dan Kandungan KaragenanAlga Euchema spinosum di Perairan Kecamatan Bluto Kabupaten Sumenep [Tesis]. Program Pasca Sarjana. Institut Pertanian Bogor. Bogor.
Apriandi, A. 2011. Aktivitas Antioksidan dan Komponen Bioaktif Keong Ipong Ipong (Fasciolaria salmo.) [Skripsi]. Departemen Teknologi Hasil
Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor.
Aslan, L. M. 1998. Budidaya Rumput Laut. Kanisius. Yogyakarta. Indonesia. Association of Official Analytical Chemist. 2005. Official Method of Analysis of
Official Analytical of Chemist. The Association of Official Analytical Chemist, Inc. Arlington.
Atmadja, W. S., Kadi, A., Sulistijo, Rachmaniar. 1996. Pengenalan Jenis Jenis Rumput Laut Indonesia. Puslitbang Oseanologi-LIPI. Jakarta. Indonesia. Azka, A. 2009. Aktivitas Antioksidan dan Komponen Bioaktif Pada Semanggi
Dwihandita, N. 2009. Perubahan Kandungan Antioksidan Anggur Laut (Caulerpa racemosa) Akibat Pengolahan [Skripsi]. Departemen Teknologi Hasil Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor.
Gardjito, M., Naruki, S., Murdiati, A., dan Sardjono. 1992. Ilmu Pangan Pengantar Ilmu Pangan, Nutrisi, dan Mikrobiologi. Gadjah Mada University Press. Yogyakarta. Indonesia.
Hanani, E., Mun’im, A., dan Sekarini, R. 2005. Identifikasi Senyawa Antioksidan dalam Spons Callyspongia sp. dari Kepulauan Seribu. Ilmu Kefarmasian. 2(3): 127-133.
Kumalaningsih, S. 2006. Antioksidan Alami.Turubus Anggisarana. Surabaya. Indonesia.
Molyneux, P. 2004. The Use of the Stable Free Radical dyphenylpicrylhydrazil
(DPPH) for Estmating Antoxidant Activity of Two Seaweeds Technology.
Songklanakarin J. Sci. Technol. 26 (2) : 211 – 219.
Nurhayati, T., Aryanti, D., dan Nurjanah. 2009. Kajian Awal Potensi Ekstrak Spons Sebagai Antioksidan. Jurnal Kelautan Nasional. 2: 43 – 51. Poncomulyo, T. 2006. Budidaya dan Pengolahan Rumput Laut. Agro Media
Pustaka. Jakarta. Indonesia.
Rachmawati, R., Defiani, M. R., dan Suriyani, N. L. 2009. Pengaruh Suhu dan Lama Penyimpanan Terhadap Kandungan Vitamin C pada Cabai Rawit Putih (Capsicum frustescens). Biologi. XII (2) : 36 – 40.
Romansyah, Y. 2011.Kandungan Senyawa Bioaktif Antioksidan Karang Lunak
Sarcophyton sp. Alami dan Transplantasi di Perairan Pulau Pramuka, Kepulauan Seribu [ Skripsi]. Departemen Ilmu dan Teknologi Kelautan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor. Rumiantin, R. O. 2011.Kandungan Fenol, Komponen Kimia, dan Aktivitas
Antioksidan Lamun Enhalus acoroides [Skripsi]. Departemen Teknologi Hasil Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor.
Safaryani, N. Haryanti, S., dan Astuti, E. D. 2007. Pengaruh Suhu dan Lama Penyimpanan terhadap Penurunan Kadar Vitamin C Brokoli (Brassica oleracea ). Anatomi dan Fisiologi. XV(2) : 39 – 45.
Salazar-Aranda, R., Pérez-Lόpez, L. A., Lόpez-Arroyo, J, Alanis-Garza, B. A., dan de Torres, N. W. 2009. Antimicrobial and Antoxidant Activities of Plants from Northeast of Mexico. Evidence-Based Complementary and Alternative Medicine. 2011(536139) : 1 – 6.
Santoso, J., Maulida, R., dan Suseno, S. H. 2006. Aktivitas Antioksidan Ekstrak Metanol, Etil Asetat, dan Heksana Rumput Laut Hijau Caulerpa
lentillifera. Ilmu Kelautan. 1 : 1-10.
Sudirman, S. 2011. Aktivitas Antioksidan dan Komponen Bioaktif Kangkung Air (Ipomea aquatic Forsk) [Skripsi]. Departemen Teknologi Hasil Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor. Suryaningrum, D., Wikanta, T., dan Kristiana, H. 2006. Uji Senyawa Antioksidan
dari Rumput Laut Halymenia harveyana dan Euchema cottonii.
Pascapanen dan Bioteknologi Kelautan dan Perikanan. 1 (1) : 51-63. Tamat, S. R., Wikanta, T., dan Maulina, L. S. 2007. Aktivitas Antioksidan dan
Senyawa Toksisitas Senyawa Bioaktif dari Ekstrak Rumput Laut Hijau
Ulva reticulata FORSSKAL. Ilmu kefarmasian Indonesia. 5(1): 31-36. Tapan, E. 2005. Kanker, Antioksidan, dan Terapi Komplementer. PT Elex Media
Komputindo. Jakarta. Indonesia.
Winarno. F. G. 2008. Kimia Pangan dan Gizi. M-Brio Press. Bogor. Indonesia. Winarsih, H. 2007. Antioksidan Alami dan Radikal Bebas Potensi dan
Aplikasinya dalam Kesehatan. Kanisius. Yogyakarta. Indonesia.
Yunizal, Murtini, J. T., Dolaria, N. Prudiwoto, B., Abdurokhmin, Carkipan. 1998. Prosedur Analisis Kimiawi Ikan dan Produk Olahan Hasil-Hasil
39
Lampiran 2. Perhitungan Persentase Rendemen
Pengukuran hasil ekstrak kasar heksana p,a
Hasil ekstrak kasar heksana p.a
Ulangan 1 (gram) Ulangan 2 (gram)
Berat awal sampel 25 25
Berat botol 11,5422 8,8354
Berat botol + ekstrak 11,5452 8,836
Berat ekstrak 0,003 0,0006
% Rendemen ulangan 1 = 0,003
25 � 100% = 0,012%
% Rendemen ulangan 2 = 0,0006
25 � 100% = 0,0024%
% Rendemen rata-rata = 0,012+0,0024 %
2 = 0,0072%
Pengukuran hasil ekstrak kasar etil asetat p.a
Hasil ekstrak kasar etil asetat p.a
Ulangan 1 (gram) Ulangan 2 (gram)
Berat awal sampel 25 25
Berat botol 11,8864 10,4758
Berat botol + ekstrak 11,9241 10,5192
Berat ekstrak 0,0377 0,0434
% Rendemen ulangan 1 = 0,0377
25 � 100% = 0,1508%
% Rendemen ulangan 2 = 0,0434
25 � 100% = 0,1736%
% Rendemen rata-rata = 0,1508 +0,1736 %
Pengukuran hasil ekstrak kasar metanol p.a
Hasil ekstrak kasar metanol p.a
Ulangan 1 (gram) Ulangan 2 (gram)
Berat awal sampel 25 25
Berat botol 9,9643 9,9960
Berat botol + ekstrak 10,4460 10,1445
Berat ekstrak 0,4817 0,1485
% Rendemen ulangan 1 = 0,4817
25 � 100% = 1,9268%
% Rendemen ulangan 2 = 0,1485
25 � 100% = 0,5940%
% Rendemen rata-rata = 1,9268+0,5940 %
2 = 1,2604%
Lampiran 3. Pembuatan Larutan Stok Ekstrak Heksana p.a, Etil Asetat p.a, Metanol p.a dan Vitamin C
a. Larutan stok heksana p.a 1000 ppm
1000 mg/L = 0,0006 gram
Larutan ekstrak sebanyak 0,0006 gram dilarutkan dalam 0,1 ml dimethyl sulfoxide
dan 0,5 ml etanol p,a
b. Larutan stok etil asetat p.a 10000 ppm
10,000 mg/L = 0,0377 gram
Larutan ekstrak sebanyak 0,0377 gram dilarutkan dalam 0,1 ml dimethyl sulfoxide
dan 3,67 ml etanol p,a
c. Larutan stok metanol p.a 2000 ppm
2000 mg/L = 0,0038 gram
Larutan ekstrak sebanyak 0,0038 gram dilarutkan dalam 0,1 ml dimethyl sulfoxide
d. Larutan stok vitamin C
Standar vitamin C 80 ppm sebanyak 40 mg diambil 0,5 mg kemudian ditambahkan etanol 12,5 ml
Lampiran 4. Perhitungan Pengenceran Stok Heksana p.a, Etil Asetat p.a, dan Metanol p.a
a. Pengenceran stok larutan ekstrak heksana p.a
Ektrak 500 ppm = V1x M1 = V2 x M2
= V1 x 1000 ppm = 0,1 ml x 500 ppm
= (0,1 ml x 500 ppm )
1000 ppm = 0,05 ml
Larutan ektrak sebanyak 0,05 ml 1000 ppm ditambahkan larutan etanol p.a hingga mencapai 0,1 ml
Ekstrak 250 ppm = V1 x M1 = V2 x M2
= V1 x 1000 = 0,1 ml x 250 ppm
= (0,1 ml x250 ppm )
1000 ppm = 0,025 ml
Larutan ekstrak sebanyak 0,025 ml 1000 ppm ditambahkan larutan etanol p.a hingga mencapai 0,1 ml
Ekstrak 125 ppm = V1 x M1 = V2 x M2
= V1 x 1000 = 0,1 ml x 125 ppm
= (0,1 ml x125 ppm )
1000 ppm = 0,0125 ml
Larutan ekstrak sebanyak 0,0125 ml 1000 ppm ditambahkan larutan etanol p.a hingga mencapai 0,1 ml
b. Pengenceran stok larutan ekstrak etil asetat p.a
Ekstrak 5000 ppm = V1 x N1 = V2 x N2
= 5000 ppm x 0,1 ml
10000 ppm = 0,05 ml
Larutan ekstrak sebanyak 0,05 ml 10000 ppm ditambahkan larutan etanol p.ahingga mencapai 0,1 ml
Ekstrak 2500 ppm = V1 x N1 = V2 x N2
= V1 X 10000 = 0,1 x 2500
= 2500 ppm x 0,1 ml
10000 ppm = 0,025 ml
Larutan ekstrak sebanyak 0,025 ml 10000 ppm ditambahkan larutan etanol p.a hingga mencapai 0,1 ml
Ekstrak 1250 ppm = V1 x N1 = V2 x N2
= V1 X 10000 = 0,1 x 1250
= 1250 ppm x 0,1 ml
10000 ppm = 0,0125 ml
Larutan ekstrak sebanyak 0,0125 ml 10000 ppm ditambahkan larutan etanol p.a hingga mencapai 0,1ml
c. Pengenceran stok larutan ekstrak metanol p.a 2000 ppm
Ekstrak 1000 ppm = V1 x N1 = V2 x N2
= V1 X 2000 = 0,1 x 1000
= 1000 ppm x 0,1 ml
2000 ppm = 0,05 ml
Larutan ekstrak sebanyak 0,05 ml 2000 ppm ditambahkan larutan etanol p.a hingga mencapai 0,1 ml
Ekstrak 500 ppm = V1 x N1 = V2 x N2
= V1 X 2000 = 0,1 x 500
= 500 ppm x 0,1 ml
Larutan ekstrak sebanyak 0,025 ml 2000 ppm ditambahkan larutan etanol p.a
Larutan ekstrak sebanyak 0,0125 ml 2000 ppm ditambahkan larutan etanol p.a hingga mencapai 0,1 ml
Ekstrak 125 ppm = V1 x N1 = V2 x N2
= V1 X 2000 = 0,1 x 250
= 125 ppm x 0,1 ml
2000 ppm = 0,00625 ml
Larutan ekstrak sebanyak 0,00625 ml 2000 ppm ditambahkan larutan etanol p.a hingga mencapai 0,1 ml
Lampiran 5. Perhitungan Persen Inhibisi dan IC50
b. Persen inhibisi dan IC50 pada larutan ekstrak etil asetat p.a Rata-rata persen (%) inhibisi dan nilai IC50
5000 ppm= 0,447−0,321
c. Persen inhibisi dan IC50 pada larutan ekstrak metanol p.a
Sampel Konsentrasi
Rata-rata persen (%) inhibisi dan nilai IC50
500 ppm = 0,452−0,429
d. Persen inhibisi dan IC50 pada vitamin C
6ppm = 0,405−0,054
0,405 x 100% = 86,6667%
8 ppm = 0,405−0,057
0,444 x 100% = 85,9259%
IC50
y = 7,209x + 36,04 50 = 7,209x + 36,04 50 – 36,04 = 7,209x x = 1,94 ppm
Lampiran 6. Foto Penelitian
Gambar 16. Maserasi Heksana p.a Gambar 17. Maserasi Etil Asetat p.a
Gambar 20. Proses Evaporasi Gambar 21. Ekstrak Heksana p,a
Gambar 22. Ekstrak Etil asetat p.a Gambar 23. Ekstrak Metanol p.a
Gambar 24. Larutan Stok DPPH Gambar 25. Hasil Uji DPPH
1
1.1 Latar Belakang
Perkembangan industri pada saat ini semakin meningkat dan menimbulkan dampak negatif maupun positif. Salah satu dampak negatif dari perkembangan industri adalah pencemaran. Pencemaran adalah salah satu pemicu terbentuknya radikal bebas yang dapat masuk melalui pernapasan maupun makanan. Radikal bebas merupakan atom atau molekul yang kehilangan pasangan elektron
dipermukaan kulit luarnya (Kumalaningsih, 2006). Radikal bebas sangat reaktif dan mudah bereaksi dengan molekul-molekul lainnya antara lain protein, lemak, karbohidrat, dan DNA. Radikal bebas dapat menimbulkan berbagai macam penyakit antara lain penyakit jantung koroner, penyakit kanker, penyakit katarak, penyakit degeneratif dan proses penuaan. Radikal bebas dapat dicegah dengan senyawa antioksidan.
Fungsi antioksidan adalah menetralisir radikal bebas sehingga tubuh akan terlindung dari berbagai penyakit yang ditimbulkan oleh radikal bebas (Tapan, 2005). Antioksidan ada yang dihasilkan oleh tubuh sendiri (endogenous) berupa enzim ataupun yang berasal dari buah-buahan dan sayuran (eksogenous). Selain itu, terdapat antioksidan sintetik yang biasa digunakan dalam bahan pangan antara lain butylated hydroxyanisol (BHA), butylated hydroxytoluene (BHT) dan