Lampiran 1. Denah Percobaan Rancangan Acak Lengkap (RAL)
Ulangan 1 Ulangan 2 Ulangan 3
Keterangan :
T : Tanpa penambahan bahan pewarna (kontrol) A : Pemberian tepung Astaxanthin 3%
W : Pemberian tepung Wortel 3% S : Pemberian tepung Spirulina 3%
T
W
S S
A
A
S
W
T
A W
Lampiran 2. Perhitungan Pakan
Berat ikan per ekor = 8,25 gram Jumlah ikan per akuarium = 5 ekor
Biomasa ikan per akuarium = 5 x 8,25 gram = 41,25 gram Takari 5% dari berat ikan = 5% x 41,25 gram
= 2,06 gram
Takari selama penelitian = Jumlah Takari x Ulangan x 30 Hari = 2,06 gram x 3 x 30
= 185,4 gram
Progol = 3 gram/kg pakan
Air = 150 ml/kg pakan
Perlakuan Kontrol
Takari = 185,4 gram
Bahan Perlakuan = 0
Progol = 0
Lampiran 2. Lanjutan
Perlakuan Wortel, Spirulina dan Astaxanthin
Lampiran 3. Daftar Panelis Penilai Warna Ikan
No Nama Keterangan
Lampiran 4. Gambar Ikan Patokan Penilaian
Ikan Nilai Keterangan
1 Suram
2 Kurang Suram
3 Biasa
4 Kurang Cerah
Lampiran 5. Perubahan Warna Ikan Koi Pada Perlakuan T
Warna Pengamatan (Hari Ke-)
30 20
10 0
Universitas
Sumatera
Lampiran 6. Perubahan Warna Ikan Koi Pada Perlakuan W
Warna Pengamatan (Hari Ke-)
30 20
10 0
Universitas
Sumatera
Lampiran 7. Perubahan Warna Ikan Koi Pada Perlakuan S
Warna Pengamatan (Hari Ke-)
30 20
10 0
Universitas
Sumatera
Lampiran 8. Perubahan Warna Ikan Koi Pada Perlakuan A
Warna Pengamatan (Hari Ke-)
30 20
10 0
Universitas
Sumatera
Lampiran 9. Lanjutan
Tabel Anova
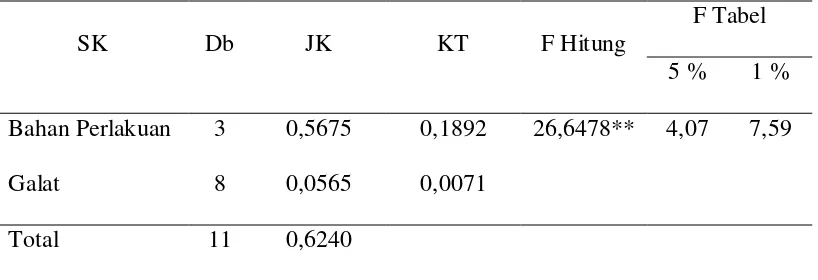
Hasil analisis sidik ragam pengaruh penambahan berbagai sumber beta karoten alami dalam pakan terhadap peningkatan kecerahan warna ikan koi.
SK Db JK KT F Hitung
F Tabel 5 % 1 % Bahan Perlakuan 3 0,5675 0,1892 26,6478** 4,07 7,59
Galat 8 0,0565 0,0071
Total 11 0,6240
Keterangan : ** = Sangat Nyata
KK = √KTG
ŷ x 100 %
= √0,0071
0,6800 x 100 %
= 0,0843
0,6800 x 100 %
Lampiran 10. Uji Lanjutan Beda Nyata Terkecil
Untuk membuktikan tingkat beda nyata perlakuan dengan perubahan warna, maka dilakukan uji lanjutan dengan menggunakan uji Beda Nyata Terkecil (Least Significant Different = LSD).
BNT α = tα . DbG .
�
(��������)�
BNT 0,01 = t x 0,01 x 8 x �(2 x 0,0071) 3
= 3,355 x �0,00473 = 3,355 x 0,069 = 0,232
BNT 0,05 = t x 0,05 x 8 x
�
(2 x 0,0071)3
= 2,306 x �0,00473 = 2,306 x 0,069 = 0,159
Keterangan :
• p > 0,01 = Beda sangat nyata (**) • p > 0,05 = Beda nyata (*)
Lampiran 10. Lanjutan
Perlakuan Rerata
T 0,36
W 0,68
S 0,71
A 0,97
P1 = W – T = 0,68 – 0,36 = 0,32 ** P2 = S – T
= 0,71 – 0,36 = 0,35 ** P3 = A – T
= 0,97 – 0,36 = 0,61 ** P4 = S – W
= 0,71 – 0,68 = 0,03 P5 = A - W
= 0,97 – 0,68 = 0,29 ** P6 = A – S
Lampiran 11. Lanjutan
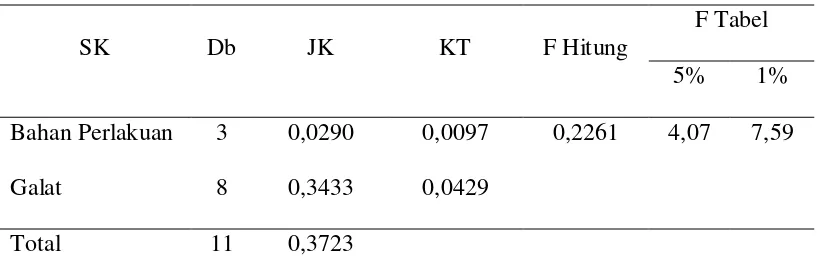
Tabel Anova
Hasil analisis sidik ragam pengaruh berbagai sumber beta karoten alami terhadap panjang ikan koi.
SK Db JK KT F Hitung
F Tabel
5% 1%
Bahan Perlakuan 3 0,0290 0,0097 0,2261 4,07 7,59
Galat 8 0,3433 0,0429
Total 11 0,3723
Lampiran 12. Lanjutan
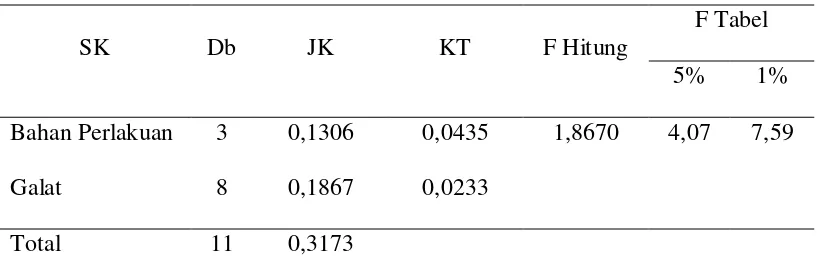
Tabel Anova
Hasil analisis sidik ragam pengaruh berbagai sumber beta karoten alami terhadap panjang ikan koi.
SK Db JK KT F Hitung
F Tabel
5% 1%
Bahan Perlakuan 3 0,1306 0,0435 1,8670 4,07 7,59
Galat 8 0,1867 0,0233
Total 11 0,3173
Lampiran 13. Dokumentasi Kegiatan Penelitian
1. Bak Tandon 2. Ember Penampung
3. Media Pemeliharaan 4. Penyifonan
Lampiran 13. Lanjutan
7. Pemberian Pakan 8. Penilaian Oleh Panelis
DAFTAR PUSTAKA
Abdullah, M. 2012. Mutu Bersandar Pakan. Trubus No.508, Maret 2012. Alex, S. 2009. Budidaya Ikan Koi. Pustaka Baru Press. Yogyakarta.
Amin, M.I., Rosidah dan W. Lili. 2012. Peningkatan Kecerahan Warna Udang Red Cherry (Neocaridina heteropoda) Jantan Melalui Pemberian Astaxanthin Dan Canthaxanthin Dalam Pakan. Jurnal Perikanan dan Kelautan. Vol.3 No.4: 243-252.
Anggawati, A. 2012. Mutu Bersandar Pakan. Trubus No.508, Maret 2012.
Barrows, F.T dan R.W. Hardy. 2001. Nutrition and Feeding. In: Wedemeyer, G. Fish Hatchery Management. Second Edition. American Fisheries Society. Bethesda. Maryland. pp 483-558.
Barus, R.S. 2014. Pengaruh Konsentrasi Tepung Spirulina platensis pada Pakan Terhadap Peningkatan Warna Ikan Maskoki (Carassius auratus). Skripsi. Fakultas Pertanian. Universitas Sumatera Utara.
Cahyono, B. 2000. Budidaya Ikan Di Perairan Umum. Kanisius. Yogyakarta. Daelami, D. 2000. Usaha Pembenihan Ikan Hias Air Tawar. Penebar Swadaya.
Jakarta.
Effendie. 1979. Metode Biologi Perikanan. Yayasan Dewi Sri. Bogor. Effendy, H. 1993. Mengenal Beberapa Jenis Koi.Kanisius. Yogyakarta. Evan, D.H. 1993. The Physiology of Fishes. CCR Press. London.
Fretes, H.D., A.B. Susanto, B. Prasetyo dan L.Limantara. 2012. Karotenoid Dari Mikroalgae Dan Mikroalgae: Potensi Kesehatan Aplikasi Dan Bioteknologi. Jurnal Teknologi dan Industri Pangan. Universitas Kristen Satya Wacana, Salatiga.
Fuji, R. 1993. Coloration and Chromatophore. The Physiology of Fish. CRC Press. Inc. United States America. Vol. 17. p:536-561.
Gupta, S.K. dan A.K. Jha. 2006. Use of Natural Carotenoids for Pigmentation in Fishes. Central Institute of Fisheries Education. India.
Hanafiah, K. A. 2007. Rancangan Percobaan. Raja Grafindo Persada. Jakarta. Hariyati, R. 2008. Pertumbuhan dan Biomassa Spirulina sp. Dalam Skala
Laboratoris. Universitas Diponegoro. Semarang.
http://www.wikipedia.com. 2009. (Diakses pada 10 Juli 2014).
Ikawati, R. 2005. Optimasi Kondisi Ekstraksi Karotenoid Wortel (Daucus carota L.) Menggunakan Response Surface Methodology (RSM). Jurnal Teknologi Pertanian. Universitas Mulawarman. Samarinda.
Irianto, A. 2005. Patologi Ikan Teleostei. Gadjah Mada University Press. Yogyakarta.
Jangkaru, Z. 2002. Pembesaran Ikan Air Tawar di Berbagai Lingkungan Pemeliharaan. Cetakan Ketujuh. Penebar Swadaya. Jakarta.
Khairyah, U., L. Nurhamida, S. Arif, W.G. Alif dan A. Ratnaningtyas. 2010. Pengkayaan Beta Karoten Pada Daphnia sp. Untuk Meningkatkan Kecerahan Warna Dan Tingkat Kematangan Gonad Pada Ikan Cupang (Betta sp.). Usulan Program Kreatifitas Mahasiswa. Universitas Airlangga. Kurniawati, Iskandar dan U. Subhan. 2012. Pengaruh Penambahan Tepung
Spirulina platensis Pada Pakan Terhadap Peningkatan Warna Lobster Air Tawar Huna Merah (Cherax quadricarinatus). Jurnal Perikanan dan Kelautan. ISSN:2088-3137.
Layam, S. dan L.K.R. Chandra, 2007. Antidiabetic Property of Spirulina. Departement of Food Science and Nutrition. India.
Lesmana, D.S. 2002. Agar Ikan Hias Cemerlang. Penebar Swadaya. Jakarta. Lesmana, D.S. 2007. Budidaya Ikan Hias Air Tawar Populer. Penebar Swadaya.
Jakarta.
Lesmana. D.S. 2009. Merawat Ikan Hias Di Rumah. Penebar Swadaya. Jakarta. Liviawaty, E. dan A. Eddy. 1990. Maskoki, Budidaya dan Pemasarannya.
Mahasri, G., L. Wulandari dan Kismiyati. 2011. Perubahan Histopatologi Kulit Ikan Koi (Cyprinus carpio) yang Terinfestasi Ichthyophthirius multifiliis Secara Kohabitasi. Jurnal Ilmiah Perikanan dan Kelautan. Vol.3, No.1. Maulid, M.A. 2011. Penambahan Karotenoid Total dari Bakteri Fotosintetik
Anoksigenik pada pakan untuk Perbaikan Penampilan Ikan Pelangi Meran (Glossolepis insicus) Jantan. Skripsi. Fakultas Perikanan dan Ilmu Kelautan. Universitas Padjajaran.
Mc Coy, M. 1999. Astaxanthin Market A Hard One To Crack. Chem and Eng News. USA.
Munifah, I. dan W. Thamrin. 2008. Astaxanthin: Senyawa Antioksidan Karoten Bersumber dari Biota Laut. Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan.
Naguib, Y.M.A. 2000. Antioxidant Activities of Astaxanthin and Related Carotenoids. Journal of Agricultural Chemicals.
Nurmatias. 2008. Tingkat Efisiensi Beberapa Pakan Buatan Terhadap Pertumbuhan Udang Galah. Sekolah Tinggi Keluatan dan Perikanan Indonesia. Lubuk Pakam. Tidak Diterbitkan.
Oryza, O. 2010. Astaxanthin Natural Antioxidant for Neuro-protection, Vision Enhancement and Skin Rejuvenation. Chemical Co Ltd., Japan.
Pinandoyo. 2005. Pengaruh Berbagai Kadar Caropyll pink Dan Tepung Wortel Dalam Pakan Buatan Terhadap Kecerahan Warna Ikan Oscar (Astronotus
ocellatus Cuvier). Fakultas Perikanan dan Ilmu Kelautan, Universitas
Diponegoro. Semarang.
Pohan, R.A. 2008. Analisis Usaha Tani dan Faktor-Faktor Yang Mempengaruhi Pendapatan Petani Wortel. Skripsi. Universitas Sumatera Utara. Medan. Prasetya, N., S. Subekti dan Kismiyati. 2013. Prevalensi Ektoparasit Yang
Menyerang Benih Ikan Koi (Cyprinus carpio) Di Bursa Ikan Hias Surabaya. Jurnal Ilmiah Perikanan dan Kelautan. Universitas Airlangga. Vol. 5 No.1.
Prayogo, H.H., R. Rostika dan I. Nuruhwaty. 2012. Pengkayaan Pakan Yang Mengandung Maggot dengan Tepung Kepala Udang Sebagai Sumber Karotenoid Terhadap Penampilan Warna dan Pertumbuhan Benih Rainbow Kurumoi (Melanotaenia parva). Jurnal Perikanan dan Kelautan. 3(3): 201-205.
Sari, I.P. dan M. Abdul. 2012. Pola Pertumbuhan Nannochloropsis oculata Pada Kultur Skala Laboratorium, Intermediet dan Massal. Jurnal Ilmiah Perikanan dan Kelautan. Vol. 4 No.2.
Sari, N.P., L. Santoso dan S. Hudaidah. 2012. Pengaruh Penambahan Tepung Kepala Udang Dalam Pakan Terhadap Pigmentasi Ikan Koi (Cyprinus carpio) Jenis Kohaku. e-Jurnal Rekayasa dan Teknologi Budidaya Perairan. Vol.1, No.1. ISSN: 2302-3600.
Sasson, A. 1991. Culture of Microalgae in Achievement and Evaluation. United Nation Educational, Scientific and Cultural Organitation (UNESCO) Place de Pontenry, Paris. France. 104p.
Satyani, D dan S. Sugito. 1997. Astaxanthin Sebagai Suplemen Pakan untuk Peningkatan Warna Ikan Hias. Warta Penelitian Perikanan Indonesia. Vol.8. Instalasi Penelitian Perikanan Depok. Jakarta.
Setiawati, J.E., Y.T. Tarsim, Adiputra dan S. Hudaidah. 2013. Pengaruh Penambahan Probiotik Pada Pakan Dengan Dosis Berbeda Terhadap Pertumbuhan, Kelulushidupan, Efisiensi Pakan dan Retensi Protein Ikan Patin (Pangasius hypophthalmus). e-Jurnal Rekayasa dan Teknologi Budidaya Perairan. Vol.1 No.2. ISSN: 2302-3600.
Setiawati, M. dan M.A. Suprayudi. 2003. Pertumbuhan dan Efisiensi Pakan Ikan Nila Merah (Oreochromis sp.) Yang Dipelihara Pada Media Bersalinitas. Jurnal Akuakultur Indonesia. 2(1): 27-30.
Setiawati, M., R. Sutajaya dan M.A. Suprayudi. 2008. Pengaruh Perbedaan Kadar Protein dan Rasio Energi Protein Pakan Terhadap Kinerja Pertumbuhan Fingerlings Ikan Mas (Cyprinus carpio). Jurnal Akuakultur Indonesia. 7(2): 171-178.
Sholichin, I., K. Haetami dan H. Suherman. 2012. Pengaruh Penambahan Tepung Rebon Pada Pakan Buatan Terhadap Nilai Chroma Ikan Mas Koki (Carassius auratus). Jurnal Perikanan dan Kelautan. Universitas Padjadjaran. Vol.3, No.4: 185-190.
Sribudiono. 2012. Mutu Bersandar Pakan. Trubus No.508, Maret 2012.
Subamia, I.W., B. Nur, A. Musa dan R.V. Kusumah. 2010a. Pemanfaatan Maggot Yang Diperkaya Dengan Zat Pemicu Warna Sebagai Pakan Untuk Peningkatan Kualitas Warna Ikan Hias Rainbow (Melanotaenia boesemani) Asli Papua. Balai Riset Ikan Hias, Depok.
Suharyanto. 2011. Spirullina platensis. http://databaseartikel.com/pendidikan/201112977-Spirullina-sp-sebagai pakan-alami.html. 1 hal. (Diakses pada 19 Juli 2014).
Sunarno, M.T.D. 2012. Mutu Bersandar Pakan. Trubus No.508, Maret 2012. Susanto, H. 2000. Koi. Penebar Swadaya. Jakarta.
Susanto, H. 2002. Mengubah Lahan Kritis Menjadi Kolam Produktif. Penebar Swadaya. Jakarta.
Trubus. 2012. Gudang Koi Juara dan Hobiis Fanatik. Trubus. No.508. Twigg, D. 2013. Buku Pintar Koi. Gramedia Pustaka Utama. Jakarta.
Utami, D.A.T., Y. Aida dan F.S. Pranata. 2013. Variasi Kombinasi Tepung Labu Kuning (Cucurbita moschata D.) dan Tepung Azolla (Azolla piñata R.br.) Pada Kecerahan Warna Ikan Koi (Cyprinus carpio L.). Jurnal. Universitas Atma Jaya. Yogyakarta.
Utomo, N.B.P., O. Carman dan N. Fitriyati. 2006. Pengaruh Penambahan Spirulina platensis Dengan Kadar Berbeda Pada Pakan Terhadap Tingkat Intensitas Warna Merah Pada Ikan Koi Kohaku (Cyprinus carpio L.). Jurnal Akuakultur Indonesia. Institut Pertanian Bogor.
Wayan, S. 2010. Peningkatan Warna Ikan Rainbow Merah (Glossolepis incises) Melalui Pengkayaan Karotenoid Tepung Kepala Udang dalam Pakan. Jurnal Iktiologi Indonesia. 10 (1) : 1-9.
Winarti, S., U. Sarofa dan D. Anggrahini. 2008. Ekstraksi Dan Stabilitas Warna Ubi Jalar Ungu (Ipomoea batatas L.) Sebagai Pewarna Alami. Jurnal Teknik Kimia, Vol.3, No.1.
Wisnu. 2012. Mutu Bersandar Pakan. Trubus. No. 508.
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan November-Desember 2014, di Pusat Informasi dan Pengembangan Ikan Hias Dinas Pertanian dan Kelautan Kota Medan, Jl. Karya Wisata, Kecamatan Medan Johor, Provinsi Sumatera Utara.
Alat dan Bahan Penelitian
Alat-alat yang digunakan dalam penelitian ini antara lain 12 unit akuarium ukuran 40 cm x 20 cm x 20 cm sebagai wadah pemeliharaan, aerator untuk menyuplai oksigen dalam media, pH meter untuk mengukur kadar asam dan basa media uji, DO meter untuk mengukur kandungan oksigen, termometer untuk mengukur suhu, timbangan digital untuk mengukur berat ikan, selang sifon untuk membuang sisa metabolisme (menjaga kualitas air), serok untuk menangkap ikan uji, alat tulis, kamera digital untuk dokumentasi dan lain-lain.
Bahan-bahan yang digunakan dalam penelitian ini adalah ikan koi ukuran panjang ± 9 cm sebanyak 60 ekor, air bersih, astaxanthin, tepung wortel, spirulina, pakan buatan berupa pelet ikan hias, progol untuk perekat bahan pewarna alami pada pakan dan lain-lain.
Rancangan Percobaan
1. Perlakuan T : Tanpa pemberian bahan pewarna (kontrol) 2. Perlakuan A : Pemberian tepung astaxanthin 3%
3. Perlakuan W : Pemberian tepung wortel 3% 4. Perlakuan S : Pemberian tepung spirulina 3%
Metode rancangan ini digunakan karena keragaman kondisi lingkungan, alat, bahan dan media yang digunakan adalah homogen karena letak/posisi masing-masing unit tidak mempengaruhi hasil-hasil percobaan dan percobaan ini dilakukan pada kondisi terkendali atau setiap unit percobaan secara keseluruhan memiliki peluang yang sama besar untuk menempati pot-pot percobaan atau dapat dilihat pada denah (Lampiran 1) (Hanafiah, 2007).
Prosedur Penelitian
1. Persiapan Wadah
Tempat pemeliharaan ikan atau wadah sebagai media uji yang digunakan adalah akuarium berjumlah 12 unit berukuran 40 cm x 20 cm x 20 cm. Akuarium terlebih dahulu dicuci hingga bersih dan dikeringkan. Setelah itu, akuarium disusun sesuai letak pot-pot percobaan dapat dilihat pada denah kemudian diisi dengan air bersih sebanyak 75% dari volume akuarium yaitu 12 liter dan diberi aerator sebagai penyuplai oksigen.
2. Persiapan Media
dalam bak tandon. Kemudian air tersebut dialirkan ke dalam ember penampung untuk diendapkan. Air yang ada di ember penampung diberi aerator untuk mengurangi kandungan karbondioksida dan membantu suplai oksigen terlarut.
Air diendapkan kurang lebih selama satu hari. Selanjutnya, aerator dimatikan dan air didiamkan minimal selama satu jam sebelum digunakan agar sisa-sisa metabolisme dalam air mengendap di dasar. Air yang diambil sebanyak 75% dari tinggi air dalam ember untuk dipindahkan ke dalam wadah uji/akuarium yang telah dibersihkan.
3. Persiapan Ikan Uji
Ikan yang digunakan dalam penelitian ini adalah ikan koi yang memiliki ukuran panjang ± 9 cm (berasal dari induk yang sama, umur sama dan ukuran sama). Sebelum ikan dimasukkan ke dalam media uji, terlebih dahulu ikan diadaptasi selama dua hari. Selama adaptasi ikan uji diberi pakan berupa pelet. Setelah diadaptasi ikan ditebar sebanyak 5 ekor per akuarium/media uji.
4. Persiapan Pakan
Bahan warna yang digunakan sebagai sumber pigmen tersedia dalam bentuk kering. Adapun tahapan pencampuran bahan warna tersebut ke dalam pakan ialah: masing-masing bahan warna sesuai dosis perlakuan terlebih dahulu dicampur dengan progol (2-3 g/kg pakan) dalam masing-masing wadah dan diaduk sampai merata. Kemudian, bahan warna yang telah diaduk merata dengan progol diberi air (150 ml/kg pakan) dan dibiarkan sampai 10 menit. Selanjutnya,
pakan Takari dituang ke dalam wadah tempat bahan warna bersama progol yang telah dilarutkan dalam air sebanyak 1 kg. Diaduk campuran tersebut hingga merata, kemudian dikeringanginkan selama 30-60 menit. Jika selama pengeringan terjadi perubahan warna dan bau pada pakan, maka pakan tersebut dibuang dan harus dibuat kembali. Perhitungan pakan dapat dilihat pada Lampiran 2.
5. Pemeliharaan Ikan
Ikan yang dijadikan sebagai ikan uji terlebih dahulu diaklimatisasikan terhadap media budidaya. Aklimatisasi merupakan proses penyesuaian atau adaptasi ikan dari suatu keadaan lingkungan (asalnya) ke suatu keadaan lingkungan baru yang kondisi fisik dan kimianya berbeda dengan lingkungan asalnya. Proses aklimatisasi dilakukan untuk mencegah ikan stres.
Setelah proses aklimatisasi selesai ikan dipuasakan selama 24 jam dengan tujuan untuk menghilangkan pengaruh sisa pakan yang ada dalam tubuh ikan. Kemudian ikan ditimbang untuk mengetahui beratnya, dilihat oleh tim panelis warna yang telah ditetapkan dan dimasukkan ke dalam akuarium/media uji.
dan pukul 15.00 WIB pada masing-masing perlakuan. Jumlah pakan yang diberikan per perlakuan yaitu sebanyak 5% dari berat ikan.
Selama pemeliharaan, kualitas air harus tetap dikontrol agar ikan uji sehat dan tumbuh dengan baik. Untuk mengurangi kotoran ikan dan sisa pakan dilakukan penyifonan setiap hari. Aerator dimatikan selama 2 menit sebelum disifon agar kotoran mengendap di dasar akuarium. Jumlah volume air yang disifon sebanyak 10% dari volume media uji yaitu 1,2 liter. Kemudian air diganti dengan air yang bersih sebanyak jumlah volume air yang terbuang saat disifon.
Parameter kualitas air yang juga diamati diantaranya adalah pengukuran suhu, pengukuran pH media uji dan mengukur kandungan oksigen terlarut. Pengukuran kualitas air ini dilakukan setiap 10 hari sekali agar kondisi media uji tetap dalam keadaan yang terkontrol.
Pengamatan Hasil
Kegiatan pengamatan hasil terhadap ikan dilakukan setiap 10 hari sekali dari awal penebaran hingga akhir penelitian yang meliputi pengukuran panjang, pengukuran berat dan pengamatan kecerahan warna ikan.
1. Pengukuran Panjang Ikan
Pm = Pt – P0
Keterangan : Pm : Pertumbuhan panjang mutlak ikan (cm) Pt : Panjang ikan pada waktu ke-t (cm) P0 : Panjang ikan pada waktu ke-0 (cm)
2. Pengukuran Berat Ikan
Pengukuran berat ikan menggunakan timbangan digital. Pertambahan berat dihitung dengan rumus Effendie (1979), yaitu:
Wm = Wt – W0
Keterangan : Wm : Pertambahan berat mutlak ikan (g) Wt : Berat ikan pada waktu ke-t (g) W0 : Berat ikan pada waktu ke-0 (g)
3. Pengamatan Warna Ikan
3.1Cara Penilaian Oleh Panelis
Warna ikan yang ada dalam wadah uji tidak sama dan berbeda-beda. Untuk menentukan warna yang diminati oleh konsumen, maka dinilai oleh orang-orang yang independen dan tidak buta warna. Cara penilaian oleh tim panelis adalah:
- Setiap panelis menilai dengan cara memberi angka 1-5. Ketentuan 1 : Suram
2 : Kurang suram 3 : Biasa
4 : Kurang Cerah 5 : Cerah
- Setiap panelis tidak diberi tahu perlakuan dan ulangan yang sedang diamati. - Selama penelitian panelis tidak boleh berganti-ganti untuk menghindari
terjadinya kekeliruan.
- Panelis tidak boleh berdiskusi dengan panelis lain dalam menentukan nilai yang sedang diamatinya.
- Nilai yang diberi oleh panelis merupakan nilai mutlak dan tidak boleh diganggu/dirubah.
3.2Pengumpulan Hasil Penilaian
Nilai perubahan warna merupakan hasil dari penilaian yang diberikan panelis. Cara penetapan nilai sebagai nilai akhir perubahan warna adalah:
- Nilai yang diamati sebagai nilai dari masing-masing perlakuan dan ulangan. - Perubahan warna dihitung dari nilai yang diberi oleh panelis pada minggu
pengamatan dibagi minggu sebelumnya.
- Data yang dianalisis adalah perubahan warna awal dengan warna akhir pengamatan.
Analisis Data
HASIL DAN PEMBAHASAN
Hasil
Pengamatan Perubahan Warna Ikan
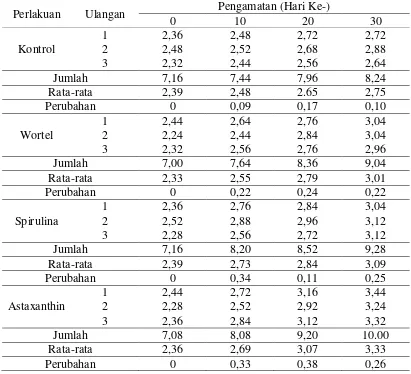
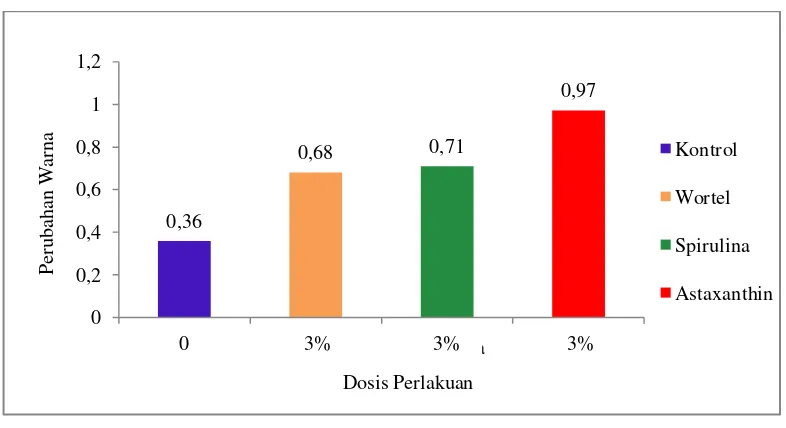
Perlakuan memberi pengaruh terhadap perubahan warna dari ikan koi. Peningkatan warna yang dihasilkan berbeda-beda di setiap perlakuan. Nilai perubahan warna ikan koi dapat dilihat pada Tabel 5.
Tabel 5. Data Perubahan Warna Ikan Koi dari Masing-Masing Perlakuan Perlakuan Ulangan Pengamatan (Hari Ke-)
0 10 20 30
0,71 pada perlakuan spirulina dan 0,68 pada perlakuan wortel serta perubahan warna yang paling kecil dengan nilai 0,36 terdapat pada perlakuan kontrol. Tingkat perubahan warna ikan koi dapat dilihat pada Gambar 6.
Gambar 6. Histogram Tingkat Perubahan Warna Ikan Koi
Pertumbuhan Panjang dan Berat Ikan
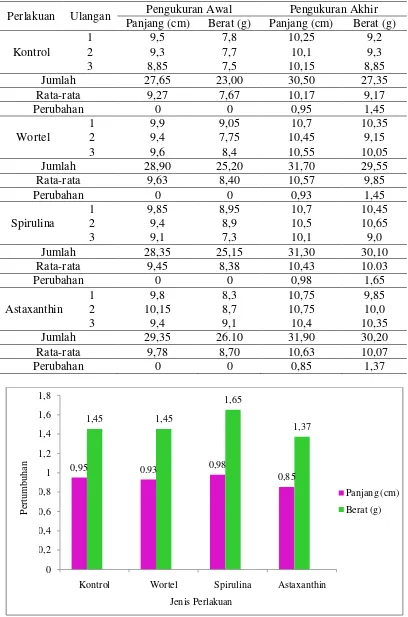
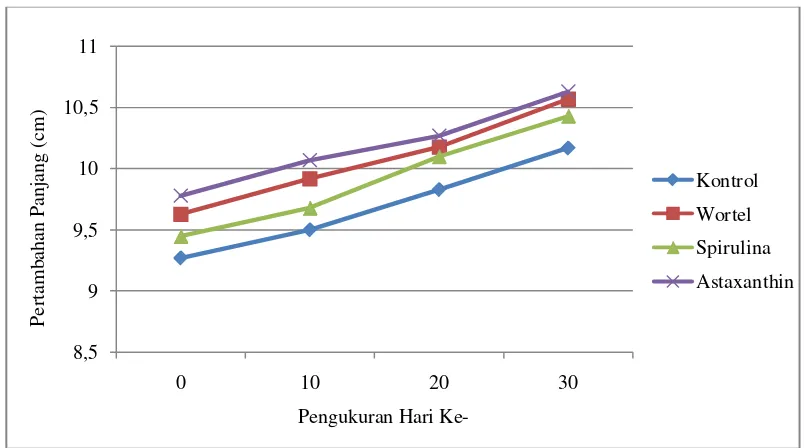
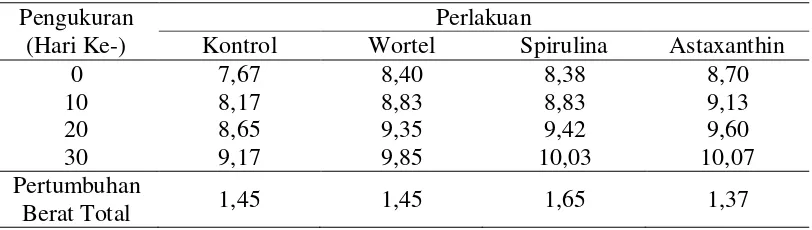
Selama penelitian ikan koi mengalami pertumbuhan baik ukuran panjang maupun bertambahnya berat. Pertumbuhan ini dipengaruhi oleh nutrisi yang terdapat pada pakan yang dikonsumsi ikan. Nilai pertumbuhan panjang dan berat ikan koi dapat dilihat pada Tabel 6.
Pertumbuhan yang paling baik terdapat pada perlakuan spirulina dengan nilai panjang 0,98 cm dan berat 1,65 g, selanjutnya perlakuan kontrol dengan nilai panjang 0,95 cm dan berat 1,45 g serta perlakuan wortel dengan nilai panjang 0,93 cm dan berat 1,45 g. Sedangkan pertumbuhan yang paling lambat terdapat pada perlakuan astaxanthin dengan nilai panjang 0,85 cm dan berat 1,37 g. Pertumbuhan panjang dan berat ikan koi dapat dilihat pada Gambar 7.
Tabel 6. Nilai Pertumbuhan Panjang dan Berat Ikan Koi
Kualitas Air
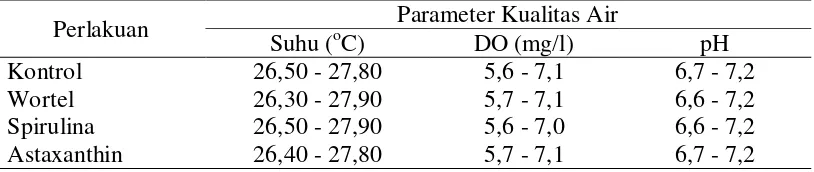
Selama penelitian berlangsung kualitas air yang digunakan tetap dalam kondisi optimal karena tetap dikontrol. Hasil pengamatan parameter kualitas air selama penelitian dapat dilihat pada Tabel 7.
Tabel 7. Nilai Parameter Kualitas Air
Perlakuan Parameter Kualitas Air
Suhu (oC) DO (mg/l) pH
Kontrol 26,50 - 27,80 5,6 - 7,1 6,7 - 7,2
Wortel 26,30 - 27,90 5,7 - 7,1 6,6 - 7,2
Spirulina 26,50 - 27,90 5,6 - 7,0 6,6 - 7,2
Pembahasan
Pengamatan Perubahan Warna Ikan
Warna yang timbul pada tubuh ikan koi disebabkan adanya pigmen dalam tubuhnya serta pakan yang mengandung pigmen warna sebagai pemicu perubahan warna. Menurut Yahyadi, dkk. (2004) bahwa pewarnaan pada ikan pada dasarnya berhubungan dengan pigmen pada kulit. Secara fisiologis ikan akan mengubah pigmen yang diperoleh dari makanannya, sehingga menghasilkan variasi warna (Evan, 1993).
Hasil penelitian menunjukkan terjadi perubahan warna ikan koi, disebabkan oleh adanya perlakuan yang diberikan pada masing-masing ikan. Wayan, dkk. (2010) menyatakan bahwa penambahan sumber peningkat warna dalam pakan akan mendorong peningkatan pigmen warna pada tubuh ikan, atau minimal mampu mempertahankan pigmen warna pada tubuhnya selama masa pemeliharaan.
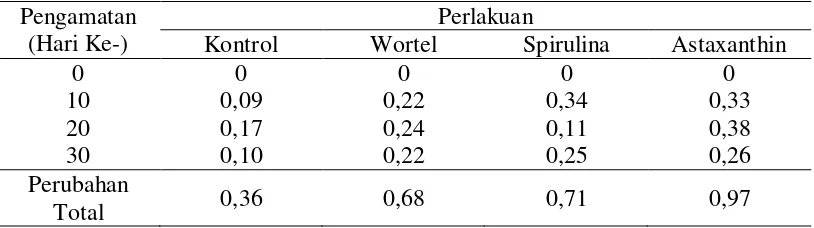
Dari pengamatan menunjukkan terjadi perubahan warna ikan koi pada masing-masing perlakuan. Perubahan warna ikan koi tertinggi terjadi pada perlakuan astaxanthin, kemudian diikuti perlakuan spirulina, wortel dan terendah pada perlakuan kontrol. Nilai perubahan warna ikan koi setiap hari pengamatan dapat dilihat pada Tabel 8.
Tabel 8. Data Perubahan Warna Ikan Koi Setiap Pengamatan Pengamatan
(Hari Ke-)
Perlakuan
Kontrol Wortel Spirulina Astaxanthin
Menurut Amin, dkk (2012), terjadinya peningkatan warna yang berbeda-beda dalam tiap perlakuan disebabkan karena ikan memiliki tingkat penyerapan berbeda terhadap jenis pigmen warna dan dosis diberikan. Dari paparan Amin tersebut terbukti bahwa hasil perubahan warna tidak sama karena bahan warna yang digunakan berbeda sedangkan dosis tiap pelakuan sama yaitu 3%. Walaupun terdapat perbedaan warna dari bahan baku namun belum diketahui pengaruh dosis terhadap perubahan warna, untuk itu dianjurkan penelitian lebih lanjut tentang pemakaian dosis yang tepat untuk setiap bahan baku.
Menurut Satyani dan Sugito (1997), perubahan warna ikan tergantung pada jumlah komposisi bahan warna dalam bahan pakan. Untuk memperoleh penampilan warna terbaik pada ikan, diperlukan dosis sumber pigmen warna yang tepat, tidak berlebihan dan tidak pula kekurangan. Jadi, pemberian bahan warna dengan dosis tepat, akan memperjelas pola warna dari tubuh ikan.
Perubahan warna paling kecil terjadi pada kontrol yaitu perlakuan tanpa menambahkan bahan warna dalam pakan. Hal ini dikarenakan tubuh ikan tidak mampu mensintesis karotenoid tanpa adanya tambahan dari luar. Sesuai pendapat Maulid (2011) menyatakan bahwa hewan akuatik tidak dapat mensintesis karotenoid dalam tubuhnya dan oleh karena itu harus mendapatkan pigmen pemicu dari luar berupa pakan.
mengandung β-karoten secara tidak langsung mempengaruhi perubahan warna pada ikan.
Berdasarkan hari pengamatan, perubahan warna ikan koi pada perlakuan kontrol hari ke-0 sampai hari ke-10 meningkat 0,09. Pada hari ke-20 warna mengalami peningkatan terbaik dengan nilai 0,17 serta pada hari ke-30 meningkat 0,10, di sini terlihat bahwa ada penurunan warna ikan dari hari 20 ke hari ke-30. Hal ini diduga karoten yang ada di pakan hanya mampu meningkatkan warna ikan secara maksimal pada hari ke-20 dan hari-hari selanjutnya akan cenderung menurun.
Nilai peningkatan warna total ikan pada perlakuan kontrol sebesar 0,36 lebih kecil dari hasil perlakuan lainnya. Ini membuktikan bahwa ikan koi membutuhkan tambahan karoten dari luar untuk merangsang kecemerlangan warnanya. Menurut Khairyah, dkk. (2010) bahwa ikan tidak dapat membuat sendiri pigmen warna oleh karenanya harus disuplai dari makanan yang dimakan. Karena itu, jika ikan diberi makan yang tidak mengandung pigmen warna sesuai dibutuhkan, maka ikan tersebut akan kehilangan warnanya.
Dengan menambahkan tepung wortel pada pakan di salah satu perlakuan, maka mampu meningkatkan warna total ikan koi sebesar 0,68. Menurut Ikawati (2005), wortel memiliki kandungan karotenoid yang tinggi, sehingga dapat dimanfaatkan sebagai bahan pewarna alami. Utami, dkk (2013), peningkatan warna ini sangat dimungkinkan sebagai akibat akumulasi beta karoten pada kulit ikan.
Peningkatan warna di hari berikutnya hingga hari ke-20 terus meningkat sebesar 0,24. Namun, hari ke-30 tidak memberikan nilai peningkatan yang lebih besar, melainkan sama dengan peningkatan di hari ke-10. Diduga hal ini terjadi karena kandungan karoten sudah banyak di dalam tubuh namun lingkungan tidak dapat mengakumulasi ataupun merangsang untuk merubah warna.
Ikan koi dengan penambahan tepung wortel pada pakan, mampu memicu pigmen warna merah dan warna hitam dalam tubuh ikan sehingga membuatnya semakin terang (Lampiran 6). Sunarno (2012), wortel kaya beta karoten sehingga bisa menaikkan warna merah seperti spirulina. Sholichin, dkk (2012), warna pada ikan disebabkan adanya sel kromatofor, yaitu eritrifora menghasilkan warna merah dan oranye, xanthofora menghasilkan warna kuning, melanofora menghasilkan warna hitam, leukofora menghasilkan warna putih dan iridofora dapat memantulkan refleksi cahaya.
Tepung wortel sebagai pakan tambahan bertujuan untuk menghasilkan warna ikan koi sebagai ikan hias yang mempunyai penampilan warna menjadi lebih menarik. Dari pengamatan yang dilakukan diketahui bahwa warna ikan dengan pemberian tepung wortel lebih cerah dan menimbulkan pigmen merah serta pigmen hitam. Dari seluruh perlakuan hanya perlakuan pemberian wortel yang dapat menimbulkan warna hitam.
Bahan warna perlakuan yang ditambahkan pada pakan telah membuat warna ikan koi lebih cemerlang. Seperti halnya juga penambahan spirulina dapat meningkatkan perubahan warna ikan. Menurut Twigg (2013) bahwa ganggang mengandung zat khusus yang disebut karoten, mampu membantu membuat warna lebih cemerlang dan banyak di makanan ikan koi seperti spirulina untuk memperkuat warna ikan.
Menurut Sunarno (2012), kandungan beta karoten pada spirulina akan masuk dalam metabolisme ikan lalu diserap tubuh untuk kemudian mempercerah pigmen. Spirulina meningkatkan warna merah pada ikan. Jadi beta karoten spirulina diberikan melalui pakan untuk kemudian diserap oleh tubuh ikan dan dimanfaatkan sehingga warnanya semakin terang.
Berkaitan dengan perubahan warna ikan yang tidak stabil pada perlakuan spirulina disebabkan karena ukuran ikan masih kecil. Pada hari ke-10 warna ikan meningkat sebesar 0,34, hari ke-20 hanya sebesar 0,11 serta hari ke-30 meningkat sebesar 0,25. Utomo, dkk (2006) menyatakan kebutuhan karotenoid pada ikan muda relatif lebih sedikit karena perubahan warna tubuhnya belum tetap. Kadar yang lebih rendah sudah mencukupi kebutuhan ikan koi akan karotenoid dalam spirulina.
warna. Pemberian sumber pigmen yang berlebih dapat menurunkan kerja hormon, sehingga tidak menyebabkan perubahan warna.
Namun demikian, penambahan spirulina pada pakan ikan koi telah mampu meningkatkan warna total ikan sebesar 0,71. Peningkatan warna ini didapatkan dari pengamatan selama 30 hari. Sejak hari pertama perlakuan diberikan tambahan spirulina sebanyak 3% dari berat pakan ikan sampai hari ke-30. Sehingga peningkatan warnanya lebih besar dari nilai perlakuan wortel dan kontrol. Perubahan warna ikan koi dengan perlakuan spirulina terlampir (Lampiran 7).
Peningkatan warna total ikan koi paling baik dari semua perlakuan terdapat pada penambahan astaxanthin dalam pakan sebesar 0,97. Menurut Naguib (2000) bahwaastaxanthin merupakan antioksidan paling kuat yang pernah ditemuka n di alam. Munifah dan Thamrin (2008) menyatakan astaxanthin merupakan salah satu senyawa aktif yang memiliki kandungan 10 kali lipat dibandingkan senyawa aktif lain untuk perubahan warna ikan.
Perubahan warna ikan koi merupakan akibat dari pemberian astaxanthin pada pakan secara optimal, karena astaxanthin mengandung karotenoid yang dapat meningkatkan warna dari ikan. Menurut Satyani dan Sugito (1997), astaxanthin merupakan salah satu senyawa dari kelompok pigmen karotenoid yang dapat digunakan sebagai suplemen pakan untuk peningkatan warna ikan hias.
tinggi sebesar 0,38. Kemudian pada hari ke-30, peningkatan warna ikan tidak sebaik pada hari-hari sebelumnya yaitu meningkat sebesar 0,26. Hal ini terjadi karena peningkatan warna ikan maksimal terjadi pada minggu ke-2 hingga minggu ke-3 selama perlakuan.
Ikan koi menyerap senyawa astaxanthin dari pakan untuk kemudian meningkatkan warna merah pada ikan koi (Lampiran 8). Menurut Subamia, dkk. (2010) bahwa secara umum, ikan akan menyerap astaxanthin dari pakan dan menggunakannya langsung sebagai sel pigmen warna merah. Namun, dapat pula beberapa ikan mengubah astaxanthin ini menjadi pigmen dasar lutein yang kuning atau zeaxanthin yang oranye tergantung kebutuhannya.
Pada pengamatan hari ke-10, nilai perubahan warna ikan uji rata-rata meningkat. Pada pengamatan hari ke-20, terjadi perubahan warna ikan tertinggi daripada pengamatan hari lainnya. Menurut Lesmana (2002), pemberian suplemen selama 2 minggu akan menunjukkan hasil warna ikan hias sudah mulai meningkat. Pemberian suplemen selama 3 minggu warna ikan menunjukkan hasil yang maksimal. Lebih dari waktu tersebut umumnya warna akan stabil dikarenakan adanya peningkatan karotenoid dalam sel pigmen ikan.
Jadi, dari hasil pengamatan harian dan peningkatan warna total ikan selama penelitian, dapat disimpulkan bahwa peningkatan warna ikan terbaik umumnya terjadi pada hari ke-20 sejak perlakuan. Untuk meningkatkan kecerahan warna ikan lebih sempurna sebaiknya ikan diberikan penambahan bahan warna pada pakan agar memicu perkembangan sel pigmen yang di dalam tubuh ikan.
ke-20 hanya akan menstabilkan warna dan tidak meningkatkannya lagi. Sehingga perlakuan tersebut kurang efisien untuk diteruskan serta bahan yang digunakan tidak memberi pengaruh terhadap peningkatan warna ikan.
Jika dilihat dari hasil pengamatan perubahan warna dari masing-masing perlakuan tidak sama, perubahan terjadi baik di kontrol maupun di perlakuan. Walaupun terjadi perubahan namun belum diketahui perubahan yang terbaik dari masing perlakuan. Untuk mengetahui perubahan warna dari masing-masing perlakuan di lakukan uji statistik ANOVA.
Hasil analisis ANOVA menunjukkan penambahan bahan warna berbeda pada pakan memberikan pengaruh sangat nyata terhadap perubahan warna ikan koi (p>0,01). Analisis sidik ragam dapat dilihat pada Lampiran 9. Hasil uji lanjut menunjukkan perlakuan astaxanthin memberikan respon paling baik terhadap perubahan warna tubuh ikan koi dibandingkan dengan perlakuan lainnya.
Berdasarkan uji lanjutan BNT (Lampiran 10), menunjukkan bahwa perlakuan wortel terhadap kontrol beda sangat nyata. Perlakuan spirulina terhadap kontrol beda sangat nyata. Perlakuan astaxanthin terhadap kontrol beda sangat nyata. Perlakuan astaxanthin terhadap wortel beda sangat nyata. Perlakuan astaxanthin terhadap spirulina beda sangat nyata. Namun, perlakuan spirulina terhadap wortel tidak berbeda nyata.
Pertumbuhan
Menurut Liviawaty dan Eddy (1990) bahwa pakan atau makanan merupakan unsur penting dalam budidaya ikan. Jadi ikan koi memerlukan nutrisi yang terkandung dalam pakan kemudian diserap dalam tubuh dan digunakan untuk pertumbuhannya.
Selama penelitian ikan koi mengalami pertumbuhan baik ukuran panjang maupun bertambahnya berat. Pertumbuhan ini dipengaruhi nutrisi pada pakan yang dikonsumsi ikan. Sesuai pendapat Cahyono (2000), pakan yang baik adalah memiliki komposisi zat gizi lengkap. Keseimbangan pakan salah satunya dilihat dari kandungan nutrisinya yang terdiri dari protein, karbohidrat, lemak, mineral dan vitamin (Redaksi Penebar Swadaya, 2008).
Adapun jenis pakan yang diberikan pada ikan koi selama penelitian adalah pakan buatan (pelet) jenis Takari. Pakan jenis ini memiliki kandungan nutrisi yang baik serta butirannya berukuran kecil cocok untuk bukaan mulut ikan. Menurut Daelami (2000), untuk memperoleh derajat efisiensi pakan lebih tinggi, bentuk dan sifat pakan buatan harus disesuaikan dengan cara dan kebiasaan makan dari masing-masing jenis ikan serta ukuran ikan.
Pertambahan Panjang Ikan
Dari hasil pengukuran menunjukkan adanya pertambahan panjang tubuh ikan koi pada masing-masing perlakuan. Data pertambahan panjang ikan koi setiap pengukuran dapat dilihat pada Tabel 9.
untuk proses pencernaan, membantu metabolisme dan bertumbuh. Sholichin dkk. (2012), pertumbuhan terjadi apabila ada kelebihan energi setelah energi yang tersedia digunakan untuk metabolisme standar yaitu untuk pencernaan serta beraktivitas.
Tabel 9. Data Pertambahan Panjang (cm) Ikan Koi Pengukuran
(Hari Ke-)
Perlakuan
Kontrol Wortel Spirulina Astaxanthin
0 9,27 9,63 9,45 9,78
Diketahui bahwa ikan koi selama penelitian mengalami pertambahan panjang. Pengukuran pada hari ke-0 sebagai ukuran awal ikan terus bertambah pada hari-hari berikutnya hingga mencapai hari ke-30. Nilai pertambahan panjang ikan tidak selamanya sama di setiap hari pengamatan dan perlakuan. Grafik pertambahan panjang harian ikan dapat dilihat pada Gambar 8.
Gambar 8. Grafik Pertambahan Panjang Harian Ikan Koi
Diperoleh hasil pertambahan panjang ikan koi paling baik terdapat pada perlakuan spirulina dengan nilai 0,98 cm. Hal ini disebabkan nutrisi ikan terpenuhi serta pakan yang diberikan mudah dicerna. Penambahan spirulina juga membuat ikan jadi tertarik mengkonsumsi pakan karena spirulina merupakan jenis mikro alga. Menurut Fretes, dkk (2012) alga hijau-biru spirulina merupakan sumber fikobili protein khususnya fikosianin, yang dapat mencapai 17-20% dari berat kering spirulina.
Selain itu pertambahan panjang pada perlakuan spirulina juga diduga akibat tumbuhnya zooplanton sebagai konsumer utama dari alga. Jadi di dalam wadah penelitian, ikan akan memakan alga spirulina dan zooplakton, sehingga kebutuhan nutrisi ikan terpenuhi. Menurut Fulks dan Main dalam Sari dan Manan (2012), fitoplankton dan zooplankton sangat dibutuhkan dalam kegiatan budidaya yang bersifat komersil, seperti pada jenis ikan (larva dan dewasa), bivalvia dan moluska.
Pertambahan panjang pada perlakuan kontrol diperoleh 0,95 cm. Pertumbuhan ini dipengaruhi pakan bernutrisi lengkap. Pakan pelet (Takari) merupakan resep istimewa yang mengandung nilai nutrisi cukup untuk pertumbuhan bagi ikan. Komposisi Takari meliputi tepung ikan, tepung udang, tepung kedelai, vitamin, mineral, pencerah warna, anti oksidan dan lainnya (PT.Central Proteinaprima Tbk, 2014).
pemeliharaan ikan adalah penyediaan makanan secara cukup dan kontinu, terutama makanan yang dapat diberikan untuk berbagai tingkatan umur serta ukuran ikan.
Pertumbuhan paling lambat terdapat pada perlakuan astaxanthin dengan panjang 0,85 cm. Diduga karena unsur nutriennya rendah serta ikan lebih memanfaatkan astaxanthin sebagai zat yang mengaktifkan peningkatan warna dari pada pertumbuhannya. Sehingga penyerapan terhadap nutrisi pakan lebih lambat. Menurut Prayogo, dkk. (2012) bahwa ikan hias yang diberi pakan sumber karoten hanyalah untuk memanfaatkan zat warna tersebut sebagai meningkatkan warna tubuhnya dan bukan untuk pertumbuhan.
Pertumbuhan Berat Ikan
Selama penelitian ikan mengalami pertumbuhan berat pada masing-masing perlakuan. Data pertumbuhan berat ikan koi setiap pengukuran dapat dilihat pada Tabel 10.
Tabel 10. Data Pertumbuhan Berat (g) Ikan Koi Pengukuran
(Hari Ke-)
Perlakuan
Kontrol Wortel Spirulina Astaxanthin
0 7,67 8,40 8,38 8,70
(2000), zat protein digunakan hewan untuk pemeliharaan tubuh, pembentukan jaringan tubuh, penambahan protein tubuh dan pengganti jaringan yang rusak.
Tingkat pertumbuhan berat harian ikan koi umumnya terus bertambah dari hari ke-0 sampai hari ke-30. Peningkatan pertumbuhan berat ikan juga berbeda-beda setiap perlakuan, tetapi berbanding lurus dengan pertambahan panjang. Pertambahan berat harian ikan disajikan pada Gambar 9.
Gambar 9. Grafik Pertumbuhan Berat Harian Ikan Koi
Pertumbuhan berat total ikan terbaik terdapat pada perlakuan spirulina seberat 1,65 g. Diduga disebabkan ikan pada perlakuan spirulina lebih cepat beradaptasi, juga nutrisi serta kesesuaian pakan memadai. Pakan yang diberikan mudah dicerna ikan karena disesuaikan dengan ukuran serta bukaan mulut ikan. Menurut Daelami (2000), benih ikan juga perlu diberi pakan tambahan agar dapat dicapai pertumbuhan dan proses kelangsungan hidup yang sebaik mungkin.
Nilai yang diperoleh dari pertumbuhan berat total pada kontrol dan perlakuan wortel sama 1,45 g. Diduga ikan yang diberi perlakuan wortel
memiliki tingkat penyerapan serta pemanfaatan nutrisi hampir sama dengan ikan kontrol. Selain itu, pertambahan berat dipengaruhi efisiensi pemberian pakan. Menurut Alex (2009), tips memberi makan ikan koi adalah lebih baik memberi makan dalam jumlah sedikit tetapi dalam frekuensi yang sering dibandingkan memberi makanan dalam jumlah banyak dalam frekuensi yang sedikit.
Pada perlakuan astaxanthin, ikan koi mengalami pertumbuhan berat paling lambat dibandingkan dengan perlakuan lainnya. Didapatkan nilai pertumbuhan berat total sebesar 1,37 g. Hal ini diduga karena sifat ikan koi yang terus bergerak aktif dalam akuarium sehingga kebutuhan akan nutrisi lebih banyak. Menurut Susanto (2002), di dalam air ikan koi mampu mengenali pakannya dan bahkan mengaduk-aduk dasar kolam atau pematang kolam untuk mencari makanan.
Perbedaan pertumbuhan yang dialami ikan disebabkan oleh kemampuan ikan dalam menyerap nutrisi dari pakan. Rata-rata pertambahan panjang ikan selama pengamatan pada kisaran 0,85-0,98 cm. Sedangkan rata-rata pertumbuhan berat pada kisaran 1,37-1,65 g. Menurut Prayogo, dkk. (2012), perubahan pertumbuhan kedua parameter tersebut berbanding lurus, semakin bertambah panjang tubuh semakin bertambah pula berat tubuh ikan.
Pengukuran panjang dan berat tubuh ikan dilakukan untuk melihat pengaruh pemberian bahan warna alami (karoten) berbeda terhadap pertumbuhan ikan. Dari hasil analisis sidik ragam (ANOVA), diketahui bahwa pertumbuhan panjang dan berat ikan koi tidak berpengaruh nyata untuk setiap perlakuan yang diberikan. Analisis sidik ragam pertumbuhan panjang dan berat ikan koi terlampir pada Lampiran 11 dan Lampiran 12.
Kualitas Air
Berdasarkan hasil penelitian, diperoleh suhu air saat penelitian termasuk pada kisaran yang optimal untuk kelangsungan hidup ikan koi yaitu antara 26,30-27,90o C. Hal ini disebabkan penelitian dilangsungkan dalam ruangan serta kondisi perairan tetap dikontrol. Sesuai literatur Redaksi Penebar Swadaya (2008) yang menyatakan bahwa ikan koi hidup di perairan air tawar di daerah beriklim sedang dengan suhu 25-30o C.
Suhu perairan optimal mempengaruhi kelangsungan hidup ikan dan membantu proses metabolisme serta pertukaran udara (respirasi) untuk perkembangannya. Menurut Jangkaru (2002), enzim dalam tubuh ikan yang berfungsi merangsang metabolisme hidup dalam batas suhu tertentu, akan berhenti beraktivitas jika terjadi perubahan suhu yang besar dan terjadi dalam waktu singkat.
Penebar Swadaya (2008), kandungan oksigen terlarut yang baik untuk kelangsungan hidup ikan koi adalah > 5 mg/l.
Oksigen diserap dari lingkungan ke dalam air melalui permukaannya. Namun, untuk tetap menjaga kandungan oksigen terlarut yang dibutuhkan ikan dalam air, perlu penambahan aerator untuk menyuplai oksigen. Hal ini sesuai pendapat Twigg (2013) yang menyatakan bahwa jika jumlah ikan terlalu banyak atau suhu udara terlalu tinggi, dibutuhkan tambahan oksigen melalui sistem aerasi. Nilai pH dalam suatu perairan merupakan salah satu faktor yang sangat penting. Dari hasil penelitian diperoleh nilai pH air berkisar antara 6,6-7,2 dan tergolong dalam skala yang baik. Hal ini sesuai pendapat Twigg (2013) bahwa tingkat pH ideal adalah sedikit di atas netral, tetapi koi masih dapat menyesuaikan diri dengan pH pada kisaran 6,5-8,5.
Derajat keasaman (pH) suatu perairan harus tetap dalam kondisi yang baik. Perubahan nilai pH dapat disebabkan oleh kotoran ikan dan sisa-sisa makanan yang telah terurai dalam air. Irianto (2005) menyatakan bahwa besaran pH dipengaruhi komposisi kimiawi air juga aktivitas biologi yang berlangsung di dalamnya.
Pengendalian kualitas air (suhu, oksigen terlarut dan pH) selama penelitian telah mendukung kelangsungan hidup ikan dan menghindari ikan stres. Dokumentasi kegiatan pengendalian kualitas air terlampir pada Lampiran 13. Lingkungan perairan optimal juga telah mendukung terjadinya peningkatan warna pada ikan koi. Sesuai pendapat Twigg (2013), pada kondisi perairan yang bagus koi menjaga atau bahkan meningkatkan kualitas bentuk tubuh, kulit dan warna. Sebaliknya, semua hal itu tidak akan terwujud jika kualitas air buruk.
Efisiensi Pakan
Setelah masa pemeliharaan selama 30 hari, terjadi pertumbuhan panjang dan berat ikan koi seiring pertambahan waktu. Hal ini menunjukkan bahwa jumlah pakan diberikan telah memadai serta nutrisi yang dibutuhkan ikan tercukupi. Sesuai pendapat Setiawati dan Suprayudi (2003), jika jumlah pakan yang diberikan dan dikonsumsi ikan sudah melebihi dari yang diperlukan untuk pemeliharaan tubuhnya, maka dapat terjadi pertumbuhan.
Jumlah konsumsi pakan ikan koi relatif sama di semua perlakuan, hal ini menunjukkan bahwa banyaknya pakan dikonsumsi sesuai dengan kapasitas tampung lambungnya. Menurut Brett dalam Setiawati dan Suprayudi (2003), jumlah pakan yang mampu dikonsumsi ikan setiap harinya merupakan salah satu faktor yang mempengaruhi potensi ikan untuk tumbuh secara maksimal dan laju konsumsi makanan harian berhubungan erat dengan kapasitas dan pengosongan perut.
pertumbuhan paling kecil. Diduga hal ini disebabkan adanya perbedaan tingkat pencernaan dalam tubuh ikan terhadap pakan yang diberikan. Sesuai pendapat Setiawati, dkk. (2008), perbedaan pertumbuhan menunjukkan adanya perbedaan tingkat pencernaan pada masing-masing pakan perlakuan sebagai akibat dari perbedaan kuantitas bahan yang digunakan.
Nilai efisiensi pakan berkaitan dengan laju pertumbuhan. Semakin tinggi laju pertumbuhan maka semakin besar pertambahan berat tubuh ikan sedangkan nilai efisiensi pakan sangat ditentukan oleh biaya pakan. Menurut Djajasewaka dalam Setiawati, dkk. (2013), nilai efisiensi pakan berbanding terbalik dengan
konversi pakan dan berbanding lurus dengan pertambahan berat tubuh ikan, sehingga semakin tinggi nilai efisiensi pakan maka nilai konversi pakan semakin rendah sehingga ikan semakin efisien memanfaatkan pakan yang dikonsumsi untuk pertumbuhan.
Barrows dan Hardy (2001) menjelaskan bahwa nilai rasio konversi pakan dipengaruhi oleh protein pakan yang sesuai dengan kebutuhan nutrisi ikan mengakibatkan pemberian pakan lebih efisien. Didapatkan perlakuan dengan tingkat efisiensi pakannya paling baik pada penambahan spirulina. Diduga karena spirulina merupakan jenis alga dengan sumber fikobili protein dapat mencapai 17-20% dari berat kering spirulina (Fretes, dkk., 2012).
Tabel 11. Efisiensi Pakan Perlakuan
Perlakuan
Jumlah Pakan Progol Perlakuan
Besar kecilnya nilai efisiensi pakan tersebut tidak hanya ditentukan oleh jumlah pakan yang diberikan, melainkan juga dipengaruhi oleh beberapa faktor seperti kepadatan, berat setiap individu, umur kelompok hewan, kualitas air dan cara pemberian pakan (Setiawati, dkk., 2013). Dari pernyataan tersebut, dapat dijelaskan bahwa ikan dengan berat tubuh terbesar terdapat pada perlakuan spirulina sehingga mempengaruhi nilai efisiensi pakan.
Dari tabel di atas, dapat dijelaskan bahwa ikan koi membutuhkan makanan sebagai sumber nutrisi bagi pertumbuhannya. Adapun pakan yang diberikan adalah pelet jenis Takari, karena pakan ini mengandung nutrisi lengkap serta harganya terjangkau. Menurut PT.Central Proteinaprima Tbk (2014), Takari merupakan resep istimewa yang mengandung nilai nutrisi cukup untuk pertumbuhan sehat bagi ikan. Adapun kandungan nutrisinya ialah protein 30%, lemak 3%, serat 4%, abu 12%, kadar air 12%, vitamin A, D3, E, B1, B6, B12, niacin, biotin, panthotenic, choline dan lainnya.
Pakan Takari yang digunakan selama penelitian pada masing-masing perlakuan sebanyak 185 g. Jumlah pakan yang digunakan ini didapatkan dari hasil pengukuran berat ikan seluruhnya kemudian dirata-ratakan per perlakuan, berat pakan yang diberikan 5% dari berat tubuh ikan. Menurut Alex (2009), jumlah pakan diberikan berdasarkan jumlah ikan (berat biomassa) dalam kolam dengan kisaran kebutuhan 3-5% perhari dengan frekuensi pemberian 2-3 kali sehari.
untuk masing-masing perlakuan tidak sama karena dipengaruhi oleh harga perperlakuan.
Perlakuan menambah bahan warna (tepung wortel, spirulina dan astaxanthin) pada pakan, dibutuhkan progol sebagai perekat bahan warna dengan pakan. Perekat progol yang digunakan pada masing-masing perlakuan sama 0,57 g dengan biaya sebesar Rp 57. Menurut Barus (2014), progol digunakan untuk perekat spirulina dengan pakan (2-3 g/kg pakan).
Penggunaan wortel, spirulina dan astaxanthin pada pakan ikan koi, berat bahan sama 5,56 g. Dikarenakan dosis perlakuan sama 3% dari berat pakan yang diberikan. Namun, biaya masing-masing bahan warna tersebut tidak sama. Disebabkan harga jual bahan berbeda-beda serta tidak didapatkan dari sumber yang sama. Sehingga mempengaruhi biaya masing-masing bahan baku perlakuan. Diperoleh biaya (output) masing-masing perlakuan berbeda. Output tertinggi terdapat pada perlakuan astaxanthin sebesar Rp 9.499, output wortel Rp 8.943, output spirulina Rp 8.387 dan output perlakuan kontrol sebesar Rp 5.550. Biaya astaxanthin, tepung wortel dan spirulina tinggi disebabkan harga bahan bakunya yang tinggi. Namun biaya kontrol hanya dipengaruhi biaya pakan, tanpa ada biaya tambahan dari bahan perlakuan serta bahan perekat.
Tabel 12. Harga Ikan Koi Setelah Penelitian No Nama Harga
Awal (Rp)
Harga Ikan Setiap Perlakuan (Rp)
Kontrol Wortel Spirulina Astaxanthin 1. Mulyadi 2.500 7.500 10.000 10.000 10.000 Penghasilan 112.500 148.125 150.00 150.000
Berdasarkan data di atas, harga awal ikan koi per ekor Rp 2.500. Peningkatan harga rata-rata ikan tertinggi menjadi Rp 10.000 per ekor, yaitu ikan perlakuan spirulina dan astaxanthin. Harga ikan perlakuan wortel menjadi Rp 9.875 per ekor serta ikan perlakuan kontrol dihargai Rp 7.500 per ekornya. Dengan adanya perlakuan penambahan bahan warna pada ikan koi akibat pemberian perlakuan, maka mampu meningkatkan harga ikan.
Jika ditotalkan harga keseluruhan ikan koi semua perlakuan setelah penelitian, maka didapatkan Rp 560.625 dari 60 ekor ikan uji. Total harga ikan awal seluruhnya sebesar Rp 150.000 dan total biaya output sebesar Rp 32.379. Maka total harga ikan akhir dikurangkan dengan total harga ikan awal serta total biaya output, didapatkan hasil sebesar Rp 378.246. Artinya waktu penelitian dan perlakuan yang diberikan pada ikan selama penelitian, telah mampu meningkatkan nilai ekonomis dan memberi keuntungan bagi pembudidaya.
dari satu maka efisien, jika nilai efisiensi sama dengan satu maka kurang efisien, jika nilai efisiensi lebih besar dari satu maka usahanya tidak efisiensi.
KESIMPULAN DAN SARAN
Kesimpulan
Hasil penelitian dapat disimpulkan bahwa:
1. Penambahan beta karoten alami astaxanthin, tepung wortel dan spirulina dapat mempengaruhi peningkatan kecerahan warna pada ikan koi.
2. Perlakuan dengan penambahan astaxanthin 3% menghasilkan tingkat kecerahan warna yang paling baik pada ikan koi dengan nilai 0,97 dibandingkan perlakuan lainnya.
3. Tingkat efisiensi dari masing-masing perlakuan menguntungkan karena nilai efisiensi lebih kecil dari 1 (satu).
Saran
1. Bagi hobiis yang ingin membudidayakan ikan koi, sebaiknya diberikan perlakuan dengan penambahan astaxanthin 3% dalam pakan untuk menghasilkan warna ikan koi yang cerah dan indah.
2. Perlu dilakukan penelitian lebih lanjut mengenai penambahan beta karoten alami untuk ikan koi yang berukuran dewasa.
TINJAUAN PUSTAKA
Biologi Ikan Koi
Ikan koi termasuk keluarga Cyprinidae, masih sekerabat dengan ikan mas (Cyprinus carpio) dan ikan maskoki (Cyprinus auratus). Hal ini bisa dibuktikan
dari sosoknya yang memang mirip yaitu pipih. Hanya saja, penampilan koi lebih cantik karena ditunjang oleh beragam warna yang sangat menawan. Warna tubuhnya sendiri sangat variatif mulai dari hitam, putih, merah, kuning, silver hingga keemasan (Redaksi Penebar Swadaya, 2008).
Ikan ini terletak dalam sistem taksonomi ilmiah. Sebagaimana diakses pada
Kingdom : Animalia Filum : Chordata Kelas : Actinopterygii Ordo : Cypriniformes Subordo : Cyprinoidea Famili : Cyprinidae Subfamili : Cyprininae Genus : Cyprinus
Spesies : Cyprinus carpio
bertahun-tahun menghasilkan garis keturunan yang menjadi standar penilaian ikan koi. Nishikigoi adalah nama Jepang untuk ikan koi (Alex, 2009).
Sejak dihasilkannya varietas pertama berwarna merah dan biru cerah, hingga kini telah tercipta puluhan varietas ikan koi yang cantik dan memikat. Jenis yang paling banyak dikenal antara lain kohaku, showa sanke, taisho sanke, asagi, beko, shusui, ogon, tancho dan kinginrin. Ikan koi paling tepat dipajang di
kolam taman sehingga dapat dinikmati keelokan seluruh tubuhnya. Jika dalam akuarium, hanya tubuh bagian samping saja yang dapat dinikmati, padahal kecantikan ikan koi justru pada bagian atas tubuhnya (Daelami, 2000).
Ikan koi mempunyai badan yang berbentuk torpedo dengan alat gerak berupa sirip. Sirip-sirip yang melengkapi bentuk morfologi ikan koi adalah sebuah sirip punggung (dorsal fin), sebuah sirip anus (anal fin), sebuah sirip ekor (caudal fin), sepasang sirip dada (pectoral fin) dan sepasang sirip perut (ventral fin).
Sirip-sirip tersebut sangat penting bagi ikan koi untuk berpindah tempat (Prasetya, dkk., 2013). Selain itu, menurut Susanto (2000), dari pertengahan kepala hingga batang ekor terdapat gurat sisi (linear lateralis) yang berguna untuk merasakan getaran suara.
Berdasarkan pada pola warna, sisik dan lain-lain, ikan koi terbagi menjadi beberapa jenis. Trubus No. 508 (2012), menyatakan beberapa jenis ikan koi adalah sebagai berikut:
Ikan koi banyak sekali jenisnya tergantung warna dan coraknya selain itu juga terdiri dari berbagai kualitas. Untuk ikan koi yang mempunyai penampilan sempurna masuk dalam kualitas A, berikutnya kualitas B, C dan yang paling rendah masuk kelas kropyokan. Tingkatan kualitas ikan koi dapat dilihat dalam Tabel 1. Harganya juga tergantung kualitas, ikan koi yang masuk kualitas A biasanya sangat mahal bahkan mencapai puluhan juta (Effendy, 1993).
Tabel 1. Tingkatan Kualitas Ikan Koi No. Tingkatan
Kualitas Keterangan
1. A Pola warna sangat tajam, kontras, bentuk tubuh bagus 2. B Pola warna tajam dan kontras, bentuk tubuh bagus 3. C Pola warna kurang tajam dan kurang kontras 4. Kropyokan Pola warna jelek
Sumber : Effendy, 1993
punggung. Spesimen kohaku yang baik mempunyai pola tertentu, yaitu tepian yang jelas dan warna dasar putih bersih tanpa cela yang sering disebut putih “salju”. Perbedaan warna merah dan putih inilah yang membuat kohaku begitu berharga. Kohaku dapat dilihat pada Gambar 2 (Twigg, 2013).
Gambar 2. Ikan Koi Jenis Kohaku
Tabel 2. Ukuran Ideal Kualitas Air Bagi Ikan Koi
10. Fosfat Munculnya alga
11. Tembaga < 0,1 ppm
Sumber : Redaksi Penebar Swadaya, 2008
Makanan dan Kebiasaan Makan
Pakan atau makanan merupakan unsur penting dalam budidaya ikan. Ada dua jenis pakan berdasarkan pembuatannya, yaitu pakan alami dan buatan. Pakan alami adalah organisme hidup, baik hewan maupun tumbuhan yang dapat dikonsumsi oleh ikan. Sedangkan, pakan buatan adalah pakan yang dibuat dengan formulasi tertentu berdasarkan pertimbangan pembuatannya, yang didasarkan pada kebutuhan nutrien ikan, kualitas bahan baku dan nilai ekonomisnya (Liviawaty dan Eddy, 1990).
tinggi, bentuk dan sifat pakan buatan harus disesuaikan dengan cara dan kebiasaan makan dari masing-masing jenis ikan serta ukuran ikan (Daelami, 2000).
Keseimbangan pakan salah satunya dilihat dari kandungan nutrisinya yang terdiri dari protein, karbohidrat, lemak, mineral dan vitamin. Protein sangat berguna untuk membentuk jaringan tubuh. Lemak merupakan sumber energi utama dan membentuk membran. Karbohidrat merupakan sumber energi siap pakai yang harus segera dimanfaatkan. Mineral membantu proses metabolisme tubuh, termasuk ikut berperan dalam pembentukan struktur tulang, osmoregulasi, membangun saraf dan membantu peredaran darah. Vitamin merupakan unsur esensial untuk metabolisme dan pertumbuhan secara normal (Redaksi Penebar Swadaya, 2008).
Pakan yang baik adalah memiliki komposisi zat gizi lengkap. Zat makanan terpenting yang diperlukan ikan untuk pertumbuhan adalah zat protein. Pertumbuhan ikan akan dapat dipercepat dengan pemberian pakan yang mengandung protein tinggi (30 – 40 %) karena protein merupakan bagian terbesar dari daging ikan. Zat protein digunakan hewan untuk pemeliharaan tubuh, pembentukan jaringan tubuh, penambahan protein tubuh dan pengganti jaringan yang rusak (Cahyono, 2000).
Pelet tersedia dalam berbagai ukuran untuk menyesuaikan dengan ukuran mulut ikan. Pakan buatan ikan koi mengandung berbagai macam bahan mentah yang dicampur untuk menghasilkan makanan seimbang. Pelet harus mengandung kualitas dan kuantitas yang tepat dalam berbagai kandungan gizi yakni protein, karbohidrat, lemak, vitamin dan mineral (Twigg, 2013).
Selain itu, tips memberi makan ikan koi adalah lebih baik memberi makan dalam jumlah sedikit tetapi dalam frekuensi yang sering dibandingkan memberi makanan dalam jumlah banyak dalam frekuensi yang sedikit. Frekuensi pemberian pakan dapat dilihat dalam Tabel 3. Karena ikan koi jika perutnya sudah penuh, makanan akan langsung dikeluarkan sebagai kotoran. Karena itu yang perlu dipertimbangkan agar jangan sampai overfeeding (Alex, 2009).
Ikan tidak dapat membuat sendiri pigmen warna oleh karenanya harus disuplai dari makanan yang dimakan. Karena itu, jika ikan diberi makan yang tidak mengandung pigmen warna yang dibutuhkan, maka ikan tersebut akan kehilangan warnanya (Khairyah, dkk., 2010). Bila ikan memiliki bakat warna yang bagus, pemberian pakan tepat dan sesuai mampu memaksimalkan warna. Pakan ikan koi idealnya memenuhi unsur yang dapat meningkatkan daya tahan tubuh, melancarkan pencernaan, mencerahkan warna dan memacu pertumbuhan (Wisnu, 2012).
Takari ialah protein 30%, Lemak 3%, Serat 4%, Abu 12%, Kadar Air 12%,
Vitamin A, D3, E, B1, B6, B12, Niacin, Biotin, Panthotenic, Choline dan lainnya (PT.Central Proteinaprima Tbk, 2014).
Tabel 3. Frekuensi Pemberian Pakan dan Tipe Pakan Ikan Koi Temperatur
Air (oC)
Frekuensi
Pemberian Pakan Tipe Pakan
< 10 Jangan memberi makan ikan koi
Suhu pada 10 oC lebih dari satu bulan mungkin memerlukan pakan tambahan protein rendah dan karbohidrat tinggi. Untuk ikan koi yang hidup di daerah bermusim dingin.
10-13
2-3 kali seminggu atau jika ikan koi lapar
Karbohidrat tinggi, rendah protein.
15
4-5 kali seminggu atau jika ikan koi lapar
Protein rendah (25%) pakan pelet, karbohidrat tinggi, sayuran dan buah. 15-18 Sekali dalam satu
hari
Kadar dan jumlah protein ditingkatkan menjadi (35%), sayuran dan buah. 18-22 Satu atau dua kali
sehari
35% protein pelet, tambahkan buah, sayuran dan plankton sebagai variasi. 22-26 3-4 kali dalam
sehari
Pelet dengan protein tinggi (35%-40%), color enhancers. Tambahkan plankton, sayuran dan buah-buahan. Sumber : Alex, 2009
Sebagai hewan omnivora, ikan koi memakan segala seperti manusia. Di dalam air ikan koi mampu mengenali pakannya dan bahkan mengaduk-aduk dasar kolam atau pematang kolam untuk mencari makanan. Karena koi mempunyai organ penciuman yang sangat tajam berupa dua pasang sungut yang terletak dipinggir mulut (Susanto, 2002).
terutama makanan yang dapat diberikan untuk berbagai tingkatan umur serta ukuran ikan.
Warna pada Ikan
Zat warna menurut asalnya terdiri dari zat warna alami dan zat warna sintetik. Zat warna alami (pigmen) adalah zat warna yang secara alami terdapat dalam tanaman maupun hewan. Zat warna alami dapat dikelompokkan sebagai warna hijau, kuning dan merah (Winarti, dkk., 2008).
Pewarnaan pada ikan pada dasarnya berhubungan dengan pigmen pada kulit. Ada dua macam sel khusus yang memberikan warna terhadap ikan, kromatofor dan iridosit. Kromatofor terletak pada dermis kulit yaitu sisi luar dan diantara sisik serta mengandung butiran pigmen sebagai sumber warna sebenarnya. Kromatofor ini dapat bergerak dalam sitoplasma atau menumpuk pada permukaan kulit. Iridosit dapat disebut sebagai sel cermin, karena mengandung materi pemantul yang memantulkan warna dari luar tubuh ikan (Yahyadi, dkk., 2004).
Berbagai warna-warni indah pada ikan pada dasarnya dihasilkan oleh sel-sel pigmen yang terletak pada kulit ikan. Mekanisme pergerakan butiran pigmen pada ikan dikendalikan oleh hormon-hormon tertentu sebagai akibat reaksi terhadap kondisi lingkungan ikan yang bersangkutan. Oleh karena itu, ikan bisa tampak berbeda pada kondisi lingkungan berbeda. Pola warna dasar ikan sepenuhnya ditentukan oleh faktor genetik ikan bersangkutan. Tampilan warna ikan selain ditentukan oleh jumlah dan konsentrasi sel-sel warna, juga ditentukan oleh kedalaman letak sel tersebut dalam lapisan kulit (Khairyah, dkk., 2010).
Bahan aktif tertentu yang ditambahkan pada makanan dapat membuat warna ikan koi lebih cemerlang. Ikan koi yang dipelihara atau diternakkan pada kolam lumpur yang banyak mengandung ganggang menunjukkan warna dan kualitas kulit yang baik. Ganggang mengandung zat khusus disebut karoten, mampu membantu membuat warna lebih cemerlang serta banyak makanan ikan koi mengandung ganggang seperti spirulina untuk memperkuat warna ikan (Twigg, 2013).
Komponen utama pembentuk warna merah dan kuning pada ikan hias adalah senyawa karotenoid. Hewan akuatik tidak dapat mensintesis karotenoid dalam tubuhnya dan oleh karena itu harus mendapatkan pigmen ini dari pakan (Maulid, 2011).
Astaxanthin
suplemen pakan untuk peningkatan warna ikan hias. Ada dua kelompok karoten yaitu bersifat nutrien aktif seperti alpa, beta dan gamma karoten serta non nutrien aktif seperti astaxanthin dan kataxanthin (Subamia, dkk., 2010).
Menurut Gupta dan Jha (2006), astaxanthin merupakan pigmen alami dan dikenal sebagai karotenoid yang memiliki warna merah. Secara alami terdapat pada tanaman serta beberapa organisme fotosintesis seperti alga dan beberapa tipe dari jamur, bakteri, pada kulit, cangkang dan kerangka luar hewan air seperti moluska, krustase dan ikan. Namun, jenis karotenoid yang paling efektif dan dominan untuk pewarnaan pada ikan adalah karotenoid dari kelas xantofil jenis astaxanthin.
Astaxanthin adalah pigmen karotenoid golongan xantofil yang dikenal sebagai antioksidan biologis yang baik. Astaxanthin bisa ditemukan pada mikroalga yang hidup di perairan seluruh dunia serta pada hewan laut seperti salmon segar, udang dan lobster. Astaxanthin digunakan sebagai sumber pigmentasi yang memberikan warna merah muda pada organisme-organisme tersebut (Fretes, dkk., 2012).
Menurut Abdullah (2012), kulit udang, lobster dan kepiting mengandung astaxanthin. Senyawa itu mampu meningkatkan kecerahan warna pada berbagai produk seperti kulit ikan. Sedangkan menurut Amin, dkk (2012), astaxanthin dapat diperoleh dari berbagai organisme laut, meliputi tumbuhan mikroskopik yang dikenal sebagai mikroalga serta didapat dari beberapa jenis ikan seperti salmon, tuna dan trout, juga terdapat pada sekelompok krustasea.
sintetis diperoleh dengan cara mengekstrak bahan-bahan, seperti: alga renik Haematococus pluvialis dikenal mempunyai kandungan astaxanthin yang tinggi.
Selain itu, astaxanthin dapat pula diperoleh melalui proses fermentasi sebangsa kamir Xanthophyllomyces dendrorhous atau dengan cara mengekstrak dari udang-udangan krill Antartik (Euphausia superba) (McCoy, 1999).
Menurut Naguib (2000), astaxanthin merupakan antioksidan paling kuat yang pernah ditemukan di alam. Astaxanthin memiliki aktifitas antioksidan 10 kali lebih kuat dari kelompok karoten berupa kanthaxanthin, lutein dan zeaxanthin. Di dalam astaxanthin terkandung karoten yang penting, yaitu berupa: α-karoten, β-karoten, likopen, lutein, zeaxanthin dan β-cryptoxanthin. Kandungan dalam tepung astaxanthin dapat dilihat pada Tabel 4.
Tabel 4. Kandungan Tepung Astaxanthin
No. Komponen Kimia Tepung Astaxanthin (100 g)
1. Air 0.00
Sumber : Oryza, 2010
Menurut Munifah dan Thamrin (2008), astaxanthin atau (3,3’-dihydroxy-β,β’-karoten-4,4’-dione) merupakan salah satu senyawa aktif yang memiliki kandungan 10 kali lipat dibandingkan antioksidan dari beta-karoten yang ditemukan pada wortel, 100 kali lipat dari Vitamin E dan 1.000 kali lipat lebih kuat dari Coenzyme Q10 (CoQ10). Astaxanthin dapat dilihat pada Gambar 3.
tidak dapat disintesa di dalam tubuh hewan sehingga harus ditambahkan ke dalam pakan (Fuji, 1993). Ikan hias air tawar yang diberi pakan astaxanthin dapat membuat warnanya menjadi lebih berkilau atau cemerlang (Sasson, 1991).
Gambar 3. Astaxanthin
Penggunaan karotenoid sebagai sumber pembentuk pigmen warna pada ikan akan lebih efektif jika bahan tersebut berada dalam tubuh makhluk hidup. Pemberian karotenoid dan xantofil yang berasal dari pakan hidup dapat meningkatkan kualitas warna pada ikan. Secara umum, ikan akan menyerap astaxanthin dari pakan dan menggunakannya langsung sebagai sel pigmen warna merah. Namun, dapat pula beberapa ikan mengubah astaxanthin ini menjadi pigmen dasar lutein yang kuning atau zeaxanthin yang oranye tergantung kebutuhannya (Subamia, dkk., 2010).
Wortel
Wortel merupakan salah satu jenis tanaman penghasil karoten yang dapat mempercantik warna ikan hias yang tidak memerlukan biaya besar. Wortel kaya akan beta karoten sehingga bisa menaikkan warna merah seperti spirulina (Sunarno, 2012).
Dalam sistem taksonomi, tanaman wortel diklasifikasikan sebagai berikut: Divisi : Spermatophyta
Subdivisi : Angiospermae Kelas : Dicotyledon Ordo : Umbelliferales Famili : Umbelliferae
Genus : Daucus
Spesies : Daucus carota L. (Pohan, 2008).
Warna oranye tua pada wortel menandakan kandungan beta karoten yang tinggi. Makin jingga warna wortel, makin tinggi kadar beta karotennya. Kadar beta karoten yang terkandung dalam wortel lebih banyak dibanding kangkung, caisim dan bayam. Secara kimia, karoten adalah terpena, disintesis secara biokimia dari delapan satuan isoprena. Dia ada dalam dua bentuk utama yang diberi karakter Yunani: alfa-karoten (α-karoten) dan beta-karoten (β-karoten). Gamma, delta, dan epsilon (γ, δ d an ε-karoten) juga ada. Tepung wortel dapat dilihat pada Gambar 4 (Khairyah, dkk., 2010).
yang disebut karoten dan derivat oksigenasinya xantofil. Dengan kandungan karotenoid yang tinggi, wortel dapat dimanfaatkan sebagai bahan pewarna pangan alami (Ikawati, 2005).
Gambar 4. Tepung Wortel
Spirulina
Spirulina merupakan makhluk hidup autotrof berwarna kehijauan, kebiruan dengan sel berkolom membentuk filamen terpilin menyerupai spiral (helix) sehingga disebut juga alga biru hijau berfilamen. Bentuk tubuh spirulina yang menyerupai benang merupakan rangkaian sel berbentuk silindris dengan dinding sel yang tipis, berdiameter 1-12 mikrometer. Filamen spirulina hidup berdiri sendiri dan dapat bergerak bebas (Hariyati, 2008).
Sumber pigmen alami dapat diperoleh dari Spirulina platensis. Komposisi pigmen yang terkandung dalam spirulina adalah phycocyanin, chlorophyll-a dan carotene. Kandungan karoten yang tersusun adalah xantofil (37%), β-karoten (28%) dan zeaxanthin (17%) (Kurniawati,dkk., 2012).
Kandungan beta karoten pada spirulina akan masuk dalam metabolisme ikan lalu diserap tubuh untuk kemudian mempercerah pigmen. Spirulina meningkatkan warna merah pada ikan (Sunarno, 2012). Selain itu, spirulina terutama mencerahkan warna kuning, merah dan jingga. Tumbuhan bersel satu itu sangat cocok untuk ikan koi yang dipelihara dalam kolam tanpa lumut atau plankton sebagai sumber nutrisi (Anggawati, 2012).
Spirulina menghasilkan berbagai senyawa bioaktif yang mempunyai nilai ekonomi tinggi seperti karotenoid (Suharyanto, 2011). Karotenoid merupakan pigmen yang secara alami terdapat pada tanaman serta beberapa organisme fotosintesis seperti alga dan beberapa tipe dari jamur serta bakteri. Fungsi penting dari karotenoid diantaranya sebagai pembentuk pigmen jingga yang dapat dimanfaatkan sebagai pakan ikan misalnya menambah kecerahan warna pada ikan koi, kandungan karotenoid pada spirulina juga dapat menjadi antioksidan dan dijadikan sebagai food supplement (Layam dan Chandra, 2007).
Pakan ikan koi yang beredar di Indonesia umumnya memiliki varian khusus untuk mencerahkan warna, kandungan utamanya adalah spirulina. Spirulina dalam pakan ikan koi berkualitas foodgrade, sehingga tidak berbahaya bagi ikan (Sribudiono, 2012).
Gambar 5. Alga Hijau Spirulina