DAN DIABETES
ELISA DIANA JULIANTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Pengaruh Pemberian Pati Tapioka Termodifikasi Polifenol Teh Hijau dan Daun Jambu Biji Merah pada Tikus Normal dan Diabetes adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2012
Elisa Diana Julianti
ELISA DIANA JULIANTI. The Effect of Tapioca Starch Modified with Green Tea and Red Guava Leaf Polyphenols on Normal and Diabetic Rats. Under direction of DEDDY MUCHTADI, NURHENI SRI PALUPI, and DEWI RATIH AGUNGPRIYONO.
The aim of this research was to develop low digestibility starch made from tapioca (Manihot utilisima) modified with polyphenol extracts of green tea and guava leaves which are useful for reducing the risk of diabetes mellitus. Ration containing of tapioca starch modified with 4% green tea and 4% guava leaf extracts were fed to streptozotocin induced diabetic Sprague dawley rats. After 35 days of experiment, the blood glucose level, blood lipid profile, liver antioxidant activity and pancreatic Langerhans islets were assayed. The result showed that the tapioca starch modified with 4% green tea and 4% guava leaf extract diets could lower blood sugar levels in diabetic rats and increase the population of beta cells of pancreatic islets. The rations did notinfluence theserumlipidprofile and liver antioxidant activity of the rats.
Keywords: Modified tapioca starch, green tea, guava leaf, diabetic rats, antioxidant status, blood lipid.
ELISA DIANA JULIANTI. Pengaruh Pemberian Pati Tapioka Termodifikasi Polifenol Teh dan Daun Jambu Biji Merah Pada Tikus Normal dan Diabetes. Dibimbing oleh DEDDY MUCHTADI, NURHENI SRI PALUPI, dan DEWI RATIH AGUNGPRIYONO.
Tapioka merupakan hasil ekstraksi dari umbi singkong (ubi kayu). Ubi kayu sebagai komoditas penghasil tapioka memiliki produktivitas yang sangat tinggi. Di beberapa daerah di Indonesia tapioka digunakan sebagai makanan pokok. Namun pemanfaatan tapioka di industri makanan juga cukup tinggi. Akan tetapi pati tapioka mengandung amilosa rendah sehingga mudah dicerna, cepat dan mudah diserap, serta cepat
Tujuan penelitian ini adalah untuk mendapatkan tapioka termodifikasi polifenol dengan daya cerna rendah, mengetahui pengaruh tapioka termodifikasi polifenol terhadap profil lipid darah, aktivitas antioksidan hati, aktivitas hipoglikemik dan gambaran histologi pankreas tikus diabetes. Daya cerna pati dilakukan dengan cara in vitro, sedangkan pengujian profil lipid darah, aktivitas antioksidan hati, aktivitas hipoglikemik dan gambaran histologi dilakukan secara
in vivo menggunakan tikus strain Sprague dawley usia 2 bulan sebanyak 36 ekor yang dibagi menjadi 6 kelompok perlakuan (1= tikus normal, pakan tapioka alami; 2= tikus normal, pakan tapioka termodifikasi polifenol 1; 3= tikus normal, pakan tapioka termodifikasi polifenol 2; 4= tikus diabetes, pakan tapioka alami; 5= tikus diabetes, pakan tapioka termodifikasi polifenol 1; 6= tikus diabetes, pakan tapioka termodifikasi polifenol). Tikus dibuat menjadi diabetes dengan induksi streptozotocin (STZ) sebanyak 45 mg/kg BB.
meningkatkan kadar glukosa darah, sehingga indeks glikemik (IG)-nya cenderung tinggi, oleh karena itu tapioka tidak disarankan digunakan untuk penderita diabetes. Senyawa polifenol merupakan komponen bioaktif yang mampu menurunkan daya cerna karbohidrat, menghambat aktivitas enzim pencernaan terutama amilase dan tripsin. Senyawa polifenol dapat membentuk komplek dengan pati yang menyebabkan terjadinya perubahan struktur molekul pati sehingga tidak dikenali oleh enzim pencernaan. Oleh karena itu perlu dilakukan penelitian mengenai pengembangan pati berdaya cerna rendah berbahan baku tapioka (Manihot utilisima) yang dimodifikasi dengan ekstrak polifenol dari teh hijau dan daun jambu biji untuk mengurangi resiko timbulnya penyakit diabetes mellitus.
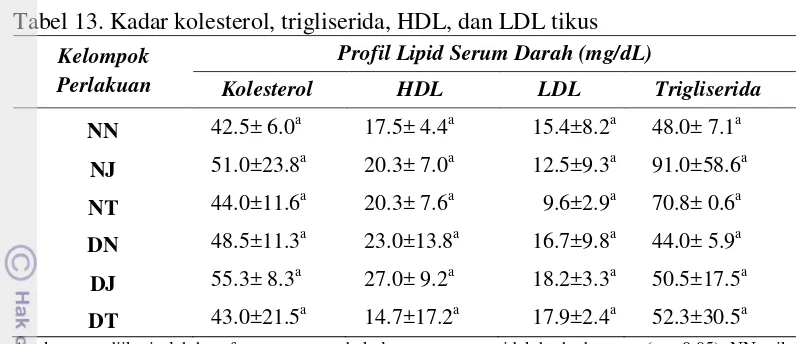
ekstrak daun jambu biji 4% tidak berpengaruh nyata terhadap profil lipid serum darah tikus, aktivitas enzim SOD dan MDA hati tikus (p>0.05) baik pada tikus normal maupun tikus diabetes. Pati modifikasi baik dengan ekstrak teh hijau 4% maupun dengan ekstrak daun jambu biji 4% dapat menurunkan glukosa darah harian pada tikus diabetes (p<0.05). Tikus diabetes yang diberi pakan pati tapioka alami memiliki glukosa darah harian paling tinggi (384.41 mg/dl) dibandingkan tikus yang diberi pakan tapioka termodifikasi ekstrak teh hijau 4% (365.63 mg/dl) dan tapioka termodifikasi ekstrak daun jambu biji 4% (313.43 mg/dl).
Persen pulau Langerhans per luas jaringan menunjukkan hasil yang tidak berbeda nyata pada keenam kelompok perlakuan. Jumlah sel beta pankreas per 10 mm2 pulau Langerhans, pada tikus diabetes dengan pakan tapioka termodifikasi baik dengan ekstrak daun jambu biji (49.96) maupun ekstrak teh hijau (48.81) lebih tinggi dibandingkan tikus diabetes dengan pakan tapioka alami (33.57). Artinya pemberian pakan tapioka termodifikasi ekstrak teh hijau dan daun jambu biji memberikan pengaruh terhadap perbaikan sel beta pankreas dengan menahan laju kerusakan sel beta sehingga kepadatannya tetap dapat dipertahankan menyamai kepadatan sel beta pada tikus normal.
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
DAN DIABETES
ELISA DIANA JULIANTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Mayor Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Penelitian : Pengaruh Pemberian Pati Tapioka Termodifikasi
Polifenol Teh Hijau dan Daun Jambu Biji Merah pada Tikus Normal dan Diabetes
Nama : Elisa Diana Julianti
NRP : F251080311
Program Studi : Ilmu Pangan
Disetujui Komisi Pembimbing
Prof. Dr. Ir. Deddy Muchtadi, MS Ketua
Anggota
Dr. Ir. Nurheni Sri Palupi, MS
Anggota
Drh. Dewi Ratih Agungpriyono, Ph.D.
Mengetahui Ketua Program Studi
Ilmu Pangan
Dekan Sekolah Pascasarjana
Dr. Ir. Ratih Dewanti Hariyadi, MSc. Dr. Ir. Dahrul Syah
Puji dan syukur penulis panjatkan kepada Allah SWT atas berkah, rahmat, dan ridho-Nya sehingga penulis dapat menyelesaikan tesish dengan judul “Pengaruh Pemberian Pati Tapioka Termodifikasi Polifenol Teh Hijau dan Daun Jambu Biji Merah pada Tikus Normal dan Diabetes”. Penulis menyampaikan terima kasih kepada:
1. Prof. Dr. Ir. Deddy Muchtadi, MS., Dr. Ir. Nurheni Sri Palupi, MSi., dan drh. Dewi Ratih Agungpriyono, Ph.D selaku dosen pembimbing atas bimbingan, dukungan, kritik, dan saran yang diberikan.
2. Kepada kedua orang tua (H.Djajang SY dan Hj. Ihat Muslihat),Suami (Ramadan), kedua putri tercinta (Deges dan Owie) serta keluarga besar atas doa, kasih sayang, pengertian,dan dukungannnya.
3. Rekan-rekan tim peneliti Puslitbang Gizi dan Makanan (Dra. Heru Yuniati MSi, Nunung, Mba Ema, Drh Endi Ridwan, MSc, dan Dr. Reviana) atas bantuan dan kerjasamanya.
4. Bapak Nurwahid, Bapak Rojak, Bapak Sobirin, Ibu Aas, Pak Pandi, Mba Dewi, Mba Ella, Mas Bangkit, Mba Kiki beserta staf Teknisi Laboratorium Departemen Ilmu dan Teknologi Pangan, FATETA-IPB, Laboratorium Toksikologi Pangan Puslitbang Gizi dan Makanan, serta Laboratorium Patologi, Departemen Klinik, Reproduksi dan Patologi, FKH-IPB.
5. Mas Nono, Muti dan rekan-rekan IPN 2008, atas bantuan, motivasi dan kebersamaannya.
Ucapan terima kasih yang sebesar-besarnya kepada Puslitbang Gizi dan Makanan, Badan Litbang Kesehatan, Kementrian Kesehatan atas bantuan dana penelitian yang telah diberikan sehingga penelitian ini dapat berjalan. Saran dan kritik sangat penulis harapkan, semoga karya ilmiah ini dapat bermanfaat bagi semua pihak yang membutuhkan.
Bogor, Juli 2012
Djadjang Syafrudin dan ibu Hj. Siti Muslihat. Penulis merupakan putri ketiga dari empat bersaudara.
Tahun 1997 penulis lulus dari SMA Negeri 3 Bogor dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis memilih jurusan Gizi Masyarakat dan Sumberdaya Keluarga, Fakultas Pertanian. Kesempatan untuk melanjutkan ke program Pascasarjana pada program studi Ilmu Pangan diperoleh pada tahun 2008. Beasiswa pendidikan diperoleh dari Badan Litbang Kesehatan, Kementrian Kesehatan Republik Indonesia.
i Halaman
DAFTAR TABEL ….……….………... iii
DAFTAR GAMBAR ………..…….………... iv
DAFTAR LAMPIRAN………. v
I. PENDAHULUAN ……….... 1
1. 1. Latar Belakang ……..……….……..………. 1
1. 2. Tujuan……… 3
1. 3. Hipotesis………..……….. 3
II. TINJAUAN PUSTAKA ………..……… 4
2.1. Pati……… …..……….…….. 4
2.1.1. Pati Tapioka (Manihot utilisima)….... 5
2.2. Polifenol………..………... 5
2.2.1. Polifenol Teh Hijau (Camellia sinensis)……….. 7
2.2.2. Polifenol Daun Jambu Biji (Psidium guajava Linn)……… 8
2.3. Enzim Antioksidan………. 10
2.3.1. Enzim Superoksida Dismutase (SOD)………. 10
2.3.2. Enzim Katalase………. 11
2.3.3. Enzim Glutathion Peroksidase………. 11
2.4. Diabetes……….. 11
2.4.1. Pati dan Diabetes……….. 16
2.4.2. Polifenol dan Diabetes……….. 17
2.4.3. Radikal Bebas dan Diabetes………. 19
2.4.4. Dislipidemia dan Diabetes……… 21
2.4.5. Induksi Diabetes dengan Streptozotocin (STZ)………... 21
III METODOLOGI……….. 23
3.1. Waktu dan Tempat Penelitian……….. 23
3.2. Bahan dan Alat………. 23
3.2.1. Bahan………. 23
3.2.2. Alat……… 24
3.3. Tahapan Penelitian………... 25
3.3.1. Penelitian Tahap 1: Ekstraksi Teh Hijau dan Daun Jambu Biji….. 26
3.3.1.1. Ekstraksi Teh Hijau dan Daun Jambu Biji………. 26
ii
yang dimodifikasi)………. 28
3.3.2. Penelitian Tahap 2: Pembuatan Pati Tapioka Termodifikasi Polifenol……….. 28
3.3.2.1. Pembuatan Pati Tapioka Termodifikasi Polifenol………. 28
3.3.2.2. Analisis Proksimat (AOAC 1995)………. 29
3.3.2.3. Analisis Kadar Serat Pangan Metode Enzimatis (AOAC 1995)……….. 30
3.3.2.4. Analisis Daya Cerna Pati Secara Enzimatis (Muchtadi & Palupi 1992)………... 32
3.3.3. Penelitian Tahap 3: Uji In vivo Pati Tapioka Termodifikasi Polifenol terhadap Profil Lipid Darah Tikus dan terhadap Aktivitas Antioksidan Hati Tikus……… 33
3.3.3.1. Persiapan Uji In vivo pada Tikus………... 33
a. Induksi Streptotozin Pada Tikus (Wu & Huan 2008)... 34
b. Pembuatan Ransum (AOAC 1995)………... 35
c. Pengukuran Jumlah Konsumsi Ransum dan Berat Badan………... 35
d. Pembedahan Tikus………. 36
3.3.3.2. Analisis Profil Lipid Darah... 36
a. Pengukuran Kolesterol Serum (Allain et al. 1974)... 36
b. Pengukuran Kadar Trigliserida (Megraw et al. 1979).. 37
c. Pengukuran Kadar HDL (Stein &Myers 1994)…... 37
d. Pengukuran Kadar LDL (Friedewald 1972)... 38
3.3.3.3. Analisis Aktivitas Antioksidan Hati... 38
a. Persiapan Homogenat Hati (Singh et al. 2000)……… 38
b. Pengukuran Aktivitas Enzim Superoksida Dismutase (SOD) Hati (Kubo et al. 2002; Wijeratne et al. 2005; Prangdimurti 2007)... 38
c. Pengukuran Kadar Malonaldehid (MDA) Hati (Singh et al 2000)... 39
3.3.4. Penelitian Tahap 4: Uji In Vivo Pati Tapioka Termodifikasi Polifenol terhadap Glukosa Darah dan Histologi Jaringan Pankreas Tikus………. 39
3.3.4.1. Analisis Kadar Glukosa Darah (Wu & Huan 2008)……... 39
3.3.4.2. Analisis Histologi (Kiernan 1990)……….. 40
3.4. Analisis Data (Walpole 1982)……….. 42
IV. HASIL DAN PEMBAHASAN…..………... 44
4.1. Ekstrak Teh Hijau dan Daun Jambu Biji Merah……….. 44
4.1.1. Total Polifenol dan Aktivitas Antioksidan……… 44
iii
4.3.1. Induksi Streptozotocin dan Pengelompokan Tikus………... 53
4.3.2. Kandungan dan Komposisi Kimia Ransum……….. 53
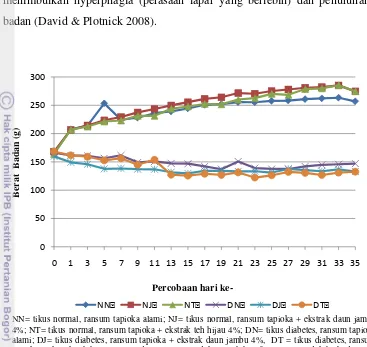
4.3.3. Konsumsi Ransum dan Berat Badan Tikus………... 55
4.3.4. Profil Lipid Darah………. 56
4.3.5. Aktivitas Antioksidan Hati……… 58
4.4. Kadar Glukosa Darah dan Histologi Pankreas…………...………. 60
4.4.1. Kadar Glukosa Darah………. 60
4.4.2. Histologi Pankreas……….. 62
V KESIMPULAN DAN SARAN………... 66
5.1. Kesimpulan………..………… 66
5.2. Saran………...……. 66
iv Halaman
1 Kandungan zat gizi beberapa jenis pati (per 100 g)………... 4
2 Klasifikasi polifenol………... 6
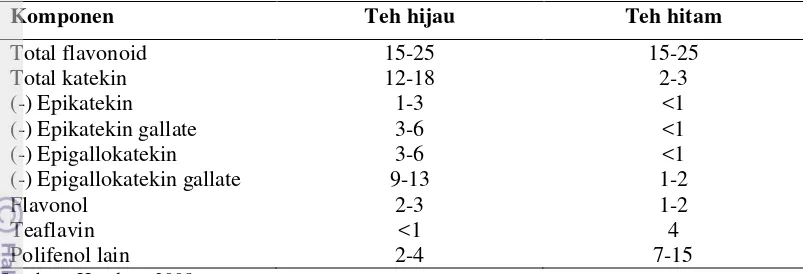
3 Kandungan polifenol teh hijau dan teh hitam (% berat kering)…... 8
4 Tahap penelitian dan analisis……… 25
5 Kelompok perlakuan tikus model………. 34
6 Kadar polifenol dan aktivitas antioksidan (bb) ekstrak teh dan daun jambu biji 58-60oBrix……… 44
7 Daya cerna pati termodifikasi (%) dengan ekstrak teh hijau dan daun jambu biji merah………... 47
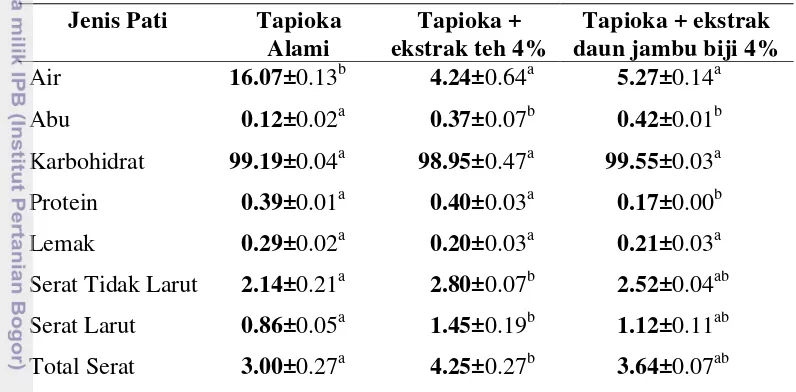
8 Komposisi kimia tapioka termodifikasi (% bk)……….... 51
9 Kelompok perlakuan tikus untuk uji hipoglikemik………...…… 53
10 Komposisi ransum tikus (per 100 g)………. 54
11 Komposisi kimia ransum tikus …………..………... 54
12 Rata-rata konsumsi ransum…………..………. 55
13 Kadar kolesterol, trigliserida, HDL, dan LDL tikus………. 57
14 Aktivitas enzim SOD dan kadar MDA hati tikus... 59
v
1 Aksi potensial dari polifenol dalam diet terhadap metabolisme karbohidrat dan keseimbangan glukosa (Hanhineva et al.2010)... 18 2 Stress oksidatif pada penderita diabetes (Johansen et al.2005).………... 20 3 Proses pembuatan bubuk teh hijau (Widowati 2007) dan daun jambu biji merah
muda kering (Nantitanon yang dimodifikasi 2010).………... 27 4 Proses ekstraksi bubuk teh hijau (Widowati 2007) dan daun jambu biji merah
kering (Nantitanon 2010)……….……… 27 5 Pembuatan pati tapioka termodifikasi untuk uji hipoglikemik dan analisis
kimianya ……….…………... 29 6 Alur penelitian in vivo pada tikus... 33
7 Pati tapioka alami, tapioka termodifikasi ekstrak teh hijau dan daun jambu biji
4%... 50 8 Rata-rata Berat badan harian tikus selama percobaan………... 56 9 Pembentukan ikatan antara flavonoid (quercetagetin) di dalam binding site α
-amylase (Piparo et al. 2008)……….. ………. 62
10 Histologi jaringan pankreas, pulau Langerhans, dan sel beta pankreas:
vi Halaman
1 Aktivitas antioksidan dan total polifenol ekstrak daun jambu dan teh… 77
2 Uji t test aktivitas antioksidan ekstrak daun jambu dan ekstrak teh……. 77
3 Uji t test total polifenol ekstrak daun jambu dan ekstrak teh……… 78
4 Daya cerna pati tapioka………. 79
5 Uji sidik ragam daya cerna pati tapioka ekstrak daun jambu……… 79
6 Uji sidik ragam daya cerna pati tapioka ekstrak daun teh……….... 80
7 Komposisi kimia pati tapioka aseli dan tapioka modifikasi…………... 80
8 Uji sidik ragam dan analisis lanjut kadar air pati tapioka aseli dan tapioka modifikasi (bk)……….. 81
9 Uji sidik ragam kadar abu pati tapioka aseli dan tapioka modifikasi (bk)………... 81
10 Uji sidik ragam kadar lemak pati tapioka aseli dan tapioka modifikasi (bk)………... 82
11 Uji sidik ragam kadar karbohidrat pati tapioka aseli dan tapioka modifikasi (bk)……… 82
12 Uji sidik ragam kadar protein pati tapioka aseli dan tapioka modifikasi (bk)……… 82
13 Uji sidik ragam kadar serat tak larut pati tapioka aseli dan tapioka modifikasi (bk)……… 83
14 Uji sidik ragam kadar serat larut pati tapioka aseli dan tapioka modifikasi (bk)…………...………. 83
15 Uji sidik ragam kadar total serat pati tapioka aseli dan tapioka modifikasi (bk)……… 84
16 Komposisi kimia ransum tikus model………. 84
17 Uji sidik ragam dan analisis lanjut kadar air ransum (bb)………. 85
18 Uji sidik ragam kadar abu ransum (bk)…….……….. 85
19 Uji sidik ragam kadar lemak ransum (bk)….……… 86
20 Uji sidik ragam kadar protein ransum (bk)………...…. 86
21 Uji sidik ragam kadar karbohidrat ransum (bk)………... 86
22 Konsumsi ransum tikus ……..……..………... 87
23 Uji sidik ragam konsumsi ransum(bk) tikus...………. 87
24 Perubahan berat badan tikus normal……… 88
25 Perubahan berat badan tikus diabetes………... 89
26 Perubahan berat badan tikus selama perlakuan………... 90
27 Uji sidik ragamperubahan berat badan tikus……… 90
28 Profil lipid serum darah tikus………... 91
29 Uji sidik ragam kolesterol serum darah tikus………... 92
30 Uji sidik ragam trigliserida serum darah tikus………. 92
31 Uji sidik ragam HDL serum darah tikus……….. 93
vii
36 Gula darah tikus normal………... 96
37 Gula darah tikus diabetes………. 97
38 Kadar gula darah harian tikus selama perlakuan………. 98
39 Uji sidik ragam gula darah harian tikus selama perlakuan……….. 98
40 Luas jaringan pankreas, luas pulau langerhans, dan jumlah sel beta pankreas tikus……….. 100
41 Uji sidik ragam % luas pulau Langerhans/luas jaringan pankreas tikus. 101 42 Uji sidik ragam jumlah sel beta pankreas per 10 mm2 luas pulau Langerhans tikus……….. 102
1.1.Latar Belakang
Tapioka merupakan hasil ekstraksi dari umbi singkong (ubi kayu). Ubi kayu sebagai komoditas penghasil tapioka memiliki produktivitas yang sangat tinggi. Data BPS tahun 2011 menunjukkan produksi ubi kayu mencapai 24 juta ton. Rata-rata produksi tapioka dari tahun 1996 sampai 2001 mencapai 15-16 juta ton, jumlah produksi tapioka yang terserap pasar dalam negeri sebanyak 13 juta ton dan permintaan dalam negeri mengalami peningkatan 10% per tahun. Di Asia Indonesia merupakan produsen nomor dua setelah Thailand (Deptan 2005).
Di beberapa daerah di Indonesia tapioka digunakan sebagai makanan pokok. Namun pemanfaatan tapioka di industri makanan juga cukup tinggi. Tapioka banyak dimanfaatkan dalam industri kue (snack food), mie instant
(noodle), glukosa, fruktosa, sorbitol, etanol, dan lain-lain (CIC 1998). Pati tapioka
mengandung amilosa rendah (20±27%) sehingga mudah dicerna, cepat dan mudah diserap, serta cepat
Senyawa polifenol merupakan komponen bioaktif yang mampu menurunkan daya cerna karbohidrat, menghambat aktivitas enzim pencernaan terutama amilase dan tripsin. Penurunan aktivitas enzim tersebut berdampak pada penurunan daya cerna pati (Piparo et al. 2008; Hanhineva et al. 2010). Senyawa polifenol dapat membentuk komplek dengan pati yang menyebabkan terjadinya perubahan struktur molekul pati sehingga tidak dikenali oleh enzim pencernaan (Thompson et al. 1984). Teh hijau dan daun jambu biji merupakan sumber
polifenol yang potensial. Penelitian menunjukkan bahwa baik teh hijau (Kwon et al. 2008) maupun daun jambu biji
meningkatkan kadar glukosa darah, sehingga indeks glikemik (IG)-nya cenderung tinggi (Moorthy 2004; Niba 2006). Dibandingkan pati jagung, aren dan sagu, tapioka memiliki daya cerna paling tinggi 99.36% dan memiliki ukuran granula pati tapioka lebih kecil (12.58 µm) hampir sama dengan jagung (12.70 µm) (Yuniati et al. 2010). Selain itu tapioka juga memiliki IG tinggi (115+9) (FAO/WHO 1998), oleh karena itu tapioka tidak disarankan digunakan untuk penderita diabetes.
melaporkan bahwa penambahan ekstrak polifenol dari teh hijau sebanyak 7% pada beras membramo pratanak dan 4% pada beras membramo instan fungsional mampu menurunkan daya cerna pati, menurunkan respon glukosa darah (indeks glikemik) dan menghambat laju kerusakan sel β-pankreas tikus diabetes mellitus.
Prevalensi penyakit diabetes di Indonesia pada tahun 2000 menempati urutan ke empat teratas setelah India, Cina dan Amerika Serikat, yaitu 8.4 juta orang. Jumlah ini perkirakan akan mencapai 21.3 juta orang pada tahun 2030 (Wild et al. 2004). Hasil Riset Kesehatan Dasar (Riskesdas) tahun 2007
melaporkan bahwa prevalensi nasional penyakit diabetes melitus berdasarkan hasil diagnosis tenaga kesehatan dan gejala adalah 1.1%. Gambaran penyebaran penyakit ini tertinggi pada daerah perkotaan. Berdasarkan hasil pengukuran gula darah pada penduduk umur > 15 tahun yang bertempat tinggal di perkotaan, prevalensi diabetes melitus adalah 5.7%. Sementara penduduk yang menunjukkan intoleransi glukosa adalah 10.2% (BALITBANGKES 2008).
Penyakit Diabetes Mellitus tipe 2 adalah penyakit yang paling banyak diderita oleh hampir 90-95 % dari seluruh penderita diabetes (Champe & Harvey 2005). Salah satu penyebab kejadian penyakit ini adalah resistensi insulin pada jaringan perifer dan gangguan sekresi insulin dari sel β-pankreas. Resistensi insulin adalah kelainan metabolik yang dicirikan oleh menurunnya sensitivitas jaringan terhadap insulin. Resistensi insulin menyebabkan intoleransi glukosa. Sel
β-pankreas sebagai penghasil hormon insulin melemah, dan mendorong intoleransi glukosa serta hiperglikemia (Mayfield 1998). Konsumsi karbohidrat (pati dan gula) yang tinggi diduga sebagai penyebabnya. Oleh karena itu pencegahan penyakit diabetes mellitus tipe 2, dapat dilakukan dengan mengubah pola makan (jenis, jumlah, dan jadwal).
Beberapa penelitian baik intervensi (Jarvi et al. 1999; Gilbertson et al.
2003) maupun epidemiologik (Kiens dan Richter 1996; Hodge et al. 2004)
menunjukkan bahwa bahan pangan yang disarankan untuk dikonsumsi penderita diabetes mellitus adalah pangan yang dicerna dan diserap secara lambat (slow release), serta meningkatkan kadar glukosa secara lambat, yang lebih dikenal
(1996) melaporkan bahwa pendekatan indek glikemik tidak hanya bermanfaat untuk penanganan penderita diabetes, tetapi juga berperan mencegah diabetes dan komplikasi yang mungkin terjadi akibat menderita diabetes seperti penyakit kardiovaskuler, stroke, kanker, ginjal dan saraf.
Dari uraian di atas maka perlu dilakukan penelitian mengenai pengembangan pati berdaya cerna rendah berbahan baku tapioka (Manihot utilisima) yang dimodifikasi dengan penambahan ekstrak polifenol dari teh hijau
dan daun jambu biji merah untuk mengurangi resiko timbulnya penyakit diabetes.
1.2.Tujuan penelitian
Tujuan umum:
Mengkaji efek hipoglikemik pati tapioka termodifikasi polifenol pada tikus diabetes.
Tujuan Khusus:
1. Menghasilkan tapioka termodifikasi polifenol dengan daya cerna rendah serta menganalisis karakteristik kimia dan biokimianya.
2. Menguji pengaruh tapioka termodifikasi polifenol terhadap kadar kolesterol, trigliserida, HDL, dan LDL darah tikus diabetes.
3. Menguji pengaruh tapioka termodifikasi polifenol terhadap aktivitas enzim superoksida dismutase (SOD) dan kadar malonaldehid hati tikus diabetes. 4. Menguji aktivitas hipoglikemik dan mendapatkan gambaran histologi
pankreas tikus diabetes yang diberi tapioka termodifikasi polifenol.
1.3. Hipotesis
1. Tapioka termodifikasi polifenol menurunkan kadar kolesterol, trigliserida, dan LDL serta meningkatkan HDL darah tikus diabetes.
2. Tapioka termodifikasi polifenol mempertahankan aktivitas enzim superoksida dismutase (SOD) tetap tinggi dan menurunkan kadar malonaldehid hati tikus diabetes.
3. Tapioka termodifikasi polifenol menurunkan kadar glukosa darah tikus diabetes.
4. Tapioka termodifikasi polifenol menghambat laju kerusakan sel β-pankreas
2.1. Pati
Sumber kalori utama manusia yang berasal dari makanan adalah pati. Sebagian besar bahan pangan di seluruh dunia memiliki pati sebagai komponennya. Kentang menjadi komponen utama dalam makanan di Eropa Utara, beras populer di Asia, dan jagung di Amerika Latin, sedangkan umbi dan akar berpati merupakan bagian penting dari konsumsi di sebagian besar daerah tropis. Pati terjadi secara alami melalui fotosintesis dan merupakan polisakarida yang tersimpan dalam tanaman. Pati terdiri dari dua komponen molekul dasar yaitu amilosa dan amilopektin. Amilosa merupakan molekul rantai lurus, sedangkan amilopektin adalah molekul bercabang. Selain itu, masing-masing dihidrolisis, dicerna, dan diserap secara berbeda. Amilosa dihidrolisis terutama oleh amilase, sedangkan amilopektin membutuhkan enzim debranching untuk
hidrolisis lengkap (Niba 2006).
Pati dapat diperoleh dari berbagai sumber tanaman. Sumber-sumber yang paling utama berasal dari serealia (seperti jagung dan gandum), umbi akar (seperti kentang dan ubi kayu/tapioka), dan pati lainnya (seperti pati sagu, pati garut, dan pati kana). Masing-masing pati memiliki kandungan gizi yang berbeda (Tabel 1).
Tabel 1. Kandungan zat gizi beberapa jenis pati (per 100 g) Jenis Pati Air
317-356 0.19-0.25 0.10-0.13 79.19-89.05
Sumber :*Persagi 2009 ; **Karim
et al. 2008
Perhitungan tersebut adalah untuk pati yang dicerna di usus kecil dan bukan pati resisten (Eastwood 2003).
Rata-rata produksi tapioka di Indonesia mencapai 29.426 ton pada tahun 2004. Bahkan Indonesia telah menjadi pengekspor tapioka untuk kawasan Asia dan Eropa. Kebutuhan tapioka dunia sebanyak 29% dipenuhi oleh Indonesia selama tahun 1999-2004 (IFAD/FAO 2000, diacu dalam Astuti et al. 2009).
2.1.1. Pati Tapioka (Manihot utilisima)
Tapioka merupakan salah satu pati yang mudah untuk diekstrak karena ubi kayu memiliki kandungan protein dan lemak yang sangat rendah. Oleh karena itu proses ekstraksi dapat dilakukan secara sederhana. Jika proses dilakukan dengan benar akan diperoleh pati murni berwarna putih. Rendahnya kadar lemak pada pati singkong (<0.1%) menyebabkan memiliki rasa non-sereal yang sangat diinginkan pada banyak produk makanan (Moorthy 2004). Pemanfaatan tapioka dalam pangan meliputi makanan ringan (snack food), aneka biskuit/kraker, bubur
bayi instan, produk olahan daging (bakso, sosis, nugget), tepung bumbu (Fageti 2009), pudding, permen, biskuit, pengental (Tjokroadikusumo 1986), bahan pelapis (coating) makanan instan, permen, dan produk olahan daging (Fadilah 2004).
2.2. Polifenol
Terdapat lebih dari 500 polifenol yang terkandung dalam makanan dan minuman. Saat ini data kandungan polifenol dalam makanan dapat dengan mudah
diperoleh melalui data base phenol-explorer yang dapat diunduh melalui website
telah dievaluasi sebelum disajikan dalam nilai rata-rata. Dari data base tersebut dapat diketahui 502 data polifenol dalam 452 makanan dan memungkinkan semua nilai kandungan aslinya dari sumber-sumber literatur (Neveu et al. 2010). Tabel 2
menunjukkan pengelompokkan polifenol ke dalam 5 kelas utama yaitu flavonoid, lignan, asam fenolik, stilben, dan polifenol lainnya.
Kelas
Tabel 2. Klasifikasi polifenol
Subkelas
Flavonoid Antosianin, dihidrochalcones, dihidroflavonols, flavanols, flavanon, flavon, flavonol, isoflavonoid, flavonoids total Lignan Lignan
Asam fenolik Asam hidrobenzoat, asam hidrocinamat, asam hidroksifenilasetat, asam hidroksifenillaktat, asam hidroksifenilpropanoat, dan total asam fenoli
Stilben Stilben
Polifenol lainnya Alkilmetoksifenol, alkilfenol, betasianin, capsaicinoid, curcuminoid, dihidrocapsaicin, furanocoumarin, hidroksibenzaldehid, hidroksibenzoketon,
hidroksicinnamaldehid, hidroksicoumarin, hidroksifenilalkohol, hidroksifenilpropen, metoksifenol, naptokuinon, terpen fenol, tirosol, dan polifenol lainnya
Sumber:
Polifenol a
diunduh pada 09 Juni 2010
sam fenolik dapat dibedakan menjadi dua kelas utama yaitu turunan dari asam benzoat dan turunan dari asam cinamat. Kandungan asam hidrobenzoat dalam tanaman yang dapat dikonsumsi umumnya sangat rendah, kecuali pada jenis buah tertentu yang berwarna merah, lobak hitam, dan bawang yang bisa mencapai 10 mg/kg berat segar (Shahidi & Naczk 2002, diacu dalam Manach et al. 2004). Polifenol yang ditemukan dalam jumlah kecil pada makanan yang dikonsumsi manusia adalah stilben. Salah satu dari jenis polifenol stilben adalah resveratrol yang memiliki efek antikarsinogenik yang terdapat dalam jumlah kecil pada anggur (0.3–7 mg aglikon/L dan 15 mg glikosida/L dalam anggur merah) (Bertelli et al. 1998, Bhat, Pezzuto 2002, Vitrac 2002, diacu
dalam Manach et al. 2004). Konsumsi polifenol di dalam diet disarankan
maksimal 1 g/hari (Ovaskainen 2008, diacu dalam Hanhineva et al. 2010).
berbeda, polifenol yang paling banyak dikonsumsi dari bahan pangan belum tentu menjadi metabolit aktif dalam target jaringan. Dari 97 penelitian yang meneliti kinetika dan tingkat penyerapan polifenol (dosis tunggal senyawa polifenol murni, ekstrak tumbuhan, atau dalam makanan/minuman) pada orang dewasa, menunjukkan bahwa metabolit yang terdapat dalam darah, hasil aktivitas pencernaan dan hati, biasanya berbeda dari senyawa asli. Asam galat dan isoflavon merupakan polifenol yang paling baik diserap, diikuti oleh katekin, flavanon, dan glukosida kuersetin. Polifenol yang paling sedikit diserap adalah proantosianidin, katekin teh, dan antosianin (Manach et al. 2005b).
Sifat biologis yang dimiliki polifenol beragam yakni sebagai antioksidan, antiapoptosis, antiaging, antikarsinogen, antiinflamasi, antiaterosklerosis, perlindungan jantung, peningkatan fungsi endotel, serta penghambatan angiogenesis dan aktivitas proliferasi sel (Han et al. 2007). Polifenol dianggap
memberikan kontribusi terhadap pencegahan berbagai macam penyakit degeneratif, termasuk penyakit kardiovaskuler. Asumsi ini bermula dari studi in vitro beberapa polifenol terhadap kemampuan antioksidan dan kemampuan
mengatur aktivitas berbagai enzim. Peran protektif polifenol terhadap penyakit kardiovaskuler diperkuat dengan sejumlah studi epidemiologi, uji klinis, percobaan pada model hewan dan studi mekanistik (Manach et al. 2005a).
2.2.1. Polifenol Teh Hijau (
Teh hijau (daun dari Camellia sinensis) merupakan minuman yang popular di kawasan Asia Timur. Di Eropa dan Amerika Selatan biasanya digunakan sebagai herbal (Benelli et al. 2002, Weisburger & Chung 2002, diacu dalam Tsuneki et al. 2004). Manfaat kesehatan dari teh dipercaya disebabkan terutama oleh kandungan polifenolnya yang tinggi terutama flavonoid. Teh dapat dikelompokkan menjadi teh hijau dan teh hitam. Teh hitam diproduksi dengan mendorong oksidasi enzimatik dari flavonoid teh. Enzim yang terlibat dalam oksidasi enzimatik polifenol diinaktifkan untuk memproduksi teh hijau. Baik teh hijau maupun teh hitam kaya akan flavonoid (Tabel 3) (Hogdson 2008).
Tabel 3. Kandungan polifenol teh hijau dan teh hitam (% berat kering)
Komponen Teh hijau Teh hitam
Total flavonoid 15-25 15-25
Total katekin
Hasil studi secara in vitro menunjukkan bahwa beberapa jenis teh
memiliki efek positif terhadap faktor resiko hiperglikemia. Hal ini berkaitan dengan kemampuan polifenol teh dalam modulasi enzim karbohidrat yang berhubungan dengan penyerapan glukosa. Teh memiliki aktivitas penghambatan terhadap salah satu enzim yang terlibat dalam metabolisme karbohidrat yaitu α -glukosidase. Komponen fenolik utama dari teh yang memiliki penghambatan
tinggi terhadap α-glukosidase adalah asam protokatekuik, asam kafeinat, asam koumarik, dan asam galat (Kwon et al. 2008).
Dari hasil studi in vitro diketahui bahwa polifenol teh juga dapat berperan sebagai antioksidan baik secara langsung maupun tidak langsung. Secara langsung melalui pemulungan spesies oksigen dan nitrogen reaktif (scavenging reactive oxygen dan spesies nitrogen) dan mengkelat ion logam transisi redoks-aktif. Secara tidak langsung melalui 1) penghambatan faktor transkripsi redoks-sensitif, factor-kB nuklir dan aktivator protein-1, 2) penghambatan enzim "pro-oksidan",
seperti, lipoksigenase, siklooksigenase dan xanthine oksidase, dan 3) induksi fase II dan enzim antioksidan seperti glutation S-transferase dan superoksida dismutase (Frei dan Higdon 2003)
2.2.2. Polifenol Daun Jambu Biji (
.
Psidium guajava Linn)
Jambu biji (Psidium guajava Linn.) digunakan tidak hanya sebagai
telah dilaporkan dalam studi terhadap hewan coba. Kandungan polifenol yang terdapat dalam daun jambu biji antara lain adalah pedunkladgin, kasuarinin dan isostrikinin. Telah banyak bukti ilmiah yang menunjukkan efektivitas dan keamanan ekstrak teh daun jambu untuk mengobati penyakit diabetes tipe 2. Di Jepang pada Maret 2000, ekstrak teh daun jambu telah disetujui sebagai FOSHU (pangan fungsional) dan dianjurkan bagi individu yang khawatir akan glukosa darahnya yang tinggi karena ekstrak ini dapat mengontrol penyerapan gula (Deguchi dan Miyazaki 2010)
Studi yang dilakukan oleh Shen et al. (2008) menunjukkan bahwa ekstrak
daun jambu biji dapat memulihkan kondisi hiperglikemia pada tikus diabetes. Ekstrak ini juga menstimulasi penggunaan glukosa pada jaringan hati. Selain itu ekstrak ini dapat meningkatkan aktivitas enzim-enzim hati seperti HKase, PFKase dan G6PDHase yang berperan dalam jalur glikolisis dan pentose monophosphat sehingga dapat menurunkan gula darah pada tikus diabet.
.
Penelitian yang dilakukan oleh Kobayashi et al. (2005), diacu dalam
Deguchi dan Miyazaki (2010) menunjukkan bahwa konsumsi oral ekstrak daun jambu sebanyak 200 dan 2000 mg/kg/hari tidak menimbulkan efek abnormal pada tikus dan tidak menunjukkan toksisitas akut dan kronis. Oyama et al. (2005), diacu dalam Deguchi dan Miyazaki (2010) melalui uji DNA repair test (Rec-assay) menyatakan bahwa ekstrak daun jambu memiliki aktivitas mutagenik dibandingkan teh hijau dan teh hitam komersial. Namun dengan uji bacterial reverse mutation test (Ames test), semua ekstrak teh tersebut tidak menunjukkan aktivitas mutagenik.
Komponen fenolik dari daun jambu memiliki kemampuan antioksidan diantaranya dalam menghambat reaksi peroksidasi dalam tubuh (Kimura et al.
1985, diacu dalam He dan Venant 2004). He dan Venant (2004) juga melaporkan bahwa beberapa ekstrak daun jambu menunjukkan aktivitas scavenging radikal
bebas. Penelitian lain yang dilakukan oleh Peng et al. (2010) menunjukkan bahwa
2.3. Enzim Antioksidan
Antioksidan adalah senyawa kimia yang dapat menghambat reaksi oksidasi dengan mengikat radikal bebas dan molekul yang sangat reaktif sehingga kerusakan sel dapat dihambat. Berkaitan dengan reaksi oksidasi di dalam tubuh, status antioksidan merupakan parameter penting untuk memantau kesehatan seseorang. Pada dasarnya tubuh manusia memiliki sistem antioksidan untuk menangkal reaktivitas radikal bebas, yang secara kontinyu dibentuk tubuh (Winarsi 2007).
Senyawa antioksidan dapat berupa enzim dan nonenzim. Enzim antioksidan merupakan antioksidan primer yang diantaranya adalah superoksida dismutase (SOD), katalase, dan glutation peroksidase. Enzim antioksidan ini bekerja dengan cara mencegah terbentuknya senyawa radikal bebas yang baru. Senyawa antioksidan nonenzim merupakan senyawa antioksidan sekunder yang dapat diperoleh melalui makanan. Senyawa ini dapat berupa senyawa nutrisi dan nonnutrisi yang bekerja dengan cara memotong reaksi oksidasi berantai dari radikal bebas atau dengan menangkapnya sehingga tidak akan bereaksi dengan komponen seluler (Winarsi 2007).
2.3.1. Enzim Superoksida Dismutase (SOD)
Superoksida dismutase (SOD) pertama kali diisolasi oleh Mann dan Kleilin pada tahun 1938. Enzim ini dikenal sebagai protein yang mengandung Cu dan diidentifikasi dalam berbagai sebutan, seperti eritrokuprein, indofenol oksidase, dan tetrazolium oksidase (McCord & Fridovitch, 1969, diacu dalam Winarsi 2007).
Enzim SOD juga berfungsi sebagai katalisator reaksi dismutase dari anion superoksida menjadi hidrogen peroksida (H2O2) dan oksigen (O2). Enzim SOD
2.3.2. Enzim Katalase
Katalase adalah enzim yang mengandung heme, yang mengkatalisis dismutase hidrogen peroksida (H2O2) menjadi air dan oksigen. Enzim ini
ditemukan pada semua jenis eukariot aerob, yang penting untuk memusnahkan H2O2
Enzim katalase terdapat pada hampir semua organ utama manusia, terutama di hati dan sel darah merah. Sementara terdapat dalam jumlah sedang di otak, jantung, dan otot. Reaksi dari katalase adalah sebagai berikut (Eastwood 2003):
yang terbentuk dalam peroksisom melalui reaksi oksidasi, seperti β -oksidasi asam-asam lemak, siklus glikosilat (dalam fotorespirasi), dan katabolisme purin (Winarsi 2007).
Fe(III) + H2O2 → Senyawa I
Senyawa I + H2O2 → Catalase–Fe(III) + 2H2O + O2
2.3.3. Enzim Glutathion Peroksidase
Substrat dari glutathion peroksidase adalah senyawa glutathione (GSH). Glutathion peroksidase secara enzimatis membantu oksidasi GSH menjadi menjadi glutation teroksidasi yaitu Glutathione disulfida (GSSG), bersamaan dengan reaksi tersebut enzim ini juga akan mengubah hidrogen peroksida menjadi H2
H
O. pada saat terjadi kelebihan hidrogen peroksida, reaksinya adalah sebagai berikut :
2O2 + 2GSH GSSG + H2
Enzim ini sulit ditemukan di otot, namun banyak ditemukan terutama di hati dan hanya sedikit yang ditemukan di jantung, paru-paru, dan otak. Enzim glutathione peroksidase terdiri dari 4 sub unit protein yang mengandung selenium pada sisi aktifnya. GSH akan mereduksi selenium dan bagian yang tereduksi dari enzim akan bereaksi dengan hidrogen peroksida (Eastwood 2003).
O
2.4. Diabetes
kerusakan toleransi glukosa yang akan meningkatkan kadar glukosa darah. Kedua hal tersebut terjadi karena kekurangan insulin, gangguan fungsi insulin, atau peningkatan faktor yang memiliki fungsi berlawanan dengan insulin, sehingga akhirnya akan menimbulkan gangguan metabolisme karbohidrat, lemak, dan protein (Schersten & Per, 1983).
Penyakit diabetes mellitus telah dikenal ribuan tahun lalu oleh masyarakat Mesir kuno, seperti dalam Ebers Papirus (±1500 SM), yang menyebutkan adanya pengobatan terhadap suatu penyakit yang ditandai dengan sering kencing (Phusparaj et al. 2001). Nama penyakit diabetes berasal dari bahasa latin yang
artinya "sweetened with honey". Hal ini merujuk pada adanya glukosa pada urin
penderita diabetes. Kata mellitus diberikan untuk membedakannya dari diabetes insipidus, yaitu penyakit diabetes yang disebabkan gangguan reabsorbsi air pada ginjal akibat gangguan sekresi hormon anti diuretik oleh hipofise (Berg et al.
2002).
World Health Organization (1980), melalui laporan kedua Expert Committee on Diabetes Mellitus mengelompokkan diabetes menjadi dua
kelompok yaitu Insulin-dependent diabetes mellitus (IDDM) dan Non-Insulin-dependent diabetes mellitus (NIDDM). Pada IDDM, pankreas tidak menghasilkan insulin dalam jumlah yang cukup, sedangkan NIDDM pankreas masih menghasilkan insulin dalam jumlah yang relatif cukup, tetapi insulin yang ada tidak bekerja secara baik karena adanya resistensi insulin (Dalimartha 2004). Pada tahun 1997, Expert Committee on the Diagnosis and Classification of Diabetes Mellitus (ECDCDM) menyepakati klasifikasi baru diabetes mellitus, menjadi DM tipe 1 (yang sebelumnya disebut IDDM atau juvenile diabetes), tipe 2 (sebelumnya disebut NIDDM atau adult-onset) dan gestational diabetes
(Foster-Powel et al. 2002; Rimbawan & Siagian 2004).
Diabetes tipe I, atau diabetes mellitus tergantung insulin (IDDM) disebabkan oleh kerusakan autoimmune dari sel β pankreas dan biasanya dimulai sebelum usia 20. Istilah insulin dependent berarti bahwa individu membutuhkan
non-insulin-dependent, diabetes mellitus (NIDDM) biasanya muncul di kemudian hari (Berg
et al. 2002).
Sekitar 95% penderita DM tipe 1 terjadi sebelum usia 25 tahun, dengan prevalensi kejadian yang sama pada pria dan wanita. Individu yang mengalami DM tipe 1 mempunyai ciri-ciri poliuria (sering kencing), polidipsia (rasa haus yang terus menerus), dan poliphagia (perasaan lapar yang berlebih). Dalam pengujian glukosa darah, pasien yang mengalami diabetes tipe ini apabila diberi 75 g glukosa secara oral dan sebelumnya telah melakukan puasa selama semalam, konsentrasi glukosa darahnya akan meningkat lebih dari 200 mg/dl. Pada individu normal dengan perlakuan sama akan meningkatkan glukosa darah sekitar 140 mg/dl. Tingginya kandungan glukosa darah dalam tubuh, mengakibatkan laju filtrasi glomerulus terhadap glukosa menjadi berlebih dan urin akan mengandung banyak glukosa (Champe & Harvey 2005).
Kelompok DM tipe 2 dicirikan oleh resistensi insulin pada jaringan perifer dan gangguan sekresi insulin dari sel β-pankreas. DM tipe 2 adalah jenis penyakit diabetes yang paling lazim dan berkaitan dengan riwayat diabetes keluarga, usia lanjut, obesitas, perubahan pola makan dan aktivitas fisik yang kurang. Resistensi insulin dan hiperinsulinemia akan menyebabkan intoleransi glukosa. Sel β yang rusak akhirnya menjadi lemah, selanjutnya mendorong intoleransi glukosa dan hiperglikemia (Mayfield 1998). Penyebab terjadinya DM ini belum diketahui dengan pasti, namun individu yang menderita diabetes, secara metabolik mengalami penurunan sensitivitas insulin akibat disfungsi sel β-pankreas dan resistensi insulin (Lebovitz 1999).
yang diamati dalam metabolisme diabetes tipe 2 lebih ringan dari yang diuraikan untuk diabetes tipe 1. Hal ini disebabkan sekresi insulin pada diabetes tipe 2 walaupun tidak memadai namun dapat menahan ketogenesis dan pengembangan ketoasidosis diabetes. Diagnosis paling sering didasarkan pada adanya hiperglikemia, yaitu, suatu konsentrasi glukosa darah lebih besar dari 126 mg/dl. Terjadinya penyakit tipe 2 hampir sepenuhnya ditentukan oleh faktor genetik. Misalnya, di hampir semua pasangan kembar monozigotik, penyakit ini berkembang di kedua individu. Penyakit ini tidak melibatkan virus atau antibodi autoimun (Champe & Harvey 2005).
Pankreas merupakan organ yang terdiri dari sel endokrin, eksokrin, dan duktus. Ketiga sel tersebut secara kolektif mensintesis dan mensekresikan hormon dan enzim yang diperlukan dalam keseimbangan nutrisi. Masing-masing tipe sel ini berasal dari sel endodermal yang terdapat di bagian atas duodenum (Pictet et al. 1976, Fontain & Douarin 1977, diacu dalam Edlund 2001).
Komplikasi mikrovaskular dari penyakit diabetes meliputi nefropati dan retinopati. Komplikasi makrovaskular diabetes dapat mengakibatkan komplikasi penyakit kardiovaskuler aterosklerotik seperti penyakit jantung koroner, penyakit serebrovaskular dan penyakit pembuluh darah perifer. Penyakit kardiovaskuler tersebut merupakan penyebab utama kematian pada populasi diabetes (ADA 2002, diacu dalam Johansen et al. 2005).
daripada tipe 2. Perubahan ukuran pulau Langerhans akibat terjadinya hipertrofi dan perubahan proporsi pulau Langerhans akan lebih terlihat pada DM tipe 1.
Perubahan kualitatif pada pulau Langerhans dapat berupa degenerasi hidropik sel beta, hipertrofi pada sel beta, degranulasi pada sel beta, atrofi pada sel-sel pulau Langerhans, perubahan inti, penimbunan lemak, fibrosis pulau Langerhans, kalsifikasi pulau Langerhans, infiltrasi sel-sel radang pada pulau Langerhans (insulinitis), amyloidosis, hialinisasi, dan kemungkinan regenerasi sel pada pulau Langerhans (Gepts 1981).
Insulin adalah hormon polipeptida yang dihasilkan oleh sel β dari kluster
pulau Langerhans yang tertanam di bagian eksokrin dari pankreas. Pulau Langerhans membuat hanya sekitar 1-2 persen insulin dari total sel pankreas. Insulin merupakan hormon yang paling penting dalam koordinasi penggunaan bahan bakar oleh jaringan. Efek metabolismenya adalah anabolik, diantaranya adalah mendukung sintesis glikogen, triasilgliserol, dan protein (Champe & Harvey 2005)
Insulin terdiri dari 51 asam amino yang tersusun dalam dua rantai polipeptida, yang berdesain A dan B. Asam-asam amino tersebut dihubungkan bersama oleh dua jembatan di-sulfida. Molekul insulin juga mengandung jembatan disulfida intramolekul antara residu asam amino pada rantai A. Sekresi
insulin oleh sel β dari pulau Langerhans pankreas dikoordinasikan dengan pelepasan glukagon oleh sel-sel pankreas. Jumlah insulin dan glukagon yang dilepaskan pankreas diatur sehingga glukosa yang disimpan hati sama dengan penggunaan glukosa oleh jaringan perifer. Mengingat peranannya dalam koordinasi, maka sel β dapat menanggapi berbagai rangsangan. Secara khusus, sintesis dan sekresi insulin meningkat oleh adanya glukosa, asam amino, dan hormon gastrointestinal (Champe & Harvey 2005).
.
Sintesis dan pelepasan insulin menurun ketika ada kelangkaan bahan bakar makanan, juga dapat terjadi selama periode stres (misalnya, demam atau infeksi). Efek ini terutama diperantarai oleh epinefrin, yang disekresi oleh medula adrenal sebagai respon terhadap stres, trauma, atau olahraga ekstrim. Dengan kondisi tersebut, pelepasan epinefrin sebagian besar dikontrol oleh sistem saraf. Epinefrin memiliki pengaruh langsung pada metabolisme energi (menyebabkan mobilisasi yang menghasilkan bahan bakar energi) termasuk glukosa dari hati (diproduksi oleh glikogenolisis atau glukoneogenesis) dan asam lemak dari jaringan adiposa. Selain itu, epinefrin dapat menormalkan kadar glukosa dan merangsang pelepasan insulin. Jadi, dalam situasi darurat, sistem saraf simpatik memegang kendali atas
sekresi sel β (Champe & Harvey 2005).
Resistensi insulin adalah kondisi terjadinya penurunan kemampuan respon dari jaringan target, seperti hati, adiposa, dan otot untuk mempertahankan konsentrasi sirkulasi insulin. Resistensi insulin dapat terjadi karena tidak terkontrolnya glukosa di hati, produksi glukosa, dan penurunan pengambilan glukosa dari darah ke otot dan adiposa (Champe & Harvey 2005).
2.4.1. Pati dan Diabetes
Pati dan sukrosa merupakan karbohidrat yang paling penting dalam makanan. Kebanyakan karbohidrat dicerna menjadi monosakarida di saluran pencernaan bagian atas dan kemudian diserap untuk disirkulasikan. Peningkatan konsentrasi glukosa darah mendorong sekresi insulin dari sel beta pankreas dan insulin menjadi agen perantara sehingga glukosa dalam darah dapat diangkut menuju jaringan. Hormon glukagon akan bekerja ketika glukosa darah turun di bawah normal. Glukagon mendorong hati untuk memproduksi glukosa melalui glikogenolisis dan glukoneogenesis (Hanhineva et al. 2010).
yang mempengaruhi nilai GI suatu bahan pangan berkaitan dengan sifat pati, pengolahannya, persiapan, dan konsumsi. Pati dihidrolisis oleh enzim amilase dari saliva dan pankreas untuk menghasilkan monosakarida seperti glukosa dan maltodekstrin. Selanjutnya akan diangkut melalui vena portal hati dan tersedia untuk metabolisme. Daya cerna dan metabolism pati diklasifikasikan ke dalam tiga kategori: pati cepat cerna, pati lambat cerna, dan pati resisten (Niba 2006).
Pati cepat cerna (rapidly digestible starch/RDS) adalah pati yang dapat
dicerna dengan sempurna, hal ini terkait dengan respon glukosa post-prandial dan memiliki pengaruh pada tingkat insulin. Pati cepat cerna umumnya terdapat pada makanan yang mengalami proses tinggi seperti sereal produk puffing gandum. Pati lambat cerna (slowly digestible starch/SDS) terdapat pada makanan seperti
kacang dan pasta. Pati cepat cerna adalah pati yang cepat diserap dan dimetabolisme, sedangkan pati lambat cerna, mencerna lebih lambat dan diserap perlahan sehingga menimbulkan rasa kenyang yang lebih lama (Niba 2006).
Kondisi fisiologis seperti penyakit diabetes tipe II dan obesitas telah dikaitkan dengan metabolisme pati. Kondisi lain seperti penyakit jantung koroner terkait dengan metabolisme glukosa dari pati bahan pangan. Daya cerna pati ditentukan oleh ketersediaan dan kerentanannya terhadap enzim pencernaan yang dipengaruhi oleh sifat kimia pati dan perubahan akibat dari pengolahan (Niba 2006).
2.4.2. Polifenol dan Diabetes
Ulasan Hanhineva et al. (2010) mengenai peranan polifenol dalam keseimbangan glukosa dan diabetes tipe 2, menyebutkan bahwa hubungan polifenol dengan penyakit diabetes berkaitan dengan aktivitas menghambat pencernaan dan penyerapan karbohidrat. Beberapa polifenol diketahui dapat
menghambat aktivitas enzim α-amilase dan α-glukosidase secara in vitro.
Polifenol tersebut diantaranya adalah flavonoid (antosianin, katekin, flavanon, flavonol, flavon dan isoflavon), asam fenolik, dan tanin (proantosianidin dan ellagitanin). Aktivitas penghambatan secara in vitro telah ditunjukkan oleh ekstrak
polifenol dari buah berry (stroberi, raspberry, blueberry dan blackcurrants),
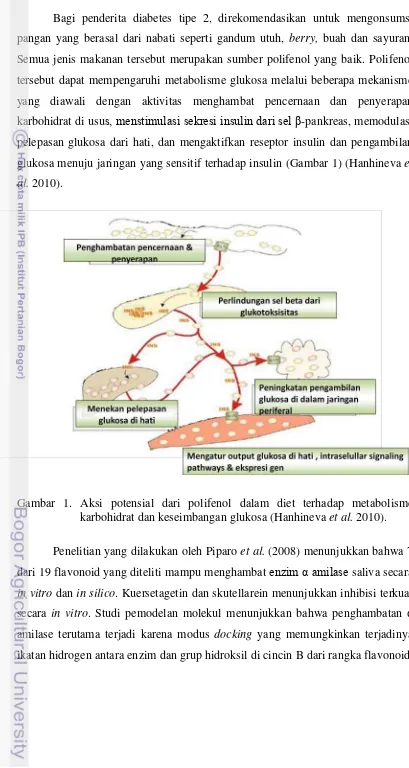
Bagi penderita diabetes tipe 2, direkomendasikan untuk mengonsumsi pangan yang berasal dari nabati seperti gandum utuh, berry, buah dan sayuran. Semua jenis makanan tersebut merupakan sumber polifenol yang baik. Polifenol tersebut dapat mempengaruhi metabolisme glukosa melalui beberapa mekanisme yang diawali dengan aktivitas menghambat pencernaan dan penyerapan karbohidrat di usus, menstimulasi sekresi insulin dari sel β-pankreas, memodulasi pelepasan glukosa dari hati, dan mengaktifkan reseptor insulin dan pengambilan glukosa menuju jaringan yang sensitif terhadap insulin (Gambar 1) (Hanhineva et al. 2010).
Gambar 1. Aksi potensial dari polifenol dalam diet terhadap metabolisme karbohidrat dan keseimbangan glukosa (Hanhineva et al. 2010).
Penelitian yang dilakukan oleh Piparo et al. (2008) menunjukkan bahwa 7 dari 19 flavonoid yang diteliti mampu menghambat enzim α amilase saliva secara
Alternatif lainnya adalah cincin kodensat AC dapat membentuk ikatan H dengan residu dari sisi aktif enzim. Hasil penelitian Tadera et al. (2006), menunjukkan bahwa luteolin, mirisetin, dan kuersetin merupakan inhibitor yang berpotensi menghambat enzim α-amilase yang berasal dari pankreas babi. Dari penelitian tersebut dinyatakan bahwa potensi penghambatan berhubungan dengan jumlah grup hidroksil dari cincin B flavonoid.
Pengaruh polifenol terhadap penyerapan glukosa berkaitan dengan transporter glukosa. Dari beberapa studi in vitro dengan menggunakan intestinal brush border membrane vesicles atau everted sacs dan sel Caco-2, diketahui
bahwa beberapa flavonoid dan asam fenolik dapat menghambat transport glukosa. Glukosa transporter (SGLT1) dihambat oleh asam klorogenik, asam ferulat, asam kafeik dan asam tanat, kuersetin monoglukosida, katekin teh dan naringenin. Glukosa transporter lainnya (GLUT2) dihambat oleh kuersetin, mirisetin, apigenin dan katekin teh (Hanhineva et al. 2010).
Polifenol dan pati dapat membentuk kompleks ikatan yang menyebabkan sisi atau bagian pati yang secara normal dihidrolisis oleh enzim pencernaan menjadi tidak dikenali, sehingga daya cerna pati menjadi rendah (Thompson et al.
1984). Meskipun informasi mengenai ikatan antara polifenol dengan karbohidrat masih sangat terbatas, namun Bear et al. (1985) di dalam Mueller-Harvey et al.
(1986) menyatakan bahwa kemungkinan ikatan antara komponen fenolik dengan karbohidrat adalah ikatan kovalen melalui jembatan eter pada C-4 karbohidrat. Kemungkinan lain tipe ikatan antara polifenol dan karbohidrat melalui jembatan H+
2.4.3. Radikal Bebas dan Diabetes
dan interaksi hidrofobik sangat penting dalam kompleks tersebut. Ukuran molekul dan fleksibilitas konformasi berperan dalam ikatan antara polifenol dan polisakarida dan dipengaruhi oleh pH. Bentuk kompleks tersebut sedikit mengubah struktur polisakarida atau polifenol sehingga menguat afinitasnya.
seringkali terjadi kebocoran elektron. Pada kondisi tersebut akan mudah terbentuk radikal bebas, misalnya hidrogen peroksida H2O2,
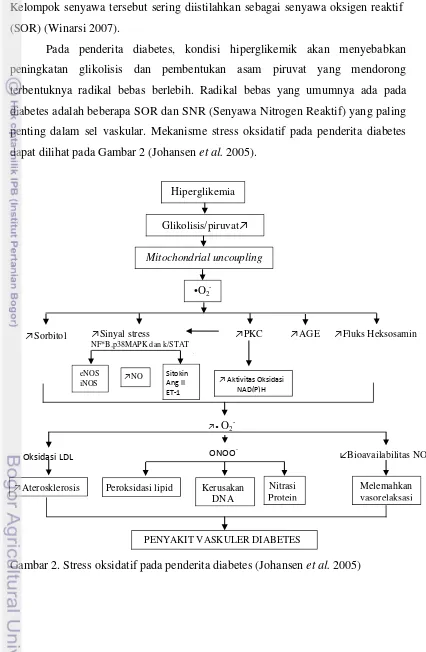
Pada penderita diabetes, kondisi hiperglikemik akan menyebabkan peningkatan glikolisis dan pembentukan asam piruvat yang mendorong terbentuknya radikal bebas berlebih. Radikal bebas yang umumnya ada pada diabetes adalah beberapa SOR dan SNR (Senyawa Nitrogen Reaktif) yang paling penting dalam sel vaskular. Mekanisme stress oksidatif pada penderita diabetes dapat dilihat pada Gambar 2 (Johansen et al. 2005).
ozon, dan lain-lain. Kelompok senyawa tersebut sering diistilahkan sebagai senyawa oksigen reaktif (SOR) (Winarsi 2007).
Gambar 2. Stress oksidatif pada penderita diabetes (Johansen et al. 2005)
↗Sorbitol ↗Sinyal stress
NF*B,p38MAPK dan k/STAT
↗PKC ↗AGE ↗Fluks Heksosamin
ONOO
-Oksidasi LDL ↙Bioavailabilitas NO
Hasil review Johansen et al. (2005) dari beberapa penelitian menyatakan bahwa SOR pada tingkat tertentu terlibat sebagai molekul sinyal dan mekanisme pertahanan seperti dalam fagositosis, fungsi neutrofil, dan tekanan vasorelaksasi. Namun akan berdampak negatif jika jumlahnya berlebih karena akan mengakibatkan stress oksidatif. Stres oksidatif memiliki konsekuensi patologis termasuk kerusakan protein, lipid, dan DNA. Kelebihan SOR dapat merangsang oksidasi low-density lipoprotein (LDL). LDL yang teroksidasi tidak dikenali oleh
reseptor LDL sehingga dapat diambil oleh reseptor scavenger di makrofag
mengakibatkan pembentukan sel busa dan plak aterosklerotik.
2.4.4. Dislipidemia dan Diabetes
Pada penderita diabetes mellitus dapat terjadi abnormalitas lipid yang dikenal dengan istilah dislipidemia. Dislipidemia pada penderita DM berkaitan dengan kelainan lipoprotein yang terkait dengan diabetes mellitus. Kelainan ini dapat meningkatkan risiko penyakit jantung koroner pada penderita diabetes mellitus. Abnormalitas lipid dalam diabetes tipe 2 ditandai dengan tingginya konsentrasi trigliserida, rendahnya HDL, dan normalnya konsentrasi (LDL-c) dan total kolesterol (Valabhji & Elkeles 2003). Pada diabetes mellitus tipe 1, biasanya kelainan ini dapat dikembalikan dengan kontrol glikemik. Pada diabetes mellitus tipe 2, meskipun kualitas lipid dapat diperbaiki, namun kelainan tetap terjadi bahkan setelah kontrol glikemik yang optimal telah dicapai (O’ Brien et al. 1998).
Hipertrigliseridemia pada penderita diabetes mellitus berkaitan erat dengan aterosklerosis karena menjadi penanda dari resistensi insulin dan abnormalitas metabolisme aterogenik. Kecilnya ukuran lipoprotein trigliserida pada penderita diabetes menyebabkan lipoprotein ini dapat masuk ke dinding pembuluh darah lalu teroksidasi, terikat pada reseptor makrofag dan diserap sehingga menyebabkan terjadinya lesi aterosklerotik (Kreisberg 1998).
2.4.5. Induksi Diabetes dengan Streptozotocin (STZ)
Matteucci dan Giampietro (2008), menyatakan bahwa STZ merupakan antibiotik yang dihasilkan oleh Streptomyces achromogenes dan menginduksi
disiapkan sebelum digunakan, karena produk ini tidak stabil, stabilitas akan maksimum pada pH 4. Dosis STZ berkisar antara 40-70 mg/kg intravena dan 35-65 mg/kg intraperitoneal. Dosis yang paling sering digunakan adalah sekitar 35-65 mg/kg bb.
STZ dibawa oleh sel β-pankreas melalui transporter glukosa GLUT2. Toksisitasnya tergantung pada kemampuan alkilasinya bersama dengan aksi sinergis oksida nitrat dan spesies oksigen reaktif yang berkontribusi untuk fragmentasi DNA. Dua jam setelah injeksi (80 mg/kg ip), hiperglikemia dapat diamati dan insulin darah akan menurun. Enam jam kemudian, insulin dalam darah meningkat dan hipoglikemia terjadi sehingga akhirnya hiperglikemia stabil dapat tercapai (West et al. 1996, diacu dalam Matteucci & Giampietro 2008).
Status diabetes dipastikan dengan mengukur kadar glukosa darah selama periode waktu yang luas (2-96 hari setelah pengobatan STZ). Cut off kadar glukosa darah
3.1. Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai bulan Juli 2010 sampai September 2011 dilaksanakan di tiga tempat yaitu 1) Laboratorium Pengolahan, Kimia, serta
Biokimia Pangan dan Gizi, Departemen Ilmu dan Teknologi Pangan, IPB; 2) Laboratorium Pengolahan, Kimia Pangan, dan Hewan Coba, Puslitbang Gizi
dan Makanan, 3) Laboratorium Patologi, Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
3.2. Bahan dan Alat 3.2.1. Bahan
Bahan yang digunakan dalam penelitian ini meliputi bahan baku dan bahan kimia. Bahan baku yang digunakan dalam pembuatan pati tapioka termodifikasi polifenol adalah tapioka/pati singkong (Manihot utilisima), teh hijau (Camellia sinensis) jenis peko super dan daun jambu biji (Psidium guajava)
merah muda sebagai sumber polifenol. Pati tapioka diperoleh dari pabrik tapioka di Ciluer-Bogor. Teh hijau kering jenis peko super varietas gambung diambil dari Kebun Percobaan Pasir Sarongge Cianjur dan daun jambu biji diambil dari daerah Cilebut-Bogor. Daun jambu biji merah yang diambil adalah bagian pucuk dan dua helai daun muda di bawahnya.
Bahan kimia yang digunakan untuk analisis proksimat, total polifenol, serat pangan, dan daya cerna pati meliputi akuades, K2SO4, HgO, H2SO4 pekat,
H3BO3, NaOH-Na2S2O3, HCl 0.02N, kertas saring Whatman no.42, kapas,
heksana, etanol 95%, NaOH 1N, reagen Foline Ciocalteu, Natrium karbonat, standar asam galat,
Tikus yang digunakan untuk uji in vivo adalah tikus Sprague dawley
jantan sebanyak 36 ekor, umur sekitar 2 bulan (berat badan 175-250 g) yang diperoleh dari Puslitbang Biomedis, BALITBANG DEPKES RI. Bahan kimia yang digunakan untuk menginduksi tikus menjadi diabetes adalah streptozotocin.
Bahan-bahan yang digunakan untuk ransum tikus meliputi ransum standar, ransum perlakuan, kasein, minyak jagung, vitamin, mineral mix, selulosa, dan pati tapioka.
Untuk pengukuran glukosa darah tikus diperlukan darah tikus, sedangkan untuk aktivitas enzim Superoksida Dismutase (SOD) dan kadar malonaldehid (MDA) diperlukan organ hati, larutan PBS (Phosphat Buffer Saline), HCl, larutan
TEP (tetraetoksipropana), buffer Natrium-bikarbonat, xantin oksidase, dan buffer kalium fosfat. Bahan yang digunakan dalam mengukur profil lipid meliputi serum darah tikus, kit pereaksi kolesterol (AMS Diagnostics), kit pereaksi trigliserida (AMS Diagnostics), dan kit pereaksi HDL (Daichii Pure Chemical).
Untuk analisis histologi pankreas, bahan yang diperlukan adalah larutan NaCl fisiologis (0.9%), larutan buffer formalin 10%, alkohol 70%, 80%, 90%, 95%, alkohol absolut, xylol, aquades, paraplast, pewarna Hematoxylin-Eosin, bahan perekat preparat, NaHPO.12H2O, NaHPO.2H2
3.2.2. Alat
O, NaCl, NaOH, HCl, timerosal, deionized water, antibodi monoklonal insulin (Sigma 12018), kit
pereaksi immunohistokimia dan es batu.
Alat yang digunakan untuk analisis kimia diantaranya erlenmeyer, labu takar, gelas piala, labu lemak, kertas saring, desikator, timbangan analitik, penangas air bergoyang, pipet, vortex, cawan porselen dan tutupnya, cawan pengabuan dan tutupnya, desikator, penjepit cawan, oven, tanur pengabuan, Soxhlet dengan kondensor, labu Kjeldahl, penangas listrik, dan spektrofotometer.
Untuk pemeliharaan tikus diperlukan tempat makan dan minum, kandang, dan peralatan membuat ransum. Alat untuk analisis aktivitas enzim antioksidan, lipid darah, dan histologi meliputi tabung sentrifus, sentrifus, wadah plastik, pengaduk, mortar, glukometer dan stripnya, tabung ependorf tertutup, mikropipet, termos es, refrigerator, gunting, pisau, silet, botol bertutup, automatic tissue processor, tissue embedding console, penangas, mikrotom, plate panas, staining
jar, corong gelas, stopwatch, magnetik stirer, mikrotip, label, keranjang preparat,
3.3. Tahapan Penelitian
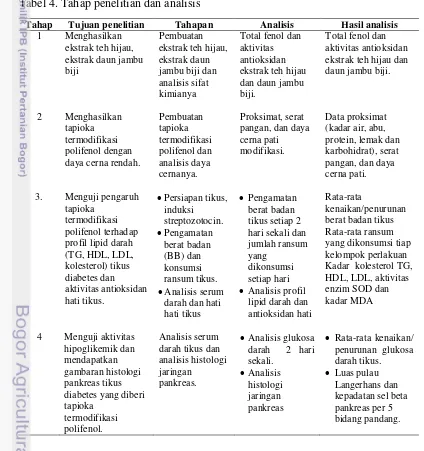
Penelitian dibagi menjadi 4 tahap (Tabel 4). Tahap pertama adalah ekstraksi teh hijau dan daun jambu biji, tahap kedua adalah pembuatan pati tapioka termodifikasi polifenol dan uji daya cerna secara in vitro, tahap ketiga uji
in vivo pengaruh tapioka termodifikasi polifenol terhadap profil lipid darah tikus
dan terhadap aktivitas antioksidan hati tikus, serta tahap keempat adalah uji in vivo aktivitas hipoglikemik dan histologi pankreas tikus diabetes yang diberi
tapioka termodifikasi polifenol.
Tabel 4. Tahap penelitian dan analisis
3.3.1. Penelitian Tahap 1: Ekstraksi Teh Hijau dan Daun Jambu Biji 3.3.1.1. Ekstraksi Teh Hijau dan Daun Jambu Biji
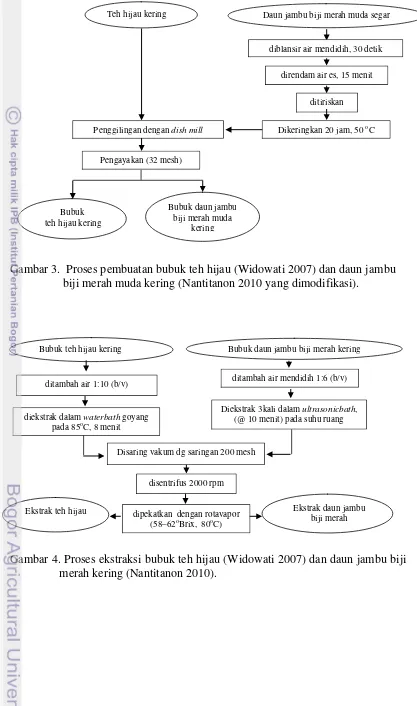
Tahap ini diawali dengan pembuatan bubuk dan ekstrak teh hijau kering dan daun muda jambu biji merah kering, masing-masing dilakukan menggunakan metode Widowati (2007) dan Nantitanon et al. (2010) yang dimodifikasi (Gambar
3). Setelah itu dilanjutkan dengan ekstraksi teh hijau dan daun jambu biji, masing-masing dilakukan dengan kondisi ekstraksi optimum hasil penelitian Widowati (2007) dan metode Nantitanon et al. (2010). (Gambar 4).
3.3.1.2. Analisis Kadar Total Fenol Metode Folin-Ciocalteu (Sato et al. 1996, diacudalam Nantitanon et al. 2010 yang dimodifikasi)
Total fenol diukur berdasarkan kemampuan reagen Folin-Ciocalteu
(campuran fosfomolibdat dan fosfotungstat) dalam mereduksi gugus hidroksi dari fenol. Inti aromatis pada senyawa fenol (gugus hidroksi fenolik) dapat mereduksi fosfomolibdat dan fosfotungstat menjadi molibdenum yang berwarna biru. Kandungan fenolik total dalam tumbuhan dinyatakan dalam GAE (Gallic Acid Equivalent) yaitu jumlah kesetaraan miligram asam galat dalam 1 gram sampel.
Ekstrak pekat sampel dilarutkan dalam etanol absolut hingga diperoleh konsentrasi akhir 0.2 mg/mL. Sebanyak 20 µL larutan ekstrak dalam etanol dicampurkan dengan 45 µL reagen Folin-Ciocalteu dan didiamkan 3 menit. Sebanyak 135 µL Na2CO3
Kadar total polifenol (mg GAE/100 mg ekstrak) =
2 g/100 mL ditambahkan ke dalam campuran, divorteks dan disimpan di tempat gelap pada suhu ruang, 2 jam dan divorteks. Absorbansinya dibaca dengan spektrofotometer pada 750 nm. Asam galat digunakan sebagai standar sehingga satuannya dinyatakan dalam mg GAE/100 mg ekstrak. Kurva standar dibuat menggunakan asam galat (0-130 µg/ml). Kadar total polifenol dihitung berdasarkan persamaan garis yang diperoleh dari kurva standar. Absorbansi yang diperoleh diplotkan pada kurva standar. Kadar total polifenol dihitung berdasarkan rumus sebagai berikut:
Keterangan: A = absorbansi sampel pada panjang gelombang 750 nm S = slope kemiringan pada kurva standar
Fp = faktor pengenceran W = berat sampel (mg)
Gambar 3. Proses pembuatan bubuk teh hijau (Widowati 2007) dan daun jambu biji merah muda kering (Nantitanon 2010 yang dimodifikasi).
Gambar 4. Proses ekstraksi bubuk teh hijau (Widowati 2007) dan daun jambu biji merah kering (Nantitanon 2010).
Bubuk daun jambu biji merah muda
kering
Daun jambu biji merah muda segar
diblansir air mendidih, 30 detik
direndam air es, 15 menit
ditiriskan
Dikeringkan 20 jam, 50 oC
Teh hijau kering
Penggilingan dengan dish mill
Pengayakan (32 mesh)
Bubuk teh hijau kering
Ekstrak teh hijau
Bubuk teh hijau kering
ditambah air 1:10 (b/v)
diekstrak dalam waterbath goyang
pada 85oC, 8 menit
disentrifus 2000 rpm Disaring vakum dg saringan 200 mesh
Ekstrak daun jambu biji merah Bubuk daun jambu biji merah kering
ditambah air mendidih 1:6 (b/v)
Diekstrak 3kali dalam ultrasonicbath, (@ 10 menit) pada suhu ruang
3.3.1.3. Aktivitas Antioksidan, Metode DPPH (Kubo et al. 2002 yang dimodifikasi)
Untuk mengukur aktivitas antioksidan adalah dengan mereaksikan sampel dengan radikal bebas DPPH, buffer asetat dan etanol dalam methanol sehingga terbentuk warna ungu. DPPH merupakan radikal bebas yang stabil. Tingginya aktivitas antioksidan pada sampel akan ditunjukkan oleh banyaknya DPPH yang direduksi yang terlihat dengan semakin pudarnya warna ungu. Warna yang terbentuk dibaca dengan spektrofotometer pada 517 nm. Trolox digunakan sebagai standar yang merupakan analog vitamin E yang larut dalam air. Aktivitas antioksidan dinyatakan dalam satuan TEAC (Trolox Equivalent Antioxidant Capacity).
Analisis dilakukan dengan memasukkan 1 ml buffer asetat 100 mM (pH 5.5), 1.87 ml etanol dan 0.1 ml radikal bebas DPPH (1,1-diphenyl-2-picryl hydrazyl) 3 mM dalam metanol ke dalam tabung reaksi. Kemudian sebanyak 0.03
ml larutan sampel ditambahkan ke dalam tabung tersebut, divorteks dan diinkubasi pada 25o
Sebagai kontrol digunakan 0.03 ml aquades sebagai pengganti sampel. Kemudian absorbansinya diukur pada 517 nm. Standar digunakan adalah Trolox
C, selama 20 menit.
®
(6-Hydroxy-2, 5, 7, 8-tetramethylchroman-2-carboxylic acid) 0; 1.25; 2.5 dan 5 mM sehingga satuannya dinyatakan dalam TEAC. Penurunan absorbansi menunjukkan adanya aktivitas scavenging atau aktivitas antioksidan.
3.3.2. Penelitian Tahap 2: Pembuatan Pati Tapioka Termodifikasi Polifenol. 3.3.2.1. Pembuatan Pati Tapioka Termodifikasi Polifenol
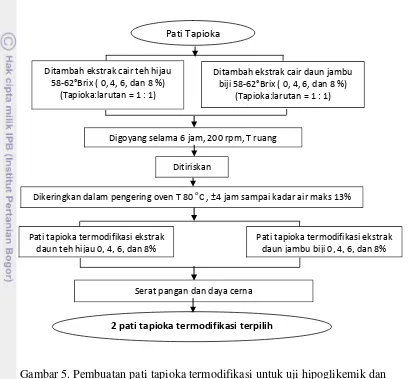
Setelah diperoleh ekstrak teh hijau dan ekstrak daun jambu biji merah, dilanjutkan dengan pembuatan pati tapioka termodifikasi. Alur pembuatan tapioka termodifikasi polifenol dapat dilihat pada Gambar 5.
masing-masing 4%, 6%, dan 8% (6 sampel). Sifat kimia yang dianalisis meliputi serat pangan, dan daya cerna. Berdasarkan evaluasi sifat kimia akan ditentukan 2 pati tapioka termodifikasi polifenol yang memiliki daya cerna terendah untuk digunakan pada penelitian tahap 2.
Gambar 5. Pembuatan pati tapioka termodifikasi untuk uji hipoglikemik dan analisis kimianya
3.3.2.2. Analisis Proksimat (AOAC 1995)
Pengujian analisis proksimat terdiri dari analisis kadar air, abu, protein, lemak, sedangkan karbohidrat diperoleh dengan cara “by difference”. Analisis
kadar air dilakukan dengan menggunakan metode oven, analisis kadar abu dengan pengabuan kering, analisis kadar lemak dengan metode Soxhlet, dan analisis kadar protein dilakukan dengan metode Mikro-Kjeldahl.
Digoyang selama 6 jam, 200 rpm, T ruang
Ditiriskan
Dikeringkan dalam pengering oven T 80 oC , ±4 jamsampai kadar air maks 13%
2 pati tapioka termodifikasi terpilih Serat pangan dan daya cerna
Pati Tapioka
Ditambah ekstrak cair teh hijau 58-62°Brix ( 0, 4, 6, dan 8 %)
(Tapioka:larutan = 1 : 1)
Ditambah ekstrak cair daun jambu biji 58-62°Brix ( 0, 4, 6, dan 8 %)
(Tapioka:larutan = 1 : 1)
Pati tapioka termodifikasi ekstrak daun jambu biji 0, 4, 6, dan 8% Pati tapioka termodifikasi ekstrak
3.3.2.3. Analisis Kadar Serat Pangan Metode Enzimatis (AOAC 1995)
Analisis kadar serat pangan dilakukan dengan mereaksikan sampel dengan enzim termamil, pepsin dan pankreatin. Residu yang merupakan serat pangan yang tidak larut dicuci dengan etanol dan aseton, kemudian dikeringkan. Filtrat yang merupakan serat larut diendapkan dengan etanol, kemudian disaring dan dikeringkan. Pengukuran serat pangan dibagi menjadi tiga tahap yaitu persiapan sampel, pengukuran serat pangan tidak larut, dan pengukuran serat pangan larut.
Persiapan Sampel
Sampel yang telah diekstrak lemaknya dengan pelarut petroleum eter pada suhu kamar selama 15 menit ditimbang sebanyak 1 g dan dimasukkan ke dalam erlenmeyer, kemudian ditambahkan 25 ml buffer natrium fosfat 0.1 M pH 6. Penambahan buffer dimaksudkan untuk menstabilkan ezim termamil. Sampel ditambahkan 100 µl termamil lalu dipanaskan sambil ditutup dan diinkubasi (T=10o
Sampel didinginkan, kemudian ditambahkan 20 ml akuades dan ditambahkan HCl 4 M hingga pH 1.5. Sampel ditambahkan 100 mg pepsin, lalu erlenmeyer ditutup dan diinkubasikan pada 40
C, selama 15 menit) sambil sesekali diaduk. Tujuan penambahan enzim termamil dan pemanasan ialah untuk memecahkan pati dengan menggelatinisasikan terlebih dahulu.
oC sambil diaduk selama 60 menit.
Pengaturan pH hingga 1.5 dimaksudkan untuk mengkondisikan agar aktivitas enzim pepsin maksimum. Sampel ditambahkan 20 ml akuades dan diatur pH-nya hingga 6.8 dengan cara ditambahkan NaOH. Sampel ditambahkan 100 ml enzim pankreatin, lalu erlenmeyer ditutup dan diinkubasi pada 40o
Pengukuran Residu (Serat Makanan Tidak Larut)
C selama 60 menit sambil diaduk, kemudian sampel ditambahkan HCl kembali hingga pH 4.5. Selanjutnya sampel disaring sehingga diperoleh endapan yang dicuci dengan menggunakan 10 ml akuades sebanyak 2 kali.