GAMBIR (UNCARIA GAMBIR) SEBAGAI ZAT WARNA ALTERNATIF
LAIN PADA PEWARNAAN HISTOTEKNIK.
Oleh :
NADIA BINTI AB ALIM
NIM : 070100397
FAKULTAS KEDOKTERAN
UNIVERSITAS SUMATERA UTARA
GAMBIR (UNCARIA GAMBIR) SEBAGAI ZAT WARNA ALTERNATIF
LAIN PADA PEWARNAAN HISTOTEKNIK.
“ Karya Tulis Ilmiah ini ditujukan sebagai salah satu syarat untuk
memperoleh Sarjana Kedokteran ”
Oleh :
NADIA BT AB ALIM
NIM : 070100397
FAKULTAS KEDOKTERAN
UNIVERSITAS SUMATERA UTARA
LEMBAR PENGESAHAN
Judul: Gambir (Uncaria Gambir) Sebagai Zat Warna Alternatif Lain Pada Pewarnaan Histoteknik. Nama: Nadia bt Ab Alim
Nim : 070100397
Dosen Pembimbing, Penguji I,
... ... (dr. Alya Amila Fitrie,M.kes) (prof Harun Al Rasyid Damanik) NIP:19660309-200012-1-007 NIP:130 802 437
Penguji II,
... (dr. Isti Ilmiati Fujiati,Msc.CM-FM,MPd.Ked) NIP:132 231 985
Medan, 20 Disember 2010 Dekan
Fakultas Kedokteran Universitas Sumatera Utara
ABSTRAK
Latar belakang : Selama ini Hematoksilin dan Eosin banyak digunakana dalam
pewarnaan jaringan sehingga ia di perlukan dalam diagnosa medis dan penelitian.
Kedua-dua zat warna ini memiliki banyak kekurangan dan kebaikannya tersendiri. Penelitian ini
dilakukan untuk mengetahui apakah uncaria gambir (lebih dikenali sebagai gambir)
dapat menjadi zat warna alternative lain dalam pewarnaan histoteknik. Selama ini gambir
sering digunakan untuk menyirih dan akibatnya timbul warna merah coklat pada mulut
orang yang mengunyahya.
Metode : Jenis penelitian merupakan penelitian eksperimental dengan melakukan
eksperimen pewarnaan histoteknik terhadap jaringan monyet untuk mengetahui apakah
larutan gambir dapat mewarnai jaringan monyet dan dapat menjadi zat warna alternatif
lain pada pewarnaan histoteknik.
Hasil : Dari eksperimen yang telah dilakukan terhadap jaringan serebellum didapati
bahawa konsentrasi larutan gambir yang paling baik adalah 2 % w/v serbuk gambir
dengan pelarut yang digunakan berupa ethanol 70%. Lama inkubasi (yang memberikan
hasil terbaik) adalah 15 menit.
Diskusi : Penelitian ini menunjukkan bahwa gambir dapat digunakan sebagai zat warna
alternatif lain pada pewarnaan histoteknik dan bermanfaat dalam teknik pewarnaan.
Penelitian ini diharapkan bias memberikan manfaat dalam teknik pewarnaan histoteknik
oleh semua pihak terutama di Laboratorium Histologi, Fakultas Universitas Sumatera
Utara, Medan.
ABSTRACT
Background : During the time Hematoksilin and Eosin a lot of uses in network staining
so that it is needing in medical diagnosa and research. Hematoksilin work worked as
alkali staining agent whenever Eosin also as acid staining agent. Both staining pigment
have their own a lot of insuffiency and separate kindliness. This research is conducted to
know whether uncaria gambir ( more recognized as gambir) can become the dyes of
colour alternative of other;dissimilar in histotechnic staining. During the time gambir is
often used for the menyirih of and as a result arise to ruddle the chocolate at mouth one
who munch it.
Method : Research type represent the research experimental by doing experiment of
coloration histoteknik to monkey network to know whether/what condensation gambir
can colour the monkey network and can become the dyes other;dissimilar alternative
colour at histotechnic staining.
Result : From experiment which have been [done/conducted] to network serebellum
discovered by, the of best condensation gambir concentration is 2 % w / v serbuk gambir
by pelarut used by in the form of ethanol 70%. Incubation time ( that give the best result)
is 15 minute
Discussion : This Research indicate that the gambir serve the purpose of dyes
other;dissimilar alternative dyes at histotechnic staining and useful in coloration
technique. This research is expected by a diffraction give the benefit in technique of
histotechnic staining by all party especially in Laboratory Histologi, University Faculty
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat ALLAH S.W.T., karena telah
memberikan kekuatan dan kesempatan kepada penulis, sehingga mampu menyelesaikan
skripsi hasil penelitian yang berjudul Gambir (Uncaria Gambir) Sebagai Zat Warna
Alternatif Lain Pada Pewarnaan Histoteknik ini meskipun dalam bentuk sederhana.
Saya menyadari bahawa hasil penelitian ini masih jauh dari kesempurnaan seperti yang
diharapkan. Saya juga menyadari adanya kesalahan-kesalahan atau kekurangan yang
terdapat dalam skripsi ini. Karena saya hanyalah manusia biasa yang tidak luput dari
kesalahan, maka sangat diharapkan kritik dan saran dari pembaca yang sifatnya
membangun, demi memperbaiki kesalahan-kesalahan yang ada. Saya ingin mengucapkan
ribuan terima kasih kepada pembimbing saya dr. Alya Amila Fitrie,M.kes dan dr. Zulham
di atas bimbingannya. Secara khusus persembahan skripsi ini sebagai ucapan terima kasih
saya kepada bapa Ab. Alim Bin Hj Yaacob dan ibu Rosni Binti Yusuf yang telah banyak
membantu dalam bentuk do’a dan materi yang tidak jemu-jemunya. Rasa terima kasih
juga saya sampaikan kepada suami tersayang Ahmad Faiz Hakimi Bin Ahmad Latfi yang
banyak memberi semangat dan inspirasi kepada saya. Tidak lupa juga teman-teman
sekelompok KTI, Yenni dan Dzul Affendi yang rela meluangkan waktunya hanya untuk
menyusun sebuah hasil penelitian ini. Semoga proposal ini akan memberikan manfaat
bagi pembaca dan mudah-mudahan segala usaha saya tidak sia-sia.
Medan, Disember 2010
Nadia Bt AB Alim
DAFTAR ISI
2.2.2 Pulasan (pewarnaan) Hematoksilin-Eosin………. 11
2.2.3 Larutan Countertaining………. 15
2.3 Pulasan (pewarnaan) Rutin Yang Banyak Dipakai……… 16
BAB 3 KERANGKA KONSEP DAN DEFENISI OPERASIONAL
3.1 Kerangka Konsep penelitian... 20
3.2 Defenisi Operasional... 21
4.4 Pengambilan sample jaringan monyet... 23
4.5 Pembuatan Sedian………...…….. 23
4.6 Pembuatan Larutan Gambir………..…… 24
4.7 Metode Pewarnaan Hematoksilin-Eosin………...…... 24
4.8 Metode Pewarnaan Larutan Gambir... 24
4.9 Analisa Data... 25
4.10 Ethical Clearance... 25
BAB 5 HASIL PENELITIAN DAN PEMBAHASAN 5.1 Hasil Penelitian... 26
5.1.1 Deskripsi Lokasi Penelitian... 26
5.1.2 Karekteristik Penelitian... 26
5.1.2.1 Karekteristik Sampel Jaringan... 26
DAFTAR TABEL
Nomor Judul Halaman
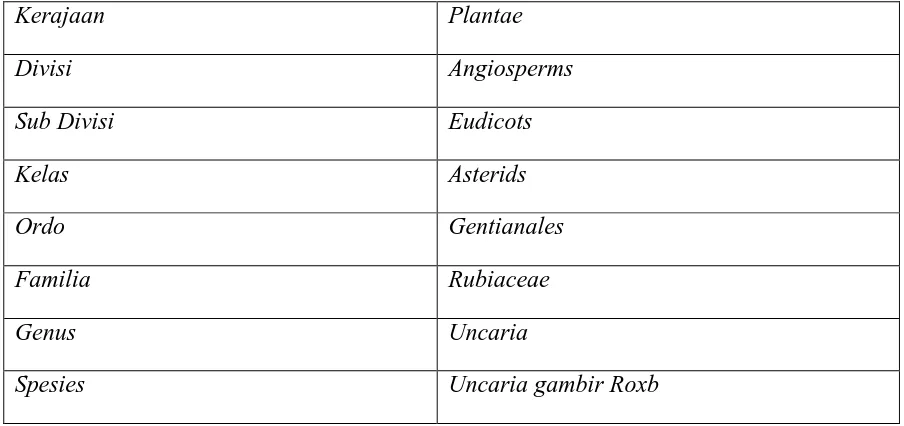
1 Taksonomi Tanaman Gambir 5
2 Berbagai Variasi Konsentrasi dan Pelarut Yang Akan Digunakan 24
DAFTAR GAMBAR
Nomor Judul Halaman
1 Gambar Daun Gambir Dan Gambir 3
2 Jaringan Serebellum Dengan Pewarnaan Hematoksilin-Eosin 17
3 Kerangka Konsep Penelitian 20
4 Konsentrasi Larutan 26
5 Lama Inkubasi 27
6 Pengukuran pH 28
7 Pewarnaan Jaringan Dengan Larutan Gambir 29
8 Pewarnaan Jaringan Dengan Larutan Gambir-hematoksilin 30
9 Pewarnaan Jaringan Dengan hematoksilin-Larutan Gambir 31
DAFTAR LAMPIRAN
Nomor
Lampiran 1 : Daftar Riwayat Hidup
Lampiran 2 : Surat Persetujuan Komisi Etik
ABSTRAK
Latar belakang : Selama ini Hematoksilin dan Eosin banyak digunakana dalam
pewarnaan jaringan sehingga ia di perlukan dalam diagnosa medis dan penelitian.
Kedua-dua zat warna ini memiliki banyak kekurangan dan kebaikannya tersendiri. Penelitian ini
dilakukan untuk mengetahui apakah uncaria gambir (lebih dikenali sebagai gambir)
dapat menjadi zat warna alternative lain dalam pewarnaan histoteknik. Selama ini gambir
sering digunakan untuk menyirih dan akibatnya timbul warna merah coklat pada mulut
orang yang mengunyahya.
Metode : Jenis penelitian merupakan penelitian eksperimental dengan melakukan
eksperimen pewarnaan histoteknik terhadap jaringan monyet untuk mengetahui apakah
larutan gambir dapat mewarnai jaringan monyet dan dapat menjadi zat warna alternatif
lain pada pewarnaan histoteknik.
Hasil : Dari eksperimen yang telah dilakukan terhadap jaringan serebellum didapati
bahawa konsentrasi larutan gambir yang paling baik adalah 2 % w/v serbuk gambir
dengan pelarut yang digunakan berupa ethanol 70%. Lama inkubasi (yang memberikan
hasil terbaik) adalah 15 menit.
Diskusi : Penelitian ini menunjukkan bahwa gambir dapat digunakan sebagai zat warna
alternatif lain pada pewarnaan histoteknik dan bermanfaat dalam teknik pewarnaan.
Penelitian ini diharapkan bias memberikan manfaat dalam teknik pewarnaan histoteknik
oleh semua pihak terutama di Laboratorium Histologi, Fakultas Universitas Sumatera
Utara, Medan.
ABSTRACT
Background : During the time Hematoksilin and Eosin a lot of uses in network staining
so that it is needing in medical diagnosa and research. Hematoksilin work worked as
alkali staining agent whenever Eosin also as acid staining agent. Both staining pigment
have their own a lot of insuffiency and separate kindliness. This research is conducted to
know whether uncaria gambir ( more recognized as gambir) can become the dyes of
colour alternative of other;dissimilar in histotechnic staining. During the time gambir is
often used for the menyirih of and as a result arise to ruddle the chocolate at mouth one
who munch it.
Method : Research type represent the research experimental by doing experiment of
coloration histoteknik to monkey network to know whether/what condensation gambir
can colour the monkey network and can become the dyes other;dissimilar alternative
colour at histotechnic staining.
Result : From experiment which have been [done/conducted] to network serebellum
discovered by, the of best condensation gambir concentration is 2 % w / v serbuk gambir
by pelarut used by in the form of ethanol 70%. Incubation time ( that give the best result)
is 15 minute
Discussion : This Research indicate that the gambir serve the purpose of dyes
other;dissimilar alternative dyes at histotechnic staining and useful in coloration
technique. This research is expected by a diffraction give the benefit in technique of
histotechnic staining by all party especially in Laboratory Histologi, University Faculty
BAB 1
PENDAHULUAN
1.1 Latar belakang
Kebanyakan jaringan didapati tidak berwarna, sehingga tidak banyak yang dapat
dilihat di bawah mikroskop. Agar dapat dilihat dibawah mikroskop, kebanyakan sediaan
harus diwarnai. Oleh sebab itu, telah dirancang pewarnaan jaringan agar berbagai unsur
jaringan jelas terlihat dan dapat dibedakan. Bahan warna mewarna berbagai jaringan,
kurang lebih secara selektif.
Hematoksilin dan Eosin adalah metode pewarnaan yang banyak digunakan dalam
dalam pewarnaan jaringan sehingga ia di perlukan dalam diagnosa medis dan penelitian.
Hematoksilin adalah bahan pewarna yang sering digunakan pada pewarnaan histoteknik,
ia merupakan ekstrak dari pohon yang diberi nama logwood tree. Hematoksilin bekerja
sebagai pewarna basa, artinya zat ini mewarnai unsur basofilik jaringan. Hematoksilin
memulas inti dan strukutur asam lainnya dari sel (seperti bagian sitoplasma yang
kaya-RNA dan matriks tulang rawan) menjadi biru.Eosin bersifat asam. Ia akan memulas
komponen asidofilik jaringan seperti mitokondria, granula sekretoris dan kolagen. Tidak
seperti hematoksilin, eosin mewarnai sitoplasma dan kolagen menjadi warna merah muda
(Junquera, 2007).
Hematoksilin eosin ini mempunyai banyak kekurangannya daripada manfaat. Pada
tahun 1970-an disebabkan oleh banyaknya penebangan hutan di Brazil dan Amerika
Tengah, menyebabkan terjadinya keterbatasan logwood tree dan produksi hematoksilin.
Hal ini meningkatkan harga hematoksilin dan sekali gus mempengaruhi biaya diagnostik
histopatologi dan mendorong pencarian alternatif lain dalam pewarnaan inti.
Kekurangannya lagi adalah komersial sampel yang bervariasi dari kelompok ke
kelompok, tidak spesifik mewarnai inti dan sitoplasma protein, menyebabkan polusi
(hematin, reagen aktif dalam larutanhematoksilin di oksidasi menjadi oksihematin) dan
gabungan hematoksilin dan metal sulit untuk di kontrol. Di sebabkan oleh
standard zat warna ideal yaitu murah, tahan lama, tidak sulit untuk di bersihkan, tidak
merusakkan lingkungan. Pada kajian hematoksilin telah dibuktikan mahal dan dapat
merusakkan lingkungan (Sigh,K, 2002).
Zat warna lain yang perlu dipertimbangkan adalah gambir. Selama ini gambir sering
digunakan secara tradisional.Gambir banyak di pergunakan dalam kehidupan sehari-hari
untuk menyirih. Akibatnya akan timbul warna merah coklat pada mulut orang yang
mengunyahnya. Selama ini gambir belum pernah di coba untuk pewarnaan histoteknik.
Kegunaan lainnya adalah sebagai bahan penyamak kulit dan pewarna. Kemampuan
mewarna gambir adalah karena ia mengandung catechu merah.
1.2 Rumusan masalah
Apakah gambir dapat digunakan sebagai zat warna alternatif lain pada pewarnaan
histoteknik.
1.3 Tujuan penelitian
1.3.1 Tujuan umum : Untuk mengetahui apakah gambir dapat menjadi zat warna
alternatif lain pada pewarnaan histoteknik.
1.3.2 Yang menjadi tujuan khusus dalam penelitian ini adalah :
1. Untuk mengetahui konsentrasi larutan gambir yang akan digunakan.
2. Untuk mengetahui lama inkubasi optimal larutan gambir.
1.4 Manfaat penelitian
1.4.1 Menemukan zat warna alami baru yang bermanfaat dalam teknik pewarnaan.
1.4.2 Mengetahui konsentrasi larutan gambir yang akan di gunakan.
1.4.3 Bila terbukti berhasil zat warna alami ini akan dapat menjadi alternatif lain
BAB 2
TINJAUAN PUSTAKA
2.1 Tanaman Gambir
Gambir (Gambar 2.1.) dikenal dengan nama latin Uncaria gambir Roxb. , nama
English; Cat’s Claw, nama Spanish; Uña de Gato atau nama India; Vilcacora. Nama
daerah untuk gambir di Indonesia yaitu gambir. (Rukmana, 1994). Spesis-spesis gambir
yaitu Uncaria elliptica R.Br. & G. Don (Malaysia), Uncaria gambir Roxb. – Gambir
(Indonesia), Uncaria guianensis J.F.Gmel. (Guyana), Uncaria rhynchophylla (Miq.)
Jacks. (China), Uncaria tomentosa DC - Cat's Claw (South America).
Taksonomi tanaman ini dapat dilihat pada table 2.1.
Tanaman gambir termasuk dalam suku kopi-kopian. Taksonomi tanaman ini dapat
dilihat pada table 2.1. Bentuk keseluruhan dari tanaman ini seperti pohon bougenvil,
yaitu merambat dan berkayu. Komponen kimia gambir sebagai berikut :
1. Catechin biasanya disebut juga dengan asam catechoat dengan rumus kimia
C15H14O6, tidak berwarna, dan dalam keadaan murni sedikit tidak larut dalam air dingin
tetapi sangat larut dalam air panas, larut dalam alkohol dan etil asetat, hampir tidak larut
dalam koloroform, benzen dan eter.
2. Asam Catechu Tannat merupakan anhidrat dari catechin, dengan rumus kimia
C15H12O5. Apabila catechin dipanaskan pada temperatur 110oC atau dengan cara
memanaskan pada larutan alkali karbonat, ia akan kehilangan satu molekul air dan
berubah menjadi Asam Catechu Tannat yang berupa serbuk berwarna coklat
kemerah-merahan, cepat larut dalam air dingin, alkohol, tidak berwarna dalam larutan timah hitam
asetat.
3. Pyrocatechol merupakan hasil penguraian dari zat lain seperti catechin dengan rumus
molekul C6H6O2, bisa larut dalam air, alkohol, eter, benzen, dan kloroform. Jika
dipanaskan akan membentuk catechol; membentuk warna hijau dengan FeCl3;
membentuk endapan dengan Brom; larutannya dalam air cepat berwarna coklat; dapat
mereduksi perak amoniakal dan Fehling.
4. Gambir Flouresensi merupakan bagian kecil dari gambir dan memberikan
flouresensi yang berwarna hijau, dapat dilihat apabila larutan gambir dalam alkohol
dikocok dengan petrolium eter dalam suasana sedikit basa.
5. Catechu Merah yaitu gambir yang memberikan warna merah.
6. Quersetin adalah suatu zat yang berwarna kuning yang terdapat dalam
tumbuh-tumbuhan dan berupa turunan flavonol dengan rumus molekul C15H10O7, disebut huga
dengan melatin atau supheretin dan larut dalam asam asetat glasial yang memberikan
warna kuning, serta larut dalam air dan alkohol, memberikan warna hijau dengan Fe3+ dan akan berubah menjadi warna gelap dengan pemanasan.
7. Fixed Oil merupakan minyak yang sukar menguap.
8. Lilin (malam) terletak pada lapisan permukaan daun gambir. Merupakan monoester
9. Alkaloid pada gambir terdapat 7 macam, yaitu dihidro gambirtaninna, gambirdina,
gambirtanina, gambirina, isogambirina, auroparina, oksogambirtanin(Hiller K dan
Melzig, 2007)
Tabel 2.1. Taksonomi Tanaman Gambir (Keplinger, 1999)
2.1.1 Morfologi tanaman
Tanaman gambir (Uncaria Gambir Roxb) biasa tumbuh liar di hutan dan
tempat-tempat lainnya yang bertanah agak miring dan cukup mendapatkan sinar matahari serta
curah hujan merata setiap tahun. Biasanya tumbuh di ketinggian antara 200 m - 900 m di
atas permukaan laut. Tanaman ini kebanyakan berada di daerah Kalimantan dan Sumatra.
Tumbuhan ini termasuk tumbuhan perdu yang memiliki batang keras yang membelit.
Daunnya bertangkai pendek dan berwarna hijau muda. Bunganya berwarna putih,
berbentuk kecil-kecil dan tongkol bulat. Bagian gambir yang dipanen adalah daun dan
ranting yang selanjutnya diolah untuk menghasilkan ekstrak gambir yang bernilai
ekonomis. (Zamarel dan Hadad,1999). Panen dan pemangkasan daun dilakukan setelah
tanaman berumur 1,50 tahun. Pemangkasan dilakukan 2-3 kali setahun dengan selang 4-6
bulan. Pangkasan daun dan ranting harus segera diolah, karena jika pengolahan ditunda
lebih dari 24jam, getahnya akan berkurang (Zamarel dan Hadad, 1999).
Kerajaan Plantae
2.1.2 Kegunaan gambir
Antara kegunaan gambir yaitu mengobati mencret (daunnya), perut mulas, eksema,
disentri, radang gusi (getahnya), radang tenggorokan, demam-kuning, batuk, haid banyak
dan berdarah.
2.1.3 Pengolahan gambir
Proses pengolahan gambir adalah proses pengeluaran getah yang terkandung dalam
daun dan ranting dengan menggunakan alat pengepres, sedangkan bahan yang akan
dikeluarkan adalah catechin, kandungan inilah yang menentukan persyaratan mutu
gambir. Bagian gambir yang dipanen adalah daun dan ranting yang selanjutnya diolah
untuk menghasilkan ekstrak gambir yang bernilai ekonomis. (Zamarel dan Hadad,1999).
Panen dan pemangkasan daun dilakukan setelah tanaman berumur 1,50 tahun.
Pemangkasan dilakukan 2-3 kali setahun dengan selang 4-6 bulan. Pangkasan daun dan
ranting harus segera diolah, karena jika pengolahan ditunda lebih dari 24jam, getahnya
akan berkurang (Zamarel dan Hadad,1999)
Secara garis besarnya ada beberapa tahapan pengolahan yag harus dilalui, setelah
membawa bahan yang telah dipanen ke tempat kempa dan dilakukan penimbangan
bahan. Tahapan pengolahan gambir terdiri dari :
1. Perebusan Bahan
Daun dan ranting yang telah dipetik dimasukkan ke dalam wadah berupa keranjang
bambu (kapuak = Minangkabau) dengan terlebih dahulu bagian dalam kapuak tersebut
dipasang rajut (jala). Bahan baku dalam wadah harus dipadatkan sedemikian rupa. Secara
tradisional, para petani melakukan pekerjaan ini dengan cara bergantung pada palang
rumah kempa lalu menghentak-hentakkan kakinya terhadap bahan baku di dalam wadah
dengan kekuatan penuh.
Pada proses perebusan ini yang terpenting adalah proses melepaskan catechin dari
sel daun. Terlepasnya catechin ini akan menentukan besar rendemen gambir yang
dihasilkan. Proses melepaskan butiran catechin ini sangat tergantung dengan proses
tusuk dengan kayu runcing guna memberikan jalan air panas masuk ke dalam buntelan
gambir tersebut.
2. Pengempaan Bahan
Bahan yang telah direbus kemudian dikempa dengan menggunakan alat kempa.
Secara tradisional, bahan yang akan dikempa terlebih dahulu harus dililit dengan tali
untuk memudahkan proses pengempaan dan menjaga supaya bahan yang dikempa tidak
berserakan. Proses pelilitan ini membutuhkan waktu sekitar 30-45 menit. Alat kempa
yang selama ini digunakan oleh petani tidak memungkinkan untuk dilakukan berulang
kali untuk satu satuan bahan karena waktu yang digunakan untuk satu kali pengempaan
cukup lama, sehingga mengakibatkan panas yang dikandung bahan setelah perebusan
akan berkurang.
Selanjutnya lilitan tersebut juga akan menyebabkan tidak optimalnya pengempaan
yang dilakukan karena tertahan oleh tali pelilit. Keadaan ini menyebabkan proses
keluarnya getah tidak optimal karena suhu bahan sudah berkurang, dimana oleh Suherdi
(1994) dijelaskan bahwa suhu yang dibutuhkan oleh getah gambir untuk lepas dari
jaringan daun dan ranting secara optimal tidak boleh kurang dari 900 C.
Dalam pengempaan gambir ada beberapa faktor yang harus dipertimbangkan, yaitu
: rendemen, tekanan maksimum di dalam buntelan gambir, kadar catechin gambir kering,
kadar abu, kadar air setelah pengeringan. Hasil pengempaan daun gambir dari perebusan
tradisional, masih menyisakan lebih kurang 25 % dari lembaran daun yang telah
terkempa masih memiliki warna hijau daun yang pekat dan tebal hal ini menandakan
bahwa bagian yang masih berwarna hijau tersebut masih mengandung catechin. Hal ini
berarti masih terdapat lebih kurang 25 % lagi dari bahan baku daun gambir yang masih
belum terekstrak.Saat ini ada beberapa jenis alat kempa yang dipergunakan oleh petani di
Sumatera Barat yang dapat mempengaruhi rendemen dan mutu gambir kering yang
dihasilkan karena adanya perbedaan tekanan maksimum di dalam bahan yang dikempa.
Namun bila ditinjau dari daya tahan alat maka akan dijumpai bahwa alat
tradisional yang mempergunakan rangka kayu akan mudah patah akibat tekanan yang
diberikan sering tidak sesuai dengan kekuatan dari rangka alat tersebut. Demikian pula
dengan alat kempa sistem ulir yang membutuhkan tenaga yang cukup besar untuk
pengoperasiannya, walaupun memperlihatkan hasil yang cukup baik, namum akan sulit
berbukit.Pengolahan model pabrik kurang diminati petani, karena pada umumnya mereka
tidak mau menjual daunnya untuk diolah di tempat lain sebab ampas hasil olahannya
selalu disebar kembali di areal pertanaman mereka sebagai pupuk.
Lama pengempaan berkisar antara 10-15 menit bergantung kepada jenis alat yang
digunakan. Getah daun dan air perasan dari getah daun (ekstrak) hasil kempa ditampung
dengan baskom plastik untuk selanjutnya dilakukan pengendapan. (Nasrun et al,1997)
3. Pengendapan Getah
Ekstrak gambir hasil kempaan dipindahkan ke dalam peraku panjang yang terbuat
dari kayu dengan terlebih dahulu dilakukan penyaringan agar kotoran daun yang terbawa
dalam cairan dapat dipisahkan, untuk selanjutnya dilakukan proses pengendapan.
Pengendapan getah dapat dirangsang dengan menggesek-gesek getah tersebut dengan
kumpulan serat karung goni/plastik. Di dalam paraku biasanya terpisah antara kristal
yang terdapat pada bagian bawah yang dominan terdiri dari katechin, sementara cairan
yang berwarna kecoklatan yang berada pada bagian atas adalah tannin atau katechu tanat.
Sedapat mungkin setelah air katechu tanat diambil baru kristal katechin dikumpulkan
untuk selanjutnya ditiriskan. Proses pengendapan ini biasanya berlangsung sekitar 20
jam. (Yuliani et al,1999)
4. Penirisan Getah
Penirisan dilakukan dengan memasukkan endapan getah (getah yang mengkristal)
ke dalam karung goni dan dihimpit dengan benda yang berat. Air penirisan ditampung
dalam paraku, dimana biasanya air ini dapat digunakan kembali untuk perebusan.
Penirisan ini dilakukan selama 10-20 jam, tergantung dengan banyaknya jumlah bahan
yang ditiriskan. Setelah didapatkan bongkahan sari getah gambir yang berbentuk pasta
padat, maka untuk selanjutnya bisa dilakukan pencetakan.
5. Pencetakan
Ekstrak gambir yang telah melewati proses penirisan akan berbentuk seperti
pasta. Pasta ini sudah dapat dicetak. Pencetakan dilakukan dengan menggunkan alat
cetakan yang terbuat dari bambu (cupak = Minangkabau), yang mempunyai diameter
Untuk keperluan konsumsi, gambir dicetak dengan menggunakan cetakan yang
berbentuk silinder cekung, dan unutk keperluan industri/ekspor gambir dicetak dengan
alat cetakan yang berbentuk koin atau silinder. Untuk 1 orang yang mencetak I kg gambir
dibutuhkan waktu 20-25 menit.
6. Pengeringan
Gambir yang telah selesai dicetak diletakkan dalam wadah yang terbuat dari
bambu/kayu yang mirip baki, disusun rapi dan siap untuk dijemur dengan cahaya
matahari atau di atas tungku pemanas/perebus daun gambir. Pengeringan ini dilakukan
selama 3-4 hari, atau tergantung cuaca jika dijemur dengan cahaya matahari.
(Zeijistra,1943)
2.2 Proses pembuatan histoteknik
2.2.1 Teknik Pewarnaan
Pewarnaan adalah proses pemberian warna pada jaringan yang telah dipotong
sehingga unsur jaringan menjadi kontras dan dapat dikenali/diamati dengan mikroskop.
Proses timbulnya warna terkait dengan terjadinya ikatan antara molekul tertentu yang
terdapat pada daerah dan struktur jaringan yang tertentu. Sinar dengan panjang
gelombang tertentu yang terdapat dalam sinar yang berasal dari cahaya matahari atau
lampu mikroskop yang dipaparkan pada sajian yang telah diwarnai akan diabsorpsi
(diserap) atau diteruskan. Zat warna yang terikat pada jaringan akan menyerap sinar
dengan panjang gelombang tertentu sehingga jaringan tersebut akan tampak berwarna.
Dengan beberapa pengecualian, kebanyakan jaringan tidak berwarna, sehingga
sulit untuk memeriksa jaringan yang tidak diwarnai di bawah mikroskop cahaya. Oleh
karena itu, telah ditemukan metode-metode pewarnaan jaringan, yang tidak hanya
membuat berbagai jaringan menjadi menyolok, tetapi memungkinkan pula diadakan
perbedaan di antara komponen-komponen tersebut. Ini dilakukan dengan menggunakan
campuran zat warna yang mewarnai komponen jaringan lebih kurang secara selektif.
Kebanyakan zat warna yang digunakan dalam pemeriksaan histologi bersifat
seperti senyawa asam atau basa dan mempunyai kecenderungan untuk membentuk ikatan
jaringan yang lebih mudah diwarnai dengan zat warna basa disebut basofilik; yang
menpunyai afinitas terhadap zat warna asam disebut asidofilik.
Contoh zat warna basa adalah biru toluidin dan biru metilen. Hematoksilin
berkelakuan seperti zat warna basa, yaitu mewarnai jaringan basofilik. Komponen ringan
utama yang berionisasi dan bereaksi dengan zat warna basa melakukan hal itu karena
asam dalam komposisi mereka (nucleoprotein dan mukopolisakarida asam). Zat warna
asam misalnya orange G, eosin dan fuchsin asam kebanyakan mewarnai komponen basa
yang ada di dalam protein sitoplasma. Sifat basa atau asam suatu zat biasanya
menjelaskan reaksi pewarnaan secara kimia, tetapi juga ada dasar-dasar fisika.
Dari semua zat warna, yang paling sering digunakan adalah gabungan
hematoksilin dan eosin (H&E). Banyak warna lain yang digunakan dalam berbagai
prosedur histologik. Meskipun mereka berguna dalam menggambarkan berbagai
komponen jaringan, mereka biasanya tidak memberikan keterangan mengenai sifat kimia
jaringan yang sedang dipelajari.
Didasarkan pada metoda produksi, ada dua jenis zat warna, yaitu yang alami dan
sintetis (Carleton, 1976). Hematoksilin diperoleh dari pohon logwood yaitu
Haematoxylum Campachianum adalah contoh pewarnaan alami (Baker & Silverton,
1976). Hematoksilin adalah zat warna mitra untuk eosin di teknik pewarnaan
Hematoksilin & Eosin. Ia akan membuat nukleus berwarna biru-violet atau coklat.
Sedangkan eosin adalah pewarna sintetis yang mewarnai sel darah merah, sitoplasma,
membran sel, kalogen dan struktur di luar sel dengan memberikan warna merah muda
atau warna merah.
Sebelum melakukan pewarnaan serangkaian persiapan yang harus dilakukan
adalah sebagai berikut:
1. Peralatan gelas harus dibersihkan dulu dan dibilas dengan akuades
2. Timbang zat warna dengan cermat dan tepat
3. Larutkan zat warna dalam pelarut yang benar dengan memperhatikan urutan
pencampurannya, misalnya hematoksilin selalu harus dilarutkan dalam alkohol
dulu sebelum ditambahkan bahan lain.
6. Siapkan juga larutan-larutan lain yang diperlukan untuk proses pewarnaan dan
tuangkan dalam wadah yang sesuai
7. Atur urutan larutan-larutan tersebut sesuai dengan prosedur proses pewarnaan
8. Zat warna beralkohol harus ditutup rapat untuk mencegah penguapan alkohol
yang akan menyebabkan presipitasi (pengendapan) zat warna
Pelarut yang umum dipakai dalam proses pewarnaan adalah air dengan derajat
keasaman yang netral (pH 7). Disamping itu juga dapat digunakan cairan pelarut lainnya
seperti etilalkohol (etanol) dengan derajat konsentrasi yang bervariasi. Bila tidak ada
keterangan dalam proses pelarutan yang menggunakan alkohol berarti konsentrasi
alkohol yang digunakan adalah alkohol absolut dengan konsentrasi 99.9%.
2.2.2 Pulasan (Pewarnaan) Hematoksilin-Eosin
Pulasan (pewarnaan) yang sering digunakan secara rutin adalah pewarnaan yang
dapat digunakan untuk memulas inti dan sitoplasma serta jaringan penyambungnya yaitu
pulasan hematoksilin-eosin (HE). Pada pulasan HE digunakan dua macam zat warna
yaitu hematoksilin yang berfungsi untuk memulas inti sel dan memberikan warna biru
(basofilik) serta eosin yang merupakan counterstaining hematoksilin, digunakan untuk
memulas sitoplasma sel dan jaringan penyambung dan memberikan warna merah muda
dengan nuansa yang berbeda.
Hematoksilin merupakan zat warna alami yang pertama kali dipakai tahun 1863.
Hematoksilin akan mengikat inti sel secara lemah, kecuali bila ditambahkan senyawaan
lainnya seperti alumunium, besi, krom dan tembaga. Senyawaan hematoksilin yang
dipakai adalah bentuk oksidasinya yaitu hematein. Proses oksidasi senyawaan
hematoksilin ini dikenal sebagai Ripening dan dapat dipercepat prosesnya dengan
menambahkan senyawaan yang bertindak sebagai oksidator seperti merkuri oksida,
hidrogen peroksida, potassium permanganat dan sodium iodat.
Selama proses oksidasi berlangsung kemampuan hematoksilin utuk mewarnai inti
sel akan terus berlangsung dan akan berkurang bila proses oksidasi telah selesai. Untuk
memperpanjang proses ini larutan hematoksilin dapat disimpan dalam wadah tertutup dan
disimpan dalam ruangan gelap. Dalam kondisi terpapar oleh cahaya sebaiknya larutan
mayer, delafied, Erlich, Bullard dan Bohmer, sedangkan counterstaining yang dipakai
adalah eosin, safranin, dan phloxine.
Beberapa larutan hematoksilin yang digunakan adalah:
1. Hematoksilin Erlich (Zulham,2009).
Hematoksilin Erlich adalah hematoksilin yang paling tahan lama, mudah
berdifferensiasi dan warnanya relatif tahan lama. Hematoksilin ini baru bisa digunakan
setelah 1-2 bulan dibuat. Waktu inkubasinya adalah 30 menit dan counterstainingnya
adalah 0.5 -1% larutan eosin dalam air. Formulanya adalah sebagai berikut
- Hematoksilin ………... 6 gram
- Alkohol absolut ……….. 300ml
- Akuades ……….. 300ml
- Glycerol ……….. 300 ml
- Glacial acetic acid ………... 30 ml
- Potassium alum ………30 ml
Cara pembuatannya adalah sebagai berikut :
- Hematoksilin dilarutkan dalam alkohol
- Sambil digerus dalam mortar secara perlahan-lahan tambahkan bahan lainnya
secara berurutan sambil digerus
- Akhirnya tambahkan kristal potassium alum (Aluminium potassium sulfate)
sambil menggoyang-goyang botol hingga terdapat endapan kristal alum di dasar
botol.
- Botol berisi larutan hematoksilin Ehrlich kemudian ditutup secara longgar dengan
gumpalan kapas dan disimpan ditempat terang selama 1-2 bulan sehingga
hematoksilinnya teroksidasi menjadi haematin. Proses ini dikenal sebagai
pematangan
2. Hematoksilin Delafield (Zulham,2009).
- Hematoksilin kristal ………... 6 gr
- Alkohol absolut ………. 50 ml
- Ammonium alum ………. 55 gr
- Aquades ……….. 600ml
- Glycerol ……… 150ml
Cara pembuiatan larutan hematoksilin Delafield adalah sebagai berikut :
- Larutkan kristal hematoksilin dengan alkohol absolut
- Larutkan ammonium alum dengan akuades hingga jenuh (saturated)
- Campurkan kedua larutan tersebut dan diamkan selama 3-5 hari
- Saring dan tambahkan glycerol
- Biarkan selama 3 hari dalam botol terpapar cahaya
- Setelah 3 hari simpan dalam botol tertutup dan lindungi dari cahaya
3. Hematoksilin Mayer
Larutan hematoksilin Mayer merupakan larutan yang dapat disimpan dalam
waktu lama (berbulan-bulan), counterstaining dengan 0.5-1% larutan eosin dan waktu
inkubasinya 10-15 menit. Formulanya adalah
- Hematoksilin kristal ……….. 1gr
- Aquades ……….. 1000ml
- Sodium iodate ……….. 0.2 gr
- Ammonium/potassium alum ………. 50gr
- Citric acid ……… 1gr
- Chloral hydrate ……… 50gr
Cara pembuatannya adalah sebagai berikut
- Larutkan ammonium/potassium alum di dalam aquades
- Tambahkan hematoksilin dan campurkan secara baik
- Campur dan aduk hingga seluruhnya tercampur dengan baik
- Biarkan semalam dan saring dengan kertas saring besoknya
4. Hematoksilin Harris
Larutan pewarna yang dapat dipakai segera setelah selesai dibuat, counterstaining
dengan 0.5-1% larutan eosin dan waktu inkubasinya adalah 15-20 menit. Formulanya
adalah sebagai berikut
Cara pembuatannya adalah sebagai berikut
- Larutkan hematoksilin di dalam alkohol
- Larutkan ammonium/potassium alum di dalam distilled water dan panaskan
- Hentikan pemanasan dan campur kedua larutan tersebut
- Panaskan dengan cepat sambil di aduk
- Hentikan pemanasan dan campurkan merkuri oksida kedalamnya
perlahan-lahan
- Panaskan kembali hingga larutan bewarna purple gelap
- Hentikan pemanasan dan tempatkan wadah berisi larutan tersebut di dalam
wadah berisi air dingin hingga laurtan hematoksilin menjadi dingin
- Larutan siap untuk digunakan segera setelah dinginkan
- Tambahkan 2-4ml asam asetat glasial per 100ml Larutan untuk
2.2.3 Larutan Counterstaining
Beberapa pulasan yang dipakai sebagai counterstaining larutan hematoksilin
adalah eosin, safranin dan phloxine.
1. Larutan Eosin
Larutan eosin yang digunakan terdiri atas larutan stok (Stock solution) dan larutan kerja (working solution). Adapun kedua larutan ini adalah sebagai berikut
1% Stock Alkohol-Eosin
Eosin stock solution ……… 1 bagian
Alkohol 80% ………... 3 bagian
Dibuat sesaat sebelum digunakan dan tambahkan asam asetat glasial 0.5ml untuk setiap 100 ml larutan dan aduk dengan baik
2. Larutan Phloxine
Laurtan phloxine terdiri atas larutan stock eosin, stock phloxine, working solution dan larutan Safran. Larutan-larutan tersebut adalah sebagai berikut
Stock Phloxine ………. 10ml
Alkohol 95% ………. 780ml
Asam asetat glasial ……….. 4ml
2% Alkohol Safran
Safran du Gatinais ………. 2 gram
Alkohol 100% ……….. 100ml
2.3 Pulasan(pewarnaan) rutin yang banyak dipakai
2.3.1 Pewarnaan Mayer Hematoxylin-Eosin
Pulasan ini banyak dipakai dengan beberapa pertimbangan :
1. Differensiasi warna sangat jelas
2. Mewarnai inti sel dengan baik dan jelas dengan background yang tidak
bewarna
3. Hasil konsisten
4. Prosedurnya sederhana
5. Dapat mewarnai preparat yang difiksasi dengan fiksasi apapun juga prosedur
yang dipakai adalah sebagai berikut
a. Deparafinisasi dengan xylol (2x2 min)
b. Hidrasi dengan serial Alkohol 100% (2x2 min) – 95% (2min) – 90% (2
min) – 80% (2 min) - 70% (2min) – Distilled water (3min)
c. Inkubasi dalam larutan hematoksilin Mayers selama 15 min
d. Cuci dalam air mengalir selama 15-20menit
e. Observasi di bawah mikroskop, bila masih terlalu biru cuci lagi di air
mengalir selama beberapa menit. Bila sudah cukup warnanya lanjutkan ke
langkah selanjutnya
f. Counterstaining dalam larutan Eosin working solution selama 15 detik
g. Dehidrasi dalam serial alkohol dengan gradasi meningkat perlahan mulai
70% hingga 100% masing-masing 2 menit.
h. Jernihkan dan dealkoholisasi dalam xylol 2x2min
i. Tutup dengan balsem kanada
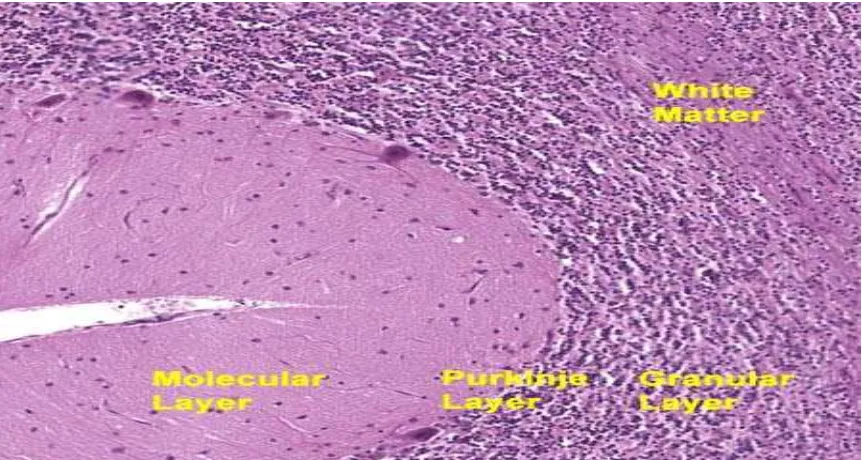
Hasil/ Interpretasi adalah
- Inti sel bewarna biru
- Sitoplasma bewarna kemerahan dengan adanya beberapa variasi warna pada
komponen tertentu (Zulham, 2009).
Gambar 2.2 Jaringan serebellum dengan pewarnaan hematoksilin-eosin. Dengan
pembesaran 10x40.
2.3.2 Pewarnaan Hematoksilin Harris-Eosin
Protokol pulasan hematoksilin Harris –eosin adalah sebagai berikut
b. Hidrasi dalam larutan alkohol dengan gradasi yang menurun dari
100%-95%-90%-80%-70%
c. Inkubasi dalam larutan hematoksilin Harris selama 15 min
d. Bilas dalam air mengalir dalam waktu yang singkat
e. Celup dalam campuran asam-alkohol secara cepat 3-10 celup cek
diferensiasi warna di bawah mikroskop
f. Bilas dalam air mengalir secara singkat
g. Celup sebanyak 3-5 kali dalam larutan ammonium atau lithium carbonat
hingga potongan bewarna biru cerah
h. Cuci dalam air mengalir selama 10-20 menit Bila pencucian tidak
maksimal jaringan sulit terwarna oleh Eosin
i. Inkubasi dalam eosin selama 15 detik hingga 2 menit
j. Dehidrasi dalam alkohol dengan konsentrasi yang meningkat secara
perlahan, masing-masing selama 2 menit
k. Inkubasi dalam xylol 2x2menit
l. Tutup dengan kaca penutup
Hasil/Interpretasi hasil pulasan
- Inti sel bewarna biru
- Sitoplasma bewarna kemerahan dengan adanya beberapa variasi warna pada
komponen tertentu (Zulham, 2009).
2.3.3 Pewarnaan Hematoksilin Mayer-Phloxyne-Safran
Prosedur pewarnaan adalah sebagai berikut
a. Deparafinisasi dalam xylol
b. Hidrasi dalam larutan alkohol dengan gradasi yang menurun dari
100%-95%-90%-80%-70%
c. Inkubasi dalam larutan asam pikrat jenuh selama 5 menit
g. Warnai dalam larutan 1.5% larutan Phyloxine B selama 2 menit
h. Basuh dengan air selama 5 menit
i. Cuci dengan alkohol absolut 3 kali
j. Warnai dalam 2% larutan alkohol Safran selama 5 menit
k. Cuci dengan alkohol absolut 2 kali
l. Inkubasi dalam xylol 2 kali masing-masing selama 2 menit
m. Rekatkan dengan objek glass menggunakan Balsam Kanada
Hasil/interpretasi
- Inti bewarna biru
- Sel darah merah bewarna vermillion pink
- Tulang bewarna kuning
- Tulang rawan bewarna hijau kekuningan
- Otot bewarna merah
BAB 3
KERANGKA KONSEP
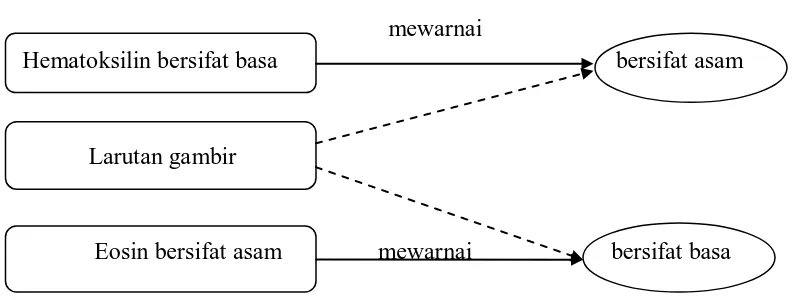
3.1 Kerangka Konsep penelitian
Zat warna komponen sel
mewarnai
Hematoksilin bersifat basa bersifat asam
Larutan gambir
Eosin bersifat asam mewarnai bersifat basa
Gambar 3.1 kerangka konsep penelitian
Komponen-komponen sel bersifat asam dan basa. Komponen sel yang bersifat asam
seperti nukleus yang kaya-RNA dan matriks tulang rawan akan diwarnai oleh
hematoksilin dengan warna biru-violet atau coklat. Komponen sel yang bersifat basa
seperti sel darah merah, sitoplasma, membran sel, kolagen dan struktur diluar sel akan
diwarnai oleh eosin dengan warna merah muda atau warna merah. Manakala larutan
gambir yang masih belum diketahui pelarutnya,apakah ia akan mewarnai komponen sel
- Konsentrasi larutan : perbandingan massa atau volume suatu pelarut terhadap
massa atau volume dari larutan atau pelarut.
- Lama inkubasi : proses mempertahankan campuran reaksi pada temperatur
tertentu dalam kurun waktu yang telah ditetapkan untuk
perkembangan reaksi kimia atau enzimatik.
- pH : lambang yang menghubungkan konsentrasi ion hidrogen (H+) atau aktivitas suatu solusio (larutan) pada suatu solusio standar tertentu.
- Histoteknik :
METODE PENELITIAN
4.1 Jenis Penelitian
Jenis penelitian ini adalah eksperimental.
4.2 Waktu dan Tempat Penelitian
Penelitian dilaksanakan di laboratorium Histologi dan laboratorium Farmasi,
Universitas Sumatera Utara, Medan. Penelitian dilaksanakan selama bulan
Maret-November 2010.
4.3 Alat dan Bahan
4.3.1 Alat
1. Cover glass
2. Microtome
3. Microscope binocular dan trinocular
4. Neraca dan kelengkapannya
5. Object glass
6. pH meter
7. Paraffin oven
8. Pipet tetes
9. Staining jar
10. Waterbath
4.3.2 Bahan
1. 10% neutral buffered formalin
5. Eosin
Seekor hewan monyet telah dianatesi dengan memberikan suntikan ketamin
intrakutan sebanyak 5mg/kgBB IM. Setelah hewan tertidur dilakukan sayatan abdominal
dimulai dari caudal hingga manubrium sterni. Pengambilan jaringan yakni cerebellum,
hati, usus, ginjal, colon, pankreas dan limpa dilakukan segera dengan ketebalan + 1 cm.
Jaringan yang diperoleh segera direndam dalam larutan pengawet 10% neutral buffer
formalin.
4.5 Pembuatan sediaan
Sampel jaringan hewan monyet dengan ketebalan 1 cm diperoleh dari proses
bedah hewan. Jaringan-jaringan ini telah diawetkan di dalam 10% neutral buffered
formalin selama 24 jam dan diproses untuk parafin embedding dengan dehidrasi melalui
alkohol 70 %, 90 %, 95 % dan etanol absolut selama 2x15 menit. Clearing
(pembeningan) tercapai melalui dua kali perendaman dalam xylene selama
masing-masing 15 menit. Infiltrasi (pembenaman) lilin parafin dilakukan dalam oven parafin
bersuhu 70 °C selama 3 x 1 jam. Selanjutnya dilakukan pembuatan blok parafin. Blok
parafin ini telah dipotong dengan ketebalan 8 µm dengan menggunakan rotary
microtome. Irisan jaringan yang diinginkan dilekatkan pada object glass berperekat
albumin pada waterbath dan dikeringkan dengan suhu ruangan semalaman.
Gambir diperoleh dari membeli di pasar bunga Padang Bulan, Sumatera Utara,
Medan. Gambir ini akan di tumbuk terlebih dahulu sehingga menjadi serbuk dan di jemur
di bawah sinar matahari sehinnga kering. Larutan gambir 0,1% w/v, 0,2% w/v, 0,5% w/v,
1% w/v yang terlarut dalam 100 ml masing-masing larutan berikut; air suling, 70%
etanol, 1% HCL dalam akuades dan 1% NaOH dalam akuades.
Tabel 4.1 Berbagai Variasi Konsentrasi dan Pelarut yang akan digunakan
Irisan jaringan dihilangkan parafinnya dengan merendam dalam xylene selama 2 x
2 menit dan dihidrasi kembali dengan larutan alkohol (absolut, 90%, 80%, 70%) dan
akuades. Irisan jaringan kemudian direndam dalam larutan Hematoxylin Mayer selama 5
menit dan dicuci dengan air kran mengalir selama 10 menit. Selanjutnya, irisan jaringan
direndam dalam larutan eosin working solution selama 2 menit dan didedhidrasi dengan
alkohol bertingkat kepekatannya, dijernihkan dengan xylene 2 x 2 menit, dan ditutup
dengan entellan™.
4.8 Metode Pewarnaan Larutan Gambir
1. Irisan jaringan dihilangkan parafinnya dengan merendam dalam xylene selama 2 x
2 menit dan dihidrasi kembali dengan larutan alkohol (absolut, 90%, 80%, 70%)
didedhidrasi dengan alkohol bertingkat kepekatannya, dijernihkan dengan xylene
2 x 2 menit, dan ditutup dengan entellan™.
2. Irisan jaringan dihilangkan parafinnya dengan merendam dalam xylene selama 2
x 2 menit dan dihidrasi kembali dengan larutan alkohol (absolut, 90%, 80%,
70%). Irisan jaringan kemudian direndam dalam larutan gambir selama 15 menit.
Selanjutnya, irisan jaringan direndam dalam larutan Hematoxylin Mayer selama 5
menit dan didedhidrasi dengan alkohol bertingkat kepekatannya, dijernihkan
dengan xylene 2 x 2 menit, dan ditutup dengan entellan™.
3. Irisan jaringan dihilangkan parafinnya dengan merendam dalam xylene selama 2
x 2 menit dan dihidrasi kembali dengan larutan alkohol (absolut, 90%, 80%, 70%)
dan akuades. Irisan jaringan kemudian direndam dalam larutan gambir selama 15
menit. Selanjutnya, irisan jaringan direndam dalam larutan eosin working solution
selama 2 menit dan didedhidrasi dengan alkohol bertingkat kepekatannya,
dijernihkan dengan xylene 2 x 2 menit, dan ditutup dengan entellan™.
4.9 Analisis Data
Sampel diamati dengan mikroskop binokular dan dilihat efek pewarnaanya
pada sel (nukleus dan sitoplasma) dan pada beberapa komponen jaringan tertentu
seperti serabut. Sampel hasil pewarnaan larutan serbuk gambir akan dibandingkan
sampel jaringan yang sama yang diwarnai dengan HE.Sampel yang telah diwarnai
akan difoto dengan mikroskop trinokular olympus BX51.
4.10 Persetujuan Etik Penelitian (Ethical Clearance)
Persetujuan atas etika penelitian telah diperolehi dari Komite Etik Penelitian
Kesehatan Fakultas Kedokteran Universitas Sumatera Utara.
HASIL PENELITIAN DAN PEMBAHASAN
5.1 HASIL PENELITIAN
5.1.1 Deskripsi Lokasi Penelitian
Eksperimen membuat sediaan histologis dan mewarnai jaringan ini telah
dilakukan di laboratorium Histologi, Fakultas Kedokteran Universitas Sumatera
Utara, Medan.
5.1.2 Karekteristik penelitian
5.1.2.1 Karekteristik sampel jaringan
Sampel jaringan diambil dari hewan monyet berupa hepar, colon,
usus, ginjal, jantung dan limpa dengan ketebalan + 1 cm. Jaringan
diparafinisasi dan dipotong dengan menggunakan rotary microtome
dengan ketebalan 8µ m.
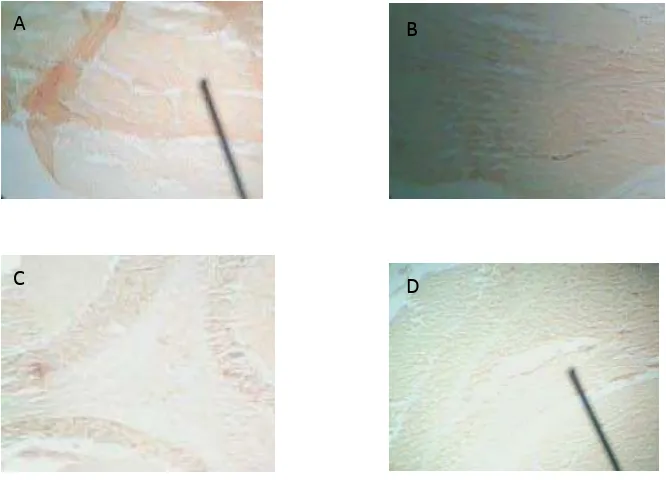
5.1.2.2 Konsentrasi Larutan
Konsentrasi larutan yang paling baik berupa 2 % w/v serbuk gambir
dengan pelarut yang digunakan berupa ethanol 70%.
Gambar 5.1 Pewarnaan jaringan serebellum dengan menggunakan
larutan gambir dengan konsentrasi yang berbeda A. Aquadest 0,5%, B.
Ethanol 0,2%, C. HCL 1%, D. NaOH 1% untuk menentukan konsentrasi
pelarut gambir yang optimum. Dengan pembesaran 10x40.
5.1.2.3 Lama Inkubasi
Lama inkubasi (yang memberikan hasil terbaik) adalah 15 menit.
Gambar 5.2 tampak pewarnaan jaringan serebellum dengan
menggunakan 2 % w/v serbuk gambir dengan pelarut ethanol 70% untuk
menentukan lama inkubasi yang paling baik. A. 10 menit, B. 15 menit, C.
30 menit, D. 1 jam. Dengan pembesaran 10x40.
5.1.2.4 pH
D C
A
D C
pH yang diukur pada larutan serbuk gambir dengan
konsentrasi 0.2 % w/v dengan pelarut ethanol 70% adalah 6,8. Ini berarti
pH optimal gambir agar dapat mewarnai adalah 6,0 dan bersifat asam.
Gambar 5.3 tampak pewarnaan jaringan-jaringan A. ethanol 0,1%
(pH 6,5), B. ethanol 0,2% (pH 6,0), ethanol 0,5% (pH 6,8), D. ethanol
1% (pH 6,3). pH larutan-larutan gambir dengan berbagai konsentrasi ini
Dari semua jaringan yang telah diwarnai, didapati hasil daripada pewarnaan
jaringan hepar, colon, usus, ginjal, pankreas, limpa dengan menggunakan gambir,
gambir-hematoksilin, hematoksilin-gambir, gambir-eosin adalah seperti berikut.
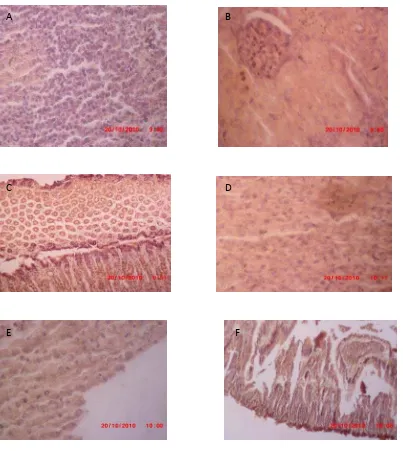
Gambar 5.4 di atas, tampak pewarnaan jaringan-jaringan A. Hepar, B. Limpa, C.
Jantung, D. Ginjal, E. Usus dan F. Colon dengan pewarnaan larutan gambir. Dengan
pembeasaran 10x100.
A B
C D
Gambar 5.5 di atas, tampak pewarnaan jaringan-jaringan A. Colon, B. Pankreas, C.
Limpa, D. Ginjal, E. Hepar, F. Usus yang diteliti dengan menggunakan pewarnaan
gambir-hematoksilin.dengan pembesaran 10x100.
C D
Gambar 6 di atas, tampak pewarnaan jaringan-jaringan A. Limpa, B. Ginjal, C.
Usus, D. Pankreas, E. Hepar, F. Colon yang diteliti dengan menggunakan pewarnaan
hematoksilin-gambir.dengan pembesaran 10x100.
A B
C D
Gambar 7 di atas, tampak pewarnaan jaringan-jaringan A. Ginjal, B. Pankreas, C.
Usus, D. Jantung, E. Limpa, F. Colon yang diteliti dengan menggunakan pewarnaan
gambir-eosin.dengan pembesaran 10x100.
A B
C D
5.2 PEMBAHASAN
Penelitian ini dilakukan untuk mengetahui apakah uncaria gambir (gambir) dapat
menjadi zat warna alternatif lain dalam pewarnaan histoteknik. Penelitian ini
dilakukan di Laboratorium Histologi, Universitas Sumatera Utara, Medan.
Berdasarkan hasil penelitian didapati larutan serbuk gambir 0,2% Weight/Volume yang
terlarut dalam 70% etanol merupakan konsentrasi optimal yang diperoleh setelah
percobaan ke atas sel jaringan monyet. Ia memberikan hasil warna merah kecoklatan
ke atas sitoplasma sel jaringan dengan lama masa inkubasinya 15 menit. Lama
inkubasi 15 menit ini dipilih setelah melakukan eksperimen terhadap jaringan
serebellum. Dapat dilihat pada gambar 5.2 hasil daripada pewarnaan larutan serbuk
gambir 0,2% Weight/Volume yang terlarut dalam 70% etanol dengan masa inkubasi
yang berbeda. Jelas terlihat bahawa masa inkubasi 15 menit lebih baik dan efisien
daripada masa inkubasi 30 menit karena warnanya jelas kelihatan dan waktunya juga
tidak terlalu lama.
Pengukuran pH diukur dengan menggunakan pH meter di Laboratorium Fakultas
Farmasi. pH yang diukur pada larutan serbuk gambir 0,2% Weight/Volume yang
terlarut dalam 70% etanol adalah 6,0 yaitu bersifat asam dibandingkan dengan larutan
serbuk gambir 0,1% Weight/Volume yang terlarut dalam 70% etanol yang memiliki pH
6,3. Ini karena serbuk gambir dengan pH 6,0 lebih asam daripada pH 6,3. Serbuk
gambir ini dengan pH nya 6,0 membolehkan ia mewarnai dengan lebih jelas struktur
yang bersifat basa iaitu struktur protein sitoplasma jaringan menghasilkan warna
merah kecoklatan. Sedangkan struktur yang bersifat asam seperti nukleus kurang
ternoda oleh zat warna gambir yang bersifat asam ini. Ini menunjukkan larutan zat
warna gambir ini lebih bersifat asidofilik. Didapati larutan zat warna gambir dapat
menjadi zat warna alternatif untuk eosin.
Pada gambar 4, dapat dilihat pewarnaan jaringan dengan larutan gambir. Pada
pewarnaan didapati larutan gambir yang bersifat asam ini hanya mewarnai sitoplasma
sel yang bersifat basa, yaitu menghasilkan warna merah kecoklatan.
Berdasarkan hasil penelitian pada gambar 5, apabila sel jaringan diwarnai oleh
larutan serbuk gambir dahulu kemudian diikuti dengan pewarnaan hematoksilin
tetapi warna merah kecoklatan gambir yang seharusnya mewarnai sitoplasma tidak
jelas kelihatan.
Pada gambar 6, apabila larutan gambir digunakan sebagai perona
(counterstaining) terhadap pewarna hematoksilin, reaksi pewarnaan sama dengan zat
warna Eosin kecuali warnanya yang merah kecoklatan pada sitoplasma. Hasil
pewarnaan ini berbeda dengan pewarnaan pada gambar 5 karena kedua-dua warna
gambir merah kecoklatan dan hematoksilin biru-violet jelas kelihatan. Ini
menunjukkan larutan gambir dapat digunakan setelah pewarnaan hematoksilin dan
menjadi perona (counterstaining) terhadap pewarna hematoksilin.
Pada gambar 7, hasil menunjukkan apabila larutan gambir digunakan bersama
dengan pewarnaan eosin working solution didapati kedua-duanya zat warna gambir
dan eosin masing-masing yang bersifat asam hanya mewarnai sitoplasma. Dan
didapati zat warna gambir merah kecoklatan tidak jelas kelihatan, yang jelas kelihatan
hanya warna merah eosin . Ini menunjukkan intensitas warna eosin lebih kuat
dibandingkan zat warna gambir sehingga komponen basa dalam protein sitoplasma
BAB 6
KESIMPULAN DAN SARAN
6.1 Kesimpulan
1. Gambir dapat di gunakan sebagai zat warna alternatif lain pada pewarnaan
histoteknik dan bermanfaat dalam teknik pewarnaan.
2. Daripada hasil penelitian, larutan gambir memberikan hasil yang optimal
pada 2 % w/v dengan pelarut ethanol 70%,lama inkubasi 15 menit serta
pH 6,0 yaitu asam dalam mewarnai sitoplasma pada jaringan serta dapat
menjadi alternatif zat warna eosin.
.2 Saran
1. Penelitian ini di harapkan bisa memberikan manfaat dalam teknik
pewarnaan histoteknik oleh semua pihak terutama di Laboratorium
Histologi, Fakultas Kedokteran Universitas Sumatera Utara,Medan.
2. Penggunaan bahan alami seperti gambir ini diharap dapat memberikan
banyak manfaat seperti lebih murah, tahan lama, tidak sulit dibersihkan
dan tidak merusak lingkungan.
3. Untuk penelitian selanjutnya, diharap dapat menjadikan hasil penelitian ini
sebagai acuan dan dapat mempertimbangkan pH, konsentrasi pelarut dan
masa inkubasi yang lebih baik untuk mendapatkan hasil yang lebih
DAFTAR PUSTAKA
Junqueira,LC., 2007. Persiapan jaringan untuk pemeriksaan mikroskopik. Histology
Dasar: teks dan atlas. Edisi 10. Jakarta : EGC. 3 – 5.
Sigh, K., 2002. Syarat-syarat standart zat warna ideal; Theory and Practice of
Histological thecnique s. Vol II, number 4, Oct-Dec 2002. 230 – 2.
Hiller, K., 2007. Guide to Species Information, Adelaide University. Available from:
National Centre for Social Research, 2006. Experimental Research. London:
National Centre for Sosial Research. Available from: [Accesed 6 March
2010].
Yuliani, S., 1999. Pemeriksaan kandungan kimia aktif antimikroba gambir. Makalah
Seminar PERHIPBA, Universitas Pancasila, Jakarta.
Zamarel, E., 1991. Budi daya tanaman gambir. Edisi Khusus Penelitian Tanaman
Rempah dan Obat 7 (2) ; 7 – 11.
[Accessed 14
August 2010]
Zeijlistra, F.Z.N., 1998. Sirih, Pinang dan Gambir. Dalam C.J.J. van Hall en C. van
de Koppel (Eds). Landbouw in Indische Archipel, w. van Hoeve’s
Gattuso, M ., 2004. Morphoanatomical studies of Uncaria tomentosa and Uncaria
guianensis bark and leaves. Phytomedicine, 11, 213 – 23.
Keplinger, K., 1999. Uncaria tomentosa (Willd.) DC.—Ethnomedicinal use and new
pharmacological, toxicological and botanical results. Journal of
Ethnopharmacology, 64, 23-34.
Bachtiar, A., 1991. Manfaat Gambir. Makalah pada Penataran Petani dan Pedagang
Pengumpul Gambir di Pangkalan. FMIPA Unand. Padang.
Rukmana, R., 1994. Gambir Indonesia. Jakarta.
Zulham., 2009. Penuntun Praktikum Histoteknik. Fakultas Kedokteran Universitas
Sumatera Utara, Medan.
Bhuyan R., 2005. Isolation of Colour Component from Native Dyebearing Plants in