ISOLASI DAN IDENTIFIKASI SENYAWA ANTIBAKTERI
DARI BAKTERI ENDOFIT TANAMAN SIRIH HIJAU
(
Piper betle
L.)
UKHRADIYA MAGHARANIQ SAFIRA PURWANTO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Isolasi dan Identifikasi Senyawa Antibakteri dari Bakteri Endofit Tanaman Sirih Hijau (Piper betle L.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Ukhradiya Magharaniq Safira Purwanto
RINGKASAN
UKHRADIYA MAGHARANIQ SAFIRA PURWANTO. Isolasi dan Identifikasi Senyawa Antibakteri dari Bakteri Endofit Tanaman Sirih Hijau (Piper betle L.). Dibimbing oleh MARIA BINTANG dan FACHRIYAN HASMI PASARIBU.
Salah satu penyebab terjadinya peningkatan kasus infeksi di Indonesia adalah adanya resistensi bakteri patogen terhadap antibiotik. Karena itu, pencarian dan penelusuran jenis dan sumber senyawa antibiotik baru, khususnya antibakteri, menjadi perlu dilakukan. Bakteri endofit merupakan bakteri yang hidup bersimbiosis dengan tanaman. Beberapa spesies bakteri endofit telah diteliti memiliki kemampuan menghasilkan senyawa bioaktif, salah satunya antibakteri. Penelitian ini bertujuan mengisolasi dan mengidentifikasi isolat bakteri endofit dari tanaman sirih hijau (Piper betle L.) yang memiliki aktivitas sebagai antibakteri sekaligus mengidentifikasi senyawa antibakteri yang dihasilkan isolat tersebut.
Isolasi bakteri endofit dilakukan terhadap tanaman sirih hijau dalam kondisi segar dengan metode sterilisasi permukaan. Isolat yang diperoleh berjumlah 14 isolat, 1 isolat berasal dari akar, 6 berasal dari batang dan 7 berasal dari daun. Isolat-isolat tersebut diuji secara langsung terhadap 4 bakteri patogen, yaitu
Staphylococcus aureus, Escherichia coli, Bacillus cereus, dan Salmonella enteritidis. Berdasarkan hasil pengujian, diperoleh isolat dengan kode BS1 sebagai isolat yang mampu menghambat bakteri patogen paling banyak (ditandai dengan terbentuknya zona hambat).
Identifikasi molekuler isolat BS1 dilakukan berdasarkan marka 16S rRNA dan dianalisis menggunakan program BLAST (Basic Local Alignment Search Tool). Hasil identifikasi molekuler menunjukkan bahwa isolat BS1 memiliki persentase kemiripan (identitiy) sebesar 94% dengan genus Pseudomonas sp. Isolat BS1 difermentasi dalam media nutrient broth (NB) selama 48 jam. Supernatan hasil fermentasi dipisahkan untuk kemudian diekstraksi. Ekstraksi senyawa antibakteri hasil fermentasi isolat BS1 dilakukan dengan kloroform (1:1) (v/v) menggunakan corong pisah. Hasil pengujian ekstrak kloroform terhadap
Staphylococcus aureus menunjukkan terbentuknya zona hambat. Analisis senyawa dalam ekstrak kloroform BS1 menggunakan GC-MS menunjukkan bahwa senyawa antibakteri yang dihasilkan isolat BS1 tersebut adalah 1-methyl-2,4-Imidazolidinedione dan piperazine.
Kata kunci: antibakteri, bakteri endofit, piperazine, Piper betle L., Pseudomonas
SUMMARY
UKHRADIYA MAGHARANIQ SAFIRA PURWANTO. Isolation and Identification of Antibacterial Compound from Green Betel’s (Piper betle L.) Endophytic Bacteria. Supervised by MARIA BINTANG and FACHRIYAN HASMI PASARIBU.
One factor that caused the increase of infectious case in Indonesia is resistence of pathogenic bacteria to antibiotic. Thus, the exploration of new source of antibiotic, especially antibacterial, is necessary. Endophytic bacteria are bacteria that live symbiotically with plant. Some species of endophytic bacteria have the ability to produce bioactive compound, one of them is antibacterial. The objective of this research are to isolate and identify endophytic bacteria from green betel (Piper betle L.) which has antibacterial activity and also to identify antibacterial compound from the endophytic bacteria isolate.
Endophytic bacteria isolation from fresh green betel was done by surface sterilization method. Total isolate obtained was 14 isolates, 1 isolate from root, 6 isolates from stem and 7 isolates from leaves. Those isolates was tested against 4 pathogenic bacteria, Staphylococcus aureus, Escherichia coli, Bacillus cereus, dan Salmonella enteritidis. Based on the test result, isolate code BS1 could inhibit more pathogenic bacteria than other isolates (showed by inhibition zone).
Molecular identification of BS1 based on 16S rRNA gene and was analyze using BLAST (Basic Local Alignment Search Tool) programe. The result of molecular identification showed that BS1 isolate has 94% correlation (identity) with Pseudomonas sp. BS1 isolate was fermented in nutrient broth (NB) for 48 hours. The supernatant from fermentation separated for extraction. The extraction of antibacterial compound from fermentation of BS1 isolate was done using chloroform (1:1) (v/v). The test result of chloroform extract toward
Staphylococcus aureus showed inhibition zone. Analysis of BS1 chloroform extract using GC-MS showed that the antibacterial compounds are 1-methyl-2,4-Imidazolidinedione and piperazine.
Keywords: antibacterial, endophytic bacteria, piperazine, Piper betle L.,
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biokimia
ISOLASI DAN IDENTIFIKASI SENYAWA ANTIBAKTERI
DARI BAKTERI ENDOFIT TANAMAN SIRIH HIJAU
(
Piper betle
L.)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Isolasi dan Identifikasi Senyawa Antibakteri dari Bakteri Endofit Tanaman Sirih Hijau (Piper betle L.).
Nama : Ukhradiya Magharaniq Safira Purwanto
NIM : G851130466
Disetujui oleh Komisi Pembimbing
Prof. Dr Drh Maria Bintang, MS Ketua
Prof. Dr Drh Fachriyan H. Pasaribu Anggota
Diketahui oleh
Ketua Program Studi Biokimia
Prof. Dr Drh Maria Bintang, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Penulis memanjatkan puji syukur kepada Allah SWT yang telah melimpahkan rahmat-Nya sehingga penulis dapat menyelesaikan karya tulis ini. Karya tulis ini merupakan hasil penelitian tesis dengan judul “Isolasi dan Identifikasi Senyawa Antibakteri dari Bakteri Endofit Tanaman Sirih Hijau (Piper betle L.)”.
Melalui karya tulis ini penulis menyampaikan terima kasih kepada Prof. Dr Drh Maria Bintang, MS dan Prof. Dr Drh Fachriyan Hasmi Pasaribu selaku Dosen Pembimbing atas saran dan arahannya dalam penyusunan tulisan ini. Terima kasih penulis sampaikan untuk teman-teman Program Akselerasi (Endah, Novi, Lusi, dan Andin) atas semangat dan bantuan yang diberikan. Penulis juga ingin mengucapkan terima kasih kepada Bapak Agus Sumantri, Mbak Eli dan Pak Jaka atas bantuan teknis di laboratorium. Tak lupa untuk keluargaku tercinta (Ibu, Ayah, Affan dan Ririn) yang selalu memberikan doa, semangat dan motivasi yang tiada putus-putusnya. Serta, pihak-pihak lain yang ikut membantu. Penulis menyadari masih terdapat banyak kekurangan dalam karya tulis ini. Walaupun demikian, penulis berharap semoga hasil penelitian ini dapat memberi manfaat.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 3
Manfaat Penelitian 3
Ruang Lingkup Penelitian 3
METODE 3
Alat 3
Bahan 4
Isolasi Bakteri Endofit 4
Seleksi untuk Memperoleh Bakteri Endofit Potensial 4 Identifikasi Bakteri Endofit Potensial dengan Marka 16S rRNA 4 Isolasi dan Identifikasi Senyawa Antibakteri 5
HASIL DAN PEMBAHASAN 5
Keragaman Bakteri Endofit Tanaman Sirih Hijau (Piper betle L.) 5 Isolat Bakteri Endofit yang Berpotensi Menghasilkan
Senyawa Antibakteri 6
Identifikasi Isolat BS1 berdasarkan Marka 16S rRNA 8
Uji Antibakteri Ekstrak Kloroform BS1 9
Hasil Analisis Senyawa Antibakteri Ekstrak Kloroform BS1
dengan GC-MS
10
KESIMPULAN DAN SARAN 11
Kesimpulan 11
Saran 11
DAFTAR PUSTAKA 11
LAMPIRAN 16
DAFTAR TABEL
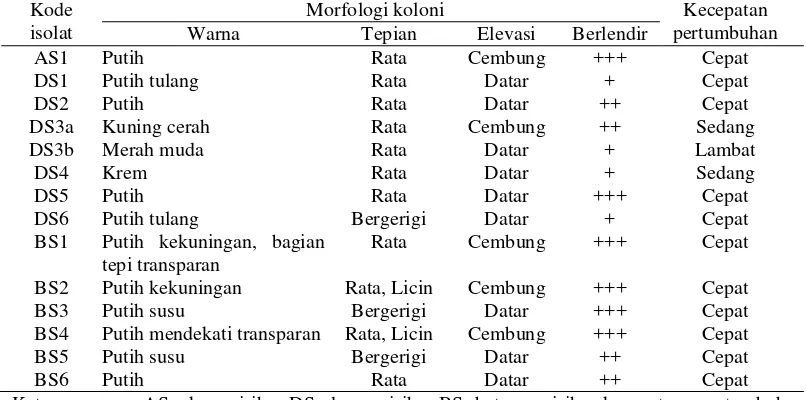
1 Morfologi koloni dan kecepatan pertumbuhan isolat bakteri endofit dari
tanaman sirih hijau 6
2 Diameter zona hambat yang terbentuk pada seleksi isolat bakteri endofit dari sirih hijau terhadap bakteri patogen 7
DAFTAR GAMBAR
1 Tanaman sirih hijau (Piper betle L.) 2
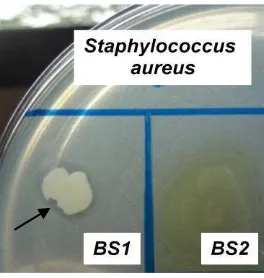
2 Zona hambat yang terbentuk berdasarkan pengujian isolat BS1 terhadap
S. aureus (tanda panah) 7
3 Zona hambat yang terbentuk pada pengujian ekstrak kloroform BS1 terhadap S. aureus. (a) kontrol positif tetrasiklin 100µg/mL, (b) ekstrak
kloroform BS1 (tanda panah) 10
DAFTAR LAMPIRAN
1 Bagan alir penelitian 16
2 Isolat bakteri endofit dari tanaman sirih hijau (Piper betle L.) 17
3 Sekuens DNA isolat BS1 hasil sequencing 18
4 Sekuens DNA isolat BS1 hasil pensejajaran 19
5 Hasil analisis sekuen konsensus BS1 dengan program BLAST 20
6 Kondisi GC-MS 21
PENDAHULUAN
Latar Belakang
Penyakit infeksi pada manusia merupakan jenis penyakit yang sangat sering terjadi dan penyebarannya cukup luas. Penyakit infeksi sering disebut sebagai penyakit menular, karena dapat berpindah dari satu individu ke individu lain, baik melalui kontak langsung maupun tidak. Agen-agen pembawa penyakit infeksi dapat berupa hewan, bakteri, virus atau jamur. Menurut WHO (2013), kasus penyakit infeksi yang terdaftar di Indonesia tiap tahunnya cenderung berada pada kisaran angka yang tetap. Data tahun 2009-2010 menunjukkan penurunan kasus, sedangkan tahun 2010-2011 justru terjadi peningkatan kasus. Kasus infeksi terbesar di Indonesia adalah penyakit tuberkulosis yang mencapai jumlah 328824 kasus pada tahun 2012.
Peningkatan kasus penyakit infeksi, terutama yang disebabkan oleh bakteri patogen, salah satunya terkait dengan resistensi bakteri patogen terhadap antibiotik komersil. Sebagai contoh, ditemukan adanya strain Staphylococcus aureus yang resisten terhadap methicillin sehingga menyulitkan pengobatan pasien yang terinfeksi bakteri tersebut (Ruhe et al. 2005). Oleh karena itu, diperlukan kajian mengenai sumber dan jenis antibiotik baru yang bersifat lebih alami dan aman bagi lingkungan. Salah satu sumber antibiotik, khususnya antibakteri, adalah bakteri endofit.
Bakteri endofit adalah bakteri yang hidup di dalam jaringan tanaman inang tanpa menyebabkan gejala-gejala penyakit (Bhore & Sathisha 2010). Beberapa jenis bakteri endofit diketahui mampu menghasilkan senyawa aktif yang bersifat antibiotik (Castillo et al. 2003), antimalaria (Simanjuntak et al. 2004) dan antifungi (Beck et al. 2003 dalam Ryan et al. 2008). Kemampuan bakteri endofit menghasilkan senyawa aktif tersebut merupakan potensi yang dapat dikembangkan mengingat umumnya senyawa aktif diperoleh dengan mengekstraksi tanaman, khususnya tanaman obat. Untuk memperoleh senyawa aktif dari tanaman dibutuhkan jumlah tanaman yang banyak dan hal ini terkait dengan isu lingkungan serta kelestarian tanaman tersebut.
Salah satu tanaman obat yang sudah dikenal dan dimanfaatkan sejak lama oleh masyarakat Indonesia adalah sirih hijau (Piper betle L.). Sirih hijau (Piper betle L.) merupakan tanaman yang memiliki khasiat medis dan banyak digunakan di Indonesia, India dan negara-negara di wilayah Indo-Cina lainnya, yaitu Malaysia, Vietnam, Laos, Kamboja, Thailand, Myanmar dan Singapura. Bagian tanaman sirih yang banyak digunakan adalah daunnya. Penggunaan daun sirih telah lama diketahui memiliki efek penyembuhan antara lain mencegah dan menyembuhkan batuk, mengurangi bau mulut serta mencegah infeksi yang disebabkan fungi dan bakteri (Kumar et al. 2010).
2
minyak esensial (0.08-0.2%) (Guha 2006). Selain itu, daun sirih juga mengandung flavonoid, sterol, fenol (Chakraborty & Shah 2011) serta senyawa yang memiliki sifat antibakteri seperti kavikol, asam dodekanoat, miristat, palmitat dan oleat (Suliantari et al. 2012).
Gambar 1 Tanaman sirih hijau (Piper betle L.) (Sumber : koleksi pribadi, 2014) Kajian mengenai sirih hijau dalam bidang kesehatan telah cukup banyak dilakukan. Diantaranya, daun sirih yang diekstrak dengan akuades steril menunjukkan aktivitas penghambatan terhadap Streptococcus mutans secara in vitro (Nalina & Rahim 2007). Al-Adhroey et al. (2011) menyatakan bahwa esktrak metanol daun sirih memiliki aktivitas antimalaria terhadap Plasmodium berghei. Senyawa hydroxychavicol (HC) yang diisolasi dari daun sirih hijau diketahui memiliki aktivitas penghambatan terhadap xantin oksidase (Murata et al.
2009) dan juga bersifat antifungi terhadap genus Candida dan Aspergillus dalam uji in vitro (Ali et al. 2010). Senyawa yang merupakan turunan HC, yaitu
hydroxychavicol acetate (HCA) memiliki berbagai aktivitas diantaranya sebagai imunomodulator (Min et al. 2009) dan antibakteri (Sharma et al. 2009, Ali et al.
2011).
Allylpyrocatechol (APC) yang sebagian besar diisolasi dari daun sirih memiliki efek terhadap pencernaan diantaranya melindungi lambung dari timbulnya ulkus (luka lambung) (Tripathi 2008), menyembuhkan ulkus (Yadav et al. 2009), antibakteri terhadap Staphylococcus aureus (Pradhan et al. 2013) dan berperan sebagai anti-inflamasi (Santhakumari et al. 2006). Menurut (Zeng et al.
1997 dalam Kumar et al. 2010), senyawa piperbetol dalam sirih hijau memiliki kemampuan selektif dalam menghambat agregasi platelet yang diinduksi oleh mekanisme platelet activating factor (PAF) pada konsentrasi tertentu, sehingga diharapkan dapat mencegah timbulnya penyakit kardiovaskular. Senyawa lain yang merupakan turunan piperbetol antara lain metilpiperbetol, piperol A dan piperol B juga telah berhasil diidentifikasi.
3 Perumusan Masalah
Bakteri endofit memiliki potensi untuk dikembangkan sebagai sumber antibiotik baru. Sirih hijau (Piper betle L.) merupakan salah satu tanaman obat yang telah terbukti bersifat sebagai antibiotik. Penelitian terkait bakteri endofit telah banyak dilakukan, namun penelitian tentang bakteri endofit pada tanaman sirih hijau (Piper betle L.) sejauh ini belum dilaporkan.
Tujuan Penelitian
Penelitian ini bertujuan mengisolasi dan mengidentifikasi isolat bakteri endofit tanaman sirih hijau yang memiliki aktivitas sebagai antibakteri sekaligus mengidentifikasi senyawa antibakteri yang dihasilkan isolat tersebut.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberi informasi mengenai kandungan dan manfaat senyawa antibakteri yang dihasilkan oleh bakteri endofit dari tanaman sirih hijau.
Ruang Lingkup Penelitian
Penelitian ini mencakup isolasi bakteri endofit dari tanaman sirih hijau (Piper betle L.). Isolat-isolat tersebut diseleksi untuk menentukan isolat yang memiliki aktivitas antibakteri melalui uji terhadap Staphylococcus aureus,
Escherichia coli, Bacillus cereus, dan Salmonella enteritidis. Isolat bakteri endofit yang mampu menekan pertumbuhan bakteri uji diidentifikasi dengan marka 16S rRNA dan dilanjutkan dengan isolasi serta identifikasi senyawa antibakteri yang dihasilkan.
METODE
Penelitian ini dilakukan pada bulan Januari – Agustus 2014 di Laboratorium Bakteriologi, Bagian Mikrobiologi Medik Fakultas Kedokteran Hewan, Laboratorium Penelitian Departemen Biokimia Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor (IPB) dan Laboratorium Pengujian Hasil Hutan P3KKPHH Bogor.
Alat
4
Bahan
Bahan – bahan yang digunakan dalam penelitian ini adalah tanaman sirih hijau (Piper betle L.) yang diperoleh dari daerah Ciampea-Bogor dalam kondisi segar, kultur Staphylococcus aureus, Escherichia coli, Bacillus cereus, dan
Salmonella enteritidis (koleksi dari Laboratorium Bakteriologi Fakultas Kedokteran Hewan, Institut Pertanian Bogor), media Nutrient Agar (NA), media Nutrient Broth (NB), larutan natrium hipoklorit 5.25%, etanol 70%, akuades, nistatin, InstaGene Matrix (Bio-Rad, USA), primer 27F (5’-AGA GTT TGA TCM TGG GTC AG-3’) dan 1492R (5’-TAC GGY TAC CTT GTT ACG ACT T-3’), Montage PCR Clean Up kit (Milipore), primer 518F dan 800R, Big Dye terminator cycle sequencing kit (Applied BioSystems, USA), kloroform, tetrasiklin dan aseton.
Isolasi Bakteri Endofit (Modifikasi Desriani et al. 2013)
Bagian tanaman sirih yang digunakan adalah daun, batang dan akar dalam kondisi segar. Sampel tanaman dalam keadaan segar dibersihkan dengan air mengalir kemudian dipotong-potong sepanjang 1-3 cm dan dipisahkan menurut bagian tanamannya. Potongan sampel direndam dalam etanol 70% selama 1 menit, larutan natrium hipoklorit 5.25% selama 5 menit, dan dicuci dengan etanol 70% sebanyak tiga kali. Potongan sampel diiris secara steril kemudian ditanam dalam media nutrient agar (NA) yang mengandung nistatin. Media yang sudah mengandung sampel tersebut diinkubasi pada suhu ruang dalam keadaan gelap dan diamati setiap hari sampai ada pertumbuhan koloni. Jika selama 24 jam di sekitar sampel tanaman belum menunjukkan adanya pertumbuhan mikroba, sterilisasi permukaan dikatakan berhasil. Bakteri endofit yang tumbuh dimurnikan satu per satu dan dikultivasi dalam agar miring. Isolat bakteri endofit yang telah murni diidentifikasi secara morfologi berdasarkan warna koloni, bentuk tepian koloni, elevasi koloni dan konsistensi koloni serta kecepatan pertumbuhan koloni. Seleksi untuk Memperoleh Isolat Bakteri Endofit Potensial (Simarmata et al. 2007)
Isolat bakteri endofit dari agar miring diregenerasi ke media NA, sedangkan bakteri uji diregenerasi ke dalam 5 mL media nutrient broth (NB) lalu diinkubasi selama 24 jam pada suhu 28-30 °C. Sebanyak 0.4 mL kultur cair bakteri uji dimasukkan ke dalam 80 mL media NA yang bersuhu ±40 °C. Lalu dituangkan sebanyak 20 mL ke dalam cawan Petri steril dan ditunggu hingga memadat. Isolat bakteri endofit yang akan diuji diinokulasikan ke media berisi patogen menggunakan ose, kemudian diinkubasi selama 24 – 48 jam. Zona hambat yang terbentuk diamati kemudian diameter zona hambat diukur. Isolat bakteri endofit yang positif menunjukkan zona hambat terhadap semua patogen dikatakan sebagai isolat potensial.
5 diinkubasi selama 30 menit pada suhu 56°C dan dipanaskan selama 10 menit pada 100°C. Setelah dipanaskan, supernatan digunakan pada proses PCR.
PCR dan pengurutan basa (sequencing) gen 16S rRNA. Sebanyak 1 µL DNA ditambahkan ke dalam 20 µL larutan reaksi PCR yang telah berisi primer 27F dan 1492R. Reaksi PCR dilakukan pada 94°C selama 45 detik, 55°C selama 60 detik dan 72°C selama 60 detik sebanyak 35 siklus. Hasil PCR dipurifikasi menggunakan Montage PCR Clean up kit (Millipore). Hasil PCR yang telah dipurifikasi kemudian disequencing menggunakan dua primer, yaitu primer 518F dan 800R dan Big Dye terminator cycle sequencing kit (Applied BioSystems, USA), kemudian dianalisis menggunakan Applied Biosystems model 3730XL automated DNA sequencing system (Applied BioSystems, USA).
Analisis hasil Sequencing. Hasil sequencing berupa urutan basa-basa DNA disejajarkan menggunakan program BioEdit Sequence Alignment Editor ver. 7.2.0. Hasil pensejajaran dianalisis lebih lanjut dengan program BLAST pada situs www.ncbi.nlm.nih.gov untuk mengetahui spesies isolat bakteri endofit potensial.
Isolasi dan Identifikasi Senyawa Antibakteri
Fermentasi dan ekstraksi senyawa antibakteri (Modifikasi Melliawati et al.. 2006). Sebanyak satu ose isolat bakteri endofit potensial ditumbuhkan dalam 50 mL media NB, kemudian difermentasi selama 48 jam dalam shaker (150 rpm, pada suhu ruang 28-30°C) selama. Kemudian, hasil fermentasi disentrifugasi pada kecepatan 5500 rpm selama 60 menit untuk memisahkan sel bakteri dan media. Supernatan diekstraksi dengan pelarut kloroform (1:1) (v/v) menggunakan corong pisah, lalu dievaporasi selama 15 menit pada suhu 50ºC. Ekstrak kloroform yang diperoleh sebagian dilarutkan dalam Tween 80 untuk diuji daya antibakterinya terhadap bakteri patogen dan sebagian lagi digunakan untuk analisis GC-MS.
Identifikasi ekstrak kloroform dengan GC-MS. Ekstrak kloroform dilarutkan dalam aseton kemudian diinjeksikan ke alat GC-MS. Proses GC-MS dilakukan menggunakan kolom kapiler tipe Phase Rtx-5MS dengan panjang 60 m dan diameter 0.25 mm (Lampiran 6).
HASIL DAN PEMBAHASAN
6
Tabel 1 Morfologi koloni dan kecepatan pertumbuhan isolat bakteri endofit dari tanaman sirih hijau
Kode isolat
Morfologi koloni Kecepatan
pertumbuhan Warna Tepian Elevasi Berlendir
AS1 Putih Rata Cembung +++ Cepat
BS1 Putih kekuningan, bagian tepi transparan
Rata Cembung +++ Cepat
BS2 Putih kekuningan Rata, Licin Cembung +++ Cepat
BS3 Putih susu Bergerigi Datar +++ Cepat
BS4 Putih mendekati transparan Rata, Licin Cembung +++ Cepat
BS5 Putih susu Bergerigi Datar ++ Cepat
BS6 Putih Rata Datar ++ Cepat
Keterangan : AS=akar sirih, DS=daun sirih, BS=batang sirih; kecepatan pertumbuhan (pertumbuhan isolat pada media baru) : cepat = 1 hari, sedang = 2 hari, lambat = >2 hari
Bakteri endofit dari tanaman sirih hijau (Piper betle L.) mulai menunjukkan pertumbuhan setelah potongan bagian tanaman diinokulasi pada media NA selama ± 48 jam (2 hari). Pernyataan ini didukung oleh Zinniel et al.
(2002), Simarmata (2007), Arunachalam dan Gayathri (2010) dan Jalgaonwala et al. (2010) yang menyatakan bahwa waktu pemilihan inkubasi selama minimal 2 hari bertujuan untuk memastikan bahwa bakteri yang tumbuh merupakan bakteri endofit, bukan bakteri filosfer, rizosfer atau kontaminan. Selain itu, penambahan nistatin (antifungi) pada media juga bertujuan untuk mengoptimalkan hasil isolasi (Kumala & Siswanto 2007).
Isolat bakteri endofit menunjukkan keragaman dari segi morfologi koloni. Bakteri endofit masuk ke dalam jaringan tanaman umumnya melalui akar, namun bagian tanaman yang terpapar udara langsung seperti bunga, batang dan kotiledon, juga dapat menjadi jalur masuk bakteri endofit. Bakteri endofit yang telah masuk ke dalam tanaman dapat tumbuh hanya di satu titik tertentu atau menyebar ke seluruh tanaman. Bakteri ini dapat hidup di dalam pembuluh vaskular atau di ruang intersel (Zinniel et al.. 2002), akar, batang, daun dan buah (Simarmata et al.. 2007; Bacon & Hinton 2006). Jumlah bakteri endofit di dalam tanaman tidak dapat ditentukan secara pasti, namun bakteri ini dapat dideteksi dengan mengisolasi pada media agar (Bacon & Hinton 2006).
Bakteri endofit dapat bersifat obligat ataupun fakultatif dalam mengkolonisasi inangnya. Bakteri endofit pada satu tanaman inang umumnya terdiri dari beberapa genus dan spesies (Bhore & Sathisha 2010). Meskipun bakteri ini memiliki kisaran inang yang luas, namun ada beberapa bakteri endofit yang hanya dapat berasosiasi dengan inang dari famili tertentu.
Isolat Bakteri Endofit yang Berpotensi Menghasilkan Senyawa Antibakteri Sebanyak 14 isolat bakteri endofit diuji terhadap 4 bakteri patogen, yaitu
7
enteritidis. Hasil seleksi isolat bakteri endofit dari tanaman sirih hijau terhadap bakteri patogen ditunjukkan dengan terbentuknya zona hambat berupa daerah bening di sekitar koloni bakteri endofit (Gambar 2). Sebanyak 3 isolat bakteri endofit, yaitu AS 1 (A), BS1 (I) dan BS2 (J) menunjukkan terbentuknya zona hambat terhadap S. aureus (Tabel 2). Sedangkan isolat BS3 (K) hanya menunjukkan sedikit penghambatan dan belum sepenuhnya membentuk daerah bening seperti 3 isolat lainnya. Pengujian ke-14 isolat bakteri endofit terhadap S. enteritidis bahkan tidak menunjukkan terbentuknya zona hambat.
Gambar 2 Zona hambat yang terbentuk berdasarkan pengujian isolat BS1 terhadap S. aureus (tanda panah)
Tabel 2 Diameter zona hambat yang terbentuk pada seleksi isolat bakteri endofit dari sirih hijau terhadap bakteri patogen
Kode isolat Diameter zona hambat
E. coli B. cereus S.aureus S. enteritidis
keterangan : V = zona hambat sangat kecil dan sulit diukur
8
Interaksi bakteri endofit dan tanaman merupakan suatu bentuk simbiosis. Simbiosis antara tanaman dengan bakteri endofit bersifat netral, mutualisme atau komensalisme (Bacon & Hinton 2006). Simbiosis mutualisme antara bakteri endofit dengan tanaman, dalam hal ini bakteri endofit mendapatkan nutrisi dari hasil metabolisme tanaman dan melindungi tanaman dalam melawan patogen, sedangkan tanaman mendapatkan derivat nutrisi dan senyawa aktif yang diperlukan selama hidupnya (Tanaka et al. 1999 dalam Simarmata et al. 2007).
Bagian akar dan batang tanaman sirih hijau memang tidak lazim digunakan sebagai obat. Umumnya, bagian tanaman sirih hijau yang digunakan adalah bagian daun, terutama daun yang berumur cukup tua. Namun, hal ini tidak menutup kemungkinan bahwa bakteri endofit dari bagian akar dan batang sirih hijau juga memiliki potensi sebagai sumber antibakteri baru. Sebagai contoh, penelitian yang dilakukan oleh Miller et al. (1998) berhasil mengisolasi senyawa antibiotik dari bakteri endofit tanaman non-obat, yaitu sejenis rumput.
Beberapa contoh bakteri endofit mampu menghasilkan produk potensial antara lain : bakteri endofit Bacillus polymixa hasil isolasi dari tanaman Anuma (Artemisia annua) dapat memproduksi senyawa kimia antimalaria artemisinin di dalam media cair sintetik (Simanjuntak et al. 2004), Streptomyces griseus dari tanaman Kandelia candel menghasilkan asam p-aminoacetophenonic sebagai antimikroba (Guan et al. 2005 dalam Ryan et al. 2008), Streptomyces NRRL 30562 dari tanaman Kennedia nigriscans menghasilkan munumbicin (antibiotik) dan munumbicin D (antimalaria) (Castillo et al. 2002 dalam Ryan et al. 2008),
Serratia marcescens dari tanaman Rhyncholacis penicillata menghasilkan oocydin A sebagai antifungi (Strobel et al. 2004 dalam Ryan et al. 2008), Paenibacillus polymyxa dari tanaman gandum menghasilkan fusaricidin A-D sebagai antifungi
(Beck et al. 2003 dalam Ryan et al. 2008). Castillo et al. (2003) juga berhasil mengisolasi senyawa kakadumycin dari Streptomyces sp., yaitu bakteri endofit asal tanaman Grevillea pteridifolia.
Identifikasi Isolat BS1 berdasarkan Marka 16S rRNA
Identifikasi isolat BS1 dilakukan dengan teknik molekuler, yaitu dengan marka (penanda) gen 16S rRNA. Gen rRNA merupakan bagian DNA yang paling terkonservasi di dalam setiap sel. Gen rRNA mampu mempertahankan susunan basa-basa nitrogennya (conserved) selama berjuta-juta tahun proses adaptasi. Gen rRNA berfungsi menyandikan protein subunit kecil ribosom (small subunit ribosom) yang merupakan bagian dari kompleks sistem ribosom di dalam sel (Stiegler et al. 1981).
Gen yang menyandikan RNA pada subunit kecil ribosom ini dipilih sebagai marka karena beberapa alasan diantaranya : terdapat di semua sel, memiliki fungsi yang sama di tiap sel, memiliki dua area yang dapat digunakan untuk mendeteksi kekerabatan jauh maupun dekat serta terkonservasi baik susunan basanya maupun bentuk strukturnya.
9 kecil dan juga tidak terlalu besar sehingga lebih memudahkan proses amplifikasi dengan PCR (Clarridge 2004).
Berdasarkan hasil seleksi isolat bakteri endofit terhadap bakteri patogen, diperoleh isolat dengan kode BS1 sebagai isolat potensial. Isolat BS1 dipilih sebagai isolat potensial karena mampu membentuk zona hambat terhadap 3 jenis bakteri patogen yaitu Staphylococcus aureus, Escherichia coli, dan Bacillus cereus. Hasil sequencing isolat BS1 yang telah disejajarkan menunjukkan bahwa gen 16S rRNA pada isolat tersebut berukuran 1530 pb (pasang basa) (Lampiran 4). Hasil analisis sekuens DNA gen 16S rRNA dengan program BLAST menunjukkan bahwa isolat BS1 memiliki persentase kemiripan (identitiy) sebesar 94% dengan genus Pseudomonas sp. (Lampiran 5).
Pseudomonas merupakan genus bakteri Gram negatif yang dikenal sebagai
plant-associated bacteria. Persebaran genus ini di alam cukup luas. Menurut Ryan
et al. (2008), beberapa bakteri endofit merupakan anggota bakteri penghuni tanah, seperti Pseudomonas, Burkholderia dan Bacillus. Genus-genus tersebut diketahui memiliki kemampuan menghasilkan metabolit sekunder yang bersifat antibiotik, antikanker, antifungi, antivirus, insektisida dan immunosuppressant agents. Bakteri endofit dengan genus Pseudomonas juga berperan sebagai agens biokontrol pada tanaman, agen fitoremediasi dan pemacu pertumbuhan tanaman.
Miller et al. (1998) berhasil mengisolasi senyawa ecomycin B dan C yang bersifat antifungi dari bakteri endofit Pseudomonas viridiflava. Bakteri endofit tersebut berasal dari sejenis rumput asal Amerika dan Eropa. Bakteri endofit genus Pseudomonas juga berhasil diisolasi oleh Jose dan Christy (2013) dari tanaman mangrove. Isolat bakteri endofit genus Pseudomonas tersebut telah diteliti memiliki kemampuan menghambat pertumbuhan bakteri dan fungi patogen, diantaranya Streptococcus pyogenes dan Candida albicans.
Uji Antibakteri Ekstrak Kloroform BS1
Ekstrak kloroform isolat BS1 diperoleh dari ekstraksi hasil fermentasi selama 48 jam. Hasil fermentasi yang digunakan adalah supernatan dari kultur isolat BS1. Pemilihan supernatan berdasarkan asumsi bahwa senyawa antibakteri yang dihasilkan bakteri endofit bersifat ekstraseluler. Hal ini diperkuat oleh hasil seleksi awal antara bakteri endofit dan bakteri patogen yang menunjukkan terbentuknya zona hambat berupa daerah bening di sekitar koloni endofit.
Ekstraksi dilakukan menggunakan pelarut kloroform sebanyak satu kali (1:1). Ekstrak selanjutnya diuji terhadap S. aureus. Hasil pengujian ditunjukkan dengan terbentuknya zona hambat di sekitar cakram (Gambar 3). Pemilihan bakteri uji yaitu S. aureus berdasarkan hasil seleksi awal isolat bakteri endofit (Tabel 2). Hasil tersebut menunjukkan bahwa isolat BS1 mampu menghambat S. aureus dengan diameter zona hambat yang lebih besar dibanding terhadap bakteri uji lainnya.
10
hasil penelitian Shukla et al. (2009) menunjukkan ekstrak kloroform daun sirih hijau segar yang diekstraksi menggunakan kloroform mampu menghambat S. aureus dengan zona hambat sebesar 6 mm. Kemungkinan bakteri endofit dari sirih hijau mampu menghasilkan senyawa antibakteri yang sama dengan ekstrak tanaman sirih hijau.
Gambar 3 Zona hambat yang terbentuk pada pengujian ekstrak kloroform BS1 terhadap S. aureus. (a) kontrol positif tetrasiklin 100µg/mL, (b) ekstrak kloroform BS1 (tanda panah).
Hasil Analisis Senyawa Antibakteri Ekstrak Kloroform BS1 dengan GC-MS Antibakteri secara garis besar terbagi menjadi dua kelompok, yaitu yang bersifat bakteriostatik dan bakterisidal. Senyawa antibakteri yang bersifat bakteriostatik bekerja dengan menghambat pertumbuhan atau penggandaan sel bakteri. Dalam kasus penyakit infeksi, senyawa antibakteri yang bersifat bakteriostatik memberi kesempatan bagi sistem imun untuk membersihkan bakteri dari sistem-sistem dalam tubuh. Senyawa antibakteri yang bersifat bakterisidal bersifat membunuh bakteri dengan atau tanpa adanya kompetisi dengan sistem imun. Secara umum mekanisme senyawa antibakteri, baik yang bersifat bakteriostatik maupun bakterisidal, antara lain menghambat sintesis dinding sel, menghambat kerja ribosom, menghambat sintesis asam nukleat, menghambat metabolisme folat dan menghambat fungsi membran sel (Sosa et al. 2010).
Ekstrak kloroform BS1 dianalisis dengan GC-MS. Hasil analisis GC-MS berupa kromatogram yang menunjukkan waktu retensi dan kelimpahan senyawa di dalam sampel ditandai dengan puncak-puncak spektrum (Lampiran 7). Ekstrak kloroform BS1 menunjukkan banyaknya puncak yang muncul dan beberapa puncak saling tumpang-tindih. Hal ini kemungkinan disebabkan kondisi ekstrak yang belum terlalu murni.
Berdasarkan data yang dihasilkan spektrum GC-MS, senyawa dengan kelimpahan terbanyak adalah 1,4-diaza-2,5-dioxobicyclo[4.3.0] nonane yaitu sebesar 38.28%. Senyawa dengan kelimpahan terbesar kedua adalah kloroform. Namun, karena waktu retensi kloroform tersebut berada di awal kemungkinan kloroform tersebut merupakan sisa pelarut yang digunakan dalam proses ekstraksi. Meski demikian, kloroform sendiri memiliki kemampuan sebagai antibakteri. Senyawa dengan kelimpahan terbesar ketiga adalah 1-methyl-2,4-Imidazolidinedione (9.55%). Menurut Bharat et al. (2013), senyawa kelompok
11 imidazol dan imidazol alkaloid dari sianobakteri memiliki kemampuan menghambat pertumbuhan S. aureus.
Selain itu, berdasarkan spektrum GC-MS senyawa piperazine dengan kelimpahan 3.55% juga terdeteksi dari ekstrak kloroform BS1. Piperazine dan turunannya seperti N-[4-(2-{4-[(S)-(4-chlorophenyl)(phenyl)methyl]-1-piperazinyl}acetyl) phenyl] acetamide memiliki sifat antibakteri terhadap bakteri Gram positif dan negatif (Amita et al.. 2011). Chue et al.. (2011) juga melaporkan bahwa turunan piperazine yang direaksikan dengan asam betulonat, yaitu N-[3-Oxo-20(29)-lupen-28-oyl]-4-(3,4-dichlorophenyl)-piperazine dan N-[3-Oxo-20(29)-lupen-28-oyl]-4-(4-trifluoromethylphenyl)-piperazine memiliki sifat antibakteri.
Senyawa asam propionat (propionic acid) dalam bentuk 3-pyrrolidin-2-yl-propionic acid (2.17%) terdeteksi dalam ekstrak kloroform. Asam propionat secara teknis bersifat menghambat pertumbuhan kapang dan bersifat bakterisidal. Senyawa ini digunakan dalam industri pengawetan pangan terutama produk hewani dan biji-bijian (The Dow Chemical Company 2008). Senyawa 1-octadecene dan fenol dalam persentase relatif kecil juga terdeteksi di dalam ekstrak kloroform BS1. Menurut Mishra dan Sree (2007), senyawa 1-octadecene
dari Finlaysonia obovata memiliki sifat sebagai antibakteri terhadap bakteri patogen ikan. Ekstrak daun sirih hijau telah diteliti juga mengandung senyawa fenol (Chakraborty & Shah 2011). Diduga, senyawa fenol yang terkandung di dalam ekstrak daun sirih hijau berasal dari bakteri endofit yang berada di batang.
KESIMPULAN DAN SARAN
Kesimpulan
Sebanyak 14 isolat bakteri endofit telah diisolasi dari tanaman sirih hijau. Pengujian ke-14 isolat terhadap empat bakteri patogen memunculkan satu isolat potensial, yaitu BS1. Hasil analisis gen 16S rRNA, menunjukkan bahwa isolat BS1 memiliki persentase kemiripan sebesar 94% dengan genus Pseudomonas sp. Berdasarkan analisis dengan GC-MS ekstrak kloroform isolat BS1 terdiri dari senyawa yang bersifat antibakteri antara lain 1-methyl-2,4-Imidazolidinedione dan
piperazine.
Saran
Perlu dilakukan optimasi waktu fermentasi isolat BS1 agar menghasilkan rendemen ekstrak yang lebih banyak. Pemurnian hasil ekstraksi dengan kromatografi kolom dan kromatografi lapis tipis (KLT) juga perlu dilakukan agar analisis GC-MS memiliki hasil yang lebih baik.
DAFTAR PUSTAKA
Al-Adhroey AH, Nor ZM, Al-Mekhlafi HM, Amran AA, Mahmud R. 2011. Antimalarial Activity of Methanolic Leaf Extract of Piper betle L. Molecules
12
Ali, I. et al.. 2010. In vitro antifungal activity of hydroxychavicol isolated from
Piper betle L. Ann. Clin. Microbiol. Antimicrob. 9 (7).
Amita T, Mridula M, Manju V. 2011. Piperazine : the molecule of diverse pharmacologic importance. IJRAP 2(5) : 1547-1548.
Arunachalam C, Gayathri P. 2010. Studies on bioprospecting of endophytic bacteria from the medicinal plant of Andrographis paniculata for their antimicrobial activity and antibiotic susceptibility pattern. Int J of Curr Pharm. Res. 2 (4) : 63-68.
Bacon CW, Hinton DM. 2006. Bacterial endophytes : the endophytic niche, its occupants, and its utility. Di dalam : Gnanamanickam SS, editor. Plant-Associated Bacteria. Netherland : Springer.
Beck HC, Hansen AM, Lauritsen FR. 2003. Novel pyrazine metabolites found in polymyxin biosynthesis by Paenibacillus polymyxa. FEMS Microbiol Lett
220: 67–73. Di dalam : Ryan RP, Germaine K, Franks A, Ryan DJ, Dowling DN. 2008. Bacterial endophytes: recent developments and applications Mini Review. FEMS Microbiol Lett 278 : 1–9.
Bharat N, Irshad Md, Rizvi Md MA, Fatma T. 2013. Antimicrobial and cytotoxic activities of cyanobacteria. Int. J. of Innovative Res. in Sci., Eng., and Technol.
2(9) : 4328-4343.
Bhore SJ, Sathisha G. 2010. Screening of endophytic colonizing bacteria for cytokinin-like compounds: crude cell-free broth of endophytic colonizing bacteria is unsuitable in cucumber cotyledon bioassay. World J. Agric. Sci. 6 (4): 345-352.
Castillo UF, Strobel GA, Ford EJ. 2002. Munumbicins,wide-spectrum antibiotics produced by Streptomyces NRRL 30562, endophytic on Kennedia nigriscans.
Microbiology 148:2675–2685. Di dalam : Ryan RP, Germaine K, Franks A, Ryan DJ, Dowling DN. 2008. Bacterial endophytes: recent developments and applications Mini Review. FEMS Microbiol Lett 278 : 1–9.
Castillo U, et al.. 2003. Kakadumycins, novel antibiotics from Streptomyces sp.NRRL 30566, an endophyte of Grevillea pteridifolia. FEMS Microbiology Letters 224: 180-190.
Chakraborty D, Shah B. 2011. Antimicrobial, antioxidative and antihemolytic activity of Piper betle leaf extracts. Int. J. of Pharm. And Pharmaceutical Sci. 3 (3) : 192-199.
Chue KT, Chang MS, Ten LN. 2011. Synthesis and antibacterial activity of betulonic acid amides with piperazine derivatives. Chem. of Natural Compounds 47(5) : 759-763.
Clarridge JE. 2004. Impact of 16S rRNA gene sequence analysis for identification of bacteria on clinical microbiology and infectious diseases. Clin. Microbiol. Rev. 17 (4) : 840-862.
Desriani, Kusumawati DE, Rivai A, Hasanah N, Amrinola W, Triratna L, Sukma A. 2013. Potential endophytic bacteria for increasing paddy var rojolele productivity. Int. J. on Adv. Sci., Eng. and Information Tech. 3 (1) : 76-78.
Guan SH, Sattler I, Lin WH, Guo DA, Grabley S. 2005. p-Aminoacetophenonic acids produced by a mangrove endophyte: Streptomyces griseus subspecies. J
13 DJ, Dowling DN. 2008. Bacterial endophytes: recent developments and applications Mini Review. FEMS Microbiol Lett 278 : 1–9.
Guha P. 2006. Betel leaf : the neglected green gold of india. J. Hum. Ecol. 19 (2) : 87-93.
Jalgaonwala RE, Mohite BV, Mahajan RT. 2010. Evaluation of endophytes for their antimicrobial activity from indigenous medicinal plants belonging to north maharashtra region india . Int. J. on Pharm and Biomed Res. 1 (5) : 136-141.
Jose AC, Christy PH. 2013. Assessment of antimicrobial potential of endophytic bacteria isolated from Rhizophora mucronata. Int. J. Curr. Microbiol. App. Sci. 2 (10) : 188-194.
Kumala S, Siswanto EB. 2007. Isolation and Screening of Endophytic Microbes from Morinda citrifolia and their Ability to Produce Anti-Microbial Substances. Microbiol. Indones. 1 (3) : 145-148.
Kumar N, Misra P, Dube A, Bhattacharya S, Dikshit M, Ranade S. 2010. Piper betle Linn. a maligned Pan-Asiatic plant with an array of pharmacological activities and prospects for drug discovery. Curr. Sci. 99 (7) : 922-932.
Melliawati R, Widyaningrum DN, Djohan AC, Sukiman H. 2006. Pengkajian bakteri endofit penghasil senyawa bioaktif untuk proteksi tanaman.
Biodiversitas 7(3) : 221-224.
Miller CM, Miller RV, Garton-Kenny D, Redgrave B, Sears J, Condron MM, Teplow DB, Strobel GA. 1998. Ecomycins, unique antimycotics from Pseudomonas viridiflava. J. of App. Microbiol. 84 : 937-944.
Min HJ, Nam JW, Yu ES, Hong JH, Seo EK, Hwang ES. 2009. Effect of naturally occurring hydroxychavicol acetate on the cytokine production in T helper cells.
Int. Immunopharmacol. 9 : 448–454.
Mishra PM, Sree A. 2007. Antibacterial activity and GCMS analysis of the extract of leaves of Finlaysonia obovata (a mangrove plant). Asian J. of Plant Sci.
6(1) : 168-172.
Murata K. et al.. 2009. Hydroxychavicol: a potent xanthine oxidase inhibitor obtained from the leaves of betel. Piper betle. J. Nat.Med. 63 : 355–359. Nalina T, Rahim ZHA. 2007. The crude aqueous extract of Piper betle L. and its
antibacterial effect towards Streptococcus mutans. American Journal of Biotechnology and Biochemistry 3 (1): 10-15.
Pradhan D, Suri KA, Pradhan DK, Biswasroy P. 2013. Golden heart of the nature : Piper betle L. J. of Pharmacognosy and Phytochem. 1 (6) : 147-167. Ruhe JJ, Monson T, Bradsher, RW, Menon A. 2005. Use of Long-Acting
Tetracyclines for Methicillin-Resistant Staphylococcus aureus Infections: Case Series and Review of the Literature. Clin. Inf. Dis. 40:1429–1434.
Ryan RP, Germaine K, Franks A, Ryan DJ , Dowling DN. 2008. Mini Review : Bacterial endophytes: recent developments and applications. FEMS Microbiol Lett 278:1–9.
Santhakumari P, Prakasam A, Pugalendi KV. 2006. Antihyperglycemic activity of Piper betle leaf on streptozotocin-induced diabetic rats. J. Med. Food 9: 108–112.
14
Shukla R, Satish V, Singh VK, Kumar S, Gupta S, Gavani S. 2009. Antibacterial Activity of Fresh leaves of “Piper betle Linn. The Pharma Research 1 : 110-113.
Simanjuntak P, Bustanussalam, Otovina DM, Rahayuningsih M, Said EG. 2004. Isolasi dan identifikasi artemisinin dari hasil kultivasi mikroba endofit dari tanaman Artemisia annua. [studi mikroba endofitik tanaman Artemisia spp.].
Majalah Farmasi Indonesia 15 (2) : 68-74.
Simarmata R, Lekatompessy S, Sukiman H. 2007. Isolasi mikroba endofitik dati tanaman obat sambung nyawa (Gymura procumbens) dan analisis potensinya sebagai antimikroba. Berk Penel Hayati 13 : 85-90.
Sosa A.de J, Byarugaba DK, Amabile C, Hsueh PR, Kariuki S, Okeke IN. 2010. Antimicrobial resistance in developing countries. Springer. Doi :10.1007/978-0-387-89370-9_2.
Stiegler P, Carbon P, Zuker M, Ebel JP, Ehresmann C. 1981. Structural organization of the 16S ribosomal RNA from E. coli : Topography and secondary structure. Nucleic Acids Res. 9(9): 2153–2172.
Strobel G, Daisy B, Castillo U, Harper J. 2004. Natural products from endophytic microorganisms. J Nat Prod 67: 257–268. Di dalam : Ryan RP, Germaine K, Franks A, Ryan DJ, Dowling DN. 2008. Bacterial endophytes: recent developments and applications Mini Review. FEMS Microbiol Lett 278 : 1–9. Suliantari, Jenie BSL, Suhartono MT. 2012. Aktivitas antibakteri fraksi-fraksi
ekstrak sirih hijau (Piper betle Linn.) terhadap patogen pangan. J. Teknol. dan Industri Pangan 23 (2) : 217-220.
Tanaka M, Sukiman H, Takebayashi M, Saito K, Suto M, Prana MS, Tomita F. 1999. Isolation, screening and phylogenetic identification of endophytes from plants in hokaido japan and java indonesia. Microbes and Environment 14(4): 237–241. Di dalam : Simarmata R, Lekatompessy S, Sukiman H. 2007. Isolasi mikroba endofitik dati tanaman obat sambung nyawa (Gymura procumbens) dan analisis potensinya sebagai antimikroba. Berk Penel Hayati 13 : 85-90. The Dow Chemical Company. 2008. Product safety assessment : proopionic acid.
The Dow Chemical Company.
Tripathi S. 2008. Chemical investigation of betel vine (Piper betle L.) as antioxidant agent [Ph D thesis]. Lucknow University, Lucknow.
[WHO] World Health Organization. 2013. Selected infectious diseases: Selected diseases for latest years by country (latest years) [terhubung berkala] http://www.apps.who.int/gho/data/view.main.1540?lang=en (3 Januari 2014). Yadav SK, Adhikary B, Maity B, Bandyopadhyay SK, Chattopadhyay S. 2009.
16
Lampiran 1 Bagan alir penelitian
Tanaman sirih hijau
Isolasi bakteri endofit
Isolat bakteri endofit Isolat bakteri
patogen
Regenerasi bakteri patogen dan bakteri
endofit
Seleksi awal untuk memperoleh bakteri endofit potensial
Isolat bakteri endofit potensial
Fermentasi
Ekstraksi senyawa antibakteri
Ekstrak
Uji antibakteri terhadap bakteri patogen
Identifikasi dengan GC-MS
Senyawa antibakteri Spesies bakteri
endofit Identifikasi dengan
18
Lampiran 3 Sekuens DNA isolat BS1 hasil sequencing
19 Lampiran 4 Sekuens DNA isolat BS1 hasil pensejajaran
>Konsensus BS1 (1530 pb)
20
21 Lampiran 6 Kondisi GC-MS
Merk : Shimadzu Type GCMS-QP2010
Gas : Helium
Detector : MS (Mass Spectrometer)
Column : Capiler Type Phase Rtx-5MS; 60 m; 0.25 mmID Column Temperature : 50°C
Inlet Press (kPa) : 100 Column Flow (ml/min) : 0.85
Split Ratio : 112.3
SPL Temperature : 280°C
MS Interface : 280°C
Ion Source : 200°C
22
23
RIWAYAT HIDUP
Penulis dilahirkan di Tegal pada tanggal 24 April 1991 dari pasangan Heri Purwanto dan Abdjad Asih Nawangsih. Penulis merupakan anak pertama dari tiga bersaudara. Tahun 2009 penulis lulus dari SMAN 1 Bogor. Di tahun yang sama penulis diterima pada program sarjana (S1) Departemen Biokimia Fakultas Matematika dan Ilmu Pengetahuan Alam IPB melalui jalur SNMPTN.