xanthorrhiza
Roxb.) INDONESIA
LUKITA DEVY
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Analisis Keragaman dan Stabilitas
Genetik Temulawak (Curcuma xanthorrhiza Roxb.) Indonesia adalah karya saya
dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2009
Lukita Devy
NRP A151060191
Temulawak (Curcuma xanthorrhiza Roxb.). Under the direction of SOBIR and DODO RUSNANDA SASTRA.
This study consists of two experiments. The first was multilocations test in dryland and the second was multiseasons test under two sunlight intensities (45% and 100%). Fourteen temulawak (Curcuma xanthorrhiza Roxb.) accessions were used in both experiments. The first experiment was conducted to determine genetic parameters in two locations (Serpong and Bogor) from December 2006 to August 2007. Direct and indirect effects of vegetative components to rhizome fresh weight through path analysis were also investigated. The observed traits in this experiment consist of vegetative, yield and secondary metabolite components. The second experiment was conducted to determine genetic parameters, genetic stability and path analysis under two sunlight intensities for three seasons (October 2004 to August 2007). Grouping of accessions tolerancy to different sunlight intensities was also investigated. The observed traits consist of vegetative and yield components.
There were no differences among tested accessions based on the analysis of variance in the multilocations experiment, except for tiller number and leaf length/width ratio. The heritability of these traits were high (h2bs=73.7% and
h2bs=61.8%, respectively). However, their genetic variabilities were narrow (σ2g <
2 σσ2g). Differences among tested accessions in two sunlight intensities showed
by 8 traits in the first season, 2 traits in the second season and 1 trait in the third season. High heritability and wide genetic variability showed by leaf length, plant height and leaf length/width ratio.
Full sunlight intensity tolerant accessions were T12 (Imogiri-Yogyakarta), T4 (Majenang-Central Java), T11 (Gunung Kidul-Yogyakarta) and T7 (Majalengka-West Java). Shading (sunlight intensity 45%) tolerant accessions were T11, T16 (Pasir Gaok 3-West Java), T4 and T12. Accessions T11 and T16 were stabil (bi= 1.0) in various conditions under 45% sunlight intensity while T4
and T12 were stabil under optimum condition (bi< 1.0) based on
Finlay-Wilkinson stability test. Those accessions showed high rhizome fresh weight (above their yield mean µ> 391.4 g/plant).
The correlation between vegetative traits and rhizome fresh weight were also analyzed. Tiller number could be used as selection criteria for rhizome fresh weight in dryland under full sunlight, while leaf width could be used in shaded area. These traits were chosen as selection criteria because of their high heritability (h2bs-tiller number= 73.7%, h2bs-leaf width = 54.2%), high direct effect (P tiller number= 0.64, P leaf width = 2.27) and high significant correlation with rhizome fresh
weight (r tiller number = 0.89, r leaf width = 0.90).
Keywords: genetic parameters, indirect selection, genetic stability, yield
LUKITA DEVY. Analisis Keragaman dan Stabilitas Genetik Temulawak (Curcuma xanthorrhiza Roxb.) Indonesia. Dibimbing oleh SOBIR dan DODO RUSNANDA SASTRA.
Temulawak (Curcuma xanthorrhiza Roxb.) merupakan tanaman obat yang
potensial untuk dijadikan komoditas unggulan Indonesia karena secara tradisional telah banyak digunakan oleh masyarakat Indonesia sejak lama. Saat ini berbagai manfaat farmakologis temulawak semakin terungkap dengan adanya kemajuan teknologi.
Tantangan yang dihadapi dalam pengembangan temulawak adalah rendahnya tingkat produktivitas. Produktivitas temulawak masih berada di bawah potensinya (20 ton/ha). Upaya untuk mengatasi hal ini adalah melalui penggunaan varietas unggul dan intensifikasi, namun varietas unggul temulawak di Indonesia belum tersedia. Perakitan varietas unggul dapat dilakukan sebagai salah satu solusi untuk meningkatkan produksi temulawak.
Temulawak merupakan tanaman yang toleran terhadap intensitas cahaya penuh sampai sedang sehingga cukup baik bila ditanam di bawah tegakan pohon yang jarak tanamnya cukup lebar. Kondisi tersebut mendukung perluasan area tanam temulawak ke lahan-lahan marjinal. Indonesia memiliki potensi lahan marjinal yang cukup tinggi untuk dijadikan sebagai daerah pengembangan temulawak. Lahan-lahan marjinal yang dapat dimanfaatkan mencakup lahan kering di bawah intensitas cahaya matahari penuh dan lahan kering ternaungi, oleh karena itu kegiatan pemuliaan untuk perakitan varietas unggul temulawak perlu dilakukan pada kedua kondisi lahan tersebut. Sebagai tujuan akhir diharapkan akan dihasilkan varietas unggul temulawak yang toleran terhadap kondisi lahan kering di bawah intensitas cahaya matahari penuh dan lahan kering ternaungi.
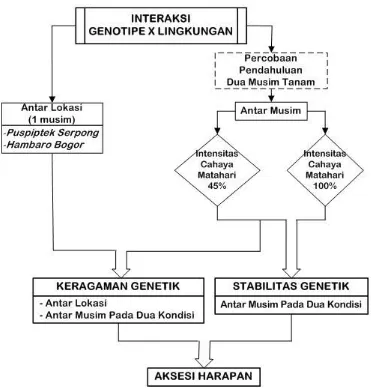
Penelitian ini merupakan bagian dari kegiatan pemuliaan yang diperlukan dalam perakitan varietas unggul temulawak pada lahan kering di bawah intensitas cahaya matahari penuh dan lahan kering ternaungi. Dua percobaan dilakukan untuk memenuhi hal tersebut. Percobaan pertama adalah pengujian antar lokasi pada lahan kering di bawah intensitas cahaya matahari penuh sedangkan percobaan kedua adalah pengujian antar musim pada lahan kering dengan intensitas cahaya matahari 45% dan intensitas cahaya matahari penuh (100%) selama tiga musim.
Pengujian antar lokasi lahan kering dilaksanakan di Kawasan Puspiptek Serpong, Kabupaten Tangerang (70 m dpl) dan Kawasan Agromedika Hambaro, Kabupaten Bogor (400 m dpl) dari bulan Desember 2006-Agustus 2007. Percobaan antar musim pada dua intensitas cahaya matahari dilaksanakan di Kawasan Puspiptek Serpong, Kabupaten Tangerang. Penanaman musim ke-1 dilakukan pada bulan Oktober 2004-Juli 2005, musim ke-2 pada bulan November 2005-Agustus 2006 dan musim ke-3 pada bulan Desember 2006-Agustus 2007. Pengamatan pada percobaan antar lokasi lahan kering di bawah intensitas cahaya matahari penuh dilakukan terhadap karakter morfologi, vegetatif, hasil, komponen hasil dan bahan aktif. Sedangkan pada percobaan antar musim di dua intensitas
kering, hanya karakter jumlah anakan/rumpun dan rasio panjang/lebar daun yang menunjukkan adanya perbedaan antar aksesi. Sedangkan pada percobaan antar intensitas cahaya matahari selama tiga musim, ditunjukkan oleh 8 karakter pada musim pertama, 2 karakter pada musim kedua dan 1 karakter pada musim ketiga. Karakter-karakter tersebut adalah jumlah anakan, panjang daun, tinggi tajuk, panjang tangkai daun, rasio panjang/lebar daun, panjang rimpang sekunder, jumlah rimpang tersier, bobot ubi akar, jumlah ubi akar, panjang ruas rimpang primer dan panjang ruas rimpang tersier. Pada pengujian gabungan tiga musim tidak ada karakter yang menunjukkan perbedaan antar aksesi maupun interaksi antara aksesi dan lingkungan.
Aksesi-aksesi yang menunjukkan perbedaan antar karakter cenderung memiliki nilai heritabilitas yang tinggi (hbs > 50%). Nilai heritabilitas yang tinggi
tidak selalu diikuti oleh keragaman genetik yang luas (σ2g > 2 σσ2g). Hal ini
ditunjukkan oleh karakter jumlah anakan/rumpun dan rasio panjang/lebar daun (h2bs-jumlah anakan/rumpun= 73.7% and h2bs-rasio panjang/lebar daun= 61.8%) pada pengujian
antar lokasi lahan kering serta tujuh karakter pada pengujian antar intensitas cahaya matahri selama tiga musim (62.40 < hbs < 81.55).
Karakter yang memiliki nilai heritabilitas tinggi dengan keragaman genetik luas adalah panjang daun, tinggi tajuk dan rasio panjang/lebar daun. Karakter-karakter ini potensial untuk dijadikan kriteria seleksi.
Aksesi-aksesi yang memiliki stabilitas genetik (bi= 1.0) pada intensitas cahaya matahari 45% dengan hasil bobot basah rimpang di atas rata-rata (> 391.4 g/rumpun) adalah T11 (Gunung Kidul-Yogyakarta) dan T16 (Pasir Gaok 3-Jawa Barat). Aksesi-aksesi ini mampu beradaptasi terhadap berbagai kondisi lingkungan pada lahan dengan intensitas cahaya matahari 45%.
Aksesi-aksesi yang memiliki stabilitas genetik di atas rata-rata pada intensitas cahaya matahari 45% (bi> 1.0) dengan hasil di atas rata-rata adalah T4 (Majenang-Jawa Tengah), T5 (Cikijing-Jawa Barat), T6 (Ciporang-Jawa Barat), T7 (Majalengka-Jawa Barat), T12 (Imogiri-Yogyakarta) dan T14 (Pasir Gaok 1-Jawa Barat). Aksesi-aksesi ini cenderung mampu beradaptasi terhadap kondisi lingkungan yang kurang optimum pada intensitas cahaya matahari 45%.
Aksesi-aksesi yang toleran terhadap intensitas cahaya matahari 45% adalah T11, T16, T4 dan T12. Aksesi-aksesi ini potensial untuk dikembangkan secara polikultur di lahan bernaungan seperti di bawah tegakan pohon buah-buahan atau perkebunan.
Aksesi-aksesi yang toleran terhadap intensitas cahaya matahari 100% adalah T12, T4, T11 dan T7. Aksesi-aksesi ini potensial untuk dikembangkan secara monokultur pada intensitas cahaya penuh.
Aksesi-aksesi yang toleran pada kondisi ternaungi maupun tanpa naungan adalah T4 dan T12. Aksesi-aksesi ini mampu berproduksi baik pada dua lingkungan tersebut.
Karakter-karakter yang terpengaruh dengan adanya perbedaan intensitas cahaya matahari adalah panjang daun, tinggi tajuk, rasio panjang lebar/daun dan panjang rimpang primer. Hal ini ditunjukkan dengan adanya interaksi antara aksesi dengan intensitas cahaya matahari. Penurunan intensitas cahaya matahari
basah rimpang, maka karakter yang dapat digunakan sebagai kriteria seleksi di lahan kering di bawah intensitas cahaya matahari penuh adalah jumlah anakan/rumpun. Kriteria seleksi pada lahan kering bernaungan (intensitas cahaya matahari 45%) adalah lebar daun. Kedua karakter ini terpilih karena memiliki nilai heritabilitas tinggi (h2bs-jumlah anakan/rumpun= 73.7%, h2bs-lebar daun= 54.2%),
pengaruh langsung yang tinggi (P jumlah anakan/rumpun = 0.64, P lebar daun = 2.27) dan
korelasi yang sangat tinggi dengan bobot basah rimpang (r jumlah anakan/rumpun =0.89,
r lebar daun = 0.90).
Kata kunci: parameter genetik, seleksi tidak langsung, stabilitas genetik, hasil
Tanpa mencantumkan atau menyebutkan sumber a.Pengutipan hanya untuk kepentingan pendidikan,
penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah. b. Pengutipan tidak merugikan kepentingan yang wajar
IPB
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apa pun tanpa izin IPB
xanthorrhiza
Roxb.) INDONESIA
LUKITA DEVY
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Agronomi dan Hortikultura
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
NRP : A151060191
Disetujui
Komisi Pembimbing
Dr. Ir. Sobir, MSi. Dr. Ir. Dodo Rusnanda Sastra, MSi.
Ketua Anggota
Diketahui
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana
Dr. Ir. Munif Ghulamahdi, MS Prof. Dr. Ir. Khairil A. Notodiputro, MS
Tanggal Ujian: 20 Januari 2009 Tanggal Lulus:
Segala puji bagi Allah Yang Maha Suci dan Maha Agung atas rahmah dan ridho-Nya sehingga karya ilmiah ini dapat berhasil diselesaikan. Karya ilmiah ini mengulas tentang temulawak dengan judul Analisis Keragaman dan Stabilitas
Genetik Temulawak (Curcuma xanthorrhiza Roxb.) Indonesia. Penelitian yang
dilaksanakan merupakan bagian dari kegiatan “Penerapan Teknologi Budidaya
Tanaman Temulawak Melalui Kaidah Good Agricultural Practices” Bidang
Teknologi Produksi Tanaman Pangan dan Hortikultura, Badan Pengkajian dan Penerapan Teknologi (BPPT).
Ucapan terimakasih penulis sampaikan kepada Dr. Ir. Sobir, MSi dan Dr. Ir. Dodo Rusnanda Sastra MSi selaku komisi pembimbing serta Dr. Desta Wirnas, SP, MSi. selaku dosen penguji. Penghargaan disampaikan kepada Direktur Pusat Teknologi Produksi Pertanian BPPT beserta jajarannya, rekan-rekan di Kebun Percobaan Puspiptek Serpong dan Kawasan Agromedika Hambaro atas bantuannya selama penelitian berlangsung serta kepada Pusbindiklat BPPT yang telah mendanai studi penulis.
Ucapan terima kasih juga disampaikan kepada rekan-rekan di Program Studi Agronomi Angkatan 2006 atas kebersamaannya. Tak lupa penghargaan pun penulis sampaikan kepada keluarga Gunadi dan keluarga Subagio atas do’a dan dukungannya. Ungkapan terimakasih tak terhingga penulis sampaikan kepada suami dan ananda tersayang atas do’a, dukungan, pengorbanan dan pengertiannya selama penulis menjalani studi.
Akhir kata, penulis berharap semoga karya tulis ini dapat bermanfaat dan dapat menjadi amal ibadah bagi penulis di sisi Allah SWT.
Bogor, Januari 2009
Lukita Devy
dan ibu Suhaeni. Penulis merupakan anak pertama dari empat bersaudara. Penulis menikah dengan Andy Rahady dan dikaruniai satu orang putra bernama Muhammad Fauzan.
Tahun 1995 penulis lulus dari SMA Negeri 5 Bogor dan pada tahun yang sama lulus Ujian Masuk Perguruan Tinggi Negeri (UMPTN) di Institut Pertanian Bogor (IPB). Penulis diterima di Program Studi Hortikultura, Jurusan Budidaya Pertanian, Fakultas Pertanian dan lulus pada tahun 2000. Selama menempuh pendidikan S1, penulis mendapatkan beasiswa dari Yayasan Beasiswa Supersemar dan “The International Community Activity Center”. Penulis diterima di Program Studi Agronomi, Sekolah Pascasarjana IPB pada tahun 2006. Kesempatan untuk melanjutkan studi ke program magister tersebut didapatkan setelah memperoleh Beasiswa Program Peningkatan Keterampilan dan Pendidikan dari tempat bekerja penulis di Badan Pengkajian dan Penerapan Teknologi (BPPT).
Penulis sejak tahun 2002 bekerja di Pusat Teknologi Produksi Pertanian BPPT dan ditempatkan di Jakarta. Bidang penelitian yang menjadi tanggungjawab penulis adalah budidaya dan pemuliaan tanaman. Sebelumnya pada tahun 2000-2002 penulis bekerja di FORDA-Komatsu Project, Bogor.
Selama mengikuti program S2, penulis telah menyajikan karya ilmiah berjudul “Correlation and path analysis among growth and yield components to essential oil yield of temulawak (Curcuma xanthorrhiza Roxb.)” pada “The First
International Symposium on Temulawak (Curcuma xanthorrhiza Roxb.)” di Bogor
pada bulan Mei 2008. Karya ilmiah tersebut merupakan bagian dari program S2 penulis.
Halaman
Kandungan Zat Kimia Temulawak ... 8
Pemuliaan Temulawak ... 9
Pengujian Antar Lokasi di Lahan Kering pada Intensitas Cahaya Matahari 100% ... 41
Pengujian Antar Musim pada Intensitas Cahaya Matahari 45% dan 100% ... 47
Toleransi Aksesi terhadap Intensitas Cahaya Matahari 45% dan 100%.... 59
Pembahasan... 61
KESIMPULAN DAN SARAN... 71
DAFTAR PUSTAKA ... 73
LAMPIRAN... 79
1. Analisis ragam percobaan antar lokasi di Hambaro dan Serpong... 28
2. Analisis ragam percobaan dua naungan selama tiga musim di Serpong ... 29
3. Analisis ragam percobaan antar naungan per musim di Serpong ... 30
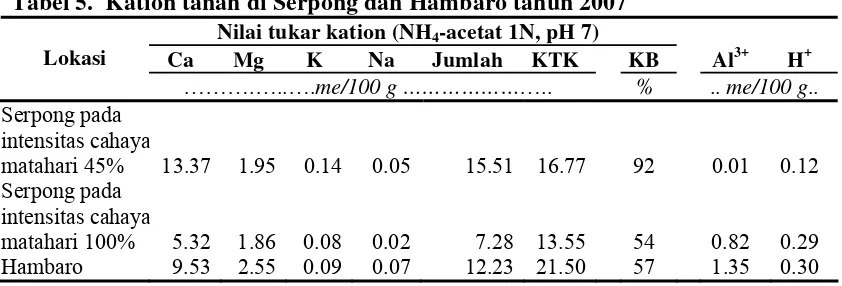
4. Tekstur, pH, kandungan bahan organik, nitrogen, fosfor dan kalium tanah di Serpong dan Hambaro tahun 2007 ... 35
5. Kation tanah di Serpong dan Hambaro tahun 2007 ... 36
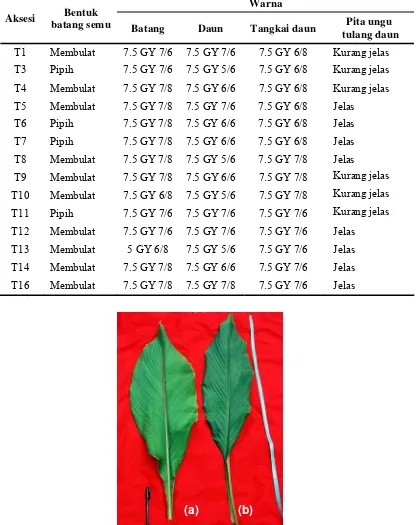
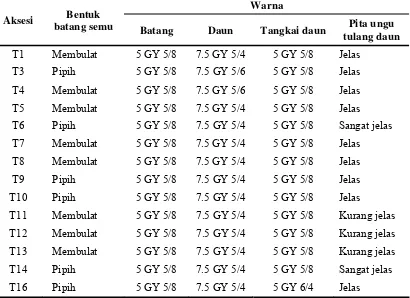
6. Keragaan karakter morfologi batang semu dan warna daun temulawak di Hambaro... 37
7. Keragaan karakter morfologi batang semu dan warna daun temulawak pada intensitas cahaya matahari 45% di Serpong ... 38
8. Keragaan karakter morfologi batang semu dan warna daun temulawak pada intensitas cahaya matahari 100% di Serpong ... 39
9. Keragaan karakter rimpang temulawak di Hambaro ... 40
10.Rekapitulasi analisis ragam karakter pertumbuhan vegetatif beberapa aksesi temulawak di dua lokasi ... 42
11.Rekapitulasi analisis ragam karakter kandungan dan produksi bahan aktif beberapa aksesi temulawak di dua lokasi ... 42
12.Rekapitulasi analisis ragam karakter hasil dan komponen hasil beberapa aksesi temulawak di dua lokasi ... 42
13.Parameter genetik rasio panjang/lebar daun serta jumlah anakan/rumpun pada percobaan antar lokasi ... 44
14.Nilai koefisien korelasi antar karakter vegetatif terhadap bobot basah rimpang temulawak di Hambaro dan Serpong... 45
15.Pengaruh langsung dan tidak langsung karakter vegetatif terhadap bobot basah rimpang temulawak pada dua lahan kering... 46
16.Rekapitulasi analisis ragam jumlah anakan/rumpun dan bobot basah rimpang total selama tiga musim di Serpong... 47
17.Rekapitulasi analisis ragam pada musim ke-1 di Serpong... 48
18.Rekapitulasi analisis ragam pada musim ke-2 di Serpong... 49
19.Rekapitulasi analisis ragam pada musim ke-3 di Serpong... 49
20.Pengaruh perbedaan intensitas cahaya matahari terhadap tinggi tajuk, panjang daun dan rasio panjang/lebar daun ... 50
21.Pengaruh perbedaan intensitas cahaya matahari terhadap panjang rimpang primer temulawak ... 51
22.Parameter genetik karakter vegetatif dan hasil pada percobaan antar intensitas cahaya matahari selama tiga musim... 53
23.Stabilitas bobot basah rimpang temulawak pada intensitas cahaya matahari 45% selama tiga musim di Serpong ... 55
24.Koefisien korelasi antara karakter vegetatif dan bobot basah rimpang 14 aksesi temulawak pada intensitas cahaya matahari 45% di Serpong musim ke-3... 58
25.Pengaruh langsung dan tidak langsung karakter vegetatif terhadap bobot basah rimpang temulawak pada intensitas cahaya matahari 45% di Serpong musim ke-3 ... 58
26.Bobot basah rimpang temulawak pada intensitas cahaya matahari 45% di Serpong ... 59
27.Jumlah anakan dan bobot basah rimpang temulawak pada intensitas
cahaya matahari 100 % di Hambaro dan Serpong ... 61
Halaman
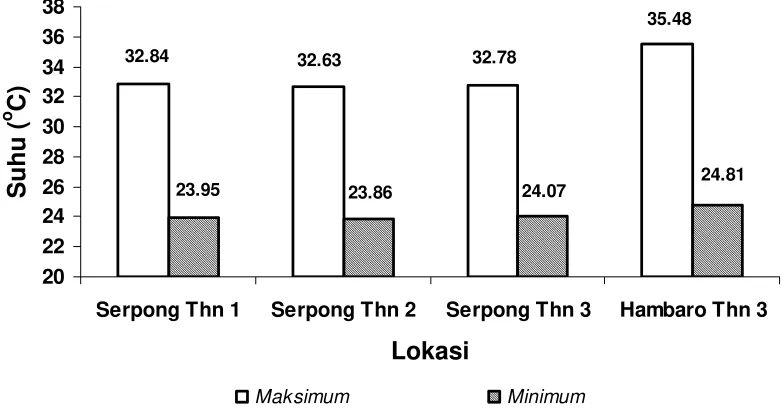
1. Tanaman temulawak dan bunga temulawak ... 6 2. Struktur kimia kurkumin I (diferuloyl methane)... 8 3. Diagram alur percobaan ... 18
4. Suhu maksimum dan minimum di Serpong selama tiga musim dan di
Hambaro pada musim ke-3 ... 33
5. Curah hujan di Serpong selama tiga musim dan di Hambaro pada
musim ke-3... 34
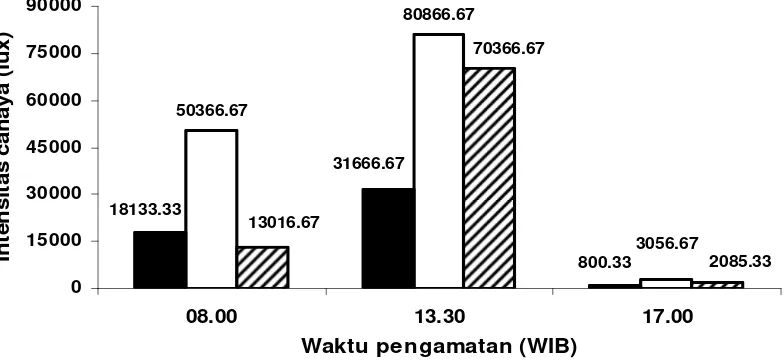
6. Intensitas cahaya di Serpong pada perlakuan intensitas cahaya
matahari 45%, 100% dan di Hambaro ... 34
7. Warna daun temulawak pada kondisi intensitas cahaya matahari
100% dan intensitas cahaya matahari 45% di Serpong... 37 8. Warna pita ungu ibu tulang daun temulawak... 38 9. Bentuk rimpang primer temulawak... 40
10. Hubungan antara bobot basah rimpang dengan curah hujan pada
intensitas cahaya 45% selama tiga tahun ... 55
11. Hubungan antara rata-rata bobot basah rimpang aksesi temulawak
pada intensitas cahaya matahari 45% selama tiga musim dengan koefisien regresi dari tiap aksesi ... 56
1. Tabel hasil uji kehomogenan ragam karakter vegetatif antar lokasi... 80 2. Tabel hasil uji kehomogenan ragam karakter bahan aktif antar lokasi ... 80 3. Tabel hasil uji kehomogenan ragam karakter hasil dan komponen hasil
antar lokasi ... 81
4. Tabel hasil uji kehomogenan ragam karakter vegetatif selama tiga
musim pada dua intensitas cahaya matahari di Serpong... 83
5. Tabel hasil uji kehomogenan ragam karakter panen selama tiga musim
pada dua intensitas cahaya matahari di Serpong... 84 6. Tabel hasil uji kehomogenan ragam karakter vegetatif dan panen pada
dua intensitas cahaya matahari musim ke-1 di Serpong ... 85 7. Tabel hasil uji kehomogenan ragam karakter vegetatif dan panen pada
dua intensitas cahaya matahari musim ke-2 di Serpong ... 86 8. Tabel hasil uji kehomogenan ragam karakter vegetatif dan panen pada
dua intensitas cahaya matahari musim ke-3 di Serpong ... 87
9. Tabel koefisien korelasi antara karakter vegetatif dan bobot basah
rimpang pada 14 aksesi temulawak di Serpong musim ke-1 ... 88 10.Tabel koefisien korelasi antara karakter vegetatif dan bobot basah
rimpang pada 14 aksesi temulawak di Serpong musim ke-2 ... 88 11.Tabel koefisien korelasi antara karakter vegetatif dan bobot basah
rimpang pada 14 aksesi temulawak di Serpong musim ke-3 ... 88
12.Tabel rekapitulasi sidik ragam karakter vegetatif dan bobot basah
rimpang temulawak pada intensitas cahaya matahari 100% musim ke-3
di Serpong ... 89
13.Tabel rekapitulasi sidik ragam karakter vegetatif dan bobot basah
rimpang temulawak pada intensitas cahaya matahari 45% musim ke-3
di Serpong ... 89
14.Tabel hasil uji kehomogenan ragam bobot basah rimpang temulawak
selama tiga musim pada masing-masing intensitas cahaya matahari... 89 15.Tabel rekapitulasi sidik ragam bobot basah rimpang temulawak selama
tiga musim pada masing-masing intensitas cahaya matahari... 90
Latar Belakang
Temulawak (Curcuma xanthorrhiza Roxb.) merupakan salah satu tanaman obat
berkhasiat yang secara tradisional telah lama digunakan di Indonesia. Tanaman ini
tersebar di Jawa, Bali dan Maluku (Wardini & Prakoso 1999). Manfaat temulawak
bagi kesehatan berhubungan dengan kandungan bahan aktifnya, yang terdiri dari
kurkuminoid, minyak atsiri dan pati. Kurkuminoid berfungsi sebagai anti inflamasi,
anti kanker, anti bakteri, anti fungi, anti parasit, anti imunodefisiensi, anti virus (virus
flu burung) dan anti oksidan (Priosoeryanto et al. 2008; Chattopadhyay et al. 2004;
Lin & Lin-Shiau 2001; Araújo & Leon 2001). Komponen minyak atsiri temulawak
terdiri dari 5 senyawa mayor dan 8 senyawa minor (Agusta & Chairul 1996). Salah
satu senyawa mayor tersebut adalah xanthorrhizol. Xanthorrhizol memiliki fungsi
sebagai obat anti fungi spektrum luas, anti bakteri, anti metastasis sel tumor dan
pencegah efek samping kemoterapi (Kim et al. 2008; Rukayadi et al. 2008; Choi et
al. 2004; Kim et al. 2005; Rukayadi et al. 2006).
Ekstrak temulawak potensial untuk dijadikan sebagai produk industri perawatan
gigi, jerawat dan ketombe (Hwang et al. 2008). Pengembangan temulawak dapat
le-bih diperluas ke berbagai kategori industri, seperti pangan fungsional maupun
kos-metika. Mengingat banyaknya manfaat yang dimiliki temulawak dan secara turun
temurun telah menjadi budaya bangsa Indonesia maka tanaman ini cocok ditetapkan
sebagai tanaman obat unggulan khas Indonesia seperti halnya ginseng dari Korea.
Tantangan yang dihadapi dalam pengembangan temulawak adalah masih
ren-dahnya tingkat produktivitas. Produktivitas tanaman temulawak pada tahun 2005 di
Indonesia adalah 13.62 ton/ha (Deptan 2006) sedangkan potensinya dapat mencapai
20 ton/ha (Wardini & Prakoso 1999). Umumnya nilai produktivitas yang rendah
disebabkan oleh belum tersedianya varietas unggul, belum adanya standardisasi bibit
bermutu dan belum dilakukannya teknik budidaya anjuran meskipun temulawak telah
Usaha peningkatan produksi temulawak dapat dilakukan melalui dua
pendekat-an yaitu peningkatpendekat-an produktivitas dpendekat-an perluaspendekat-an areal penpendekat-anampendekat-an. Produksi
temu-lawak pada tahun 2005 adalah 22 582 ton (Deptan 2006). Nilai produksi ini masih
dapat ditingkatkan melalui penggunaan varietas unggul temulawak dan teknik
budi-daya berdasarkan kaidah good agricultural practices (GAP).
Luas panen temulawak Indonesia pada tahun 2005 adalah 1 657.4 ha (Deptan
2006). Pengembangan areal penanaman dapat dilakukan dengan memanfaatkan
la-han-lahan marjinal. Lahan tersebut banyak tersedia di Indonesia, seperti lahan lahan
kering di bawah intensitas cahaya matahari penuh atau lahan kering ternaungi. Lahan
ternaungi yang potensial untuk pengembangan temulawak di Indonesia adalah lahan
perkebunan sekitar 19.6 juta ha (BPS 2005/2006). Selain itu terdapat juga lahan
kering berupa tegal/kebun/ladang/huma seluas 14.9 juta ha serta lahan yang
semen-tara tidak diusahakan seluas 1.2 juta ha (BPS 2005/2006). Pemanfaatan lahan-lahan
tersebut akan sangat mendukung peningkatan produksi temulawak Indonesia.
Perakitan varietas unggul temulawak yang toleran terhadap lahan kering
ter-naungi dan lahan kering di bawah intensitas cahaya matahari penuh menjadi hal yang
penting untuk dilakukan sebagai upaya untuk meningkatkan produksi temulawak
In-donesia. Perakitan varietas unggul ini dilakukan melalui kegiatan pemuliaan
tana-man. Kegiatan pemuliaan dapat terlaksana jika tersedia keragaman genetik dalam
suatu populasi yang akan diseleksi. Ketersediaan materi genetik yang beragam dan
kemampuan mengidentifikasikannya merupakan kunci keberhasilan dalam pemuliaan
tanaman (Welsh 1981).
Aspek penting lain yang perlu mendapat perhatian dalam pemuliaan tanaman
adalah stabilitas genetik dan korelasi antar karakter. Stabilitas genetik bermanfaat
untuk mengetahui respon suatu genotipe terhadap berbagai kondisi lingkungan,
se-hingga dapat digunakan untuk mengidentifikasi genotipe unggul. Korelasi antar
karakter dapat digunakan untuk menentukan kriteria seleksi terhadap karakter utama
sehingga proses seleksi akan berjalan lebih efisien. Korelasi sederhana tidak dapat
sehingga perlu dilakukan sidik lintas yang dapat mengurai korelasi menjadi pengaruh
langsung dan tidak langsung (Singh & Chaudhary 1979).
Pendugaan keragaman, stabilitas genetik dan sidik lintas temulawak belum
ba-nyak dilaporkan hingga saat ini. Hal ini menyebabkan perlunya dilakukan studi
ter-hadap ketiga komponen tersebut sebagai dasar dari perakitan varietas unggul
temula-wak.
Perumusan Masalah
Rendahnya tingkat produktivitas temulawak pada lahan-lahan marjinal
disebab-kan oleh belum tersedianya varietas unggul temulawak yang toleran. Perakitan
varietas unggul temulawak yang toleran terhadap lahan-lahan marjinal merupakan
solusi yang dapat dilakukan untuk mengatasi permasalahan tersebut. Kegiatan
pe-muliaan temulawak yang mencakup karakterisasi keragaman, uji stabilitas hasil dan
pendugaan kriteria seleksi perlu dilakukan sebagai dasar dari perakitan varietas
ung-gul temulawak.
Kondisi lahan marjinal yang potensial untuk dijadikan wilayah pengembangan
temulawak adalah lahan kering di bawah intensitas cahaya matahari penuh dan lahan
kering ternaungi. Pengembangan temulawak di lahan kering ternaungi memerlukan
varietas yang toleran terhadap naungan. Sedangkan untuk pengembangan budidaya
secara monokultur di lahan kering memerlukan varietas yang toleran terhadap
inten-sitas cahaya matahari penuh. Oleh karena itu perlu dilakukan studi keragaman,
sta-bilitas dan pendugaan kriteria seleksi pada dua kondisi lahan tersebut. Hasil studi ini
diharapkan mampu mengakomodasi kebutuhan varietas unggul temulawak yang
to-leran terhadap lahan kering di bawah intensitas cahaya matahari penuh dan lahan
kering ternaungi. Berdasarkan kebutuhan penyediaan varietas unggul temulawak
pada lahan kering di bawah intensitas cahaya matahari penuh dan lahan kering
ter-naungi maka dilakukan dua pengujian pada penelitian ini, yang terdiri dari (1)
pengu-jian antar lokasi pada dua lahan kering di bawah intensitas cahaya matahari penuh
selama satu musim tanam serta (2) pengujian antar musim tanam (3 tahun) pada lahan
dilakukan di Kebun Percobaan Puspiptek Serpong, Kabupaten Tangerang, sedangkan
pengujian kedua dilakukan di Kebun Percobaan Puspiptek Serpong, Kabupaten
Tangerang dan Kawasan Agromedika Hambaro, Kabupaten Bogor.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan informasi tentang:
1. Keragaman genetik temulawak antar musim pada intensitas cahaya matahari
pe-nuh dan ternaungi serta antar lokasi lahan kering pada intensitas cahaya matahari
penuh.
2. Stabilitas genetik temulawak antar musim pada lahan kering dengan intensitas
cahaya matahari penuh dan ternaungi.
3. Karakter seleksi daya hasil (bobot basah rimpang) temulawak pada lahan kering
dengan intensitas cahaya matahari penuh dan naungan.
TINJAUAN PUSTAKA
Botani Tanaman Temulawak
Tanaman temulawak (Curcumaxanthorrhiza Roxb.) termasuk ke dalam Divisi
Spermatophyta, Sub-divisi Angiospermae, Kelas Monocotyledonae, Ordo
Zingiber-ales, Famili Zingiberaceae, Genus Curcuma, Sub-genus Eucurcuma pada Seksi
Exantha yang menunjukkan bahwa tanaman ini menghasilkan bunga majemuk lateral.
Bibit spesies yang dipakai untuk pertelaan oleh Roxburgh pada tahun 1820 berasal
dari Maluku. Secara morfologi, tanaman ini merupakan yang terbesar di
go-longannya, baik itu dari penampakan tajuk (ukuran batang semu, daun dan bunga)
maupun bagian bawah tanah (rimpang) (Prana 2008; Djakamihardja et al. 1985).
Secara alami, tumbuhan ini banyak ditemukan di bawah tegakan hutan jati, di
padang alang-alang dan tanah kering lainnya (Djakamihardja et al. 1985). Wilayah
pengembangan temulawak di Indonesia pada tahun 2004 meliputi 15 provinsi dan
pada tahun 2005 meliputi 27 provinsi, sedangkan sentra produksi tingkat kabupaten
masih didominasi oleh DI Yogyakarta dan Jawa Tengah (Deptan 2006).
Temulawak merupakan tanaman terna tahunan yang tumbuh merumpun dengan
tinggi 1.5-2.0 m. Batang semu temulawak tersusun dari upih-upih daun berwarna
hijau atau coklat. Temulawak memiliki jumlah daun 2-9per batang, bentuk helai
daun jorong agak melonjong (oblong elliptic) dengan ukuran 31-84 cm dan lebar
10-18 cm. Bagian sisi kiri dan kanan ibu tulang daun temulawak biasanya ditutupi
se-macam pita memanjang berwarna merah keunguan (Prana 1985; Djakamihardja et al.
1985).
Bunga majemuk temulawak muncul langsung dari rimpang (exantha) dengan
panjang 9-23 cm dan lebar 4-6 cm. Bagian atas bunga majemuk terdiri atas
daun-daun pelindung yang membentuk kantung-kantung. Daun-daun-daun pelindung pada
ujung bunga mejemuk berwarna merah lembayung dan mandul (tidak ada bunga)
se-dangkan pada bagian yang lebih bawah terdapat 3-5 kuntum bunga berwarna kuning
Temulawak membentuk rimpang induk bulat panjang dengan anak rimpang 3-7
buah. Permukaan luar rimpang berkerut dan berwarna coklat kuning sampai coklat
sedangkan bidang irisannya berwarna coklat kuning buram, melengkung tidak
bera-turan, seringkali dengan tonjolan melingkar pada batas antara silinder pusat dengan
korteks (Djakamihardja et al. 1985).
(b) (a)
Gambar 1. Tanaman temulawak (a) dan bunga temulawak (b)
Umumnya tanaman temulawak tidak membentuk buah atau biji. Hal ini diduga
karena temulawak merupakan tanaman triploid dengan jumlah kromosom yang besar
2n = 3x = 63 sehingga menimbulkan banyak gangguan dalam proses meiosis.
Aki-batnya terlihat pada ukuran dan bentuk serbuk sari yang sangat beragam. Sebagian di
antaranya adalah serbuk sari abortif yang berdinding sangat tipis dan sangat mudah
pecah dengan kesuburan sangat rendah (0-2%). Hal tersebut menyebabkan
temula-wak berkembang biak secara vegetatif melalui pembentukan tunas yang tumbuh dari
Syarat Tumbuh Temulawak
Temulawak dapat tumbuh baik pada dataran rendah hingga 1 500 m di atas
permukaan laut (dpl) dengan curah hujan 1 500-4 000 mm/tahun atau di daerah
de-ngan tipe iklim A, B dan C menurut Schmidt-Ferguson. Tanaman temulawak dapat
mengalami pengeringan daun dan batang semu dengan cepat pada daerah tipe C
dise-babkan oleh musim hujan yang relatif pendek (Sudiarto & Affandi 1989; Wahid &
Sudiarto 1985). Produksi rimpang segar dan kadar pati temulawak pada dataran
ren-dah-sedang (240-450 m dpl) lebih tinggi daripada di dataran tinggi sedangkan kadar
minyak atsiri lebih banyak pada dataran tinggi (Wahid & Sudiarto 1985).
Toleransi suhu untuk pertumbuhan temulawak adalah 19-35 oC. Intensitas
ca-haya yang dibutuhkan adalah penuh-sedang dengan jenis tanah ringan agak berpasir
dan bahan organik cukup hingga tinggi (Sudiarto & Affandi 1989; Wahid & Sudiarto
1985).
Penanaman dilakukan pada awal musim hujan dengan kebutuhan bibit 2 ton/ha
jika menggunakan rimpang induk dan 0.5-0.7 ton/ha jika menggunakan rimpang
ca-bang. Penunasan dilakukan 1-2 minggu dan kemudian dilanjutkan dengan
penana-man menggunakan jarak tanam 50 x 50 cm, 50 x 60 cm atau 60 cm x 60 cm.
Pemupukan dilakukan menggunakan pupuk organik dan pupuk buatan. Pupuk
organik diberikan sebanyak 10-20 ton/ha. Pupuk buatan yang diberikan adalah urea
200 kg/ha, SP-36 100 kg/ha dan KCl 100 kg/ha untuk monokultur dan 200 kg/ha
un-tuk tumpangsari. Pupuk SP-36 dan KCl diberikan saat tanam sedangkan urea
diberi-kan tiga kali pada umur 1, 2 dan 3 bulan (Rahardjo & Rostiana 2005).
Pemanenan dilakukan pada saat tanaman berumur 10-12 bulan dengan cara
di-garpu. Pemanenan dapat pula dilakukan pada saat tanaman berumur 20-24 bulan.
Tanaman siap panen jika sudah memiliki daun dan tanaman yang menguning atau
mengering, memiliki rimpang besar dan berwarna kuning kecoklatan. Potensi
pro-duktivitas temulawak adalah 10-20 ton/ha (Warintek 2006; Rahardjo & Rostiana
Kandungan Zat Kimia Temulawak
Rimpang temulawak segar mengandung sekitar 75% air. Kandungan zat kimia
temulawak memberi arti bagi penggunannya sebagai sumber obat maupun bahan
pangan dan minuman (LP Unpad 1985). Secara garis besar kandungan temulawak
terbagi atas fraksi kurkuminoid, minyak atsiri dan pati.
Fraksi kurkuminoid terdiri dari curcumin (diferuloyl methane atau kurkumin I)
dan turunannya yaitu desmethoxy-curcumin (feruloyl-p-hydroxy-cinnamoyl methane
atau kurkumin II) dan bis-desmethoxy-curcumin (bis-(p-hydroxycinnamoyl)-methane
atau kurkumin III) (Wardini & Prakoso 1999). Kurkumin dapat digunakan untuk
pewarna makanan, minuman dan kosmetika.
Gambar 2. Struktur kimia kurkumin I (diferuloyl methane)
Berdasarkan manfaat medis, kurkumin berpotensi besar dalam aktivitas
farma-kologi yaitu sebagai anti inflamasi, anti imunodefisiensi, anti virus (virus flu burung),
anti bakteri, anti fungi, anti oksidan, anti karsinogenik, anti infeksi, anti kanker,
kar-diovaskular, stroke, reumatik, penurun kadar lipid darah dan meluruhkan plak pada
otak penderita penyakit Alzheimer (Kristina et al. 2007; Bermawie et al. 2006;
Chattopadhyay et al. 2004). Banyak hasil penelitian menunjukkan bahwa kurkumin
aman dan tidak toksik bila dikonsumsi oleh manusia. Jumlah kurkumin yang aman
dikonsumsi oleh manusia adalah 100 mg/hari (Commandeur & Vermeulen 1996).
Kandungan kurkuminoid temulawak adalah 1-2% (Sidik 2008). Kadar
kurkumin pada temulawak hasil kultur in vitro lebih tinggi daripada hasil penanaman
yang menghasilkan kadar kurkuminoid dan xanthorrhizol tertinggi adalah pada
tana-man berumur 9 bulan (Ghulamahdi et al. 2008).
Fraksi selanjutnya adalah minyak atsiri. Minyak atsiri terdiri dari senyawa
tu-runan sesquiterpenoid keton. Minyak atsiri dan kurkuminoid bekerja secara sinergis
dalam menghasilkan manfaat farmakologis. Minyak atsiri memiliki daya kolekinetik,
kolereik, koleretik serta anti bakteri yang baik (LP Unpad 1985).
Kandungan minyak atsiri pada temulawak adalah sekitar 3-12% (Sidik 2008).
Menurut Agusta dan Chairul (1996) komponen minyak atsiri pada temulawak terdiri
dari lima senyawa mayor dan delapan senyawa minor. Salah satu senyawa mayor
tersebut adalah xanthorrhizol. Xanthorrhizol memiliki fungsi sebagai obat anti fungi
spektrum luas, anti bakteri, anti metastasis sel tumor dan pencegah efek samping
ke-moterapi (Kim et al. 2008; Rukayadi et al. 2008; Rukayadi et al. 2006; Kim et al.
2005; Choi et al. 2004). Sebagai produk industri, ekstrak temulawak berpotensi
un-tuk perawatan gigi, jerawat dan ketombe (Hwang et al. 2008).
Fraksi pati merupakan komponen utama dengan kandungan yang relatif tinggi
sekitar 30-40% bobot kering. Pati temulawak dapat dikembangkan menjadi makanan
dan minuman (LP Unpad 1985).
Pemuliaan Temulawak
Pemuliaan tanaman rimpang-rimpangan belum dilakukan seintensif pemuliaan
untuk tanaman pangan. Komoditas rimpang-rimpangan yang telah dimuliakan di
In-donesia adalah jahe (Zingiber officinale), kunyit (Curcuma domestica), temulawak
dan kencur (Kaempferia angustifolia).
Karakterisasi pada temulawak telah dilakukan terhadap komponen pertumbuhan
vegetatif, komponen hasil, hasil dan kandungan bahan aktif. Balai Penelitian
Tana-man Obat dan Aromatika telah mempunyai 10 nomor harapan temulawak yang
memiliki potensi produksi 20-40 ton/ha, kadar minyak atsiri 6.2-10.6% dan kadar
kurkumin 2.0-3.3% (Rahardjo & Rostiana 2005). Setiyono dan Ajijah (2002) telah
melakukan karakterisasi sifat agronomis temulawak. Sifat yang diperoleh dari
jum-lah daun 6.6-8.7, panjang daun 55.1-101 cm, lebar daun 16.5-25.2 cm, diameter
batang 7.8-13.9 mm.
Penelitian lain yang telah dilakukan adalah pendugaan kriteria seleksi untuk
bobot basah rimpang temulawak/rumpun dan produksi minyak atsiri/rumpun. Seleksi
untuk bobot basah rimpang dapat dilakukan melalui karakter tinggi tanaman, jumlah
rimpang dan lebar rimpang (Ajijah et al. 2005). Devy et al. (2008) menyatakan
bahwa kriteria seleksi untuk produksi minyak atsiri/rumpun dapat dilakukan melalui
bobot kering rimpang, kadar minyak atsiri dan panjang daun.
Pengujian parameter genetik pada temulawak di Indonesia belum pernah
dila-porkan. Pengujian parameter genetik di India telah banyak dilakukan untuk genus
Curcuma terutama kunyit (Chaudhary et al. 2006; Rao et al. 2004; Singh et al. 2003;
Pathania et al. 1988).
Keragaman Genetik dan Heritabilitas
Keragaman genetik dalam suatu populasi yang akan diseleksi merupakan hal
yang harus diperhatikan dalam pemuliaan tanaman. Selain itu kemampuan
meng-identifikasikannya merupakan kunci keberhasilan dalam pemuliaan tanaman (Welsh
1981). Pembandingan keragaman antara dua atau lebih populasi dinyatakan dengan
koefisien keragaman genetik yang diperoleh dari nisbah antara akar kuadrat dari
ragam genetik dengan nilai tengah karakter yang diuji (Poehlman & Sleeper 1996).
Untuk menentukan kriteria keragaman genetik dapat dilakukan dengan
membanding-kan nilai ragam genetik dengan simpangan dari ragam genetiknya (Hallauer &
Miranda 1988).
Sifat yang terlihat pada suatu tanaman adalah fenotipe (P). Fenotipe
dikontri-busi oleh faktor genetik (G) dan lingkungan (E) dimana P = G + E. Ragam fenotipe
dalam suatu populasi digunakan untuk menseleksi sifat kuantitatif tanaman. Ragam
fenotipe (σ2P) terdiri dari ragam genetik (σ2G), ragam lingkungan (σ2E) dan interaksi
antara ragam genetik dan lingkungan (σ2GxE). Ragam genetik terdiri dari ragam
ge-netik dominan (σ2D), ragam genetik aditif (σ2A) dan ragam genetik epistasis (σ2I)
Ragam yang berperan dalam pewarisan sifat dari tetua kepada turunannya
adalah ragam genetik. Sejauh mana terjadinya pewarisan dapat diduga melalui
nis-bah antara ragam genotipe dengan ragam fenotipenya. Nisnis-bah ini disebut heritabilitas
(Roy 2000). Menurut Poehlman dan Sleeper (1996) kegunaan dasar dari nilai
herita-bilitas adalah untuk menentukan pengaruh faktor genetik penting yang dapat
diwaris-kan dari tetua pada turunannya, menentudiwaris-kan metode seleksi yang tepat untuk
mem-perbaiki suatu karakter dan memprediksi kemajuan genetik.
Heritabilitas dapat diduga dari komponen ragam atau regresi (Poehlman &
Sleeper 1996). Sedangkan dari jenisnya, heritabilitas terbagi menjadi heritabilitas arti
luas (broad sense) dan arti sempit (narrow sense). Kalkulasi heritabilitas arti luas
dilakukan dengan menghitung nisbah antara ragam genotipe dengan ragam fenotipe.
Kalkulasi heritabilitas arti sempit dilakukan dengan menghitung nisbah antara ragam
aditif dengan ragam fenotipe (Roy 2000).
Heritabilitas beberapa karakter penting seperti hasil panen, kualitas dan
be-berapa tipe ketahanan terhadap penyakit seringkali bernilai rendah. Hal ini sangat
disayangkan karena menunjukkan pengaruh lingkungan cukup besar sehingga
perolehan genetik (genetic gain) menjadi berkurang. Nilai heritabilitas yang rendah
tidak menjadi masalah selama terdapat keragaman genetik. Keragaman genetik
ma-sih mampu mendukung terjadinya kemajuan seleksi yang diharapkan (Welsh 1981).
Stabilitas Genetik
Stabilitas genotipe pada berbagai lingkungan didefinisikan sebagai tampilan
konsisten sebuah karakter dari sebuah genotipe pada berbagai lingkungan dan atau
waktu. Perhitungan interaksi genotipe dan lingkungan dengan menggunakan statistik
stabilitas perlu dilakukan untuk mengidentifikasi genotipe yang stabil (Fernandez
1991). Genotipe yang stabil menurut Eberhart dan Russell (1966), diacu dalam
Bea-ver dan Johnson (1980) adalah genotipe yang keragaan responnya di berbagai tingkat
produktivitas lingkungan berada pada nilai rata-rata dan regresinya memiliki
simpa-ngan minimum. Lin et al. (1986) menyatakan bahwa suatu genotipe dikatakan stabil
paralel dengan rata-rata respon dari semua genotipe dalam percobaan dan (3) residu
kuadrat tengah dari model regresi pada indeks lingkungan bernilai kecil.
Pengaruh lingkungan terhadap tampilan genotipe suatu tanaman membuat
se-leksi genotipe tidak mungkin dilakukan pada satu lingkungan (waktu maupun lokasi).
Hal ini mendasari dilakukannya salah satu tahap terakhir dari kegiatan pemuliaan
yaitu uji multilokasi, yang bertujuan untuk mengevaluasi nilai genetik dan stabilitas
dari masing-masing genotipe yang diuji (Robert 1997; Ortiz & Izquierdo 1994).
Klasifikasi genotipe cenderung beragam tergantung pada lingkungan tempat uji
multilokasi. Varietas yang spesifik lokasi atau yang beradaptasi tinggi dengan
ling-kungan tertentu harus memiliki interaksi yang sangat nyata dengan lingling-kungan.
Se-baliknya jika dikehendaki varietas yang stabil atau beradaptasi luas maka harus
dida-patkan genotipe yang tidak atau kurang berinteraksi dengan lingkungan (Satoto &
Suprohatno 1996). Umumnya genotipe dengan hasil yang konsisten pada berbagai
lingkungan lebih disukai daripada yang berproduksi tinggi pada lingkungan tertentu
(Ortiz & Izquierdo 1994).
Selain uji multilokasi, perlu juga dilakukan uji antar musim. Pengkajian
sta-bilitas hasil menggunakan nilai tengah genotipe sebagai kombinasi musim x lokasi
dapat dilakukan pada kondisi demikian (Robert 1997). Pengujian di beberapa lokasi
selama beberapa musim sangat penting untuk mengetahui daya adaptasi dan stabilitas
hasil suatu genotipe (Suwarso et al. 2004). Stabilitas hasil merupakan hal penting.
Jalan terbaik dalam memuliakan genotipe stabil yang beradaptasi luas adalah melalui
seleksi tanaman pada berbagai lingkungan tumbuh (Romagosa & Fox 1993; Ntare &
Aken’ova 1985).
Fisiologi Naungan
Cahaya merupakan faktor yang penting bagi proses fisiologis tanaman seperti
fotosintesis, respirasi, penutupan dan pembukaan stomata serta perkecambahan (Taiz
& Zeiger 1991). Tanaman tidak dapat tumbuh tanpa energi radiasi sehingga cahaya
dianggap sebagai faktor pembatas produksi dan penyebab perbedaan produksi antar
Menurut Monteith (1981) spektrum cahaya yang dibutuhkan tanaman berkisar
antara 400-700 nm yang biasa disebut photosynthetically active radiation (PAR).
Ra-diasi matahari mempengaruhi laju transpirasi secara tidak langsung yaitu melalui
pengaruhnya terhadap pembukaan stomata dan suhu udara. Radiasi yang tinggi akan
meningkatkan suhu udara. Suhu udara akan mempengaruhi laju transpirasi karena
besarnya penguapan dari permukaan sel. Transpirasi yang terlalu tinggi akan
meng-akibatkan kandungan air dalam sel berkurang secara drastis dan menurunkan proses
fotosintesis karena sirkulasi CO2 terhambat akibat menutupnya stomata (Baharsjah et
al. 1985).
Kondisi lingkungan bernaungan yang kurang optimum akan memicu tanaman
untuk melakukan adaptasi. Smith (1981) menyatakan bahwa respon tanaman yang
toleran dan peka terhadap naungan lebih merupakan strategi untuk bertahan hidup
daripada untuk meningkatkan produksi. Efek paling cepat dari naungan adalah
me-nyebabkan pengurangan kandungan karbohidrat yang diikuti oleh perubahan
metabo-lisme lain (Hale & Orcutt 1987).
Adaptasi tanaman terhadap naungan dapat terjadi melalui (1) peningkatan luas
daun sebagai cara untuk mengurangi penggunaan metabolit dan (2) mengurangi
jum-lah cahaya yang ditransmisikan dan direfleksikan (Hale & Orcutt 1987). Fitter &
Hay (1981) menambahkan bahwa respon tanaman terhadap cekaman naungan
meli-puti (1) pengurangan laju respirasi, (2) peningkatan luas daun untuk mendapatkan
permukaan absorbsi cahaya yang lebih luas dan (3) peningkatan efesiensi fotosintesis.
Adaptasi tanaman terhadap naungan dapat dicapai melalui mekanisme (1)
penghindaran (avoidance) yang berkaitan dengan perubahan anatomi dan morfologi
daun untuk efisiensi fotosintesis dan (b) toleransi (tolerance) yang berkaitan dengan
penurunan titik kompensasi cahaya serta efisiensi respirasi (Levitt 1980). Secara
le-bih jauh Smith (1981) menyatakan ada dua mekanisme adaptasi yang dilakukan
adalah melalui (1) penghindaran cahaya (shade avoidance) dengan cara memicu
per-tumbuhan lebih cepat pada batang dan tangkai daun, mengurangi percabangan atau
memicu dominansi apikal, mengurangi luas daun, mengurangi ketebalan daun,
terhadap cahaya (shade tolerance) dengan cara mengurangi kecepatan pertumbuhan,
meningkatkan luas daun, meningkatkan ketebalan daun, meningkatkan luas daun
spe-sifik akibat peningkatan luas daun, meningkatkan kandungan klorofil, meningkatkan
kompleksitas dan komponen fotosintesis.
Besarnya daya adaptasi tanaman terhadap naungan tidak terlepas dari
kemam-puan tanaman untuk mengubah sifat morfologis maupun fisiologis antara lain dengan
memperpanjang tanaman, memperluas permukaan daun dan memperbanyak klorofil.
Peningkatan naungan dapat meningkatkan panjang daun, tinggi tanaman, jumlah
daun, luas daun, kandungan klorofil dan ketebalan daun (Maftuh et al. 2005; Sukarjo
2004; Marjenah 2001; Bahmani et al. 2000). Peningkatan panjang daun disebabkan
oleh terpicunya kerja auksin pada kondisi ternaungi (Gardner et al. 1985).
Daun tanaman toleran naungan memiliki struktur sel-sel palisade yang kecil dan
ukurannya tidak jauh berbeda dengan sel-sel bunga karang sehingga daun lebih tipis.
Struktur tersebut akan lebih berongga menambah efisiensi penangkapan energi radiasi
cahaya untuk fotosintesis (Taiz & Zeiger 1991). Ukuran daun akan lebih tipis tapi
luas permukaannya lebih lebar (Hale & Orcutt 1987).
Rasio daun dan biomasa tajuk menurun dengan adanya naungan (Ephrath et al.
1993). Peningkatan naungan akan menghasilkan sistem perakaran yang lebih pendek
karena fotosintat yang dihasilkan banyak didistribusikan untuk perpanjangan batang
tanaman, perluasan daun dan pertumbuhan rimpang (Sukarjo 2004).
Peningkatan taraf naungan akan menurunkan jumlah anakan pada tanaman
te-mulawak (Maftuh et al. 2005), temu kunci (Randriani et al. 2001) dan ryegrass
(Bahmani et al. 2000). Penurunan jumlah anakan dapat menurunkan hasil panen.
Penurunan intensitas cahaya di bawah taraf jenuh untuk fotosintesis akan
me-ngurangi bobot kering panen (Bos & Neuteboom 1998). Penurunan hasil panen akibat
penurunan intensitas cahaya dilaporkan terjadi pada tanaman temulawak (Maftuh et
al. 2005), talas (Djukri & Purwoko 2003) dan jahe (Januwati & Muhammad 1988).
Hal ini terjadi akibat adanya penurunan kandungan karbohidrat terutama fruktosa dan
sukrosa akibat penurunan laju fotosintesis (Kephart et al. 1992). Tanaman
hingga taraf naungan 30% (Sukarjo 2004). Selain itu peningkatan naungan dapat
mengurangi kandungan triterpenoid pada pegagan (Rachmawaty 2005).
Penurunan intensitas cahaya akan menyebabkan warna daun menjadi lebih
hi-jau. Hal ini disebabkan oleh pengumpulan kloroplas pada dua sisi dinding sel
ter-dekat dan terjauh dari cahaya (Salisbury & Ross 1992). Peningkatan kloroplas
ber-banding lurus dengan peningkatan klorofil a dan b.
Peningkatan klorofil a dan b akan menyebabkan kemampuan penangkapan
energi radiasi cahaya lebih tinggi. Klorofil a dan b berperan dalam fotosintesis
tana-man. Klorofil b berfungsi sebagai antena fotosintetik yang mengumpulkan cahaya.
Peningkatan kandungan klorofil b pada kondisi ternaungi berkaitan dengan
pening-katan klorofil sehingga akan meningkatkan efisiensi fungsi antenna fotosintetik pada
Light Harvesting Complex II. Penyesuaian tanaman terhadap radiasi rendah dicirikan
dengan membesarnya antena untuk fotosistem II. Membesarnya antena untuk
foto-sistem II akan meningkatkan efisiensi pemanenan cahaya (Hidema et al. 1992).
Kandungan klorofil daun yang cenderung tinggi pada kondisi ternaungi tidak diiringi
dengan meningkatnya laju fotosintesis. Hal ini sering dihubungkan dengan tingginya
resistensi stomata dan rendahnya aktivitas Ribulose bifosfat (RuBP).
Djukri dan Purwoko (2003) melakukan percobaan perbedaan intensitas naungan
pada talas. Hasil percobaan menunjukkan bahwa kandungan nitrogen talas yang peka
terhadap naungan cenderung menurun. Penggunaan nitrogen pada klon toleran lebih
diarahkan pada sintesis klorofl a dan b sehingga kadar klorofil a dan b meningkat
le-bih banyak daripada klon peka. Penurunan kadar nitrogen daun tanaman akan
ber-pengaruh terhadap fotosintesis melalui penurunan kandungan klorofil maupun enzim
fotosintetik sehingga fotosintat yang terbentuk akan berkurang dan selanjutnya terjadi
penurunan bobot umbi.
Perubahan kandungan klorofil dan enzim fotosintetik akibat naungan tercermin
pada perubahan kandungan nitrogen daun, kandungan rubisco dan aktivitasnya.
Rubisco adalah enzim yang memegang peranan penting dalam fotosintesis yaitu
rubisco pada kondisi naungan akan berkurang (Makino et al. 1984), selain itu
BAHAN DAN METODE
Waktu dan Tempat
Percobaan ini dilaksanakan pada dua lokasi penanaman yaitu di Kebun
Perco-baan Puspiptek Serpong, Kabupaten Tangerang (70 m dpl) dan di Kawasan
Agromedika Hambaro Leuwiliang, Kabupaten Bogor (400 m dpl). Penanaman di
Serpong dilakukan selama tiga musim (tiga tahun), sedangkan di Hambaro sebanyak
satu musim (tahun ke-3). Penanaman musim ke-1 dilakukan pada bulan Oktober
2004-Juli 2005, musim ke-2 pada bulan November 2005-Agustus 2006 sedangkan
musim ke-3 pada bulan Desember 2006-Agustus 2007.
Bahan dan Alat
Bahan genetik yang digunakan adalah aksesi temulawak (Curcuma
xanthor-rhiza Roxb.) hasil eksplorasi tahun 2004 yang diambil dari beberapa daerah di
Indo-nesia. Aksesi yang digunakan diberi nama berdasarkan daerah asalnya. Aksesi-aksesi
tersebut adalah T1 (Pagar Alam-Sumatera Selatan), T3 (Manna-Bengkulu), T4
jenang-Jawa Tengah), T5 (Cikijing-Jawa Barat), T6 (Ciporang-Jawa Barat), T7
(Ma-jalengka-Jawa Barat), T8 (Citangtu-Jawa Barat), T9 (Sleman-Yogyakarta), T10
(Bantul-Yogyakarta), T11 (Gunung Kidul-Yogyakarta), T12 (Imogiri-Yogyakarta),
T13 (Kalibawang-Yogyakarta), T14 (Pasir Gaok 1-Jawa Barat) dan T16 (Pasir Gaok
3-Jawa Barat). Bahan penelitian yang digunakan adalah naungan berupa screen
house paranet 55%, kertas merang untuk persiapan pembibitan serta bahan untuk
penanaman yang terdiri dari pupuk kandang, Urea, SP-36, KCl dan dolomit. Alat
yang digunakan adalah polybag untuk pembibitan, timbangan, pisau, alat-alat
perta-nian, alat-alat tulis, jangka sorong, meteran, lightmeter, thermohigrometer,
om-brometer dan Munsell Color Chart for Plant Tissue.
Metode
Penelitian untuk menguji keragaman dan stabilitas genetik temulawak ini terdiri
la-han kering pada intensitas cahaya matahari penuh dan (2) Pengujian keragaman dan
stabilitas genetik antar intensitas cahaya matahari di lahan kering selama tiga musim.
Gambar 3 menunjukkan diagram alur percobaan.
Gambar 3. Diagram alur percobaan
Percobaan 1. Pengujian antar lokasi lahan kering di bawah intensitas cahaya
matahari penuh
Percobaan dilaksanakan menggunakan Rancangan Kelompok Lengkap Teracak
(Randomized Complete Block Design). Sebagai faktor pertama adalah lokasi
dan di Kawasan Agromedika Hambaro Leuwiliang Bogor. Sebagai faktor kedua
adalah aksesi temulawak yang terdiri dari 14 nomor yaitu T1, T3, T4, T5, T6, T7, T8,
T9, T10, T11, T12, T13, T14 dan T16. Percobaan dilakukan sebanyak tiga ulangan
sehingga secara keseluruhan terdapat 84 satuan percobaan. Setiap satu satuan
perco-baan terdiri dari 10 tanaman dan diambil 5 tanaman sebagai contoh sehingga secara
keseluruhan terdapat 420 tanaman yang diamati.
Model linear aditif dari rancangan ini adalah:
Yijr = µ + Lj + βr/j + Gi + (GL)ij + εijr
(i= 1,2,...,14; j= 1,2; r= 1,2,3)
Keterangan:
Yijk = Respon aksesi ke-i, lokasi ke-j dan ulangan ke-r
µ = Rataan umum
Lj = Pengaruh perlakuan lokasi ke-j
βr/j = Galat ulangan ke-r dalam lokasi ke-j
Gi = Pengaruh perlakuan aksesi ke-i
(GL)ij = Pengaruh interaksi antara lokasi ke-i dan aksesi ke-j
εijr = Galat percobaan pada lokasi ke-j, aksesi ke-i dan ulangan ke-r
Percobaan 2. Pengujian antar intensitas cahaya matahari di lahan kering selama
tiga musim
Percobaan dilaksanakan menggunakan Rancangan Kelompok Lengkap Teracak
(Randomized Complete Block Design). Sebagai faktor pertama adalah intensitas
ca-haya matahari yang terdiri dari dua taraf yaitu 100% (caca-haya matahari penuh) dan
45% (di bawah naungan paranet 55%). Sebagai faktor kedua adalah aksesi
temula-wak yang terdiri dari 14 nomor yaitu T1, T3, T4, T5, T6, T7, T8, T9, T10, T11, T12,
ta-raf yaitu musim tanam ke-1, ke-2 dan ke-3. Percobaan dilakukan sebanyak 3 ulangan
sehingga secara keseluruhan terdapat 252 satuan percobaan. Setiap 1 satuan
perco-baan terdiri dari 10 tanaman dan diambil 5 tanaman sebagai contoh sehingga terdapat
1 260 tanaman. Percobaan ini dilakukan selama 3 musim tanam sehingga secara
ke-seluruhan pengamatan dilakukan terhadap 3 780 tanaman.
Model linear aditif dari rancangan ini adalah:
Yijkl = µ + Sk + Lj + (SL)jk + βr/kj + Gi + (GS)ik + (GL)ij + (GSL)ijk + εijkr
(i= 1,2,...,14; j= 1,2; k= 1,2,3; r= 1,2,3)
Keterangan:
Yijkl = Respon naungan ke-j, aksesi ke-i, musim ke-k dan ulangan ke-r
µ = Rataan umum
Sk = Pengaruh perlakuan musim ke-k
Lj = Pengaruh perlakuan intensitas cahaya matahari ke-j
(SL)jk = Pengaruh interaksi antara musim ke-k dan intensitas cahaya matahari ke-j
βr/kj = Galat ulangan ke-r dalam musim ke-k dan intensitas cahaya matahari ke-j
Gi = Pengaruh perlakuan aksesi ke-i
(GS)ik = Pengaruh interaksi antara aksesi ke-i dan musim ke-k
(GL)ij = Pengaruh interaksi antara aksesi ke-i dan intensitas cahaya matahari ke-j
(GSL)ijk = Pengaruh interaksi antara aksesi ke-i, musim ke-k dan intensitas cahaya
matahari ke-j
εijkl = Galat percobaan pada intensitas cahaya matahari ke-j, aksesi ke-i, musim
ke-k dan ulangan ke-r
Pelaksanaan
Percobaan ini diawali dengan melakukan eksplorasi aksesi temulawak dari
be-berapa habitat. Eksplorasi ini berupa pengambilan contoh aksesi temulawak yang
ber-beda yang diduga merupakan ekotipe. Langkah selanjutnya adalah melakukan
ana-lisis keragaman dan stabilitas.
Analisis keragaman dan stabilitas dilakukan pada kondisi lingkungan tumbuh
yang berbeda sehingga terdapat dua pengujian yaitu: (1) evaluasi antar lokasi di lahan
kering pada intensitas cahaya matahari penuh dan (2) evaluasi antar intensitas cahaya
matahari di lahan kering selama tiga musim. Secara umum tahapan pelaksanaan
per-cobaan terdiri dari pembibitan, persiapan lahan, penanaman dan pemanenan.
Kegiatan pembibitan diawali dengan pembersihan rimpang pada air mengalir
yang kemudian dikeringanginkan. Rimpang tersebut lalu disemai pada keranjang
plastik yang dialasi dan ditutupi kertas merang basah dan dijaga kelembabannya di
atas rak dalam ruang penunasan. Setelah mata tunas muncul maka dilakukan
pemo-tongan rimpang berukuran 20-40 gram. Rimpang yang telah dipotong tersebut
dipin-dahkan ke polybag berukuran 20 cm x 10 cm untuk ditempatkan di screenhouse
pembibitan dengan naungan paranet 55%. Bibit ditanam di lapang setelah memiliki
tinggi tunas sekitar 5-10 cm.
Persiapan lahan dilaksanakan dengan mengolah tanah. Pengapuran dengan
dolomit dilakukan pada musim tanam pertama. Pemberian pupuk kandang dilakukan
sebanyak 1 kg/lubang tanam. Naungan paranet dibuat sebanyak 3 buah,
masing-masing berukuran 20 m x 8 m x 2.5 m. Petakan penelitian berupa guludan dibuat
dengan ukuran 7.2 m x 0.7 m.x 0.25 m. Jarak tanam yang digunakan adalah 70 cm
x 60 cm.
Penanaman dilaksanakan pada pagi hari dan bibit yang telah siap kemudian
di-tanam dan diberi mulsa alang-alang untuk mengurangi evapotranspirasi. Pemupukan
saat tanam dilakukan dengan 5 gram SP-36/tanaman + 4 gram KCl/tanaman
sedang-kan 5 gram Urea/tanaman diberisedang-kan pada 1 Bulan Setelah Tanam (BST). Kegiatan
pemeliharaan yang dilakukan meliputi pencabutan gulma dan pembumbunan.
Panen dilaksanakan pada saat tanaman berumur 9 BST dengan cara menggali
dan mengangkat rimpang secara keseluruhan. Rimpang tersebut dicuci dari tanah dan
pada Standard Operation Procedures (SOP) menurut Rahardjo dan Rostiana (2005)
dengan sedikit modifikasi.
Pengamatan
Komponen pengamatan yang digunakan mengacu pada deskriptor untuk
tana-man temulawak menurut Ajijah et al. (2006) dan tambahan lain.
Komponen-kompo-nen tersebut adalah:
Komponen Pertumbuhan
1. Batang semu
a. Tinggi batang semu. Pengamatan dilakukan sepuluh hari sekali sampai
pertumbuhan maksimum (4 BST). Tinggi batang semu diukur dari
permu-kaan tanah sampai ujung daun.
b. Diameter batang semu. Pengamatan dilakukan pada saat pertumbuhan
mak-simum (4 BST). Diameter batang semu diukur pada ketinggian 15 cm dari
permukaan tanah dengan menggunakan jangka sorong.
c. Jumlah anakan per rumpun. Pengamatan dilakukan sepuluh hari sekali sampai
pertumbuhan maksimum (4 BST).
d. Warna pangkal batang semu. Pengamatan dilakukan pada ketinggian 15 cm di
atas permukaan tanah menggunakan Munsell Color Chart for Plant Tissue.
Pengamatan dilakukan pada saat pertumbuhan maksimum (4 BST).
e. Bentuk batang semu. Pengamatan dilakukan terhadap bentuk batang semu
yaitu bulat, membulat atau pipih. Pengamatan dilakukan pada saat
pertumbu-han maksimum (4 BST).
f. Arah pertumbuhan. Pengamatan dilakukan terhadap arah pertumbuhan batang
semu yaitu erek, semi erek atau menyebar. Pengamatan dilakukan pada saat
2. Daun
a. Jumlah daun per batang. Pengamatan dilakukan sepuluh hari sekali sampai
pertumbuhan maksimum (4 BST). Jumlah daun yang dihitung adalah pada
batang utama.
b. Lebar daun. Pengamatan dilakukan sepuluh hari sekali sampai pertumbuhan
maksimum (4 BST). Pengukuran dilakukan pada daun terbesar, diukur dari
ujung kiri sampai ujung kanan daun pada bagian terlebarnya.
c. Panjang daun. Pengamatan dilakukan sepuluh hari sekali sampai pertumbuhan
maksimum (4 BST). Pengukuran dilakukan pada daun terbesar, diukur dari
pangkal sampai ujung daun.
d. Rasio panjang/lebar daun. Rasio dihitung berdasarkan hasil pengukuran
pan-jang dan lebar daun dengan rumus: Rasio = panpan-jang daun/lebar daun.
e. Panjang tangkai daun. Pengamatan dilakukan sepuluh hari sekali sampai
per-tumbuhan maksimum (4 BST). Pengukuran dilakukan pada daun terbesar,
diukur dari batang semu sampai pangkal daun.
f. Warna daun dan tangkai daun. Pengamatan warna daun dan tangkai daun
dila-kukan terhadap daun ke-3 dari atas pada pada saat pertumbuhan maksimum
dengan menggunakan Munsell Color Chart for Plant Tissue. Pengamatan
di-lakukan pada saat pertumbuhan maksimum (4 BST)
g. Pita ungu ibu tulang daun. Pengamatan pita ungu pada ibu tulang daun
dilakukan pada daun ke-3 dari atas yang terdiri dari sangat jelas jika > 75%
ibu tulang daun tetutup pita ungu, jelas jika antara 50% hingga 75% ibu tulang
daun tertutup pita ungu, kurang jelas jika 25% hingga 50% ibu tulang daun
tertutup pita ungu dan tidak jelas jika tidak terdapat pita ungu pada ibu tulang
daun. Pengamatan dilakukan pada saat pertumbuhan maksimum (4 BST).
h. Bentuk daun. Bentuk daun diamati pada daun ke-3 dari atas yaitu elips,
ob-long, oblong lanceolate. Pengamatan dilakukan pada saat pertumbuhan
i. Bentuk pangkal daun. Bentuk pangkal daun diamati pada daun ke-3 dari atas
yaitu runcing, meruncing. Pengamatan dilakukan pada saat pertumbuhan
maksimum (4 BST).
j. Bentuk ujung daun. Bentuk ujung daun diamati pada daun ke-3 dari atas yaitu
runcing, meruncing. Pengamatan dilakukan pada saat pertumbuhan
mak-simum (4 BST).
k. Bentuk pertulangan daun. Bentuk pertulangan daun diamati pada daun ke-3
dari atas yaitu menyirip, menjari. Pengamatan dilakukan pada saat
pertumbu-han maksimum (4 BST).
Komponen Produksi
1. Bunga
Pengamatan dilakukan pada saat bunga muncul, meliputi:
a. Warna, bentuk dan ukuran kelopak pelindung (bractea).
b. Warna, bentuk dan ukuran kelopak.
c. Warna, bentuk dan ukuran mahkota.
d. Ukuran tandan bunga.
e. Waktu munculnya bunga.
f. Jumlah bunga per rumpun.
2. Rimpang
Pengamatan rimpang dilakukan pada saat panen yaitu 9 BST, meliputi:
a. Bobot basah gabungan rimpang, akar dan ubi akar; rimpang total; akar;
rim-pang primer; rimrim-pang sekunder; rimrim-pang tersier dan ubi akar. Pengamatan
dilakukan dengan menimbang bahan segar.
b. Bobot kering rimpang total, rimpang primer, rimpang sekunder dan rimpang
tersier. Pengamatan dilakukan setelah dioven selama 48 jam dengan suhu 40
o
C.
c. Panjang rimpang primer, rimpang sekunder, rimpang tersier, ruas rimpang
d. Lebar rimpang primer, rimpang sekunder dan rimpang tersier.
e. Jumlah rimpang primer, rimpang sekunder, rimpang tersier, ruas rimpang
primer, ruas rimpang sekunder, ruas rimpang tersier, ubi akar, mata tunas
rim-pang primer dan mata tunas rimrim-pang sekunder.
f. Bentuk rimpang induk. Pengamatan dilakukan terhadap bentuk rimpang
in-duk yaitu oval, jorong, kerucut atau lainnya.
g. Bentuk rimpang sekunder. Pengamatan dilakukan terhadap bentuk rimpang
sekunder yaitu bulat, pipih atau lainnya.
h. Warna daging rimpang, kulit rimpang dan mata tunas. Pengamatan dilakukan
menggunakan Munsell Color Chart for Plant Tissue.
i. Tekstur permukaan. Pengamatan dilakukan terhadap rimpang primer yaitu
ha-lus atau kasar.
Komponen Kandungan Bahan Aktif
Komponen bahan aktif yang diamati adalah kadar kurkumin, kadar minyak
at-siri, produksi kurkumin/rumpun dan produksi minyak atsiri/rumpun. Produksi bahan
aktif dihitung melalui perkalian antara kadar bahan aktif dan bobot kering
rim-pang/rumpun. Analisis kandungan bahan aktif ini dilakukan di Balai Penelitian
Tanaman Obat dan Aromatika, Departemen Pertanian RI, Bogor. Kadar kurkumin
diukur menggunakan metode GC-MS sedangkan kadar minyak atsiri dengan destilasi
menggunakan protokol dari SNI.
Komponen Lingkungan
Komponen pengamatan lingkungan terdiri dari cuaca dan tanah. Karakter
yang diamati adalah:
1. Curah hujan (mm/hari). Pengamatan dilakukan setiap hari mulai saat tanam
hingga panen pada dua lokasi penanaman dengan menggunakan ombrometer.
2. Suhu (oC). Pengamatan dilakukan setiap hari mulai saat tanam hingga panen
3. RH (%). Pengamatan dilakukan setiap hari mulai saat tanam hingga panen
pada pukul 08.00 WIB, 13.30 WIB dan 17.00 WIB.
4. Intensitas cahaya (lux). Pengamatan dilakukan sebanyak tiga hari
berturut-tu-rut pada intensitas cahaya matahari 100% di Hambaro dan Serpong serta pada
intensitas cahaya matahari 45% di Serpong. Pengamatan dilakukan pukul
08.00 WIB, 13.30 WIB dan 17.00 WIB.
5. Tanah. Pengamatan kondisi tanah dilakukan terhadap terhadap 5 contoh yaitu
masing-masing ulangan pada lokasi Hambaro, komposit dari 3 ulangan pada
kondisi ternaungi dan komposit dari 3 ulangan pada kondisi tak ternaungi
pada lokasi Serpong. Peubah yang diamati terdiri dari tekstur tanah; pH;
kandungan hara: C, N, P-tersedia, K-tersedia; Kapasitas Tukar Kation (KTK);
Kejenuhan Basa (KB); kation dapat ditukar (K, Na, Ca, Mg-dd), kemasaman
dapat ditukar (Al dan H-dd). Analisis tanah ini dilakukan di Balai Penelitian
Tanah, Departemen Pertanian RI, Bogor.
Analisis Data
1. Analisis korelasi antar sifat dan sidik lintas
Analisis sidik lintas dilakukan terhadap karakter vegetatif sebagai peubah bebas
dan bobot basah rimpang/rumpun sebagai peubah tak bebas. Hubungan keeratan
antara peubah X (karakter vegetatif) dan Y (bobot basah rimpang/rumpun)
dihi-tung dengan korelasi Pearson sebagai berikut:
rxy =
kemudian analisis dilanjutkan dengan sidik lintas berdasarkan persamaan sebagai
⎥
Rx = matriks korelasi antar peubah bebas ; Rx-1 = invers matriks Rx; C = vektor koefisien
lintasan yang menunjukkan pengaruh langsung setiap peubah bebas terhadap peubah tak
bebas; Ry = vektor koefisien korelasi antara peubah bebas Xi (i = 1, 2, …, p) dengan
peubah tak bebas Y.
2. Analisis ragam dan pendugaan parameter genetik
Pengujian analisis ragam dan parameter genetik dilakukan pada kedua percobaan.
Parameter yang diamati meliputi:
a. Heritabilitas dalam arti luas (h2bs)
Pendugaan heritabilitas dilakukan dengan metode komponen ragam (Osborne &
Paterson 1952, diacu dalam Adie 1992). Pendugaan komponen ragam genetik,
ragam interaksi genotipe dengan lingkungan, ragam galat dan ragam fenotipe
untuk percobaan antar lahan kering pada intensitas cahaya matahari penuh di
Serpong dan Hambaro dilakukan berdasarkan pada nilai harapan kuadrat tengah
analisis ragam Tabel 1. Karakter yang diperbolehkan untuk dianalisis
meng-gunakan model tersebut adalah yang memiliki ragam homogen antar lokasi
(Gomez & Gomez 1984) berdasarkan uji Bartlett (uji homogenitas ragam).
heritabilitas
= (Osborne & Paterson 1952, diacu dalam
Adie 1992).
Tabel 1. Analisis ragam percobaan antar lokasi di Hambaro dan Serpong
Sumber
Keterangan: l=jumlah lokasi; r=jumlah ulangan; g=jumlah aksesi
Tabel 2 merupakan model yang digunakan pada pengujian antar intensitas
ca-haya matahari selama tiga musim di Serpong. Karakter yang diperbolehkan
untuk dianalisis menggunakan model ini adalah yang memiliki ragam homogen
antara musim dan intensitas cahya matahari.
Ragam interaksi aksesi x musim x intensitas cahaya matahari (σ2 gyl) =
r M
M4− 5
, ragam interaksi antara aksesi x intensitas cahaya matahari (σ2gl) =
Tabel 2. Analisis ragam percobaan dua intensitas cahaya matahari selama tiga
Keterangan: s = jumlah musim tanam; r= jumlah ulangan; l= jumlah intensitas cahaya matahari; g=
jumlah aksesi; ***= perhitungan menggunakan quasi nisbah F.
Perhitungan quasi nisbah F:
F p,q =
dimana Mi=kuadrat tengah dari sumber keragaman ke-i, maka derajat bebas
efek-tif:
dimana fi= derajat bebas sumber keragaman ke-i (Satterthwaite 1946).
Selain itu pada pengujian antar intensitas cahaya matahari selama tiga musim
dila-kukan juga pendugaan parameter genetik terhadap masing-masing musim
perco-baan. Analisis hanya dilakukan terhadap karakter yang memiliki ragam homogen
antar intensitas cahaya matahari. Tabel 3 merupakan model yang digunakan