PENGARUH SALINITAS TERHADAP KADAR GLUKOSA DARAH DAN LAJU METABOLISME PADA PENDEDERAN IKAN KAKAP PUTIH (Lates calcalifer, Bloch)
KADEK RENNI NATALIA
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul pengaruh salinitas terhadap kadar glukosa darah dan laju metabolisme pada pendederan ikan kakap putih (Lates calcalifer, Bloch) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2013
Kadek Renni Natalia
ABSTRAK
KADEK RENNI NATALIA. Pengaruh Salinitas terhadap Kadar Glukosa Darah dan Laju Metabolisme pada Pendederan Ikan Kakap Putih (Lates calcalifer,
Bloch). Dibimbing oleh IRZAL EFFENDI dan YUNI PUJI HASTUTI.
Peningkatan produksi ikan kakap putih (Lates calcalifer) dapat dilakukan dengan memperluas lahan budi daya, antara lain dengan memanfaatkan perairan payau termasuk tambak menganggur. Oleh sebab itu, penelitian salinitas pada ikan kakap putih perlu dilakukan. Penelitian ini bertujuan untuk mengetahui kemampuan adaptasi ikan kakap putih pada salinitas rendah dengan cara mengukur kadar glukosa darah, laju metabolisme, sintasan, pertumbuhan serta rasio konversi pakan pada pendederan ikan kakap putih ukuran 4,88 cm. Perlakuan pada penelitian ini terdiri dari salinitas 4, 18 dan 32 g/L dan diulang 3 kali. Pengukuran kadar glukosa darah dilakukan pada hari ke-0, 5 dan 10 pemeliharaan dengan menggunakan alat uji glukosa untuk manusia (GlucoDr). Pengukuran laju metabolism ikan kakap putih dilakukan setiap 10 hari sekali, secara tidak langsung dengan menentukan tingkat konsumsi oksigen. Hasil penelitian ini menunjukan bahwa kadar glukosa darah, laju metabolisme, sintasan, pertumbuhan serta rasio konversi pakan pada ikan kakap putih yang dideder dengan salinitas 4, 18 dan 32 g/L adalah sama, meskipun kadar glukosa pada salinitas 18 g/L relatif lebih tinggi (p<0,05) pada hari ke-10 pemeliharaan. Hal ini membuktikan bahwa ikan kakap putih dapat beradaptasi dengan baik pada salinitas rendah, dan berpeluang dibudidayakan dalam tambak air tawar.
Kata kunci: Lates calcalifer, salinitas, glukosa, metabolisme
ABSTRACT
KADEK RENNI NATALIA. Effect of Salinity on Blood Glucose Level and Metabolism Rate of Barramundi (Lates calcalifer, Bloch) in Nursery System. Supervised by IRZAL EFFENDI and YUNI PUJI HASTUTI.
The increase production of barramundi (Lates calcalifer) can be increased extensively by using brackishwater and idlle pond. Therefore, the study about salinity in this fish must be done. The study aim is to know the adaptation of barramundi of 4.88 cm on low salinity by measuring blood glucose level, metabolic rate, survival rate, growth and feed conversion ratio in nursery system. The treatment in this study consists of salinity 4, 18 and 32 g/L. Blood glucose level was measured at 0, 5th and 10th days by using a glucose test kit for human beings. The metabolic rate was measured every ten days, indirectly by measturing the total of oxygen of barramundi. The results showed that blood glucose level, metabolic rate, survival rate, growth and feed conversion ratio were not affected by rearing media salinity of barramundi, althought blood glucose level in salinity of 18 g/L higher (p<0.05) in 10th days of rearing. This study showed that Barramundi have good adaptation on low salinity, and can be cultured in fresh water pond.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Budidaya Perairan
KADEK RENNI NATALIA
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
2013
Judul Skripsi : Pengaruh Salinitas terhadap Kadar Glukosa Darah dan Laju Metabolisme pada Pendederan Ikan Kakap Putih (Lates calcalifer,
Bloch)
Nama : Kadek Renni Natalia
NIM : C14090011
Disetujui oleh
Ir Irzal Effendi M.Si Pembimbing I
Yuni Puji Hastuti S.Pi, M.Si Pembimbing II
Diketahui oleh
Dr Ir Sukenda, M.Sc Ketua Departemen
PRAKATA
Puji syukur kehadirat Tuhan Yang Maha Esa atas segala rahmat dan karuniaNya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Pengaruh Salinitas terhadap Kadar Glukosa Darah dan Laju Metabolisme pada Pendederan Ikan Kakap Putih (Lates calcalifer, Bloch)”. Penelitian ini dilaksanakan pada April sampai dengan Juni 2013 di Laboratorium Pemeliharaan Juwana Kuda Laut dan Laboratorium Penguji Kualitas Air, Balai Besar Pengembangan Budidaya Laut Lampung.
Dalam kesempatan kali ini, penulis mengucapkan terima kasih kepada:
1. Bapak Ir Irzal Effendi M.Si dan Ibu Yuni Puji Hastuti S.Pi., M.Si. selaku Dosen Pembimbing dan Ibu Maya Meiyana, SP., M.Si. selaku Pembimbing Lapang di Balai Besar Pengembangan Budidaya Laut Lampung yang telah membimbing dengan baik selama penelitian dan penyusunan skripsi.
2. Bapak Dr Ir Sukenda, M.Sc. Ketua Departemen Budi Daya Perairan Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor yang telah banyak memberikan masukan, semangat dan motivasi.
3. Dr Tatag Budiardi selaku Pembimbing Akademik yang senantiasa membimbing selama perkuliahan.
4. Bapak Ir Badrudin M.Si selaku Kepala Balai Besar Pengembangan Budidaya Laut Lampung yang telah memberikan izin Penulis untuk melakukan penelitian di instansi ini.
5. Keluarga tercinta terutama ayah, ibu, kakak, adik serta keluarga besar yang telah banyak memberikan semangat dan doa kepada Penulis.
6. Keluarga besar kontrakan Tilotama (T2) dan Putu Angga Kristyawan yang selalu meberikan motivasi dan doa.
7. Teman seperjuangan Yeyen Hardayani atas kerjasama dan partisipasinya selama kegiatan penelitian berlangsung. Teman-teman BDP 46 (Dayu, Via, Riska dan Anindilla) terima kasih atas dukungannya selama ini.
Penulis berharap laporan ini dapat memberikan banyak manfaat kepada pembaca.
Bogor, Juli 2013
DAFTAR ISI
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 2
METODE ... 2
Persiapan wadah ... 2
Pemeliharaan Ikan ... 3
Pengukuran Glukosa ... 3
Pengukuran Laju Konsumsi Oksigen ... 4
Sintasan ... 4
Laju Pertumbuhan Spesifik ... 5
Pertumbuhan Panjang Mutlak ... 5
Konversi Pakan ... 5
Fisika Kimia Air ... 6
Rancangan Percobaan ... 6
Analisis Data ... 6
HASIL DAN PEMBAHASAN ... 7
Hasil ... 7
Pembahasan ... 11
SIMPULAN DAN SARAN ... 14
Simpulan ... 14
Saran ... 14
DAFTAR PUSTAKA ... 14
LAMPIRAN ... 16
DAFTAR TABEL
1. Hasil pengukuran fisika-kimia air pada media pemeliharaan benih ikan kakap putih ... 11
DAFTAR GAMBAR
1. Kadar glukosa darah benih ikan kakap putih (Lates calcalifer) selama pemeliharaan pada salinitas 4, 18 dan 32 g/L. ... 7 2. Laju konsumsi oksigen benih ikan kakap putih (Lates calcalifer) selama
pemeliharaan pada salinitas 4, 18 dan 32 g/L. ... 7 3. Sintasan (survival rate, SR) benih ikan kakap putih (Lates calcalifer)
selama pemeliharaan pada salinitas 4, 18 dan 32 g/L. ... 8 4. Laju pertumbuhan spesifik (specific growth rate, SGR) benih ikan kakap
putih (Lates calcalifer) selama pemeliharaan pada salinitas 4, 18 dan 32 g/L. ... 8 5. Pertambahan bobot benih ikan kakap putih (Lates calcalifer) selama
pemeliharaan pada salinitas 4, 18 dan 32 g/L ... 9 6. Pertumbuhan panjang mutlak benih ikan kakap putih (Lates calcalifer)
selama pemeliharaan pada salinitas 4, 18 dan 32 g/L. ... 9 7. Pertambahan panjang benih ikan kakap putih (Lates calcalifer) selama
pemeliharaan pada salinitas 4, 18 dan 32 g/L ... 10 8. Rasio konversi pakan benih ikan kakap putih (Lates calcalifer) selama
pemeliharaan pada salinitas 4, 18 dan 32 g/L. ... 10
DAFTAR LAMPIRAN
1. Pertumbuhan ikan kakap putih (Lates calcalifer) selama pemeliharaan pada media salinitas 4, 18 dan 32 g/L. ... 16 2. Laju Konsumsi O2 benih ikan kakap putih (Lates calcalifer) selama
pemeliharaan pada media salinitas 4,18 dan 32 g/L ... 17 3. Kadar glukosa (mg/dL) benih ikan kakap putih (Lates calcalifer) selama
pemeliharaan pada media salinitas 4,18 dan 32 g/L ... 18 4. Laju konsumsi oksigen (mg O2/g jam) benih ikan kakap putih (Lates
calcalifer) selama pemeliharaan pada media salinitas 4,18 dan 32 g/L ... 18 5. Sintasan (survival rate, SR), laju pertumbuhan harian (LPH),
pertumbuhan panjang mutlak (PPM) dan rasio konversi pakan (feed convertion ratio, FCR) benih ikan kakap putih (Lates calcalifer) selama pemeliharaan pada media salinitas 4, 18 dan 32 g/L. ... 18 6. Hasil Uji ANOVA selama pemeliharaan benih kakap putih (Lates
1
PENDAHULUAN
Latar Belakang
Potensi sumber daya perairan Indonesia untuk budi daya laut cukup besar, namun tingkat pemanfaatannya masih sangat rendah. Salah satu komoditas perikanan yang menjadi andalan dalam budi daya laut adalah ikan kakap putih (Lates calcalifer). Ikan ini bernilai ekonomis penting dan prospektif untuk diusahakan. Pasar kakap putih cukup besar, mulai dari pasar tradisional, rumah makan, restoran, hotel, pasar swalayan, sampai ekspor ke Singapura, Perancis dan Amerika Serikat. Ikan ini dapat hidup di berbagai habitat pesisir dan teluk. Dagingnya yang tebal dan putih, serta sedikit tulang membuat ikan ini banyak disukai oleh konsumen, namun produksinya masih sangat rendah. Kakap putih diproduksi dari penangkapan di alam dan budi daya. Menurut FAO (2012), produksi spesies ikan kakap putih di dunia dari kegiatan budi daya tahun 2010 hanya mencapai 0,1 juta ton. Secara nasional produksi ikan kakap melalui usaha budidaya pada tahun ini (2013) diperkirakan mencapai 7.500 ton dan target produksi pada 2014 sebesar 8.500 ton. Angka ini sangat kecil jika dibandingkan dengan komoditas unggulan lainnya (KKP 2011b).
Menurut KKP (2011a), pada 2011 potensi lahan budi daya tambak
(brackishwater pond) seluas 2.963.717 ha, namun tingkat pemanfaatannya 23% saja. Melihat potensi lahan tambak di Indonesia masih cukup luas, maka peningkatkan produksi ikan kakap putih dapat dilakukan dengan memperluas areal budi daya, antara lain dengan memanfaatkan potensi tambak dan tambak produktif yang tidak terpakai. Informasi mengenai pengaruh salinitas yang cukup rendah terhadap kondisi fisiologis, sintasan, pertumbuhan serta rasio konversi pakan pada ikan kakap putih menjadi dibutuhkan, dalam rangka pemanfaatan lahan tambak untuk pendederan ikan ini.
Salinitas merupakan salah satu variabel lingkungan yang cukup berperan dalam mendukung keberhasilan pendederan ikan kakap putih. Ikan ini bersifat
euryhaline sehingga dapat dipelihara di air payau dan laut namun agar tumbuh optimal salinitas perlu dipertahankan pada kisaran tetap. Menurut SNI (1999) salinitas yang digunakan dalam kegiatan pendederan kakap putih umur D60 berukuran 3-4 cm adalah 28-35 g/L. Hingga saat ini pengaturan salinitas dalam kegiatan pendederan belum memiliki standar, karena belum diketahui salinitas optimum untuk benih ikan kakap putih. Kondisi salinitas yang tidak sesuai dapat mempengaruhi kehidupan ikan, baik terhadap proses fisiologis maupun tingkah lakunya, resisten ataupun kematian. Dalam rangka menyesuaikan diri dengan salinitas hewan memiliki toleransi dan resistensi pada kisaran tertentu (Affandi dan Tang 2002).
2
pertumbuhan. Pada hewan berdarah panas laju metabolisme dapat diukur berdasarkan jumlah panas yang dihasilkan, namun pada hewan berdarah dingin metode tersebut sulit untuk dilakukan. Metode yang umum digunakan untuk mengukur laju metabolisme ini adalah mengukur jumlah konsumsi oksigen. Tingkat metabolisme dinyatakan dalam panas yang dihasilkan atau oksigen yang dikonsumsi per unit berat dan per unit waktu. Konsumsi oksigen adalah indikator respirasi yang juga menunjukkan metabolisme energetik (Affandi dan Tang 2002). Dari penelitian yang pernah dilakukan oleh Nugroho (1999) laju konsumsi oksigen optimum ikan kakap putih ukuran 1,4 cm adalah pada salinitas 26 g/L dengan nilai 0,09 mg O2/g jam.
Oleh sebab itu diperlukan penelitian untuk pemeliharaan ikan kakap putih pada berbagai tingkat salinitas. Sehingga diketahui apakah ikan kakap putih yang dipelihara pada salinitas yang lebih rendah daripada air laut menunjukkan sintasan dan pertumbuhan yang lebih baik, dengan mengamati kadar glukosa darah dan laju metabolisme pada ikan. Hal ini merupakan langkah awal untuk mengetahui potensi dari ikan kakap putih dalam rangka deversifikasi spesies budi daya air payau.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui kemampuan adaptasi ikan kakap putih yang dipelihara pada salinitas 4, 18 dan 32 g/L, dengan cara mengukur kadar glukosa darah, laju metabolisme, sintasan, pertumbuhan serta rasio konversi pakan pada pendederan ikan kakap putih ukuran 4,88 cm.
BAHAN DAN METODE
Persiapan Wadah
Akuarium yang berukuran 40x40x40 cm dengan volume 64 liter sebanyak 12 unit digunakan sebagai wadah pemeliharaan kakap putih. Akuarium tandon berukuran 40x40x65 cm dengan volume 104 liter sebanyak 4 unit digunakan sebagai wadah stok air salinitas yang ditentukan. Sebelum digunakan akuarium dibilas dengan air tawar lalu disikat hingga bersih, kemudian dikeringkan selama satu hari. Akuarium diisi dengan air bersalinitas 4,18 dan 32 g/L. Untuk mendapatkan air media bersalinitas tersebut maka dilakukan pengenceran yang berpedoman pada formula berikut:
S2 =
Keterangan: S2 = tingkat salinitas yang dikehendaki (g/L)
S1 = Tingkat salinitas air laut yang akan diencerkan (g/L) a = Volume air laut yang diencerkan (L)
n = Volume air tawar yang perlu ditambahkan (L)
3 (digunakan sacara bergantian). Saluran aerasi ke bak pemeliharaan menggunakan pipa berukuran 2,5 inchi disambung dengan pipa berukuran 2 inchi yang bercabang dan didistribusikan ke unit-unit pemeliharaan, kemudian melalui pipa ¾ inchi diteruskan ke wadah pemeliharaan. Selang aerasi dipasang pada pipa-pipa blower tersebut, pada bagian ujung selang bawah dipasang batu aerasi dan pada ujung selang bagian atas dipasang kran aerasi untuk mengatur besarnya aerasi yang digunakan. Satu akuarium pemeliharaan menggunakan 2 selang aerasi agar kebutuhan oksigen tercukupi dengan baik.
Pemeliharaan Ikan
Penebaran ikan uji dilakukan pada pagi hari dengan suhu air berkisar 28-29oC agar ikan tidak stres. Ikan yang akan ditebar diseleksi terlebih dahulu untuk mendapatkan ukuran ikan yang diinginkan, lalu ditampung sementara di akuarium tandon sebelum dipindahkan di akuarium. Ikan kakap putih yang digunakan berukuran 4,88±0,084cm dengan berat berkisar antara 2,07±0,063 g/ekor. Benih dihasilkan dari induk yang berasal dari hasil tangkapan di alam dan hasil pemeliharaan di KJA. Pemijahan induk dilakukan secara alami dengan menggunakan manipulasi lingkungan, dalam satu bak induk jumlah jantan 10 ekor dan betina 15 ekor.
Padat penebaran yang digunakan adalah 800 ekor/m3, jumlah ikan yang ditebar per akuarium adalah 30 ekor. Jadi total benih yang ditebar dalam 9 akuarium adalah 270 ekor, sedangkan untuk stok disiapkan 3 buah akuarium dengan perlakuan yang sama. Benih ikan kakap yang awalnya dipelihara pada salinitas 32 g/L diberi stressor (penurunan salinitas) mendadak. Untuk mendapatkan salinitas pemeliharaan 4 g/L dilakukan dengan mengurangi volume air awal sebanyak 87,5%, kemudian dilakukan penambahan air tawar (0 g/L) sebanyak 87,5% selama kurang lebih 10 menit. Salinitas pemeliharaan 18 g/L didapatkan dengan pengurangan volume air awal dan penambahan air tawar (0 g/L) sebanyak 44% selama kurang lebih 5 menit. Debit yang digunakan adalah 0,05 liter/sekon.
Pakan merk NRD G12 berbentuk pelet dengan kandungan protein 47,49% dan lemak 10,44% (bobot kering) digunakan sebagai pakan ikan kakap putih. Pemberian pakan dilakukan secara ad satiation (sekenyangnya) sebanyak 3 kali sehari, yaitu pada pagi hari (08.00), siang hari (13.00), dan sore hari (16.30). Air pemeliharaan ikan diganti sebanyak 60% setiap pagi dan sore hari agar air tetap bersih dan suhu air tetap stabil. Penelitian ini dilakukan selama 40 hari dari ukuran benih kakap putih 4,88 cm sampai ukuran 8,00 cm.
Pengukuran Glukosa
4
sampel ikan untuk setiap perlakuan. Total sampel ikan yang digunakan adalah sebanyak 9 ekor.
Pengujian glukosa dilakukan pada pagi hari sebelum ikan diberikan pakan. Pengambilan ikan sampel dilakukan secara perlahan, saat ikan diangkat dari air ikan ditutup menggunakan kain basah di bagian kepala dan tubuh ikan, lalu dengan cepat memotong bagian ekor ikan dan mengambil darahnya agar ikan tidak stress. Darah yang digunakan sebanyak 4 microliter diteteskan ke strip yang telah dipasang pada alat. Alat akan segera membaca kadar glukosa darah pada ikan dan ditampilkan di layar. Ikan yang digunakan untuk pengukuran glukosa adalah ikan stok yang sengaja disiapkan dengan padat tebar dan kondisi yang sama seperti perlakuan. Pengecekan glukosa darah dapat dilakukan dengan menggunakan alat uji glukosa untuk manusia (Philipson et al 2010). Alat uji glukosa yang digunakan adalah merk GlucoDr dengan range 20-600 mg/dL. Prinsip pengujian alat ini adalah menggunakan aliran listrik elektrik yang disebabkan reaksi glukosa dengan reagen pada elektroda di strip. Sampel darah akan tergambar dalam reaksi strip melalui aktivitas kapiler.
Pengukuran Laju Konsumsi Oksigen
Laju metabolisme pada ikan dapat diukur secara tidak langsung dengan menentukan jumlah oksigen yang digunakan dalam proses oksidasi untuk memperoleh energi. Pengukuran laju konsumsi oksigen dilakukan dengan sistem tertutup dalam air diam (Nugroho 1999). ikan dimasukkan dalam wadah bervolume satu liter berbentuk tabung. Sampel ikan yang akan diukur tingkat konsumsi oksigennya diambil dengan menggunakan seser. Dalam satu wadah ukur dimasukkan satu ekor ikan, untuk mengetahui laju konsumsi oksigen per ekornya. Jumlah sampel ikan yang diuji adalah 3 ekor untuk setiap perlakuan. Air dalam wadah diaerasi terlebih dahulu hingga jenuh oksigen, lalu diukur dengan DO meter dengan cara mencelupkan probe DO meter ke dalam air sampai probe terendam dan ditetapkan sebagai oksigen awal. Ikan dimasukkan ke dalam wadah ukur lalu diambil satu jam kemudian. Selanjutnya oksigen media diukur kembali dan ditetapkan sebagai oksigen akhir. Ikan yang digunakan tadi tidak lupa ditimbang bobotnya menggunakan timbangan digital dengan ketelitian alat 0,01 g. Tingkat konsumsi oksigen dapat dihitung menggunakan rumus Watanabe et al
(2008):
dO2/dt =
Keterangan: dO2/dt = Laju konsumsi oksigen (mgO2/g jam)
DOg = Kandungan oksigen terlarut pada awal percobaan (mg/L) DOy = Kandungan oksigen terlarut pada akhir percobaan (mg/L) V = Volume air (L)
g = Bobot ikan (g)
t = Lama pengamatan (jam)
Sintasan
5
kemudian dibagi dengan jumlah ikan awal yang ditebar di masing-masing akuarium. Ikan yang mati saat masa pemeliharaan dihitung dan ditimbang menggunakan timbangan digital dengan ketelitian alat 0,01 g. Berikut ini merupakan rumus perhitungan tingkat kelangsungan hidup ikan menurut Effendie (2002):
SR =
Keterangan : SR = Tingkat kelangsungan hidup (%) Nt = Jumlah ikan akhir (ekor)
No = Jumlah ikan awal (ekor)
Laju Pertumbuhan Harian
Pengukuran bobot tubuh ikan dilakukan dengan cara sampling hari ke-0, hari ke-10 hari ke-20, hari ke-30, dan hari ke-40 (akhir pemeliharaan). Ikan yang akan diukur diambil dengan serok kemudian ditimbang menggunakan timbangan digital dengan ketelitian alat 0,01 g. Jumlah ikan yang disampling adalah 10 ekor per akuarium.
Laju pertumbuhan harian merupakan persentase dari pertambahan berat ikan setiap harinya selama masa pemeliharaan. Laju pertumbuhan spesifik dapat dihitung dengan menggunakan rumus sebagai berikut (Huisman 1987):
[ √
]
Keterangan : LPH = Laju pertumbuhan harian (%)
Wt = Bobot rata-rata ikan pada waktu t (g)
Wo = Bobot rata-rata ikan pada awal percobaan (g) t = Lama percobaan (hari)
Pertumbuhan Panjang Mutlak
Pengukuran panjang tubuh ikan dilakukan dengan cara sampling sebelum perlakuan, hari ke-10, 20, 30, dan 40 (akhir pemeliharaan). Ikan diambil dengan serok kemudian diukur dengan penggaris (cm) dari bagian ujung kepala sampai ujung ekor. Jumlah ikan yang disampling adalah 10 ekor per akuarium. Pertumbuhan panjang mutlak dapat diketahui dengan menngunakan rumus sebagai berikut (Effendie 2002):
PPM = Lt – L0
Keterangan : PPM = Pertumbuhan panjang mutlak (cm) Lt = Panjang rata-rata ikan pada waktu t (cm)
6
Konversi Pakan
Jumlah pakan yang diberikan pada ikan selama pemeliharaan didapatkan dengan cara menimbang pakan yang akan diberikan dengan timbangan digital. Jumlah pakan awal dikurangi jumlah pakan akhir merupakan jumlah pakan yang diberikan kepada ikan selama pemeliharaan. Konversi pakan merupakan perbandingan jumlah pakan yang diberikan dengan pertambahan biomasa ikan, konversi pakan dapat dihitung dengan menggunakan rumus sebagai berikut (Zonneveld et al 1991): Bm = Biomassa ikan yang mati (Kg)
Fisika-Kimia Air
Fisika-kimiaair meliputi pengukuran suhu, salinitas, pH, amoniak (NH3), nitrit (NO2) dan oksigen terlarut (dissolve oxygen). Pengukuran suhu dilakukan pada pagi dan sore hari dengan cara mencelupkan termometer ke dalam masing-masing akuarium lalu dicatat suhunya. Pengukuran salinitas dilakukan berdekatan dengan waktu pemberian pakan menggunakan refraktometer, hal ini bertujuan memantau salinitas tetap sesuai dengan perlakuan. Pengukuran oksigen terlarut dilakukan sekali selama masa pemeliharaan yaitu pada pagi hari dengan menggunakan alat DO meter, probe di celupkan ke dalam akuarium, angka pada layar dicatat. Pengukuran pH, amoniak (NH3), dan Nitrit (NO2) dilakukan setiap sampling yaitu 10 hari sekali. Sampel air diambil dengan menggunakan botol sampel bervolume 330 ml pada pagi hari sebelum pergantian air. Pengukuran pH menggunakan alat pH meter, probe pH meter dicelupkan ke dalam botol sampel kemudian angka pada layar dicatat. Prosedur pengukuran nitrit (NO2) dan amoniak (NH3) dapat dilihat pada lampiran 8 dan 9.
Rancangan Percobaan
Penelitian ini menggunakan rancangan percobaan berupa Rancangan Acak Lengkap (RAL) dengan 3 perlakuan dan 3 kali ulangan. Perlakuan yang digunakan yaitu pemeliharaan ikan kakap putih pada salinitas 4, 18 dan 32 g/L.
Analisis Data
Data yang diperoleh diolah dengan menggunakan Microsoft Excel 2010, kemudian dilakukan uji lanjut Duncan dengan menggunakan program komputer
7
HASIL DAN PEMBAHASAN
Hasil
Kadar Glukosa Darah
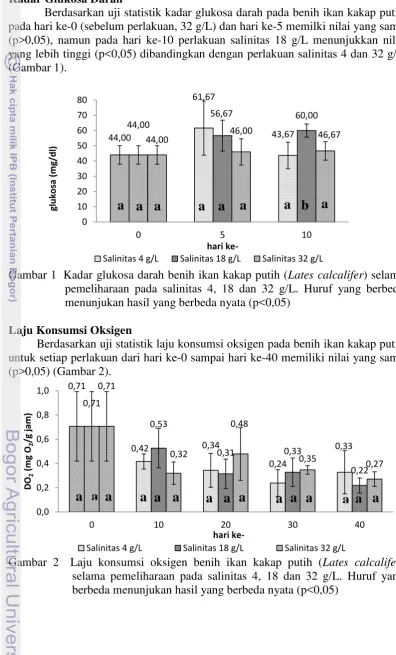
Berdasarkan uji statistik kadar glukosa darah pada benih ikan kakap putih pada hari ke-0 (sebelum perlakuan, 32 g/L) dan hari ke-5 memilki nilai yang sama (p>0,05), namun pada hari ke-10 perlakuan salinitas 18 g/L menunjukkan nilai yang lebih tinggi (p<0,05) dibandingkan dengan perlakuan salinitas 4 dan 32 g/L (Gambar 1).
Gambar 1 Kadar glukosa darah benih ikan kakap putih (Lates calcalifer) selama pemeliharaan pada salinitas 4, 18 dan 32 g/L. Huruf yang berbeda menunjukan hasil yang berbeda nyata (p<0,05)
Laju Konsumsi Oksigen
Berdasarkan uji statistik laju konsumsi oksigen pada benih ikan kakap putih untuk setiap perlakuan dari hari ke-0 sampai hari ke-40 memiliki nilai yang sama (p>0,05) (Gambar 2).
Gambar 2 Laju konsumsi oksigen benih ikan kakap putih (Lates calcalifer) selama pemeliharaan pada salinitas 4, 18 dan 32 g/L. Huruf yang berbeda menunjukan hasil yang berbeda nyata (p<0,05)
44,00
Salinitas 4 g/L Salinitas 18 g/L Salinitas 32 g/L
a a a
a
a
a
a b a
Salinitas 4 g/L Salinitas 18 g/L Salinitas 32 g/L
8
Sintasan
Sintasan atau tingkat kelangsungan hidup benih ikan kakap putih dapat diamati pada akhir pemeliharaan. Berdasarkan uji statistik setiap perlakuan memiliki nilai sintasan yang sama (p>0,05) (Gambar 3).
Gambar 3 Sintasan (survival rate, SR) benih ikan kakap putih (Lates calcalifer) selama pemeliharaan pada salinitas 4, 18 dan 32 g/L. Huruf yang berbeda menunjukan hasil yang berbeda nyata (p<0,05)
Laju Pertumbuhan Harian
Berdasarkan uji statistik setiap perlakuan memiliki nilai laju pertumbuhan harian (LPH) yang sama (p>0,05) (Gambar 4).
Gambar 4 Laju pertumbuhan harian (LPH) benih ikan kakap putih (Lates calcalifer) selama pemeliharaan pada salinitas 4, 18 dan 32 g/L. Huruf yang berbeda menunjukan hasil yang berbeda nyata (p<0,05)
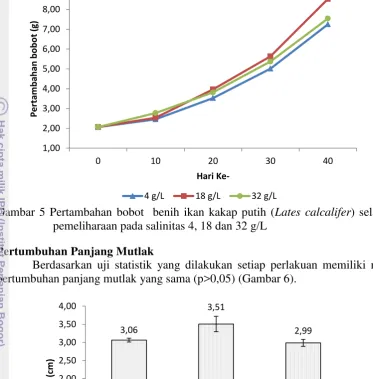
Peningkatan bobot dari hari ke-0 sampai hari ke-10 tertinggi adalah pada perlakuan salinitas 32 g/L dan terendah adalah pada perlakuan salinitas 4 g/L, namun pada hari ke-20 sampai akhir pemeliharaan peningkatan bobot tertinggi adalah pada perlakuan 18 g/L dan terendah pada perlakuan 4 g/L (Gambar 5).
9
Gambar 5 Pertambahan bobot benih ikan kakap putih (Lates calcalifer) selama pemeliharaan pada salinitas 4, 18 dan 32 g/L
Pertumbuhan Panjang Mutlak
Berdasarkan uji statistik yang dilakukan setiap perlakuan memiliki nilai pertumbuhan panjang mutlak yang sama (p>0,05) (Gambar 6).
Gambar 6 Pertumbuhan panjang mutlak benih ikan kakap putih (Lates calcalifer) selama pemeliharaan pada salinitas 4, 18 dan 32 g/L. Huruf yang berbeda menunjukan hasil yang berbeda nyata (p<0,05)
Peningkatan panjang benih ikan kakap dari hari ke-0 sampai hari ke-40 tertinggi adalah pada perlakuan salinitas 18 g/L, sedangkan pada hari ke-0 sampai hari ke-30 terendah adalah pada perlakuan salinitas 4 g/L, namun mengalami peningkatan pada hari ke-40 dibandingkan perlakuan salinitas 32 g/L (Gambar 7).
10
Gambar 7 Pertambahan panjang benih ikan kakap putih (Lates calcalifer) selama pemeliharaan pada salinitas 4, 18 dan 32 g/L
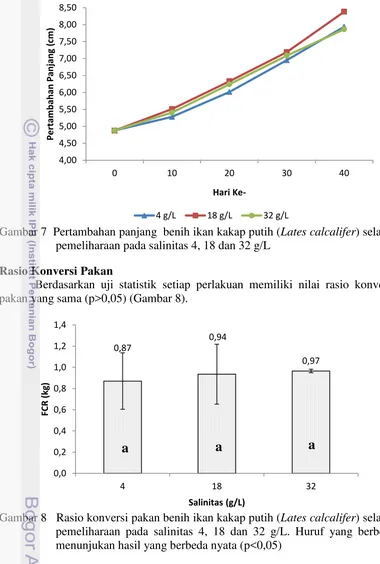
Rasio Konversi Pakan
Berdasarkan uji statistik setiap perlakuan memiliki nilai rasio konversi pakan yang sama (p>0,05) (Gambar 8).
Gambar 8 Rasio konversi pakan benih ikan kakap putih (Lates calcalifer) selama pemeliharaan pada salinitas 4, 18 dan 32 g/L. Huruf yang berbeda menunjukan hasil yang berbeda nyata (p<0,05)
Fisika-Kimia Air
Parameter kualitas air yang diukur setiap hari adalah suhu, sedangkan pH, NH3, dan NO2 diukur setiap 10 hari sekali, serta DO diukur satu kali selama pemeliharaan. Nilai kualitas air benih ikan kakap putih selama pemeliharaan sesuai dengan SNI 01-6147-1999 kecuali pada NH3. Nilai NH3 rata-rata lebih besar dari 0,01 mg/l untuk semua perlakuan (Tabel 1).
11
Tabel 1 Hasil pengukuran fisika-kimia air pada media pemeliharaan benih ikan kakap putih
Suatu biota apabila diletakkan dalam lingkungan yang tidak sesuai maka diperlukan adaptasi atau penyesuaian diri secara bertahap terhadap lingkungan yang baru. Ketika keadaan lingkungan pada kisaran yang tidak diinginkan dapat menyebabkan ikan stres, tekanan atau cekaman eksternal yang dapat menyebabkan ikan stres disebut dengan stresor. Tekanan eksternal pada ikan dapat disebabkan oleh lingkungan budidaya seperti oksigen terlarut, salinitas, suhu, metabolit toksik dan lain sebagainya. Penurunan salinitas di perairan secara mendadak dari salinitas awal 32 g/L menjadi salinitas 18 dan 4 g/L dapat menjadi salah satu stressor bagi ikan kakap putih.
Secara fisiologis indikator stres pada ikan terdiri dari indikator primer, sekunder dan tersier. Indikator stres sekunder dan tersier muncul sebagai akibat dari adanya indikator primer (Barton et al 2002). Ketika ikan mengalami stres maka organ reseptor menerima informasi penyebab faktor stres tersebut yang selanjutnya disampaikan ke otak bagian hipothalamus melalui system saraf. Hipothalamus memerintahkan sel kromafin untuk mensekresikan katekolamin melalui serabut saraf simpatik. Adanya katekolamin (indikator stres primer) ini akan mengaktivasi enzim-enzim yang terlibat dalam katabolisme simpanan glikogen, sehingga kadar glukosa darah (indikator stres sekunder) mengalami peningkatan (Sahetapy 2011). Porchase et al (2009) menyatakan bahwa respon stres ikan dapat dilihat dari peningkatan glukosa.
Berdasarkan Gambar 1, dari uji statistik kadar glukosa darah pada benih ikan kakap putih yang diberi stresor untuk setiap perlakuan saat hari ke-5 memiliki nilai yang sama (p>0,05). Hal ini diduga karena setiap biota memiliki kemampuan yang berbeda dalam mentolerir variabel lingkungannya dimana erat kaitannya dengan faktor genetik dari ikan (Affandi dan Tang 2002). Meningkatnya kadar glukosa darah untuk semua perlakuan dari hari ke-0 (sebelum perlakuan) hingga hari ke-5 disebabkan oleh lingkungan yang tidak sesuai sehingga ikan stres, pada saat ikan stres kadar glukosa terus meningkat yang diperlukan untuk mengatasi homeostasis. Homeostasis merupakan keadaan stabil yang dipertahankan melalui proses aktif yang melawan perubahan (Affandi dan Tang 2002).
12
g/L sudah bisa beradaptasi dengan baik pada hari ke-10 yang ditandai dengan penurunan glukosa, sedangkan pada salinitas 32 g/L kadar glukosa cendrung stabil dari hari ke hari. Hal ini disebabkan karena salinitas 32 g/L merupakan salinitas yang digunakan sebelum perlakuan sehingga ikan tidak perlu lagi beradaptasi dengan lingkungannya. Ikan rainbow trout (Oncorhynchus mykiss) yang mengalami stres memiliki kadar glukosa darah yang tinggi dibandingkan dengan yang tidak stress (Kubulay dan Uluk 2002).
Stres yang berlangsung secara terus menerus dengan besaran stresor yang lebih dahsyat mengakibatkan batas toleransi aklimatisasi fisologis ikan terlewati dan terjadilah penyakit, perubahan perilaku, pertumbuhan menurun dan bahkan kematian. Menurut Affandi dan Tang (2002) ikan mempunyai tekanan osmotik yang berbeda dengan lingkungannya, maka untuk mencegah kelebihan air ataupun kekurangan air sehingga proses-proses fisiologi di dalam tubuhnya dapat berlangsung dengan normal diperlukan pengaturan yang disebut dengan osmoregulasi. Perubahan yang terjadi pada proses osmoregulasi menyebabkan peningkatan kebutuhan energi ikan untuk beradaptasi dengan perubahan lingkungan dan mengurangi alokasi energi untuk pertumbuhan (Halver dan Hardy 2002). Pertumbuhan merupakan pertambahan ukuran panjang atau berat dalam suatu waktu.
Berdasarkan uji statistik laju pertumbuhan harian (LPH), serta pertumbuhan panjang mutlak (PPM) pada semua perlakuan memiliki nilai yang sama (p>0,05). Hal ini diduga karena kisaran salinitas 4-32 g/L masih dalam batas toleransi ikan kakap putih sehingga tidak diperlukan energi yang banyak untuk beradaptasi, namun dapat digunakan untuk pertumbuhan. Selain itu dapat dilihat dari rasio konversi pakan (feed convertion ratio, FCR) pada setiap perlakuan memiliki nilai yang sama (p>0,05), dimana pakan yang diberikan dapat dimanfaatkan secara optimal untuk pertumbuhan. Fungsi pakan secara umum adalah sebagai sumber energi dan materi pembangun tubuh. Materi pembangun tubuh adalah protein, sedangkan sumber energi berasal dari lemak dan karbohidrat. Kecernaan serta penyerapan pakan melalui usus akan lebih efisien bila media eksternal sedikit hipotonik di bawah rentang isoosmotik organisme akuatik euryhaline (Nugroho 1999).
Rasio konversi pakan untuk semua perlakuan kurang dari 1 artinya untuk menghasilkan 1 kg daging dibutuhkan pakan kurang dari 1 kg. Hal ini disebabkan karena adanya pakan lain yang tumbuh di perairan tersebut misalnya saja pakan alami atau bahan organik yang ada di peraiaran tersebut. Selain itu penentuan konversi pakan didasarkan pada perbandingan pakan buatan dalam bobot kering dan daging ikan dalam bobot basah, hal ini sesuai dengan pernyataan Effendi (2002).
13
memaksa air kembali ke lingkungannya, dengan demikian transformasi energi yang digunakan untuk proses pertumbuhan berkurang (Fitriawati 1997).
Menurut Ath-thar dan Gustiano (2010) salinitas yang terlalu tinggi dapat mempengaruhi pertumbuhan akibat efek salinitas yang mempengaruhi metabolisme terhadap perubahan fungsi pada sel klorid epitel insang. Pengaruh tersebut menyerap energi yang seharusnya untuk pertumbuhan dan digunakan sebagai sumber energi pada perubahan proses metabolisme.
Tingkat konsumsi oksigen adalah banyaknya oksigen yang dikonsumsi oleh biota akuatik dalam waktu tertentu yang berhubungan linear dengan banyaknya oksigen terlarut di perairan tersebut. Tingkat konsumsi oksigen menunjukkan tingkat metabolisme, metabolisme merupakan proses-proses perubahan kimia (transportasi materi dan energi) yang berlangsung secara kontinyu di dalam sel makhluk hidup. Berdasarkan Gambar 2 dari uji statistik laju konsumsi oksigen pada benih ikan kakap putih untuk setiap perlakuan pada hari ke-10, sampai hari ke-40 sama (p>0,05). Dari hasil penelitian ini berarti bahwa salinitas tidak berpengaruh terhadap perubahan tingkat metabolisme benih ikan kakap putih. Selain itu juga jumlah oksigen terlarut (dissolve oxygen) pada semua perlakuan masih dalam kisaran yang normal dan layak untuk budi daya.
Hal ini diduga karena tingkat konsumsi oksigen bukan hanya dipengaruhi oleh salinitas, menurut Affandi dan Tang (2002) faktor-faktor yang mempengaruhi tingkat konsumsi oksigen salah satunya adalah suhu. Suhu pada wadah pemeliharaan berkisar antara 28-32,5oC, fluktuasi suhu pada saat pemeliharaan masih dapat ditolerir oleh benih ikan kakap putih sehingga tidak terjadi perbedaan tingkat konsumsi oksigen pada masing-masing perlakuan. Peningkatan suhu diikuti dengan peningkatan laju metabolisme, hal ini berarti dapat meningkatkan konsumsi oksigen di perairan padahal pada suhu yang tinggi akan mengurangi daya larut oksigen dalam air. Menurut SNI (1999), pada benih ikan kakap putih suhu yang optimal untuk budidaya adalah berkisar antara 28-32oC. Namun menurut Taqwa (2008) peningkatan atau penurunan salinitas dapat mempengaruhi laju metabolisme yaitu memicu pergerakan pernapasan, tingkat konsumsi oksigen yang tinggi dan ekskresi yang tinggi pada ikan. Pada penelitian yang dilakukan Nugroho (1999) laju konsumsi oksigen optimum ikan kakap putih ukuran 1,4 cm adalah pada salinitas 26 ppt dengan nilai 0,09 mg O2/g jam.
Selain berdampak terhadap pertumbuhan ikan, stres pada ikan juga berdampak buruk terhadap ketahanan penyakit dan sintasan. Berdasarkan Gambar 3, dari uji statistik hasil sintasan pada setiap perlakuan memiliki nilai yang sama
(p˃0,05). Hal ini menunjukkan bahwa pemeliharaan ikan kakap putih dapat
14
salinitas yang terlalu tinggi kematian ikan disebabkan karena kadar garam lingkungan lebih tinggi daripada kadar garam yang dapat ditolerir oleh benih ikan kakap putih.
Tingginya kadar amoniak (NH3) akan menyebabkan timbulnya keracunan pada ikan, dimana saat amoniak di air lebih tinggi daripada amoniak pada darah merupakan stressor selain penurunan salinitas yang cukup tinggi (Zonneveld et al 1991). Tingginya amoniak (NH3) disebabkan oleh sisa pakan dan kotoran biota yang terakumulasi di dalam peraiaran. Pakan merupakan sumber bahan organik yang bila mengalami dekomposisi (terutama protein) akan menjadi amonia. Berdasarkan penelitian (Arrokhman 2012) benih ikan bawal bintang ukuran 3,5 cm yang dipelihara selama 30 hari pada salinitas 4 g/L memilki nilai sintasan 100%, sedangkan yang dipelihara pada salinitas 24 g/L dan 14 g/L memilki nilai sintasan 99%.
SIMPULAN DAN SARAN
Simpulan
Hasil penelitian ini menunjukan bahwa kadar glukosa darah, laju metabolisme, sintasan, pertumbuhan serta rasio konversi pakan pada pendederan ikan kakap putih ukuran 4,88cm yang dipelihara pada salinitas 4, 18 dan 32 g/L adalah sama (p>0,05), meskipun kadar glukosa pada salinitas 18 g/L relatif lebih tinggi (p<0,05) pada hari ke-10 pemeliharaan. Hal ini membuktikan bahwa ikan kakap putih dapat beradaptasi dengan baik pada salinitas rendah, sehingga diharapkan mampu dipelihara di tambak dengan kadar salinitas yang rendah sekalipun.
Saran
Pendederan ikan kakap putih dapat diterapkan langsung di tambak-tambak dengan kisaran salinitas 4-32 g/L. Kajian lebih lanjut perlu dilakukan untuk mengetahui salinitas yang sesuai bagi ikan kakap putih dengan rentang salinitas yang lebih tinggi dan menggunakan sistem flow trough.
DAFTAR PUSTAKA
Affandi R, Tang UM. 2002. Fisiologi Hewan Air. Pekanbaru (ID): UNRI Pers. Ath-thar MHF, Gustiano R. 2010. Performa Ikan Nila Best dalam Media Salinitas.
Prosiding Forum Inovasi Teknologi Akuakultur. 493-499.
Arrokhman S, Abdulgani N, Hidayati D. 2012. Survival Rate Ikan Bawal Bintang (Trachinotus blochii) dalam Media Pemeliharaan Menggunakan Rekayasa Salinitas. Jurnal Sains dan Seni ITS. Vol 1.
15
Effendi I. 2009. Pengantar Akuakultur. Jakarta (ID): Penebar Swadaya.
Effendie M.I. 2002. Biologi Perikanan. Yogyakarta (ID): Yayasan Pustaka Nusantara.
FAO. 2012. The State of World Fisheries and Aquaculture. Rome: Food and Agriculture Organization of the United Nations.
Fitriawati DN. 1997. Pengaruh Perbedaan Salinitas terhadap Pertumbuhan dan Mortalitas Larva Ikan Kakap Merah (Lutjanus argentimaculatus, Forsskal) Umur 1-5 hari [Skripsi]. Lampung (ID): Universitas Lampung. Halver JE, Hardy RW. 2002. Fish Nutrition. Third Edition. Academic Press,
Inc.University of Washington. Seattle. Washington.
Huisman EA. 1987. The principles of fish culture production. Netherland: Departement of Aquaculture, Wageningen University.
[KKP] Kementerian Kelautan Perikanan. 2011a. Kelautan dan Perikanan dalam Angka. Jakarta (ID): Kementerian Kelauatan dan Perikanan.
[KKP] Kementerian Kelautan Perikanan. 2011b. Produksi rumput laut lampaui target [internet]. [diacu 2012 Mei 18]. Tersedia dari: http://www.kkp.go.id/index.php/ archives/ c/34/3934/ produksi-rumputlaut-lampaui-target/.
Kubulay A, Uluk G. 2002. The Effects of Acute Stress on Rainbow Trout (Oncorhynchus mykiss). Turk J. Zool., 26: 249-254.
Nugroho A. 1999. Pengaruh Salinitas terhadap Tingkat Kerja Osmotik, Konsumsi Pakan, Pertumbuhan dan Efisiensi Pakan Juwana Ikan Kakap Putih
(Lates calcalifer) [Tesis]. Bogor (ID): Institut Pertanian Bogor.
Philipson HL, Stefani CE, Victoria EP, Mary DK 2010. Blood Sugar Measurement in Zebrafish Reveals Dynamics of Glucose Homeostasis.
Zebrafish. 7: 2.
Porchase MM, Luis R, Martines C, Ramos R. 2009. Cortisol and Glucose Reliable indicator of Fish. American Journal of Aquatic Sciences.Vol. 4.No. 2, 157-178p.
Sahetapy JMF. 2011. Toksisitas Logam Berat Timbal (Pb) dan Pengaruhnya pada Konsumsi Oksigen dan Respon Hematologi Juvenil Ikan Kerapu Macan (Ephinephelus fuscoguttatus) [Tesis]. Bogor (ID): Institut Pertanian Bogor.
SNI (Standar Nasional Indonesia). 1999. Produksi Benih Ikan Kakap Putih (Lates calcalifer, Bloch) Kelas Benih Sebar. Badan Standarisasi Nasional. Studer A, Poulin R. 2012. Effects of salinity on an intertidal host-parasite system:
Is the parasite more sensitive than its host?. Journal of Experimental Marine Biology and Ecology. 412:110-116.
Taqwa FU. 2008. Pengaruh penambahan kalium pada masa adaptasi penurunan salinitas dan waktu penggantian pakan alami oleh pakan buatan terhadap performa pascalarva udang vaname (Litopenaeus vannamei ) [Tesis]. Bogor (ID): Institut Pertanian Bogor.
Watanabe S, Ahmad F, Segawa S, Yokata M. 2008. Effect of Light on Oxygen Consumption and Ammonia Excretion in Haliotis discus discus, H. gigantea, H. madaka and their Hybrids. Aquaculture. 279:160-165. Zonneveld N, Huisman EA, Boon JH. 1991. Prinsip-Prinsip Budidaya Ikan.
16
LAMPIRAN
Lampiran 1 Pertumbuhan ikan kakap putih (Lates calcalifer) selama pemeliharaan pada media salinitas 4, 18 dan 32 g/L.
17
Lampiran 2 Laju Konsumsi O2 benihikan kakap putih (Lates calcalifer) selama pemeliharaan pada media salinitas 4,18 dan 32 g/L
18
Keterangan: A1: Perlakuan Salinitas 32 g/L ulangan 1 A2: Perlakuan Salinitas 32 g/L ulangan 2 A3: Perlakuan Salinitas 32 g/L ulangan 3 B1 : Perlakuan Salinitas 18 g/L ulangan 1 B2 : Perlakuan Salinitas 18 g/L ulangan 2 B3 : Perlakuan Salinitas 18 g/L ulangan 3 C1 : Perlakuan Salinitas 4 g/L ulangan 1 C2 : Perlakuan Salinitas 4 g/L ulangan 2 C3 : Perlakuan Salinitas 4 g/L ulangan 3
Lampiran 3 Kadar glukosa (mg/dL) benih ikan kakap putih (Lates calcalifer)
selama pemeliharaan pada media salinitas 4,18 dan 32 g/L
perlakuan hari ke-0 hari ke-5 hari ke-10 hari ke-40
32 g/L 44,00±6,08 46,00±8,66 46,67±6,11 61,33±16,80
18 g/L 44,00±6,08 56,67±10,21 60,00±4,36 58,33±3,79
4 g/L 44,00±6,08 61,67±17,79 43,67±8,74 86,33±17,89
Lampiran 4 Laju konsumsi oksigen (mg O2/g jam) benih ikan kakap putih (Lates
calcalifer) selama pemeliharaan pada media salinitas 4,18 dan 32
selama pemeliharaan pada media salinitas 4, 18 dan 32 g/L.
Perlakuan SR(%) FCR LPH (%) PPM (cm)
32 g/L 85,56±3,85 0,97±0,017 3,29±0,202 2,99±0,095
18 g/L 77,78±19,53 0,94±0,282 3,61±0,792 3,51±0,214
19
Lampiran 6 Hasil Uji ANOVA selama pemeliharaan benih kakap putih (Lates calcalifer) selama pemeliharaan pada media salinitas 4,18 dan 32 g/L
ANOVA
Sum of Squares df Mean Square F Sig.
SR Between Groups 541.015 2 270.507 2.047 .210
Within Groups 792.719 6 132.120
Total 1333.733 8
FCR Between Groups .015 2 .007 .145 .868
Within Groups .303 6 .050
Total .318 8
SGR Between Groups .217 2 .109 .396 .689
Within Groups 1.643 6 .274
Total 1.860 8
PPM Between Groups .473 2 .236 .771 .503
Within Groups 1.840 6 .307
Total 2.313 8
GLK0 Between Groups .000 2 .000 .000 1.000
Within Groups 222.000 6 37.000
Total 222.000 8
GLK5 Between Groups 384.222 2 192.111 1.163 .374
Within Groups 991.333 6 165.222
Total 1375.556 8
GLK10 Between Groups 453.556 2 226.778 5.128 .050
Within Groups 265.333 6 44.222
Total 718.889 8
LM0 Between Groups .000 2 .000 .000 1.000
Within Groups .493 6 .082
Total .493 8
LM10 Between Groups .064 2 .032 2.515 .161
Within Groups .077 6 .013
Total .141 8
LM20 Between Groups .047 2 .024 .875 .464
20
Total .210 8
LM30 Between Groups .019 2 .010 1.085 .396
Within Groups .053 6 .009
Total .073 8
LM40 Between Groups .017 2 .009 .667 .547
Within Groups .077 6 .013
Total .094 8
Lampiran 7 Hasil uji lanjut duncan selama pemeliharaan benih kakap putih (Lates calcalifer) selama pemeliharaan pada media salinitas 4,18 dan 32 g/L
GLK10
Duncana
perlakua
n N
Subset for alpha = 0.05
1 2
4ppt 3 43.6667
32ppt 3 46.6667
18 ppt 3 60.0000
Sig. .601 1.000
Means for groups in homogeneous subsets are
displayed.
a. Uses Harmonic Mean Sample Size = 3,000.
Keterangan :
SR : Survival Rate
FCR: Konversi Pakan
SGR : Laju Pertumbuhan Harian
PPM : Pertumbuhan Panjang Mutlak
GLK0: Glukosa hari ke-0
GLK5: Glukosa hari ke-5
GLK10: Glukosa hari ke-10
LM0: Laju metabolisme hari ke-0
LM10 : Laju metabolisme hari ke-10
LM20: Laju metabolisme hari ke-20
LM30: Laju metabolisme hari ke-30
21
Lampiran 8 Prosedur pengukuran NO2
1. Masukkan sampel air laut yang sudah disaring dengan kertas saring berdiameter pori 0,45µm ke dalam erlenmeyer 100 ml, sebanyak 25 ml
2. Tambahkan 1 ml larutan pewarna, kocok dan diamkan selama 10 menit untuk membentuk reaksi komplek.
3. Ukur dengan menggunakan spektro dengan panjang gelombang 543 nm. 4. Konsentrasi hasil pengkuran dicacat.
Lampiran 9 Prosedur pengukuran NH3
1. Ke dalam erlenmeyer 100 ml dimasukkan sampel air laut yang sudah disaring dengan kertas saring berdiameter pori 0,45µm sebanyak 25 ml.
2. Ditambahkan 1 ml larutan fenol, kocok kemudian tambahkan 1 ml larutan natrium nitroprusid dan 2,5 ml larutan oksidator. Kocok dan diamkan kira-kira 10 menit untuk membentuk reaksi komplek.
22
RIWAYAT HIDUP
Penulis dilahirkan di Bali tanggal 25 Desember 1990 dari Ayah bernama Putu Dana dan Ibu bernama Sayu Sarmawati. Penulis merupakan anak kedua dari tiga bersaudara. Pendidikan formal yang dilalui yaitu SMAN 1 Singaraja dan lulus pada tahun 2009. Pada tahun yang sama penulis diterima masuk IPB melalui jalur Ujian Seleksi Masuk IPB (USMI) pada Program Studi Teknologi dan Manajemen Perikanan Budidaya, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan penulis pernah magang di PT. Dewata Laut Bali pada tahun 2010 bagian kultur pakan alami dan Balai Budidaya Air Payau Situbondo, Jawa Timur pada tahun 2011 dengan komoditas kerapu macan. Tahun 2012 penulis melakukan praktek lapangan akuakultur di Balai Besar Penelitian dan Pengembangan Budi Daya Laut Gondol Bali dengan komoditas ikan kerapu sunu. Penulis aktif dalam UKM KMHD sebagai anggota divisi kerohanian periode 2009/2010, bendahara divisi kesekertariatan periode 2010/2011, dan sekertaris divisi sosial lingkungan periode 2011/2012. Selain itu penulis juga aktif dalam Himpunan Mahasiswa Akuakultur (HIMAKUA) sebagai anggota divisi olahraga dan seni periode 2010/2011 dan sebagai sekertaris divisi pengembangan masyarakat periode 2011/2012.
Tugas akhir dalam pendidikan tinggi pada jenjang S1 ini diselesaikan
dengan menulis skripsi yang berjudul “Pengaruh Salinitas terhadap Kadar