ABSTRACT
RAHMANITIA PUHANDA. Bacteria and Parasitic Worm on The Gills and Digestive Tract of Catfish (Pangasius sp.). Under direction of USAMAH AFIFF dan RISA TIURIA.
The present study was conducted to isolte, culture and identificatify of bacteria and parasitic worm from gills and digestive tract of catfish. A group of 10 of catfish were used, each gills and digestive tract was collected. The parasitic worms were colored with
Se icho ’s Acetocar i e for per anent staining. Differentiations and characterizations of variants isolate were based on biochemical reactions and Gram staining technique. Parasitic worms that can be identified from gills were Dactylogyrus sp. and Pseudodactylogyrus sp. The laboratory result shows that the gills and digestive tract of catfish were predominantly contaminated with Aeromonas sp. and Staphylococcus epidermidis, followed by Streptococcus sp., Edwardsiella tarda, Escherichia coli, Basillus sp. dan Vibrio cholerae.
RINGKASAN
RAHMANITIA PUHANDA. Bakteri dan Cacing Parasitik Pada Insang dan Saluran Pencernaan Ikan Patin (Pangasius sp.). Dibimbing oleh USAMAH AFIFF dan RISA TIURIA.
Pada usaha budi daya atau peternakan ikan, hal utama yang dituju tentunya adalah keuntungan ekonomi yang sebesar–besarnya. Hal ini memicu peternak untuk tetap menjaga kualitas ternaknya terutama dalam hal kesehatan. Banyak faktor yang dapat menjadi pemicu terganggunya kesehatan ikan sehingga menyebabkan turunnya produksi, diantaranya faktor fisik, kimia dan biologi. Hal– hal yang termasuk dalam faktor fisik adalah suhu dan cahaya. Faktor kimia terdiri dari gas–gas terlarut, parameter fisiko–kimia (nilai pH, konstanta ionisasi asam dan basa lemah, efek ion umum, alkalinitas karbonat dan kesadahan, keasaman, oksigen, karbondioksida, amonia, nitrit, nitrat, hidrogen sulfida dan mineral) dan polutan (logam dan logam berat, non logam, air limbah, lumpur dan partikel, minyak bumi, polutan panas dan polutan yang mempengaruhi rasa, warna dan bau produk). Faktor terakhir yang sangat berpengaruh ialah faktor biologi berupa hewan perairan lain yang bersifat predator ataupun reservoir penyakit–penyakit infeksi dan mikroorganisme yang dapat bersifat patogen terhadap ikan (bakteri, virus dan jamur) serta endo dan ektoparasit (Irianto 2005).
Penelitian ini bertujuan untuk mengetahui keberadaan serta mengidentifikasi bakteri dan cacing parasitik yang terdapat pada insang dan saluran pencernaan ikan patin (Pangasius sp.). Hasil dari penelitian ini diharapkan dapat memberikan informasi mengenai keberadaan bakteri dan cacing parasitik pada insang dan pencernaan ikan patin (Pangasius sp.) sehingga dapat dimanfaatkan sebagai acuan dalam dunia akademik dan praktisi dalam mengendalikan penyakit bakteri dan kecacingan yang berasal dari ikan konsumsi.
pewarnaan semi permanen menggunakan minyak cengkeh untuk nematoda (Soulbsy 1982). Identifikasi cacing dilakukan setelah pewarnaan selesai. Spesimen cacing diukur dan diamati dengan menggunakan mikroskop stereo dan video mikrometer. Koloni terpisah dari bakteri ditanam pada media agar nutrien dan dibuat pewarnaan Gram. Bakteri Gram positif coccus diidentifikasi dengan uji katalase, uji glukosa mikroaerofilik dan uji MSA. Bakteri Gram positif batang dibedakan atas batang berspora dan tidak berspora. Bakteri Gram negatif batang diidentifikasi dengan menggunakan uji oksidase dan uji-uji biokimia seperti uji TSIA, indol, sitrat, urea dan fermentasi glukosa.
Berdasarkan hasil uji dan identifikasi yang telah dilakukan terdapat 7 jenis bakteri yang ditemukan pada insang dan saluran pencernaan ikan patin.
Edwardsiella tarda, Aeromonas sp., Streptococcus sp. dan Staphylococcus
epidermidis ditemukan pada insang dan saluran pencernaan. Vibrio cholerae dan
Bacillus sp. ditemukan hanya pada insang. Escherichia coli ditemukan hanya pada saluran pencernaan. E. tarda dan Aeromonas sp. merupakan dua spesies bakteri yang bersifat patogen dan zoonotik pada ikan patin. Jenis cacing parasitik yang ditemukan pada insang ikan patin adalah Dactylogyrus sp dan
Pseudodactylogyrus sp, sedangkan pada saluran pencernaan ikan patin tidak ditemukan cacing parasitik.
BAKTERI DAN CACING PARASITIK PADA INSANG DAN
SALURAN PENCERNAAN IKAN PATIN (
Pangasius
sp.)
RAHMANITIA PUHANDA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi dengan judul Bakteri dan Cacing Parasitik pada Insang dan Saluran Pencernaan Ikan Patin (Pangasius sp.) adalah karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, September 2012
Rahmanitia Puhanda
ABSTRACT
RAHMANITIA PUHANDA. Bacteria and Parasitic Worm on The Gills and Digestive Tract of Catfish (Pangasius sp.). Under direction of USAMAH AFIFF dan RISA TIURIA.
The present study was conducted to isolte, culture and identificatify of bacteria and parasitic worm from gills and digestive tract of catfish. A group of 10 of catfish were used, each gills and digestive tract was collected. The parasitic worms were colored with
Se icho ’s Acetocar i e for per anent staining. Differentiations and characterizations of variants isolate were based on biochemical reactions and Gram staining technique. Parasitic worms that can be identified from gills were Dactylogyrus sp. and Pseudodactylogyrus sp. The laboratory result shows that the gills and digestive tract of catfish were predominantly contaminated with Aeromonas sp. and Staphylococcus epidermidis, followed by Streptococcus sp., Edwardsiella tarda, Escherichia coli, Basillus sp. dan Vibrio cholerae.
RINGKASAN
RAHMANITIA PUHANDA. Bakteri dan Cacing Parasitik Pada Insang dan Saluran Pencernaan Ikan Patin (Pangasius sp.). Dibimbing oleh USAMAH AFIFF dan RISA TIURIA.
Pada usaha budi daya atau peternakan ikan, hal utama yang dituju tentunya adalah keuntungan ekonomi yang sebesar–besarnya. Hal ini memicu peternak untuk tetap menjaga kualitas ternaknya terutama dalam hal kesehatan. Banyak faktor yang dapat menjadi pemicu terganggunya kesehatan ikan sehingga menyebabkan turunnya produksi, diantaranya faktor fisik, kimia dan biologi. Hal– hal yang termasuk dalam faktor fisik adalah suhu dan cahaya. Faktor kimia terdiri dari gas–gas terlarut, parameter fisiko–kimia (nilai pH, konstanta ionisasi asam dan basa lemah, efek ion umum, alkalinitas karbonat dan kesadahan, keasaman, oksigen, karbondioksida, amonia, nitrit, nitrat, hidrogen sulfida dan mineral) dan polutan (logam dan logam berat, non logam, air limbah, lumpur dan partikel, minyak bumi, polutan panas dan polutan yang mempengaruhi rasa, warna dan bau produk). Faktor terakhir yang sangat berpengaruh ialah faktor biologi berupa hewan perairan lain yang bersifat predator ataupun reservoir penyakit–penyakit infeksi dan mikroorganisme yang dapat bersifat patogen terhadap ikan (bakteri, virus dan jamur) serta endo dan ektoparasit (Irianto 2005).
Penelitian ini bertujuan untuk mengetahui keberadaan serta mengidentifikasi bakteri dan cacing parasitik yang terdapat pada insang dan saluran pencernaan ikan patin (Pangasius sp.). Hasil dari penelitian ini diharapkan dapat memberikan informasi mengenai keberadaan bakteri dan cacing parasitik pada insang dan pencernaan ikan patin (Pangasius sp.) sehingga dapat dimanfaatkan sebagai acuan dalam dunia akademik dan praktisi dalam mengendalikan penyakit bakteri dan kecacingan yang berasal dari ikan konsumsi.
pewarnaan semi permanen menggunakan minyak cengkeh untuk nematoda (Soulbsy 1982). Identifikasi cacing dilakukan setelah pewarnaan selesai. Spesimen cacing diukur dan diamati dengan menggunakan mikroskop stereo dan video mikrometer. Koloni terpisah dari bakteri ditanam pada media agar nutrien dan dibuat pewarnaan Gram. Bakteri Gram positif coccus diidentifikasi dengan uji katalase, uji glukosa mikroaerofilik dan uji MSA. Bakteri Gram positif batang dibedakan atas batang berspora dan tidak berspora. Bakteri Gram negatif batang diidentifikasi dengan menggunakan uji oksidase dan uji-uji biokimia seperti uji TSIA, indol, sitrat, urea dan fermentasi glukosa.
Berdasarkan hasil uji dan identifikasi yang telah dilakukan terdapat 7 jenis bakteri yang ditemukan pada insang dan saluran pencernaan ikan patin.
Edwardsiella tarda, Aeromonas sp., Streptococcus sp. dan Staphylococcus
epidermidis ditemukan pada insang dan saluran pencernaan. Vibrio cholerae dan
Bacillus sp. ditemukan hanya pada insang. Escherichia coli ditemukan hanya pada saluran pencernaan. E. tarda dan Aeromonas sp. merupakan dua spesies bakteri yang bersifat patogen dan zoonotik pada ikan patin. Jenis cacing parasitik yang ditemukan pada insang ikan patin adalah Dactylogyrus sp dan
Pseudodactylogyrus sp, sedangkan pada saluran pencernaan ikan patin tidak ditemukan cacing parasitik.
© Hak Cipta Milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak mengurangi kepentingan yang wajar IPB
BAKTERI DAN CACING PARASITIK PADA INSANG DAN
SALURAN PENCERNAAN IKAN PATIN
(
Pangasius
sp.)
RAHMANITIA PUHANDA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
HALAMAN PENGESAHAN
Judul Tugas akhir :Bakteri dan Cacing Parasitik Pada Insang dan Saluran Pencernaan Ikan Patin (Pangasius sp.)
Bentuk Tugas Akhir : Penelitian
Nama Mahasiswa : Rahmanitia Puhanda NIM : B04080071
Disetujui,
Pembimbing I
drh. Usamah Afiff, M.Sc. NIP. 19600624 198703 1 001
Pembimbing II
Dr. drh. Risa Tiuria, MS. NIP. 19630430 198703 2 001
Diketahui, Wakil Dekan
Fakultas Kedokteran Hewan-IPB
drh. Agus Setiyono, MS, PhD, APVet NIP. 19630810 198803 1 004
KATA PENGANTAR
Puji dan syukur Penulis ucapkan ke hadirat Allah SWT atas segala limpahan rahmat dan karunia-Nya sehingga Penulis dapat menyelesaikan skripsi yang
berjudul “Bakteri dan Cacing Parasitik pada Insang dan Saluran Pencernaan Ikan
Patin (Pangasius sp.). Penulis juga mengucapkan terimakasih yang sebesar-besarnya kepada semua pihak yang telah membantu baik secara langsung maupun tidak langsung khususnya kepada :
1. Bapak drh. Usamah Afiff, M.Sc. selaku dosen pembimbing I, yang telah memberikan waktu, tenaga dan arahan selama penelitian dan penulisan skripsi ini.
2. Ibu Dr. drh. Risa Tiuria, MS. selaku dosen pembimbing II, yang telah memberikan waktu, tenaga dan arahan selama penelitian dan penulisan skripsi ini.
3. Ibu Dr. drh. Min Rahminiwati selaku dosen Pembimbing Akademik.
4. Ayahanda Puhilis, S.Pd, Ibunda Hasneli, S.Pd, Kakak Febriani Puhanda, Abang Fernandes, Adinda Rani Oktavia Puhanda, Reno Oktavia Puhanda dan Rafif Dzakhwan Nazif serta seluruh keluarga tercinta atas do’a, dorongan, bantuan material dan spiritual serta kasih sayang yang selalu diberikan.
5. Uda Rico Faslah, S.Kh atas do’a, dorongan, kasih sayang dan bantuannya dalam mendukung Penulis untuk menyelesaikan skripsi ini.
6. Teman satu penelitian Nurhayati, Hafiz dan Ismi atas bantuan dan kerjasamanya. 7. Teman seperjuangan Tiara, Hilma, Antari, Puspi, Hapsah, Imelda, Elin dan Aulia
terima kasih atas dukungannya.
8. Bapak Eman dan Bapak Almarhum Rafiq yang telah membantu selama penelitian. Semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan, saran dan kritik yang bersifat membangun sangat Penulis harapkan.
RIWAYAT HIDUP
Penulis dilahirkan di Bukittinggi pada tanggal 9 September 1990 dari ayah Puhilis dan ibu Hasneli. Penulis merupakan anak kedua dari empat bersaudara.
Penulis menyelesaikan jenjang pendidikan di Sekolah Dasar Negeri 38 Cingkariang. Pada tahun 2002, Penulis melanjutkan pendidikan di Sekolah Lanjutan Tingkat Pertama Negeri 2 Bukittinggi dan melanjutkan pendidikan di Sekolah Menengah Atas Negri 3 Bukitinggi pada tahun 2005. Setelah itu, Penulis diterima di Institut Pertanian Bogor pada tahun 2008 melalui jalur Undangan Seleksi Masuk IPB (USMI) dengan Program Studi Kedokteran Hewan, Fakultas Kedokteran Hewan Institut Pertanian Bogor (FKH IPB).
DAFTAR ISI
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 3
Manfaat ... 3
TINJAUAN PUSTAKA ... 4
Morfologi Ikan Patin ... 4
Siklus Hidup ... 5
Sifat dan Habitat Alami ... 5
Makanan dan Kebiasaan Makan ... 6
Taksonomi ... 6
Jenis-Jenis Ikan Patin ... 6
Bakteri Pada Ikan ... 7
Parasit Cacing Pada Ikan ... 11
BAHAN DAN METODA PENELITIAN ... 18
Waktu dan Tempat Penelitian ... 18
Bahan dan Alat Penelitian ... 18
Metode Penelitian ... 18
HASIL DAN PEMBAHASAN ... 26
Bakteri Pada Insang dan Saluran Pencernaan Ikan Patin ... 26
Cacing Parasitik Pada Insang dan Saluran Pencernaan Ikan Patin ... 34
KESIMPULAN DAN SARAN ... 38
DAFTAR TABEL
DAFTAR GAMBAR
Gambar 1 Anatomi Ikan Patin (Pangasius sp.) ... 5
Gambar 2 Anatomi dan Morfologi Bakteri ... 7
Gambar 3 Bakteri Aeromonas hydrophila ... 8
Gambar 4 Infeksi Aeromonas hydrophila pada Kulit Ikan Patin ... 8
Gambar 5 Infeksi Edwardsiella tarda pada Kulit Ikan Patin ... 9
Gambar 6 Infeksi Edwardsiella ictaluri pada Kulit Ikan Patin ... 10
Gambar 7 Bakteri Pseudomonas aeruginosa ... 10
Gambar 8 Anatomi dan Morfologi Gyrodactylus sp. ... 12
Gambar 9 Anatomi dan Morfologi Dactylogyrus sp. ... 12
Gambar 10 Anatomi dan Morfologi Digenea ... 13
Gambar 11 Siklus Hidup Digenea ... 14
Gambar 12 Anatomi dan Morfologi Nematoda ... 15
Gambar 13 Siklus Hidup Nematoda ... 15
Gambar 14 Tipe Scolex Cestoda ... 16
Gambar 15 Siklus Hidup Cestoda ... 17
Gambar 16 Diagram Alir Identifikasi Bakteri ... 20
Gambar 17 Pewarnaan Gram Edawardsiella tarda pada Insang Ikan Patin . 26 Gambar 18 Pewarnaan Gram Aeromonas sp. ... 28
Gambar 19 Pewarnaan Gram Vibrio cholerae pada Insang Ikan Patin ... 30
Gambar 20 Pewarnaan Gram Escherichia coli ... 31
Gambar 21 Pewarnaan Gram Bacillus sp. pada Insang Ikan Patin ... 31
Gambar 22 Pewarnaan Gram Streptococcus sp. ... 32
Gambar 23 Pewarnaan Gram Staphylococcus epidermidis ... 33
Gambar 24 Cacing Dactylogyrus sp. ... 34
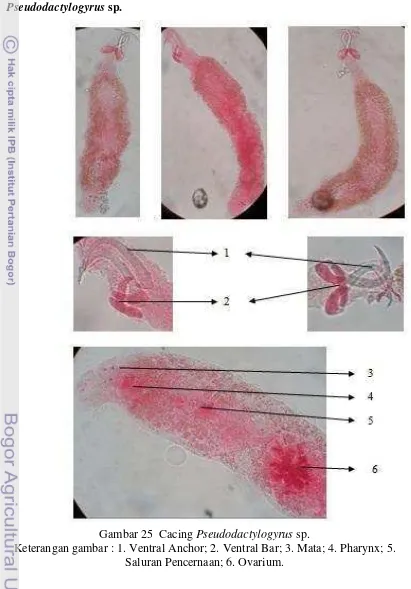
Gambar 25 Cacing Pseudodactylogyrus sp. ... 36
PENDAHULUAN
Latar Belakang
Indonesia merupakan negara maritim yang terdiri dari gugusan kepulauan dan kelautan yang terletak di daerah tropis. Wilayah laut Indonesia mendapatkan pengaruh dari dua laut yaitu Samudra Indonesia dan Samudra Pasifik. Keadaan geografis Indonesia dengan banyak pulau–pulau yang terpisah secara strategis menyebabkan Indonesia menjadi persimpangan jalan dan persinggahan sehingga pulau–pulau Indonesia memiliki keragaman fauna dan flora (Subarijati 2008). Ikan merupakan salah satu kekayaan fauna Indonesia yang berpotensi besar untuk membangun perekonomian rakyat, baik ikan laut maupun ikan air tawar.
Indonesia merupakan salah satu negara yang kaya akan jenis–jenis ikan air tawar. Menurut The World Bank pada tahun1998 di Indonesia terdapat sekitar 1.3 x 103 jenis ikan air tawar dengan kepadatan 0.72 jenis/103 km2, sehingga Indonesia termasuk ke dalam negara “megabiodiversity” kedua setelah Brazil
(Wargasasmita 2002). Menurut Khairuman Khairul, terdapat 7 x 103 spesies ikan yang hidup di perairan Indonesia dan 2 x 103 diantaranya merupakan jenis ikan air tawar.
Lingkungan perairan air tawar terdiri dari dua kategori yaitu habitat lentik (lentic) dan habitat lotik (lotic). Habitat lentik adalah habitat yang memiliki badan air yang diam seperti danau dan kolam. Habitat lotik ialah habitat yang memiliki badan air yang bergerak seperti sungai dan mata air. Jika dilihat dari faktor nutrien yang terkandung di dalam airnya, lingkungan perairan air tawar memiliki kandungan nutrien yang lebih tinggi dibandingkan dengan perairan air laut. Hal ini disebabkan oleh perairan air tawar mendapat perlakuan atau masukan dari aktivitas manusia (Irianto 2005).
Pada usaha budi daya atau peternakan ikan hal utama yang dituju tentunya adalah keuntungan ekonomi yang sebesar–besarnya. Hal ini memicu peternak untuk tetap menjaga kualitas ternaknya terutama dalam hal kesehatan. Banyak faktor yang dapat menjadi pemicu terganggunya kesehatan ternak ikan yang dapat menyebabkan turunnya produksi, diantaranya faktor fisik, kimia dan biologi. Hal– hal yang termasuk dalam faktor fisik adalah suhu dan cahaya. Faktor kimia terdiri dari gas–gas terlarut, parameter fisiko–kimia (nilai pH, konstanta ionisasi asam dan basa lemah, efek ion umum, alkalinitas karbonat dan kesadahan, keasaman, oksigen, karbondioksida, amonia, nitrit, nitrat, hidrogen sulfida dan mineral) dan polutan (logam dan logam berat, non logam, air limbah, lumpur dan partikel, minyak bumi, polutan panas dan polutan yang mempengaruhi rasa, warna dan bau produk). Faktor terakhir yang sangat berpengaruh ialah faktor biologi berupa hewan perairan lain yang bersifat predator ataupun reservoir penyakit–penyakit infeksi dan mikroorganisme yang dapat bersifat patogen (bakteri, virus dan jamur) serta endo dan ektoparasit (Irianto 2005).
Ikan patin merupakan salah satu komoditas ekspor yang bernilai ekonomi tinggi baik dalam segi pembenihan ataupun pembesaran. Ikan patin banyak disukai masyarakat karena tekstur dagingnya yang lembut, memiliki warna yang bersih (hampir putih) dan memiliki kandungan protein yang tinggi. Ikan ini dianggap lebih aman juga untuk dikonsumsi karena kadar kolesterol yang terkandung di dalamnya relatif rendah. Selama ini ikan patin yang dikonsumsi diperoleh dari penangkapan dari alam, namun seiring berjalannya waktu permintaan dan kebutuhan terhadap ikan patin semakin tinggi namun populasinya di alam justru semakin menurun. Oleh sebab itu banyak dibuka usaha budidaya ikan patin. Tapi tentunya usaha ini tak selalu berjalan lancar karena banyak faktor penghambat diantaranya keberadaan cacing dan bakteri pada tubuh ikan.
penurunan imunitas tubuh, gangguan reproduksi, penurunan kualitas karkas bahkan dapat berakibat pada kematian (Chandra et al. 2007). Bakteri merupakan mikroorganisme yang dapat menjadi flora normal dan patogen di dalam tubuh hewan. Keberadaannya dalam jumlah yang besar dan ditambah dengan penurunan imunitas tubuh ikan dapat menyebabkan gangguan metabolisme, penurunan berat badan dan produksi hingga kematian.
Tujuan
Penelitian bertujuan untuk mengetahui keberadaan serta mengidentifikasi bakteri dan cacing parasitik yang terdapat pada insang dan saluran pencernaan ikan patin (Pangasius sp.).
Manfaat
Penelitian ini bertujuan untuk mengetahui keberadaan serta mengidentifikasi bakteri dan cacing parasitik yang terdapat pada insang dan saluran pencernaan ikan patin (Pangasius sp.). Hasil dari penelitian ini diharapkan dapat memberikan informasi mengenai keberadaan bakteri dan cacing parasitik pada insang dan pencernaan ikan patin (Pangasius sp.) sehingga dapat dimanfaat sebagai acuan dalam dunia akademik dan praktisi dalam mengendalikan penyakit bakteri dan kecacingan yang berasal dari ikan konsumsi. Identifikasi cacing parasitik berpedoman pada Noga (1996), Hoffman (1977) dan Bychowsky (1961). Indentifikasi bakteri berpedoman pada Jang et al. (1976) dan Cowan & Steel (1974).
TINJAUAN PUSTAKA
Morfologi Ikan Patin
Ikan patin merupakan salah satu jenis ikan yang berasal dari kelompok lele–lelean. Secara anatomi ikan ini memiliki bentuk tubuh memanjang dan agak pipih. Tubuh dominan berwarna putih seperti perak, sedangkan bagian punggung berwarna kebiru–biruan. Patin memiliki tubuh yang licin tanpa sisik (Amri Khairuman 2008).
Secara umum tubuh ikan patin terdiri dari tiga bagian, yaitu kepala, badan dan ekor. Kepala ikan ini relatif kecil jika dibandingkan dengan ukuran badannya. Bentuk kepalanya agak pipih dengan batok kepala yang keras. Mata dan hidung memiliki ukuran yang kecil. Mulutnya memiliki celah yang lebar dengan dua pasang sungut atau kumis pada bagian maksila dan mandibula. Sungut ini merupakan ciri khas catfish (ikan berkumis seperti kucing) yang berfungsi sebagai indra peraba saat berenang dan alat pencari pakan. Di dalam rongga mulut ikan ini memiliki gigi palatin yang terpisah dari tulang vomer. Penutup insang pada bagian kiri dan kanan kepalanya tidak terlalu besar sehingga tidak menutupi seluruh bagian kepala (Dewi 2011).
Gambar 1 Anatomi Ikan Patin (Pangasius sp.) (Hamilton 1822)
Keterangan gambar : 1. Mulut; 2. Mata; 3. Sirip dada; 4. Patil; 5. Sirip punggung; 6. Sirip perut; 7. Sirip anal; 8. Gurat sisi; 9. Sirip ekor.
Siklus Hidup
Ikan patin dalam menjalani hidupnya mengalami perkembangan atau fase yang akan dijalaninya selama beberapa waktu sampai akhirnya dapat dikonsumsi ataupun dijadikan induk untuk menghasilkan benih-benih yang berkualitas. Menurut Lusac dan Southgate (2012) ikan patin memiliki fase kehidupan yaitu telur, larva, benih dan dewasa.
Sifat dan Habitat Alami
persembunyiannya dan melakukan aktivitas pada malam hari. Patin hidup secara berkelompok atau bergerombol. Hal ini merupakan faktor yang dapat merangsang nafsu makannya.
Makanan dan Kebiasaan Makan
Ikan patin termasuk jenis omnivora (pemakan segala). Ikan ini biasa memakan ikan–ikan kecil, cacing, serangga, biji–bijian, udang kecil dan moluska. Namun pada stadium larva , ikan lebih bersifat karnivora dan memakan
Brachionus sp, Crustacea dan Cladocera. Sementara itu ikan yang dalam stadium larva yang baru habis kuning telurnya mempunyai sifat kanibal yang tinggi (Susanto 2009).
Taksonomi
Secara sistematika ikan patin dapat diklasifikasikan ke dalam domain eukaryota, kingdom animalia, subkingdom bilateria, phylum Chordata, subphylum Vertebrata, infraphylum Gnathostoma, superkelas Osteichtyes, kelas Osteichtyes, subkelas Actinopterygii, ordo Siluriformes, famili Pangasiidae, genus
Pangasius dan spesies Pangasius sp. Ikan patin memiliki nama Inggris Catfish
(Saanin 1968).
Jenis – Jenis Ikan Patin
Bakteri dan Cacing Parasitik pada Ikan
Bakteri pada Ikan
Bakteri ialah organisme bersel satu yang termasuk ke dalam kategori organisme prokariot. Organisme ini memiliki karakteristik seperti membran sel, nukleus (inti sel), reproduksi aseksual dan seksual (mitosis dan meiosis), memiliki ribosom sitoplasmik, endoplasmik retikulum (RE), mitokondria, cloroplas, aparatus golgi dan membran lipid (Carter & Wise 2004).
Gambar 2 Anatomi dan Morfologi Bakteri (Krisno 2011)
Aeromonas merupakan bakteri Gram negatif yang berbentuk batang,
ukurannya 1-4 x 0,4-1 mikron, fakultatif aerob (dapat hidup dengan atau tanpa oksigen), tidak berspora, motil karena memiliki satu flagel (monotrichous flagella) yang keluar dari salah satu kutubnya, senang hidup di lingkungan bersuhu 15-300C dan pH antara 5,5-9 (Gufron & Kordi 2004). Bakteri ini banyak terdapat di air tawar yang mengandung banyak bahan organik dengan kadar salinitas rendah. Aeromonas dapat ditemukan di permukaan tubuh dan organ dalam ikan (Noga 1996).
hemorrhagic septicemia (BHS) atau motile aeromonas septicemia(MAS)) pada berbagai spesies ikan air tawar seperti patin (Irianto 2005).
Gambar 3 Bakteri Aeromonas hydrophilia (Anonim 2012)
Gambar 4 Infeksi Aeromonas hydrophila pada kulit ikan patin (Noga 1996)
Edwardsiella tarda merupakan bakteri yang berbentuk batang
melengkung pleomorfik dan bersifat Gram negatif. Bakteri ini termasuk dalam famili Enterobacteriaceae yang bersifat fakultatif anaerob, berbentuk batang dengan ukuran sedang, oksidasi negatif, katalase positif (beberapa negatif), tidak berspora, fermentatif (sering diikuti dengan terbentuknya gas) dan motil. E. tarda
E. tarda merupakan salah satu spesies bakteri yang bersifat patogen pada ikan patin. Bakteri ini biasanya menyerang ikan patin dewasa. E. tarda hidup di air kolam pemeliharaan ikan patin bersifat kronis dengan mortalitas yang rendah, namun saat ikan stres dan imunitas tubuh menurun bakteri ini dapat menginfeksi ikan patin dengan mortalitas yang tinggi karena menyebabkan penyakit
Edwardsiella septicaemia (ES). E. tarda merupakan salah satu jenis bakteri yang bersifat zoonotik yang dapat menyebabkan terjadinya enteritis pada manusia (Noga 1996).
Gambar 5 Infeksi Edwardsiella tarda pada kulit ikan patin (Noga 1996)
E. ictaluri merupakan salah satu spesies yang juga termasuk famili dari
Gambar 6 Infeksi Edwarsiella ictaluri pada kulit ikan patin (Noga 1996)
Pseudomonas sp. Merupakan bakteri Gram negatif bersifat fakultatif anaerob atau aerob, berbentuk batang dengan ukuran sedang, motil (beberapa memiliki polar flagella), katalase dan oksidasi positif dan beberapa spesies dapat menghasilkan water-soluble pigment. Bakteri ini hidup bebas di alam , sehingga dapat ditemukan di air ataupun tanah. Bakteri Pseudomonas terdiri dari beberapa spesies namun hanya satu spesies yang bersifat patogen yaitu Pseudomonas aeruginosa. Sama dengan spesies Pseudomonas lainnya bakteri ini memiliki habitat alami di air dan tanah. Pseudomonas sp. juga dapat ditemukan di kulit, mukosa membran dan feses. Infeksi oleh P. aeruginosa dapat menyebabkan infeksi pada luka, abses, diare, infeksi pada traktus urinari, genital dan telinga. Tingkat infektif bakteri ini dapat meningkat jika adanya kombinasi dengan infeksi
Streptococcus dan Staphylococcus (Carter & Wise 2004).
Parasit Cacing pada Ikan
Parasit adalah adalah organisme yang hidup pada tubuh organisme lain yang dapat menimbulkan kerugian atau efek negatif pada organisme yang ditempatinya (Akbar 2011). Berdasarkan tempat hidupnya parasit terbagi menjadi dua yaitu ektoparasit dan endoparasit. Ektoparasit merupakan organisme parasit yang hidup di bagian luar tubuh inangnya, sedangkan endoparasit merupakan organisme parasit yang hidup di dalam tubuh inangnya.
Monogenea merupakan parasit yang termasuk dalam phylum Platyhelminthes. Anggota dari kelas Monogenea ini sebagian besar bersifat ektoparasit pada ikan, namun ada beberapa yang bersifat endoparasit yaitu
Acolpenteron sp., Kritskya sp. dan Enterogyrus sp. Monogenea bersifat
hermaprodit, bertelur/ovipar (kecuali Gyrodactilus, vivipar) dan memiliki larva yang berenang bebas disebut oncomiracidium. Oncomiracidium menyerang inang dan post oncomiracidium bermigrasi melalui insang atau permukaan tubuh menuju target organ terakhir. Hal ini sejalan dengan infeksi oleh Monogenea yang sering ditemukan pada insang, kulit dan sirip ikan. Namun ada juga Monogenea yang menginfeksi organ dalam seperti rektum, uretra, rongga tubuh bahkan pembuluh darah (Anshary 2008).
Monogenea dapat dikelompokkan menjadi dua kelompok berdasarkan cara makannya. Kelompok pertama adalah Monogenea yang menghisap darah inang sehingga dapat menyebabkan terjadinya anemia. Kelompok kedua adalah Monogenea yang memakan jaringan inang dan sel–sel debris sehingga dapat merusak permukaan epitel akibat aktivitas “grazing” yang dilakukannya pada permukaan integumen. Beberapa spesies Monogenea yang bersifat patogen pada ikan ialah Microbothriidae (Dermophthirius), Capsalidae (Benedenia,
Neobenedenia), Dactylogyridae Dactylogyrus spp, Pseudodactylogyrus) dan
Gyrodactylidae (Gyrodactylus spp) (Anshary 2008).
Gyrodactylus sering ditemukan melekat pada permukaan tubuh atau sirip ikan. Ia melekat dengan menggunakan alat pelekat (haptor) yang memiliki dua sauh (anchors) yang dilengkapi dengan 16 kait tepi (marginal hooklets).
lingkungan, telur ini bersifat resisten terhadap bahan kimia ataupun desinfektan. Telur kemudian akan menetas dan menghasilkan larva yang memiliki bulu getar yang dapat berenang bebas hingga menemukan inangnya (Irianto 2005).
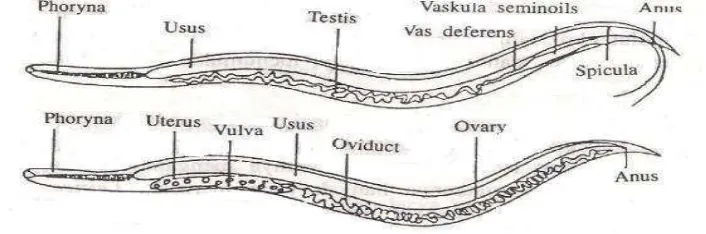
Gambar 8 Anatomi dan Morfologi Gyrodactylus sp. (Ghufran & Kordi 2004). Keterangan Gambar : 1. Organ peraba; 2. Kepala; 3. Mulut; 4. Pharynx; 5.
Embrio; 6. Mata; 7. Usus; 8. Testis; 9. Ovary; 10. Posterior haptor.
Gambar 9 Anatomi dan Morfologi Dactylogirus sp. (Ghufran & Kordi 2004). Keterangan Gambar : 1. Kepala; 2. Mata; 3. Mulut; 4. Telur; 5. Ovary; 6. Testis;
7. Posterior haptor.
Gambar 10 Anatomi dan Morfologi Digenea (Ghufran & Kordi 2004)
Digenea dewasa akan melepaskan telur ke lingkungan, telur ini akan menetas dan menghasilkan mirasidium yang akan menumpang hidup pada inang sementara atau inang perantara I misalnya siput. Mirasidium akan berkembang di dalam tubuh siput menjadi sporocyst/rediae. Kemudian sebagian besar dari
Gambar 11 Siklus Hidup Digenea (Noga 1996)
Ikan yang terinfeksi oleh Digenea memperlihatkan gejala klinis seperti spot coklat kehitaman pada kulit, sirip dan insang, perut kembung akibat obstruksi gastrointestinal, pertumbuhan lambat, hemoragi, nekrosa dan infeksi sepanjang jalur migrasi metasercaria. Parasit Digenea berpotensi zoonotik jika manusia memakan ikan yang mengandung cacing dewasa ataupun kista metasercaria yang tidak dimasak hingga matang.
Gambar 12 Anatomi dan Morfologi Nematoda (Ghufran & Kordi 2004)
Nematoda dapat dibedakan menjadi dua kelompok berdasarkan siklus hidupnya. Kelompok pertama yaitu Nematoda yang memilki silkus hidup langsung yaitu tidak membutuhkan inang antara dalam berkembang biakannya. Kelompok kedua ialah Nematoda yang membutuhkan inang antara dalam masa perkembangbiakannya. Nematoda jenis ini ada yang menjadikan ikan sebagai inang definitif ataupun inang antara. Jika ikan hanya sebagai inang antara maka inang definitifnya adalah hewan pemakan ikan seperti burung pemakan ikan atau mamalia (Irianto 2005).
Infeksi oleh Nematoda pada ikan dapat memperlihatkan gejala klinis berupa hemoragi, pembentukan kista atau granuloma, bintil – bintil atau nodul eksternal, inflamasi dan nekrosis. Keberadaan nematoda pada saluran pencernaan dapat merusak dinding traktus intestinal yang dapat mengganggu proses penyerapan makanan, menurunkan nafsu makan dan berujung pada penurunan berat badan serta produksi.
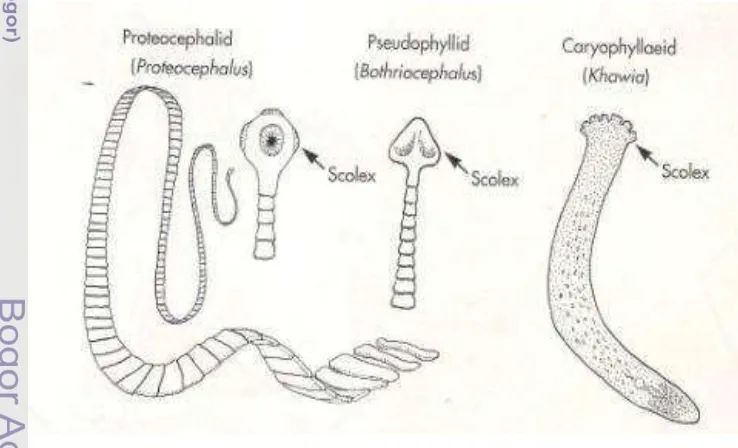
Cestoda merupakan parasit dari phylum Platyhelminthes. Cacing ini dikenal juga dengan sebutan cacing pita. Menurut Muslim (2005) cestoda sering ditemukan pada pencernaan manusia dan vertebrata, sedangkan larvanya dapat ditemukan pada vertebrata dan avertebrata. Parasit ini memiliki bentuk tubuh pipih seperti pita dan memiliki ruas–ruas di tubuhnya. Cacing jantan dan betina memiliki masing–masing testis dan ovari sebagai alat reproduksinya. Pada bagian anterior tubuhnya cacing ini memiliki alat hisap serta asetabulum untuk menempel pada inangnya (Ghufran & Kordi 2004).
Cestoda dapat dibedakan tiga jenis jika dikelompokkan berdasarkan bentuk scolexnya yaitu proteocephalid, pseudophyllid dan caryophyllaeid (Gambar 14).
Gambar 14 Tipe Scolex Cestoda (Noga 1996)
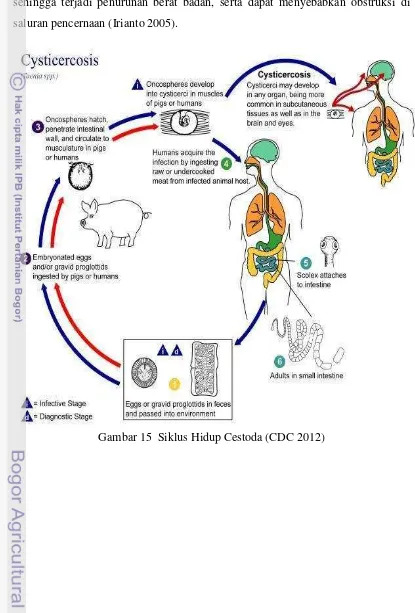
Cacing dapat menginfeksi otot, saluran pencernaan dan rongga tubuh ikan . Gejala klinis yang ditunjukkan adalah nafsu makan menurun, metabolisme terganggu sehingga terjadi penurunan berat badan, serta dapat menyebabkan obstruksi di saluran pencernaan (Irianto 2005).
BAHAN DAN METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Juli 2011 hingga bulan Maret 2012 bertempat di Laboratorium Helmintologi Bagian Parasitologi dan Entomologi Kesehatan dan Laboratorium Bateriologi Bagian Mikrobiologi Medis Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Bahan dan Alat Penelitian
Bahan yang digunakan dalam penelitian ini adalah sampel ikan patin, NaCl fisiologis, etanol bertingkat, etanol absolut, ethanol 70%, minyak cengkeh, pewarna Semichon’s Acetocarmine, entelan, xylol, aquades, Blood Agar, Mac Conkey Agar, Nutrient Agar, pewarna Gram, glukosa, sukrosa, maltosa, laktosa, manitol, indol, TSIA, sitrat, KOH 10% dan KOH 4%.
Alat yang digunakan pada penelitian ini adalah seperangkat alat bedah, timbangan, cawan petri, pinset, kait, pipet tetes,gunting, botol kaca, spidol, label nama, gelas objek dan kaca penutup, mikroskop cahaya, mikroskop stereo, video mikroskop, bunsen, ose, needle, tabung reaksi dan rak tabung reaksi.
Metode Penelitian
1. Teknik Pengambilan Sampel
Sampel ikan diambil dari kolam petani ikan patin di daerah Parung Kabupaten Bogor sebanyak 10 ekor dengan berat rata–rata 500 g.
2. Teknik Parasitologi
bawah mikroskop stereo untuk mengoleksi cacingnya. Cacing yang ditemukan direlaksasikan di dalam NaCl fisiologis kemudian difiksasi di dalam etanol 70% sebelum diwarnai.
3. Pewarnaan
Pada penelitian ini digunakan dua jenis teknik pewarnaan, yaitu pewarnaan permanen untuk trematoda dan pewarnaan semi permanen untuk Nematoda.
a. Pewarnaan Permanen
Pewarnaan permanen atau dikenal juga dengan pewarnaan Semichon’s
Acetocarmine biasa digunakan untuk mengindentifikasi cacing pipih (golongan trematoda). Tahap pertama dalam pewarnaan ini adalah dengan merendam spesimen dalam larutan Semichon’s Acetocarmine selama 15-20 menit (sampai warna terserap dan spesimen berubah warna menjadi merah cerah). Setelah itu spesimen dibilas dengan menggunakan etanol 70% dan kemudian direndam di dalam larutan asam alkohol (99 bagian etanol 70% dicampur dengan 1 bagian HCl). Kemudian dilakukan dehidrasi pada spesimen dengan menggunakan etanol bertingkat (70%, 85%, 95%, 100%) dengan cara merendamnya selama 5 menit pada setiap konsentrasi etanol. Setelah itu spesimen direndam di dalam xylol sampai spesimen terlihat tembus pandang. Langkah terakhir adalah spesimen
di-mounting dengan entelan sebagai media fiksasi (Soulbsy 1982). b. Pewarnaan Semi Permanen
4. Pemeriksaan Bakteri
Persiapan Bahan
Contoh berupa insang dan saluran pencernaa ikan. Insang dipotong ±1x1 cm ditambah ±10 tetes aquades digerus dan hasil gerusan ditanam pada media MCA dan agar darah. Sisa organ insang diletakkan didalam cawan petri yang berisi NaCl fidiologis. Satu tetes isi saluran pencernan ditambah ±10 tetes aquades digerus dan hasil gerusan ditanam pada media MCA dan agar darah. Sisa saluran pencernaan diletakkan didalam cawan petri yang berisi NaCl fidiologis, kemudian digunting sampai. Pengerjaannya dilakukan secara aseptis.
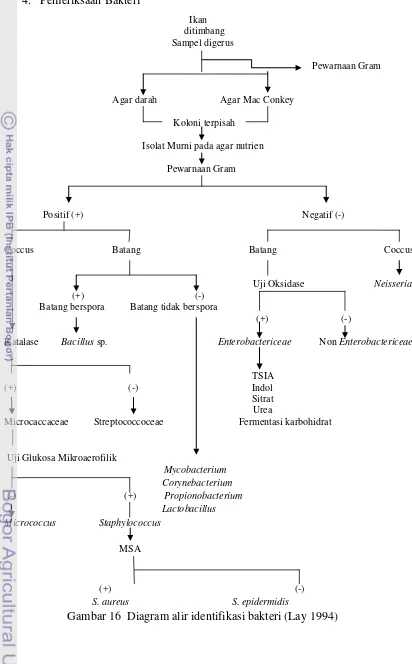
Isolasi Bakteri
Suspensi hasil gerusan ditanam di atas media agar darah dan agar Mac-conkey untuk menumbuhkan koloni dengan teknik goresan T. Media yang telah digores kemudian diinkubasi selama kurang lebih 24 jam. Koloni terpisah yang tumbuh pada agar darah dan agar Mac-conkey dikarakterisasi berdasarkan persamaan morfologis, yaitu ukuran, warna, bentuk, tepi permukaan, dan transparansi. Koloni bakteri yang berbeda diambil dan dibiakkan pada agar nutrien sebagai isolat murni pada suhu 37 °C selama 24 jam dan dilakukan pewarnaan Gram untuk mengetahui sifat Gram dan morfologi bakteri. Menurut Lay (1994), teknik pewarnaan Gram yaitu spesimen ditetesi kristal violet selama 1 menit kemudian dibilas dengan aquades. Setelah itu, spesimen ditetesi dengan larutan pemucat (alkohol) selama 10-20 detik. Tahap terakhir ialah spesimen ditetesi safranin selama 1 menit kemudian dibilas dengan aquades serta dikeringkan dengan kertas pengering.
Identifikasi Bakteri
tahan asam yaitu Mycobacterium dan tidak tahan asam (Corynebacterium dan
Listeria).
Isolat dengan hasil Gram positif yang berbentuk coccus, selanjutnya diuji dengan uji katalase. Katalase adalah enzim yang mengkatalisiskan (H2O2) menjadi air dan oksigen. Penentuan adanya katalase diuji dengan penambahan 3% H2O2 pada koloni terpisah. Uji ini dilakukan untuk membedakan antara bakteri kelompok Microcaccaceae dan Streptococcoceae (Lay 1994). Kelompok
Streptococcoceae bersifat katalase negatif, sedangkan kelompok Microcaccaceae
bersifat katalase positif. Bakteri yang bersifat katalase positif akan terlihat pembentukan gelembung udara di sekitar koloni. Reaksi kimiawi yang dikatalisasikan oleh enzim katalase terlihat berikut:
Bakteri dengan sifat katalase positif selanjutnya dilakukan uji. Hasil negatif uji glukosa menunjukkan bakteri Micrococcus, sedangkan hasil positif menunjukan bakteri Staphylococcus. Bakteri dengan hasil positif kemudian dilakukan uji pada agar Manitol Salt Agar (MSA) yang mengandung kadar NaCl tinggi, sehingga akan menghambat pertumbuhan bakteri selain Staphylococcus. Media ini terutama digunakan untuk membedakan kelompok Staphylococcus yang bersifat patogen dan non-patogen. S. aureus pada umumnya bersifat patogen dan menghasilkan warna kuning pada agar. S. epidermidis bersifat tidak patogen dan membentuk zona merah pada agar. Warna kuning disebabkan oleh fermentasi manitol disertai pembentukan asam, sedangkan warna merah disebabkan manitol yang tidak difermentasikan.
dilanjutkan dengan proses identifikasi menggunakan media Triple Sugar Iron Agar (TSIA), indol, MRVP (Methyl Red–Voges Proskauer), sitrat, urea, uji fermentasi karbohidrat. Hasil uji oksidase yang menunjukkan hasil negatif mengindikasikan jenis bakteri Pseudomonas dan Bordetella.
Uji TSIA dilakukan dengan menggunakan Triple Sugar Iron Agar. Media mengandung tiga macam gula yaitu glukosa, laktosa dan sukrosa, selain itu media juga mengandung indikator merah fenol dan FeSO4 untuk memperlihatkan pembentukan H2S yang ditunjukkan dengan adanya endapan hitam. Konsentrasi glukosa adalah 1/10 dari konsentrasi laktosa atau sukrosa agar fermentasi glukosa dapat terlihat. Media TSIA terdiri dari dua bagian yaitu butt (bawah) dan slant
(atas). Tahapan uji TSIA yaitu koloni bakteri diambil dengan menggunakan
needle, kemudian ditusukkan pada bagian tengah butt dan langsung dilanjutkan dengan penggoresan di bagian slant. Setelah itu media diinkubasi pada suhu 37°C selama 24-48 jam (Lay 1994).
Reaksi yang dapat terlihat pada media TSIA adalah bagian butt bersifat asam dan berwarna kuning sedangkan bagian slant bersifat basa dan berwarna merah akibat dari fermentasi glukosa. Keseluruhan media terjadi pembentukan asam sehingga seluruh media berwarna kuning akibat fermentasi laktosa atau sukrosa atau keduanya. Adanya pembentukan gas pada bagian butt, sehingga media terpecah akibat pembentukan gas seperti H2 dan CO2. Seluruh media berwarna merah karena ketiga jenis glukosa tidak difermentasi. Seperti yang telah dijelaskan sebelumnya dapat terbentuk endapan hitam pada bagian butt karena pembentukan H2S (Lay 1994).
Uji indol dilakukan dengan menggunakan media indol yang kaya akan triptofan. Koloni bakteri yang telah diambil dengan menggunakan needle
ditusukkan ke bagian tengah media kemudian diinkubasi pada suhu 37°C selama 24-48 jam. Uji indol dilakukan dengan penambahan reagen Erlich-Bohme
Uji Methyl Red digunakan untuk menentukan adanya fermentasi asam campuran. Fermentasi asam campuran ditentukan dengan cara menumbuhkan mikroorganisme dalam kaldu yang mengandung glukosa dan menambahkan reagens methyl red ke dalam kaldu setelah masa inkubasi pada suhu 37 °C selama 24 jam. Kaldu biakan akan berubah menjadi kuning atau jingga jika tidak terjadi fermentasi asam campuran. Uji ini sangat berguna dalam mengidentifikasi kelompok bakteri yang menempati saluran pencernaan.
Uji Voges Proskauer digunakan untuk mengidentifikasi mikroorgnisme yang memfermentasi 2,3-butanadiol yang mengakibatkan penumpukan bahan dalam pertumbuhan. Penambahan 10 tetes 40% KOH dan 15 tetes 5% larutan
alphanapthol dalam etanol dapat menentukan adanya asetoin
(asetilmetilkarbinol), yaitu suatu senyawa pemuka dalam sintesis 2,3-butanadiol. Keberadaan asetoin ditunjukkan oleh perubahan warna kaldu menjadi merah muda. Hasil reaksi dapat terlihat paling lambat setelah 30 menit. Perubahan warna kaldu biakan akan lebih jelas pada bagian yang berhubungan dengan udara karena sebagian 2,3-butanadiol dioksidasikan kembali menjadi asetoin sehingga memperjelas hasil reaksi.
Uji sitrat dilakukan dengan menggunakan media Simmon’s citrate yang berbentuk padat dan berwarna hijau. Media sitrat merupakan medium sintetik dengan Na sitrat sebagai satu-satunya sumber karbon, NH4+ sebagai sumber N dan
brom thymol blue sebagai indikator pH. Koloni bakteri yang telah diambil dengan menggunakan ose kemudian digoreskan pada permukaan media dan diinkubasi pada suhu 37 °C selama 24-48 jam. Hasil uji positif diperlihatkan dengan perubahan warna media dari warna hijau menjadi biru. Hal ini menunjukan kemampuan dari bakteri yang diuji dalam menggunakan sitrat dari media sebagai satu-satunya sumber karbon (Lay 1994).
HASIL DAN PEMBAHASAN
Berdasarkan hasil pengamatan selama penelitian tentang identifikasi bakteri dan cacing parasitik pada insang dan saluran pencernaan ikan patin (Pangasius sp.) dengan menggunakan sepuluh sampel ikan patin, jenis–jenis bakteri dan cacing parasitik yang ditemukan adalah :
Tabel 1 Hasil Identifikasi Cacing Parasitik dan Bakteri pada Ikan Patin
Ikan Cacing (Jumlah) Bakteri
- Staphylococcus epidermidis Aeromonas sp.
Staphylococcus
Bakteri Pada Insang dan Saluran Pencernaan Ikan Patin
Edwardsiella tarda
Koloni bakteri yang tumbuh terpisah diamati kemudian diisolasi dan dilakukan serangkaian uji dan pengamatan sesuai dengan karakter Edwardsiella tarda yang merujuk pada Jang et al. (1976) dan Cowan & Steel (1990). Menurut Ismail et al. (2005) karakter definitif dari E. tarda adalah terbentuknya H2S dan indol positif selain karakater umumnya yang merupakan bakteri Gram negatif, aerob, negatif oksidase dan VP (Voges Proskauer).
Edwardsiella tarda ditemukan di insang dan saluran pencernaan ikan patin. Namun menurut Carter & Wise (2004) E. tarda biasa ditemukan pada traktus intestin hewan dan manusia serta air kolam. Keberadaan bakteri ini di insang kemungkinan berhubungan dengan habitatnya di air kolam yang sangat memberikan peluang bagi E. tarda hidup di insang yang merupakan salah satu organ yang memiliki kontak besar dengan air.
Edwardsiellosis/emphisemathous putrevactive disease of catfish (EPDC) atau Edwardsiella septicaemia (ES) merupakan penyakit akibat infeksi
Edwarsiella tarda pada ikan patin (Post 1987). Gejala klinis yang ditimbulkan oleh infeksi E. tarda pada tahap infeksi ringan hanya berupa luka–luka kecil di bagian kulit namun infeksi lebih lanjut menyebabkan luka bernanah pada otot dan lambung. Pada kasus akut luka bertambah besar dalam waktu cepat, berisi gas (H2S), berbentuk cembung dan menyebar ke seluruh tubuh. Gejala khas pada ikan patin ialah perdarahan pada organ viseral (Austin 1999). Hal ini sesuai dengan penelitian yang telah dilakukan Andriyanto et al. (2009), ikan patin yang dinfeksi
E. tarda menunjukkan gejala klinis berupa luka (ulser) dari muskular sampai pedunkel, perdarahan pada sirip dan anus, perut membesar, organ interna bengkak dan pucat serta ulser yang terjadi menimbulkan bau.
Edwardsiella tarda merupakan bakteri yang bersifat zoonotik. Infeksi E. tarda pada manusia dapat menyebabkan gastroenteritis, diare, peritonitis dengan sepsis dan selulitis serta pada infeksi ekstra intestinal dapat menyebabkan penyakit menyerupai tifus (Woo & Bruno 1999).
pemeliharaan ikan. Jika infeksi berlanjut dapat dilakukan pengobatan dengan menggunakan terramycin, oxytetracyclin dan sulfonamid (Bullock & Herman 1985).
Aeromonas sp.
Gambar 18 Pewarnaan Gram Aeromonas sp. pada Saluran Pencernaan Ikan Patin.
Hasil koloni yang tumbuh terpisah diamati dan diisolasi serta dilakukan serangkaian uji sesuai dengan karakter Aeromonas sp. yang merujuk pada Jang et al. (1976) dan Cowan & Steel (1990). Bakteri Aeromonas diklasifikasikan ke dalam filum Protophyta, kelas Schizomycetes, ordo Pseudanonadeles, famili Vibrionaceae, genus Aeromonas dan spesies Aeromonas sp. (Holt et al. 1998).
Aeromonas sp. ditemukan di insang dan saluran pencernaan ikan patin. Menurut Songer dan Post (2005) Aeromonas sp. dapat ditemukan di air, tanah dan feses. Namun secara lebih spesifik Noga (1996) menjelaskan bahwa bakteri ini banyak terdapat di air tawar yang mengandung banyak bahan organik dengan kadar salinitas rendah. Selain itu Aeromonas sp. dapat ditemukan di permukaan tubuh dan organ dalam ikan. Hal ini menguatkan pernyataan Songer dan Post pada tahun 2005 bahwa Aeromonas sp. dapat menyebabkan infeksi dengan tingkat mortalitas yang tinggi pada satwa aquatik.
Aeromonas hydrophila merupakan salah satu spesies dari genus
Aeromonas yang menyebabkan penyakit motile aeromonad septicaemia/motile
infeksi dengan gejala klinis dan manifestasi lesio pada kulit dan otot di daerah bawah kulit dan infeksi laten septicaemia tanpa gejala klinis eksternal, melainkan internal berupa oedema, hemoragi dan nekrosis (Woo 2006). Muslim dan Widjayanti (2009) menyatakan bahwa ikan patin yang diinfeksi dengan A. hydrophila menampakkan gejala klinis berupa pergerakan ikan lambat, produksi mukus yang berlebihan, mata cekung, insang pucat, perut kembung, terdapat bintik–bintik merah pada seluruh permukaan tubuh, mulut kemerahan, ekor geripis dan bila dibedah terdapat cairan berwarna kuning kehitaman.
Aeromonas sp.juga dapat menginfeksi beberapa jenis vertebrata termasuk
katak, kura-kura dan manusia. Berdasarkan laporan yang tercatat, infeksi
Aeromonas sp. pada manusia dapat menyebabkan gangguan gastrointestinal dan infeksi yang bersifat sistemik (Noga 1996). Beberapa strain dari A. hydrophila
dapat menyebabkan kasus enteropathogenic, khususnya pada anak – anak, orang tua dan penderita immunocompromised (rusaknya imun akibat infeksi patogen) (Trower et al. 2000).
Vibrio cholerae
Gambar 19 Pewarnaan Gram Vibrio cholerae pada Insang Ikan Patin
Vibrio cholerae merupakan agen dari penyakit cholera pada manusia. Transmisi dari bakteri ini melalui air yang terkontaminasi feses. Dulu V. cholerae
hanya mampu hidup di dalam tubuh dan feses manusia namun sekarang V. cholerae telah hidup bebas di alam dan memiliki reservoar alamiah. V. cholerae
juga dapat diisolasi dari udang, kerang, remis, dan kepiting (Lesmana 2004).
V. cholerae memiliki kapsul polisakarida, lipopolisakarida, pili dan menghasilkan toksin. Toksin yang dihasilkan oleh V. cholerae mirip dengan toksin yang dihasilkan oleh Escherichia coli. Toksin ini memiliki dua subunit, yaitu subunit A dan B. Subunit B merupakan media untuk masuknya subunit A yang dapat mengaktifkan adenylat cyclate cellular, sehingga terjadi akumulasi cAMP dan hipersekresi dari elektrolit dan cairan (Post & Songer 2005).
V. cholerae bukan merupakan bakteri patogen yang umum ditemukan pada ikan patin. Menurut Noga (1996) hanya ada satu laporan dari negara Jepang tentang infeksi V. cholerae pada ikan. Keberadaan bakteri ini pada sampel ikan patin yang diteliti kemungkinan berhubungan dengan air yang terkontaminasi oleh bakteri V. cholerae. Spesies Vibrio yang bersifat patogen pada ikan diantara
Vibrio anguillarum, V. ordalii, V. damsela, V. carchariae, V. alginolyticus dan V.
Escherichia coli
Gambar 20 Pewarnaan Gram Escherichia coli pada Saluran Pencernaan Ikan Patin
Menurut Songer dan Post (2005) E. coli merupakan bakteri Gram negatif yang berukuran medium hingga panjang sekitar 0.4-0.7 µm dan 1-3 µm, tunggal dan berpasangan. E. coli bersifat oksidasi negatif, motil dan katalase positif. Hampir semua spesies E. coli mampu menghasilkan asam dan gas dari fermentasi glukosa. E. coli merupakan flora normal pada saluran pencernaan sehingga dapat diisolasi pada feses, selain itu dapat ditemukan di lingkungan seperti air dan tanah. Hal ini sesuai dengan hasil penelitian, dimana E. coli ditemukan di saluran pencernaan. Hampir semua strain E. coli bersifat low pathogenic tapi ada beberapa strain dari E. coli bersifat high patogen dan bersifat opportunis infeksi diantaranya Enterotoxigenic E.coli (ETEC), Enteropathogenic E. coli (EPEC),
Enterohemorragic E. coli (EHEC), Enteroaggregative E. coli (EAEC),
Enteroinvasife E. coli (EIEC) dan Difuse Adhering E. coli (DAEC) (Bhunia 2008).
Bacilllus sp.
Bacilllus sp. merupakan bakteri Gram positif yang berbentuk batang yang berukuran medium hingga panjang. Bakteri ini dapat hidup secara aerob dan anaerob fakultatif. Hampir semua spesies dari dari Bacilllus sp. bersifat katalase positif dan motil. Ciri khas dari Bacilllus sp. ialah memiliki spora yang terlihat jelas dengan menggunakan pewarnaan Gram. Bacilllus sp. hidup di lingkungan seperti di tanah (Songer & Post 2005). Selama dilakukan penelitian Bacilllus sp. ditemukan di insang dari ikan, hal ini mungkin berhubungan dengan kontaminasi air oleh tanah sekitar yang tercemar Bacilllus sp.
Bacilllus sp. memiliki lebih dari 40 jenis spesies, tetapi hanya beberapa diantaranya yang bersifat patogen. Beberapa spesies yang bersifat patogen diantaranya Bacillus cereus dapat menyebabkan gangrenous mastitis pada sapi dan terkadang menyebabkan aborsi pada sapi, domba dan kuda. Bacillus licheniformis dapat menyebabkan aborsi pada sapi. Spesies yang paling bersifat patogen adalah B. anthracis yang dapat menyebabkan penyakit anthrax yang paling sering menyerang domestic dan wild ruminan serta kuda (Songer & Post 2005).
Streptococcus sp.
Gambar 22 Pewarnaan Gram Streptocoocus sp. pada Insang Ikan Patin
H2O2 3%. Hal ini mengindikasikan bahwa Streptococcus sp. tidak menghasilkan enzim katalase sehingga tidak ada reaksi yang terjadi (Lay 1994).
Streptococcus sp. merupakan bakteri Gram negatif yang berbentuk bulat memiliki sifat fakultatif anaerob, katalase positif, tidak berspora dan tidak motil. Habitat dari Streptococcus sp. tergantung jenis dari bakterinya, selain itu bakteri ini banyak di lingkungan sehingga dapat mengkontaminasi air dan tanah.
Streptococcus sp.yang bersifat patogen pada hewan dibagi kedalam grup A, B, C, D, E, G, L dan V. Selain dibagi kedalam beberapa grup seperti yang dijelaskan sebelumnya, Streptococcus sp. juga dibagi ke dalam dua grup yaitu β-hemolytic
Streptococcus (S. pyogen, S. agalctiae, S. canis, S. porcinus dan lain – lain) dan
non β-hemolytic Streptococcus (S. pneumoniae, S. equinus, S. suis dan S. uberis) (Songer & Post 2005).
S. agalactiae merupakan spesies yang bersifat patogen pada ikan air tawar, namun kasusnya jarang terjadi pada ikan patin tetapi sering ditemukan pada ikan nila dengan gejala klinis berupa exophtalmia, meningoencepalitis, vakuolisasi dan nekrosis sel – sel hati serta nekrosis dan kongesti limpa (Lusiastuti2010).
Staphylococcus epidrmidis
Gambar 23 Pewarnaan Gram Staphylococcus sp. Pada Insang Ikan Patin
Bakteri Gram positif yang berbentuk bulat dapat dibagi kedalam dua grup yaitu grup katalase positif yang merupakan famili Micrococcaceaea (genus
ditemukan pada spesimen klinik hewan. Beberapa spesies Staphylococcus yang penting di dunia kedokteran hewan adalah S. aureus, S. epidermidis, S. warneri, S. saprophyticus, S. kloosii, S. intermedius, S. hycus dan lain – lain (Songer & Post 2005).
S. epidermidis tidak bersifat patogen pada ikan patin. Namun menurut Baehaki (2005) ada strain S. epidermidis yang menghasilkan protease yang bersifat toxic tetapi belum diketahui dapat menginfeksi ikan patin atau tidak. Selain itu Sutrisno dan Purwandari (2004) menginjeksikan Staphylococcus sp. secara intraperitoneal pada ikan nila menunjukkan gejala klinis berupa abdomen membesar, berisi cairan, insang pucat, ekor nekrosis, dorsal erosi, lesu, berenang di permukaan dan pada posisi lateral tubuh. Injeksi buatan dari Staphylococcus sp. ini menyebabkan kematian pada 80% sampel.
Cacing Parasitik pada Insang dan Saluran Pencernaan Ikan Patin
Dactylogyrus sp.
Gambar 24 Cacing Dactylogyrus sp
Keterangan gambar : 1. Kepala; 2. Badan; 3. Ekor; a. Organ Kepala; b. Mata; c. Pharynx; d. Ovarium; e. Dorsal Anchor; f. Dorsal Bar; g.
Dactylogyrus sp. memiliki panjang tubuh 0.7 mm, lebar tubuh 0.18 mm dan 2 buah spot mata yang terlihat. Menurut Noga (1996) Dactylogyrus sp memiliki panjang tubuh rata – rata 0.3 – 2 mm. Menurut Bychowsky (1961)
Dactylogyrus sp. dewasa memiliki panjang tubuh sekitar 2-5 mm untuk spesies yang berukuran sedang dan >5 mm untuk spesies yang berukuran besar.
Dactylogyrus sp. memiliki 2 pasang kait besar pada bagian posteriodorsal (dorsal anchor) yang dihubungkan oleh dorsal bar. Pada bagian pinggir dari dorsal anchor terdapat 14 kait kecil (marginal hook) yang memilki ukuran yang bervariasi. Selanjutnya Bychowsky (1961) menjelaskan bahwa Dactylogyrus sp. merupakan parasit yang bersifat hermaprodit yang memiliki ovarium dan testis sekaligus. Sesuai dengan Gambar 24 terlihat bentuk organ ovarium namun organ testis tidak terlalu jelas.
Dari sepuluh sampel yang digunakan, semuanya menunjukkan hasil positif terhadap keberadaan Dactylogyrus sp. pada organ insang. Dactylogyrus sp. termasuk ke dalam jenis ektoparasit yang hidup di insang ikan. Parasit ini bersifat patogen bagi ikan–ikan air tawar (Abdullah 2009).
Dactylogyrus sp. dewasa melepaskan telur ke lingkungan. Telur akan berkembang menjadi oncomirasidia yang dilengkapi dengan kait–kait halus sehingga oncomirasidia dapat melekat pada bagian tubuh ikan terutama insang.
Oncomirasidia tumbuh dewasa di tubuh inang dan kembali menghasilkan telur (Noga 1996).
Infeksi Dactylogyrus sp. pada ikan menyebabkan meningkatnya sekresi mucus, warna kulit menjadi gelap, epitel insang hiperplasia, insang pucat dan hemoragi pada kulit. Keberadaan Dactylogyrus sp. dapat menyebabkan luka pada kulit dan insang sehingga dapat mengundang datangnya bakteri dan menyebabkan infeksi sekunder. Tingkat mortalitas akibat infeksi Dactylogyrus sp. bergantung pada jumlah populasi dan imunitas dari inang. Semakin banyak jumlah populasi dan semakin rendah imunitas maka tingkat mortalitas akan semakin meningkat, begitu pula sebaliknya (Woo et al. 2002).
Tindakan utama yang dapat dilakukan untuk mencegah infeksi oleh
Dactylogyrus sp. adalah dengan perbaikan pakan dan kualitas lingkungan
ikan oleh Dactylogyrus sp. dapat diatasi dengan pemberian anthelmintik seperti
mebendazole dan praziquantel selain itu dapat juga menggunakan formalin atau organophospat dan potasium permanganat (Woo 2006).
Pseudodactylogyrus sp.
Gambar 25 Cacing Pseudodactylogyrus sp.
Pseudodactylogyrus sp. masih termasuk ke dalam famili Dactylogyrydae. Parasit ini memiliki bentuk tubuh yang sangat mirip dengan Dactylogyrus sp. tetapi Pseudodactylogyrus sp. memiliki haptor atau kait pada bagian
posterioventral tubuh yang terdiri dari 2 pasang ventral anchor yang dihubungkan oleh ventral bar (Hoffman). Pseudodactylogyrus sp. memiliki marginal hook atau kait kecil yang letaknya tidak beraturan. Parasit ini memiliki panjang tubuh bervariasi sekitar 0.45-0.99 mm. Pseudodactylogyrus sp. merupakan parasit yang bersifat hermaprodit sehingga memilki ovarium dan testis sekaligus di dalam tubuhnya. Sesuai dengan Gambar 25, organ ovarium terlihat jelas namun organ testis tidak terlalu jelas.
Pseudodactylogyrus bini dan P. angillae merupakan spesies yang sering menyebabkan infeksi pada ikan air tawar. Infeksi menunjukkan gejala klinis berupa hyperemi pada kulit dan insang, peningkatan sekresi mukus, dekstruksi dari struktur insang, terkadang muncul hemoragi dan hyperplasia epitel insang (Buchmann 1987).
KESIMPULAN DAN SARAN
Kesimpulan
1. Bakteri yang ditemukan pada saluran insang adalah Edwardsiella tarda,
Aeromonas sp., Streptocoocus sp. Staphylococcus epidermidis, Vibrio
cholerae, dan Bacilllus sp. Bakteri yang ditemukan pada saluran pencernaan adalah Edwardsiella tarda, Aeromonas sp., Streptocoocus sp. Staphylococcus epidermidis dan Escheriachia coli.
2. Cacing parasitik yang ditemukan pada insang adalah Dactylogirus sp. dan
Pseudodactylogyrus sp. Pada saluran pencernaan tidak ditemukan cacing parasitik.
3. Jenis bakteri yang terdapat pada insang dan saluran pencernaan ikan patin tidak jauh berbeda yaitu dari 7 spesies yang ditemukan 4 diantaranya ada di kedua organ yaitu Edwardsiella tarda, Aeromonas sp., Streptocoocus sp. dan
Staphylococcus epidermidis. Sedangkan Vibrio cholerae, dan Bacilllus sp. hanya ditemukan di insang dan Escheriachia coli hanya ditemukan di saluran pencernaan.
4. Dua spesies bakteri yang ditemukan bersifat patogen pada ikan patin dan bersifat zoonotik yaitu E. tarda dan Aeromonas sp.
Saran
1. Pada budidaya ikan patin agar dapat lebih memperhatikan dan meningkatkan manajemen kesehatan dari ternak ikan diantaranya dengan meningkatkan kualitas pakan dan lingkungan terutama air, sehingga faktor stres dan imunosupresi yang menjadi pemicu penyakit dapat dikurangi.
DAFTAR PUSTAKA
Abdullah SMA. 2009. Additional records of Dactylogyrus (Monogenea) from some Cyprinid fishes from Darbandikhan lake, Iraq. Jorda J of Bio Sci
2:145-150.
Akbar J. 2001. Identifikasi parasit pada ikan Betok (Anaba testudius).
Bioscientiae 8:36-45.
Amri K,Khairuman. 2008. Buku Pintar Budi Daya 15 Ikan Konsumsi. Jakarta:PT AgroMedia Pustaka.
Andriyanti S. et al. 2009. Deteksi Edwarsiella tarda secara immunohistokimia pada ikan patin (Pangasius Pangasius). Indones J of Vet Sci & Medicine
1:7-12.
Anonim. 2012. Aeromonas Hydrophila. [terhubung berkala]. http://www.gopetsamerica.com/bio/bacteria/aeromonas-hydrophila.aspx. [4 September 2012].
Anshary H. 2008. Modul Pembelajaran Berbasis Student Center Learning (SCL). Mata Kuliah Parsitologi Ikan Fakultas Ilmu Kelautan Perikanan Universitas Hassanudin.
Baehaki et al. 2005. Karakteristik protease dari bakteri patogen Staphylococcus Aureus.Buletin Teknologi Hasil Perairan III:2.
Bhunia AK. 2008. Foodborne Microbial Pathogens: Machanisms and Pathogenesis. New York: Springer Science & Business Media, LLC. Bullock GL, Herman RL. 1985. Edwardsiella Infection of Fishes. Washington.
National Fish Health Research Laboratory.
Chandra AA et al. 2007. Potensi anthelmintik akar tanaman Putri Malu(Mimosa Jakarta:PT. Rineka Cipta dan PT. Bina Adikarsa.
Hamilton. 1822. Pangasius pangsius. [terhubung berkala]. http://www.fishbase.org/summary/Pangasius-pangasius.html. [2 April 2012].
Holt JG et al. 1998. Bergey’s Manual of Determinant Bacteriology Ninth
Edition.Wiliam and Wilkins A.Waterly Company USA.
Irianto A. 2005. Patologi Ikan Teleostei. Yogyakarta:Gajah Mada University Press.
Ismail SGM et al. 2005. Studies on Edwardsiella infection in Oreocrhomis nilocatus. Egyptian J of Aquatic Research 31:460-471.
Jang SS, EL Biberstein, DC Hirsh. 1976. A Manual of Veterinary Clinical Bacteriology and Mycology. Davis: University of California.
Khairunnisa. 2007. Minyak cengkeh (Eugenia aromatica) dan Kalium Hidroksida 10% Sebagai Bahan Pewarna Semi Permanen pada Cacing Nematoda
Dan Acanthocephala Ikan Air Laut [Skripsi]. Bogor: FakultasKedokteran
Hewan, Institut Pertanian Bogor.
Krisno A. 2011. Anatomi dan Morfologi Bakteri, Virus dan Jamur.[terhubung berkala]. http://aguskrisnoblog.wordpress.com/2011/01/14/anatomi-dan-morfologi-bakteri-jamur-virus/. [26 Mei 2012].
Lay, BW. 1994. Analisis Mikroba di Laboratorium. Jakarta:PT. Raja Grafindo. Lesmana M. 2004. Perkembangan mutakhir infeksi Kolera. Jurnal Kedokteran
Trisakti 23:101-109.
Lusac JS, Southgate PC. 2012. Aquaculture. UK : Willey Publishing Science. Lusiastuti AM, Hadie W. 2010. Penggunaan Vaksin Aeromonas : Pengeruhnya
hypopthalmus). Berita Biologi Balai Riset Perikanan Budidaya Air Tawar Bogor 10(2).
Mahardika KZ, 2004. Infeksi Iridovirus Pada JuvenilKerapu Bebek (Cromileptes
altivelis) Di Karamba Jaring Apung.Balai Besar Riset Perikanan Budidaya
Laut Gondol. Bali. Prosiding. Pengendalian Penyakit Pada Ikan DanUdang berbasis Imunisasi Dan Biosecurity.
Muslim HM. 2005. Parasitologi Keperawatan. Jakarta: Penerbit buku kedokteran ECG.
MuslimMPH, Widjajanti H. 2009. Penggunaan ekstrak bawang putih (Alium sativum) untuk mengobati benih Patin Siam (Pangasius hypophtalmus) yang terinfeksi bakteri Aeromonas Hydrophila. J Akuakultur Indones.8:91-100. Noga EJ. 1996. Fish Disease. USA:Iowa State Press.
Post G . 1987. Text Book of Fish Health. T.F.H. Publication Isnc:31 - 37.
Saanin H. 1968. Taksonomi dan Kunci Identifikasi Ikan Jilid I dan II. Bandung:Bina Cipta
Songer G, Post KW. 2005. Veterinary Microbiology. North Carolina:Elsevier Sauners.
Soulsby EJL. 1982. Helmints, Athropods and Protozoa of Domesticated Animals. Edisi ke-7. London: Bailiere-Tindall.
Subarijati HU. 2008. Inventarisasi jenis–jenis ikan air tawar dan air laut di Jawa Timur. Jurnal penelitian perikanan 11:7–12.
Susanto H. 2009. Budi Daya Ikan di Pekarangan. Depok:Penebar swadaya. Sutrisno B, Purwandari KY. 2004. Lesi patologik organ dan jaringan Ikan Nila
(Oerochromis niloticus) yang diinfeksi bakteri Staphylococcus sp. J Sain Vet XXII (1).
Tucker CS, Hargreaves JA. 2006. Biology And Culture of Channel Catfish. USA: Esevier.
Todar K. 2012. Pseudomonas aeruginosa. [terhubung berkala]. http://textbookofbacteriology.net/pseudomonas.html. [26 Mei 2012]. Trower CJ et al. 2000. Bacterial pathogenicity: production of an enterotoxin by a
Wargasasmita S. 2002. Ikan Air Tawar Endemik Sumatera yang Terancam Punah.
J Iktiologi Indones 2:41-49.
Woo PTK. 2006. Fish Disease and Disorder 2nd Edition. UK:CABI.
Woo PTK, Bruno DW. 1999. Fish Disease and Disorder Volume 3.UK:CABI Publishing.