1.1 Latar Belakang
Isu keamanan pangan saat ini menjadi isu yang penting bagi dunia industri
pangan. Dinamika pasar pangan internasional yang begitu ketat mengharuskan
produsen pangan memperhatikan prosedur dan tata aturan yang berlaku di dunia
pangan internasional. Kemananan pangan merupakan salah satu isu yang paling
penting karena berhubungan langsung pada kesehatan manusia. Pelanggaran
terhadap keamanan pangan dapat menyebabkan suatu kasus yang dinamakan
foodborne diseases, atau penyakit yang disebabkan oleh keracunan pangan.
Penyakit keracunan pangan ini disebabkan oleh bahaya biologis, kimiawi
dan fisik. Bahaya biologis umumnya disebabkan oleh mikroba patogen, fungi,
virus, prion, protozoa, parasit helmintis. Bahaya kimiawi termasuk di dalamnya
alergen, mikotoksin, logam berat, pestisida, bahan kimia saniter dan pembersih
Bahaya biologis dapat dicegah dengan penambahan bahan preservatif pada
pangan dengan tujuan membunuh atau menghambat bakteri patogen seperti
Bacillus cereus dan Staphylococcus aureus. Bahan preservatif juga mampu
menimbulkan potensi bahaya kimia karena bahan preservatif yang digunakan
berasal dari bahan kimia sintetis yang berpotensi sebagai karsinogen (Wallace et
al. 2011). Pencegahan terhadap penggunaan preservatif sintetis adalah
penggunaan biopreservatif.
Biopreservatif digunakan sebagai bahan pengawet pangan alami yang
berasal dari mikroba seperti bakteri asam laktat. Berbagai jenis bakteri asam laktat
telah diketahui dan digunakan sebagai biopreservatif alami karena zat metabolit
sekunder yang dihasilkannya yang cenderung tidak berbahaya dan memiliki efek
inhibitor pada bakteri lain seperti inhibitor pada bakteri enteropatogenik (Theron
dan Lues 2011). Bakteri asam laktat juga diketahui memiliki kemampuan
menghambat bakteri Salmonella yang bersifat enteritidis (Higgins et al. 2007).
Bakteri asam laktat biasa ditemukan pada produk makanan fermentasi,
dimana produk fermentasi masih banyak diproduksi di Indonesia. Salah satu
produk fermentasi perikanan di Indonesia adalah bekasam. Bekasam merupakan
banyak dikenal di daerah Jawa Tengah dan Sumatera Selatan. Bekasam dibuat
dari ikan air tawar atau laut yang difermentasi spontan oleh mikroba alami selama
satu sampai dua minggu. Pengolahan bekasam di daerah Kalimantan Selatan
umumnya dikenal dengan nama samu. Bahan baku berupa ikan gabus, betok,
sepat siam, dan sepat rawa dengan penambahan garam sekitar 15 – 20% dan
ditambahkan samu atau beras gingseng sebanyak 15%, kemudian difermentasi
kurang lebih satu minggu sampai menghasilkan aroma dan rasa yang khas
bekasam (Adawyah 2007). Makanan yang pengolahannya serupa dengan bekasam
ditemukan di Thailand, yang dikenal dengan nama plaa-som. Menurut
Kopermsub dan Yunchalard (2010), fermentasi yang terjadi selama proses
pembuatan akan mengubah rasa, aroma, dan tekstur. Nilai pH produk yang
menurun akan menjamin kualitas dan keamanan.
Pengolahan bekasam di Indonesia merupakan pengolahan hasil perikanan
secara tradisional yang masih banyak ditemukan. Persentasi penggunaan teknologi
tradisional ini adalah sekitar 49% dari total keseluruhan konsumsi ikan Negara per
kapital per tahun, dimana 30,5% dari total tersebut diolah secara tradisional
menggunakan teknik penggaraman dan fermentasi (Astawan 1997). Besarnya
produksi pengolahan perikanan tradisional berbasis fermentasi seperti bekasam
inilah yang merupakan potensi besar yang perlu dikaji lanjut untuk mengetahui
adanya kandungan senyawa antibakteri hasil produksi bakteri asam laktat yang
terdapat pada produk tersebut.
1.2 Tujuan
Penelitian ini bertujuan untuk mempelajari potensi senyawa antibakteri yang
dihasilkan oleh isolat bakteri asam laktat NS(9) yang diisolasi dari bekasam ikan
nila (Oreochromis niloticus) dan memproduksi senyawa antibakteri dari isolat
NS(9) serta menghitung daya hambat maksimum senyawa yang dihasilkan dari
2.1 Ikan Nila (Oreochromis niloticus)
Ikan nila (Oreochromis niloticus) merupakan jenis ikan yang diintroduksi
dari luar negeri, ikan tersebut berasal dari Afrika bagian timur di Sungai Nil,
Danau Tangayika, Chad, Nigeria dan Kenya, lalu dibawa oleh orang ke Eropa,
Amerika, negara-negara Timur Tengah dan Asia. Benih ikan nila di Indonesia
secara resmi didatangkan dari Taiwan oleh Balai Penelitian Perikanan Air Tawar
tahun 1969 (Suyanto 2003). Habitat ikan nila adalah di aliran sungai dan danau.
Ukuran maksimalnya adalah 60 cm. Ikan nila diklasifikasikan menurut Saanin
(1984) sebagai berikut :
Filum : Chordata
Sub Filum : Vertebrata
Kelas : Osteichthyes
Sub Kelas : Acanthoptherigii
Ordo : Perchomorphi
Sub Ordo : Percoidea
Famili : Cichlidae
Genus : Oreochromis
Spesies : Oreochromis niloticus
Ikan nila memiliki ciri morfologi, seperti berjari-jari keras, sirip perut
torasik, letak mulut subterminal dan berbentuk meruncing. Selain itu, tanda
lainnya yang dapat dilihat dari ikan nila adalah warna tubuhnya hitam dan agak
keputihan. Bagian bawah tutup insang berwarna putih, sedangkan pada nila lokal,
putih agak kehitaman bahkan ada yang kuning. Sisik ikan nila besar, kasar dan
tersusun rapi. Sepertiga sisik belakang menutupi sisi bagian depan. Tubuhnya
memiliki garis linea lateris yang terputus antara bagian atas dan bawahnya. Linea
lateralis bagian atas memanjang mulai dari tutup insang hingga belakang sirip
punggung sampai pangkal sirip ekor. Ukuran kepalanya relatif kecil dengan mulut
berada di ujung kepala serta mempunyai mata yang besar (Kottelat et al. 1993).
2.2 Fermentasi Ikan
Fermentasi ikan adalah teknologi tradisional yang digunakan untuk
mengawetkan biota air tawar dan laut, yang sangat mudah membusuk,
terlokalisasi dalam produksi, dan fluktuatif per musimnya dalam penangkapannya
(Campbell-Platt 2009). Fermentasi ikan merupakan salah satu metode penerapan
proses fermentasi pada produk perikanan. Fermentasi adalah proses yang
mikroorganisme seperti bakteri lakukan untuk mengubah substansi di dalam ikan,
seperti gula menjadi alkohol dan asam (contohnya asam laktat) dan memproduksi
substansi rasa seperti ester atau keton. Normalnya, fermentasi terjadi tanpa
keberadaan oksigen. Tujuan fermentasi ikan itu sendiri antara lain mengawetkan
ikan, membuat substansi rasa baru, atau mengubah tekstur (Mouritsen dan
Mouritsen 2009).
Fermentasi yang terjadi pada produk ikan hasil fermentasi antara lain
adalah fermentasi asam laktat. Fermentasi asam laktat dapat terjadi sebagai akibat
aktivitas bakteri asam laktat yang dibedakan menjadi dua kelompok, yaitu bakteri
asam laktat homofermentatif dan heterofermentatif. Proses fermentasi dikatakan
bersifat homofermentatif jika hanya menghasilkan satu jenis komponen saja
sebagai hasil utamanya; dan heterofermentatif jika menghasilkan campuran
berbagai senyawa atau komponen utama. Bakteri asam laktat yang tergolong
asam laktat. Karbondioksida dan asam-asam volatil lainnya juga dihasilkan, tapi
jumlahnya sangat kecil (Adawyah 2007).
Produk fermentasi ikan di belahan dunia ini masih banyak ditemukan dan
beberapa diantaranya merupakan makanan favorit di daerahnya masing-masing.
Patis dan bagoong merupakan makanan fermentasi ikan di Filipina. Produk
fermentasi dari ikan herring berasal dari Eropa (Hall 2010).
2.3 Bekasam
Bekasam merupakan produk olahan ikan dengan cara fermentasi yang
rasanya asam. Olahan tersebut banyak dikenal di daerah Jawa Tengah dan
Sumatera Selatan. Ikan yang dapat digunakan sebagai bekasam merupakan jenis
ikan air tawar. Pengolahan bekasam di daerah Kalimantan Selatan umumnya
dikenal dengan nama samu. Bahan baku berupa ikan gabus, betok, sepat siam dan
sepat rawa dengan penambahan garam sekitar 15-20%, dan ditambahkan samu
atau beras ginseng sebanyak 15%, kemudian difermentasi kurang lebih satu
minggu sampai menghasilkan aroma dan rasa yang khas bekasam (Adawyah
2007).
2.4 Bakteri Asam Laktat (BAL)
Bakteri asam laktat meliputi grup heterogen dari mikroorganisme yang
memiliki properti metabolik dari produksi asam laktat sebagai mayoritas produk
akhir dari fermentasi karbohidrat. Bakteri asam laktat adalah kelompok bakteri
Gram positif, tidak membentuk spora, katalase negatif, toleran terhadap asam, dan
fakultatif anaerob. Kecuali untuk beberapa spesies, golongan BAL bersifat non
patogen dengan reputasi GRAS (Generally Recognized as Safe). Bakteri asam
laktat termasuk di dalamnya bakteri homofermentatif yang memproduksi sebagian
besar utamanya adalah asam laktat, dan heterofermentatif yang selain
memproduksi asam laktat juga memproduksi variasi yang luas dari produk
fermentasi seperti asam asetat, etanol, karbon dioksida, dan asam format. Spesies
tipikal BAL antara lain termasuk kedalam genera Lactobacillus, Lactococcus,
Streptococcus, Pediococcus, Oenococcus, Enterococcus, dan Leuconostoc (Mozzi
2.4.1 Senyawa antibakteri yang dihasilkan oleh bakteri asam laktat
Berbagai jenis bakteri asam laktat telah diketahui dan digunakan sebagai
biopreservatif alami karena zat metabolit sekunder yang dihasilkannya yang
cenderung tidak berbahaya dan memiliki efek inhibitor pada bakteri lain seperti
inhibitor pada bakteri enteropatogenik. Efek inhibitor utama dispekulasikan pada
jalur metabolisme utama bakteri asam laktat, yang berarti jalur fermentasi. Bakteri
asam laktat menggunakan jalur fermentasi untuk menghasilkan energi selular dan
memproduksi asam oganik dimana pun mereka tumbuh. Hal ini juga
mengakibatkan penurunan pH pada media di sekitar tempat pertumbuhannya
(Theron dan Lues 2011).
Asam laktat merupakan salah satu metabolit utama dari bakteri asam
laktat, namun pada bakteri heterofermentatif, bakteri asam laktat juga
memproduksi asam asetat dan sebagian asam propionat dalam jumlah besar.
Bakteriosin juga diproduksi oleh bakteri asam laktat sebagai substansi inhibitor
bagi mikroba lain. Asam organik memicu aktivitas bakteriosin, sedangkan
asidifikasi (pengasaman) yang diakibatkan asam organik meningkatkan aktivitas
antibakterial baik asam organik maupun substansi inhibitor lain seperti bakteriosin
(Theron dan Lues 2011).
2.4.1.1 Asam organik
Asam organik adalah tipe produk hasil metabolisme mikroorganisme.
Asam organik adalah komponen organik dengan kelengkapan asam dan
mengandung karbon, seperti komponen organik lainnya. Asam organik yang
paling umum adalah asam karboksilat yang asiditasnya diasosiasikan dengan
gugus karboksilnya –COOH. Asam jenis ini tergolong asam lemah dan tidak larut
sempurna dalam air (kecuali asam format dan asam asetat). Kebanyakan asam
organik memiliki keuntungan karena ukurannya yang relatif kecil sehingga dapat
bergerak dengan bebas antara sel dengan sel (Theron dan Lues 2011). Struktur
umum asam organik dapat dilihat pada Gambar 2.
Berbagai jenis asam organik beserta komponennya digunakan sebagai
bahan tambahan pangan (food additives) yang dapat dimasukkan secara langsung
pada makanan manusia. Asam organik lemah memiliki sejarah yang cukup
organik ini faktanya adalah preservatif yang paling umum digunakan dalam
makanan, GRAS, memiliki spektrum yang luas sebagai agen antibakteri. Asam
organik efektif untuk mengawetkan makanan karena selain aktivitas antibakteri,
mereka juga bertindak sebagai penambah rasa asam (acidulants) dan dengan
demikian mengurangi pertumbuhan bakteri dengan menurunkan pH dari produk
makanan ke tingkat keasaman yang menghambat pertumbuhan bakteri (Theron
dan Lues 2011).
Gambar 2 Struktur umum dari asam organik (Theron dan Lues 2011).
Asam organik yang biasanya diasosiasikan dengan bakteri asam laktat
adalah asam laktat, asam propionat, dan asam asetat yang diproduksi dalam
jumlah yang kecil. Asam laktat telah menunjukkan adanya aktivitas antibakteri
melawan bakteri pembentuk spora, akan tetapi memiliki efek yang kecil terhadap
fungi. Asam asetat dan asam propionat secara umum menghambat pertumbuhan
bakteri lain lebih efektif daripada asam laktat sejak nilai pKa yang lebih tinggi
dapat menyebabkan kemungkinan berdifusi melalui membran sel lain pada pH
yang lebih tinggi. Keduanya telah digunakan secara luas dalam industri pangan
sebagai aditif antibakteri. Selain itu telah ditunjukkan pula bahwa asam propionat
lebih efektif menghambat fungi daripada asam asetat (Mayo dan van Sinderen
2010).
Asam laktat mampu melemahkan permeabilitas bakteri Gram negatif
dengan merusak membran luar bakteri Gram negatif. Asam laktat merupakan
bakteri Gram negatif melalui protein porin pada membran luarnya. Pelindung dari
permeabilitas membran luar berupa lapisan lipopolisakarida yang terletak pada
permukaan membran dirusak oleh asam laktat sehingga substrat antibakteri yang
lain yaitu diasetil, bakteriosin, hidrogen peroksida dan lactoperidase system dapat
berpenetrasi ke dalam membran sitoplasma (Pelaez dan Orue 2010).
Gambar 3 Struktur kimia D-asam laktat (C3H6O3)
(Theron dan Lues 2011).
Selain memaksa zat antibakteri lain masuk, aktivitas antibakteri asam
organik seperti asam laktat juga memiliki perannya tersendiri. Asam yang masuk
melalui plasma membran sel akan terdisosiasi menjadi kation dan anion toksik.
Membran sel akan luruh dan menyebabkan transportasi sel terganggu. Selain itu
aktivitas air bebas (water activity) dan metabolisme sel seperti glikolisis
terganggu (Theron dan Lues 2011). Struktur kimia asam laktat dapat dilihat pada
Gambar 3.
2.4.1.2 Hidrogen peroksida
Hidrogen peroksida (H2O2) diproduksi oleh bakteri asam laktat sebagai
hasil dari aksi flavoprotein oksidase atau nikotinamida adenin dinukleotida
(NADH) peroksidase. Efek antibakteri dari H2O2 adalah hasil dari oksidasi grup
sulfohydryl yang menyebabkan denaturasi sejumlah enzim, dan dari peroksidase
membran lipid meningkatkan permeabilitas membran (Kong dan Davison 1980
diacu dalam Ammor et al. 2006). Senyawa H2O2 dapat juga digunakan sebagai
prekursor untuk produksi bakterisidal radikal bebas seperti superoksida (O2-) dan
radikal hidroksil (OH-) yang dapat merusak DNA (Byczkowski dan Gessner 1988
2.4.1.3 Karbon dioksida
Karbon dioksida diproduksi terutama oleh BAL heterofermentatif. CO2
memainkan peranan penting dalam membuat lingkungan anaerobik yang
menghambat enzimatik dekarboksilase, dan akumulasi CO2 membran lipid bilayer
dapat menyebabkan disfungsi permeabilitas (Eklund 1984 diacu dalam Ammor et
al. 2006). Senyawa CO2 secara efektif dapat menghambat banyak mikroorganisme
perusak makanan, terutama bakteri psikotropik Gram-negatif (Farber 1991 diacu
dalam Ammor et al. 2006).
2.4.1.4 Diasetil
Diasetil diproduksi oleh strain dalam semua genera dari BAL oleh
fermentasi sitrat. Diasetil menghambat pertumbuhan bakteri Gram-negatif yang
bereaksi dengan pemanfaatan arginin (Jay 1986 diacu dalam Ammor et al. 2006).
Bakteri negatif lebih sensitif terhadap diasetil daripada bakteri
Gram-positif. Diasetil pada 344 µg/mL dapat menghambat strain Listeria, Salmonella,
Yersinia, E.coli dan Aeromonas (Jay 1982 diacu dalam Ammor et al. 2006).
2.4.1.5 Bakteriosin
Bakteriosin adalah komponen antibakteri protein yang diproduksi dari
berbagai jenis bakteri, namun tidak letal bagi bakteri yang memproduksi
bakteriosin tersebut. Bakteri asam laktat adalah varian yang paling penting dalam
produksi bakteriosin dan substansi mirip bakteriosin. Bakteriosin yang diproduksi
oleh bakteri asam laktat sangat potensial untuk dijadikan sebagai pengawet
makanan alami (Simon 2001). Beberapa varian bakteriosin yang sudah dikenal
dan termasuk ke dalam kategori GRAS adalah nisin, pediosin, laktisin, dan
propionisin (Toldra 2010).
Antibakteri berjenis peptida (juga disebut sebagai bakteriosin), adalah zat
penting yang dihasilkan oleh bakteri asam laktat. Bakteriosin komersial saat ini
diterapkan dalamberbagai sistem industri makanan untuk kontrol patogen. Zat-zat
ini juga dikenal untuk karakteristik yang menarik mereka yang membuat mereka
cocok untuk pengawetan makanan. Mereka tidak beracun untuk sel eukariotik,
mereka memiliki sedikit pengaruh pada mikroflora usus, memiliki spektrum
antibakteri yang luas, memiliki sifat bakterisida, dan toleran terhadap pH dan
seperti asam organik. Nisin adalah bakteriosin yang tersedia secara komersial
penting dan diproduksi oleh strain dari Lactococcus lactis. Nisin termasuk ke
dalam kategoriGRAS dan salah satu bakteriosin yang diizinkan dalam makanan.
Nisin telah berhasil diterapkandalam berbagai makanan, seperti produk susu dan
salad dressing (Theron dan Lues 2011).
2.4.2 Faktor yang mempengaruhi pertumbuhan bakteri asam laktat
Bakteri asam laktat adalah bakteri fermentatif yang tumbuh pada media
yang biasanya kaya akan kandungan gula dan protein. Suhu akan berpengaruh
terhadap pertumbuhan sel dan juga pembentukan produk oleh mikroba. Hal ini
berhubungan dengan jenis mikroba yang dominan selama fermentasi. Nilai pH
medium merupakan salah satu parameter penting yang dapat mempengaruhi
pertumbuhan mikroba. Bakteri pada umumnya tumbuh dengan baik pada pH
sekitar 6,5-7,5. Asam laktat yang dihasilkan akan menurunkan nilai pH pada
lingkungan pertumbuhannya (Mozzi et al. 2011)
Garam digunakan dalam proses fermentasi ikan. Pada umumnya jumlah
garam yang ditambahkan dalam pembuatan bekasam berkisar antara 15 - 20% dari
berat ikan segar (Murtini 1992). Konsentrasi garam yang tinggi akan menghambat
pertumbuhan bakteri. Penelitian yang dilakukan oleh Ratanatriwong et al. (2009)
menunjukkan bahwa semakin besar konsentrasi garam yang ada dalam media
akan semakin menghambat pertumbuhan bakteri dalam media.
2.5 Bakteri Uji
Bakteri uji merupakan bakteri yang digunakan untuk melakukan uji
aktivitas antibakteri. Bakteri uji yang digunakan pada uji aktivitas antibakteri
asam laktat antara lain Escherichia coli, Salmonella typhimurium, Listeria
monocytogenes, Bacillus cereus, dan Staphylococcus aureus.
2.5.1 Escherichiacoli
Escherichia coli adalah bakteri Gram negatif, prokariot yang paling umum
ditemukan sebagai patogen. Pada banyak hal, bakteri ini bersifat komensalis pada
inang, dimana bakteri tersebut mengambil beberapa nutrisi dari inang tanpa
menyebabkan simptom yang berbahaya. Namun pada beberapa kejadian spesifik,
bakteri ini dapat menyebabkan berbagai penyakit pada manusia seperti enteritis,
diare. Bakteri ini diidentifikasi pertama kali tahun 1885 oleh Theodor Escherich
pada bayi yang mengalami inflamasi di kelenjar pencernaan (enteritis). Bakteri ini
bersifat enterik, atau tahan pada kondisi di dalam gastrointestinal, serta anaerob
fakultatif. Bakteri E coli yang sangat terkenal dan bersifat patogen adalah E coli
O157:H7 yang menyebabkan penyakit klinis seperti diare dan kejadian luar biasa
(outbreaks) foodborne di Amerika Serikat. Meskipun begitu, dikenal juga istilah E
coli enteropatogenik, enterotoksigenik, enterohemoragik, dan enteroinvasif yang
dapat menyebabkan penyakit pada manusia (Manning 2010).
2.5.2 Salmonellatyphimurium
Salmonella typhimurium diklasifikasikan di bawah kelas besar dari
Enterobactericeae, yang termasuk di dalamnya patogen seperti Escherichia coli
dan Shigella. Organisme yang tergolong dalam golongan ini memiliki ciri Gram
negatif, berbentuk batang, non motil atau motil dengan flagel. Infeksi karena
Salmonella dinamakan Salmonellosis dengan ciri-ciri sakit pada saluran
pencernaan dan gastroenteritis. Serotip dari Typhimurium dan Enteriditis
memiliki potensi untuk menginfeksi dan menyebabkan penyakit pada inang
seperti manusia, ternak, babi, dan pengerat meskipun perpindahan inang sangat
jarang terjadi. Salmonellosis adalah salah satu dari penyakit yang sering terjadi
pada kasus infeksi makanan dan mudah menyebar pada makanan dan minuman
yang telah terkontaminasi (Shah dan Gharbia 2010).
2.5.3 Listeriamonocytogenes
Listeria monocytogenes merupakan bakteri Gram positif yang bersifat
fakultatif anaerob. Bakteri ini merupakan penyebab utama penyakit Listeriosis.
Bakteri ini adalah salah satu dari beberapa patogen penyebab foodborne illness
dengan 20 – 30 % infeksi klinis dihasilkan oleh bakteri ini. Bakteri ini
bertanggung jawab terhadap sekitar 2.500 penyakit hingga 500 kematian di
Amerika Serikat per tahun. Listeriosis adalah penyebab utama kematian diantara
kasus bakteri patogen penyebab foodborne illness dengan rataan kematian
melebihi bahkan Salmonella dan Clostridium botulinum. Sifat bakteri ini motil
2.5.4 Bacilluscereus
Bacillus cereus adalah bakteri Gram positif yang memiliki spora yang
tahan panas hingga diatas 100 oC (Graumann 2007). Strain dari bakteri ini adalah
fakultatif patogen yang dapat memproduksi dua tipe umum dari toksin. Toksin
enetik yang stabil terhadap panas diproduksi dari strain bakteri yang tumbuh di
makanan yang mengandung pati seperti nasi dan kentang. Penyakit yang
diasosiasikan dengan makanan ini dapat dihindari dengan refrigerasi yang cukup
dari makan yang telah dimasak. Enterotoksin yang labil terhadap suhu diproduksi
dari strain lain, beberapa ada yang psikotropik yang tumbuh pada makanan yang
berprotein (Wallace et al. 2011).
2.5.5 Staphylococcusaureus
Staphylococcus aureus adalah bakteri Gram positif yang menyebabkan
berbagai macam penyakit pada manusia. Bakteri ini menginfeksi tubuh manusia
melalui kulit dan menyerang berbagai jaringan tubuh manusia seperti darah
(bakterimia), hati, paru-paru (pneumonia), otot, daging, tulang, mata, dan sendi.
Infeksi bisa terjadi secara cepat (akut) atau lama (kronis). Sejumlah kejadian telah
dilaporkan di negara UK bahwa infeksi oleh bakteri ini sekitar 2% dari total kasus
infeksi penyakit dalam dan hampir 20.000 kasus bakterimia (darah) terjadi setiap
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan mulai dari bulan Februari 2011 hingga Agustus
2011 di Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil
Perairan, dan Laboratorium Bioteknologi Akuakultur, Departemen Budidaya
Perairan, Institut Pertanian Bogor, Bogor, Jawa Barat.
3.2 Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah isolat bakteri NS(9) yang
diisolasi dari bekasam ikan nila (Oreochromis niloticus), media pertumbuhan
bakteri MRS (Mann Rogosa Sharpe) agar dan broth, NA (nutrient agar), NB
(nutrient broth), MHA (Mueller Hinton Agar), Coamassie Brilliant Blue G-250,
etanol 95%, asam fosfat 85%, akuades, bakteri uji Salmonella typhimurium,
Listeria monocytogenes, Escherichia coli, Bacillus cereus, dan Staphylococcus
aureus.
Alat yang digunakan dalam penelitian ini adalah tabung reaksi, kaleng,
efendorf 1,5 mL, cawan petri, shaker water bath, timbangan digital, labu
erlenmeyer, gelas ukur, micropipette, penangas listrik, clean bench, pipet Pasteur,
inkubator, spektrofotometer, sentrifuse dingin, kertas saring steril (milipore),
syringe, vortex, botol Schott®, botol universal, dan digital colony counter.
3.3 Metode Penelitian
Penelitian ini dibagi menjadi tiga tahap yaitu karaterisasi isolat NS(9),
penapisan senyawa antibakteri dari isolat NS(9), dan penentuan waktu optimum
produksi antibakteri dari isolat NS(9).
3.3.1 Karakterisasi isolat NS(9)
Tahap karakterisasi isolat NS(9) bertujuan untuk mengetahui karakter
isolat NS(9) sebagai dugaan awal bakteri asam laktat. Tahap ini dilakukan dengan
menguji isolat NS(9) dengan beberapa uji seperti uji motilitas, uji fermentasi
morfologi dan produksi asam laktat dilakukan terhadap koloni NS(9) yang
terbentuk pada permukaan agar MRS + CaCO3 sebanyak 0,5%.
1) Uji motilitas (Tiwari et al. 2009).
Uji motilitas dilakukan dengan menusuk isolat NS(9) yang telah
disegarkan melalui metode refresh isolat selama dua hari ke dalam agar Sulfate
Indole Motility (SIM) pada tabung reaksi. Isolat NS(9) yang diawetkan dalam
gliserol disegarkan kembali dengan agar MRS miring selama dua hari dalam
inkubator bersuhu 37oC. Isolat NS(9) yang telah disegarkan diambil dengan kawat
penusuk yang sudah disteril, kemudian ditusukkan ke dalam media agar SIM
steril. Hasil uji isolat yang motil ditunjukkan dengan penyebaran isolat ke seluruh
media yang menyebabkan media tersebut keruh (Tiwari et al. 2009).
2) Uji fermentasi glukosa (Hayward 1957).
Pendeteksian produksi gas dari isolat NS(9) dilakukan dengan metode
fermentasi glukosa dalam tabung Durham. Uji fermentasi glukosa dilakukan
dengan menginokulasikan isolat NS(9) pada media MRS Broth steril yang sudah
dicampur glukosa 10% hingga larut. Isolat NS(9) diinokulasikan secara aseptik ke
dalam media MRS Broth + glukosa 10% dan diinkubasi selama 24 jam pada suhu
37oC. Hasil uji heterofermentatif ditunjukkan dengan adanya gas yang terbentuk
dalam tabung Durham.
3) Uji katalase (Cappucino dan Sherman 1983).
Uji katalase dilakukan pada biakan isolat NS(9). Satu ose koloni bakteri
dioleskan pada kaca objek kering dan diteteskan 2-3 tetes 3% H2O2. Bila
terbentuk gelembung udara, maka bakteri dinyatakan katalase positif. Bakteri
aerob memberikan reaksi positif, sebaliknya pada bakteri anaerob.
4) Uji perwarnaan Gram (Tiwari et al. 2009).
Uji pewarnaan Gram dilakukan dengan mewarnai biakan isolat NS(9)
dengan pewarna kristal ungu dan safranin. Isolat digores diatas kaca preparat
untuk difiksasi. Isolat yang telah difiksasi diteteskan kristal ungu dan ditunggu
selama satu menit. Setelah itu isolat disiram dengan air dan diteteskan iodium.
Isolat disiram kembali dengan air dan dilakukan pemucatan dengan alkohol 95%.
Setelah disiram kembali dengan air, isolat diberi pewarna tandingan safranin
dengan perbesaran 10x100. Gram positif berwarna biru gelap sedangkan Gram
negatif berwarna merah (Tiwari et al. 2009).
5) Uji pewarnaan spora (Tiwari et al. 2009).
Uji pewarnaan spora dilakukan dengan mewarnai spora yang terbentuk
pada isolat NS(9) dengan malasit hijau. Isolat difiksasi diatas kaca preparat,
kemudian ditetesi pewarna malasit hijau. Preparat dipanaskan diatas api yang
berjarak kurang lebih 10 cm selama 10 menit. Preparat dicuci dengan air dan
ditetesi safranin. Pengamatan dilakukan dibawah mikroskop dengan perbesaran
10x100. Endospora yang terbentuk ditandai dengan adanya warna hijau,
sedangkan sel vegetatif berwarna merah (Tiwari et al. 2009).
6) Pengamatan morfologi koloni (Tiwari et al. 2009).
Pengamatan morfologi koloni isolat NS(9) dilakukan dengan mengamati
morfologi koloni isolat NS(9)yang terbentuk pada agar MRS. Pengamatan yang
dilakukan meliputi warna koloni, bentuk permukaan, bentuk tepian, bentuk
koloni.
7) Pendeteksian asam laktat (Kopermsub dan Yunchalard 2010).
Pendeteksian adanya senyawa asam laktat yang terbentuk dilakukan
dengan pengujian isolat NS(9) diatas media agar MRS yang dicampur dengan
CaCO3 dengan perbandingan 0,5 gram CaCO3 dalam 100 mL MRS agar. Isolat
digores keatas cawan yang berisi agar MRS + CaCO3. Selanjutnya cawan
diinkubasi dalam inkubator bersuhu 37 oC selama 2 hari. Hasil positif ditunjukkan
dengan perubahan warna media dari keruh menjadi lebih bening.
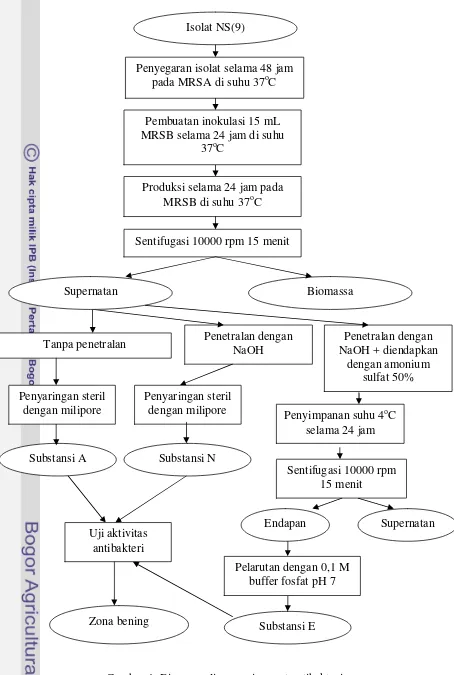
3.3.2 Penapisan senyawa antibakteri dari isolat NS(9)
Tahap selanjutnya adalah penapisan senyawa antibakteri dari isolat NS(9)
yang bertujuan untuk mengetahui potensi dan jenis zat antibakteri yang dihasilkan
oleh isolat NS(9). Isolat yang disimpan pada gliserol disegarkan pada agar MRS
miring dan selanjutnya diinkubasi dalam kaleng yang disimpan dalam inkubator
pada suhu 37oC selama 48 jam. Isolat yang telah disegarkan pada media MRSA
kemudian diambil satu ose dan dimasukkan ke dalam media MRS broth sebagai
inokulum. Inokulum diinkubasi pada suhu 37oC pada shaker shaker water bath
selama 18 jam hingga OD660 inokulum mencapai 0,6 hingga 0,8 untuk selanjutnya
Sebanyak 10% inokulum dimasukkan ke dalam media produksi dengan
volume kerja 100 mL, kemudian diinkubasi dalam shaker water bath pada suhu
37oC selama 24 jam. Pengamatan yang dilakukan adalah pengukuran OD awal
dan OD akhir inkubasi (24 jam). Setelah 24 jam kemudian, dilakukan pemanenan.
Pemanenan dilakukan dengan cara sentrifugasi media kultivasi pada suhu
4oC dengan kecepatan 10.000 rpm selama 15 menit. Supernatan dipisah dari
biomassa, setelah itu supernatan diberi tiga perlakuan, yaitu: (1) supernatan yang
tidak diberi perlakuan apa-apa sehingga kondisi asam pada supernatan tetap
terjaga (diberi label A); (2) supernatan yang diberikan perlakuan penambahan
NaOH 1 N atau penetralan untuk menghilangkan zat asam yang ada pada
supernatan (diberi label N); (3) supernatan yang telah dinetralkan pH-nya dan
dilakukan pengendapan protein (diberi label E). pengendapan dilakukan dengan
amonium sulfat sebanyak 50%, kemudian didiamkan selama 24 jam pada suhu
chilling (4oC). Selanjutnya cairan tersebut dipanen dengan menggunakan kembali
dengan kecepatan 10.000 rpm selama 15 menit pada suhu 4oC. Endapan hasil
sentrifuse dilarutkan dengan 0,1 M buffer fosfat pH 7.
Ketiga supernatan atau substansi tersebut (A, N, dan E) diuji aktivitas
antibakterinya terhadap lima bakteri uji, yaitu Salmonella typhimurium, Listeria
monocytogenes, Escherichia coli, Bacillus cereus, dan Staphylococcus aureus
dengan metode difusi sumur agar (agar well difusion). Diagram alir penapisan
Gambar 4 Diagram alir penapisan zat antibakteri. MRSB selama 24 jam di suhu
3.3.3 Penentuan waktu optimum produksi zat antibakteri (modifikasi Sarika et al. 2010)
Tahap ini dimulai dengan penyegaran isolat NS(9) yang diisolasi dari
bekasam ikan nila (Oreochromis niloticus). Penyegaran dilakukan dengan
penggoresan isolat yang disimpan pada gliserol pada agar MRS miring dan
selanjutnya diinkubasi dalam kaleng pada suhu 37oC di dalam inkubator selama
48 jam. Isolat yang telah disegarkan pada media MRSA kemudian diambil dengan
menggunakan ose untuk membuat inokulum pada media MRS broth. Inokulum
diinkubasi pada suhu 37oC selama 18 jam hingga OD inokulum mencapai 0,8
hingga 1.
Selanjutnya 10% inokulum tersebut ditumbuhkan ke media produksi dengan
volume kerja 10 mL, kemudian diinkubasi pada suhu 37 oC. Pengamatan
dilakukan setiap tiga jam selama 24 jam. Parameter yang diamati antara lain
OD660 dan pH untuk tiap label tabung. Tahap selanjutnya adalah pemanenan untuk
mendapatkan supernatan. Parameter yang diukur dari supernatan yaitu aktivitas
antibakteri, kadar asam laktat, dan kadar protein yang diukur dengan metode
Bradford (Nielsen 2010).
a) Tahap analisis uji aktivitas antibakteri
Tahap uji aktivitas antibakteri dilakukan dengan metode sumur agar (agar
well difusion). Pengujian diawali dengan persiapan media MHA yang sudah terisi
dengan bakteri uji Salmonella typhimurium, Listeria monocytogenes, dan
Escherichia coli, Bacillus cereus, dan Staphylococcus aureus. Tahap persiapan
media MHA dilakukan dengan mencampur media MHA steril pada suhu 50oC dan NB berisi bakteri uji dengan perbandingan antara 10 µl NB bakteri uji untuk 10 mL MHA steril. Media MHA yang sudah berisi bakteri uji tersebut disiapkan
dalam cawan steril dan kemudian dilubangi sebesar ujung pipet Pasteur sehingga
terbentuk sumur kecil yang mampu terisi oleh supernatan isolat NS(9) yang
diperoleh dari proses pemanenan. Sumur-sumur tersebut kemudian diisi dengan
supernatan isolat bakteri NS(9), kemudian diinkubasi selama 21 jam untuk
melihat zona bening yang terbentuk pada tiap bakteri uji dan masing-masing
supernatan. Pengukuran diameter zona bening dilakukan untuk pembuatan kurva
b) Pengukuran kadar asam laktat
Pengukuran kadar asam laktat dilakukan dengan metode titrasi asam basa
menggunakan larutan NaOH (N=0,1091) (Moore et al. 2011). Setiap supernatan
dilarutkan dengan pewarna fenoftalein, kemudian dititrasi oleh NaOH hingga
warna larutan supernatan berubah kemerahan. Volume NaOH yang terpakai
digunakan untuk melakukan perhitungan % asam laktat yang dihitung
menggunakan rumus:
% Asam Laktat = × × × × 100%
Keterangan:
V NaOH = Volume NaOH yang terpakai
N NaOH = Normalitas NaOH yang terukur (0,1091) FP = Faktor Pengencer (1)
Bobot sampel = 1000 mg 90 = BM Asam laktat
c) Analisis kadar protein dengan metode Bradford (Nielsen 2010)
Pengujian kandungan protein pada supernatan dilakukan dengan metode
Bradford. Metode ini mengandalkan sifat amfoter dari protein. Ketika protein
terasamkan hingga mencapai titik isoelektrik, zat warna akan terikat secara
elektrostatik. Efisiensi pengikatan dipacu oleh interaksi hidrofobik oleh molekul
pewarna dengan polypeptide backbone bermuatan positif yang berdekatan dalam
protein. Pada uji Bradford, pewarna terikat pada protein mengubah absorbansi
spektrum terhadap pewarna yang tidak terikat.
Ketika Coomasie Brillian Blue G-250 terikat pada protein, warna Reagen
Coomassie Blue yang bebas berwarna merah kecokelatan (λ = 465 nm), akan
berada dalam bentuk anion yang akan mengikat protein membenuk warna biru (λ
= 595 nm). Jumlah Coomassie Blue terikat pada protein proporsional dengan
muatan positif yang ditemukan pada protein dan dilakukan pengukuran optical
densitydengan spektrofotometer pada λ = 660 nm.
Pembuatan reagen Coomassie Blue dilakukan dengan mencampurkan
Coomassie Blue G-250 sebanyak 50 mg dengan 25 mL etanol 95% hingga larut.
dengan akuades hingga 500 mL. larutan ini disaring dengan kertas saring. Larutan
yang telah disaring inilah yang digunakan untuk pengukuran protein. Reagen
Coomassie Blue yang sudah disaring dicampur pada kontrol yaitu akuades, dan
dicampur ke dalam semua supernatan. Nilai absorbansi yang terukur dicatat untuk
pengukuran kadar protein selanjutnya.
Proses penentuan kadar protein dilakukan dengan pembuatan kurva standar
dari BSA (bovine serum albumin) pada konsentrasi 0,01 mg/mL hingga 0,14
mg/mL dengan menggunakan metode Bradford. Nilai absorbansi yang terukur
dicatat dan digambar pada kurva standar untuk menentukan rumus penentuan
kadar protein sampel. Rumus yang didapat dari kurva standar tersebut digunakan
untuk mengukur kadar protein pada sampel uji, dalam hal ini adalah supernatan.
Diagram alir penentuan waktu panen optimum zat antibakteri dapat dilihat pada
Gambar 5.
Gambar 5 Diagram alir penentuan waktu optimum produksi. Penyegaran isolat selama 48 jam
pada MRSA di suhu 37oC Isolat NS(9)
Produksi selama 24 jam pada MRSB dengan suhu 37oC dalam inkubator
Pengamatan OD660 dan pH setiap 3 jam
Pembuatan inokulum 15 mL MRSB selama 24 jam di suhu
37oC
Biomassa
Sentifugasi 10.000 rpm selama 15 menit
Supernatan
- Pengukuran zona bening - Pengukuran kadar asam laktat - Pengukuran kadar protein
Analisis zat antibakteri isolat NS(9) dari bekasam ikan nila (Oreochromis
niloticus) terdiri dari tiga tahap penelitian. Tahap pertama adalah karakterisasi
isolat NS(9) yang bertujuan untuk mengetahui karakter awal dari isolat NS(9).
Tahap kedua adalah penapisan zat antibakteri pada isolat NS(9) yang bertujuan
untuk mengetahui potensi dan jenis antibakteri yang dihasilkan oleh isolat NS(9).
Tahap ketiga adalah penentuan waktu optimum produksi senyawa antibakteri
yang dihasilkan oleh isolat NS(9). Ketiga tahap tersebut menunjukkan potensi
senyawa antibakteri yang dihasilkan oleh isolat NS(9) dan optimasi produksinya.
4.1 Karakterisasi Isolat NS(9)
Karakteriasi isolat NS(9) bertujuan untuk mengetahui karakter dari isolat
NS(9). Uji karakterisasi yang dilakukan antara lain uji pewarnaan Gram, uji
pewarnaan spora, uji fermentasi glukosa, uji katalase, uji motilitas, dan
pengamatan morfologi koloni. Hasil uji karakterisasi tersebut dapat dilihat pada
Tabel 1.
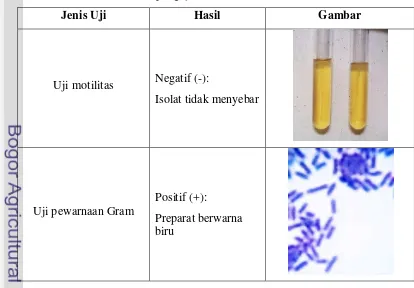
Tabel 1 Hasil pengujian karakterisasi isolat NS(9)
Jenis Uji Hasil Gambar
Uji motilitas Negatif (-):
Isolat tidak menyebar
Uji pewarnaan Gram
Positif (+):
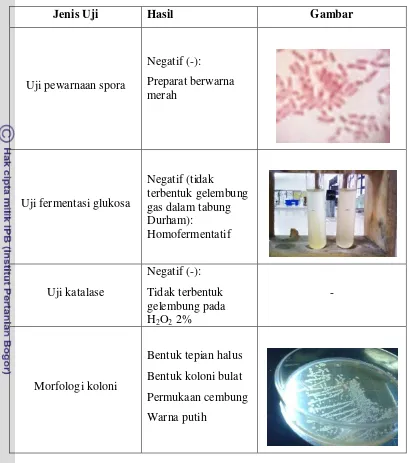
Jenis Uji Hasil Gambar
Gram positif, spora negatif, homofermentatif, dan katalase negatif (Tabel 1). Hal
ini sesuai dengan penyampaian Mozzi et al. (2010) dan Klaenhammer et al.
(2011) yang menyatakan bahwa bakteri asam laktat adalah kelompok bakteri
Gram positif, tidak membentuk spora, katalase negatif.
Mozzi et al. (2010) menyatakan bahwa bakteri asam laktat termasuk di
dalamnya bakteri homofermentatif yang memproduksi sebagian besar utamanya
adalah asam laktat, dan heterofermentatif yang selain memproduksi asam laktat
juga memproduksi variasi yang luas dari produk fermentasi seperti asam asetat,
fermentasi glukosa menunjukkan bahwa isolat NS(9) tidak menghasilkan gas
karbon dioksida dalam jumlah yang besar. Menurut Hayward (1957), ketiadaan
gas yang terbentuk pada isolat NS(9) menunjukkan bahwa isolat NS(9) diduga
merupakan bakteri homofermentatif.
Pendeteksian bakteri asam laktat dengan metode lain adalah dengan
penambahan kalsium karbonat (CaCO3) pada media agar MRS steril yang
ditumbuhkan isolat NS(9) diatasnya. Hasil pendeteksian asam laktat pada media
agar MRS yang telah ditambahkan CaCO3 dapat dilihat pada Gambar 6.
Gambar 6 Perbandingan antara MRSA + CaCO3 yang steril (kiri) dan yang sudah
ditumbuhi isolat NS(9) (kanan).
Media agar MRS + CaCO3 yang steril terlihat keruh dan tidak terlalu
transparan karena ada kandungan CaCO3 yang ada di dalam media agar MRS
tersebut, sedangkan media agar MRS + CaCO3 yang sudah ditumbuhi isolat NS(9)
terlihat lebih transparan (Gambar 6). Hal ini disebabkan karena CaCO3 yang
terkandung dalam media agar MRS tersebut bereaksi dengan asam laktat yang
dihasilkan NS(9) menjadi kalsium laktat sehingga warna media yang terlihat
menjadi lebih bening dibandingkan media agar MRS + CaCO3 yang tidak
ditumbuhi isolat NS(9). Hal ini sesuai dengan penelitian Kopermsub dan
Yunchalard (2010) yang menyatakan bahwa asam laktat dapat bereaksi dengan
kalsium membentuk kalsium laktat dan membuat warna media menjadi lebih
jernih.
4.2 Penapisan Senyawa Antibakteri dari Isolat NS(9)
Penapisan senyawa antibakteri dari isolat NS(9) bertujuan untuk mengetahui
potensi dan jenis antibakteri yang dihasilkan oleh isolat NS(9). Isolat NS(9) yang
telah dikultivasi selama 24 jam diambil supernatannya yang telah diberi kode A,
patogen pada makanan yang menjadi bakteri uji, yaitu Escherichia coli, Listeria
monocytogenes, Bacillus cereus, Staphylococcus aureus dan Salmonella
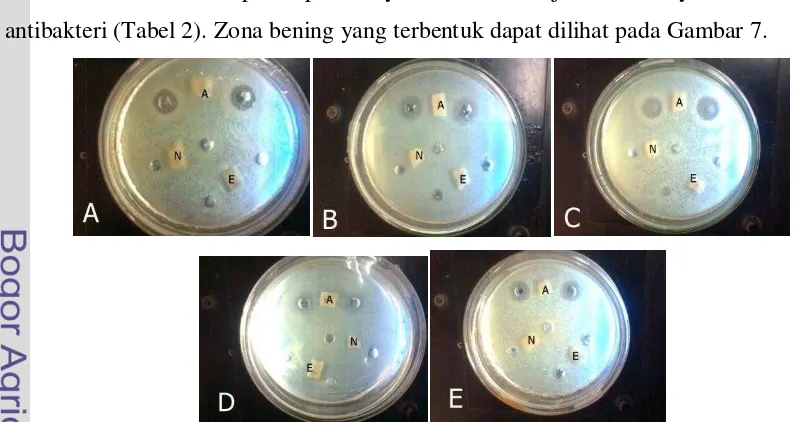
typhimurium. Hasil uji aktivitas antibakteri dapat dilihat pada Tabel 2.
Tabel 2 Hasil uji aktivitas antibakteri
Keterangan:
A = supernatan kondisi asam (tidak dinetralkan) N = supernatan dinetralkan dengan NaOH
E = supernatan dinetralkan dan diendapkan dengan amonium sulfat 50% - = tidak terdeteksi
Aktivitas antibakteri positif ditunjukkan pada substansi yang tidak diberi
perlakuan, atau dengan kondisi asam yang dipertahankan. Substansi yang
dinetralkan dan diendapkan proteinnya tidak menunjukkan adanya aktivitas
antibakteri (Tabel 2). Zona bening yang terbentuk dapat dilihat pada Gambar 7.
Gambar 7 Aktivitas antibakteri substansi A, N dan E pada ketiga jenis bakteri: A) Bacillus cereus, B) Escherichia coli, C) Listeria monocytogenes
D) Staphylococcus aureus, E) Salmonella typhimurium. Bakteri
Rataan diameter zona bening (mm)
A N E
S. aureus 2,5 - -
B. cereus 6,5 - -
E. coli 9,0 - -
S. typhimurium 7,0 - -
Zona bening tidak tampak sama sekali pada sumur yang diberikan substansi
N dan E yang ditanam pada tiap bakteri uji (Gambar 7). Hal ini menunjukkan
bahwa aktivitas antibakteri hanya terdeteksi pada substansi yang kondisi asamnya
dipertahankan (A).
Theron dan Lues (2011) menyampaikan bahwa bakteri asam laktat
menghasilkan senyawa sekunder yang dapat menghambat pertumbuhan bakteri
lain disekitarnya. Zat asam organik yang dihasilkan oleh bakteri asam laktat dapat
menurunkan pH media dan menghambat pertumbuhan bakteri. Selain itu zat lain
yang diproduksi oleh bakteri asam laktat seperti peroksida, diasetil, dan senyawa
protein seperti bakteriosin diketahui dapat menghambat pertumbuhan bakteri lain
disekitarnya.
Perlakuan berbeda yang diaplikasikan pada ketiga supernatan isolat NS(9)
bertujuan untuk mengidentifikasi jenis antibakteri yang dihasilkan oleh isolat
NS(9). Supernatan yang tidak diberi perlakuan sama sekali (kode A) bertujuan
untuk mempertahankan kondisi asam dan mengidentifikasi zat antibakteri yang
bersifat asam. Perlakuan penetralan pada supernatan (kode N) bertujuan untuk
menghilangkan efek antibakteri yang bersifat asam, sehingga hanya zat antibakteri
yang bersifat non-asam saja yang bekerja menghambat pertumbuhan bakteri lain.
Perlakuan pengendapan protein pada supernatan (kode E) bertujuan untuk
mengendapkan protein dari supernatan dan mengetahui aktivitas antibakteri dari
protein tersebut. Hasil dari percobaan ini menunjukkan bahwa aktivitas antibakteri
yang dihasilkan dari supernatan isolat NS(9) hanya terlihat pada supernatan yang
diberi kode A. Berdasarkan hasil ini dapat disimpulkan bahwa isolat NS(9) tidak
memproduksi antibakteri yang termasuk ke dalam jenis protein seperti bakteriosin
pada pengendapan amonium sulfat 50%. Antibakteri yang dihasilkan oleh isolat
NS(9) termasuk ke dalam jenis asam organik.
4.3 Penentuan Waktu Optimum Produksi Antibakteri
Pengukuran waktu optimum produksi antibakteri bertujuan untuk
mengetahui waktu optimum produksi antibakteri yang dihasilkan dari isolat
diamati setiap 3 jam selama 24 jam menunjukkan adanya pola perubahan pH,
produksi protein dan asam laktat (Lampiran 1).
4.3.1 Pertumbuhan isolat dan perubahan pH
Pertumbuhan isolat bakteri NS(9) diukur dengan cara menginkubasikan
bakteri isolat pada media MRSB selama 24 jam. Pengukuran dilakukan setiap tiga
jam sekali. Pengukuran yang dilakukan meliputi pengukuran nilai absorbansi
media pada panjang gelombang 660 nm serta pengukuran nilai pH. Hasil
pengukuran nilai absorbansi untuk optical density (OD) dan nilai pH setiap tiga
jam selama 24 jam dapat dilihat pada Gambar 8.
Gambar 8 Grafik nilai Optical Density (OD) ( ), dan pH ( ) bakteri isolat NS(9) selama fase produksi 24 jam.
Fase pertumbuhan yang berbeda-beda terlihat selama 24 jam inkubasi dari
isolat NS(9) (Gambar 8). Pertumbuhan isolat mulai terjadi pada jam ke-0 hingga
jam ke-15. Fase ini disebut dengan fase eksponensial (fase log). Cohen (2011)
menyatakan bahwa fase eksponensial terjadi karena konsumsi nutrisi dalam media
oleh kultur. Hal tersebut mengakibatkan kultur berkembang pada growth rate
yang konstan, dimana growth rate proporsional terhadap nilai OD. Pommerville
(2011) menyatakan fase log terjadi ketika semua sel dalam kultur mengalami
pembelahan biner. Setiap generasi yang dilalui, jumlah sel bertambah dua kali
Pertumbuhan isolat melambat pada fase yang ditunjukkan pada jam ke-6
hingga jam ke-15. Pertumbuhan tersebut bertambah secara simultan, konstan,
dengan growth rate yang hampir mendekati nol. Cohen (2011) menyatakan bahwa
hal tersebut terjadi karena nutrien yang hilang akibat konsumsi, medium yang
semakin asam, akumulasi toksik atau karena zat yang dapat menghambat
pertumbuhan. Meskipun demikian, pertumbuhan masih tetap terjadi.
Kurva pertumbuhan mengalami kecenderungan stasioner pada jam ke-15
hingga jam ke-21. Cohen (2011) menyatakan bahwa kondisi nutrien yang hilang
akibat konsumsi, medium yang semakin asam, akumulasi toksik atau karena zat
yang dapat menghambat pertumbuhan menyebabkan pertumbuhan semakin
menurun sehingga level pertumbuhan akan mendekati nol dan penambahan
jumlah sel tidak ada.
Penurunan grafik OD pada jam ke-21 hingga jam ke-24 menunjukkan
bahwa isolat NS(9) memasuki fase kematian (decline phase). Pommerville (2011)
menyatakan bahwa hal ini terjadi karena nutrien dalam media yang tersisa terbatas
atau jumlahnya menjadi jauh lebih rendah.
Kecenderungan penurunan nilai pH mulai dari waktu inkubasi awal pada
jam 0 hingga jam 12 (Gambar 8). Nilai pH pada jam 12 hingga jam
ke-24 sudah menunjukkan kestabilan dimana nilai pH tetap tidak berubah hingga
akhir masa inkubasi, yaitu 4.
Hubungan yang terlihat antara nilai absorbansi dan nilai pH pada tahap ini
adalah perbandingan terbalik. Ketika isolat NS(9) pertama kali diinkubasi pada
jam ke-0, pH yang terlihat menunjukkan nilai yang tertinggi yaitu 6, sedangkan
nilai absorbansi pada waktu awal inkubasi memiliki nilai terendah, yaitu 0,19.
Ketika kepadatan isolat bertambah ditandai dengan naiknya nilai OD hingga
mencapai 6,48 pada jam ke-12, nilai pH yang ditunjukkan menurun dari 6 hingga
4. Nilai pH 4 ini merupakan nilai pH yang terendah dan tidak berubah hingga fase
death yang ditunjukkan pada menurunnya nilai OD dari jam ke-21 hingga jam
ke-24.
Hwang et al. (2011) menyatakan bahwa metabolit sekunder yang dihasilkan
oleh bakteri asam laktat seperti asam laktat dipengaruhi oleh beberapa faktor
pertumbuhan), keberadaan oksigen, tingkat pH, dan konsentrasi metabolit
sekunder dari produk. Fase eksponensial pada jam ke-0 hingga jam ke-15
menunjukkan peningkatan nilai OD, yang diakibatkan oleh kandungan media
MRS broth yang kaya akan nutrisi pertumbuhan bakteri asam laktat seperti pepton
dan glukosa. Adanya glukosa memacu terjadinya proses fermentasi yang
menghasilkan senyawa metabolit sekunder seperti asam laktat. Zat ini terus
diproduksi hingga konsentrasinya meninggi. Hwang et al. (2011) juga
menyatakan bahwa konsentrasi asam laktat yang tinggi juga dapat memperlambat
pertumbuhan sel selama masa fermentasi. Oleh karena itu, semakin banyak asam
laktat yang diproduksi selama masa fermentasi (ditandai dengan penurunan nilai
pH pada grafik), maka pertumbuhan sel yang terjadi semakin lambat. Kondisi
media yang semakin minim nutrisi akibat proses fermentasi yang terus menerus
mengakibatkan pertumbuhan sel berkurang dan mengakibatkan kematian sel
pertumbuhan sel pada akhir masa inkubasi.
4.3.2 Kadar asam laktat
Kadar asam laktat yang diproduksi ini erat kaitannya dengan
kemampuannya sebagai inhibitor bakteri patogen pada makanan. Pengukuran
kadar asam laktat dari substansi antibakteri yang dihasilkan oleh bakteri isolat
NS(9) dilakukan dengan metode titrasi. Supernatan direaksikan dengan reagen
fenoftalein sebagai indikator warna perubahan pH. Larutan dititrasi dengan NaOH
( N = 0,1091 mol) hingga larutan berubah menjadi warna merah. Hasil kadar asam
laktat pada setiap tiga jam pengamatan selama 24 jam dapat dilihat pada Gambar
9.
Perubahan konsentrasi asam laktat terjadi setiap tiga jam pengambilan
sampel (Gambar 9). Perubahan tersebut menunjukkan peningkatan mulai dari
awal produksi hingga akhir. Hal tersebut menunjukkan bahwa asam laktat
diproduksi oleh bakteri isolat NS(9) selama fase produksi 24 jam.
Kadar asam laktat yang terukur berhubungan dengan pH media dan
pertumbuhan isolat. Ketika berada di awal fase pertumbuhan dimana pH media
tinggi, kadar asam laktat yang terukur sangat rendah. Bentuk kurva kadar asam
laktat yang ditunjukkan pada Gambar 9 merupakan bentuk kurva log dimana pada
awal masa inkubasi, terjadi peningkatan yang cukup besar dan seiring dengan
bertambahnya waktu, peningkatan tersebut tetap ada namun cenderung melambat
hingga mencapai kondisi statis. Penurunan produksi asam laktat ini erat kaitannya
dengan fase pertumbuhan sel semakin menurun juga. Produksi asam laktat pada
fase tersebut tidak setinggi produksi pada awal masa pertumbuhan bakteri yaitu
pada jam ke-0 hingga jam ke-15.
Asam laktat merupakan salah satu jenis asam organik yang diproduksi
oleh bakteri asam laktat. Menurut Theron dan Lues (2011), asam laktat
merupakan salah satu metabolit utama dari bakteri asam laktat, namun pada
bakteri heterofermentatif, bakteri asam laktat juga memproduksi asam asetat dan
sebagian asam propionat dalam jumlah besar. Asidifikasi (pengasaman) yang
diakibatkan asam organik meningkatkan aktivitas antibakterial baik asam organik
maupun substansi inhibitor lain seperti bakteriosin.
Asam laktat berperan dalam proses penghambatan bakteri lain. Theron dan
Lues (2011) menyatakan bahwa asam terdisosiasi menjadi ion hidrogen dan anion
toksik yang mampu mengganggu fungsi fisiologis sel dan mendestabilasi protein
sel. Menurut Pelaez dan Orue (2010), asam laktat mampu melemahkan
permeabilitas bakteri Gram negatif dengan merusak membran luar bakteri Gram
negatif. Asam laktat merupakan molekul yang larut dalam air sehingga mampu
menembus ke dalam periplasma bakteri Gram negatif melalui protein porin pada
membran luarnya. Pelindung dari permeabilitas membran luar berupa lapisan
lipopolisakarida yang terletak pada permukaan membran dirusak oleh asam laktat
peroksida dan lactoperidase system dapat berpenetrasi ke dalam membran
sitoplasma.
4.3.3 Kadar protein
Pengukuran kadar protein dilakukan dengan metode Bradford (Nielsen
2010) (Lampiran 2). Kadar protein supernatan per tiga jam selama 24 jam dapat
dilihat pada Gambar 10.
Gambar 10 Kadar protein supernatan tiap 3 jam selama 24 jam.
Perubahan konsentrasi protein terjadi setiap tiga jam selama 24 jam
(Gambar 10). Namun perubahan kadar protein tidak menunjukkan adanya
peningkatan yang besar. Oleh karena itu dari grafik ini dapat diambil simpulan
yang menguatkan bahwa protein tidak diproduksi dalam jumlah besar oleh bakteri
isolat NS(9) selama fase produksi.
Keberadaan kandungan protein pada supernatan isolat NS(9) penting untuk
diketahui untuk mengetahui adanya potensi senyawa antibakteri lain berjenis
protein seperti bakteriosin. Theron dan Lues (2011) menyatakan bahwa
antibakteri berjenis peptida(juga disebut sebagai bakteriosin), adalah zat penting
yang dihasilkan olehbakteri asamlaktat. Bakteriosin adalah komponen antibakteri
protein yang diproduksi dari berbagai jenis bakteri, namun tidak letal bagi bakteri
yang memproduksi bakteriosin tersebut.
Bakteri asam laktat adalah varian yang paling penting dalam produksi
bakteriosin dan substansi mirip bakteriosin. Bakteriosin yang diproduksi oleh
bakteri asam laktat sangat potensial untuk dijadikan sebagai pengawet makanan
bahwa produksi bakteriosin pada NS(9) tidak terdeteksi pada tahap penapisan
awal dengan pengendapan menggunakan amonium sulfat 50%.
4.3.4 Aktivitas antibakteri
Pengujian aktivitas antibakteri dilakukan untuk setiap supernatan yang
dikultivasi setiap tiga jam selama 24 jam terhadap bakteri uji dengan
menggunakan metode difusi sumur agar. Hasil pengujian aktivitas antibakteri dan
dokumentasi gambar disajikan pada Lampiran 3 dan 4.
Substansi antibakteri yang dihasilkan oleh isolat NS(9) memiliki daya
inhibisi yang bervariasi pada kelima bakteri uji (Gambar 11). Secara umum,
substansi antibakteri yang dihasilkan bakteri isolat NS(9) memiliki daya hambat
yang paling rendah untuk S. aureus dibandingkan daya hambat terhadap bakteri
uji lainnya. Diameter penghambatan yang terbesar terjadi pada jam ke-12 pada
bakteri uji L. monocytogenes.
Gambar 11 Grafik perbandingan zona bening supernatan pada ke-5 bakteri uji:
Escherichia coli ( ), Salmonella typhimurium ( ), Listeria monocytogenes ( ),
Bacillus cereus ( ),dan Staphylococcus aureus ( ).
Diameter penghambatan terbesar bagi bakteri B. cereus yaitu dengan
diameter sebesar 6 mm terjadi di jam ke-12. Diameter penghambatan terbesar bagi
bakteri E. coli yaitu dengan diameter sebesar 6 mm terjadi pada jam ke-15.
Diameter penghambatan terbesar bagi bakteri S. typhimurium yaitu dengan
diameter sebesar 6 mm terjadi pada jam ke-24. Diameter penghambatan terbesar
bagi bakteri S. aureus yaitu dengan diameter sebesar 3 mm terjadi pada jam ke-21.
maksimum pada kelima bakteri uji pada jam ke-21 setara dengan rata-rata
diameter kontrol positif asam asetat antara 0,6 – 0,8 %.
Gambar 12 Grafik perbandingan zona bening kontrol positif pada ke-5 bakteri uji: Escherichia coli ( ), Salmonella typhimurium ( ), Listeria monocytogenes
( ), Bacillus cereus ( ),dan Staphylococcus aureus ( ).
Daya hambat zat antibakteri asam organik terhadap kelima bakteri patogen
tersebut juga dipengaruhi oleh pH. Batas toleransi pH untuk pertumbuhan kelima
bakteri uji tersebut dapat dilihat pada Tabel 3.
Tabel 3 Toleransi bakteri patogen terhadap pH untuk tumbuh optimum
Jenis Bakteri pH
Salmonella typhimurium 4,0 6,6-8,2 9,0
Listeria monocytogenes 4,3 7,0 9,4
Escherichia coli 4,0 7,0 9,0
Staphylococcus aureus 4,0 6,0-7,0 10,0
Bacillus cereus 5 6,5 8,8
Sumber: ICMSF (1996) diacu dalam Theron dan Lues (2011)
Bakteri patogen seperti L. monocytogenes dan B. cereus terhambat
maksimum pada jam ke-12 dimana pada jam tersebut, pH supernatan mencapai 4
(Gambar 11). Pada jam tersebut, kedua bakteri uji tersebut sudah tidak mampu
mentolerir pH yang terjadi sehingga mengakibatkan zona hambat yang terbentuk
telah mencapai titik maksimal pada jam ke-12.
Bakteri uji seperti E. coli dan S. typhimurium adalah bakteri Gram negatif.
Keduanya termasuk ke dalam golongan bakteri enteropatogenik. Bakteri jenis ini
biasanya tahan terhadap pH yang cukup rendah. Korelasi dengan zona bening
menghambat bakteri ini. Gambar 11 menunjukkan bahwa zona bening maksimum
yang ditunjukkan pada bakteri uji E. coli terbentuk pada jam ke-15, lebih lama
daripada bakteri uji L. monocytogenes dan B. cereus. Begitu juga dengan bakteri
uji S. typhimurium. Zona hambat maksimum ditunjukkan pada jam ke-24.
Menurut Alvarez-Ordonez et al. (2009), S. typhimurium diketahui dengan
kemampuannya bertahan hidup pada pH ekstrim, yaitu 3. Namun kemampuan
hidup pada pH ekstrim tersebut tidak menjadikan bakteri ini dapat hidup dengan
normal ketika bereaksi dengan asam organik. Sifat adaptasi asam dari
S. typhimurium juga didapat dari peningkatan osmotik, toleransi terhadap garam,
dan proteksi silang menjadi sistem laktoperoksidase yang aktif.
Daya hambat asam organik yang dihasilkan isolat NS(9) terhadap S. aureus
paling rendah dibandingkan dengan bakteri uji lainnya. Sesuai dengan hasil
penelitian, Linke dan Goldman (2011) menyatakan hal ini disebabkan karena daya
adhesivitas dinding sel S. aureus yang rendah. Gaya intermolekul seperti Van der
Waals, elektrostatis, kelarutan, dan interaksi sterik mengontrol bagaimana dinding
sel bakteri berinteraksi dengan permukaan zat lain.
Menurut Theron dan Lues (2011), setiap bakteri uji memiliki ketahanan
masing-masing terhadap jenis asam organik yang berbeda. L. monocytogenes
memiliki kerentanan yang lebih besar terhadap asam laktat dibandingkan dengan
asam asetat. E. coli dan S. typhimurium memiliki kerentanan yang tinggi terhadap
asam laktat dan asam asetat. B. cereus yang merupakan golongan bakteri Gram
positif memiliki kerentanan yang tinggi terhadap asam laktat dan asam propionat.
Bakteri uji S. aureus memiliki ketahanan asam yang paling tinggi dibandingkan
dengan kelima bakteri uji lainnya. Charlier et al. (2009) menyatakan bahwa
S. aureus akan bertambah rentan terhadap asam apabila terjadi peningkatan kadar
garam. Bakteri S. aureus juga sangat peka terhadap aktivitas asam asetat.
Perbedaan nilai zona bening yang dihasilkan dalam penelitian ini
menunjukkan bahwa pada jam tertentu, salah satu jenis asam organik yang
dihasilkan oleh isolat BAL NS(9) diproduksi dalam kondisi optimum, sehingga
menghambat bakteri uji yang rentan terhadap salah satu jenis asam organik
tersebut. Bakteri L. monocytogenes yang telah mencapai zona hambat terbaik pada
asam laktat dan asam propionat mencapai titik tertinggi. Kondisi yang sama dapat
dijelaskan pada bakteri uji E. coli dan S. typhimurium. Menurut Alvarez-Ordonez
et al. (2009), kedua bakteri uji ini rentan terhadap aktivitas antibakteri dari asam
laktat dan asam asetat. Kondisi maksimum zona hambat yang terjadi pada E. coli
di jam ke-15 menunjukkan bahwa pada jam tersebut, kandungan asam asetat dan
asam laktat dalam supernatan antibakteri terdapat pada kondisi yang maksimum.
Zona hambat maksimum yang terjadi pada bakteri S. typhimurium lebih lama dari
E. coli disebabkan karena bakteri S. typhimurium lebih tahan asam dibandingkan
5.1 Kesimpulan
Isolat NS(9) yang diisolasi dari bekasam ikan nila (Oreochromis niloticus)
merupakan bakteri asam laktat. Isolat NS(9) menghasilkan zat asam organik yang
memiliki aktivitas antibakteri. Zat antibakteri jenis protein seperti bakteriosin
tidak terdeteksi pada pengendapan supernatan dari isolat NS(9) dengan amonium
sulfat 50%. Isolat NS(9) memiliki fase pertumbuhan dengan puncak pertumbuhan
pada jam ke-15 dan stasioner hingga jam ke-21 dan turun kembali pada jam jam
ke-24. Produksi optimum zat asam organik dari isolat NS(9) yang memiliki
aktivitas antibakteri terdapat pada jam ke-12 hingga jam ke-24.
Isolat NS(9) menghasilkan zat antibakteri asam organik yang mampu
menghambat pertumbuhan lima jenis patogen pada makanan yaitu Escherichia
coli, Salmonella typhimurium, Staphylococcus aureus, Bacillus cereus, dan
Listeria monocytogenes. Daya hambat terbaik zat asam organik isolat NS(9)
terdapat pada media MHA yang ditumbuhkan Listeria monocytogenes dan
Bacillus cereus.
5.2 Saran
Perlu dilakukan penapisan zat protein antibakteri seperti bakteriosin pada
berbagai konsentrasi pengendapan amonium sulfat sehingga dimungkinkan
terdeteksinya senyawa protein antibakteri yang dihasilkan oleh isolat NS(9).
Pengukuran konsentrasi tiap jenis asam organik yang terkandung dalam
supernatan tersebut perlu dilakukan untuk mempertegas hasil penelitian ini. Selain
itu penerapan zat asam organik antibakteri yang diproduksi oleh isolat NS(9) pada
pangan perlu dilakukan untuk mengetahui efektifitas penghambatan zat asam
organik tersebut pada mikroba dalam pangan sebenarnya dengan metode TPC.
Penerimaan kosumen terhadap aplikasi zat asam organik yang diproduksi oleh
isolat NS(9) pada pangan melalui uji hedonik dan organoleptik juga sebaiknya
dilakukan untuk penelitian yang selanjutnya. Pembuktian GRAS juga dapat
dilakukan dengan mencari dosis letal (lethal dose) pada senyawa asam organik
YOGA INDRA PURNAMA
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
YOGA INDRA PURNAMA. C34070060. Produksi Senyawa Antibakteri Isolat Bakteri NS(9) dari Bekasam Ikan Nila (Oreochromis niloticus). Dibimbing Oleh: DESNIAR dan IRIANI SETYANINGSIH
Keamanan pangan merupakan salah satu isu yang paling penting karena berhubungan langsung pada kesehatan manusia. Pelanggaran terhadap keamanan pangan dapat menyebabkan suatu kasus yang dinamakan foodborne diseases, atau penyakit yang disebabkan oleh keracunan pangan, antara lain bahaya biologis, kimiawi dan fisik. Bahaya biologis umumnya disebabkan oleh mikroba patogen dan dapat dicegah dengan penambahan bahan preservatif pada pangan dengan tujuan membunuh atau menghambat bakteri patogen. Bahan preservatif sintetis mampu menimbulkan potensi bahaya kimia karena berpotensi sebagai karsinogen. Biopreservatif digunakan untuk mencegah bahaya kimia pada preservatif sintetis. Biopreservatif merupakan bahan pengawet pangan alami yang berasal dari mikroba seperti bakteri asam laktat karena zat metabolit sekunder yang dihasilkannya yang cenderung tidak berbahaya dan memiliki efek inhibitor pada bakteri lain seperti inhibitor pada bakteri enteropatogenik. Bakteri asam laktat biasa ditemukan pada produk makanan fermentasi. Salah satu produk fermentasi perikanan di Indonesia adalah bekasam.
Penelitian ini bertujuan untuk mempelajari potensi senyawa antibakteri yang dihasilkan oleh isolat bakteri asam laktat NS(9) yang diisolasi dari bekasam ikan nila (Oreochromis niloticus) dan memproduksi senyawa antibakteri dari isolat NS(9) serta menghitung daya hambat maksimum senyawa yang dihasilkan dari isolat NS(9) terhadap patogen pada makanan.
Penelitian dibagi menjadi tiga tahap. Tahap pertama adalah karakterisasi isolat NS(9). Tahap kedua adalah penapisan antibakteri. Tahap ketiga adalah produksi antibakteri selama 24 jam yang meliputi penentuan waktu optimum produksi antibakteri, pengukuran kadar asam laktat, dan pengukuran kadar protein dengan menggunakan metode Bradford.
Isolat NS(9) yang diisolasi dari bekasam ikan nila (Oreochromis niloticus) merupakan bakteri asam laktat. Isolat NS(9) menghasilkan zat asam organik yang memiliki aktivitas antibakteri. Zat antibakteri jenis protein seperti bakteriosin tidak terdeteksi pada pengendapan supernatan dari isolat NS(9) dengan amonium sulfat 50%. Isolat NS(9) memiliki fase pertumbuhan dengan puncak pertumbuhan pada jam ke-12 dan stasioner hingga jam ke-21 dan turun kembali pada jam ke-24. Produksi optimum zat asam organik dari isolat NS(9) yang memiliki aktivitas antibakteri terdapat pada jam ke-12 hingga jam ke-24.
Isolat NS(9) menghasilkan zat antibakteri asam organik yang mampu menghambat pertumbuhan lima jenis patogen pada makanan yaitu Escherichia coli, Salmonella typhimurium, Staphylococcus aureus, Bacillus cereus, dan
YOGA INDRA PURNAMA C34070060
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul : Produksi Senyawa Antibakteri Isolat Bakteri NS(9) dari Bekasam Ikan Nila (Oreochromis niloticus)
Nama : Yoga Indra Purnama
NRP : C34070060
Menyetujui,
Mengetahui,
Ketua Departemen Teknologi Hasil Perairan
Dr. Ir. Ruddy Suwandi, MS, M.Phil NIP. 19580511 198503 1 002
Tanggal lulus:……… Pembimbing I
Desniar, S.Pi, M.Si NIP : 19701224 199702 2 001
Pembimbing II
Dengan ini saya menyatakan bahwa skripsi dengan judul “Produksi Senyawa Antibakteri Isolat Bakteri NS(9) dari Bekasam Ikan Nila (Oreochromis niloticus)” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal
atau dikutip dari karya yang telah diterbitkan dari penulis lain telah disebutkan
dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, November 2011