! "# " $ "
%"& "' ! ()* %) %(')+! ,+ $ ) %" ! *, ' & "# %) * $%"# " *" $ %( ') ( !%"##+" ( " %, )+' %' , %' ' %%" ! *, ' '%) % +' $ , - .
- /. - 0. - . - . $ " - 1 ( ') ( ( ) ('%) '%) % +' (%!+$ "
$ +2 (' 3 ' "& '%) $ % %) ! ()* '*#%" $ " "*" '*#%" ,"& % # " %( ') (
( ) *, ' ('%) ! ) " '%) % +' !%! , ( (' 3 ' ! ' " '%) $ . 4.
. . . $ " *" %"') ! ' " ! " !+! 5 46 $ )
+ %)" ' " ('%) ! ) " '%) % +' %)( ) "' ) .78 "## 8 , ()*! '*#) 9 , ' $ " ) : 1;7 "! !%"+"2+(( " ! "#-! "# *, ' ('%) ! ) " !%! , (
9) ( & "# (' 9 !%"# ! ' !%, ,+ +2 * +'*#) 9 + $ ) %" ! *, '
!%! #%" 5 6 $ " , ! $ ) %" ! *, ' !%! #%"
5 6
' (+"< = ('%) & "# %) * $%"# " *" . %"& * (' 9. (' 3 ' "' ! ()*
4 : 4
4 44 4 4
"$%) $ )%<' *" *9 "$
$% %<')+! *9 "' ! <)* , <*! *+"$ 9)*! > <'%) *< '%$ ' ' % *"#% %)% %>') <'%$ + "# %' &, <%' '% *,3%"' * % *, '% %)% - . - /. - 0. - . - . "$ - 1 <'%) , <)+$% %>') <' %)% '% '%$ ' % ) <' 3 ' % # " ' ' *#%" < "$ "*" ' *#%" < ! <)* % % )% +,' * %$ ' ' <)+$% %>') <' *9
<'%) , *, '% $ " '*)& <' 3 '& # " ' . 4. . .
. " !+! " '*)& <*"<%"') ' *" 5 46 *9 <'%) , + %)" ' "' ) "#%$ %' %%" 78 '* 8 " , &%) < )*! '*#) & 9'%) %>') <' +"$%) : 1;7 "! "$ < '%$ ' ' % < <'%) , *, '% $ " <' 3% 9) <' *" " '%$ ' )*+# * +'*#) & '% ' * *+' *9 ' % > *, '% < )) %$ #%"% %"<*$ "# 5 6
"$ 9 3% *+' *9 > *, '% %"<*$ "# 5 6
1 Spons merupakan nenek moyang
metazoa lebih dari 580 juta tahun lalu. Habitatnya terdapat pada lingkungan tropis dan subtropis tetapi juga ditemukan pada tempat yang lebih tinggi dan pada danau air tawar dan aliran sungai. Sampai saat ini telah ditemukan 15.000 spesies spons, namun keragamannya mungkin jauh lebih besar. Spons sebagai organisme
mampu mengolah ribuan liter air laut per hari. Pada permukaan tubuhnya terdapat lubang kecil sebagai tempat masuknya air, partikel organik dan sirkulasi kanal tubuhnya. Spons menjadi inang dari berbagai jenis komunitas mikroba secara umum yang dapat mencapai 50!60% dari tubuhnya (Wang 2006). Peran dari mikroba tersebut bervariasi, mulai dari sumber makanan hingga melakukan simbiosis mutualisme dengan spons itu sendiri (Kennedy 2009). Spons berperan sebagai substrat bagi mikroba, menyediakan akses ke matahari bagi mikroba yang berfotosintesis, dan sebagai pensuplai nutrisi. Keuntungan bagi spons dari simbiosis ini antara lain meningkatkan kepadatan spons, menghancurkan zat yang tak dapat larut oleh kolagen spons, dan penggunaan metabolit sekunder yang dihasilkan oleh mikrob tersebut sebagai mekanisme pertahanan terhadap kompetitor dan predator (Taylor 2007).
Para peneliti menemukan bahwa spons menghasilkan metabolit sekunder sebagai mekanisme perlindungan diri. Penelitian lain juga mengungkapkan bahwa metabolit sekunder ini tidak hanya berperan dalam metabolisme organisme tersebut tetapi juga berperan dalam strategi adaptasi organisme terhadap lingkungannya (Thakur & Müller 2004). Pada species sp. lebih dari 190 metabolit dengan aktivitas spektrum luas telah diisolasi (Yu 2006). Senyawa tersebut diketahui sebagai
, antimikrob, antifungi, antimalaria, dan sitotoksik (Fiesler 2004). Senyawa yang diisolasi dari sp. mencakup steroid, terpenoid, poliasetilen, alkaloid, peptida asam lemak tak jenuh, dan poliketida (Yu 2006). Isolasi dan identifikasi komponen!komponen senyawa organik yang berpotensi sebagai senyawa bioaktif dapat dilakukan dengan beberapa
cara, salah satunya dengan kromatografi lapis tipis (KLT)
KLT merupakan teknik pemisahan senyawa berdasarkan distribusi komponen yang berbeda dari suatu campuran antara fase gerak dan fase diam (Khopkar 1990). Hasil pemisahan senyawa tersebut akan menghasilkan fraksi!fraksi yang terpisah sepanjang pelat KLT berdasarkan tingkat kepolarannya. Setiap fraksi menghasilkan nilai Rf yang merupakan langkah awal untuk memperkirakan jenis suatu komponen senyawa organik yang telah terpisah (Smart 2002; Furniss 1984). Untuk melihat ada tidaknya aktivitas fraksi yang dihasilkan dari uji KLT maka dilakukan uji lanjut yaitu uji bioautografi.
Analisis fungsional metagenom telah menghasilkan banyak senyawa baru (Gillespie 2002),
baru (PKS) (Courtois 2003; Moffitt and Neilan 2003), dan fungsi baru seperti sistem asosiasi membran proteolitik (Beja
2000). (PKS) dan
non!ribosomal (NRPS)
merupakan kompleks enzim multifungsional yang berperan dalam sintesis beragam struktur senyawa bioaktif secara luas, kebanyakan merupakan kepentingan medis (Hutchinson 2003).
Berbagai senyawa antimikrob telah diisolasi dari bakteri yang berasosiasi dengan spons. Bakteri yang berasosiasi
dengan spons sp. dapat
menghasilkan senyawa bioaktif yang
menghambat non!
patogen, patogen,
non!patogen, EPEC,
, dan . Berdasarkan
analisis kekerabatannya keenam isolat yaitu HAA!02, HAA!07, HAL!08, HAL!20, HAL!10, HAL!23 menunjukkan homologi dengan genus Aktivitas antimikrob ditunjukkan dengan adanya konsentrasi hambat minimum (MIC) yaitu konsentrasi terendah dari senyawa antimikrob yang akan menghambat pertumbuhan mikroorganismee setelah diinkubasi selama satu malam (Andrews 2001). Pada penelitian ini dilakukan uji MIC, ekstraksi senyawa antimikrob dengan menggunakan etil asetat, analisis kandungan dan aktivitas antimikrob fraksi senyawa ekstrak kasar, serta deteksi gen penyandi domain KS pada
(PKS) dan domain A pada non!
2 Penelitian ini bertujuan menganalisis
senyawa bioaktif antimikrob bespektrum luas dari bakteri yang berasosiasi dengan
spons sp.
Penelitian ini dilaksanakan dari bulan Januari 2011 hingga Juni 2011 di Laboratorium Mikrobiologi Departemen Biologi, FMIPA, IPB.
Bahan yang digunakan adalah isolat! isolat terbaik dari bakteri yang berasosiasi dengan spons hasil penelitian terdahulu yaitu HAA!02, HAA!07, HAL!08, HAL!20, HAL!10, HAL!23 koleksi Pauliasi Tokasaya (2010).
Mikrob indikator yang digunakan untuk uji antagonis adalah
(EPEC)
K.1.1, ,
dan . Media yang digunakan
yaitu SWC ( ), NB
(! ), NA (! " ), PDB
( # ) dan PDA (
# " ). Pelarut yang digunakan untuk ekstraksi adalah etil asetat. Alat!alat laboratorium yang digunakan adalah pelat KLT ($% "
60F254 produksi Merck) vorteks, laminar (Jouan, Perancis), autoklaf, , mesin PCR, pipet mikro, cawan, tabung, serta peralatan umum yang digunakan di laboratorium.
!"
Isolat bakteri marin dikulturkan dalam medium SWC lalu diinkubasi selama tiga hari di suhu ruang. Mikrob target diremajakan kembali dalam media NB untuk
EPEC, dan
atau dalam media PDB untuk
dan Mikrob target
tersebut diinkubasi selama 24 jam pada suhu ruang kemudian diinkubasi kemudian disentrifugasi dengan kecepatan 10000 rpm selama 30 menit. Filtrat dari hasil sentrifugasi dimasukkan ke dalam 5 tabung reaksi dengan konsentrasi yang berbeda! beda masing!masing 6.25%, 12.5%, 25%, 50%, dan 100%. Selain kelima konsentrasi
tersebut, dibuat juga kontrol yang tidak diberi filtrat bakteri. Setelah itu, masing! masing tabung diisi dengan 1 ml bakteri target. Biakan uji MIC tersebut lalu diinkubasi selama 24 jam. Kemudian diamati kekeruhan masing!masing biakan di dalam tabung reaksi. MIC ditentukan berdasarkan kekeruhan biakan dibandingkan dengan kontrol.
# # $ % & '
#
Isolat bakteri marin dikulturkan ke dalam 500 ml media SWC cair. Kultur diinkubasi pada mesin penggoyang (100 rpm, 30 ºC) selama tiga hari. Kemudian ke dalam kultur ditambahkan 500 ml etil asetat, diaduk selama 3 jam, dan dievaporasi. Ekstrak yang dihasilkan disimpan pada suhu 5 ºC untuk pemakaian selanjutnya (Muller
2004).
# ( # $ % &
)
Mikrob indikator dikultur selama 24 jam. Sebanyak 1% kultur mikrob indikator dicampurkan ke media NA dan PDA semi padat lalu dituangkan di cawan. Ekstrak kasar senyawa antimikrob yang telah dilarutkan dengan metanol (100 mg/ml) diteteskan ke kertas cakram masing!masing sebanyak 100 Dl kemudian diletakkan di permukaan media agar semipadat tersebut. Cawan uji diinkubasi selama 24 jam. Hasil uji positif ditunjukkan dengan terbentuknya zona bening.
* # # # #
Isolasi dan identifikasi senyawa bioaktif sampel dilakukan dengan KLT terhadap senyawa organik dari ekstrak kasar. Fraksinasi dilakukan pada pelat 25 $%
" 60F254.
3 antimikrob kemudian diuji aktivitasnya
(bioautografi) untuk mengetahui komponen antimikrob yang dapat menghambat bakteri.
# # + # ) $ % &
# * # # ' "
Bahan yang digunakan adalah pelat KLT yang mengandung senyawa yang sudah difraksinasi. Pelat tersebut disterilisasi menggunakan sinar UV selama 30 menit, lalu diletakkan di atas agar nutrien pada cawan petri. Kemudian lapisan tersebut dilapisi oleh media agar cair yang mengandung bakteri uji
dengan metode agar tuang, kemudian diinkubasi pada suhu 37 ºC selama 24 jam. Setelah masa inkubasi, zona bening yang terbentuk diamati, untuk melihat komponen senyawa organik yang dapat menghambat pertumbuhan bakteri (Zheng 2005).
# # ,
Isolat bakteri dikulturkan dalam media kaldu SWC selama 24 jam. Sebanyak 1.5 ml kultur disentrifugasi 10000 rpm selama 10 menit. DNA genom bakteri diekstrak dengan mengikuti metode CTAB (Sambrook & Russell 2001).
# ($ , ($
, - $
!-Reaksi PCR untuk mengamplifikasi domain KS dari gen penyandi PKS dan domain A dari gen penyandi NRPS dilakukan dengan mengikuti metode
Schirmer (2005). Reaksi PCR
dilakukan sebanyak 30 siklus dengan masing!masing tahap yaitu predenaturasi selama 1 menit dan denaturasi selama 30 detik pada suhu 94 ºC, 50 ºC selama 30 detik, polimerisasi 75 ºC selama 1 menit 10 detik, dan post PCR dilakukan pada suhu 72 ºC selama 5 menit. Visualisasi amplikon PKS dan NRPS dilakukan melalui elektroforesis. Isolat yang mempunyai gen penyandi domain keto!sintase (KS) dari PKS menunjukkan terbentuknya pita pada ukuran di sekitar 700 pasang basa ( ), sedangkan pada deteksi gen penyandi domain adenilasi (A) dari NRPS ditunjukkan dengan munculnya pita pada ukuran sekitar 1000 bp.
$
$
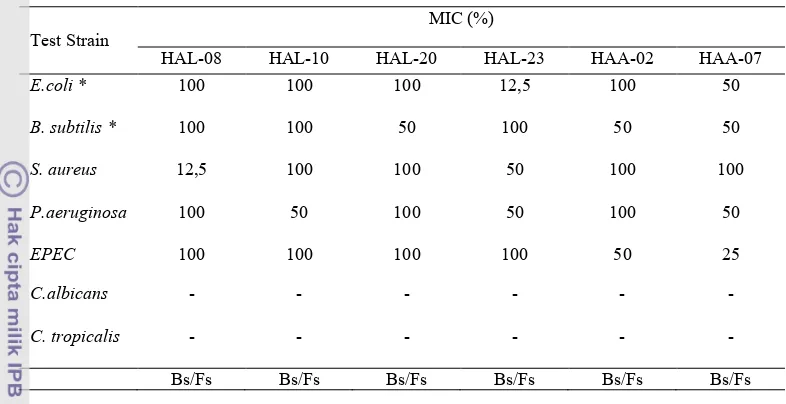
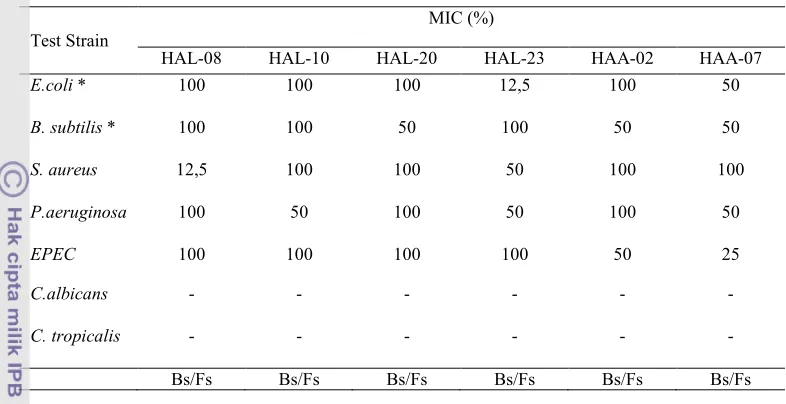
Uji MIC menghasilkan kisaran hambatan yang berbeda, yaitu antara 12,5%
sampai 100% Isolat HAL!08 memiliki nilai MIC sebesar 12,5% terhadap
(Tabel 1). Hal ini merupakan indikasi yang bagus terhadap efek senyawa antimikrob yang dihasilkan oleh isolat tersebut. HAL! 10 menghambat paling kuat terhadap
. HAL!20 menghambat paling kuat terhadap . HAL!23 memiliki nilai MIC yang tinggi yaitu 12,5% terhadap . Selain itu isolat ini juga memiliki aktivitas hambat yang tinggi terhadap
dan . Isolat HAA!02
memiliki aktivitas hambat terhadap dan EPEC dengan konsentrasi sebesar 50%. Sedangkan HAA!07 menghambat EPEC dengan konsentrasi 25%. Berdasarkan uji MIC, semua isolat hanya menghambat pertumbuhan bakteri atau bakteriostatik.
Semua supernatan dari bakteri marin tidak memiliki aktivitas terhadap
dan . Hal ini karena kedua cendawan tersebut merupakan cendawan patogen yang memiliki dinding sel yang tebal sehingga sulit untuk didegradasi. Selain itu terdapat mekanisme pertahanan dari sel cendawan patogen tersebut yang dapat menghambat atau menghilangkan efek senyawa bioaktif dari supernatan bakteri marin, seperti produksi enzim, perubahan permeabilitas dinding sel, dan jalur metabolik yang menjadi target dari senyawa bioaktif tersebut (Lay 1994). Uji MIC bersifat tidak stabil tergantung dari mikrob uji, ukuran inokulum, komposisi kultur media, waktu inkubasi, dan kondisi inkubasi seperti temperatur, pH, dan aerasi (Tokasaya 2010).
# ( # $ % &
)
Bagian selanjutnya dari penelitian ini yaitu ekstraksi senyawa bioaktif dari bakteri dengan menggunakan etil asetat. Proses ekstraksi menghasilkan ekstrak kasar senyawa bioaktif sebagai antimikrob. Hasil yang didapat dari uji
menggunakaan difusi
3 antimikrob kemudian diuji aktivitasnya
(bioautografi) untuk mengetahui komponen antimikrob yang dapat menghambat bakteri.
# # + # ) $ % &
# * # # ' "
Bahan yang digunakan adalah pelat KLT yang mengandung senyawa yang sudah difraksinasi. Pelat tersebut disterilisasi menggunakan sinar UV selama 30 menit, lalu diletakkan di atas agar nutrien pada cawan petri. Kemudian lapisan tersebut dilapisi oleh media agar cair yang mengandung bakteri uji
dengan metode agar tuang, kemudian diinkubasi pada suhu 37 ºC selama 24 jam. Setelah masa inkubasi, zona bening yang terbentuk diamati, untuk melihat komponen senyawa organik yang dapat menghambat pertumbuhan bakteri (Zheng 2005).
# # ,
Isolat bakteri dikulturkan dalam media kaldu SWC selama 24 jam. Sebanyak 1.5 ml kultur disentrifugasi 10000 rpm selama 10 menit. DNA genom bakteri diekstrak dengan mengikuti metode CTAB (Sambrook & Russell 2001).
# ($ , ($
, - $
!-Reaksi PCR untuk mengamplifikasi domain KS dari gen penyandi PKS dan domain A dari gen penyandi NRPS dilakukan dengan mengikuti metode
Schirmer (2005). Reaksi PCR
dilakukan sebanyak 30 siklus dengan masing!masing tahap yaitu predenaturasi selama 1 menit dan denaturasi selama 30 detik pada suhu 94 ºC, 50 ºC selama 30 detik, polimerisasi 75 ºC selama 1 menit 10 detik, dan post PCR dilakukan pada suhu 72 ºC selama 5 menit. Visualisasi amplikon PKS dan NRPS dilakukan melalui elektroforesis. Isolat yang mempunyai gen penyandi domain keto!sintase (KS) dari PKS menunjukkan terbentuknya pita pada ukuran di sekitar 700 pasang basa ( ), sedangkan pada deteksi gen penyandi domain adenilasi (A) dari NRPS ditunjukkan dengan munculnya pita pada ukuran sekitar 1000 bp.
$
$
Uji MIC menghasilkan kisaran hambatan yang berbeda, yaitu antara 12,5%
sampai 100% Isolat HAL!08 memiliki nilai MIC sebesar 12,5% terhadap
(Tabel 1). Hal ini merupakan indikasi yang bagus terhadap efek senyawa antimikrob yang dihasilkan oleh isolat tersebut. HAL! 10 menghambat paling kuat terhadap
. HAL!20 menghambat paling kuat terhadap . HAL!23 memiliki nilai MIC yang tinggi yaitu 12,5% terhadap . Selain itu isolat ini juga memiliki aktivitas hambat yang tinggi terhadap
dan . Isolat HAA!02
memiliki aktivitas hambat terhadap dan EPEC dengan konsentrasi sebesar 50%. Sedangkan HAA!07 menghambat EPEC dengan konsentrasi 25%. Berdasarkan uji MIC, semua isolat hanya menghambat pertumbuhan bakteri atau bakteriostatik.
Semua supernatan dari bakteri marin tidak memiliki aktivitas terhadap
dan . Hal ini karena kedua cendawan tersebut merupakan cendawan patogen yang memiliki dinding sel yang tebal sehingga sulit untuk didegradasi. Selain itu terdapat mekanisme pertahanan dari sel cendawan patogen tersebut yang dapat menghambat atau menghilangkan efek senyawa bioaktif dari supernatan bakteri marin, seperti produksi enzim, perubahan permeabilitas dinding sel, dan jalur metabolik yang menjadi target dari senyawa bioaktif tersebut (Lay 1994). Uji MIC bersifat tidak stabil tergantung dari mikrob uji, ukuran inokulum, komposisi kultur media, waktu inkubasi, dan kondisi inkubasi seperti temperatur, pH, dan aerasi (Tokasaya 2010).
# ( # $ % &
)
Bagian selanjutnya dari penelitian ini yaitu ekstraksi senyawa bioaktif dari bakteri dengan menggunakan etil asetat. Proses ekstraksi menghasilkan ekstrak kasar senyawa bioaktif sebagai antimikrob. Hasil yang didapat dari uji
menggunakaan difusi
4 semua ekstrak etil asetat positif terhadap
semua bakteri uji, hanya isolat HAA!07 yang tidak memiliki aktivitas hambat terhadap EPEC. hanya dapat dihambat oleh HAA!02, HAL!20, dan HAL! 23. Sedangkan semua ekstrak kasar tidak memiliki aktivitas terhadap .
Hasil penapisan yang diperoleh memiliki perbedaan dengan penelitian sebelumnya. Perbedaan yang dihasilkan disebabkan karena pelarut yang digunakan untuk ekstraksi berbeda.Pada penelitian sebelumnya pelarut yang digunakan yaitu n! butanol. Senyawa bioaktif memiliki kelarutan yang berbeda pada setiap pelarut yang berbeda pula. Perbedaan ini disebabkan karena adanya perbedaan tingkat polaritas. Pelarut polar akan menarik senyawa yang polar sedangkan pelarut yang nonpolar akan menarik senyawa yang nonpolar pula. Aktivitas hambatan dari senyawa antimikrob juga dipengaruhi oleh keberadaan dari senyawa pengotor yang terdapat pada ekstrak kasar bakteri marin.
Menurut Lay (1994) besarnya zona hambat yang dihasilkan dari senyawa bioaktif dipengaruhi oleh sifat fisik dan kimia dari senyawa tersebut, salah satunya dalah berat molekul. Semakin besar berat molekul senyawa bioaktif maka akan semakin besar zona hambat yang dihasilkan. Selain itu besarnya konsentrasi senyawa bioaktif juga mempengaruhi laju difusi senyawa bioaktif pada media agar. Semakin
besar konsentrasi dari senyawa bioaktif maka akan semakin besar laju difusinya pada media agar. Faktor lain yang
mempengaruhi penghambatan
mikroorganisme antara lain kepadatan populasi mikroorganisme, kepekaan terhadap senyawa antimikrob, kandungan bahan organik, suhu, dan lama waktu mikroorganisme terpapar bahan antimkrob.
# # ( # #
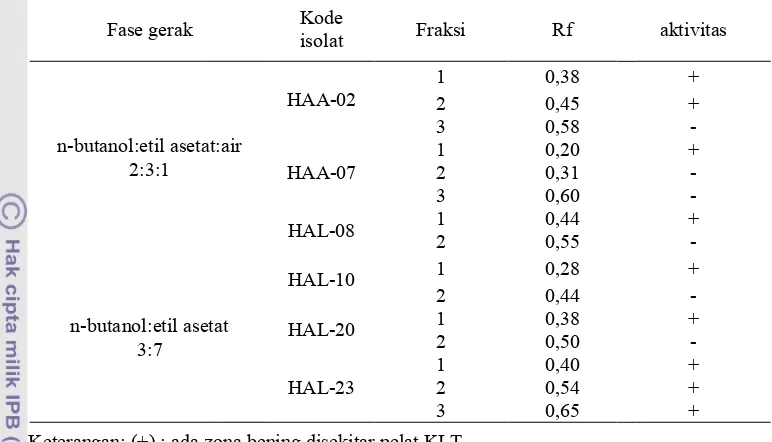
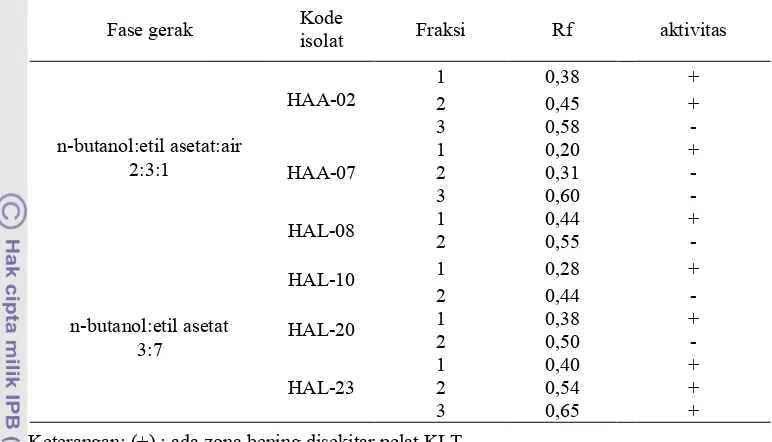
Analisis kandungan senyawa ekstrak etil asetat ini dilakukan dengan menggunakan kromatografi lapis tipis. Isolat
HAA!02, HAA!07, dan HAL!08
terfraksinasi oleh eluen n!butanol: etil asetat: akuades (2:3:1) sedangkan tiga isolat lainnya terfraksinasi oleh eluen n!butanol: etil asetat (3:7). Pada isolat HAA!02 dan HAA!07 dihasilkan tiga fraksi, sedangkan pada isolat HAL!08 dihasilkan dua fraksi HAA!02 memiliki nilai Rf 0,38; 0,45, dan 0,58 (Tabel 3). HAA!07 memiliki nilai Rf masing! masing 0,20; 0,31, dan 0,60. Isolat HAL!08 memiliki nilai Rf 0,44 dan 0,45 Isolat HAL! 23 memiliki Rf 0,40; 0,54, dan 0,65. Untuk isolat HAL!10 dan HAL!20 memiliki dua fraksi dengan nilai Rf berbeda yaitu 0,38 dan 0,50 dan 0,28 dan 0,44. Penggunaan eluen berbeda pada isolat!isolat tersebut. Isolat HAA!02, HAA!07, dan HAL!08 terfraksinasi dengan eluen yang terdiri dari n!butanol:etil asetat: akuades dengan Test Strain
MIC (%)
HAL!08 HAL!10 HAL!20 HAL!23 HAA!02 HAA!07
& 100 100 100 12,5 100 50
& 100 100 50 100 50 50
12,5 100 100 50 100 100
100 50 100 50 100 50
100 100 100 100 50 25
! ! ! ! ! !
! ! ! ! ! !
[image:6.595.111.504.123.325.2]Bs/Fs Bs/Fs Bs/Fs Bs/Fs Bs/Fs Bs/Fs
Tabel 1 ' ( dari supernatan bakteri asal spons sp.
terhadap bakteri dan cendawan pathogen serta bakteri non patogen.
perbandingan 2:3:1. Seda isolat lainnya tidak terfr terjadi karena senyawa yan masing!masing isolat be polaritasnya pun berbeda. dari n!butanol : etil ase perbandingan 2:3:1 m kepolaran yang lebih ting isolat lainnya memiliki po rendah. Oleh karena itu dig yang memiliki polaritas terdiri atas n!butanol: et perbandingan 3:7. Pada pe ini ketiga isolat lainnya
HAL!20, dan HAL!
Sedangkan ketiga isolat s mengalami fraksinasi.
Nilai Rf belum dapat identifikasi dengan kom tetapi hanya untuk komponen yang terkandun senyawa dan sebagai dasar
Tabel 2 Aktivitas antim sp.terhadap bakte Kode
Isolat
HAA!02 +++
HAA!07 +
HAL!08 ++
HAL!10 +
HAL!20 ++
HAL!23 ++
Keterangan : + : diameter zo +++++: > 25 mm
Gambar 1 Aktivitas a terhadap (c) HAL!08
a
b
Sedangkan pada tiga terfraksinasi. Hal ini a yang dikandung oleh lat berbeda, sehingga beda. Eluen yang terdiri il asetat : air dengan 1 memiliki tingkat h tinggi. Diduga ketiga liki polaritas yang lebih itu digunakan eluen lain lebih rendah yang ol: etil asetat dengan ada perbandingan eluen ainnya yaitu HAL!10, !23 terfraksinasi. solat sebelumnya tidak dapat dijadikan sebagai komponen senyawa, tuk melihat jumlah kandung dalam ekstrak
dasar purifikasi pada
‘
kromatografi kolom atau kinerja tinggi (HPLC).
Namun Ismet (
menemukan senyawa org dengan norharman (β!carb [3,4b] indole) yang dihas yang berasosiasi
) . memiliki nilai Rf 0,42 yan spons "
diperkirakan sama kare pelat KLT, sistem pelaru sistem yang sama.
+ # )
* # #
Fraksi yang diper fraksinasi ekstrak seny selanjutnya diuji aktivita
dengan met Hasil uji inimenunjukkan HAL!23 memiliki aktivitas antimikrob ekstrak etil asetat dari bakteri asal spon bakteri dan cendawan patogen serta bakteri non patogen.
Mikrob Uji & & +++ ++ +++ ++ ++ ++ ! ++ + ! +++ +++ +++ ++ ! ++ +++ ++ ++ ! +++ +++ ++ ++ ++ +++ +++ ++ ++ ++
eter zona hambat 6!9 mm; ++ : 10!14 mm ; +++ : 15!19 mm;++++ 5 mm ; *: non patogen
vitas antimikrob ekstrak etil asetat dari bakteri asal spon dengan kode isolat: (a) HAA 08, (d) HAL!10, (e) HAL!20, (f) HAL!23, dan (g) kontro
f
d
e
c
g
f
5 atau kromatografi cair
t (2007) berhasil organik yang mirip carboline, 9H!Pyrido dihasilkan dari bakteri
i dengan spons
Senyawa tersebut yang dihasilkan oleh Senyawa tersebut karena menggunakan pelarut, dan temperatur
) $ % & #
diperoleh dari hasil senyawa antimikrob ktivitasnya terhadap
metode bioautografi. ukkan ketiga fraksi dari tivitas hambat terhadap spons ++ + ++ ++ ++ ++
;++++ : 20!24 mm;
l spons sp.
HAA!02, (b) HAA!07, kontrol negatif.
g
[image:7.595.111.501.99.429.2] [image:7.595.111.500.118.332.2], yang ditand zona bening disekitar pel 2). Sedangkan pada isolat HAL!08, dan HAA!07 han yang memiliki aktivitas HAA_02 memiliki dua f dapat menghambat bakter satu dan dua (Tabel 3). Be tidak memiliki aktivitas ha muncul zuna bening dise Hal ini dikarenakan frak merupakan senyawa pe senyawa aktif yang tidak mikrob uji. Selain itu dapat
Fase gerak
n!butanol:etil asetat: 2:3:1
[image:8.595.105.507.92.716.2]n!butanol:etil aseta 3:7 Tabel 3. Fraksinasi da
Rf:0,60
Rf:0,31 Rf:0,20
(a)
Gambar 2 (a) Kromat bioautogr yang neg Keterangan: (+) : ada zo
ditandai dengan adanya ar pelat KLT (Gambar solat HAL!20, HAL!10, 7 hanya fraksi satu saja tivitas hambat. Isolat dua fraksi aktif yang bakteri uji yaitu fraksi 3). Beberapa fraksi lain itas hambat karena tidak g disekitar pelat KLT. n fraksi!fraksi tersebut a pengotor ataupun tidak terdeteksi dengan dapat juga fraksi
tersebut merupakan seny namun tidak sensitif terh yang digunakan. (Sudi secara tidak langsung bioautografi dapat diketah senyawa bioaktif yang da setiap ekstrak kasar da seperti spons
menghasilkan norharman 2005). Perbedaan munculn karena setiap pendeteksi yang berbeda.
Selain itu disebabkan tiap pelarut dalam mengelu Kode
isolat Fraksi Rf
asetat:air
HAA!02
1 0,38
2 0,45
3 0,58
HAA!07
1 0,20
2 0,31
3 0,60
HAL!08 1 0,44
2 0,55
il asetat
HAL!10 1 0,28
2 0,44
HAL!20 1 0,38
2 0,50
HAL!23
1 0,40
2 0,54
3 0,65
nasi dan uji aktivitas ekstrak etil asetat terhadap
f:0,60
f:0,31 f:0,20
(b)
romatogram dari kromatografi lapis tipis ekstrak metanol autografi HAA!07 yang positif (Rf 0,20); dan (c) hasil u
negatif (Rf 0,60)
ada zona bening disekitar pelat KLT
6 senyawa yang aktif if terhadap bakteri uji Sudirman 2005). Jadi sung melalui metode iketahui berapa banyak ang dapat diisolasi dari ar dari bakteri marin ) yang arman (Zheng
unculnya bercak terjadi eteksi memiliki fungsi bkan juga kekuatan dari engelusi sampel. aktivitas + + ! + ! ! + ! + ! + ! + + + (c)
[image:8.595.112.498.106.595.2] [image:8.595.112.498.107.328.2]7 Umumnya pelarut yang memiliki sifat
semipolar banyak memunculkan bercak dan yang terdapat dalam bakteri marin bersifat semipolar dapat memisahkan dengan baik. Sehingga dapat dikatakan bahwa senyawa! senyawa. Selain itu pola pemisahan senyawa yang diperoleh mencirikan perbedaan komposisi senyawa yang terkandung sehingga dapat dijadikan idetifikasi senyawa apa yang terkandung dalam ektrak tersebut. Sistem pengembangan yang digunakan pada KLT ini berdasarkan prinsip )
, yaitu memisahkan komponen yang bersifat polar menggunakan sistem pelarut yang bersifat polar dan memisahkan komponen yang bersifat non!polar menggunakan sistem pelarut non!polar. Sistem pengembangan ini akan lebih baik bila ruangan pengembangan telah jenuh dengan uap sistem pelarut (Christian 1994).
# , % ($ ($"
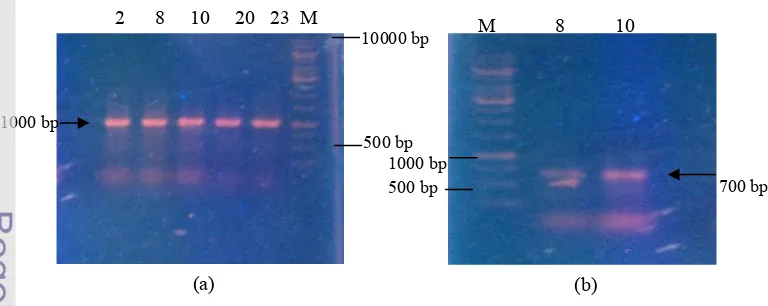
- $"
!-Isolat HAA!02, HAL!08, HAL!10, HAL!20, dan HAL!23 memiliki gen penyandi NRPS, sedangkan gen penyandi PKS hanya dimiliki oleh isolat HAL!08 dan HAL!10 (Gambar 3). Deteksi terhadap gen penyandi domain KS pada PKS menghasilkan pita berukuran 700 pasang basa, sedangkan deteksi gen penyandi domain A pada NRPS memiliki ukuran pita sebesar 1000 pasang basa.
Contoh dapat ditemukan dalam spons
# dan $
* , yang telah terbukti untuk menghasilkan senyawa antitumor (Gunasekera . 1990), onnamide dan theopederin (Piel
2004a). Selain itu, bakteri Salinispora
diisolasi dari spons )
telah diidentifikasi sebagai sumber antibiotik baru rifamycin, yang diproduksi oleh PKS (Kim 2006).
Karakteristik struktural dari senyawa bioaktif dari bakteri marin merupakan dua senyawa kimia penting yaitu poliketida dan siklopeptida yang dihasilkan oleh kompleks
multienzim yaitu (PKS)
dan (NRPS)
(Zhu 2009). Domain KS bertanggung jawab atas kondensasi unit ke rantai poliketida tumbuh selama biosintesis poliketida, dan terlibat dalam produksi berbagai macam struktural metabolit (Moffitt dan Neilan 2003). Analog dengan modul gen PKS, NRPS biasanya berisi adenylation (A) domain, peptidil pembawa protein domain, dan domain kondensasi (Schwarzer dan Marahiel 2001). Nonribosomal peptida disintesis oleh kondensasi monomer asam amino. Poliketida dibuat dari penambahan dua unit karbon ketida secara berulang yang berasal dari monomer asil!koenzim A, kemudian setiap unit disusun menjadi polimer linier berupa poliketida (Tanovic 2008).
Hasil deteksi gen PKS menunjukkan bahwa dua isolat bakteri marin positif menyandikan gen domain enzim ketosintase, yaitu HAL!08 dan HAL!10 (Gambar 3). Ketosintase merupakan salah satu jenis enzim yang berperan dalam sintesis
.
poliketida (Schirmer 2005). Selain itu, deteksi gen NRPS juga menunjukkan hasil positif pada lima isolat, yaitu HAA!02, HAL!08, HAL!10, HAL!20, dan HAL!23.
! merupakan
sistem biosintesis yang terkandung dalam jumlah yang besar dalam mikroorganisme. 2 8 10 20 23 M M 8 10
Gambar 3. Hasil visualisasi PCR gen (a) isolat HAA!02, HAL!08,HAL!10, HAL!20, dan HAL!23 (berurutan dari kiri ke kanan) mempunyai gen penyandi NRPS; (b) isolat HAL!08 dan HAL!10 mempunyai gen penyandi PKS.
10000 bp
1000 bp
500 bp 1000 bp
700 bp 500 bp
8 Modul inti pada NRPS dalam produksi
senyawa bioaktif pada minimal terdapat adenilat (A) untuk seleksi dan aktivasi monomer asam amino, domain kondensasi (C) untuk mengkatalisis bentuk ikatan
dan domain (PCP) dengan grup
untuk mentransfer monomer situs katalis. $
Keenam isolat bakteri marin yaitu HAA_02, HAA!07, HAL!08, HAL!10, HAL!20, dan HAL!23 merupakan bakteri penghasil senyawa antimikrob dengan spektrum yang luas. Hasil penapisan isolat dan ekstrak kasar isolat bakteri marin tersebut menunjukkan aktivitas antimikrob
terhadap EPEC,
, dan
Isolat!isolat ini memiliki konsentrasi hambat minimum yang berbeda!beda berkisar antara 12,5% sampai 100% tergantung dari mikrob uji. Hasil fraksinasi sebagian besar memiliki aktivitas hambat terhadap
dengan nilai Rf yang berbeda!beda. Isolat! isolat tersebut juga terdeteksi mempunyai gen penyandi PKS dan NRPS, yaitu HAL!08 dan HAL!10 untuk gen PKS dan HAA!02, HAL!08, HAL!10, HAL!20, dan HAL!23 untuk gen NRPS.
$
-Perlu dilakukan penelitian lanjutan untuk mengetahui fraksi senyawa antimikrob murni yang dihasilkan oleh bakteri marin melalui kromatografi preparatif.
*
-
$
(
Andrews JM. 2001. Determinations of minimum inhibitory concentration.
" 48: 5!16.
Beja O 2000. Construction and analysis of bacterial artificial chromosome libraries from a marine
microbial assemblage. )
' 2:516–529.
Blunt JW . 2008. Marine natural products. ! + 25: 35–94. Cane DE, Walsh CT, Khosla C. 1998.
Harnessing the biosynthetic code: combinations, permutations, and mutations. 282: 63–68.
Christian DG. 1994. " .
Fifth Edition. USA: University of Washington. John Wiley & Sons. Courtois S 2003. Recombinant
environmental libraries provide access to microbial diversity for drug discovery from natural products. "
) ' 69: 49–55.
Crosa JH, Walsh CT. 2002. Genetics and assembly line enzymology of siderophore biosynthesis in bacteria.
' ' + ) 66: 223–249.
Fiesler L, Horn M, Wagner W, Hentschel U. 2004. Discovery of the novel candidate
phylum “ ” in marine
sponges. " ) ' 60:
3724–3732.
Furniss BS, AJ Hannaford, V Rogers, PWG Smith, AR Tatchell. 1984. ,
-$ Organik
. ( / )
Organik . Fourth edition.
England: English Languange Book Society/ Longman.
Gillespie DE 2002. Isolation of antibiotics turbomycin A and B from metagenomic library of soil microbial
DNA. " ) ' 68:
4301–4306.
Gunasekera SP, Gunasekera M, Longley
RE, Schulte GK. 1990.
Discodermolide–a new bioactive polyhydroxylated lactone from the
marine sponge # . 0
1 55: 4912–4915.
Hunt B, ACJ Vincent. 2006. Scale and sustainability of marine bioprospecting for pharmaceuticals. " 35: 57!64. Hutchinson CR. 2003. Polyketide and non!
ribosomal peptide synthases: falling together by coming apart. ! " 2 "100: 3010–3012.
Ismet MS. 2007. Penapisan senyawa bioaktif spons Aaptos aaptos dan petrosia sp. dari lokasi yang berbeda [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor
Kennedy J, Beker P, Piper C, Cotter PD, Walsh M . 2009. Isolation and analysis of bacteria with antimicrobial activities from the marine spons collected from Irish
waters. ' 33: 384–396.
Khopkar. 1990. Konsep Dasar Kimia Analitik. Saptoraharjo, penerjemah. Jakarta: UI Press
8 Modul inti pada NRPS dalam produksi
senyawa bioaktif pada minimal terdapat adenilat (A) untuk seleksi dan aktivasi monomer asam amino, domain kondensasi (C) untuk mengkatalisis bentuk ikatan
dan domain (PCP) dengan grup
untuk mentransfer monomer situs katalis. $
Keenam isolat bakteri marin yaitu HAA_02, HAA!07, HAL!08, HAL!10, HAL!20, dan HAL!23 merupakan bakteri penghasil senyawa antimikrob dengan spektrum yang luas. Hasil penapisan isolat dan ekstrak kasar isolat bakteri marin tersebut menunjukkan aktivitas antimikrob
terhadap EPEC,
, dan
Isolat!isolat ini memiliki konsentrasi hambat minimum yang berbeda!beda berkisar antara 12,5% sampai 100% tergantung dari mikrob uji. Hasil fraksinasi sebagian besar memiliki aktivitas hambat terhadap
dengan nilai Rf yang berbeda!beda. Isolat! isolat tersebut juga terdeteksi mempunyai gen penyandi PKS dan NRPS, yaitu HAL!08 dan HAL!10 untuk gen PKS dan HAA!02, HAL!08, HAL!10, HAL!20, dan HAL!23 untuk gen NRPS.
$
-Perlu dilakukan penelitian lanjutan untuk mengetahui fraksi senyawa antimikrob murni yang dihasilkan oleh bakteri marin melalui kromatografi preparatif.
*
-
$
(
Andrews JM. 2001. Determinations of minimum inhibitory concentration.
" 48: 5!16.
Beja O 2000. Construction and analysis of bacterial artificial chromosome libraries from a marine
microbial assemblage. )
' 2:516–529.
Blunt JW . 2008. Marine natural products. ! + 25: 35–94. Cane DE, Walsh CT, Khosla C. 1998.
Harnessing the biosynthetic code: combinations, permutations, and mutations. 282: 63–68.
Christian DG. 1994. " .
Fifth Edition. USA: University of Washington. John Wiley & Sons. Courtois S 2003. Recombinant
environmental libraries provide access to microbial diversity for drug discovery from natural products. "
) ' 69: 49–55.
Crosa JH, Walsh CT. 2002. Genetics and assembly line enzymology of siderophore biosynthesis in bacteria.
' ' + ) 66: 223–249.
Fiesler L, Horn M, Wagner W, Hentschel U. 2004. Discovery of the novel candidate
phylum “ ” in marine
sponges. " ) ' 60:
3724–3732.
Furniss BS, AJ Hannaford, V Rogers, PWG Smith, AR Tatchell. 1984. ,
-$ Organik
. ( / )
Organik . Fourth edition.
England: English Languange Book Society/ Longman.
Gillespie DE 2002. Isolation of antibiotics turbomycin A and B from metagenomic library of soil microbial
DNA. " ) ' 68:
4301–4306.
Gunasekera SP, Gunasekera M, Longley
RE, Schulte GK. 1990.
Discodermolide–a new bioactive polyhydroxylated lactone from the
marine sponge # . 0
1 55: 4912–4915.
Hunt B, ACJ Vincent. 2006. Scale and sustainability of marine bioprospecting for pharmaceuticals. " 35: 57!64. Hutchinson CR. 2003. Polyketide and non!
ribosomal peptide synthases: falling together by coming apart. ! " 2 "100: 3010–3012.
Ismet MS. 2007. Penapisan senyawa bioaktif spons Aaptos aaptos dan petrosia sp. dari lokasi yang berbeda [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor
Kennedy J, Beker P, Piper C, Cotter PD, Walsh M . 2009. Isolation and analysis of bacteria with antimicrobial activities from the marine spons collected from Irish
waters. ' 33: 384–396.
Khopkar. 1990. Konsep Dasar Kimia Analitik. Saptoraharjo, penerjemah. Jakarta: UI Press
9 source of rifamycin antibiotics in
marine sponge actinobacteria by phylogenetic prediction. " )
' 72: 2118–2125.
Lay KM. 1994. The biogeography and phylogeny of unicellular cyanobacterial symbionts in sponges from Australia and the Mediterranean. '
/01167–177.
Madigan MT, Martinko JM, Parker J. 2006.
' Ed
ke!8. Prentice Hall International, Inc. Moffitt MC, Neilan BA. 2003. Evolutionary
affiliations within the superfamily of ketosynthases reflect complex pathway associations. 0 ' ) 56: 446–457. Müller WEG 2004. Oxygen!controlled
Bacterial Growth in the Sponge : toward a Molecular Understanding of the symbiotic relationships between sponge and bacteria. " ) '
70: 2332!2341.
Peng Z, Zheng Y, You Y, Yan X, Shao J 2009. Molecular phylogeny and modular structure of hybrid NRPS/PKS gene fragment of Pseudoalteromonas sp. NJ6!3!2 isolatd from sponge
) 0 ( '
34: 229–237.
Piel J, Hofer I, Hui D. 2004. Evidence for a symbiosis island involved in horizontal acquisition of pederin biosynthetic capabilities by the bacterial symbiont of Paederus fuscipes beetles. 0
186: 1280–1286.
Sambrook W, Russel DW. 2001. Molecular Cloning: A Laboratory Manual. Ed ke! 3. New York: Gold Spring Harbor Laboratory.
Schirmer A . 2005. Metagenomic analysis reveal diverse polyketide synthase gene cluster in microorganisms associated with the marine sponge
# . " )
' 71: 4840!4849.
Schwarzer D, Marahiel MA. 2001. Multimodular biocatalysts for natural product assembly. ! *
88: 93–101.
Smart L. 2002. $ ' .
( . Cambridge: The Open
University.
Stahl E. 1985. Analisis Obat secara Kromatografi dan Mikroskopi. Padmawinata K, penerjemah. Bandung:
ITB. Terjemahan dari: Drug Analysis by Chromatography and Microscopy. Staunton JK, Weissman JK. 2001.
Polyketide biosynthesis. ! + 18: 380!416.
Sudirman LI. 2005. Detection of antimicrobial compounds isolatd from
several tropical % by
bioautographic method. 12:67! 72.
Tanovic A, Samel SA, Essen LO, Marahiel MA. 2008. Peptide synthetase crystal structure of the termination module of a nonribosomal. 321: 659!663. Taylor MW, Radax R, Steger D, Wagner M.
2007. Spons associated
microorganisms: evolution,ecology and biotechnological potential. '
' + ) 53: 295–347.
Thakur NL, Müller WEG. 2004. Biotechnological potential of marine sponges. 33. 86.
Tokasaya P. 2010. Sponge!associated bacteria producing antimicrobial compounds and their genetic biodiversity analysis. [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor
Wang G. 2006. Diversity and biotechnological potential of the spons! associated microbial consortia. 0 (
' 66: 545–551.
Yu S, Deng Z, Proksch P, Lin W. 2006. Oculatol, oculatolide, and Anor sterols from the sponge oculata. 0
! 69:1330–1334.
Zhang H, Lee YK, Zhang W, Lee HK. 2006. Culturable actinobacteria from the
marine spons ) :
isolation and phylogenetic diversity by 16 SrRNA gene!RFLP analysis. "
) % * 90: 159–169.
Zheng L, H Chen, X Han, X Yan. 2005. Antimicrobial screening and active compound isolation from marine bacterium NJ6!3!1 associated with the
sponge ) . 0
! "# " $ "
%"& "' ! ()* %) %(')+! ,+ $ ) %" ! *, ' & "# %) * $%"# " *" $ %( ') ( !%"##+" ( " %, )+' %' , %' ' %%" ! *, ' '%) % +' $ , - .
- /. - 0. - . - . $ " - 1 ( ') ( ( ) ('%) '%) % +' (%!+$ "
$ +2 (' 3 ' "& '%) $ % %) ! ()* '*#%" $ " "*" '*#%" ,"& % # " %( ') (
( ) *, ' ('%) ! ) " '%) % +' !%! , ( (' 3 ' ! ' " '%) $ . 4.
. . . $ " *" %"') ! ' " ! " !+! 5 46 $ )
+ %)" ' " ('%) ! ) " '%) % +' %)( ) "' ) .78 "## 8 , ()*! '*#) 9 , ' $ " ) : 1;7 "! !%"+"2+(( " ! "#-! "# *, ' ('%) ! ) " !%! , (
9) ( & "# (' 9 !%"# ! ' !%, ,+ +2 * +'*#) 9 + $ ) %" ! *, '
!%! #%" 5 6 $ " , ! $ ) %" ! *, ' !%! #%"
5 6
' (+"< = ('%) & "# %) * $%"# " *" . %"& * (' 9. (' 3 ' "' ! ()*
4 : 4
4 44 4 4
"$%) $ )%<' *" *9 "$
$% %<')+! *9 "' ! <)* , <*! *+"$ 9)*! > <'%) *< '%$ ' ' % *"#% %)% %>') <'%$ + "# %' &, <%' '% *,3%"' * % *, '% %)% - . - /. - 0. - . - . "$ - 1 <'%) , <)+$% %>') <' %)% '% '%$ ' % ) <' 3 ' % # " ' ' *#%" < "$ "*" ' *#%" < ! <)* % % )% +,' * %$ ' ' <)+$% %>') <' *9
<'%) , *, '% $ " '*)& <' 3 '& # " ' . 4. . .
. " !+! " '*)& <*"<%"') ' *" 5 46 *9 <'%) , + %)" ' "' ) "#%$ %' %%" 78 '* 8 " , &%) < )*! '*#) & 9'%) %>') <' +"$%) : 1;7 "! "$ < '%$ ' ' % < <'%) , *, '% $ " <' 3% 9) <' *" " '%$ ' )*+# * +'*#) & '% ' * *+' *9 ' % > *, '% < )) %$ #%"% %"<*$ "# 5 6
"$ 9 3% *+' *9 > *, '% %"<*$ "# 5 6
()
%
#
,
'+ & ) ' +"'+( !%! %)*,% #%, )
)2 "
"
$
?+$+, () = " , %"& * (' 9 "' ! ()* %) %(')+! + $ ) ('%) & "# %) * $%"# " *"
! = *( % #+"# %)! "
= 1@ / ;
%"&%'+2+ =
%"#%' + . %'+ % )'%!%" *,*#
) ) "<% )!* ? & + %" .
A;@ A0A 1
"## , +,+ =
%! ! "#
) ) ) &+$ .
A;1 / 7 AA 1 7
%! ! "#
) +$ * ).
i
! " #
$ %&'' $ %&'' " ! ( !
) * ( + +
, ) ( ) ) (
! ! !
-. / + ( " ! ( ! 0
+! " ! 1 !
, ! ,
22 3 ! 3
! ! !
! ! !
ii
$ '% '566
-7 $ !
( 5 $ %&&2 ( 86
$ %&&9 +
- (+ :- ( + ;
! 0 ) + "
) ! < (
:<+( +4; %&&5 %&'& ")1 )1( < %&&6
0/-( 7 %&&6 ! !
+ %&&5 / = %&&5 * = + ( %&&6 !
) %&&5 1 = (
iii
) ! >>>>>>>>>>>>>>>>>>>>>>>>>>>>> =) 7 ! >>>>>>>>>>>>>>>>>>>>>>>>>>>>>>> =
>>>>>>>>>>>>>>>>>>>>>>>>>> ' " >>>>>>>>>>>>>>>>>>>>>>>>>>>>> ' >>>>>>>>>>>>>>>>>>>>>>>>>>>>> % >>>>>>>>>>>>>>>>>>>>>>> %
% >>>>>>>>>>>>>>>>>>>>>>>>>>>>> % ( >>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>> %
- :(+3; >>>>>>>>>>>>>>> %
0 ( 0 >>>>>>>>>> %
0 1 ! >>>>>>>>>>>>>>> % * 0 0 >>>>>>>>>>>>>>>>>>>>> %
= ! < * : ;>>>>> ?
+ 7 >>>>>>>>>>>>>>>>>>>>>>>>>>>> ?
) 7 ) 1 : 1 ; ) : / ; 3/ >> ?
>>>>>>>>>>>>>>>>>>>>>>>> ? >>>>>>>>>>>>>>>> ? 0 1 !>>>>>>>>>>>>>>>> ? 1 0 1 >>>>>>>>>>>>>>>>>>>> 2 = ! < * >>>>>>>>>>>>>>> 8
) 7 ) 1 : 1 ; ) : / ; 3/>> 9
>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>> 6
>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>>> 6
iv
' !
! , 2
% = ! !
! , 8
? * = >>>>>>> @
' = ! !
8
% 1 ! @
? < = 3/ 1 / 9
<
1 Spons merupakan nenek moyang
metazoa lebih dari 580 juta tahun lalu. Habitatnya terdapat pada lingkungan tropis dan subtropis tetapi juga ditemukan pada tempat yang lebih tinggi dan pada danau air tawar dan aliran sungai. Sampai saat ini telah ditemukan 15.000 spesies spons, namun keragamannya mungkin jauh lebih besar. Spons sebagai organisme
mampu mengolah ribuan liter air laut per hari. Pada permukaan tubuhnya terdapat lubang kecil sebagai tempat masuknya air, partikel organik dan sirkulasi kanal tubuhnya. Spons menjadi inang dari berbagai jenis komunitas mikroba secara umum yang dapat mencapai 50!60% dari tubuhnya (Wang 2006). Peran dari mikroba tersebut bervariasi, mulai dari sumber makanan hingga melakukan simbiosis mutualisme dengan spons itu sendiri (Kennedy 2009). Spons berperan sebagai substrat bagi mikroba, menyediakan akses ke matahari bagi mikroba yang berfotosintesis, dan sebagai pensuplai nutrisi. Keuntungan bagi spons dari simbiosis ini antara lain meningkatkan kepadatan spons, menghancurkan zat yang tak dapat larut oleh kolagen spons, dan penggunaan metabolit sekunder yang dihasilkan oleh mikrob tersebut sebagai mekanisme pertahanan terhadap kompetitor dan predator (Taylor 2007).
Para peneliti menemukan bahwa spons menghasilkan metabolit sekunder sebagai mekanisme perlindungan diri. Penelitian lain juga mengungkapkan bahwa metabolit sekunder ini tidak hanya berperan dalam metabolisme organisme tersebut tetapi juga berperan dalam strategi adaptasi organisme terhadap lingkungannya (Thakur & Müller 2004). Pada species sp. lebih dari 190 metabolit dengan aktivitas spektrum luas telah diisolasi (Yu 2006). Senyawa tersebut diketahui sebagai
, antimikrob, antifungi, antimalaria, dan sitotoksik (Fiesler 2004). Senyawa yang diisolasi dari sp. mencakup steroid, terpenoid, poliasetilen, alkaloid, peptida asam lemak tak jenuh, dan poliketida (Yu 2006). Isolasi dan identifikasi komponen!komponen senyawa organik yang berpotensi sebagai senyawa bioaktif dapat dilakukan dengan beberapa
cara, salah satunya dengan kromatografi lapis tipis (KLT)
KLT merupakan teknik pemisahan senyawa berdasarkan distribusi komponen yang berbeda dari suatu campuran antara fase gerak dan fase diam (Khopkar 1990). Hasil pemisahan senyawa tersebut akan menghasilkan fraksi!fraksi yang terpisah sepanjang pelat KLT berdasarkan tingkat kepolarannya. Setiap fraksi menghasilkan nilai Rf yang merupakan langkah awal untuk memperkirakan jenis suatu komponen senyawa organik yang telah terpisah (Smart 2002; Furniss 1984). Untuk melihat ada tidaknya aktivitas fraksi yang dihasilkan dari uji KLT maka dilakukan uji lanjut yaitu uji bioautografi.
Analisis fungsional metagenom telah menghasilkan banyak senyawa baru (Gillespie 2002),
baru (PKS) (Courtois 2003; Moffitt and Neilan 2003), dan fungsi baru seperti sistem asosiasi membran proteolitik (Beja
2000). (PKS) dan
non!ribosomal (NRPS)
merupakan kompleks enzim multifungsional yang berperan dalam sintesis beragam struktur senyawa bioaktif secara luas, kebanyakan merupakan kepentingan medis (Hutchinson 2003).
Berbagai senyawa antimikrob telah diisolasi dari bakteri yang berasosiasi dengan spons. Bakteri yang berasosiasi
dengan spons sp. dapat
menghasilkan senyawa bioaktif yang
menghambat non!
patogen, patogen,
non!patogen, EPEC,
, dan . Berdasarkan
analisis kekerabatannya keenam isolat yaitu HAA!02, HAA!07, HAL!08, HAL!20, HAL!10, HAL!23 menunjukkan homologi dengan genus Aktivitas antimikrob ditunjukkan dengan adanya konsentrasi hambat minimum (MIC) yaitu konsentrasi terendah dari senyawa antimikrob yang akan menghambat pertumbuhan mikroorganismee setelah diinkubasi selama satu malam (Andrews 2001). Pada penelitian ini dilakukan uji MIC, ekstraksi senyawa antimikrob dengan menggunakan etil asetat, analisis kandungan dan aktivitas antimikrob fraksi senyawa ekstrak kasar, serta deteksi gen penyandi domain KS pada
(PKS) dan domain A pada non!
2 Penelitian ini bertujuan menganalisis
senyawa bioaktif antimikrob bespektrum luas dari bakteri yang berasosiasi dengan
spons sp.
Penelitian ini dilaksanakan dari bulan Januari 2011 hingga Juni 2011 di Laboratorium Mikrobiologi Departemen Biologi, FMIPA, IPB.
Bahan yang digunakan adalah isolat! isolat terbaik dari bakteri yang berasosiasi dengan spons hasil penelitian terdahulu yaitu HAA!02, HAA!07, HAL!08, HAL!20, HAL!10, HAL!23 koleksi Pauliasi Tokasaya (2010).
Mikrob indikator yang digunakan untuk uji antagonis adalah
(EPEC)
K.1.1, ,
dan . Media yang digunakan
yaitu SWC ( ), NB
(! ), NA (! " ), PDB
( # ) dan PDA (
# " ). Pelarut yang digunakan untuk ekstraksi adalah etil asetat. Alat!alat laboratorium yang digunakan adalah pelat KLT ($% "
60F254 produksi Merck) vorteks, laminar (Jouan, Perancis), autoklaf, , mesin PCR, pipet mikro, cawan, tabung, serta peralatan umum yang digunakan di laboratorium.
!"
Isolat bakteri marin dikulturkan dalam medium SWC lalu diinkubasi selama tiga hari di suhu ruang. Mikrob target diremajakan kembali dalam media NB untuk
EPEC, dan
atau dalam media PDB untuk
dan Mikrob target
tersebut diinkubasi selama 24 jam pada suhu ruang kemudian diinkubasi kemudian disentrifugasi dengan kecepatan 10000 rpm selama 30 menit. Filtrat dari hasil sentrifugasi dimasukkan ke dalam 5 tabung reaksi dengan konsentrasi yang berbeda! beda masing!masing 6.25%, 12.5%, 25%, 50%, dan 100%. Selain kelima konsentrasi
tersebut, dibuat juga kontrol yang tidak diberi filtrat bakteri. Setelah itu, masing! masing tabung diisi dengan 1 ml bakteri target. Biakan uji MIC tersebut lalu diinkubasi selama 24 jam. Kemudian diamati kekeruhan masing!masing biakan di dalam tabung reaksi. MIC ditentukan berdasarkan kekeruhan biakan dibandingkan dengan kontrol.
# # $ % & '
#
Isolat bakteri marin dikulturkan ke dalam 500 ml media SWC cair. Kultur diinkubasi pada mesin penggoyang (100 rpm, 30 ºC) selama tiga hari. Kemudian ke dalam kultur ditambahkan 500 ml etil asetat, diaduk selama 3 jam, dan dievaporasi. Ekstrak yang dihasilkan disimpan pada suhu 5 ºC untuk pemakaian selanjutnya (Muller
2004).
# ( # $ % &
)
Mikrob indikator dikultur selama 24 jam. Sebanyak 1% kultur mikrob indikator dicampurkan ke media NA dan PDA semi padat lalu dituangkan di cawan. Ekstrak kasar senyawa antimikrob yang telah dilarutkan dengan metanol (100 mg/ml) diteteskan ke kertas cakram masing!masing sebanyak 100 Dl kemudian diletakkan di permukaan media agar semipadat tersebut. Cawan uji diinkubasi selama 24 jam. Hasil uji positif ditunjukkan dengan terbentuknya zona bening.
* # # # #
Isolasi dan identifikasi senyawa bioaktif sampel dilakukan dengan KLT terhadap senyawa organik dari ekstrak kasar. Fraksinasi dilakukan pada pelat 25 $%
" 60F254.
3 antimikrob kemudian diuji aktivitasnya
(bioautografi) untuk mengetahui komponen antimikrob yang dapat menghambat bakteri.
# # + # ) $ % &
# * # # ' "
Bahan yang digunakan adalah pelat KLT yang mengandung senyawa yang sudah difraksinasi. Pelat tersebut disterilisasi menggunakan sinar UV selama 30 menit, lalu diletakkan di atas agar nutrien pada cawan petri. Kemudian lapisan tersebut dilapisi oleh media agar cair yang mengandung bakteri uji
dengan metode agar tuang, kemudian diinkubasi pada suhu 37 ºC selama 24 jam. Setelah masa inkubasi, zona bening yang terbentuk diamati, untuk melihat komponen senyawa organik yang dapat menghambat pertumbuhan bakteri (Zheng 2005).
# # ,
Isolat bakteri dikulturkan dalam media kaldu SWC selama 24 jam. Sebanyak 1.5 ml kultur disentrifugasi 10000 rpm selama 10 menit. DNA genom bakteri diekstrak dengan mengikuti metode CTAB (Sambrook & Russell 2001).
# ($ , ($
, - $
!-Reaksi PCR untuk mengamplifikasi domain KS dari gen penyandi PKS dan domain A dari gen penyandi NRPS dilakukan dengan mengikuti metode
Schirmer (2005). Reaksi PCR
dilakukan sebanyak 30 siklus dengan masing!masing tahap yaitu predenaturasi selama 1 menit dan denaturasi selama 30 detik pada suhu 94 ºC, 50 ºC selama 30 detik, polimerisasi 75 ºC selama 1 menit 10 detik, dan post PCR dilakukan pada suhu 72 ºC selama 5 menit. Visualisasi amplikon PKS dan NRPS dilakukan melalui elektroforesis. Isolat yang mempunyai gen penyandi domain keto!sintase (KS) dari PKS menunjukkan terbentuknya pita pada ukuran di sekitar 700 pasang basa ( ), sedangkan pada deteksi gen penyandi domain adenilasi (A) dari NRPS ditunjukkan dengan munculnya pita pada ukuran sekitar 1000 bp.
$
$
Uji MIC menghasilkan kisaran hambatan yang berbeda, yaitu antara 12,5%
sampai 100% Isolat HAL!08 memiliki nilai MIC sebesar 12,5% terhadap
(Tabel 1). Hal ini merupakan indikasi yang bagus terhadap efek senyawa antimikrob yang dihasilkan oleh isolat tersebut. HAL! 10 menghambat paling kuat terhadap
. HAL!20 menghambat paling kuat terhadap . HAL!23 memiliki nilai MIC yang tinggi yaitu 12,5% terhadap . Selain itu isolat ini juga memiliki aktivitas hambat yang tinggi terhadap
dan . Isolat HAA!02
memiliki aktivitas hambat terhadap dan EPEC dengan konsentrasi sebesar 50%. Sedangkan HAA!07 menghambat EPEC dengan konsentrasi 25%. Berdasarkan uji MIC, semua isolat hanya menghambat pertumbuhan bakteri atau bakteriostatik.
Semua supernatan dari bakteri marin tidak memiliki aktivitas terhadap
dan . Hal ini karena kedua cendawan tersebut merupakan cendawan patogen yang memiliki dinding sel yang tebal sehingga sulit untuk didegradasi. Selain itu terdapat mekanisme pertahanan dari sel cendawan patogen tersebut yang dapat menghambat atau menghilangkan efek senyawa bioaktif dari supernatan bakteri marin, seperti produksi enzim, perubahan permeabilitas dinding sel, dan jalur metabolik yang menjadi target dari senyawa bioaktif tersebut (Lay 1994). Uji MIC bersifat tidak stabil tergantung dari mikrob uji, ukuran inokulum, komposisi kultur media, waktu inkubasi, dan kondisi inkubasi seperti temperatur, pH, dan aerasi (Tokasaya 2010).
# ( # $ % &
)
Bagian selanjutnya dari penelitian ini yaitu ekstraksi senyawa bioaktif dari bakteri dengan menggunakan etil asetat. Proses ekstraksi menghasilkan ekstrak kasar senyawa bioaktif sebagai antimikrob. Hasil yang didapat dari uji
menggunakaan difusi
4 semua ekstrak etil asetat positif terhadap
semua bakteri uji, hanya isolat HAA!07 yang tidak memiliki aktivitas hambat terhadap EPEC. hanya dapat dihambat oleh HAA!02, HAL!20, dan HAL! 23. Sedangkan semua ekstrak kasar tidak memiliki aktivitas terhadap .
Hasil penapisan yang diperoleh memiliki perbedaan dengan penelitian sebelumnya. Perbedaan yang dihasilkan disebabkan karena pelarut yang digunakan untuk ekstraksi berbeda.Pada penelitian sebelumnya pelarut yang digunakan yaitu n! butanol. Senyawa bioaktif memiliki kelarutan yang berbeda pada setiap pelarut yang berbeda pula. Perbedaan ini disebabkan karena adanya perbedaan tingkat polaritas. Pelarut polar akan menarik senyawa yang polar sedangkan pelarut yang nonpolar akan menarik senyawa yang nonpolar pula. Aktivitas hambatan dari senyawa antimikrob juga dipengaruhi oleh keberadaan dari senyawa pengotor yang terdapat pada ekstrak kasar bakteri marin.
Menurut Lay (1994) besarnya zona hambat yang dihasilkan dari senyawa bioaktif dipengaruhi oleh sifat fisik dan kimia dari senyawa tersebut, salah satunya dalah berat molekul. Semakin besar berat molekul senyawa bioaktif maka akan semakin besar zona hambat yang dihasilkan. Selain itu besarnya konsentrasi senyawa bioaktif juga mempengaruhi laju difusi senyawa bioaktif pada media agar. Semakin
besar konsentrasi dari senyawa bioaktif maka akan semakin besar laju difusinya pada media agar. Faktor lain yang
mempengaruhi penghambatan
mikroorganisme antara lain kepadatan populasi mikroorganisme, kepekaan terhadap senyawa antimikrob, kandungan bahan organik, suhu, dan lama waktu mikroorganisme terpapar bahan antimkrob.
# # ( # #
Analisis kandungan senyawa ekstrak etil asetat ini dilakukan dengan menggunakan kromatografi lapis tipis. Isolat
HAA!02, HAA!07, dan HAL!08
terfraksinasi oleh eluen n!butanol: etil asetat: akuades (2:3:1) sedangkan tiga isolat lainnya terfraksinasi oleh eluen n!butanol: etil asetat (3:7). Pada isolat HAA!02 dan HAA!07 dihasilkan tiga fraksi, sedangkan pada isolat HAL!08 dihasilkan dua fraksi HAA!02 memiliki nilai Rf 0,38; 0,45, dan 0,58 (Tabel 3). HAA!07 memiliki nilai Rf masing! masing 0,20; 0,31, dan 0,60. Isolat HAL!08 memiliki nilai Rf 0,44 dan 0,45 Isolat HAL! 23 memiliki Rf 0,40; 0,54, dan 0,65. Untuk isolat HAL!10 dan HAL!20 memiliki dua fraksi dengan nilai Rf berbeda yaitu 0,38 dan 0,50 dan 0,28 dan 0,44. Penggunaan eluen berbeda pada isolat!isolat tersebut. Isolat HAA!02, HAA!07, dan HAL!08 terfraksinasi dengan eluen yang terdiri dari n!butanol:etil asetat: akuades dengan Test Strain
MIC (%)
HAL!08 HAL!10 HAL!20 HAL!23 HAA!02 HAA!07
& 100 100 100 12,5 100 50
& 100 100 50 100 50 50
12,5 100 100 50 100 100
100 50 100 50 100 50
100 100 100 100 50 25
! ! ! ! ! !
! ! ! ! ! !
[image:25.595.111.504.123.325.2]Bs/Fs Bs/Fs Bs/Fs Bs/Fs Bs/Fs Bs/Fs
Tabel 1 ' ( dari supernatan bakteri asal spons sp.
terhadap bakteri dan cendawan pathogen serta bakteri non patogen.
perbandingan 2:3:1. Seda isolat lainnya tidak terfr terjadi karena senyawa yan masing!masing isolat be polaritasnya pun berbeda. dari n!butanol : etil ase perbandingan 2:3:1 m kepolaran yang lebih ting isolat lainnya memiliki po rendah. Oleh karena itu dig yang memiliki polaritas terdiri atas n!butanol: et perbandingan 3:7. Pada pe ini ketiga isolat lainnya
HAL!20, dan HAL!
Sedangkan ketiga isolat s mengalami fraksinasi.
Nilai Rf belum dapat identifikasi dengan kom tetapi hanya untuk komponen yang terkandun senyawa dan sebagai dasar
Tabel 2 Aktivitas antim sp.terhadap bakte Kode
Isolat
HAA!02 +++
HAA!07 +
HAL!08 ++
HAL!10 +
HAL!20 ++
HAL!23 ++
Keterangan : + : diameter zo +++++: > 25 mm
Gambar 1 Aktivitas a terhadap (c) HAL!08
a
b
Sedangkan pada tiga terfraksinasi. Hal ini a yang dikandung oleh lat berbeda, sehingga beda. Eluen yang terdiri il asetat : air dengan 1 memiliki tingkat h tinggi. Diduga ketiga liki polaritas yang lebih itu digunakan eluen lain lebih rendah yang ol: etil asetat dengan ada perbandingan eluen ainnya yaitu HAL!10, !23 terfraksinasi. solat sebelumnya tidak dapat dijadikan sebagai komponen senyawa, tuk melihat jumlah kandung dalam ekstrak
dasar purifikasi pada
‘
kromatografi kolom atau kinerja tinggi (HPLC).
Namun Ismet (
menemukan senyawa org dengan norharman (β!carb [3,4b] indole) yang dihas yang berasosiasi
) . memiliki nilai Rf 0,42 yan spons "
diperkirakan sama kare pelat KLT, sistem pelaru sistem yang sama.
+ # )
* # #
Fraksi yang diper fraksinasi ekstrak seny selanjutnya diuji aktivita
dengan met Hasil uji inimenunjukkan HAL!23 memiliki aktivitas antimikrob ekstrak etil asetat dari bakteri asal spon bakteri dan cendawan patogen serta bakteri non patogen.
Mikrob Uji & & +++ ++ +++ ++ ++ ++ ! ++ + ! +++ +++ +++ ++ ! ++ +++ ++ ++ ! +++ +++ ++ ++ ++ +++ +++ ++ ++ ++
eter zona hambat 6!9 mm; ++ : 10!14 mm ; +++ : 15!19 mm;++++ 5 mm ; *: non patogen
vitas antimikrob ekstrak etil asetat dari bakteri asal spon dengan kode isolat: (a) HAA 08, (d) HAL!10, (e) HAL!20, (f) HAL!23, dan (g) kontro
f
d
e
c
g
f
5 atau kromatografi cair
t (2007) berhasil organik yang mirip carboline, 9H!Pyrido dihasilkan dari bakteri
i dengan spons
Senyawa tersebut yang dihasilkan oleh Senyawa tersebut karena menggunakan pelarut, dan temperatur
) $ % & #
diperoleh dari hasil senyawa antimikrob ktivitasnya terhadap
metode bioautografi. ukkan ketiga fraksi dari tivitas hambat terhadap spons ++ + ++ ++ ++ ++
;++++ : 20!24 mm;
l spons sp.
HAA!02, (b) HAA!07, kontrol negatif.
g
[image:26.595.111.501.99.429.2] [image:26.595.111.500.118.332.2], yang ditand zona bening disekitar pel 2). Sedangkan pada isolat HAL!08, dan HAA!07 han yang memiliki aktivitas HAA_02 memiliki dua f dapat menghambat bakter satu dan dua (Tabel 3). Be tidak memiliki aktivitas ha muncul zuna bening dise Hal ini dikarenakan frak merupakan senyawa pe senyawa aktif yang tidak mikrob uji. Selain itu dapat
Fase gerak
n!butanol:etil asetat: 2:3:1
[image:27.595.105.507.92.716.2]n!butanol:etil aseta 3:7 Tabel 3. Fraksinasi da
Rf:0,60
Rf:0,31 Rf:0,20
(a)
Gambar 2 (a) Kromat bioautogr yang neg Keterangan: (+) : ada zo
ditandai dengan adanya ar pelat KLT (Gambar solat HAL!20, HAL!10, 7 hanya fraksi satu saja tivitas hambat. Isolat dua fraksi aktif yang bakteri uji yaitu fraksi 3). Beberapa fraksi lain itas hambat karena tidak g disekitar pelat KLT. n fraksi!fraksi tersebut a pengotor ataupun tidak terdeteksi dengan dapat juga fraksi
tersebut merupakan seny namun tidak sensitif terh yang digunakan. (Sudi secara tidak langsung bioautografi dapat diketah senyawa bioaktif yang da setiap ekstrak kasar da seperti spons
menghasilkan norharman 2005). Perbedaan munculn karena setiap pendeteksi yang berbeda.
Selain itu disebabkan tiap pelarut dalam mengelu Kode
isolat Fraksi Rf
asetat:air
HAA!02
1 0,38
2 0,45
3 0,58
HAA!07
1 0,20
2 0,31
3 0,60
HAL!08 1 0,44
2 0,55
il asetat
HAL!10 1 0,28
2 0,44
HAL!20 1 0,38
2 0,50
HAL!23
1 0,40
2 0,54
3 0,65
nasi dan uji aktivitas ekstrak etil asetat terhadap
f:0,60
f:0,31 f:0,20
(b)
romatogram dari kromatografi lapis tipis ekstrak metanol autografi HAA!07 yang positif (Rf 0,20); dan (c) hasil u
negatif (Rf 0,60)
ada zona bening disekitar pelat KLT
6 senyawa yang aktif if terhadap bakteri uji Sudirman 2005). Jadi sung melalui metode iketahui berapa banyak ang dapat diisolasi dari ar dari bakteri marin ) yang arman (Zheng
unculnya bercak terjadi eteksi memiliki fungsi bkan juga kekuatan dari engelusi sampel. aktivitas + + ! + ! ! + ! + ! + ! + + + (c)
[image:27.595.112.498.106.595.2] [image:27.595.112.498.107.328.2]7 Umumnya pelarut yang memiliki sifat
semipolar banyak memunculkan bercak dan yang terdapat dalam bakteri marin bersifat semipolar dapat memisahkan dengan baik. Sehingga dapat dikatakan bahwa senyawa! senyawa. Selain itu pola pemisahan senyawa yang diperoleh mencirikan perbedaan komposisi senyawa yang terkandung sehingga dapat dijadikan idetifikasi senyawa apa yang terkandung dalam ektrak tersebut. Sistem pengembangan yang digunakan pada KLT ini berdasarkan prinsip )
, yaitu memisahkan komponen yang bersifat polar menggunakan sistem pelarut yang bersifat polar dan memisahkan komponen yang bersifat non!polar menggunakan sistem pelarut non!polar. Sistem pengembangan ini akan lebih baik bila ruangan pengembangan telah jenuh dengan uap sistem pelarut (Christian 1994).
# , % ($ ($"
- $"
!-Isolat HAA!02, HAL!08, HAL!10, HAL!20, dan HAL!23 memiliki gen penyandi NRPS, sedangkan gen penyandi PKS hanya dimiliki oleh isolat HAL!08 dan HAL!10 (Gambar 3). Deteksi terhadap gen penyandi domain KS pada PKS menghasilkan pita berukuran 700 pasang basa, sedangkan deteksi gen penyandi domain A pada NRPS memiliki ukuran pita sebesar 1000 pasang basa.
Contoh dapat ditemukan dalam spons
# dan $
* , yang telah terbukti untuk menghasilkan senyawa antitumor (Gunasekera . 1990), onnamide dan theopederin (Piel
2004a). Selain itu, bakteri Salinispora
diisolasi dari spons )
telah diidentifikasi sebagai sumber antibiotik baru rifamycin, yang diproduksi oleh PKS (Kim 2006).
Karakteristik struktural dari senyawa bioaktif dari bakteri marin merupakan dua senyawa kimia penting yaitu poliketida dan siklopeptida yang dihasilkan oleh kompleks
multienzim yaitu (PKS)
dan (NRPS)
(Zhu 2009). Domain KS bertanggung jawab atas kondensasi unit ke rantai poliketida tumbuh selama biosintesis poliketida, dan terlibat dalam produksi berbagai macam struktural metabolit (Moffitt dan Neilan 2003). Analog dengan modul gen PKS, NRPS biasanya berisi adenylation (A) domain, peptidil pembawa protein domain, dan domain kondensasi (Schwarzer dan Marahiel 2001). Nonribosomal peptida disintesis oleh kondensasi monomer asam amino. Poliketida dibuat dari penambahan dua unit karbon ketida secara berulang yang berasal dari monomer asil!koenzim A, kemudian setiap unit disusun menjadi polimer linier berupa poliketida (Tanovic 2008).
Hasil deteksi gen PKS menunjukkan bahwa dua isolat bakteri marin positif menyandikan gen domain enzim ketosintase, yaitu HAL!08 dan HAL!10 (Gambar 3). Ketosintase merupakan salah satu jenis enzim yang berperan dalam sintesis
.
poliketida (Schirmer 2005). Selain itu, deteksi gen NRPS juga menunjukkan hasil positif pada lima isolat, yaitu HAA!02, HAL!08, HAL!10, HAL!20, dan HAL!23.
! merupakan
sistem biosintesis yang terkandung dalam jumlah yang besar dalam mikroorganisme. 2 8 10 20 23 M M 8 10
Gambar 3. Hasil visualisasi PCR gen (a) isolat HAA!02, HAL!08,HAL!10, HAL!20, dan HAL!23 (berurutan dari kiri ke kanan) mempunyai gen penyandi NRPS; (b) isolat HAL!08 dan HAL!10 mempunyai gen penyandi PKS.
10000 bp
1000 bp
500 bp 1000 bp
700 bp 500 bp
[image:28.595.118.502.476.629.2]8 Modul inti pada NRPS dalam produksi
senyawa bioaktif pada minimal terdapat adenilat (A) untuk seleksi dan aktivasi monomer asam amino, domain kondensasi (C) untuk mengkatalisis bentuk ikatan
dan domain (PCP) dengan grup
untuk mentransfer monomer situs katalis. $
Keenam isolat bakteri marin yaitu HAA_02, HAA!07, HAL!08, HAL!10, HAL!20, dan HAL!23 merupakan bakteri penghasil senyawa antimikrob dengan spektrum yang luas. Hasil penapisan isolat dan ekstrak kasar isolat bakteri marin tersebut menunjukkan aktivitas antimikrob
terhadap EPEC,
, dan
Isolat!isolat ini memiliki konsentrasi hambat minimum yang berbeda!beda berkisar antara 12,5% sampai 100% tergantung dari mikrob uji. Hasil fraksinasi sebagian besar memiliki aktivitas hambat terhadap
dengan nilai Rf yang berbeda!beda. Isolat! isolat tersebut juga terdeteksi mempunyai gen penyandi PKS dan NRPS, yaitu HAL!08 dan HAL!10 untuk gen PKS dan HAA!02, HAL!08, HAL!10, HAL!20, dan HAL!23 untuk gen NRPS.
$
-Perlu dilakukan penelitian lanjutan untuk mengetahui fraksi senyawa antimikrob murni yang dihasilkan oleh bakteri marin melalui kromatografi preparatif.
*
-
$
(
Andrews JM. 2001. Determinations of minimum inhibitory concentration.
" 48: 5!16.
Beja O 2000. Construction and analysis of bacterial artificial chromosome libraries from a marine
microbial assemblage. )
' 2:516–529.
Blunt JW . 2008. Marine natural products. ! + 25: 35–94. Cane DE, Walsh CT, Khosla C. 1998.
Harnessing the biosynthetic code: combinations, permutations, and mutations. 282: 63–68.
Christian DG. 1994. " .
Fifth Edition. USA: University of Washington. John Wiley & Sons. Courtois S 2003. Recombinant
environmental libraries provide access to microbial diversity for drug discovery from natural products. "
) ' 69: 49–55.
Crosa JH, Walsh CT. 2002. Genetics and assembly line enzymology of siderophore biosynthesis in bacteria.
' ' + ) 66: 223–2