KAJIAN HISTOMORFOLOGI OTAK TIKUS PUTIH
PADA KONDISI HIPERGLIKEMIA
DAN PEMBERIAN VITAMIN E
BAYU AJI WIBOWO
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
ABSTRAK
BAYU AJI WIBOWO. Kajian Histomorfologi Otak Tikus Putih Pada Kondisi Hiperglikemia dan Pemberian Vitamin E. Dimbimbing oleh ADI WINARTO dan EKOWATI HANDHARYANI.
Penelitian ini bertujuan mengetahui gambaran histomorfologis otak tikus putih dan pengaruh pemberian vitamin E pada kondisi hiperglikemia. Penelitian ini menggunakan 12 ekor tikus putih jantan galur Sprague Dawley yang dibagi secara acak menjadi 4 kelompok. Kelompok kontrol tanpa perlakuan, kelompok vitamin E diberi vitamin E 80 IU/ekor per hari selama 19 hari, kelompok STZ diberi Streptozotosin (STZ) 50 mg/kg BB dosis tunggal intraperitoneal pada awal
perlakuan, kelompok STZ+vit.E diberi STZ 50 mg/kg BB dan vitamin E 80 IU/ekor per hari selama 19 hari. Kadar glukosa darah diukur pada saat pengambilan sampel histologis organ otak pada akhir penelitian. Pengamatan histopatologis dan penghitungan jumlah neuron piramidal yang mengalami nekrosa dilakukan menggunakan mikroskop cahaya. Hasil penelitian ini adalah vitamin E mampu memperbaiki gambaran mikromorfologis cortex cerebri. Vitamin E dapat menurunkan kejadian nekrosa neuron dari 15.00 ± 3.61 menjadi 12.00 ± 1.00 pada kelompok nondiabetik, sedangkan pada kelompok diabetik kejadian nekrosa turun dari 71.33 ± 3.06 menjadi 27.33 ± 2.08. Dari penelitian ini dapat disimpulkan bahwa pemberian vitamin E pada tikus model diabetik dapat memperbaiki gambaran mikromorfologis cortex cerebri secara umum dan menurunkan secara nyata jumlah neuron yang mengalami nekrosa pada area 4 (primary motor cortex) dan somatosensory cortex area dari cortex cerebri (p< 0.05).
KAJIAN HISTOMORFOLOGI OTAK TIKUS PUTIH
PADA KONDISI HIPERGLIKEMIA
DAN PEMBERIAN VITAMIN E
BAYU AJI WIBOWO
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi :
Nama : Bayu Aji Wibowo NIM : B04103048
Disetujui
Diketahui
Tanggal Lulus: 4 September 2007
Kajian Histomorfologi Otak Tikus Putih pada Kondisi Hiperglikemia dan Pemberian Vitamin E
Pembimbing I
Drh. Adi Winarto, Ph.D NIP 131 578 835
Pembimbing II
Drh. Ekowati Handharyani, MS. Ph.D NIP 131 578 831
Wakil Dekan Fakultas Kedokteran Hewan Institut Pertanian Bogor
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT atas limpahan hidayah dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian ini dilaksanakan sejak bulan Juli 2006 bertempat di laboratorium Histologi Departemen Anatomi Fisiologi dan Farmakologi dan laboratorium Patologi Departemen Klinik Reproduksi dan Patologi. Karya ilmiah ini diberi judul Kajian Histomorfologi Otak Tikus Putih Pada Kondisi Hiperglikemia dan Pemberian Vitamin E, dengan tema Diabetes melitus.
Terima kasih dan penghargaan penulis sampaikan kepada:
1. Allah SWT atas segala kenikmatan tak terbatas yang telah diberikan pada penulis selama 22 tahun.
2. Keluarga terkasih di Purworejo (Ayah, Ibu, dan Adik) atas kasih sayang, dukungan, dan doa-doanya.
3. Bapak Drh. Adi Winarto, Ph.D dan Ibu Drh. Ekowati Handharyani, MS. Ph.D selaku pembimbing atas bimbingan dan kesabaran selama penelitian hingga terselesainya penulisan karya ilmiah ini.
4. Bapak Drh. Hernomoadi Huminto, MVS selaku penilai dan penguji yang telah memberi banyak saran dan masukan.
5. Bapak Dr. Drh. Koekoeh Santoso selaku pembimbing akademik atas bimbingan selama 4 tahun penulis menempuh pendidikan sarjana di Fakultas Kedokteran Hewan.
6. Reny Agustin dan keluarga atas kebaikan dan cintanya selama hari-hari penulis di Bogor.
7. Keluarga besar di Temanggung, Ngombol, dan di Jakarta atas semangat dan bantuannya.
8. Staf Bagian Anatomi Histologi dan Embriologi, Departemen Anatomi Fisiologi dan Farmakologi dan Bagian Patologi, Departemen Klinik Reproduksi dan Patologi.
9. Pegawai Laboratorium Histologi (Pak Maman) dan Laboratorium Patologi (Pak Kasnadi dan Pak Endang).
12.Sahabat-sahabat di Purworejo (Alumni SMUN 1 Purworejo), pengurus dan anggota FIM 2004-2006.
13.Komir (sahabat terbaik), Zaldi, Indra, Dompu, Adam, Agung, Vian, Rhiska, Agustin, Indah, Eka atas waktunya dalam hari-hari penulis. 14.Serta kepada pihak-pihak yang tidak dapat penulis sebutkan satu
persatu.
Akhirnya penulis berharap karya ilmiah ini dapat bermanfaat bagi pembaca dan khalayak pada umumnya, sehingga menambah khasanah pengetahuan dan menjadi inspirasi bagi peneliti-peneliti selanjutnya.
Bogor, September 2007
RIWAYAT HIDUP
Penulis dilahirkan di Purworejo pada tanggal 18 Juli 1985 dari ayah Drs. H. Sugeng Haryadi, M.Pd dan ibu Sri Murwani, SE. Penulis merupakan putra pertama dari dua bersaudara.
Tahun 2003 Penulis lulus dari SMU Negeri 1 Purworejo dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis memilih program studi Kedokteran Hewan Fakultas Kedokteran Hewan.
DAFTAR TABEL
Halaman 1 Hasil pengukuran kadar glukosa darah
pada akhir penelitian 20
2 Populasi neuron piramidal pada cortex cerebri 25 3 Hasil uji Duncan pada jumlah neuron piramidal
DAFTAR GAMBAR
Halaman 1 Pembagian area pada hemisphere cerebri 6 2 Mekanisme penyebaran impuls pada cortex cerebri 7
3 Struktur kimia streptozotosin 14
4 Struktur kimia vitamin E (α-tokoferol) 15 5 Sebaran neuron piramidal cortex cerebri tikus
kelompok nondiabetik 23
6 Sebaran neuron piramidal cortex cerebri tikus
kelompok diabetik 24
7 Hasil penghitungan 100 neuron piramidal pada primary motor cortex area dan somatosensory cortex area 25 8 Jumlah neuron piramidal nekrosa pada cortex cerebri 28
..………...………..…….. …....…..…...…..….. …………...………..………..……….. ………...…….………..
……….…….…...……….……..
……….……….…...………..
DAFTAR LAMPIRAN
Halaman 1 Tahap-tahap pewarnaan Hematoksilin Eosin (HE) 35
2 Data hasil pengukuran kadar glukosa darah dan analisa secara statistik menggunakan uji ANOVA dan
dilanjutkan uji Duncan 36
3 Data hasil pengukuran jumlah neuron piramidal yang mengalami nekrosa dan analisa secara statistik
menggunakan uji ANOVA dan dilanjutkan uji Duncan 38 ..……..………..
……….……….…….……….…………..
PENDAHULUAN
Latar Belakang
Perkembangan dunia kedokteran dewasa ini sangat mendukung terhadap peningkatan kualitas kesehatan dan daya hidup manusia. Hal ini disebabkan banyaknya penemuan-penemuan baru cara pengobatan maupun pencegahan berbagai penyakit, terutama penyakit akibat infeksi bakteri dan virus, sehingga umur harapan hidup dapat meningkat. Namun seiring perkembangan ilmu pengetahuan dan teknologi terjadi perubahan perilaku hidup. Perilaku hidup yang kurang sehat, seperti pola makan yang tidak seimbang dan terlalu banyak mengkonsumsi makanan cepat saji disertai kurang olah raga dapat menimbulkan timbulnya suatu penyakit meskipun tanpa disertai paparan agen penyakit dari luar. Salah satu penyakit yang ditimbulkan adalah penyakit gangguan metabolisme (Anonimus 2006).
Diabetes melitus merupakan salah satu penyakit gangguan metabolisme yang jumlah penderitanya semakin meningkat seiring berjalannya waktu. Menurut data WHO yang diacu dalam Anonimus (2006) penderita Diabetes melitus di dunia pada tahun 2003 mencapai 200 juta orang dan diperkirakan akan meningkat menjadi 330 juta orang pada tahun 2025. Sedangkan di Indonesia sendiri penderita Diabetes melitus pada tahun 2003 tercatat sebanyak 13 juta orang dan diperkirakan akan meningkat menjadi 20 juta penderita pada tahun 2030.
pada penderita diabetes melitus (Fouad 2007) maupun kematian sel akibat kekurangan nutrisi (Paolissa et al. 1993)
Pengobatan utama penderita Diabetes melitus adalah pengaturan diet yang tepat, sedangkan obat hanya merupakan pelengkap. Obat perlu diberikan apabila pengaturan diet tidak berhasil menurunkan kadar glukosa darah. Contoh obat yang sering digunakan adalah insulin secara parenteral dan golongan sulfonil urea (tolazomida) dan biguanida (merformin). Namun pengobatan Diabetes melitus dengan obat-obatan sintetis ini, selain menghabiskan biaya yang besar, penggunaan jangka panjang dapat menyebabkan timbulnya efek-efek samping yang merugikan. Oleh sebab itu penelitian terhadap obat-obatan alternatif bagi penderita Diabetes melitus banyak dilakukan. Salah satunya penggunaan vitamin E pada penderita Diabetes melitus (Manning et al. 2004).
Streptozotosin (STZ) merupakan senyawa hasil sintesis Streptomycetes achromogenes dan digunakan untuk menginduksi diabetes tergantung insulin (IDDM) pada hewan coba. Dosis yang digunakan untuk menginduksi IDDM secara intravena sebanyak 40 mg/ kg BB sampai dengan 60 mg/ kg BB. Pemberian STZ sebanyak 50 mg/ kg BB secara intraperitoneal pada tikus, dapat meningkatkan kadar glukosa sampai sekitar 15mM (270 mg/ dl) setelah dua minggu (Szkudelski 2001).
Rumusan Masalah
Meskipun telah terbukti bahwa vitamin E berfungsi sebagai antioksidan yang dapat melindungi sel dan jaringan dari lesio akibat radikal bebas. Namun penggunaan vitamin E pada penderita Diabetes mellitus sebagai terapi untuk mengurangi kerusakan akibat kondisi hiperglikemia belum diketahui.
Tujuan Penelitian
Penelitian ini bertujuan mengetahui gambaran histomorfologis otak tikus putih dan pengaruh pemberian vitamin E pada kondisi hiperglikemia
Hipotesis H0 =
H1 =
Manfaat Penelitian
Penelitian ini diharapkan menjadi landasan penggunaan vitamin E pada penderita Diabetes melitus dan memberikan informasi ilmiah tentang penggunaan vitamin E pada kondisi hiperglikemia.
Pemberian vitamin E tidak dapat mengurangi nekrosa neuron piramidal otak tikus putih pada kondisi hiperglikemia.
TINJAUAN PUSTAKA
Susunan Saraf Pusat
Susunan saraf pusat merupakan organ vital yang menjamin kepekaan hewan terhadap lingkungan, sehingga mampu sadar akan diri dan lingkungan (Dellmann dan Brown 1989). Menurut Banks (1993) susunan saraf pusat terdiri atas otak dan perpanjangannya, dan medulla spinalis. Secara umum terdapat dua daerah pada susunan saraf pusat yaitu, daerah yang beraspek putih (substansia alba), terdiri atas berkas-berkas serabut saraf pekat yang dibungkus oleh selubung mielin dan derah yang beraspek abu-abu (substansia grisea), yang tidak atau sedikit menunjukkan struktur mielin dan banyak mengandung badan sel saraf (perikarion), sel-sel glia, dan neuropil. Substansia grisea yang terdapat pada
cerebrum lazim disebut cortex sedangkan substansia alba sering disebut medulla
(Dellmann dan Brown 1989). Pada otak cortex terletak di luar medulla, kondisi sebaliknya ditemukan pada medulla spinalis dimana substansia grisea terletak dalam substansia alba (Banks 1993).
Otak
Otak adalah bagian dari susunan saraf pusat yang terletak di dalam cavum cranii (rongga tengkorak). Menurut Dyce et al. (2002) struktur anatomi otak dibagi menjadi hindbrain (rhombenchephalon) terdiri atas medulla oblongata,
pons, dan cerebellum; midbrain (mesencephalon); forebrain terdiri atas diencephalon, telencephalon (cerebrum) dan sumsum punggung (medulla spinalis). Berdasarkan strukturnya, fungsi otak secara umum berkaitan dengan fungsi vital somatik, otonomik, reflek, dan suatu fungsi vegetatif agar dapat bertahan hidup dan memelihara kehidupan (Mardiati 1996).
1. Otak besar (cerebrum)
menutupi medulla oblongata hingga dekat cerebrum, hal ini menjadikan hemisphere struktur terbesar pada otak. Hemisphere kanan dan kiri dihubungkan melalui garis tengah oleh substansia alba (corpus calosum) (Dyce et al. 2002). Permukaan cerebrum diperluas dengan lipatan-lipatan yang terdiri atas peninggian-peninggian berbentuk bulat yang disebut gyri, yang dipisahkan oleh suatu alur yang disebut sulci (Junqueira dan Jose 1991; Delmann dan Brown 1989). Menurut Boorman etall. (1990) pada tikus nucleus caudatus dan puramen
tidak dipisahkan oleh internal kapsul tetapi membentuk komplek caudatus-puramen.
Menurut Hartono (1989) secara histologis cerebrum terdiri atas dua lapisan utama yaitu, substansia grisea dan substansia alba. Substansia grisea pada
cerebrum terletak pada bagian superfisial, langsung di bawah piameter dan lazim disebut cortex cerebri. Kompleksitas dan luasnya fungsi cerebrum ditunjukkan oleh komplektisitas cytoarchitecture dari cortex cerebri (Banks 1993). Menurut Banks (1993) dan Dellmann & Brown (1989) cortex cerebri dapat dibedakan menjadi enam lapis sel, dari permukaan luar yaitu: (1) Lapisan molekular, lapis ini terdiri atas neuropil utama yang tersusun atas dendrit apikal dari sel piramid telodendron dari serbut saraf yang masuk ke cortex; (2) Lapisan granular luar, sebagian besar terdiri atas neuron kecil; (3) Lapisan piramid luar, mengandung neuron berukuran medium atau besar; (4) Lapisan granular dalam, merupakan lapisan reseptif primer untuk masukan khusus ke cortex, terdiri atas neuron stelata kecil yang membentuk lapis tebal dalam daerah cortex sensori (misalnya daerah visual); (5) Lapis piramid dalam, terdapat neuron piramid medium dan besar, membentuk lapis tebal pada daerah cortex motorik di mana rangsangan listrik membangkitkan gerakan; (6) Lapis polimorf (multiformis), banyak terdapat neuron berbentuk gelendong substansia alba, terdiri atas serabut saraf yang keluar dan masuk dari cortex.
Selain dalam cortex akumulasi substansia grisea juga terdapat pada
substansia alba yang biasa disebut nucleus. Nucleus terdiri atas kumpulan badan sel saraf pada substansia alba yang mampu menerima akson dari satu atau lebih traktus pada substansia alba (Dellmann dan Brown 1989; Hartono 1989). Nucleus
medula oblongata, cortex cerebri dan cortex cerebelli (Dellmann dan Brown 1989).
Struktur fungsional dari cortex cerebri berupa kolumna vertikalis, menjulur dari substansia alba hingga permukaan cortex. Basis anatomi dari kolumna vertikalis adalah neuron piramid yang memiliki dendrit basal tersusun radial dalam kolumna perfisial dan akson mengarah ke dalam (Dellmann dan Brown 1989). Menurut Hartono (1989) otak besar (cerebrum) berfungsi sebagai pusat kesadaran dan kemauan.
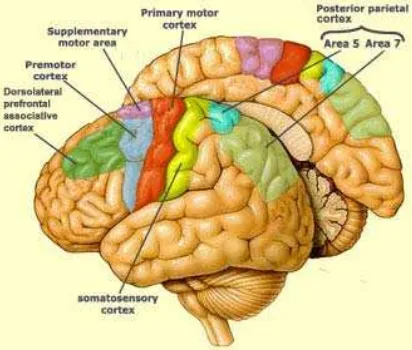
Gambar 1 Pembagian area pada hemisphere cerebri (Anonimus 2007a)
Motor cortex
Secara anatomis motor cortex terletak caudal dari lobus frontalis, tepat sebelum sulcus centralis yang memisahkan lobus frontalis dengan lobus parietalis.
Motor cortex area merupakan suatu daerah besar yang terdapat pada area motoris
cortex cerebri, namun istilah motor cortex biasanya mengacu pada area 4 dan area 6 motor cortex. Area 4 disebut primary motor cortex, sedangkan area 6 (rostral dari area 4) dibagi menjadi premotor area dan suplementary motor area. Fungsi
merencanakan dan menginisiasi gerakan berdasarkan memori pengalaman (Anonimus 2007a)
Somatosensory cortex area
Somatosensory cortex area adalah akhir dari jalur somatosensori (Anonimus 2007a). Fungsi dari area ini adalah menerima dan memproses impuls (informasi sensoris) dari reseptor perifer (Anonimus 2003). Informasi sensoris yang diterima area ini berupa sentuhan ringan, rasa sakit, tekanan, temperatur, dan propioseptif (Anonimus 2007a). Menurut Anonimus (2007a) fungsi somatosensori dibagi menjadi tiga berdasarkan jalur dan target organ pada otak yaitu: (1)
Discriminative touch, termasuk sentuhan, getaran, dan tekanan. Fungsi ini memungkinkan kita menggambarkan bentuk dan tekstur dengan tanpa melihatnya; (2) Rasa sakit dan temperatur, termasuk rasa gatal dan geli; (3) Propioseptif, termasuk reseptor di bawah kulit sehingga kita mengetahui posisi sendi, tarikan otot, dan kekuatan tendo.
Gambar 2 Mekanisme penyebaran impuls pada cortex cerebri
2. Otak kecil (cerebellum)
Cerebellum merupakan materi globular kasar dengan banyak lipatan.
Cerebellum terletak pada dorsal pons dan medulla oblongata, dihubungkan dengan batang otak dengan tiga pedunculi pada tiap sisinya. Secara anatomis cerebellum dipisahkan dari hemisphere cerebri oleh fissura transversal.
Cerebellum terdiri atas lateral hemisphere yang luas (hemisphere cerebelli) dan tepi median yang sempit yang biasa disebut vermis (Dyce et al. 2002). Bagian anterior cerebellum menghadap ke arah dorso-anterior, sedangkan permukaan posteriornya menghadap ke ventral (Junqueira dan Jose 1991).
Secara mikroskopis permukaan cerebellum terlihat struktur mirip daun (folia) yang dipisah oleh alur (sulcus) dan dibalut oleh cortex. Substansia alba terletak di dalam cortex (substansia grisea) (Dellmann dan Brown 1989). Cortex cerbelli lebih tipis bila dibandingkan cortex cerebrum. Cortex cerbelli terdiri atas tiga lapisan, yaitu: (1) Lapisan molekular, terutama terdiri atas neuropil, terletak paling superfisial; (2) Lapisan piriformis, terdiri atas badan sel saraf berukuran besar; (3) Lapisan granular, berbatasan dengan substansia alba, terdiri atas neuron kecil dengan inti heterokromatik (Banks 1993).
Menurut Fletcher (1995) cerebellum berfungsi mengatur tonus otot skelet serta gerakan, sehingga pola koordinasi menjadi wajar, sedangkan menurut Dyce et al. (2002) cerebellum berfungsi mengontrol keseimbangan dan koordinasi postur dan aktivitas lokomotor.
3. Sumsum punggung (medulla spinalis)
Menurut Banks (1993) morfologi medulla spinalis bervariasi pada berbagai tempat dalam tubuh seperti, cervicalis, thoracalis, lumbalis, hingga sacralis. Secara umum medulla spinalis berbentuk bulat hingga oval terletak pada columna vertebralis dan dilindungi oleh meningens (Dyce et al. 2002).
Secara mikroskopis gambaran melintang medulla spinalis memperlihatkan
grisea dibungkus oleh substansia alba yang terdiri atas serabut bermielin dan tidak bermielin serta pembuluh darah (Dellmann dan Brown 1989; Banks 1993)
Jaringan saraf
Jaringan saraf merupakan alat komunikasi tubuh. Jaringan saraf bertugas menerima stimuli, memproses, dan membawa impuls efferen menuju alat gerak dan jaringan sekretif (Trautmann dan Fiebiger 1957). Menurut Dellmann dan Brown (1989) parenkim jaringan saraf terdiri atas neuron yang didukung oleh
neuroglia. Neuron merupakan satuan morfologis serta fungsional dari jaringan saraf.
1. Neuron
Secara mikroskopis neuron berbentuk sel, memiliki membran plasma (neurolema), sitoplasma (neuroplasma), dan mengandung inti. Diameter badan selnya bervariasi, luas antara 4-150 μm. Ciri khas yang terlihat pada mikroskop cahaya adalah intinya besar dan pucat (karena miskin khromatin) dan nukleolusnya besar (Hartono 1989).
Neuron mempunyai sifat khusus dalam menerima, mengubah, dan meneruskan rangsang yang diterimanya. Dalam menerima, mengubah dan meneruskan ransangan memerlukan alur protein yang berbeda, sehingga neuron memiliki daerah khusus, yaitu: 1) daerah dendrit, tempat eksitasi berasal; 2) daerah telodendron, dimana eksitasi diteruskan ke neuron lain; 3) akson, menyalurkan rangsangan; dan 4) badan sel (perikarion) yang mengatur sel (Dellmann dan Brown 1989).
namun hanya satu yang berfungsi sebagai neurit, selebihnya dendrit. Tipe ini banyak dijumpai pada susunan saraf pusat, misalnya neuron piramidal (cerebrum), sel purkinje (cerebellum), dan neuron motorik (medulla spinalis).
2. Neuroglia
Neuroglia atau sel glia adalah sel saraf penunjang neuron. Ciri khas neuroglia adalah diameternya lebih kecil dari neuron, inti tidak memiliki nukleolus, dan penjuluran selnya banyak (Hartono 1989). Menurut Dellmann dan Brown (1989) neuroglia pada susunan saraf pusat mencakup ependim, astrosit, oligodendrosit, dan mikroglia.
Sel-sel ependim membalut ventrikel otak dan kanalis centralis sumsum punggung. Permukaan bebas tiap sel memiliki banyak mikrovili dan banyak silia aktif (Dellmann dan Brown 1989). Astrosit adalah sel yang memiliki banyak penjuluran sitoplasma. Astrosit dibagi menjadi 2, yaitu: astrosit protoplasmik dan astrosit fibrosa. Astrosit fibrosa dianggap sebagai sel parut (scarring cells) yang akan mengisi rongga atau jaringan yang hilang. Oligodendrosit berperan dalam proses satelitosis (Hartono 1989). Mikroglia merupakan sel yang mampu berproliferasi dan menjadi fagositik bila terjadi perlukaan jaringan atau sebagai makrofag dalam mengeluarkan sel debris (Mardiati 1996).
Meningens
Meningen merupakan selaput yang menutupi dan melindungi otak. Fungsi meningen sebagi pembatas (barrier) fisik dan fagositik terhadap pengaruh trauma (Fletcher 1995). Menurut Nabib (1987) selain sebagai pelindung meningen juga berfungsi sebagai penyuplai cairan otak. Secara umum meningen terdiri atas tiga lapis utama, yaitu:
Arachnoid merupakan lapisan yang berhubungan dengan durameter. Karena wujudnya menyerupai jaring laba-laba maka diberi nama arachnoid. Menurut Dyce et al. (2002) lapisan ini merupkan selaput membran tipis yang terdiri atas sel-sel endotel. Antara arachnoid dan piameter terdapat ruang subarachnoid yang berisi cairan cerebrospinal, terdapat pula pembuluh darah, saraf dan makkrofag.
Piameter merupakan lapisan yang paling dalam. Lapisan ini memiliki membran yang sangat halus dan berhubungan erat dengan otak. Lapisan ini menutupi mengikuti bentuk sulci dan gyri otak. Menurut Junqueira dan Jose (1991) piameter banyak mengandung pembuluh darah terletak sangat dekat dengan jaringan saraf tetapi tidak berhubungan langsung dengan sel atau serabut saraf.
Diabetes Melitus (DM)
Menurut Aiella (1998) Diabetes melitus (DM) merupakan penyakit degeneratif dan bersifat kronis yang menyebabkan gangguan metabolisme karbohidrat dengan gejala yang khas yaitu adanya hiperglikemia dan glukosuria.
Sedangkan menurut American Diabetes Associaton (ADA) (2004) Diabetes melitus adalah kelompok penyakit metabolisme yang dicirikan dengan kondisi hiprglikemia akibat adanya gangguan pada sekresi insulin, kerja insulin atau keduanya.
Hormon insulin diproduksi oleh sel-β pulau Langerhans kelenjar endokrin pankreas. Defesiensi hormon insulin disebabkan oleh kerusakan sebagian kecil atau sebagian besar sel-sel β pualu langerhans dalam kelenjar pankreas. Hal ini menyebabkan kadar gula tubuh melebihi batas normal (hiperglikemia) dan adanya gula dalam air seni (glukosuria), sehingga dalam dunia kedokteran sering disebut panyakit kencing manis (Utami 2003).
Menurut Utami (2003) terdapat beberapa faktor yang menyebabkan diabetes melitus, yaitu:
a. Genetik dan faktor keturunan
hanya 15% yang tidak memiliki riwayat keluarga penderita diabetes melitus.
b. Virus dan bakteri
Hasil penelitian menyebutkan bahwa virus menyebabkan Diabetes melitus akibat mekanisme infeksi sitolitik pada sel β yang menyebabkan kerusakan sel. Virus yang diduga menyebabkan Diabetes melitus adalah rubela, mumps dan human coxsackievirus B4.
c. Bahan toksik
Ada beberapa zat yang dapat merusak sel β secara langsung, seperti alloxan, pyrinuron, dan streptozotosin.
d. Nutrisi
Diabetes melitus adalah penyakit yang berhubungan dengan nutrisi, sebagai penyebab maupun pengobatan. Ketidakseimbangan nutrisi menjadi predisposisi terjadinya diabetes melitus.
Menurut Aiella (1998) gejala umum yang dirasakan pada penderita diabetes melitus adalah poliuria (sering kencing), polifagia (sering lapar), dan polidipsia
(sering haus). Defesiensi insulin menyebabkan glukosa darah tidak dapat diserap sempurna oleh sel, sehingga metabolisme sel terganggu. Hal ini menyebabkan penderita diabetes mudah lelah dan kehilangan berat badan secara drastis. Menurut Utami (2003) gejala lain yang dapat terjadi bisa bervariasi seperti (1) kelainan ginekologi, seperti keputihan; (2)kelainan kulit seperti gatal dan bisul (3) kesemutan dan mati rasa; (4) Luka yang tidak kunjung sembuh meskipun hanya luka kecil (lecet); (5) infeksi saluran kemih; (5) impotensi; (6) katarak dan gangguan refraksi
Menurut Shils (1994) Spontaneus Diabetes Melitus ada dua macam yaitu: Diabetes Melitus tipe I (Insulin-Dependent Diabetes Melitus)
Diabetes melitus tipe ini atau Insulin-Dependent Diabetes Melitus (IDDM), di mana sebagian besar sel β pulau Langerhans yang memproduksi insulin dalam pankreas mengalami kerusakan. Akibatnya kadar insulin yang diproduksi sangat sedikit atau sama sekali tidak diproduksi. Oleh karena itu penderita memerlukan suntikan insulin dalam persembuhannya. Gejala biasanya timbul pada masa anak-anak dan mencapai puncaknya pada saat usia dewasa.
Diabetes Melitus tipe II (Noninsulin-Dependent Diabetes Melitus)
Diabetes melitus tipe ini atau Noninsulin-Dependent Diabetes Melitus
(NIDDM), dimana pankreas masih relatif cukup menghasilkan insulin tetapi insulin yang ada bekerja kurang sempurna karena adanya retensi insulin. Pada tipe ini kebanyakan timbul pada penderita yang berusia di atas 40 tahun dan umumnya disertai kegemukan.
Diabetes sekunder
Terjadinya kondisi hiperglikemia pada diabetes tipe ini disebabkan adanya gangguan atau kerusakan organ lain (bukan pada sel β pulau Langerhans) sehingga menyebabkan peningkatan kadar glukosa darah. Beberapa kondisi yang dapat menyebabkan diabetes melitus tipe ini antara lain: diabetes yang berhubungan dengan malnutrisi, penyakit pada pankreas, penyakit hormonal, rangsangan bahan kimia atau obat-obatan, abnormalitas reseptor insulin, sindrom genetik tertentu
Streptozotosin
Streptozotosin (STZ, Zanosar, 1-methyl-1-nitroso-3-[2,4,5-trihydroxy-6- (hydroxymethyl)oxan-3-yl]-urea) merupakan senyawa hasil sintesis
IDDM secara intravena sebanyak 40 mg/kg BB sampai dengan 60 mg/kg BB, sedangkan pemberian STZ sebanyak 50 mg/kg BB secara intraperitoneal pada tikus, dapat meningkatkan kadar glukosa sampai sekitar 15mM (270 mg/dl) setelah dua minggu (Szkudelski 2001).
Menurut Cooperstein dan Watkins (1981) streptozotosin masuk ke dalam sel-β pankreas melalui GLUT 2 (Glucose Transport 2) . Dalam sel streptozotosin akan mengalami metabolisme yang akhirnya terbentuk ion karbonium reaktif atau radikal metil yang dapat menyisipkan gugus alkil pada berbagai komponen selular seperti DNA. STZ adalah donor nitrit oksida yang ditemukan sebagai penyebab kerusakan sel pulau Langerhans pankreas, dengan cara meningkatkan aktivitas guanilil siklase. Pembentukan anion superoksida dalam mitokondria dapat terjadi disebabkan oleh kerja STZ, disamping terjadi juga peningkatan aktifitas xantin oksidase. Telah dilaporkan juga bahwa STZ dapat menghambat siklus Krebs, dan akibatnya konsumsi oksigen berkurang. Sehingga terjadi pembatasan produksi ATP dalam mitokondria yang menyebabkan deplesi nukleotida dalam sel-β.
Gambar 3
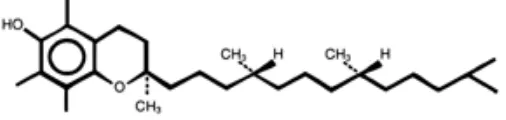
Vitamin E
tanaman. Bentuk yang paling aktif dan paling banyak dalam bahan makanan adalah α-tokoferol. Hal ini disebabkan adanya gugus metil substitusi dan gugus hidroksil yang penting untuk fungsi biologis vitamin E (Laidlaw dan Swendseid 1991). Vitamin E yang terdapat dalam bahan makanan berhubungan erat dengan minyak tanaman yang terkandung yang bersifat polyunsaturated. Vitamin E dapat melindungi minyak (terutama asam lemak yang tidak stabil) dari proses oksidasi. Bahan makanan yang mengandung banyak vitamin E diantaranya adalah minyak safflower, kacang almond, gandum, wortel, mentega, dan telur.
Fungsi utama vitamin E adalah sebagai antioksidan, terutama untuk asam lemak tidak jenuh pada fosfolipid dalam membran sel (Linder 1992). Antioksidan adalah substansi yang diperlukan tubuh untuk menetralisir radikal bebas dan mencegah kerusakan yang ditimbulkannya. Antioksidan menstabilkan radikal bebas dengan melengkapi kekurangan elektron yang dimiliki radikal bebas dan menghambat terjadinya reaksi berantai dari pembentukan radikal bebas (Fouad 2007). Pada membran sel vitamin E mengumpulkan radikal bebas sehingga melindungi polyunsaturated fatty acid (PUFA), protein, dan sitoskeleton selular dari oxidant injury (Laidlaw dan Swendseid 1991).
Defisiensi vitamin E dapat terlihat pada individu yang tidak mampu menyerap lemak secara baik dimana dapat menimbulkan pankreatitis dan cystic fibrosis. Gejala defisiensi vitamin E adalah kelemahan otot, gerakan mata yang abnormal, penurunan fungsi mata, serta cara berjalan yang tidak seimbang. Defisiensi vitamin E pun dapat menimbulkan kelahiran prematur (Hart 2004).
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan mulai bulan Juli 2006 hingga bulan Februari 2007, bertempat di Laboratorium Histologi bagian Anatomi, Histologi, dan Embriologi, Departemen Anatomi, Fisiologi, dan Farmakologi (AFF) dan Laboratorium Patologi Bagian Patologi Departemen Klinik, Reproduksi, dan Patologi (KRP), Fakultas Kedokteran Hewan IPB.
Bahan dan Alat Bahan
Hewan coba
Hewan percobaan yang digunakan dalam penelitian adalah tikus putih (Rattus norvegicus) galur Sprague-Dawley, dengan jenis kelamin jantan, berat badan 250 gram, berumur 2 bulan, sebanyak 12 ekor, diadaptasikan selama 1 minggu.
Streptozotosin
Sediaan yang digunakan berupa streptozotosin dalam larutan. Dosis streptozotosin yang digunakan dalam penelitian ini adalah 50 mg/kg BB per ekor (Szkudelski 2001). Diaplikasikan secara injeksi intraperitoneal pada hari pertama perlakuan.
Vitamin E
Vitamin E yang digunakan pada penelitian ini dalam emulsi corn oil
Alat
Peralatan yang digunakan pada penelitian ini berupa spoit untuk menginjeksikan sediaan streptozotosin, sonde lambung untuk mengaplikasikan vitamin E secara oral, peralatan bedah minor digunakan pada sampling organ,
digital blood glucosemeter, kandang tikus sebagai tempat tikus selama perlakuan, gelas ukur dan pipet tetes.
Metode Penelitian
Sebelum penelitian dilaksanakan, dilakukan adaptasi terhadap tikus yang digunakan dalam penelitian dengan cara 12 tikus yang digunakan dipelihara selama satu minggu setelah kedatangan. Kemudian tikus yang akan digunakan dalam penelitian ditimbang dan dipilih yang memiliki berat badan seragam yaitu 250 gram. Setelah itu tikus secara acak dibagi dalam empat kelompok, dengan perlakuan pada masing-masing kelompok sebagai berikut:
1. Kelompok kontrol, tikus dipelihara tanpa perlakuan. 2. Kelompok vitamin E, diberikan vitamin E 80 IU/ekor.
3. Kelompok STZ, diinjeksi Streptozotosin (STZ) 50 mg/kg BB intraperitoneal.
4. Kelompok STZ+ vit. E, diberikan STZ dan vitamin E.
Setelah melalui tahap persiapan tikus diberikan perlakuan sesuai dengan masing-masing kelompok selama 19 hari. Kelompok tikus yang diberikan perlakuan streptozotosin diberikan dalam dosis tunggal 50 mg/kg BB pada hari pertama, sedangkan kelompok tikus yang diberi perlakuan vitamin E diberikan 80 IU/ekor selama 19 hari. Kelompok tikus yang diberi suntikan streptozotosin diharapkan terjadi hiperglikemik.
Prosedur pembuatan preparat histologi sebagai berikut : a. Sampling
Sampling diawali dengan pemeriksaan kadar gula darah dan dilanjutkan pengambilan organ. Organ yang diambil adalah otak (cerebrum dan cerebellum)
b. Fiksasi
Seluruh otak dimasukkan dalam cairan fiksatif Buffered Neutral Formalin (BNF) 10%, setelah dua hari organ otak mengeras. Potongan jaringan berukuran 2x2x1 cm dimasukkan kembali ke dalam BNF 10% selama 3x24 jam, kemudian dipotong lebih tipis dengan ketebalan sama, lalu dimasukkan ke dalam kaset dan siap diproses dalam Tissue Processor.
c. Pencetakan jaringan
Setelah organ terfiksasi dilanjutkan dengan dehidrasi dengan mengunakan alkohol konsentrasi bertingkat dengan cara organ otak dalam alkohol 70% selama 2 jam. Selanjutnya sampel dipotong kecil dan dimasukkan ke dalam tissue basket serta diberi label. Potongan jaringan dalam tissue basket selanjutnya diproses dalam tissue processor untuk didehidrasi dengan alkohol bertingkat (80%, 90%, dan 95%) selama 6 jam kemudian direndam dalam alkohol absolut I, II, dan III masing-masing selama 2 jam. Selanjutnya Potongan jaringan dijernihkan dalam xylol I dan II selama masing-masing 2 jam. Potongan jaringan kemudian diinfiltrasi dengan parafin yang terdapat pada tissue processor, dilanjutkan dengan pencetakan organ dengan memasukkan potongan jaringan dengan media parafin.
d. Embedding
Parafin cair dimasukkan dalam cetakan (setengah dari volume cetakan), kemudian dimasukkan potongan jaringan sampai menyentuh dasar cetakan, lalu cetakan dipenuhi dengan parafin cair.
e. Pemotongan
Hasil pemotongan diletakkan di atas permukaan air hangat (40°C) hingga kerutan-kerutannya hilang. Setelah itu dilekatkan pada gelas objek lalu disimpan dalam inkubator selama satu malam dengan suhu 56°C.
f. Pewarnaan Hematoksilin Eosin
Pewarnaan Hematoksilin Eosin (HE) diawali dengan: deparafinasi dari jaringan ke dalam larutan xylol III, II, I, alkohol absolut I, II, III, 95%, 90%, 80%, 70%, lalu dimasukkan ke dalam air kran selama 10 menit dan dibilas aquades selama 5 menit. Jaringan diwarnai dengan Hematoksilin selama 1 menit kemudian direndam kembali dalam air kran selama 10 menit dan aquades selama 30-60 detik. Jaringan kemudian diwarnai Eosin selama 2 menit dan direndam dalam aquades selama 5 menit. Setelah diwarnai dilakukan dehidrasi dengan alkohol bertingkat, alkohol 70%, 80%, 90%, 95%, absolut I, II dan III dilanjutkan clearing
dengan xylol I, II, III, dan di-mounting dengan entelan dan ditutup dengan cover glass.
Pengamatan Histopatologik dan Analisa
HASIL DAN PEMBAHASAN
Kadar Glukosa Darah
Pengukuran kadar glukosa darah pada akhir penelitian menunjukkan perbedaan nilai yang nyata antara kelompok nondiabetik dan kelompok diabetik (p<0.05). Pada kelompok nondiabetik kadar glukosa darah berkisar antara 84.33-84.67 mg/dl sedangkan pada kelompok diabetik kadar glukosa darah mencapai 443.33 mg/dl. Hasil pengukuran kadar glukosa darah secara lengkap ditampilkan pada Tabel 1.
Tabel 1 Hasil pengukuran kadar glukosa darah pada akhir penelitian Kelompok Rataan kadar glukosa
Pada Tabel 1 pengukuran kadar glukosa darah setelah 19 hari perlakuan memperlihatkan keadaan hiperglikemia pada kelompok diabetik (kelompok STZ dan kelompok STZ+vitamin E). Hal ini menunjukkan pembuatan hewan model diabetik berhasil dengan baik. Hiperglikemia adalah peningkatan kadar glukosa dalam plasma. Kondisi ini sesuai tulisan Szkudelski (2001) hiperglikemia pada pemberian streptozotosin disebabkan kerusakan sel β pulau Langerhans akibat peningkatan guanilil siklase dan xantin oksidase, serta pembentukan anion reaktif (NO dan superoksida). Peningkatan kadar glukosa setelah pemberian streptozotosin selama dua minggu dapat mencapai 270 mg/dl.
Menurut data di atas vitamin E tidak memperlihatkan efek penurunan kadar glukosa baik pada kelompok nondiabetik (kontrol dan vitamin E) maupun kelompok diabetik (STZ dan STZ+vitamin E). Kemungkinan hal ini disebabkan vitamin E tidak merangsang peningkatan insulin sehingga tidak terjadi peningkatan penggunaan glukosa oleh sel sehingga glukosa tetap berada dalam peredaran darah. Ini diperkuat tulisan Paolissa et al. (1993) yang menyatakan
bahwa vitamin E pada penderita Diabetes Melitus tipe 2 dapat meningkatkan kontrol metabolisme tetapi tidak merangsang sekresi insulin. Perbaikan kondisi penderita diabetes melitus yang diberi vitamin E lebih disebabkan perbaikan sensitifitas reseptor insulin, penurunan lipid peroxidation dan oxidative stress.
Selain itu kemungkinan lain adalah vitamin E tidak memperbaiki kerusakan yang terjadi pada sel β pulau Langerhans pankreas akibat induksi Streptozotosin. Walaupun vitamin E dapat melindungi epitel dari aktivitas zat-zat perusak sehingga mencegah kerusakan pulau Langerhans akibat aktivitas ion superoksida dan NO yang langsung menyerang epitel sel β. Seperti pada tulisan Bursell et al.
(1999) yang menyatakan vitamin E dapat melindungi sel dari zat tosik dan polutan serta mengurangi kerusakan yang ditimbulkan zat-zat tersebut. Namun vitamin E tidak dapat mencegah aktivitas guanilil siklase dan xantin oksidase di dalam sel β, karena vitamin E yang larut lemak tidak diabsorbsi oleh membran semi permiabel sel β.
Kemungkinan lain yang dapat dilaporkan yaitu lama pemberian vitamin E yang tidak mencukupi. Menurut Manning et al. (2004) penurunan kadar glukosa darah tertinggi pada penderita diabetes melitus tercapai setelah tiga bulan pemberian vitamin E. Pada penelitian ini vitamin E hanya diberikan selama 19 hari sehingga belum mencukupi untuk menurunkan kadar glukosa darah.
Gambaran Mikromorfologis Otak Tikus
Pengamatan pada morfologi organ otak secara mikroskopis pada semua kelompok memperlihatkan bahwa batas lapisan-lapisan cortex cerebri tidak jelas. Hal ini menunjukkan bahwa perubahan yang terjadi pada batas antar lapisan
cortex cerebri bukan karena pengaruh perlakuan. Gambaran lain yang ditemukan adalah hiperemi ringan pembuluh darah cortex yang juga terlihat pada semua kelompok. Hal ini dapat dipahami bahwa perubahan yang terjadi pada pembuluh darah cortex mungkin karena pengaruh pembiusan dengan menggunakan eter. Pembiusan menggunakan eter dapat menyebabkan perluasan hingga pecahnya pembuluh darah (Ganiswarna 1995).
ditemukan pada kelompok nondiabetik. Sebagai tambahan informasi, edema vasogenik juga sering menyertai kasus stroke yang juga menyebabkan iskhemia (Rick et al. 2003). Perubahan lain di sekitar jaringan yang dapat diamati adalah perbedaan keteraturan serabut saraf. Pada kelompok yang diberi vitamin E menunjukkan gambaran yang lebih baik dibandingkan kelompok yang tidak diberi vitamin E. Pada kelompok nondiabetik perubahan yang terjadi tidak teramati dengan jelas, sedangkan pada kelompok diabetik serabut saraf yang lebih teratur dapat diamati pada kelompok yang diberi vitamin E. Hal ini menunjukkan efek neuroprotektif vitamin E yang menyebabkan peningkatan daya hidup neuron (Pace et al. 2003). Perubahan keteraturan disebabkan fibrolisis jaringan saraf (Ressang 1983).
Pengamatan pada neuron mengindikasikan adanya penurunan kepadatan neuron pada area yang dievaluasi. Penurunan kepadatan yang terjadi dalam jumlah yang cukup tinggi disebabkan oleh adanya neuron-neuron yang mengalami nekrosa terutama pada kelompok STZ. Neuron yang mengalami nekrosa akan segera difagosit oleh mikroglia sedangkan serabut-serabut sarafnya akan mengalami fibrolisis (Ressang 1983). Pada cerebrum dan sistem saraf pada umumnya kematian atau nekrosa neuron tidak dapat digantikan oleh neuron lain, sehingga meninggalkan ruang pada tempat neuron yang mengalami nekrosa dan menyebabkan terjadinya pengurangan kepadatan.
Pengamatan perubahan neuron bervariasi mulai dari karioreksis hingga nekrosa. Jumlah neuron yang mengalami nekrosa bervariasi pada tiap kelompok. Tingkat keajdian nekrosa neuron dari yang terbanyak ditemukan mulai dari kelompok STZ, kelompok STZ + vit. E, kelompok kontrol dan kelompok vitamin E. Sedangkan kejadian karioreksis tertinggi ditemukan pada kelompok STZ.
Gambar 5
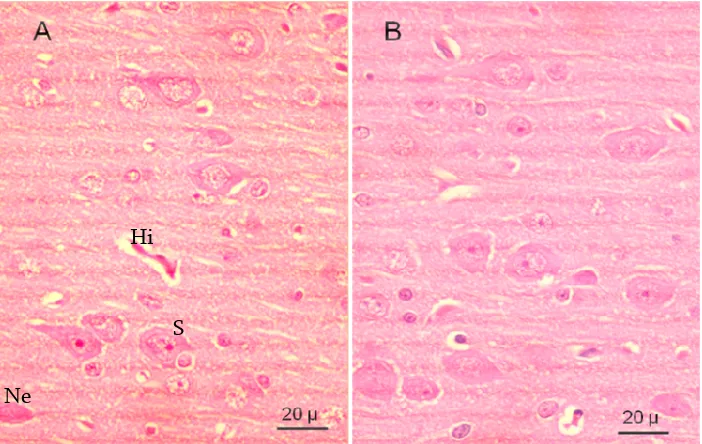
Pada gambar A (kontrol) dapat dilihat adanya sebaran neuron piramidal yang mengalami gangguan seperti, neuron piramidal yang hilang sitoplasmanya, satelitosis neuron oleh sel glia, hingga nekrosa neuron piramidal. Satelitosis neuron oleh sel glia (oligodendroglia) mengindikasikan adanya gangguan pada neuron tersebut (Ressang 1983). Pada gambar A dan B dapat dilihat adanya gambaran hipremi. Gambaran hipremi merupakan gambaran umum yang sering didapatkan pada hewan yang dibius menggunakan eter (Ganiswarna 1995). Pada gambar A juga dapat dilihat sel-sel glia yang strukturnya kurang baik (mengalami degenerasi). Sedangkan pada gambar B (vitamin E) terlihat gambaran yang lebih baik, ditandai sebaran neuron piramidal normal lebih baik banyak dan sel-sel glia dengan struktur jelas. Hal ini menandakan vitamin E mencegah kerusakan pada sel-sel saraf akibat zat toksik maupun polutan yang mungkin terdapat pada otak (Bursell et al. 1999).
Gambaran histologis cortex cerebri kelompok diabetik dapat dilihat pada Gambar 6.
Ne
S
Sebaran neuron piramidal cortex cerebri tikus kelompok nondiabetik. A: kelompok kontrol; B: kelompok vitamin E; Sa: satelitosis; Ne: nekrosa neuron piramidal; Hi: hiperemi; pewarnaan HE (perbesaran objektif 40X)
Gambar 6
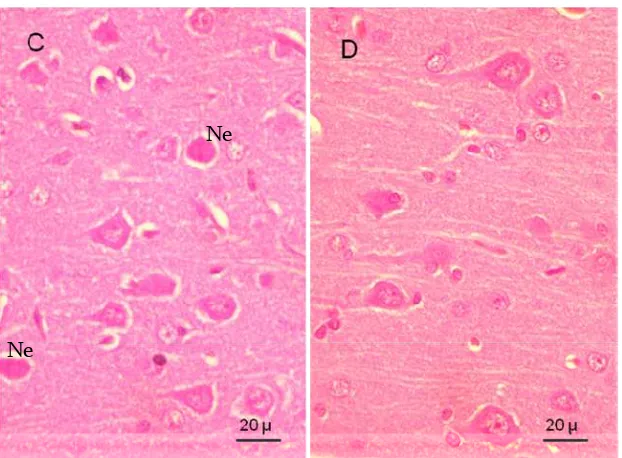
Pada gambar C (STZ) terlihat populasi neuron piramidal yang mengalami nekrosa dalam satu lapang pandang sangat tinggi dan terdapat ruang kosong di sekitar neuron piramidal yang juga merupakan indikasi adanya gagguan pada neuron tersebut. Pada gambar C juga terlihat jalur-jalur serabut saraf yang tidak teratur hingga tidak terindetifikasi. Sedangkan pada gambar D (STZ+vit.E) terlihat gambaran yang lebih baik, ditandai dengan populasi neuron piramidal normal dalam satu lapang pandang lebih banyak dan jalur-jalur serabut saraf yang jelas dan lebih teratur. Hal ini disebabkan efek neuroprotektif vitamin E terhadap radikal bebas dan zat-zat toksik lainnya (Pace et al. 2003).
Pengamatan Histopatologik Neuron Piramidal
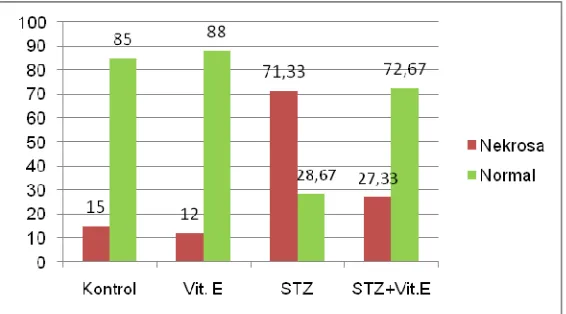
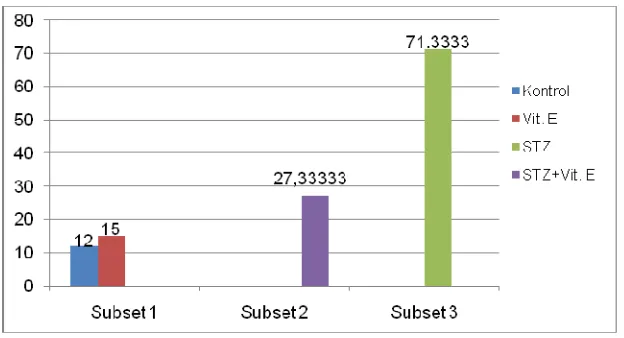
Hasil yang diperoleh pada penghitungan sebanyak 100 neuron piramidal pada area 4 (primary motor cortex) dan somatosensory cortex pada kelompok yang diberi vitamin E 80 IU/ekor selama 19 hari, jumlah neuron yang mengalami nekrosa berkisar 27,33 ± 2,08 sedangkan pada kelompok yang tidak diberi vitamin E jumlah neuron yang mengalami nekrosa mencapai 71,33 ± 3,06. Hasil perhitungan secara lengkap dapat dilihat pada Tabel 2.
Ne
Ne
Tabel 2 Populasi neuron piramidal pada cortex cerebri
Dari Tabel 2 dapat diketahui bahwa terjadi perbaikan pada kelompok yang diberi vitamin E, ditandai dengan berkurangnya jumlah neuron yang mengalami nekrosa baik pada kelompok nondiabetik maupun pada kelompok diabetik. Pada kelompok nondiabetik jumlah neuron yang mengalami nekrosa turun dari 15.00 ± 3.61 (kontrol) menjadi 12.00 ± 1.00 (vitamin E) sedangkan pada kelompok diabetik neuron yang mengalami nekrosa turun dari 71.33 ± 3.06 (STZ) menjadi 27.33 ± 2.08 (STZ+Vit. E). Gambaran lebih jelas hasil penghitungan neuron piramidal dapat dilihat pada Gambar 7.
Gambar 7
Peningkatan jumlah neuron yang mengalami nekrosa pada kondisi hiperglikemia disebabkan peningkatan glukoneogenesis. Hal ini sebagai akibat sel tidak dapat menggunakan glukosa (Fouad 2007). Menurut Halliwell (2002) radikal bebas secara normal diproduksi sebagai hasil metabolisme tubuh (seperti oksidasi adrenalin, dopamine, dan tetrahidrofolat) dan berbagai reaksi pertahanan tubuh (fagositosis oleh makrofag dan monosit), namun pada kondisi hiperglikemia Angka yang diperlihatkan merupakan rataan ± standar deviasi; STZ: Streptozotosin; Vit. E: vitamin E
terjadi peningkatan produksi radikal bebas karena peningkatan proses pemecahan lemak (glukoneogenesis), sehingga menyebabkan terjadinya kondisi oxidative stress, yaitu kondisi dimana kadar radikal bebas lebih tinggi dibandingkan kadar antioksidan endogenous (Fouad 2007). Apabila radikal bebas menyerang membran sel (lipoprotein) akan menyebabkan terjadinya reaksi berantai lipid peroksidasi (Halliwell 2002 dan Fouad 2007). Kondisi hiperglikemia juga dapat menyebabkan terjadinya atherosklerosis yang kemudian akan mengarah oxidative damage, yaitu perusakan jaringan oleh biomolekul oksigen reaktif (Halliwell 2002). Kondisi atherosklerosis juga menyebabkan iskhemia pada jaringan atau organ yang mendapatkan suplai. Kondisi-kondisi tersebut menyebabkan terjadinya kerusakan jaringan atau organ secara umum pada kondisi hiperglikemia, terutama jaringan atau organ yang memiliki kandungan lemak tinggi sebab lemak sangat rentan terhadap serangan radikal bebas dibandingkan jaringan lain dalam tubuh (Fouad 2007). Otak merupakan salah satu organ dengan kandungan lemak sangat tinggi (±80%) sehingga otak sangat rentan terhadap serangan radikal bebas. Hal ini menyebabkan terjadinya peningkatan kejadian nekrosa neuron piramidal pada kelompok diabetik. Namun peningkatan kejadian nekrosa pada kelompok diabetik mungkin juga disebabkan komplikasi akibat kondisi hiperglikemia. Kondsi hiperglikemia yang berlangsung dalam waktu lama akan menyebabkan kematian sel akibat kekurangan nutrisi (Utami 2003).
tersebut menyebabkan meningkatnya daya hidup neuron, baik pada kelompok nondiabetik maupun kelompok diabetik.
Untuk mengetahui pengaruh pemberian vitamin E terhadap jumlah neuron yang mengalami nekrosa dilakukan uji statistik. Hasil yang diperoleh dari analisa menggunakan uji statistik memperlihatkan penurunan jumlah neuron yang mengalami nekrosa pada kelompok nondiabetik tidak berbeda nyata (p<0.05), sedangkan penurunan jumlah neuron yang mengalami nekrosa pada kelompok diabetik berbeda nyata (p<0.05). Hasil analisa secara lengkap dapat dilihat pada Tabel 3.
Tabel 3 Hasil uji Duncan pada jumlah neuron piramidal yang mengalami nekrosa
Dari Tabel 3 dapat diketahui bahwa pemberian vitamin E pada penelitian ini dapat menurunkan secara nyata jumlah neuron yang mengalami nekrosa (p<0.05) pada kelompok diabetik sebesar 62%. Namun penurunan jumlah nekrosa sebesar 62% tersebut belum menyamai nilai nekrosa kelompok kontrol, hal ini ditunjukkan nilai nekrosa kelompok STZ + Vit.E masih berbeda secara nyata terhadap kelompok nondiabetik (p<0.05). Sedangkan pada kelompok nondiabetik dapat diketahui adanya penurunan jumlah neuron yang mengalami nekrosa sebesar 20%. Penurunan jumlah neuron yang mengalami nekrosa pada kelompok ini tidak berbeda secara nyata (p<0.05) .
vitamin E menangkap radikal bebas vitamin E akan berubah menjadi radikal bebas sehingga dibutuhkan vitamin C untuk membuat vitamin E stabil kembali. Selain itu kemungkinan waktu pemberian belum mencukupi untuk menurunkan jumlah neuron piramidal yang mengalami nekrosa. Karena menurut Manning et al. (2004) vitamin E memberikan efek penurunan kadar glukosa tertinggi setelah pemberian selama 3 bulan.
Gambaran nilai penurunan neuron yang mengalami nekrosa berdasarkan pengelompokan uji Duncan dapat dilihat pada Gambar 8.
Gambar 8 Jumlah neuron piramidal nekrosa pada cortex cerebri
Pada penelitan ini daerah yang dievaluasi terdapat pada area 4 (primary motor cortexarea = M1) dan pada somatosensory cortex area (Anonimus 2007a).
Kedua area tersebut berada pada regio motor cortex yang bertugas mengendalikan alat gerak sehingga memiliki proporsi dan presisi yang tepat. Menurut Anonimus (2007b) primary motor cortex berperan dalam pengendalian gerakan yang disadari, sedangkan somatosensory cortex area berfungsi menerima informasi dari saraf perifer. Fungsi somatomotory cortex dibagi dalam tiga grup yaitu
discriminative touch, rasa sakit dan temperatur, serta propioseptif (Anonimus 2003).
(Daniaty 2004). Terjadinya lesio neuron pada primary motor cortex area dapat menyebabkan inkoordinasi gerakan, seperti tidak dapat menentukan kontraksi otot pada alat gerak, pada tahap selanjutnya penderita diabetes melitus dapat terjadi kelumpuhan. Kondisi ini terjadi karena perluasan kerusakan otak akibat oxidative stress (Bloomgarden 2005). Sedangkan lesio neuron pada somatosensory cortex area menyebabkan penurunan sensitifitas reseptor di luar tubuh, seperti pada ujung jari, bibir, lidah, ujung hidung dan lain sebagainya pada tahap selanjutnya dapat menyebabkan keadaan aesthesia (mati rasa) baik sementara maupun permanen. Hal ini sesuai dengan tulisan Anonimus (2007b) penderita diabetes melitus dapat mengalami neurophaty saraf perifer yang gejalanya sering terjadi pada kaki, rasa sakit hingga mati rasa pada kaki. Hal ini menyebabkan komplikasi pada kaki akibat luka yang tidak terdeteksi, sehingga 70% penderita diabetes melitus memerlukan prosedur pembedahan dan lebih dari 40% harus mengalami amputasi (Tobing 2006).
Menurut Masharani (2007) salah satu bentuk neuropathy pada penderita diabetes melitus adalah distal simmetrical polyneuropathy yang biasa terjadi pada
KESIMPULAN
Kesimpulan1. Pemberian vitamin E 80 IU per hari selama 19 hari pada tikus model diabetik (kondisi hiperglikemia) yang diinduksi STZ tidak menurunkan kadar glukosa darah.
2. Vitamin E dapat memperbaiki gambaran mikromorfologis cortex cerebri
tikus pada kondisi hiperglikemia.
3. Vitamin E dapat menurunkan kejadian nekrosa neuron piramidal pada area 4 (primary motor cortex area) dan somatosensory cortex area secara nyata (p<0.05) pada tikus model diabetik (kondisi hiperglikemia).
Saran
DAFTAR PUSTAKA
[ADA] American Diabetes Association. 2004. Diagnosis and Classification of Diabetes Mellitus. Diabetes Care. Vol 27:S5-S10.
Anonimus. 2003. Somatosensory Pathway. http://thalamus.wustl.edu/course.html [14 Juli 2003]
Anonimus. 2006. Perawatan Basal dan Perawatan Basal Plus Untuk Diabetes. http://www.hanyawanita.com/_health/article.php [2 Juli 2007]
Anonimus. 2007a. Motor Cortex. http://thebrain.mcgill.ca/flash.html [1 Juli 2007]
Anonimus. 2007b. Diabetes Monitor. http://www.biomedcentral.com/1472-6793/6/4 [9 Juli 2007]
Aiella SE 1998. Merck Veterinary Manual. Edisi ke-8. USA: Publishing Merck & Co Company Inc.
Argyriou AA et al. 2005. Vitamin E for prophylaxis against chemotherapy-induced neuropathy. Neurology Vol 64: 24-31
Banks WJ. 1993. Applied Veterinary Histology. Edisi ke-3. Missouri: Mosby Inc.
Boorman GA et al. 1990. Pathology of the Fischer Rat. New York: Academic Press Inc.
Bursell S et al. 1999. High-dose vitamin E supplementation normalizes retinal blood flow and creatinine clearance in patients with type 1 diabetes.
Diabetes Care.Vol 22 No.8:1245-1251 .
Cooperstein SJ, Watkins D. 1981. The Islets of Langerhans: Biochemistry, Physiology, and Pathology. New York: Academic Press Inc.
Dellman HD, Brown EM. 1989. Buku Teks Histologi Veteriner. Edisi ke-3. Jakarta: Universitas Indonesia Press
Daniaty R. Dina. 2004. Gambaran Histopatologis Organ Otak Tikus Penderita Diabetes Melitus yang Diberi Infus Batang Brotowali (Tinospora tuberculata L.) sebagai Bahan Antidiabetik. [Skripsi]. Bogor: Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Halliwell B. 2002. Vitamin E and The Treatment and Prevention of Diabetes Melitus: A Case for Clinical Control. Singapore Medical Journal. Vol 43(9): 479-484.
Hartono R. 1989. Histologi Veteriner. Bogor: Pusat Antar Universitas Ilmu Hayat Institut Pertanian Bogor.
Hart JA et al. 2004. Vitamin E. http://www.umm.edu/altmed/ConsSupplements/ VitaminEcs.html [16 Februari 2007]
Fletcher TF 1995. Histologi Dasar Jaringan Saraf. Jakarta: Gramedia Pustaka.
Fouad T. 2007. Free Radical Source, Type, and Damging Reaction. Http://www.doctorslouge.com [7 Juli 2007]
Junqueira LC, Jose C. 1991. Histologi Jaringan Saraf. Jakarta: Gramedia.
Laidlaw SA dan Swendseid ME. 1991. Vitamin and Cancer Prevention. New York: Wiley-Liss.
Linder MC. 1992. Biokimia Nutrisi dan Metabolisme. Jakarta: Universitas Indonesia Press.
Manning PJ et al. 2004. Effect of High-Dose Vitamin E on Insulin Resistance and Associated Parameters in Overweight Subjects. Diabetes Care Journal. Vol 27:2166-271.
Mardiati R. 1996. Buku Kuliah Sistem Otak Manusia. Edisi ke-1. Jakarta: CV Agung Seto.
Masharani U. 2007. Diabetic Neuropathy. http://www.health.am/db/diabetes-complications-diabetic-neuropathy/. [ 1 Juli 2007]
Nabib, R. 1987. Patologi Khusus Veteriner. Edisi ke-2. Bogor: Institut Pertanian Bogor Press.
Pace A et al. 2003. Neuroprotective Effect of Vitamin E Supplementation in Patients Treated With Cisplatin Chemotherapy. Journal of Clinical Oncologi. Vol 5. No 5:927-931.
Paolissa A et al. 1993. Daily vitamin E supplements improve metabolic control but not insulin secretion in elderly type II diabetic patients. Diabetes Care Journal. Vol.16 No.11:1433-1437
Rick MD et al. 2003. Correlation between Brain Reorganization, Ischemic Damage, and Neurologic Status after Transient Focal Cerebral Ischemia in Rats: A Functional Magnetic Resonance Imaging Study. The Journal of Neuroscience. Vol 23 No.8:510-517
Tambunan V. 2003. Antioksidan, Radikal Bebas, dan Penuaan. http://www.sinarharapan.co.id/iptek/kesehatan.html. [11 Mei 2003]
Trautmann A dan Fiebiger J. 1957. Fundamental of Histology of Domestic Animals. Edisi ke-2. New York: Compstock Publishing Associates
Tobing D. 2006. Paling Ditakuti, Tetapi Bisa Dihindari. http://www.gizi.net/cgi-bin/berita/fullnews.cgi. [6 Juli 2006]
Shils ME et al. 1994. Modern Nutrition in Health and Disease. Edisi ke-8. USA: Lea and Febiger.
Skudelski T. 2001. The Mechanism of Alloxan and Streptozotocin action in B Cells of Rat Pancreas. Physiol. Vol 50: 536-546.
Utami P. 2003. Tanaman Obat untuk Mengatasi Diabetes Melitus. Jakarta: Agromedia Pustaka.
Lampiran 1 Tahap-tahap pewarnaan Hematoksilin Eosin (HE)
Pewarnaan menggunakan Haematoxylin eosin (HE) sebagai berikut :
• Xylol I 2 menit
• Xylol II 2 menit
• Alkohol absolut 2 menit • Alkohol 95% 1 menit • Alkohol 80% 1 menit • Cuci dalam air kran 10 menit • Mayers Haematoxylin 1 menit • Cuci dalam air kran 10 menit • Lithium Carbonat 15-30 detik • Cuci dalam air kran 2 menit
• Eosin 2 menit
• Cuci dalam air kran 30-60 detik • Alkohol 95% 10 celupan • Alkohol absolut I 10 celupan • Alkohol absolut II 10 celupan
• Xylol I 1 menit
• Xylol II 2 menit
Lampiran 2
Kadar gula darah kelompok-kelompok tikus yang diukur akhir perlakuan Perlakuan Kelompok Hasil (mg/dL)
Kontrol
Test of Homogeneity of Variances
VAR00002
Levene
Statistic df1 df2 Sig.
8,180 3 8 ,008
N Mean Std. Deviation Std. Error
95% Confidence Interval for Mean
Minimum Maximum
Lower Bound Upper Bound
Kontrol 3 84,3333 5,13160 2,96273 71,5857 97,0809 80,00 90,00
Vit.E 3 84,6667 3,05505 1,76383 77,0775 92,2558 82,00 88,00
STZ 3 202,0000 92,50405 53,40724 -27,7928 431,7928 99,00 278,00
STZ+Vit.E 3 443,3333 11,01514 6,35959 415,9702 470,6965 436,00 456,00
Total 12 203,5833 158,10265 45,64030 103,1297 304,0370 80,00 456,00
ANOVA
Sum of
Squares df Mean Square F Sig.
Between Groups 257532,91
7 3 85844,306 39,405 ,000
Within Groups 17428,000 8 2178,500
Total 274960,91
7 11
Duncan
VAR00001 N
Subset for alpha = .05
1 2 3
Kontrol 3 84,3333
Vit.E 3 84,6667
STZ 3 202,0000
STZ+Vit.E 3 443,3333
Sig. ,993 1,000 1,000
Lampiran 3
Perubahan pada neuron cerebrum pada tiap kelompok perlakuan Kelompok
Perlakuan
Nekrosa/ degenerasi Normal
Kontrol 1 18 82
Jumlah Neuron Nekrosa
N Mean Std. Deviation Std. Error
95% Confidence Interval for Mean
Minimum Maximum Lower Bound Upper Bound
Kontrol 3 15,0000 3,60555 2,08167 6,0433 23,9567 11,00 18,00
Vit E 3 12,0000 1,00000 ,57735 9,5159 14,4841 11,00 13,00
STZ 3 71,3333 3,05505 1,76383 63,7442 78,9225 68,00 74,00
STZ+Vit E 3 27,3333 2,08167 1,20185 22,1622 32,5045 25,00 29,00
Total 12 31,4167 24,90877 7,19054 15,5904 47,2429 11,00 74,00
Test of Homogeneity of Variances
Jumlah Neuron Nekrosa
Levene
Statistic df1 df2 Sig.
1,716 3 8 ,241
ANOVA
Jumlah Neuron Nekrosa
Sum of
Squares df Mean Square F Sig.
Between Groups 6769,583 3 2256,528 326,245 ,000
Within Groups 55,333 8 6,917
Total 6824,917 11
Jumlah Neuron Nekrosa
Duncan
Kelompok N
Subset for alpha = .05
1 2 3
Vit E 3 12,0000
Kontrol 3 15,0000
STZ+Vit E 3 27,3333
STZ 3 71,3333
Sig. ,200 1,000 1,000

![Gambar 3 Struktur kimia streptozotosin (1-methyl-1-nitroso-3-[2,4,5-trihydroxy 6-(hydroxymethyl)oxan-3-yl]-urea) (Wikipedia 2006)](https://thumb-ap.123doks.com/thumbv2/123dok/537416.336371/25.612.238.392.398.484/gambar-struktur-streptozotosin-methyl-nitroso-trihydroxy-hydroxymethyl-wikipedia.webp)