SKRIPSI
KAJIAN SENYAWA ANTIMIKROBA BAKTERI ASAM LAKTAT HETEROFERMENTATIF ISOLAT ASI
Oleh :
FITRIANA ROHANI F24051780
2010
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
Fitriana Rohani. F24051780. Kajian Senyawa Antimikroba Bakteri Asam Laktat Heterofermentatif Isolat ASI. Dibawah Bimbingan Dr. Ir. Lilis Nuraida, M.Sc. dan Siti Nurjanah, S.TP., M.Si.
RINGKASAN
Bakteri asam laktat (BAL) dapat menghasilkan metabolit berupa senyawa yang dapat menghambat pertumbuhan mikroba pembusuk dan patogen. Senyawa antimikroba yang dihasilkan oleh BAL dapat digunakan untuk memperpanjang waktu penyimpanan makanan dan minuman karena dapat menekan pertumbuhan mikroorganisme yang tidak diinginkan sehingga dapat digunakan sebagai bahan pengawet makanan. Peranan bakteri asam laktat yang dapat memproduksi bahan pengawet makanan menjadi perhatian khusus untuk dikembangkan lebih lanjut karena dapat menjadi alternatif pengawet makanan dan mengurangi penggunaan zat pengawet kimia yang sering disalahgunakan.
Berdasarkan jalur yang digunakan dalam memfermentasi glukosa, bakteri asam laktat dibagi menjadi dua kelompok, yaitu BAL homofermentatif dan BAL heterofermentatif. Dibandingkan bakteri asam laktat homofermentatif, bakteri asam laktat heterofermentatif menghasilkan senyawa antimiroba yang lebih beragam, yaitu selain menghasilkan asam laktat juga dapat menghasilkan asam asetat/etanol, karbon dioksida, dan bakteriosin. Penelitian ini bertujuan untuk menyeleksi BAL heterofermentatif isolat ASI yang memiliki aktivitas penghambatan tertinggi terhadap bakteri patogen dan menyeleksi BAL heterofermentatif isolat ASI yang berpotensi menghasilkan bakteriosin.
Penelitian ini dibagi ke dalam dua tahapan, yaitu : (1) Seleksi awal isolat BAL dengan pengujian aktivitas penghambatan terhadap bakteri patogen (2) Seleksi BAL yang berpotensi menghasilkan bakteriosin. Tahap kedua terbagi menjadi empat bagian, yaitu: (a) Penentuan aktivitas antimikroba dengan metode kontak, (b) Penentuan waktu pertumbuhan BAL, (c) Konfirmasi BAL penghasil bakteriosin, (d) Ekstraksi bakteriosin dan uji penghambatannya terhadap bakteri patogen.
Kultur isolat ASI yang digunakan berjumlah 25 isolat, yaitu Lactobacillus heterofermentatif (A10, A17, A21, A33, R2, R3, R4, R5, R6, R7, R8, R29, dan R33), Leuconostoc (R1, R9, dan R10), dan bakteri asam laktat heterofermentatif isolat ASI lain yang belum diketahui genusnya (A5, A6, A11, A13, A25, A30, A32, A37, dan B2). Kultur bakteri uji yang digunakan adalah Listeria monocytogenes, Staphylococcus aureus, Bacillus cereus, Escherichia coli, dan Salmonella typhimurium.
metode kontak ini, supernatan isolat A10 yang dinetralkan dapat menurunkan jumlah Listeria monocytogenes sebesar 0.03 log cfu/ml, sedangkan pada supernatan 5 isolat yang dinetralkan lainnya (R29, R1, R2, A21, dan R33), jumlah Listeria monocytogenes meningkat dengan peningkatan yang bervariasi, yaitu berkisar antara 0.03-0.6 log cfu/ml. Kenaikan ini masih di bawah kenaikan pada kontrol, dimana kenaikkan Listeria monocytogenes pada kontrol sebesar 1.3 log cfu/ml.
Masing-masing BAL membutuhkan waktu inkubasi yang berbeda-beda untuk mencapai akhir fase eksponensial. Isolat A10, A21, dan R1 mencapai akhir fase eksponensial setelah 13 jam inkubasi, isolat R2 setelah 16 jam inkubasi, isolat R29 setelah 21 jam inkubasi, dan isolat R33 setelah 19 jam inkubasi.
Pada supernatan isolat A10 dan R2 yang diinkubasi sampai akhir fase eksponensial (A10 13 jam, R2 16 jam) dan dinetralkan, Listeria monocytogenes mengalami kenaikan sebesar 1.1 dan 0.9 log cfu/ml. Kenaikan ini lebih tinggi bila dibandingkan dengan perubahan jumlah Listeria monocytogenes yang dikontakkan dengan isolat A10 dan R2 yang telah diinkubasi selama 24 jam. Hal ini menunjukkan bahwa penghambatan terhadap Listeria monocytogenes oleh supernatan isolat A10 dan R2 yang diinkubasi selama 24 jam lebih baik daripada isolat A10 dan R2 yang diinkubasi sampai akhir fase eksponensial. Oleh karena itu, untuk pengujian tahap selanjutnya dipilih isolat BAL dengan waktu inkubasi 24 jam yang menunjukkan penghambatan terbesar pada metode kontak, yaitu isolat A10 karena paling berpotensi menghasilkan bakteriosin.
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
KAJIAN SENYAWA ANTIMIKROBA BAKTERI ASAM LAKTAT HETEROFERMENTATIF ISOLAT ASI
SKRIPSI
Sebagai salah satu ayarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh:
FITRIANA ROHANI F24051780
2010
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
Judul Skripsi : Kajian Senyawa Antimikroba Bakteri Asam Laktat Heterofermentatif Isolat ASI
Nama : Fitriana Rohani NRP : F24051780
Menyetujui,
Dosen Pembimbing I Dosen Pembimbing II
(Dr. Ir. Lilis Nuraida, M.Sc.) (Siti Nurjanah, S.TP, M.Si.) NIP. 19621009.198703.2.002 NIP. 19760131.200501.2.001
Mengetahui, Ketua Departemen
(Dr. Ir. Dahrul Syah) NIP. 19650814.199002.1.001
RIWAYAT PENULIS
Penulis dilahirkan di Jakarta pada tanggal 6 Juni 1987 sebagai anak ketiga dan terakhir dari pasangan Nazmiral Yunus dan drg. Murni Nawawi (almarhum). Bangku sekolah penulis dimulai dari TK Mitra Batik, SDN Babakan IV, SLTPN 1 Pamulang, SMAN 1 Serpong, dan kemudian penulis diterima menjadi mahasiswi Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian melalui jalur Undangan Seleksi Masuk IPB (USMI) pada tahun 2005.
Selama belajar di Departemen Ilmu dan Teknologi Pangan IPB, penulis mengikuti beberapa kegiatan dan organisasi kemahasiswaan. Diantaranya, penulis pernah menjadi panitia BAUR 2007, MPF 2007, pengurus Rohis ITP Divisi Infokom periode 2006-2007, pengurus BKO Food Processing Club HIMITEPA Divisi Ekstrusi tahun 2006, dan Penyuluh Keamanan Pangan UKM sekitar kampus yang diadakan oleh HIMITEPA dan SEAFAST IPB tahun 2008. Selain itu, penulis juga tercatat sebagai Asisten Praktikum Teknik Pangan tahun 2009.
Penulis pernah mengikuti Pelatihan Sistem Manajemen Halal tahun 2008, Seminar Mahasiswa Teknologi Pangan dan ilmu Gizi Tingkat Nasional tahun 2008, dan Seminar dan Talkshow HACCP VII tahun 2009.
Selama menempuh pendidikan sarjana, penulis memperoleh beasiswa pendidikan dari Indonesia Belajar Mandiri (Ijari), Alumni TPG 24 (Gossypin) dan Women’s Internasional Club (WIC). Penulis pernah bekerja sebagai pengajar di Nurul Ilmi Darmaga Bogor, freelance interviewer panelis di San Miguel Pure Foods, dan analis mikrobiologi RND di PT. Luvin Indonusa.
KATA PENGANTAR
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala karunia, hidayah, dan rahmat-Nya sehingga penulis dapat menyelesaikan penelitian yang berjudul “Kajian Senyawa Antimikroba Bakteri Asam Laktat Heterofermentatif Isolat ASI”.
Ucapan terima kasih penulis sampaikan kepada sejumlah pihak yang telah berkontribusi secara langsung maupun tidak langsung dalam penyelesaian tugas akhir ini. Penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Dr. Ir. Lilis Nuraida, M.Sc. dan Siti Nurjanah, S.TP, M.Si. selaku pembimbing akademik yang telah memberikan dukungan, motivasi, bimbingan, dan pengarahan kepada penulis sehingga tugas akhir ini dapat terselesaikan.
2. Elvira Syamsir, S.TP, M.Si. atas waktu dan kesediaannya sebagai dosen penguji serta masukan-masukan yang berarti demi perbaikan skripsi ini. 3. SEAFAST Center IPB atas penyediaan fasilitas dan dana untuk penelitian ini. 4. Ayah, almarhum ibu, abang, ima, dan uni atas doa dan dukungannya selama
ini sehingga penulis bisa lulus dengan baik.
5. Teman satu bimbingan : Ike dan Siska atas kesabaran kalian dalam bekerja sama dalam penelitian ini.
6. Mba Hana, Mba April, Mba Ari, Kak Riska, dan Kak Sissy atas saran dan bantuannya pada pengerjaan penelitian ini.
7. Serta seluruh pihak yang tidak dapat disebutkan satu persatu terima kasih atas bantuannya sehingga tugas akhir ini dapat terselesaikan dengan baik.
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
DAFTAR ISI ... ii
DAFTAR TABEL ... iv
DAFTAR GAMBAR ... v
DAFTAR LAMPIRAN ... vi
I. PENDAHULUAN ... 1
A. LATAR BELAKANG... 1
B. TUJUAN ... 3
C. MANFAAT ... 3
II. TINJAUAN PUSTAKA ... 4
A. Bakteri Asam Laktat ... 4
B. Bakteri Asam Laktat Heterofermentatif ... 6
1. Leuconostoc... 8
2. Weisella dan Oenococcus ... 9
3. Lactobacillus ... 9
C. Senyawa Antimikroba Bakteri Asam Laktat Heterofermentatif ... 10
1. Asam Organik ... 11
2. Hidrogen peroksida ... 13
3. Karbondioksida ... 14
4. Diasetil ... 14
5. Bakteriosin ... 15
D. Peranan Bakteri Asam Laktat Sebagai Pengawet Makanan ... 18
III. METODOLOGI PENELITIAN ... 19
A. Bahan dan Alat ... 19
B. Metode Penelitian... 19
1. Seleksi Awal Isolat Bakteri Asam Laktat dengan Pengujian Aktivitas Antimikroba Terhadap Bakteri Patogen ... ... 20
2. Seleksi Bakteri Asam Laktat yang Berpotensi Menghasilkan Bakteriosin ... 20
a. Pengujian Aktivitas Antimikroba dengan Metode Kontak ... 20
b. Penentuan Waktu Pertumbuhan Bakteri Asam Laktat ... 21
c. Konfirmasi Bakteri Asam Laktat Penghasil Bakteriosin ... 21
d. Ekstraksi Bakteriosin dan Uji Penghambatannya Terhadap Bakteri Patogen ... 23
IV. HASIL DAN PEMBAHASAN ... 24
A. Seleksi Awal Isolat Bakteri Asam Laktat dengan Pengujian Aktivitas Antimikroba Terhadap Bakteri Patogen ... 24
1. Pengujian Aktivitas Antimikroba dengan Metode Kontak ... 27
2. Penentuan Waktu Pertumbuhan BAL ... 32
3. Konfirmasi BAL Penghasil Bakteriosin ... 35
4. Ekstraksi Bakteriosin dan Uji Penghambatannya Terhadap Bakteri Patogen ... 38
V. KESIMPULAN DAN SARAN ... 40
A. KESIMPULAN ... 40
B. SARAN ... 41
DAFTAR PUSTAKA ... 42
DAFTAR TABEL
Halaman Tabel 1. Karakteristik tipe fermentasi BAL ... 6 Tabel 2. Bakteriosin yang dihasilkan oleh BAL fakultatif heterofermentatif dan
obligat heterofermentatif... 7 Tabel 3. Daftar spesies Lactobacillus berdasarkan tipe fermentasi ... 10 Tabel 4. Nilai pKa dan Rasio Tak Terdisosiasi dari Asam Laktat,
Asetat, dan Propionat ... 12 Tabel 5. Aktivitas penghambatan supernatan yang dinetralisasi
terhadap bakteri gram positif ... 36 Tabel 6. Aktivitas penghambatan protein terendapkan dari supernatan isolat
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur kimia asam laktat ... 11
Gambar 2. Aktivitas antimikroba BAL terhadap kelima bakteri uji ... 25
Gambar 3. Perubahan jumlah Listeria monocytogenes setelah dikontakkan dengan supernatan BAL selama 8 jam ... 29
Gambar 4. Hubungan antara pH supernatan BAL dengan penurunan jumlah Listeria monocytogenes ... 31
Gambar 5. Kurva pertumbuhan isolat A10 ... 33
Gambar 6. Kurva pertumbuhan isolat A21 ... 33
Gambar 7. Kurva pertumbuhan isolat R1 ... 33
Gambar 8. Kurva pertumbuhan isolat R2 ... 34
Gambar 9. Kurva pertumbuhan isolat R29 ... 34
Gambar 10. Kurva pertumbuhan isolat R33 ... 34
DAFTAR LAMPIRAN
Halaman Lampiran 1. Jalur fermentasi glikolisis (BAL homofermentatif) dan
6-phosphogluconate/phosphoketolase (6PG/PK) (BAL
heterofermentatif) ... 46 Lampiran 2. Cara perhitungan diameter penghambatan pada metode sumur.... 47 Lampiran 3. Cara perhitungan koloni pada cawan dengan berdasarkan
SPC (Standard Plate Count)... 47 Lampran 4. Cara perhitungan nilai OD isolat BAL... 47 Lampiran 5. Daya hambat BAL terhadap bakteri uji Listeria monocytogene 48 Lampiran 6. Daya hambat BAL terhadap bakteri uji Staphylococcus aureus 49 Lampiran 7. Daya hambat BAL terhadap bakteri uji Bacillus cereus ... 50 Lampiran 8. Daya hambat BAL terhadap bakteri uji Escherichia coli...... 51 Lampiran 9. Daya hambat BAL terhadap bakteri uji Salmonella thypimurium 52 Lampiran 10. Perubahan jumlah L. monocytogenes pada supernatan isolat BAL
yang dinetralkan dan tidak dinetralkan dengan metode kontak ... 53 Lampiran 11. Perubahan jumlah L. monocytogenes pada supernatan isolat BAL
yang diinkubasi selama 24 jam dan sampai awal fase stasioner . . 55 Lampiran 12. Hasil uji statistik perubahan jumlah L. monocytogenes pada
supernatan isolat BAL yang dinetralisasi... 56 Lampiran 13. Hasil uji statistik perubahan jumlah L. monocytogenes pada
I. PENDAHULUAN
A. LATAR BELAKANG
Bakteri asam laktat (BAL) telah lama diketahui berperan dalam proses fermentasi produk-produk pangan. Pada awalnya fermentasi hanya terbentuk secara spontan dan tidak disengaja, tetapi setelah manusia mengetahui keuntungan dan manfaat produk hasil fermentasi, BAL sengaja ditambahkan ke dalam produk pangan dan pakan disertai dengan pengaturan kondisi tertentu agar fermentasi berjalan optimal. Seiring dengan berkembangnya ilmu pengetahuan, bakteri asam laktat tidak hanya digunakan untuk memfermentasi makanan, tetapi juga dapat digunakan sebagai pengawet makanan. Hal ini dikarenakan bakteri asam laktat dapat menghasilkan metabolit berupa senyawa yang dapat menghambat pertumbuhan mikroba pembusuk dan patogen. Senyawa antimikroba yang dihasilkan oleh bakteri asam laktat diantaranya adalah asam-asam organik, hidrogen peroksida, karbondioksida, diasetil, etanol, dan bakteriosin.
Penelitian tentang senyawa antimikroba dari bakteri asam laktat hingga saat ini telah banyak dilakukan. Senyawa antimikroba yang dihasilkan oleh bakteri asam laktat memberikan beberapa keuntungan, yaitu selain dapat memperpanjang waktu penyimpanan dan menekan pertumbuhan mikroorganisme yang tidak diinginkan, juga aman bagi manusia yang mengkonsumsinya karena tidak bersifat toksik. Selain itu, bakteri asam laktat termasuk golongan mikroorganisme yang aman ditambahkan dalam makanan karena tidak menghasilkan toksin, dan dikenal dengan sebutan food grade microorganism (Holzapfel et al., 1995). Peranan bakteri asam laktat yang dapat memproduksi bahan pengawet makanan menjadi perhatian khusus untuk dikembangkan lebih lanjut karena dapat menjadi alternatif penanganan masalah penggunaan zat pengawet bukan untuk pangan yang akhir-akhir ini sering disalahgunakan.
Liang Bogor. Dari 71 isolat yang ditemukan, 60 % adalah Lactobacillus homofermentatif, 23 % adalah Lactobacillus heterofermentatif, 8 % adalah Bifidobacterium, 4 % adalah Streptococcus homofermentatif, 4 % adalah Leuconostoc heterofermentatif, dan 1 % adalah Pediococcus homofermentatif. Kultur-kultur tersebut telah diidentifikasi berdasarkan pengamatan morfologi, ciri-ciri fisiologis, dan sifat-sifat biokimia bakteri. Dari beberapa isolat BAL tersebut yang bersifat homofermentatif telah diuji penghambatannya terhadap bakteri uji Staphylococcus aureus, Bacillus cereus, Salmonella thypimurium dan Escherichia coli dengan metode difusi agar atau sumur. Sedangkan isolat BAL yang bersifat heterofermentatif belum diuji aktivitas penghambatannya.
Di antara 12 genus bakteri asam laktat (Lactobacillus, Bifidobacterium, Enterococcus, Streptococcus, Pediococcus, Leuconostoc, Carnobacterium, Lactococcus, Oenococcus, Tetragenococcus, Vagococcus, dan Weissella), yang bersifat heterofermentatif adalah Leuconostoc, Oenococcus, Weissella, dan beberapa spesies Lactobacillus (Salminen et al., 2004).
Dibandingkan bakteri asam laktat homofermentatif, bakteri asam laktat heterofermentatif menghasilkan senyawa antimikroba yang lebih beragam, yaitu selain menghasilkan asam laktat juga dapat menghasilkan asam asetat/etanol, karbon dioksida, dan bakteriosin. Oleh karena itu perlu dilakukan pengkajian senyawa antimikroba yang dihasilkan oleh bakteri asam laktat heterofermentatif terutama bakteriosin karena sangat potensial digunakan sebagai bahan pengawet alami.
B. TUJUAN PENELITIAN
Tujuan penelitian ini adalah untuk (1) mendapatkan BAL heterofermentatif isolat ASI yang memiliki aktivitas penghambatan tertinggi terhadap bakteri patogen, (2) mendapatkan BAL heterofermentatif isolat ASI yang berpotensi menghasilkan bakteriosin.
C. MANFAAT
II. TINJAUAN PUSTAKA
A. BAKTERI ASAM LAKTAT
Bakteri asam laktat (BAL) merupakan bakteri Gram positif, tidak berspora, berbentuk batang atau basil maupun kokus, bersifat anaerobik tetapi toleran terhadap O2, tidak memiliki sitokrom, bersifat katalase negatif walaupun beberapa menunjukkan reaksi positif di bawah kondisi pertumbuhan tertentu, dan menghasilkan asam laktat sebagai produk akhir fermentasi karbohidrat. Asam laktat merupakan produk utama dari bakteri asam laktat yang merupakan hasil fermentasi dari laktosa (Ouwehand, 1998).
BAL tidak dapat mensintesis heme (porfirin), oleh karena itu BAL bersifat katalase negatif. Apabila dilakukan penambahan heme (atau hemoglobin) ke dalam media pertumbuhan, maka katalase dan bahkan sitokrom dapat dibentuk (Salminen et al., 2004). BAL tidak membentuk spora, sel berbentuk batang atau bulat, baik tunggal, berpasangan atau berantai, kadang-kadang bentuk tetrad. BAL bersifat mikroaerofilik sampai anaerob, tidak motil atau sedikit motil, bersifat kemoorganotropik dan kompleks, serta bersifat mesofilik atau menyukai suhu 10-40oC (Stamer, 1980). BAL termasuk golongan osmotoleran yang mempunyai Aw minimal 0.95 untuk pertumbuhannya tetapi beberapa mampu bertahan pada Aw 0.93 (Hadi dan Fardiaz, 1990).
BAL umumnya tumbuh pada media yang kaya akan nutrisi, seperti pada berbagai produk makanan (susu, daging, minuman, sayuran), tatapi beberapa BAL ada yang terdapat secara alami pada tubuh manusia dan hewan mamalia, seperti pada mulut, usus, vagina, dan pada permukaan mukosa (Salminen et al., 2004).
Penentuan hubungan filogenetik antar BAL pada mulanya hanya bisa dilakukan dengan penentuan karakter fenotip saja. Seiring dengan berkembangnya teknologi, hubungan sampai tingkat spesies bisa ditentukan secara lebih akurat dengan persamaan DNA. Pada mulanya penentuan sekuen rRNA (ribosomal RNA) bakteri dilakukan dengan teknik trankriptasi, tetapi sekarang dapat dilakukan dengan PCR (Polymerase Chain Reaction). Dengan teknik ini, bisa didapatkan gambaran filogeni BAL dengan lebih jelas (Salminen et al., 2004).
Klasifikasi terbaru menggolongkan BAL ke dalam 12 genus, yaitu Lactobacillus, Bifidobacterium, Enterococcus, Streptococcus, Pediococcus, Leuconostoc, Carnobacterium, Lactococcus, Oenococcus, Tetragenococcus, Vagococcus, dan Weisella. Klasifikasi ini didasarkan pada morfologi, cara memfermentasi glukosa, pertumbuhan pada suhu yang berbeda, susunan asam laktat yang dihasilkan, kemampuan untuk tumbuh pada garam dengan konsentrasi tinggi, dan ketahanan terhadap asam atau basa (Salminen et al., 2004).
Berdasarkan jalur yang digunakan dalam memfermentasi glukosa, bakteri asam laktat dibagi menjadi dua kelompok, yaitu BAL homofermentatif dan BAL heterofermentatif. BAL homofermentatif menggunakan jalur glikolisis (jalur Embden-Meyerhof-Parnas), sedangkan BAL heterofermentatif menggunakan jalur 6-fosfoglukonat/fosfoketolase (6PG/PK). Kedua jalur ini dapat dilihat pada Lampiran 1.
Fermentasi glukosa oleh BAL homofermentatif menghasilkan 2 mol asam laktat dan 2 ATP per mol glukosa yang dikonsumsi, sedangkan fermentasi glukosa oleh BAL heterofermentatif menghasilkan masing-masing 1 mol asam laktat, etanol/asam asetat, dan CO2, dan 1 mol ATP per mol glukosa (Salminen et al., 2004).
Tabel 1 Karakteristik tipe fermentasi BAL (Salminen et al., 2004) Karakteristik Obligat
homofermentatif
Fakultatif heterofermentatif
Obligat heterofermentatif Fermentasi
pentosa
- + -
CO2 dari glukosa
- - +
CO2 dari glukonat
- +a +a
Keberadaan FDP aldolase
+ + -
Keberadaan Fosfoketolase
- +b +
Keterangan : a Ketika difermentasi bDibantu oleh pentosa
B. BAKTERI ASAM LAKTAT HETEROFERMENTATIF
Dalam memfermentasi glukosa, BAL heterofermentatif menggunakan jalur 6-fosfoglukonat/fosfoketolase (6PG/PK) dan menghasilkan masing-masing 1 mol asam laktat, etanol/asam asetat, dan CO2, dan 1 mol ATP per mol glukosa. Diantara 12 genus bakteri asam laktat, BAL yang bersifat heterofermentatif adalah Leuconostoc, Oenococcus, Weissella, dan beberapa Lactobacillus (Salminen et al., 2004).
Peranan bakteri asam laktat heteroferntatif yang tidak kalah penting adalah kemampuannya untuk menghasilkan senyawa antimikroba, seperti asam organik (asam laktat dan asam asetat), hidrogen peroksida, karbondioksida, diasetil, dan bakteriosin. Senyawa-senyawa ini bersifat antagonistik terhadap mikroba sekerabat maupun terhadap golongan di luar genusnya, sehingga memberikan kontribusi yang nyata terhadap pengawetan (Jennie, 1996 diacu dalam Wiarawati, 2002).
Hingga saat ini sudah banyak bakteriosin yang diketahui dihasilkan oleh bakteri asam laktat heterofermentatif. Beberapa di antaranya dapat dilihat pada Tabel 2.
Tabel 2 Bakteriosin yang dihasilkan oleh BAL fakultatif heterofermentatif dan obligat heterofermentatif (Salminen et al., 2004)
No. Bakteriosin Galur bakteri yang memproduksi
1. Lactocin S Lactobacillus sake L45
2. Bavaricin A Lactobacillus sake M1401
3. Bavaricin MN Lactobacillus sake MN
4. Curvacin A Lactobacillus curvatus LTH1174
5. Leucocin A/b-Ta11a Leuconostoc gelidum UAL187dan Leuconostoc carnosum Ta11a 6. Mesentericin Y105 Leuconostoc mesentroides Y105 7. Pediocin PA-1/AcH/SJ-1 Lactobacillus plantarum
8. Sakacin 674 Lactobacillus sake LB764
9. Sakacin A Lactobacillus sake LB706
10. Sakacin P Lactobacillus sake LB673
11. Plantaricin EF Lactobacillus plantarum C11 12. Plantaricin JK Lactobacillus plantarum C11 13. Plantaricin A Lactobacillus plantarum C11 14. Plantaricin S Lactobacillus plantarum
15. Plantacin B Lactobacillus plantarum NCDO 1193
Berikut adalah penjelasan dari masing-masing genus BAL yang bersifat heterofermentatif.
1. Leuconostoc
Leuconostoc merupakan bakteri asam laktat heterofermentatif dan berbentuk bulat/kokus. Leuconostoc dapat menghasilkan sejumlah diasetil dari sitrat pada susu, dan beberapa spesies terutama Ln. mesentroides subsp. cremoris telah digunakan pada industri susu. Bakteri ini belum dipelajari sejauh genus Lactobacillus dan bakteri asam laktat lainnya. Peranan bakteri ini terutama pada perubahan kualitas organoleptik dan tekstur dari produk makanan fermentasi seperti susu, mentega, keju, dan daging. Beberapa Leuconostoc juga dapat berperan pada fermentasi adonan.
Beberapa strain dari Leuc. Mesentroides menghasilkan dekstran ekstraseluler yang membentuk lapisan elektron tebal pada permukaan sel (Brooker, 1977). Pembentukan dekstran seringkali hilang ketika ditumbuhkan pada media dengan konsentrasi garam yang tinggi. Sebaliknya, strain yang tidak memproduksi dekstran dapat memproduksi dekstran pada media yang mengandung sari tomat atau jeruk.
Beberapa strain Leuconostoc telah diketahui dapat menghasilkan bakteriosin. Hasting dan Stiles (1991) mengisolasi bakteriosin yang dihasilkan oleh Leuc. gelidum yang menghambat Laktobasili, Leuconostoc, dan Listeria monocytogenes. Bakteriosin ini sensitif terhadap protease dan tripsin dan dapat diendapkan dengan ammonium sulfat, menunjukkan bahwa bakteriosin memiliki sifat protein. Aktivitasnya tidak hilang ketika dipanaskan hingga 62 oC selama 30 menit. Bakteriosin ini lebih bersifat bakteriostatik.
Lewus et al. (1992) mengisolasi bakteriosin dari Leuc. paramesentroides. Seperti bakteriosin yang diisolasi dari Leuc. gelidum, bakteriosin ini tahan panas selama 30 menit pada 60 oC. Bakteriosin ini diinaktifasi oleh α-amylase, trypsin, α-chymotrypsin, protease, dan proteinase K. Bakteriosin ini memiliki efek bakteriostatik terhadap Listeria monocytogenes, Staphylococcus aureus, Yersinia enterocolitica, dan Clostridium botulinum.
2. Weisella dan Oenococcus
Pada awalnya Weissella dan Oenococcus termasuk ke dalam genus Leuconostoc, tetapi kemudian dipisahkan karena memiliki beberapa perbedaan karakteristik. Pembedaan kedua genus ini juga dapat dilakukan dengan penentuan sekuen rRNA dan metode berbasis PCR (Polymerase Chain Reaction).
Weissella dibedakan dari Leuconostoc berdasarkan karakteristiknya seperti pola fermentasi karbohidrat, pembentukan dekstran (dari sukrosa), hidrolisis eskulin, kebutuhan pertumbuhan, pertumbuhan pada pH dan suhu berbeda, dan disimilasi sitrat dan/atau malat. Disimilasi malat menghasilkan L-asam laktat. Pada saat penentuan konfigurasi asam laktat harus diperhatikan apakah malat terdapat pada media pertumbuhan atau tidak.
Oenococcus pada awalnya bernama Leuconostoc oenos dan dijuluki “Wine Leuconostoc”. Kemudian Oenococcus dibedakan dari Leuconostoc berdasarkan ketahanannya terhadap asam dan etanol yang tinggi (Salminen et al., 2004).
3. Lactobacillus
Lactobacillus ada yang bersifat homofermentatif, fakultatif heterofermentatif, dan obligat heterofermentatif. Pembagian spesies Lactobacillus berdasarkan tipe fermentasinya dapat dilihat pada Tabel 3.
Tabel 3 Daftar spesies Lactobacillus berdasarkan tipe fermentasi (Wood et al., 1995)
Tipe Fermentasi Spesies
Obligat
homofermentatif
Lb. animalis, Lb. aviarius, Lb. ruminis, Lb. salivarius, Lb. sharpeae, Lb. yamanashiensis (Lb. mali)
Fakultatif
heterofermentatif
Lb. agilis, Lb. alimentarius, Lb.
bifermentans, Lb. casei, Lb. coryniformis, Lb. curvatus, Lb. graminis, Lb. homohiochii, Lb. paracasei, Lb. pentosus, Lb. plantarum, Lb. rhamnosus, Lb. sake
Obligat heterofermentatif Lb. brevis, Lb. buchneri, Lb. fermentum, Lb. fructivorans, Lb. hilgardii, Lb. kefir, Lb. oris, Lb. parabuchneri, Lb. reuteri, Lb.
sanfransisco, Lb. suebicus, Lb. vaccinostercus, Lb. vaginalis
C. SENYAWA ANTIMIKROBA BAKTERI ASAM LAKTAT
HETEROFERMENTATIF
Senyawa antimikroba adalah senyawa biologis atau kimia yang dapat menghambat pertumbuhan atau aktifitas mikroba. Menurut Fardiaz (1992), senyawa antimikroba dapat bersifat bakterisidal (membunuh bakteri), bakteristatik (menghambat pertumbuhan bakteri), fungisidal (membunuh kapang), dan germisidal (menghambat germinasi spora bakteri).
Kemampuan bakteri asam laktat (BAL) dalam memproduksi senyawa antimikroba telah lama digunakan untuk mengawetkan makanan. Fermentasi mereduksi sejumlah karbohidrat yang tersedia dan menghasilkan molekul organik yang menunjukkan aktivitas antimikroba, yang paling umum adalah asam laktat, asetat, dan propionat. Di samping metabolit utama tersebut, banyak komponen antimikroba lainnya dapat dibentuk oleh BAL, di anataranya hidrogen peroksida, karbon dioksida, diasetil, dan bakteriosin. Berikut adalah penjelasan dari berbagai macam senyawa antimikroba yang dihasilkan oleh BAL (Salminen et al., 2004).
1.Asam organik
Asam-asam organik yang dihasilkan selama proses fermentasi makanan dapat menyebabkan penurunan pH makanan sehingga mencapai batas minimal mikroorganisme dapat tumbuh (Ouwehand, 1998).
Metabolit primer dari BAL adalah asam laktat yang bertanggung jawab pada perubahan pH pada lingkungan pertumbuhan mereka, dan dapat bersifat antagonis bagi mikroorganisme lainnya (Wood, 1999). Asam laktat dapat mengakibatkan perubahan dalam rasa, tekstur, dan daya awet bahan pangan. Berikut adalah struktur kimia asam laktat.
Gambar 1 Struktur kimia asam laktat (C3H6O3) (Wood, 1999)
Berdasarkan Tabel 4, asam asetat dan asam propionat memiliki nilai pKa yang lebih tinggi dibandingkan dengan asam laktat sehingga memiliki rasio tidak terdisosiasi yang lebih tinggi daripada asam laktat pada beberapa pH. Hal ini menyebabkan daya antimikrobanya lebih tinggi dibandingkan dengan asam laktat (Wood, 1999). Asam yang tak terdisosiasi (netral) berdifusi ke dalam membran sel karena bersifat larut lemak.
Tabel 4 Nilai pKa dan rasio tak terdisosiasi dari asam laktat, asetat, dan propionat (Wood, 1999)
Asam pKa Asam tak terdisosiasi (%)
pH 3 pH 4 pH 5 pH 6 pH 7
Laktat 3.08 56 11 1 >1 >1
Asetat 4.75 98 85 36 5.4 0.6
Propionat 4.87 99 88 43 7.0 0.8
Meskipun asam asetat memiliki daya antimikroba yang paling kuat dibandingkan dengan asam laktat, tetapi penggunaan asam asetat sebagai pengawet makanan sangat terbatas karena mempunyai rasa asam yang sangat kuat dan menggigit. Asam organik yang paling sering digunakan dalam pengawetan makanan adalah asam laktat.
Mekanisme penghambatan bakteri oleh asam-asam organik berhubungan dengan keseimbangan asam-basa, penambahan proton, dan produksi energi oleh sel. Keseimbangan asam-basa pada mikroba ditunjukkan dengan pH yang mendekati netral. Protein, asam nukleat, dan fosfolipid dapat rusak oleh perubahan pH.
Setelah memasuki sel, asam akan berdisosiasi (memisah) karena pH sitoplasma biasanya netral. Pelepasan proton ke dalam sitoplasma menyebabkan pengasaman dan pengacauan gradien pH membran yang menyebabkan pertumbuhan terhambat (Blom et al., 1991). Akumulasi anion dapat mengurangi laju sintesis makromolekul dan mempengaruhi transport melalui sel membran (Cherrington et al., 1991).
molekul yang tidak bermuatan. Perubahan permeabilitas membran akan menghasilkan efek ganda, yaitu mengganggu transport nutrisi ke dalam sel dan menyebabkan metabolit internal keluar dari sel (Davidson dan Branen, 1993). Bakteri asam laktat, seperti bakteri lainnya, meniadakan efek akumulasi anion dengan mengurangi pH sitoplasma mereka (Russell, 1992).
2.Hidrogen peroksida
Salah satu produk sampingan yang dihasilkan oleh bakteri asam laktat adalah hidrogen peroksida (H2O2). Hidrogen peroksida dihasilkan oleh bakteri asam laktat dengan adanya oksigen melalui aktifitas oksidasi flavoprotein atau peroksida NADH. Selain itu, produksi hidrogen peroksida juga tergantung pada adanya galur khusus yang bersifat katalase negatif di dalam sistem. Dengan tidak adanya heme, BAL tidak dapat memproduksi katalase untuk penghilangan hidrogen peroksida. Hal ini mengakibatkan akumulasi hidrogen peroksida (Condon, 1987).
Efek bakterisidal hidrogen peroksida disebabkan oleh efek oksidasi yang kuat pada sel bakteri dan perusakan struktur molekul dasar dari sel protein. Hidrogen peroksida mempunyai aktivitas bakteristatik terhadap bakteri Gram positif dan aktivitas bakterisidal terhadap bakteri Gram negatif (Ouwehand, 1998).
Kemungkinan H2O2 diproduksi oleh bakteri asam laktat untuk pengawetan makanan terbatas karena banyak faktor pembatas yang kompleks seperti ketersediaan oksigen dan keberadaan superoksida dismutase dan katalase. Terlebih lagi, oksidasi dari H2O2 dan radikal bebas yang dihasilkan telah diketahui memberikan efek pada kualitas sensori yang menyebabkan ketengikan pada lemak dan minyak dan reaksi perubahan warna dan pada kondisi tertentu menyebabkan produksi reaktif aldehydes (Tamura et al., 1991). Menurut Fontaine (1996), hidrogen peroksida tidak berakumulasi dalam jumlah yang signifikan pada in vivo karena dapat diurai oleh peroksida, flavoprotein, dan pseudokatalase.
pepton seperti media MRS cair hanya 8-9 µg/ml setelah diinkubasi selama 2 hari pada suhu 30oC (Ray dan Daeschel, 1992).
3.Karbondioksida
Karbondioksida (CO2) secara umum dihasilkan dari hexosa selama proses fermentasi asam laktat heterofermentatif berlangsung. Karbondioksida dapat menciptakan lingkungan yang anaerobik dengan cara mengganti molekul oksigen yang ada sehingga pH intraseluler dan ekstraseluler mengalami penurunan dan menimbulkan kerusakan pada membran sel (Ouwehand, 1998).
Karbondioksida juga dapat menghambat dekarboksilasi enzimatik. Selain itu, akumulasi karbondioksida pada lapisan lipid menyebabkan disfungsi permeabilitas membran. Pada konsentrasi rendah, karbondioksida dapat merangsang pertumbuhan pada beberapa organisme, tetapi sebaliknya pada konsentrasi yang tinggi dapat menghambat pertumbuhan beberapa organisme (Lindgren, 1990).
4.Diasetil
Selama proses fermentasi, dihasilkan juga diasetil (2,3-butanedione). Diasetil memberikan karakteristik flavour yang diinginkan pada beberapa produk. Diasetil dihasilkan oleh bakteri dari galur Lactobacillus, Leuconostoc, Pediococcus, dan Streptococcus. Diasetil dapat diproduksi apabila terjadi metabolisme sitrat. Sitrat dikonversi melalui piruvat menjadi diasetil.
Diasetil memiliki sifat antimikroba hanya pada konsentrasi yang tinggi, sedangkan pada konsentrasi yang rendah tidak efektif karena dapat dihancurkan oleh beberapa mikroorganisme (Ray dan Daeschel, 1992). Diasetil akan memiliki efek antibakteri apabila dipekatkan hingga konsentrasi 500-2500 µg/ml. Pada konsentrasi 150 µg/ml, diasetil memiliki efek bakteriostatik (Nurhasanah, 2004).
mengikat arginin pada protein bakteri Gram negatif dan dengan demikian penggunaan arginin terganggu (Ouwehand, 1998). Bakteri Gram negatif membutuhkan konsentrasi paparan kurang lebih sebesar 200 mg/kg sehingga dapat dihambat. Penggunaan diasetil sebagai pengawet pada produk makanan dan minuman tidak dimungkinkan karena level penerimaan sensori yang rendah. Pada produk susu fermentasi, level penerimaan sensori berada pada kisaran 2-7 mg/kg (Wood, 1999).
5.Bakteriosin
Bakteriosin merupakan senyawa peptida yang memiliki sifat bakterisidal terhadap pertumbuhan mikroorganisme yang secara genetis dekat dengan mikroorganisme penghasil bakteriosin tersebut. Bakteriosin sangat mudah didegradasi oleh enzim proteolitik, merupakan produk ekstraseluler berupa protein yang disintesis langsung pada ribosom, memiliki aktivitas antibakteri dengan spektrum yang relatif sempit (Jack et al., 1995).
Beberapa kriteria bakteriosin yaitu berupa protein, bersifat bakterisidal, bakteri target memiliki sifat pengikatan spesifik (specific binding site), gen pengkode bakteriosin ada dalam plasmid, aktif terhadap bakteri yang dekat secara filogenik. Syarat bakteriosin adalah sebagai protein dan tidak membunuh bakteri penghasilnya.
Bakteriosin biasanya tahan terhadap panas, misalnya pada suhu 100˚C atau 121˚C selama 15 menit (Ogunbawo, 2003), dan aktivitasnya masih tetap ada dalam lingkungan asam. Demikian pula suhu yang sangat rendah dalam penyimpanan tidak mempengaruhi aktivitas bakteriosin. Umumnya bakteriosin sensitif terhadap protease.
Nisin sebagai bakteriosin merupakan senyawa biopreservatif pertama yang diisolasi dari bakteri asam laktat Lactococcus lactis spp. Senyawa ini sekarang telah digunakan di 57 negara sebagai bahan pengawet makanan yang aman dan dapat mencegah pertumbuhan bakteri perusak atau bahkan bakteri patogen (Ray, 1996).
Penggunaan bakteriosin sebagai bahan pengawet pada makanan mempunyai beberapa keuntungan sebagai berikut: a) Bakteriosin bukan bahan yang toksik dan mudah mengalami degradasi oleh enzim proteolitik karena merupakan senyawa protein, b) Penggunaannya tidak membahayakan mikroflora usus karena mudah dicerna oleh enzim-enzim dalam saluran pencernaan, c) Ditinjau dari segi lingkungan, penggunaan bakteriosin dapat mengurangi penggunaan bahan kimia yang selama ini digunakan sebagai bahan pengawet, dan d) Penggunaannya sangat fleksibel, dapat berupa biakan starter karena mampu menghasilkan senyawa antibakteri yang mampu menghambat bakteri pembusuk dan patogen pada makanan.
Sintesis bakteriosin oleh sel galur produsen terjadi selama pertumbuhan fase eksponensial, biasanya mengikuti pola sintesis protein. Sistem ini diatur oleh plasmid DNA ekstra kromosomal dan dipengaruhi oleh beberapa faktor terutama pH. Pada umumnya aktivitas bakteriosin setelah memasuki fase stasioner mengalami penurunan. Hal ini disebabkan oleh meningkatnya produksi enzim-enzim proteolitik yang akan mereduksi bakteriosin (Jimenez dan Diaz, 1993).
ataupun masuknya substansi ekstraseluler (lingkungan). Hal ini dapat menghambat produksi energi dan biosintesis protein atau asam nukleat sehingga pertumbuhan sel terhambat dan menyebabkan proses kematian pada sel (Gonzales et al., 1996).
Bakteriosin yang dihasilkan oleh beberapa galur asam laktat dikelompokkan ke dalam tiga kelas, yaitu: (1) lantibiotik, merupakan bakteriosin yang mengandung cincin lantionin dalam molekulnya, contohnya nisin, lacticin 481, lacticin S, Streptococcin SA-FF22; (2) bakteriosin kecil (<13000 D), hidrofobik dan relatif tahan panas; (3) bakteriosin berukuran besar (>30000 D) yang tidak tahan panas, contohnya Helvetion J dan Brevicin 27; (4) bakteriosin yang mengandung molekul protein kompleks, terdiri atas komponen karbohidrat maupun lipid (Klaenhammer, 1992 diacu dalam Ouwehand 1998).
Bakteriosin merupakan protein, maka isolasinya dapat menggunakan ammonium sulfat (Yang et al., 1992). Ammonium sulfat dapat mengendapkan bakteriosin dari media kultur menggunakan prinsip salting out. Berdasarkan hasil-hasil penelitian yang ada, metode pemurnian dapat melalui beberapa tahapan proses, yaitu setelah pengendapan dengan ammonium sulfat dapat dilakukan pemisahan kromatografi, meliputi pertukaran kation, filtrasi gel, interaksi hidrofobik, dan kromatografi cair reverse-phase untuk pemurnian bakteriosin yang signifikan. Tetapi biasanya rendemen yang didapatkan sedikit. Hal ini kemungkinan dikarenakan tahap pengerjaannya yang panjang sehingga memakan waktu sehingga tidak cocok untuk pemurnian bakteriosin skala besar (Coughlin dan Crabb, 2002). Selain itu metode ini membutuhkan peralatan yang mahal pada setiap tahapnya, dan dapat menyebabkan kehilangan produk yang diinginkan.
Nutrisi, pH media, dan suhu (Todorov dan Dicks, 2005) adalah faktor kritis suatu bakteri dalam menghasilkan senyawa bakteriosin. Selain itu, setiap bakteri menghasilkan bakteriosin pada fase pertumbuhan tertentu (fase logaritmik atau fase stasioner) sehingga waktu inkubasi merupakan salah satu faktor kritis untuk produksi bakteriosin.
D. PERANAN BAKTERI ASAM LAKTAT SEBAGAI PENGAWET MAKANAN
Kemampuan bakteri asam laktat (BAL) dalam memproduksi senyawa antimikroba telah lama digunakan untuk mengawetkan makanan. Fermentasi berbagai macam produk makanan oleh BAL adalah salah satu bentuk pengawetan tertua yang dilakukan oleh manusia, yaitu telah dilakukan sejak tahun 6000 SM (Soomro, 2002).
Sekarang ini konsumen lebih menyukai makanan yang menggunakan lebih sedikit bahan pengawet kimia karena kesadaran mereka akan kesehatan semakin meningkat. Dengan demikian, ada peningkatan ketertarikan terhadap pengawetan dengan menggunakan BAL karena selain dapat memperpanjang waktu penyimpanan dan menekan pertumbuhan mikroorganisme yang tidak diinginkan, juga aman dikonsumsi karena tidak bersifat toksik.
Beberapa produk metabolit yang dihasilkan oleh BAL mempunyai efek antimikroba, diantaranya asam-asam organik, asam lemak, hidrogen peroksida, dan diasetil (Holzapfel et al., 1995; Ouwehand, 1998). Tetapi perhatian lebih difokuskan pada kemampuan BAL dalam memproduksi senyawa protein khusus, yaitu bakteriosin yang dapat menghambat pertumbuhan patogen seperti Listeria, Clostridium, Staphylococcus, Bacillus spp. dan Enterococcus spp. sehingga dapat meningkatkan umur simpan makanan.
III. BAHAN DAN METODOLOGI
A. BAHAN DAN ALAT
Isolat BAL yang digunakan berjumlah 25 isolat, yaitu Lactobacillus heterofermentatif (A10, A17, A21, A33, R2, R3, R4, R5, R6, R7, R8, R29, dan R33), Leuconostoc (R1, R9, dan R10), dan BAL heterofermentatif isolat ASI lain yang belum diketahui genusnya (A5, A6, A11, A13, A25, A30, A32, A37, dan B2). Kultur bakteri uji yang digunakan adalah Listeria monocytogenes, Staphylococcus aureus, Bacillus cereus, Escherichia coli, dan Salmonella typhimurium. Kultur-kultur tersebut diperoleh dari SEAFAST Center IPB dan Fakultas Kedokteran Hewan IPB.
Bahan-bahan yang digunakan pada analisis mikrobiologi adalah Nutrient Broth (NB) (Oxoid), Nutrient Agar (NA) (Oxoid), de Mann Rogosa Sharpe Broth (MRSB) (Oxoid), de Mann Rogosa Sharpe Agar (MRSA) (Oxoid), NaCl (Merck), NaOH, ammonium sulfat, buffer sitrat fosfat, Na2CO3, dan aquades. Alat-alat yang digunakan adalah sentrifuse berpendingin, inkubator, refrigerator, autoklaf, neraca analitik, neraca kasar, vortex, pH meter, spektrofotometer UV visible Shimadzu 4250, hotplate, mikropipet, tip, membran filter 0.22 µm, syringe, tabung reaksi, cawan petri, gelas piala, gelas ukur, labu erlenmeyer, labu takar, pipet mohr, pipet tetes, sudip, pengaduk, bunsen, jarum ose, plastik HDPE tahan panas, kapas, dan aluminium foil.
A. Metode Penelitian
Penelitian ini dibagi ke dalam dua tahapan, yaitu: (1) Seleksi awal isolat bakteri asam laktat dengan pengujian aktivitas penghambatan terhadap bakteri patogen, (2) Seleksi bakteri asam laktat yang berpotensi menghasilkan bakteriosin. Tahap kedua terbagi menjadi empat bagian, yaitu: (a) Penentuan aktivitas antimikroba dengan metode kontak, (b) Penentuan kurva pertumbuhan bakteri asam laktat, (c) Konfirmasi bakteri asam laktat penghasil bakteriosin, (d) Ekstraksi bakteriosin dan uji penghambatannya terhadap bakteri patogen.
Pengujian aktivitas antimikroba BAL terhadap bakteri patogen dilakukan dengan metode difusi agar atau sumur (Garriga, Hugas, Aymerich dan Monfrot, 1993). Bakteri uji yang digunakan adalah bakteri Gram positif (Listeria monocytogenes, Bacillus cereus, dan Staphylococcus aureus) dan bakteri Gram negatif (Escherichia coli dan Salmonella typhimurium). Kultur BAL diinokulasikan dalam media MRSB dan diinkubasi selama 24 jam. Kultur bakteri uji disegarkan dalam media NA dan diinkubasi selama 24 jam. Kultur bakteri uji yang telah disegarkan diinokulasikan sebanyak ±106 bakteri ke dalam media NA. Selanjutnya 20 ml media agar NA yang telah terisi kultur uji dituangkan ke cawan dan dibiarkan menjadi padat. Setelah memadat, dibuat sumur-sumur dengan diameter 6 mm, kemudian dimasukkan 60 µl kultur BAL dan diinkubasi pada suhu 37 oC selama 2 hari. Zona penghambatan adalah lebar areal bening yang terbentuk di sekitar sumur yang dinyatakan dengan satuan mm. Cara perhitungan diameter penghambatan dapat dilihat pada Lampiran 2.
2. Seleksi Bakteri Asam Laktat yang Berpotensi Menghasilkan Bakteriosin Tahap ini dibagi menjadi empat bagian, yaitu (a) Penentuan aktivitas antimikroba dengan metode kontak, (b) Penentuan kurva pertumbuhan BAL, (c) Konfirmasi BAL penghasil bakteriosin, (d) Ekstraksi bakteriosin dan uji penghambatannya terhadap bakteri patogen.
a. Pengujian Aktivitas Antimikroba dengan Metode Kontak (Fardiaz, 1989 dan Rahayu, 2000)
Isolat yang menunjukkan sifat penghambatan yang baik pada tahap pertama diujikan sifat penghambatannya terhadap Listeria monocytogenes dengan metode kontak. Pada tahap ini digunakan supernatan yang dinetralkan dengan NaOH 1 N sampai pH 6.5 untuk mengeliminasi kemungkinan penghambatan oleh asam. Sebagai perbandingan, dibuat juga supernatan yang tidak dinetralkan.
(40C) selama 15 menit. Supernatan yang terbentuk dibagi menjadi dua bagian, yaitu untuk dinetralkan dan tidak dinetralkan masing-masing sebanyak 10 ml. Kemudian kedua bagian supernatan tersebut disaring dengan menggunakan membran filter 0.22 µm.
Pengujian senyawa antimikroba dilakukan dengan metode uji kontak dengan menggunakan bakteri uji Listeria monocytogenes. Sebanyak 10 ml supernatan yang dinetralkan dan tidak dinetralkan diinokulasikan dengan ±105 bakteri uji Listeria monocytogenes dan diinkubasi selama 8 jam pada suhu 37 0C. Jumlah koloni Listeria monocytogenes dihitung pada jam ke-0 dan jam ke-8 inkubasi. Perhitungan jumlah koloni dilakukan berdasarkan SPC (Standard Plate Count) dan dapat dilihat pada Lampiran 3.
Apabila ada penghambatan terhadap Listeria monocytogenes, diduga ada senyawa antimikroba yang dihasilkan selain asam, yaitu bakteriosin.
b. Penentuan Kurva Pertumbuhan Bakteri Asam Laktat (Rattanachaikunsopon dan Phumkhachorn, 2006)
Isolat BAL yang menunjukkan aktivitas bakteriosin diinokulasikan ke dalam MRSB sebanyak 2 %. Kemudian dibaca nilai absorbansi atau OD (Optical Density) dengan menggunakan spektofotometer UV visible setiap 1 atau 2 jam sekali sampai nilai absorbansi konstan yang menunjukkan pertumbuhan BAL telah mencapai fase stasioner. Apabila pembacaan absorbansi di spektrofotometer menunjukkan nilai di atas 1, MRSB isolat BAL diencerkan dengan menggunakan MRSB steril dengan faktor pengenceran tertentu. Perhitungan nilai OD dapat dilihat pada Lampiran 4.
c. Konfirmasi Bakteri Asam Laktat Penghasil Bakteriosin
Pada metode sumur digunakan bakteri uji Gram positif, yaitu Listeria monocytogenes, Bacillus cereus, dan Staphylococcus aureus. Kultur BAL diinokulasikan pada media MRSB dan diinkubasi pada suhu 37 oC sampai akhir fase eksponensial. Selanjutnya kultur disentrifugasi pada 8000 rpm (40C) selama 15 menit. Supernatan yang terbentuk dinetralkan sampai pH 6.5 menggunakan NaOH 1 N. Kemudian supernatan yang dinetralkan dan tidak dinetralkan disaring dengan menggunakan membran filter 0.22 µm. Kultur bakteri uji yang telah disegarkan diinokulasikan sebanyak ±106 bakteri ke dalam media NA. Selanjutnya 20 ml media agar NA yang telah terisi kultur uji dituangkan ke cawan dan dibiarkan menjadi padat. Setelah memadat, dibuat sumur-sumur dengan diameter 6 mm, kemudian dimasukkan 60 µl kultur BAL yang telah diinkubasi dalam MRSB sampai fase stasioner. Sumur ini kemudian diinkubasi pada suhu 37 oC selama 2 hari. Zona penghambatan adalah lebar areal bening yang terbentuk di sekitar sumur yang dinyatakan dengan satuan mm. Cara perhitungan diameter penghambatan dapat dilihat pada Lampiran 2.
Pada metode kontak digunakan bakteri uji Listeria monocytogenes. Kultur BAL diinokulasikan pada media MRSB dan diinkubasi pada suhu 37 o
d. Ekstraksi Bakteriosin dan Uji Penghambatannya Terhadap Bakteri Patogen (modifikasi Jimenez et al., 1995)
IV. HASIL DAN PEMBAHASAN
A. SELEKSI AWAL ISOLAT BAKTERI ASAM LAKTAT DENGAN
PENGUJIAN AKTIVITAS ANTIMIKROBA TERHADAP BAKTERI
PATOGEN
Bakteri asam laktat (BAL) yang bersifat heterofermentatif dapat memproduksi senyawa antimikroba berupa asam organik (asam laktat, asam format dan asam asetat), diasetil, hidrogen peroksida, karbondioksida dan bakteriosin (de Vuyst & Vandamme 1994). Senyawa-senyawa ini bersifat antagonistik terhadap mikroba yang berkerabat dekat maupun terhadap golongan di luar genusnya sehingga dapat menghambat pertumbuhan mikroba lain termasuk bakteri patogen.
Tahap ini bertujuan menyeleksi BAL yang memiliki penghambatan tertinggi terhadap bakteri uji. BAL yang digunakan berjumlah 25 isolat, yaitu Lactobacillus heterofermentatif (A10, A17, A21, A33, R2, R3, R4, R5, R6, R7, R8, R29, dan R33), Leuconostoc (R1, R9, dan R10), dan bakteri asam laktat heterofermentatif isolat ASI lain yang belum diketahui jenisnya (A5, A6, A11, A13, A25, A30, A32, A37, dan B2). BAL heterofermentatif menghasilkan senyawa antimikroba yang lebih beragam dibandingkan BAL homofermentatif sehingga perlu dikaji senyawa antimikroba apa saja yang dihasilkan oleh BAL heterofermentatif ini. Isolat-isolat BAL tersebut diisolasi dari ASI 31 ibu di Leuwi Liang Bogor oleh Nuraida et al (2008). Isolat-isolat BAL tersebut digolongkan sebagai heterofermentatif karena diketahui dapat menghasilkan karbondioksida. Bakteri uji yang digunakan adalah bakteri Gram positif (Listeria monocytogenes, Staphylococcus aureus, dan Bacillus cereus) dan bakteri Gram negatif (Salmonella thypimurium dan Escherichia coli). Kelima bakteri uji tersebut dipilih karena mewakili bakteri patogen Gram positif dan Gram negatif yang sering terdapat pada makanan dan sering menyebabkan berbagai penyakit pada manusia.
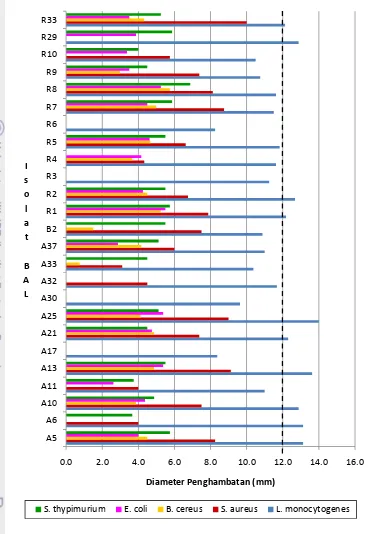
Gambar 2 Aktivitas antimikroba BAL terhadap kelima bakteri uji
Keterangan : Garis putus-putus menunjukkan batas 10 isolat BAL yang memiliki diameter penghambatan tertinggi terhadap Listeria monocytogenes yang akan digunakan pada tahap selanjutnya
0.0 2.0 4.0 6.0 8.0 10.0 12.0 14.0 16.0
A5 A6 A10 A11 A13 A17 A21 A25 A30 A32 A33 A37 B2 R1 R2 R3 R4 R5 R6 R7 R8 R9 R10 R29 R33
Diameter Penghambatan (mm) I
s o l a t
B A L
Aktivitas penghambatan terhadap bakteri Listeria monocytogenes berkisar antara 8.2-14 mm. Aktivitas penghambatan terhadap bakteri Staphylococcus aureus berkisar antara 0-10 mm. Aktivitas penghambatan terhadap bakteri Bacillus cereus berkisar antara 0-5.8 mm. Aktivitas penghambatan terhadap bakteri Escherichia coli berkisar antara 0-5.5 mm. Aktivitas penghambatan terhadap bakteri Salmonella thypimurium berkisar antara 0-6.9 mm.
Penghambatan terhadap bakteri Gram positif (L. Monocytogenes dan S. aureus) lebih besar dibandingkan bakteri Gram negatif (E. coli dan S. thypimurium). Hal ini disebabkan oleh adanya perbedaan pada senyawa penyusun struktur dinding sel, dimana pada bakteri Gram positif dinding selnya mengandung lipid yang rendah, yaitu 1-4 %, sedangkan pada bakteri Gram negatif terdapat kandungan lipid yang lebih tinggi, yaitu 11-22 %. Asam-asam organik yang terdisosiasi bersifat tidak larut lemak (polar) sehingga lebih sulit menembus dinding sel bakteri Gram negatif yang kandungan lemaknya lebih tinggi daripada dinding sel bakteri Gram positif. Selain itu, dinding sel bakteri Gram positif hanya berlapis tunggal (peptidoglikan), sedangkan pada Gram negatif berlapis tiga (peptidoglikan, lipopolisakarida, dan lipoprotein) (Pelezar dan Chan, 1993). Penyebab lainnya adalah karena BAL menghambat bakteri yang memiliki kekerabatan dekat dengannya, sehingga BAL yang bersifat Gram positif lebih mudah menghambat bakteri yang bersifat Gram positif pula. Tetapi terdapat pengecualian terhadap bakteri Gram positif B. cereus yang memiliki aktivitas penghambatan lebih kecil dibandingkan dengan bakteri uji lainnya, termasuk bakteri Gram negatif. Hal ini kemungkinan dikarenakan B. cereus dapat membentuk spora sehingga lebih resisten terhadap senyawa antimikroba. Bacillus cereus adalah bakteri Gram positif dengan flagella peritrichous, berbentuk batang, membentuk spora, endospora berbentuk oval, kemoorganotrof, dan umumnya katalase positif (Holt et al., 1994).
diproduksi apabila terjadi metabolisme sitrat yaitu sitrat dikonversi melalui piruvat menjadi diasetil. Pembentukan diasetil dihambat ketika terjadi metabolisme heksosa (Salminen et al., 2004), sehingga kemungkinan diasetil tidak dihasilkan secara signifikan pada tahap ini dan tidak dapat menghambat bakteri uji. Diasetil memiliki sifat antimikroba hanya pada konsentrasi yang tinggi, sedangkan pada konsentrasi yang rendah tidak efektif karena dapat dihancurkan oleh beberapa mikroorganisme (Ray dan Daeschel, 1992). Hidrogen peroksida bersifat bakterisidal pada konsentrasi 20-22 µg/ml, sedangkan produksinya pada media pepton seperti media MRS cair hanya 8-9 µg/ml setelah diinkubasi selama 2 hari pada suhu 30oC sehingga tidak dapat menghambat bakteri uji (Ray dan Daeschel, 1992). Selain itu, bakteri uji yang digunakan bersifat katalase positif sehingga dapat menguraikan hidrogen peroksida.
B. SELEKSI BAKTERI ASAM LAKTAT YANG BERPOTENSI
MENGHASILKAN BAKTERIOSIN
1. Pengujian Aktivitas Antimikroba dengan Metode Kontak
Pada tahap ini, isolat BAL yang menunjukan sifat penghambatan yang tinggi terhadap bakteri uji pada metode sumur diujikan sifat penghambatannya dengan menguji supernatan yang dinetralkan dengan NaOH untuk mengeliminasi kemungkinan penghambatan oleh asam. Selain itu, diujikan juga supernatan yang tidak dinetralkan sebagai pembanding.
Pengujian aktivitas antimikroba BAL pada tahap ini dilakukan dengan metode kontak agar perubahan jumlah bakteri uji dapat terukur dengan jelas. Metode kontak adalah metode yang mengevaluasi aktivitas antimikroba berdasarkan perkembangan atau kematian bakteri dengan mengukur jumlah bakteri setelah diberi sejumlah zat antimikroba dan dikontakkan pada waktu tertentu (Fardiaz, 1989).
Isolat BAL terbesar terhadap A21, R2, dan R33 isolat BAL ini dil BAL dan tidak ber dilakukan penyisih rendah terhadap L diuji.
Isolat BAL
Setelah itu disentri sehingga diperoleh NaOH hingga menc dinetralkan dan tida diinkubasi pada suhu dari Listeria monoc
Perubahan dapat dilihat pada
Gambar 3 Perubaha superna -6 -5 -4 -3 -2 -1 0 1 2 1.3 p e ru b ah an ju m lah Li st e ri a m o n o cyt o g e n e s (l o g c fu /m l) Superna
AL yang diujikan adalah isolat yang menunjukka p Listeria monocytogenes, yaitu A25, A13, A5, A
33 dengan penghambatan berkisar antara 12.1-14 dilakukan berdasarkan perbandingan relatif terhada berdasarkan nilai tertentu. Hal ini dikarenakan pada sihan terhadap isolat BAL yang memiliki pengham
Listeria monocytogenes dibandingkan isolat BA
AL diinokulasi pada media MRSB dan diinkubas
ntrifugasi dan disaring dengan menggunakan membr leh supernatan. Supernatan tersebut sebagian din
encapai pH 6.5. Masing-masing sebanyak 10 ml tidak dinetralkan diinokulasikan dengan Listeria mono suhu 37 oC selama 8 jam. Setelah itu dihitung perub onocytogenes.
han jumlah log Listeria monocytogenes setelah 8 ja da Gambar 3, dan data selengkapnya dapat dilihat pa
ubahan jumlah Listeria monocytogenes setelah dik rnatan BAL selama 8 jam
1.4 1.5 1.8 1.5
-0.03 0.01 0.3 0.3
-2.4 -2.9
-1.4 -1
-5.3 -5.2 -5.1 -5.1
Isolat BAL
rnatan yang dinetralkan Supernatan tidak dinetral
ukkan penghambatan A6, A10, R29, R2, 14 mm. Pemilihan hadap seluruh isolat pada tahap ini ingin hambatan yang lebih BAL lainnya yang
ubasi selama 24 jam.
bran filter 0.22 µm dinetralkan dengan ml supernatan yang a monocytogenes dan perubahan jumlah log
8 jam waktu kontak pada Lampiran 10.
ikontakkan dengan
0.3 0.6
.1 -5.2 -5.4
Berdasarkan Gambar 3, terdapat 6 isolat BAL yang memiliki aktivitas penghambatan tertinggi terhadap Listeria monocytogenes, yaitu A10, R29, R1, R2, A21, dan R33. Supernatan A10 yang dinetralkan dapat menurunkan jumlah Listeria monocytogenes sebesar 0.03 log, sedangkan pada supernatan 5 isolat lainnya, yaitu R29, R1, R2, A21, dan R33, Listeria monocytogenes mengalami kenaikan berkisar antara 0.01-0.6 log. Kenaikkan ini masih di bawah kenaikan pada kontrol, dimana kenaikkan Listeria monocytogenes pada kontrol adalah sebesar 1.3 log. Hasil pengujian dengan statistik menunjukkan bahwa perubahan jumlah Listeria monocytogenes pada supernatan isolat A10, R29, R1, R2, A21, dan R33 yang dinetralkan berbeda nyata dengan perubahan jumlah Listeria monocytogenes pada kontrol (Lampiran 12). Berdasarkan hal ini, diduga keenam isolat BAL tersebut menghasilkan senyawa antimikroba lain selain asam, yaitu bakteriosin sehingga dapat menghambat pertumbuhan Listeria monocytogenes.
Seperti yang telah dijelaskan sebelumnya, karbondioksida, etanol, diasetil, dan hidrogen peroksida kemungkinan dihasilkan, namun tidak dapat menghambat bakteri uji karena jumlahnya tidak signifikan. Karbondioksida hanya menghambat pada konsentrasi tinggi (Lindgren, 1990), sedangkan pada tahap ini karbondioksida dapat hilang karena dilakukan pada kondisi aerob sehingga tidak dapat menghambat bakteri uji. Etanol juga tidak dihasilkan secara signifikan karena inkubasi BAL dilakukan pada kondisi aerob. Adanya oksigen dapat mengaktifkan NADH oksidase yang menghambat pembentukan etanol (Salminen et al., 2004). Diasetil banyak diproduksi apabila terjadi metabolisme sitrat yaitu sitrat dikonversi melalui piruvat menjadi diasetil. Pembentukan diasetil dihambat ketika terjadi metabolisme heksosa (Salminen et al., 2004), sehingga kemungkinan diasetil tidak dihasilkan secara signifikan pada tahap ini dan tidak dapat menghambat bakteri uji. Diasetil memiliki sifat antimikroba hanya pada konsentrasi yang tinggi, sedangkan pada konsentrasi yang rendah tidak efektif karena dapat dihancurkan oleh beberapa mikroorganisme (Ray dan Daeschel, 1992). Hidrogen peroksida bersifat bakterisidal pada konsentrasi 20-22 µg/ml, sedangkan produksinya pada media pepton seperti media MRS cair hanya 8-9 µg/ml setelah diinkubasi selama 2 hari pada suhu 30oC sehingga tidak dapat menghambat bakteri uji (Ray dan Daeschel, 1992). Selain itu, Listeria monocytogenes bersifat katalase positif sehingga dapat menguraikan hidrogen peroksida.
kemungkinan dikarenakan isolat A13, A25, A5, dan A6 tidak menghasilkan senyawa antimikroba lain selain asam atau konsentrasi senyawa antimikroba yang dihasilkan sangat rendah sehingga tidak dapat menghambat Listeria monocytogenes. Kenaikkan ini lebih besar daripada kenaikan pada kontrol, hal ini kemungkinan disebabkan media MRSB streril yang digunakan untuk menunbuhkan Listeria monocytogenes memiliki pH yang lebih rendah (6,1) daripada pH supernatan bebas sel netral (6,5), sehingga kenaikan Listeria monocytogenes pada kontrol lebih rendah dibandingkan pada supernatan. Tetapi kenaikan ini tidak berbeda nyata dengan kenaikan Listeria monocytogenes pada kontrol berdasarkan uji statistik (Lampiran 12).
Pada supernatan yang tidak dinetralkan, Listeria monocytogenes mengalami penurunan berkisar antara 1-5.4 log. Hal ini dikarenakan masih terdapat asam yang dapat menghambat pertumbuhan Listeria monocytogenes.
Mekanisme penghambatan bakteri oleh asam-asam organik berhubungan dengan keseimbangan asam-basa, penambahan proton, dan produksi energi oleh sel. Keseimbangan asam-basa pada mikroba ditunjukkan dengan pH yang mendekati normal. Protein, asam nukleat, dan fosfolipid dapat rusak oleh perubahan pH (Davidson dan Branen, 1993). Hubungan antara pH supernatant BAL dengan penurunan jumlah L. Monocytogenes dapat dilihat pada Gambar 4.
Gambar 4 Hubungan antara pH supernatant BAL dengan penurunan jumlah L. monocytogenes A5 A6 A10 R29 R1 R2 A21 R33 -6 -5 -4 -3 -2 -1 0
0 1 2 3 4 5
P e n u ru n an ju m lah L. m o n o cyt o g e n e s (l o g c fu /m l)
[image:43.595.179.458.511.664.2]Berdasarkan Gambar 4, nilai pH yang lebih rendah tidak berarti penghambatan terhadap Listeria monocytogenes lebih tinggi. Contohnya saja isolat A5 dan A6 yang memiliki pH 4.4 dan 4.5, tetapi hanya dapat menurunkan Listeria monocytogenes sebesar 1.4 dan 1 log, sedangkan isolat R1, R2, A10, dan R29 yang memiliki pH lebih tinggi tetapi dapat menurunkan Listeria monocytogenes lebih banyak. Hal ini kemungkinan disebabkan isolat tersebut menghasilkan senyawa antimikroba selain asam. Nilai pH supernatan BAL berkisar antara 4.3-4.5 dan tidak menunjukkan perbedaan yang signifikan.
Listeria monocytogenes adalah bakteri patogen yang bertanggung jawab pada beberapa kasus keracunan makanan di seluruh dunia dan menjadi perhatian khusus pada masalah keamanan pangan dikarenakan karakteristik psikotropikanya dan berada di mana-mana (Parada et al., 2007). Senyawa-senyawa antimikroba yang dihasilkan oleh BAL diharapkan dapat menghambat bakteri patogen seperti Listeria monocytogenes sehingga dapat mencegah keracunan makanan yang diakibatkan oleh bakteri ini.
2. Penentuan Kurva Pertumbuhan Bakteri Asam Laktat
Tahap ini bertujuan untuk mengetahui kurva pertumbuhan isolat BAL sehingga dapat diketahui fase pertumbuhannya pada waktu tertentu. Dalam pengujian ini, tingkat pertumbuhan BAL diinterpretasikan dengan nilai absorbansi atau OD (Optical Density). Nilai absorbansi diperoleh dari spektrofotometri dengan panjang gelombang 660 nm, karena panjang gelombang ini berada pada kisaran panjang gelombang cahaya tampak. Prinsip pada pengujian dengan metode spektrofotometri mengacu pada prinsip turbidimetri. Menurut Harrigan (2000), semakin tinggi kandungan organisme dalam larutan, maka akan menyebabkan semakin sedikit cahaya yang dapat penetrasi tehadap larutan, dan makin banyak cahaya yang akan diserap oleh larutan tersebut. Dalam metode spektrofotometri, cahaya yang terserap oleh larutan akan menghasilkan nilai absorbansi tertentu. Nilai absorbansi yang tinggi menunjukkan jumlah sel yang tinggi pula.
bakteriosin. Kurva pertumbuhan isolat BAL dibuat dengan menggunakan skala log (Gambar 5-10). Data selengkapnya dapat dilihat pada Lampiran 14-19.
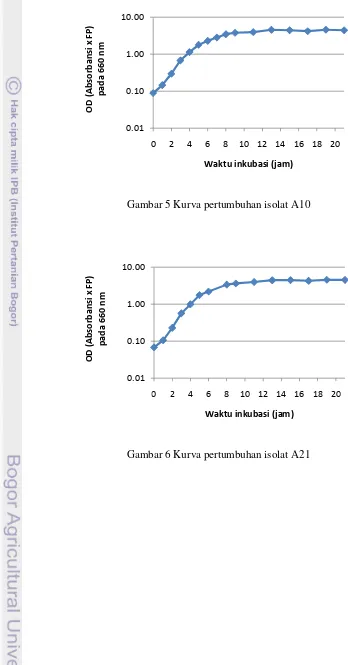
[image:45.595.104.452.127.792.2]Gambar 5Kurva pertumbuhan isolat A10
Gambar 6Kurva pertumbuhan isolat A21 0.01
0.10 1.00 10.00
0 2 4 6 8 10 12 14 16 18 20
O D ( A b so rb an si x F P ) p ad a 6 6 0 n m
Waktu inkubasi (jam)
0.01 0.10 1.00 10.00
0 2 4 6 8 10 12 14 16 18 20
O D ( A b so rb an si x F P ) p ad a 6 6 0 n m
Gambar 7Kurva pertumbuhan isolat R1
Gambar 8Kurva pertumbuhan isolat R2 0.01
0.10 1.00 10.00
0 2 4 6 8 10 12 14 16 18 20
O D ( A b so rb an si x F P ) p ad a 6 6 0 n m
Waktu inkubasi (jam)
0.01 0.10 1.00 10.00
0 2 4 6 8 10 12 14 16 18
O D ( A b so rb an si x F P ) p ad a 6 6 0 n m
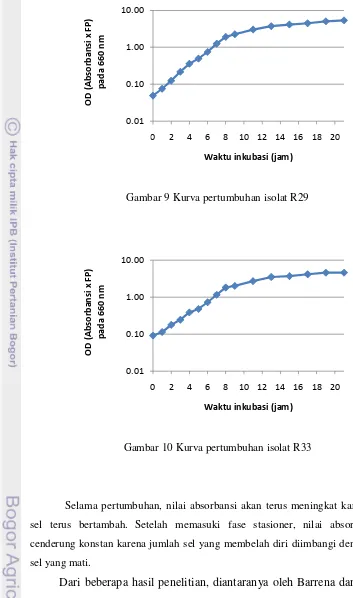
Gambar 9 Kurva pertumbuhan isolat R29
Gambar 10Kurva pertumbuhan isolat R33
Selama pertumbuhan, nilai absorbansi akan terus meningkat karena jumlah sel terus bertambah. Setelah memasuki fase stasioner, nilai absorbansi akan cenderung konstan karena jumlah sel yang membelah diri diimbangi dengan jumlah sel yang mati.
Dari beberapa hasil penelitian, diantaranya oleh Barrena dan Gonzales (1996), Schnell (1998), dan Rattanachaikunsopon dan Phumkhachorn (2006), bakteriosin dihasilkan selama fase eksponensial dan setelah memasuki fase stasioner aktivitas bakteriosin mengalami penurunan. Sedangkan Karthikeyan
0.01 0.10 1.00 10.00
0 2 4 6 8 10 12 14 16 18 20
O D ( A b so rb an si x F P ) p ad a 6 6 0 n m
Waktu inkubasi (jam)
0.01 0.10 1.00 10.00
0 2 4 6 8 10 12 14 16 18 20
O D ( A b so rb an si x F P ) p ad a 6 6 0 n m
dan Santhosh (2009) menyatakan bahwa bakteriosin yang dihasilkan oleh Lactobacillus acidophillus masih dihasilkan selama fase stasioner. Selain itu, Diop et al. (2008) menyatakan bahwa produksi senyawa mirip bakteriosin oleh Lactococcus lactis CWBI-B1410 dimulai pada fase eksponensial dan mencapai maksimum selama fase stasioner. Hal ini membuktikan bahwa masing-masing BAL memproduksi bakteriosin pada waktu yang berbeda-beda. Untuk tahap selanjutnya BAL diinkubasi sampai fase stasioner. Berdasarkan Gambar 5-10, isolat A10, A21, dan R1 memasuki fase stasioner setelah 13 jam inkubasi, isolat R2 setelah 16 jam inkubasi, isolat R29 setelah 21 jam inkubasi, dan isolat R33 setelah 19 jam inkubasi.
3. Konfirmasi Bakteri Asam Laktat Penghasil Bakteriosin
Tahap ini bertujuan untuk mengetahui isolat BAL yang berpotensi menghasilkan bakteriosin. Sebelum dipresipitasi dengan ammonium sulfat, supernatan bebas sel netral diuji terlebih dahulu aktivitas penghambatannya dengan metode difusi agar atau sumur.
Keenam isolat BAL yang diuji, yaitu A10, R29, R1, R2, A21, dan R33 diinkubasi sampai mencapai fase stasioner. Pada tahap ini hanya digunakan bakteri Gram positif sebagai bakteri uji. Bakteriosin kurang efektif melawan bakteri Gram negatif karena bakteri ini memiliki membran luar yang menjadi penghalang permeabel untuk selnya (Stevens et al., 1991). Bakteri uji yang digunakan yaitu Listeria monocytogenes, Staphylococcus aureus, dan Bacillus cereus.
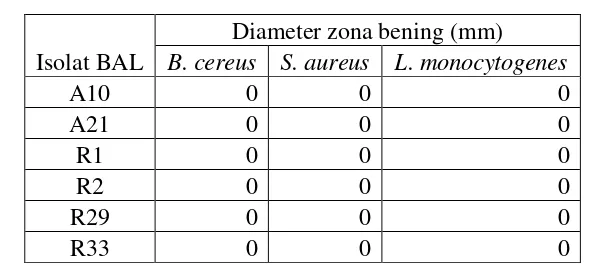
Tabel 5 Aktivitas penghambatan supernatan isolat BAL yang dinetralisasi terhadap bakteri gram positif.
Isolat BAL
Diameter zona bening (mm) B. cereus S. aureus L. monocytogenes
A10 0 0 0
A21 0 0 0
R1 0 0 0
R2 0 0 0
R29 0 0 0
R33 0 0 0
Tidak adanya penghambatan bukan berarti tidak ada senyawa antimikroba yang dihasilkan selain asam, karena pada metode kontak sebelumnya, Listeria monocytogenes dapat dihambat dengan supernatan yang dinetralkan. Penghambatan yang terjadi pada metode kontak kemungkinan dikarenakan dosis senyawa antimikroba yang lebih besar karena menggunakan 10 ml supernatan, sedangkan pada metode sumur hanya menggunakan 50 µl. Oleh karena itu, dilakukan kembali uji penghambatan dengan metode kontak.
Gambar 11Perbandi kontak stasion
Berdasark Listeria monocytoge isolat R2 Listeria lebih besar darip kemungkinan dis tidak mencapai m itu, waktu inkuba aktivitas pengham
Hasil pengu Listeria monocytoge 24 jam berbeda kontrol dan pada jam (Lampiran 13 baik dibandingkan -0.2 0 0.2 0.4 0.6 0.8 1 1.2 1.4 p e ru b ah an ju m lah Li st e ri a m o n o cyt o g e n e s (l o g c fu /m l)
ndingan perubahan jumlah log Listeria monocytoge ontak dengan inkubasi BAL selama 24 jam dan s
ioner
arkan Gambar 11, pada supernatan A10 ya ytogenes mengalami kenaikan sebesar 1.1 log, ria monocytogenes mengalami kenaikan 0.9 log ripada metode kontak dengan inkubasi BAL 24 disebabkan bakteriosin yang dihasilkan oleh isol
i maksimum pada waktu inkubasi 13 dan 16 ja nkubasi BAL sangat mempengaruhi pembentukan ambatannya terhadap Listeria monocytogenes. ngujian dengan statistik menunjukkan b