KAJIAN ANTIINFEKSI ISOLAT BAKTERI ASAM LAKTAT
ASAL MANDAI
ASWITA EMMAWATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa disertasi berjudul Kajian Antiinfeksi Bakteri Asam Laktat Asal Mandai adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ii
RINGKASAN
ASWITA EMMAWATI. Kajian Antiinfeksi Isolat Bakteri Asam Laktat Asal Mandai. Dibimbing oleh SRI LAKSMI SURYAATMADJA, LILIS NURAIDA dan DAHRUL SYAH.
Probiotik didefinisikan sebagai mikroorganisme hidup yang jika dikonsumsi dalam jumlah yang cukup akan memberikan manfaat bagi kesehatan inangnya. Probiotik telah banyak digunakan dalam pengobatan dan pencegahan penyakit-penyakit yang disebabkan oleh infeksi bakteri enterik. Eksplorasi sumber-sumber probiotik dapat dilakukan pada pangan fermentasi tradisional, salah satu di antaranya mandai, untuk mencari isolat-isolat yang mempunyai sifat fungsional yang dapat meningkatkan kesehatan. Mandai merupakan pangan fermentasi yang terbuat dari dami atau bagian dalam kulit cempedak yang tidak dikonsumsi. Sejumlah isolat bakteri asam laktat sebelumnya telah diisolasi dari mandai, tetapi perlu dilakukan pengujian sifat dasar yang harus dimiliki sebagai kandidat probiotik.
Untuk memperoleh isolat bakteri asam laktat yang mempunyai khasiat dan manfaat yang unggul, maka perlu dilakukan seleksi lebih lanjut berupa skrining potensi probiotik. Tujuan penelitian ini pada tahap pertama adalah untuk melakukan isolasi dan karakterisasi bakteri asam laktat yang diisolasi dari mandai serta mengevaluasi potensinya sebagai probiotik. Tujuan tahap kedua adalah untuk mengevaluasi agregasi, adhesi terhadap sel HCT-116 dan kemampuan berkompetisi terhadap enteropatogen (Listeria monocytogenes ATCC 13932, Enteropathogenic Escherichia coli (EPEC) K1.1 dan Salmonella enterica serovar Typhimurium ATCC 14028). Tujuan tahap ketiga adalah untuk mengevaluasi kemampuan Lactobacillus plantarum MB427 asal mandai sebagai antidiare terhadap Escherichia coli enteropatogenik (EPEC) secara in vivo.
diidentifikasi sebagai Lactobacillus plantarum dengan API 50 CHL dan dikonfirmasi dengan real-time-PCR.
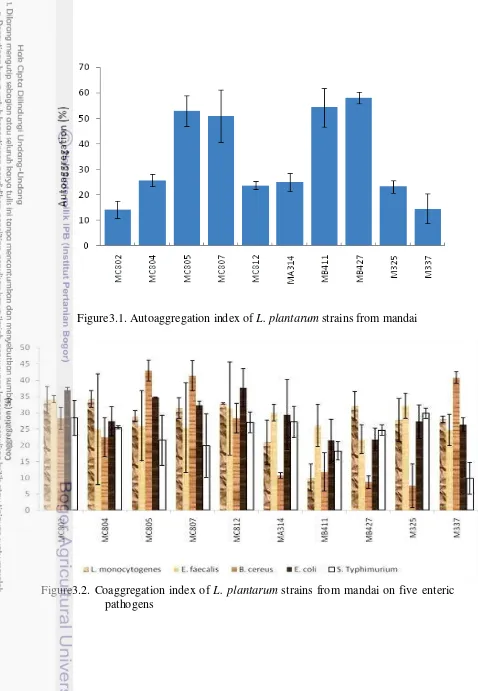
Empat strain L. plantarum MC805, MC807, MB411 dan MB427 memiliki kemampuan autoagregasi yang baik, di atas 50%, tetapi hanya dua strain, MC802 dan MC812, yang menunjukkan kemampuan koagregasi (di atas 25%) dengan semua enteropatogen yang diuji. Lima strain L. plantarum(MB427, MB411, MC807, MC805, MC802), menunjukkan kemampuan beradhesi terhadap sel HCT-116 di atas 60%, dengan adhesi tertinggi (74%) ditunjukkan oleh MB427 setelah 1 jam inkubasi pada 37oC. Semua patogen dapat menempel pada sel HCT-116 dengan persentase adhesi berkisar dari 51 sampai 62%.L. plantarum menunjukkan potensi untuk melakukan penggantian (displacement), berkompetisi dan mengeksklusi enteropatogen pada sel HCT-116, tetapi kemampuan tersebut bersifat spesifik untuk setiap strain L. plantarumdan setiap patogen. Strain L. plantarum menunjukkan kemampuan kompetisi, eksklusi dan penggantian terhadap EPEC lebih baik daripada S. Typhimurium dan L. monocytogenes.L. plantarum MB427 menunjukkan kemampuan penghambatan yang kuat terhadap tiga pathogen kecuali dalam menggantikan L. monocytogenes. Strain L. plantarum dengan kemampuan tertinggi untuk berkompetisi, mengeksklusi dan menggantikan EPECdan S. Typhimurium adalah MB427 dan MB411 serta MB427, MC802, dan MC805; secara berurutan.
iv
SUMMARY
ASWITA EMMAWATI. Study of Antiinfection Properties of Lactic Acid Bacteria Isolated from Mandai. Supervised by SRI LAKSMI SURYAATMADJA, LILIS NURAIDA and DAHRUL SYAH.
Mandai is a fermented product made of cempedak (Artocarpus champeden) dami. The research aims to isolate and characterize lactic acid bacteria isolated from mandai and to evaluate their probiotic potency, to assess for aggregation, adhesion to enterocyte-like HCT-116 cells and competition abilities of L. plantarum strains towards enteropathogens Listeria monocytogenes ATCC 13932, enteropathogenic Escherichia coli (EPEC) K1.1 and Salmonella enterica serovar Typhimurium ATCC 14028, to evaluate the abilities of L. plantarum MB427 from mandai as antidiarrheae agent towards enteropathogenic Escherichia coli (EPEC) in vivo.
Mandai samples were collected from several home industries in East Kalimantan area made with 5, 10 and 15% salt contents. Eighty-five lactic acid bacteria (LAB) isolates were obtained from mandai on day 4, 8, and 12 fermentation and assessed for their probiotic properties. All isolates showed good tolerances towards low pH (pH 2.0) with the decrease of viable counts of less than 2 log cfu/ml. The LAB isolates could grow in the present of 0.5% bile salt although the viable counts decreased as compared to those in medium without bile salt. Reduction of viable counts less than 1 log cfu/ml was observed in 21 isolates. Nineteen isolates could tolerate pH 2.0 and 0.5% bile salt better than others with the total decrease in viable counts less than 1 log cfu/ml. Most of isolates (11 out of 19 isolates) which tolerate low pH were obtained from 8 days mandai fermentation. Isolate MC812 had good antimicrobial properties against Listeria monocytogenes ATCC 13932, Enterococcus faecalis ATCC 19433, Bacillus cereus ATCC10876, Escherichia coli ATCC 25922 and Salmonella typhimurium ATCC 14028. Ten isolates had good antimicrobial properties against at least 3 pathogens tested. Their resistance toward antibiotics varied between isolates. All isolates was identified as Lactobacillus plantarum with API 50 CHL and confirmed with real-time-PCR.
Typhimurium were MB427 and MB411 strains; and MB427, MC802, and MC805 strains; respectively. These results suggest that L. plantarum strains isolated from “mandai” were promising as probiotic candidates acquired protection against certain enteropathogenic infection.
L. plantarum MB427 (1 x 109 cfu) feeding to Sprague-Dawley rats intragastrically once a day was able to decrease the incident, severity and duration of diarrhea compared with nonprobiotic feeding group. Preinfection feeding on rats decrease the diarrhea incident, duration and severity compared with postinfection feeding and EPEC group. Strain L. plantarum MB427 showed ability to survive accross rats gastrointestinal and was able to adhere and colonize the rats gastrointestinal tract (caecum and colon). There was no observed the possibility of invasive characteristic of L. plantarum MB427 strain. Preinfection feeding group showed IgA and IgG higher than postinfection feeding group. Overall results showed L. plantarum MB427 considered as probiotic candidate and had abilities as antidiarrhea towards EPEC infection on mice.
vi
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Ilmu Pangan
KAJIAN ANTIINFEKSI ISOLAT BAKTERI ASAM LAKTAT
ASAL MANDAI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
ii
Penguji pada Ujian Tertutup: Dr. Ir.Nurheni Sri Palupi, MS
(Staf Pengajar Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian IPB)
Dr. Irma Isnafia Arief, S.Pt., M.Si.
(Staf Pengajar Departemen Ilmu Produksi dan Teknologi Peternakan Fakultas Peternakan IPB)
Penguji pada Ujian Terbuka: Prof. Dr. Ir. I Komang G. Wiryawan, M.Sc
(Guru Besar Departemen Ilmu Nutrisi dan Teknologi Pakan Fakultas Peternakan IPB)
Dr. Ir. Ingrid S. Surono, M.Sc.
Judul Tesis : Kajian Antiinfeksi Isolat Bakteri Asam Laktat Asal Mandai Nama : Aswita Emmawati
NIM : F261090041
Disetujui oleh Komisi Pembimbing
Prof. Dr. Ir. Sri Laksmi Suryaatmadja, M.S. Ketua
Prof. Dr. Ir. Lilis Nuraida, M.Sc. Anggota
Dr Ir Dahrul Syah, M.Sc. Agr. Anggota
Diketahui oleh
Ketua Program Studi Ilmu Pangan
Prof Dr Ir Ratih Dewanti-Hariyadi, MSc.
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli 2012 ini ialah eksplorasi dan karakterisasi probiotik, dengan judul Kajian Antiinfeksi Isolat Bakteri Asam Laktat Asal Mandai.
Terima kasih sebesar-besarnya penulis ucapkan kepada komisi pembimbing, Prof. Dr. Ir. Sri Laksmi Suryaatmadja, M.S., Prof. Dr. Ir. Lilis Nuraida, M.Sc.dan Dr. Ir. Dahrul Syah, M.Sc.Agr. atas bimbingan, motivasi, dorongan, bantuan, dan nasihat sehingga penulis dapat menyelesaikan penelitian dan disertasi ini. Penghargaan juga penulis sampaikan kepada penguji di ujian tertutup Dr. Ir. Nurheni Sri Palupi, M.S dan Dr. Irma Isnafia Arief, S.Pt., M.Si., penguji di ujian terbuka Prof. Dr. Ir. I Komang G. Wiryawan, MSc. dan Dr Ir Ingrid S. Surono, M.Sc., ketua dan sekretaris program studi Ilmu Pangan Prof. Dr. Ir. Ratih Dewanti Hariyadi, M.Sc. dan Dr. Ir. Endang Prangdimurti, M.Si. atas segala bantuan dan masukan yang diberikan.
Penulis juga mengucapkan terima kasih atas bantuan selama pelaksanaan penelitian kepada seluruh teknisi dan laboran Departemen ITP Fateta IPB dan Seafast Center. Terima kasih juga penulis sampaikan pada Ibu Silmi Mariya dan Ibu Sri Maryati dari Laboratorium Mikrobiologi dan Imunologi Pusat Studi Satwa Primata IPB atas bantuan dalam penggunaan kultur sel.
Atas terlaksananya kuliah dan penelitian penulis sampaikan terima kasih pada Dikti atas bantuan biaya pendidikan dalam BPPS 2009, pada Universitas Mulawarman atas ijin tugas belajar yang diberikan dan alokasi bantuan dana penelitian dalam hibah Penelitian Disertasi Doktor, pada Pemerintah Propinsi Kalimantan Timur atas bantuan beastudi dalam Beasiswa Kaltim Cemerlang. Tak lupa penulis sampaikan penghargaan pada Dekan Sekolah Pascasarjana IPB dan seluruh staf, Ketua Departemen Ilmu dan Teknologi Pangan beserta staf, Ketua dan Sekretaris Program Studi Ilmu Pangan beserta staf.
Terima kasih dan rasa sayang tak lupa penulis sampaikan pada teman-teman mahasiswa IPN khususnya angkatan 2009 atas kebersamaan dan kekompakan selama studi di IPB. Rasa terima kasih dan permohonan maaf sebesar-besarnya penulis haturkan pada orang tua, suami, anak-anakku tersayang, serta seluruh keluarga besar atas bantuan dan pengorbanan selama penulis menyelesaikan kuliah S3 di Ilmu Pangan IPB ini.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR ISI vii
DAFTAR TABEL ix
DAFTAR GAMBAR x
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan 3
Hipotesis 3
Manfaat 4
Ruang Lingkup 4
Daftar Pustaka 4
2 Karakterisasi Isolat Bakteri Asam Laktat dari Mandai – Makanan Fermentasi Tradisional dari Dami Cempedak (Artocarpus champeden) yang berpotensi sebagai Probiotik
7
Pendahuluan 7
Metode Penelitian 9
Hasil dan Pembahasan 13
Kesimpulan 21
Daftar Pustaka 21
3 Aggregation and adhesion abilities to HCT-116 cells of probiotic candidates Lactobacillus plantarum strains isolated from “mandai”, Indonesian fermented food against enteropathogens
25
Introduction 25
Methods 27
Results 29
Discussion 33
Conclusion 35
References 35
4 Kajian Antidiare Kandidat Probiotik Lactobacillus plantarum MB427 Asal Mandai pada Tikus yang Diinfeksi EPEC
38
Pendahuluan 38
Metode 40
Hasil dan Pembahasan 43
Kesimpulan 56
viii
5 PEMBAHASAN UMUM 60
Isolasi Bakteri Asam Laktat dan Skrining Kandidat Probiotik Identifikasi Bakteri Asam Laktat Kandidat Probiotik
Sifat Aggregasi dan Adhesi Kandidat Probiotik Kajian Antidiare Kandidat Probiotik pada Tikus Daftar Pustaka
60 63 64 65 67
6 SIMPULAN DAN SARAN 70
Simpulan Saran
70 70
DAFTAR GAMBAR
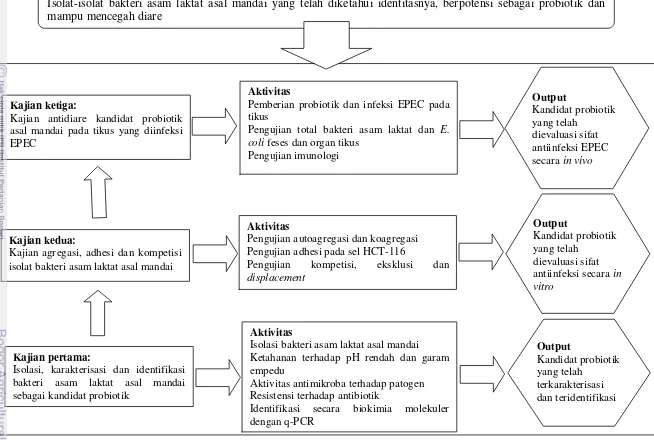
Gambar 1.1. Tahapan, rincian aktivitas dan output untuk mencapai tujuan penelitian penelitian
6 Gambar 2.1. Jumlah bakteri asam laktat selama fermentasi mandai pada tiga
tingkatan kadar garam 5% (♦), 10% (■) dan 15% (▲) 14 Gambar 2.2.Kemampuan isolat bakteri asam laktat asal mandai mentoleransi
kondisi keasaman lambung (pH 2.0) dan empedu (0.5%)
16 Gambar 2.3.Kurva melting beberapa isolat bakteri asam laktat asal mandai
dibandingkan dengan kurva melting Lactobacillus plantarumBSL sebagai bakteri standar
21
Figure 3.1. Autoaggregation index of L. plantarum strains from mandai 30 Figure 3.2. Coaggregation index of L. plantarum strains from mandai on five
enteric pathogens
30 Figure 3.3. Adherence (%) of L. plantarum from mandai and three enteric
pathogens to HCT-116 cell
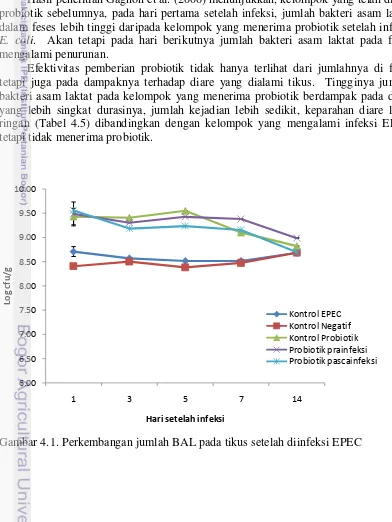
31 Gambar 4.1. Perkembangan jumlah bakteri asam laktat pada tikus mulai satu
hari setelah diinfeksi EPEC
48
Gambar 4.2. Jumlah bakteri asam laktat pada isi sekum tikus tujuh hari setelah infeksi 49
Gambar 4.3. Perkembangan jumlah E.coli pada feses tikus selama tujuh hari setelah infeksi
50
Gambar 4.4. Jumlah E. coli pada isi sekum tikus tujuh hari setelah infeksi 51
Gambar 4.5. Jumlah E. coli pada sekum, dan kolon 52
Gambar 4.6. Jumlah bakteri asam laktat pada sekum, dan kolon 53 Gambar 4.7.Respon antibodi terhadap pemberian probiotik dan infeksi EPEC
pada tikus, setelah hari ketujuh (IgA) dan setelah hari keempat belas (IgG) (KN=kontrol negatif, KE=kontrol EPEC, KP=kontrol probiotik, PA=probiotik prainfeksi, PB=probiotik pascainfeksi).
x
DAFTAR TABEL
Tabel 2.1. Jumlah dan morfologi isolat bakteri asam laktat asal mandai pada beberapa tahap fermentasi
14
Tabel 2.2.Isolat bakteri asam laktat asal mandai yang mempunyai aktivitas antimikroba yang kuat terhadap tiga atau lebih isolat.
17
Tabel 2.3. Resistensi beberapa isolat bakteri asam laktat asal mandai terhadap beberapa antibiotik
18
Tabel 2.4. Hasil identifikasi beberapa isolat bakteri asam laktat asal mandai yang berpotensi sebagai kandidat probiotik
20
Table 3.1. Competitive inhibition of enteropathogens adhesion by five L. plantarum strains on HCT-116 cells
32
Table 3.2. Exclusion of enteropathogens adhesion by five L. plantarum strains on HCT-116 cells
32
Table 3.3. Displacement of enteropathogens adhesion by five L. plantarum strains on HCT-116 cells
33
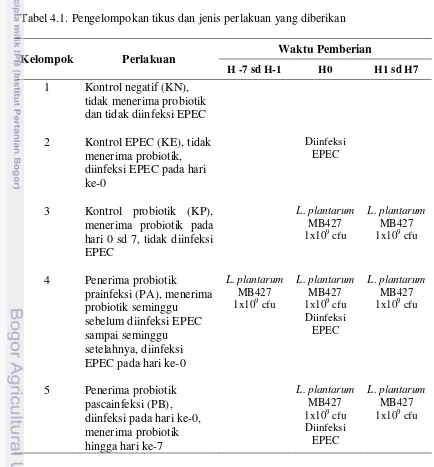
Tabel 4.1. Pengelompokan tikus dan jenis perlakuan yang diberikan 41
Tabel 4.2. Pengaruh dosis EPEC dalam menginduksi diare pada tikus 43
Tabel 4.3. Konsumsi ransum dan pertambahan bobot badan tikus per hari 45
Tabel 4.4. Kenaikan bobot badan tikus selama satu minggu perlakuan 45
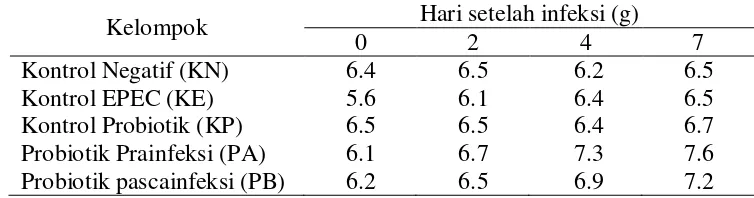
Tabel 4.5. Kejadian diare pada tikus dalam tujuh hari setelah infeksi EPEC 46
Tabel 5.1. Jumlah isolat yang diperoleh dari mandai pada berbagai kadar garam dan hari fermentasi
1 PENDAHULUAN
Latar Belakang
Penyakit infeksi saluran pencernaan karena bakteri enteropatogen masih menjadi masalah besar bagi kesehatan masyarakat. Setiap tahun penyakit infeksi gastrointestinal bertanggung jawab terhadap kasus-kasus kematian dan masalah kesehatan di seluruh dunia. Diperkirakan lebih dari empat milyar kejadian diare terjadi setiap tahunnya di seluruh dunia, termasuk 2.2 juta kematian per tahun akibat infeksi patogen enterik (WHO 2008).
Pengobatan diare akibat infeksi bakteri enteropatogen umumnya dilakukan dengan menggunakan antibiotik. Penggunaan antibiotik secara berlebihan telah melahirkan strain-strain bakteri patogen yang resisten terhadap antibiotik. Menghadapi kekhawatiran munculnya pandemi resistensi antibiotik, salah satu pengobatan alternatif yang dipilih adalah penggunaan kelompok bakteri yang secara kompetitif mampu menghambat pertumbuhan bakteri patogen enterik dalam saluran pencernaan. Kelompok bakteri ini, secara awam disebut bakteri baik, dan lebih dik\enal sebagai bakteri probiotik (Sleator 2010).
Istilah probiotik awalnya digunakan sebagai antonim dari antibiotik. Probiotik didefinisikan sebagai mikroorganisme hidup yang jika dikonsumsi dalam jumlah yang cukup akan menguntungkan kesehatan inangnya (FAO/WHO 2002). Probiotik telah banyak digunakan dalam pengobatan dan pencegahan penyakit diare yang disebabkan oleh infeksi bakteri enteropatogen dan rotavirus, necrotizing enterocolitis (NEC) dan inflammatory bowel disease (radang perut) (Culligan et al. 2009; Vasiljevic dan Shah 2008). Probiotik yang telah banyak dikenal saat ini umumnya merupakan kelompok bakteri asam laktat, terutama dari genus Lactobacillus dan Bifidobacterium.
Bakteri asam laktat merupakan kelompok besar mikroorganisme yang secara alami terdapat pada banyak bahan pangan serta saluran gastrointestinal dan urogenital manusia dan hewan. Selama pertumbuhannya, bakteri asam laktat dapat memproduksi komponen metabolit, seperti asam organik, hidrogen peroksida, bakteriosin, dan komponen lainnya. Bakteriosin merupakan suatu péptida antimikroba yang dihasilkan bakteri asam laktat selama fase pertumbuhan eksponensial yang dalam jumlah yang cukup, dapat membunuh atau menghambat bakteri lain yang berkompetisi dalam ekologi yang sama (Vasiljevic dan Shah 2008).
Sifat fungsional bakteri asam laktat bersifat spesifik strain sehingga perlu dilakukan eksplorasi strain bakteri asam laktat yang unggul dalam sifat fungsional tertentu. Eksplorasi sumber-sumber bakteri asam laktat dapat dilakukan pada pangan fermentasi tradisional, seperti tauco, tempoyak, pikel, sawi asin, bekasam, mandai dan lain-lain (Rahayu, 2003), untuk mencari isolat-isolat yang mempunyai sifat fungsional yang dapat meningkatkan kesehatan. Isolat yang diperoleh dapat dipergunakan sebagai kultur starter pada pangan fermentasi sehingga akan menaikkan nilai tambah produk fermentasi menjadi bernilai fungsional.
Pangan yang diproses dengan fermentasi yang melibatkan bakteri asam laktat telah menjadi bagian dari khasanah kekayaan budaya tradisional kita. Salah satunya adalah makanan fermentasi khas masyarakat yang hidup di wilayah propinsi Kalimantan Tengah, Selatan dan Timur, yaitu mandai. Mandai merupakan makanan fermentasi yang dibuat secara tradisional dari dami buah cempedak (Artocarpus champeden), yaitu bagian buah yang tidak dimakan, yang telah dibersihkan dan direndam dalam larutan garam selama dua minggu. Mandai hasil fermentasi, dicuci, diberi bumbu dan dikonsumsi sebagai lauk teman nasi. Rasanya yang enak dan gurih serta teksturnya yang menyerupai daging membuat makanan ini digemari. Proses fermentasi mandai merupakan bagian dari upaya pengawetan makanan agar tersedia untuk waktu yang lama sekaligus upaya pemanfaatan limbah dari konsumsi buah cempedak. Mandai yang dibuat dengan baik, umumnya dapat bertahan hingga 1 tahun atau lebih.
Rahayu (2003) telah mengisolasi sembilan isolat bakteri asam laktat dari mandai cempedak. Berdasarkan homologi DNA, lima di antaranya diidentifikasi sebagai Lactobacillus plantarum, satu spesies diidentifikasi sebagai Lactobacillus sp. dan tiga yang lain adalah Pediococcus pentosaceus. Akan tetapi belum dilakukan karakterisasi terhadap bakteri-bakteri yang telah diisolasi dari mandai. Dalam penelitian ini, eksplorasi bakteri asam laktat pada mandai tidak hanya dilakukan pada produk akhir fermentasi, melainkan akan diperluas selama berlangsungnya proses fermentasi meliputi variasi kadar garam dan lama fermentasi sehingga diharapkan akan diperoleh strain-strain bakteri asam laktat yang lebih bervariasi. Karakterisasi terhadap isolat-isolat yang diperoleh meliputi sifat-sifat yang menunjukkan potensi dasar sebagai probiotik dan sifat-sifat fungsional lain yang diharapkan dimiliki oleh bakteri asam laktat, khususnya dalam pencegahan infeksi bakteri enteropatogen.
Perumusan Masalah
Salmonella typhimurium ATCC 14028) juga perlu dilakukan, termasuk mekanisme agregasi, adhesi dan kompetisi dalam menghambat bakteri enterik secara in vitro dengan menggunakan sel HCT-116. Pengujian efektivitas bakteri asam laktat asal mandai dalam mencegah atau mereduksi infeksi bakteri Enteropatogenic E. coli (EPEC) K1.1 perlu dilakukan secara in vivo. Bakteri asam laktat sebagai probiotik harus diketahui identitasnya secara molekuler sehingga terhadap spesies atau strain yang menunjukkan potensi probiotik perlu diidentifikasi secara molekuler.
Tujuan
Tujuan dalam penelitian ini adalah untuk memperoleh isolat-isolat bakteri asam laktat asal mandai yang mempunyai sifat-sifat fungsional yang dapat memberikan dampak positif terhadap kesehatan manusia, secara spesifik dalam pencegahan infeksi oleh bakteri enteropatogen, yang telah teruji melalui pengujian secara in vitro dan in vivo.
Tujuan spesifik dari penelitian ini adalah sebagai berikut:
1. Memperoleh isolat bakteri asam laktat dari mandai yang telah dikarakterisasi sifat-sifat dasar sebagai probiotik dan diidentifikasi dengan menggunakan metode biokimia dan molekuler
2. Mengetahui mekanisme antiinfeksi berdasarkan kemampuan agregasi isolat bakteri asam laktat terhadap 5 spesies bakteri enteropatogen serta kemampuan adhesi dan kompetisi pada kultur sel HCT-116
3. Mengetahui potensi antiinfeksi isolat bakteri asam laktat terpilih terhadap EPEC secara in vivo
Hipotesis
1. Terdapat beberapa isolat bakteri asam laktat asal mandai yang bersifat sebagai kandidat probiotik
2. Kandidat probiotik yang diisolasi dari mandai mempunyai aktivitas antagonistik terhadap salah satu atau lebih dari lima spesies bakteri enteropatogen yang diujikan
3. Kandidat probiotik yang diisolasi dari mandai mampu mencegah atau mengurangi adhesi lima jenis bakteri enteropatogen secara in vitro pada kultur sel
4. Kandidat probiotik yang diisolasi dari mandai mampu mencegah atau mengurangi dampak infeksi bakteri enteropatogen pada tikus
5. Kandidat probiotik yang diisolasi dari mandai mampu memodulasi respon imun pada tikus yang diinfeksi oleh bakteri enteropatogen
Manfaat
enteropatogen dan telah teruji baik secara in vitro maupun in vivo. Hasil penelitian berupa kandidat probiotik diharapkan dapat diaplikasikan pada berbagai jenis pangan dalam rangka pengembangan pangan probiotik.
Ruang Lingkup Penelitian
Kegiatan ini dimulai dengan pengumpulan isolat dari produk fermentasi dami cempedak (mandai) dari wilayah Samarinda Kalimantan Timur. Sampel mandai sejumlah 45 sampel diperoleh dari Samarinda Kalimantan Timur, terdiri atas beberapa kelompok berdasarkan kadar garam (5, 10, 15%) dan waktu fermentasi (4, 8, 12 hari), masing-masing 5 sampel. Terhadap isolat yang diperoleh dilakukan pengujian ketahanan terhadap pH rendah dan ketahanan terhadap garam empedu untuk melihat kemampuan bertahan dalam saluran pencernaan manusia, aktivitas antimikroba terhadap patogen yang umum ditemukan pada saluran pencernaan (enteropatogen), seperti Enterococcus faecalis, Listeria monocytogenes, Bacillus cereus, Escherichia coli dan Salmonella enterica serovar Typhimurium, serta resistensi terhadap antibiotik. Identifikasi isolat yang potensial akan dilakukan secara biokimia dengan kit API 50 CHL dan dikonfirmasi dengan qualitative PCR yang mengidentifikasi melalui analisis kurva pelelehan.
Lebih jauh pada tahap kedua, isolat terpilih dianalisis kemampuannya melakukan autoagregasi dan koagregasi.Analisis sifat fungsional lebih lanjut akan dilakukan secara in vitro menggunakan kultur sel HCT-116 untuk mengkaji kemampuan isolat melakukan adhesi pada sel usus serta kemampuan penghambatan adhesi dan kolonisasi bakteri enterik pada sel usus.
Pada tahap ketiga, secara in vivo dilakukan pemberian isolat kultur kandidat probiotik pada tikus yang telah diinfeksi EPEC. Analisis yang akan dilakukan adalah analisis imunologi, dan analisis mikrobiologi feses dan organ tikus. Tahapan dan rincian aktivitas yang dilakukan dalam tiap tahapan secara menyeluruh disajikan pada Gambar 1.1.
Daftar Pustaka
Culligan EP, Hill C, dan Sleator RD. 2009. Probiotics and gastrointestinal disease: Successes, problems, and future prospects. Gut Pathogens 1: 19.
[FAO/WHO] Food and Agricultural Organization/World Health Organization. 2002. Guidelines for the Evaluation of Probiotics in Food. Report of a Joint FAO/WHO Working Group on Drafting Guidelines for the Evaluation of Probiotics in Food. Ontario, Canada
Lee. H.J., H.Yoon, Y.Ji, H.Kim, H.Park, J.Lee. 2011. Functional properties of Lactobacillus strains isolated from kimchi. Int J Food Microbiol 145:155-161
Reid G, Kim SO, Köhler GA. 2006. Selecting, testing and understanding probiotic microorganisms. FEMS Immunol Med Microbiol 46(2):149-57
Saad N, Delattre C, Urdaci M, Schmitter JM, Bressolier P. 2013. An overview of the last advances in probiotic and prebiotic field. LWT 50: 1-16
Tamang, J.P., Tamang B., Schillinger U., Guigas C., Holzapfel W. H. 2009. Functional properties of lactic acid bacteria isolated from ethnic fermented vegetables of the Himalayas. Int J Food Microbiol 135: 26-33
Vasiljevic, T. dan Shah, N.P. 2008. Probiotics – From Metchnikoff to bioactive. International Dairy Journal 18: 414-728
Gambar 1.1. Tahapan, rincian aktivitas dan output untuk mencapai tujuan penelitian
Isolat-isolat bakteri asam laktat asal mandai yang telah diketahui identitasnya, berpotensi sebagai probiotik dan mampu mencegah diare
Kajian pertama:
Isolasi, karakterisasi dan identifikasi bakteri asam laktat asal mandai
Identifikasi secara biokimia molekuler dengan q-PCR
Kajian agregasi, adhesi dan kompetisi isolat bakteri asam laktat asal mandai
Aktivitas
Pengujian autoagregasi dan koagregasi Pengujian adhesi pada sel HCT-116
Pengujian kompetisi, eksklusi dan
displacement
Kajian antidiare kandidat probiotik asal mandai pada tikus yang diinfeksi EPEC
Aktivitas
2 KARAKTERISASI ISOLAT BAKTERI ASAM LAKTAT DARI MANDAI – MAKANAN FERMENTASI TRADISIONAL DARI DAMI CEMPEDAK (Artocarpus champeden) YANG BERPOTENSI SEBAGAI
PROBIOTIK1
ABSTRAK
Mandai merupakan pangan fermentasi yang terbuat dari dami atau bagian dalam kulit cempedak yang tidak dikonsumsi. Penelitian tentang mandai, khususnya bakteri yang terlibat dalam fermentasi mandai, masih belum banyak dilakukan. Tujuan penelitian ini adalah untuk melakukan isolasi dan karakterisasi bakteri asam laktat yang diisolasi dari mandai, mengevaluasi potensinya sebagai probiotik serta mengidentifikasinya. Sampel mandai diperoleh dari beberapa industri rumah tangga di Kalimantan Timur, yang dibuat dengan kadar garam 5, 10 dan 15%. Delapan puluh lima isolat bakteri asam laktat diperoleh dari mandai pada hari ke-4, 8 dan 12 fermentasi dan dikaji sifat-sifat probiotiknya. Semua isolat menunjukkan toleransi yang baik terhadap pH rendah (pH 2.0) dengan penurunan jumlah sel hidup kurang dari dua log cfu/ml. Isolat bakteri asam laktat dapat tumbuh dengan adanya 0.5% garam empedu walaupun jumlah sel hidupnya menurun dibandingkan dengan jumlah sel hidup pada medium tanpa garam empedu. Penurunan jumlah isolat hidup kurang dari 1 log cfu/ml teramati pada 21 isolat. Sembilan belas isolat dapat mentoleransi pH 2.0 dan garam empedu 0.5% lebih baik daripada yang lain dengan total penurunan jumlah sel hidup kurang dari 1 log cfu/ml. Sebagian besar isolat (11 dari 19) yang mentoleransi pH rendah diperoleh dari fermentasi mandai hari ke-8 dan kadar garam 15%. Isolat MC812 mempunyai sifat antimikroba yang baik terhadap semua patogen uji (Listeria monocytogenes ATCC 13932, Enterococcus faecalis ATCC 19433, Bacillus cereus ATCC 10876, Escherichia coli ATCC 25922 dan Salmonella typhimurium ATCC 14028). Sembilan isolat lain mempunyai sifat antimikroba yang baik terhadap 3 atau lebih patogen uji. Resistensi terhadap antibiotik bervariasi di antara isolat. Kesepuluh isolat diidentifikasi sebagai Lactobacillus plantarum dengan API 50 CHL dan dikonfirmasi dengan qualitative-PCR. Keseluruhan hasil mengindikasikan bahwa kesepuluh bakteri asam laktat yang diisolasi dari mandai berpotensi sebagai probiotik.
Kata kunci: probiotik, bakteri asam laktat, sifat antimikroba, mandai, Lactobacillus plantarum
1. PENDAHULUAN
Pangan yang diproses dengan fermentasi yang melibatkan bakteri asam laktat telah menjadi bagian dari khasanah kekayaan budaya tradisional kita. Salah satunya adalah makanan fermentasi khas masyarakat yang hidup di wilayah propinsi
1
Kalimantan Tengah, Selatan dan Timur, yaitu Mandai. Mandai merupakan makanan fermentasi yang dibuat secara tradisional dari dami atau kulit buah cempedak bagian dalam yang telah dibersihkan dan direndam dalam larutan garam. Mandai yang telah jadi, dicuci, diberi bumbu dan dikonsumsi sebagai lauk teman nasi. Rasanya yang enak dan gurih serta teksturnya yang menyerupai daging membuat makanan ini digemari. Proses fermentasi mandai merupakan bagian dari upaya pengawetan makanan agar tersedia untuk waktu yang lama sekaligus upaya pemanfaatan limbah dari konsumsi buah cempedak. Mandai yang dibuat dengan baik, umumnya dapat bertahan hingga 1 tahun atau lebih.
Sebagai pangan fermentasi yang belum banyak dikenal, penelitian tentang mandai masih terbatas. Rahayu (2003) melakukan penelitian tentang mikroorganisme yang terlibat dalam pangan fermentasi tradisional Indonesia, salah satunya mandai, dan telah berhasil mengisolasi 9 bakteri dari mandai, di antaranya telah diidentifikasi sebagai Lactobacillus plantarum dan Pediococcus pentosaceus. Kedua bakteri ini tergolong dalam kelompok bakteri asam laktat. Proses fermentasi mandai berikut perubahan yang terjadi selama fermentasi telah diteliti oleh Nur (2009) meliputi kenaikan jumlah khamir dan bakteri asam laktat, penurunan kadar gula tereduksi, penurunan pH, dan kenaikan kadar garam produk selama fermentasi.
Bakteri asam laktat merupakan kelompok besar mikroorganisme yang secara fisiologis menghasilkan asam laktat sebagai metabolit utama. Kelompok ini secara alami terdapat pada banyak bahan pangan serta saluran gastrointestinal dan urogenital manusia dan hewan. Selama pertumbuhannya, bakteri asam laktat dapat memproduksi komponen metabolit, seperti asam organik, hidrogen peroksida, bakteriosin, dan komponen lainnya. Bakteriosin merupakan suatu peptida antimikroba yang dihasilkan bakteri asam laktat selama fase pertumbuhan eksponensial yang dalam jumlah yang cukup, dapat membunuh atau menghambat bakteri lain yang berkompetisi dalam ekologi yang sama (Vasiljevic dan Shah 2008).
Beberapa spesies dari kelompok bakteri asam laktat, terutama dari genera Lactobacillus and Bifidobacterium, telah dikarakterisasi sebagai probiotik. Probiotik didefinisikan sebagai mikrorganisme hidup yang jika dikonsumsi dalam jumlah cukup akan memberikan manfaat kesehatan bagi yang mengkonsumsinya (FAO/WHO 2002). Mikroorganisme probiotik memberikan manfaat terhadap kesehatan manusia, melindungi dari infeksi bakteri enteropatogen, menurunkan kejadian dan durasi diare, necrotizing enterocolitis (NEC) dan radang perut (Culligan et al. 2009; Vasiljevic dan Shah 2008).
Probiotik mempunyai kemampuan untuk tumbuh secara kompetitif dengan bakteri enterik, sehingga dapat menghambat pertumbuhan bakteri enterik dalam saluran pencernaan manusia.
Sifat fungsional bakteri asam laktat bersifat spesifik strain sehingga masih perlu dilakukan eksplorasi strain bakteri asam laktat yang unggul dalam sifat fungsional tertentu. Eksplorasi sumber-sumber bakteri asam laktat dapat dilakukan pada pangan fermentasi tradisional, seperti tauco, tempoyak, pikel, sawi asin, bekasam, dan lain-lain (Rahayu, 2003) untuk mencari isolat-isolat yang mempunyai sifat fungsional yang dapat meningkatkan kesehatan. Isolat yang diperoleh dapat dipergunakan sebagai kultur starter pada pangan fermentasi sehingga akan menaikkan nilai tambah produk fermentasi menjadi bernilai fungsional.
Karakterisasi dan fungsionalitas isolat-isolat bakteri asam laktat asal mandai masih belum dilakukan dan perlu diinvestigasi lebih lanjut untuk mengetahui kelayakan sebagai kandidat probiotik. Tujuan dari penelitian ini adalah melakukan isolasi dan mengkarakterisasi isolat bakteri asam laktat asal mandai sebagai bagian dari seleksi sesuai kriteria sebagai kandidat probiotik.
2. METODE PENELITIAN
Kultur Bakteri
Kultur bakteri, Escherichia coli ATCC 25922, Listeria monocytogenes ATCC 13932, Bacillus cereus ATCC 10876, dan Salmonella typhimurium ATCC 14028 diperoleh dari SEAFAST Center IPB. Enterococcus faecalis ATCC 19433 dibeli dari Oxoid. Semua bakteri patogen kecuali Enterococcus faecalis ATCC 19433 dipelihara dalam BHI broth (Oxoid, Hampshire UK). Semua isolat bakteri asam laktat dan Enterococcus faecalis ATCC 19433 dipelihara dalam MRS broth (Oxoid, Hampshire UK).
Pengumpulan Sampel
Penghitungan dan Isolasi Bakteri Asam Laktat Selama Fermentasi Mandai
Sepuluh gram sampel, secara aseptis, dimasukkan ke dalam 90 ml larutan fisiologis (mengandung 0.85% NaCl) dan dihomogenkan. Suatu seri pengenceran (10-1-10-6) dibuat untuk masing-masing sampel. Satu ml dari pengenceran yang sesuai dipupuk pada cawan dan dituang MRS agar (Oxoid, Hampshire UK) yang disuplementasi dengan 0.3% garam empedu (Difco) dan 3% CaCO3 (Merck,
Darmstadt, Germany). Semua cawan diinkubasi pada 30oC selama 24-48 jam secara aerobik. Penghitungan dilakukan pada cawan yang berisi 25-250 koloni sesuai BAM (2001).
Koloni yang representatif dicuplik dari cawan dan digores pada cawan berisi MRS agar. Koloni yang mempunyai morfologi berbeda dimurnikan dengan cara dicuplik dan digoreskan kembali pada cawan baru berisi MRS agar sampai dihasilkan koloni dengan bentuk dan ukuran seragam. Satu koloni tunggal dicuplik dan digoreskan pada agar miring. Morfologi isolat diamati dengan melakukan pewarnaan Gram dan uji katalase menggunakan hidrogen peroksida 3%. Isolat dengan morfologi batang/bulat Gram positif dan katalase negatif dikonfirmasi sebagai bakteri asam laktat.
Stok kultur gliserol dibuat untuk tujuan pengawetan kultur. Masing-masing isolat diinokulasi dalam MRS broth (Oxoid, Hampshire UK) yang mengandung 30% gliserol dan disimpan pada -20oC. Stok kultur diperbaharui setelah penyimpanan 6 bulan. Untuk penyimpanan jangka panjang, dilakukan liofilisasi terhadap kultur terpilih.
Kemampuan bertahan dalam pH 2.0 (Hosseini et al. 2009)
Kemampuan isolat bakteri asam laktat untuk bertahan dalam suasana asam di lambung dievaluasi dengan menginkubasi bakteri dalam suasana pH 2.0 sesuai pH lambung selama 3 jam. Sel bakteri asam laktat dari kultur 24 jam dalam MRS broth dipanen dengan sentrifugasi, dicuci dengan PBS steril (Oxoid, Hampshire UK). Sel bakteri diresuspensi dalam PBS steril yang telah disesuaikan pH-nya menjadi pH 2.0 dan diinkubasi pada 37oC selama 3 jam. Jumlah bakteri asam laktat sebelum dan setelah inkubasi ditentukan pada MRS agar.
Toleransi terhadap garam empedu
pada 560 nm dan dibandingkan dengan kultur yang ditumbuhkan dalam MRS broth aktivitas antimikroba, telah disiapkan sebelumnya. Sejumlah 25 µ l kultur dari setiap strain enteropatogen disebarkan pada cawan berisi 25 ml Mueller Hinton Agar (MHA, Oxoid, Hampshire UK) untuk membuat konsentrasi bakteri patogen dalam media 105 cfu/ml. Sumur berukuran 6 mm dibuat pada agar dan 50 µl kultur bakteri asam laktat yang diuji diinokulasi pada sumur. Setelah inkubasi 24 jam pada 37oC, diameter zona penghambatan diukur dari 3 sisi yang berbeda.
Pengujian aktivitas antimikroba dilakukan juga pada supernatan yang telah dinetralkan. Kultur bakteri asam laktat dalam medium cair MRS disentrifugasi pada 10.000 g selama 10 menit. Supernatan yang telah dinaikkan pH-nya menjadi 6.5 dengan NaOH 2 N digunakan dalam metode difusi sumur seperti yang dilakukan pada kultur bakteri asam laktat.
Mikroba uji yang digunakan dalam penelitian ini adalah bakteri-bakteri enteropatogen, yaitu E. faecalis, L. monocytogenes, B. cereus, S .typhimurium, E. coli. Hasil pengukuran diameter penghambatan (setelah dikurangi diameter sumur), diklasifikasikan sebagai berikut: kekuatan penghambatan lemah (0-3 mm), sedang (3-6 mm), kuat ((3-6-9 mm), dan sangat kuat (>9 mm) (Pan et al. 2009).
Pengujian Resistensi Antibiotik
Pengujian resistensi antibiotik dilakukan dengan metode difusi kertas cakram sesuai standar NCCLS (National Committee for Clinical Laboratory Standards, 1998) menggunakan media Mueller Hinton Agar. Cakram pengujian resistensi antibiotik (antibiotic susceptibility disc) diperoleh dari Oxoid (Hampshire UK) dan disimpan dalam wadah tertutup yang dilengkapi dengan penyerap kelembaban (desiccant) pada 4oC. Pengujian resistensi antibiotik dilakukan terhadap amoksisilin (15 µg/cakram), kloramfenikol (30 µg), siprofloksasin (30 µg), sefadroksil (30 µg), eritromisin (15 µg), streptomisin (30 µg), tetrasiklin (30 µg), trimetoprim/sulfametoksazol (30 µg), dan rifampisin (30 µg). Larutan stok antibiotik sebelumnya telah disterilisasi dengan membran 0.22 µm dan disimpan pada -20oC. Antibiotik yang dipilih mewakili yang berspektrum luas maupun terbatas serta mewakili beberapa tipe mode aksi terhadap mikroorganisme.
antibiotik dilakukan dengan menentukan lebar zona penghambatan di sekitar disc yang mengandung antibiotik. Berdasarkan ukuran zona penghambatan, isolat diklasifikasikan sebagai resisten, moderat atau sensitif terhadap antibiotik, sesuai klasifikasi untuk masing-masing antibiotik dengan mengacu pada NCCLS (1998). Aktivitas penghambatan lebih besar daripada nilai breakpoint yang ditentukan NCCLS (1999) ditentukan sebagai resisten dan sebaliknya.
Identifikasi Isolat Menggunakan API (Analytical Profile Index) 50 CHL
Identifikasi isolat bakteri asam laktat menggunakan API 50 CHL (Biomerieux) dilakukan sesuai dengan prosedur yang ditentukan oleh produsen. Kultur bakteri yang digunakan adalah yang berusia 24 jam pada cawan berisi MRS agar. Isolat bakteri asam laktat asal mandai yang diidentifikasi adalah yang telah melewati penapisan berdasarkan sifat-sifat probiotik, yaitu ketahanan terhadap pH 2.0 dan garam empedu 0.5% serta mempunyai sifat antimikroba yang kuat.
Identifikasi Mikroorganisme dengan Qualitative-PCR Sejumlah 50 µl buffer TE dan 100 µl lisozim ditambahkan ke pellet, diinkubasi 4oC 5 menit. Ke dalam suspensi ditambahkan 25µ l SDS 10%, 50 µl NaCl 5M, 100 µl proteinase k (20 mg/ml) lalu diinkubasi pada 55oC selama 2 jam.
Suspensi ditambah 500 µ l Phenol – Chloroform (PC = 1:1) dan diinkubasi pada -20oC selama 30 menit untuk kemudian disentrifus pada 12000 rpm 10 menit 4oC. Supernatan dipindahkan ke microtube baru yang steril. Proses penambahan PC, inkubasi dan sentrifugasi diulang sampai 3 kali. Supernatan ditambah 500 µ l kloroform dan disentrifus pada 12000 rpm 10 menit 4oC. Sejumlah 0.3x volume ammonium asetat 10M pH 7.4 dan 1x volume isopropanol dingin ditambahkan ke dalam supernatan yang telah dipindahkan ke microtube baru lalu. Setelah diinkubasi selama 2 jam pada -20oC, suspensi disentrifus pada 14000 rpm selama 30 menit 4oC, lalu supernatan dibuang. Pellet ditambah 500 µ l etanol 70% dingin dan disentrifus lagi pada 12000 rpm selama 5 menit 4oC. Supernatan dibuang dan pellet diangin-anginkan. Setelah kering, pellet diresuspensi dengan 50 µ l buffer TE dan siap disimpan pada -20oC.
suhu awal 72oC dan target suhu akhir 94oC dengan step 0.5oC. Primer yang digunakan adalah primer universal 9F sebagai primer forward, 5′ -GAGTTTGATYMTGGCTCAG-3′ dan 1541R sebagai primer reverse, dengan sekuen 5′-AAGGAGGTGWTCCARCC-3′ (Arief 2011).
3. HASIL DAN PEMBAHASAN
Perkembangan Jumlah Bakteri Asam Laktat selama Fermentasi Mandai
Selama fermentasi, jumlah bakteri asam laktat pada mandai meningkat sampai hari ke-12 (Gambar 2.1). Jumlah bakteri asam laktat pada hari ke-4 sekitar 6-7 log cfu/ml dan jumlah akhir pada kisaran 7-7.7 log cfu/ml. Hasil ini tidak jauh berbeda dengan hasil penelitian Nur (2009) yang menunjukkan kecenderungan peningkatan jumlah bakteri selama fermentasi mandai sampai hari ke-14. Total jumlah bakteri adalah 5 log cfu/ml pada awal fermentasi, 6 log cfu/ml pada hari ke-5 dan 7 log cfu/ml pada hari ke-14.
Gambar 2.1. Pengaruh konsentrasi garam terhadap jumlah bakteri asam laktat selama fermentasi mandai
fermentasi mandai dengan kadar garam berbeda menunjukkan pengaruh lingkungan terhadap pertumbuhan bakteri asam laktat. Garam dalam fermentasi mandai ditambahkan sebagai faktor seleksi lingkungan. Garam dapat menurunkan nilai aw dan meningkatkan potensial reduksi. Dengan adanya garam, mikroorganisme yang dapat tumbuh hanyalah yang dapat mentoleransi garam. Hal serupa juga dilaporkan oleh Bautista-Gallego et al. (2013) bahwa semakin tinggi garam yang ditambahkan pada fermentasi buah zaitun, jumlah bakteri asam laktat yang dapat tumbuh semakin berkurang.
Pengaruh kadar garam terhadap pertumbuhan bakteri asam laktat selama fermentasi juga dilaporkan oleh Ji et al. (2007). Pada fermentasi kubis, peningkatan kadar garam diikuti oleh penurunan total hitungan bakteri asam laktat. Penghambatan pertumbuhan bakteri asam laktat sempat terjadi pada konsentrasi garam 8-12% di awal fermentasi untuk kemudian mengalami peningkatan pada akhir fermentasi. Verluyten et al. (2004) juga melaporkan bahwa pada sosis fermentasi dengan kadar garam NaCl lebih tinggi, pertumbuhan L. curvatus LTH 1174 menurun. Garam mempengaruhi pertumbuhan mikroba dengan cara menurunkan ketersediaan air dalam sel. Adanya garam juga menurunkan potensial reduksi sehingga membatasi pertumbuhan mikroorganisme aerobik dan sebaliknya mendukung pertumbuhan mikroorganisme yang bersifat mikroaerofilik dan anaerobik.
Pada hari ke-8, jumlah bakteri asam laktat pada mandai dengan kadar garam 5% turun sedangkan pada mandai dengan kadar garam 10 dan 15% tetap meningkat. Pada hari ke-12 kecenderungannya sama dengan hari ke-4. Pada mandai dengan kadar garam 5% diduga mikroba-mikroba lain masih dapat tumbuh dan menekan pertumbuhan bakteri asam laktat. Akan tetapi dengan berjalannya fermentasi, pertumbuhan bakteri asam laktat kembali meningkat.
Profil Isolat Bakteri Asam Laktat asal Mandai
Isolasi bakteri asam laktat dari mandai telah memperoleh 85 isolat dari beberapa waktu fermentasi (Tabel 2.1). Umumnya isolat bakteri asam laktat mempunyai morfologi batang, 68 isolat, dan bulat atau kokus, 17 isolat. Isolat berbentuk kokus umumnya diperoleh pada hari ke-4 dan 8 fermentasi. Dilihat dari kadar garam dan hari fermentasi, isolat mandai lebih banyak diperoleh pada kadar garam 15% dan hari fermentasi ke-8. Banyaknya isolat yang diperoleh pada mandai dengan kadar garam 15% mengindikasikan isolat yang bersifat halotoleran atau halofilik.
Tabel 2.1. Jumlah dan morfologi isolat bakteri asam laktat asal mandai pada beberapa tahap fermentasi
Konsentrasi Garam
Lama Fermentasi Jumlah
Hari ke-4 Hari ke-8 Hari ke-12 Kokus Batang Kokus Batang Kokus Batang
Garam 5% 1 3 0 7 0 5 16
Garam 10% 6 10 2 4 0 2 24
Garam 15% 3 3 5 24 0 10 45
Jumlah 10 16 7 35 0 17 85
Ballesteros et al. (1999) melaporkan bahwa dalam fermentasi Almagro, asam-asam organik telah diproduksi sejak dimulainya fermentasi dan berimplikasi pada penurunan pH. Produksi asam organik dan penurunan pH sejak awal fermentasi juga dilaporkan oleh Roberts dan Kidd (2005) pada fermentasi bawang merah. Dalam laporan sebelumnya, Osmanagaoglu et al. (2010) melaporkan bahwa Pediococcus, yang merupakan salah satu bakteri asam laktat berbentuk kokus, tidak resisten terhadap pH 2, sedangkan Argyri et al. (2013) melaporkan bahwa Leuconostoc mesenteroides, yang merupakan juga bakteri asam laktat berbentuk kokus, jumlahnya turun hingga di bawah 1 log cfu/ml setelah 3 jam dipapar pada pH 2.5.
Kemampuan Mentoleransi pH 2.0 dan Garam Empedu
Hampir semua isolat bakteri asam laktat asal mandai mempunyai kemampuan mentoleransi keasaman lambung ditandai dengan kemampuan bertahan hidup selama 3 jam pada pH 2, dengan penurunan jumlah bakteri hingga 1 log cfu/ml (Gambar 2.2). Nilai pH lambung adalah 1.5-2.0 dan lama waktu transit adalah 2-3 jam. Kemampuan mentoleransi pH 2 diduga berhubungan dengan lingkungan asal isolat (yaitu mandai), yang cenderung asam, dengan pH akhir produk setelah fermentasi 12 hari adalah 4.16-4.8.
Kemampuan mentoleransi 0.5% garam empedu ditunjukkan hanya oleh 21 isolat (Gambar 2.2), ditandai oleh kemampuan untuk tumbuh dan memperbanyak diri dalam media yang mengandung 0.5% empedu, dengan selisih jumlah di bawah 2 log dibandingkan dengan pertumbuhan isolat yang sama dalam media yang tidak mengandung empedu. Kemampuan mentoleransi empedu 0.5% merupakan karakteristik yang penting dimiliki oleh bakteri probiotik sebab merupakan prasyarat untuk dapat melewati saluran pencernaan dan sampai di kolon.
isolat bakteri asam laktat dari idly yang dapat mentoleransi asam juga dapat mentoleransi empedu 0,3%.
Jumlah total isolat yang mampu mentoleransi asam dan empedu dengan total maksimum penurunan jumlah bakteri sebesar 1 log cfu/ml adalah 19 isolat. Kesembilan belas isolat ini yang akan diteruskan dalam analisis selanjutnya.
Gambar 2.2. Kemampuan isolat bakteri asam laktat asal mandai mentoleransi pH 2.0 dan empedu 0.5%
Aktivitas Antimikroba terhadap Bakteri Patogen
Dari pengujian terhadap 19 isolat yang mempunyai toleransi asam dan garam empedu, sepuluh di antaranya mempunyai aktivitas antimikroba yang kuat terhadap tiga atau lebih bakteri uji (Tabel 2.2). Isolat MC812 mempunyai sifat antimikroba yang kuat terhadap semua bakteri uji. Isolat MB411, MB427, MA314, M325 dan M337 bersifat antimikroba hanya terhadap tiga bakteri uji. Akan tetapi supernatannya yang telah dinetralkan tidak mempunyai atau hanya mempunyai aktivitas antimikroba yang lemah terhadap bakteri uji. Diduga aktivitas antimikroba ini disebabkan oleh penurunan pH karena produksi asam-asam organik selama
fermentasi seperti asam laktat dan asam asetat (Vitali et al. 2012) dan bukan karena produksi substansi antimikroba seperti bakteriosin.
Beberapa penelitian juga melaporkan hasil serupa. Argyri et al. (2013) melaporkan bahwa tak satupun supernatan bebas sel dari isolat bakteri asam laktat asal zaitun terfermentasi, yang mempunyai aktivitas antimikroba. Demikian juga isolat-isolat Lactobacillus asal susu yang dilaporkan Maragkoudakis et al. (2006) tidak lagi bersifat antimikroba pada pH netral.
Dari kelima bakteri uji, ke-10 isolat bakteri asam laktat asal mandai lebih bersifat menghambat terhadap L.monocytogenes dan E.coli. Diduga pertumbuhan L. monocytogenes lebih dihambat karena sensitivitasnya terhadap adanya asam organik seperti asam laktat. Wilson et al. (2005) melaporkan aktivitas antilisterial L. plantarum SK1 terjadi pada akhir fase log dari pertumbuhannya yang dihubungkan dengan turunnya pH media pertumbuhan sampai 4.26. Rendahnya pertumbuhan juga teramati saat L. monocytogenes ditumbuhkan pada supernatan dari media pertumbuhan L. plantarum yang diadjust pH-nya dengan penambahan asam laktat.
Tabel 2.2. Isolat bakteri asam laktat asal mandai yang mempunyai aktivitas antimikroba yang kuat terhadap tiga atau lebih isolat.
Isolat Aktivitas Antimikroba terhadap
L.monocytogenes E.faecalis B.cereus E.coli S.typhimurium
MC802 V V V V
MC804 V V V V
MC805 V V V V
MC807 V V V V
MC812 V V V V V
MB411 V V V
MB427 V V V
MA314 V V V
M325 V V V
M337 V V V
pertumbuhan sehingga adanya penghambatan karena pH rendah atau produksi asam organik tidak selalu berpengaruh terhadap pertumbuhannya (Stuart et al. 2006).
Resistensi terhadap Antibiotik
Resistensi antibiotik merupakan salah satu indikator keamanan kandidat probiotik. Semua isolat bakteri asam laktat asal mandai bersifat resisten (R) terhadap semua antibiotik yang diujikan kecuali streptomisin (Tabel 2.3). Pola resistensi yang teramati bersifat spesifik spesies. Beberapa isolat sensitif terhadap amoksisilin dan eritromisin. Dilihat dari mode aksi antibiotik, seluruh isolat bakteri yang diujikan resisten terhadap tipe antibiotik inhibitor metabolisme folat (trimetoprim/sulfametoksazol), inhibitor sintesis dinding sel (sefadroksil dan amoksisilin), inhibitor sintesis DNA (siprofloksasin) dan RNA (rifampisin). Isolat-isolat bakteri asam laktat asal mandai bervariasi resistensinya terhadap antibiotik tipe inhibitor sintesis protein. Isolat bakteri asam laktat sensitif terhadap streptomisin, serta resisten terhadap tetrasiklin dan kloramfenikol, namun resistensinya terhadap eritromisin bervariasi.
Tabel 2.3. Resistensi beberapa isolat bakteri asam laktat asal mandai terhadap beberapa antibiotik
Isolat Amx Tri/Sm Tec Chl Rpn Cfdx Ern Strn Cfpx
MC802 R R R R R R R S R
MC804 R R R R R R R S R
MC805 R R R R R R R R R
MC807 R R R R R R R S R
MC812 R R R R R R R S R
MC314 R R R R R R S S R
MC411 S R R R R R S S R
MC427 S R R R R R R S R
MC325 R R R R R R R S R
MC337 S R R R R R R S R
Keterangan: R: resisten, S: sensitif/susceptible, Amx: Amoxicillin, Tri/Sm: Trimethoprim/Sulphamethoxazole, Tec: Tetracyclin, Chl:Chloramphenicol, Rpn: Rifampicin, Cfdx: Cefadroxil, Ern: Erythromicin, Strn:Streptomicin, Cfpx: Ciprofloxacin
oleh Liu et al. (2009). Resistensi terhadap antibiotik menjadi perhatian dan tidak dikehendaki sebab diduga berbasis genetik dan dikhawatirkan terdapat potensi untuk dipindahkan kepada mikroorganisme lain.
Dugaan adanya potensi tranfer gen resistensi antibiotik perlu diklarifikasi lebih lanjut. Menurut Mathur dan Singh (2005), resistensi antibiotik bakteri asam laktat ada yang bersifat intrinsik dan perolehan (acquired). Resistensi antibiotik yang bersifat intrinsik merupakan resistensi yang bersifat alami, disandikan dalam kromosom, diturunkan pada saat membelah diri dan tidak dipindahkan pada spesies lain. Resistensi yang bersifat intrinsik dapat disebabkan oleh komposisi tertentu pada dinding sel sehingga tidak mudah dilemahkan oleh antibiotik. Diduga resistensi isolat bakteri asam laktat asal mandai terhadap beberapa antibiotik dengan mode aksi terhadap dinding sel (seperti sefadroksil dan amoksisilin) bersifat intrinsik.
Resistensi intrinsik laktobasili terhadap siprofloksasin, streptomisin, trimetoprim/sulfametoksazol dilaporkan oleh Danielsen dan Wind (2003). Ouoba et al. (2008) yang menginvestigasi resistensi antibiotik terhadap beberapa strain bakteri asam laktat asal Afrika dan Eropa, melaporkan resistensi terhadap antibiotik yang bersifat intrinsik dengan tidak ditemukannya gen resisten terhadap antibiotik tertentu.
Berbeda dengan resistensi intrinsik, resistensi yang bersifat perolehan disandikan di plasmid dan dapat dipindahkan secara horisontal ke spesies lain. Laktobasili dapat mempunyai plasmid dan dapat dipindahkan secara konyugasi (Mathur dan Singh 2005). Gen tet dan erm (menyandi resistensi terhadap tetrasiklin dan eritromisin) pada plasmid dilaporkan pada beberapa laktobasilli yang diisolasi dari manusia dan susu, yaitu L. acidophilus, L. crispatus, L. gasseri dan L. plantarum yang menunjukkan adanya antibiotik dapatan (Cataloluk dan Gogebaken 2004). Dalam penelitian ini, isolat bakteri asam laktat asal mandai juga ditemukan bersifat resisten terhadap tetrasiklin dan eritromisin, hanya belum diketahui apakah resistensi bersifat intrinsik atau perolehan. Untuk memastikan bakteri asam laktat asal mandai aman dikonsumsi manusia dari sisi resistensi antibiotik, maka perlu dilakukan penelitian lebih lanjut untuk melihat potensi transfer gen resistensi pada spesies lain.
Identifikasi Isolat Bakteri Asam Laktat yang Potensial sebagai Probiotik
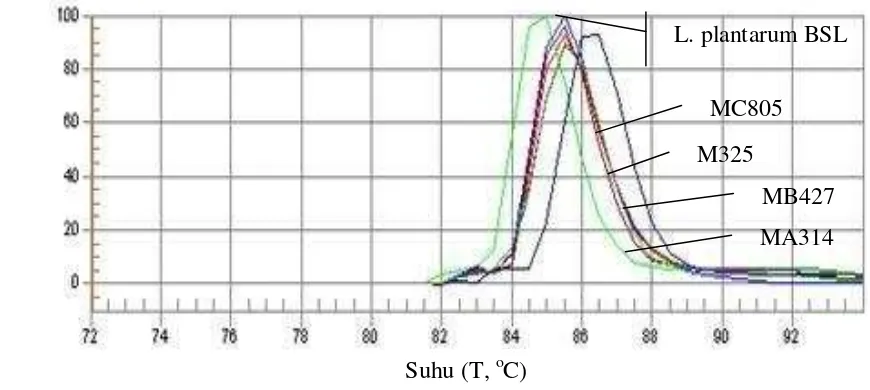
Dengan menggunakan API 50 CHL, kesepuluh isolat bakteri asam laktat asal mandai diidentifikasi sebagai Lactobacillus plantarum dengan persen identitas di atas 99% (Tabel 2.4). Hanya isolat MA314 memiliki persen identitas 99.4% sedangkan sembilan isolat yang lain memiliki persen identitas 99.9%. Hasil ini dikonfirmasi dengan membandingkan profil kurva pelelehan ekstrak DNA dari sepuluh isolat asal mandai yang dianalisis dengan q-PCR secara kualitatif. Analisis pelelehan dilakukan setelah tiga tahapan PCR dilakukan, yaitu denaturasi, penempelan (annealing) dan perpanjangan untai DNA (elongasi). Pola dan suhu pelelehan yang diperoleh dibandingkan dengan pola dan suhu pelelehan bakteri standar yang telah diketahui identitasnya yaitu Lactobacillus plantarum BSL. Bakteri standar dipilih berdasarkan dugaan identitas spesies dari hasil identifikasi dengan API 50 CHL yaitu L. plantarum.
Tabel 2.4. Hasil identifikasi beberapa isolat bakteri asam laktat asal mandai yang berpotensi sebagai kandidat probiotik
Isolat Teridentifikasi sebagai % ID
MC802 Lactobacillus plantarum 1 99.9% MC804 Lactobacillus plantarum 1 99.9% MC805 Lactobacillus plantarum 1 99.9% MC807 Lactobacillus plantarum 1 99.9% MC812 Lactobacillus plantarum 1 99.9% MB411 Lactobacillus plantarum 1 99.9% MB427 Lactobacillus plantarum 1 99.9% MA314 Lactobacillus plantarum 1 99.4% M325 Lactobacillus plantarum 1 99.9% M337 Lactobacillus plantarum 1 99.9%
sakazaki secara molekuler, akan tetapi berbeda strain, dapat menunjukkan perbedaan suhu pelelehan hingga 0.5oC (Jenie et al. 2014).
Identifikasi isolat kandidat probiotik harus dilakukan hingga level strain dengan sekuensing atau penentuan urutan basa pada gen yang menyandikan 16S rRNA. Dari urutan basa yang diperoleh dapat diketahui identitas bakteri dengan cara membandingkan dengan data yang sudah ada di genebank.
Gambar 2.3. Kurva pelelehan beberapa isolat bakteri asam laktat asal mandai dibandingkan dengan kurva pelelehan Lactobacillus plantarum BSL sebagai bakteri standar
KESIMPULAN
Sejumlah 19 isolat bakteri asam laktat asal mandai mempunyai kemampuan mentoleransi lingkungan ber-pH 2 dan mengandung 0.5% garam empedu dengan penurunan pertumbuhan sampai 1 log cfu/ml dibandingkan lingkungan ber-pH netral tanpa garam empedu. Sepuluh di antara isolat bakteri asam laktat mempunyai sifat antimikroba baik terhadap tiga dari lima bakteri yang diujikan. Isolat MC812 mempunyai aktivitas antimikroba yang baik terhadap semua bakteri uji. Umumnya sepuluh isolat bakteri asam laktat asal mandai bersifat resisten terhadap 8 antibiotik yang diujikan dan bersifat sensitif terhadap streptomisin. Berdasarkan identifikasi dengan API 50 CHL dan dikonfirmasi dengan rt-PCR, kesepuluh isolat asal mandai termasuk Lactobacillus plantarum. Berdasarkan hasil karakterisasi yang telah dilakukan, sepuluh isolat L.plantarum asal mandai dapat dipertimbangkan sebagai kandidat probiotik.
Suhu (T, oC)
D
eri
v
at
if
(-dF
/d
T
) L. plantarum BSL
MA314 4
MB427 M325
Daftar Pustaka
Arief, I.I. 2011. Karakterisasi Bakteri Asam Laktat Indigenus Asal Daging Sapi sebagai Probiotik dan Identifikasinya dengan Analisis Urutan Basa Gen 16SrRNA. Disertasi Program Doktor Institut Pertanian Bogor
Argyri, A.A., Zoumpopoulou, G., Karatzas, K.G. Tsakalidou, E., Nychas, G.E., Panagou, E.Z., dan Tassou, C.C. 2013. Selection of potential probiotic lactic acid bacteria from fermented olives by in vitro tests. Food Microbiology 33:282-291
Balitbangkes. 2007. Riset Kesehatan Dasar. Badan Penelitian dan Pengembangan Kesehatan.
Balesteros, C., Palop, L., dan Sanchez, I. 1999. Influence of sodium chloride concentration on the controlled lactic acid fermentation of “Almagro” eggplants. International Journal of Food Microbiology 53: 13-20
Bautista-Gallego, J., Arroyo-Lopez, F.N., Rantsiou, K., dan Jimenez-Diaz, R. 2013. Screening of lactic acid bacteria isolated from fermented table olives with probiotic potential. Food Research Internaional 50:135-142
Culligan, E.P., Hill, C., dan Sleator, R.D. 2009. Probiotics and gastrointestinal disease: Successes, problems, and future prospects. Gut Pathogens1: 19. Danielsen M dan Wind A. 2003. Susceptibility of Lactobacillus spp. to
antimicrobial agents. International Journal of Food Microbiology 82(1): 1– 11
[FAO/WHO] Food and Agricultural Organization/World Health Organization. 2002. Guidelines for the Evaluation of Probiotics in Food. Report of a Joint FAO/WHO Working Group on Drafting Guidelines for the Evaluation of Probiotics in Food. Ontario, Canada
Hagen, R.M., Seegmueller, I., Navai, J., Kappstein, I.,Lehn, N. dan Miethke, T. 2005. Development of a real-time PCR assay for rapid identification of methicillin-resistant Staphylococcus aureus from clinical samples. International Journal of Medical Microbiology 295: 77–86
Ji, F., Ji, B., Li, B., dan Han, B. 2007. Microbial changes during the salting process of traditional pickled chinese cabbage. Food Science and Technology International 13: 11-16
Liu, C., Zhancg, Z., Dong,K., Yuan,J., dan Guo, X. 2009. Antibiotic resistance of probiotic strains of lactic acid bacteria isolated from marketed foods and drugs. Biomedical and Environmental Sciences 22: 401-412
Maragkoudakis, P. A., Zoumpopoulou, G., Miaris, C, Kalantzopoulos, G., Pot, B., dan Tsakalidou, E. 2006. Probioticpotential of Lactobacillus strains isolated from dairy products. International Dairy Journal16: 189–199.
Mathur S. dan Singh R. 2005. Antibiotic resistance in food lactic acid bacteria – a review. International Journal Food Microbiology 105: 281-295
Maturin, L. dan Peeler, J. T. 2001. Bacteriological Analytical Manual, Chapter 3: Aerobic plate count. US.Food and Drug Administration.
[NCCLS] National Committee for Clinical Laboratory Standards. 1998. Performance Standards for Antimicrobial Disc Susceptibility Test. National Committee for Clinical Laboratory Standards.
Nur, H.S. 2009. Suksesi mikroba dan aspek biokimiawi fermentasi mandai dengan kadar garam rendah. Makara 13(1): 13-16
Osmanagaoglu, O., Kiran, F., dan Ataoglu, H.2010. Evaluation of in vitro probiotic potential of Pediococcus pentosaceusOZFisolated from human breast milk. Probiotics and Antimicrobial Proteins, 2: 162–174.
Ouoba, L. I. I. O., Lei, V., dan Jensen, L.B. 2008. Resistance of potential probiotic lactic acid bacteria and bifidobacteria of African and European origin to antimicrobials: Determination and transferability of the resistance genes to other bacteria. International Journal of Food Microbiology 121: 218-224 Pan X, Chen F, Wua T, Tang H, Zhao Z. 2009. The acid, bile tolerance and
antimicrobial property of Lactobacillus acidophilus NIT. Food Control 20: 598–602
Rahayu ES. 2003. Lactic acid bacteria in fermented foods of Indonesian origins. Agritech 23:75-84
Sambrook J dan Russel DW. 2001. Molecular Cloning: A laboratory manual. Cold Spring Harbour Laboratory Press, New York
Stuart CH, Schwartz SA, Beeson TJ, dan Owatz CB. 2006. Enterococcus faecalis: its role in root canal treatment failure and current concepts in retreatment. Journal of Endodontics.32:93-8.
Todar K. 2008. Listeria. Dalam: Online Textbook of Bacteriology,
www.textbookofbacteriology.net
Vasiljevic T. dan Shah NP. 2008. Probiotics – From Metchnikoff to bioactive. International Dairy Journal 18: 414-728
Verluyten J, Messens W, dan De Vuyst L. 2004. Sodium chloride reduces production of curvacin A, a bacteriocin produced by Lactobacillus curvatus strain LTH 1174, originating from fermented sausage. Applied and Environmental Microbiology 70 (4): 2271–2278
Vinderola CG. dan Reinheimer JA. 2003. Lactic acid starter and probiotic bacteria: a comparative “in vitro” study of probiotic characteristics and biological barrier resistance. Food Research International 36: 895-904
Vidhyasagar V. dan JeevaratnamK. 2013. Evaluation of Pediococcus pentosaceus strains isolated from Idly batter for probiotic properties in vitro.Journal of Functional Food 5:235 –243
3 Aggregation and adhesion abilities to HCT-116 cellsof probiotic
candidates
Lactobacillus plantarum
strains isolated from
“mandai”,Indonesian fermented food
against enteropathogens
2Abstract
Ten probiotic candidates of L. plantarum strains isolated from “mandai” (fermented Artocarpus champeden fruitwaste) were assessed for aggregation, adhesion to enterocyte-like HCT-116 cells and competition abilities towards enteropathogens. Listeria monocytogenes ATCC 13932), enteropathogenic Escherichia coli (EPEC) K1.1 and Salmonella enterica serovar Typhimurium ATCC 14028 were used as tested enteric bacteria in the adhesion study. The results showed that four L. plantarum strains of MC805, MC807, MB411 and MB427 had good autoaggregation ability above 50%, but only two strains, MC802 and MC812, demonstrated coaggregation ability (above 25%) with all enteropathogens tested. Five strains of L. plantarum (MB427, MB411, MC807, MC805, MC802) showed the ability to adhere to HCT-116 cells above 60%, with the highest adhesion (74%) was performed by MB427 after 1 h incubation at 37oC. All pathogens were also able to adhere to HCT-116 cells with the adhesion percentage ranging from 51 to 62%. L. plantarum strains showed the potential to displace, compete, and inhibit the enteropathogens on HCT-116 cells, but their abilities were specific for each L. plantarum strain and each pathogen. L. plantarum strains showed stronger competitive exclusion, inhibition, and displacement towards EPEC than S. Typhimurium and L. monocytogenes.L. plantarum MB427 strain showed strong inhibition abilities towards the three pathogens except in displacing of L. monocytogenes. L. plantarum strains with the highest ability to compete with, inhibit and displace of EPEC and S. Typhimuriumwere MB427 and MB411 strains; and MB427, MC802, and MC805 strains; respectively. These results suggest that L. plantarum strains isolated from “mandai” were promising as probiotic candidates acquired protection against certain enteropathogenic infection.
Keyword: probiotic, aggregation, adhesion, Lactobacillus plantarum, enteropathogen
Introduction
The development of probiotic foods especially with a specific health benefit has drawn much attention to the scientist. The characteristics of the probiotic strain incorporated into the food product will be very important before the food itself can be claimed as a probiotic food. FAO/WHO (2002) defined probiotics as live microorganisms which when administered in adequate amounts confer a health benefit to the host. Probiotics have been reported having some abilities to protect
2