ABSTRAK
AMANDA THALITA PRIMA LIA. Evaluasi Morfologi Mikrokapsul Tersalut Alginat-Kitosan yang Mengandung IgG Anti-Escherichia coli Asal Kolostrum Sapi. Dibimbing oleh BAYU FEBRAM PRASETYO dan ANITA ESFANDIARI.
Penelitian ini bertujuan untuk mengevaluasi morfologi mikrokapsul tersalut alginat-kitosan yang mengandung imunoglobulin G (IgG) anti-Escherichia coli (E. coli) asal kolostrum sapi. Penelitian ini menggunakan IgG anti E. coli murni yang diperoleh dari kolostrum dari induk sapi yang telah divaksinasi dengan vaksin E. coli polivalen pada trimester akhir kebuntingan. Imunoglobulin G anti E. coli murni diperoleh melalui purifikasi, kemudian dikemas dalam bentuk mikrokapsul tersalut alginat-kitosan. Pembuatan mikrokapsul tersalut kitosan-alginat dilakukan menggunakan metode ekstruksi, menggunakan Microencapsulator, dengan waktu penyalutan selama 30 dan 60 menit. Mikrokapsul kemudian dievaluasi menggunakan Scanning Electron Microscope. Hasil pengamatan menunjukkan bahwa pada mikrokapsul berisi IgG anti E. coli dengan waktu penyalutan 60 menit menghasilkan mikrokapsul yang lebih baik dibandingkan dengan waktu penyalutan 30 menit. Secara mikroskopis tidak ada perbedaan bentuk antara mikrokapsul yang disalut dengan larutan kitosan 1% dengan waktu penyalutan 30 dan 60 menit. Dapat disimpulkan, mikrokapsul berisi IgG anti E. coli tersalut kitosan-alginat dengan waktu penyalutan 60 menit menghasilkan permukaan mikrokapsul yang lebih baik dibandingan dengan waktu penyalutan 30 menit. Kata kunci: kolostrum, IgG, mikrokapsul, alginat, kitosan, SEM
ABSTRACT
AMANDA THALITA PRIMA LIA. The Evaluation of Coated Alginate-Chitosan Microcapsules Morphology Consist of IgG Anti-Escherichia coli Derived from Bovine Colostrum. Supervised by BAYU FEBRAM PRASETYO and ANITA ESFANDIARI.
The objective of this experiment was to evaluate the morphology of alginate- chitosan coated microcapsule consist of anti E. coli IgG derived from bovine colostrum. Pure IgG anti E. coli were obtained from colostrum collected from cows vaccinated by polyvalent E. coli vaccine. The IgG were purified and packed in form of alginate chitosan coated microcapsule. The microcapsules were made by extruction method, using Microencapsulator with 30 and 60 minutes coating time in chitosan, respectively. Microcapsules then be evaluated by using Scanning Electron Microscope. Results of the experiment indicated that there was no significant different in the formation of microcapsules between 30 and 60 minutes coating time. The microscopic evaluation has indicated the smoother surface of microcapsules coated in 60 minutes . In conclusion, the IgG microcapsules with the 60 minutes coating time better than of those coated in 30 minutes.
EVALUASI MORFOLOGI MIKROKAPSUL TERSALUT
ALGINAT-KITOSAN YANG MENGANDUNG IgG ANTI
Escherichia coli
ASAL KOLOSTRUM SAPI
AMANDA THALITA PRIMA LIA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Evaluasi Morfologi Mikrokapsul Tersalut Alginat-Kitosan yang Mengandung IgG Anti-Escherichia coli Asal Kolostrum Sapi. adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
AMANDA THALITA PRIMA LIA. Evaluasi Morfologi Mikrokapsul Tersalut Alginat-Kitosan yang Mengandung IgG Anti-Escherichia coli Asal Kolostrum Sapi. Dibimbing oleh BAYU FEBRAM PRASETYO dan ANITA ESFANDIARI.
Penelitian ini bertujuan untuk mengevaluasi morfologi mikrokapsul tersalut alginat-kitosan yang mengandung imunoglobulin G (IgG) anti-Escherichia coli (E. coli) asal kolostrum sapi. Penelitian ini menggunakan IgG anti E. coli murni yang diperoleh dari kolostrum dari induk sapi yang telah divaksinasi dengan vaksin E. coli polivalen pada trimester akhir kebuntingan. Imunoglobulin G anti E. coli murni diperoleh melalui purifikasi, kemudian dikemas dalam bentuk mikrokapsul tersalut alginat-kitosan. Pembuatan mikrokapsul tersalut kitosan-alginat dilakukan menggunakan metode ekstruksi, menggunakan Microencapsulator, dengan waktu penyalutan selama 30 dan 60 menit. Mikrokapsul kemudian dievaluasi menggunakan Scanning Electron Microscope. Hasil pengamatan menunjukkan bahwa pada mikrokapsul berisi IgG anti E. coli dengan waktu penyalutan 60 menit menghasilkan mikrokapsul yang lebih baik dibandingkan dengan waktu penyalutan 30 menit. Secara mikroskopis tidak ada perbedaan bentuk antara mikrokapsul yang disalut dengan larutan kitosan 1% dengan waktu penyalutan 30 dan 60 menit. Dapat disimpulkan, mikrokapsul berisi IgG anti E. coli tersalut kitosan-alginat dengan waktu penyalutan 60 menit menghasilkan permukaan mikrokapsul yang lebih baik dibandingan dengan waktu penyalutan 30 menit. Kata kunci: kolostrum, IgG, mikrokapsul, alginat, kitosan, SEM
ABSTRACT
AMANDA THALITA PRIMA LIA. The Evaluation of Coated Alginate-Chitosan Microcapsules Morphology Consist of IgG Anti-Escherichia coli Derived from Bovine Colostrum. Supervised by BAYU FEBRAM PRASETYO and ANITA ESFANDIARI.
The objective of this experiment was to evaluate the morphology of alginate- chitosan coated microcapsule consist of anti E. coli IgG derived from bovine colostrum. Pure IgG anti E. coli were obtained from colostrum collected from cows vaccinated by polyvalent E. coli vaccine. The IgG were purified and packed in form of alginate chitosan coated microcapsule. The microcapsules were made by extruction method, using Microencapsulator with 30 and 60 minutes coating time in chitosan, respectively. Microcapsules then be evaluated by using Scanning Electron Microscope. Results of the experiment indicated that there was no significant different in the formation of microcapsules between 30 and 60 minutes coating time. The microscopic evaluation has indicated the smoother surface of microcapsules coated in 60 minutes . In conclusion, the IgG microcapsules with the 60 minutes coating time better than of those coated in 30 minutes.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
EVALUASI MORFOLOGI MIKROKAPSUL TERSALUT
ALGINAT-KITOSAN YANG MENGANDUNG IgG ANTI
Escherichia coli
ASAL KOLOSTRUM SAPI
AMANDA THALITA PRIMA LIA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis sampaikan kepada Allah SWT atas berkat dan limpahan rahmat serta hidayah-Nya, penulis dapat menyelesaikan skripsi dengan judul “Evaluasi Morfologi Mikrokapsul Tersalut Alginat-Kitosan yang Mengandung IgG Anti-Escherichia coli Asal Kolostrum Sapi”.
Penulis mengucapkan terima kasih kepada bapak Bayu Febram Prasetyo MSi Apt selaku pembimbing pertama, ibu Dr drh Anita Esfandiari MSi selaku pembimbing kedua dan ibu Dr Drh Sri Murtini MSi yang senantiasa memberikan arahan, dorongan semangat, dan doa kepada penulis selama melaksanakan penelitian.
Penulis juga mengucapkan terima kasih tak terhingga untuk orang tua dan keluarga yang telah mendukung secara moril dan materil. Serta tak lupa untuk Dini Nurwahyuni (rekan sepenelitian dan mouster), Donny Artika, mouster (Shine dan Shovia), Intan Pandini, M. Zaenal Abidin Mursyid, Chillis (Nafisatul dan Riena) dan teman-teman Acromion 47 yang telah membantu penulis dalam menyusun skripsi ini. Penulis berharap skripsi ini dapat bermanfaat bagi perkembangan ilmu pengetahuan.
DAFTAR ISI
DAFTAR GAMBAR viii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
TINJAUAN PUSTAKA 2
Mikrokapsul 2
Kolostrum 3
Imunoglobulin Kolostrum Sapi 4
Escherichia coli 5
Diare 5
METODE 6
Bahan 6
Alat 6
Prosedur 7
HASIL DAN PEMBAHASAN 9
SIMPULAN DAN SARAN 11
Simpulan 11
Saran 11
DAFTAR PUSTAKA 11
DAFTAR GAMBAR
1 Bentuk mikrokapsul dengan dengan konsentrasi alginat-kolostrum 1:1 10 2 Fotomikrograf mikrokapsul blanko dan berisi IgG anti-E.coli 10
1
PENDAHULUAN
Latar Belakang
Anak sapi (pedet) yang baru lahir dilindungi oleh imunitas pasif yang berasal dari induk agar terhindar dari paparan faktor eksternal. Imunitas pasif yang berasal dari induk tergantung dari jenis plasenta yang dimiliki oleh masing-masing hewan. Plasenta sapi memiliki struktur yang terpisah antara aliran darah maternal dan fetus sehingga menyebabkan pedet terlahir tanpa immunoglobulin (Ig) atau agammaglobulinemia. Pedet sepenuhnya bergantung pada absorpsi kolostrum untuk memperoleh kekebalan yang cukup sehingga dapat terlindung dari organisme patogen sampai pedet mampu mensintesis pertahanan imunitas aktifnya sendiri, yaitu pada umur 3–4 minggu (Godden 2008).
Kolostrum adalah sekresi yang dihasilkan oleh kelenjar ambing mamalia pada tahap akhir kebuntingan sampai tiga hari setelah melahirkan, berwarna kekuningan dengan konsistensi kental (Tizard 2004). Kolostrum merupakan sumber imunoglobulin (antibodi) alami yang sangat besar . Menurut Esfandiari et al. (2004), fungsi kolostrum bagi hewan ruminansia adalah sebagai penyedia antibodi untuk kepentingan imunisasi pasif dari induk kepada anaknya yang baru lahir. Quigley et al. (2002) melaporkan bahwa kebutuhan kolostrum seringkali tidak terpenuhi dengan baik sehingga menyebabkan kegagalan transfer imunitas pasif pada pedet neonatus. Kondisi ini dapat menyebabkan terjadinya peningkatan level morbiditas dan mortalitas pada pedet.
Escherichia coli (E. coli) merupakan salah satu bakteri penyebab kolibasilosis pada pedet, terutama pada periode neonatal. Agen infeksius ini memiliki banyak serotipe, dan serotipe yang banyak terdapat di lapangan adalah Enterotoxigenic Escherichia coli (ETEC) K99, F41 atau K99F41. Escherichia coli K99 merupakan bakteri penting karena menyebabkan diare yang mematikan pada pedet. Prevalensi diare pada pedet sapi perah berkisar antara 20–31% dengan mortalitas 65–85%. Tingginya mortalitas pada pedet penderita diare sangat merugikan bagi peternak. Kerugian yang timbul karena penyakit ini tidak hanya berupa kematian, namun juga meningkatnya biaya pengobatan dan perawatan, penurunan berat badan serta terganggunya pertumbuhan (Supar 2001).
Hasil penelitian Esfandiari et al. (2007) menunjukkan bahwa imunoglobulin G (IgG) spesifik anti E. coli asal kolostrum berpotensi untuk dikembangkan di lapangan. Kolostrum sapi perah berpotensi sebagai pabrik biologis untuk memproduksi zat kebal terhadap berbagai macam penyakit untuk kepentingan hewan maupun manusia. Menurut Esfandiari et al. (2011), IgG pada kolostrum menunjukkan efektifitasnya melawan ETEC.
2
kerusakan karena pengaruh lingkungan saluran pencernaan, sehingga dapat menjalankan fungsinya secara efektif dan efisien.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi mikrokapsul yang mengandung IgG anti-E.coli asal kolostrum sapi tersalut alginat-kitosan melalui pengamatan morfologi mikrokapsul. Morfologi yang diamati meliputi bentuk, ukuran, dan keadaan permukaan mikrokapsul.
Manfaat Penelitian
Hasil dari penelitian ini diharapkan dapat memberikan informasi tentang morfologi mikrokapsul tersalut alginat-kitosan yang mengandung IgG anti-E.coli sehingga didapatkan gambaran tentang karakteristik mikrokapsul.
TINJAUAN PUSTAKA
Mikrokapsul
Mikrokapsul merupakan partikel kecil berbentuk bulat yang berisi senyawa aktif atau bahan inti yang dibungkus atau disalut oleh suatu lapisan (Jadupati et al. 2012). Enkapsulasi dibedakan menjadi dua, yaitu makroenkapsulasi dan mikroenkapsulasi. Kedua proses dibedakan berdasarkan ukuran kapsul yang dihasilkan (Uludag et al. 2000). Mikroenkapsulasi adalah suatu proses pelapisan/penyalutan partikel kecil dari zat padat atau zat cair maupun zat terdispersi menggunakan bahan polimer untuk menghasilkan suatu partikel kecil dengan ukuran berkisar antara 1–500 m (Sabitha et al. 2010). Beberapa jenis bahan yang dapat digunakan sebagai penyalut meliputi gum (gum arabic, sodium alginate, carrageenan), karbohidrat (pati, dextran, sukrosa), selulosa (carboxymethylcellulose, methycellulose), lipida (bees wax, stearic acid, phospholipids), dan protein (gelatin, albumin) (Jyothi et al. 2012).
3
memiliki kapasitas retensi rendah untuk proses enkapsulasi pada berat molekul yang rendah dan obat larut air.
Kitosan merupakan biopolimer polikationik yang tersusun dari unit berulang 2-amino-2-deoksi-D-glukopiranosa yang terhubung oleh ikatan β-(1,4). Kitosan berasal dari kitin dengan alkaline deacylation yang telah lama digunakan untuk memperkuat microsphere alginat yang didasari oleh interaksi elektrostatik antara karboksilat grup alginat dan grup kitosan (Xu et al. 2007).
Kitosan bersifat alami, biodegradabel, biokompatibel, dan tidak beracun bagi tubuh. Kitosan merupakan polimer bermuatan positif sehingga dapat membentuk ikatan silang dengan polimer anionik yaitu polimer yang bermuatan negatif diantaranya adalah alginat, karagenan, dan karboksimetil selulosa. Penggunaan sistem penyalut berganda alginat-kitosan dapat mengurangi porositas dan meningkatkan kestabilan kapsul yang dihasilkan (Silva et al. 2006). Chavarri et al. (2010) menyebutkan bahwa komplek alginat-kitosan dapat menurunkan porositas butiran alginat dan mengurangi kebocoran enkapsulasi dan selebihnya mampu bertahan stabil pada bebagai macam kondisi pH.
Mikrokapsul yang lebih efektif untuk mentranspor obat, dibuat dengan
menggunakan kombinasi antara alginat dan kitosan. Interaksi antara alginat dan kitosan membentuk polyelectrolyte complex melalui ikatan ionik. Polyelectrolyte complex yang terbentuk dari keduanya telah banyak digunakan sebagai media perantara untuk mengontrol pelepasan obat (Xu et al. 2007). Penyalutan mikrokapsul alginat dengan kitosan dapat meningkatkan stabilitas dari butiran alginat dan kemudian akan meningkatkan viabilitas dari organisme dalam mikrokapsul (Krasaekoopt et al. 2004). Matriks enkapsulasi dapat menyediakan penghalang fisik terhadap kondisi lingkungan yang ekstrim seperti pembekuan dan segala unsur yang ditemui selama melewati lambung (Champagne dan Kailasapathy 2008). Hal tersebut memungkinkan mikrokapsul dapat mencapai usus dan terjadi degradasi kitosan oleh mikroflora usus serta pelarutan gel alginat, dengan cara perombakan ion kalsium (Hejazi dan Amiji 2003).
Penelitian tentang enkapsulasi menggunakan bahan penyalut alginat-kitosan telah banyak dilakukan. Penelitian yang dilaporkan seperti obat-obatan anti-tuberkulosis rifampicin, isoniazide, dan pyrazinamide (Sabitha et al. 2010), ketoprofen (Sugita et al. 2010), dan kurkumin (Herdini et al. 2010). Enkapsulasi pada materi biologis pernah dilakukan terhadap hemoglobin (Silva et al. 2006) dan sel hidup seperti sel bakteri (Mandal et al. 2006) serta pulau-pulau Langerhans menggunakan polietilen glikol (Teramura dan Iwata 2009).
Kolostrum
4
Absorpsi imunoglobulin kolostrum hanya terjadi pada periode waktu yang singkat dan terbatas. Hilangnya kemampuan absorpsi, berhubungan dengan perkembangan saluran pencernaan pada sel-sel epitel intestinal dan penggantian populasi sel (Penchev 2008). Asupan kolostrum pada jam-jam pertama setelah kelahiran sangat penting untuk meningkatkan ketahanan spesifik dan non-spesifik pedet terhadap patogen berbahaya yang dapat menyebabkan gangguan pencernaan, pernapasan dan gangguan lain pada periode setelah lahir (Penchev 2008). Periode kolostrum menggambarkan waktu yang penting dari transfer imunitas pasif dari induk ke pedet neonatus sehingga hewan yang baru lahir mendapatkan perlindungan yang baik terhadap serangan penyakit (Zarcula et al. 2008).
Menurut Penchev (2008), konsentrasi maksimum IgG dalam kolostrum mencapai maksimum selama 24 jam dan kemudian akan berkurang pada hari ke-5 sampai ke-12 setelah induk partus. Imunoglobulin diserap oleh mukosa usus halus pedet neonatus dengan cara pinositosis dalam waktu yang singkat yaitu 8–12 jam setelah lahir. Belli (2009) menambahkan bahwa kemampuan permeabilitas pada mukosa usus pedet tersebut akan berkurang dan menjadi impermeable setelah jam ke-36. Suksesnya transfer imunitas pasif dapat diukur melalui konsentrasi IgG dalam serum pedet pada 24–48 jam setelah lahir.
Waktu penyerapan dari berbagai jenis imunoglobulin bervariasi pada pedet neonatus. Penyerapan IgG pada pedet neonatus akan berakhir setelah 27 jam, sedangkan IgA setelah 16 jam setelah lahir (Penchev 2008). Penurunan konsentrasi IgG kolostrum terjadi secara serempak, disebut sebagai periode intestinal closure, yang terjadi pada 24 jam atau 1 hari pertama setelah lahir (Belli 2009). Hal tersebut menunjukkan bahwa pemberian kolostrum pada 1 jam pertama setelah lahir kepada neonatus sangat penting, mengingat mukosa (epitel) usus akan menurun kemampuannya untuk mengabsorbsi IgG secara utuh seiring dengan bertambahnya umur pedet (Penchev 2008).
Salah satu hal yang membedakan kolostrum dengan susu sapi adalah tingginya kadar immunoglobulin dalam kolostrum. Kolostrum sapi mengandung komponen utama IgG, yang dapat digunakan sebagai indikator untuk menentukan kualitas kolostrum (Waterman 1998). Menurut Godden (2007), banyaknya kolostrum yang diperlukan oleh hewan neonatus tergantung dari kualitas kolostrum yang dikonsumsi. Kualitas imunoglobulin dalam kolostrum yang dihasilkan tergantung pada musim, ras sapi, umur induk, kesehatan kelenjar ambing, waktu pemerahan setelah partus, periode kering kandang dan kemampuan mengatasi infeksi oleh antigen (Jaster 2005).
Imunoglobulin Kolostrum Sapi
5
paling berlimpah di dalam sirkulasi darah adalah imunoglobulin gamma (IgG) (Kuby 2004). Kandungan IgG dalam kolostrum bervariasi antar-breed, dengan konsentrasi berkisar antara 18–92 mg/ml (Butler dan Kehrli 2005).
Imunoglobulin dalam kolostrum sapi terdiri dari tiga kelas utama yaitu IgG, IgM, dan IgA. Imunoglobulin utama di dalam kolostrum hewan domestik pada umumnya adalah IgG, berkisar antara 65–90% dari total antibodi, sedangkan kandungan IgA dan imunoglobulin lainnya hanya sedikit (Tizard 2004). Imunoglobulin G terdiri dari dua macam sub-kelas yaitu IgG1 dan IgG2. Jenis imunoglobulin terbanyak adalah IgG, terutama IgG1, yang mempunyai persentase sebesar 90% dari total imunoglobulin dalam kolostrum, dan sisanya IgG2 (Ontsuka et al. 2003). Imunoglobulin G1 merupakan antibodi utama yang berperan dalam pengaturan respon kekebalan sekunder dan terlibat dalam kekebalan pasif pada anak yang baru dilahirkan. Imunoglobulin G2 berperan dalam fiksasi komplemen, mediator sitokinisitas sel neutrofil PMN (polymorphonuclear) dan presipitasi antigen (Roitt et al. 1998).
Escherichia coli
Escherichia coli (E. coli) adalah spesies bakteri yang berasal dari genus Escherichia yang terdiri dari sebagian besar bakteri batang gram negatif yang motil dan tergabung dalam famili Enterobacteriaceae. Escherichia coli merupakan bakteri fakultatif anaerob yang banyak ditemukan sebagai flora alami dalam kolon manusia (Kaper et al. 2004). Bakteri E. coli dapat membentuk koloni pada saluran pencernaan manusia maupun hewan dalam beberapa jam setelah kelahiran. Faktor predisposisi pembentukan koloni meliputi rendahnya populasi mikroflora dalam tubuh, rendahnya kekebalan tubuh, faktor stres, pakan, dan infeksi agen patogen lain. Kebanyakan E. coli memiliki virulensi yang rendah dan bersifat oportunis (Songer dan Post 2005).
Strain E. coli patogen yang menyebabkan penyakit pada saluran pencernaan dibedakan menjadi enam golongan, yaitu Escherichia coli enterotoksigenik (ETEC), Escherichia coli enteroinvasif (EIEC), Escherichia coli enteropatogenik (EPEC), Escherichia coli enterohemorhagik (EHEC), Escherichia coli enteroagregatif (EAEC), dan diffusely adherent Escherichia coli (DAEC) (Kaper et al. 2004). Golongan ETEC merupakan penyebab diare
6
sapi, anak babi, dan anak domba. Mekanisme infeksi ETEC di dalam tubuh yaitu ETEC menempel pada sel enterosit melalui pili (fimbriae). Esherichia coli enterotoksigenik kemudian berproliferasi dan berkolonisasi pada mukosa usus sehingga terjadi peningkatan jumlah ETEC di dalam saluran pencernaan dan muncul lesio. Diare terjadi karena dinding usus mengalami kerusakan dan menghalangi reabsorbsi cairan (Biowey dan Weaver 2003).
Diare dibagi menjadi dua kategori, yaitu diare yang disebabkan oleh ketidakseimbangan nutrisi (non-infeksius) dan diare yang disebabkan oleh infeksi mikroorganisme (infeksius). Diare non-infeksius biasanya disebabkan akibat adanya perubahan yang mendadak dari program pemberian pakan. Diare infeksius disebabkan oleh infeksi virus, bakteri, dan protozoa. Oleh sebab itu, identifikasi terhadap sumber penyebab diare merupakan sebuah langkah penting dalam membuat program pencegahan diare. Beberapa bakteri yang berperan terhadap infeksi ini yaitu E. coli, Salmonella sp, dan Clostridium sp. Diare infeksius merupakan masalah yang sering terjadi, terutama pada sapi pedet. Menurut Priyadi dan Natalia (2005), dari anak sapi perah yang mengalami gejala diare, berhasil diisolasi kuman E. coli, coliform dan C. perfringens.
METODE
Waktu dan Tempat
Penelitian ini dilakukan di Laboratorium Bakteriologi, Balai Besar Penelitian Veteriner (BBALITVET) Bogor; Laboratorium Patologi Klinik Divisi Penyakit Dalam, Departemen Klinik, Reproduksi, dan Patologi FKH IPB; Laboratorium Terpadu FKH IPB; Laboratorium Reproduksi, Balai Penelitian Ternak (BALITNAK) Ciawi, Bogor; dan Laboratorium Mikroskopik, Lembaga Ilmu Pengetahuan Indonesia, Cibinong. Penelitian dilaksanakan selama enam bulan, mulai akhir bulan Maret sampai dengan akhir bulan September 2014.
Bahan
Bahan yang digunakan meliputi sampel kolostrum sapi, amonium sulfat, akuabides steril, buffer saline phosphate (PBS), larutan Bradfort, sodium alginat, kitosan, CaCl2, NaOH, akuades, Caccodylate buffer, larutan glutaraldehid 2,5%, tannic acid 2%, alkohol 50%, alkohol 70%, alkohol 95%, alkohol 85%, tert butanol, alkohol absolut (96%).
Alat
7
Prosedur
Preparasi dan Koleksi Kolostrum
Kolostrum yang digunakan berasal dari induk sapi Friesian Holstein (FH) yang divaksin pada saat bunting trimester akhir dengan vaksin E. coli polivalen yang berisi antigen O157 dan O9, 101, enterotoksigenik E. coli K99 dan F41 inaktif yang diemulsikan dalam alhidrogel. Kolostrum yang mengandung anti E. coli K-99 dikoleksi sesegera mungkin setelah induk sapi melahirkan (Esfandiari et al. 2008). Sampel kolostrum kemudian dipreparasi untuk pembuatan mikrokapsul kolostrum anti E. coli K-99.
Purifikasi Kolostrum
Presipitasi amonium sulfat merupakan metode yang sering digunakan untuk memurnikan antibodi dengan mengubah kelarutan dari serum atau hibridoma supernatan. Prinsip pengendapan amonium sulfat terletak pada salting out protein dari solusi (Grodzki dan Berenstein 2010).
Teknik purifikasi yang digunakan yaitu presipitasi garam (presipitasi dengan 40% amonium sulfat jenuh). Kolostrum yang mengandung anti-Escherichia coli masing-masing sebanyak 300 ml dihomogenkan dengan stirrer, kemudian ditambahkan amonium sulfat sedikit demi sedikit sebanyak 73 gr sampai mengental dan homogen. Setelah itu, sampel kolostrum disentrifus dengan kecepatan 5000 rpm pada suhu 4˚C selama 30 menit sampai terjadi pemisahan antara supernatan dan pelet. Supernatan dan pelet kolostrum dimasukkan ke dalam tabung yang berbeda dan diberi label. Pelet sampel kolostrum ditimbang sebanyak 25 gr lalu dilarutkan dalam 50 mL larutan PBS, dan dihomogenkan menggunakan vorteks sampai homogen. Setelah itu supernatan dan pelet disimpan di dalam lemari pendingin untuk selanjutnya dilakukan proses dialisis.
8
Pembuatan Mikrokapsul Tersalut Alginat-Kitosan
Pembuatan mikrokapsul dilakukan menggunakan metode ekstruksi, yaitu mencampurkan larutan hidrokoloid seperti alginat dengan suspensi IgG anti E. coli kemudian diekstruksi melalui jarum (nozzle) dalam bentuk butiran ke dalam larutan pengeras seperti kalsium klorida (Krasaekoopt et al. 2003). Mikrokapsul dibuat melalui beberapa persiapan, yaitu pembuatan mikrokapsul alginat-kitosan blanko dan dilanjutkan dengan pembuatan mikrokapsul alginat-kitosan yang berisi IgG anti E. coli.
Pembuatan Mikrokapsul Alginat-Kitosan Blanko
Larutan alginat 3% dicampur dengan aquades dengan perbandingan 1:1 (10 ml:10 ml) kemudian dihomogenkan menggunakan stirrer. Setelah larutan homogen, dilakukan proses pembuatan mikrokapsul menggunakan alat Microencapsulator BUCHI B-390® dengan ukuran nozzle 300, frekuensi 1000, elektroda 650 dan pressure 209–210 kemudian ditampung dengan larutan CaCl2 yang sudah dihomogenkan dengan stirrer agar butiran mikrokapsul tidak saling menempel satu sama lain. Butiran mikrokapsul tersebut dicuci dengan aquades sebanyak tiga kali pengulangan kemudian direndam dalam larutan kitosan 1% pH 4.0 dengan lama perendaman 30 (IgG anti E. coli 30 menit) dan 60 menit (IgG anti E. coli 60 menit). Pencucian dengan aquades dilakukan terhadap mikrokapsul yang telah tersalut kitosan sebanyak lima kali pengulangan, lalu disimpan di refrigerator dalam keadaan terendam aquades. Metode penyalutan dengan alginat dan kitosan pada penelitian ini menggunakan two step method (Areekul et al. 2006).
Pembuatan Mikrokapsul Alginat-Kitosan berisi IgG
Larutan IgG anti E. coli (hasil purifikasi) dicampurkan dengan larutan alginat 3% dengan perbandingan 1:1 (10 ml:10 ml) kemudian dihomogenkan menggunakan stirrer. Setelah larutan homogen, dilakukan proses pembuatan mikrokapsul menggunakan alat Microencapsulator BUCHI B-390® dengan ukuran nozzle 300, frekuensi 1000, elektroda 650 dan pressure 432. Tahap selanjutnya sama dengan metode pembuatan mikrokapsul blanko.
Pengamatan Morfologi Mikrokapsul
9
selama 20 menit dalam suhu ruang, perendaman dalam alkohol absolut selama 10 menit dengan dua kali pengulangan. Tahapan terakhir adalah pengeringan, dimana sampel direndam dalam tert butanol selama 10 menit sebanyak dua kali pengulangan. Sampel kemudian dibekukan dalam freezer sampai beku, selanjutnya sampel dimasukkan dalam freezed drier sampai benar-benar kering (Chavarri et al. 2010).
Setelah melalui tahapan preparasi, sampel sudah dalam keadaan kering dan siap untuk dilakukan pengamatan morfologi dengan SEM. Mikrokapsul dianalisis menggunakan SEM (JEOL JSM-5310LV). Sejumlah kecil mikrokapsul disebarkan diatas glass stub. Glass stub yang berisi mikrokapsul selanjutnya diletakkan pada chamber SEM dan dilapis (coating) dengan logam emas (Au) menggunakan sputter coater SC 502. Scanning electron photomicrograps dioperasikan dengan menggunakan tegangan akselerasi 20 Kv, tekanan chamber 0.01 mmHg dan pembesaran asli x600 (Sabitha et al. 2010).
HASIL DAN PEMBAHASAN
Pengembangan inovasi bentuk sediaan farmasi yang dapat menunda pelepasan obat merupakan teknologi baru yang masih dikembangkan dalam dunia farmasi, seperti teknologi penyalutan sediaan mikrokapsul (Chella et al. 2010). Pada penelitian ini telah dilakukan pembuatan mikrokapsul dengan menggunakan perbandingan konsentrasi alginat-IgG anti E. coli 1:1, 1:2 dan 2:1. Hasil terbaik didapatkan pada perbandingan 1:1.
Morfologi mikrokapsul dapat memberikan gambaran sifat aliran dan pelepasan zat aktif. Mikrokapsul yang banyak mengandung pori atau selaput polimer tipis akan lebih cepat terurai dalam tubuh, oleh karena itu struktur mikrokapsul dan keadaan permukaan kapsul penting untuk diketahui. Bentuk mikrokapsul dapat diamati dengan mikroskop sedangkan keadaan permukaan dan ukuran mikrokapsul dapat diamati dengan scanning electron microscope (SEM) (Apparao et al. 2010).
10
Gambar 1 Bentuk mikrokapsul dengan dengan konsentrasi alginat-kolostrum 1:1
Gambar 2 Fotomikrograf mikrokapsul blanko (kiri) dan berisi IgG anti E. coli (kanan)
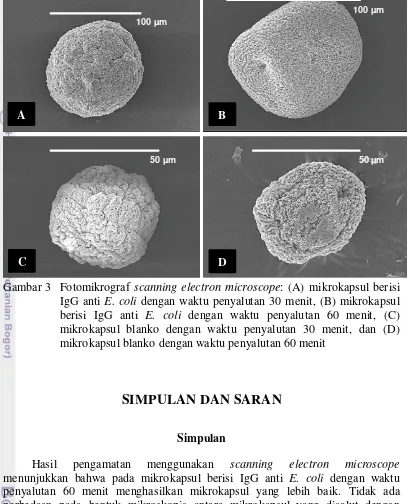
Ukuran butiran mikrokapsul yang dihasilkan tergantung pada diameter nozzle dan jarak jatuhnya droplet pada larutan CaCl2 (Krasaekoopt et al. 2003). Ukuran mikrokapsul blanko dengan waktu penyalutan 30 menit dan 60 menit yaitu 50 mikron sedangkan untuk mikrokapsul berisi IgG anti E. coli sebesar 100 mikron (Gambar 3). Ukuran mikrokapsul blanko lebih kecil karena dalam rongga inti kosong, tidak mengandung IgG anti E. coli (tidak bermateri).
11
Gambar 3 Fotomikrograf scanning electron microscope: (A) mikrokapsul berisi IgG anti E. coli dengan waktu penyalutan 30 menit, (B) mikrokapsul berisi IgG anti E. coli dengan waktu penyalutan 60 menit, (C) mikrokapsul blanko dengan waktu penyalutan 30 menit, dan (D) mikrokapsul blanko dengan waktu penyalutan 60 menit
SIMPULAN DAN SARAN
Simpulan
Hasil pengamatan menggunakan scanning electron microscope menunjukkan bahwa pada mikrokapsul berisi IgG anti E. coli dengan waktu penyalutan 60 menit menghasilkan mikrokapsul yang lebih baik. Tidak ada perbedaan pada bentuk mikroskopis antara mikrokapsul yang disalut dengan larutan kitosan 1% selama 30 dan 60 menit. Mikrokapsul berisi IgG anti E. coli dengan waktu penyalutan 60 menit menghasilkan permukaan mikrokapsul yang lebih baik dibandingan dengan waktu penyalutan 30 menit.
Saran
Perlu dilakukan evaluasi lebih lanjut terhadap lamanya waktu penyalutan mikrokapsul, dan evaluasi terhadap mikrokapsul dengan parameter kemampuan disolusi mikrokapsul, stabilitas mikrokapsul, dan dosis pemberian.
100 µm
100 µm
50 µm 50 µm
A B
12
DAFTAR PUSTAKA
Apparao B, Shivalingam M, Reddy YK, Sunitha N, Jyothibasu T, Shyam T. 2010. Design and evaluation of sustain release microcapsule containing diclofenac sodium. Int J of Pharm and Biomed Research 1(3):90–93.
Areekul W, Kruenate J, Prahsarn C. 2006. Preparation and in vitro of mucoadhesive properties of alginate/chitosan microparticles containing prednisolone. Int J Pharm. 312 (1-2): 113–118.
Belli H. 2009. Peran kolostrum dalam transfer imunitas pasif pada anak sapi baru lahir. Wartazoa. 19(2): 76–83.
Biowey RW, Weaver AD. 2003. Color Atlas of Diseases and Disorders of Cattle
2nd Ed. USA (US): Eisevier Limited.
Blum JW, Hammon H. 2000. Colostrum effect on the gastrointestinal tract and on nutritional, endocrine and metabolic parameter in neonatal calves. Livestock Prod Sci. 66: 151–159.
Butler JE, Kehrli ME Jr. 2005. Immunoglobulins and immunocytes in the mammary gland and its secretions. Di dalam: Mestecky J, Lamm M, Strober W, Bienenstock J, McGhee JR, Mayer L. Mucosal Immunology 3rd ed. Burlington (US): Elsevier Academic Press. Vol 2 hlm 1764–1793.
Champagne CP, Kailasapathy K. 2008. Controlled Release Technologies for Targeted Nutrition. Cambridge (UK): Woodhead Publishing CRC Press. pp: 344–369.
Chavarri M, Izaskun M, Raquel A, Francisco CI, Florencio M, Maria DCV. 2010. Microencapsulation of a probiotic and prebiotic in alginate-chitosan capsule improves survival in simulated gastro-intestinal conditions. J of Food Microbiol. 142:185–189.
Chella N, Yada KK, Vempati R. 2010. Preparation and evaluation of ethyl cellulose microspheres containing diclofenac sodium by novel W/O/O emulsion method. J of pharm sci and research. 2(12):884–888.
Esfandiari A, Widhyari SD, Hujarat A. 2011. Diare pada sapi neonatus yang ditantang escherichia coli k-99. JIPI 16 (3)
Esfandiari A, Widhyari SD, Wibawan IWT, Murtini S, Febram. 2008. Produksi kolostrum antivirus avian influenza dalam rangka pengendalian infeksi virus flu burung. JIPI 13(2):69–79.
Esfandiari A, Widhyari SD, Wibawan IWT, Sajuthi D, Sutama
IK. 2004.
Pemanfaatan keterlimpahan kolostrum sapi sebagai sumber imunoglobulin pengganti dalam rangka transfer kekebalan pasif pada anak kambing neonatus. Laporan Penelitian Hibah Bersaing X1/2. Lembaga Penelitian dan Pemberdayaan Masyarakat, Bogor (ID). lnstitut Pertanian Bogor.Esfandiari A, Widhyari SD, Wibawan IWT, Sajuthi D, Sutama IK. 2007. Produksi kolostrum anti enteropatogen spesifik dalam rangka imunoterapi pasif guna mencegah kematian neonatal akibat diare .Laporan Penelitian Hibah Bersaing Lembaga Penelitian dan Pemberdayaan Masyarakat, Bogor (ID). lnstitut Pertanian Bogor.
13
Godden S. 2007. Colostrum management for dairy calves [internet]. [diunduh pada 2014 Okt 02].Tersedia pada: http://www.hint.no/calfmanagement/ foredrag/Proceedings_Calf_ Management.pdf
Godden S. 2008.Colostrum Management For Dairy Calves. J Vet Clin North Am Food Anim Pract. 24: 19–39
Gombotz WR, Wee SF. 1998. Protein release from alginate matrices. Adv Drug Deliv Rev. 31:267–85
Grodzki AC, Berenstein E. 2010. Antibody purification: ammonium sulphate fractionation or gel filtration [internet].[diunduh pada 2014 Sept 25]. Tersedia pada: http://www.ncbi.nlm.nih.gov/pubmed/20012814
Hanif SK, Sumiarto B, Budiharta S. 2003. Prevalensi dan analisis faktor-faktor infeksi escherichia coli pada peternakan sapi perah rakyat di kabupaten sleman. J Sain Vet. 21: 50–54.
Hejazi R, Amiji M, 2003. Chitosan-based gastrointestinal delivery systems. J Controlled Release. 89:151–165.
Herdini, Darusman LK, Sugita P. 2010. Disolusi mikroenkapsulasi kurkumin tersalut gel kitosan-alginat-glutaraldehida. Makara 14: 57–62.
Jadupati M, Tanmay D, Souvik G. 2012. Microencapsulation: an indispensable technology for drug delivery system. IRJP. 3(4): 8–13.
Jaster EH. 2005. Evaluation of quality, quantity and timing of colostrum feeding on immunoglobulin G1absorption in Jersey calves. J Dairy Sci .88: 296– 302.
Jyothi SS, Seethadevi A, Prabha KS, Muthuprasanna P, Pavita P. 2012. Microencapsulation: a review. IJPBS. 3(1):509–531.
Kaper JB, Nataro JP, Mobley HL. 2004. Pathogenic escherichia coli. Nat Rev Microbiol. 2:123–140.
Kovacs-Nolan J, Phillips M, Mine Y. 2005. Advances in the value of eggs and egg component for human health. J Agricult and Food Chem. 53: 8421–8431. Krasaekoopt W, Bhandari B, Deeth H. 2003. Evaluation of encapsulation
techniques of probiotics for yoghurt. Int Dairy J. 3:3–13
Krasaekoopt W, Bhandari B, Deeth H. 2004. The influence of coating materials on some properties of alginate beads and survivability of microencapsulated probiotic bacteria. Int Dairy J. 14: 737–743.
Kuby J. 2004. Immunology 10th Ed. New York (US): WH Freeman.
Lazzaro J. 2000. Colostrum/supplementing colostrum. [internet]. [diunduh pada 2014 Juni 5]. Tersedia pada: http//wichway@saanendoah. com.
Mandal S, Puniya AK, Singh K. 2006. Effect of alginate concentrations on survival of microencapsulated lactobacillus casei ncdc-298. Int Dairy J. 16:1190–1195.
Marliasih PH. 2011. Pembuatan dan Karakterisasi Mikrokapsul Natrium Diklofenak menggunakan HPMCP HP-55 dan Eudragit L 100-55 sebagai sediaan lepas tunda [skripsi]. Jakarta (ID): Universitas Indonesia.
Ontsouka CE, Bruckmaier RM, Blum JW. 2003. Fractionized milk composi- tion during removal of colostrum and mature milk. J of Dairy Scien. 86: 2005–2011. Penchev G. 2008. Differences in chemical composition between cow colostrum
and milk. Bulg J Vet Med. 11(1):3−12.
14
Peternakan dan Veteriner 2005. Tersedia pada: http//peternakan.litbang.deptan.go.id
Quigley JD, Kost CJ, Wolfe TM. 2002. Absorption of protein and IgG in calves fed a colostrum supplement or replacer. J. Dairy Sci. 85:1243–1248.
Roitt IM, Brosstoff J, Male DK. 1998. Immunology. 5th Ed. London (UK): Mosby International Ltd.
Sabitha P, Vijaya RJ, Ravindra RK. 2010. Desain and evaluation of controled release chitosan-calsium alginate microcapsule of anti tubercular drugs for oral use. Int J of Chem Tech Research. 2(1): 88–98.
Sæther HV, Hilde K. Holme HK, Maurstad G, Smidsrod O, Stokke BT. 2008. Polyelectrolyte complex formation pusing alginate and chitosan. Carb Polym J. 74:813–821.
Silva CM, Riberio AJ, Figueiredo M, Ferreira D, Veiga F. 2006. Microencapsulation of hemoglobin in chitosan-coated alginate microspheres prepared by emulsification/internal gelation. AAPS J. 7: 903–912.
Songer JG, Post KW. 2005. Veterinary Microbiologi. Bacterial and Fungal Agent of Animal Disease. USA (US) : Elsevier Saunders.
Sugita P, Napthaleni, Kurniati M, Wukirsari T. 2010. Enkapsulasi ketoprofen dengan kitosan-alginat berdasarkan jenis dan ragam konsentrasi tween 80 dan span 80. Makara 14(2):107–112.
Supar. 2001. Pemberdayaan plasma nutfah mikroba veteriner dalam pengembangan peternakan: harapan vaksin Escherichia coli enterotoksigenik, enteropatogenik dan verotoksigenik isolate local untuk pengendalian kolibasilosis neonatal pada anak sapi dan babi. Wartazoa. 11:36–43.
Teramura Y, Iwata H. 2009. Islet encapsulation with living cells for improvementof biocompatibility. Biomaterials. 30:2270–2275.
Tizard IR. 2004. Veterinary Immunology an Introduction. 7th Ed. USA (US): Saunders.
Uludag H, De Vos P, Tresco PA. 2000. Technology of mammalian All encapsulation. Advance Drug Delivery. 42:29–64.
Waterman D. 1998. Colostrum: The Begining of a Successful Calf Raising Program. [internet] [diunduh pada 2014 Juni 5]. Tersedia pada: http//www.1noormans.com/dairy/dairyff/dairymar98/colostrum.
Wong TW, Chan LW, Kho SB, Heng PWS. 2003. Design of controlled release solid dosage forms of alginate and chitosan using microwave. J Contr Release. 84:99–114.
Xu Y, Zhan C, Fan L, Wang L, Zheng H. 2007. Preparation of dual cross-linked alginate-chitosan blend with gel beads and in vitro controlled release in oral site specific drug delivery system. J Int Pharm. 329–336.
15
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta tanggal 06 Juni 1991. Penulis merupakan putri sulung dari empat bersaudara pasangan Bambang Suhardiman dan Titiek Retno Dwiningsih.
Penulis menempuh pendidikan sekolah dasar di SD Negeri Serayu 1 Yogyakarta pada tahun 1998-2003. Pada tahun 2003-2006 melanjutkan pendidikannya di sekolah menengah pertama SMP Negeri 214 Jakarta. Penulis melanjutkan pendidikannya di sekolah menengah atas Venkateshwar International School New Delhi, India, kemudian di SMA Negeri 39 Jakarta. Penulis diterima di Institut Pertanian Bogor pada tahun 2010 melalui jalur Undangan Seleksi Masuk IPB (USMI).
1
PENDAHULUAN
Latar Belakang
Anak sapi (pedet) yang baru lahir dilindungi oleh imunitas pasif yang berasal dari induk agar terhindar dari paparan faktor eksternal. Imunitas pasif yang berasal dari induk tergantung dari jenis plasenta yang dimiliki oleh masing-masing hewan. Plasenta sapi memiliki struktur yang terpisah antara aliran darah maternal dan fetus sehingga menyebabkan pedet terlahir tanpa immunoglobulin (Ig) atau agammaglobulinemia. Pedet sepenuhnya bergantung pada absorpsi kolostrum untuk memperoleh kekebalan yang cukup sehingga dapat terlindung dari organisme patogen sampai pedet mampu mensintesis pertahanan imunitas aktifnya sendiri, yaitu pada umur 3–4 minggu (Godden 2008).
Kolostrum adalah sekresi yang dihasilkan oleh kelenjar ambing mamalia pada tahap akhir kebuntingan sampai tiga hari setelah melahirkan, berwarna kekuningan dengan konsistensi kental (Tizard 2004). Kolostrum merupakan sumber imunoglobulin (antibodi) alami yang sangat besar . Menurut Esfandiari et al. (2004), fungsi kolostrum bagi hewan ruminansia adalah sebagai penyedia antibodi untuk kepentingan imunisasi pasif dari induk kepada anaknya yang baru lahir. Quigley et al. (2002) melaporkan bahwa kebutuhan kolostrum seringkali tidak terpenuhi dengan baik sehingga menyebabkan kegagalan transfer imunitas pasif pada pedet neonatus. Kondisi ini dapat menyebabkan terjadinya peningkatan level morbiditas dan mortalitas pada pedet.
Escherichia coli (E. coli) merupakan salah satu bakteri penyebab kolibasilosis pada pedet, terutama pada periode neonatal. Agen infeksius ini memiliki banyak serotipe, dan serotipe yang banyak terdapat di lapangan adalah Enterotoxigenic Escherichia coli (ETEC) K99, F41 atau K99F41. Escherichia coli K99 merupakan bakteri penting karena menyebabkan diare yang mematikan pada pedet. Prevalensi diare pada pedet sapi perah berkisar antara 20–31% dengan mortalitas 65–85%. Tingginya mortalitas pada pedet penderita diare sangat merugikan bagi peternak. Kerugian yang timbul karena penyakit ini tidak hanya berupa kematian, namun juga meningkatnya biaya pengobatan dan perawatan, penurunan berat badan serta terganggunya pertumbuhan (Supar 2001).
Hasil penelitian Esfandiari et al. (2007) menunjukkan bahwa imunoglobulin G (IgG) spesifik anti E. coli asal kolostrum berpotensi untuk dikembangkan di lapangan. Kolostrum sapi perah berpotensi sebagai pabrik biologis untuk memproduksi zat kebal terhadap berbagai macam penyakit untuk kepentingan hewan maupun manusia. Menurut Esfandiari et al. (2011), IgG pada kolostrum menunjukkan efektifitasnya melawan ETEC.
2
kerusakan karena pengaruh lingkungan saluran pencernaan, sehingga dapat menjalankan fungsinya secara efektif dan efisien.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi mikrokapsul yang mengandung IgG anti-E.coli asal kolostrum sapi tersalut alginat-kitosan melalui pengamatan morfologi mikrokapsul. Morfologi yang diamati meliputi bentuk, ukuran, dan keadaan permukaan mikrokapsul.
Manfaat Penelitian
Hasil dari penelitian ini diharapkan dapat memberikan informasi tentang morfologi mikrokapsul tersalut alginat-kitosan yang mengandung IgG anti-E.coli sehingga didapatkan gambaran tentang karakteristik mikrokapsul.
TINJAUAN PUSTAKA
Mikrokapsul
Mikrokapsul merupakan partikel kecil berbentuk bulat yang berisi senyawa aktif atau bahan inti yang dibungkus atau disalut oleh suatu lapisan (Jadupati et al. 2012). Enkapsulasi dibedakan menjadi dua, yaitu makroenkapsulasi dan mikroenkapsulasi. Kedua proses dibedakan berdasarkan ukuran kapsul yang dihasilkan (Uludag et al. 2000). Mikroenkapsulasi adalah suatu proses pelapisan/penyalutan partikel kecil dari zat padat atau zat cair maupun zat terdispersi menggunakan bahan polimer untuk menghasilkan suatu partikel kecil dengan ukuran berkisar antara 1–500 m (Sabitha et al. 2010). Beberapa jenis bahan yang dapat digunakan sebagai penyalut meliputi gum (gum arabic, sodium alginate, carrageenan), karbohidrat (pati, dextran, sukrosa), selulosa (carboxymethylcellulose, methycellulose), lipida (bees wax, stearic acid, phospholipids), dan protein (gelatin, albumin) (Jyothi et al. 2012).
2
kerusakan karena pengaruh lingkungan saluran pencernaan, sehingga dapat menjalankan fungsinya secara efektif dan efisien.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi mikrokapsul yang mengandung IgG anti-E.coli asal kolostrum sapi tersalut alginat-kitosan melalui pengamatan morfologi mikrokapsul. Morfologi yang diamati meliputi bentuk, ukuran, dan keadaan permukaan mikrokapsul.
Manfaat Penelitian
Hasil dari penelitian ini diharapkan dapat memberikan informasi tentang morfologi mikrokapsul tersalut alginat-kitosan yang mengandung IgG anti-E.coli sehingga didapatkan gambaran tentang karakteristik mikrokapsul.
TINJAUAN PUSTAKA
Mikrokapsul
Mikrokapsul merupakan partikel kecil berbentuk bulat yang berisi senyawa aktif atau bahan inti yang dibungkus atau disalut oleh suatu lapisan (Jadupati et al. 2012). Enkapsulasi dibedakan menjadi dua, yaitu makroenkapsulasi dan mikroenkapsulasi. Kedua proses dibedakan berdasarkan ukuran kapsul yang dihasilkan (Uludag et al. 2000). Mikroenkapsulasi adalah suatu proses pelapisan/penyalutan partikel kecil dari zat padat atau zat cair maupun zat terdispersi menggunakan bahan polimer untuk menghasilkan suatu partikel kecil dengan ukuran berkisar antara 1–500 m (Sabitha et al. 2010). Beberapa jenis bahan yang dapat digunakan sebagai penyalut meliputi gum (gum arabic, sodium alginate, carrageenan), karbohidrat (pati, dextran, sukrosa), selulosa (carboxymethylcellulose, methycellulose), lipida (bees wax, stearic acid, phospholipids), dan protein (gelatin, albumin) (Jyothi et al. 2012).
3
memiliki kapasitas retensi rendah untuk proses enkapsulasi pada berat molekul yang rendah dan obat larut air.
Kitosan merupakan biopolimer polikationik yang tersusun dari unit berulang 2-amino-2-deoksi-D-glukopiranosa yang terhubung oleh ikatan β-(1,4). Kitosan berasal dari kitin dengan alkaline deacylation yang telah lama digunakan untuk memperkuat microsphere alginat yang didasari oleh interaksi elektrostatik antara karboksilat grup alginat dan grup kitosan (Xu et al. 2007).
Kitosan bersifat alami, biodegradabel, biokompatibel, dan tidak beracun bagi tubuh. Kitosan merupakan polimer bermuatan positif sehingga dapat membentuk ikatan silang dengan polimer anionik yaitu polimer yang bermuatan negatif diantaranya adalah alginat, karagenan, dan karboksimetil selulosa. Penggunaan sistem penyalut berganda alginat-kitosan dapat mengurangi porositas dan meningkatkan kestabilan kapsul yang dihasilkan (Silva et al. 2006). Chavarri et al. (2010) menyebutkan bahwa komplek alginat-kitosan dapat menurunkan porositas butiran alginat dan mengurangi kebocoran enkapsulasi dan selebihnya mampu bertahan stabil pada bebagai macam kondisi pH.
Mikrokapsul yang lebih efektif untuk mentranspor obat, dibuat dengan
menggunakan kombinasi antara alginat dan kitosan. Interaksi antara alginat dan kitosan membentuk polyelectrolyte complex melalui ikatan ionik. Polyelectrolyte complex yang terbentuk dari keduanya telah banyak digunakan sebagai media perantara untuk mengontrol pelepasan obat (Xu et al. 2007). Penyalutan mikrokapsul alginat dengan kitosan dapat meningkatkan stabilitas dari butiran alginat dan kemudian akan meningkatkan viabilitas dari organisme dalam mikrokapsul (Krasaekoopt et al. 2004). Matriks enkapsulasi dapat menyediakan penghalang fisik terhadap kondisi lingkungan yang ekstrim seperti pembekuan dan segala unsur yang ditemui selama melewati lambung (Champagne dan Kailasapathy 2008). Hal tersebut memungkinkan mikrokapsul dapat mencapai usus dan terjadi degradasi kitosan oleh mikroflora usus serta pelarutan gel alginat, dengan cara perombakan ion kalsium (Hejazi dan Amiji 2003).
Penelitian tentang enkapsulasi menggunakan bahan penyalut alginat-kitosan telah banyak dilakukan. Penelitian yang dilaporkan seperti obat-obatan anti-tuberkulosis rifampicin, isoniazide, dan pyrazinamide (Sabitha et al. 2010), ketoprofen (Sugita et al. 2010), dan kurkumin (Herdini et al. 2010). Enkapsulasi pada materi biologis pernah dilakukan terhadap hemoglobin (Silva et al. 2006) dan sel hidup seperti sel bakteri (Mandal et al. 2006) serta pulau-pulau Langerhans menggunakan polietilen glikol (Teramura dan Iwata 2009).
Kolostrum
4
Absorpsi imunoglobulin kolostrum hanya terjadi pada periode waktu yang singkat dan terbatas. Hilangnya kemampuan absorpsi, berhubungan dengan perkembangan saluran pencernaan pada sel-sel epitel intestinal dan penggantian populasi sel (Penchev 2008). Asupan kolostrum pada jam-jam pertama setelah kelahiran sangat penting untuk meningkatkan ketahanan spesifik dan non-spesifik pedet terhadap patogen berbahaya yang dapat menyebabkan gangguan pencernaan, pernapasan dan gangguan lain pada periode setelah lahir (Penchev 2008). Periode kolostrum menggambarkan waktu yang penting dari transfer imunitas pasif dari induk ke pedet neonatus sehingga hewan yang baru lahir mendapatkan perlindungan yang baik terhadap serangan penyakit (Zarcula et al. 2008).
Menurut Penchev (2008), konsentrasi maksimum IgG dalam kolostrum mencapai maksimum selama 24 jam dan kemudian akan berkurang pada hari ke-5 sampai ke-12 setelah induk partus. Imunoglobulin diserap oleh mukosa usus halus pedet neonatus dengan cara pinositosis dalam waktu yang singkat yaitu 8–12 jam setelah lahir. Belli (2009) menambahkan bahwa kemampuan permeabilitas pada mukosa usus pedet tersebut akan berkurang dan menjadi impermeable setelah jam ke-36. Suksesnya transfer imunitas pasif dapat diukur melalui konsentrasi IgG dalam serum pedet pada 24–48 jam setelah lahir.
Waktu penyerapan dari berbagai jenis imunoglobulin bervariasi pada pedet neonatus. Penyerapan IgG pada pedet neonatus akan berakhir setelah 27 jam, sedangkan IgA setelah 16 jam setelah lahir (Penchev 2008). Penurunan konsentrasi IgG kolostrum terjadi secara serempak, disebut sebagai periode intestinal closure, yang terjadi pada 24 jam atau 1 hari pertama setelah lahir (Belli 2009). Hal tersebut menunjukkan bahwa pemberian kolostrum pada 1 jam pertama setelah lahir kepada neonatus sangat penting, mengingat mukosa (epitel) usus akan menurun kemampuannya untuk mengabsorbsi IgG secara utuh seiring dengan bertambahnya umur pedet (Penchev 2008).
Salah satu hal yang membedakan kolostrum dengan susu sapi adalah tingginya kadar immunoglobulin dalam kolostrum. Kolostrum sapi mengandung komponen utama IgG, yang dapat digunakan sebagai indikator untuk menentukan kualitas kolostrum (Waterman 1998). Menurut Godden (2007), banyaknya kolostrum yang diperlukan oleh hewan neonatus tergantung dari kualitas kolostrum yang dikonsumsi. Kualitas imunoglobulin dalam kolostrum yang dihasilkan tergantung pada musim, ras sapi, umur induk, kesehatan kelenjar ambing, waktu pemerahan setelah partus, periode kering kandang dan kemampuan mengatasi infeksi oleh antigen (Jaster 2005).
Imunoglobulin Kolostrum Sapi
5
paling berlimpah di dalam sirkulasi darah adalah imunoglobulin gamma (IgG) (Kuby 2004). Kandungan IgG dalam kolostrum bervariasi antar-breed, dengan konsentrasi berkisar antara 18–92 mg/ml (Butler dan Kehrli 2005).
Imunoglobulin dalam kolostrum sapi terdiri dari tiga kelas utama yaitu IgG, IgM, dan IgA. Imunoglobulin utama di dalam kolostrum hewan domestik pada umumnya adalah IgG, berkisar antara 65–90% dari total antibodi, sedangkan kandungan IgA dan imunoglobulin lainnya hanya sedikit (Tizard 2004). Imunoglobulin G terdiri dari dua macam sub-kelas yaitu IgG1 dan IgG2. Jenis imunoglobulin terbanyak adalah IgG, terutama IgG1, yang mempunyai persentase sebesar 90% dari total imunoglobulin dalam kolostrum, dan sisanya IgG2 (Ontsuka et al. 2003). Imunoglobulin G1 merupakan antibodi utama yang berperan dalam pengaturan respon kekebalan sekunder dan terlibat dalam kekebalan pasif pada anak yang baru dilahirkan. Imunoglobulin G2 berperan dalam fiksasi komplemen, mediator sitokinisitas sel neutrofil PMN (polymorphonuclear) dan presipitasi antigen (Roitt et al. 1998).
Escherichia coli
Escherichia coli (E. coli) adalah spesies bakteri yang berasal dari genus Escherichia yang terdiri dari sebagian besar bakteri batang gram negatif yang motil dan tergabung dalam famili Enterobacteriaceae. Escherichia coli merupakan bakteri fakultatif anaerob yang banyak ditemukan sebagai flora alami dalam kolon manusia (Kaper et al. 2004). Bakteri E. coli dapat membentuk koloni pada saluran pencernaan manusia maupun hewan dalam beberapa jam setelah kelahiran. Faktor predisposisi pembentukan koloni meliputi rendahnya populasi mikroflora dalam tubuh, rendahnya kekebalan tubuh, faktor stres, pakan, dan infeksi agen patogen lain. Kebanyakan E. coli memiliki virulensi yang rendah dan bersifat oportunis (Songer dan Post 2005).
Strain E. coli patogen yang menyebabkan penyakit pada saluran pencernaan dibedakan menjadi enam golongan, yaitu Escherichia coli enterotoksigenik (ETEC), Escherichia coli enteroinvasif (EIEC), Escherichia coli enteropatogenik (EPEC), Escherichia coli enterohemorhagik (EHEC), Escherichia coli enteroagregatif (EAEC), dan diffusely adherent Escherichia coli (DAEC) (Kaper et al. 2004). Golongan ETEC merupakan penyebab diare
6
sapi, anak babi, dan anak domba. Mekanisme infeksi ETEC di dalam tubuh yaitu ETEC menempel pada sel enterosit melalui pili (fimbriae). Esherichia coli enterotoksigenik kemudian berproliferasi dan berkolonisasi pada mukosa usus sehingga terjadi peningkatan jumlah ETEC di dalam saluran pencernaan dan muncul lesio. Diare terjadi karena dinding usus mengalami kerusakan dan menghalangi reabsorbsi cairan (Biowey dan Weaver 2003).
Diare dibagi menjadi dua kategori, yaitu diare yang disebabkan oleh ketidakseimbangan nutrisi (non-infeksius) dan diare yang disebabkan oleh infeksi mikroorganisme (infeksius). Diare non-infeksius biasanya disebabkan akibat adanya perubahan yang mendadak dari program pemberian pakan. Diare infeksius disebabkan oleh infeksi virus, bakteri, dan protozoa. Oleh sebab itu, identifikasi terhadap sumber penyebab diare merupakan sebuah langkah penting dalam membuat program pencegahan diare. Beberapa bakteri yang berperan terhadap infeksi ini yaitu E. coli, Salmonella sp, dan Clostridium sp. Diare infeksius merupakan masalah yang sering terjadi, terutama pada sapi pedet. Menurut Priyadi dan Natalia (2005), dari anak sapi perah yang mengalami gejala diare, berhasil diisolasi kuman E. coli, coliform dan C. perfringens.
METODE
Waktu dan Tempat
Penelitian ini dilakukan di Laboratorium Bakteriologi, Balai Besar Penelitian Veteriner (BBALITVET) Bogor; Laboratorium Patologi Klinik Divisi Penyakit Dalam, Departemen Klinik, Reproduksi, dan Patologi FKH IPB; Laboratorium Terpadu FKH IPB; Laboratorium Reproduksi, Balai Penelitian Ternak (BALITNAK) Ciawi, Bogor; dan Laboratorium Mikroskopik, Lembaga Ilmu Pengetahuan Indonesia, Cibinong. Penelitian dilaksanakan selama enam bulan, mulai akhir bulan Maret sampai dengan akhir bulan September 2014.
Bahan
Bahan yang digunakan meliputi sampel kolostrum sapi, amonium sulfat, akuabides steril, buffer saline phosphate (PBS), larutan Bradfort, sodium alginat, kitosan, CaCl2, NaOH, akuades, Caccodylate buffer, larutan glutaraldehid 2,5%, tannic acid 2%, alkohol 50%, alkohol 70%, alkohol 95%, alkohol 85%, tert butanol, alkohol absolut (96%).
Alat
6
sapi, anak babi, dan anak domba. Mekanisme infeksi ETEC di dalam tubuh yaitu ETEC menempel pada sel enterosit melalui pili (fimbriae). Esherichia coli enterotoksigenik kemudian berproliferasi dan berkolonisasi pada mukosa usus sehingga terjadi peningkatan jumlah ETEC di dalam saluran pencernaan dan muncul lesio. Diare terjadi karena dinding usus mengalami kerusakan dan menghalangi reabsorbsi cairan (Biowey dan Weaver 2003).
Diare dibagi menjadi dua kategori, yaitu diare yang disebabkan oleh ketidakseimbangan nutrisi (non-infeksius) dan diare yang disebabkan oleh infeksi mikroorganisme (infeksius). Diare non-infeksius biasanya disebabkan akibat adanya perubahan yang mendadak dari program pemberian pakan. Diare infeksius disebabkan oleh infeksi virus, bakteri, dan protozoa. Oleh sebab itu, identifikasi terhadap sumber penyebab diare merupakan sebuah langkah penting dalam membuat program pencegahan diare. Beberapa bakteri yang berperan terhadap infeksi ini yaitu E. coli, Salmonella sp, dan Clostridium sp. Diare infeksius merupakan masalah yang sering terjadi, terutama pada sapi pedet. Menurut Priyadi dan Natalia (2005), dari anak sapi perah yang mengalami gejala diare, berhasil diisolasi kuman E. coli, coliform dan C. perfringens.
METODE
Waktu dan Tempat
Penelitian ini dilakukan di Laboratorium Bakteriologi, Balai Besar Penelitian Veteriner (BBALITVET) Bogor; Laboratorium Patologi Klinik Divisi Penyakit Dalam, Departemen Klinik, Reproduksi, dan Patologi FKH IPB; Laboratorium Terpadu FKH IPB; Laboratorium Reproduksi, Balai Penelitian Ternak (BALITNAK) Ciawi, Bogor; dan Laboratorium Mikroskopik, Lembaga Ilmu Pengetahuan Indonesia, Cibinong. Penelitian dilaksanakan selama enam bulan, mulai akhir bulan Maret sampai dengan akhir bulan September 2014.
Bahan
Bahan yang digunakan meliputi sampel kolostrum sapi, amonium sulfat, akuabides steril, buffer saline phosphate (PBS), larutan Bradfort, sodium alginat, kitosan, CaCl2, NaOH, akuades, Caccodylate buffer, larutan glutaraldehid 2,5%, tannic acid 2%, alkohol 50%, alkohol 70%, alkohol 95%, alkohol 85%, tert butanol, alkohol absolut (96%).
Alat
7
Prosedur
Preparasi dan Koleksi Kolostrum
Kolostrum yang digunakan berasal dari induk sapi Friesian Holstein (FH) yang divaksin pada saat bunting trimester akhir dengan vaksin E. coli polivalen yang berisi antigen O157 dan O9, 101, enterotoksigenik E. coli K99 dan F41 inaktif yang diemulsikan dalam alhidrogel. Kolostrum yang mengandung anti E. coli K-99 dikoleksi sesegera mungkin setelah induk sapi melahirkan (Esfandiari et al. 2008). Sampel kolostrum kemudian dipreparasi untuk pembuatan mikrokapsul kolostrum anti E. coli K-99.
Purifikasi Kolostrum
Presipitasi amonium sulfat merupakan metode yang sering digunakan untuk memurnikan antibodi dengan mengubah kelarutan dari serum atau hibridoma supernatan. Prinsip pengendapan amonium sulfat terletak pada salting out protein dari solusi (Grodzki dan Berenstein 2010).
Teknik purifikasi yang digunakan yaitu presipitasi garam (presipitasi dengan 40% amonium sulfat jenuh). Kolostrum yang mengandung anti-Escherichia coli masing-masing sebanyak 300 ml dihomogenkan dengan stirrer, kemudian ditambahkan amonium sulfat sedikit demi sedikit sebanyak 73 gr sampai mengental dan homogen. Setelah itu, sampel kolostrum disentrifus dengan kecepatan 5000 rpm pada suhu 4˚C selama 30 menit sampai terjadi pemisahan antara supernatan dan pelet. Supernatan dan pelet kolostrum dimasukkan ke dalam tabung yang berbeda dan diberi label. Pelet sampel kolostrum ditimbang sebanyak 25 gr lalu dilarutkan dalam 50 mL larutan PBS, dan dihomogenkan menggunakan vorteks sampai homogen. Setelah itu supernatan dan pelet disimpan di dalam lemari pendingin untuk selanjutnya dilakukan proses dialisis.
8
Pembuatan Mikrokapsul Tersalut Alginat-Kitosan
Pembuatan mikrokapsul dilakukan menggunakan metode ekstruksi, yaitu mencampurkan larutan hidrokoloid seperti alginat dengan suspensi IgG anti E. coli kemudian diekstruksi melalui jarum (nozzle) dalam bentuk butiran ke dalam larutan pengeras seperti kalsium klorida (Krasaekoopt et al. 2003). Mikrokapsul dibuat melalui beberapa persiapan, yaitu pembuatan mikrokapsul alginat-kitosan blanko dan dilanjutkan dengan pembuatan mikrokapsul alginat-kitosan yang berisi IgG anti E. coli.
Pembuatan Mikrokapsul Alginat-Kitosan Blanko
Larutan alginat 3% dicampur dengan aquades dengan perbandingan 1:1 (10 ml:10 ml) kemudian dihomogenkan menggunakan stirrer. Setelah larutan homogen, dilakukan proses pembuatan mikrokapsul menggunakan alat Microencapsulator BUCHI B-390® dengan ukuran nozzle 300, frekuensi 1000, elektroda 650 dan pressure 209–210 kemudian ditampung dengan larutan CaCl2 yang sudah dihomogenkan dengan stirrer agar butiran mikrokapsul tidak saling menempel satu sama lain. Butiran mikrokapsul tersebut dicuci dengan aquades sebanyak tiga kali pengulangan kemudian direndam dalam larutan kitosan 1% pH 4.0 dengan lama perendaman 30 (IgG anti E. coli 30 menit) dan 60 menit (IgG anti E. coli 60 menit). Pencucian dengan aquades dilakukan terhadap mikrokapsul yang telah tersalut kitosan sebanyak lima kali pengulangan, lalu disimpan di refrigerator dalam keadaan terendam aquades. Metode penyalutan dengan alginat dan kitosan pada penelitian ini menggunakan two step method (Areekul et al. 2006).
Pembuatan Mikrokapsul Alginat-Kitosan berisi IgG
Larutan IgG anti E. coli (hasil purifikasi) dicampurkan dengan larutan alginat 3% dengan perbandingan 1:1 (10 ml:10 ml) kemudian dihomogenkan menggunakan stirrer. Setelah larutan homogen, dilakukan proses pembuatan mikrokapsul menggunakan alat Microencapsulator BUCHI B-390® dengan ukuran nozzle 300, frekuensi 1000, elektroda 650 dan pressure 432. Tahap selanjutnya sama dengan metode pembuatan mikrokapsul blanko.
Pengamatan Morfologi Mikrokapsul
9
selama 20 menit dalam suhu ruang, perendaman dalam alkohol absolut selama 10 menit dengan dua kali pengulangan. Tahapan terakhir adalah pengeringan, dimana sampel direndam dalam tert butanol selama 10 menit sebanyak dua kali pengulangan. Sampel kemudian dibekukan dalam freezer sampai beku, selanjutnya sampel dimasukkan dalam freezed drier sampai benar-benar kering (Chavarri et al. 2010).
Setelah melalui tahapan preparasi, sampel sudah dalam keadaan kering dan siap untuk dilakukan pengamatan morfologi dengan SEM. Mikrokapsul dianalisis menggunakan SEM (JEOL JSM-5310LV). Sejumlah kecil mikrokapsul disebarkan diatas glass stub. Glass stub yang berisi mikrokapsul selanjutnya diletakkan pada chamber SEM dan dilapis (coating) dengan logam emas (Au) menggunakan sputter coater SC 502. Scanning electron photomicrograps dioperasikan dengan menggunakan tegangan akselerasi 20 Kv, tekanan chamber 0.01 mmHg dan pembesaran asli x600 (Sabitha et al. 2010).
HASIL DAN PEMBAHASAN
Pengembangan inovasi bentuk sediaan farmasi yang dapat menunda pelepasan obat merupakan teknologi baru yang masih dikembangkan dalam dunia farmasi, seperti teknologi penyalutan sediaan mikrokapsul (Chella et al. 2010). Pada penelitian ini telah dilakukan pembuatan mikrokapsul dengan menggunakan perbandingan konsentrasi alginat-IgG anti E. coli 1:1, 1:2 dan 2:1. Hasil terbaik didapatkan pada perbandingan 1:1.
Morfologi mikrokapsul dapat memberikan gambaran sifat aliran dan pelepasan zat aktif. Mikrokapsul yang banyak mengandung pori atau selaput polimer tipis akan lebih cepat terurai dalam tubuh, oleh karena itu struktur mikrokapsul dan keadaan permukaan kapsul penting untuk diketahui. Bentuk mikrokapsul dapat diamati dengan mikroskop sedangkan keadaan permukaan dan ukuran mikrokapsul dapat diamati dengan scanning electron microscope (SEM) (Apparao et al. 2010).
9
selama 20 menit dalam suhu ruang, perendaman dalam alkohol absolut selama 10 menit dengan dua kali pengulangan. Tahapan terakhir adalah pengeringan, dimana sampel direndam dalam tert butanol selama 10 menit sebanyak dua kali pengulangan. Sampel kemudian dibekukan dalam freezer sampai beku, selanjutnya sampel dimasukkan dalam freezed drier sampai benar-benar kering (Chavarri et al. 2010).
Setelah melalui tahapan preparasi, sampel sudah dalam keadaan kering dan siap untuk dilakukan pengamatan morfologi dengan SEM. Mikrokapsul dianalisis menggunakan SEM (JEOL JSM-5310LV). Sejumlah kecil mikrokapsul disebarkan diatas glass stub. Glass stub yang berisi mikrokapsul selanjutnya diletakkan pada chamber SEM dan dilapis (coating) dengan logam emas (Au) menggunakan sputter coater SC 502. Scanning electron photomicrograps dioperasikan dengan menggunakan tegangan akselerasi 20 Kv, tekanan chamber 0.01 mmHg dan pembesaran asli x600 (Sabitha et al. 2010).
HASIL DAN PEMBAHASAN
Pengembangan inovasi bentuk sediaan farmasi yang dapat menunda pelepasan obat merupakan teknologi baru yang masih dikembangkan dalam dunia farmasi, seperti teknologi penyalutan sediaan mikrokapsul (Chella et al. 2010). Pada penelitian ini telah dilakukan pembuatan mikrokapsul dengan menggunakan perbandingan konsentrasi alginat-IgG anti E. coli 1:1, 1:2 dan 2:1. Hasil terbaik didapatkan pada perbandingan 1:1.
Morfologi mikrokapsul dapat memberikan gambaran sifat aliran dan pelepasan zat aktif. Mikrokapsul yang banyak mengandung pori atau selaput polimer tipis akan lebih cepat terurai dalam tubuh, oleh karena itu struktur mikrokapsul dan keadaan permukaan kapsul penting untuk diketahui. Bentuk mikrokapsul dapat diamati dengan mikroskop sedangkan keadaan permukaan dan ukuran mikrokapsul dapat diamati dengan scanning electron microscope (SEM) (Apparao et al. 2010).
10
Gambar 1 Bentuk mikrokapsul dengan dengan konsentrasi alginat-kolostrum 1:1
Gambar 2 Fotomikrograf mikrokapsul blanko (kiri) dan berisi IgG anti E. coli (kanan)
Ukuran butiran mikrokapsul yang dihasilkan tergantung pada diameter nozzle dan jarak jatuhnya droplet pada larutan CaCl2 (Krasaekoopt et al. 2003). Ukuran mikrokapsul blanko dengan waktu penyalutan 30 menit dan 60 menit yaitu 50 mikron sedangkan untuk mikrokapsul berisi IgG anti E. coli sebesar 100 mikron (Gambar 3). Ukuran mikrokapsul blanko lebih kecil karena dalam rongga inti kosong, tidak mengandung IgG anti E. coli (tidak bermateri).
11
Gambar 3 Fotomikrograf scanning electron microscope: (A) mikrokapsul berisi IgG anti E. coli dengan waktu penyalutan 30 menit, (B) mikrokapsul berisi IgG anti E. coli dengan waktu penyalutan 60 menit, (C) mikrokapsul blanko dengan waktu penyalutan 30 menit, dan (D) mikrokapsul blanko dengan waktu penyalutan 60 menit
SIMPULAN DAN SARAN
Simpulan
Hasil pengamatan menggunakan scanning electron microscope menunjukkan bahwa pada mikrokapsul berisi IgG anti E. coli dengan waktu penyalutan 60 menit menghasilkan mikrokapsul yang lebih baik. Tidak ada perbedaan pada bentuk mikroskopis antara mikrokapsul yang disalut dengan larutan kitosan 1% selama 30 dan 60 menit. Mikrokapsul berisi IgG anti E. coli dengan waktu penyalutan 60 menit menghasilkan permukaan mikrokapsul yang lebih baik dibandingan dengan waktu penyalutan 30 menit.
Saran
Perlu dilakukan evaluasi lebih lanjut terhadap lamanya waktu penyalutan mikrokapsul, dan evaluasi terhadap mikrokapsul dengan parameter kemampuan disolusi mikrokapsul, stabilitas mikrokapsul, dan dosis pemberian.
100 µm
100 µm
50 µm 50 µm
A B