KUALITAS SEMEN BEKU BABI DALAM PENGENCER BTS DAN MIII
MENGGUNAKAN KRIOPROTEKTAN DIMETHYLACETAMIDE DAN
GLISEROL DENGAN
SODIUM DEDOCYL SULPHATE
NANCY DIANA FREDERIKA KATERINA FOEH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Kualitas Semen Beku Babi dalam Pengencer BTS dan MIII menggunakan Krioprotektan Dimethylacetamide dan Gliserol dengan Sodium Dedocyl Sulphate adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2015
Nancy Diana Frederika Katerina Foeh
RINGKASAN
NANCY DIANA FREDERIKA KATERINA FOEH. Dengan ini saya menyatakan bahwa tesis berjudul Kualitas Semen Beku Babi dalam Pengencer BTS dan MIII menggunakan Krioprotektan Dimethylacetamide dan Gliserol dengan Sodium Dedocyl Sulphate. Dibimbing oleh RADEN IIS ARIFIANTINI dan TUTY LASWARDI YUSUF.
Inseminasi Buatan (IB) menggunakan semen beku babi di Indonesia masih terbatas, karena penyediaan semen beku masih didatangkan dari luar negeri. Spermatozoa babi memiliki komposisi membran plasma yang mengandung
sphingomyelin dan phosphatidylethanolamine yang sangat tinggi 14% dan 24%, sehingga mudah mengalami cold shock saat pembekuan. Pengencer semen cair yang mudah diperoleh di Indonesia adalah BTS® dan MIII®. Semen cair umumnya disimpan pada suhu 16-18 oC dan bertahan hanya beberapa hari saja, untuk penyimpanan yang lebih lama dibutuhkan pembekuan semen yang memerlukan krioprotektan. Krioprotektan yang umum digunakan adalah gliserol, sedangkan golongan amida seperti dimethylacetamide (DMA) menunjukkan potensi yang baik sebagai krioprotektan karena memiliki berat molekul yang lebih rendah (87.12 g/mol) jika dibandingkan dengan gliserol (92.05 g/mol). Penambahan Sodium Dodecyl Sulphate (SDS) dalam bahan pengencer semen beku dapat mempertahankan motilitas spermatozoa pada saat kriopreservasi, dengan cara melarutkan dan meningkatkan dispersi molekul kuning telur, sehingga dapat meningkatkan kontak dengan membran plasma spermatozoa yang diharapkan mengurangi efek negatif dari bahaya selama kriopreservasi.
Penelitian ini bertujuan untuk menguji krioprotektan terbaik dalam pengencer BTS dan MIII. Semen dikoleksi dari 4 ekor pejantan dengan menggunakan dummy sow. Semen yang menunjukkan motilitas spermatozoa >70%, konsentrasi spermatozoa >200.106 sel/ml dan abnormalitas < 20% yang digunakan dalam penelitian ini. Penelitian dilakukan dalam empat tahap yaitu 1) Pemeriksaan karakteristik semen babi meliputi pemeriksaan makroskopis dan mikroskopis. 2) Penambahan gliserol, DMA, dan kombinasi gliserol-DMA dalam pengencer BTSdan MIII. 3) Penambahan SDS dalam bahan pengencer semen beku 4) Uji fertilitas semen beku.
Tahap 1, pemeriksaan karakteristik semen segar dilakukan secara makroskopik meliputi volume, warna, pH, dan konsistensi sedangkan pemeriksaan mikroskopis meliputi motilitas, viabilitas, konsentrasi, dan abnormalitas spermatozoa.
straw semen beku ditambahkan 80 ml pengencer BTS yang setara dengan 5000 juta sel/80 ml, kemudian diinseminasi pada 10 ekor betina estrus. Keberhasilan IB diukur dengan menghitung angka konsepsi dan angka kelahiran dari betina yang diinseminasi.
Data Tahap 1 dianalisis secara deskriptif, Tahap 2 dan 3 menggunakan rancangan acak lengkap (RAL) dan RAL faktorial. Data dianalisis dengan analisis of variance (ANOVA) menggunakan program SPSS v.21. Data yang memperlihatkan perbedaan nyata diuji lanjut dengan uji Duncan.
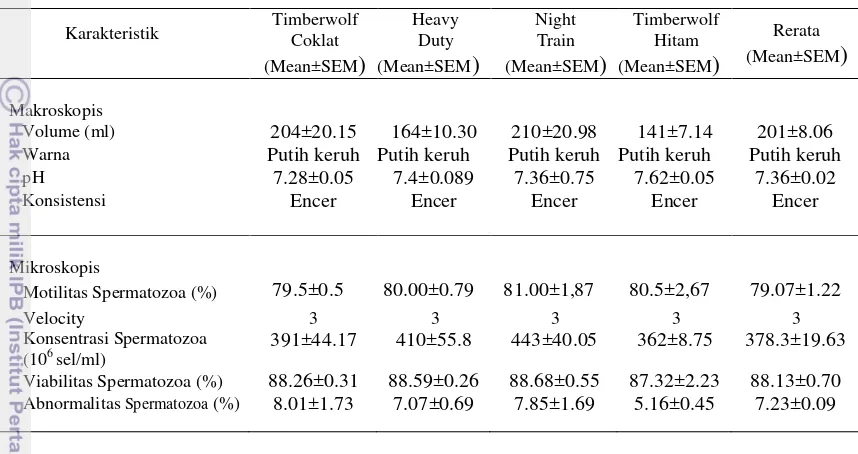
Hasil evaluasi karakteristik semen babi menunjukkan rerata volume 176±4.85 ml, dengan pH 7.40±0.066, berwarna putih keruh dengan konsistensi encer. Secara mikroskopis hasil penelitian menunjukkan motilitas spermatozoa 80.85±8.72%, dengan konsentrasi spermatozoa 429.17±7.93.106 sel/ml, viabilitas spermatozoa 88.61±0.21%, dan abnormalitas spermatozoa hanya 6.87±0.23%.
Hasil pengamatan Tahap 2, krioprotektan terbaik dalam pengencer BTS adalah BTSDMA 20.92±0.91% lebih tinggi (P<0.05) jika dibandingkan dengan BTSGliserol 15.67±0.7% dan BTSGliserol-DMA 12.33±0.70%, sedangkan krioprotektan terbaik dalam pengencer MIII adalah MIIIGliserol 19.92±1.16% lebih tinggi (P<0.05) jika dibandingkan MIIIDMA 14.21±2.74% dan MIIIGliserol-DMA 9.04.17±4.23%.
Penelitian Tahap 3 dengan penambahan SDS, motilitas spermatozoa setelah
thawing dalam pengencer BTSDMA-SDS 40.17±0.2% lebih tinggi (P<0.05) dibandingkan 7 pengencer lainnya. Tahap 4, keberhasilan IB pada babi menggunakan semen beku cukup tinggi yaitu 5 dari 10 ekor dengan angka konsepsi 50% dan jumlah anak keseluruhan 54 ekor (7-15 ekor/induk).
Hasil penelitian dapat disimpulkan bahwa penambahan SDS dalam bahan pengencer semen beku lebih baik jika dibandingkan tanpa penambahan SDS. Pengencer semen beku terbaik adalah pengencer BTS dengan krioptotektan DMA 5% yang disuplementasi SDS 0.05% dengan angka konsepsi 50%.
SUMMARY
NANCY DIANA FREDERIKA KATERINA FOEH. The Quality of Boar Frozen Semen in BTSand MIII Extender with Dimethylacetamide and Glycerol Cryoprotectant Supplemented Sodium Dedocyl Sulphate. Supervised by RADEN IIS ARIFIANTINI and TUTY LASWARDI YUSUF.
The application of artificial insemination (AI) using boar frozen semen is limited in Indonesia, due to the availability of the extender and prover freezing technique. The diluents of liquid semen which is available in Indonesia are BTS® and MIII®. Liquid semen is usually store at 16-18 oC and it will survive only for a few days. For longer storage purpose, frozen semen can be an appropriate choice.
Among the spermatozoa of domestic animals, boar spermatozoa shows the highest sensitivity to cold shock, caused by contained higher sphingomyelin and phospatidylethanolamine in membrane plasma composition. To minimalized cold shock in frozen semen needed cryoprotectant. The cryoprotectant commonly used is glycerol, while the amide group such as DMA showed good potential because it has lower molecular weight (87.12 g/mol) compared glycerol (92.05 g/mol). Beside cryoprotectant the addition of egg yolk might protect spermatozoa membrane against cold shock. The addition of egg yolk in BTS and MIII® were difficult to dissolved. Sodium Dedocyl Sulphate (SDS) improve dispersion of egg yolk molecules, thus enhance the contact between the egg yolk and spermatozoa cell membrane.
The study aimed to determine the best cryprotectant on BTS® and MIII® diluents with and without SDS in boar semen cryopreservation. The semen were collected from four boars using dummy sow. Immediately after collection the semen were evaluated macro and microscopically. Semen showed >70% spermatozoa motility, >200 million cells/ml spermatozoa concentration, and <20% spermatozoa abnormality used in this study. This research consisted of four phases; 1) Boar semen characteristic. 2) Addition of glycerol or DMA as a cryoprotectant in BTS and MIII diluents. 3) Addition with or without SDS to the best diluents of Phase 2; and phase 4) fertility test using frozen semen based on phase 3 inseminated to estrus sows.
Phase 1, fresh semen characteristics consist of macroscopically examination including volume, colour, pH, concistency and microscopically examination including motility, viability, concentration, and spermatozoa abnormality.
phase 2 using completely randomized design (CRD) and phase 3 analized by CRD factorial, if there were significant differences among treatments, followed by Duncan test.
The result of semen characteristics showed the average of volume was 176±4.85 ml, light white to creamy in colour and 7.40±0.066 in pH. The spermatozoa motility, viability and abnormality were 80.85±0.72%, 88.61±0.21%, 6.87±0.23% respectively with 429.17±7.93.106 cell/ml in spermatozoa concentration. The best cryoprotectant in BTS® diluent was BTSDMA 20.92±0.91%; compared with BTSGliserol 15.67±0.7% and BTSGliserol-DMA 12.33±0.70%. in contrast the besst cryoprtectant in MIII® diluents was MIIIGliserol 19.92±1.16% compared with MIIIDMA 14.21±2.74% and MIIIGliserol-DMA 9.04.17±4.23%. Spermatozoa in BTS supplemented with SDS and DMA as cryoprotectant demonstrated higher spermatozoa motility and viability compared with non SDS. Spermatozoa motility in BTSDMA-SDS treatment was 40.17±0.2% which is higher (P<0.05) compared with the others diluent. The conception rate of AI using frozen semen was 50% (5/10) of sows were pregnant and the number of piglet were 54 head with average of 7-15 piglet/sow.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Reproduksi
KUALITAS SEMEN BEKU BABI DALAM PENGENCER BTS DAN MIII
MENGGUNAKAN KRIOPROTEKTAN DIMETHYLACETAMIDE DAN
GLISEROL DENGAN
SODIUM DEDOCYL SULPHATE
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Kualitas Semen Beku Babi dalam Pengencer BTS dan MIII Menggunakan Krioprotektan Dimethylacetamide dan Gliserol dengan Sodium Dedocyl Sulphate
Nama : Nancy Diana Frederika Katerina Foeh NIM : B352130011
Disetujui oleh Komisi Pembimbing
Prof Dr Dra R Iis Arifiantini, MSi Ketua
Prof Dr drh Tuty L Yusuf, MS Anggota
Diketahui oleh
Ketua Program Studi Biologi Reproduksi
Prof Dr drh M Agus Setiadi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Bapa, Putra dan Roh Kudus, Allah yang Maha Kuasa atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2015 ialah Kualitas Semen Beku Babi dalam Pengencer BTS dan MIII menggunakan Krioprotektan Dimethylacetamide dan Gliserol dengan Sodium Dedocyl Sulphate.
Rasa hormat dan terima kasih penulis ucapkan kepada Prof Dr Dra R Iis Arifiantini, Msi selaku pembimbing I yang telah meluangkan waktunya untuk menemani dan membimbing selama penelitian dan memberi banyak masukkan serta saran dalam penulisan. Terima kasih kepada Prof Dr drh Tuty L Yusuf, MS pembimbing II yang dengan sabar membimbing dan menuntun serta memberi banyak masukan. Terima kasih kepada Prof Dr drh M Agus Setiadi selaku Ketua Program Studi Biologi Reproduksi dan drh Ni Wayan Kurniani Karja MP, PhD selaku penguji yang telah banyak memberi saran. Di samping itu, penghargaan penulis sampaikan kepada Bapak Alex Kasim dan staf PT. Adhi Farm (Ibu Tinik, Ibu Londoh dan Bapak Maryanto) yang telah mengijinkan dan membantu dalam penelitian. Tidak lupa penulis berterima kasih kepada seluruh staf dan pegawai pada Departemen Klinik, Reproduksi dan Kebidanan Fakultas Kedokteran Hewan, Bapak Bondan Ahmadi SE, Ibu Yanti dan Ibu Seli. Terima kasih juga penulis sampaikan kepada rekan seperjuangan Biologi Reproduksi 2013.
Rasa hormat dan terima kasih penulis persembahkan kepada kedua orang tua Bapak Daud Foeh, Ibu Kalista Ngatini Krismiaty, kakak adik tersayang (Danny Eduard Foeh dan Astuty Foeh), kedua orang tua rohani (Bapak Isak Temluru dan Ibu Kusmiati Adam), suami tercinta Aris Lobo yang senantiasa memberikan doa, semangat dan dukungan kepada penulis selama ini serta semua pihak yang tidak bisa disebutkan satu persatu.
Penulis menyadari karya ilmiah ini masih jauh dari kesempurnaan. Namun, semoga tesis ini bermanfaat bagi yang membacanya.
Bogor, September 2015
DAFTAR ISI
DAFTAR GAMBAR vii
DAFTAR TABEL vii
PENDAHULUAN 1
Latar Belakang 1
Kerangka Pemikiran 2
Tujuan Penelitian 3
Manfaat Penelitian 3
TINJAUAN PUSTAKA 4
Sistem Reproduksi Ternak Babi 4
Sistem Reproduksi Hewan Jantan 4
Fisiologi Semen 5
Morfologi Spermatozoa 6
Bahan Pengencer Semen Babi 7
Krioprotektan 8
Sodium Dodecyl Sulphate (SDS) 9
Kriopreservasi Semen 11
Holdingtime, Equilibrasi, Pembekuan dan Thawing 12
Inseminasi Buatan pada Ternak Babi 13
METODE PENELITIAN 13
Waktu dan Tempat Penelitian 14
Sumber Semen 14
Tahap 1: Pemeriksaan Karakteristik Semen Segar 14 Tahap 2: Pengaruh Penambahan Gliserol, DMA, dan Kombinasi
Gliserol- DMA dalam Pengencer BTSdan MIII 15
Tahap 3: Pengaruh Penambahan SDS dalam Bahan Pengencer Semen
Beku 17
Tahap 4: Uji Fertilitas Semen Beku 18
Prosedur Analisis Data 19
HASIL DAN PEMBAHASAN 20
Karakteristik Semen Segar 20
Kualitas semen beku dalam pengencer BTS dan MIII dengan
penambahan krioprotektan gliserol, DMA, dan kombinasi gliserol-DMA 22 Kualitas semen beku dalam pengencer BTS 22 Kualitas semen beku dalam pengencer MIII 24 Hasil Penambahan SDS dalam Pengencer Semen Beku 27
Hasil Uji Fertilitas Semen Beku 31
SIMPULAN DAN SARAN 33
Simpulan 33
DAFTAR PUSTAKA 34
DAFTAR TABEL
1 Karakteristik semen segar babi 5
2 Komposisi plasma semen babi 6
3 Komposisi pengencer dasar BTS® dan MIII® 15 4 Komposisi pengencer BTS dan MIII semen beku 16 5 Komposisi pengencer BTS dan MIII semen beku dengan
penambahan SDS
17 6 Karakteristik semen segar babi (Mean±SEM) 20 7 Kualitas semen segar babi yang digunakan dalam pengencer
BTS semen beku (Mean±SEM)
22 8 Motilitas dan viabilitas spermatozoa setelah pengenceran dan
setelah Holding time pada pengenecer BTS (Mean±SEM)
23 9 Persentase motilitas spermatozoa dalam pengencer BTS pada
berbagai tahapan (Mean±SEM)
23 10 Pernsentase viabilitas spermatozoa dalam pengencer BTS pada
berbagai tahapan (Mean±SEM)
24 11 Kualitas semen segar babi yang digunakan dalam pengencer
MIII semen beku (Mean±SEM)
25 12 Motilitas dan viabilitas spermatozoa setelah pengenceran dan
setelah Holding time pada pengencer MIII (Mean±SEM)
25 13 Persentase motilitas spermatozoa dalam pengencer MIII pada
berbagai tahapan (Mean±SEM)
26 14 Persentase viabilitas spermatozoa dalam pengencer MIII pada
berbagai tahapan (Mean±SEM)
27 15 Kualitas semen segar babi yang digunakan dalam pengencer
semen beku tahap 3 (Mean±SEM)
28 16 Motilitas dan viabilitas spermatozoa setelah pengenceran dan
setelah Holding time pada pengencer BTS dan MIII (Mean±SEM)
28
17 Motilitas spermatozoa setelah equilibrasi dan setelah thawing
dalam pengencer BTS dan MIII dengan krioprotektan gliserol dan DMA dengan dan tanpa penambahan SDS (Mean±SEM)
27
18 Viabilitas spermatozoa setelah equilibrasi dan setelah thawing
dalam pengencer BTS dan MIII dengan krioprotektan gliserol dan DMA dengan dan tanpa penambahan SDS (Mean±SEM)
28
19 Litter size hasil uji fertilitas semen beku 29
DAFTAR GAMBAR
1 Struktur spermatozoa 6
2 Struktur kimia gliserol 8
3 Struktur kimia dimethylacetamide 9
4 Molekul surfaktan 10
5 Struktur Sodium Dodecyl Sulphate 10
6 Spermatozoa hidup dan mati dengan pewarnaan eosin nigrosin (a) spermatozoa hidup dan (b) spermatozoa mati
21
PENDAHULUAN
Latar Belakang
Peternakan babi di Indonesia mempunyai peranan penting dalam penyediaan protein hewani untuk daerah tertentu dan juga ekspor daging ke beberapa negara seperti Singapura, Thailand dan Malaysia. Oleh sebab itu salah satu upaya meningkatkan produktivitas dan perbaikan mutu genetik adalah dengan inseminasi buatan (IB). Pengembangan IB di Indonesia pada babi masih menggunakan semen cair sedangkan IB dengan menggunakan semen beku masih sangat terbatas, karena semen beku babi masih didatangkan dari luar negeri dengan harga yang sangat mahal. Sampai saat ini hanya peternakan besar yang menggunakan semen beku impor seperti di Solo dan Kalimantan Barat dengan hasil kebuntingan yang diperoleh 70-80%.
Semen beku di Indonesia perlu dikembangkan untuk meningkatkan keberhasilan populasi dan nilai genetiknya. Menurut Aboagla dan Terada (2004a) untuk menghasilkan semen beku yang berkualitas perlu memperhatikan beberapa hal seperti bahan pengencer yang digunakan, jenis dan konsentrasi krioprotektan yang ditambahkan, dan teknik yang tepat dalam pembekuan semen.
Bahan pengencer komersial untuk semen cair babi telah banyak tersedia di pasaran, namun yang umum digunakan di Indonesia adalah beltsville thawing solution (BTS®) yang berdaya simpan singkat 1-3 hari dan MIII®yang berdaya simpan sedang 5-7 hari (Gadea 2003). Semen cair babi hanya bisa bertahan beberapa hari saja (3-11 hari) pada suhu 16-18 oC bergantung bahan pengencer yang digunakan, untuk penyimpanan jangka panjang dibutuhkan pembekuan semen.
Pembekuan semen harus melewati proses equilibrasi pada suhu 4-5 oC, sehingga dibutuhkan lesitin dan phospholipid untuk mengurangi cold shock. Kuning telur yang ditambahkan pada pengencer komersial sulit larut, sehingga perlu ditambahkan Sodium Dodecyl Sulphate (SDS). Penambahan SDS menurut El-Kon et al.(2010) dapat melarutkan dan meningkatkan dispersi molekul dari kuning telur sehingga meningkatkan kontak antara phospholipid kuning telur dengan membran plasma spermatozoa.
Kualitas semen beku juga ditentukan oleh jenis dan konsentrasi krioprotektan dalam bahan pengencer semen. Gliserol merupakan krioprotektan yang umum digunakan pada pembekuan semen ternak, namun pada semen babi hasilnya kurang memuaskan. Buranamnuay et al.(2008) melaporkan penggunaan 9% gliserol dalam pengencer BTS dengan 1.5% equex-STM paste menghasilkan
Post Thawing Motility (PTM) 34%. Menurut Medeiros et al. (2002) golongan amida seperti dimethyformamide (DMF) dan dimethylacetamide (DMA) juga dapat digunakan sebagai krioprotektan. Tahun 2010 golongan amida mulai digunakan sebagai krioprotektan pada ternak babi. Penelitian terakhir penggunaan krioprotektan golongan amida dilakukan oleh Pinho et al.(2014) dengan PTM yang telah dicapai 51.7% dalam pengencer Modena yang dikombinasi laktosa, kuning telur, dan Equex STM Paste.
2
Equex STM Paste. Equex STM Paste merupakan produk komersial dengan zat aktif SDS yang mudah diperoleh di Indonesia. Penggunaan SDS pada kriopreservasi semen anjing terbukti dapat mempertahankan motilitas, viabilitas dan integritas membran spermatozoa (Ponglowhapan dan Chatdarong 2008).
Salah satu kendala pembekuan semen babi adalah komposisi membran plasma spermatozoa babi yang mengandung phosphatidylethanolamine dan
sphingomyelin yang sangat tinggi 24% dan 14%, sehingga mudah mengalami cold shock. Membran plasma menjadi target utama kerusakan saat kriopreservasi sehingga perlu dijaga integritasnya. Pada proses pembekuan semen suhu diturunkan hingga mencapai -196 oC, menurut Triwulaningsih (2003) proses pembekuan ini dapat menyebabkan kematian spermatozoa sekitar 30%.
Penelitian semen beku babi di Indonesia baru dilaporkan oleh Dapawole (2014) menggunakan pengencer BTS dengan krioprotektan gliserol 4% ditambah 50 mM trehalosa, tetapi menghasilkan PTM kurang dari 30%. Mengingat kriopreservasi semen babi di Indonesia belum dilakukan secara mendalam dan pentingnya kriopreservasi semen babi dalam manajemen pejantan unggul serta nilai ekonomis yang tinggi maka penelitian ini bertujuan untuk menguji krioprotektan gliserol dan DMA dengan penambahan SDS dalam pengencer BTS dan MIII.
Kerangka Pemikiran
Semen terdiri dari plasma semen dan spermatozoa. Spermatozoa babi memiliki komposisi membran plasma phosphatidylethanolamine dan
sphingomyelin yang sangat tinggi mencapai 24% dan 14% jika dibandingkan dengan ternak lain. Hal ini yang menyebabkan semen babi sangat sensitif terhadap penurunan suhu yang ektrim, sehingga mudah cold shock. Untuk mengurangi efek cold shock, semen babi yang telah diencerkan harus di simpan pada suhu ruang 15-22 oC (holding time).
Pengaruh bahan pengencer juga menentukan kualitas spermatozoa. Bahan pengencer BTS® merupakan bahan pengencer berdaya simpan singkat 1-3 hari, dengan sumber energi berupa glukosa yang merupakan karbohidrat golongan monosakarida yang mudah dimetabolisme oleh spermatozooa. Sedangkan MIII® merupakan bahan pengencer berdaya simpan sedang 5-7 hari dengan sumber energi berupa glisin yang merupakan protein dari asam amino sederhana yang mudah dirombak menjadi energi yang berguna bagi spermatozoa. Selain bahan pengencer dalam proses kriopreservasi juga membutuhkan penambahan krioprotektan yang tepat dengan tujuan melindungi spermatozoa dari bahaya fisik akibat pembentukan kristal es.
3 krioprotektan menembus membran sel spermatozoa sehingga dapat mengurangi kerusakan sel yang disebabkan oleh kriopreservasi. Penambahan suplemen SDS dalam pengencer semen beku babi dapat mendisprsi molekul kuning telur menjadi lebih kecil agar mampu meningkatkan kontak dengan membran plasma spermatozoa, sehingga melindungi spermatozoa selama proses kriopreservasi. Oleh sebab itu penelitian ini dilakukan untuk menguji pengaruh gliserol dan DMA dengan penambahan SDS dan non SDS dalam pengencer BTS dan MIII pada semen babi.
Tujuan Penelitian
Tujuan yang diharapkan dari penelitian :
1. Mengetahui karakteristik semen babi melalui evaluasi makroskopis maupun mikroskopis.
2. Menentukan krioprotektan yang terbaik dari gliserol dan DMA dalam bahan pengencer BTS dan MIII.
3. Menguji pengaruh SDS sebagai bahan yang dapat meningkatkan motilitas spermatozoa.
4. Mengevaluasi fertilitas semen beku melalui aplikasi inseminasi buatan.
Manfaat Penelitian
Hasil penelitian ini dapat memberi manfaat yaitu :
1. Mendapatkan pengencer semen beku babi dengan pilihan krioprotektan dan tambahan SDS yang dapat mempertahankan motilitas spermatozoa.
4
TINJAUAN PUSTAKA
Sistem Reproduksi Ternak Babi
Tujuan dari kehidupan adalah melanjutkan generasi melalui perkawinan yang mempertemukan sel kelamin jantan (spermatozoa) dan sel kelamin betina (ovum). Spermatozoa yang dihasilkan harus motil/hidup, memiliki potensial fertil, dan secara sempurna mampu menembus dinding ovum untuk melakukan proses fertilisasi.
Sistem Reproduksi Hewan Jantan
Sistem reproduksi hewan jantan meliputi organ reproduksi primer, saluran reproduksi, kelenjar assesoris, dan alat kopulatoris. Organ reproduksi primer, terdiri dari dua buah testis yang terbungkus di dalam skrotum. Testis berfungsi untuk memproduksi spermatozoa dan menghasilkan hormon testosteron (T4), sedangkan skrotum berfungsi sebagai pembungkus dan menyediakan lingkungan yang sesuai untuk produksi dan pematangan spermatozoa.
Saluran reproduksi terdiri dari vas eferens, epididimis, vas deferens, dan uretra. Saluran reproduksi setelah testis adalah epididimis, dibagi menjadi tiga bagian caput, corpus, dan cauda. Epididimis mempunyai peranan sebagai jalan spermatozoa dari tubulus seminiferus, penyimpanan sementara spermatozoa, tempat pematangan spermatozoa dan proses pengentalan (konsentrasi) spermatozoa. Vas deferens, tersusun dari otot polos yang berperan pada pengeluaran spermatozoa saat ejakulasi, pada bagian ini terdapat ampula pada kedua vas deferens yang terletak bersebelahan di atas vesika urinaria, pada babi ampula ini sangat kecil.
Kelenjar assesoris terdiri dari kelenjar vesika seminalis (vesikularis), prostat, dan bulbouretralis (kelenjar Cowper). Ketiga kelenjar ini relatif lebih besar jika dibandingkan dengan kelenjar assesoris sapi dan kerbau. Pada ternak babi kelenjar vesikularis merupakan kelenjar assesoris terbesar dari ketiga kelenjar yang lain, hal ini yang menyebabkan semen babi bersifat voluminous.
Cairan yang disekresikan dari kelenjar vesikularis berfungsi sebagai medium transport, sebagai sumber energi seperti fruktosa, sorbitol dan sebagai larutan buffer yang terdiri dari fosfat dan karbonat yang berperan dalam menjaga keseimbangan pH semen. Kelenjar prostat berfungsi memproduksi cairan dan ion anorganik seperti sodium, klorin, kalsium, dan magnesium yang merupakan medium bagi transport spermatozoa. Kelenjar Cowper memproduksi komponen semen yang berbentuk seperti gel yang akan digunakan saat coitus sebagai media spermatozoa (Ensminger dan Holden 2006).
5 cm, namun saat kopulasi panjang penis sekitar 20-35 cm yang keluar dari preputium (Garner dan Hafez 2000).
Fisiologi Semen
Menurut Garner dan Hafez (2000) semen disekresi dari organ reproduksi jantan yang terdiri dari spermatozoa dan plasma semen. Pada saat penampungan semen babi terdiri dari tiga fraksi yaitu fraksi prasperma (presperm fraction), fraksi kaya semen (rich sperm fraction) dan fraksi setelah sperma (postsperm). Fraksi prasperma merupakan fraksi semen yang keluar terlebih dahulu dengan volume sekitar 5-15 ml dan hanya mengandung gelatin. Fraksi kaya semen merupakan fraksi semen sesungguhnya yang memiliki komponen spermatozoa dan plasma semen, pada babi jantan memiliki volume sekitar 100-300 ml dan pada babi jantan dewasa sekitar 100-500 ml, sedangkan fraksi postsperm
merupakan fraksi gelatinous seperti fraksi presperm (Shipley 1999).
Spermatozoa dihasilkan oleh testes di bawah pengaruh hormon gonadotropin dan hormon gonada, sedangkan plasma semen merupakan campuran sekresi dari epididimis dan kelenjar-kelenjar assesoris. Karakteristik semen babi disajikan pada Tabel 1.
Tabel 1 Karakteristik semen babi segar
Parameter Jumlah Konsentrasi Spermatozoa/ml 150-300 106 sel/ml
Motilitas Spermatozoa 50-80%
Morfologi Spermatozoa Normal 70-90%
Protein 3.7%
pH 7.3-7.8
Sumber: Garner dan Hafez (2000)
Semen babi bersifat voluminous, setiap kali penampungan dapat mencapai 150-400 ml dengan konsentrasi spermatozoa yang rendah yaitu 200-300.106 sel/ml (Garner dan Hafez 2000). Semen yang diejakulasi terlihat putih susu, agak lengket, dan mengandung bahan gelatin seperti Jelly. Semen memiliki larutan
buffer nitrat, bikarbonat, kation, dan pH antara 7.3-7.8 serta memiliki tekanan osmotik hampir sama dengan darah. Plasma semen juga terkandung protein kasar sekitar 3.7% yang terdiri atas asam-asam amino, peptida, mukoprotein dan terdapat berbagai enzim, vitamin, lipid, dan asam lemak Gadea (2003).
6
Tabel 2 Komposisi plasma semen babi
Kandungan Jumlah (mg/100 ml)
Fructose 9
Sorbitol 6-18
Citrid acid 173
Inositol 380- 630
Ergothioneine 17
Glycerylphosphoryl-choline 110-240
Sodium 587
Potasium 197
Chlorida 260-430
Calsium 6
Magnesium 5-14
Sumber : Garner dan Hafez (2000)
Fruktosa berguna bagi spermatozoa sabagai sumber energi, asam sitrat mengumpalkan semen saat ejakulasi, spermin berfungsi memberi bau khas pada semen dan prostaglandin yang berperan dalam melancarkan pengangkutan spermatozoa dalam saluran kelamin jantan dan betina.
Morfologi Spermatozoa
Semen babi terdiri atas spermatozoa dan plasma semen. Bagian kepala terdiri dari nukleus spermatozoa dan akrosom. Akrosom/tudung akrosom merupakan struktur berupa dua lapis kantong membran yang terdapat diantara plasma membran dan anterior dari kepala spermatozoa. Bagian ini mengandung akrosin, hyaluronidase dan enzim hidrolitik lainnya yang berperan dalam menembus ovum. Bagian ujung dari akrosom inilah yang akan menembus membran oosit. Kepala spermatozoa berbentuk oval memanjang, lebar dan datar. Bagian ini berisi materi genetik berupa kromosom yang terdiri dari untaian rantai DNA (deoxyribonucleic acid) yang terbentuk melalui tahapan meiosis dalam proses spermatogenesis sehingga jumlah kromosom pada DNA ini adalah diploid atau setengah dari DNA sel somatik dari spesies yang sama Gambar 1.
Ekor spermatozoa dibagi menjadi tiga bagian yaitu mid piece, principal piece dan end piece. Bagian ekor ini terdiri dari aksonema yang tersusun dari
7 sembilan pasang mikrotubulus yang melingkari dua inti filament, aksonema itu sendiri dibungkus oleh banyak mitokondria yang tersusun secara helix yang mengelilingi serabut longitudinal dari ekor.
Pada mitokondria fruktosa dipakai sebagai sumber pembentukan Adenosin triphosphate (ATP). ATP ini digunakan sebagai sumber energi bagi spermatozoa. ATP dirombak menjadi adenosin diphosphate (ADP). ADP dirombak menjadi
adenosin mono phosphate (AMP) yang kemudian energinya dipakai dalam proses pergerakan spermatozoa. Menurut Bearden dan Fuquay (2004) perombakan ATP menjadi ADP menghasilkan energi sebanyak 7000 kalori/mol.
Bahan Pengencer Semen Babi
Bahan pengencer semen merupakan media yang mempengaruhi kualitas spermatozoa selama proses preservasi dan kriopreservasi (Aboagla dan Terada 2004a). Bahan pengencer harus memenuhi syarat yaitu dapat memperbanyak volume semen, sebagai sumber energi bagi spermatozoa, mampu melindungi spermatozoa dari cold shock, sebagai Penyangga (buffer) untuk mencegah perubahan pH akibat pembentukan asam laktat dari hasil metabolisme spermatozoa, mengandung unsur-unsur yang sifat fisik dan kimianya hampir sama dengan semen dan tidak mengandung zat yang bersifat toksik bagi spermatozoa dan saluran kelamin betina, mampu mencegah pertumbuhan mikroorganisme, mampu mempertahankan tekanan osmotik dan keseimbangan elektrolit yang sesuai sehingga dapat melindungi sel spermatozoa selama proses pembekuan (Gadea 2003).
Berdasarkan daya simpan, pengencer komersial semen babi dibagi menjadi tiga yaitu Bahan pengencer berdaya simpan pendek/short-term (1-3 hari) seperti
Beltsville Liquid (BL–1), BeltsvilleThawing Solution (BTS®), Illinois Variable Temperature (IVT). Bahan pengencer berdaya simpan sedang/medium-term
seperti MIII® dengan daya tahan 5-7 hari dan bahan pengencer berdaya simpan panjang/ Long-term extender (7-12 hari) seperti Acromax®, Mulberry III®, Androhep®, Modena®, X-Cell®, Zorlesco® dan Zorpva® ( Gadea 2003; Johnson et al. 2000; Zhou et al. 2004).
Bahan pengencer BTS®mengandung glukosa sebagai sumber energi, EDTA yang berfungsi dalam mengatur kadar Ca dalam larutan, antibiotik (Pennisilin dan Streptomisin) berfungsi menekan pertumbuhan bakteri, unsur-unsur seperti Natrium Sitrat, Natrium Bicarbinat berfungsi sebagai penyangga (buffer), dan Potasium Klorida yang berfungsi untuk membius/ mendepress spermatozoa (Dube
et al. 2004). Pengencer MIII® juga mengandung BSA yang berfungsi sebagai penyangga (buffer) dan glisin yang berfungsi sebagai sumber energi.
8
Krioprotektan
Krioprotektan adalah suatu zat kimia non elektrolit yang mempunyai peran untuk melindungi sel dari kerusakan mekanik yang terjadi saat pembekuan, penyimpanan, dan thawing. Krioprotektan berfungsi mencegah terbentuknya kristal es (Purdy 2006). Berdasarkan fungsinya krioportektan dibagi menjadi 2 jenis yaitu krioprotektan intraseluler dan ekstraseluler. Krioprotektan intraseluler adalah krioprtektan yang dapat masuk ke dalam sel, seperti gliserol, etilen glikol, propanoldiol, dietilenglikol, dan golongan Amida baik DMA maupun DMF, sedangkan krioprotektan ekstraseluler adalah krioprotektan yang hanya melindungi bagian luar dari sel seperti rafinosa, trehalosa, fruktosa, sukrosa dan lain-lain.
Menurut Purdy 2006 Gliserol (C3H5(OH)3) merupakan komponen utama lipida yang mengandung tiga atom karbon (C) dan tiga gugus OH yang dibentuk melalui lipolisis, yakni disforilasi dan dioksidasi menjadi dihidroksiaseton fosfat dan selanjutnya dihidrolisis menjadi gliseradehida 3-fosfat (Gambar 2).
Penambahan gliserol ke dalam pengencer semen beku dapat meningkatkan daya tahan spermatozoa dengan cara mencegah kristalisasi es pada daerah titik beku larutan. Gliserol akan berdifusi, menembus, menurunkan konsentrasi elektrolit intraseluler dan mengurangi kerusakan mekanik dengan jalan memodifisir kristal-kristal es yang terbentuk (Tambing et al. 2000). Gliserol juga akan memasuki sel spermatozoa dan terjadi aktivitas metabolisme oksidatif, menggantikan sebagian air yang bebas dan mendesak keluar elektrolit-elektrolit serta berikatan dengan gugus pusat phospholipid pada membran sehingga mengurangi ketidakstabilan pada membran sel selama proses pembekuan.
Menurut Leboeuf et al. (2000), Gliserol telah menjadi krioprotektan yang umum digunakan pada ternak untuk kriopreservasi. Beberapa penelitian melaporkan bahwa dengan konsentrasi gliserol 3-9% kriopreservasi spermatozoa telah berhasil dilakukan pada ternak namun penggunaan gliserol pada kriopreservasi semen babi kurang memuaskan.
Beberapa penelitian penggunaan gliserol sebagai berikut, gliserol 6% dalam pengencer BTS yang dikombinasi laktosa kuning telur dan N-acetyl-D-glucosamine memperoleh PTM 35% (Yi et al. 2002). Menurut Buranaamnuay et al. (2008) 9% gliserol dalam pengencer Modena yang dikombinasi dengan equex -STM paste 1.5% menunjukkan PTM 34%. Komposisi pengencer semen beku yang sama seperti Buranaamnuay et al. (2008) dengan penambahan laktosa kuning telur menunjukkan PTM 40% (Panida et al. 2014). Pada tahun yang sama penelitian terakhir penggunaan Gliserol 5% dalam pengencer yang sama
9 menunjukkan PTM 46% (Pinho et al. 2014). Dari beberapa hasil penelitian diatas dapat disimpulkan bahwa semen babi sangat sensitif terhadap gliserol dengan konsentrasi yang tinggi.
Menurut Medeiros et al.(2002) golongan amida dimethyformamide (DMF) dan dimethylacetamide (DMA) dapat digunakan sebagai krioprotektan. Krioprotektan ini telah diusulkan sebagai krioprotektan artenatif untuk pembekuan semen terutama semen yang berasal dari pejantan yang sensitif terhadap efek toksik, karena amida (DMA) memiliki berat molekul lebih rendah (87.12 g/mol) jika dibandingkan dengan gliserol (92.05 g/mol). Keberadaan gugus metil (CH3) dalam DMA dapat meningkatkan permeabilitas membran spermatozoa dan meningkatkan efisiensi dalam pembekuan (Bazzera et al. 2011). DMA merupakan derivat acyl dan mempunyai rumus struktur CH CN(CH ) terdiri atas sepasang grup fungsional dimana sebuah karbonil bergabung dengan oksigen dan halogen (Gambar 3).
Derivat acyl yang penting adalah asam klorida, ester dan amida yang mendekati struktur asam karboksilat. N,N dimethylacetamide adalah amida yang dihasilkan Nalkil tersubtitusi atau N, N-dialkil tersubtitusi, dan amida relatif stabil terhadap air (Fessenden dan Fessenden 2006). Rendahnya kualitas semen beku babi diduga akibat struktur membran plasma babi dimana mengandung
phospatidylethanolamine 24% dan sphingomyelin 14% yang lebih tinggi jika dibandingkan pada sapi yang hanya mengandung sphingomyelin 9% dan
phospatidylethanolamine 12%. Oleh sebab itu dibutuhkan pelindung membran plasma untuk menstabilkan membran sel spermatozoa saat pembekuan. Kuning telur mengandung phospholipid dalam pengencer yang sangat dibutuhkan karena melindungi spermatozoa dari cold shock pada saat pendinginan ataupun pembekuan (Amirat et al.2004).
Tahun 2010 golongan amida mulai digunakan sebagai krioprotektan artenatif pada ternak babi. Penelitian terakhir penggunaan krioprotektan golongan amida dilakukan oleh Pinho et al. (2014) dan memperoleh PTM 51.7% dalam Modena yang ditambahkan equex-STMdengan kombinasi DMA 5%.
Sodium Dodecyl Sulphate (SDS)
Sodium Dodecyl Sulphate (C12H25SO4Na) adalah surfaktan anionik yang
digunakan dalam produk industri seperti produk pembersih lantai, sabun pencuci, pasta gigi, sampo, dan lain-lain. Molekul ini mempunyai bagian hidrofobik (ekor) dan hidrofilik (kepala). Bagian hidrofilik mudah larut dalam air sedangkan bagian
10
hidrofobik baian yang mudah larut dalam minyak. Menurut Salager (2002) SDS mengandung 12 atom karbon dan yang mengikat gugus sulfat yang menjadikannya sebagai senyawa ampifilik. Struktur senyawa SDS dapat dilihat pada Gambar 4.
Molekul amphiphilik mengandung gugus hidrofilik dan lipofilik dalam molekul yang sama (Gambar 5). Menurut Buana (2013) secara umum fungsi SDS adalah untuk menstabilkan partikel yang terdispersi dan mengontrol jenis formasi emulsi baik oil in water atau water in oil, serta berfungsi untuk menurunkan tegangan permukaan. Molekul amphiphilik disajikan pada Gambar 5.
Menurut Tsutsui et al. (2000) SDS mempunyai aksi melarutkan dan meningkatkan dispersi dari molekul kuning telur dalam pengencer sehingga motilitas spermatozoa tetap terjaga. Penambahan SDS 0.05% pada bahan pengencer kuning telur dapat meningkatkan motilitas progresif sebesar 63±0.6% pada spermatozoa kambing. Motilitas progresif spermatozoa kambing tesebut tidak berbeda nyata antara suplementasi SDS 0.05% dengan SDS 0.1%, kemudian akan menurun dengan suplementasi SDS 0.2% (Aboagla dan Terada 2004b), namun penelitian penambahan SDS pada pengencer semen beku babi di Indonesia belum dilaporkan.
Zat aktif SDS dijual komersial dengan nama dagang Equex STM dan dapat dijadikan suplemen pengencer semen beku. Penambahan Equex STM paste dalam bahan pengencer dilaporkan efektif untuk meningkatkan motilitas spermatozoa, intregritas membran akrosom dan mempertahankan longivitas spermatozoa anjing (Tsuitsui et al. 2000; Ponglowhapan dan Chatdarong 2008), rusa (Cheng et al.
2004), kambing (El-Kon et al. 2010), dan babi (Pinho et al. 2014). Equex STM paste merupakan produk komersial dengan zat aktif sodium dodecyl sulphate
(SDS) yang mudah diperoleh di Indonesia dapat dijadikan suplemen pengencer semen beku. Penggunaan SDS dengan konsentrasi 0.05% pada bahan pengencer semen beku dapat mempertahankan motilitas dan viabilitas spermatozoa pada
Gambar 5 Molekul amphiphilik
11 ternak kambing (Hidayati et al. 2015), namun SDS pada tikus kurang efektif (Dewit et al. 2000).
Kriopreservasi Semen
Kriopreservasi adalah penyimpanan materi genetik dalam keadaan beku pada temperatur rendah atau dalam keadaan beku melalui reduksi aktifitas metabolisme tanpa mempengaruhi organel-organel didalam sel, fungsi fisiologi, biologi, dan morfologi.
Menurut Supriatna dan Pasaribu (1992) prinsip utama kriopreservasi adalah pengeluaran air dalam sel spermatozoa atau dikenal dengan proses dehidrasi sebelum terjadi pembekuan intraseluler. Bila tidak terjadi proses dehidrasi maka akan terbentuk kristal es dalam ukuran besar sehingga dapat merusak sel secara mekanik, namun jika terjadi dehidrasi yang hebat maka sel akan krenasi yang berujung pada kematian (plasmolisis).
Oleh karena itu, proses dehidrasi sebelum deep frezing maupun rehidrasi yang terjadi saat pencairan kembali (thawing) menjadi suatu perhatian khusus, beberapa hal yang perlu diperhatikan dalam kriopreservasi semen adalah proses dehidrasi sebelum pembekuan dan proses rehidrasi setelah thawing. Beberapa faktor yang memengaruhi kerusakan sel spermatozoa adalah 1) pembentukan kristal es, 2) cold shock, 3) osmotic shock, dan 4) radikal bebas.
Faktor pertama pembentukan kristal-krital es; jika kristal es terbentuk pada saat pembekuan maka akan menyebabkan volume es lebih besar dari volume air dan berat jenis es lebih kecil dari berat jenis air sehingga dapat menyebabkan kerusakan mekanik dari sel tersebut, yang mengakibatkan penurunan motilitas spermatozoa, viabilitas spematozoa, peningkatan pengeluaran enzim ekstra dan intraseluler serta kerusakan pada organel sel.
Faktor kedua adalah cold shock; cold shock merupakan cekaman dingin yang terjadi akibat penurunan temperatur secara mendadak dari temperatur tubuh ke temperatur dibawah 0 oC sehingga akan merubah struktur membran spermatozoa. Akibat perubahan ini akan berpengaruh terhadap motilitas dan viabilitas spermatozoa.
Faktor ketiga adalah osmotic shock; ini adalah cekaman yang terjadi pada spermatozoa bila tekanan osmotik diluar dan didalam sel tidak isotonik. Apabila spermatozoa terpapar dalam larutan hipotonik maka akan menyebabkan masuknya cairan dari luar sel ke dalam sel sehingga sel mengalami kebengkakan, atau sebaliknya jika spermatozoa terpapar larutan hipertonik maka sel akan mengalami krenasi pengerutan. Kerusakan membran sel spermatozoa merupakan gejala yang paling mudah dilihat saat terjadi cekaman osmotik seperti ekor melingkar. Menurut Tambing et al. (2003) akibat dari cekaman osmotik dapat menyebabkan penurunan motilitas, viabilitas dan integritas membran plasma spermatozoa.
12
Menurut Colenbrander et al. (1992) kerusakan membran plasma pada bagian ekor juga menyebabkan terlepasnya enzim aspartat-aminotransferase
(AspaT) sehingga produksi ATP pada mitokondria akan terhenti dan mengakibatkan spermatozoa tidak dapat bergerak. Hal ini di pertegas oleh Siswanto (2006) yang menyatakan bahwa jika terjadi kerusakan pada mitokondria maka menyebabkan rantai oksida terputus, akibatnya mitokondria tidak bisa menjalankan fungsinya sebagai penghasil energi yang akan menggertak mikrotubuli akibat pergesekan ini spermatozoa dapat bergerak progresif.
Kerusakan bagian kepala spermatozoa menyebabkan keluarnya enzim akrosin dan hyaluronidase yang berfungsi dalam proses kapasitasi, sedangkan pelepasan ion-ion bebas dalam jumlah banyak seperti kalsium dapat mengaktifkan enzim endonuclease yang dapat menghancurkan DNA dalam inti spermatozoa dan enzim transglutaminase yang akan berikatan dengan protein membran yang dapat mematikan sel. Jika lisosom rusak atau pecah akan mengakibatkan pengeluaran enzim hidrolase sehingga akan mencerna bagian sel yang lain.
Holdingtime, Equilibrasi, Pembekuan dan Thawing
Teknik pembekuan spermatozoa setiap hewan berbeda-beda karena setiap hewan memiliki susunan membran plasma yang berbeda. Komposisi membran plasma spermatozoa babi tersusun atas phosphatidylethanolamine dan
sphingomyelin yang sangat tinggi sehingga menyebabkan cold shock karena sangat sensitif terhadap penurunan suhu ekstrim (Shipley 1999; Garner dan Hafez 2000) akibatnya motilitas dan daya hidup spermatozoa pun menurun.
Menurut Paulenz et al. (2000) keunikan dari semen babi dibandingkan dengan semen hewan mamalia yang lain yaitu semen babi dapat disimpan dengan tetap mempertahankan kualitasnya pada kisaran suhu 15-22 oC (holding time) dan daya simpan semen babi yang cukup lama yaitu kisaran 3-11 hari bergantung pada bahan pengencer yang digunakan (Johnson et al. 2000; Gadea 2003; Robert 2006). Hal ini didukung oleh Althouse dan Casas (2013) yang menyatakan bahwa semen babi setelah dikoleksi dan diencerkan harus disimpan dalam suhu ruang 15-22 oC sehingga mampu mempertahankan daya hidup lebih lama. Proses ini dikenal dengan istilah Holding Time. Holding Time merupakan waktu penyesuaian spermatozoa agar mampu mempertahankan daya hidupnya. Proses ini berlangsung selama lebih kurang dua jam sebelum dilanjutkan ke tahap equilibrasi.
Equlibrasi adalah periode adaptasi spermatozoa untuk mengurangi metabolisme dengan cara menempatkan straw yang berisi semen dan pengencer semen beku pada suhu 4-5 oC selama dua jam (Yi et al. 2008) sedangkan pada sapi dan domba dilakukan selama empat jam (Arifiantini et al. 2010). Hal ini juga di pertegas oleh Leboeuf et al. (2000) yang menyatakan bahwa tahap equilibrasi dilakukan pada suhu 4 sampai dengan 5 oC selama 1.5 sampai dengan 4 jam bergantung pada ternak. Pada tahap ini terjadi kontak spermatozoa dengan krioprotektan dan bahan pengencer sebelum tahap kriopreservasi. Selama dua jam ini terjadi penetrasi gliserol kedalam spermatozoa untuk memciptakan keseimbangan konsentrasi intraseluler dan ekstraseluler.
13 kurang 12 menit dengan menggunakan box styrofoam. Setelah itu semen beku disimpan pada suhu -196 oC minimal 24 jam sampai dilakukan evaluasi (Purdy 2006). Thawing merupakan proses rehidrasi atau pencairan kembali semen beku ke bentuk cair. Proses ini pada semen beku babi dilakukan pada suhu 37 oC selama 20 detik. Pada saat thawing terjadi pencairan dan pengaliran krioprotektan intraseluler secara perlahan-lahan sehingga harus dilakukan secara hati-hati agar tidak merusak spermatozoa (Leboeuf et al. 2000).
Semen beku merupakan teknologi yang efektif untuk mendapatkan pejantan unggul dari dalam dan luar negeri, dapat disimpan dalam waktu yang sangat lama dan bebas dari penyakit menular yang disebabkan kawin alam. Namun pengembangan ternak babi di Indonesia masih menggunakan kawin alamiah dan sebagian besar IB semen cair meskipun daya hidup terbatas pada pengencer yang digunakan, penggunaan semen beku babi di Indonesia baru dilakukan di beberapa peternakan besar seperti d PT. Adhi farm Solo dan PT. Fajar Lestari Kalimantan Barat, kendala harga yang sangat mahal kerena didatangkan dari Kanada.
Inseminasi Buatan pada Ternak Babi
Inseminasi buatan merupakan teknik pengawinan dengan memanfaatkan pejantan unggul secara maksimal untuk perbaikan mutu genetik dan produktivitas ternak. Pejantan yang akan digunakan dalam IB harus teruji mutunya dalam hal performa, fisik, kesehatan dan manajemen pemeliharaan yang memenuhi standar. Menurut Sihombing (1997) periode yang efektif untuk menginseminasi adalah sekitar 24 hingga 36 jam setelah onset estrus.
Berdasarkan Standar Nasional Indonesia (SNI) No. 8034 tahun 2014 untuk semen cair babi, persyaratan mutu semen cair babi yang digunakan harus tidak mengandung mikroorganisme dan untuk semen cair babi yang sudah diawetkan atau preservasi suhu 16-18 oC harus menunjukkan motilitas minimal 40% dan gerakan individu spermatozoa minimal skor 2(dua), dengan konsentrasi 200-300.106 sel/ml dan jumlah spermatozoa motil 2500-3000.106 sel/ml dalam kemasan tube/botol 80-100 ml. Standar IB dengan menggunakan semen beku, berpatokan pada sertifikat yang dikeluarkan oleh Swine Genetic International
(SGI) dengan motilitas minimal 40% dan jumlah spermatozoa motil 5.500.106 sel/ml dalam kemasan makrotube 5 ml.
14
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian dilakukan di PT. Adhi farm yang berlokasi di Kabupaten Karang Anyar, Kelurahan Sroyo, Desa Sapreh Solo, Jawa Tengah. Penelitian dilaksanakan pada bulan Februari-Juni 2015. Penelitian ini telah disetujui oleh Komisi Etik Hewan Fakultas Kedokteran Hewan IPB dengan Nomor: 023/KEH/SKE/III/2015.
Sumber Semen
Semen segar berasal dari empat ekor babi jantan dewasa kelamin, berasal dari breed duroc, cross breed dan yorkshire yang berumur 1-4 tahun. Babi dipelihara dalam kandang individual. Pakan diberikan sebanyak 3 kg/ekor/hari dalam bentuk konsentrat racikan sendiri dan air minum yang diberikan secara ad libitum.
Tahap Penelitian
Penelitian dilaksanakan dalam 4 tahap yaitu : 1. Pemeriksaan karakteristik semen segar.
2. Penambahan gliserol, DMA, dan kombinasi gliserol DMA dalam pengencer BTSatau MIII.
3. Penambahan SDS dalam bahan pengencer semen beku. 4. Uji fertilitas semen beku.
Tahap 1: Pemeriksaan Karakteristik Semen Segar
Semen dikoleksi dua kali dalam seminggu, menggunakan glove hand method dan dummy sow. Tabung penampung dilengkapi dengan kertas saring untuk menyaring fraksi gelatin. Pemeriksaan karakteristik semen meliputi evaluasi makroskopis dan evaluasi mikroskopis.
Evaluasi makroskopis semen segar dilakukan secara visual yang meliputi:
Volume, volume semen segar diukur dengan melihat skala yang tercantum pada gelas ukur.
Warna, warna semen segar diidentifikasi secara visual. Normalitas warna semen babi adalah putih keruh.
Derajat keasaman (pH), pengujian pH dengan menggunakan pH indikator
paper (Merck scala 6.4-8). pH normal pada babi berkisar 7.4-7.8.
Konsistensi, pengamatan konsistensi semen babi diketahui dengan cara memiringkan tabung dan meluruskan kembali tabung penampung. Konsistensi semen babi normal adalah encer.
Evaluasi mikroskopis dilakukan dengan menggunakan mikroskop binokuler (Olympus CX21) dengan pembesaran 10x40, meliputi:
15 spermatozoa yang progresif maju ke depan dengan gerakan spermatozoa yang tidak progresif seperti reverse, circuler, vibrator dan tidak bergerak atau mati.
Konsentrasi Spermatozoa (jumlah spermatozoa/ml semen), pemeriksaan konsentrasi dihitung dengan menggunakan kotak hitung Neubauer dengan pengenceran 100 kali (10 µL semen dalam 990 µL formolsaline).
Persentase viabilitas spermatozoa/pemeriksaan spermatozoa hidup,
pengamatan viabilitas spermatozoa menggunakan zat pewarna eosin-nigrosin. Spermatozoa dihitung minimal 200 sel dari 10 lapang pandang. Spermatozoa yang hidup/viable tidak menyerap warna (transparan) dan yang mati akan menyerap warna merah pada bagian kepala, dihitung dengan rumus:
₃
Persentase morfologi abnormalitas spermatozoa, morfologi spermatozoa menggunakan pewarnaan carbofucshin, sesuai Arifiantini et al. (2012). Morfologi diklasifikasi berdasarkan kelainan pada bagian kepala (abnormalitas primer) dan bagian leher dan ekor (abnormalitas sekunder), Spermatozoa dihitung minimal 200 sel dari 10 lapang pandang, dihitung dengan rumus:
₃ ₃ ₃
Semen yang menunjukkan motilitas >70% dengan konsentrasi >200.106 sel/ml dengan abnormalitas <20%, yang digunakan dalam penelitian ini.
Tahap 2: Pengaruh Penambahan Gliserol, DMA, dan Kombinasi Gliserol
-DMA dalam Pengencer BTSdan MIII
Proses pembekuan semen terdiri atas beberapa tahapan meliputi: 1. Penyiapan bahan pengencer dasar
2. Penyiapan bahan pengencer semen beku 3. Pengenceran dan pembekuan semen 4. Evaluasi pasca pembekuan
Penyiapan Bahan Pengencer Dasar
Bahan pengencer dasar yang digunakan adalah pengencer komersial BTS® dan MIII® (Minitub Germany). Proses pengenceran sebagai berikut: 50 g BTS® dan 60 g MIII® masing-masing diencerkan dengan aquadest secara perlahan hingga mencapai 1000 ml (Tabel 3). Kedua pengencer selanjutnya disimpan pada suhu 37 oC.
Tabel 3 Komposisi pengencer dasar BTS® dan MIII®
Bahan BTS® MIII®
BTS® (g) 50 -
MIII® (g) - 60
16
Penyiapan Bahan Pengencer Semen Beku
Bahan pengencer semen beku terdiri atas pengencer dasar 80% ditambah 20% kuning telur, setelah itu dihomogenkan dan disentrifus dengan kecepatan 2000 rpm selama 15 menit. Pellet dibuang dan supernatan ditambahkan krioprotektan gliserol, DMA, dan kombinasi gliserol-DMA. Komposisi pengencer BTS/MIII (Tabel 4).
Tabel 4 Komposisi pengencer BTS dan MII semen beku
Pengencer Bahan
BTS/MIII(%) Gliserol(%) DMA(%)
BTSG 95 5 -
BTSD 95 - 5
BTSGD 95 2 3
MIIIG 95 5 -
MIIID 95 - 5
MIIIGD 95 2 3
BTS-gliserol (BTSG), BTS-DMA (BTSD), BT-gliserol-DMA (BTSGD) MIII-gliserol
(MIIIG), MIII-DMA (MIIID), MIII-gliserol-DMA (MIIIGD)
Pengenceran dan Pembekuan Semen pada pengencer BTS dan MIII
Proses dan tahapan pengenceran semen beku untuk pengencer BTS sama dengan pengenceran semen beku untuk pengencer MIII. Semen dibagi ke dalam tiga tabung dengan perbandingan semen dan pengencer dasar 8 : 5. Semen yang telah diencerkan disimpan pada suhu ruang 20-22 oC selama dua jam (holding time), selanjutnya disentrifus dengan kecepatan 2000 rpm selama 15 menit. Pellet
dalam satu ml supernatan diencerkan kembali dengan pengencer semen beku.
Pellet BTS diencerkan dengan pengenecr BTSG, BTSD, dan BTSGD sedangkan pellet MIII diencerkan dengan pengencer MIIIG, MIIIG, dan MIIIGD sesuai perlakuan (Tabel 4). Setelah itu semen yang telah diencerkan dikemas dalam straw 0.5 ml, dengan konsentrasi 200 juta/0.5 ml, kemudian disusun dalam rak pembekuan dan diekuilibrasi pada suhu 4-5 oC selama dua jam. Setelah itu dilanjutkan pembekuan semen di atas permukaan uap N2 cair dengan jarak 4 cm selama 20 menit (Yi et al. 2008) dan selanjutnya disimpan di dalam kontainer N2 cair (-196 oC) untuk pengujian lebih lanjut. Jumlah pengencer yang ditambahkan dihitung dengan menggunakan rumus sebagai berikut:
₃ ₃ ₃ ₃ ₃
₃ ₃ ₃ Keterangan:
V = Volume pellet
17
Evaluasi Pasca Pembekuan
Evaluasi semen beku pasca pembekuan dilakukan minimal 24 jam setelah penyimpanan. Tahapan evaluasi pasca pembekuan meliputi: Straw semen beku dicairkan kembali (thawing) dalam waterbath dengan suhu 37 oC selama 30 detik. Setelah itu dilakukan evaluasi meliputi motilitas dan viabilitas spermatozoa seperti Tahap 1.
Tahap 3: Pengaruh Penambahan SDS dalam Bahan Pengencer Semen Beku
Penyiapan Bahan Pengencer Dasar
Bahan pengencer BTS® 50 g dan MIII® 60 g masing-masing diencerkan dengan aquadest secara perlahan hingga mencapai 1000 ml. setelah itu kedua pengencer disimpan pada suhu 37 oC.
Penyiapan Bahan Pengencer Semen Beku
Penyiapan bahan pengencer semen beku terdiri dari: pengencer dasar BTS dan MIII 80% ditambah 20% kuning telur (KT), BTS-KT dan MIII-KT dihomogenkan dan disentrifus dengan kecepatan 2000 rpm selama 15 menit. Supernatan BTS dan MIII ditambahkan krioprotektan gliserol dan DMA yang disuplementasikan dengan SDS (Tabel 5).
Tabel 5 Komposisi pengencer BTS dan MII semen beku dengan penambahan SDS
Pengencer Bahan
BTS (%) MIII (%) SDS (%) Gliserol (%) DMA(%)
BTSG 95 - - 5 -
BTSD 95 - - - 5
BTSGS 95 - 0.05 5 -
BTSDS 95 - 0.05 - 5
MIIIG - 95 - 5 -
MIIID - 95 - - 5
MIIIGS - 95 0.05 5 -
MIIIDS - 95 0.05 - 5
BTS-gliserol (BTSG); BTS-DMA (BTSD); BTS-gliserol-SDS(BTSGS); BTS-DMA-SDS
(BTSDS); MIII-gliserol (MIIIG);MIII-DMA (MIIID); BTS-gliserol-SDS (MIIIGS); MIII-DMA
SDS (MIIIDS)
Pengenceran dan Pembekuan Semen
Semen dibagi ke dalam 8 tabung yaitu empat tabung pertama ditambahkan pengencer dasar BTS dan empat tabung lainnya ditambahkan pengencer dasar MIIIdengan perbandingan 8:5 ml. Semen yang telah diencerkan di-holding time
18
pengencer semen beku sesuai perlakuan (Tabel 5). Perhitungan jumlah pengencer yang ditambahkan sama dengan perhitungan pada Tahap 2.
Semen yang telah diencerkan dan dikemas dalam straw 0.5 ml, dengan konsentrasi 200 juta/0.5 ml, kemudian disusun dalam rak pembekuan dan diekuilibrasi pada suhu 4-5 oC selama dua jam. Pembekuan semen dilakukan di atas permukaan uap N2 cair dengan jarak 4 cm selama 10 menit dan disimpan di dalam kontainer N2 cair (-196 oC) untuk pengujian lebih lanjut. Evaluasi semen pasca pembekuan dilakukan minimal 24 jam setelah penyimpanan. Semen beku dicairkan kembali (thawing) dalam waterbath dengan suhu 37 oC selama 20 detik. Setelah itu dilakukan evaluasi terhadap motilitas dan viabilitas spermatozoa seperti Tahap 1.
Tahap 4: Uji Fertilitas Semen Beku
Penyiapan Betina Estrus
Pengujian fertilitas semen beku dilakukan pada 10 ekor betina paritas yang menunjukkan gejala estrus alamiah. Gejala estrus yang nampak seperti berdiri diam, tegak, dan kaku bila ditekan punggungnya, alat kelamin luar mengalami perubahan yaitu agak bengkak dan haemorhagis. Inseminasi buatan dilakukan 24 jam dan 36 jam setelah onset estrus. Penyiapan betina yang akan di IB meliputi pembersihan vulva dengan air atau kertas tissu pembersih, dilanjutkan dengan menggunakan alkohol konsentrasi rendah dan NaCl Fisiologi 0.9%.
Penyiapan Straw dan Gun Kateter
Straw semen yang digunakan berasal dari hasil pengujian semen beku terbaik Tahap 3. Penyiapan straw sebagai berikut dua puluh lima straw yang terbaik Tahap 3 di-thawing dalam waterbath pada suhu 37 oC selama 20 detik. Straw di-pool menjadi satu dan dikemas dalam kemasan semen cair yang telah berisi 80 ml bahan pengencer dasar.
Alat yang digunakan yaitu gun kateter IB babi. Sebelum IB ujung gun kateter diberi pelicin atau pelumas nonspermiosidal seperti jelly.
Cara Inseminasi Buatan
Gun kateter babi yang digunakan berujung spiral dimasukan ke arah vagina dengan cara memutar berlawanan arah jarum jam dengan posisi agak sedikit miring ke atas untuk mencegah kateter masuk ke dalam uretra. Setelah ujung terjepit dalam servik masukan botol/tube yang berisi semen yang telah diencerkan dan diangkat lebih tinggi dari betina yang diinseminasi.
Keberhasilan inseminasi dihitung dengan rumus sebagai berikut:
19
Prosedur Analisis Data
20
HASIL DAN PEMBAHASAN
Karakteristik Semen Segar
Pemeriksaan kualitas semen segar babi bertujuan untuk mengevaluasi tingkat pengenceran yang akan digunakan. Syarat semen segar yang dibekukan adalah persentase motilitas spermatozoa minimal 70%, konsentrasi minimal 200.106 sel/ml dan morfologi abnormalitas spermatozoa maksimal 20% (Johnson
et al. 2000).
Pemeriksaan karakteristik semen segar babi secara makroskopis menunjukkan volume berkisar 139-205 ml dengan rerata 176±4.85 ml, berwarna putih keruh, dan konsistensi encer serta pH berkisar 7.28-7.59 dengan rerata 7.40±0.066 (Tabel 6).
Tabel 6 Karakteristik semen segar babi (Mean±SEM) Karakteristik Timberwolf
Motilitas Spermatozoa (%) 79.17±0.17 82.33±1.16 81.73±0.37 80.17±1.16 80.85±0.72
Velocity 3 3 3 3 3
Konsentrasi Spermatozoa (106 sel/ml)
457.67±13.00 416.00±3.33 458.00±7.67 384.00±9.00 429.17±7.93
Viabilitas Spermatozoa (%) 88.39±0.67 89.09±0.25 88.79±0.53 88.17±0.42 88.61±0.21 Abnormalitas Spermatozoa (%) 7.25±0.24 6.45±0.31 6.74±0.55 6.77±0.80 6.87±0.23
Karakteristik semen segar yang dihasilkan tidak jauh berbeda dengan hasil penelitian Gadea (2003) dan Robert (2006) yang menyatakan bahwa volume semen babi tanpa gelatin berkisar 150-250 ml, dengan konsistensi encer dan pH berkisar 7.40±0.2. Adapun faktor-faktor yang memengaruhi karakteristik secara makroskopis adalah variasi umur dari pejantan, tingkat stimulasi, kualitas pakan, dan frekuensi ejakulasi.
Hasil pemeriksaan mikroskopik menunjukkan persentase motilitas spermatozoa berkisar 79.17-82.33% dengan rerata 80.85±0.72% dan persentase viabilitas spermatozoa berkisar 88.17-89.09% dengan rerata 88.61±0.21%. Hasil Pemeriksaan persentase motilitas dan viabilitas spermatozoa ini tidak jauh berbeda dengan hasil penelitian Garner dan Hafez (2000) yaitu berkisar 50-80% dan 70-90%.
21 mati mempunyai permeabilitas membran yang tinggi sehingga akan menyerap warna yang dipaparkan sedangkan spermatozoa yang hidup tidak akan menyerap warna (transparan) pada bagian kepala spermatozoa (Gambar 2).
Konsentrasi spermatozoa hasil penelitian mencapai 429.17±7.93.106 sel/ml berkisar 384-456.106 sel/ml. Hasil ini lebih tinggi dari hasil penelitian Garner dan Hafez (2000); Gadea (2000); Sumardani et al.(2008); Gadea (2003) yaitu 200-300.106 sel/ml. Menurut Johnson et al. (2000) faktor-faktor yang dapat memengaruhi konsentrasi spermatozoa adalah breed, genetik, jumlah ejakulat, umur pejantan, kandungan pakan, dan temperatur. Persentase abnormalitas spermatozoa hasil penelitian tergolong rendah yaitu berkisar 6.45-6.77% dengan rerata 6.87±0.23%. Beberapa abnormalitas spermatozoa yang ditemukan pada penelitian ini adalah detached head, coil under the head, cytoplasmic droplet, double heads, abaxial, abaxial, dan coiled tail Gambar 7.
Gambar 6 spermatozoa hidup dan mati dengan pewarnaan eosin nigrosin (a) spermatozoa hidup dan (b) spermatooza mati (perbesaran 400 kali)
a b
Gambar 7 Abnormalitas spermatozoa (a) detached head (b) coil under the head (c) cytoplasmic droplet (d) double head (e) abaxial (f)
asimetris tail (g) coiled tail (perbesaran 400 kali) b
a e
a
g
e
f f
22
Kualitas semen beku dalam pengencer BTS dan MIII dengan penambahan krioprotektan gliserol, DMA, dan kombinasi gliserol-DMA
Tujuan penelitian pada tahap ini, untuk mengetahui kompisisi pengencer semen beku yang terbaik pada BTS maupun MIII. Pengencer semen merupakan media yang secara langsung memengaruhi kelangsungan hidup spermatozoa.
Kualitas semen beku dalam pengencer BTS
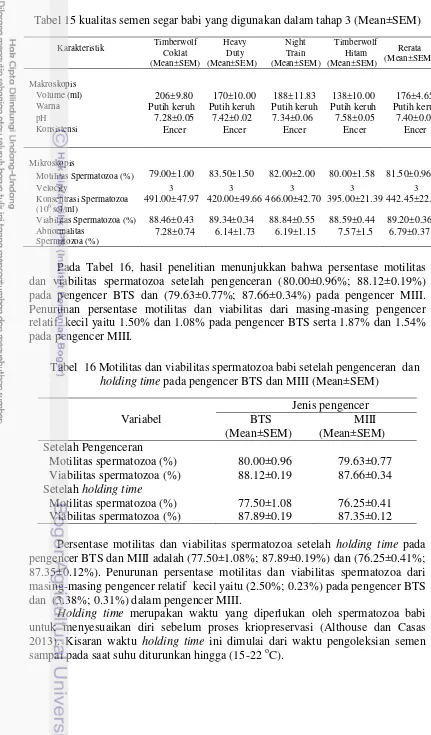
Hasil evaluasi semen segar pada Tahap IIa secara makros dan mikroskopis menunjukkan motilitas spermatozoa yaitu 79.6±1.46%, dengan konsentrasi spermatozoa 412±27.75.106 sel/ml dan abnormalitas spermatozoa 7.13±1.15%. Semen yang dihasilkan dari empat ekor pejantan sesuai standar, dengan demikian semen layak dipakai dalam kriopreservasi (Tabel 7).
Tabel 7 Kualitas semen segar babi yang digunakan dalam pengencer BTS semen beku (Mean±SEM)
Motilitas Spermatozoa (%) 79.00±1.00 83.50±1.50 82.00±2.00 80.00±1.58 80.60±1.46
Velocity 3 3 3 3 3
Konsentrasi Spermatozoa (106 sel/ml)
491±47.97 420±49.66 466±42.70 395±21.39 412±27.75
Viabilitas Spermatozoa (%) 88.46±0.43 89.34±0.34 88.84±0.55 88.59±0.44 88.16±0.54 Abnormalitas Spermatozoa (%) 7.28±0.74 6.14±1.73 6.19±1.15 7.57±1.50 7.13±1,15
Pada Tabel 8 menunjukkan bahwa persentase motilitas dan viabilitas spermatozoa berturut-turut dari pengamatan semen segar (80.60±1.46%; 88.16±0.54%), setelah pengenceran (80.00±0.60%; 88.12±0.19%) sampai dengan setelah holding time (77.50±0.65%; 87.10±0.31%). Setelah dua jam holding time
motilitas dan viabilitas spermatozoa mengalami penurunan yang tidak signifikan yaitu 3.1% untuk motilitas spermatozoa dan 1.06% untuk viabilitas spermatozoa (Tabel 8).
23 Tabel 8 Motilitas dan viabilitas spermatozoa setelah pengenceran dan setelah
Holding time pada pengenecer BTS (Mean±SEM)
Variabel Semen segar Motilitas Spermatozoa (%) 80.60±1.46 80.00±0.60 77.50±0.65 Viabilitas Spermatozoa (%) 88.16±0.54 88.12±0.19 87.10±0.31
Persentase motilitas spermatozoa dengan perlakuan BTSD, BTSG dan BTSGD pada suhu penyimpanan 5 oC berturut-turut adalah 56.38±4.13%, 54.88±2.56%, dan 51.00±1.87% (Tabel 9).
Tabel 9 Persentase motilitas spermatozoa dalam pengencer BTS pada berbagai Setelah equilibrasi 56.38±4.13a 54.88±2.56ab 51.00±1.87b Setelah thawing 20.92±0.91a 15.67±0.70b 12.33±0.36c Angka yang diikuti huruf yang sama pada baris menunjukkan tidak berbeda nyata pada taraf nyata 5 %; pengencer BTS-gliserol (BTSG); BTS-DMA (BTSD); BTS-gliserol-DMA (BTSGD)
Meskipun mengalami penurunan setelah equilibrasi antara 18.50 sampai dengan 23.38%, namun motilitas spermatozoa lebih unggul dari hasil penelitian Dapawole (2014) yaitu 44.00±00.00% pada pengencer BTS dengan gliserol 4%. Penyimpanan pada suhu 4 oC akan menyebabkan perubahan fase cair ke gel. Namun proses metabolisme sel masih berlangsung meskipun hanya 10% saja (McKinnon 1999). Prinsip penekanan metabolisme dalam preservasi ini masih memungkinkan spermatozoa tetap melakukan aktivitas seluler.
Pengencer BTSD, BTSG dan BTSGD sangat berpengaruh nyata terhadap motilitas spermatozoa (P<0.05). Hasil penelitian memperlihatkan bahwa pengencer BTSD 25.92±0.91% lebih unggul jika dibandingkan pengencer BTSG 20.67±0.70%, dan BTSGD 17.33±0.36%. Penurunan persentase motilitas spermatozoa dari pengenceran setelah sentrifugasi sampai dengan setelah thawing
sangat signifikan. Hal ini disebabkan oleh penurunan suhu ekstrim dari 22 oC (holdingtime) ke suhu 4 oC (equilibrasi) dan suhu -196 oC (pembekuan).
Menurut Watson (2000) penurunan suhu menyebabkan cold shock. Cold shock berpengaruh terhadap perubahan struktur phospholipid membran plasma spermatozoa yang berujung pada kerusakan membran. Kerusakan membran plasma spermatozoa di bagian midpiece menyebabkan terlepasnya enzim
aspartat-aminotransferase (AspAT) pada mitikondria yang berfungsi memproduksi energi dalam bentuk ATP, dimana ATP dipakai sebagia sumber pergerakan bagi speratozoa (Colenbrander et al. 1992).