PENAPISAN BAKTERI PENGHASIL SENYAWA
ANTIMIKROB ASAL SPONS LAUT
NYDIA AINUR SURWENDA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Penapisan Bakteri Penghasil Senyawa Antimikrob Asal Spons Laut adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
ABSTRAK
NYDIA AINUR SURWENDA. Penapisan Bakteri Penghasil Senyawa Antimikrob Asal Spons Laut. Dibimbing oleh ARIS TRI WAHYUDI dan SRI LISTIYOWATI
Spons merupakan invertebrata yang banyak terdapat pada ekosistem terumbu karang. Spons memproduksi banyak senyawa bioaktif sebagai hasil dari metabolit sekunder. Senyawa bioaktif tersebut sebagian besar dihasilkan oleh kehadiran mikroorganisme pada jaringan spons sebagai simbion. Senyawa bioaktif yang dihasilkan dapat berpotensi dalam bidang biomedis dan farmasi, di antaranya sebagai antimikrob. Penelitian ini bertujuan menapis bakteri asal spons laut dari Pulau Bira, Kepulauan Seribu, Provinsi DKI Jakarta, yaitu Callyspongia sp. dan Petrosia sp. yang berpotensi menghasilkan senyawa antimikrob. Hasil isolasi dengan menggunakan enam jenis medium menunjukkan bahwa sebanyak 147 isolat bakteri berhasil diisolasi dari spons jenis Callyspongia sp. dan Petrosia sp. Medium yang cocok digunakan untuk mengisolasi bakteri simbion spons agar didapatkan jenis koloni bakteri yang beragam, yaitu medium Nutrient Agar dan Zobel Marine Agar. Hasil penapisan menunjukkan bahwa 26 isolat (13%) menghasilkan senyawa antimikrob. Sebanyak tujuh isolat bakteri (5%) di antaranya mampu menghambat lima bakteri target, yaitu Pseudomonas aeruginosa, Staphylococcus aureus, Bacillus subtilis, Escherichia coli (ATCC 8739), dan Enterophatogenic Escherichia coli (EPEC). Isolat tersebut adalah CAL36, CAL42, PTR8, PTR21, PTR40, PTR41, dan PTR47. Pewarnaan Gram yang dilakukan terhadap ke-26 isolat bakteri tersebut menunjukkan bahwa semua isolat termasuk ke dalam kelompok bakteri gram negatif. Isolat yang bersifat hemolisis positif berasal dari spons jenis Callyspongia sp. dengan jumlah enam isolat, yaitu CAL22, CAL24, CAL25, CAL26, CAL34, dan CAL49.
ABSTRACT
NYDIA AINUR SURWENDA. Screening of Bacteria Producing Antimicrobial Compounds Isolated from Marine Sponges. Supervised by ARIS TRI WAHYUDI and SRI LISTIYOWATI.
Sponges are invertebrate found on coral reef ecosystems. Sponges produce many bioactive compounds as a result of secondary metabolites. The bioactive compounds is produced by microorganisms in the presence of sponges tissue as symbionts. Bioactive compounds are potential to be used in the biomedical and pharmaceutical fields, one of them is antimicrobial. This study aims to screen bacteria from marine sponges of Bira Island, Thousand Islands, DKI Jakarta Province, namely Callyspongia sp. and Petrosia sp. that could potentially produce antimicrobial compounds. The results of isolation using six types of medium showed a total of 147 bacterial isolates were isolated from the sponge type Callyspongia sp. and Petrosia sp. The suitable mediums used to isolate bacteria associated with sponge to obtain various types of bacterial colonies, were medium Nutrient Agar and Zobel Marine Agar. The results of the screening obtained from 26 isolates (13%) could produce antimicrobial compound. Seven isolates (5%) of them were able to inhibit five bacterial targets, i.e. Pseudomonas aeruginosa, Staphylococcus aureus, Bacillus subtilis, Escherichia coli (ATCC 8739), and Enterophatogenic Escherichia coli (EPEC). The isolates were CAL36, CAL42, PTR8, PTR21, PTR40, PTR41 and PTR47. Gram staining performed on 26 bacterial isolates showed all of them belong to the group of gram-negative bacteria. Six isolates among 26 isolates were positive hemolysis derived from the sponge type Callyspongia sp., namely CAL22, CAL24, CAL25, CAL26, CAL34, and CAL49.
PENAPISAN BAKTERI PENGHASIL SENYAWA
ANTIMIKROB ASAL SPONS LAUT
NYDIA AINUR SURWENDA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Alhamdulillah puji serta syukur penulis panjatkan kehadirat Allah SWT atas berkah, rahmat, dan hidayah-Nya sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul “Penapisan Bakteri Penghasil Senyawa Antimikrob Asal Spons Laut” yang telah dilaksanakan sejak bulan Februari hingga Juli 2014 di Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Bapak Prof. Dr. Aris Tri Wahyudi, M.Si selaku pembimbing I dan Ibu Dr. Sri Listiyowati, M.Si selaku pembimbing II atas segala bimbingan, saran, pengertian, serta kepercayaannya kepada penulis selama penelitian berlangsung. Terima kasih kepada Ibu Dr. Ir. Tatik Chikmawati, M.Si selaku penguji atas saran-sarannya yang telah diberikan. Terima kasih kepada Ibu Ir. Dyah Murtiningsih, M.Hum dan Bapak Yohanes selaku pihak dari Balai Taman Nasional Kepulauan Seribu atas segala bantuannya. Terima kasih juga kepada Bapak Beginer Subhan, S.Pi, M.Si dan Kak Mahardika atas bantuannya dalam proses pengambilan sampel serta identifikasi spons. Penulis juga mengucapkan terima kasih kepada Bapak Agus Laboran FKH yang telah membantu membuatkan agar darah, Kak Rahayu, Kak Cessa, Kak Noor, Kak Ai, Kak Sasa, Mbak Gege, Kak Fadhil, Kak Icha, Bapak Jaka, Ibu Heni, serta seluruh Kakak-Kakak S2 dan S3 di Laboratorium Mikrobiologi atas bantuan dan sarannya selama penelitian berlangsung.
Penulis juga mengucapkan terima kasih kepada kedua orang tua, Ayahanda Hendra Surwenda dan Ibunda Siti Saotika atas dukungan, doa, dan kasih sayangnya, serta keluarga Cendana, sahabat, dan teman-teman Biologi 47 yang telah menghiasi perjalanan hidup penulis selama menempuh S1 di Departemen Biologi.
Akhir kata, penulis berharap semoga karya ilmiah ini dapat bermanfaat bagi para pembacanya serta bagi perkembangan ilmu pengetahuan.
Bogor, September 2014
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 1
METODE 2
Waktu dan Tempat 2
Bahan 2
Prosedur 2
HASIL DAN PEMBAHASAN 4
Isolasi Bakteri dari Sampel 4
Penapisan Bakteri Penghasil Senyawa Antimikrob 6
Pewarnaan Gram 11
Uji Hemolisis 12
SIMPULAN DAN SARAN 13
Simpulan 13
Saran 13
DAFTAR PUSTAKA 14
LAMPIRAN 16
DAFTAR TABEL
1 Diameter zona hambat isolat-isolat bakteri asal spons laut yang menghasilkan senyawa antimikrob 8 2 Indeks zona hambat isolat-isolat bakteri asal spons laut yang
menghasilkan senyawa antimikrob 9 3 Hasil pewarnaan Gram dan uji hemolisis 12
DAFTAR GAMBAR
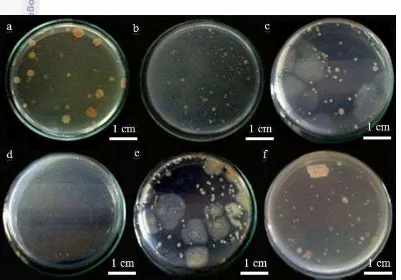
1 Penampilan spons a. Callyspongia sp. dan b. Petrosia sp., asal Pulau Bira, Kepulauan Seribu, Provinsi DKI Jakarta 2 2 Penampilan koloni bakteri (umur 24 jam) yang diisolasi dari spons laut
jenis Callyspongia sp. (a-e) dan Petrosia sp. (f) pada berbagai medium: a. NA; b. SCA; c. SWC; d. MA; e. Zobel; f. YMA 4 3 Jumlah bakteri yang berhasil diisolasi dari spons laut jenis
Callyspongia sp. dan Petrosia sp. dengan menggunakan beberapa media, yaitu NA, SCA, SWC, MA, YMA, dan Zobel 5 4 Penampilan zona hambat (umur 48 jam) yang dihasilkan oleh beberapa
isolat bakteri terhadap a. P. aeruginosa, b. S. aureus, c. B. subtilis, d.
EPEC, e. E. coli (ATCC 8739) 7
5 Jumlah isolat bakteri asal spons laut jenis Callyspongia sp. dan Petrosia sp. penghasil senyawa antimikrob yang mampu menghambat
mikrob target 10
6 Hasil pewarnaan Gram isolat CAL36: a. Profil koloni isolat CAL36 pada media SWC dan b. Hasil pewarnaan bakteri gram negatif isolat
CAL36 11
7 Penampakan beta hemolisis (umur 48 jam) pada isolat bakteri CAL22, CAL24, CAL25, CAL26, CAL34, dan CAL49 yang ditumbuhkan pada
medium agar darah 13
DAFTAR LAMPIRAN
1 Peta lokasi pengambilan sampel 16 2 Komposisi media untuk 1 liter 17 3 Ciri-ciri koloni isolat-isolat bakteri yang diisolasi dari sponslaut jenis
PENDAHULUAN
Latar Belakang
Spons tergolong dalam hewan invertebrata yang banyak terdapat pada ekosistem terumbu karang (Pringgenies 2010). Spons juga merupakan organisme filter feeder yang memiliki banyak pori tipis pada permukaan tubuhnya, sehingga mikroorganisme serta partikel organik dapat disaring dan dimakan (Wilkinson 1978). Mikroorganisme yang tersaring, akan bersimbiosis dengan spons. Mikroorganisme tersebut memakai tubuh spons yang berpori-pori sebagai inang untuk tempat hidup dan perlindungan (Taylor et al. 2007). Hampir 40-50% dari jaringan spons terdapat mikrob simbion (Proksch et al. 2002). Simbiosis mikroorganisme pada spons ada yang bersifat eksosimbion maupun endosimbion. Eksosimbion terjadi pada permukaan luar spons, sedangkan endosimbion terjadi pada bagian mesohyl (Lee et al. 2001)
Spons memproduksi banyak senyawa bioaktif sebagai hasil dari metabolit sekunder. Senyawa bioaktif tersebut sebagian besar dihasilkan oleh kehadiran mikroorganisme pada jaringan spons sebagai simbion. Mikroorganisme yang berasosiasi dengan spons memiliki beberapa peran, meliputi penyedia nutrien tertentu, menstabilkan rangka spons, dan memproduksi metabolit sekunder (Hentschel et al. 2002). Senyawa bioaktif yang dihasilkan oleh mikroorganisme simbion merupakan salah satu bentuk pertahanan bagi hewan invertebrata laut yang sesil (Berdy 2005). Senyawa bioaktif yang dihasilkan spons merupakan senyawa bioaktif yang dihasilkan oleh simbionnya. Senyawa bioaktif yang dihasilkan oleh spons mulai banyak dipelajari karena dapat berpotensi dalam bidang biomedis dan farmasi, salah satunya yaitu sebagai antimikrob, sehingga senyawa tersebut dapat digunakan untuk mengobati berbagai penyakit yang disebabkan oleh mikroba patogen (Thomas et al. 2010).
Eksploitasi senyawa bioaktif dengan cara mengekstraksi dari organisme spons dapat menghabiskan kekayaan spons laut. Penggunaan bakteri yang bersimbiosis dengan spons untuk menghasilkan senyawa bioaktif lebih sesuai dibandingkan dengan mengisolasi dari inangnya, karena bakteri dapat dimurnikan dan dikultur dalam skala laboratorium, dan dapat diperbanyak dalam waktu yang lebih cepat, serta relatif lebih mudah dimanipulasi dengan menggunakan teknologi molekuler sehingga tidak harus menghabiskan banyak spons serta merusak kekayaan laut (Abubakar 2009). Menurut West et al. (2000), untuk mendapatkan 2 gram senyawa Peloruside A murni dibutuhkan 200 kg ekstrak dari Mycale hentscheli.
Tujuan Penelitian
2
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Februari sampai dengan Juli 2014 di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB.
Bahan
Bahan yang digunakan dalam penelitian ini adalah spons yang diambil dari Pulau Bira, air laut, akuades, NaCl fisiologis, media Sea Water Complete (SWC), Marine Agar (MA), Starch Casein Agar (SCA), Zobel Marine Agar, Nutrient Agar (NA), Yeast Malt Extract Agar (YMA), Potato Dextrose Agar (PDA), dan Potato Dextrose Broth (PDB) (Lampiran 2). Senyawa antibakteri diujikan terhadap Pseudomonas aeruginosa, Staphylococcus aureus, Bacillus subtilis, Escherichia coli (ATCC 8739), dan Enterophatogenic Escherichia coli (EPEC), sedangkan senyawa antikhamir diujikan terhadap Candida albicans dan Candida tropicalis.
Prosedur
Pengambilan Sampel
Spons diambil dari Pulau Bira, Kepulauan Seribu, Provinsi DKI Jakarta (Lampiran 1). Pengambilan spons dilakukan dengan menelusuri laut pada tingkat kedalaman yang berbeda (1.5 meter hingga 3 meter dari permukaan laut) menggunakan teknik selam permukaan (Snorkeling). Spons kemudian dimasukkan ke dalam plastik sampel yang telah berisi air laut dan diberi ruang udara. Selanjutnya spons ditempatkan dalam coolbox untuk analisis mikrobiologis di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB. Identifikasi spons dilakukan oleh Beginer Subhan, S.Pi, M.Si, dosen di Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan, IPB (Komunikasi pribadi). Spons tersebut adalah Callyspongia sp. dan Petrosia sp. (Gambar 1).
3
Isolasi Bakteri dari Sampel
Permukaan spons dibilas dengan air laut steril, sehingga hanya bakteri dengan daya simbiosis yang kuat saja yang akan tersampling (Amstrong et al. 2001). Bakteri hanya diisolasi dari bagian jaringan 1 spons Callyspongia sp. dan 1 spons Petrosia sp. Bakteri tersebut diisolasi dengan cara memotong bagian spons sebanyak ±1 gram, digerus, dan diencerkan dengan NaCl fisiologis steril (Kim et al. 2006). Selanjutnya hasil isolasi dibuat suspensi dari pengenceran 10-1 sampai 10-7. Hasil pengenceran 10-3, 10-4, 10-5, 10-6, masing-masing dipipet sebanyak 0,1 ml dan dimasukkan ke dalam cawan petri yang telah berisi media NA, SCA, SWC, MA, YMA, dan Zobel, kemudian disebar dengan menggunakan batang kaca penyebar serta diinkubasi selama 24 jam pada suhu 37oC. Koloni bakteri yang tumbuh pada media tersebut diamati. Setiap koloni bakteri yang tumbuh dipisahkan berdasarkan warna dan bentuk koloni, serta dimurnikan dengan menggunakan media yang sama (Abubakar 2009).
Penapisan Bakteri Penghasil Senyawa Antimikrob
Pengujian aktivitas senyawa antimikrob terhadap bakteri dan khamir menggunakan teknik medium dua lapis (bilayer), yaitu lapisan bawah hanya berisi medium SWC atau PDA saja, sedangkan lapisan atas berisi medium SWC atau PDA dan kultur mikrob target yang akan dihambat. Jenis medium untuk uji penghambatan terhadap antibakteri menggunakan medium SWC, sedangkan untuk uji antikhamir menggunakan PDA, begitu pula jenis medium yang akan digunakan untuk menumbuhkan isolat penghasil senyawa antimikrob adalah sesuai dengan macam mikrob yang akan dihambatnya. Sebanyak 1 ml kultur cair mikrob yang akan dihambat (umur 24 jam) dimasukkan ke dalam 100 ml medium dan dituangkan ke dalam cawan petri berisi medium lapisan bawah yang telah padat. Setelah medium bilayer padat, isolat bakteri asal spons digoreskan pada permukaannya dan diinkubasi selama 24 jam pada suhu 37oC. Senyawa antimikrob yang dihasilkan diindikasikan dengan keberadaan zona bening di sekitar koloni bakteri (Abubakar 2009).
Isolat bakteri hasil penapisan dikulturkan dalam medium cair untuk memperoleh peletnya. Pelet diperoleh dari hasil sentrifugasi (10.000 rpm, 15 menit) 1 ml kulturnya. Supernatan hasil sentrifugasi dibuang dan disisakan sedikit untuk disuspensikan kembali dengan peletnya. Sebanyak 10 µl suspensi pelet diteteskan di atas medium bilayer. Diameter zona hambat (DZH) senyawa antimikrob maupun indeks zona hambatnya (IZH) dihitung dengan rumus:
DZH = Diameter zona hambat – Diameter koloni
IZH = Diameter zona hambat – Diameter koloni Diameter koloni
Pewarnaan Gram
4
Uji Hemolisis
Isolat-isolat yang dapat menghasilkan senyawa antimikrob selanjutnya diuji kemampuan hemolisisnya dengan menggunakan agar darah yang didapatkan dari Laboratorium Fakultas Kedokteran Hewan, IPB, Bogor. Isolat-isolat tersebut digoreskan pada agar darah, kemudian diinkubasi selama 24 jam pada suhu ruang. Setelah inkubasi 24 jam, zona bening akan nampak di sekitar goresan isolat. Hal tersebut menandakan bahwa isolat yang digoreskan dapat melisiskan sel darah sehingga uji hemolisis bersifat positif.
HASIL DAN PEMBAHASAN
Isolasi Bakteri dari Sampel
Bakteri asal kedua jenis spons dapat diisolasi menggunakan enam jenis medium, yaitu NA, SCA, SWC, MA, YMA, dan Zobel. Hasil isolasi diperoleh 147 isolat bakteri, masing-masing 92 isolat bakteri dari spons jenis Callyspongia sp. dan 55 isolat bakteri dari spons jenis Petrosia sp. yang ditandai dengan warna dan bentuk koloni yang berbeda-beda (Gambar 2). Semua isolat tersebut diamati morfologi dan warna koloninya (Lampiran 3). Pemberian nama isolat berdasarkan nama spons asal bakteri tersebut diisolasi, yaitu CAL1 menunjukkan asal Callyspongia dengan pengambilan isolat bakteri nomor urut 1. Hal serupa untuk kode PTR1.
5
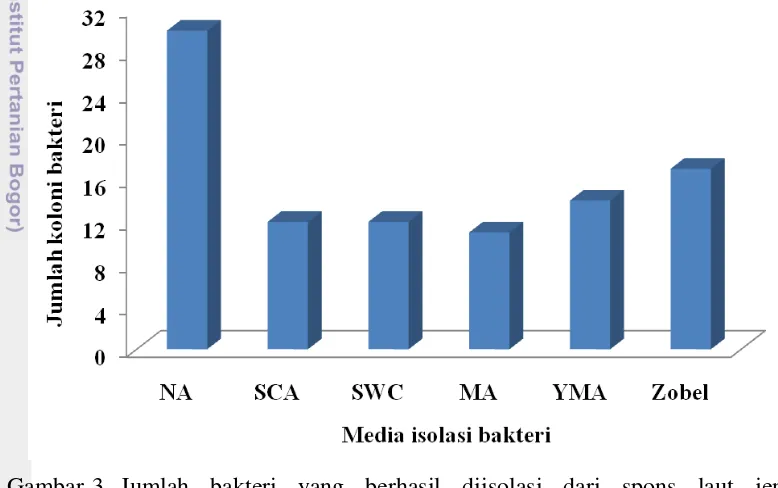
Hasil isolasi dengan menggunakan enam jenis medium tersebut menunjukkan bahwa masing-masing medium menghasilkan jenis koloni bakteri yang berbeda. Jenis koloni bakteri dari spons Callyspongia sp. dan Petrosia sp. pada medium NA yaitu 30 jenis koloni, medium SCA memiliki 12 jenis koloni, medium SWC memiliki 12 jenis koloni, medium MA memiliki 11 jenis koloni, medium YMA memiliki 14 jenis koloni, dan medium Zobel memiliki 17 jenis koloni (Gambar 3). Hasil tersebut menunjukkan bahwa untuk mendapatkan jenis koloni bakteri yang beragam, medium yang cocok untuk mengisolasi mikrob simbion spons yaitu medium NA dan Zobel, namun medium yang umum digunakan untuk mengisolasi bakteri dari spons laut adalah medium SWC. Medium NA merupakan medium umum untuk pertumbuhan bakteri, sedangkan medium Zobel merupakan medium yang digunakan untuk kultivasi, isolasi, dan perhitungan bakteri laut yang bersifat heterotropik (Himedia, Mumbai). Menurut Magnino et al. (1999), bakteri simbion yang berasal dari bagian mesohyl umumnya memiliki populasi yang berlimpah dan sekitar 75% bakteri yang berasal dari bagian mesohyl tersebut merupakan bakteri heterotropik, sehingga berbagai jenis koloni bakteri dapat tumbuh di medium NA dan Zobel tersebut.
Gambar 3 Jumlah bakteri yang berhasil diisolasi dari spons laut jenis Callyspongia sp. dan Petrosia sp. dengan menggunakan beberapa media, yaitu NA, SCA, SWC, MA, YMA, dan Zobel
6
masing-masing 70 isolat dari bagian mesohyl serta 68 isolat dari bagian permukaan, sedangkan Tokasaya (2010) menggunakan medium SWC untuk mengisolasi bakteri yang bersimbiosis dengan spons jenis Haliclona sp. asal Pulau Waigeo, Kabupaten Raja Ampat dan diperoleh 125 isolat bakteri masing-masing 105 isolat dari bagian mesohyl serta 20 isolat dari bagian permukaan. Medium MA digunakan oleh Aboul-Ela et al. (2012) untuk mengisolasi bakteri yang berasosiasi dengan spons jenis Amphimedon ochracea, sedangkan medium SCA dan YMA digunakan untuk mengkultur bakteri yang berasosiasi dengan spons jenis Rhopaloeides odorabile oleh Webster et al. (2001).
Keberhasilan dalam mengisolasi mikrob penghasil senyawa bioaktif yang bersimbiosis dengan spons dipengaruhi oleh beberapa faktor, di antaranya yaitu kondisi spons yang masih segar dan saat penyebaran mikrob di media isolasi (Burja et al. 1999), sedangkan kesulitannya adalah kebutuhan nutrisi mikrob yang bersimbiosis dengan spons sangat sulit untuk dipenuhi bila dikultur dalam laboratorium (Proksch et al. 2002).
Penapisan Bakteri Penghasil Senyawa Antimikrob
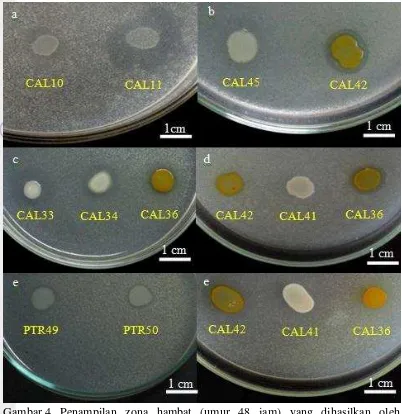
Penapisan bakteri penghasil senyawa antimikrob dilakukan menggunakan dua kelompok mikrob target, yaitu bakteri dan khamir. Hasil penapisan menunjukkan bahwa dari 147 isolat bakteri yang berhasil diisolasi, ternyata terdapat 26 isolat yang dapat menghasilkan senyawa antimikrob. Senyawa antimikrob yang dihasilkan ditandai dengan terbentuk zona bening di sekitar goresan isolat bakteri (Gambar 4). Hal tersebut menunjukkan bahwa isolat bakteri yang menghasilkan senyawa antimikrob mampu menghambat atau membunuh mikrob target, di antaranya dengan cara mengganggu metabolisme sel, mengganggu permeabilitas membran sel, menghambat sintesis dinding sel, menghambat sintesis protein sel, dan menghambat sintesis atau merusak asam nukleat sel mikrob target (Kohanski et al. 2010).
7
Gambar 4 Penampilan zona hambat (umur 48 jam) yang dihasilkan oleh beberapa isolat bakteri terhadap a. P. aeruginosa, b. S. aureus, c. B. subtilis, d. EPEC, e. E. coli (ATCC 8739)
8
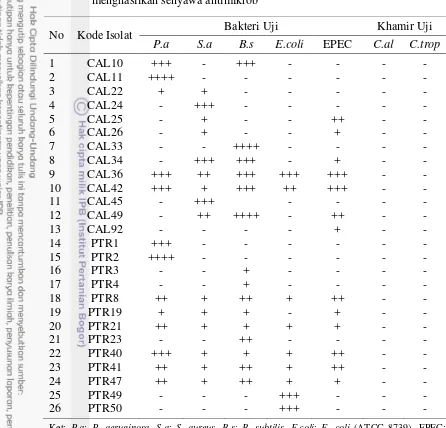
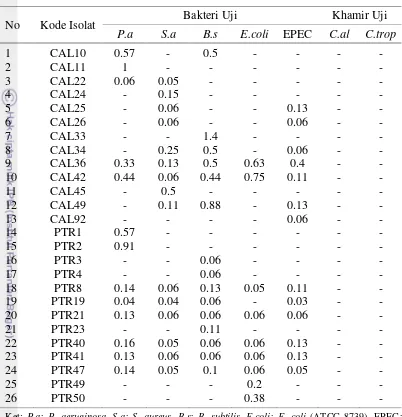
Tabel 1 Diameter zona hambat isolat-isolat bakteri asal spons laut yang menghasilkan senyawa antimikrob
Ket: P.a: P. aeruginosa, S.a: S. aureus, B.s: B. subtilis, E.coli: E. coli (ATCC 8739), EPEC:
Enterophatogenic Escherichia coli, C.al: C. albican, C.trop: C. tropicalis ; + : 0.1-0.5 mm,
++ : 0.6-1 mm, +++ : 2-6 mm, ++++ : 7-11 mm, - : Tidak dihasilkan senyawa antimikrob
No Kode Isolat Bakteri Uji Khamir Uji P.a S.a B.s E.coli EPEC C.al C.trop
1 CAL10 +++ - +++ - - - -
2 CAL11 ++++ - - - -
3 CAL22 + + - - - - -
4 CAL24 - +++ - - - - -
5 CAL25 - + - - ++ - -
6 CAL26 - + - - + - -
7 CAL33 - - ++++ - - - -
8 CAL34 - +++ +++ - + - -
9 CAL36 +++ ++ +++ +++ +++ - - 10 CAL42 +++ + +++ ++ +++ - -
11 CAL45 - +++ - - - -
12 CAL49 - ++ ++++ - ++ - -
13 CAL92 - - - - + - -
14 PTR1 +++ - - - -
15 PTR2 ++++ - - - -
16 PTR3 - - + - - - -
17 PTR4 - - + - - - -
18 PTR8 ++ + ++ + ++ - -
19 PTR19 + + + - + - -
20 PTR21 ++ + + + + - -
21 PTR23 - - ++ - - - -
22 PTR40 +++ + + + ++ - -
23 PTR41 ++ + ++ + ++ - -
24 PTR47 ++ + ++ + + - -
25 PTR49 - - - +++ - - -
10
penelitian Tokasaya (2010) yang mengisolasi bakteri simbion spons jenis Haliclona sp. asal Pulau Waigeo, Kabupaten Raja Ampat diperoleh 15 isolat bakteri mampu menghambat aktivitas C. albican dan 11 isolat mampu menghambat aktivitas C. tropicalis. Berdasarkan data tersebut dapat diketahui bahwa banyak isolat bakteri asal Pulau Waigeo, Kabupaten Raja Ampat yang memiliki aktivitas penghambatan terhadap Candida dibandingkan dengan isolat bakteri asal Pulau Bira, Kepulauan Seribu. Hal tersebut kemungkinan disebabkan perbedaan jenis spons maupun lokasi pengambilan sampel, walaupun ketiga jenis spons tersebut termasuk ke dalam ordo yang sama, yaitu Haplosclerida. Kemampuan isolat-isolat bakteri yang mampu menghambat pertumbuhan mikrob target merupakan bentuk aktivitas antagonis yang dilakukan isolat tersebut dengan menghasilkan kandungan senyawa yang bersifat antimikrob (Romanenko et al. 2008). Jenis-jenis senyawa metabolit sekunder yang bersimbiosis dengan spons, yaitu terpenoid, alkaloid, peptide, dan polyketida (Taylor et al. 2007).
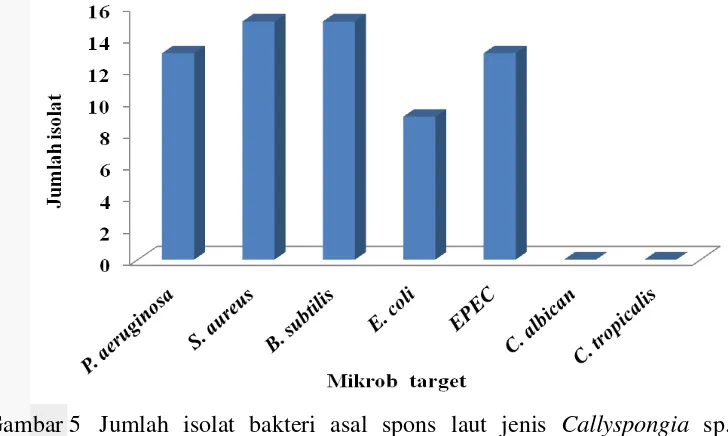
Gambar 5 Jumlah isolat bakteri asal spons laut jenis Callyspongia sp. dan Petrosia sp. penghasil senyawa antimikrob yang mampu menghambat mikrob target
11
Pewarnaan Gram
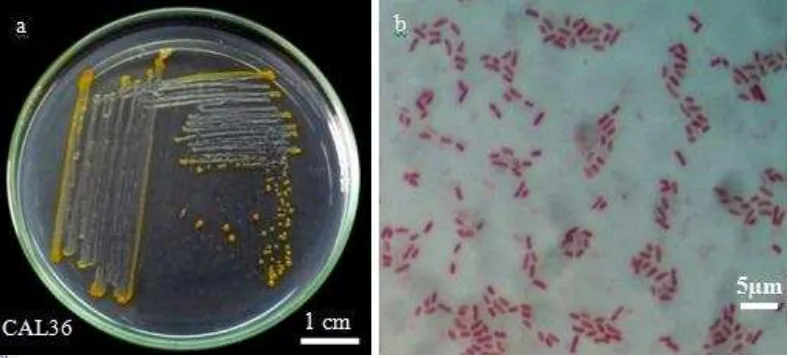
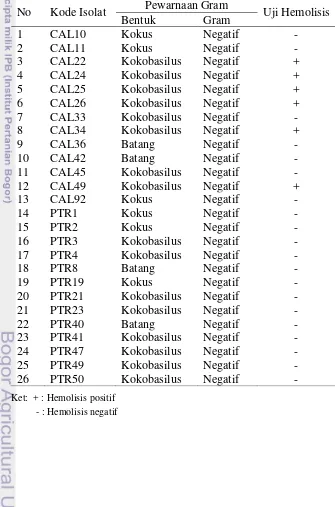
Pewarnaan Gram dilakukan pada 26 isolat bakteri yang mampu menghasilkan senyawa antimikrob. Hasil pewarnaan Gram menunjukkan bahwa semua isolat tersebut termasuk ke dalam kelompok bakteri gram negatif, sehingga tidak dilakukan uji lanjut dengan pewarnaan spora. Kelompok bakteri gram negatif tersebut memiliki beberapa bentuk koloni, yaitu kokus, batang, dan kokobasilus (Gambar 6; Tabel 3).
Gambar 6 Hasil pewarnaan Gram isolat CAL36: a. Profil koloni isolat CAL36 pada media SWC dan b. Hasil pewarnaan bakteri gram negatif isolat CAL36
12
Uji Hemolisis
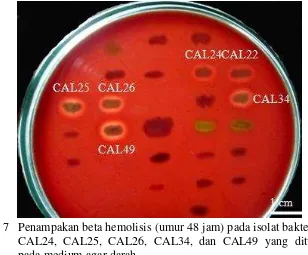
Sebanyak 6 isolat (CAL22, CAL24, CAL25, CAL26, CAL34, dan CAL49) menunjukkan hemolisis positif dari 26 isolat bakteri yang menghasilkan senyawa antimikrob, sehingga tidak digunakan untuk uji lebih lanjut (Tabel 3). Sebanyak 6 isolat tersebut diduga termasuk ke dalam jenis beta hemolisis (Gambar 7). Jenis hemolisis ada tiga, yaitu beta hemolisis, alpha hemolisis, dan gamma hemolisis. Beta hemolisis atau hemolisis total merupakan lisis seluruh sel darah merah. Streptococcus pyogenes memiliki karakteristik beta hemolisis (Tokasaya 2010).
Tabel 3 Hasil pewarnaan Gram dan uji hemolisis
Ket: + : Hemolisis positif - : Hemolisis negatif
13
Gambar 7 Penampakan beta hemolisis (umur 48 jam) pada isolat bakteri CAL22, CAL24, CAL25, CAL26, CAL34, dan CAL49 yang ditumbuhkan pada medium agar darah
SIMPULAN DAN SARAN
Simpulan
Sebanyak 147 isolat bakteri berhasil diisolasi dari spons jenis Callyspongia sp. dan Petrosia sp., dan 26 isolat di antaranya dapat menghasilkan senyawa antimikrob. Total isolat bakteri yang mampu menghambat pertumbuhan Pseudomonas aeruginosa sebanyak 13 isolat, Staphylococcus aureus sebanyak 15 isolat, Bacillus subtilis sebanyak 15 isolat, Escherichia coli (ATCC 8739) sebanyak 9 isolat, dan Enterophatogenic Escherichia coli (EPEC) sebanyak 13 isolat. Sebanyak tujuh isolat bakteri mampu menghambat kelima bakteri target, yaitu isolat CAL36, CAL42, PTR8, PTR21, PTR40, PTR41, dan PTR47. Isolat yang bersifat hemolisis positif berasal dari spons jenis Callyspongia sp. dengan jumlah enam isolat, yaitu CAL22, CAL24, CAL25, CAL26, CAL34, dan CAL49.
Saran
14
DAFTAR PUSTAKA
.
Aboul-Ela HM, Shreadah MA, Abdel-Monem NM, Yakout GA, Van Soest RWM. 2012. Isolation, cytotoxic activity and phylogenetic analysis of Bacillus sp. bacteria associated with the red sea sponge Amphimedon ochracea. Adv in Biosci and Biotech. 3: 815-823.
Abubakar H. 2009. Bakteri yang berasosiasi dengan spons Jaspis sp.: analisis penghasil senyawa antimikrob dan keragaman genetiknya [tesis]. Bogor (ID): Institut Pertanian Bogor.
Abubakar H, Wahyudi AT, Yuhana M. 2011. Skrining bakteri yang berasosiasi dengan spons Jaspis sp. sebagai penghasil senyawa antimikroba. Ilmu Kelautan. 16(1): 35-40.
Amstrong E, Yan L, Boyd KG, Wright PC, Burgess JG. 2001. The symbiotic role of marine microbes on living surfaces. Hydrobiologia. 461: 37-40.
Anand TP, Bhat AW, Shouche YS, Roy U, Siddharth J, Sarma SP. 2006. Antimicrobial activity of marine bacteria associated with sponges from the waters off the coast of South East India. Microbiol Research. 161: 252-262. Bae GY, Lee HW, Chang SE, Moon KC, Lee MW, Choi JH, Koh JK. 2005.
Clinicopathologic review of 19 patients with systemic candidiasis with skin lesions. Int J Demartol. 44(7): 550-555.
Berdy J. 2005. Bioactive microbial metabolites. J Antibiot. 58(1): 1-26.
Burja AM, Webster N, Murphy P, Russel TH. 1999. Microbial symbiont of great barrier reef sponges. Mem Qld Mus. 44: 63-75.
Fenical W. 1993. Chemical studies of marine bacteria: developing a new resource. Chem Rev. 93(5): 1673-1683.
Hadioetomo RS. 1993. Mikrobiologi Dasar Dalam Praktek. Jakarta (ID): Gramedia Pustaka Utama.
Hentschel U, Hopke J, Horn M, Friendrich AB, Wagner M, Hacker J, Moore BS. 2002. Molecular evidence for a uniform microbial community in sponges from different oceans. Appl Environ Microbiol. 68(9): 4431-4440.
Jawetz E, JL Melnick, EA Adelberg, GF Brooks, JS Butel, LN Ornston. 1995. Mikrobiologi Kedokteran. Ed 20. San Francisco (US): University of California.
Kim TK, Hewavitharana AK, Shaw PN, Fuerst JA. 2006. Discovery of a new source of rifamycin antibiotic in marine spone actinobacteria by phylogenetic prediction. Appl Environ Microbial. 72(3): 2118-2125.
Kohanski MA, Dwyer DJ, Collins JJ. 2010. How antibiotics kill bacteria: from targets to networks. Nature Rev Microbiol. 8: 423-435.
Kumamoto CA, Vinces MD. 2005. Alternative Candida albican lifestyles: growth on the surfaces. Annu Rev Microbiol. 59: 113-133.
Lee KY, Lee JH, Lee HK. 2001. Microbial symbiosis in marine sponges. J Microbiol. 39(4): 254-264.
Lukisari C, Harijanti K. 2010. Penatalaksana Kandidiasis Oral karena Candida tropicalis pada Pasien dengan Median Rhomboid Glossitis. Surabaya (ID): Universitas Airlangga.
15
Pastra DA, Melki, Surbakti H. 2012. Penapisan bakteri yang bersimbiosis dengan spons jenis Aplysina sp. sebagai penghasil antibakteri dari perairan Pulau Tegal Lampung. Maspari Journal. 4(1): 77-82.
Pringgenies D. 2010. Karakteristik senyawa bioaktif bakteri simbion moluska dengan GC-MS. J Ilmu dan Teknologi Kelautan Tropis. 2(2): 34-40.
Proksch P, Edrada RA, Ebel R. 2002. Drugs from the seas-current status and microbiological implication. Appl Microbiol Biotech. 59: 125-134.
Romanenko LA, Tanaka N, Uchino M, Kalinovskaya NI, Mikhailov VV. 2008. Diversity and antagonistic activity of sea ice bacteria from the sea of Japan. Micro Environ. 23(3): 209-214.
Taylor MW, Radax R, Steger D, Wagner M. 2007. Sponge-associated microorganisms: evolution, ecology, and biotechnological potential. Microbiol Mol Bio Reviews. 71(2): 295-347.
Thomas TRA, Kavlekar DP, LokaBharathi PA. 2010. Marine drugs from sponge-microbe association-a review. Mar Drugs 8: 1417-1468.
Timotius KH. 1982. Mikrobiologi Dasar. Salatiga (ID): Universitas Kristen Satya Wacana.
Tokasaya P. 2010. Sponge-associated bacteria producing antimicrobial compounds and their genetic diversity analysis [tesis]. Bogor (ID): Institut Pertanian Bogor.
Warsa UC. 1994. Staphylococcus dalam Buku Ajaran Mikrobiologi Kedokteran, Edisi Revisi. Jakarta (ID): Binarupa Aksara. hlm 103-110.
Webster NS, Wilson KJ, Blackall LL, Hill RT. 2001. Phylogenetic diversity of bacteria associated with the marine sponge Rhopaloeides odorabile. App Environ Microbiol. 67: 434-444.
West LM, PT Northcote, CN Battershill. 2000. Peloruside A: a potent cytotoxic macrolide isolated from the New Zealand marine sponge Mycale sp. J Org Chem. 65(2): 445-449.
Wilkinson CR. 1978. Microbial associations in sponges. i. ecology, physiology, and microbial populations of coral reef sponges. Marine Biology. 49: 161-167.
16
Lampiran 1 Peta lokasi pengambilan sampel
Lokasi pengambilan
17
Lampiran 2 Komposisi media untuk 1 liter
1. Sea Water Complete
4. Yeast Malt Extract Agar
18
Lampiran 3 Ciri-ciri koloni isolat-isolat bakteri yang diisolasi dari spons laut jenis Callyspongia sp. dan Petrosia sp.
No Kode
Isolat Bentuk Tepian Elevasi Warna
1 CAL1 Bentuk L Licin Datar Cream 2 CAL2 Bentuk L Licin Datar Cream 3 CAL3 Bentuk L Licin Timbul Cream 4 CAL4 Bentuk L Licin Timbul Cream 5 CAL5 Bundar Licin Seperti tetesan Putih 6 CAL6 Tidak beraturan Berombak Cembung Cream 7 CAL7 Tidak beraturan Tidak beraturan Timbul Putih
8 CAL8 Bundar Licin Timbul Cream bening 23 CAL23 Tidak beraturan Tidak beraturan Timbul Putih 24 CAL24 Bundar Licin Timbul Putih 37 CAL37 Menyebar Berombak Timbul Putih bening 38 CAL38 Bundar Licin Datar Putih
19
Lampiran 3 Ciri-ciri koloni isolat-isolat bakteri yang diisolasi dari spons laut jenis Callyspongia sp. dan Petrosia sp. (lanjutan)
No Kode
Isolat Bentuk Tepian Elevasi Warna
20
Lampiran 3 Ciri-ciri koloni isolat-isolat bakteri yang diisolasi dari spons laut jenis Callyspongia sp. dan Petrosia sp. (lanjutan)
No Kode
Isolat Bentuk Tepian Elevasi Warna
85 CAL85 Bentuk L Licin Timbul Cream 91 CAL91 Tidak beraturan Bercabang Datar Putih
92 CAL92 Bundar dengan
tepian timbul Licin Timbul Kuning
93 PTR1 Bentuk L Licin Cembung Orange dengan
tepian timbul Licin Timbul Putih
101 PTR9 Bundar Licin Cembung Putih bening 102 PTR10 Bundar Licin Seperti tetesan Putih
103 PTR11 Bundar dengan
tepian karang Licin Datar Kuning 104 PTR12 Keriput Licin Datar Putih
105 PTR13 Bundar dengan
tepian karang Licin Datar Merah muda 106 PTR14 Bundar Licin Seperti tetesan Cream
107 PTR15 Bentuk L Licin Cembung Orange bening 108 PTR16 Bundar Licin Cembung Putih
109 PTR17 Bundar Licin Cembung Putih
110 PTR18 Bundar dengan
tepian karang Licin Datar Kuning 111 PTR19 Bundar Licin Seperti tetesan Putih 112 PTR20 Bentuk L Licin Cembung Orange
113 PTR21 Bundar Licin Seperti tombol Putih dengan tepian bening 114 PTR22 Bundar Licin Seperti tetesan Kuning 115 PTR23 Bundar Licin Cembung Putih bening 116 PTR24 Tidak beraturan Licin Timbul Putih
117 PTR25 Bundar dengan
21
Lampiran 3 Ciri-ciri koloni isolat-isolat bakteri yang diisolasi dari spons laut jenis Callyspongia sp. dan Petrosia sp. (lanjutan)
No Kode
Isolat Bentuk Tepian Elevasi Warna
119 PTR27 Bundar Licin Seperti tetesan Kuning 120 PTR28 Bentuk L Licin Seperti tetesan Putih 128 PTR36 Benang-benang Licin Datar Kuning 129 PTR37 Bentuk L Licin Seperti tetesan Bening
tepian timbul Licin Timbul Cream
136 PTR44 Bundar dengan
tepian timbul Licin Timbul Putih 137 PTR45 Bundar Licin Seperti tetesan Cream
138 PTR46 Bundar dengan
tepian timbul Licin Timbul Cream 139 PTR47 Bentuk L Licin Seperti tombol Cream
22
RIWAYAT HIDUP
Penulis dilahirkan di Bekasi pada tanggal 02 Januari 1993, putri tunggal dari ayah Hendra Surwenda dan ibu Siti Saotika. Tahun 2010 penulis lulus dari SMA Negeri 3 Bekasi dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk (USMI) IPB dan diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis menjadi asisten praktikum Fisiologi Prokariot pada semester ganjil tahun ajaran 2013-2014, serta asisten praktikum Mikrobiologi Dasar pada semester genap tahun ajaran 2014-2015. Penulis juga pernah aktif berorganisasi di Himpunan Mahasiswa Biologi (HIMABIO) sebagai Sekretaris Divisi Biosains pada tahun kepengurusan 2011-2012 dan 2012-2013, di Gentra Kaheman sebagai Sekretaris Divisi Profesi dan Keahlian (PROKEH) pada tahun 2011-2012, serta menjadi panitia di berbagai kegiatan, antara lain Pesta Sains Nasional (PSN) di sub Lomba Cepat Tepat Biologi (LCTB) pada tahun 2011 dan 2012, Gebyar Nusantara (GENUS) pada tahun 2013, P4 (Pelatihan Pembuatan Proposal PKM) pada tahun 2011 dan 2012, serta BIONIC pada tahun 2012 dan 2013. Bulan Juli-Agustus 2013 penulis melaksanakan Praktik Lapangan di PT. Mitratani Agro Unggul Cianjur dengan judul Proses Produksi Kentang (Solanum tuberosum) di PT. Mitratani Agro Unggul, Cipanas-Cianjur, Jawa Barat.