SISTEM AKUAPONIK
SRI WAHYUNINGSIH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis berjudul Pengolahan Limbah Nitrogen dari Kegiatan Budidaya Ikan Nila (Oreochromis niloticus) pada Sistem Akuaponik adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Sri Wahyuningsih
Ikan Nila (Oreochromis niloticus) pada Sistem Akuaponik. Dibimbing oleh HEFNI EFFENDI dan YUSLI WARDIATNO.
Senyawa nitrogen (amonia, nitrit, dan nitrat) merupakan kontaminan utama dalam air limbah budidaya. Amonia menjadi limbah nitrogen utama yang dihasilkan oleh hewan air. Pakan merupakan sumber utama amonia dalam sistem budidaya. Hal ini dikarenakan hanya sekitar 20-30% dari nutrisi pakan menjadi biomassa, sedangkan sisanya diekskresikan ke lingkungan dalam bentuk amonia dan urea. Meningkatnya pemberian pakan akan diikuti dengan buangan dan akumulasi limbah nitrogen yang semakin tinggi, dan pada akhirnya menyebabkan penurunan kualitas air. Untuk mempertahankan kualitas air budidaya yang baik, diperlukan pengembangan dan penerapan metode baru. Metode yang dapat digunakan salah satunya adalah sistem akuaponik. Sistem akuaponik dikenal sebagai integrasi produksi tanaman hidroponik dengan budidaya ikan dalam sistem resirkulasi. Tanaman pada sistem akuaponik dapat menyerap nutrien yang berasal dari limbah budidaya, sedangkan bakteri mengurangi amonia melalui proses nitrifikasi.
Tujuan dari penelitian ini adalah untuk menilai efektivitas pengolahan limbah nitrogen dari kegiatan budidaya ikan nila (Oreochromis niloticus) dalam sistem akuaponik. Penelitian ini dilakukan pada bulan Februari sampai April 2015 di Pusat Penelitian Lingkungan Hidup Institut Pertanian Bogor (PPLH IPB). Percobaan terdiri dari tiga perlakuan dengan tiga ulangan, tanpa tanaman sebagai kontrol (P1), selada romain (Lactuca sativa L. var. longifolia) (P2), selada romain dan bakteri komersial (P3).
Hasil penelitian menunjukkan bahwa konsentrasi nutrien berfluktuasi selama periode pengamatan. Secara deskriptif P3 menunjukkan hasil lebih baik dari P1 dan P2. Kisaran nutrien anorganik dalam sistem adalah 0,91-6,49 mg/L untuk TAN, 0,0022-0,4522 mg/L untuk NH3, 0,91-6,46 mg/L untuk NH4+, 0,03-0,93 mg/L
untuk NO2-, dan 0,91-3,60 mg/L untuk NO3-. Integrasi budidaya ikan nila dan
selada romain dapat menghilangkan nutrien dengan efisiensi penghilangan terbaik 91,50%, 34,41%, 22,86%, dan 49,74% untuk amonia, amonium, nitrat, dan nitrit, berturut-turut. Tingkat kelangsungan hidup ikan nila tertinggi adalah 96,11±1,44% pada P3, diikuti P2 dan P1 yaitu 94,44±6,45% dan 89,17±0,96%, berturut-turut. Hasil panen selada romain pada P2 dan P3 tidak berbeda nyata, dengan berat akhir adalah 61,87±5,59 g pada P2 dan 57,74 ± 04,35 g pada P3.
Secara deskriptif P3 lebih baik dalam pengolahan limbah budidaya dan lebih optimal dalam performa ikan nila dibandingkan P1 dan P2. Sementara itu analisis statistik secara keseluruhan antara P1, P2, dan P3 tidak berbeda nyata.
Tilapia (Oreochromis niloticus) on Aquaponic Systems. Supervised by HEFNI EFFENDI dan YUSLI WARDIATNO.
Nitrogenous compounds (ammonia, nitrite, and nitrate) are considered as major contaminants in aquaculture wastewater. Ammonia is the principal nitrogenous waste produced by aquatic animals. Feed is a major source of ammonia in the culture system. This is due to only about 20-30% of nutrition from feed is harvested fish through biomass, while the remaining is excreted into the environment in ammonia and urea form. Increased feeding will be followed by the discharge and high accumulation of nitrogen waste, and eventually led to decrease of water quality. To mantain good water quality in aquaculture system, required a development and application of new method. The method can be used one of them is aquaponics system. Aquaponics is known as integration hydroponic production of plants and the aquaculture of fish in recirculation systems. At aquaponic system plant can absorb nutrient from farming waste, whereas bacteria functions in reducing the ammonia through the nitrification process.
The aim of study was to assess the effectiveness of nitrogen waste treatment from aquaculture activities of tilapia (Oreochromis niloticus) in aquaponic system. This experiment was carried out from February to April 2015 at Center for Environmental Research of Bogor Agricultural University (PPLH IPB). The experiment consisted of three treatments with three replications, without plant as control (P1), romaine lettuce (Lactuca sativa L. var. longifolia) (P2), romaine lettuce and inoculation with commercial bacteria (P3).
The result showed that the nutrient concentration fluctuated during the observation periods. Descriptively P3 showed better results than P1 and P2. The range of inorganic nutrient in systems was at 0,91-6,49 mg/L for TAN, 0,0022-0,4522 mg/L for NH3, 0,91-6,46 mg/L for NH4+, 0,03-0,93 mg/L for NO2-, and
0,91-3,60 mg/L for NO3-. Integration of tilapia fish farming and romaine lettuce can
reduce inorganic nitrogen with the best removal efficiency were 91,50%, 34.41%, 22,86%, and 49,74% for ammonia, ammonium, nitrate, and nitrite, respectively. Tilapia highest survival rate was 96,11±1,44% at P3, followed by P2 and P1 were 94,44±6,45% and 89,17±0,96%, respectively. Romaine lettuce harvests between P2 and P3 showed no significantly difference, with a final weight was 61,87±5,59 g for P2 and 57,74 ± 4,35 g for P3.
Descriptively P3 showed better than P1 and P2 in wastewater treatment and more optimal in performance of tilapia. Meanwhile overall statistical analysis between P1, P2, and P3 were not significantly different.
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Pengelolaan Sumberdaya Perairan
SISTEM AKUAPONIK
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan dengan baik. Tema yang dipilih pada penelitian yang dilaksanakan sejak Februari 2015 ini ialah pengolahan limbah budidaya ikan pada sistem akuaponik, dengan judul Pengolahan Limbah Nitrogen dari Kegiatan Budidaya Ikan Nila (Oreochromis niloticus) pada Sistem Akuaponik. Penelitian ini dapat diselesaikan dengan bantuan dan dukungan dari semua pihak. Oleh karena itu, terimakasih penulis sampaikan kepada:
1. Dr Ir Hefni Effendi, MPhil dan Dr Ir Yusli Wardiatno, MSc selaku dosen komisi pembimbing yang selama ini telah banyak memberikan bimbingan, semangat dan bantuan kepada penulis
2. Dr Ir Sigid Hariyadi, MSc selaku Ketua Program Studi SDP untuk tahun studi 2014-2017 yang telah banyak membantu kelancaran studi penulis
3. Dr Ir Niken TM Pratiwi, MSi selaku dosen penguji luar komisi pada ujian tesis yang telah banyak memberikan masukan dan saran kepada penulis
4. Seluruh keluarga terutama kedua orang tua, Bapak Mukidin dan Ibu Arkami serta adik-adik dan kakak-kakak untuk doa, bantuan dan kasih sayangnya kepada penulis
5. Pihak DIKTI yang telah memberikan beasiswa, sehingga penulis dapat menyelesaikan pendidikan dengan baik
6. PPLH IPB yang telah memberikan fasilitas dan bantuan penelitian, staff PPLH terutama pak Nata dan mas Bagus yang banyak membantu selama proses penelitian
7. Teman-teman seperjuangan SDP 2013 (terutama Putu, Desy, Mayanda, Yuyun, Lusita, Luffisari, Iyat, dan Elinah), Diding Prastian, dan teman-teman serta pihak lainnya yang tidak dapat disebutkan satu per satu atas bantuan yang diberikan.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2015
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN
Latar Belakang 1
Perumusan Masalah 2
Tujuan 3
Manfaat 3
Hipotesis 4
METODE
Tempat dan Waktu Penelitian 4
Rancangan Penelitian 4
Prosedur Penelitian 4
Persiapan sistem percobaan 4
Penebaran ikan nila 5
Penambahan bakteri komersial 5
Penanaman selada romain 6
Parameter pengamatan 6
Kualitas air 7
Persentase amonia tidak terionisasi 7
Persentase penghilangan nutrien 7
Pertumbuhan, kelangsungan hidup, dan rasio konversi pakan 8
Pertumbuhan selada romain 9
Analisis Data 9
HASIL DAN PEMBAHASAN
Hasil 10
Pengaruh kualitas air terhadap proses biofiltrasi 10
Kelimpahan bakteri pada sistem akuaponik 15
Penghilangan nutrien pada sistem akuaponik 16
Performa ikan nila pada sistem akuaponik 17
Pertumbuhan selada romain 19
Pembahasan 21
SIMPULAN 29
SARAN 29
DAFTAR PUSTAKA 30
LAMPIRAN 35
2 Nilai pKa untuk mencari amonia tidak terionisasi 7
3 Rata-rata ± standar deviasi parameter kualitas air 11
4 Persentase penghilangan nutrien pada sistem akuaponik 16
5 Performa ikan nila pada sistem akuaponik 17
DAFTAR GAMBAR
1 Perumusan masalah 3
2 Rangkaian instalasi sistem percobaan 5
3 Selada romain 6
4 Fluktuasi pH 12
5 Fluktuasi TAN 12
6 Fluktuasi NH3 13
7 Fluktuasi NH4+ 14
8 Fluktuasi NO2- 14
9 Fluktuasi NO3- 15
10 Kelimpahan bakteri 16
11 Rasio konversi pakan (FCR) 18
12 Tingkat kelangsungan hidup (SR) 18
13 Pertumbuhan bobot ikan nila dan pakan 19
14 Tinggi selada romain selama periode pengamatan 20
15 Laju pertumbuhan harian tinggi tanaman dan lebar daun 20
DAFTAR LAMPIRAN
1 Gambar percobaan 35
2 Contoh ukuran ikan nila 35
3 Ukuran selada romain awal dan akhir percobaan 36
4 Rata-rata ± standar deviasi performa ikan nila 37
5 Rata-rata ± standar deviasi performa selada romain 37
6 Desain dan evaluasi sistem akuaponik 38
7 Uji ANOVA kekeruhan 39
8 Uji ANOVA suhu 39
9 Uji ANOVA pH 40
10 Uji ANOVA TAN 41
11 Uji ANOVA NH3 41
12 Uji ANOVA NH4+ 42
13 Uji ANOVA NO2- 42
14 Uji ANOVA NO3- 43
15 Uji ANOVA alkalinitas total 43
16 Uji ANOVA bakteri total 43
PENDAHULUAN
Latar Belakang
Permasalah utama pada usaha perikanan adalah penurunan kualitas air yang disebabkan oleh tingginya akumulasi limbah budidaya. Menurut Avnimelech (2006), ikan budidaya dapat tumbuh pada kepadatan yang tinggi dengan diaerasi, akan tetapi ketika biomassa ikan semakin meningkat menyebabkan kualitas air menjadi faktor pembatas. Sarwono dan Agustina (2002) melaporkan bahwa penurunan kualitas air pada sistem budidaya disebabkan oleh padat penebaran dan dosis pakan tinggi, yang berakibat pada akumulasi buangan metabolit dan sisa pakan. Dekomposisi sisa pakan dan buangan metabolit akan menghasilkan produk samping, yaitu amonia. Selanjutnya menurut Francis-Floyd et al. (1996), dari semua parameter kualitas air yang mempengaruhi ikan, amonia menjadi faktor pembatas kedua setelah oksigen.
Pakan dan urea menjadi sumber utama nitrogen pada limbah budidaya (Hargreaves dan Tucker 2004). Menurut Avnimelech (2006), ikan hanya mampu menyerap 20-30% nutrisi dari pakan, sedangkan sisanya diekskresikan ke lingkungan dalam bentuk amonia dan protein organik. Selanjutnya Ebeling et al. (2006) menambahkan bahwa dari 80% nitrogen yang diekskresikan, 90% terdapat sebagai amonia dan 10% sebagai urea
Amonia di perairan terdapat dalam dua bentuk yang bersama-sama disebut sebagai amonia nitrogen total (TAN), dan direpresentasikan sebagai amonia tidak terionisasi (NH3) dan amonia terionisasi (NH4+) (Francis-Floydet al. 1996; Körner
et al. 2001; Rahmaniet al. 2004; Eshchar et al. 2006; Rijn et al. 2006; Titiresmi dan Sopiah 2006). Suhu dan pH mempengaruhi kesetimbangan TAN, ketika terjadi peningkatan pH dan suhu, bentuk NH3 menjadi lebih dominan. Toksisitas NH3
diperlihatkan dari ciri-ciri, seperti hiperaktif dan kehilangan keseimbangan (Hargreaves 1998). Senyawa NH3 juga menyebabkan pertumbuhan ikan menjadi
lambat akibat tingkat kecernaan pakan yang buruk, dan resistensi terhadap penyakit berkurang (Hargreaves dan Tucker 2004). Chen et al. (2006) melaporkan tingkat NH3yang dapat ditoleransi dalam sistem budidaya hanya 0,025 mg/L N.
Pada umumnya untuk mempertahankan kualitas air yang baik, 5-10% volume air yang kaya nitrogen diganti dengan air baru (Masseret al. 1999). Menurut Huet al. (2015) hal tersebut hanya akan meningkatkan konsumsi air, dan air yang dibuang ke ekosistem akan menyebabkan masalah lingkungan seperti eutrofikasi. Dengan demikian diperlukan suatu pengolahan untuk mempertahankan kualitas air budidaya, dan mengurangi buangan limbah ke lingkungan. Salah satu alternatif yang dapat diterapkan adalah menggunakan sistem akuaponik. Sistem akuaponik dikenal sebagai kombinasi budidaya ikan dengan tanaman hidroponik dalam sistem resirkulasi (Diver 2006; Rakocy et al. 2006; Endut et al. 2010; Roosta dan Hamidpour 2011; Zheljazkov dan Horgan 2011; Liang dan Chien 2013). Amonia dalam sistem akuaponik diubah menjadi nitrat (NO3-) oleh bakteri nitrifikasi
sedangkan bakteri nitrifikasi memberikan peran ganda dengan mengurangi konsentrasi amonia melalui oksidasi, dan mengkonversi amonia menjadi nitrat yang dibutuhkan tanaman (Tysonet al. 2011).
Tanaman yang dapat digunakan dalam sistem akuaponik, salah satunya adalah selada varietas romain (Lactuca sativaL. var. longifolia). Hasil penelitian Trang et al. (2010) menunjukkan bahwa kapasitas serapan nitrogen oleh selada sebesar 2,2 g/m2selama 60 hari periode budidaya. Menurut Rakocy et al. (2006) selada merupakan tanaman yang banyak digunakan pada sistem akuaponik, karena dapat dipanen dalam waktu singkat (tiga sampai empat minggu dalam sistem), dan relatif lebih sedikit bermasalah dengan hama dibandingkan dengan tanaman berbuah. Demikian pula halnya dengan ikan nila (Oreochromis niloticus) yang digunakan memiliki tingkat toleransi yang baik, dan banyak diadaptasikan pada sistem resirkulasi dengan kondisi air yang berfluktuasi, serta memiliki nilai ekonomis yang tinggi (Diver 2006).
Kajian mengenai pengolahan limbah budidaya dengan sistem akuaponik telah banyak dilakukan di negara lain. Hasil penelitian Dediuet al. (2012) menunjukkan bahwa tingkat penghapusan TAN dalam sistem akuaponik menggunakan selada mencapai 0,32 g/m2/hari untuk laju aliran tinggi (HFR), dan 0,27 g/m2/hari untuk
laju aliran rendah (LFR). Penelitian lain menggunakan sistem akuaponik dengan tanaman kangkung air (Ipomoea aquatica) dilakukan oleh Endut et al. (2010), menunjukkan persentase penghapusan TAN dan nitrat melebihi 50%. Tysonet al. (2008) pada penelitiannya menggunakan tanaman mentimun (Cucumis sativa) menunjukkan bahwa kehilangan TAN lebih tinggi terjadi pada sistem akuaponik dibandingkan dengan sistem hidroponik dan akuakultur. Penelitian ini dilakukan untuk menilai efektivitas sistem akuaponik menggunakan selada romain dalam pengolahan limbah nitrogen hasil budidaya ikan nila.
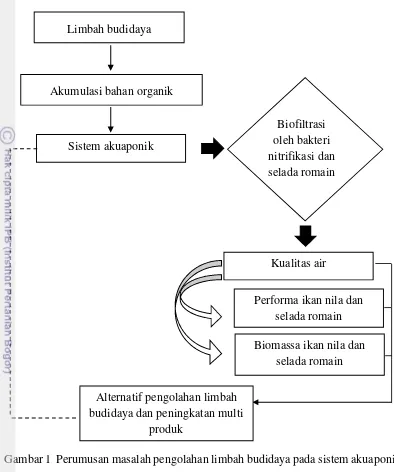
Perumusan Masalah
Kegiatan budidaya menghasilkan limbah berupa bahan organik maupun anorganik, yang berasal dari residu pakan, buangan metabolisme ikan, dan organisme mati. Pada kondisi lingkungan anaerob, perombakan bahan organik menghasilkan hidrogen sulfida (H2S) dan metan (CH4), yang merupakan gas toksik
bagi ikan. Sementara pada kondisi aerob, dekomposisi bahan organik menghasilkan bahan anorganik terlarut seperti amonia, nitrit (NO2-), dan nitrat, yang merupakan
nutrien di perairan. Tingginya masukan bahan organik dapat berdampak negatif, yaitu penurunan oksigen terlarut, akibat kebutuhan bakteri terhadap oksigen terlarut untuk proses dekomposisi dan oksidasi meningkat. Selain itu air limbah dengan kandungan nutrien terlarut tinggi, yang dibuang ke lingkungan dapat menyebabkan eutrofikasi. Dampak negatif lainnya dapat terjadi ketika terdapat NH3terlarut dalam
sistem. Senyawa NH3dapat menganggu pertumbuhan ikan yang dipelihara, bahkan
Gambar 1 Perumusan masalah pengolahan limbah budidaya pada sistem akuaponik
Tujuan
Penelitian ini bertujuan untuk:
1. Menilai efektivitas sistem akuaponik dengan membandingkan perlakuan yang diuji terhadap pengolahan limbah nitrogen hasil budidaya ikan nila.
2. Menganalisis pengaruh air hasil pengolahan terhadap pertumbuhan ikan nila yang dibudidayakan.
Manfaat
Hasil penelitian ini diharapkan dapat bermanfaat dalam penyediaan informasi mengenai efektivitas akuaponik dalam pengolahan limbah budidaya,
Limbah budidaya
Akumulasi bahan organik
Sistem akuaponik
Biofiltrasi oleh bakteri nitrifikasi dan selada romain
Kualitas air
Performa ikan nila dan selada romain
Biomassa ikan nila dan selada romain
Alternatif pengolahan limbah budidaya dan peningkatan multi
mempertahankan kualitas air guna mendukung pertumbuhan, dan kelangsungan hidup ikan yang dipelihara. Selanjutnya informasi ini diharapkan dapat diaplikasikan secara berkelanjutan, sehingga mengurangi buangan limbah ke lingkungan, dan diperoleh nilai tambah dari tanaman yang dipanen.
Hipotesis
Hipotesis yang diajukan adalah perbedaan perlakuan yang diuji pada sistem dapat berimplikasi pada efektivitas penurunan limbah nitrogen, dan secara sistematis berdampak pula pada pertumbuhan ikan yang dipelihara.
METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Pusat Penelitian Lingkungan Hidup (PPLH) Institut Pertanian Bogor (IPB), selama tiga bulan mulai Februari-April 2015. Analisis kualitas air dan perhitungan bakteri total dilakukan di Laboratorium PPLH IPB dan Laboratorium Fisika-Kimia Perairan, Divisi Produktivitas dan Lingkungan Perairan (Proling), Departemen Manajemen Sumberdaya Perairan, IPB.
Rancangan Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) in timeyang terdiri dari tiga perlakuan dan diulang sebanyak tiga kali. Perlakuan yang diberikan pada percobaan ini adalah perlakuan I tanpa tanaman sebagai kontrol (P1), perlakuan II adalah selada romain tanpa penambahan bakteri (P2), dan perlakuan III selada romain dan penambahan bakteri komersial (P3). Pada RAL in time, pengamatan dilakukan secara berulang, dengan waktu pengamatan dianggap sebagai faktor tambahan pengamatan (Widiharih 2001).
Prosedur Penelitian
Prosedur penelitian terdiri dari persiapan percobaan, penebaran ikan, penambahan bakteri nitrifikasi, dan penanaman selada. Hal-hal tersebut disajikan dalam uraian sebagai berikut.
Persiapan sistem percobaan
menggunakan talang air, yang dipasang pot-pot hidroponik berdiameter 5 cm. Setiap sistem percobaan juga dilengkapi bak tandon air yang diisi 60 L air, dan ditambahkan bioball, dengan jumlah sesuai dengan luas penutupan diameter bak tandon. Rangkaian percobaan kemudian disusun untuk bekerja dengan metode resirkulasi, yaitu air hasil budidaya dari akuarium dialirkan dengan debit air dipertahankan 187 L/jam ke bagian talang melewati akar selada. Air kemudian mengalir dari talang dan ditampung dalam tandon untuk dihomogenkan, selanjutnya air dipompa secara vertikal untuk masuk kembali ke akuarium. Gambar sistem akuaponik ditunjukkan pada Gambar 2.
Gambar 2 Rangkaian instalasi percobaan. Akuarium tempat pemeliharaan ikan (a), tabung aliran (b), talang hidroponik (c), tandon (d), = arah aliran air
Penebaran ikan nila
Ikan nila sebanyak 20 ekor dengan bobot antara 20-25 g/ekor (panjang baku 9-10 cm), ditebar ke dalam akuarium. Kisaran kepadatan pemeliharaan ikan nila yaitu 5 g/L, mengacu pada kisaran padat tebar ikan nila pada sistem akuaponik oleh Sace dan Fitzsimmons (2013). Selama satu minggu ikan diaklimatisasi dan diberi pakan komersial agar terjadi akumulasi nutrien untuk mengaktifkan bakteri, dan menyediakan nutrien yang dapat dimanfatkan oleh tanaman. Setelah itu ikan dipelihara selama 35 hari dan diberi pakan sebanyak 3% dari bobot rata-rata ikan, dengan frekuensi pemberian pakan tiga kali sehari. Pengukuran panjang dan bobot dilakukan setiap minggu.
Penambahan bakteri komersial
Penanaman selada romain
Tanaman yang digunakan adalah selada dari varietas romain.Jenis selada ini memiliki bentuk lonjong dan mampu mencapai tinggi 25 cm. Daunnya lebih tegak dibandingkan daun selada pada umumnya. Bentuk selada romain disajikan pada Gambar 3.
Gambar 3 Selada romain (Lactuca sativa L. var.longifolia) (Dok.pribadi)
Bibit selada berukuran tinggi 11 cm ditimbang bobotnya secara acak untuk P2 dan P3 sebagai bobot awal. Media tanam yang digunakan adalahrockwool, dan ditimbang bersama penimbangan bobot bibit selada romain. Berdasarkan penimbangan secara acak, bobot awal selada romain pada P2 yaitu 18 g, sedangkan pada P3 yaitu 20 g. Setiap pot-pot sebelumnya dipasang padastyrofoam, yang telah diberi lubang sesuai dengan diameter pot yang digunakan. Selada romain dengan umur tebar sekitar dua minggu kemudian ditanam di pot-pot yang telah diletakkan pada talang air (P2 dan P3), dengan jarak tanam 20 cm mengikuti aturan jarak tanam sayuran oleh petani hidroponik. Penanaman selada romain dilakukan setelah bakteri ditambahkan dalam sistem. Masing-masing talang ditanam dengan lima selada romain, menggunakan metode nutrient film technique (NFT). NFT merupakan metode hidroponik dengan aliran air yang tipis setinggi ±1 cm, sehingga akar tumbuh pada lapisan nutrisi yang dangkal, sedangkan akar yang tidak terendam dapat menyerap oksigen melalui difusi (Rakocyet al. 2006).
Parameter pengamatan
Kualitas Air
Pengambilan contoh dan pengamatan parameter dilakukan setiap minggu selama 35 hari. Parameter kualitas air yang diukur terdiri atas parameter fisika (suhu dan kekeruhan), kimia (pH, oksigen terlarut, alkalinitas, TAN, nitrat, dan nitrit), dan biologi (bakteri total). Analisis kualitas air menggunakan metode yang dipublikasikan APHA (2012).
Analisis parameter fisika dan kimia dilakukan dengan mengambil contoh air kemudian dilakukan analisis di laboratorium. Analisis kelimpahan bakteri dengan mengambil 100 mL contoh air, kemudian dilakukan analisis perhitungan di laboratorium menggunakan metodetotal plat count(TPC). Parameter beserta alat atau metode dan waktu pengukuran selengkapnya disajikan pada Tabel 1.
Tabel 1 Metode/alat dan waktu pengukuran parameter pengamatan (APHA 2012)
Parameter Satuan Metode/Alat Waktu Pengukuran
Fisika
Suhu oC Termometer Setiap minggu
Kekeruhan NTU Turbidity meter Setiap minggu
Kimia
pH - pH meter Setiap minggu
TAN mg/L Spektrofotometer Setiap minggu
Nitrat (mg/L) mg/L Spektrofotometer Setiap minggu
Nitrit (mg/L) mg/L Spektrofotometer Setiap minggu
Oksigen terlarut mg/L DO meter Setiap minggu
Alkalinitas mg CaCO3/l Titrasi Setiap minggu
Biologi
Kelimpahan bakteri CFU/mL TPC Setiap minggu
Persentase amonia tidak terionisasi
Amonia tidak terionisasi dapat dicari dari hasil pengukuran TAN dengan menggunakan data suhu dan pH yang diukur selama percobaan. Dengan data suhu dapat ditentukan nilai pKa atau faktor pengali seperti yang tercantum dalam Tabel 2, sedangkan rumus untuk mencari persentase amonia tidak terionisasi adalah sebagai berikut (Strickland & Parsons 1972):
% Amonia tidak terionisasi = 100
1 + antilog (pKa pH)
Tabel 2 nilai pKa untuk mencari persentase amonia tidak terionisasi
Suhu (°C) 5 10 15 20 25 30
pKa 9,90 9,73 9,56 9,40 9,24 9,09
Persentase penghilangan nutrien (nutrient removal)
% Penghilangan = a b
a X 100%
Keterangan :
a = Konsentrasi nutrien kontrol pada waktu t b = Konsentrasi nutrien perlakuan pada waktu t
Pertumbuhan, kelangsungan hidup, dan rasio konversi pakan ikan nila
Pengukuran panjang dan bobot ikan dilakukan dengan melakukan pengambilan contoh ikan pada setiap akuarium percobaan (N=10 ekor). Contoh ikan yang dipilih kemudian diukur panjangnya dengan penggaris dan bobot ditimbang dengan timbangan digital.
a. Pertumbuhan
Laju pertumbuhan spesifik atauspecific growth rate(SGR) dan harian atau
growth rate(GR) ikan nila dihitung menggunakan persamaan dari Zonneveldet al. (1991), yaitu sebagai berikut:
t0 = Waktu awal pengamatan (hari)
t = Waktu pengamatan ke t (hari)
b. Kelangsungan hidup
Kelangsungan hidup (SR) ikan nila dihitung untuk mengetahui persentase jumlah ikan yang mati dan masih hidup sampai percobaan selesai. Kelangsungan hidup ikan nila dihitung menggunakan persamaan berdasarkan Zonneveld et al. (1991), yaitu sebagai berikut:
SR =N N
N × 100%
Keterangan :
Nt = Jumlah individu hari ke-t (g)
N0 = Jumlah individu awal (g)
c. Konversi pakan /Food Convertion Ratio(FCR)
Rasio konversi pakan ikan nila dihitung untuk mengetahui efektivitas pakan yang diberikan kepada ikan terhadap pertumbuhan. Tingkat konversi pakan dihitung dengan menggunakan rumus dari Ridha dan Cruz (2001), yaitu sebagai berikut:
FCR = P
W W
Keterangan :
FCR =Food convertion ratio
Pertumbuhan selada romain
Pengamatan pertumbuhan selada romain meliputi pengukuran lebar dan jumlah daun selada yang diukur setiap minggu sejak penanaman. Pengamatan lebar dan jumlah daun dilakukan saat tanaman berumur 7, 14, 21 dan 28, 35 hari setelah tanam (HST). Bobot awal dan akhir selada setelah panen diukur kemudian dilakukan perhitungan laju pertumbuhannya.
a. Pertumbuhan spesifik (SGR) selada dihitung mengikuti persamaan Gaudet in
Mitchell 1974 sebagai berikut:
t0 = Waktu awal pengamatan (hari)
t = Waktu pengamatan ke t (hari)
b. Pertumbuhan relatif (RGR) selada mengikuti persamaan (Buzby dan Lin 2014) sebagai berikut:
t0 = Waktu awal pengamatan (hari)
t = Waktu pengamatan ke t (hari)
Analisis Data
Data kualitas air dan pertumbuhan ikan yang diperoleh disajikan dalam bentuk tabel dan gambar kemudian dianalisa secara deskriptif. Analisis statistik menggunakan RAL in time. Pada RAL in time selain perlakuan yang diberikan, perkembangan respon selama penelitian juga ingin dilihat, sehingga pengaruh waktu perlu dikaji disamping perlakuan yang diberikan (Mattjik dan Sumertajaya 2013). Berikut model linier yang digunakan:
yijk= μ + αi+ δik+ βj+ (αβ)ij+ εijk
Keterangan:
yijk : Nilai pengamatan pada perlakuan ke-i, waktu ke-j, ulangan ke-k; i=1,2,3
(Kontrol : tanpa tanaman; S : selada romaine; SB : selada romain dan bakteri), j=1,2,...,6 (hari ke- 0, 7, 14, 21, 28, 35), k=1,2,3
μ : Rataan umum
αi : Pengaruh perlakuan ke-i δik : Komponen galat (a) βj : Pengaruh waktu ke-j
(αβ)jk : Pengaruh interaksi perlakuan ke-i dan waktu ke-j
εijk : Pengaruh acak dari interaksi waktu dengan perlakuan yang menyebar
Hipotesis
1. Pengaruh perlakuan terhadap respon Hipotesis :
H0 : αK= αS= αSB= 0 (tidak ada pengaruh perlakuan terhadap respon)
H1 : minimal ada satu αj≠ 0 (ada pengaruh perlakuan terhadap respon)
2. Pengaruh waktu pengamatan Hipotesis :
H0 : β0=β7= β14= β ….= β35= 0 (tidak ada pengaruh perlakuan terhadap
respon)
H1 : minimal ada satu βk≠ 0 (ada pengaruh waktu pengamatan terhadap
respon)
3. Pengaruh interaksi perlakuan dan waktu pengamatan Hipotesis :
H0 : (αβ)K0= (αβ)K6= … = (αβ)SB35= 0 (tidak ada pengaruh perlakuan dan
waktu pengamatan)
H1 : minimal ada satu (αβ)jk ≠ 0 (ada pengaruh interaksi perlakuan dan waktu
pengamatan)
Berdasarkan hasil analisis, jika hipotesis nol ditolak atau ada pengaruh pada respon yang diamati maka dilakukan uji lanjut untuk melihat perlakuan yang berbeda. Uji lanjut yang digunakan adalah Uji Duncan pada taraf kepercayaan 95% (P<0,05) menggunakansoftwareSPSS.
HASIL DAN PEMBAHASAN
Hasil
Pengaruh kualitas air terhadap proses biofiltrasi
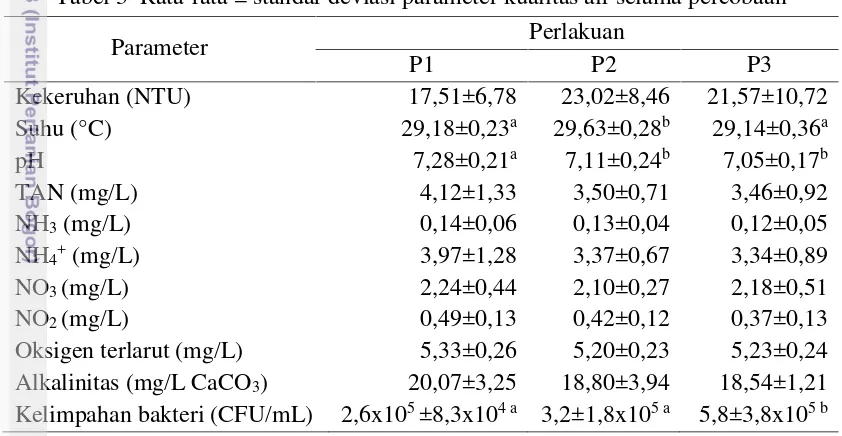
Rata-rata kualitas air pada setiap perlakuan disajikan pada Tabel 3. Berdasarkan tabel tersebut diketahui bahwa perlakuan tanpa tanaman (P1), selada romain (P2), dan selada romain dengan penambahan bakteri komersial (P3), memiliki suhu, pH, oksigen terlarut, dan alkalinitas yang nilainya relatif tidak jauh berbeda. Kekeruhan pada P3 relatif lebih rendah, begitu juga dengan kandungan nutrien anorganik (TAN, NH3, NH4+, NO2-) pada P3 cenderung lebih rendah dari
berkisar antara 28,5-30,2oC. Secara deskriptif diketahui bahwa rata-rata suhu pada P2 lebih tinggi dari P1 dan P3 (Tabel 3). Sementara berdasarkan hasil analisis statistik, diketahui bahwa suhu pada P1 berbeda nyata dengan P2 (P<0,05), namun tidak berbeda dengan P3 (P>0,05). Waktu pengamatan memberikan pengaruh signifikan terhadap nilai suhu (P<0,05) (Lampiran 8).
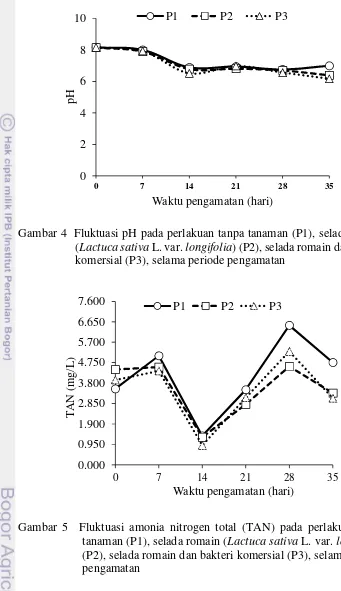
Selama periode pengamatan nilai pH berkisar antara 6,2-8,2. Fluktuasi pH pada setiap perlakuan seiring waktu pengamatan disajikan pada Gambar 4. Berdasarkan gambar tersebut, nilai pH berfluktuasi dan cenderung menurun seiring periode pengamatan untuk semua perlakuan. Secara deskriptif diketahui bahwa rata-rata pH pada P3 lebih rendah dari P1 dan P2, dengan perbedaan yang tidak signifikan (Tabel 3). Sementara secara statistik diketahui bahwa pH pada P1 berbeda nyata dengan P2 dan P3 (P<0,05), sedangkan pH antara P2 dan P3 tidak berbeda nyata (P>0,05). Selanjutnya waktu pengamatan memberikan pengaruh signifikan terhadap nilai pH (P<0,05) (Lampiran 9).
Tabel 3 Rata-rata ± standar deviasi parameter kualitas air selama percobaan
Parameter Perlakuan
P1 P2 P3
Kekeruhan (NTU) 17,51±6,78 23,02±8,46 21,57±10,72
Suhu (°C) 29,18±0,23a 29,63±0,28b 29,14±0,36a
pH 7,28±0,21a 7,11±0,24b 7,05±0,17b
TAN (mg/L) 4,12±1,33 3,50±0,71 3,46±0,92
NH3(mg/L) 0,14±0,06 0,13±0,04 0,12±0,05
NH4+(mg/L) 3,97±1,28 3,37±0,67 3,34±0,89
NO3(mg/L) 2,24±0,44 2,10±0,27 2,18±0,51
NO2(mg/L) 0,49±0,13 0,42±0,12 0,37±0,13
Oksigen terlarut (mg/L) 5,33±0,26 5,20±0,23 5,23±0,24
Alkalinitas (mg/L CaCO3) 20,07±3,25 18,80±3,94 18,54±1,21
Kelimpahan bakteri (CFU/mL) 2,6x105±8,3x104 a 3,2±1,8x105 a 5,8±3,8x105 b
P1: tanpa tanaman, P2: selada romain (Lactuca sativaL. var.longifolia), P3: selada romain dan bakteri komersial.
Gambar 4 Fluktuasi pH pada perlakuan tanpa tanaman (P1), selada romain (Lactuca sativaL. var.longifolia) (P2), selada romain dan bakteri komersial (P3), selama periode pengamatan
Gambar 5 Fluktuasi amonia nitrogen total (TAN) pada perlakuan tanpa tanaman (P1), selada romain (Lactuca sativaL. var.longifolia) (P2), selada romain dan bakteri komersial (P3), selama periode pengamatan
Perubahan suhu dan pH selama periode pengamatan berpengaruh pada kesetimbangan NH3dan NH4+. Gambar 6 menunjukkan fluktuasi amonia (NH3)
selama periode pengamatan pada setiap perlakuan. Gambar tersebut juga menunjukkan bahwa pada awal percobaan (Hari ke-0), nilai pH mencapai 8,0 mempengaruhi kesetimbangan TAN, sehingga konsentrasi NH3 pada hari ke-0
cenderung relatif tinggi. Nilai pH kemudian turun menjadi 6,0 pada hari ke-14, menyebabkan amonia menurun tajam pada semua perlakuan. Secara deskriptif diketahui bahwa P3 memiliki rata-rata amonia lebih rendah dari P1 dan P2 (Tabel 3). Selanjutnya secara statistik, amonia antara P1, P2, dan P3 tidak berbeda nyata (P>0,05), sedangkan waktu pengamatan memberikan pengaruh signifikan terhadap NH3(P<0,05) (Lampiran 11).
Gambar 6 Fluktuasi amonia (NH3) pada perlakuan tanpa tanaman (P1), selada
romain (Lactuca sativaL. var.longifolia) (P2), selada romain dan bakteri komersial (P3), selama periode pengamatan
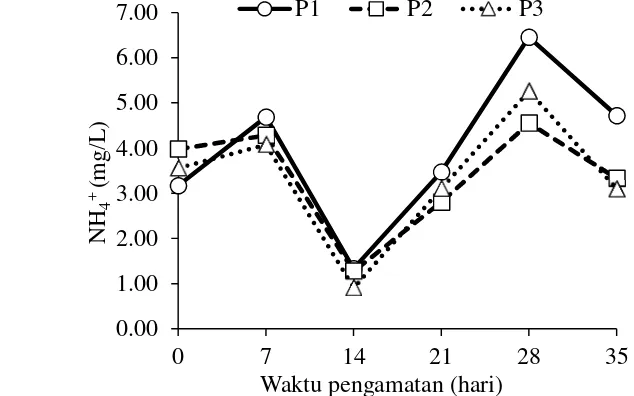
Berdasarkan hasil pengukuran amonium (NH4+), diketahui bahwa kisaran
amonium selama periode pengamatan yaitu 0,90-6,45 mg/L. Pada akhir percobaan, P1 memiliki nilai amonium lebih tinggi (4,72±1,04 mg/L) dari P2 (3,33±0,44 mg/L), dan P3 (3,09±0,11 mg/L). Fuktuasi amonium dari waktu ke waktu selama periode pengamatan disajikan pada Gambar 7. Gambar tersebut menunjukkan bahwa fluktuasi amonium memiliki pola yang sama dengan fluktuasi TAN. Selanjutnya amonium teramati mengalami penurunan pada pengamatan hari ke-14, dan hari ke-35 untuk semua perlakuan. Secara deskriptif diketahui bahwa P3 memiliki rata-rata amonium lebih rendah dari P1 dan P2 (Tabel 3). Sementara secara statistik (P>0,05), NH4+ antara P1, P2, dan P3 tidak berbeda nyata,
sedangkan waktu pengamatan memberikan pengaruh signifikan terhadap nilai amonium (P<0,05) (Lampiran 12).
Nitrit terbentuk sebagai produk antara dari oksidasi senyawa amonia oleh
Nitrosomonas. Secara deskriptif diketahui bahwa P3 memiliki rata-rata nitrit lebih rendah dari P1 dan P2 (Tabel 3). Nilai nitrit selama periode pengamatan berkisar antara 0,03-0,93 mg/L. Perubahan nitrit pada setiap perlakuan selama periode pengamatan disajikan pada Gambar 8. Berdasarkan gambar tersebut, konsentrasi nitrit cenderung meningkat, dan menurun hanya pada pengamatan hari ke-28. Selanjutnya hasil analisis statistik menunjukkan antara P1, P2, dan P3 tidak berbeda
nyata (P>0,05), sedangkan waktu pengamatan memberikan pengaruh signifikan terhadap nilai nitrit (P<0,05) (Lampiran 13).
Gambar 7 Fluktuasi amonium (NH4+) pada perlakuan tanpa tanaman (P1),
selada romain (Lactuca sativa L. var. longifolia) (P2), selada romain dan bakteri komersial (P3), selama periode pengamatan
Gambar 8 Fluktuasi nitrit (NO2-) pada perlakuan tanpa tanaman (P1), selada
romain (Lactuca sativaL. var.longifolia) (P2), selada romain dan bakteri komersial (P3), selama periode pengamatan
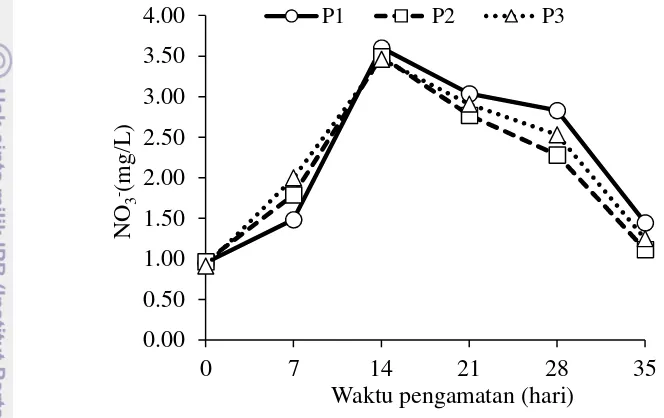
Gambar 9 menunjukkan fluktuasi nitrat dari waktu ke waktu selama periode pengamatan. Gambar tersebut menunjukkan bahwa nitrat awal percobaan meningkat sampai hari ke-14, kemudian menurun sampai hari ke-35 untuk semua
perlakuan. Selama periode pengamatan nilai nitrat berkisar antara 0,91-3,60 mg/L. Secara deskriptif diketahui bahwa P2 memiliki rata-rata nitrat lebih rendah dari P1 dan P3 (Tabel 3). Sementara hasil analisis statistik menunjukkan antara P1, P2, dan P3 tidak berbeda nyata (P>0,05), sedangkan waktu pengamatan memberikan pengaruh signifikan terhadap nilai nitrat (P<0,05) (Lampiran 14).
Gambar 9 Fluktuasi nitrat (NO3-) pada perlakuan tanpa tanaman (P1), selada
romain (Lactuca sativaL. var.longifolia) (P2), selada romain dan bakteri komersial (P3), selama periode pengamatan
Berdasarkan hasil pengukuran oksigen terlarut, rata-rata kandungan oksigen terlarut masih di atas 5 mg/L untuk semua perlakuan, dengan kisaran antara 4,8-5,7 mg/L. Baik secara deskriptif maupun statistik, antara P1, P2, dan P3 tidak menunjukkan perbedaan signifikan, begitu juga dengan waktu pengamatan yang tidak memberikan pengaruh signifikan terhadap nilai oksigen terlarut (P>0,05). Selanjutnya alkalinitas total selama periode pengamatan berfluktuasi, dengan kisaran antara 9,67-24,53 mg/L CaCO3. Nilai alkalinitas total pada setiap perlakuan
cenderung menurun seiring periode pengamatan. Secara deskriptif diketahui bahwa P3 memiliki rata-rata alkalinitas total lebih rendah dari P1 dan P2 (Tabel 3). Sementara analisis statistik menunjukkan bahwa alkalinitas total pada P1, P2, dan P3 tidak berbeda nyata (P>0,05), tetapi waktu pengamatan memberikan pengaruh signifikan terhadap nilai alkalinitas total (P<0,05) (Lampiran 15).
Kelimpahan bakteri pada sistem akuaponik
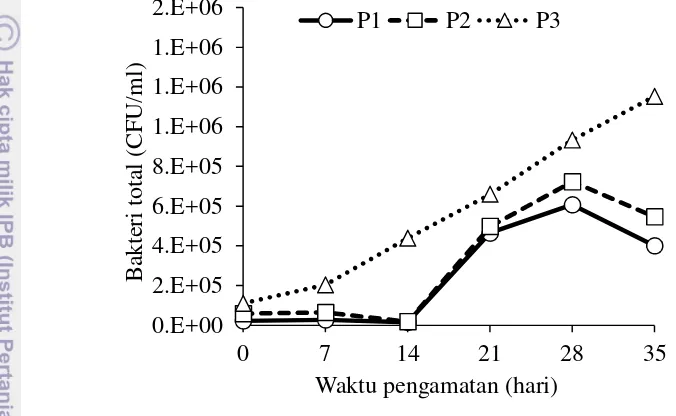
Kelimpahan bakteri pada setiap perlakuan selama perioe pengamatan disajikan pada Gambar 10. Berdasarkan gambar tersebut diketahui bahwa kelimpahan bakteri pada P3 meningkat dengan semakin bertambahnya waktu pengamatan, sedangkan penurunan kelimpahan bakteri teramati pada pengamatan hari ke-14, dan hari ke-35 untuk P1 dan P2. Kelimpahan bakteri di akhir percobaan pada P3 mencapai 1,2x106CFU/mL, yakni dua kali lipat dari kelimpahan bakteri
pada P1 dan P2. Secara deskriptif diketahui bahwa P3 memiliki kelimpahan bakteri lebih tinggi dari P1 dan P2 (Tabel 3). Begitu juga secara statistik menunjukkan bahwa, kelimpahan bakteri pada P3 secara nyata lebih tinggi dari P1 dan P2 (P<0,05), sedangkan antara P1 dan P2 tidak berbeda nyata (P>0,05). Selanjutnya waktu pengamatan memberikan pengaruh signifikan terhadap kelimpahan bakteri (P<0,05) (Lampiran 16).
Gambar 10 Kelimpahan bakteri pada perlakuan tanpa tanaman (P1), selada romain (Lactuca sativaL. var.longifolia) (P2), selada romain dan bakteri komersial (P3), selama periode pengamatan
Penghilangan nutrien pada sistem akuaponik
Penghilangan nutrien dapat dilihat dari persentase penghilangan nutrien selama periode pengamatan. Persentase penghilangan nutrien dihitung dengan membandingkan antara nutrien perlakuan dan kontrol. Persentase penghilangan nutrien pada P2 dan P3 untuk amonia (NH3), amonium (NH4+), nitrat (NO3-), dan
nitrit (NO2-) berfluktuasi selama periode pengamatan, dan nilainya disajikan pada
Tabel 4.
Tabel 4 Persentase penghilangan nutrien pada pada sistem akuaponik
Hari
ke-Persentase penurunan (%)
Amonia (NH3) Amonium (NH4+) Nitrat (NO3-) Nitrit (NO2-)
P2 P3 P2 P3 P2 P3 P2 P3
7 30,96 24,16 8,62 13,06 -20,71 -34,80 -15,33 2,14
14 37,76 86,23 4,14 31,90 2,90 3,87 4,89 4,66
21 27,60 14,13 19,19 10,51 8,77 4,26 -15,74 -5,78
28 26,45 47,25 29,48 18,47 19,35 10,56 40,17 41,61
35 83,59 91,50 29,36 34,41 22,86 13,58 28,64 49,74
P2: selada romain (Lactuca sativaL. var.longifolia), P3: selada romain dan bakteri komersial; tanda minus menunjukkan peningkatan persentase nutrien.
Penghilangan tertinggi terjadi di akhir percobaan pada P3, yaitu 91,50%, 34,41%, dan 49,74% untuk ammonia, amonium, dan nitrit berturut-turut. Penghilangan tertinggi untuk nitrat yaitu 22,86% pada P2, seperti yang disajikan pada Tabel 4. Secara deskriptif diketahui bahwa P3 memiliki tingkat penghilangan nutrien anorganik tertinggi, dan lebih efektif dari P2 untuk NH3, NH4+, dan NO2-,
sementara penghilangan NO3-lebih efektif pada P2.
Performa ikan nila pada sistem akuaponik
Performa ikan nila dapat dilihat dari pertumbuhan, tingkat kelangsungan hidup, dan rasio konversi pakan selama percobaan. Selama periode pemeliharaan, ikan nila dapat tumbuh dengan bobot akhir mencapai 48,49±3,92 g pada P3, 47,80±1,97 g pada P2, dan 45,89±1,10 g pada P1. Selanjutnya untuk biomassa ikan nila di akhir percobaan mencapai dua kali lipat dari biomassa awal. Biomassa tertinggi pada P3 (914,68±53,09 g), kemudian diikuti P2 (895,51±104,23 g), dan terendah pada P1 (800,83±21,10 g). Rata-rata pertumbuhan, tingkat kelangsungan hidup, dan konversi pakan ikan nila disajikan pada Tabel 5.
Tabel 5 Performa ikan nila (Oreochromis niloticus) pada sistem akuaponik
Parameter Perlakuan
P1 P2 P3
Specific growth rate(SGR) (%/hari) 6,14±0,69 6,40 ±0,64 6,46±0,70
Growth rate(GR) (g/ekor/hari) 1,74±0,14 1,84±0,20 1,87±0,29
Food convertion ratio(FCR) 2,02±0,13 1,70±0,40 1,60±0,07
Survival rate(SR) (%) 89,17±0,96a 94,44±6,45b 96,11±1,44b
Huruf superscrip yang berbeda menunjukkan hasil berbeda nyata pada taraf uji 5%; P1: tanpa tanaman, P2: selada romain (Lactuca sativa L. var. longifolia), P3: selada romain dan bakteri komersial.
Berdasarkan Tabel 5 diketahui bahwa pada setiap perlakuan memiliki pertumbuhan spesifik (SGR), dan pertumbuhan harian (GR) ikan nila yang relatif tidak jauh berbeda. Secara deskriptif diketahui bahwa ikan nila pada P3 memiliki pertumbuhan lebih optimal dari P1 dan P2, baik untuk pertumbuhan spesifik maupun pertumbuhan harian. Sementara secara statistik pertumbuhan pada P1, P2, dan P3 tidak berbeda nyata (P>0,05).
Rata-rata rasio konversi pakan pada setiap perlakuan disajikan pada Gambar 11. Gambar tersebut menunjukkan bahwa rasio konversi pakan ikan nila pada setiap perlakuan bervariasi, dan relatif tidak jauh berbeda. Secara deskriptif diketahui bahwa P3 memiliki rata-rata FCR lebih rendah dari P1 dan P2 (Tabel 5). Rasio konversi pakan sebesar 2,02 pada P1 menunjukkan bahwa untuk menghasilkan 1 kg daging dibutuhkan 2,02 kg pakan. Hal ini menunjukkan bahwa pada P3 lebih efektif karena hanya dibutuhkan 1,60 kg pakan untuk menghasilkan 1 kg daging. Selanjutnya analisis statistik menunjukkan antara P1, P2, dan P3 tidak berbeda nyata (P>0,05).
dengan P1 berbeda nyata (P<0,05), tetapi antara P3 dengan P2 tidak menunjukkan perbedaan (P>0,05) (Lampiran 17).
Gambar 11 Rasio konversi pakan (FCR) ikan nila (Oreochromis nilo ticus) pada perlakuan tanpa tanaman (P1), selada romain (Lactuca sativa L. var. longifolia) (P2) dan selada romain dan bakteri komersial (P3) berdasarkan uji beda nyata pada taraf 5%
Gambar 12 Kelangsungan hidup (SR) ikan nila (Oreochromis niloticus) pada perlakuan tanpa tanaman (P1), selada romain (Lactuca sativa L. var.longifolia) (P2) dan selada romain dan bakteri komersial (P3) berdasarkan uji beda nyata pada taraf 5%
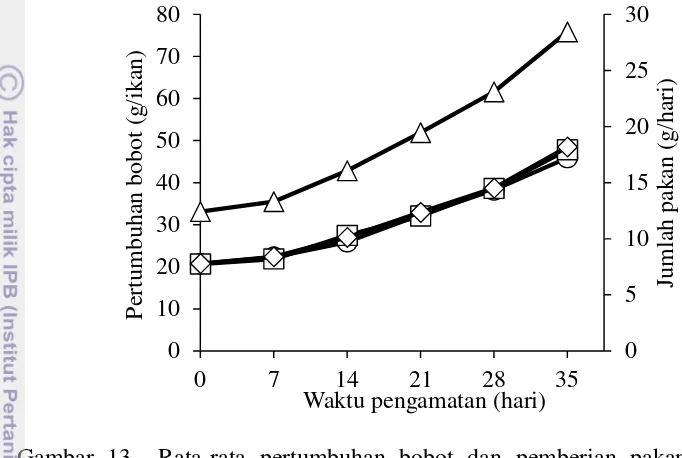
Selama masa percobaan ikan nila diberi pakan 3% dari bobot tubuhnya dengan frekuensi pemberian pakan tiga kali sehari. Jumlah pemberian pakan
meningkat seiring dengan pertambahan bobot ikan setiap minggunya, dan jumlah pemberiannya mengikuti pertumbuhan bobot. Rata-rata konsumsi pakan dari awal sampai akhir percobaan berkisar antara 12,44±0,83 g/hari sampai 29,10±2,35 g/hari. Laju pertambahan bobot ikan dan jumlah pakan selama periode pengamatan disajikan pada Gambar 13.
Gambar 13 Rata-rata pertumbuhan bobot dan pemberian pakan selama pemeliharaan. tanpa tanaman, selada romain (Lactuca sativa L. var. longifolia), selada romain dan bakteri komersial, total pakan
Pertumbuhan selada romain
Selada romain dapat tumbuh tanpa penambahan nutrisi tambahan, sehingga nutrien hanya berasal dari limbah budidaya ikan nila. Selama periode pemeliharaan, selada romain tumbuh pesat dan menunjukkan respon positif terhadap nutrien yang berasal dari limbah budidaya ikan nila. Selama periode pertumbuhan, selada romain menunjukkan gejala pertumbuhan yang baik, ditandai dengan warna daun hijau segar, dan tidak ada tanda-tanda defisiensi nutrien untuk semua perlakuan. Performa selada romain dapat dilihat dari pertumbuhan jumlah dan lebar daun, tinggi dan bobot tanaman, serta panjang akar. Pada akhir periode pemeliharaan, selada romain mencapai ukuran pasar yaitu 25,2 cm untuk P2 dan 24,6 cm untuk P3. Selanjutnya untuk pertumbuhan tinggi selada romain dari waktu ke waktu selama periode pengamatan disajikan pada Gambar 14. Gambar tersebut menunjukkan bahwa pertumuhan selada romain meningkat seiring waktu pemeliharaan, dan antara P2 dan P3 memiliki pola pertumbuhan yang sama.
Jumlah daun di awal percobaan adalah 4 helai untuk P2 dan P3, kemudian jumlah daun bertambah dan mencapai 16±1 di akhir percobaan untuk P2 dan P3. Pada awal penanaman, rata-rata bobot selada romain yang diukur secara acak adalah 18,00±0,17 g untuk P2, dan 20,00±1,37 g untuk P3. Setelah selada romain dipelihara selama 35 hari, bobot selada romain saat panen mencapai 61,87±5,59 g untuk P2 dan 57,74±4,35 g untuk P3.
Gambar 14 Rata-rata tinggi selada romain (Lactuca sativa L. var.longifolia) pada perlakuan selada romain (P2) dan selada romain dan bakteri komersial (P3), selama periode pengamatan
Pertumbuhan spesifik (SGR) selada romain pada P2 dan P3 menunjukkan pola pertumbuhan yang sama, dengan rata-rata pertumbuhan spesifik 3,52±0,27%/hari pada P2 dan 3,03±0,22%/hari pada P3. Demikian pula halnya dengan pertumbuhan relatif (RGR) selada romain menunjukkan hasil yang relatif tidak berbeda, yaitu 0,035±0,002 g/hari untuk P2 dan 0,030±0,002 g/hari pada P3. Selanjutnya pertumbuhan harian (GR) selada romain untuk tinggi tanaman dan lebar daun disajikan pada Gambar 15.
Gambar 15 Laju pertumbuhan harian (GR) selada romain (Lactuca sativa L. var. longifolia) pada perlakuan selada romain (P2) dan selada romain dan bakteri komersial (P3)
Gambar 15 menunjukkan bahwa P2 dan P3 memiliki pertumbuhan harian yang tidak berbeda, baik untuk tinggi tanaman dan lebar daun. Selanjutnya sistem perakaran selada romain tumbuh dan mencapai 15,5 cm untuk P2 dan 14,5 cm untuk P3. Secara deskriptif diketahui bahwa P2 memiliki sistem perakaran yang lebih panjang dari P3, dengan perbedaan yang tidak signifikan.
Pembahasan
Proses pengolahan limbah budidaya pada sistem akuaponik mempengaruhi keberadaan nitrogen dan bentuk-bentuknya. Pada sistem akuaponik, proses penguraian bahan organik dan penghilangan nutrien terlarut (NH3, NH4+, NO3-, dan
NO2-) melalui nitrifikasi sangat dipengaruhi oleh faktor lingkungan. Beberapa
faktor lingkungan yang mempengaruhi proses ini, diantaranya adalah suhu, pH, oksigen terlarut, alkalinitas, dan kelimpahan bakteri dalam sistem.
Suhu selama periode pengamatan cenderung konstan, dengan perubahan yang relatif kecil. Rata-rata nilai suhu selama percobaan masih dalam kisaran normal (rata-rata suhu 29 oC), akan tetapi menurut Colt (2006) suhu optimal untuk kehidupan ikan nila adalah 28 °C. Selanjutnya pH pada setiap perlakuan cenderung menurun seiring waktu pengamatan (Gambar 4). Penurunan pH disebabkan oleh proses respirasi ikan dan bakteri yang menghasilkan CO2. Keberadaan CO2
kemudian menggeser reaksi kesetimbangan karbonat, dan menghasilkan ion H+ yang menurunkan pH. Penurunan pH juga berkaitan dengan proses oksidasi yang dilakukan oleh bakteri. Menurut Princicet al. (1998), pada lingkungan dengan input amonia yang tinggi seperti masukan air limbah budidaya, bioksidasi senyawa ini menghasilkan CO2dan menurunkan pH. Lebih jelasnya selama proses nitrifikasi,
energi yang dilepaskan dari proses oksidasi digunakan oleh Nitrosomonas dan
Nitrobacter untuk proses kelangsungan hidup. Selama proses ini dibutuhkan oksigen dan menghasilkan ion hidrogen yang dapat menurunkan pH, dan menghasilkan nitrit sebagai produk antara (Chenet al. 2006). Ebelinget al. (2006) menambahkan bahwa penurunan pH akan menyebabkan pergeseran bentuk karbon anorganik dari bikarbonat menjadi CO2terlarut yang dapat mempengaruhi beberapa
spesies budidaya termasuk ikan nila.
Berdasarkan hasil pengukuran pH pada setiap perlakuan diketahui bahwa P3 memiliki nilai pH lebih rendah (Gambar 4). Hasil tersebut diduga berkaitan dengan kelimpahan bakteri yang lebih tinggi pada perlakuan ini, sehingga menyebabkan laju respirasi dan oksidasi meningkat, menghasilkan CO2, dan menurunkan pH.
Selanjutnya perubahan suhu dan pH selama periode pengamatan mempengaruhi keseimbangan amonia tidak terionisasi (NH3) dan amonia terionisasi (NH4+).
Amonia dihasilkan sebagai produk akhir dari katabolisme protein pada ikan. Amonia yang terukur adalah sebagai total amonia nitrogen (TAN), dimana TAN merupakan penjumlahan dari NH3 dan NH4+. Berdasarkan Gambar 5 diketahui
untuk semua perlakuan. Hasil tersebut diduga berkaitan dengan laju nitrifikasi dan penyerapan oleh selada romain yang optimal pada waktu pengamatan tersebut, meskipun dengan kelimpahan bakteri dan jumlah tanaman yang sedikit.
Berdasarkan Tabel 3 diketahui bahwa P1 memiliki rata-rata TAN tertinggi, sedangkan rata-rata TAN terendah pada P3. Pada P1 kelimpahan bakteri lebih sedikit dan tidak adanya tanaman menyebabkan proses nitrifikasi tidak berjalan optimal, dan jumlah nutrien yang dihasilkan dari proses nitrifikasi tidak dimanfaatkan dengan baik, sehingga nilai TAN cenderung lebih besar pada P1 dibandingkan P2 dan P3. Selanjutnya pada P3 jumlah bakteri lebih banyak diduga menyebabkan laju oksidasi amonia lebih cepat, sementara selada romain pada sistem kemudian memanfaatkan nutrien yang dihasilkan dari proses ini. Menurut Tysonet al. (2011), tanaman dapat memberikan peran biofiltrasi dengan menyerap amonium, sedangkan bakteri nitrifikasi memberikan peran ganda dengan mengurangi konsentrasi amonia melalui oksidasi, dan mengkonversi amonia menjadi nitrat yang dibutuhkan tanaman. Hasil tersebut secara deskriptif menunjukkan bahwa P3 lebih baik dalam mempertahankan nilai TAN pada kisaran lebih rendah dari perlakuan lainnya. Hasil penelitian yang dilakukan oleh Sheteet al. (2013) juga menunjukkan bahwa sistem akuaponik dengan menggunakan bayam (Spinacea oleracea), terbukti lebih baik dalam mempertahankan nilai TAN lebih rendah dibandingkan sistem tanpa penambahan tanaman.
Amonia dalam bentuk tidak terionisasi (NH3) cenderung bersifat toksik bagi
sebagian besar organisme perairan. Rata-rata NH3pada P3 diketahui memiliki nilai
lebih rendah dari P1 dan P2 (Tabel 3). Hasil tersebut diduga terkait dengan perubahan suhu, pH, dan kelimpahan bakteri pada sistem. Pada P3 kelimpahan bakteri lebih tinggi menyebabkan laju respirasi dan oksidasi meningkat dan menyebabkan nilai pH menurun. Menurut Eshchar et al. (2006), proses respirasi dan dekomposisi menghasilkan sejumlah besar CO2,yang kemudian disusul dengan
penurunan pH, sehingga menyebabkan penurunan fraksi NH3. Losordoet al. (1998)
melaporkan bahwa pada pH 7,0 sebagian besar TAN berada dalam bentuk NH4+,
sementara pada pH 8,75 hingga 30 % TAN berada dalam bentuk NH3. Hargreaves
(1998) menambahkan bahwa peningkatan pH dan suhu akan diikuti dengan meningkatnya gas NH3. Diperkirakan pada pH 9,3 sekitar 50% dari TAN berbentuk
NH3, pada pH 8,3 bentuk NH3sekitar 10% dan pada pH 7,3 hanya sekitar 1%.
Pada kolam budidaya, konsentrasi NH3 berfluktuasi setiap harinya karena
pengaruh dari proses fotosintesis, respirasi, dan oksidasi yang kemudian mempengaruhi nilai pH. Pada saat pagi hari, pH berada dalam kisaran rendah dan sebagian besar TAN berada dalam bentuk amonium. Kemudian saat sore hari, ketika pH berada dalam kisaran maksimum, kesetimbangan TAN bergeser menjadi bentuk NH3. Oleh karena itu saat sore hari ikan akan mengalami tekanan
lingkungan akibat peningkatan NH3 sementara waktu (Hargreaves dan Kucuk
2001). Konsentrasi NH3 juga dapat berubah-ubah mengikuti perubahan suhu,
dimana ketika musim panas, suhu lingkungan yang tinggi menyebabkan proses nitrifikasi meningkat dan diikuti dengan penurunan NH3. Pada musim hujan, suhu
Secara deskriptif nilai NH3 pada penelitian ini lebih rendah dari hasil
penelitian Kamal (2006), pada pemeliharaan ikan nila dalam sistem akuaponik yang mencapai 0,75±0,03 mg/L, 0,31±0,03 mg/L, dan 0,41±0,03 mg/L untuk perlakuan tanpa tanaman (T3), perlakuan 15 tanaman bayam per m2(T2), dan perlakuan 10 tanaman bayam per m2(T1) berturut-turut. Konsentrasi NH3 pada penelitian ini
telah melebihi batas yang disarankan oleh El-Shafaiet al. (2004), yaitu konsentrasi NH3harus dipertahankan di bawah 0,1 mg/L. NH3bersifat toksik karena bentuk ini
memiliki sifat mudah larut dalam lemak dan tidak memiliki ion, sehingga dengan bebas dapat berdifusi melewati membran. Menurut Svobodova et al. (1993), molekul NH3dapat dengan mudah berdifusi melintasi jaringan penghalang. Dalam
kondisi normal asam-basa berada dalam keseimbangan antara air dan jaringan, jika keseimbangan bergeser maka sisi yang memiliki pH rendah akan menarik molekul NH3. Mekanisme ini yang menjelaskan bagaimana molekul NH3 masuk dari air
melalui epitel insang ke dalam darah, dan dari darah ke jaringan. Efek toksik NH3
terutama diperlihatkan pada gangguan syaraf. Toksisitas NH3 pada LC50 96 jam
adalah 2,88 mg/L (Daudet al. 1988dalamRidha dan Cruz 2001).
Amonia dalam bentuk terionisasi (NH4+) relatif tidak berbahaya dan
dibutuhkan oleh tanaman untuk dimanfaatkan secara langsung. Amonium yang terukur dihitung dari pengurangan antara TAN dengan NH3. Amonium pada setiap
perlakuan memiliki pola perubahan yang sama dengan TAN, dan secara deskriptif diketahui bahwa P3 memiliki rata-rata amonium lebih rendah dari P1 dan P2 (Gambar 7; Tabel 3). Keberadaan amonium selain dipengaruhi oleh suhu, pH, dan konsentrasi TAN, juga dipengaruhi oleh tingkat penyerapan tanaman. Amonium pada P2 dan P3 dimanfaatkan sebagai nutrien oleh selada romain, sementara akar tanaman menjadi ruang tambahan bagi bakteri yang berperan dalam proses penguraian bahan organik dan anorganik. Menurut Endut et al. (2011), tanaman pada sistem akuaponik memanfaatkan amonium yang menjadi sumber utama nutrien anorganik melalui akar tanaman. Amonium juga diasimilasi oleh bakteri untuk diubah kembali menjadi materi organik atau dihilangkan melalui proses nitrifikasi. Secara deskriptif nilai amonium pada P1 diketahui lebih tinggi dari P2 dan P3. Hal ini diduga berkaitan karena pada perlakuan ini tidak dilakukan penambahan bakteri dan tanaman, menyebabkan proses penguraian dan pemanfaatan nutrien tidak berjalan optimal.
penelitian ini masih di atas 5 mg/L, sehingga masih optimal untuk pertumbuhan
Nitrobacter, dan tidak memberikan kesempatan terjadinya akumulasi nitrit karena segera teroksidasi menjadi nitrat.
Secara deskriptif rata-rata nitrit pada penelitian ini lebih rendah jika dibandingkan dengan rata-rata nitrit pada penelitian Ridha dan Cruz (2001), yaitu 0,59 mg/L dan 0,72 mg/L untuk media filter plastik polipropilen chip dan polietilen blok berturut-turut. Akumulasi nitrit dapat menjadi masalah bagi ikan, karena konsentrasi nitrit yang tinggi bersifat toksik akibat ikan secara aktif dapat menyerap nitrit dari lingkungan perairan, dan terakumulasi dalam tubuh dengan konsentrasi tinggi. Nitrit memiliki afinitas dengan sel-sel klorida insang, dan melalui sel inilah nitrit terserap kemudian berdifusi ke dalam plasma darah. Nitrit dari plasma darah akan berdifusi ke sel darah merah, kemudian mengoksidasi zat besi dalam hemoglobin dan membentuk methaemoglobin. Kondisi ini dapat mengurangi kapasitas darah untuk mengikat oksigen, menyebabkan hipoksia, dan kematian (Svobodova et al. 1993; Kroupova et al. 2005; Svobodova et al. 2005; Qinet al. 2005). Tingkat toksisitas nitrit untuk ikan nila adalah 5 mg/L, dan dalam kebanyakan kasus harus tetap di bawah 1 mg/L (Rakocy 1989; Losordoet al. 1998). Nitrit selanjutnya akan dioksidasi oleh bakteri Nitrobacter menghasilkan nitrat. Nitrat menjadi produk akhir dari siklus nitrogen, dan relatif tidak berbahaya bagi ikan, serta dibutuhkan oleh tanaman dan fitoplankton. Berdasarkan Gambar 9 diketahui bahwa P1, P2, dan P3 cenderung memiliki pola perubahan yang sama, dengan rata-rata nitrat tertinggi pada P1 (Tabel 3). Hasil tersebut menunjukkan bahwa perubahan nitrat erat kaitannya dengan tingkat penyerapan nitrat oleh selada romain. Pada P2 dan P3 penambahan selada romain menyebabkan laju penurunan nitrat lebih tinggi melalui penyerapan akar, sedangkan P1 tidak dilakukan penambahan tanaman menyebabkan nitrat tidak dapat dimanfaatkan secara optimal. Lebih jelasnya penurunan nitrat pada sistem akuaponik selain berkaitan dengan penyerapan nitrat oleh selada romain, juga adanya asosiasi biofilm dengan akar selada romain. Menurut Tyson et al. (2011), tanaman pada sistem akuaponik memberikan peran biofiltrasi dengan memanfaatkan nutrien yang berasal dari limbah budidaya. Selanjutnya menurut Vaillantet al. (2004), nitrat menjadi nutrien terlarut yang banyak diserap oleh akar tanaman. Akar tanaman juga menjadi media tambahan bakteri nitrifikasi, yang membantu mereduksi amonia dan menyediakan nitrat yang dibutuhkan tanaman.
Secara deskriptif rata-rata nitrat pada percobaan ini lebih rendah dari hasil penelitian Snowet al. (2008), yakni 7,92 mg/L, 10,42 mg/L, 5,89 mg/L, dan 10,76 mg/L untuk kontrol, perlakuan wheat, barley, dan oats. Konsentrasi nitrat yang direkomendasikan untuk kegiatan budidaya ikan tidak melebihi 100 mg/L, karena konsentrasi nitrat yang tinggi akan menyebabkanblooming alga, dan dari waktu ke waktu dapat menurunkan pH (Watson dan Hill 2006). Toksisitas nitrat untuk ikan yaitu >1000 mg/L pada LC50 96 jam, dan diduga berhubungan dengan masalah osmoregulasi (Colt 2006). Hasil penelitian Pedersen et al. (2013) menunjukkan bahwa akumulasi nitrat sekitar 200 mg/L tidak mempengaruhi kelangsungan hidup, aktivitas dan rasio konversi pakan ikan.
masih di atas 5 mg/L untuk semua perlakuan, sehingga masih optimal untuk kelangsungan hidup ikan nila (Villarroel et al. 2011), dan proses nitrifikasi. Menurut Losordoet al. (1998), konsentrasi oksigen terlarut dalam sistem sirkulasi harus dipertahankan di atas 5 mg/L untuk pertumbuhan optimal ikan dan penghapusan maksimal amonia dan nitrit. Penelitian lain menunjukkan bahwa bakteri nitrifikasi menjadi tidak efisien dalam proses nitrifikasi ketika konsentrasi oksigen terlarut di bawah 2 mg/L (Hargreaves 2006). Oksigen terlarut sangat berhubungan dan menjadi kebutuhan utama untuk proses nitrifikasi. Secara teoritis kebutuhan oksigen untuk oksidasi 1 mg NH3melalui proses nitrifikasi adalah 3,43
mg O2, dan 1,14 mg untuk oksidasi 1 mg NO2. Oksigen juga mempengaruhi
pertumbuhan bakteri nitrifikasi, karena Nitrosomonas dapat tumbuh dengan konsentrasi oksigen terlarut di atas 1 mg/L, sedangkanNitrobacterdi atas 2 mg/L (Chenet al. 2006).
Selain oksigen terlarut, alkalinitas total juga berkaitan dengan proses biofiltrasi nutrien anorganik dalam sistem, karena berpengaruh terhadap perubahan pH dan proses nitrifikasi. Alkalinitas berperan dalam menjaga kestabilan pH, dan menjadi ukuran kapasitas air untuk menetralkan keasaman (ion hidrogen). Rata-rata alkalinitas terendah pada P3 diduga berkaitan dengan kelimpahan bakteri lebih tinggi dari P1 dan P2, sehingga menyebabkan laju oksidasi lebih tinggi. Selama proses oksidasi amonia, bakteri membutuhkan alkalinitas sebagai sumber karbon dan menghasilkan asam, sehingga menurunkan nilai pH. Menurut Chen et al. (2006), alkalinitas dalam bentuk karbonat dan bikarbonat adalah elemen nutrisi untuk bakteri nitrifikasi dan menjadi kapasitas penyangga untuk mencegah perubahan pH akibat produksi asam selama proses nitrifikasi. Ebelinget al. (2006) melaporkan untuk mengkonversi setiap gram amonia menjadi nitrat, bakteri autotrof membutuhkan 4,18 g O2, 7,05 g alkalinitas dan menghasilkan 0,20 g
biomassa bakteri, sedangkan bakteri heterotrof membutuhkan 4,71 gO2, 3,57 g alkalinitas dan menghasilkan 8,07 g biomassa bakteri.
Losordo et al. (1998) melaporkan bahwa nilai alkalinitas total harus dipertahankan pada 50-100 mg/L CaCO3. Hal tersebut menunjukkan bahwa
rata-rata alkalinitas pada penelitian ini masih di bawah nilai yang disarankan tersebut. Hasil penelitian Summerfelt et al. (2015) pada sistem resirkulasi menggunakan alkalinitas 10 mg/L CaCO3, 70 mg/L CaCO3, dan 200 mg/L CaCO3,menunjukkan
bahwa pada alkalinitas 10 mg/L CaCO3nilai TAN lebih stabil dengan laju nitrifikasi
lebih tinggi. Namun pada hasil penelitian ini menunjukkan bahwa pada nilai alkalinitas terendah, menyebabkan perubahan pH yang sangat cepat (relatif asam). Hal ini yang kemudian menjadi dasar Summerfelt et al. (2015) untuk mempertahankan alkalinitas pada kisaran 70 mg/L agar menjaga stabilitas pH dan TAN.
Fluktuasi pembentukan maupun pengambilan nutrien anorganik (TAN, NO3
-, dan NO2-) selain dipengaruhi oleh faktor fisika dan kimia, juga ditentukan oleh
dioksidasi menjadi nitrit oleh bakteri nitrifikasi AOB, kemudian nitrit menjadi nitrat oleh bakteri nitrifikasi NOB. Pada penelitian ini kelimpahan bakteri yang terukur merupakan kelimpahan bakteri total.
Secara umum kelimpahan bakteri yang diperoleh cenderung berfluktuasi pada P1 dan P2, sedangkan kelimpahan bakteri pada P3 meningkat dari waktu ke waktu (Gambar 10). Adanya penambahan bakteri komersial pada P3 menyebabkan kelimpahan bakteri pada perlakuan ini terus mengalami peningkatan, sedangkan fluktuasi kelimpahan bakteri pada P1 dan P2 diduga berkaitan dengan konsentrasi amonia yang cenderung mengalami fluktuasi dengan pola yang sama. Hasil tersebut menunjukkan bahwa nutrien yang rendah dapat menjadi faktor pembatas pertumbuhan bakteri dalam sistem. Pada kondisi normal nutrien yang berasal dari sisa pakan dan organisme mati akan didekomposisi oleh bakteri amonifikasi menjadi amonia. Selanjutnya amonia digunakan bakteri nitrifikasi sebagai sumber energi pada proses nitrifikasi. Bakteri heterotrof juga secara langsung mengkonversi amonia menjadi biomassa bakteri. Jumlah nutrien yang terbatas kemudian akan menyebabkan pertumbuhan bakteri menurun. Menurut Liu dan Han (2004) dinamika populasi bakteri dibatasi oleh ketersediaan nutrien dalam sistem. Selanjutnya Ebeling et al. (2006) menambahkan bahwa faktor utama yang mempengaruhi pertumbuhan bakteri autotrof dan heterotrof adalah amonia, oksigen terlarut, pH dan alkalinitas.
Kelimpahan bakteri pada penelitian ini jauh lebih rendah jika dibandingkan dengan hasil penelitian Hu et al. (2015) yang mencapai 108 – 1012CFU/mL pada sistem akuaponik, menggunakan tanaman tomat (Lycopersicon esculentum) dan pak choi (Brassica campestrisL.subsp. chinensis). Rendahnya jumlah bakteri pada penelitian ini salah satunya karena pembuangan kotoran ikan selama penelitian. Sisa pakan dan buangan metabolisme ikan yang mengendap di dasar akuarium merupakan bahan organik yang dibutuhkan bakteri heterotrof pada proses dekomposisi untuk kemudian dihasilkan amonia. Degradasi bahan organik ini akan menghambat laju nitrifikasi, sehingga mengganggu pertumbuhan bakteri, menghambat oksidasi amonia, dan menyebabkan akumulasi TAN (Chen et al. 2005).
Adanya aktivitas oksidasi dan reduksi yang dilakukan bakteri serta pengaruh faktor fisika kimia perairan, menyebabkan penurunan maupun penambahan N dalam sistem. Penghilangan atau penambahan nutrien dalam sistem dapat dihitung dengan membandingkan antara nutrien pada P2 dan P3 dengan nutrien pada P1. Tabel 4 menunjukkan bahwa senyawa N dalam bentuk amonia (NH3), amonium
(NH4+), nitrit (NO2-), dan nitrat (NO3-) mengalami fluktuasi. Penurunan nutrien
tertinggi cenderung terjadi di akhir pengamatan (hari ke-35), dan secara deksriptif diketahui bahwa P3 memiliki penurunan terbaik untuk amonia, amonium, dan nitrit, sedangkan penurunan nitrat tertinggi pada P2. Hasil tersebut diduga terkait dengan kelimpahan bakteri pada P3 yang lebih tinggi dari P2. Kelimpahan bakteri yang tinggi pada P3 diduga menunjukkan adanya aktivitas pemanfaatan nutrien yang lebih optimal dari P2.
Persentase penghilangan amonia (NH3) pada percobaan ini cenderung lebih
cepat daripada NOB ketika suhu di atas 25 °C. Rata-rata suhu pada penelitian ini adalah 29 oC, menyebabkan tingkat pertumbuhan AOB jauh lebih cepat dibandingkan NOB. Hal ini diduga menyebabkan laju oksidasi amonia menjadi lebih besar dari nitrit.
Persentase penghilangan NH3 juga diamati lebih tinggi dari nitrat. Hasil
penelitian Lennard dan Leonard (2006) menunjukkan bahwa tingkat penurunan nitrat dengan sistem nutrient film technique(NFT) kurang dari 20%. Faktor yang dapat menjelaskan hasil ini adalah pada sistem NFT bidang kontak akar dengan air kurang dari 50%, lebih rendah dari sistem terapung yang bagian akarnya terendam 100% air, sehingga lebih banyak memberikan kesempatan untuk mengasimilasi nitrat pada sistem. Rasio antara tanaman dan kepadatan ikan juga mempengaruhi jumlah masukan limbah dan kemampuan tanaman dalam menurunkan nutrien. Penurunan nutrien juga dapat dipengaruhi faktor lain seperti intensitas cahaya, suhu udara dan suhu zona akar (Buzby dan Lin 2014). Selanjutnya persentase penghilangan amonium diketahui lebih besar dari nitrat. Amonium selain dibutuhkan oleh tanaman juga dimanfaatkan oleh bakteri. Menurut Olsson dan Grerup (2000), bakteri cenderung lebih banyak mengasimilasi amonium dibandingkan nitrat. Adanya selada romain dan jumlah bakteri yang lebih tinggi pada P3 diduga menyebabkan tingkat pemanfaatan amonium lebih besar dibandingkan nitrat.
Persentase penghilangan nutrien pada penelitian ini lebih baik dari hasil penelitian Effendiet al. (2015) pada sistem akuaponik menggunakan selada yaitu, 90,1 % dan 23,3 % untuk ammonia dan nitrat berturut-turut. Akan tetapi persentase penurunan nutrien pada penelitian ini lebih rendah dari hasil penelitian Endutet al, (2011), yang menunjukkan efisiensi penurunan nutrien yakni 78,32–85,48%, 82,93–92,22%, dan 79,17–87,10% untuk TAN, nitrit, dan nitrat berturut-turut.
Analisis kandungan nutrien (amonia, nitrit, dan nitrat) dan kualitas air lainnya pada sistem akuaponik menjadi penting, karena secara langsung maupun tidak langsung berpengaruh terhadap ikan yang dipelihara. Penilaian efektivitas sistem akuaponik salah satunya dapat dilihat dari performa ikan yang dipelihara. Performa ikan dapat dilihat berdasarkan pertumbuhan, tingkat kelangsungan hidup, dan rasio konversi pakan selama periode pemeliharaan.
Pertumbuhan ikan nila secara deskriptif diketahui bahwa P3 memiliki pertumbuhan spesifik dan harian lebih cepat dari P1 dan P2. Hasil tersebut diduga berkaitan dengan rata-rata amonia yang lebih rendah pada P3, sehingga menyebabkan pertumbuhan ikan nila lebih optimal dari P1 dan P2. Hasil tersebut juga menunjukkan bahwa amonia pada sistem dapat menghambat pertumbuhan ikan, akibat gangguan terhadap proses metabolisme tubuh. Hargreaves dan Kucuk (2001) melaporkan bahwa akumulasi amonia menyebabkan pertumbuhan ikan menurun. Hal ini terjadi karena paparan amonia menyebabkan penurunan nafsu makan ikan dan mengurangi tingkat kecernaan pakan yang dikonsumsi. Mekanisme lain yang dapat menjelaskan penurunan pertumbuhan akibat paparan amonia adalah deplesi glikogen hati dan akibat asidosis darah. Hal ini berkontribusi dalam peningkatan kerentanan terhadap hipoksia, efek histopatologi terutama yang mempengaruhi insang dan fungsi hati.
tingkat konversi pakan yang tinggi akibat sebagian energi digunakan untuk proses ekskresi amonia. Hargreaves dan Kucuk (2001) melaporkan bahwa paparan amonia menyebabkan konversi pakan menjadi lebih besar, akibat daya cerna protein makanan dan sumber energi terganggu. Reaksi biokimia deviasi energi dari lemak, karbohidrat, dan khususnya protein terganggu oleh kehadiran amonia. Hal ini karena saat penghilangan amonia dalam tubuh dibutuhkan energi, dan dapat menurunkan 68% produksi energi pada kondisi normal. Secara kumulatif kemudian efek amonia terhadap pemanfaatan energi dapat menekan pertumbuhan ikan. Hasil penelitian El-Shafai et al. (2004) menunjukkan bahwa peningkatan konsentrasi amonia tidak terionisasi (NH3) melebihi 0,068 mg/L menyebabkan penurunan rasio
efisiensi protein, dan efek negatif amonia pada performa pertumbuhan ikan nila meningkat seiring meningkatnya waktu pemaparan.
Rata-rata nilai FCR pada penelitian ini sebanding dengan nilai FCR ikan nila yang dilaporkan oleh Sace dan Fitzsimmons (2013), yakni 1,69 pada sistem akuaponik dengan kombinasi udang, dan 1,72 untuk sistem akuaponik tanpa udang. Hasil ini juga lebih baik jika dibandingkan dengan penelitian yang dilakukan oleh Kamal (2006), dengan nilai FCR ikan nila yakni 1,81 dan 1,86 pada sistem dengan penambahan tanaman paprika (Capsicum annuumL. Godeon), dan 2,2 pada sistem tanpa penambahan tanaman.
Pemaparan amonia dalam waktu lama kemudian akan berdampak pada kematian ikan. Kematian ikan yang terjadi pada penelitian ini diduga diakibatkan paparan amonia selama periode pemeliharaan. Pada paparan singkat, amonia pada penelitian ini hanya akan berdampak pada pertumbuhan, tetapi amonia dapat menyebabkan efek letal pada ikan ketika terpapar dalam waktu lama. Menurut Colt (2006), toksisitas amonia umumnya diasumsikan karena molekul amonia (NH3)
memiliki kemampuan untuk berdifusi pada membran sel. Selanjutnya Hargreaves dan Kucuk (2001) menambahkan bahwa biasanya NH3diekskresikan melalui difusi
pasif di epitel insang dari darah ke air, yang bertujuan untuk menanggapi gradien tekanan parsial gas NH3. NH3 selanjutnya diekskresikan melalui lapisan batas
epitel. Jika tekanan parsial NH3dalam lapisan batas epitel lebih besar dari yang di
dalam darah, ekskresi NH3terhambat dan NH3akan berifusi dari air ke dalam darah.
Selanjutnya tingkat kelangsungan hidup pada P3 secara nyata lebih tinggi dari P1 dan P2. El-Shafaiet al. (2004) melaporkan bahwa konsentrasi amonia pada sistem budidaya harus dipertahankan <0,1 mg/L.