UIN SYARIF HIDAYATULLAH JAKARTA
Modifikasi Struktur Senyawa Etil p-metoksisinamat yang
Diisolasi dari Kencur (
Kaempferia galanga
Linn.) Melalui
Transformasi Gugus Fungsi Serta Uji Aktivitas Sebagai
Antiinflamasi
SKRIPSI
SYARIFATUL MUFIDAH
NIM : 1110102000056
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
UIN SYARIF HIDAYATULLAH JAKARTA
Modifikasi Struktur Senyawa Etil p-metoksisinamat yang
Diisolasi dari Kencur (
Kaempferia galanga
Linn.) Melalui
Transformasi Gugus Fungsi Serta Uji Aktivitas Sebagai
Antiinflamasi
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi
SYARIFATUL MUFIDAH
NIM : 1110102000056
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
iii
HALAMAN PERNYATAAN ORISINALITAS
Skripsi ini adalah hasil karya saya sendiri,
dan semua sumber baik yang dikutip maupun dirujuk
telah saya nyatakan dengan benar
Nama : Syarifatul Mufidah
NIM : 1110102000056
Tanda Tangan :
HALAMAN PERSETUJUAN PEMBIMBING
Nama : Syarifatul Mufidah
NIM : 1110102000056
Program Studi : Strata-1 Farmasi
Judul Skripsi : Modifikasi Struktur Senyawa Etil p-metoksisinamat yang Diisolasi dari Kencur (Kaempferia galanga Linn.) Melalui Transformasi Gugus Fungsi Serta Uji Aktivitas Sebagai Antiinflamasi
Pembimbing I
Ismiarni Komala, Ph.D., M.Sc., Apt. NIP. 197806302006042001
Pembimbing II
Ofa Suzanti Betha, M.Si., Apt. NIP. 19750104200912201
Mengetahui,
Ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan
UIN Syarif Hidayatullah Jakarta
v
HALAMAN PENGESAHAN SKRIPSI
Skripsi ini diajukan oleh :
Nama : Syarifatul Mufidah
NIM : 1110102000056
Program Studi : Strata-1 Farmasi
Judul Skripsi : Modifikasi Struktur Senyawa Etil p-metoksisinamat yang Diisolasi dari Kencur (Kaempferia galanga Linn.) Melalui Transformasi Gugus Fungsi Serta Uji Aktivitas Sebagai Antiinflamasi
Telah berhasil dipertahankan di hadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Sarjana Farmasi pada Program Studi Farmasi, Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
DEWAN PENGUJI
Pembimbing I : Ismiarni Komala, Ph.D., M.Sc., Apt. ( )
Pembimbing II : Ofa Suzanti Betha, M.Si., Apt. ( )
Penguji I : Supandi, M.Si., Apt. ( )
Penguji II : Eka Putri, M.Si., Apt. ( )
ABSTRAK
Nama : Syarifatul Mufidah Program Studi : Farmasi
Judul Skripsi : Modifikasi Struktur Senyawa Etil p-metoksisinamat yang Diisolasi dari Kencur (Kaempferia galanga Linn.) Melalui Transformasi Gugus Fungsi Serta Uji Aktivitas Sebagai Antiinflamasi
Telah dilakukan isolasi senyawa etil p-metoksisinamat (EPMS) dari kencur (Kaempferia galanga Linn.) melalui maserasi menggunakan n-heksan menghasilkan rendemen sebesar 2,65%. Senyawa EPMS diuji dengan metode inhibisi denaturasi Bovine Serum Albumine (BSA) dengan nilai IC50 sebesar
34,9 ppm. Transformasi pada gugus fungsi EPMS dilakukan untuk mengeksplorasi hubungan struktur aktivitas EPMS terhadap antiinflamasi, pertama melalui reaksi hidrolisis dengan katalis basa menghasilkan asam p-metoksisinamat dengan rendemen 82,3%. Kedua melalui reaksi transesterifikasi dengan metanol menghasilkan metil p-metoksisinamat dengan rendemen 53,6%. Ketiga melalui reaksi degradasi sinamat dengan asam nitrat menghasilkan 4-metoksibenzoat dengan rendemen 20,16%. Pengujian aktivitas antiinflamasi dilakukan menggunakan metode inhibisi denaturasi BSA didapatkan bahwa aktivitas etil metoksisinamat > metil metoksisinamat > 4-metoksibenzoat (hasil uji negatif) > asam p-metoksisinamat (hasil uji negatif). Hal ini menunjukkan bahwa gugus ester pada etil p-metoksisinamat memiliki peranan penting dalam aktivitas antiinflamasi.
ABSTRACT
Name : Syarifatul Mufidah Major : Pharmacy
Title : Structure Modification Ethyl p-methoxycinnamate Compounds Isolated from Kencur (Kaempferia galanga
Linn.) Through Functional Groups Transformation and Antiinflammatory Assay to the Result of Modification Compound
Isolation of Ethyl p-methoxycinnamate (EPMS) from kencur (Kaempferia galanga Linn.) had been done by maseration using n-hexane with 2,56% yield. Antiinflammatory activity of EPMS was analyzed by using inhibition of bovine serum albumine (BSA) denaturation method gave the IC50 34,9
ppm. In exploring the structure activity relationship of EPMS against the anti-inflammatory had been done by functional group transformation through hydrolysis, transesterification and degradation of cinnamic with nitric acid. Base catalyzed hydrolysis produces p-methoxycinnamate acid in 82,3% yield. Transesterification using methanol produces methyl p-methoxycinnamate in 53.6% yield and cinnamic degradation with nitric acid produces 4-methoxybenzoate in 20.16% yield. Antiinflammatory activity assays performed by using inhibition of bovine serum albumine (BSA) denaturation method. It was found that the activity of EPMS > methyl methoxycinnamate > 4-methoxybenzoate (negative test result) > p-methoxycinnamate acid (negative test result). This suggests that the ethyl ester group on the EPMS have an important role in anti-inflammatory activity.
KATA PENGANTAR
Segala puji dan syukur kehadirat Allah SWT yang senantiasa mencurahkan segala rahmat-Nya kepada kita semua, khususnya penulis dalam
menyelesaikan skripsi yang berjudul “Modifikasi Struktur Senyawa Etil
p-metoksisinamat yang Diisolasi dari Kencur (Kaempferia galanga Linn.) Melalui Transformasi Gugus Fungsi Serta Uji Aktivitas Sebagai Antiinflamasi”. Shalawat dan salam senantiasa terlimpah kepada junjungan kita Nabi Muhammad SAW, teladan bagi umat manusia dalam menjalani kehidupan.
Skripsi ini disusun untuk memenuhi salah satu syarat menempuh ujian akhir guna mendapatkan gelar Sarjana Farmasi pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah jakarta. Selesainya penelitian dan penyusunan skripsi ini tidak lepas dari bantuan berbagai pihak, maka dalam kesempatan ini perkenankanlah penulis menyampaikan ucapan terimakasih yang tulus dan sebesar-besarnya, khususnya kepada :
1. Bapak Prof. Dr. (hc). Dr. MK.Tadjudin, Sp.And selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
2. Ibu Ismiarni Komala, M.Sc., Ph.D., Apt. sebagai Pembimbing I dan Ibu Ofa Suzanti Betha, M.Si., Apt. sebagai Pembimbing II yang telah memberikan ilmu, nasehat, waktu, tenaga, dan pikiran selama penelitian dan penulisan skripsi.
3. Bapak Drs.Umar Mansur, M.Sc.,Apt selaku Ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
4. Ibu Lina Elfita, M.Si., Apt. selaku pembimbing akademik yang telah memberikan arahan selama masa perkuliahan.
6. Bapak dan Ibu staf pengajar, serta karyawan yang telah memberikan bimbingan dan bantuan selama menempuh pendidikan di Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
7. Kakak A. Ubaidillah Nur dan Roudhotul Jannah yang selalu memberikan arahan dan semangat. Kedua adik tercinta, A. Amirul Fuad dan Zuhria Azhari, yang selalu memberikan semangat ketika melihat keduanya.
8. Teman-teman Andalusia yang telah menjadi kepingan memori yang berharga di Ibu kota. Tanpa mereka, cerita ini tidak akan lengkap.
9. Mba rani, Kak lisna, Kak tiwi, Kak Rahmadi, Kak Liken dan Kak eris yang sangat banyak membantu penulis melakukan penelitian di laboratorium. 10. Teman-teman seperjuangan BSA : Finti dan Ninik yang spesial dengan
semangat juang tinggi dan juga Mirza dan Hadi. Terimakasih atas segala bantuannya.
11. Teman-teman ‘ngocol’ berdelapan, mayta, salma, rifa, metha, yeyet, mala, vina, dan yuni serta seluruh pejuang kosan ‘bu selly’, terimakasih atas
dukungan dan semangatnya.
12. Dan kepada semua pihak yang telah membantu penulis selama ini yang tidak dapat disebutkan namanya satu persatu.
Semoga semua bantuan yang telah diberikan mendapatkan balasan dari Allah SWT. Penulis menyadari bahwa penulisan skripsi ini masih jauh dari kesempurnaan, ibarat tak ada gading yang tak retak. Oleh karena itu, saran dan kritik yang bersifat membangun akan penulis nantikan. Dan semoga skripsi ini bisa bermanfaat bagi pengembangan ilmu pengetahuan.
Jakarta, 7 Juli 2014
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademika Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta, saya yang bertanda tangan di bawah ini:
Nama : Syarifatul Mufidah
NIM : 1110102000056
Program Studi : Strata-1 Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan Jenis Karya : Skripsi
demi pengembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah saya, dengan judul :
MODIFIKASI STRUKTUR SENYAWA ETIL P-METOKSISINAMAT
YANG DIISOLASI DARI KENCUR (Kaempferia Galanga Linn.) MELALUI
TRANSFORMASI GUGUS FUNGSI SERTA UJI AKTIVITAS SEBAGAI
ANTIINFLAMASI
untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta.
Demikian pernyataan publikasi karya ilmiah ini saya buat dengan sebenarnya.
Dibuat di : Jakarta Pada tanggal : 7 Juli 2014
Yang menyatakan,
xi HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI ... DAFTAR ISI ... 2.1.3 Kandungan Kimia Kaempferia galanga Linn ... 2.1.4 Manfaat Kaempferia galanga Linn ... 2.2. Isolasi Etil p-metoksisinamat ... 2.3. Senyawa Etil p-metoksisinamat ...
BAB III METODOLOGI PENELITIAN ... 3.1. Tempat dan Waktu Penelitian ...
3.1.1 Tempat Penelitian ... 3.1.2 Waktu Penelitian ... 3.2. Alat dan Bahan ... 3.2.1 Alat ... 3.2.2 Bahan ... 3.3. Prosedur Penelitian ... 3.3.1 Preparasi ... 3.3.2 Isolasi Etil p-metoksisinamat ... 3.3.3 Modifikasi Senyawa EPMS ... 3.3.4 Identifikasi Senyawa ... 3.3.5 Uji In vitro Antiinflamasi ... BAB IV HASIL DAN PEMBAHASAN ...
4.1. Hasil Isolasi Senyawa Etil p-Metoksisinamat ... 4.1.1 Hasil Determinasi ... 4.1.2 Pembuatan Serbuk Simplisia ... 4.1.3 Isolasi Etil p-metoksisinamat ... 4.1.4 Identifikasi Etil p-metoksisinamat ... 4.2. Modifikasi Struktur Etil p-metoksisinamat ... 4.2.1 Reaksi Hidrolisis ... 4.2.2 Reaksi Transesterifikasi ... 4.2.3 Degradasi Sinamat dengan Asam Nitrat ... 4.3. Identifikasi Senyawa Hasil Modifikasi ... 4.3.1 Senyawa A ... 4.3.2 Senyawa B ... 4.3.3 Senyawa C ... 4.4. Pengujian Aktivitas Antiinflamasi dan Hubungan
DAFTAR GAMBAR
DAFTAR TABEL
Tabel 4.1. Daftar Daerah Spektrum IR Isolat Kencur ... Tabel 4.2. Data pergeseran kimia (δ) spektrum 1H NMR senyawa etil p-metoksisinamat ... Tabel 4.3. Daftar Daerah Spektrum IR Senyawa A ... Tabel 4.4. Data pergeseran kimia (δ) spektrum 1H NMR dan senyawa A
( CD3OD, 500 MHz) ...
Tabel 4.5. Daftar Daerah Spektrum IR Senyawa B ... Tabel 4.6. Daftar Daerah Spektrum IR Senyawa C ... Tabel 4.7. Data pergeseran kimia (δ) spektrum 1H NMR dan senyawa C
(CD3OD, 500 MHz) ...
Tabel 4.8. Hasil Uji Antiinflamasi ... 27
30 37
39 40 42
DAFTAR LAMPIRAN
Lampiran 1 : Kerangka Penelitian ... Lampiran 2 : Isolasi Etil p-metoksisinamat ... Lampiran 3 : Determinasi Tanaman Kencur ... Lampiran 4 : Sertifikat Analisa Natrium Diklofenak ... Lampiran 5 : Hasil Analisa DSC Etil p-metoksisinamat ... Lampiran 6 : Spektrum IR Etil p-metoksisinamat ... Lampiran 7 : Spektrum GCMS Etil p-metoksisinamat ... Lampiran 8 : Spektrum 1H NMR Etil p -metoksisinamat ... Lampiran 9 : Hasil Analisa DSC Senyawa A... Lampiran 10 : Spektrum IR Senyawa A... Lampiran 11 : Spektrum GCMS Senyawa A ... Lampiran 12 : Spektrum 1H NMR Senyawa A ... Lampiran 13 : Hasil Analisa DSC Senyawa B ... Lampiran 14 : Spektrum IR Senyawa B ... Lampiran 15 : Spektrum GCMS Senyawa B ... Lampiran 16 : Spektrum IR Senyawa C ... Lampiran 17 : Spektrum GCMS Senyawa C ... Lampiran 18 : Spektrum 1H NMR Senyawa C ... Lampiran 19 : Perhitungan Reaksi ... Lampiran 20 : Hasil Perhitungan Uji Antiinflamasi ... Lampiran 21 : Kurva Uji Antiinflamasi ... Lampiran 22 : Tabel Hasil Uji Antiinflamasi Triplo Senyawa .. Lampiran 23 : Gambar Isolasi Etil p-metoksisinamat ... Lampiran 25 : Gambar Senyawa ... Lampiran 26 : Gambar Identifikasi Senyawa ...
DAFTAR ISTILAH
g gram
IR Infra Red
KLT Kromatografi Lapis Tipis NMR Nuclear Magnetic Resonance
UV Ultra Violet
MIC Minimum Inhibitor Concentration COX Siklooksigenase
DSC Differential Scanning Calorimeter
BSA Bovine Serum Albumin
IC Inhibitor Concentration
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Indonesia dikenal sebagai negara dengan sumber daya hayati kedua terbesar yang tersebar dari Sabang hingga Merauke, oleh karena itu Indonesia memiliki potensi yang sangat besar dalam penyediaan bahan baku tumbuhan obat. Kekayaan alam tumbuhan obat Indonesia terdiri atas 30.000 jenis tumbuhan dari total 40.000 jenis tumbuhan di dunia, dimana 940 jenis diantaranya merupakan tumbuhan berkhasiat obat dan jumlah ini merupakan 90% dari jumlah tumbuhan obat di kawasan Asia (BPOM RI, 2009 ; Nugroho, 2010).
Diantara salah satu potensi alam Indonesia yang bisa digunakan sebagai obat adalah kencur (Kaempferia galanga L.). Kencur termasuk dalam famili Zingiberaceae dan merupakan tanaman asli India yang penyebarannya sudah memasuki kawasan Asia Tenggara termasuk
Indonesia dan Cina. Rimpang kencur secara empiris telah dimanfaatkan dalam mengobati berbagai penyakit seperti radang lambung, radang anak telinga, influenza pada bayi, masuk angin, sakit kepala, batuk,
memperlancar haid, mata pegal, keseleo, diare, menghilangkan darah kotor dan mengusir lelah (Al-Fattah, 2011).
Beberapa penelitian yang telah dilakukan mengenai aktivitas ekstrak etanol kencur antara lain sebagai penyembuh luka (Tara, 2006), dan sebagai analgesik dan antiinflamasi (Vittalrao, 2011). Ekstrak minyak atsiri sebagai antibakteri dan antifungi (Tewtrakul et al., 2005), dan ekstrak air dari kencur memiliki aktivitas sebagai antinosiseptif dan antiinflamasi (Sulaiman et al., 2008).
Dalam studi in vitro, etil p-metoksisinamat secara non-selektif menghambat aktivitas COX-1 dan COX-2, dengan masing-masing nilai IC50
1,12 µM dan 0,83 µM. Hasil ini memvalidasi aktivitas anti-inflamasi kencur yang dihasilkan oleh penghambatan COX-1 dan COX-2 (Umar et al, 2012).
Dari berbagai penelitian, epidemiologi, dan studi klinis menunjukkan bahwa AINS khususnya yang selektif terhadap COX-2 mempunyai prospek yang menjanjikan sebagai agen antikanker (Thun, 2002). Oleh karena itu, desain dan sintesis obat antiinflamasi khususnya golongan AINS banyak mengambil perhatian ahli kimia medisinal, khususnya pada dekade terakhir ini. Maka dilakukan banyak sekali modifikasi pada AINS seperti memberikan elaborasi konjugat gugus tertentu sesuai tujuan khusus (Qandil, 2012).
Senyawa etil p-metoksisinamat mudah diisolasi dan merupakan senyawa yang sangat potensial sebagai bahan dasar sintesa untuk turunan sinamat karena mempunyai gugus fungsi reaktif seperti olefin dan ester yang mudah ditransformasikan menjadi gugus fungsi yang lain (Surbakti,
2008). Pada hubungan struktur aktivitas AINS turunan asam arilasetat, dinyatakan bahwa pengurangan atau penambahan atom C dapat mempengaruhi aktivitas antiinflamasi (Siswandono, 2000). Berdasarkan hal
tersebut maka hubungan struktur aktivitas senyawa etil p-metoksisinamat sebagai agen antiinflamasi akan dieksplorasi lebih dalam dengan melihat transformasi gugus fungsi khususnya pada ester dan olefin dengan reaksi hidrolisis, transesterifikasi dan degradasi sinamat.
Modifikasi etil p-metoksisinamat dewasa ini mulai menjadi perhatian para ahli kimia medisinal. Diantaranya, sintesis oktil p-metoksisinamat sebagai sunblock melalui reaksi transesterifikasi (Suzana, 2011). Modifikasi Etil p-metoksisinamat sebagai agen kemopreventif pada fibrosarkoma tikus (Ekowati et al., 2012). Namun belum dilakukan penelitian modifikasi etil p-metoksisinamat terhadap aktivitas antiinflamasi sehingga ini menjadi menarik untuk dilakukan.
karena mudah, menggunakan sedikit sampel, waktu analisa yang cepat dan merupakan uji pendahuluan yang dilakukan sebagai skrining awal aktivitas antiinflamasi.
1.2. Rumusan Masalah
a. Apakah gugus fungsi pada senyawa etil p-metoksisinamat yang telah diisolasi dari kencur dapat ditransformasi melalui reaksi hidrolisis, transesterifikasi dan degradasi sinamat?
b. Bagaimana hubungan struktur senyawa hasil transformasi gugus fungsi etil p-metoksisinamat terhadap aktivitas antiinflamasi?
1.3. Tujuan Penelitian
a. Melakukan modifikasi struktur senyawa etil p-metoksisinamat yang telah diisolasi dari kencur melalui reaksi hidrolisis, transesterifikasi dan degradasi sinamat
b. Mengetahui hubungan struktur aktivitas antiinflamasi senyawa yang dihasilkan dari transformasi gugus fungsi etil p-metoksisinamat.
1.4. Manfaat Penelitian
a. Mendapatkan senyawa turunan etil p-metoksisinamat yang diharapkan dapat memberikan informasi baru mengenai hubungan struktur aktivitas senyawa etil p-metoksisinamat sebagai agen antiinflamasi
b. Hasil dari penelitian ini diharapkan bisa memberikan informasi untuk proses modifikasi struktur dan uji aktivitas dari senyawa etil p-metoksisinamat lebih lanjut.
1.5. Hipotesis
a. Hidrolisis etil p-metoksisinamat akan merubah gugus ester menjadi karboksilat, transesterifikasi akan merubah jumlah atom C
BAB 2
TINJAUAN PUSTAKA
2.1Tumbuhan Kencur
Kencur (Kaempferia galanga Linn.) sudah sejak lama dikenal dan ditanam di Indonesia. Tanaman ini diperkirakan berasal dari daerah Asia Tropika. Sebagian kalangan menduga bahwa asal usul kencur adalah dari kawasan Indo-Malaysia. Tetapi sumber literatur lainnya memastikan bahwa asal tanaman kencur adalah dari India. Daerah penyebaran kencur meluas ke kawasan Asia Tenggara dan Cina. Dalam perkembangan selanjutnya, diketahui bahwa keluarga Zingiberaceae ini merupakan salah satu jenis temu-temuan yang dipakai dalam obat tradisional (Rukmana, 1994).
2.1.1 Klasifikasi (USDA)
Kingdom : Plantae
Subkingdom : Traecheobionta Super Divisi : Spermatophyta
Divisi : Magnoliophyta
Spesies : Kaempferia galanga Linn.
2.1.2 Tempat Tumbuh (Roemantyo, 1996)
Peta distribusi tipe tanah di Jawa menunjukkan bahwa kencur dapat tumbuh baik di berbagai tipe tanah, yaitu: latosol, regosol, kombinasi antara latosol-andosol, latosol serta regosol-litosol. Selain itu, peta curah hujan di Jawa menunjukkan bahwa kencur dapat beradaptasi di daerah yang basah (9 bulan basah) maupun yang sedang (5-6 bulan basah dan 5-6 bulan kering) dan mencakup areal kira-kira 60% dari luas pulau Jawa, umumnya terletak di daerah dengan ketinggian antara 80 m - 600 m dpl. Kencur yang ditanam di kawasan pegunungan dengan ketinggian lebih dari 600 m dpl. mempunyai resiko pertumbuhan yang kurang baik.
2.1.3 Kandungan Kimia Kaempferia galanga Linn.
Kandungan kimia dalam ekstrak minyak atsiri kencur telah diteliti oleh Umar et al. (2012) diantaranya ialah asam propionat (4,71%), pentadekan (2,08%), asam tridekanoat (1,81%), 1,21-docosadiene
(1,47%), beta-sitosterol (9,88%), dan komponen terbesar adalah etil
p-metoksisinamat (80,05%). Selain itu pada penelitian Tewtrakul et al.
juga disebutkan bahwa terdapat kandungan α –pinen, kamphen, karvon, benzen , eukaliptol, borneol dan metil sinamat.
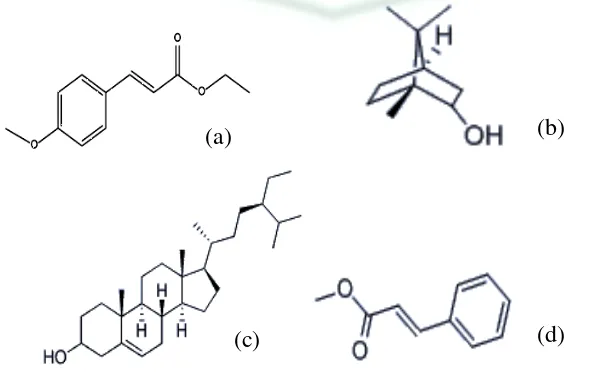
Gambar 2.1 Struktur Senyawa dari (a) etil p-metoksisinamat (b) borneol (c) beta-sitosterol (d) metil sinamat (www.chemicalbook.com)
(a) (b)
2.1.4 Manfaat Kaempferia galanga Linn.
Ekstrak minyak atsiri kencur memiliki aktivitas antimikroba untuk gram positif (Staphylococcus aureus ATCC 25923,
Streptococcus faecalis, Bacillus subtilis), gram negatif (Salmonella typhi, Shigella flexneri, Eschericia coli ATCC 2592), dan juga memiliki ativitas antifungi pada Candida albicans (Tewtrakul et al., 2005). Ekstrak metanol dari kencur memiliki toksisitas terhadap larva dan pupa Anopheles stephensi dan juga berpotensi sebagai repellent
(Dhandapani et al., 2011). Ekstrak air dari kencur memiliki aktivitas sebagai antinosiseptif dan antiinflamasi (Sulaiman et al., 2008). Ekstrak alkohol dari kencur diteliti memiliki aktivitas sebagai antiinflamasi dan analgesik (Vittalrao et al., 2011), juga memiliki aktivitas sebagai penyembuh luka (Tara V et al., 2006).
Selain aktivitas dari ekstrak kencur dengan berbagai pelarut, telah diteliti pula bioaktivitas dari isolat kencur yang bertanggungjawab dalam aktivitas antiinflamasi yakni etil metoksisinamat. Etil
p-metoksisinamat (EPMS) menghambat induksi edema karagenan pada tikus dengan MIC 100mg/kg dan juga berdasarkan hasil uji in vitro
EPMS secara non-selektif menghambat aktivitas COX-1 dan COX-2
dengan nilai IC50 masing-masing 1,12 µM dan 0,83 µM (Umar et al.,
2012).
2.2 Isolasi Etil p-metoksisinamat (EPMS)
mampu larut dalam beberapa pelarut dengan kepolaran bervariasi. Hasil penelitian pada pemilihan pelarut pada suhu kamar didapat bahwa heksan adalah pelarut yang paling sesuai ditandai dengan % hasil isolasi tertinggi yaitu 2,111% yang diikuti etanol yaitu 1,434%, dan etil asetat 0,542% sedangkan dengan aquades tidak terdapat kristal (Taufikkurohmah dkk, 2008).
EPMS adalah salah satu produk alam yang terdapat pada kencur (Kaempferia galanga Linn) dalam jumlah yang relatif besar. Isolasi dan pemurnian EPMS dapat dilakukan dengan mudah menggunakan metanol sehingga didapatkan kristal berwarna putih. Selain itu EPMS mempunyai gugus fungsi yang reaktif sehingga sangat mudah ditransformasikan menjadi gugus fungsi yang lain (Barus, 2009)
2.3 Senyawa Etil p-metoksisinamat
Etil p-metoksisinamat atau C12H14O3 termasuk turunan asam sinamat,
dimana asam sinamat adalah turunan senyawa fenil propanoad. EPMS sebelumnya dimanfaatkan sebagai bahan tabir surya (Windono dkk, 1997),
namun dewasa ini telah diteliti lebih lanjut bahwa EPMS merupakan senyawa isolat kencur yang memiliki aktivitas sebagai antiinflamasi non-selektif menghambat COX-1 dan COX-2 secara in vitro (Umar et al., 2012). Senyawa
EPMS berbentuk kristal berwarna putih dengan berat molekul 206.24 g/mol dan memiliki titik lebur 55-560C (Bangun, 2011).
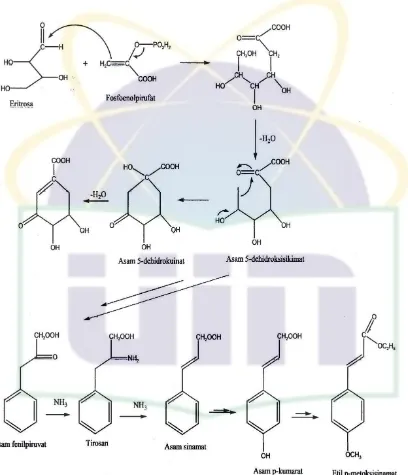
Gambar 2.2 Jalur asam sikhimat dalam biosintesa fenilpropanoid untuk menghasilkan etil p-metoksisinamat (Bangun, 2011).
2.4 Hidrolisis
reaksi yang dapat didefinisikan oleh jenis pusat reaksi di mana terjadi hidrolisis. Mekanisme Reaksi yang paling sering ditemui subtitusi nukleofilik baik secara langsung maupun tidak langsung dan eliminasi-adisi nukleofilik (Larson and Weber, 1994).
Gambar 2.3 Prinsip Reaksi Hidrolisis (Larson and Weber, 1994).
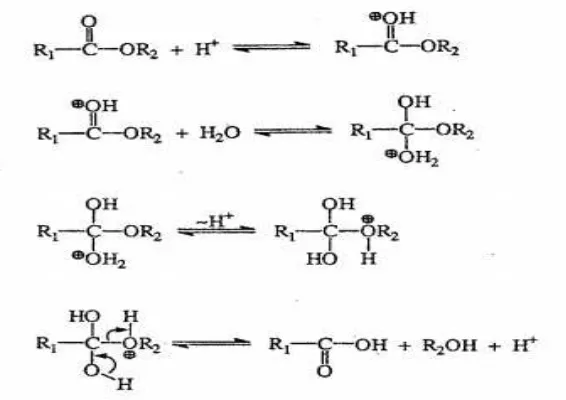
Reaksi hidrolisis dapat terjadi dengan katalis basa atau asam. Mekanisme reaksi hidrolisis sendiri dikelompokkan berdasarkan tipe reaksi dasar seperti subtitusi nukleofilik, gugus fungsi yang ditransformasikan dengan reaksi substitusi nukleofilik, substitusi asil nukelofilik, gugus fungsi yang ditransformasikan dengan reaksi substitusi asil nukleofilik. Hidrolisis untuk turunan asam karboksilat masuk ke dalam kategori terakhir yakni gugus fungsi yang ditransformasikan dengan reaksi subtitusi asil nukleofilik.
Mekanisme hidrolisis pada gambar 2.4 diinisiasi oleh protonasi pada karbonil oksigen. Protonasi menyebabkan keadaan terpolarisasi pada gugus karbonil melepaskan elektron dari karbon sehingga bersifat lebih elektrofilik dan akan menerima penambahan nukleofilik dari air (Larson and Weber,
1994).
Hidrolisis ester dengan katalis basa melalui mekanisme penambahan nukleofilik OH (gambar 2.5) secara langsung kepada gugus karbonil. Hidrolisis ester berkatalis basa terjadi karena ion OH merupakan nukleofil yang lebih kuat dibandingkan air (Larson and Weber, 1994).
Gambar 2.5 Mekanisme Reaksi Hidrolisis Ester dengan Katalis Basa (Larson and Weber, 1994).
2.5 Transesterifikasi
Transesterifikasi adalah istilah umum yang digunakan untuk
menggambarkan bagian penting dari reaksi organik di mana ester akan berubah menjadi ester lain melalui pertukaran gugus alkoksi. Ketika ester asli direaksikan dengan alkohol, proses transesterifikasi yang terjadi disebut alkoholisis seperti pada skema.
Istilah transesterifikasi akan digunakan sebagai sinonim untuk alkoholisis ester karboksilat, sebagaimana telah disepakati oleh beberapa pubilkasi. Transesterifikasi merupakan reaksi kesetimbangan dan pada dasarnya terjadi transformasi mencampurkan reaktan. Adanya katalis (biasanya asam kuat atau basa) mempercepat terjadinya kesetimbangan. Untuk mencapai hasil yang tinggi dari ester, alkohol harus digunakan secara berlebihan. Transesterifikasi bisa dilakukan dengan katalis asam ataupun basa. Pada
2.6 Identifikasi
2.6.1 Kromatografi
Kromatografi didefinisikan sebagai prosedur pemisahan zat terlarut oleh suatu proses migrasi deferensial dinamis dalam sistem yang terdiri dari dua fase atau lebih, salah satu di antaranya bergerak secara berkesinambungan dalam arah tertentu dan di dalamnya zat-zat itu menunjukkan perbedaan mobilitas disebabkan adanya perbedaan dalam adsorpsi, partisi, kelarutan, tekanan uap, ukuran molekul atau kerapatan muatan ion. Deangan demikian, masing-masing zat dapat diidentifikasi atau ditetapkan dengan metode analitik (Departemen Kesehatan, 1995).
Teknik kromatografi umum membutuhkan zat terlarut terdistribusi diantara dua fase, satu diantaranya diam (fase diam), yang lainnya bergerak (fase gerak). Fase gerak membawa zat terlarut melalui media, hingga terpisah dari zat terlarut lainnya, yang tereluasi lebih awal atau lebih akhir. Umumnya zat terlarut dibawa
melewati media pemisah oleh aliran suatu pelarut berbentuk cairan atau gas yang disebut eluen. Fase diam dapat bertindak sebagai zat penjerap, seperti halnya penjerap alumina yang diaktifkan, silika
gel, dan resin penukar ion, atau dapat bertindak melarutkan zat terlarut sehingga terjadi partisi antara fase diam dan fase gerak. Dalam proses terakhir ini suatu lapisan cairan pada suatu penyangga yang inert berfungsi sebagai fase diam (Departemen Kesehatan,1995).
pemisahan masing-masing senyawa secara kuantitatif dari suatu campuran. (Departemen Kesehatan,1995)
a. Kromatografi Lapis Tipis
Kromatografi lapis tipis adalah metode pemisahan fisikokimia. Lapisan yang memisahkan, yang terdiri atas bahan berbutir-butir (fase diam), ditempatkan pada penyangga berupa pelat gelas, atau lapisan yang cocok. Campuran yang akan harus ditampakkan (dideteksi) (Stahl Egon dalam Khoirunni’mah, 2013).
Diantara berbagai jenis teknik kromatografi, kromatografi lapis tipis adalah yang paling banyak digunakan untuk analisis
obat di laboratorium farmasi. Metode ini hanya memerlukan investasi kecil untuk perlengkapan dan menggunakan waktu yang singkat untuk menyelesaikan analisis (15-60 menit),
memerlukan jumlah cuplikan yang sangat sedikit (kira-kira 0,1 g). Selain itu, hasil palsu yang disebabkan oleh komponen sekunder tidak mungkin terjadi, kebutuhan ruangan minimum, dan penanganannya sederhana (Stahl Egon dalam
Beri tanda pada jarak 10 cm hingga 15 cm di atas titik penotolan. Tempatkan lempeng pada rak penyangga, hingga tempat penotolan terletak di sebelah bawah,dan masukkan rak ke dalam bejana kromatografi. Pelarut dalam bejana harus mencapai tepi bawah lapisan penjerap, tetapi titik penotolan jangan sampai terendam. Letakkan tutup bejana pada tempatnya,dan biarkan sistem hingga pelarut merambat 10 cm hingga 15 cm di atas titik penotolan, umumnya diperlukan waktu lebih kurang 15 menit hingga 1 jam. Keluarkan lempeng dari bejana ,buat tanda batas rambat pelarut, keringkan lempeng di udara,dan amati bercak mula-mula dengan cahaya ultraviolet gelombang pendek (254 nm) dan kemudian dengan cahaya ultraviolet gelombang panjang (366 nm). Ukur dan catat jarak tiap bercak dari titik penotolan serta catat panjang gelombang untuk tiap bercak yang diamati. Tentukan harga Rf untuk bercak utama. Jika diperlukan,
semprot bercak dengan pereaksi yang ditentukan, amati dan bandingkan kromatogram zat uji dengan kromatogram baku pembanding (Departemen kesehatan, 1995).
b. Kromatografi Kolom
Alat-alat yang diperlukan untuk kromatografi kolom sangat sederhana, terdiri dari tabung kromatografi dan sebuah batang pemampat yang diperlukan untuk memadatkan wol kaca atau kapas pada dasar tabung jika diperlukan, serta untuk memadatkan zat penjerap atau campuran zat penjerap dan air secara merata di dalam tabung. Kadang-kadang digunakan cakram kaca berpori yang melekat pada dasar tabung untuk menyangga isinya. Tabung berbentuk silinder dan terbuat dari kaca, kecuali bila dalam monografi, disebutkan terbuat dari bahan lain. Sebuah tabung mengalir dengan diameter yang lebih kecil untuk mengeluarkan cairan yang menyatu dengan tabung atau disambung melalui suatu sambungan anti bocor pada ujung bawah tabung utama (Departemen kesehatan, 1995).
Ukuran kolom bervariasi; kolom yang umum digunakan dalam analisis farmasi mempunyai diameter dalam antara 150
mm hingga 400 mm, tidak termasuk tabung pengalir. Tabung pengalir, umumnya berdiameter dalam antara 3 mm hingga 6 mm,dapat dilengkapi dengan sebuah kran untuk mengatur laju
aliran pelarut yang melalui kolom dengan teliti. Batang pemampat merupakan suatu batang silinder, melekat kuat pada sebuah tangkai yang terbuat dari plastik, kaca, baja tahan karat, atau aluminium, kecuali bila dinyatakan lain dalam monografi. Tangkai batang pemampat biasanya mempunyai diameter yang lebih kecil dari kolom dan panjang minimal 5 cm melebihi panjang efektif kolom, batang mempunyai diameter lebih kurang 1 mm lebih kecil dari diameter dalam kolom (Departemen kesehatan, 1995).
tabung kromatografi kaca atau kuarsa. Zat uji yang dilarutkan dalam sejumlah kecil pelarut, dituangkan ke dalam kolom dan dibiarkan mengalir ke dalam zat penjerap. Zat berkhasiat diadsorpsi dari larutan secara kuantitatif oleh bahan penjerap berupa pita sempit pada permukaan atas kolom. Dengan penambahan pelarut lebih lanjut melalui kolom, oleh gaya gravitasi atau dengan memberikan tekanan, masing-masing zat bergerak turun dalam kolom dengan kecepatan tertentu, sehingga terjadi pemisahan dan diperoleh kromatogram (Departemen Kesehatan,1995).
2.6.2 Spektrofotometri
Spektrofotometri merupakan pengukuran suatu interaksi antara radiasi elektromagnetik dan molekul atau atom dari suatu zat kimia. Teknik yang sering digunakan dalam analisis farmasi meliputi spektrofotometri serapan ultraviolet, cahaya tampak, inframerah dan serapan atom (Departemen Kesehatan,1995).
a. Spektrofotometri IR fungsi (Departemen Kesehatan, 1995).
Hampir semua senyawa yang memiliki ikatan kovalen, baik organik maupun anorganik, menyerap berbagai frekuensi radiasi elektromagnetik di wilayah inframerah dari spektrum elektromagnetik. Wilayah ini terletak pada panjang gelombang yang berkisar dari sekitar 400 sampai 800 nm (Pavia et al.
b. Spektrofotometri UV-Vis
Spektrofotometri serap merupakan pengukuran interaksi antara radiasi elektromagnetik panjang gelombang tertentu yang sempit dan mendekati monokromatik, dengan molekul atau atom dari suatu zat kimia. Hal ini didasarkan pada kenyataan bahwa molekul selalu mengabsorbsi cahaya elektromagnetik jika frekuensi cahaya tersebut sama dengan frekuensi getaran dari molekul tersebut. Elektron yang terikat dan elektron yang tidak terikat akan tereksitasi pada suatu daerah frekuensi yang sesuai dengan cahaya ultraviolet dan cahaya tammpak (UV-Vis) (Roth et al., 1994).
Spektrum absorbsi daerah ini adalah sekitar 220 nm sampai 880 nm dan dinyatakan sebagai spektrum elektron. Suatu spektrum ultraviolet meliputi daerah bagian ultraviolet (190-380 nm), spektrum Vis (Visible) bagian sinar tampak (380-780 nm).
Pengukuran dengan alat spektrofotometer UV-Vis didasarkan pada hubungan antara berkas radiasi elektromagnetik yang ditransmisikan (diteruskan) atau yang
diabsorbsi dengan tebalnya cuplikan dengan konsentrasi dari komponen penyerap. Hubungan tersebut dinyatakan dalam Hukum Lambert-Beer (Sastroamidjojo, 1985) :
A = a . b . c Keterangan :
(a) Daya Serap ; (b) Tebal Kuvet ; (c) Konsentrasi larutan ; (A) Serapan
Instrumentasi dari spektrofotometer UV-Vis ini dapat diuraikan sebagai berikut :
2. Suatu monokromator, yakni sebuah piranti untuk memencilkan pita sempit panjang gelombang dari spektrum lebar yang dipancarkan oleh sumber cahaya. 3. Suatu wadah untuk sampel (dalam hal ini digunakan
kuvet).
4. Suatu detektor, yang berupa transduser yang merubah energi cahaya menjadi suatu isyarat listrik.
5. Suatu amplifier (pengganda) dan rangkaian yang merubah energi cahaya menjadi suatu isyarat listrk.
6. Suatu sistem baca dimana diperagakan besarnya isyarat listrik yang ditangkap.
c. Spektrofotometri Resonansi Magnetik
Resonansi magnetik nuklir (NMR) adalah metode spektrofotometri yang bahkan lebih penting bagi ahli kimia organik dari spektrofotometri inframerah. Banyak inti dapat dipelajari dengan teknik NMR, tapi hidrogen dan karbon yang
paling umum tersedia. Jika spektrofotometri inframerah (IR) digunakan untuk mengidentifikasi gugus fungsi, NMR memberikan informasi mengenai jumlah atom magnetis yang
berbeda dari jenis yang dipelajari.
NMR dapat menentukan jumlah masing-masing jenis yang berbeda dari inti hidrogen serta memperoleh informasi mengenai sifat dasar dari lingkungan terdekat dari masing-masing jenis. Informasi yang sama dapat ditentukan untuk inti karbon. Kombinasi IR dan data NMR seringkali cukup untuk menentukan secara benar struktur molekul yang tidak diketahui (Pavia et al., 2008).
Instrumen NMR terdiri atas komponen-komponen sebagai berikut (Willard et al., 1988) :
a. Magnet untuk memisahkan energi spin nuklir.
frekuensi radio untuk energi penyinaran. Yang ketiga dapat digunakan untuk masing-masing inti yang akan dipisahkan. c. Probe sampel yang mengandung kumparan untuk kopling
sampel dengan bidang frekuensi radio. d. Detektor untuk memproses sinyal NMR.
e. Generator (Sweep Generator) untuk menyapu bersih baik medan magnet maupun frekuensi radio melalui frekuensi resonansi sampel.
f. Rekorder untuk menampillkan spektrum
2.7 Uji Antiinflamasi
Inflamasi merupakan respon imun tubuh yang secara umum terjadi karena adanya stimulus. Hal itu bisa dikarenakan oleh bakteri, misalnya kontaminasi bakteri pada luka. Inflamasi juga dapat terjadi ketika sistem kekebalan tubuh berjuang melawan sesuatu dan terkadang memunculkan efek berbahaya (IQWiQ, 2010). Untuk itu dikembangkanlah obat antiinflamasi untuk mengatasi efek berbahaya dari proses inflamasi yang ada di dalam
tubuh.
Beberapa metode in vitro dapat digunakan dalam mengetahui potensi atau aktivitas antiinflamasi dari suatu obat, kandungan kimia dan preparat
herbal. Teknik-teknik yang bisa digunakan antara lain adalah pelepasan fosforilasi oksidatif (ATP biogenesis terkait dengan respirasi), penghambatan denaturasi protein, stabilisasi membran eritrosit, stabilisasi membran lisosomal, tes fibrinolitik dan agregasi trombosit (Oyedapo et al., 2010. Selain itu uji antiinflamasi secara in vitro juga bisa dilakukan dengan melihat efek inhibisi pada siklooksigenase menggunakan kit khusus uji skrining siklooksigenase (Umar et al., 2012).
itu, penggunaan suatu agen tertentu yang bisa mencegah denaturasi protein akan bermanfaat pada pengembangan obat antiinflamasi (Chatterjee et al., 2012).
Beberapa AINS seperti indometasin, ibufenak, asam flufenamik dan asam salisilat memiliki kemampuan dalam mencegah denaturasi BSA yang dipanaskan pada pH patologis yakni 6,2-6,5. Selain itu beberapa ekstrak dan komponen murni tumbuhan seperti ekstrak Boehmeria jamaicensis (Urb), fenil propanoid, eugenol, polisulfid, dibenzil trisulfid dapat menghambat denaturasi BSA, memiliki aktivitas sebagai antioksidan dan merupakan kandidat obat antiinflamasi. Pada uji BSA, jika senyawa sampel menghambat denaturasi dengan persen inhibisi >20% maka dianggap memiliki aktivitas antiinflamasi dan layak untuk dikembangkan lebih lanjut. (Williams et al.,
BAB 3
METODOLOGI PENELITIAN
3.1 Tempat Dan Waktu Penelitian
3.1.1 Tempat
Penelitian ini dilaksanakan di Laboratorium Farmakognosi dan Fitokimia, Laboratorium Penelitian I dan Laboratorium Kimia Obat Program Studi Farmasi, Fakultas Kedokteran dan Ilmu Kesehatan.
3.1.2 Waktu
Penelitian ini dilaksanakan pada bulan Januari 2014 sampai dengan Juni 2014.
3.2 Alat Dan Bahan
3.2.1 Alat
Spektrofotometri ¹H-NMR (500 MHz, JEOL), spektrofotometer UV-Vis (HITACHI), vacuum rotary evaporator (SB-1000 Eyela), digital water bath (SB-100 Eyela), spektrofotometri IR (SHIMADZU),
Differential scanning calorimeter (SHIMADZU), refrigerator, Plat aluminium TLC silica gel 60 F254 (Merck), oven, timbangan analitik,
3.3 Prosedur Penelitian
3.3.1 Preparasi
a. Pengambilan Sampel
Sampel kencur diperoleh dari kebun balittro (Balai Penelitian Tanaman Rempah dan Obat) di wilayah Sukabumi, Jawa Barat.
b. Determinasi Tumbuhan
Determinasi tumbuhan kencur (Kaempferia galanga L.) dilakukan di Herbarium Bogoriense Bidang Botani, Puslit Biologi, LIPI Cibinong.
c. Penyiapan Bahan untuk Ekstraksi
Sebanyak 10 kg kencur dibersihkan, dicuci dengan air mengalir, kemudian dirajang sekitar 2-3 mm. Setelah itu kencur dijemur selama 5-6 hari tanpa kena sinar matahari. Setelah kencur yang dijemur berwarna coklat muda lalu dihaluskan menggunakan blender (Barus, 2009).
d. Pembuatan Reagen untuk Uji Antiinflamasi
1. Larutan TBS (Tris Buffer Saline) pH 6.3
Sebanyak 1,21 g Tris base dan 8,7 g NaCl dilarutkan dalam 1000 mL
aquades. Kemudian pH diadjust sampai 6,3 menggunakan asam asetat glasial (Mohan, 2003)
2. Penyiapan variat konsentrasi Na Diklofenak sebagai kontrol positif
Pembuatan larutan induk sebesar 4000 ppm Na diklofenak dengan pelarut metanol. Kemudian dilakukan pengenceran menjadi 2000, 1000, 500 dan 250 ppm.
3. Penyiapan variat konsentrasi EPMS dan senyawa hasil modifikasi (sampel)
Pembuatan larutan induk sebesar 4000 ppm ppm baik senyawa hasil modifikasi maupun EPMS dengan pelarut metanol. Kemudian dilakukan pengenceran menjadi 2000, 1000, 500 dan 250 ppm.
4. Pembuatan BSA 0,2% (w/v)
Sebanyak 0.2 g BSA dilarutkan dalam TBS 100 mL (Williams et al.,
3.3.2 Isolasi Etil p-metoksisinamat
Serbuk simplisia kencur dimaserasi dengan menggunakan pelarut n-heksana yang telah didestilasi dengan waktu perendaman 5 hari sambil sesekali dilakukan pengocokan. Setelah 5 hari disaring sehingga diperoleh ampas dan filtrat. Ampas dilakukan maserasi ulang sebanyak 4 kali hingga hasil maserasi menunjukkan warna hampir menyerupai jernih. Seluruh filtrat hasil maserasi dipekatkan dengan vacuum rotary evaporator. Kemudian filtrat pekat ini diendapkan pada suhu kamar sampai terbentuk kristal.
Kristal yang terbentuk pada filtrat dipisahkan dengan penyimpanan. Kristal yang diperoleh dimurnikan menggunakan n-heksan dan rekristalisasi dengan cara melarutkan kristal dalam n-heksan dan beberapa tetes metanol dan kemudian dibiarkan pada suhu kamar sehingga terbentuk kristal kembali. Kristal dipisahkan dengan penyaringan. Kristal murni dilarutkan dalam etil asetat dan dicek menggunakan KLT dengan eluen n-heksan : etil asetat perbandingan 9:1. Lalu dilakukan identifikasi terhadap kristal yang
didapat.
Kemudian dihitung rendemennya :
% rendemen =
x 100 % 3.3.3 Modifikasi Senyawa EPMS
a. Hidrolisis Etil p-metoksisinamat dan Degradasi sinamat
Sebanyak 1,5 g NaOH dilarutkan dengan etanol pro analisis dalam gelas kimia dengan pengadukan. Kemudian ditambahkan senyawa EPMS sebanyak 5 g ke dalamnya. Pengecekan reaksi dilakukan dengan menggunakan KLT. Hasil reaksi difiltrasi, filtrat yang didapat ditambahkan HCl 15% hingga tidak ada endapan putih yang terbentuk atau
pH filtrat mencapai 4. Residu berupa senyawa hasil hidrolisis kemudian dikeringanginkan.
b. Transesterifikasi
berlangsung selama 20 jam, dilakukan pengecekan dengan KLT. Hasil reaksi difiltrasi, filtrat yang didapat ditambahkan HCl 15% hingga tidak ada endapan putih yang terbentuk atau pH filtrat mencapai 4. Residu berupa senyawa hasil transesterifikasi kemudian dikeringanginkan (Yoeswono, 2008).
c. Degradasi Sinamat
Sebanyak 2,5 g etil p-metoksisinamat ditambahkan ke dalam 10 mL asam nitrat 65% dalam suhu -150C. Campuran reaksi (keadaan dingin, -150C) tersebut kemudian diiradiasi menggunakan mikrowave pada 450 W selama 2 menit. Setelah iradiasi, campuran reaksi dituangkan ke dalam batu es aquades kemudian difiltrasi, maka akan didapatkan padatan berwarna orange kekuningan. Direkristalisasi menggunakan metanol-etil asetat (Bose et al, 2006) .
3.3.4 Identifikasi Senyawa
a. Identifikasi Organoleptis
Senyawa yang didapat baik senyawa murni etil p-metoksisinamat maupun senyawa hasil modifikasi kemudian diidentifikasi warna, bentuk dan juga bau.
b. Pengukuran titik leleh
Senyawa yang didapat baik senyawa murni etil p-metoksisinamat maupun senyawa hasil modifikasi kemudian diidentifikasi titik lelehnya menggunakan alat apparatus melting point dan DSC.
c. Identifikasi senyawa menggunakan FTIR
Sedikit sampel padat (kira-kira 1 - 2 mg), kemudian ditambahkan bubuk KBr murni (kira-kira 200 mg) dan diaduk hingga rata. Kemudian sampel yang terbentuk diambil dan kemudian ditempatkan dalam tempat sampel pada alat spektrofotometri inframerah untuk dianalisis (Hidayati, 2012). d. Identifikasi senyawa menggunakan GCMS
massa paling rendah yakni 35 sampai paling tinggi 550 (Umar et al, 2012).
e. Identifikasi senyawa menggunakan H-NMR
Sedikit sampel padat (kira-kira 10 mg), kemudian dilarutkan dalam pelarut bebas proton (khusus NMR), setelah dilarutkan kemudian dimasukkan ke dalam tabung khusus NMR untuk kemudian dianalisis. 3.3.5 Uji Invitro Antiinflamasi (Williams et al., 2008)
Pengujian Aktivitas Senyawa Hasil Modifikasi Terhadap Denaturasi BSA : a. Pembuatan Larutan Uji
Larutan uji (5 mL) terdiri dari 50 µL larutan sampel yang kemudian ditambah dengan BSA hingga volume 5 mL sehingga didapatkan variat konsentrasi menjadi 40, 20, 10, 5 dan 2,5 ppm.
b. Pembuatan Larutan Kontrol Negatif
Larutan kontrol negatif (5 mL) terdiri dari 50 µL metanol yang kemudian ditambah dengan BSA hingga volume 5 mL Pembuatan c. Pembuatan Larutan Kontrol Positif
Larutan kontrol positif (5 mL) terdiri dari 50 µL larutan natrium diklofenak yang kemudian ditambah dengan BSA hingga volume 5 mL sehingga didapatkan variat konsentrasi menjadi 40, 20, 10, 5 dan
2,5 ppm.
Setiap larutan di atas dipanaskan selama 5 menit pada suhu 720C. Lalu didinginkan dan diukur turbiditasnya dengan spektrofotometer UV-Vis (HITACHI) pada gelombang 660 nm.
Persentase inhibisi dari denaturasi atau presipitasi BSA dikalkulasikan dengan rumus berikut :
% inhibisi =
25 UIN Syarif Hidayatullah Jakarta BAB 4
HASIL DAN PEMBAHASAN
Pada penelitian ini dilakukan modifikasi senyawa etil p-metoksisinamat yang diisolasi dari kencur melalui transformasi gugus fungsi reaktif yang dimilikinya yaitu olefin dan ester. Tujuan modifikasi ini dilakukan untuk melihat pengaruh gugus fungsi yang ada pada aktivitas antiinlamasi etil p-metoksisinamat. Uji antiinflamasi ini dilakukan secara invitro menggunakan BSA (Bovine Serum Albumin) dengan prinsip inhibisi denaturasi protein.
4.1 Hasil Isolasi Senyawa Etil p-Metoksisinamat
4.1.1 Hasil Determinasi
Gambar 4.1 Rimpang Kencur [Sumber : Koleksi Pribadi]
Untuk memastikan kebenaran tumbuhan yang digunakan dalam penelitian ini, maka dilakukan determinasi di Herbarium Bogoriense, Pusat Penelitian Biologi LIPI, Bogor, Jawa Barat. Hasil determinasi menunjukkan bahwa sampel merupakan spesies Kaempferia galanga
L. Sertifikat hasil determinasi dapat dilihat pada Lampiran 3.
4.1.2 Pembuatan Serbuk Simplisia
Rimpang Kencur segar yang digunakan sebanyak 10 kg, setelah melalui serangkaian proses pembuatan simplisia (Lampiran 2)
simplisia yang dihasilkan berwarna kecokelatan. Gambar serbuk simplisia dapat dilihat pada Gambar 4.2.
Gambar 4.2. Serbuk kering simplisia kencur (Kaempferia galanga L.) [Sumber : Koleksi Pribadi]
4.1.3 Isolasi Etil p-metoksisinamat
Isolasi senyawa etil p-metoksisinamat secara garis besar dilakukan dalam 3 tahap yakni preparasi simplisia, ekstraksi maserasi simplisia
kencur dengan pelarut n-heksan, dan rekristalisasi senyawa (lihat skema isolasi pada Lampiran 2). Senyawa etil p-metoksisinamat ini akan mengkristal pada suhu ruang sehingga tahap isolasi bisa menjadi lebih mudah. Hampir 80% dari ekstrak kental yang didapat mengkristal saat dibiarkan di suhu ruang (Umar et al., 2012).
Proses rekristalisasi dilakukan dengan n-heksan dan metanol. Kristal yang didapat berwarna putih kekuningan kemudian dilakukan pengecekan dengan KLT. Eluen yang digunakan adalah heksan : etil asetat perbandingan 9:1, didapatkan nilai Rf= 0,5882 seperti pada gambar 4.3.
Nilai rendemen kristal :
% rendemen =
x 100 % = 2,564 %
UIN Syarif Hidayatullah Jakarta 4.1.4 Identifikasi Etil p-metoksisinamat
a. Pemerian
Warna : putih kekuningan
Bau : aromatik khas
Bentuk : kristal
b. Pengukuran Titik Leleh
Pengukuran titik leleh dilakukan menggunakan alat DSC seperti pada lampiran 5. Rentang titik leleh senyawa etil p-metoksisinamat ada pada 47-520C dengan nilai entalpi (H) 78,60 J/g.
c. Analisa Senyawa Etil p-metoksisinamat
Analisa senyawa etil p-metoksisinamat dilakukan menggunakan spektrofotometri IR untuk mengetahui gugus fungsi, spektrofometer 1H-NMR untuk mengetahui letak proton H pada struktur, dan GCMS untuk mengetahui berat molekul senyawa serta fragmentasi massa.
Tabel 4.1. Daftar daerah spektrum IR isolat kencur (etil p-metoksisinamat)
Aromatik posisi para 829,43
pita serapan pada bilangan gelombang v 3007,15 – 3045,73 cm⁻¹ yang merupakan serapan spesifik vibrasi ulur ikatan antar atom C-H pada gugus aromatik. Keberadaan aromatik juga ditunjukkan dengan adanya C=C pada bilangan gelombang v
1629,92 – 1573,02 cm⁻¹. C-H Alifatik ditemukan pada bilangan gelombang 2979,18 – 2842,23 cm⁻¹. Aromatik disubstitusi para
juga ditunjukkan dengan munculny serapan pada bilangan gelombang v 829,43 cm⁻¹. Dan pada bilangan gelombang 1252,82
– 1210,38 cm⁻¹ dan 1029,07 cm⁻¹ terdapat C-O yang berikatan pada aromatik.
Pita serapan pada bilangan gelombang v 1704,18 cm⁻¹
merupakan serapan spesifik vibrasi ulur dari gugus C=O karbonil, dan juga serapan vibrasi C–O ditemukan pada pita v
1367,59 – 1321,3 cm⁻¹, serapan dari keduanya menunjukkan
adanya suatu gugus ester.
Analisa kedua dilakukan menggunakan GCMS. Literatur untuk senyawa etil p-metoksisinamat menunjukkan bahwa senyawa tersebut muncul pada waktu retensi 9,9 dengan berat molekul 206,4 serta memiliki fragmentasi massa pada 161; 134; 118; 89; 77; 63; 51 (Umar et al., 2012).
UIN Syarif Hidayatullah Jakarta dikonfirmasi kembali dengan analisa terakhir yakni H-NMR.
Interpretasi analisa NMR berupa nilai pergeseran kimia (δ) dalam satuan ppm. Nilai δ merupakan perbedaan resonansi
frekuensi suatu inti relatif terhadap standar (Pavia et al., 2008).
Adapun hasil analisis senyawa isolat kencur dengan H1 NMR (Lampiran 8) ditunjukkan pada tabel 4.2. dengan panduan gambar 4.4.
Gambar 4.4 Struktur senyawa etil p-metoksisinamat
Interpretasi NMR pada penelitian ini dibandingkan dengan hasil interpretasi pada penelitian Umar (2012). Spektrum H1 NMR memberikan sinyal pada pergeseran kimia 1,33 (3H) berbentuk
triplet dan juga muncul pada 4,25 ppm (2H) berbentuk quartet. Sinyal ini lebih downfield karena berikatan dengan oksigen. Spektrum H1 NMR juga memberikan sinyal pada pergeseran kimia 3,82 ppm (3H) berbentuk singlet. Sinyal ini lebih downfield karena berikatan dengan oksigen (-OCH3, metoksi). Pergeseran kimia 6,31
pada pergeseran kimia 7,65 ppm (1H) berbentuk doublet, dengan rentang nilai konstanta kopling yang dekat yaitu 15,6 dan 16,25 Hz. Bentuk tersebut adalah olefin dengan proton berkonfigurasi trans. Kemudian pada pergesaran kimia 6,9 ppm – 7,4 ppm (4H) merupakan proton-proton dari benzen dengan dua substitusi. Pola sinyal ini menunjukkan bahwa 2 proton yang ekivalen terkopling secara ortho dengan 2 proton yang ekivalen lainnya, yang kemudian menunjukkan bahwa sinyal ini adalah sinyal dari H 7/11 dan H 8/10.
Tabel 4.2. Data pergeseran kimia (δ) spektrum 1H NMR 500 MHz senyawa etil p-metoksisinamat
4.2 Modifikasi Struktur Etil p-Metoksisinamat
Hubungan struktur dan aktivitas AINS pada turunan asam aril asetat menunjukkan bahwa pengurangan atau penambahamn atom C pada gugus fungsi dapat mempengaruhi aktivitas antiinflamasi (Siswandono, 2000).
UIN Syarif Hidayatullah Jakarta pada senyawa etil p-metoksisinamat yang diisolasi dari kencur melalui reaksi hidrolisis, reaksi transesterifikasi dan degradasi sinamat dengan asam nitrat.
4.2.1 Reaksi Hidrolisis
Reaksi hidrolisis dilakukan dengan NaOH sebagai katalis basa dan etanol p.a sebagai pelarut. Mekanisme reaksi hidrolisis diinisiasi oleh protonasi pada karbonil oksigen. Protonasi menyebabkan keadaan terpolarisasi pada gugus karbonil melepaskan elektron dari karbon sehingga bersifat lebih elektrofilik dan akan menerima penambahan nukleofilik OH (Larson dan Weber, 1994).
Pengecekan dengan KLT selama reaksi hidrolisis berlangsung dilakukan untuk melihat lamanya reaksi ini berlangsung. Berdasarkan hasil KLT, didapatkan bahwa hidrolisis ini berlangsung selama 32 jam (gambar 4.5) pada suhu kamar dengan hasil berupa padatan berwarna putih. Ketika reaksi ini selesai, dilakukan filtrasi dan pencucian dengan aquades. Filtrat yang diperoleh memiliki pH basa yakni 13 kemudian
ditambahkan HCl 15% untuk mengikat Na+ sehingga terbentuklah endapan putih berupa hasil hidrolisis sampai pH 4 atau tidak lagi terbentuk endapan.
Gambar 4.5. KLT senyawa hasil hidrolisis dengan eluen heksan:etil asetat perbandingan 4:1 (visualisasi UV 245 nm)
Keterangan : (1) etil p-metoksi sinamat (2) Senyawa A – hasil hidrolisis
Residu yang didapat kembali dicuci dengan aquades untuk menghilangkan garam yang terbentuk kemudian residu dikeringanginkan. Residu yang didapatkan berwarna putih (lihat lampiran 25). Mekanisme reaksi hidrolisis etil p-metoksisinamat dapat dilihat pada gambar 4.6.
Gambar 4.6. Mekanisme Reaksi Hidrolisis Etil p-metoksisinamat
Hidrolisis ini bertujuan untuk menghilangkan gugus ester sehingga dapat dilihat efek gugus ester pada etil p-metoksisinamat terhadap aktivitas antiinflamasi yang dihasilkan.
% rendemen hidrolisis =
x 100 % = 82,304 % 4.2.2 Reaksi Transesterifikasi
UIN Syarif Hidayatullah Jakarta Gambar 4.7. KLT senyawa hasil transesterifikasi dengan eluen
heksan:etil asetat perbandingan 9:1 (visualisasi UV 245 nm)
Keterangan : (1) etil p-metoksi sinamat (2) Senyawa B-hasil percobaan skala kecil (3) Senyawa B-hasil percobaan skala besar
Penggunaan NaOH sebagai katalis dalam transesterifikasi menurut Yoeswono (2008) dinilai lebih efektif dibandingkan menggunakan asam. Oleh karena itu, penelitian kali ini menggunakan NaOH sebagai katalis. Sebagaimana pada hidrolisis, pengecekan dengan KLT dilakukan untuk mengetahui lamanya waktu reaksi. Berdasakan hasil KLT, didapatkan bahwa reaksi transesterifikasi etil p-metoksisinamat berlangsung selama 20 jam (gambar 4.7). Senyawa C hasil transesterifikasi berbentuk serbuk putih mengkilat.
% rendemen transesterifikasi =
Gambar 4.8. Reaksi Transesterifikasi Etil p-metoksisinamat
4.2.3 Degradasi Sinamat dengan Asam Nitrat
Degradasi sinamat dalam penelitian Defnoun (2003) dilakukan oleh bakteri anaerob Papillibacter cinnamivorans menjadi benzoat
melalui β-oksidasi. Namun pada penelitian ini, degradasi sinamat
dilakukan melalui reaksi dengan asam nitrat menggunakan metode
‘Cold Microwave’.
Metode ‘Cold Microwave’ biasa digunakan untuk nitrasi.
Keuntungan metode ini adalah memiliki waktu reaksi yang cepat dalam hitungan menit dan meniadakan asam sulfat dalam reaksi nitrasi. Namun pada kali ini metode ini digunakan untuk degradasi sinamat.
Metode ‘Cold Microwave’ baru dikembangkan pada dekade terakhir ini
untuk lebih memudahkan sintesa. Hal penting yang harus diperhatikan adalah preparasi pencampuran antara senyawa sampel dengan reagen yaitu asam nitrat harus dilakukan pada suhu dingin (Bose, 2006). Suhu menjadi faktor penting yang harus dijaga pada metode ini. Suhu akhir reaksi tidak boleh lebih dari 200C. Pada reaksi degradasi sinamat etil p-metoksisinamat, suhu campuran reaksi awal adalah -150C dan suhu setelah reaksi dengan mikrowave adalah 100C.
O
Langsung setelah reaksi degradasi sinamat selesai, campuran reaksi
dituangkan ke dalam batu es aquades kemudian dibiarkan beberapa saat dengan pengadukan. Padatan orange didapatkan dengan melakukan
filtrasi. Filtrat yang didapat dipartisi dengan etil asetat untuk mengambil senyawa hasil reaksi yang kemungkinan masih ada. KLT hasil reaksi degradasi sinamat dapat dilihat pada gambar 4.10. yang menunjukkan bahwa etil p-metoksisinamat telah bereaksi sempurna dalam waktu 2 menit. Padatan kering berwarna orange yang didapat lalu direkristalisasi menggunakan etil asetat dan metanol sehingga didapatkan kristal berwarna putih. Kemudian diidentifikasi lebih lanjut.
% rendemen =
UIN Syarif Hidayatullah Jakarta Gambar 4.10. KLT Hasil Degradasi Etil p-metoksisinamat sebelum dilakukan rekristalisasi dengan eluen heksan : etil asetat perbandingan
3:2 (visualisasi UV 245 nm).
Keterangan : (1) Etil p-metoksisinamat (2) Hasil Degradasi
4.3 Identifikasi Senyawa Hasil Modifikasi
Identifikasi senyawa hasil modifikasi dimulai dengan melihat perbandingan nilai Rf seluruh senyawa yang di KLT menggunakan eluen heksan : etil asetat dengan perbandingan 9:1 (Lihat gambar 4.11). Nilai Rf yang didapat adalah sebagai berikut :
Etil p-metoksisinamat = 0,588
Senyawa Hidrolisis = 0,082
Senyawa Transesterifikasi = 0,529
Senyawa Degradasi sinamat = 0,094
bahwa reaksi hidrolisis dan degradasi sinamat telah meningkatkan polaritas pada senyawa hasil modifikasi.
Gambar 4.11. KLT senyawa dengan heksan:etil asetat perbandingan 9:1 (visualisasi UV 245 nm).
4.3.1 Senyawa A
Senyawa hasil hidrolisis etil p-metoksisinamat memiliki karakteristik sebagai berikut :
Warna : Putih
Bau : Tidak berbau
Bentuk : Serbuk
Pengukuran titik leleh dilakukan menggunakan alat DSC seperti pada lampiran 9. Rentang titik leleh senyawa hasil hidrolisis etil p-metoksisinamat ada pada 172-1760C dengan nilai entalpi (H) 89,3 J/g.
Elusidasi struktur senyawa A dilakukan dengan analisa menggunakan IR, GCMS dan 1H NMR. Penafsiran spektrum IR senyawa A hasil hidrolisis etil p-metoksisinamat dari berbagai bilangan gelombang absorbsi gugus fungsi yang spesifik ditunjukkan dalam Tabel 4.3 (dan Lampiran 10) yaitu ditemukan pita serapan
UIN Syarif Hidayatullah Jakarta ditunjukkan dengan munculnya serapan pada bilangan gelombang v
825,57 cm⁻¹. C-H Alifatik ditemukan pada bilangan gelombang 2974,36 – 2882,74 cm⁻¹. Dan pada bilangan gelombang 1261,50 –
1220,03 cm⁻¹ terdapat C-O yang berikatan pada aromatik.
Tabel 4.3 Daftar daerah spektrum IR Senyawa A Ikatan Daerah Absorbsi (v, cm-1)
Aromatik posisi para 825,57
Pita serapan pada bilangan gelombang v 1690,68 –
Hal ini menunjukkan bahwa reaksi hidrolisis telah berhasil dilakukan dimana gugus ester pada etil p-metoksisinamat telah berubah menjadi karboksilat.
OH
Data analisa spektrum IR dan interpretasi GCMS dikonfirmasi kembali dengan analisa terakhir yakni H-NMR. Interpretasi analisa NMR berupa nilai pergeseran kimia (δ) dalam satuan ppm (Pavia et al., 2008). Adapun hasil analisis senyawa hasil hidrolisis etil p-metoksisinamat dengan H1 NMR (Lampiran 12) ditunjukkan pada tabel 4.4. dengan panduan gambar 4.12.
OH
Gambar 4.12 Struktur Senyawa A
Pergeseran kimia pada 1,33 ppm dan 4,25 ppm sudah tidak muncul dimana itu menandakan senyawa A sudah tidak memiliki gugus ester. Spektrum H1 NMR memberikan sinyal pada pergeseran kimia 3,82 ppm (3H) berbentuk singlet. Sinyal ini lebih downfield karena berikatan dengan oksigen (-OCH3 , metoksi). Pergeseran kimia 6,34 ppm (1H)
UIN Syarif Hidayatullah Jakarta proton berkonfigurasi trans. Kemudian pada pergesaran kimia 6,95 ppm
– 7,54 ppm (4H) merupakan proton-proton dari benzen dengan dua substitusi. Pola sinyal ini menunjukkan bahwa 2 proton yang ekivalen terkopling secara ortho dengan 2 proton yang ekivalen lainnya, yang kemudian menunjukkan bahwa sinyal ini adalah sinyal dari H 7/11 dan H 8/10.
Tabel 4.4 Data pergeseran kimia (δ) spektrum 1H NMR etil p-metoksisinamat dan senyawa A ( CD3OD, 500 MHz)
Posisi
Pergeseran Kimia (δ, ppm)
Senyawa A Etil p-Metoksisinamat
1 - 1,33 (t, 3H, J=7,15) hidrolisis etil p-metoksisinamat adalah asam p-metoksisinamat.
4.3.2 Senyawa B
Senyawa hasil transesterifikasi etil p-metoksisinamat memiliki karakteristik sebagai berikut :
Warna : Putih
Bau : Tidak berbau
Pengukuran titik leleh dilakukan menggunakan alat DSC seperti pada lampiran 13. Rentang titik leleh senyawa hasil transesterifikasi etil p-metoksisinamat ada pada 85-940C dengan nilai entalpi (H) 36,74 J/g.
Elusidasi struktur senyawa B dilakukan dengan analisa menggunakan IR dan GCMS. Penafsiran spektrum IR senyawa B hasil transesterifikasi etil p-metoksisinamat dari berbagai bilangan gelombang absorbsi gugus fungsi yang spesifik ditunjukkan dalam Tabel 4.5 (dan Lampiran 14) yaitu ditemukan pita serapan pada bilangan gelombang v 3095,88 – 3033,19 cm⁻¹ adalah serapan
spesifik vibrasi ulur ikatan antar atom C-H pada gugus aromatik. Keberadaan aromatik juga ditunjukkan degan adanya C=C pada bilangan gelombang v 1640,53 – 1604,84 cm⁻¹. Aromatik disubstitusi para juga ditunjukkan dengan munculnya serapan pada bilangan
gelombang v 825,57 cm⁻¹. C-H Alifatik ditemukan pada bilangan gelombang 2964,72 – 2844,16 cm⁻¹. Dan pada bilangan gelombang
1259,57 – 1205,56 cm⁻¹ terdapat C-O yang berikatan pada aromatik. Tabel 4.5 Daftar daerah spektrum IR Senyawa B.
Ikatan Daerah Absorbsi (v, cm-1)
Aromatik posisi para 837,14
Pita serapan pada bilangan gelombang v 1721,54 – 1711,90 cm⁻¹ yang merupakan serapan spesifik vibrasi ulur dari gugus C=O ester, dan juga serapan vibrasi C–O ditemukan pada pita v
UIN Syarif Hidayatullah Jakarta Analisa kedua dilakukan menggunakan GCMS. Interpretasi GCMS menunjukkan bahwa senyawa B muncul pada waktu retensi 9,471 dengan berat molekul 192 dengan fragmentasi massa pada 161; 133; 107; 89; 77 dan 63 (Lihat Lampiran 15). Adapun fragmentasi yang terjadi pada senyawa B adalah sebagai berikut :
O CH2-) menunjukkan bahwa transesterifikasi telah berhasil dilakukan.
Berdasarkan hasil identifikasi menggunakan IR dan GCMS didapatkan bahwa senyawa tersebut adalah metil p-metoksisinamat.
4.3.3 Senyawa C
Senyawa hasil degradasi etil p-metoksisinamat memiliki karakteristik sebagai berikut :
Warna : Putih
Bau : Tidak berbau
Bentuk : Kristal jarum
Pengukuran titik leleh dilakukan menggunakan alat apparatus melting point. Rentang titik leleh senyawa C ada pada 189-1920C.
yaitu ditemukan pita serapan pada bilangan gelombang v 3075,63 cm⁻¹ adalah serapan spesifik vibrasi ulur ikatan antar atom C-H pada gugus aromatik. C-H Alifatik ditemukan pada bilangan gelombang
2984,01 cm⁻¹. Pita serapan pada bilangan gelombang v 1325,15 cm⁻¹ merupakan serapan spesifik vibrasi ulur dari C–O. Dan kemudian muncul pita serapan OH pada bilangan gelombang v 3300 – 2500 cm⁻¹
serta diperkuat dengan pita serapan pada 2574,12 cm-1 yang menunjukkan bahwa senyawa C memiliki gugus karboksilat.
Tabel 4.6 Daftar daerah spektrum IR Senyawa C.
Ikatan Daerah Absorbsi (v, cm-1)
Aromatik posisi para 825,57
Analisa kedua dilakukan menggunakan GCMS. Interpretasi GCMS menunjukkan bahwa senyawa C muncul pada waktu retensi 7,905 dengan berat molekul 152 dengan fragmentasi massa pada 135; 107; 92; 77; dan 63 (Lihat Lampiran 17). Adapun fragmentasi yang terjadi pada senyawa C adalah sebagai berikut :
UIN Syarif Hidayatullah Jakarta Data analisa spektrum IR dan interpretasi GCMS dikonfirmasi kembali dengan analisa terakhir yakni H-NMR. Interpretasi analisa
NMR berupa nilai pergeseran kimia (δ) dalam satuan ppm (Pavia et
al., 2008). Adapun hasil analisis senyawa C dengan H1 NMR (Lampiran 18) ditunjukkan pada tabel 4.7 dengan panduan gambar 4.13.
O
Gambar 4.13 Struktur Senyawa C
Tabel. 4.7 Data pergeseran kimia (δ) spektrum 1H NMR etil p-metoksisinamat dan senyawa C ( CD3OD, 500 MHz)
Posisi
Pergeseran Kimia (δ, ppm)
Senyawa C Etil p-Metoksisinamat
1 - 1,33 (t, 3H, J=7,15)
Spektrum H1 NMR memberikan sinyal pada pergeseran kimia 3,82 ppm (3H) berbentuk singlet. Sinyal ini lebih downfield karena berikatan dengan oksigen (-OCH3 , metoksi). Pergeseran kimia 6,31 ppm dan 7,63
ppm juga tidak muncul yang mana itu menunjukkan bahwa olefin pada etil p-metoksisinamat telah terputus ikatannya. Kemudian pada pergesaran kimia 6,75 ppm – 7,97 ppm (4H) merupakan proton-proton dari benzen dengan dua substitusi. Pola sinyal ini menunjukkan bahwa 2 proton yang ekivalen terkopling secara ortho dengan 2 proton yang ekivalen lainnya, yang kemudian menunjukkan bahwa sinyal ini adalah sinyal dari H 7/11 dan H 8/10.
Dari data interpretasi IR, GCMS dan 1H NMR, senyawa hasil degradasi etil p-metoksisinamat adalah 4-metoksibenzoat.
4.4 Pengujian Aktivitas Antiinflamasi dan Hubungan Struktur Aktivitas
Senyawa Hasil Modifikasi
Banyak sekali masalah yang terjadi berkaitan tentang penggunaan hewan pada penelitian farmakologi seperti kode etik dan kurang rasionalnya
penggunaan metode tersebut jika terdapat metode lain yang bisa digunakan (Chatterjee et al., 2012). Pada penelitian ini, uji aktivitas antiinflamasi
invitro dengan prinsip penghambatan denaturasi protein (William et al.,
2008) dipilih untuk melakukan skrining awal antiinflamasi pada senyawa hasil modifikasi.