STUDI KASUS: PATOMORFOLOGI
TRAKHEOBRONKHITIS SUPURATIVA PADA KUCING
(
Felis catus
)
SRI RAHAYU RESMAWATI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Studi Kasus: Patomorfologi Trakheobronkhitis Supurativa pada Kucing (Felis catus) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
SRI RAHAYU RESMAWATI. Studi Kasus: Patomorfologi Trakheobronkhitis Supurativa pada Kucing (Felis catus). Dibimbing oleh VETNIZAH JUNIANTITO dan EVA HARLINA.
Trakheobronkhitis merupakan penyakit saluran respirasi yang sering terjadi pada hewan kecil, terutama anjing dan kucing. Penelitian berupa studi kasus ini bertujuan untuk mempelajari patomorfologi trakheobronkhitis supurativa pada kucing. Perubahan patologi anatomi berupa eksudat purulen pada lumen trakhea dan warna paru-paru yang tidak homogen, warna lebih gelap pada salah satu lobus, dan permukaan paru-paru lebih menonjol. Perubahan histopatologi berupa badan inklusi amfofilik-eosinofilik intranuklear yang dikelilingi oleh clear halo dan titik-titik kromatin ditepinya pada epitel kelenjar trakhea dan epitel bronkhiolus. Badan inklusi ini merupakan ciri dari FHV-1 dan adenovirus. Pada trakhea juga ditemukan koloni bakteri berbentuk coccobacillus sebagai infeksi sekunder. Bakteri tersebut diduga Bordetella sp. yang sering menginfeksi saluran respirasi kucing. Deskuamasi terjadi pada epitel trakhea dan bronkhiolus. Selain itu, ditemukan juga sel radang limfosit, makrofag, sel plasma, dan neutrofil. Pada paru-paru ditemukan lesio bronkhiolitis. Ditemukan juga bronkhopneumonia yang ditandai infiltrasi sel radang neutrofil dan sel nekrosis pada lumen bronkhiolus. Paru-paru juga mengalami emfisema dan edema pulmonum. Hiperemia dan hemoragi juga ditemukan pada kapiler paru-paru. Pada kasus ini, trakheobronkhitis supurativa diduga disebabkan oleh FHV-1, adenovirus, dan bakteri jenis Bordetella sp.
ABSTRACT
SRI RAHAYU RESMAWATI. Pathomorphology of Suppurative Tracheobronchitis in a Cat (Felis catus): a Case Study. Supervised by VETNIZAH JUNIANTITO and EVA HARLINA.
Tracheobronchitis is a common respiratory tract disease on small animals, particularly cats and dogs. This study was aimed to observe the pathological changes of suppurative tracheobronchitis in a cat. The gross lesions were purulent exudate within tracheal lumen, nonhomogeneous color of lungs, dark appearance of lung lobules, and bulging lung surface. Histopathologically, there were amphophilic to eosinophilic intranuclear inclusion bodies which is surrounded by clear halo and chromatin spots on the epithelium of tracheal glands and bronchioles. This inclusion bodies were consistent with FHV-1 and adenoviral infection. Coccobacillary bacterial colonies were also found scattered in necrotizing tracheal tissue and supposed to act as a secondary infection. It is suspected that the bacterial colonies were Bordetella sp. which commonly found in the respiratory tract of cats worldwide. The epithelium of trachea and bronchioles were desquamated. Additionally, bronchiolitis lesion was found on lungs. Bronchopneumonia which is indicated by neutrophils, plasma cells, macrophages and lymphocytes infiltration and necrosis cells on the lumen of bronchioles and alveoli were also found throughout the lung. In addition, emphysema and pulmonary edema were occurred along with hyperemia and hemorrhage. Conclusively, in the present case, there is acute suppurative tracheobronchitis which were suggested by FHV-1, adenovirus, and Bordetella sp. Keywords: amphophilic to eosinophilic viral intranuclear inclusion bodies,
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
STUDI KASUS: PATOMORFOLOGI
TRAKHEOBRONKHITIS SUPURATIVA PADA KUCING
(
Felis catus
)
SRI RAHAYU RESMAWATI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2015 ini ialah Studi Kasus: Patomorfologi Trakheobronkhitis Supurativa pada Kucing (Felis catus).
Terima kasih penulis ucapkan kepada Drh Vetnizah Juniantito, Ph.D, APVet dan Dr Drh Eva Harlina, MSi, APVet selaku pembimbing yang telah banyak memberikan ilmu, arahan, dan bimbingan dalam penelitian dan penulisan skripsi ini. Ungkapan terima kasih juga disampaikan kepada Drh Min Rahminiwati, MS, Ph.D selaku pembimbing akademik yang telah banyak memberikan motivasinya.
Terima kasih tak terhingga penulis ucapkan kepada orangtua dan seluruh keluarga atas segala doa, motivasi, dan kasih sayangnya. Penulis juga sangat berterima kasih kepada teman-teman terdekat, Teh Pipit, Ulfah, Faisal, Rifky, Dewi, Suci, dan Naim, teman-teman satu pembimbing akademik, Aris, Syauqi, Riska NJ, dan Willa serta teman-teman Ganglion 48 atas dukungan, semangat, dan bantuannya.
Penulis menyadari bahwa dalam penulisan skripsi ini masih terdapat kekurangan, namun penulis berharap semoga skripsi ini bermanfaat.
DAFTAR ISI
DAFTAR GAMBAR vii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
TINJAUAN PUSTAKA 2
METODE 3
Waktu dan Tempat Penelitian 3
Alat dan Bahan 3
Metode Penelitian 4
HASIL DAN PEMBAHASAN 4
Patologi Anatomi Trakheobronkhitis 4
Histopatologi Trakheobronkhitis 5
SIMPULAN DAN SARAN 12
Simpulan 12
Saran 12
DAFTAR PUSTAKA 12
DAFTAR GAMBAR
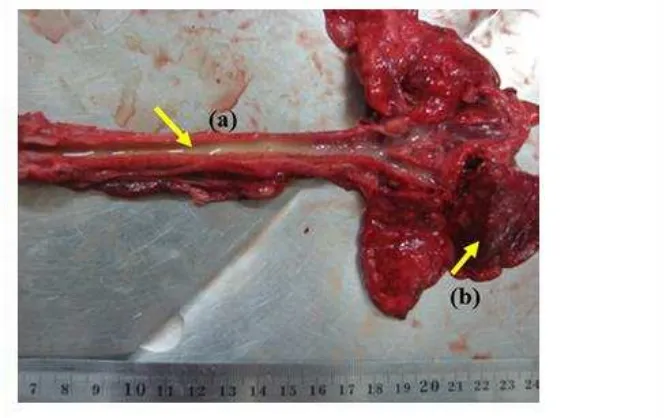
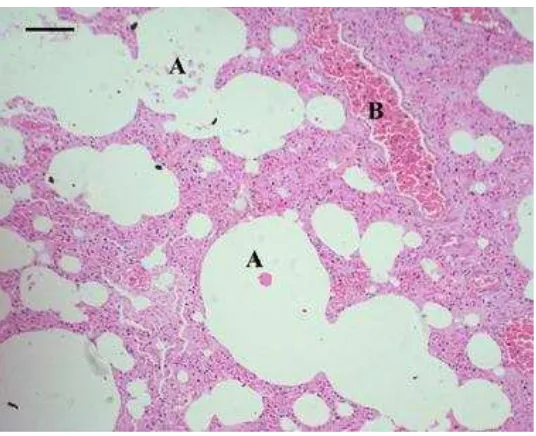
1 Patologi anatomi trakhea dan paru-paru kucing yang mengalami
trakheobronkhitis 5
2 Trakheobronkhitis 6
3 Lesio submukosa trakhea dan badan inklusi amfofilik intranuklear 6
4 Infeksi sekunder pada trakheobronkhitis 7
5 Bronkhopneumonia dan badan inklusi amfofilik intranuklear 8 6 Emfisema pulmonum dan hiperemia pada kapiler paru-paru 9
7 Bronkhiolitis 9
PENDAHULUAN
Latar Belakang
Infeksi saluran respirasi masih menjadi penyakit yang menyebabkan morbiditas dan mortalitas tinggi pada kucing. Kucing sangat rentan terhadap infeksi, baik disebabkan oleh bakteri maupun virus yang sering disebut infeksi saluran respirasi bagian atas (Dallas 2006). Penyakit saluran respirasi yang disebabkan oleh bakteri dapat terjadi akibat bakteri patogen atau proliferasi bakteri normal akibat sistem pertahanan yang lemah (Schulz et al. 2006). Setengah dari kucing yang menderita penyakit respirasi disebabkan oleh infeksi herpesvirus-1, setengah lainnya disebabkan oleh infeksi calicivirus, dan hanya beberapa yang terkena infeksi Chlamydia psittaci (Fenner et al. 1993).
Trakheobronkitis merupakan penyakit saluran respirasi yang sering terjadi pada hewan kecil, terutama anjing dan kucing. Pada anjing, trakheobronkhitis sering disebut penyakit kennel cough yang disebabkan oleh canine adenovirus-2 (CAV-2), virus parainfluenza, dan infeksi Bordetella bronchiseptica (Schlacks dan Ridgway 2012). Pada kucing, penyakit saluran respirasi biasanya disebabkan oleh banyak agen seperti feline herpesvirus-1 (FHV-1), feline calicivirus (FCV), Chlamydophila felis (Chlamydia psittaci), Bordetella bronchiseptica, Mycoplasma spp, dan Cryptococcus neoformans (August dan Bahr 2006).
Pada kasus yang akan dibahas ini adalah dugaan terhadap infeksi feline herpesvirus-1. Feline herpesvirus-1 (FHV-1) atau feline viral rhinotracheitis (FVR) merupakan agen penyakit saluran respirasi atas yang penting pada kucing. Hal ini disebabkan transmisi penyakit yang mudah. Kucing terinfeksi FHV-1 melalui kontak langsung dengan sekreta konjungtival atau oronasal dari kucing yang terinfeksi (Darling 2012). Infeksi biasanya terjadi di tempat penampungan (shelter), menghirup bersin, makan atau minum bersama dengan kucing yang terinfeksi maupun lingkungan. Menurut Burns (2011), kucing di tempat penampungan dapat terinfeksi penyakit saluran respirasi atas yang disebabkan oleh FHV-1. Infeksi FHV-1 biasanya akut, ditandai dengan bersin, konjungtivitis, dan discharge ocunasal yang bersifat serous selama 10−14 hari. Infeksi akut yang tidak khas berupa ulserasi dermal, ulserasi oral, pneumonia, penyakit sistemik, dan tiba-tiba mati. Pada infeksi kronik yang aktif, gejala klinis yang terlihat berupa bersin dan rhinitis dan atau keratitis kronik ulseratif (Darling 2012).
2
Indonesia belum banyak dipublikasikan, sehingga penelitian ini dapat menjadi informasi penting bagi dunia kedokteran hewan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mempelajari patomorfologi kasus trakheobronkhitis supurativa pada kucing.
Manfaat Penelitian
Penelitian ini diharapkan mampu menjelaskan patogenesis kasus trakheobronkhitis supurativa pada kucing melalui pengamatan patologi anatomi dan histopatologi.
TINJAUAN PUSTAKA
Sistem respirasi adalah sistem pertukaran gas oksigen dan karbondioksida antara struktur dalam tubuh dan lingkungannya. Sistem ini dimulai dari hidung, nasofaring, laring, trakhea, bronkhus, bronkhiolus, dan alveoli pada paru-paru (Dallas 2006). Sistem respirasi pada umumnya tersusun atas sel-sel epitel bersilia yang berfungsi sebagai pertahanan dari agen penyakit (Jubb et al. 1993).
Penyakit pada saluran respirasi dapat disebabkan oleh mikroorganisme, seperti bakteri, virus, fungi, dan protozoa. Transmisi penyakit tersebut dapat melalui kontak langsung, tidak langsung (melalui sprei, mangkuk air minum dan pakan), aerosol, air dan makanan yang terkontaminasi, dan hewan pembawa (carrier) (Dallas 2006). Penyakit yang sering terjadi pada kucing yang berumur kurang dari satu tahun adalah penyakit saluran respirasi bagian atas yang disebabkan oleh berbagai agen. Penyakit tersebut umumnya memiliki gejala klinis yang cenderung sama. Sekitar 40% agen yang menyerang saluran respirasi bagian atas yaitu feline herpesvirus-1 (FHV-1) atau feline viral rhinotracheitis (FVR) dan feline calicivirus (FCV) (Little 2008).
3 Feline herpesvirus-1 (FHV-1) menyebabkan penyakit saluran respirasi bagian atas pada kucing umur kurang dari satu tahun. Transmisi FHV-1 dapat terjadi akibat kontak langsung melalui cairan tubuh kucing yang terinfeksi terutama sekresi cairan respirasi dan okular. Masa inkubasi virus ini 24−48 jam dan secara mendadak terjadi bersin, batuk, adanya discharge dari hidung dan mata, konjungtivitis, sesak napas, menurunnya nafsu makan, dan demam (Stiles 2003; Little 2008). Pada infeksi FHV-1 terjadi nekrosis pada epitel rongga respirasi, faring, epiglotis, tonsil, laring, dan trakhea. Pada kucing muda dengan kasus yang berat dapat terjadi bronkhopneumonia (Fenner et al. 1993).
Bordetella bronchiseptica merupakan patogen yang penting pada saluran respirasi pada berbagai hewan, seperti anjing, kucing, babi, dan hewan laboratorium (Bagcigil et al. 2007). Penularan bakteri ini dapat terjadi melalui aerosol (De Jong 1999). Habitat alami dari Bordetella sp. adalah saluran respirasi bagian atas. Bordetella bronchiseptica merupakan patogen utama pada kucing domestik yang menyebabkan trakheobronkhitis, konjungtivitis, dan pneumonia pada kucing. Penyakit ini juga biasanya diikuti oleh agen lain seperti FCV dan FHV-1 (Songer dan Post 2005; Egberink 2009). Infeksi akibat Bordetella sp. pada hewan umumnya menyebabkan bronkhitis kronis pada anjing, atrofi rhinitis pada babi, dan bronkhopneumonia supuratif pada kebanyakan hewan termasuk kucing (Jubb et al. 1993). Infeksi pada anak babi menyebabkan gejala klinis bersin dan discharge hidung yang bersifat serous (Chotiah dan Tarmudji 2007). Menurut Bagcigil et al. (2007), infeksi B. bronchiseptica pada anjing menyebabkan bronkhopneunomonia mukopurulen, terdapat cairan berbusa pada lumen trakhea dan hiperemia yang parah pada permukaan mukosa. Infeksi pada kucing akibat B. bronchiseptica ditandai dengan adanya discharge pada hidung dan mata disertai dengan bersin (Pasmans et al. 2001).
METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan di Divisi Patologi, Departemen Klinik, Reproduksi, dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Penelitian dilaksanakan mulai pada Januari hingga Februari 2015.
Alat dan Bahan
4
Metode Penelitian
Pembuatan Preparat
Organ respirasi yang sudah direndam dalam larutan BNF 10% dipotong dengan ketebalan 0.3−0.5 mm, kemudian disusun ke dalam tissue cassette. Selanjutnya proses dehidrasi, clearing, dan infiltrasi dengan cara merendam jaringan berturut-turut ke dalam larutan alkohol bertingkat 70, 80%, 95%, dan 100%, xylol I dan II, dan paraffin cair masing-masing selama 2 jam. Proses selanjutnya adalah embedding, pencetakan jaringan dalam parafin cair. Blok parafin yang mengandung jaringan kemudian dipotong menggunakan mikrotom dengan ketebalan berkisar 3–4 m, kemudian diletakkan secara hati-hati di atas permukaan air dalam waterbath bersuhu 46 °C, selanjutnya mounting ke gelas objek (Muntiha 2001).
Pewarnaan Preparat
Preparat dicelupkan secara berurutan ke dalam larutan xylol III, xylol II, dan xylol I masing-masing 3 menit (deparafinasi), rehidrasi dengan larutan alkohol 100%, 95%, 80%, dan 70% masing-masing 3 menit, dialiri air mengalir selama 1−2 menit, diwarnai hematoksilin selama 5−7 menit, dan dialiri air mengalir selama 1−2 menit. Selanjutnya preparat dimasukkan ke dalam larutan eosin selama 10−20 menit, dan dialiri air selama 3 menit. Dehidrasi preparat ke dalam alkohol bertingkat 70%, 80%, 95%, dan 100%, dan xylol I dan II masing-masing 3 menit. Selanjutnya ditetesi cairan perekat (Entelan®) dan ditutup dengan kaca penutup. Hasil pewarnaan dapat dilihat di bawah mikroskop (Muntiha 2001). Analisis Data
Perubahan mikroskopis pada preparat dilihat di bawah mikroskop dengan perbesaran 4x, 10x, dan 40x, dan dianalisis secara deskriptif.
HASIL DAN PEMBAHASAN
Patologi Anatomi Trakheobronkhitis
5 semua lobus paru-paru menunjukkan pleuropneumonia yang bersifat fibrinopurulen dan difus. Lesio yang terjadi tergantung dari tempat predileksi replikasi virus. Pada awalnya, inflamasi bersifat serous kemudian menjadi mukopurulen atau fibrinous dalam beberapa hari (Jubb et al. 1993). Menurut Mattoo dan Cherry (2005), perubahan patologi anatomi pada saluran respirasi akibat infeksi B. bronchiseptica seringkali tidak terlihat, namun pada saat pemeriksaan histopatologi menunjukkan trakheobronkhitis.
Histopatologi Trakheobronkhitis
6
silia mukosa saluran respirasi bagian atas pada anak babi yang diinfeksi isolat B. bronchiseptica.
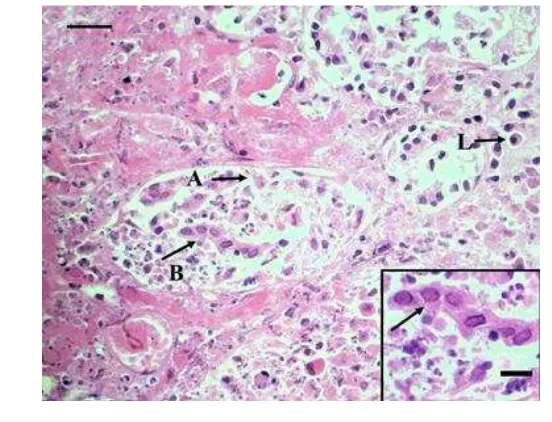
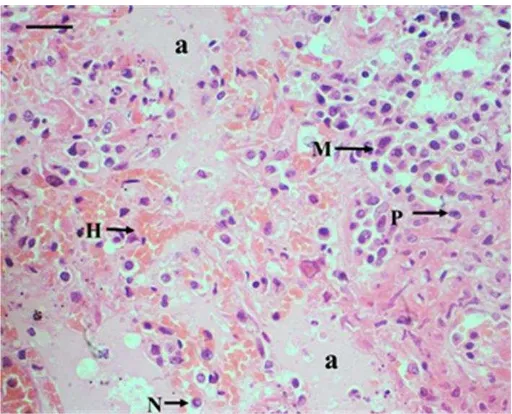
Gambar 2 Trakheobronkhitis. (A) lesio berupa nekrosis pada mukosa dan hilangnya silia sel epitel (panah), (B) nekrosis pada submukosa, (C) tulang rawan hyalin. Pewarnaan HE, bar 100 m.
7
Feline herpesvirus (FHV-1) termasuk ke dalam famili Herpesviridae dan subfamili Alphaherpesvirinae yang menyebabkan rhinotrakheitis dan lesio okular pada kucing (Rantam 2005; Maes 2012). Virus ini termasuk ke dalam virus yang memiliki DNA, berselubung, nukleokapsidnya berbentuk ekosahedris, dan virionnya berukuran 100−200 nm. Replikasi virus ini berlangsung di dalam inti, dan kebanyakan bersifat laten (Rantam 2005). Virus akan menginvasi sel epitel dan menyebabkan permukaan epitel erosi dan inflamasi. Pada sel epitel trakhea juga dapat dilapisi oleh fibrin dan debris sel yang mengalami nekrosis disertai dengan neutrofil yang bermigrasi ke mukosa, sedangkan di submukosa trakhea terdapat infiltrasi limfosit, sel plasma, dan makrofag (Maes et al. 2011). Infiltrasi sel radang limfosit dan sel plasma akibat dari infeksi virus, sedangkan infiltrasi neutrofil terjadi akibat adanya infeksi sekunder yang disebabkan oleh bakteri. Infeksi FHV-1 menyebabkan epitel saluran respirasi menjadi nekrosis multifokus disertai infitrasi neutrofil dan fibrin (Gaskell et al. 2007).
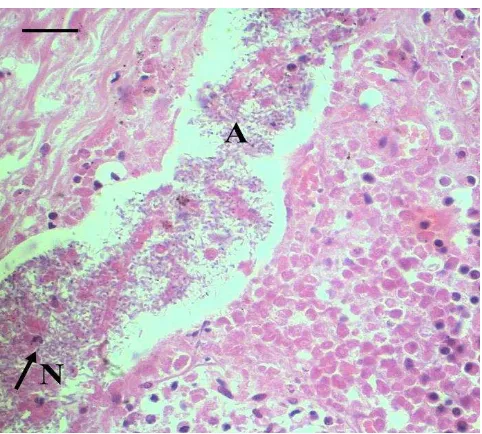
Pada mukosa trakhea juga ditemukan koloni bakteri berbentuk coccobacillus yang berkelompok (Gambar 4). Bakteri ini merupakan infeksi sekunder sehingga mengundang infiltrasi sel radang neutrofil. Infiltrasi sel radang neutrofil menyebabkan radang supuratif. Menurut Foster et al. (2004), bakteri patogen yang sering menginfeksi saluran respirasi kucing adalah Bordetella bronchiseptica, Chlamydia felis, Streptococcus canis, dan Mycoplasma spp., Mycobacterium thermoresistibile, Salmonella typhimurium, Escherichia coli, Pasteurella multocida, Pseudomonas aeruginosa, Streptococcus viridans, dan Staphylococcus intermedius.
Penyakit viral biasanya diikuti dengan infeksi sekunder oleh bakteri. Infeksi FHV-1 sering terjadi bersama dengan B. bronchiseptica atau E. coli yang mengakibatkan pneumonia fibrinonekrotik (Little 2008). Menurut Pasmans et al. (2001), kucing yang terinfeksi bakteri ini biasanya berasal dari tempat penampungan (shelter atau catteries).
8
Bordetella bronchiseptica merupakan patogen utama pada kucing domestik yang menyebabkan trakheobronkhitis, konjungtivitis, dan pneumonia. Penyakit ini juga biasanya diikuti oleh agen lain seperti FCV dan FHV-1 (Songer dan Post 2005; Egberink 2009), sedangkan menurut Rand (2006) bakteri ini berperan dalam infeksi sekunder penyakit tersebut. Pada infeksi yang disebabkan oleh bakteri, trakheobronkhitis biasanya bersifat purulen atau supuratif karena banyaknya neutrofil pada eksudat, sedangkan trakheobronkhitis ulseratif biasanya terjadi akibat infeksi virus atau bakteri yang menyebabkan rusaknya sel-sel epitel (Jubb et al. 1993).
Bordetella sp. termasuk ke dalam famili Alcaligenaceae, Gram negatif, berbentuk coccobacillus baik berkelompok maupun soliter, motil, aerob, tidak membentuk H2S dan asetilmetilkarbinol, serta memiliki host pada silia sel epitel saluran respirasi (Syahrurachman et al. 1994; Datz 2003; Staveley et al. 2007). Banyak spesies dari bakteri ini di antaranya B. bronchiseptica, B. pertussis, B. parapertussis, B. avium, B. hinzii, B. holmesii, B. trematum, dan B. petri. Kerusakan sel yang timbul terjadi karena faktor virulensi bakteri tersebut, diantaranya adhesin, toksin, dan sistem sekresi tipe III khusus pada B. bronchiseptica. Faktor adhesin diantaranya filamentous hemaglutinin (FHA), pertactin, tracheal colonization factor, dan fimbrae, sedangkan toksin pada bakteri ini berupa adenylate cyclasehemolysin, toksin dermonekrotik, dan sitotoksin
trakheal (Parkhill et al. 2003).
Menurut Mattoo dan Cherry (2005), eksudat mukopurulen terdapat pada lumen dan edema pada lamina propria yang ditandai dengan infiltrasi neutrofil. Lesio yang terjadi pada trakhea dan bronkhus diduga karena beberapa faktor virulensi, diantaranya FHA dan fimbriae berperan dalam penempelan pada epitel saluran respirasi, serta sitotoksin trakheal menyebabkan hilangnya sel-sel bersilia dan kerusakan mitokondria.
9
Gambar 6 Emfisema pulmonum (A), hiperemia pada kapiler paru-paru (B). Pewarnaan HE, bar 25 m.
10
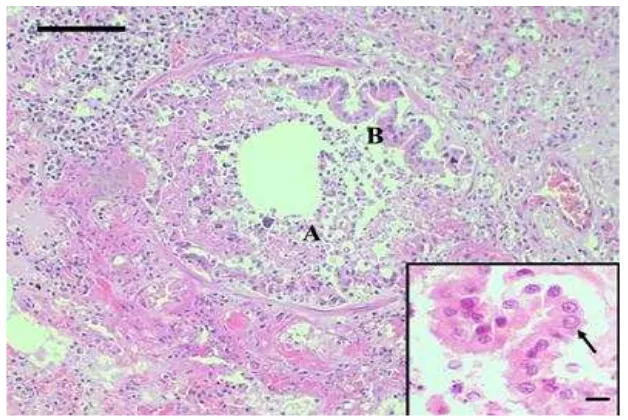
Pada paru-paru, lesio yang ditemukan berupa bronkhiolitis yang ditandai dengan infiltrasi sel radang yang didominasi oleh sel radang neutrofil (Gambar 7). Epitel bronkhiolus mengalami deskuamasi. Selain itu juga terdapat sel radang makrofag, limfosit, dan sel plasma (Gambar 8). Ditemukan juga bronkhopneumonia yang ditandai banyaknya infiltrasi sel radang neutrofil pada jaringan paru-paru (Gambar 5). Hal ini serupa dengan pernyataan Bagcigil et al. (2007). Menurut Maes et al. (2011), paru-paru yang terinfeksi oleh FHV-1 mengalami bronkhopneumonia nekrotikan multifokal, sedangkan menurut Mannsberger et al. (2009), pneumonia pada kucing berupa pneumonia fibrinonekrotik dan nekrosis pada epitel bronkhus dan bronkhiolus. Bronkhopneumonia mukopurulen akibat infeksi B. bronchiseptica dicirikan oleh lesio nekrotik dan hemoragi, eritrosit hemolisis, akumulasi fibrin, dan neutrofil pada jaringan alveolar (Bagcigil et al. 2007). Infeksi akibat Bordetella sp. umumnya menyebabkan bronkhitis kronis pada anjing, atrofi rhinitis pada babi, dan bronkhopneumonia supuratif pada kebanyakan hewan, termasuk kucing (Jubb et al. 1993). Adanya neutrofil, makrofag dan sel debris di dalam lumen bronkhus, bronkhiolus, dan alveolus merupakan ciri bronkhopneumonia supurativa.
11 terjadi dengan bronkhopneumonia akibat ketidakseimbangan aliran udara yang keluar masuk paru-paru (Zachary dan McGavin 2012).
Bentuk badan inklusi biasanya sesuai dengan keberadaan inti yang terwarnai. Ketika diwarna dengan pewarnaan HE, badan inklusi dapat bersifat asidofilik atau basofilik. Namun, tingkat basofiliknya jarang seintensif atau sama dengan warna yang dihasilkan dari membran nukleus. Badan inklusi tersebut terlihat bergranul atau densitasnya tidak merata (Craighead 2000). Badan inklusi amfofilik intranuklear berwarna gelap dan biru keunguan banyak ditemukan di sel epitel kelenjar trakhea (Gambar 3) dan sel epitel bronkhiolus (Gambar 7). Infeksi virus yang memiliki badan inklusi amfofilik intranuklear diantaranya adalah herpesvirus dan adenovirus. Perbedaannya adalah herpesvirus memiliki badan inklusi amfofilik intranuklear sampai eosinofilik yang dikelilingi oleh halo dan titik-titik kromatin ditepinya, sedangkan pada adenovirus memiliki badan inklusi amfofilik atau basofilik yang dikelilingi oleh clear halo dan tanpa titik-titik kromatin ditepinya (Procop dan Pritt 2014).
Craighead (2000) menyebutkan ciri khas infeksi herpesvirus pada manusia (kecuali Gamma herpesvirus) adalah adanya badan inklusi intranuklear yang merupakan hasil dari degenerasi kromatin secara total. Badan inklusi tersebut berbentuk amorf dan dapat juga berbentuk massa bulat yang mengalami kondensasi. Pada inti sel, semua substansi nukleus terganggu dan kromatin yang bersifat basofilik menepi pada membran nukleus. Beberapa ahli patologi juga menyebutkan adanya clear halo. Pada sel tersebut, struktur kromatin hilang dan nukleoplasma tampak bergranul, homogen, amfofilik, dan nukleolus terlihat tidak jelas.
Menurut Sanchez et al. (2012) dan Maes et al. (2011), pada infeksi FHV-1 ditemukan badan inklusi amfofilik intranuklear dengan kromatin ditepinya dan badan inklusi eosinofilik intranuklear yang dikelilingi oleh clear halo, sedangkan menurut Rand (2006), badan inklusi FHV-1 berupa badan inklusi basofilik. Hal ini mengakibatkan adanya dugaan kemungkinan infeksi virus lain, seperti adenovirus. Virus ini sering menginfeksi anjing yang disebut dengan kennel cough (CAV-2) dan hepatitis (CAV-1). Laporan mengenai infeksi adenovirus pada kucing belum banyak dipublikasikan. Studi kasus yang dilakukan oleh Kennedy dan Mullaney (1993) terhadap kucing domestik yang diduga terinfeksi adenovirus menyebutkan ditemukannya partikel adenovirus pada intestinal. Melalui mikroskop elektron, badan inklusi berbentuk bulat eosinofilik dengan amfofilik bergranul, yang ditemukan pada sel endotel arteri koroner. Beberapa nukleus juga hampir terisi dengan badan inklusi basofilik dengan tepi yang dikelilingi oleh sebagian kecil kromatin. Terkadang nukleus basofilik memiliki
batas yang tidak jelas, sehingga disebut “smudge cell”. Selain itu, badan inklusi
hepatitis yang diduga adenovirus pernah dilaporkan pada harimau kumbang (Panthera pardus pardus) oleh Gupta pada tahun 1978 (Kennedy dan Mullaney 1993).
12
neutrofil dan makrofag, serta badan inklusi amfofilik intranuklear pada sel epitel alveolar dan badan inklusi asidofilik intrasitoplasmik di epitel bronkhus. Namun, menurut Yoon et al. (2010) badan inklusi pada sel epitel bronkhial berupa badan inklusi basofilik intranuklear. Kemungkinan adanya infeksi virus lain selain FHV-1 dapat terjadi, namun karena keterbatasan metode diagnostik sehingga informasi mengenai penyebab penyakitnya tidak dapat dipastikan.
SIMPULAN DAN SARAN
Simpulan
Pada studi kasus ini dapat disimpulkan bahwa penyebab trakheobronkhitis supurativa yang terjadi pada kucing diduga oleh infeksi FHV-1 dan adenovirus, yang dicirikan oleh adanya badan inklusi amfofilik dan eosinofilik intranuklear disertai dengan infeksi sekunder bakteri coccobacillus yang diduga adalah dari jenis Bordetella sp.
Saran
Perlu dilakukan penelitian lebih lanjut dengan pewarnaan khusus, seperti imunohistokimia sehingga agen penyebab virus dan bakteri yang menginfeksi kucing ini dapat terlihat lebih jelas. Jika memungkinkan dilakukan pengamatan sel dan jaringan menggunakan Transmissible Electron Microscope (TEM) untuk melihat morfologi dari virus yang menyebabkan lesio.
DAFTAR PUSTAKA
August JR, Bahr A. 2006. Chronic Upper Respiratory Disease: Principles of Diagnosis and Management. Di dalam: August JR, editor. Consultations in Feline Internal Medicine.Volume 5. Philadelphia (US): Elsevier.
Bagcigil AF, Sennazli G, Metiner K, Yildiz F. 2007. A case of death caused by Bordetella bronchiseptica in a dog. J Fac Vet Med Istanbul Univ. 33 (1): 75-83.
Burns RE, Wagner DC, Leutenegger CM, Pesavento PA. 2011. Histologic and molecular correlation in shelter cats with acute upper respiratory infection. J Clin Microbiol. 49(7): 2454-2460.doi: 0.1128/jcm.00187-11.
Chvala S, Benetka V, Mostl K, Zeugswetter F, Spergser J, Weissenbock H. 2007. Simultaneous canine distemper virus, canine adenovirus type 2, and Mycoplasma cynos infection in a dog with pneumonia. Vet Pathol. 44:508 512.doi:10.1354/vp.44-4-508.
13 dalam: Garcia J, Hall M, Merrill L, editor. Small Animal Internal Medicine for Veterinary Technicians and Nurses. Iowa (US): John Wiley & Sons. Datz C. 2003. Bordetella infections in dogs and cats: pathogenesis, clinical signs,
and diagnosis. Compendium. 25(12): 896-901.
De Jong MF. 1999. Progressive and nonprogressive atrophic rhinitis. Di dalam: Straw BE, Allaire SD, Mangeling WL, Taylor DJ, editor. Diseases of Swine. Edisi 8. Iowa (US): Iowa University Pr.
Egberink H, Addie D, Belak S, Baralon CB, Frymus T, Jones TG, Hartmann K, Hosie MJ, Lloret A, Lutz H, et al. 2009. Bordetella bronchiseptica infection in cats. ABCD guidelines on prevention and management. J Feline Med Surg. 11(7): 6104.doi: 10.1016/j.jfms.2009.05.010.
Fenner FJ, Gibbs EPJ, Murphy FA, Rott R, Studdert MJ, White DO. 1993. Virologi Veteriner. Edisi 2. Harya P, penerjemah. Semarang (ID): IKIP Semarang Pr. Terjemahan dari: Veterinary Virology.
Foster SF, Martin P, Allan GS, Barrs VR, Malik R. 2004. Lower respiratory tract infections in cats: 21 cases (1995-2000). J Feline Med Surg. 6: 167–180. Gaskell R, Dawson S, Radford A, Thiry E. 2007. Feline herpesvirus. Vet Res.
38:337-354.doi: 10.1051/vetres:2006063.
Jubb KVF, Kennedy PC, Palmer N. 1993. Pathology of Domestic Animals. Volume 2. San Diego (US): Academic Pr.
Kennedy FA, Mullaney TP. 1993. Dissaminated adenovirus infection in a cat. J Vet Diagn Invest. 5:273-276.
Lakatos B, Knotek Z, Farkas J, Adam E, Dobay O, Nasz I. 1999. Adenovirus infection in cats: an epidemiological survey in the Czech republic. Acta Vet Brno. 68: 275–280.
Little S. 2008. Feline Herpesvirus and Calicivirus. [Internet]. [diunduh 2014 Juli 10]. Tersedia pada: http://veterinarycalendar.dvm360.com/feline herpesvirus-and calicivirus-infections-whats-newproceedings?relcanonical Maes S, Goethem BV, Saunders J, Binst D, Chiers K, Ducatelle R. 2011.
Pneumomediastinum and subcutaneous emphysema in a cat associated with necrotizing bronchopneumonia caused by feline herpesvirus-1. Can Vet J. 52:1119-1122.
Maes R. 2012. Felid herpesvirus type 1 infection in cats: a natural host model for alphaherpesvirus pathogenesis. ISRN Vet Sci: 1-14.doi:10.5402/2012/495830.
Mannsberger SC, Bagot Z, Weissenbock H. 2009. Occurrence, morphological characterization and antigen localization of felid herpesvirus-induced pneumonia in cats: a retrospective study (2000–2006) [Abstrak]. J Compar Pathol [Internet]. [diunduh 2015 April 9]; 141: 163-169. Tersedia pada: http://www.sciencedirect.com/science/article/pii/S0021997509000553. Mattoo S, Cherry JD. 2005. Molecular pathogenesis, epidemiology, and clinical
14
other Bordetella subspecies. J Clin Microbiol. 18(2): 326-382.doi:10.1128/CMR.18.2.326–382.2005.
Muntiha M. 2001. Teknik pembuatan preparat histopatologi dari jaringan hewan dengan pewarnaan hematoksilin dan eosin. Temu Teknis Fungsional Non Peneliti: 156-163.
Parkhill J, Sebaihia M, Preston A, Murphy LD, Thomson N, Harris DE, Holden MTG, Churcher CM, Bentley SD, Mungall KL et al. 2003. Comparative analysis of the genome sequences of Bordetella pertussis, Bordetella parapertussis and Bordetella bronchiseptica. Nature Genetics. 35(1): 32-40. Pasmans F, Acke E, Vanrobaeys M, Haesebrouck F. 2001. Prevalence of Bordetella bronchiseptica infections in cats from different environments. Vlaams Diergeneeskundig Tijdschrift. 70: 124-126.
Pirarat N, Une Y, Nomura Y. 2001. Immunohistochemical detection of feline viral rhinotracheitis in a cat. Thai J Vet Med. 31 (4): 42-46.
Procop GW, Pritt BS. 2014. Pathology of Infectious Diseases: A Volume in the Series: Foundations in Diagnostic Pathology. Edisi 1. Philadelphia (US): Elsevier.
Rand J. 2006. Problem-based feline Medicine. Philadelphia (US): Elsevier. Rantam FA. 2005. Virologi. Surabaya (ID): Airlangga University Pr.
Sanchez MD, Goldshcmidt MH, Mauldin EA. 2012. Herpesvirus dermatitis in two cats without facial lesions. Vet Dermatol. 23: 171-173.doi:10.1111/j.1365-3164.2011.01031.x
Schlacks S, Ridgway MD. 2012. Lower Airway Disease. Di dalam: Garcia J, Merrill L, editor. Small Animal Internal Medicine for Veterinary Technicians and Nurses. Iowa (US): John Wiley & Sons.
Schulz BS, Wolf G, Hartmann K. 2006. Bacteriological and antibiotic sensitivity test results in 271 cats with respiratory infections. Vet Record. 158: 269-270.
Songer JG, Post KW. 2005. Veterinary Microbiology. Missouri (US): Elsevier Saunder.
Staveley CM, Register KB, Miller MA, Brockmeier SL, Jessup DA, Jang S. 2003. Molecular and antigenic characterization of Bordetella bronchiseptica isolated from a wild southern sea otter (Enhydra lutris nereis) with severe suppurative bronchopneumonia. J Vet Diagn Invest. 15:570–574.
Stiles J. 2003. Feline herpesvirus. Clin Tech Small Anim Pract. 18(3): 178-185.doi:10.1053/svms.2003.ysvms28.
Syahrurachman A, Chatim A, Kurniawati A, Santoso AUS, Harun BMH, Bela B, Soemarsono F, Rahim A, Karsinah, Isjah L et al. 1994. Mikrobiologi Kedokteran. Jakarta (ID): Binarupa Aksara.
Yoon SS, Byun JW, Park YL, Kim MJ, Bae YC, Song JY. 2010. Comparison of the diagnostic methods on the canine adenovirus type 2 infection. Basic Applied Pathol. 3: 52–56.doi:10.1111/j.1755-9294.2010.01073.
Zachary JF, McGavin MD. 2012. Pathology Basis of Veterinary Disease. Edisi 5. Missouri (US): Elsevier.
15
RIWAYAT HIDUP
Penulis dilahirkan di Lebak, pada tanggal 3 Februari 1994 dari ayah bernama Endun (Alm) dan ibu Juju Juhaeni. Penulis merupakan putri kedua dari empat bersaudara. Tahun 2011 penulis lulus dari SMA Negeri 1 Rangkasbitung dan pada tahun yang sama penulis diterima di Fakultas Kedokteran Hewan Institut Pertanian Bogor (IPB) melalui jalur SNMPTN Undangan.