DETEKSI KERUSAKAN DNA SPERMATOZOA SAPI
MENGGUNAKAN PEWARNAAN TOLUIDINE BLUE
DAN KIT HALOMAX
®YANG DIMODIFIKASI
LANGGENG PRIYANTO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Deteksi Kerusakan DNA Spermatozoa Sapi Menggunakan Pewarnaan Toluidine Blue dan Kit Halomax®
yang Dimodifikasi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
Langgeng Priyanto
RINGKASAN
LANGGENG PRIYANTO. Deteksi Kerusakan DNA Spermatozoa Sapi Menggunakan Pewarnaan Toluidine Blue dan Kit Halomax® yang Dimodifikasi. Dibimbing oleh R. IIS ARIFIANTINI dan TUTY LASWARDI YUSUF.
Keutuhan deoxyribonucleic acid (DNA) spermatozoa sangat penting dalam keberhasilan fertilisasi dan perkembangan embrio. Tingginya jumlah DNA spermatozoa yang rusak akan menurunkan angka kebuntingan. Terdapat beberapa faktor yang dapat menjadi penyebab rusaknya DNA spermatozoa, seperti kurangnya protamin pada saat spermatogenesis, umur, infeksi, ketidakseimbangan hormonal, paparan zat kimia beracun, obat-obatan, hipertermia testis, apoptosis dan tingginya kadar reactive oxygen species (ROS) pada proses pembekuan dan
thawing.
Beberapa cara dapat digunakan untuk mendeteksi kerusakan DNA pada spermatozoa, seperti metode sederhana dengan prinsip Cytochemical Assays
(pewarnaan Aniline Blue and Toluidine blue) yang dievaluasi menggunakan mikroskop cahaya dan Flow Cytomatic-Based Sperm Chromatin Structure Assay
menggunakan mikroskop fluorescent. Saat ini, tersedia Kit Halomax® (Halotech DNA® SL Madrid, Spanyol) yang dapat mendeteksi kerusakan DNA spermatozoa. Metode ini bekerja berdasarkan sebaran dari kromatin spermatozoa yang dapat dibedakan dalam dua bentuk morfologi spermatozoa, yaitu dari terbentuk atau tidaknya “halo” yang berkorelasi terhadap tingkat sebaran kromatinnya.
Penelitian ini bertujuan untuk menguji beberapa parameter kualitas semen segar dan semen beku, dibandingkan dengan kerusakan DNA spermatozoa yang di evaluasi menggunakan Toluidine Blue dan Kit Halomax® yang telah dimodifikasi.
Penelitian dilakukan di Balai Inseminasi Buatan (BIB) Lembang dan di laboratorium Unit Rehabilitasi Reproduksi (URR), Fakultas Kedokteran Hewan, IPB. Semen dikoleksi menggunakan vagina buatan sebanyak 2 kali dalam seminggu, yang diperoleh dari 8 ekor sapi pejantan unggul (2 Brahman, 2 Ongole, 2 Simental dan 2 Limousin) kemudian dievaluasi secara makroskopis dan mikroskopis (motilitas, viabilitas, konsentrasi, abnormalitas, membran plasma utuh (MPU), tudung akrosom utuh (TAU), dan keutuhan DNA spermatozoa). Kualitas semen yang digunakan dalam penelitian ini harus menunjukkan motilitas >70%, konsentrasi spermatozoa >1000x106 dan abnormalitas spermatozoa <20%. Setelah dikoleksi semen diolah menggunakan pengencer skim kuning telur, selanjutnya dikemas dalam mini straw, diekuilibrasi dan dibekukan dengan N2
cair, dan disimpan dalam kontainer N2 cair untuk pengujian lebih lanjut.
beku 92.06±2.41%. Persentase penurunan kerusakan DNA spermatozoa hanya 1.84%.
Perbandingan persentase keutuhan DNA spermatozoa setelah thawing, menggunakan Toluidine Blue dan Kit Halomax® menunjukkan bahwa Kit
Halomax® (85.44 ±7.52%) lebih rendah (P <0.05) dibandingkan dengan Toluidine
Blue (92.06 ±2.41%).
Kesimpulan yang diperoleh dalam penelitian ini adalah semen segar dan semen beku sapi yang terdapat BIB Lembang mempunyai kualitas yang baik. Kit
Halomax® lebih akurat dibandingkan dengan Toluidine Blue untuk mendeteksi
kerusakan DNA serta tidak terdapat hubungan antara parameter kualitas semen segar dan semen beku yang diuji kecuali pada motilitas dan viabilitas spermatozoa. Kerusakan DNA spermatozoa pada sapi pejantan yang digunakan dalam penelitian ini sangat kecil (3-5%). Hasil ini dapat digunakan sebagai standar kualitas kerusakan DNA spermatozoa untuk dibandingkan dengan sapi pejantan lain, terutama sapi pejantan dengan masalah reproduksi.
SUMMARY
LANGGENG PRIYANTO. Detection of DNA Damage in Bulls Sperm Using Toluidine Blue Staining and Kit Halomax® modified. Supervised by R. IIS ARIFIANTINI and TUTY LASWARDI YUSUF.
Integrity of sperm deoxyribonucleic acid (DNA) is very important in the success of fertilization and embryo development. High number of sperm DNA damage will decrease the success rate of pregnancy. There are many factors can make sperm DNA damage, such as lack of protamine during spermatogenesis, age, infection, hormone imbalance, toxic chemicals exposure, drugs, testes hyperthermia, apoptosis, and high level of reactive oxygen species in freezing process and thawing.
Several technique has been used to detect DNA damage in sperm, such as simple method with cytochemical assay (Aniline blue and Toluidin blue staining) evaluated using light microscope, and flow cytomatic-based sperm chromatin structure assay, analyzed by fluorescence microscope. Nowadays, there is Halomax® (Halotech DNA® SL Madrid Spain) kit, which available to detect DNA damage in sperm. This method based on the sperm chromatin dispersion, which can differentiate into two sperm different morphology, depend on the presence of “haloes” correlated with level of chromatin dispersion.
The aims of this study were to examine several semen quality parameters in fresh and frozen semen, compared with sperm DNA damage evaluated using Toluidine blue stained and Halomax® modified Kit.
The study was conducted at AI center, Lembang and Unit Rehabilitation of Reproduction (URR), Faculty of Veterinary Medicine, IPB. Semen was collected using artificial vagina, twice a week from 8 bulls (2 Brahman, 2 Ongole, 2 Simental and 2 Limousine), then evaluated macros and microscopically (sperm motility, viability, concentration, abnormality, plasma membrane intact (MI), acrosome intact (IA) and DNA integrity). Semen quality used in this study must have >70% motility, >1000.106 sperm concentration, and <20% abnormality. After collection and evaluation the semen than diluted with skim egg yolk diluents, packed in ministraw, equilibrated and froze above liquid N2, stored in liquid N2 container for further examination.
The results showed that bull fresh semen used in this study have a good quality and can processed into frozen semen. The quality of semen after freezing and thawing decrease significantly (p<0.05) on the motility, viability, MI and AI spermatozoa compared to fresh semen. High decreased of semen quality demonstrated by motility (28.3%), followed by viability (21.6%), MI (14.1%) and AI (11.8%). There were no significant different (p>0.05) on the spermatozoa DNA integrity of fresh semen 93.91 ± 4.77% and frozen semen 92.06 ± 2.41 % (P>0.05). Decrease in spermatozoa DNA damage is low only 1.84%.
Comparison of DNA spermatozoa intact after thawing using TB and halomax® demonstrated that halomax was 85.44±7.52% lower (p<0.05) compared to TB 92.06±2.41%.
viability of spermatozoa. Sperm damage in good quality bull used in this study was small (3-5%). This result can be used as DNA standard quality for comparison to another bull, especially bull with the reproductive problems.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Reproduksi
DETEKSI KERUSAKAN DNA SPERMATOZOA SAPI
MENGGUNAKAN PEWARNAAN TOLUIDINE BLUE
DAN KIT HALOMAX
®YANG DIMODIFIKASI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karuniaNya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian ini berkaitan dengan penggunaan pewarnaan Toluidine Blue dan Kit Halomax® untuk deteksi kerusakan DNA spermatozoa sapi. Balai inseminasi buatan yang ada di Indonesia belum ada yang menggunakan di dalam parameter pemeriksaan kualitas semen segar maupun semen beku. Kerusakan DNA spermatozoa sapi sangat penting di dalam perkembangan embrio, karena bagaimanapun kualitas DNA spermatozoa penting di dalam program inseminasi buatan, sedangkan ketergantungan akan inseminasi buatan pada sapi lebih dari 90% tergantung pada kesedian straw yang ada di balai-balai inseminasi buatan yang ada di Indonesia.
Karya ilmiah ini juga berisikan informasi mengenai protokol analisis penggunakan pewarnaan Toluidine Blue dan Kit Halomax® untuk deteksi kerusakan DNA spermatozoa sapi yang tepat dan selanjutnya dapat dipergunakan sebagai bahan referensi untuk pemeriksaan peneguhan diagnosa di dalam pemeriksaan DNA spermatozoa beberapa sapi pejantan yang ada di balai inseminasi buatan yang ada di Indonesia.
Pada kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada Prof Dr Dra R. Iis Arifiantini MSi selaku ketua komisi pembimbing dan Prof Dr drh Tuty Laswardi Yusuf MS selaku anggota komisi pembimbing atas bimbingan dan arahannya sehingga tesis ini dapat diselesaikan secara sempurna. Terima kasih saya ucapkan juga kepada Prof Dr drh Bambang Purwantara MSc selaku penguji luar komisi, serta Prof Dr drh Mohamad Agus Setiadi selaku ketua Program Studi Biologi Reproduksi Pascasarjana IPB. Ucapan terima kasih juga penulis sampaikan kepada seluruh dosen Program Studi Biologi Reproduksi Pascasarjana IPB. Terima kasih tidak lupa saya ucapkan kepada Balai Inseminasi Buatan Lembang beserta staf dan kepala Unit Rehabilitasi Reproduksi FKH IPB beserta staf yang telah bersedia menyediakan tempat untuk penelitian ini. Terima kasih saya ucapkan kepada Direktorat Jenderal Pendidikan Tinggi Departemen Pendidikan Nasional melalui Rektor IPB yang telah mendanai penelitian ini.
Karya ilmiah ini didedikasikan untuk istri tersayang ‘Indah Agustina Ekowati’ dan anak-anakku tercinta ‘Aisyah Mahasiwi Az zahro’ dan ‘Asmi Khalid Amrulloh’ yang tidak ada lelahnya memberi motivasi dan dukungannya selama penulis menempuh studi. Tidak lupa rekan-rekan mahasiswa Program Studi Biologi Reproduksi 2012 atas bantuan dan kebersamaannya saya ucapkan terima kasih. Akhirnya, semoga karya ilmiah berupa tesis ini dapat memberikan informasi yang bermanfaat dan berguna bagi semuanya.
Bogor, September 2014
DAFTAR ISI
3 METODE PENELITIAN 15 Tempat dan Waktu Penelitian 15
4 HASIL DAN PEMBAHASAN 20
Kualitas Semen Segar 20
DAFTAR ISI (lanjutan)
Evaluasi Kerusakan DNA Spermatozoa Sebelum dan Setelah
Pembekuan dengan Pewarnaan Toluidine Blue pada Berbagai Bangsa 22 Perbandingan Kerusakan DNA Spermatozoa Semen Beku dengan
Toluidine Blue dan Kit Halomax® 24
Hubungan Kerusakan DNA Spermatozoa Setelah Pembekuan dengan
Parameter Kualitas Semen Lainnya 26
5 SIMPULAN DAN SARAN 29
DAFTAR PUSTAKA 30
DAFTAR TABEL
1 Hasil pemeriksaan kualitas semen segar sapi 21
2 Kualitas semen segar dan semen beku sapi 23
3 Penurunan kerusakan DNA semen segar dan semen beku sapi dari berbagai bangsa yang diuji menggunakan pewarnaan Toluidine Blue
24 4 Pemeriksaan DNA spermatozoa semen beku sapi dari berbagai bangsa
yang diuji menggunakan Toluidine Blue dan Kit Halomax®
26
5 Rerata kualitas semen beku dari berbagai bangsa 27
DAFTAR GAMBAR
1 Diagram Venn untuk menunjukkan sub-populasi spermatozoa dalam satu ejakulat yang mampu melakukan fertilisasi
5
2 Morfologi spermatozoa sapi 6
3 Proses spermatogenesis 9
4 Fase Golgi 10
5 Fase tudung dan akrosom 11
6 Fase pematangan 12
7 Pewarnaan Toluidine Blue pada spermatozoa 25
PENDAHULUAN
Latar Belakang
Balai Inseminasi Buatan (BIB) dan Balai Inseminasi Buatan Daerah (BIBD) adalah instansi pemerintah yang bertanggung jawab dalam produksi semen beku yang beredar di Indonesia. Kualitas semen beku sangat ditentukan oleh beberapa faktor di antaranya adalah faktor sumber daya manusia, pejantan sebagai sumber semen, peralatan dan jenis pengencer yang digunakan. Pengujian mutu semen beku berdasarkan Badan Standardisasi Nasional (BSN) hanya menguji motilitas dan skoring individu (SNI 4869.1:2008). Padahal menurut Morrell dan Rodriguez-Martinez (2009) untuk dapat membuahi sel telur spermatozoa harus hidup, motil, mempunyai morfologi dan kromatin Deoxyribonucleic acid (DNA) yang baik.
Pada sapi tingginya spermatozoa dengan kromatin yang abnormal menyebabkan fertilitas yang rendah dan menyebabkan kegagalan kebuntingan (Bochenek et al. 2010). Kerusakan DNA dapat diakibatkan karena terganggunya proses spermatogenesis. Hal tersebut dapat disebabkan oleh pengaruh stres lingkungan, mutasi gen dan abnormalitas pembentukan kromatin (Lewis dan Aitken 2005), sehingga menyebabkan kelainan susunan DNA spermatozoa. Faktor lain yang dapat menyebabkan kerusakan DNA adalah proses pembekuan semen, dengan adanya penurunan suhu ektrim. Pengaruh komposisi pengencer yang berakibat terbentuknya kristal-kristal es. Kristal es dapat menyebabkan penurunan dari motilitas, viabilitas, membran plasma, tudung akrosom dan kerusakan DNA spermatozoa.
Fertilisasi dengan menggunakan spermatozoa yang mengalami kerusakan DNA akan menghambat perkembangan embrio, menurunkan kemampuan implantasi, serta mengakibatkan gagalnya kebuntingan sehingga akan memperpanjang calving interval (Seli et al. 2004; Virro et al. 2004). Hal tersebut diperkuat oleh pernyataan Vassilev et al. (2005) melaporkan kejadian kematian embrio dini setelah 35 hari inseminasi menggunakan semen beku adalah 5.45%−13.21%. Kematian embrio dini ini akan menyebabkan siklus estrus yang panjang (prolong estrus) sehingga akan menimbulkan kerugian bagi peternak akibat panjangnya calving interval (Vassilev et al. 2005).
Kerusakan DNA telah dievaluasi oleh beberapa peneliti dengan beberapa teknik diantaranya Sperm Chromatin Structur Assay (SCSA), Comet Assay,
Terminal Deoxynucleotidyl Transferase Nick end Labeling (TUNEL) dan
Cytochemical Assays, (Kim et al. 2013). Cytochemical Assays menggunakan
Toluidine Blue (TB) merupakan teknik yang sensitif, sederhana dan murah serta
tidak membutuhkan alat yang khusus seperti Flow Cytometry. Pada DNA yang sempurna akan terdapat pada spermatozoa yang sudah matang sempurna.
Selain teknik yang sudah disebutkan di atas pada saat ini dipasaran juga tersedia kit untuk melihat kerusakan DNA diantaranya adalah Kit Halomax®
(Halotech DNA® SL Madrid Spanyol) dan telah digunakan untuk mendeteksi kerusakan DNA pada sapi (García-Macías et al. 2007) menggunakan mikroskop
2
Mikroskop fluorescent masih sulit ditemukan di BIB, sehingga perlu dilakukan modifikasi pengujian DNA dengan Kit Halomax® agar bisa dievaluasi menggunakan mikroskop cahaya. Mengingat fungsi DNA sangat penting dalam fertilisasi maka penelitian ini dilakukan untuk mendeteksi kerusakan DNA akibat pembekuan dan untuk membandingkan teknik pengujian DNA dengan Toluidine
Blue dan Kit Halomax® yang dimodifikasi.
Kerangka Pemikiran
Deoxyribonucleic acid (DNA) spermatozoa dapat rusak pada saat proses
spermatogenesis berlangsung dan disebabkan karena faktor hormon, kekurangan protamin, faktor umur, infeksi, pemaparan zat kimia atau pemaparan racun, rokok, obat-obatan, hipertermia testis, apoptosis dan tingginya kadar reactive oxygen
species (ROS). Kerusakan DNA pada spermatozoa dapat juga terjadi disaat
pembekuan dan saat thawing, dimana spermatozoa mengalami perubahan suhu yang ekstrim menyebabkan kerusakan sel, menurunkan motilitas, viabilitas, keutuhan membran plasma dan merusak DNA spermatozoa.
Deoxyribonucleic acid (DNA) merupakan suatu polimer heliks ganda yang
terdiri dari nukleotida, setiap nukleotida terdiri dari tiga komponen; satu basa nitrogen, satu gula pentosa yang disebut deoksiribosa dan satu gugus fosfat. Basa nitrogennya bisa adenin (A), timin (T), guanin (G), atau sitosin (S). Adenin dan guanin adalah purin, basa nitrogen dengan dua cincin organik. Sebaliknya, sitosin dan timin adalah anggota famili basa nitrogen yang dikenal sebagai pirimidin yang mempunyai satu cincin tunggal.
Kerusakan DNA dapat terjadi karena perubahan polimer DNA dan secara terus menerus terpapar pada lingkungan fisik dan kimia yang sangat bervariasi yang berpotensi mengubah struktur alamiah DNA tersebut. Perubahan ini akan memengaruhi proses replikasi dan transkripsi DNA yang mengarah pada kerusakan DNA. Bentuk kerusakan yang lain adalah terputusnya struktur polimer DNA. Pemanasan yang melebihi 37 oC akan menyebabkan terputusnya ikatan glikosida yang menghubungkan basa nitrogen dan struktur gula fosfat sehingga basa nitrogen akan hilang.
Selama spermatogenesis, protein pelindung spermatozoa yang disebut histon akan digantikan oleh protamin. Perubahan ini akan menentukan kualitas proses kondesasi kromatin yang dapat dideteksi melalui pewarnaan Toluidine Blue
dan Kit Halomax®. Semakin kompak kondensasi yang terjadi, maka warna biru
terang akan muncul, sebaliknya pada kondensasi yang kurang kompak warna biru tua akan muncul. Sedangkan gambaran pada Kit Halomax® semakin kompak kondensasi maka kepala spermatozoa tidak akan berpedar, sedangkan pada kondensasi yang kurang kompak maka kepala spermatozoa akan berpendar. Kondensasi yang kurang kompak berkorelasi positif dengan abnormalitas kromatin dan DNA spermatozoa.
3
Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Mengevaluasi kerusakan DNA pada semen segar dan semen beku menggunakan pewarnaan Toluidine Blue.
2. Membandingkan pengujian kerusakan DNA pada semen beku menggunakan Toluidine Blue dan Kit Halomax®.yang dimodifikasi.
3. Mempelajari hubungan antara kerusakan DNA dengan parameter kualitas semen beku lainnya (membran plasma utuh, tudung akrosom utuh, motilitas dan viabilitas).
Manfaat Penelitian
Adapun manfaat yang diharapkan dari pelaksanaan penelitian ini adalah : 1. Memperoleh standardisasi tingkat kerusakan DNA spermatozoa pada sapi
sehingga dapat menentukan diagnosis terhadap sapi-sapi yang mengalami penurunan fertilitas.
2. Diperoleh teknik sederhana, murah dan aplikatif untuk menguji kerusakan DNA hasil pembekuan agar kualitas semen beku dapat ditingkatkan. 3. Memberikan bantuan kepada balai-balai inseminasi buatan untuk menguji
DNA spermatozoa sapi-sapi yang diduga kurang fertil.
Hipotesis
1. Deteksi kerusakan DNA spermatozoa menggunakan Toluidine Blue sama baiknya dengan Kit Halomax®.
2. Kerusakan DNA tidak berhubungan dengan parameter kualitas semen beku lainnya.
TINJAUAN PUSTAKA
Balai Inseminasi Buatan dan Teknik Pengujian Spermatozoa
4
Sampai saat ini keberhasilan IB masih rendah terbukti dari tingkat impor daging atau bakalan yang masih tinggi, sehingga menimbulkan ketergantungan ke negara lain. Sudarsono (2009) dalam laporannya menyatakan di daerah Indonesia Timur menunjukkan, persentase sapi yang tidak bunting pada tahun 2005 sampai dengan tahun 2009 berkisar antara 45%-65% dan ada kecenderungan tiap tahun terus meningkat.
Penggunaan sapi jantan yang ada di BIB dan BIBD dipilih berdasarkan seleksi dari sapi jantan yang telah lulus uji progeny dan lolos dalam seleksi pejantan menggunakan breeding soundness evaluation (BSE). Breeding soundness
evaluation merupakan teknik untuk mengidentifikasi kesuburan dari pejantan
secara individu (Allexander 2008). Teknik ini telah diterapkan pada sapi (Godfrey dan Dodson 2005; Al-Makhzoomi et al. 2007). Secara umum BSE terdiri atas tiga bagian yaitu evaluasi fisik (evaluasi pada organ genital eksternal dan eksplorasi rektal), pengukuran lingkar skrotum dan analisis kualitas spermatozoa. Analisis yang umum dilakukan adalah konsentrasi, motilitas dan morfologi spermatozoa (Al-Makhzoomi et al. 2007), gerakan massa (Fitzpatrick
et al. 2002) dan integritas akrosom (Hoflack et al. 2006).
Penilaian kualitas semen berbeda-beda, secara umum dinilai berdasarkan jumlah spermatozoa, motilitas dan abnormalitas spermatozoa (Colenbrander et al.
2003). Selain itu terdapat parameter tambahan, yaitu keutuhan membran plasma dan keutuhan kromatin (Graham 2001; Rodriguez-Martinez 2007). Menurut Morrell dan Rodriguez-Martinez (2009), terdapat hubungan yang kuat antara fertilitas dan motilitas post-thawing, jumlah akrosom normal, keutuhan membran plasma, serta abnormalitas spermatozoa pada sejumlah spesies seperti pada kerbau (Ahmad et al. 2003), sapi (Al-Makhzoomi et al. 2008), dan morfologi spermatozoa, integritas kromatin dan pregnancy rates pada kuda (Morrell et al. 2009).
Penilaian terhadap motilitas dan konsentrasi spermatozoa telah berkembang dengan baik di Indonesia, beberapa BIB telah dilengkapi dengan computerized
assisted sperm analyzed (CASA). Di sisi lain, penilaian terhadap morfologi
5
Gambar 1 Diagram Venn untuk menunjukkan sub-populasi spermatozoa dalam satu ejakulat yang mampu melakukan fertilisasi (Morrell dan Rodriguez-Martinez 2009)
Fisiologi Semen dan Morfologi Spermatozoa
Semen adalah cairan yang disekresikan dari organ kelamin jantan yang keluar pada saat ejakulasi terdiri atas plasma semen dan sel kelamin jantan atau gamet jantan pembawa materi genetik, yang terbagi atas bagian kepala dan bagian ekor. Johnson et al. (1997) menyatakan bahwa spermatozoa terdiri atas kepala dan ekor yang keseluruhannya diselubungi oleh membran plasma. Bagian kepala spermatozoa pada hewan ruminansia berbentuk oval, datar dengan nukleus terdiri atas kromatin yang kompak. Jumlah kromosom yang terdapat pada spermatozoa adalah haploid atau setengah dari jumlah DNA sel somatik pada spesies yang sama, yang dihasilkan dari pembelahan miosis yang terjadi selama pembentukan spermatozoa (Ball dan Peters 2004).
Gilbert (1994) menyatakan bahwa spermatozoa terdiri atas suatu inti haploid, sistim penggerak spermatozoa dan kumpulan enzim yang dapat membantu kepala spermatozoa memasuki sitoplasma oosit pada saat fertilisasi. Inti haploid akan mengalami perubahan, demikian halnya dengan DNA akan mengalami pemadatan juga. Lebih lanjut dikatakan bahwa di depan inti sel spermatozoa terdapat akrosom yang berasal dari aparatus golgi dan mengandung banyak enzim-enzim.
Motilitas
Keutuhan DNA Viabilitas
6
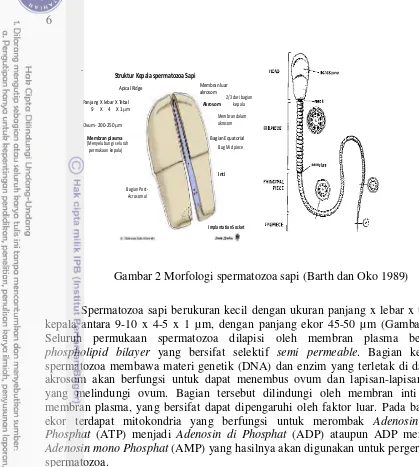
Struktur Kepala spermatozoa Sapi
Panjang X lebar X Tebal 9 X 4 X 1 µm
Gambar 2 Morfologi spermatozoa sapi (Barth dan Oko 1989)
Spermatozoa sapi berukuran kecil dengan ukuran panjang x lebar x tebal kepala antara 9-10 x 4-5 x 1 µm, dengan panjang ekor 45-50 µm (Gambar 2). Seluruh permukaan spermatozoa dilapisi oleh membran plasma berupa
phospholipid bilayer yang bersifat selektif semi permeable. Bagian kepala
spermatozoa membawa materi genetik (DNA) dan enzim yang terletak di dalam akrosom akan berfungsi untuk dapat menembus ovum dan lapisan-lapisan sel yang melindungi ovum. Bagian tersebut dilindungi oleh membran inti dan membran plasma, yang bersifat dapat dipengaruhi oleh faktor luar. Pada bagian ekor terdapat mitokondria yang berfungsi untuk merombak Adenosin Tri
Phosphat (ATP) menjadi Adenosin di Phosphat (ADP) ataupun ADP menjadi
Adenosin mono Phosphat (AMP) yang hasilnya akan digunakan untuk pergerakan
spermatozoa.
Pergerakan spermatozoa sendiri dilakukan oleh fibril-fibril atau aksonema dalam jumlah tertentu dengan bantuan energi dari mitokondria tadi ataupun dari media lingkungan. Lapisan plasma terdiri dari glikoprotein, phospholipid dan lemak dimana susunannya dapat berubah apabila dalam lingkungan yang kurang sesuai. Proses pembekuan semen dapat memengaruhi kerusakan membran plasma dan berakibat pada kerusakan DNA.
Semen Beku
7 Untuk menghasilkan semen beku yang berkualitas dibutuhkan bahan pengencer yang mampu mempertahankan kualitas spermatozoa selama proses pendinginan, pembekuan maupun pada saat thawing (Aboagla dan Terada 2004). Pengencer semen beku harus mengandung sumber nutrisi, buffer, bahan anti cold
shock, antibiotik, dan krioprotektan yang dapat melindungi spermatozoa selama
proses pembekuan (Arifiantini et al. 2005).
Bahan pengencer semen mempunyai fungsi, antara lain sebagai sumber energi, melindungi spermatozoa terhadap kerusakan akibat pendinginan yang cepat (anti cold shock), sebagai penyangga (buffer) yang mencegah efek membahayakan terhadap perubahan pH akibat terbentuknya asam laktat, mempertahankan tekanan osmotik dan keseimbangan elektrolit, menghambat pertumbuhan bakteri, menambah volume semen, dan melindungi sel spermatozoa selama proses pembekuan (krioprotektan). Secara umum bahan pengencer terdiri atas tiga bagian, yaitu 1) bahan dasar seperti kuning telur dan susu, 2) buffer
seperti natrium-kalium karbonat, asam sitrat dan tris, 3) bahan tambahan, seperti gliserol dan antibiotik.
Sumber nutrisi yang paling banyak digunakan adalah karbohidrat terutama fruktosa yang paling mudah dimetabolisme oleh spermatozoa (Toelihere 1993). Gazali dan Tambing (2002) menjelaskan bahwa beberapa jenis pengencer yang sering digunakan dalam pembekuan semen antara lain glukosa, laktosa, sukrosa, sitrat, susu skim dan tris. Glukosa, laktosa dan sukrosa merupakan sumber energi sehingga spermatozoa tetap bertahan hidup selama proses pembekuan. Buffer
yang umum digunakan adalah tris (tris hydroxymethylaminomethan) yang mempunyai kemampuan sebagai penyangga yang baik dengan toksisitas yang rendah dalam konsentrasi yang tinggi. Gazali dan Tambing (2002) menyatakan bahwa tris memiliki kelebihan sebagai bahan pengencer karena memiliki kapasitas sebagai buffer yang baik dan mampu mempertahankan tekanan osmotik karena mengandung garam-garam dan asam amino. Sitrat dapat juga digunakan juga sebagai buffer sehingga dapat mempertahankan pH semen secara fisiologis.
Anti cold shock, perlu ditambahkan dalam bahan pengencer agar dapat melindungi spermatozoa pada saat perubahan suhu dari suhu ruang (28 oC) pada saat pengolahan ke suhu ekuilibrasi (5 oC) karena akan menurunkan motilitas dan viabilitas sel. Anti cold shock yang umum ditambahkan adalah kuning telur atau yang dapat melindungi membran spermatozoa sapi pada saat pendinginan. Ada dua tipe kerusakan pada sel akibat cold shock dapat terjadi secara langsung dan tidak langsung (Gazali dan Tambing 2002). Dijelaskan lebih lanjut bahwa kerusakan langsung akan memengaruhi struktur dan fungsi seluler, misalnya penurunan proses metabolisme spermatozoa, sedangkan kerusakan tidak langsung sulit untuk diamati dan baru terlihat setelah proses pencairan kembali. Pengaruh utama dari cold shock terhadap sel spermatozoa ialah penurunan motilitas, viabilitas dan perubahan komponen lipid seperti phospholipid dan kolesterol yang sangat berperan dalam mempertahankan integritas membran plasma, serta penurunan kemampuan sel spermatozoa untuk mengontrol aliran Ca2+ (Ogbuewu
et al. 2010).
8
untuk mengatasi permasalahan di atas di antaranya penggunaan gliserol secara perlahan untuk mencegah osmotic shock serta pemberian kesempatan ekuilibrasi atau adaptasi untuk keseimbangan molekuler antara spermatozoa dengan bahan pengencer.
Kriopreservasi semen pada sapi sebagian besar masih menggunakan gliserol sebagai krioprotektan. Gliserol, bersama metanol dan etilen glikol termasuk kelompok krioprotektan yang dapat menembus ke dalam sel spermatozoa. Namun, jika gliserol digunakan dalam konsentrasi tinggi maka akan memiliki beberapa toksisitas dan krioprotektan tersebut akan menyebabkan kerusakan terbesar untuk spermatozoa karena permeabilitasnya menembus membran plasma spermatozoa lebih rendah dari pada air dan krioprotektan lainnya (Guthrie et al. 2002).
Dalam proses kriopreservasi (pembekuan) semen, akibat perlakuan suhu yang sangat rendah (-196 °C) akan terbentuk kristal-kristal es dan peningkatan konsentrasi elektrolit intraseluler yang menyebabkan kerusakan sel spermatozoa. Untuk mengurangi efek ini, di dalam pengencer harus ditambahkan senyawa krioprotektan. Selain gliserol yang berperan sebagai krioprotektan intraseluler, juga dikenal berbagai macam gula seperti laktosa yang dapat berfungsi sebagai krioprotektan ekstraseluler (Rizal et al. 2008).
Spermatogenesis
Spermatogenesis adalah proses pembentukan spermatozoa yang sangat penting dalam proses reproduksi hewan jantan dengan melibatkan serangkaian peristiwa di dalam sel-sel germinal yang berperan penting di dalam merubah spermatogonia menjadi spermatozoa. Spermatogenesis dikendalikan oleh hormon gonadotropin yaitu follicle stimulating hormone (FSH) dan luteinizing hormone
(LH) (Garner dan Hafez et al. 2000). Selama proses tersebut jumlah kromosom akan direduksi dari diploid menjadi haploid (n) pada setiap selnya. Fuentes-Mascorro et al. (2000) menyatakan bahwa spermatogenesis merupakan suatu proses yang unik dan melibatkan serangkaian perubahan seperti pembelahan mitosis dan meiosis, penggantian histon oleh protein dan pembentukan protamin yang membuat struktur kromatin DNA inti spermatozoa sangat kompak.
Deoxyribonucleic acid spermatozoa terangkai sedemikian rupa sehingga kromatin
yang ada di dalam inti sel menjadi sangat kompak dan stabil. Struktur yang kompak dan menyerupai kekuatan kristal tersebut dibentuk oleh suatu protein sederhana yaitu protamin.
9 pembelahan meiosis hingga dihasilkan spermatid yang membawa kromosom haploid. Spermatogenesis sangat bergantung pada kondisi tubulus seminiferus yang optimal, dimulai saat pubertas dan biasanya menurun pada saat umur tua. Pada sapi proses spermatogenesis berlangsung 54 hari (Susilawati 2011) dengan tahapan sebagai berikut :
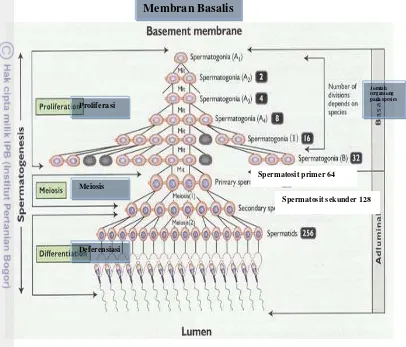
Gambar 3 Proses spermatogenesis (Senger 2005)
Spermatositogenesis
Selama perkembangan embrio, sel khusus germinal primordial berpindah dari bagian kantong kuning telur pada gonad embrio yang belum terdeferensiasi. Setelah fetus sel primordial berubah menjadi gonosit pada ternak jantan dan terus mengalami deferensiasi (Garner dan Hafez 2000).
Sebelum pubertas sudah terbentuk spermatogonia tipe Ao yang berasal dari membran basalis. Spermatogonia tipe A1 secara progresif membelah menjadi A2, A3 dan A4. Kemudian membentuk tipe intermediate dan selanjutnya membelah menjadi spermatosit. Proses pembelahan di atas adalah pembelahan mitosis (2N menjadi 2N). Selanjutnya spermatosit primer membelah menjadi spermatosit sekunder disebut dengan miosis I, sedangkan pembelahan spermatosit sekunder menjadi spermatid disebut meiosis II.
Sel tipe A2 tidak hanya membelah yang akhirnya menjadi spermatozoa akan tetapi juga membentuk stem sel yaitu spermatogonia tipe A1, walau masih
Membran Basalis
Spermatosit sekunder 128 Spermatosit primer 64
Proliferasi
Meiosis
Deferensiasi
10
tetap ada spermatogonia tipe Ao yang merupakan cadangan dan populasi dari stem sel. Sel tipe A4 membelah membentuk intermediate spermatogonia (tipe In) dan selanjutnya membentuk spermatogonia tipe B (Garner dan Hafez 2000). Spermatogonia tipe B membelah menjadi lebih kecil dan menjadi 2 spermatosit primer. Spermatosit primer mengalami pembelahan miosis yaitu profase yang terdapat tahapan pre leptotene, leptotene, zygotene, pachytene dan diplotene sebelum menjadi spermatosit sekunder. Masing-masing spermatosit sekunder selanjutnya akan menjalani proses meiosis II untuk menghasilkan dua buah spermatid haploid (Garner dan Hafez 2000).
Spermiogenesis
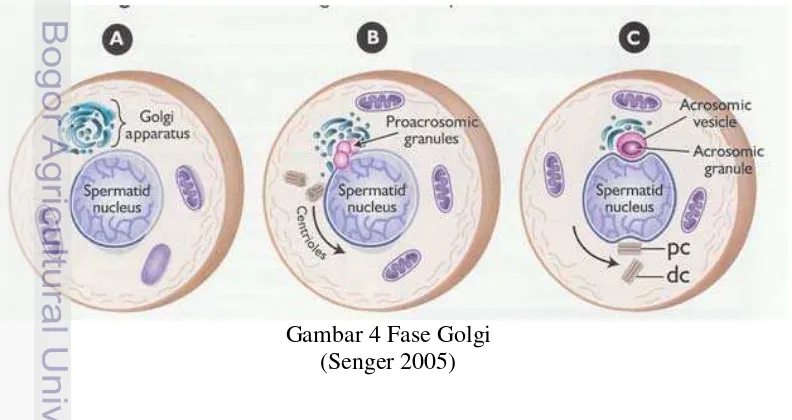
Merupakan transformasi spermatid menjadi spermatozoa oleh serangkaian perubahan morfologi yang berlangsung dengan cepat secara kolektif dimana setelah kehilangan sebagian dari sitoplasma, spermatid kemudian mengalami diferensiasi menjadi spermatozoa. Spermiogenesis menurut Garner dan Hafez (2000) meliputi 4 tahap yaitu tahap golgi, tahap tudung, tahap akrosom dan tahap pematangan.
Tahap golgi akan membentuk badan golgi, aksonema dan terjadi kondensasi pada DNA. Tahap ini ditandai dengan pembentukan butiran
proacrosomal dalam aparatus golgi, dari penggabungan butiran menjadi granul
akrosom tunggal kemudian granul akrosom menjadi granul inti dan tahap awal pertumbuhan ekor pada bagian ujung lain dari akrosom. Selain itu, sentriol proksimal akan bermigrasi dekat dengan inti yang diperkirakan membentuk dasar dari ekor ke kepala (Gambar 4).
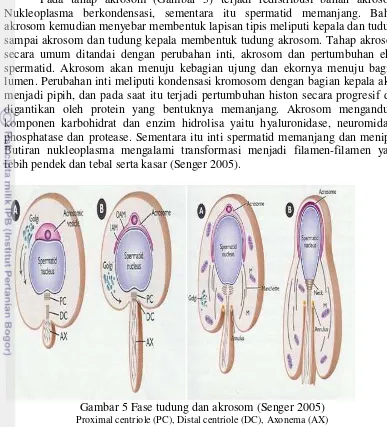
Tahap tudung atau cap (Gambar 5) ditandai dengan menyebarnya granul ke permukaan nukleus spermatid, proses dilanjutkan ke bagian 2/3 bagian anterior pada masing-masing inti spermatid yang tertutup oleh lapisan double layer
(Susilawati 211). Tahap tudung ini saat akrosom semakin besar kemudian membentuk lipatan tipis melingkupi bagian kutub yang akan menjadi bagian depan, yang pada akhirnya terbentuk semacam tutup pada spermatozoa. Selama fase tudung terjadi perkembangan komponen aksonema pada bagian ekor yang dibentuk dari elemen-elemen pada distal sentriol mengalami pemanjangan di bagian sitoplasma sel.
11 Pada tahap akrosom (Gambar 5) terjadi redistribusi bahan akrosom. Nukleoplasma berkondensasi, sementara itu spermatid memanjang. Bahan akrosom kemudian menyebar membentuk lapisan tipis meliputi kepala dan tudung, sampai akrosom dan tudung kepala membentuk tudung akrosom. Tahap akrosom secara umum ditandai dengan perubahan inti, akrosom dan pertumbuhan ekor spermatid. Akrosom akan menuju kebagian ujung dan ekornya menuju bagian lumen. Perubahan inti meliputi kondensasi kromosom dengan bagian kepala akan menjadi pipih, dan pada saat itu terjadi pertumbuhan histon secara progresif dan digantikan oleh protein yang bentuknya memanjang. Akrosom mengandung komponen karbohidrat dan enzim hidrolisa yaitu hyaluronidase, neuromidase, phosphatase dan protease. Sementara itu inti spermatid memanjang dan menipis. Butiran nukleoplasma mengalami transformasi menjadi filamen-filamen yang lebih pendek dan tebal serta kasar (Senger 2005).
Gambar 5 Fase tudung dan akrosom (Senger 2005)
Proximal centriole (PC), Distal centriole (DC), Axonema (AX)
Tahap pematangan (Gambar 6) merupakan trasformasi akhir dari spermatid yang memanjang ke dalam sel yang akan dilepaskan ke dalam lumen tubulus semeniferus. Tahap ini melibatkan perubahan bentuk spermatid sesuai dengan ciri spesies. Ketika akrosom terbentuk sentriol pun bergerak ke kutub yang berseberangan. Sentriol terdepan membentuk flagellum, sentriol-sentriol terbentuk di pangkal ekor. Mitokondria membentuk cincin-cincin di bagian
middle piece ekor dan fibrosa pada bagian luar. Mikrotubul muncul dan
berkumpul dibagian samping spermatid membentuk satu batang besar. Ketika ekor mengalami diferensiasi, sitoplasma sisa yang diselaputi membran melepaskan diri ke samping (sitoplasma difagosit oleh sel sertoli). Tahap pematangan adalah suatu tahap akhir dari proses pemanjangan dan menuju lumen tubulus seminiferus. Di dalam inti spermatozoa terdapat granula kromatin yang secara progresif mengalami kondensasi merubah protein menjadi protamin.
12
sederhana yang secara bergantian menstabilkan struktur inti spermatozoa selama spermatogenesis. Penggantian protein ini dianggap bertanggung jawab terhadap penghambatan proses transkripsi pada inti dan pengompakan kromatin (Saili 2006). Pada saat spermatozoa melewati epididimis, residu sistein pada protamin akan membentuk ikatan sulfida satu sama lain. Terbentuknya ikatan ini menyebabkan daya tahan inti spermatozoa semakin tinggi terhadap pengaruh fisik dan kimia.
Gambar 6 Fase pematangan (Senger 2005)
Kerusakan DNA
Kerusakan DNA spermatozoa dapat disebabkan oleh beberapa hal di antaranya faktor hormonal, faktor umur, infeksi, tingginya kadar reactive oxygen
species (ROS), pemaparan zat kimia/ pemaparan racun, rokok, obat-obatan,
hipertermia testis, apoptosis dan kekurangan protamin saat spermatogenesis (Purwaningsih et al. 2011). Kerusakan DNA spermatozoa jika melebihi 30-40% akan menyebabkan infertilitas dan tidak disarankan untuk dijadikan semen beku (Evenson et al. 1999; Spano et al. 2000).
Protamin adalah suatu protein utama di dalam inti spermatozoa yang mengikat DNA (Aulanni’am et al. 2011). Pada manusia dan tikus terdapat dua jenis protamin P1 dan protamin P2 (Corzett et al. 2002), dan pada sapi hanya satu tipe yaitu protamin P1(Beletti et al. 2005). Protamin berperan penting untuk pembentukan kromatin yang diperlukan pada fungsi normal spermatozoa. Ekspresi abnormal protamin menyebabkan terjadinya penurunan jumlah spermatozoa, motilitas, morfologi dan peningkatan kerusakan kromatin spermatozoa (Mengual et al. 2003), penurunan viabilitas dan meningkatkan kerusakan DNA (Aoki et al. 2006). Selama tahap elongasi spermatid pada saat
Kepala
Bagian Tengah
Bagian Utama Akrosom
Tudung post akrosom
Annulus
13 spermiogenesis sekitar 85 % inti spermatozoa histon akan diganti oleh protamin (Aulanni’am et al. 2011).
Keseluruhan genom spermatozoa terdapat di dalam pilinan DNA dengan panjang rata-rata 27 kilobite. Pilinan DNA ini berikatan dengan elemen struktural inti yang disebut matriks inti. Beberapa faktor yang menyebabkan terganggunya proses spermatogenesis seperti stress lingkungan, mutasi gen dan abnormalitas kromosom berpotensi merusak struktur kromatin yang berhubungan dengan kejadian infertilitas. Abnormalitas kromatin inti dapat juga disebabkan oleh radikal bebas (Lewis dan Aitken. 2005) atau akibat apoptosis. Salah satu agen oksidasi adalah reactive oxygen species (ROS) yang dalam kadar tinggi dapat bersifat toksik terhadap spermatozoa (Saleh dan Argawal 2002). Seperti halnya agen oksidasi yang lain (hidrogen peroksida, superoksidasi dan radikal bebas), ROS sangat reaktif. Radikal bebas adalah atom atau molekul yang memiliki satu atau lebih elektron bebas yang tidak berpasangan (Warren et al. 1987).
Kantor (1995) menyatakan bahwa kerusakan DNA dapat diartikan sebagai semua bentuk perubahan polimer DNA. Secara alamiah DNA terus menerus terpapar pada lingkungan fisik dan kimia yang sangat bervariasi dan perpotensi mengubah struktur alamiah DNA tersebut. Perubahan ini dapat memengaruhi proses replikasi dan transkripsi DNA yang mengarah pada kerusakan DNA. Konsekuensi biologisnya dapat berupa kejadian mutasi atau kematian sel bahkan kanker, kemunduran mental dan terkait pertumbuhan dan perkembangan. Lebih lanjut dikatakan bahwa kerusakan modifikasi struktur DNA diinduksi oleh beberapa penyebab seperti radiasi, panas, tekanan dan bahan kimia. Bentuk kerusakan yang lain adalah terputusnya struktur polimer DNA. Pemanasan yang melebihi 37 oC menyebabkan terputusnya ikatan glikosida yang menghubungkan antara basa nitrogen dan struktur gula fosfat sehingga basa nitrogen akan hilang.
Pemeriksaan kerusakan DNA spermatozoa telah banyak dilakukan dengan berbagai metode analisis antara lain Sperm Chromatin Structure Assay (SCSA) (Evenson et al.2002), Acridine Orange Test (AO) (Tejada et al. 1984), Terminal
Deoxynucleotidyl Transferase Nick end Labelling (TUNEL) (Gorcyza et al. 1993)
Toluidine Blue (TB) Test (Erenpreisa et al. 2003), Comet Assay (Fraser dan
Strzezek 2004) dan Kit Halomax® (Langdon 2012).
Metode pemeriksaan TB merupakan metode pemeriksaan status DNA spermatozoa secara tidak langsung karena hanya memeriksa perubahan struktur kromatin spermatozoa yang sangat berhubungan dengan kondisi kestabilan DNA spermatozoa tersebut (Erenpreisa et al. 2003). Sedangkan pemeriksaan langsung dapat digunakan Comet Assay (Fraser dan Strzezek 2004) dan Kit Halomax®
(Langdon 2012).
Kematian Embrio
Penelitian yang dilakukan oleh Musafie et al. (2010), menyimpulkan bahwa kematian embrio hasil inseminasi buatan di Yogyakarta sebesar 80 % hal ini sangat merugikan bagi peternak. Pengaruh hormon PGF2α yang disekresikan
14
yang berpengaruh terhadap anti-luteolytic dan agen luteoprotective seperti PGE2
yang terjadi sekitar 8-9 hari setelah fertilisasi (Senger 2005).
Kematian embrio menunjukkan kematian sel telur yang telah dibuahi dan embrio yang telah berimplantasi. Keberhasilan inseminasi buatan hanya 70%, sisanya 30% mengalami kegagalan fertilisasi dan kegagalan kebuntingan, dari 30% yang mengalami kegagalan kebuntingan 65% kegagalan disebabkan oleh kematian embrio di antara hari ke 6 sampai hari 18 setelah fertilisasi (Vassilev et al. 2005) atau hari ke 8 sampai hari ke 16. Akibat kematian embrio dini menyebabkan prolong estrus sehingga menyebabkan calving interval yang semakin panjang dan kerugian peternak yang sangat besar. Kematian embrio dini biasanya terjadi sebelum tanggal 13 setelah fertilisasi dan diikuti dengan siklus estrus yang normal. Kematian embrio lanjut terjadi sebelum hari ke 42 hari dan ditandai dengan prolong estrus yang panjang sampai 3 bulan.
Pewarnaan Toluidine Blue dan Kit Halomax®
Toluidine Blue (TB) merupakan metode pemeriksaan status DNA
spermatozoa secara tidak langsung karena hanya memeriksa perubahan struktur kromatin spermatozoa yang berhubungan erat dengan stabilitas DNA spermatozoa tersebut (Erenpreisa et al. 2003). Pewarnaan TB terbukti sensitif untuk menguji struktur dan kemasan pembungkus DNA atau kromatin (Erenpreisa et al. 2003; Prinosilova et al. 2012). Pewarnaan TB termasuk Cytochemical Assays dan mulai dipopulerkan pertama kali oleh Erenpreisa et al. (2003). Teknik ini selain sensitif, sederhana dan murah serta tidak membutuhkan alat yang khusus seperti Flow Cytometry (Kim et al. 2013).
Pewarnaan TB yang digunakan untuk menguji kerusakan DNA pada penelitian ini, sebenarnya telah digunakan selama 40 tahun untuk mendiagnosis suatu penyakit yaitu mendeteksi adanya keganasan pada sel mukosa (Bobot 2011) dan juga dipakai dalam pewarnaan bakteri Stapylococcus aureus. Pewarnaan TB mulai dipopulerkan penggunaanya dalam pemeriksaan tingkat kesuburan pejantan dan digunakan sebagai standar pemeriksa kerusakan DNA pada spermatozoa (Erenpreisa et al. 2003; Beletti et al. 2005). Karena pewarnaan TB ini sensitif, sederhana dan murah serta tidak membutuhkan alat yang khusus maka banyak digunakan oleh para peneliti di antaranya oleh Erenpreisa et al. (2003) pada spermatozoa manusia, Beletti et al. (2005) pada spermatozoa sapi dan Saili (2006) pada spermatozoa domba.
Toluidine Blue adalah pewarna DNA yang digunakan untuk mengevaluasi
integritas kromatin spermatozoa dengan mendeteksi ada tidak pecahnya ikatan disulfida di dalam kromatin. Dengan demikian, kepala spermatozoa yang menunjukan warna biru tua mengindikasikan kerusakan dari DNA spermatozoa. Teknik pewarnaan ini telah digunakan untuk mengevaluasi integritas kromatin spermatozoa pada beberapa spesies antara lain sapi, kuda, kelinci, kerbau dan manusia (Erenpreisa et al. 2003; Beletti et al. 2005). Pada manusia pewarnaan TB menunjukkan korelasi yang tinggi dengan SCSA, TUNEL dan AO (Erenpreisa et al. 2003).
15 kualitas proses kondensasi kromatin yang dapat dideteksi melalui pewarnaan TB. Semakin kompak atau utuh kondensasi yang terjadi, maka warna biru terang akan muncul, sebaliknya pada kondensasi yang kurang kompak atau tidak utuh warna yang muncul biru tua. Kondensasi yang tidak kompak berhubungan positif dengan abnormalitas kromatin dan keutuhan DNA spermatozoa (Saili 2006). Kondisi ini dapat terjadi akibat bermacam-macam faktor seperti terpapar oleh radikal bebas saat proses spermatogenesis (Aitken et al. 1998), akibat apoptosis, kurangnya protein terutama arginin dan sistin, infeksi, stres, paparan zat kimia beracun, hipertermia testis dan hormonal.
Selain teknik yang sudah disebutkan di atas pada saat ini dipasaran juga tersedia kit untuk melihat kerusakan DNA di antaranya adalah Kit Halomax®
(Halotech DNA® SL Madrid Spanyol) dan telah digunakan untuk mendeteksi kerusakan DNA pada sapi (García-Macías et al. 2007) dengan menggunakan mikroskop fluorescent dan Mikroskop cahaya. Mikroskop fluorescent masih sulit ditemukan di BIB, sehingga perlu dilakukan modifikasi pengujian DNA dengan
Kit Halomax® agar bisa dievaluasi menggunakan mikroskop cahaya.
Kit Halomax® adalah kit diagnostik in vitro yang digunakan untuk
pengukuran kerusakan DNA spermatozoa yang terfragmentasi pada spesies hewan yang berbeda. Kit Halomax® dapat mengevaluasi kualitas spermatozoa yang lebih baik. Peningkatan kerusakan DNA spermatozoa memiliki dampak negatif pada tingkat fertilisasi dan perkembangan embrio. Hasil analisis Kit Halomax® didasarkan pada respon DNA yang terfragmentasi dan yang tidak terfragmentasi dapat dilihat dengan menggunakan mikroskop fluorescent namun dapat dimodifikasi dengan pewarnaan tertentu agar dapat dianalisis menggunakan mikroskop cahaya. Pada DNA spermatozoa yang terfragmentasi akan terdapat ‘halo’ dan kelihatan kompak, sedangkan sel dengan DNA yang rusak akan terlihat ‘halo’ disekitar kepala spermatozoa. Semakin rendah DNA yang terfragmentasi (SDF), maka semakin besar kemungkinan betina akan mengalami kebuntingan.
METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Balai Inseminasi Buatan Lembang dan di Unit Rehabilitasi Reproduksi (URR), Bagian Reproduksi dan Kebidanan. Departemen Klinik Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Dilaksanakan pada bulan Juli 2013 sampai bulan Desember 2013.
Materi Penelitian
16
produksi semen beku dilakukan di BIB Lembang, sedangkan pengujian post
thawing di lakukan di URR.
Metode Penelitian Koleksi, Evaluasi dan Pengolahan Semen
Semen dikoleksi menggunakan vagina buatan dua kali seminggu. Semen segar selanjutnya dievaluasi secara makroskopis dan mikroskopis. Evaluasi makroskopis meliputi, volume, warna, pH dan konsistensi dan mikroskopis meliputi gerakan massa, motilitas, viabilitas, membran plasma utuh (MPU) dan tudung akrosom utuh (TAU) mengacu kepada (Arifiantini 2012).
Pengujian Kualitas Semen Segar
a. Motilitas Spermatozoa
Sebanyak 10 µ L semen diambil menggunakan mikropipet diteteskan pada gelas objek dan ditambah NaCl fisiologis dengan perbandingan 1:4, dihomogenkan kemudian diambil satu tetes campuran larutan dan dipindahkan ke gelas objek lain kemudian ditutup gelas penutup. Pengamatan dilakukan menggunakan mikroskop (Olympus CH 20) dengan perbesaran 100x dan 400x pada 10 lapangan pandang. Penilaian diberikan dalam kisaran 0-100% dengan skala 5%.
b. Viabilitas (Spermatozoa Hidup)
Sebanyak 10 µ L semen diletakkan pada gelas objek, ditambah pewarna eosin-nigrosin 50 µ L, dihomogenkan dan dibuat preparat ulas serta dikeringkan diatas meja penghangatdalam waktu 15-20 detik. Preparat diamati di bawah mikroskop menggunakan perbesaran 400x, spermatozoa yang hidup tidak menyerap warna dan spermatozoa yang mati akan menyerap warna. Spermatozoa yang hidup dan mati dihitung dalam 10 lapangan pandang. Persentase spermatozoa hidup dihitung menggunakan rumus:
c. Keutuhan Membran Plasma (MPU)
Keutuhan membran plasma dievaluasi menggunakan larutan Hypoosmotic
Swelling Test (HOS). Sebanyak 10 µ L semen dimasukkan ke dalam mikrotub
17
d. Keutuhan Tudung Akrosom (TAU)
Satu tetes semen dimasukkan ke dalam mikrotub berisi larutan formol-saline
(2.54 g potassium dihydrogen phosphate, 5.41 g sodium chloride, 6.19 g di-sodium hydrogen phosphate dehydrate, 125 mL formaldehyde solution 37%), dan 875 ml aquadest. Semen segar dimasukkan dalam larutan formol-saline dengan perbandingan 1:100. Dibiarkan selama 1 jam dan diambil satu tetes kemudian diletakkan pada gelas objek dan ditutup dengan gelas penutup. Pengamatan dilakukan di bawah mikroskop fase kontras dengan perbesaran 400x. Spermatozoa yang memiliki tudung akrosom yang utuh ditandai dengan 1/2 sampai 2/3 bagian anterior kepala berwarna lebih gelap dari bagian posterior. Pemeriksaan dilakukan pada 10 lapangan pandang yang berbeda.
e. Pengujian Toluidine Blue (TB)
Satu tetes semen segar dibuat preparat ulas pada gelas objek, dikeringudarakan dan difiksasi dalam etanol 96% - aseton (1:1) selama 30 menit pada suhu 4 oC. Setelah fiksasi, preparat dikeringudarakan lalu dihidrolisis dalam HCL 0.1 N selama 5 menit pada suhu 4 oC. Preparat dibilas tiga kali menggunakan aquadest, lalu diwarnai dengan pewarnaan TB 0.05% dibiarkan selama 10 menit. Preparat yang telah diwarnai dicuci kembali dengan aquadest dan didehidrasi dengan menggunakan t-butanol dua kali serta dibersihkan dengan
xylol sebanyak dua kali. Preparat diamati di bawah mikroskop cahaya dengan
pembesaran 400x. Kepala spermatozoa memiliki integritas kromatin yang baik akan berwarna biru terang, sedangkan dengan integritas kromatin yang sudah berkurang akan berwarna biru tua. Pemeriksaan dilakukan pada 100 spermatozoa untuk setiap sampel (Erenpreisa et al. 2003).
Pembekuan Semen
Semen yang memiliki motilitas spermatozoa >70% dengan konsentrasi >1000 juta/mL diproses menjadi semen beku. Proses produksi semen beku dilakukan sesuai dengan protokol BIB Lembang menggunakan bahan pengencer Skim milk egg yolk dengan konsentrasi gliserol 8% dan dikemas dalam ministraw 0.25 mL dengan dosis inseminasi 25 juta/straw. Semen beku yang telah diproduksi disimpan dalam kontainer nitrogen cair (-196 oC) sampai pengujian lebih lanjut. Pengujian semen beku dilakukan dengan cara melakukan thawing
18
Pengujian Kualitas Semen beku
a. Motilitas Spermatozoa
Sebanyak 10 µ L semen diambil menggunakan mikrotub diteteskan pada gelas objek yang telah dihangatkan kemudian ditutup dengan gelas penutup. Pengamatan dilakukan menggunakan mikroskop perbesaran100X dan 400X pada 10 lapang pandang. Penilaian diberikan dalam kisaran 0-100%.
b. Viabilitas (Spermatozoa Hidup)
Sebanyak 10 µ L semen diletakkan pada gelas objek, ditambah pewarna Eosin-Nigrosin 20 µ L, dihomogenkan dan dibuat preparat ulas dari campuran tersebut dalam waktu 15 detik, dan dikeringkan diatas meja penghangat hingga kering. Preparat diamati di bawah mikroskop menggunakan perbesaran 400X. Spermatozoa yang hidup tidak menyerap warna dan spermatozoa yang mati akan menyerap warna. Spermatozoa yang hidup dan mati dihitung dalam 10 lapang pandang. Persentase spermatozoa hidup dihitung menggunakan rumus:
c. Keutuhan Membran Plasma (MPU)
Keutuhan membran plasma dievaluasi menggunakan larutan Hypoosmotic
Swelling Test (HOS). Sebanyak 50 µ L semen dimasukkan ke dalam mikrotub
yang berisi larutan HOS dan dihomogenkan. Campuran larutan tersebut dan simpan pada pada water bath suhu 37 °C. Pemeriksaan MPU semen beku dilakukan setelah 30 menit inkubasi dengan cara meneteskan satu tetes campuran larutan pada sebuah gelas objek, kemudian ditutup menggunakan gelas penutup dan diamati di bawah mikroskop dengan perbesaran 400X, spermatozoa yang normal dan yang bereaksi dihitung pada pada 10 lapang pandang. Perhitungan persentase spermatozoa yang beraksi dilakukan dengan cara :
d. Keutuhan Tudung Akrosom (TAU)
19
e. Pengujian Toluidine Blue (TB)
Semen segar diambil satu tetes dan dibuat preparat ulas, pada 4 buah gelas objek. Preparat selanjutnya dikeringudarakan dan difiksasi di dalam etanol 96% - aseton (1:1) selama 30 menit pada suhu 4 oC. Setelah difiksasi, preparat dikering udarakan, selanjutnya dihidrolisis di dalam HCL 0.1 N selama 5 menit pada suhu 4 oC. selanjutnya preparat dibilas tiga kali menggunakan aquadest.
Preparat selanjutnya diwarnai dengan pewarnaan TB 0.05% selama 10 menit. Preparat yang telah diwarnai dicuci kembali dengan aquadest dan didehidrasi dengan menggunakan t-butanol dua kali serta dibersihkan menggunakan xylol sebanyak dua kali. Preparat kemudian ditutup dengan gelas penutup dan diamati dibawah mikroskop cahaya dengan pembesaran 400 X. Kepala spermatozoa yang integritas kromatinnya masih baik akan berwarna biru terang, sedangkan spermatozoa yang integritas kromatinnya sudah berkurang akan berwarna biru tua. Pemeriksaan dilakukan terhadap 100 spermatozoa untuk setiap sample (Erenpreisa et al. 2003).
f. Pengujian DNA dengan Kit Halomax® yang dimodifikasi
Urutan pemeriksaan kerusakan DNA spermatozoa sapi menggunakan Kit Halomax® sebagai berikut ;
1. Encerkan semen dengan konsentrasi akhir 15-20 juta sel /mL dalam
Phosphate Buffered Saline (PBS).
2. Lelehkan agarose dalam water bath (90 °C-100 °C) selama 5 menit 3. Inkubasi agarose pada suhu 37 °C selama 5 menit.
4. Ambil 25 μL semen dan masukkan dalam agarose (mixing).
5. Suspensi semen (no.4) dimasukkan dalam gelas objek sebanyak 25μL, kemudian tutup dengan gelas penutup.
6. Inkubasi preparat dalam kulkas selama 5 menit.
7. Angkat perlahan gelas penutup kemudian teteskan dengan Lysis
Solution (LS) hingga agarose terendam, inkubasi pada suhu ruang
selama 5 menit.
8. Preparat diinkubasi dalam aquadest selama 5 menit.
9. Inkubasi preparat dalam etanol 70%, 90%, 100% (masing-masing dalam waktu 4 menit).
10.Keringanginkan preparat.
11.Preparat diinkubasi dalam aquadest selama 5 menit, kemudian keringanginkan.
12.Staining preparat: Inkubasi preparat dalam kotak berisi pewarna Eosin
selama 5 menit, kemudian cuci menggunakan aquadest dalam kotak selama 2 menit. Inkubasi preparat dalam kotak berisi pewarna
Methylene Blue selama 5 menit kemudian cuci menggunakan aquadest
dalam kotak selama 2 menit.
13.Amati preparat di bawah mikroskop perbesaran 400x dengan menggunakan green filter. Pemeriksaan dilakukan terhadap 100 spermatozoa untuk setiap sampel.
20
Analisis Data
Penelitian ini dirancang menggunakan Rancangan Acak Lengkap (RAL). Sampel berupa semen segar dan semen beku berasal dari delapan ekor sapi terdiri atas Brahman, Ongole, Limosin dan Simental masing-masing dua ekor dengan tiga kali koleksi dan prosesing (n=24). Data yang diperoleh dianalisis menggunakan uji one sample t test dengan bantuan program sotfware SPSS 16
for windows dan Microsoft excel. Data disampaikan dalam rataan dan standar
deviasi.
HASIL DAN PEMBAHASAN
Kualitas Semen Segar
Secara umum semen segar dari berbagai bangsa sapi (Limosin, Ongole, Brahman dan Simental) yang digunakan dalam penelitian ini mempunyai kualitas baik dan memenuhi syarat untuk dibekukan. Secara makroskopis volume semen berkisar antara 5.81±2.36 mL sampai dengan 8.20±0.75 mL, berwarna krem, konsistensi sedang dan pH antara 6.47±0.16 sampai dengan 6.56±2.92 (Tabel 1). Secara mikroskopis gerakan massa cukup baik dengan nilai +++, motilitas antara 70.00±0.00% sampai dengan 71.67±3.73%, viabilitas antara 78.63±6.21% sampai dengan 83.93±6.81%, morfologi normal 92.28±2.19%, konsentrasi spermatozoa terendah adalah 1180±204.17 juta/mL dan tertinggi 1578±80.00 juta/mL.
Tabel 1 Hasil pemeriksaan kualitas semen segar sapi
Parameter Limosin Ongole Brahman Simental Rerata
Makroskopis
Volume (mL) 6.83±0,58 8.20±0.75 6.00±1.67 5.81±2.36 6.71±0.94
Warna Krem Krem Krem Krem Krem
pH 6.51±0.03 6.47±0.16 6.53±0.04 6.56±2.92 6.52±0.03
Konsistensi Sedang Sedang Sedang Sedang Sedang
Mikroskopis
Gerakan Massa +++ +++ +++ +++ +++
Motilitas (%) 70.00±0.00 70.00±0.00 71.67±3.73 70.00±0.00 70.41±2.04 Viabilitas (%) 83.93±6.81 82.17±2.19 79.92±2.23 78.63±6.12 81.16±5.36 Morfologi normal(%) 93.34±7.82 95.35±2.05 90.55±4.09 89.9±4.70 92.28±2.19 Konsentrasi
(Juta/mL)
1180±204.17 1578±80.00 1340±242.49 1290±496.12 1347±145.38
MPU (%) 85.76±4.57 79.50±4.86 74.25±13.47 74.92±7.25 81.17±7.17 TAU (%) 84.67±3.40 85.42±5.86 81.17±5.96 83.67±7.16 83.72±6.10 DNA Utuh (%) 94.83±2.92 96.16±1.16 93.83±6.21 90.81±6.13 93.91±4.77
21
Hasil pengujian MPU dan TAU adalah 81.17%±7.17% dan 83.72±6.10 (Tabel 1) lebih tinggi dari motilitas (70.41±2.04%). Berdasarkan hasil evaluasi semen segar, seluruh semen yang dikoleksi mempunyai kualitas yang baik dan layak untuk diproses menjadi semen beku, sesuai dengan karakteristik semen sapi yang normal menurut Ax et al. (2000) yaitu volume 5-8 mL, motilitas >70%, konsentrasi >1000 juta/mL dan abnormalitas spermatozoa <20%.
Hasil pengujian keutuhan DNA pada semen segar dari keempat bangsa sapi adalah 93.91±4.77% nilai tersebut baik, hal ini disebabkan semen berasal dari sapi-sapi pejantan unggul yang telah diseleksi, dipelihara dengan standar yang baik. Hasil pemeriksaan DNA ini dapat diartikan bahwa DNA pada sapi yang mempunyai kualitas genetik tinggi dan dalam kondisi yang baik memiliki persentase nilai yang tinggi.
Kualitas Semen Beku
Selama proses pembekuan spermatozoa akan mengalami berbagai perubahan suhu dan tekanan osmotik yang akan menurunkan kualitas semen. Hasil penelitian ini menunjukkan penurunan kualitas sangat signifikan pada berbagai parameter yang diuji. Penurunan kualitas yang paling tinggi terlihat pada motilitas, viabilitas MPU dan TAU (Tabel 2). Motilitas merupakan parameter utama yang banyak dilaporkan oleh para peneliti (Garner dan Hafez 2000). Secara keseluruhan, semen beku ini dapat digunakan untuk inseminasi karena nilai PTM telah melampaui standar produksi semen beku di Indonesia yang tertuang dalam SNI 4869, 1:2008, yaitu untuk dapat didistribusikan dan diinseminasikan persentase spermatozoa motil post thawing minimal 40%.
Pengujian viabilitas dilakukan dengan memaparkan spermatozoa pada pewarnaan Eosin Nigrosin. Spermatozoa yang mati akan menyerap warna eosin nigrosin tetapi spermatozoa yang hidup tidak akan menyerap warna. Pengujian viabilitas dilakukan untuk menguji kerusakan pada bagian kepala spermatozoa. Nilai viabilitas spermatozoa hidup dari keempat bangsa sapi mempunyai nilai yang cukup baik, yaitu 81.16±5.36% pada semen segar dan 59.49±9.98% pada semen beku (Tabel 2).
Integritas membran plasma adalah suatu keadaan yang menunjukkan fungsi fisiologis membran yang terjaga sebagai kontrol terhadap transport air sehingga cairan di luar sel tidak dapat memasuki sel. Untuk mengetahui integritas membran spermatozoa maka dilakukan Hypoosmotic Swelling Test (HOS). Pada penelitian ini nilai MPU cukup bagus yaitu 81.17±7.17% pada semen segar dan 67.01±12.16% pada semen beku.
Motilitas mengalami penurunan yang paling tinggi yaitu 28.3%, diikuti viabilitas sebesar 21.6%. Membran plasma utuh dan TAU masing-masing turun hanya 14.1% dan 11.8%. Penurunan tersebut dapat dipahami karena dalam proses pembekuan, spermatozoa mengalami penurunan suhu ekstrim berkali-kali. Penurunan pertama terjadi pada saat ekuilibrasi, dari suhu ruang menjadi suhu 5
o
C sehingga spermatozoa mengalami cold shock. Penurunan suhu selanjutnya adalah pada saat pembekuan dalam uap nitrogen cair yang suhunya -130 oC. Cold
shock menyebabkan terjadinya kerusakan pada spermatozoa terutama pada
22
Membran plasma merupakan pelindung spermatozoa bagian luar yang akan langsung dipengaruhi oleh perubahan lingkungan. Jika kerusakan terjadi pada membran spermatozoa di bagian kepala maka akan terdeteksi pada pemeriksaan viabilitas, sehingga akan banyak spermatozoa yang terwarnai oleh pewarna yang diberikan. Sedangkan jika kerusakan terjadi di bagian ekor, terutama pada bagian midpiece, maka mitokondria akan terganggu sehingga ATP tidak diproduksi sehingga motilitas akan terhenti. Collenbrander et al. (1992) menyatakan bahwa untuk bisa menghasil ATP dibutuhkan enzim ATP trasferase, jika membran pada bagian midpiece rusak diduga enzim ini akan hilang dan kemampuan bergerak juga hilang.
Tabel 2 Kualitas semen segar dan semen beku sapi (Rerata±SD) Parameter Semen Segar (%) Semen Beku (%) Penurunan (%)
Motilitas 70.41±2.04a 42.08±4.40b 28.30±5.03 Viabilitas 81.16±5.36a 59.49±9.98b 21.67±11.95 MPU 81.17±7.17a 67.01±12.16b 14.15±12.73
TAU 83.72±6.10a 71.91±8.34b 11.81±11.31
DNA Utuh 93.91±4.77a 92.06±2.41a 1.84±4.47
Huruf superskrip berbeda yang mengikuti angka pada baris yang sama menunjukkan perbedaan yang nyata P<0.05
MPU : Membran Plasma Utuh TAU : Tudung Akrosom Utuh
Selain akibat cold shock, kerusakan juga dapat disebabkan oleh pengencer semen yang mengandung krioprotektan yang bersifat hiperosmotik. Bahan pengencer yang mengandung kriprotektan mempunyai tekanan osmotik >1000 mOsm kg-1sedangkan tekanan osmotik semen segar adalah antara 250-350 mOsmkg-1 (Arifiantini 2012). Akibatnya proses pembekuan tersebut dapat menurunkan motilitas antara 30% sampai dengan 60%, perubahan morfologi spermatozoa, kerusakan mitokondria dan kerusakan akrosom (Kim et al. 2013).
Keutuhan dari tudung akrosom juga secara nyata menurun, tetapi persentase penurunan hanya 11.81±11.31% tidak sebesar motilitas dan viabilitas, hal ini disebabkan akrosom terlindungi oleh lapisan membran akrosom dalam maupun luar.
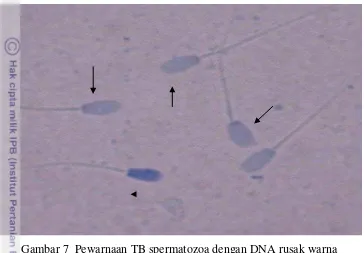
Evaluasi Kerusakan DNA Spermatozoa Sebelum dan Setelah Pembekuan dengan Pewarnaan Toluidine Blue pada berbagai Bangsa
23 fertilitas. Kerusakan DNA 10.34% pada semen beku sapi White Holstein
dilaporkan oleh Bochenek dan Smorag (2010). Selain faktor pembekuan tersebut, kerusakan DNA diduga juga disebabkan oleh musim, hal ini dilaporankan Nandre
et al. (2011) kerusakan DNA spermatozoa pada kerbau sebelum dan sesudah
pembekuan 3.00% dan 4.61% pada musim dingin. Kerusakan DNA pada musim panas 7.61% dan 13.61%.
Pengujian lebih lanjut menunjukkan bahwa setiap bangsa berbeda penurunan kerusakan DNAnya. Sapi Ongole menunjukkan penurunan integritas DNA sebesar 3.85±1.97% dan berbeda (P<0.05) dibandingkan DNA semen segarnya. Penurunan DNA spermatozoa sapi Brahman hanya 0.65±5.05%, Limosin 2.72±2.85%, dan Simental 0.14±6.60%, ketiganya tidak berbeda (P>0.05) antara semen segar dan semen beku (Tabel 3).
Tabel 3 Penurunan kerusakan DNA semen segar dan semen beku sapi dari berbagai bangsa yang diuji menggunakan pewarnaan TB (Rerata±SD)
Bangsa Sapi Jumlah (n)
DNA Utuh (%) Penurunan
(%) Semen Segar Semen Beku
Simental 6 90.81±6.13a 90.66±3.76a 0.14±6.60 Brahman 6 93.83±6.21a 93.17±1.25a 0.65±5.05 Ongole 6 96.16±1.16a 92.31±1.17b 3.85±1.97 Limosin 6 94.83±2.92a 92.11±2.39a 2.72±2.85 Rataan 24 93.91±4.77a 92.06±2.41a 1.84±4.47 Huruf superskrip yang berbeda pada baris yang sama menunjukkan perbedaan yang nyata P<0.05
.
Kualitas kromatin dalam inti sel sangat menentukan status DNA yang terikat erat pada protamin yang berfungsi sebagai pelindung bagi DNA inti (Saili 2006). Perubahan yang terjadi pada kromatin berakibat pada perubahan status DNA. Pemeriksaan ini berdasarkan kondisi dari kondensasi kromatin berupa perbedaan intensitas warna yang dihasilkan. Perubahan ini menentukan kualitas proses kondensasi kromatin yang dapat dideteksi melalui pewarnaan TB (Gambar 7). Semakin kompak atau utuh kondensasi yang terjadi, maka warna biru terang akan muncul, sebaliknya pada kondensasi yang kurang kompak atau tidak utuh warna yang muncul biru tua. Kondensasi yang tidak kompak berhubungan positif dengan abnormalitas kromatin dan keutuhan DNA spermatozoa (Saili 2006). Kondisi ini dapat terjadi akibat bermacam-macam faktor seperti terpapar oleh radikal bebas saat proses spermatogenesis (Aitken et al. 2001), akibat apoptosis, kurangnya protein terutama arginin dan sistein, infeksi, stres, paparan zat kimia beracun, hipertermia testis dan hormonal.
24
pengencer yang baik sehingga tidak menimbulkan kerusakan DNA yang berlebihan. Hasil penelitian juga menunjukkan bahwa proses pembekuan semen akan menurunkan persentase motilitas, viabilitas, MPU dan TAU tetapi tidak menurunkan keutuhan DNA.
Gambar 7 Pewarnaan TB spermatozoa dengan DNA rusak warna biru tua (kepala panah) spermatozoa dengan DNA utuh
warna biru terang (panah) (Pembesaran 400x)
Perbandingan Kerusakan DNA Spermatozoa Semen beku dengan Toluidine Blue dan Kit Halomax®
Pengujian DNA menggunakan TB pada prinsipnya mengevaluasi struktur kromatin DNA (Kim et al. 2013), sehingga DNA spermatozoa yang rusak akan berwarna biru tua dan yang masih utuh akan berwarna biru terang (Gambar 7), sedangkan menggunakan Kit Halomax® prinsipnya adalah melihat fragmentasi DNA spermatozoa (Sperm DNA fragmentation; SDF). Fragmentasi DNA ini terlihat dari keluarnya kromatin dari sel, sehingga membentuk ‘halo’ untuk spermatozoa yang rusak DNAnya dan tidak menunjukkan ‘halo’ untuk spermatozoa dengan DNA yang utuh (Langdon 2012). Kit Halomax® dapat digunakan sebagai kontrol kualitas spermatozoa yang disebabkan oleh kerusakan DNA misalnya yang disebabkan oleh media pengencer semen, krioprotektan, pembekuan dan manipulasi lainnya seperti prosedur sexing spermatozoa (http://www.halotechdna.com/en/products/halomax).
25 fase ini sangat penting karena sekitar 85% inti spermatozoa berupa histon akan digantikan oleh protamin (Wykes dan Krawetz 2003). Penggantian histon oleh protamin berperan penting dalam penyusunan inti kromatin dan pematangan spermatozoa (Arpanahi et al. 2009).
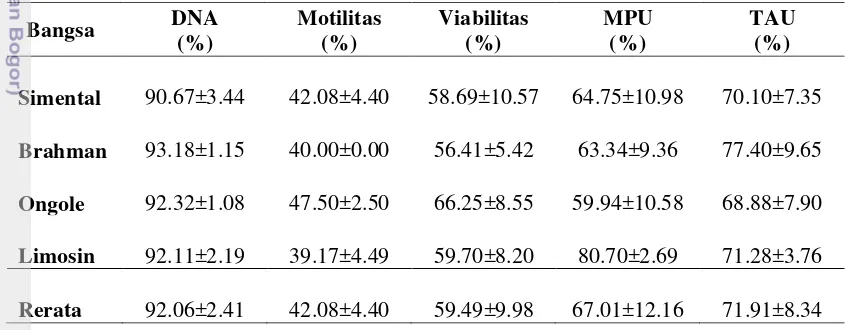
Tabel 4 Pemeriksaan DNA semen beku sapi dari berbagai bangsa yang diuji menggunakan Toluidine Blue dan Kit Halomax®
(Rerata±SD)
Bangsa Sapi Jumlah (n) DNA Utuh (%)
Toluidine Blue Kit Halomax®
Simental 6 90.66±3.76a 80.32±11.24a
Brahman 6 93.17±1.25a 87.33±2.73b
Ongole 6 92.31±1.17a 85.19±5.72b
Limosin 6 92.11±2.39a 88.94±6.56a
Rataan 24 92.06±2.41a 85.44±7.52b
Huruf superskrip yang berbeda pada baris yang sama menunjukkan perbedaan yang nyata P<0.05
Pada penelitian ini Kit Halomax® dimodifikasi dengan pewarnaan Eosin dan
Methylen Blue dan dianalisis menggunakan mikroskop cahaya. Hasilnya ternyata
lebih mudah dianalisis dan memberikan gambaran yang cukup akurat (Gambar 8). Berdasarkan bentuk halo dapat dibedakan menjadi 2 kriteria yaitu yang berbentuk halo (berpendar) yang menunjukan kerusakan DNA pada spermatozoa dan yang tidak menunjukan halo (tidak berpendar) untuk DNA spermatozoa yang utuh.
Kerusakan DNA spermatozoa pada semen beku dari empat bangsa yang diuji antara pewarnaan Toluidine Blue dan Kit Halomax® berbeda nyata (P<0.05) (Tabel 4). Pengujian lebih lanjut menunjukkan bahwa setiap bangsa berbeda tingkat kerusakan DNAnya. Sapi Ongole menunjukkan keutuhan DNA paling tinggi sebesar 92.31±1.17% dan paling rendah sapi Simental sebesar 90.68±3.76% dengan pemeriksaan TB. Sapi Limosin menunjukan keutuhan DNA paling tinggi 88.94±6.56% dan paling rendah 80.32±11.24%. Rerata dari keempat bangsa yang diuji antara pewarnaan TB adalah 92.06±2.41 dan Kit Halomax®
adalah 85.44±7.52. Dilihat dari hasil penelitian ini terlihat Kit Halomax® lebih sensitif dari pada pemeriksaan dengan TB.
Penelitian Enciso et al. (2011) melaporkan keutuhan DNA spermatozoa pada sapi Friesian-Holstein sebesar 82.11% dengan menggunakan Kit Halomax®. Penelitian Langdon (2012) menunjukkan keutuhan DNA spermatozoa kuda sebesar 87% dengan menggunakan Kit Halomax® dinyatakan normal walaupun ada juga yang rendah sampai 58% dari individu kuda yang abnormal. Jadi tingkat keutuhan DNA spermatozoa sapi BIB Lembang sebesar 85.44±7.52% dikatakan masih normal dengan pemeriksaan Kit Halomax®. Kit Halomax lebih sensitif tetapi kelemahannya adalah membutuhkan biaya yang besar karena Kit Halomax®
26
Pengujian DNA sangat penting dilakukan karena dapat memengaruhi kemampuan spermatozoa dalam fertilisasi dan perkembangan embrio (Partyka et al. 2012). Pada manusia tingkat kerusakan DNA spermatozoa lebih dari 30% akan menurunkan fertilitas (Larson et al. 2003). Menurut Perez-Cerezales et al (2010) pada mamalia kerusakan DNA spermatozoa melebihi 10% akan menyebabkan 61.1±2.3% mengalami fertilisasi tetapi akan mengalami keguguran pada fase gastrulasi, dan hanya 14.5±4.4% yang dapat mengalami kebuntingan. Melihat dari kedua peneliti di atas kerusakan DNA spermatozoa sapi BIB Lembang sebesar 85.44±7.52% masih diambang batas normal. Hal ini diperkuat dari penelitian Langdon (2012) dan penelitian Enciso et al. (2011) yang sama-sama menggunakan Kit Halomax® di dalam pemeriksaan DNA spermatozoa (82.11% dan 87%).
Gambar 8 Pengujian dengan Kit Halomax® spermatozoa dengan DNA utuh kepala spermatozoa tidak berpendar (kepala panah) spermatozoa dengan DNA rusak kepala spermatozoa berpendar (panah) (Pembesaran 400x)
Hubungan Kerusakan DNA Spermatozoa dengan Parameter Kualitas Semen Lainnya