REKAYASA BIOPROSES PEMBUATAN BIOETANOL DARI
SIRUP GLUKOSA UBI JALAR (Ipomoea batatas L) DENGAN
MENGGUNAKAN Saccharomyces cerevisiae
AHNUR WAHYUNI
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis dengan judul: Rekayasa Bioproses Pembuatan Bioetanol dari Sirup Glukosa Ubi Jalar (Ipomoea batatas L) dengan Menggunakan Saccharomyces cerevisiae adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan tercantum dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2008
Ahnur Wahyuni
AHNUR WAHYUNI. Bio-process engineering of Bio-Ethanol from Sweet Potatoes Syrup (Ipomoea batatas L) using Saccharomyces cerevisiae. Under direction of KHASWAR SYAMSU and NUR RICHANA.
Indonesia is one of petroleum importer countries which 30% of fuel consumption must come from import. Several materials from plants which is often used as raw materials for bio-ethanol are molasses and tapioca. Meanwhile, Indonesia is still importing the molasses. Tapioca is used for starch material industry. One of the alternatives for starch material is sweet potatoes. Sweet potatoes has a short harvesting time (3 – 3.5 months). Moreover, by using superior variety the productivity can be increased up to 40 ton/ha. This research is to seek the potency of bio-ethanol production from glucose syrup that comes from sweet potatoes as the raw material. More specific, is to quest for a better system of fermentation growth of Saccharomyces cerevisiae to produce a higher content of bio-ethanol using bio-process engineering.
The first stage of research is to prepare the substrate, which consists of starch extracted from fresh sweet potatoes of Sukuh variety and then hydrolysis the starch enzymatically using α-amylase and amyloglucosidase (AMG) enzymes. Preliminary research was conducted to determine optimum concentration in which S. cerevisiae can live and produce the highest ethanol content. The concentrations being tested were 18, 24, 30 and 36% (g/l) of total sugar. While the main research consists of two systems: batch and fed batch.
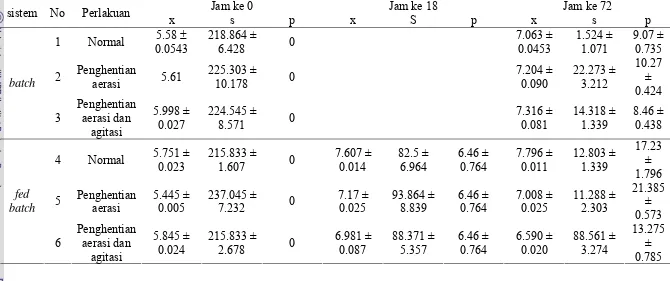
Result shows that 24% concentration (g/l) was find to be the optimum concentration for S. cerevisiae with ethanol production reaches up to 0.18±0.0283% (v/v). On the main research using batch system, the best result of highest ethanol content is reached (10.27±0.424% v/v) when aeration was stopped after biomass condition has reached the maximum condition. The best result on fed batch system of the highest ethanol concentration (21.385±0.573% v/v) also was gained at the same treatment. The ethanol content gained on this fed batch system has shown a significant increase up to two times compared to batch system.
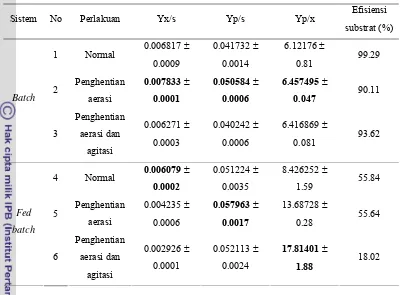
Based on calculation of fermentation kinetic parameters, it is shown that in batch system the highest Yx/s, Yp/s, Yp/x (0.007833±0.0001, 0.050584±0.0006, 6.457495±0.047) was gained on the second treatment that is aeration was stopped at 18th hour. On fed batch system, the highest Yp/s value (0.057963±0.0017) is shown on treatment of which aeration is stopped after the 18th hour.
As a whole, this research has shown that by bio-process engineering, the ethanol content can be increased. Also, to produce 1 L ethanol of 99.5% concentration, there will be only 5.07 kg sweet potatoes needed (Sukuh variety) for the process. This is lower compared to the conversion of cassava to become ethanol with 6.5 kg of cassava needed to get the 99.5% concentration.
AHNUR WAHYUNI. Rekayasa Bioproses Pembuatan Bioetanol dari Sirup Glukosa Ubi Jalar (Ipomoea batatas L) dengan Menggunakan Saccharomyces cerevisiae. Dibimbing oleh KHASWAR SYAMSU dan NUR RICHANA.
Seiring dengan perkembangan jumlah penduduk dunia, kebutuhan akan transportasi juga meningkat, namun persediaan bahan bakar semakin menipis karena merupakan sumber daya alam yang bersifat tidak dapat diperbaharui. Indonesia merupakan salah satu negara yang mengimpor BBM. Kebutuhan bensin nasional mencapai 17.5 miliar liter per tahun dan 30% dari kebutuhan tersebut harus diimpor. Pada Peraturan Pemerintah No 5/2006 dalam kurun waktu 2007-2010, pemerintah menargetkan mengganti 1.48 miliar liter bensin dengan bioetanol akibat kian menipisnya cadangan minyak bumi. Beberapa bahan yang berasal dari tumbuhan yang sering digunakan sebagai bahan baku pembuatan bioetanol adalah molases dan tapioka dari ubi kayu. Namun Indonesia merupakan negara pengimpor molases serta penggunaan tapioka untuk industri berbahan baku pati merupakan kelemahan dari bahan yang digunakan selama ini. Salah satu alternative bahan baku pembuatan bioetanol adalah ubi jalar. Ubi jalar memiliki umur panen yang relatif singkat yaitu antara 3-3.5 bulan dengan produktivitas mencapai 40 ton/ha. Beberapa teknologi pembuatan bioetanol yang ada di Indonesia menggunakan singkong sebagai bahan bakunya dengan kadar etanol yang dihasilkan 8–11 persen. Melalui penelitian ini diharapkan dapat dihasilkan rendemen kadar bioetanol yang lebih tinggi dengan menggunakan bahan baku yang berasal dari ubi jalar
Penelitian ini bertujuan untuk melihat potensi pembuatan bioetanol dari sirup glukosa yang berasal dari pati ubi jalar sebagai bahan baku. Sedangkan tujuan spesifik dari penelitian ini adalah untuk mencari kondisi tumbuh Saccharomycess cerevisiae yang lebih baik untuk menghasilkan bioetanol pada tingkat rendemen yang lebih tinggi dengan melakukan rekayasa bioproses.
Tahap penelitian dimulai dengan mempersiapkan substrat yang akan digunakan. Persiapan tersebut terdiri atas ekstraksi pati dari ubi jalar segar. Ternyata ubi jalar varietas Sukuh memiliki rendemen pati yang lebih tinggi (22.53±1.48%) bila dibandingkan denganubi jalar lokal yang diperoleh dari Bogor. Tahap selanjutnya adalah melakukan hidrolisis pati secara enzimatis untuk membuat sirup glukosa. Enzim yang digunakan adalah enzim α-amilase dan enzim amiloglukosidase (AMG). Pada proses hidrolisis pati ini diperoleh nilai efisiensi mencapai 97.47±1.27%. Nilai ini menunjukkan bahwa proses hidrolisis yang dilakukan cukup efisien dan bagus.
mencapai kondisi yang maksimal.
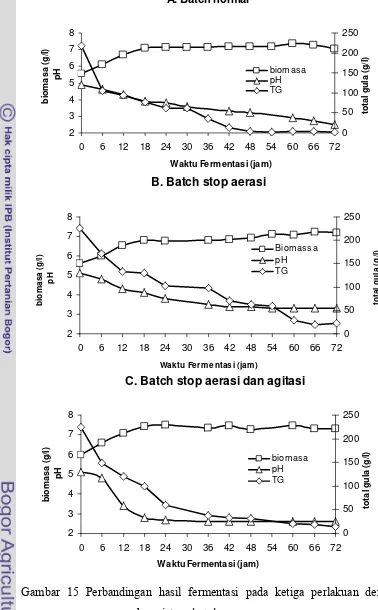
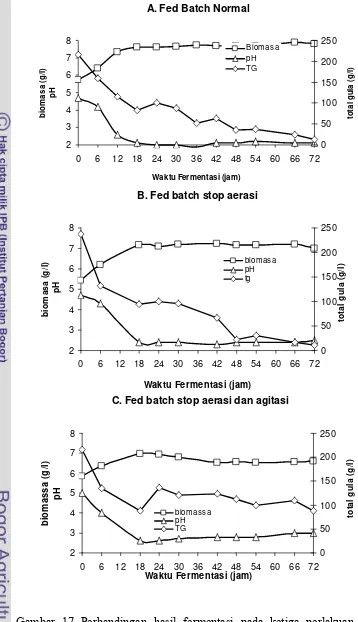
Hasil yang diperoleh menunjukkan bahwa konsentrasi 24% (g/l) merupakan konsentrasi yang optimal bagi pertumbuhan S. cerevisiae dengan produksi etanol mencapai 0.18±0.0283% (v/v) lebih tinggi bila dibandingkan dengan konsentrasi lain yang diujikan. Pada penelitian utama dengan sistem batch, diperoleh hasil terbaik dengan kadar etanol tertinggi (10.27±0.424% v/v ) pada perlakuan dengan penghentian sistem aerasi pada saat kondisi biomasa telah mencapai keadaan yang maksimal. Penghentian ini dilakukan pada jam ke-18. Hal ini menunjukkan bahwa dengan dihentikannya aerasi maka sisa substrat yang ada dalam media dimanfaatkan untuk pembentukan bioetanol oleh S.cerevisiae.
Hasil terbaik pada sistem fed batch konsentrasi etanol tertinggi (21.385±0.573% v/v) juga diperoleh pada perlakuan yang sama dengan sistem batch yaitu penghentian aerasi pada jam ke-18. Bahkan kadar etanol yang diperoleh pada sistem fed batch ini menunjukkan peningkatan hingga mencapai dua kali lipat bila dibandingkan dengan sistem batch. Hal ini menunjukkan bahwa pada sistem fed batch, substrat yang ditambahkan pada saat proses fermentasi berlangsung, dapat dimanfaatkan oleh S.cerevisiae untuk pembentukan bioetanol.
Berdasarkan hasil perhitungan pada parameter kinetika fermentasi, menunjukkan bahwa pada sistem batch, nilai dari Yx/s, Yp/s, Yp/x yang paling tinggi (0.007833±0.0001, 0.050584±0.0006, 6.457495±0.047) terdapat pada perlakuan kedua yaitu penghentian aerasi. Berdasarkan hasil perhitungan ini menunjukkan bahwa pada sistem batch, sistem fermentasi yang dilakukan telah berlangsung secara efisien, sehingga diperoleh kadar etanol yang relatif lebih tinggi bila dibandingkan dengan perlakuan lainnya. Pada sistem fed batch, nilai Yp/s paling tinggi (0.057963±0.0017) ditunjukkan pada perlakuan dengan penghentian aerasi setelah jam ke-18. Hal ini menunjukkan bahwa efisiensi pembentukan produk dalam hal ini etanol telah efisien, namun nilai Yp/x masih lebih rendah (13.68728±028) bila dibandingkan dengan perlakuan ketiga yaitu penghentian aerasi dan agitasi setelah jam ke-18(17.81401±1.88). Ini menunjukkan bahwa pada sistem fed batch ini, biomasa yang ada dalam hal ini S cerevisiae belum efisien dalam pembentukan substrat. Hal ini dapat disebabkan karena konsentrasi substrat yang tinggi dalam media sehingga S cerevisiae tidak dapat memproduksi etanol secara maksimal.
Secara keseluruhan hasil penelitian ini menunjukkan bahwa dengan dilakukannya rekayasa bioproses dapat meningkatkan kadar etanol yang diperoleh. Berdasarkan hasil penelitian ini juga diperoleh bahwa untuk memproduksi satu liter etanol dengan konsentrasi 99.5% membutuhkan ubi jalar dengan varietas Sukuh sebanyak 5.07 kg. Hasil ini lebih tinggi bila dibandingkan dengan konversi ubi kayu menjadi etanol yang membutuhkan ubi kayu sebanyak 6.5 kg untuk membuat satu liter etanol dengan konsentrasi 99.5%.
© Hak cipta milik IPB, tahun 2008
Hak cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencamtumkan atau menyebutkan sumber.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya tulis ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar Institut Pertanian Bogor (IPB)
SIRUP GLUKOSA UBI JALAR (Ipomoea batatas L) DENGAN
MENGGUNAKAN Saccharomyces cerevisiae
AHNUR WAHYUNI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Teknologi Industri Pertanian
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Glukosa Ubi Jalar (Ipomoea batatas L) dengan Menggunakan Saccharomyces cerevisiae
Nama : Ahnur Wahyuni
NIM : F351050051
Disetujui Komisi Pembimbing
Dr. Ir. Khaswar Syamsu, MSc Dr. Ir. Nur Richana MSi
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Teknologi Industri Pertanian
Dr. Ir. Irawadi Jamaran Prof.Dr.Ir.Khairil Anwar Notodiputro, MS
Puji syukur kehadirat Allah SWT yang telah melimpahkan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini yang berjudul “ Rekayasa Bioproses Pembuatan Bioetanol dari Sirup Glukosa Ubi Jalar (Ipomoea batatas L) dengan Menggunakan Saccharomyces cereviseae”.
Selama proses penyusunan karya ilmiah ini penulis banyak mendapat bantuan dan bimbingan dari berbagai pihak baik secara langsung maupun tidak langsung hingga tersusunnya tesis ini. Terima kasih penulis ucapkan kepada Bapak Dr. Ir. Khaswar Syamsu, MSc dan Ibu Dr. Ir. Nur Richana, MSi selaku dosen pembimbing yang telah memberikan bimbingan, arahan dan masukannya. Terima kasih kepada Ibu Dr. Ir. Erliza Noor sebagai dosen penguji atas masukan sarannya. Terima kasih kepada Departemen Pertanian atas pendanaan untuk penelitian melalui program Kerjasama Kemitraan Penelitian Pertanian dengan Perguruan Tinggi (KKP3T). Terima kasih juga penulis ucapkan kepada tim Bioetanol saudara Diah Rochana dan Sri Haryani atas penelitian bersama serta diskusinya, Mba Emi dan Mba Pepi atas bantuannya di laboratorium RBP. Terima kasih juga ditujukan kepada rekan-rekan TIP khususnya angkatan 2005 atas masukan sarannya.
Ungkapan terima kasih yang sebesar-besarnya atas kasih sayang, kesabaran serta doa dan dukungan yang tak ternilai disampaikan kepada ayahanda H. A. Halim Mansul, ibunda Hj. A. St. Nurhayati H, suami tersayang Roni, anakku tercinta Risky Cahyapratama, kakak-kakakku: A. Naharuddin SE, A. Suharman, A. Luthfi SE, Ahnur Tenri S.Sos, Ahnur Gusdiyanto ST, serta kepada seluruh keluarga atas segala doa dan kasih sayangnya.
Penulis menyadari bahwa dalam penyusunan tesis ini masih terdapat kekurangan dan kesalahan, karenanya penulis mengharapkan adanya masukan dan saran yang dapat dipergunakan dalam perbaikan karya ilmiah ini. Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2008
Penulis dilahirkan di Toli-toli Sulawesi Tengah pada tanggal 11 Agustus 1983 dari ayah H. A. Halim Mansul dan ibu Hj. A. St. Nurhayati H. Penulis merupakan putri keenam dari enam bersaudara.
Tahun 2000 penulis lulus dari SMUN 4 Makassar Sulawesi Selatan dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis masuk pada Program Studi Teknologi Industri Pertanian, Fakultas Teknologi Pertanian. Selama mengikuti perkuliahan, penulis menjadi asisten pada praktikum Laboratorium Bioproses dan Laboratorium Lingkungan. Selama perkuliahan penulis pernah menjadi Finalis pada Pekan Ilmiah Mahasiswa Nasional (PIMNAS) XVI di Surakarta pada tahun 2003, dan menjadi wakil dari Program Studi Teknologi Industri Pertanian.
Halaman
DAFTAR TABEL ... iv
DAFTAR GAMBAR ... v
DAFTAR LAMPIRAN ... vi
I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 3
1.3 Ruang Lingkup... 4
1.4 Hipotesa Awal ... 4
II TINJAUAN PUSTAKA... 5
2.1 Ubi Jalar ... 5
2.2 Sirup Glukosa... 6
2.3 Bioetanol ... 9
2.4 Khamir ... 12
2.5 Kinetika Fermentasi ... 16
III METODOLOGI PENELITIAN ... 20
3.1 Bahan Dan Alat ... 20
3.2 Metodologi ... 20
3.3 Waktu dan Tempat Penelitian ... 27
IV HASIL DAN PEMBAHASAN ... 28
4.1 Ekstraksi pati ubi jalar ... 28
4.2 Pembuatan sirup glukosa ubi jalar ... 31
4.3 Penentuan Konsentrasi Hidrolisat Pati yang akan Digunakan ... 32
4.4 Penelitian utama ... 36
4.4.1 Fermentasi dengan Sistem Batch (nir sinambung) ... 37
4.4.2 Fermentasi dengan Sistem Fed Batch (semi sinambung) ... 42
4.5 Perhitungan Kinetika Fermantasi ... 47
V KESIMPULAN DAN SARAN ... 52
5.1 Kesimpulan ... 52
5.2 Saran ... 52
Halaman
1 Perbandingan Karakteristik Tanaman Umbi... 7
2 Tanaman Penghasil Bioetanol ... 10
3 Jenis Substrat serta Mikroorganisme yang digunakan untuk memproduksi Etanol ... 11
4 Variasi perlakuan yang dilakukan pada penelitian utama ... 26
5 Perbandingan komposisi kimia ubi putih dan merah ... 26
6 Perbandingan rendemen pati dari ubi jalar yang digunakan ... 27
7 Hasil analisa proximat ubi jalar varietas sukuh dan pati yang dihasilkan ... 28
8 Konversi pati menjadi sirup glukosa ... 30
9 Data pendukung kinetika fermentasi ... 49
10 Perhitungan kinetika fermentasi ... 50
11 Penetapan Gula Berdasarkan Luff Schoorf ... 58
12 Kurva standar total gula ... 62
13 Kurva pertumbuhan standar S. cerevisiae ... 65
14 Data penelitian utama perlakuan normal sistem batch... 68
15 Data penelitian utama perlakuan stop aerasi sistem batch... 69
16 Data penelitian utama perlakuan stop aerasi dan agitasi sistem batch... 70
17 Data penelitian utama perlakuan normal sistem fed batch ... 71
18 Data penelitian utama perlakuan stop aerasi sistem fed batch... 72
Halaman
1 Struktur bangun etanol ... 10
2 Tahap glikolisis (Embden-Meyerhof-Parnas Pathway) ... 14
3 Proses pembentukan etanol dari pyruvat ... 15
4 Kurva pertumbuhan microbial pada kultur batch... 16
5 Pola kinetika pertumbuhan dan pembetukan produk pada fermentasi batch ... 19
6 Ubi jalar yang digunakan ... 20
7 Diagram alir proses pembuatan pati ubi jalar ... 21
8 Pati ubi jalar varietas sukuh yang dihasilkan ... 21
9 Diagram alir proses pembuatan sirup glukosa ... 22
10 Media propagasi ... 23
11 Perbandingan biomasa akhir hasil fermentasi pada berbagai konsentrasi ... 33
12 Grafik perbandingan total gula hasil fermentasi pada berbagai konsentrasi ... 35
13 Grafik perbandingan hasil akhir fermentasi pada berbagai tingkat konsentrasi pada jam ke-48 ... 36
14 Fermentor yang digunakan ... 37
15 Perbandingan hasil fermentasi pada ketiga perlakuan dengan menggunakan sistem batch ... 38
16 Perbandingan hasil akhir fermentasi sistem batch pada jam ke-72 ... 41
17 Perbandingan hasil fermentasi pada ketiga perlakuan dengan menggunakan sistem fed batch ... 44
18 Perbandingan hasil akhir fermentasi pada sistem fed batch pada jam ke-72... 45
19 Kurva standar total gula (metode fenol)... 62
20 Kurva pertumbuhan standar S. cerevisiae ... 65
21 Areal perkebunan ubi jalar varietas sukuh ... 67
22 Ubi jalar varietas Sukuh ... 67
Halaman
1 Analisa proximat ubi jalar dan pati ubi jalar... 58
2 Prosedur Analisis Sirup Glukosa ... 62
3 Prosedur Analisis Parameter Fermentasi ... 63
4 Kurva pertumbuhan standar S. cereisiae ... 65
5 Deskripisi tanaman ubi jalar varietas Sukuh yang digunakan ... 66
6 Data penelitian pada sistem batch ... 68
7 Data penelitian pada sistem fed batch ... 71
I PENDAHULUAN
1.1 Latar Belakang
Seiring dengan perkembangan jumlah penduduk dunia, maka kebutuhan
akan transportasi juga semakin meningkat. Peningkatan tersebut diiringi dengan
permintaan akan bahan bakar yang saat ini jumlahnya semakin menipis karena
bahan bakar tersebut berasal dari minyak bumi yang bersifat tidak dapat
diperbaharui. Bahkan saat ini Indonesia merupakan salah satu negara yang
mengimpor BBM. Kebutuhan bensin nasional mencapai 17.5 miliar liter per tahun
dan 30% dari kebutuhan tersebut harus diimpor. Pada Peraturan Pemerintah No
5/2006 dalam kurun waktu 2007-2010, pemerintah menargetkan mengganti 1.48
miliar liter bensin dengan bioetanol akibat kian menipisnya cadangan minyak
bumi (Duryatmo et al. 2007). Oleh karena itu perlu dicari alternative sumber penghasil bioetanol yang bersifat dapat diperbaharui.
Saat ini telah dilakukan beberapa penelitian untuk menemukan
sumber-sumber energi yang berasal dari tanaman. Diantaranya adalah biodiesel yang
dapat berasal dari minyak jarak ataupun minyak sawit. Bioetanaol pun telah
diproduksi dengan menggunakan molases, dan beberapa sumber pati sebagai
bahan baku untuk pembuatannya. Penggunaan biodiesel dimaksudkan untuk
mensubtitusi solar sedangkan bioetanol dimaksudkan untuk mensubtitusi
premium.
Bioetanol dibuat dengan menfermentasikan glukosa menggunakan
mikroorganisme tertentu dalam hal ini S. cerevisiae. S. cerevisiae merupakan “Top Yeast” di dunia. Hal ini dikarenakan, S. cerevisiae banyak digunakan dalam membantu kehidupan manusia baik untuk industri maupun rumah tangga.
Penggunaan S. cerevisiae diantaranya untuk membuat bir atau minuman beralkohol maupun roti. Selain digunakan sebagai bahan bakar, etanol juga
banyak digunakan pada industri kimia, kosmetika serta industri lainnya yang
membutuhkan.
Bahan yang saat ini banyak digunakan untuk membuat etanol adalah
molases. Data dari BPS menunjukkan bahwa impor molases Indonesia pada tahun
Indonesia merupakan salah satu negara pengimpor molases. Hal ini dikarenakan
molases selain digunakan untuk membuat bioetanol, molases juga digunakan
sebagai bahan baku untuk pembuatan produk fermentasi lain diantaranya MSG
dan asam organik.
Alternatif bahan baku pembuatan bioetanol lainnya adalah dengan
menggunakan bahan berpati diantaranya ubi kayu atau singkong. Namun
singkong memiliki umur panen yang lama yaitu sekitar 8–14 bulan (Deptan,
2006). Namun demikian ubi kayu sangat beragam penggunaannya diantaranya
untuk pembuatan pati termodofikasi, sehingga apabila bioetanol dibuat dari ubi
kayu akan dikhawatirkan mengganggu produksi produk lainnya. Oleh karena itu
pencarian sumber bahan baku lainnya perlu dilakukan.
Salah satu alternatif bahan sumber pati yang memiliki keunggulan
dibanding ubi kayu adalah ubi jalar. Ubi jalar memiliki umur panen yang lebih
singkat yaitu antara 3–3.5 bulan dengan produktivitas rata-rata 11-30 ton/ha
(Deptan, 2006). Bahkan dengan menggunakan varietas unggulan seperti varietas
Sukuh, produktivitasnya dapat mencapai 25–30 ton/ha (Puslittan 2008; Musaddad
2005).
Indonesia merupakan salah satu negara penghasil ubi jalar. Pada tahun 2006,
luas panen ubi jalar mencapai 176 507 ha dengan produksi dan produktivitas
masing-masing 1 854 238 ton dan 10.5 ton/ha (Deptan 2006). Jika dilihat dari
produktivitas nasional, nilai tersebut masih rendah, namun bila diusahakan dan
dibudidayakan dengan benar serta menggunakan bibit unggul, maka produktivitas
ubi jalar dapat mencapai 27 hingga 40 ton/ha (Lingga et al. 1986).
Bagi masyarakat Indonesia, ubi jalar hanya dimanfaatkan sebagai tanaman
sampingan saja, yang penggunaannya hanya sebatas makanan pengganti yang
biasanya dikonsumsi dengan cara direbus atau digoreng. Pemanfaatan ubi jalar di
Indonesia belum maksimal sehingga diperlukan teknologi pengolahan ubi jalar
menjadi produk yang memiliki nilai tambah yang lebih baik. Salah satu alternative
teknologi tersebut adalah dengan menggunakan ubi jalar sebagai bahan baku
untuk pembuatan bioetanol. Ubi jalar dapat tumbuh dengan baik di seluruh daerah
di Indonesia baik wilayah timur maupun barat. Hal ini dikarenakan ubi jalar dapat
ubi jalar sebagai bahan baku pembuatan etanol diharapkan dapat dimanfaatkan
oleh daerah-daerah yang berpotensi menghasilkan ubi jalar sehingga dapat
meningkatkan kesejahtraan masyarakatnya.
Beberapa penelitian telah dilakukan untuk menghasilkan bioetanol dari
beberapa sumber. Diantaranya yaitu molases yang dikembangkan di negara Brasil,
jagung yang dikembangkan oleh Negara Amerika dan China, gandum oleh
Zaldivar et al. (2005), bunga tanaman mahula (Madhuca latifolia L) oleh Swain et al. (2007). Ubi jalar pernah digunakan oleh Yu et al. (1996) sebagai bahan baku untuk pembuatan bioetanol tanpa melakukan proses ekstraksi pati. Hasil etanol
yang diperoleh sebesar 9.8 g/l (1.23% v/v). Namun hasil yang diperoleh tersebut
masih sangat kecil. Kumar et al. 2006 menggunakan teknologi fed batch dengan memanfaatkan tanaman Typha latifolia yang banyak terdapat di India. Pada sistem
fed batch hasil etanol yang diperoleh 28.5±0.46 g/l (3.59% v/v). Hasil yang diperoleh dengan sistem fed batch ini lebih tinggi bila dibandingkan dengan sistem batch yaitu 9.74±0.1 g/l (1.23% v/v). Teknologi pembuatan bioetanol yang ada di Indonesia dengan menggunakan singkong sebagai bahan bakunya
menghasilkan kadar etanol sekitar 8–11 persen (Hidayat, 2007).
Namun penelitian dengan melakukan rekayasa biproses terhadap
perubahan sistem petumbuhan dari S. cerevisiae belum pernah dilakukan. Perubahan yang dimaksud dalam hal ini adalah perubahan dari kondisi aerobik
menjadi anaerobik. Sehingga melalui penelitian ini diharapkan dapat dihasilkan
rendemen kadar bioetanol yang lebih tinggi menggunakan bahan baku atau
substrat yang berasal dari ubi jalar dengan melakukan rekayasa bioproses.
1.2 Tujuan
Tujuan umum yang mendasari diadakannya penelitian ini adalah untuk
melihat potensi pembuatan bioetanol dari sirup glukosa yang berasal dari pati ubi
jalar sebagai bahan baku. Sedangkan tujuan spesifik dari penelitian ini adalah
untuk mencari sistem kultivasi yang terbaik bagi S. cerevisiae untuk menghasilkan bioetanol pada tingkat rendemen yang lebih tinggi dengan
1.3 Ruang Lingkup
Ruang lingkup yang menjadi batasan pada penelitian ini adalah: • Melakukan karakerisasi bahan baku ubi jalar yang akan digunakan;
• Pembuatan pati ubi jalar yang dilanjutkan dengan pembuatan sirup glukosa secara enzimatis;
• Penggunaan kultur S. cerevisiae sebagai mikroorganisme untuk menghasilkan bioetanol;
• Pengaturan kondisi fermentasi untuk mendapatkan kadar etanol yang tertinggi pada sistem batch maupun fed batch.
1.4 Hipotesa Awal
S. cerevisiae merupakan jenis mikroorganisme yang bersifat anaerobik fakultatif. Mikroorganoisme ini dapat menghasilkan etanol pada kondisi anaerobik,
dimana persediaan oksigen terbatas. Pada kondisi yang aerobik, S. cerevisiae
menggunakan substrat yang ada untuk pembentukan dan peningkatan jumlah sel.
Melalui penelitian ini, diharapkan kadar etanol tertinggi diperoleh pada
saat terjadi perubahan kondisi dari aerobik menjadi anaerobik. Perubahan kondisi
yang dimaksud yaitu pada awal fermentasi, kondisi bioreaktor dibuat dalam
keadaan aerobik dengan memberikan aerasi dan agitasi. Setelah mencapai kondisi
biomassa yang maksimal, atau akhir dari fase logaritmik, kondisi fermentasi
II TINJAUAN PUSTAKA
2.1 Ubi Jalar
Ubi jalar atau ketela rambat atau “sweet potato” diduga berasal dari Benua
Amerika. Para ahli botani dan pertanian memperkirakan daerah asal tanaman ubi
jalar adalah Selandia Baru, Polinesia, dan Amerika bagian tengah. Nikolai
Ivanovich Vavilov, seorang ahli botani Soviet, memastikan daerah sentrum primer
asal tanaman ubi jalar adalah Amerika Tengah. Ubi jalar mulai menyebar ke
seluruh dunia, terutama negara-negara beriklim tropika pada abad ke-16.
Orang-orang Spanyol menyebarkan ubi jalar ke kawasan Asia, terutama Filipina, Jepang,
dan Indonesia (Prihatman 2000).
Klasifikasi lengkap Ubi jalar (Ipomoea batatas L) adalah: kingdom : Plantae (tumbuh-tumbuhan)
divisi : Spermatophyte (tumbuhan berbiji)
sub divisi : Angiospermae (berbiji tertutup)
kelas : Dycotyledoneae (biji berkeping dua)
ordo : Concolvulalesm
famili : Convolvuceae
genus : Ipomoea
spesies : Ipomoea batatas L
Menurut Prihatman (2000), plasma nutfah (sumber genetik) tanaman ubi
jalar yang tumbuh di dunia diperkirakan berjumlah lebih dari 1000 jenis, namun
baru 142 jenis yang diidentifikasi oleh para peneliti. Lembaga penelitian yang
menangani ubi jalar, antara lain: International Potato centre (IPC) dan Centro
Internationale de La Papa (CIP). Di Indonesia, penelitian dan pengembangan ubi
jalar ditangani oleh Pusat Penelitian dan Pengembangan Tanaman Pangan atau
Balai Penelitian Kacang-Kacangan dan Umbi-Umbian (Balitkabi), Departemen
Pertanian. Varietas atau kultivar atau klon ubi jalar yang ditanam di berbagai
daerah jumlahnya cukup banyak, antara lain: Lampenueng, Sawo, Cilembu,
Rambo, SQ-27, Jahe, Kleneng, Gedang, Tumpuk, Georgia, Layang-layang, Karya,
Menurut Lingga et al. (1986), umbi dari ubi jalar bermacam-macam tergantung dari varietas tanaman yang diusahakan. Tapi umumnya hasil umbi dibagi dua
golongan yakni ubi yang berumbi keras (karena banyak mengandung tepung) dan
ubi yang berumbi lunak (karena banyak mengandung air dan berdaging manis).
Umbi putih mengandung kadar air yang lebih sedikit dibandingkan dengan ubi
merah.
Ubi jalar memiliki waktu panen yang lebih singkat jika dibandingkan
dengan beberapa tanaman umbi di indonesia. Tabel 1 menunjukkan perbandingan
karakterisitik beberapa tanaman umbi di Indonesia. Umur panen ubi jalar lebih
singkat (3–3.5 bulan) serta produktivitas yang cukup tinggi (10–30 ton/ha), selain
itu ubi jalar merupakan tanaman yang cocok ditanam pada daerah yang marjinal
yang tidak terlalu subur. Ubi jalar tidak membutuhkan pupuk yang banyak untuk
tumbuhnya. Melihat beberapa keunggulan dari ubi jalar tersebut, maka
diharapkan ubi jalar dapat digunakan sebagai salah satu alternatif bahan baku pada
pembuatan bahan bakar yang bersumber dari alam (biofuel).
2.2 Sirup Glukosa
Sirup glukosa merupakan salah satu jenis dari gula cair, dimana komponen
utamanya adalah glukosa sehingga disebut sirup glukosa. Namun bila komponen
utamanya adalah fruktosa yang dipekatkan, maka dikenal sebagai HFS (High
Fruktose Syrup) yang memiliki derajat kemanisan yang lebih tinggi.
Pembuatan sirup glukosa dilakukan dengan menghidrolisa pati yang
merupakan bahan baku pembuatnya. Hidrolisa pati dapat dilakukan dengan cara
hidrolisa dengan katalis asam, kombinasi asam dan enzim, serta kombinasi enzim
dan enzim (Judoamidjojo, 1989). Pada hidrolisa pati dengan asam, diperlukan
suhu tinggi yaitu 140–160 0C. Asam akan memecah molekul pati secara acak dan gula yang dihasilkan sebagian besar merupakan gula pereduksi.
Hidrolisa pati dengan asam mempunyai kelemahan antara lain yaitu
diperlukan peralatan yang tahan korosi, menghasilkan sakarida dengan
spektra-spektra tertentu saja karena katalis asam menghidrolisa secara acak. Kelemahan
7
Tabel 1 Perbandingan karakteristik tanaman umbi
Karakteristik Ubi Jalar Singkong Tebu Kentang Talas
Jenis Tanah Cocok untuk semua
jenis tanah
Cocok untuk semua
jenis tanah
Tanah lembab Tanah lembab Tanah lembab
pH 5.5 – 7.5 4.5 – 8 5 - 6 5.5-6.0 5 - 6
Kebutuhan pupuk rendah Rendah tinggi Tinggi tinggi
Masa panen (bulan) 3 – 3.5 6 – 12 8 -14 3-7 6 - 10
Kandungan
karbohidrat (%) bk
98.13 51.36 Kadar sukrosa =
10%
18 21-27
Produktivitas (ton/ha) 11 - 30 10 -13 90 13,7 30
karbohidrat, juga terjadi rekombinasi produk degradasi yang dapat mempengaruhi
warna, rasa, bahkan menimbulkan masalah teknis.
Hidrolisa pati dengan enzim dapat menghasilkan sirup dengan DE lebih dari
95 persen. Selain itu, penggunaan enzim dapat mencegah terjadinya reaksi
sampingan karena sifat enzim sangat spesifik, sehingga dapat mempertahankan
flavour dan aroma bahan dasar. Pembuatan sirup glukosa dengan menggunakan
enzim terdiri atas dua tahap penting yaitu likuifikasi dan sakarifikasi.
Pada proses likuifikasi, pati diubah menjadi glukosa, maltosa, maltotriosa
dan oligosakarida. Proses ini berlangsung pada suhu yang tinggi dengan
menggunakan enzim yang tahan serta lebih efektif bekerja pada suhu tinggi yaitu α-amilase. Tahap selanjutnya adalah proses sakarifikasi. Pada tahap ini, larutan hasil likuifikasi diturunkan suhunya hingga mencapai 55–58 0C, setelah itu ditambahkan enzim AMG (amiloglukosidase). Pada tahap ini, enzim akan
merubah semua karbohidrat menjadi glukosa. Proses pada tahap sakarifikasi ini
berlangsung pada suhu 55–58 0C selama 48–96 jam.
Setelah proses sakarifikasi selesai, selanjutnya hidrolisat yang diperoleh
disaring dan dihilangkan warnanya dengan menggunakan karbon aktif. Untuk
mendapatkan konsentrasi sirup glukosa yang tinggi maka dilakukan proses
evaporasi.
Enzim yang digunakan pada pembuatan sirup glukosa dimulai dari tahap
likuifikasi hingga sakarifikasi adalah sebagai berikut:
α- Amilase
Menurut Judoamidjojo et al. (1989), α-amilase termasuk enzim pemecah dari dalam molekul, bekerja menghidrolisa dengan cepat ikatan α-1,4 glukosida
pati yang telah mengalami gelatinisasi. Pada proses likuifikasi, α-amilase akan
memecah ikatan α-1,4 pada amilosa dan menghasilkan dekstrin. Aktivitas α
-amilase pada amilopektin menghasilkan oligosakarida dengan jumlah monomer
dua sampai enam.
Mekanisme kerja enzim ini pada amilosa dibagi dalam dua tahap, yaitu:
(1) Degradasi secara cepat molekul amilosa menjadi maltosa dan maltotriosa yang
(2) Pembentukan glukosa dan maltosa dengan laju lebih lambat tidak secara acak.
Degradasi α-amilase pada amilopektin akan menghasilkan glukosa, maltosa
dan berbagai jenis α-limit dekstrin.
Sumber enzim α-amilase sangat beragam, mulai dari tanaman, jaringan
mamalia sampai mikroorganisme. Saat ini sumber enzim α-amilase yang paling
potensial dan banyak digunakan di industri berasal mikroorganisme. Salah satu
bakteri penghasil enzim α-amilase adalah yang berasal dari spesies Bacillus. Bakteri ini menghasilkan enzim yang tahan terhadap panas (termostabil)
(Judoamidjojo, 1989).
Amiloglukosidase
Enzim amiloglukosidase atau disebut juga glukoamilase (1,4 glucan
glucohydrolase, EC. 3.2.1.3) mengkatalis pemotongan gugusan glukosa dari ujung
non reduksi dari polimer pati, hasil akhir dari hidrolisa adalah senyawa glukosa
(Schwimmer, 1981). Enzim amiloglukosidase dapat menghidrolisis ikatan α-1,6
glukosida namun reaksinya berlangsung lambat. Aktivitas optimal dari enzim
amiloglukosidase sangat dipengaruhi oleh pH dan suhu.
Secara komersial, enzim amiloglukosidase diproduksi dari Aspergillus niger
dan Rhizopus sp. Amiloglukosidase dapat menghidrolisa pati sampai mencapai DE 95 – 98 persen. Produk hidrolisa yang dihasilkan bersifat lebih manis, namun
cenderung membentuk kristal disebabkan kandungan dekstrosanya yang tinggi
(Judoamidjojo, 1989).
2.3 Bioetanol
Bioetanol merupakan produk yang dihasilkan dari fermentasi gula,
walaupun sebenarnya, etanol juga dapat dibuat dengan menggunakan reaksi kimia
dengan menggunakan etilene. Etanol atau etil alkohol (C2H5OH) merupakan
cairan jernih tidak berwarna, biodegradable, rendah kadar racunnya, dan sangat
sedikit menimbulkan polusi bagi lingkungan apabila tertumpah
(www.indobiofuel.com).
Jika dibakar, etanol menghasilkan karbondioksida dan air. Dengan
mencampurkan etanol dan bensin, maka dapat dihasilkan bahan bakar campuran
udara. Bahan bakar campuran ini telah banyak digunakan secara luas di Amerika
Serikat. Kendaraan yang tanpa modifikasi dapat menggunakan bahan bakar
campuran 10% etanol dan 90% bensin atau yang lebih dikenal dengan gasohol
(Gasoline - alcohol fuels). Sekarang telah ada kendaraan yang dapat menggunakan bahan bakar campuran dengan kandungan 85% etanol dan 15%
bensin (www.ristek.go.id)
Gambar 1 Rumus bangun etanol.
Bioetanol memiliki beberapa keuntungan diantaranya berasal dari bahan
yang dapat diperbaharui, serta tidak menghasilkan emisi gas yang dapat
menimbulkan polusi udara. Keuntungan lainnya yaitu biodegradabel, serta cara pembuatannya yang sederhana yaitu melalui fermentasi gula–gula sederhana yang
berasal dari tumbuhan (www.ristek.go.id). Tabel 2 berikut memperlihatkan
beberapa tanaman penghasil bioetanol.
Tabel 2 Tanaman Penghasil Bioetanol
Tanaman Etanol
(l/ton)
Produktivitas
(t/ha)
Umur panen
(bulan)
Etanol
(l/ha/tahun)
Ubi kayu 180 40 9 7200
Jagung 385 6 3.5 4620(6930)*
Ubi jalar 142 20 4 5680 (8520)*
Sweet sorgum 76.7 6 4 920.4(1378.8)*
Biji sorgum 389 4 3.5 3112(4668)*
Talas 142 20 10 2840
* diganti oleh penulis dengan 3 kali panen ubi jalar dalam setahun
Menurut Judoamidjojo et al. (1989), proses fermentasi pembentukan etanol membutuhan bantuan yeast atau khamir. Untuk bahan yang mengandung gula dalam bentuk polisakarida atau oligosakarida, terlebih dahulu harus dirubah dulu
dalam bentuk yang lebih sederhana yaitu monosakarida (fruktosa atau glukosa).
Yeast tersebut akan merubah gula–gula sederhana yaitu fruktosa atau glukosa (C6H12O6) menjadi etanol (C2H5OH) dan karbondioksida (CO2). Reaksi yang
terjadi adalah sebagai berikut (Judoamidjojo, 1990).
C6H12O6 2C2H5OH + 2CO2
Monosakarida Etanol Karbondioksida
Etanol memiliki berat jenis pada 15 ºC adalah sebesar 0.7937 g/ml dan titik
didihnya 78.32 ºC pada tekanan 766 mmHg. Sifatnya yang lain adalah larut dalam
air dan eter dan mempunyai panas pembakaran 328 Kkal. Penggunaan etanol yang
terbanyak adalah sebagai pelarut sebesar 40 persen, untuk membuat asetildehid
36 persen, untuk penggunaan secara kimiawi yang lain 15 persen, serta eter, glikol
eter, etil asetat dan khoral 9 persen (Paturau, 1981).
Menurut Paturau (1981), fermentasi etanol membutuhkan waktu 30–72 jam.
Frazier dan Westhoff (1978) menambahkan suhu optimum fermentasi 25–30 oC dan kadar gula 10–18 persen.
Beberapa jenis substrat telah digunakan untuk memproduksi bioetanol
diantaranya adalah dapat dilihat pada Tabel 3 berikut:
Tabel 3 Jenis Substrat serta Mikroorganisme yang digunakan untuk memproduksi
Etanol
Substrat Kadar etanol tertinggi Mikroorganisme Ubi Jalar(a) 9.8 g/l (1.23% v/v) S. cerevisiae
Gandum (b) 6.9 g/l (0.869% v/v) S. cerevisiae rekombinan kode CR2
Molases (c) 1.8 – 2.3 g/l (0.29% v/v)
S. cerevisiae yang diimobilisasi
Typha latifolia(d) 28.5 g/l (3.59% v/v) Candida shehatae
Daun tebu (e) 1.6 g/l (0.20% v/v) S. cerevisiae
Mahula(f) 33.99 g/l (4.27% v/v) S. cerevisiae strain CTCRI Onggok tapioka(g) 1.635% v/v Schizosaccharomyces sp.
(a)
Yu et al. (1996).
(b)
(c)
Gaptista et al. (2006).
(d)
Chandel et al. (2006).
(e)
Krishna et al. (1998).
(f)
Swain et al. (2007).
(g)
Judoamidjojo et al. (1987).
2.4 Khamir
Khamir adalah mikroorganisme bersel tunggal, berbentuk oval tidak
beraturan dan berukuran antara 5-20 μ (Paturau, 1981). Fungsi utama khamir dalam pembuatan etanol adalah mengubah gula dalam substrat menjadi etil
alkohol dan CO2. Menurut Frazier (1977), enzim yang dihasilkan oleh khamir
adalah enzim invertase yang berfungsi sebagai pemecah sukrosa menjadi
monosakarida (glukosa dan fruktosa) serta enzim zimase yang mengubah
monosakarida tersebut menjadi etanol pada proses fermentasi.
Khamir termasuk kelompok kapang dan umumnya membelah diri dengan
pertunasan. Tunas ini tumbuh sampai ukurannya mendekati ukuran induk, dan
kemudian sel anak memisahkan diri. Pada kondisi tumbuh tertentu, tunas tidak
memisahkan diri dari sel induk, sehingga suatu sel yang panjang dan bercabang
terbentuk. Pada kondisi optimal khamir dapat membagi diri setelah 45 menit,
tetapi kadang – kadang juga setelah 90 – 120 menit.
S. s cerevisiae merupakan “Top Yeast” di dunia. Hal ini dikarenakan, S. cerevisiae banyak digunakan dalam membantu kehidupan manusia baik untuk industri maupun rumah tangga. Penggunaan S. cerevisiae diantaranya untuk membuat beer atau minuman beralkohol maupun roti.
Produktivitas sel khamir merupakan fungsi dari konsentrasi glukosa,
konsentrasi oksigen dan konsentrasi etanol (beberapa variabel kontrol juga
berpengaruh seperti suhu dan pH). Glukosa merupakan reaktan dasar untuk
metabolisme khamir. Menurut Judoamidjojo et al. (1989), pemecahan zat gula seperti glukosa oleh khamir dapat terjadi secara anaerobik (fermentasi) atau
aerobik (respirasi). Tetapi proses yang lebih tipikal adalah pemecahan anaerobik
yang dikenal juga sebagai fermentasi alkohol.
Pada kondisi aerobik, pemecahan gula mengikutsertakan oksigen atmosfir
menghasilkan CO2 dan air, sedang oksidasi tidak sempurna diikuti oleh akumulasi
asam dan lain-lain produk intermediet.
Khamir dapat tumbuh pada suhu yang cukup bervariasi dari 0 0C sampai 47
0
C. Secara umum dianggap bahwa khamir dapat tumbuh dengan baik pada
suasana asam, yaitu pH 3.5 sampai 3.8 yang dapat menghambat sebagian bakteri.
Toleransi asamnya adalah selang pH 2.2 sampai 8.0.Mekanisme pembentukan
etanol oleh khamir melalui sebuah jalur Embden-Meyerhof-Parnas Pathway atau
lebih dikenal dengan jalur glikolisis. Alur dari tahap glikolisis tersebut dapat
dilihat pada Gambar 2.
Hasil dari glikolisis atau EMP pathway adalah memecah glukosa menjadi
dua molekul piruvat. Proses yang terjadi dalam jalur glikolisis adalah sebagai
berikut:
1. Langkah pertama pada tahap glikolisis adalah reaksi phosphorilasi dari
glukosa menjadi glukosa-6-phosphat (G-6P) dengan bantuan enzim
hexokinase; pada tahap ini, satu molekul ATP digunakan dan satu molekul
ADP dihasilkan;
2. Selanjutnya glukosa-6-phosphat (G-6P) dikonversi menjadi
fruktosa-6-phosphat (F-6P) dengan menggunakan enzim phosphoglukose isomerase;
3. Fruktosa-6-phosphat (F-6P) selanjutnya dikonversi menjadi
fruktosa-1,6-bisphosphat oleh enzim phosphofructokinase; pada tahap ini pun satu
molekul ATP digunakan dan satu molekul ADP dihasilkan;
4. Tahap selanjutnya adalah pemecahan fruktosa-1,6-bisphosphat oleh enzim
aldolase menjadi dihidroxyacetone phosphat (DHAP) dan
glyceraldehydes-3-phosphat (GA-3P); tahap ini merupakan salah satu
tahap penting dalam proses glikolisis (dimana C6 dirubah menjadi 2C3);
DHAP dan GA-3P merupakan senyawa yang memiliki susunan molekul
yang sama; GA-3P langsung digunakan dalam tahap selanjutnya glikolisis
dan DHAP dikonversi menjadi GA-3P oleh enzim triose phosphat
isomerase;
5. Glyceraldehydes-3-phosphat (GA-3P) dioksidasi dengan penambahan
phosphat inorganic (Pi) menjadi 1,3-diphospho-glycerat (1,3-dP-GA) oleh
Glucose Hexokinase Glucose 6-phosphate ATP ADP Fructose 6-phosphate Phosphofructokinase aldolase ATP ADP Phosphoglucose isomerase Fructose 1,6-bisphosphate Dihydroxyacetone phosphate Glyceraldehhyde 3-phosphate (2 molecules) Triose phosphate isomerase
2 NAD++ 2P1 2 NADH + 2H+
O OH H H H O H OH H OH H CH2OH
O OH H H H O H OH H OH H CH2-OPO3
2-O CH2OH
OH OH
H H
OH CH2-OPO3
2-H
O CH2-OPO3
2-OH OH
H H
OH CH2-OPO3
2-H C H C OH HC O H H
OPO3
2-1,3-Bisphosphoglycerate (2 molecules) 2 ATP 2 ADP Glyceraldehide 3-phosphate dehydrogenase Phosphoglycerate kinase 3-Phosphoglycerate (2 molecules) 2-Phosphoglycerate (2 molecules)
2 H2O
Phosphoenolpyruvate (2 molecules) 2 ATP 2 ADP Pyruvate (2 molecules) Phosphoglycero-mutase Enolase Pyruvate kinase C H C OH C O H H
OPO3 2-2- O3PO
C H C OH C O H H
OPO3
2--O
C H
C
2- O3PO
C
O H
H OPO3
2--O
C H
C
2- O3PO C O H H -O C O C C O H H H -O C O C C H OH H H OPO3
[image:30.595.116.490.77.715.2]H-H
Gambar 2 Tahap glikolisis (Embden-Meyerhof-Parnas Pathway) (Crueger &
CH3
C
COOH O
CH3
HC O
acetaldehyde
CH3
CH2OH CO2
ethanol pyruvate
+
Pyruvate decarboxylase
NADH NAD+
Alcohol dehydrogenase
6. 1,3-diphospho-glycerat melepaskan satu grup phosphat untuk membentuk
ATP dari ADP dan kemudian dikonversi menjadi 3-phosphoglycerate
(3P-GA) oleh enzim 3-phosphoglycerate kinase;
7. 3-phosphoglycerate (3P-GA) selanjutnya dikonversi menjadi 2-
phosphoglycerate (2G-PA) oleh enzim phosphoglyceromutase;
8. Langkah selanjutnya adalah proses dehidrasi dari 2- phosphoglycerate
(2G-PA) menjadi phosphemol pyruvate (PEP) oleh enzim enolase.
9. Langkah terakhir dari glikolisis adalah dephosphorelasi phosphemol
pyruvate (PEP) menjadi pyruvat oleh enzim pyruvat kinase; pada tahap ini
dibentuk sebuah molekul ATP.
Reaksi setelah pembentukan DHAP dan GA-3P selama proses glikolisis
berlangsung sebanyak dua kali. Pyruvat yang merupakan produk akhir dari
tahap glikolisis ini merupakan metabolit kunci pada proses metabolisme.
Secara keseluruhan, reaksi dari proses glikolisis adalah sebagai berikut:
Setelah melalui tahap glikolisis, pyruvat yang terbentuk kemudian dirubah
menjadi asetaldehide dan CO2 oleh enzim pyruvate decarboxylase, setelah itu oleh
enzim alcohol dehydrogenase, asetaldehide tersebut dirubah menjadi alkohol.
Gambar 3 Proses pembentukan etanol dari pyruvat.
Ln konsentrasi
bi
om
assa
Waktu
Fase adaptasi
Fase log/exponensial
F
as
e per
tum
buhan l
am
bat Fase stasioner 2.5 Kinetika Fermentasi
Pertumbuhan mikroorganisme secara batch yang ditumbuhkan pada medium tertentu memiliki kurva pertumbuhan seperti yang ditunjukkan oleh
Gambar 4 berikut.
Gambar 4 Kurva pertumbuhan mikroorganisme pada kultur batch
(Stanbury & Whitaker 1993).
Menurut Fardiaz (1988), beberapa fase pertumbuhan yang umumnya terjadi
pada mikroorganisme secara umum adalah sebagai berikut:
a. Fase Adaptasi
Jika mikrrorganisme dipindahkan ke dalam suatu medium, mula-mula
akan mengalami fase adaptasi untuk menyesuaikan dengan kondisi lingkungan
di sekitarnya. Lama fase adaptasi ini dipengaruhi oleh beberapa faktor
diantaranya medium dan lingkungan sekitar serta jumlah inokulum..
b. Fase Logaritmik/eksponensial
Pada fase ini mikroorganisme membelah dengan cepat dan konstan
mengikuti kurva logaritmik. Pada fase ini kecepatan pertumbuhan sangat
dipengaruhi oleh medium tempat umbuhnya seperti pH dan kandungan
x
t
d
x
d
μ
=
N
t
d
N
d
n
μ
=
fase ini mikroorganisme membutuhkan energi lebih banyak daripada fase
lainnya. Pada fase ini kultur paling sensitif terhadap keadaan lingkungan.
c. Fase Pertumbuhan Lambat
Pada fase ini pertumbuhan populasi mikroorganisme diperlambat karena
beberapa sebab: (1). zat-zat nutrisi dalam medium sudah sangat berkurang; (2).
adanya hasil-hasil metabolisme yang mungkin beracun atau dapat
menghambat pertumbuhan mikroorganisme. Pada fase ini jumlah populasi
masih meningkat karena jumlah sel yang tumbuh masih lebih banyak daripada
jumlah sel yang mati.
d. Fase Stasioner
Pada fase ini jumlah populasi sel tetap karena jumlah sel yang tumbuh
sama dengan jumlah sel yang mati. Ukuran sel pada fase ini menjadi lebih
kecil karena sel tetap membelah meskipun zat-zat nutrisi sudah habis. Karena
kekurangan zat nutrisi, sel kemungkinan mempunyai komposisi berbeda
dengan sel yang tumbuh pada fase logaritmik. Pada fase ini, sel lebih tahan
terhadap keadaan ekstrim seperti panas, dingin, radiasi, dan bahan-bahan
kimia.
Pertumbuhan mikroorganisme biasanya dicirikan dengan waktu yang
dibutuhkan untuk menggandakan massa sel atau jumlah sel. Waktu ganda massa
dapat berbeda dengan waktu ganda sel, karena massa sel dapat meningkat tanpa
peningkatan dalam jumlah sel. Namun demikian bila dalam suatu lingkungan
tertentu interval antara massa sel atau penggandaan jumlah sel adalah konstan
dengan waktu, maka organisme itu tumbuh pada kecepatan eksponensial. Pada
keadaan ini maka pertumbuhan dinyatakan sebagai:
…… (1) atau ……. (2)
dimana: x = konsentrasi sel (g/l)
N = konsentrasi sel dalam keseluruhan (sel/l)
t = waktu
∫
∫
=
21 2 1 t t x x
dt
x
x
d
μ
t
x
x
Ln
=
μ
Δ
1 2
μ
μ
693
.
0
2
ln
=
=
td
S
K
S
s maks+
=
μ
μ
Persamaan (1) menggambarkan peningkatan massa sel dan kesetimbangan,
sedang persamaan (2) menggambarkan peningkatan jumlah sel dengan fungsi
waktu. Pada umumnya pertumbuhan diukur dengan peningkatan massa sehingga μ dapat digunakan. Jika persamaan (1) diintegralkan maka akan menjadi:
Bila laju pertumbuhan spesifik tetap, maka menghasilkan
Untuk kasus dimana Δ t = td, maka
Dimana td adalah waktu ganda sel.
Menurut Stanbury & Whitaker (1993), selama fermentasi batch, laju pertumbuhan spesifik adalah konstan dan tidak tergantung pada perubahan
konsentrasi nutriennya. Bentuk hubungan antara laju pertumbuhan dan
konsentrasi substrat telah diteliti oleh Monod (1942), dengan persamaan sebagai
berikut:
Dimana:
μ = laju pertumbuhan spesifik
μmaks = laju pertumbuhan spesifik yang maksimal
S = konsentrasi substrat
Ks = suatu konstanta yang sebanding pada konsentrasi substrat bila μ = ½
μmaks.
Pertumbuhan dan pembentukan produk oleh mikroorganisme merupakan
proses – proses biokonversi. Dimana nutrien kimiawi yang diumpankan pada
fermentasi dikonversi menjadi massa sel dan metabolit–metabolit. Setiap konversi
S
x
Y
s xΔ
Δ
=
S
p
Y
s pΔ
Δ
=
waktu x atau p waktu x atau p waktu x atau psel atau produk yang terbentuk per unit massa nutrien yang dikonsumsi, yaitu Yx/s
untuk sel dan Yp/s untuk produk yang dihitung sebagai:
Dimana:
Yx/s = rendemen pembentukan sel oleh substrat
Yp/s = rendemen pembentukan produk oleh substrat
Menurut Wang et al.(1978), pertumbuhan juga dapat dihubungkan dengan konsumsi nutrien selain dihubungkan dengan pembentukan produk. Pembentukan
produk tidak mungkin terjadi tanpa adanya sel. Oleh karena itu diharapkan
pertumbuhan dan pembetukan produk terpadankan dengan erat dengan
penggunaan nutrien, dan ini tergantung pada kontrol pengaturan metaboliknya.
Hubungan kinetika di antara pertumbuhan dan pembentukan produk
tergantung pada peranan produk dalam metabolisme sel. Dua buah kinetika yang
umum digunakan adalah kinetika yang menggambarkan sintesis produk selama
pertumbuhan dan kinetika yang menggambarkan sintesis produk setelah
pertumbuhan terhenti. Suatu pola lain yang jarang diterapkan adalah bila
pertumbuhan terjadi tanpa adanya pembentukan produk, tetapi setelah melalui
selang waktu tertentu produk mulai muncul dan pertumbuhan terus berlangsung.
Kinetika pola ini diperlihatkan pada Gambar 5 berikut.
(a) (b) (c)
Gambar 5 Pola kinetika pertumbuhan dan pembetukan produk pada fermentasi
III METODOLOGI PENELITIAN
3.1 Bahan dan Alat
Bahan–bahan yang dipergunakan pada penelitian ini adalah : Ubi jalar
varietas Sukuh, aquades, NaOH, HCl, H2SO4, fenoftalein, CH3COOH, larutan Luff, KI, larutan sodium sulfat 0.1 N, larutan kanji, enzim α-amilase (Liquizims), enzim AMG (Dekstrozims), kultur S. cerevisiae strain ATCC 9763 yang diperoleh dari Departemen Teknologi Pangan Institut Pertanian Bogor, peptone, ekstrak malt, ekstrak khamir, glukosa.
Alat – alat yang digunakan berupa wadah plastik, parut, oven, cawan, kertas
saring, pendingin tegak, reaktor 2 liter, penangas air, inkubator bergoyang, tabung
reaksi, Erlenmeyer, timbangan, Effendorf, botol sampling, aluminium foil, kapas,
tisu, pipet, spektrofotometer, HPLC, GC, pompa peristaltik.
3.2 Metodologi
3.2.1 Persiapan Substrat dan Penelitian Pendahuluan
3.2.1.1 Pengujian Ubi Jalar Yang Digunakan
Sebelum dilakukan pembuatan pati ubi jalar, terlebih dahulu ubi jalar
segar yang akan digunakan dilakukan analisa proximat (kadar air, kadar abu,
kadar protein, kadar lemak, kadar serat kasar) dan kadar pati. Ubi jalar yang
digunakan pada awal persiapan substrat terdiri atas dua jenis yang berbeda
yaitu ubi jalar yang berasal dari Bogor dan ubi jalar dengan varietas Sukuh
yang berasal dari Malang. Prosedur pengujian dapat dilihat pada Lampiran 1.
(a) (b)
Gambar 6 Ubi jalar yang digunakan; (a) Ubi jalar Varietas Sukuh; (b) Ubi
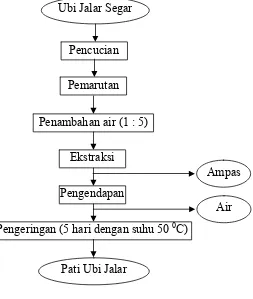
3.2.1.2 Pembuatan Pati Ubi Jalar
Penelitian selanjutnya yaitu dengan membuat pati dari ubi jalar. Setelah
dilakukan pengujian awal, kemudian ubi jalar yang akan digunakan dicuci,
lalu diparut, ditambahkan air dan disaring. Hasil saringan kemudian
diendapkan lalu dikeringkan. Setelah itu dilakukan juga analisa proximat serta
kadar pati dari pati yang telah dibuat. Diagram alir proses pembuatan pati ubi
[image:37.595.222.475.237.536.2]jalar dapat dilihat pada Gambar 7.
Gambar 7 Diagram alir proses pembuatan pati ubi jalar.
Gambar 8 Pati ubi jalar varietas Sukuh yang dihasilkan. Ubi Jalar Segar
Pencucian
Pemarutan
Penambahan air (1 : 5)
Ekstraksi
Pengendapan
Pengeringan (5 hari dengan suhu 50 0C)
Pati Ubi Jalar
Ampas
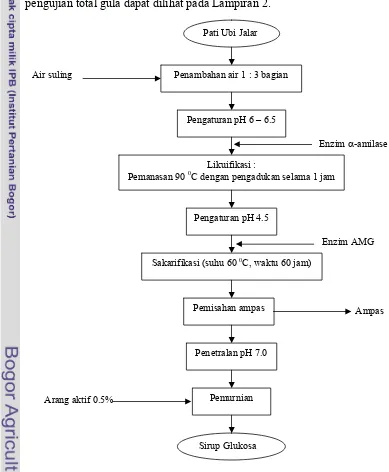
[image:37.595.235.426.567.712.2]3.2.1.3 Pembuatan Sirup Glukosa
Setelah pembuatan pati ubi jalar dilanjutkan dengan pembuatan sirup
glukosa dengan menambahkan enzim α-amilase dan enzim AMG (amiloglukosidase). Diagram alir pembuatan sirup glukosa dapat dilihat pada
Gambar 9. Sirup glukosa yang dihasilkan, selanjutnya dilakukan pengujian
untuk mengetahui kandungan yang terdapat didalamnya. Pengujian yang
dilakukan meliputi kadar gula total. Prosedur analisis serta kurva standar
[image:38.595.106.495.235.707.2]pengujian total gula dapat dilihat pada Lampiran 2.
Gambar 9 Diagram alir proses pembuatan sirup glukosa (Budiyanto, et al.
2006).
Air suling
Enzim α-amilase
Enzim AMG
Ampas
Arang aktif 0.5%
Pati Ubi Jalar
Penambahan air 1 : 3 bagian
Pengaturan pH 6 – 6.5
Likuifikasi :
Pemanasan 90 0C dengan pengadukan selama 1 jam
Pengaturan pH 4.5
Sakarifikasi (suhu 60 0C, waktu 60 jam)
Pemisahan ampas
Penetralan pH 7.0
Pemurnian
3.2.1.4 Persiapan Kultur S. cerevisiae
Media yang digunakan untuk menumbuhkan khamir S. cerevisiae adalah media YMGP yang terdiri atas 5 g ekstrak khamir, 5 g ekstrak malt, 5 g
peptone, dan 20 g glukosa serta 1 liter aquades. Mula–mula bahan ditimbang
sesuai dengan jumlah yang ditentukan. Kemudian dimasukan ke dalam
Erlenmeyer dan dilarutkan dengan aquades.
Erlenmeyer ditutup dengan menggunakan kapas dan aluminium foil
untuk selanjutnya dimasukkan ke dalam autoklaf dan disterilisasi pada suhu
121 0C selama 15 menit. Setelah sterilisasi selesai, Erlenmeyer dikeluarkan dari otoklaf untuk didinginkan pada suhu kamar.
Pembuatan starter dilakukan dengan cara memindahkan kultur murni
khamir S. cerevisiae dari agar miring dengan jarum ose secara aseptis ke dalam media cair yang telah disterilisasi. Kemudian Erlenmeyer tersebut
ditutup kembali dan difermentasikan di dalam inkubator bergoyang selama ≤ 48 jam pada suhu kamar sebelum digunakan sebagai media propagasi pada
fermentasi etanol yang akan dilakukan.
(a) (b)
Gambar 10 Media propagasi (a). Sebelum penambahan kultur; (b). Setelah
propagasi 48 jam.
3.1.2.5 Penentuan Konsentrasi Sirup glukosa yang akan digunakan
Sebelum dilakukan pengujian dengan menggunakan bioreaktor, maka
akan digunakan. Pengujian dilakukan dengan menggunakan konsentrasi 18%,
24%, 30%, dan 36%. Penentuan konsentrasi ini dilakukan pada skala
Erlenmeyer, dengan penambahan kultur starter S. cerevisiae pada media propagasi yang telah berumur ≤ 48 jam. Fermentasi dilakukan selama 72 jam dengan kecepatan agitasi 125 rpm.
Pada proses ini, dilakukan pengambilan sample untuk dianalisis dengan
selang waktu 6 jam sekali. Pengamatan yang dilakukan meliputi total gula,
OD, biomassa, serta kadar etanol yang dihasilkan. Setelah didapatkan
konsentrasi pembentukan etanol yang paling tinggi, maka konsentrasi tersebut
digunakan pada penelitian utama.
3.2.2 Penelitian Utama
3.2.2.1 Variasi kondisi kultivasi pada sistem batch
Sebanyak 1200 ml sirup glukosa yang telah dibuat dengan konsentrasi
terbaik pada penelitian pendahhuluan dimasukkan ke dalam reaktor 2 liter.
Setelah itu reaktor disterilisasi di dalam autoklaf pada suhu 105 0C selama 15 menit. Setelah dingin, kemudian ditambahkan sumber N dan trace element
yang disterilisasi terpisah lalu dilakukan inokulasi dengan media propagasi S. cerevisiae yang telah dibuat sebelumnya. Inokulasi dilakukan sebanyak 10% dari volume substrat yang akan digunakan serta dalam keadaan aseptis setelah
bioreaktor dingin. Inokulasi ini dilakukan untuk setiap variasi perlakuan yang
akan dilakukan. Kondisi aerobik dilakukan dengan aerasi 0.2-0.4 vvm dan
agitasi 150 rpm.
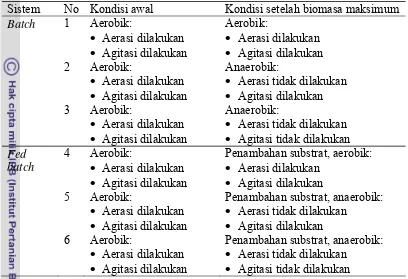
Beberapa variasi pengkondisian yang akan dilakukan pada sistem batch
ini meliputi:
o Reaktor dari awal perlakuan dalam kondisi yang aerobik, dalam hal ini,
diberi aerasi dan agitasi;
o Reaktor dari awal perlakuan dalam kondisi yang aerobik, dalam hal ini,
diberi aerasi dan agitasi; dan setelah mencapai keadaan biomassa yang
maksimum aerasi dihentikan;
o Reaktor dari awal perlakuan dalam kondisi yang aerobik, dalam hal ini,
biomassa yang maksimum kondisi kultivasi dirubah menjadi anaerobik.
Perubahan ini dilakukan dengan meniadakan perlakuan agitasi dan aerasi
pada reaktor yang digunakan.
3.2.2.2 Variasi kondisi kultivasi pada sistem fed batch
Sebanyak 600 ml sirup glukosa yang telah dibuat sebelumnya
dimasukkan ke dalam reaktor 2 liter. Setelah itu reaktor disterilisasi di dalam
autoklaf pada suhu 105 0C selama 15 menit. Setelah dingin, kemudian dilakukan inokulasi dengan media propagasi S. cerevisiae yang telah dibuat sebelumnya. Inokulasi dilakukan dalam keadaan aseptis setelah reaktornya
dingin. Pada wadah lain, juga dipersiapkan substrat sirup glukosa yang telah
steril sebanyak 600 ml untuk dimasukkan ke dalam reaktor dengan laju alir
sesuai dengan nilai μ maks yang diperoleh. Hal ini dimaksudkan untuk melakukan sistem fed batch. Inokulasi ini dilakukan untuk setiap variasi perlakuan yang akan dilakukan.
Beberapa variasi pengkondisian yang akan dilakukan pada sistem fed batch ini meliputi:
o Pada awal kultivasi digunakan sistem batch secara aerobik dengan aerasi dan agitasi, untuk selanjutnya setelah mencapai keadaan biomasa
maksimum dilakukan penambahan substrat secara fed batch dengan laju alir disesuaikan dengan laju pertumbuhan maksimum (μ maks) pada sistem batch dan kondisi aerobik tetap dilakukan dengan menggunakan aerasi dan agitasi.
o Pada awal kultivasi digunakan sistem batch secara aerobik dengan aerasi dan agitasi, untuk selanjutnya setelah mencapai keadaan biomasa
maksimum dilakukan penambahan substrat secara fed batch dengan menghentikan aerasi namun agitasi tetap dilakukan.
o Pada awal kultivasi digunakan sistem batch secara aerobik dengan aerasi dan agitasi, untuk selanjutnya setelah mencapai keadaan biomasa
Secara umum perlakuan yang akan dilakukan pada penelitian utama ini
[image:42.595.106.514.146.425.2]disajikan dalam Tabel 4.
Tabel 4 Variasi perlakuan yang dilakukan pada penelitian utama
Sistem No Kondisi awal Kondisi setelah biomasa maksimum
Batch 1 Aerobik:
• Aerasi dilakukan • Agitasi dilakukan
Aerobik:
• Aerasi dilakukan • Agitasi dilakukan
2 Aerobik:
• Aerasi dilakukan • Agitasi dilakukan
Anaerobik:
• Aerasi tidak dilakukan • Agitasi dilakukan
3 Aerobik:
• Aerasi dilakukan • Agitasi dilakukan
Anaerobik:
• Aerasi tidak dilakukan • Agitasi tidak dilakukan
Fed batch
4 Aerobik:
• Aerasi dilakukan • Agitasi dilakukan
Penambahan substrat, aerobik: • Aerasi dilakukan
• Agitasi dilakukan
5 Aerobik:
• Aerasi dilakukan • Agitasi dilakukan
Penambahan substrat, anaerobik: • Aerasi tidak dilakukan
• Agitasi dilakukan
6 Aerobik:
• Aerasi dilakukan • Agitasi dilakukan
Penambahan substrat, anaerobik: • Aerasi tidak dilakukan
• Agitasi tidak dilakukan
3.2.2.3 Pengamatan dan Analisa
Untuk setiap kondisi kultivasi yang digunakan, dilakukan pengamatan
terhadap biomasa, kadar gula total, pH dan kadar etanol yang dihasilkan.
Proses kultivasi dan fermentasi berlangsung selama 72 jam, untuk masing–
masing perlakuan kondisi. Pengamatan dan pengambilan sampel dilakukan
setiap 6 jam untuk mengetahui keadaan larutan fermentasi. Prosedur pengujian
dan analisa dapat dilihat pada Lampiran 3.
3.2.2.4 Parameter Perhitungan
Parameter yang diukur dan dihitung sebagai indikator kinerja proses
fermentasi adalah:
♦ Kadar etanol yang diproduksi pada akhir fermentasi (p)
♦ Total biomasa atau sel khamir yang dihasilkan pada awal dan akhir fermentasi (x)
♦ Laju pertumbuhan sel spesifik (μ)
♦ Rendemen (Yield) pemakaian substrat terhadap pembentukan sel dan produk (Yx/s dan Yp/s)
♦ Rendemen pembentukan produk terhadap sel (Yp/x) ♦ Efisiensi penggunaan substrat (1-S/So).
3.2 Waktu dan Tempat Penelitian
Penelitian dimulai pada bulan Mei 2007-Maret 2008. Persiapan substrat
dilaksanakan pada Laboratoruim Balai Besar Penelitian Pascapanen Bogor.
Penelitian pendahuluan serta penelitian utama dilakukan pada Laboratorium
Rekayasa Bioproses Pusat Penelitian Sumber Daya Hayati dan Bioteknologi
IV HASIL DAN PEMBAHASAN
4.1 Ekstraksi Pati Ubi Jalar
Ubi jalar merupakan jenis tanaman yang berumbi. Umbi dari ubi jalar
bermacam-macam tergantung dari jenis dan varietas yang diusahakan. Pada
umumnya umbi dari ubi jalar ada dua jenis yaitu yang berumbi keras dan berumbi
lunak. Umbi yang keras memiliki kadar air yang lebih sedikit namun kadar
patinya lebih banyak. Sebaliknya, umbi yang lunak, memiliki kadar air yang
tinggi namun memiliki kadar pati yang lebih rendah. Menurut Lingga et al.
(1986), umbi yang berwarna putih memiliki kadar pati yang lebih tinggi bila
dibandingkan dengan umbi yang berwarna merah. Berikut Tabel 5 merupakan
perbandingan antara ubi jalar yang memiliki umbi berwarna putih dan merah.
Tabel 5 Perbandingan komposisi kimia ubi putih dan merah
Jumlah (%) Komponen
Ubi putih Ubi merah
Air 64.60 79.59
Abu 0.98 0.92
Pati 28.19 17.06
Protein 2.07 1.19
Gula 0.38 0.43
Serat kasar 2.16 5.24
Beta karoten 51.20 174.20
Sumber: Lingga et al. 1986
Berdasarkan uraian di atas, maka dalam penelitian ini digunakan umbi yang
berwarna putih karena diharapkan memperoleh rendemen pati yang lebih banyak.
Salah satu varietas unggul ubi jalar yang memiliki warna daging putih adalah
varietas Sukuh. Varietas unggul ubi jalar lainnya juga banyak, namun memiliki
warna daging umbi jingga dan orange diantaranya yaitu: Daya, Prambanan dan
Borobudur yang memiliki warna kulit dan daging umbi jingga, sedangkan
kelebihan yang terdapat pada ubi jalar varietas Sukuh adalah umur panen yang
relatif singkat (3-3.5 bulan) serta kandungan pati yang tinggi mencapai 31.16%
(Puslittan 2008). Ciri–ciri umum ubi jalar varietas Sukuh dapat dilihat pada
Lampiran 5.
Setelah dilakukan pemilihan varietas ubi jalar, untuk selanjutnya dilakukan
ekstraksi pati dari ubi jalar tersebut. Ekstraksi pati dilakukan dengan
menggunakan dua varietas yang berbeda yaitu ubi jalar yang berasal/dibeli di
daerah Bogor dan ubi jalar yang di beli di Malang dari varietas Sukuh.
Penggunaan dua jenis ubi jalar pada saat ekstraksi pati ini, dimaksudkan untuk
membandingkan varietas unggulan dengan varietas yang biasa terdapat di pasaran.
Ekstraksi yang dilakukan merupakan ekstraksi basah yaitu dengan memarut
ubi serta melakukan penambahan air sebanyak 1 : 5 untuk mengekstrak pati dari
ampasnya. Pemarutan umbi dari ubi jalar tersebut dimaksudkan agar pati yang
terdapat dalam umbi dapat keluar dengan jumlah yang maksimal, karena dengan
pemarutan, maka sel dari umbi tersebut akan pecah. Penambahan air 1 : 5
dimaksudkan untuk melarutkan pati yang terdapat pada ampas ubi sehingga dapat
diperoleh pati yang banyak. Hasil perbandingan rendemen pati ubi jalar dari dua
varietas tersebut dapat dilihat pada Tabel 6.
Tabel 6 Perbandingan rendemen pati dari ubi jalar yang digunakan
Varietas Ubi Jalar Berat Awal Ubi
Jalar (gr)
Berat Akhir Pati
(gr)
Rendemen (%)
Ubi jalar dari Bogor 1537.08 ± 110.36 302.62 ± 39.66 19.65 ± 1.5
Varietas Sukuh 1006 ± 0.05 227 ± 0.14 22.53 ± 1.48
Berdasarkan Tabel 6 di atas, dapat dilihat bahwa rendemen pati yang
dihasilkan dari dua jenis ubi jalar yang digunakan yaitu ubi jalar yang berasal dari
Bogor dan ubi jalar Varietas Sukuh terdapat perbedaan. Pati yang dihasilkan oleh
Ubi jalar dengan varietas Sukuh memiliki rendemen yang paling tinggi.
Hal ini dikarenakan ubi jalar dengan varietas Sukuh merupakan salah satu
jenis ubi jalar varietas unggulan yang memang terkenal dengan kandungan pati
(Musaddad 2005). Oleh karena itu, pembuatan sirup glukosa selanjutnya
dilakukan dengan menggunakan pati yang berasal dari varietas Sukuh tersebut.
Hasil analisa proximat dari ubi jalar varietas Sukuh serta pati yang dihasilkan
dapat dilihat pada Tabel 7 berikut.
Tabel 7 Hasil analisa proximat ubi jalar varietas Sukuh dan pati yang dihasilkan
Parameter (% bb) Ubi Jalar Pati Ubi Jalar
Kadar Air 64.73 ± 1.018 7.03 ± 0.241
Kadar Abu 1.06 ± 0.248 0.27 ± 0.086
Kadar Protein 0.92 ± 0.085 0.86 ± 0.057
Kadar Serat Kasar 0.72 ± 0.184 0
Kadar Lemak 1.72 ± 0.031 0.69 ± 0.243
Kadar Pati 28.21 ± 0.933 92.95 ± 1.633
Hasil analisa proximat di atas menunjukkan nilai kandungan yang terdapat
dalam ubi jalar segar serta pati hasil ekstraksi. Jika dilihat dari kadar airnya, ubi
jalar varietas Sukuh memiliki kandungan air yang lebih rendah bila dibandingkan
dengan ubi jalar varietas Borobudur yang mencapai 71.4%, serta ubi jalar yang
berumbi merah 79.59% (Lingga et al. 1986). Rendahnya kandungan air ini, disebabkan karena ubi jalar varietas Sukuh merupakan jenis ubi jalar yang
memiliki kandungan bahan kering yang tinggi dalam hal ini berupa pati. Menurut
Lingga et al. (1986), ubi jalar yang berumbi putih memiliki kadar air yang lebih sedikit bila dibandingkan dengan ubi jalar yang berumbi merah.
Nilai kadar pati pada ubi jalar segar sebesar 28.21±0.933%. Hal ini berbeda dengan nilai kandungan pati ubi jalar varietas Sukuh yang dilaporkan
oleh Musaddad (2005) sebesar 31% serta Puslittan (2005) sebesar 31.16%.
Perbedaan tersebut kemungkinan disebabkan oleh lamanya waktu panen serta
selang waktu antara pengukuran dari kadar pati tersebut dengan waktu panen dari
ubi terpaut beberapa hari. Menurut Winarno (1992), kandungan pati dalam suatu
bahan akan berkurang seiring dengan lamanya waktu panen. Hal ini disebabkan
terjadinya perubahan oleh enzim yang terdapat dalam tanaman yang dapat
Nilai kadar pati pada ubi jalar yang diukur mencapai 28.21±0.933%, namun hasil rendemen yang diperoleh tidak mencapai nilai kadar pati tersebut yaitu
22.53±1.48%. Perbedaan ini, diakibatkan terjadinya loss (kehilangan) pati pada saat ekstraksi dilakukan. Loss tersebut kemungkinan terdapat pada saat proses pemarutan, pencucian ubi serta pada saat perendaman. Pada saat ekstraksi
kemungkinan masih terdapat sisa pati pada ampas, sehingga tidak ikut terekstraksi.
Setelah dilakukan ekstrasi untuk mendapatkan pati, nilai dari kadar abu,
kadar protein, kadar lemak serta kadar serat kasar dari pati ubi jalar terjadi
penurunan jika dibandingkan dengan parameter yang sama pada ubi jalar segar.
Hal ini disebabkan pada saat ekstraksi, beberapa senyawa berupa lemak, protein,
serat serta abu tidak ikut terekstraksi, namun ikut terbuang bersama ampas.
Nilai kadar pati dari pati ubi jalar mencapai 92.95±1.633%. Hal ini berarti proses ekstraksi yang dilakukan cukup bagus dan efisien Nilai kadar pati tersebut
tidak mencapai angka mutlak 100% karena masih terdapatnya kandungan bahan
lainnya yang berupa lemak, protein, abu, serta air yang masih ikut terbawa dengan
pati setelah proses ekstraksi.
4.2 Pembuatan Sirup Glukosa Ubi Jalar
Proses pembuatan hidrolisat pati dilakukan dengan menggunakan dua
enzim yaitu enzim α-amilase dan enzim AMG (amiloglukosidase). Penggunaan
kedua enzim ini dimaksudkan untuk merubah komponen pati yang merupakan
polisakarida menjadi glukosa serta gula–gula sederhana lainnya yang merupakan
monosakarida. Perubahan ini dimaksudkan agar proses fermentasi dengan
menggunakan kultur S. cerevisiae dapat berlangsung. Efisiensi proses pembuatan sirup glukosa dari pati ubi jalar varietas Sukuh dapat dilihat pada Tabel 8 berikut.
Proses pembuatan sirup glukosa ini berlangsung dalam dua tahap utama
yaitu likuifikasi dan sakarifikasi. Tahap pertama yang berlangsung adalah tahap
likuifikasi yang terjadi pada suhu 90 0C selama 1 jam. Pada tahap ini, digunakan enzim α-amilase. Enzim α-amilase termasuk enzim pemecah dari dalam molekul, bekerja menghidrolisa dengan cepat ikatan α-1,4 glukosida pati yang telah mengalami gelatinisasi. Pada proses likuifikasi ini, α-amilase memecah ikatan α
amilopektin menghasilkan oligosakarida dengan jumlah monomer dua sampai
enam (Judoamidjojo et al., 1989).
Tabel 8 Konversi pati menjadi sirup glukosa
Ulangan Berat
pati (g)
Volume Akhir
Sirup (L)
Total Gula
(g/L)
Berat Gula
Akhir (g)
Efisiensi (%)
I 2000 4.642 421.89 1958.41 97.92
II 2000 2.300 835.101 1920.73 96.04
III 2000 4.085 481.99 1968.9