STUDI IRADIASI SINAR GAMMA PADA
KULTUR KALUS NODULAR MANGGIS UNTUK
MENINGKATKAN KERAGAMAN GENETIK
DAN MORFOLOGI REGENERAN
OLEH :
WARID ALI QOSIM
SEKOLAH PASCASARJANA
STUDI IRADIASI SINAR GAMMA PADA
KULTUR KALUS NODULAR MANGGIS UNTUK
MENINGKATKAN KERAGAMAN GENETIK DAN
MORFOLOGI REGENERAN
OLEH :
WARID ALI QOSIM
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada Program Studi Agronomi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul : Studi Iradiasi Sinar Gamma pada Kultur Kalus Nodular Manggis untuk Meningkatkan Keragaman Genetik dan Morfologi
Regeneran.
Nama : Warid Ali Qosim Nomor pokok : A156010031 Program Studi : Agronomi
Disetujui,
Komisi Pembimbing
Prof. Dr. Ir. H. Roedhy Poerwanto, M.Sc. Ketua
Prof. Dr. Ir. G.A. Wattimena, M.Sc. Dr. Ir. Witjaksono, M.Sc. Anggota Anggota
Diketahui,
Ketua Program Studi Agronomi, Dekan Sekolah Pascasarjana,
Dr. Ir. Satriyas Ilyas, M.S. Prof. Dr. Ir. Syafrida Manuwoto, M.Sc.
SURAT PERNYATAAN
Bersama ini saya menyatakan dengan sesungguhnya bahwa segala pernyataan dalam disertasi saya yang berjudul :
“Studi Iradiasi Sinar Gamma pada Kultur Kalus Nodular Manggis untuk
Meningkatkan Keragaman Genetik dan Morfologi Regeneran”.
merupakan gagasan dan hasil penelitian saya sendiri yang dibimbing oleh Tim Komisi Pembimbing. Disertasi ini belum pernah diajukan untuk memperoleh gelar apapun di perguruan tinggi lain. Semua data dan informasi yang digunakan telah dinyatakan secara akurat, jelas dan dapat dipercaya kebenarannya.
Bogor, Januari 2006 Yang membuat pernyataan,
Warid Ali Qosim
RIWAYAT HIDUP
WARID ALI QOSIM dilahirkan di Indramayu pada tanggal 7 Mei 1966 sebagai anak ketiga dari pasangan H. Casim (alm) dan H. Rasih. Penulis menyelesaikan pendidikan dasar di SDN Tugu III, Indramayu pada tahun 1979, pendidikan menengah pertama di MTsN Babakan Ciwaringin, Cirebon pada tahun 1982 dan lulus pendidikan menengah atas di MAN Babakan Ciwaringin, Cirebon pada tahun 1985. Pendidikan sarjana ditempuh di Program Studi Pemuliaan Tanaman, Jurusan Budidaya Pertanian, Fakultas Pertanian Universitas Padjadjaran (UNPAD), lulus pada tahun 1990. Pada tahun 1995, penulis diterima di program studi Ilmu Tanaman Bidang Kajian Utama Pemuliaan Tanaman pada Program Pascasarjana UNPAD, lulus pada tahun 1999. Pada tahun 2001, penulis berkesempatan untuk melanjutkan ke Program Doktor pada Program Studi Agronomi pada Sekolah Pascasarjana (SPs) Institut Pertanian Bogor (IPB). Beasiswa pendidikan pascasarjana (BPPS) diperoleh dari Departemen Pendidikan Nasional Republik Indonesia.
WARID ALI QOSIM bekerja sebagai staf pengajar pada Program Studi Pemuliaan Tanaman Fakultas Pertanian UNPAD sejak tahun 1991 sampai sekarang. Dalam kegiatan profesi, penulis ikut sebagai pengurus Perhimpunan Ilmu Pemuliaan Indonesia (PERIPI) komda Jawa Barat
ABSTRAK
WARID ALI QOSIM. 2006. Studi Iradiasi Sinar Gamma pada Kultur Kalus Nodular Manggis untuk Meningkatkan Keragaman Genetik dan Morfologi Regeneran. Di bawah bimbingan ROEDHY POERWANTO sebagai Ketua Komisi Pembimbing, GA WATTIMENA dan WITJAKSONO sebagai anggota.
Tanaman manggis termasuk tanaman apomik obligat dan karena itu keragaman genetiknya sempit. Peningkatan keragaman genetik ini dapat dilakukan dengan induksi mutasi dengan sinar gamma. Tujuan dari penelitian ini adalah mengembangkan metode regenerasi tanaman manggis secara in vitro dan meningkatkan keragaman genetik manggis melalui induksi mutasi dengan iradiasi pada kultur kalus nodular. Penelitian terdiri dari empat rangkaian percobaan, yaitu : (1) Studi regenerasi tanaman manggis in vitro, (2) Induksi mutasi dengan sinar gamma pada kultur kalus nodular dan uji keragaman dari regeneran, (3) Studi anatomi daun mutan putatif manggis in vitro, (4) Uji keragaman genetik mutan putatif dengan marka RAPD. Percobaan dilakukan di Laboratorium Kultur Jaringan dan Molekuler Pusat Kajian Buah-buahan Tropika (PKBT) IPB, sejak Juli 2002 sampai dengan Desember 2005.
Untuk mendapatkan mutan solid, iradiasi sinar gamma dilakukan terhadap kalus nodular. Oleh karena itu, dalam penelitian ini dipelajari organogenesis tidak langsung dari kalus nodular manggis membentuk tunas. Pembentukan kalus nodular optimum diperoleh pada medium MS dengan kombinasi perlakuan 2,22 µM BAP dan 2,27 µM TDZ menghasilkan 79, 4 % eksplan membentuk kalus nodular, 3,6 jumlah kalus nodular per eksplan dan waktu membentuk kalus nodular 24,5 hari. Sedangkan regenerasi tunas diperoleh pada medium WPM dengan 2,2 µM BAP menghasilkan 34,7 % kalus nodular membentuk tunas, 5,9 jumlah tunas dan waktu membentuk tunas 13,5 minggu.
Kalus nodular diiradiasi dengan sinar gamma dengan level dosis (0; 5; 10; 15; 20; 25; 30; 35; 40) Gy. Iradiasi dengan sinar gamma mempengaruhi daya regenerasi dari kalus nodular membentuk tunas. Respon daya regenerasi kalus nodular menurun dengan meningkatnya tingkat iradiasi. Variabel persen kalus nodular membentuk tunas dan jumlah tunas per kalus nodular menurun secara linier dengan meningkatnya dosis iradiasi. Sedangakan variabel waktu pembentukan tunas meningkat secara linier dengan meningkatnya dosis iradiasi. Dosis respon yang menghasilkan respon sebanyak 50 % dari regenaran kontrol tanpa iradiasi (DR50) untuk persen kalus
nodular membentuk tunas adalah 25 Gy.
memiliki parenkima palisade, jaringan bunga karang dan daun yang lebih tebal dari kontrol. Namun, pada umumnya jaringa n bunga karang dan jumlah berkas pembuluh dari regeneran mutan lebih tebal dan lebih banyak
dari pada regeneran kontrol. Perubahan anatomi daun pada regeneran mutan manggis in vitro tersebut sangat baik sebagai mutan putatif.
ABSTRACT
WARID ALI QOSIM. 2006. Study of gamma ray irradiation of mangosteen nodular callus increased genetic and morphological variability of theregenerants. Supervised by ROEDHY POERWANTO as chairman, GA WATTIMENA and WITJAKSONO as members of the advisory committee.
Mangosteen is an apomict obligate plant and consequently it has narrow genetic variability. Improvement of the genetic variability of this plant can be done by mutation induction with gamma rays. The purpose of this study was to develop in vitro plant regeneration and to use it for increasing the variability of mangosteen through induced mutation with gamma rays irradiation on nodular callus culture. This study consisted of four sets of experiments: (1) Study of in vitro regeneration of mangosteen, (2) Induced mutation with gamma rays irradiation on nodular callus and phenotypic variability among analysis among regenerants, (3) Anatomical analysis of putative mutants regenerants in vitro, (4) RAPD marker-based genetic variability test of putative mutant regenerants. The experiments were conducted at the Tissue Culture and Molecular laboratory of the Center Tropical Fruits Studies-IPB, from September 2002 to December 2005.
To get solid mutants, gamma ray irradiation was subjected to nodular callus. This research used indirect organgenesis (regeneration of shoot from nodular callus). The optimum medium for formation of nodular callus was MS medium with 2,2 µM BAP and 2,27 µM TDZ and resulted in 79,4 % explants formed nodular callus, 3,6 nodular callus per explant and 24,5 day for nodular callus formation. While transfer of nodular callus on to WPM medium supplemented with 2,2 µM BAP resulted in 34,7 % shoot formation, 5,9 shoot per nodular callus, and time of shoot formation to be 13,5 weeks.
Nodular callus was irradiated with gamma rays at dose level of 0, 5, 10, 15, 20, 25, 30, 35, 40 Gy. Gamma rays irradiation affected the regeneration capacity of nodular callus. Regeneration capacity of nodular callus decreased linearly with increasing level of irradiation for variable percentage of nodular callus forming shoot and variable of number of shoot per callus nodular, while variable of time of formed shoot increased linearly with increasing level of irradiation. Response dose was yielded response 50 % from control regenerants DR50 to percentage of nodular callus
forming shoot was 25 Gy.
regenerant. However, ge nerally, the thickness spongy mesophyll and the number of vascular of the mutant regenerants were greater than that of control regenerants.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga karya ilmiah dalam bentuk disertasi berhasil diselesaikan. Penelitian untuk disertasi telah dilaksanakan pada bulan Juli 2002 – Desember 2005 dengan judul “Studi Iradiasi Sinar Gamma pada Kultur Kalus Nodular Manggis untuk Meningkatkan Keragaman Genetik dan Morfologi Regeneran”.
Pada kesempatan ini, penulis menyampaikan terima kasih banyak dan penghargaan kepada yang terhormat Bapak Prof. Dr.Ir. H. Roedhy Poerwanto, M.Sc. dan keluarga atas bimbingan beliau yang sangat lugas, cermat, seksama dan terarah baik dalam bidang akademis, maupun keprofesian di bidang buah-buahan tropika, bimbingan tersebut sangat berharga dalam mengubah pola pikir penulis dalam memahami dan mengembangkan buah-buahan tropik di Indonesia. Selain itu, penulis mendapat bimbingan kesabaran, disiplin dan konsistensi dari beliau. Budi baik beliau akan menjadi catatan khusus penulis dalam mengembangkan bidang akademis dan keprofesian di bidang buah-buahan.
Penghargaan dan ucapan terima kasih yang tulus juga disampaikan kepada Bapak Prof. Dr. Ir. G.A. Wattimena, M.Sc. dan Dr. Ir. Witjaksono, M.Sc. atas bimbingan dan saran-sarannya yang terarah, cermat dan lugas sejak merumuskan usulan penelitian sampai menjadi laporan penelitian ini. Terima kasih disampaikan kepada Dr. Ir. Darda Effendi, MSi, Dr. Ir. Nurul Khumaida, MSi dan Dr. Ika Mariska sebagai dewan penguji di luar komisi pembimbing.
Ucapan terima kasih disampaikan kepada Rektor Universitas Padjadjaran dan Dekan Fakultas Pertanian Universitas Padjadjaran atas ijin dan kesempatan yang diberikan penulis untuk mengikuti program doktor (S3) di SPs IPB. Ucapan terima
kasih juga disampaikan kepada kepala Laboratorium Pemuliaan Tanaman Ibu Prof.Dr.Ir. Hj. Murdaningsih HK, M.Sc. dan Ketua Program Studi Pemuliaan Tanaman Bapak Dr. Ir. Medy Rachmadi, MP atas dorongan untuk melanjutkan studi S3 di IPB, begitu juga untuk Bapak Prof. Dr. Ir. H. Achmad Baihaki, M.Sc., Prof. Dr.
MS., penulis sampaikan terima kasih atas ijin dan surat rekomendasinya. Serta rekan-rekan staf pengajar PS Pemuliaan Tanaman dan Jurusan Budidaya Pertanian UNPAD atas segala bantuan moril yang telah diberikan. Kepada Rektor IPB, Dekan Sekolah Pascasarjana IPB, Dekan Faperta IPB dan Ketua Program Studi Agronomi SPs IPB, penulis sampaikan terima kasih dan penghargaan atas segala pelayanannya.
Penulis mengucapkan terima kasih sedalam-dalamnya kepada kepala Pusat Kajian Buah-buahan Tropika (PKBT) Lembaga Penelitian IPB atas dukungan dana penelitian dan fasilitas laboratorium melaui proyek RUSNAS. Ucapan terima kasih disampaikan Kepada Dirjen Dikti Departemen Pendidikan Nasional melalui beasiswa BPPS dan Hibah Bersaing XII atas dukungan dana selama penulis mengikuti pendidikan dan penelitian S3 di SPs IPB.
Rasa hormat dan terima kasih yang sebesar-besarnya penulis sampaikan kepada Ayahanda H. Casim (alm) dan Ibunda H. Rasih, Bapak mertua Raden S. Arifin dan Ibu mertua Anah Hendrayanah yang telah memberikan kasih sayang, doa restu, dorongan, semangat dan motivasi. Penghargaan yang sangat dalam dan kebanggaan yang tulus disampaikan kepada istri tercinta Raden Nia Nurhayati dan anak-anakku yang tersayang Winna Firdawati dan Inneke Amalia atas segala pengorbanan, ketabahan, pengertian dan dorongan semangat yang telah diberikan kepada penulis selama mengikuti pendidikan S3 di SPs IPB.
Ucapan terima kasih kepada Ibu Prof. Dr. Ir. Syafrida Manuwoto, M.Sc., Bapak Prof. Dr. Ir. Roedhy Poerwanto, M.Sc., Bapak Dr. Ir. Sobir, M.S., Ibu Ir. Yayah K. Wagiono, M.Sc., Prof. Dr. Ir. Sri Setyati Haryadi, M.Sc., Dr. Ir. Sriani Suprihati, M.S., Dr. Ir. Darda Effendi, MS, serta para peneliti dan staf Pusat Kajian Buah-buahan Tropika (PKBT) LP-IPB atas segala fasilitas dan kerjasamanya selama penulis mengikuti penelitian untuk program S3.
Penulis mengharapkan disertasi ini bermanfaat untuk mengembangkan buah-buahan tropika di Indonesia dan pengembangan ilmu pertanian pada umumnya. Disertasi ini masih banyak kekurangan, penulis sangat mengharapkan kritik dan saran untuk perbaikan disertasi ini. Semoga Allah SWT memberikan balasan dan rahmat-Nya kepada semuanya, Amin.
Bogor, Januari 2006
DAFTAR ISI
Bab Halaman
Ringkasan Summary
Kata Pengantar i
Daftar Isi iv
Daftar Tabel vi
Daftar Gambar viii
Daftar Lampiran x
Daftar Istilah (Glossary) xi
I. PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 6
Strategi Penelitian 6
Manfaat Penelitian 8
II. TINJAUAN PUSTAKA 9
Tanaman Manggis 9
Keragaman pada Manggis 12
Apomiksis pada Manggis 13
Kultur Jaringan pada Manggis 16
Induksi Mutasi In Vitro 17
Mekanisme Mutasi pada Tanaman 23
Deteksi Mutan Manggis dengan Analisis RAPD 26 Identifikasi Mutan Manggis dengan Anatomi Daun 28 III. STUDI REGENERASI TANAMAN MANGGIS IN VITRO 31
Abstrak 31
Pendahuluan 30
Bahan dan Metode 32
Hasil dan Pembahasan 36
Kesimpulan dan Saran 59
IV. INDUKSI MUTASI DENGAN IRADIASI SINAR GAMMA PADA MANGGIS IN VITRO
61
Bahan dan Metode 62
Hasil dan Pembahasan 65
Kesimpulan dan Saran 77
V. STUDI ANATOMI DAUN PADA MUTAN MANGGIS IN VITRO
78
Abstrak 78
Pendahuluan 78
Bahan dan Metode 80
Hasil dan Pembahasan 81
Kesimpulan dan Saran 94
VI. DETEKSI MUTAN MANGGIS IN VITRO DENGAN MARKA RAPD
95
Abstrak 95
Pendahuluan 95
Bahan dan Metode 97
Hasil dan Pembahasan 101
Kesimpulan dan Saran 112
VII. PEMBAHASAN UMUM 113
VIII. KESIMPULAN UMUM DAN SARAN 120
Kesimpulan 120
Saran 121
DAFTAR PUSTAKA 122
DAFTAR TABEL
No. Judul Halaman
1. Luas pane n, , produksi, produktivitas volume dan nilai ekspor manggis di Indonesia Tahun 1996 - 2003
2 2. Berbagai dosis dan mutagen yang digunakan pada beberapa
Tanaman membiak vegetatif atau tahunan
20 3. Varietas/klon komersial tanaman buah-buahan yang dihasil
Kan mutasi dan karakter yang diperbaiki
25 4. Nilai rata-rata dan hasil uji gugus berganda Duncan pada
jumlah tunas organogenesis pada media MS setelah 16 minggu kultur
47
5. Nilai rata-rata dan hasil uji gugus berganda Duncan pada persentase eksplan yang membentuk kalus nodular, jumlah kalus nodular per eksplan dan waktu membentuk kalus nodular setelah empat minggu kultur
50
6. Nilai rata-rata dan hasil uji gugus berganda Duncan pada jumlah tunas setelah 20 minggu kultur
55 7. Nilai rata-rata dan hasil uji gugus berganda Duncan pada
jumlah pasang daun dan jumlah panjang tunas akibat perlakuan iradiasi sinar gamma pada media WPM 2,2 µM BAP setelah 20 minggu kultur
69
8. Keragaman fenotipik dan jumlah mutan potensial yang dihasilkan akibat dosis iradiasi sinar gamma. menurut variabel persentase kultur membentuk tunas dan jumlah tunas per kalus nodular pada medium WPM 2,2 µM BAP
71
9. Keragaman fenotipik dan jumlah mutan potensial yang dihasilkan akibat dosis iradiasi sinar gamma menurut variabel jumlah pasang daun dan waktu membentuk tunas planlet pada medium WPM 2,2 µM BAP
71
10. Keragaman fenotipik dan jumlah mutan potensial yang dihasilkan akibat dosis iradiasi sinar gamma menurut variabel panjang tunas pada medium WPM 2,2 µM BAP
72
11. 21 regeneran hasil seleksi dan satu genotip kontrol 75 12. Pengamatan irisan paradermal pada beberapa regeneran
manggis in vitro
84 13. Pengamatan irisan transversal pada beberapa regeneran
manggis in vitro
90 14. Jumlah pita hasil amplifikasi lima primer acak pada analisis
RAPD
dendogram analisis RAPD
16. Matrik Kesamaan genetik 22 regeneran dan kontrol manggis berdasarkan marka RAPD
108 17. Matrik Kesamaan ge netik 22 regeneran dan kontrol manggis
dan kontrol berdasarkan karakter morfologi
110 18. Pengelompokan 22 regeneran dan kontrol berdasarkan
dendogram karakter morfologi
DAFTAR GAMBAR
No. Judul Halaman
1. Skema kerangka pemikiran penelitian induksi mutasi mangis in vitro
4 2. Skema penelitin pemuliaan induksi mutasi pada manggis in
vitro
7 3. Perbandingan siklus hidup tanaman normal (A); apomiksis
gametofit (B); dan nuselar embriony (C)
15 4. Irisan transversal daun manggis (Pembesaran 400X) 30 5. Pohon manggis No. 8 (A), Buah manggis (B) 33 6. Skema studi regenerasi tanaman manggis in vitro 33 7. Bahan tanaman untuk organogenesis langsung 35 8. Bakal tunas adventif mulai muncul dari permukaan biji (A);
Tunas multiple berasal dari perlakuan 22,2 µM BAP
38 9. Pengaruh konsentrasi BAP terhadap persentase pembentukan
tunas pada perkecambahan manggis dalam media MS setelah tiga minggu kultur
39
10. Pengaruh konsentrasi BAP terhadap jumlah tunas per eksplan pada perkecambahan manggis dalam media MS setelah tiga minggu kultur
39
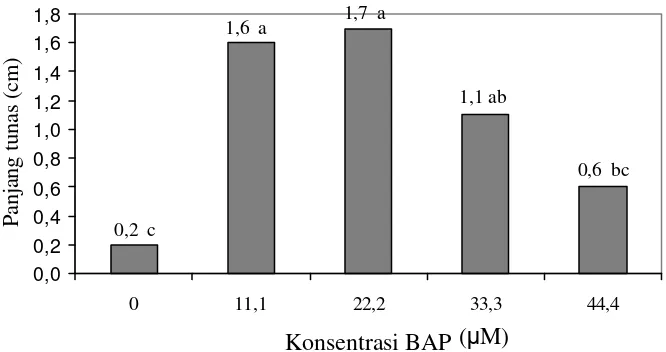
11. Pengaruh konsentrasi BAP terhadap waktu pembentukan tunas pada perkecambahan manggis dalam media MS setelah tiga minggu kultur
40
12. Pengaruh konsentrasi BAP terhadap panjang tunas pada perkecambahan manggis dalam media MS setelah tiga minggu kultur
41
13. Bakal tunas muncul dari tulang daun (A); Tunas adventif dari perlakuan 22,2 µM BAP (B)
43 14. Pengaruh konsentrasi BAP terhadap pembentukan tunas pada
organogenesis langsung dalam media MS setelah 16 minggu kultur
44
15. Pengaruh konsentrasi BAP terhadap jumlah tunas per eksplan pada organogenesis langsung dalam media MS setelah 16 minggu kultur
45
16. Pengaruh konsentrasi BAP terhadap waktu pembentukan tunas pada organogenesis langsung dalam media MS setelah 16 minggu kultur
45
17. Pengaruh konsentrasi BAP terhadap jumlah pasang daun pada organogenesis langsung dalam media MS setelah 16 minggu kultur
48
dari tulang daun
19. Kalus nodular muncul dari tulang daun (A); kalus nodular dari perlakuan 2,22 µM BAP dan 2,27 µM TDZ
48
20. Proses terbentuknya tunas 51
21. Pengaruh konsentrasi BAP terhadap persentase kalus nodular membentuk tunas pada organogenesis tidak langsung dalam media WPM setelah 20 minggu kultur
52
22. Pengaruh konsentrasi BAP terhadap jumlah tunas per kalus nodular pada organogenesis tidak langsung dalam media WPM setelah 20 minggu kultur
53
23. Pengaruh konsentrasi BAP terhadap waktu pembentukan tunas pada organogenesis tidak langsung dalam media WPM setelah 20 minggu kultur
54
24. Pengaruh konsentrasi BAP terhadap jumlah pasang daun pada organogenesis tidak langsung dalam media WPM setelah 20 minggu kultur
55
25. Irisan transversal kalus nodular yang mengalami diferensiasi membentuk tunas (A); tunas pucuk meristem pada perlakuan 2,22 µM BAP
56
26. Perbandingan tiga tipe regenerasi tanaman berdasarkan persentase pembentukan tunas
57 27. Perbandingan tiga tipe regenerasi tanaman berdasarkan jumlah
tunas
58 28. Perbandingan tiga metode regenerasi tanaman berdasarkan
waktu pembentukan tunas
58
29. Gambar Chamber 4000 A 63
30. Pengaruh dosis iradiasi sinar gamma terhadap persentase kalus nodular membentuk tunas pada medium WPM 2,2 µM BAP
66 31. Pengaruh dosis iradiasi sinar gamma terhadap jumlah tunas per
kalus nodular membentuk tunas pada medium WPM 2,2 µM BAP
67
32. Pengaruh dosis iradiasi sinar gamma terhadap waktu pembentukan tunas pada medium WPM 2,2 µM BAP
68 33. Penampilan mutan albino pada 5 Gy (R-5/2) dan R-10/1 (B) 69 34. Struktur anatomi daun manggis irisan paradermal (400X) 80 35. Perbandingan struktur anatomi irisan paradermal daun manggis 85 36. Struktur anatomi daun manggis irisan transversal (400X) 86 37. Perbandingan struktur anatomi irisan transversal daun manggis 88 38. Pola pita DNA 22 regeneran dan tanaman kontrol pada lima
primer
102 39. Dendogram tanaman regeneran manggis in vitro berdasarkan
analisis RAPD
105 40. Dendogram tanaman regeneran manggis in vitro berdasarkan
karakter morfologi
DAFTAR LAMPIRAN
No. Judul Halaman
1. Komposisi media MS dan WPM 134
2. Proses pembuatan media MS 135
3. Analisis varians pengaruh BAP terhadap variabel yang diamati pada perkecambahan manggis empat minggu setelah kultur
136
4. Analisis varians pengaruh BAP terhadap variabel yang diamati pada organogenesis langsung 16 minggu setelah kultur
137
5. Analisis varians pada persentase eksplan membentuk kalus nodular, jumlah kalus nodular per eksplan dan waktu
membentuk kalus nodular setelah empat minggu kultur
138
6. Analisis varians variabel yang diamati pada regenerasi tanaman akibat perlakuan BAP pada media WPM setelah 20 minggu kultur
139
7. Analisis varians variabel yang diamati pada regenerasi tanaman akibat iradiasi gamma pada media WPM 2,2 µM BAP setelah 20 minggu kultur
140
8. Proses pembuatan preparat irisan paradermal dan transversal daun manggis ……….
141 9. Komposisi larutan dan bahan-bahan yang digunakan untuk
isolasi DNA, analisis RAPD dan elektroforesis ………….
144 10. Nilai Rasio absorbans λ260/280 dan konsentrasi DNA pada
beberapa regeneran manggis
147 11. Data biner pola pita RAPD 22 regeneran dan kontrol manggis
in vitro
148 12. Data biner karakter morfologi 22 regeneran dan kontrol
manggis in vitro
I. PENDAHULUAN
Latar Belakang
Manggis (Garcinia mangostana L.) merupakan salah satu tanaman buah tropika yang digemari oleh masya rakat dan dijuluki sebagai Queen of tropical fruit (Cox, 1976). Buah manggis memiliki nilai ekonomi tinggi dan mempunyai prospek yang baik untuk dikembangkan sebagai komoditi ekspor.
Berdasarkan data statistik, volume ekspor buah manggis tahun 2002 adalah 6.512,423 ton dengan nilai ekspor US $ 6.956.915, sedangkan volume ekspor buah manggis tahun 2003 adalah 9.304,511 ton dengan nilai ekspor US $ 9.306.042 atau volume ekspor meningkat 42,8 % (Tabel 1) (Departemen Pertanian, 2004).
Di Indonesia tanaman manggis tersebar hampir di semua kepulauan. Luas panen dari tahun ke tahun meningkat terus. Pada tahun 2002 luas panen 8.051 ha mengalami peningkatan menjadi 9.354 ha pada tahun 2003 atau meningkat 16,2 %. Begitu juga, produksi manggis terus mengalami peningkatan dari 62.055 ton pada tahun 2002 menjadi 79.073 ton pada tahun 2003 atau meningkat 27,4 % (Tabel 1). Tabel 1. Luas panen, produksi, produktivitas, volume dan nilai ekspor manggis di
Indonesia tahun 1999 – 2003
Ekspor Manggis Tahun Luas Panen
(Ha)
Produksi (ton)
Produktivitas
(kw/ha) Volume (ton) Nilai (US $) 1999 4.124 19.174 46,49 4.743,493 3.887,816 2000 4.124 26.400 46,49 7.182,089 5.885.035 2001 4.607 25.812 56,03 4.868,528 3.953.234 2002 8.051 62.055 77,08 6.512,423 6.956.915 2003 9.354 79.073 84,53 9.304,511 9.306.042
Sumber : Departemen Pertanian, 2004 (www. Deptan.go.id , download April 2004)
produktivitas pohon manggis di Wanayasa (Purwakarta) dapat mencapai 500 kg buah per pohon. Produktivitas yang rendah disebabkan kebun manggis tidak dikelola dengan baik. Peningkatan produksi manggis dapat ditingkatkan antara lain dengan kultur teknis dan penggunaan klon unggul manggis.
Tanaman manggis mempunyai kelemahan, yaitu : (1) fase juvenil panjang, tanaman manggis pertama berbuah setelah berumur 10-15 tahun sejak tanam (Wiebel, 1993), (2) lambatnya laju pertumbuhan bibit. Kelemahan tersebut dapat diperbaiki melalui program pemuliaan tanaman. Menurut Poerwanto (2000) pemuliaan tanaman manggis diarahkan untuk mendapatkan sifat pertumbuhan cepat, masa juvenil pendek, produktivitas tinggi, kualitas buah yang baik dan tahan terhadap hama dan penyakit. Rekombinasi genetik dengan teknik hibridisasi tidak dapat dilakukan karena benang sari tidak dapat berkembang (rudimenter) dan serbuk sari bersifat hampa (Richards, 1990b).
Biji manggis merupakan bijiapomik obligat. Embrio manggis berkembang dari sel nuselus pada jaringan ovul (Richard, 1990a), sehingga embrio manggis yang muncul merupakan embrio somatik dan secara genetik mewarisi sifat sama dengan induknya (Horn, 1940; Verheij & Coronel, 1992). Secara teori, tidak ada keragaman genetik pada tanaman manggis. Ternyata di lapang tanaman manggis ada keragaman, mungkin disebabkan oleh faktor lingkungan atau perubahan genetik akibat mutasi alami (Ramage et al., 2004; Supriyanto et al., 1999).
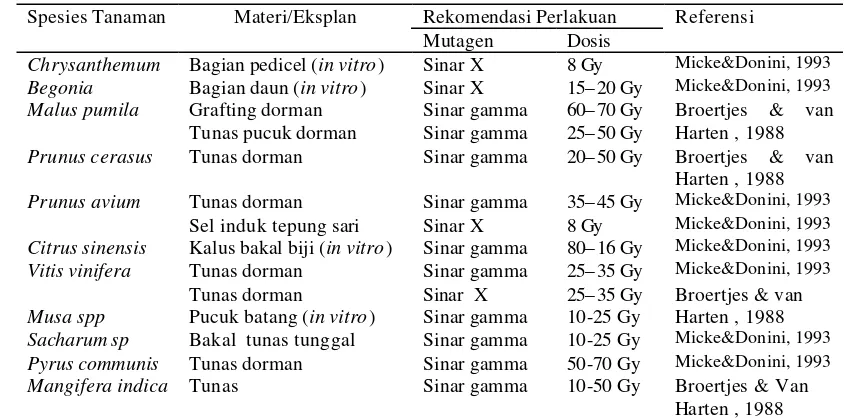
Mutasi spontan terjadi di alam dengan frekuensi sangat rendah, yaitu 10-6 per pembelahan sel (van Harten, 1998). Frekuensi mutasi dapat ditingkatkan dengan teknik induksi mutasi. Mutagen fisik yang sering digunakan antara lain sinar gamma (ã) yang bersumber dari isotop Cobalt-60 (60Co) dan Caesium–137 (137Cs). Energi yang berasal dari sinar gamma dapat mengubah material genetik tanaman (Broertjes & van Harten, 1988).
Menurut Micke & Donini (1993), pada umumnya bagian tanaman yang diiradiasi adalah biji, sedangkan untuk tanaman yang diperbanyak secara vegetatif adalah umbi, stek, stolon, dan rimpang. Bagian tanaman tersebut merupakan jaringan multiseluler. Apabila jaringan multiseluler diiradiasi, maka akan menghasilkan mutasi sektoral dan mutan tersebut bersifat kimera. Kimera adalah jaringan tanaman yang mengandung sel-sel yang mengalami mutasi dan sel-sel normal, sel-sel dalam jaringan tersebut memiliki konstitusi genetik yang berbeda (Broertjes, 1977). Kelemahan mutan kimera secara genetik tidak stabil, sehingga tidak dapat diwariskan ke generasi selanjutnya. Pada jeruk terjadi kimera sektoral dimana kulit buah terdapat dua warna, yaitu merah dan orange-kekuningan (Soost, 1987). Pada apel terjadi kimera periklinal pada warna buah akibat iradiasi 80 Gy (Tilney-Basset, 1987).
sulit dipisahkan, subkultur dengan memisahkan ruas batang sangat sulit, daya regenerasinya rendah sehingga kemungkinan berhasilnya rendah dan membutuhkan waktu yang lama.
Mutan solid dapat diperoleh secara langsung, jika bagian yang diiradiasi berupa kalus, suspensi sel, embrio somatik atau protoplas (Maluszynski et al., 1995). Kelemahannya ialah bagian tersebut memiliki daya regenerasi yang rendah (van Harten, 1998). Oleh karena itu, daya regenerasi harus ditingkatkan dengan mencari protokol yang baku dengan modifikasi medium dan zat pengatur tumbuh yang digunakan. Selain bagian tersebut, mutan solid dapat diperoleh dari eksplan daun yang diiradiasi selanjutnya diregenerasikan menjadi tunas adventif, karena tunas adventif berasal dari sel epidermis (Broertjes & van Harten, 1988). Skema kerangka pemikiran penelitian induksi mutasi manggis in vitro tersaji dalam Gambar 1.
Iradiasi γ
mutan kimera biji manggis/ pucuk in vitro
subkultur berulang kalus nodular kelemahan daya regenerasi pada manggis sulit dari eksplan daun rendah
dilakukan
Iradiasi γ
mutan solid kalus nodular peningkatan daya teriradiasi regenerasi
tunas adventif mutan solid
Ada beberapa opsi tipe regenerasi tanaman yang dikembangkan dengan urutan prioritas sebagai berikut, yaitu : (1) embriogenesis somatik atau suspensi sel, (2) organogenesis tidak langsung (pembentukan tunas dari kalus nodular), (3) organogenesis langsung (pembentukan tunas dari daun) dan (4) perkecambahan biji. Namun dalam penelitian pendahuluan, regenerasi tanaman melalui embrio somatik atau suspensi sel tidak berhasil dikembangkan, hanya tiga tipe regenerasi tanaman yang berhasil dikembangkan, yaitu organogenesis tidak langsung, organogenesis langsung dan perkecambahan biji. Dibandingkan dua tipe regenerasi lain, organogenesis tidak langsung memberikan peluang lebih besar untuk mendapatkan mutan solid. Oleh karena itu, tipe regenerasi ini yang digunakan untuk penelitian induksi mutasi manggis in vitro. Perkecambahan biji dan organogenesis langsung dikembangkan hanya untuk mendukung organogenesis tidak langsung.
Goh e t al. (1994) menyatakan bahwa pembentukan tunas adventif manggis dapat berasal dari eksplan daun setelah ditanam pada medium WPM (Woody Plant Medium) + 22,2 µM BAP (Benzilaminopurin). Sedangkan Te-chato & Lim (2000) menyatakan bahwa induksi kalus nodular manggis in vitro setelah ditanam pada medium MS (Murashige & Skoog’s) yang dilengkapi 2,22 µM TDZ (thidiazuron) dan 2,25 µM BAP mencapai 34 %, sedangkan regenerasi tanaman dari kalus nodular tersebut pada medium WPM dengan konsentrasi 0,44 µM BAP setelah tiga minggu mencapai 8,39 %.
Induksi mutasi pada tanaman dapat dilakukan dengan mutagen fisik seperti sinar X, sinar gamma, partikel beta dan neutron cepat. Namun mutagen fisik yang paling banyak digunakan pada tanaman adalah sinar gamma, karena frekuens i mutasinya tinggi dan mudah diaplikasikan dibandingkan mutagen fisik lainnya.
Iradiasi sinar gamma dapat menyebabkan perubahan pada tanaman dan meningkatkan keragaman genetik tanaman. Pada penelitian ini, kalus nodular akan diiradiasi dengan sinar gamma selanjutnya kalus nodular tersebut akan diregenerasikan menjadi tunas.
transversal. Selain itu, deteksi mutan dilakukan untuk mengetahui pola pita DNA 22 regeneran mutan dan kontrol dengan analisis RAPD (Random Amplified Polymorphyc DNA) dan mengetahui keragaman genetik berdasarkan analisis dendogram.
Tujuan Penelitian
Tujuan penelitian secara umum adalah memperoleh mutan-mutan solid manggis yang memiliki laju pertumbuhan yang cepat dan perakaran yang baik. Sedangkan tujuan penelitian secara khusus adalah (1) mengembangkan tipe regenerasi tanaman manggis in vitro meliputi : organogenesis tidak langsung, organogenesis langsung dan perkecambahan biji untuk menunjang pemuliaan mutasi in vitro, (2) mengembangkan teknik induksi mutasi dengan iradiasi sinar gamma pada manggis in vitro untuk memperoleh mutan solid, (3) mempelajari perubahan struktur anatomi daun manggis in vitro akibat iradiasi sinar gamma, dan (4) mendeteksi mutan manggis in vitro berdasarkan analisis RAPD dan mengetahui keragaman genetik manggis akibat iradiasi sinar gamma.
Strategi Penelitian
Hibridisasi tidak mungkin Manggis Keragaman ge netik dilakukan (apomik obligat) sempit (≈ 0)
tipe regenerasi tanaman
Perkecambahan Organogenesis biji langsung
Rekayasa Organogenesis Induksi mutasi genetik tidak langsung dengan sinar gamma
Keragaman genetik tanaman luas
Marka RAPD
Fenotipik/
morfologi Anatomi/ histologi
Identifikasi mutan putatif
Sifat2 Agronomis
seleksi mutan putatif
Klon unggul
Manfaat Penelitian
Manfaat penelitian secara umum adalah untuk memperoleh mutan- mutan manggis yang memiliki laju pertumbuhan yang cepat dan perakaran yang baik. Sedangkan manfaat penelitian secara khusus adalah:
1. Penelitian tentang studi regenerasi tanaman manggis in vitro akan diperoleh protokol baku yang dapat digunakan untuk menunjang program pemuliaan mutasi in vitro khususnya memperoleh mutan solid, transformasi genetik, variasi somaklonal, dan kriopreservasi atau perbanyakan tanaman secara cepat.
2. Teknik induksi mutasi sangat bermanfaat untuk mendapatkan mutan- mutan putatif yang memiliki pertumbuhan cepat dan meningkatkan keragaman genetik manggis. Teknik ini dapat digunakan khususnya tanaman manggis dan umumnya tanaman tahunan.
3. Studi anatomi daun sangat bermanfaat untuk mengetahui perubahan pada jaringan daun akibat iradiasi sinar gamma dan memberikan bukti tentang adanya perbedaan atau variasi dari regeneran yang diiradiasi sehingga dapat diidentifikasi sebagai mutan.
II. TINJAUAN PUSTAKA
Tanaman Manggis
Laurent Garcin (1683 – 1751) memberi nama tanaman manggis adalah Garcinia mangostana L. (Yaacob & Tindall, 1995). Tanaman manggis kemungkinan berasal dari Peninsular Malaysia (Richard, 1990b). Tanaman ini menyebar ke timur sampai ke Papua Nugini dan kepulauan Mindanau (Filipina), sedangkan ke utara menyebar ke Thailand bagian selatan, Myanmar, Vietnam dan Kamboja (Verheij & Coronel, 1992). Dalam dua abad terakhir tanaman manggis menyebar ke Srilangka, India Selatan, Amerika Tengah, Brazil, dan Australia (Nakasone & Paul, 1998).
Tanaman manggis mempunyai banyak kegunaan dan kandungan gizi yang tinggi. Buah manggis segar mengandung gula yang terdiri dari sakarosa, dekstrosa dan levulosa. Komposisi buah manggis per 100 g terdiri dari 79,2 g air, 0,5 g protein, 19,8 g karbohidrat, 0,3 g serat, 11 mg kalsium, 17 mg fosfor, 0,9 mg besi, 14 IU vitamin A, 66 mg vitamin C (Verheij & Coronel, 1992), vitamin B (thiamin) 0,09 mg, vitamin B2 (riboflavin) 0,06 mg dan vitamin B5 (niacin) 0,1 mg (Chau kay-Ming 1990 dalam Yaacob & Tindall, 1995).
dapat berperan pada pewarnaan kulit manggis (Yaacob & Tindall, 1995; Verheij, 1997).
Famili Guttiferae memiliki sekitar 35 genera dan lebih dari 800 spesies berasal dari daerah tropika. Di antaranya terdapat sembilan genera dengan spesies yang berupa pohon buah-buahan. Lima genera dengan anggota sekitar 50 spesies dari famili Guttiferae berasal dari kawasan Asia Tenggara (Verheij & Coronel, 1992).
Kromosom manggis berukuran kecil dan jumlahnya banyak, sehingga sulit untuk dihitung. Para peneliti belum mencapai kesepekatan tentang jumlah kromosom manggis. Ada pendapat yang mengatakan manggis merupakan tanaman poliploid (2n = 96) (Tixier,1955). Ada pendapat lain manggis merupakan tanaman alotetraploid (2n = 90) turunan dari G. malaccensis (2n = 42) dan G. hombroniana (2n = 48), karena tanaman manggis mempunyai morfologi intermediet antara dua spesies diploid tersebut (Richards, 1990c). Jumlah kromosom bervariasi, yaitu 56 - 76; 88 - 90; 120 – 130 (Nakasone & Paul, 1998).
Tanaman manggis memiliki pertumbuhan yang sangat lambat. Lambatnya pertumbuhan manggis disebabkan oleh (a) sistem perakaran yang buruk dan mudah patah, sehingga (b) penyerapan air dan hara lambat, (c) rendahnya laju fotosintesis, karena rendahnya kapasitas daun menangkap CO2 (Downton et al., 1990), (d)
rendahnya laju pembelahan sel pada meristem pucuk (Wieble et al., 1992 ; Ramlan et al., 1992; Verheij, 1997).
Daun berhadapan dengan tangkai daun pendek, yaitu 1,5 – 2 cm. Helaian daun berbentuk bulat telur, bulat panjang atau elip dengan panjang 15 – 25 cm x lebar 7 – 13 cm mengkilap, tebal dan kaku, ujung daun meruncing (acuminate) dan licin (glabrous) (Verheij, 1997).
kekuning-dikelilingi oleh 4 petal merah bergaris. Ke empat sepal tersebut besar, kuat dan menyirip ganda (biseriate). Petal pada umumnya berukuran lebih besar, berbentuk bulat telur, tumpul dan berdaging, berwarna hijau kekuningan berukuran panjang 3 cm x lebar 2,5 cm. Benangsari tersusun dalam 1–3 kelompok dalam 1– 2 seri, membentuk cincin di sekitar dasar ovari, ovari melekat pada dasar bunga (sessile) dengan 4 – 8 ruang. Stigmanya menonjol dan tebal, melekat dan terbentuk dengan jumlah yang sama dengan jumlah ruang dalam ovari. Bunga manggis membuka pada sore hari dan tidak tahan lama, kemudian petal segera mengering dan jatuh dari bunga (Yaacob & Tindall, 1995).
Pada bunga manggis tidak pernah dijumpai serbuk sari yang viabel atau hampa. Pada kepala sari yang masih muda, sel-sel induk mikrospora terbentuk dengan baik, tetapi pada saat pembelahan meiosis, sel-sel tersebut mengalami degenerasi yang diawali oleh nuk leus dan sitoplasmanya (Lim, 1984). Dasar ovari dikelilingi oleh 14 – 16 tangkai sari, pistil reseptik terjadi antara pukul 4 – 6 sore hari. Petal gugur setelah 24 jam sedangkan sepal tetap sampai buah rusak. Primordia ovul berkembang dari plasenta, integumen bagian dalam mengalami diferensiasi yang diikuti bagian luar, sel-sel nuklear membentuk sel arkesporial yang berfungsi sebagai sel-sel induk megaspora selanjutnya membentuk kantong embrio (Yaacob & Tindall, 1995).
Di Negeri Sembilan, Malaysia telah ditemukan pohon jantan manggis yang berumur ± 70 tahun dengan tinggi 25 m. Posisi bunga di terminal, ukuran bunga jantan lebih kecil (5 cm) dibandingkan bunga betina pohon betina manggis. Ukuran filamen sangat pendek 0,5 mm, dan terdapat serbuk sari berdiameter 36 µm. Ovari tidak berkembang (rudimenter) berwarna merah kekuningan dan berukuran kecil panjangnya 3 mm dan lebarnya 5 mm, dan tidak terdapat cuping. Bunga betina cepat mengering dan beberapa hari selanjutnya jatuh. Pada pohon jantan manggis tidak ditemukan pembentukan buah (Idris & Rukayah, 1988). Sebelumnya, pohon jantan manggis pernah ditemukan di Indocina (Corner, 1952).
bawahnya terdapat sepal yang tebal dan rongga-rongga stigma, sisa rongga stigma tetap tinggal pada ujung buahnya (Yaacob & Tindall, 1995).
Biji manggis merupakan biji apomik yang terbentuk dari sel nuselus pada buah partenokarpi (Almeyda & Martin, 1976). Pada embrio manggis tidak nampak jelas lokasi plumula dan radikelnya. Akan tetapi embrio muncul di permukaan biji. Berat biji bervariasi antara 0,1 – 2,2 g dengan rata-rata 1,0 – 1,6 g (Yaacob & Tindall 1995). Tanaman Manggis biasanya diperbanyak dengan biji yang bersifat rekalsitran (Goh et al., 1990). Jumlah biji per buah sangat terbatas biasanya satu atau dua (Almeyda & Martin, 1976; Yaacob & Tindall 1995).
Keragaman pada Manggis
faktor lingkungan, karena kedua bentuk kanopi oval dan kerucut terdapat di semua lokasi. (Mansyah et al.,1992).
Hasil analisis isozim keragaman pohon manggis dari sentra produksi di Jawa yang meliputi Kaligesing (Purworejo), Dampit (Malang), Cipaku (Bogor), Cikalong (Cianjur) dan Lombok yang meliputi Narmada dan Lingsar menunjukkan bahwa enzim esterase dan acid fosfatase tidak menunjukkan keragaman polimorfik, sedangkan enzim peroksidase menunjukkan keragaman polimorfik (Supriyanto et al., 1999).
Hasil studi keragaman genetik manggis dengan marka RAPD dan fenotipik dari sentra produksi di Jawa yang meliputi Wanayasa (Purwakarta), Leuwiliang (Bogor), Cantayan (Sukabumi), Kaligesing (Purworejo), Watulimo (Trenggalek) dan Sumatera Barat yang meliputi Balai Baru (Padang), Padang Laweh dan Subarang Sukam menunjukkan bahwa tanaman manggis bervariasi secara fenotipik dan genetik. Variasi fenotipik yang spesifik terlihat pada kanopi tanaman dan bentuk buah, bentuk kanopi terdiri atas oblong dan piramid, dan bentuk buah dapat dibagi atas tiga jenis yaitu bentuk bulat dengan dasar buah agak lonjong dan cupat menonjol, buah bulat dengan cupat datar, dan buah agak gepeng dengan cupat datar. Variasi genetik dijumpai pada tanaman induk dari berbagai lokasi maupun antar tanaman induk dan keturunannya. Untuk pohon induk yang mewakili populasi tanaman dari berbagai lokasi variasi genetiknya sebesar 56.6 % (Mansyah, 2002). Di Australia, tedapat variasi genetik (60-70 %) di antara 37 aksesi pohon manggis berdasarkan analisis RAPD (Ramage et al., 2004).
Apomiksis pada Manggis
mengalami reduksi (den Nijs & van Dijk, 1993). Jumlah kromosom yang tidak mengalami reduksi dapat berasal dari sel somatik dalam ovul yang berkembang menjadi embrio tanpa penggabungan inti telur dan sperma (Ramulu et al., 1995). Keturunan tanama n manggis bersifat uniform dan identik dengan tanaman induknya (Horn, 1940; Nakasone & Paul, 1998)).
Apomiksis dapat dikategorikan menjadi fakultatif dan obligat (den Nijs & van Dijk, 1993). Apomiksis fakultatif adalah bentuk apomiksis dimana proses fertilisasi juga dijumpai, seperti pada spesies jeruk, proses fertilisasi dan apomiksis terjadi secara bersamaan dalam ovul yang sama (Koltunow, 1993). Apomiksis fakultatif mempunyai tendensi seksualitas rendah bahkan mendekati apomiksis obligat (den Nijs & van Dijk, 1993). Apomiksis obligat adalah bentuk apomiksis keseluruhan dimana biji terbentuk tanpa proses fertilisasi, seperti manggis (Richard, 1990a). Mekanisme apomiksis dapat dibedakan menjadi tiga kelompok (den Nijs &
van Dijk, 1993), yaitu :
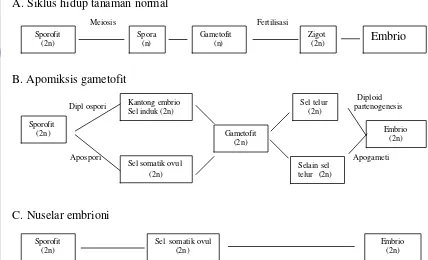
1. Diplospori adalah berkembangnya kantong embrio non-reduksi dari sel arkespora (kantong embrio sel induk megaspora) melalui pencegahan atau restitusi meiosis, sel telur membentuk embrio melalui proses partenogenesis atau sel lain dari kantong embrio membelah dan berkembang menjadi embrio melalui proses apogameti (Gambar 3B).
2. Apospori adalah berkembangnya kantong embrio non-reduksi dari sel somatik nuselus atau integumen daripada sel induk kantong embrio (Gambar 3B).
3. Nuselar embrioni adalah embrio berkembang langsung dari jaringan nuselus sporofitik tanpa pembentukan gametofit terlebih dahulu (Gambar 3C).
A. Siklus hidup tanaman normal
Meiosis Fertilisasi
B. Apomiksis gametofit
Diploid
Dipl ospori partenogenesis
Apospori Apogameti
[image:34.612.101.529.109.369.2]C. Nuselar embrioni
Gambar 3. Perbandingan siklus hidup tanaman normal (A); apomiksis gametofit (B); dan nuselar embrioni (C). (Sumber: den Nijs & van Dijk, 1993)
Mekanisme reproduksi apomiksis pada manggis termasuk ke dalam nuselar embrioni, perkembangan endosperm bersifat autonomous (tanpa adanya fertilisasi) dari primary endosperm nucleus (Richard, 1990a), perkembangan proembrio adventif dari integumen bagian luar pada endosperm dewasa tanpa adanya stimulasi dari perkembangan seksual (Lim, 1984).
Sebagian besar spesies apomiktik adalah poliploid, kecuali pada genus citrus dan beberapa spesies Potentilla. Beberapa kerabat seksual spesies apomiktik bersifat self incompatibility. Analisis keturunan pada persilangan antara apomiksis dan bentuk seksual menunjukkan bahwa kemampuan untuk reproduksi ditentukan secara genetik. Sebagai contoh nuselar embrioni pada jeruk dikontrol oleh lokus tunggal dominan Selain faktor genetik, apomiksis juga distimulasi oleh faktor lingkungan dan nutrisi (Koltunow, 1993). Sporofit (2n) Spora (n) Gametofit (n) Zigot
(2n) Embrio
Sporofit (2n)
Kantong embrio Sel induk (2n)
Sel somatik ovul (2n) Gametofit (2n) Sel telur (2n) Selain sel telur (2n)
Embrio (2n)
Sporofit (2n)
Sel somatik ovul (2n)
Kultur Jaringan pada Manggis
Sistem regenerasi tanaman yang efesien sangat diperlukan untuk menunjang program pemuliaan tanaman melalui kultur in vitro seperti rekayasa genetik, variasi somaklonal, dan induksi mutasi (Litz & Gray, 1992).
Ada beberapa metode regenerasi, yaitu organogenesis langung (direct organogenesis), organogensis tidak langsung (indirect organogenesis) dan embriogenesis somatik (somatic embryogenesis). Pada kultur in vitro kesesuaian media dan pemilihan eksplan merupakan hal penting untuk menghasilkan planlet (Hartmann et al., 1997). Pada manggis, embrio kemungkinan terdapat di sepanjang permukaan biji (Yaccob & Tindall, 1995), sehingga biji bersifat poliembrioni (Richards, 1990a). Tunas adventif dapat diperoleh dari segmen kotiledon yang ditanam pada medium MS yang dilengkapi dengan konsentrasi 5,0 mg l-1 BAP (Goh et al., 1988).
Organogenesis langsung adalah proses pembentukan tunas adventif langsung dari eksplan. Tunas adventif yang dihasilkan berstruktur unipolar dan jaringan tersebut masih terkait dengan jaringan asalnya (Tisseret, 1994). Organogenesis in vitro tergantung pada fitohormon eksogen, seperti auksin dan sitokinin dan juga kemampuan jaringan merespon fitohormon selama kultur (Sugiyama, 1999). Pada beberapa spesies tanaman, tunas adventif diinduksi dengan konsentrasi sitokinin yang tinggi dibandingkan auksin (Phillips et al., 1995; Sugiyama, 1999). Pada manggis, pembentukan tunas adventif berasal dari eksplan daun yang ditanam pada medium WPM (Woody Plant Medium) dengan konsentrasi 5,0 mg l-1 BAP (Goh et al., 1994). Planlet manggis telah didapatkan dengan menggunakan biji sebagai eksplannya (Goh et al., 1988), daun muda dari bibit dan pohon dewasa (Goh et al., 1990), daun muda dari kultur in vitro (Te-chato & Lim, 2000).
totipotensinya (Yeoman, 1986). Pada ekplan yang ditransfer ke dalam media dengan konsentrasi auksin yang tinggi, seperti 2,4-D kalus akan menjadi friable (remah) dan berproliferasi lebih cepat. Pertumbuhan kalus friable yang ditempatkan pada media cair dan digojok akan membentuk suspensi sel (Yeoman, 1986). Ketika suspensi sel ditransfer ke media dengan konsentrasi auksin yang lebih rendah, maka struktur meristem akan membentuk struktur bipolar embrio somatik (Reinar et al., 1977 cit Yeoman, 1986).
Pada manggis, induksi kalus nodular manggis berasal dari eksplan daun muda dari kultur in vitro yang ditanam pada medium Murashige & Skoog (MS) yang dilengkapi 2,22 µM thidiazuron (TDZ) dan 2,25 µM Benzyladenin (BA) setelah tiga minggu menghasilkan 34 %, sedangkan regenerasi tanaman dari nodul kalus dilakukan pada WPM dengan konsentrasi 0,44 µM BA setelah tiga minggu menghasilkan rata-rata 8,39 tunas (Te-chato & Lim, 2000). Pada tanaman berkayu, penggunaan TDZ dapat menginduksi kalus dan regenerasi tanaman. Penggunaan TDZ yang lebih kecil dari 1µM dapat merangsang pembentukan kalus, tunas adventif, atau embrio somatik (Fiola et al., 1990). TDZ adalah derivat diphenilurea yang terbukti dapat meningkatkan biosintesis dan akumulasi sitokinin endogen kelompok purin dalam kultur jaringan (Massimo et al., 1995).
kimera (Litz & Gray, 1992). Pada embriogenesis somatik, embrio berkembang melalui beberapa tahap, yaitu globular, hati, torpedo, kotiledonari dan maturasi (Phillips et al., 1995). Kalus embriogenik dapat dinduksi dengan adanya 2,4-D pada basal medium (Phillips et al., 1995). Pada Linum usitatissimum, kalus embriogenik dapat diinduksi dengan 2,24 – 18,10 µM 2,4-D atau 2,85-28,54 µM IAA (Tejavathi et al., 2000); Chepaelis apecacuantia 0,5 mg l-1 kinetin dan 4,0 mg l-1 2,4-D (Rout et al., 2000); Prunus cerasus kombinasi 2,4-D dan kinetin (Tang et al., 2000); Anacardium occidentale 6,78 µM 2,4-D (Ananthakrishnan et al., 1999). Dalam beberapa kasus, konsentrasi thidiazuron lebih besar dari 1 µM dapat merangsang pembentukan kalus, tunas adventif dan embrio somatik (Huettemen & Preece, 1993). Pada manggis, induksi kalus dapat dilakukan pada medium MS dengan konsentrasi 2,22 µM TDZ dan 2,25 µM BA (Te-chato & Lim, 2000).
Induksi Mutasi
In vitro
Keberhasilan program pemuliaan mutasi sangat tergantung pemilihan mutagen (fisik atau kimia), metode aplikasi (akut atau kronik), dosis yang optimum, tahap perkembangan fisiologi materi tanaman (dorman atau pertumbuhan), bagian tanaman atau jaringan yang diperlukan (mata tunas, setek, jaringan, nuselus, zigot atau embrio) dan teknik penanganan materi yang diradiasi dan seleksi pada generasi selanjutnya (Donini et al., 1990).
yang kecil, sedangkan gamma field ditempatkan dalam rumah kaca biasanya yang diiradiasi adalah seluruh bagian tanaman dan dalam jumlah besar.
Pembuatan Cobalt-60 dilakukan dalam reaktor atau dengan menembak Co-59 yang diperoleh dari alam dengan berkas-berkas neutron.
59
Co +
1 n 60Co
27 0 27
Energi sinar gamma yang dikeluarkan Cobalt-60 cukup besar, yaitu 1,17 MeV yang dihasilkan dari proses peluruhan beta Cobalt-60 menjadi isotop Ni-60 (Briggs & Constantin, 1977).
60
Co
60Ni +
â
-+ ã
27 27
Sedangkan radioisotop Cs-137 merupakan salah satu radioisotop hasil samping reaksi fisi nuklir dalam sebuah reaksi atom. Radioisotop Cs-137 meluruh menjadi Ba-137 dengan sinar gamma yang berenergi 0,66 MeV (Briggs & Constantin, 1977).
137
Cs
137Ba +
â
-+ ã
55 56Penggunaan mutagen fisik sangat dianjurkan karena mudah diaplikasikan, penetrasi dan reprodusibilitas tinggi dan frekuensinya tinggi (Boertjes & van Harten, 1988), sedangkan mutagen kimia penetrasinya sangat rendah dan bersifat toksik (Briggs & Constantin, 1977; Poehlman & Sleper, 1995).
Pada umumnya bagian tanaman yang dapat mutasi adalah biji atau tepung sari, sedangkan untuk tanaman yang diperbanyak secara vegetatif yang dimutasi adalah umbi, stek, stolon, dan rimpang Mutagen fisik (iradiasi) dan kimia dapat digunakan pada semua bahan tanaman (Micke & Donini, 1993).
Tabel 2. Berbagai dosis dan mutagen yang digunakan pada beberapa tanaman tahunan atau yang diperbanyak secara vegetatif
Rekomendasi Perlakuan Spesies Tanaman Materi/Eksplan
Mutagen Dosis
Referensi
Chrysanthemum Bagian pedicel (in vitro) Sinar X 8 Gy Micke&Donini, 1993
Begonia Bagian daun (in vitro) Sinar X 15– 20 Gy Micke&Donini, 1993
Malus pumila Grafting dorman Tunas pucuk dorman
Sinar gamma Sinar gamma
60– 70 Gy 25– 50 Gy
Broertjes & van Harten , 1988 Prunus cerasus Tunas dorman Sinar gamma 20– 50 Gy Broertjes & van
Harten , 1988 Prunus avium Tunas dorman Sinar gamma 35– 45 Gy Micke&Donini, 1993
Sel induk tepung sari Sinar X 8 Gy Micke&Donini, 1993
Citrus sinensis Kalus bakal biji (in vitro) Sinar gamma 80– 16 Gy Micke&Donini, 1993
Vitis vinifera Tunas dorman Sinar gamma 25– 35 Gy Micke&Donini, 1993
Musa spp
Tunas dorman
Pucuk batang (in vitro)
Sinar X Sinar gamma
25– 35 Gy 10-25 Gy
Broertjes & van Harten , 1988 Sacharum sp Bakal tunas tunggal Sinar gamma 10-25 Gy Micke&Donini, 1993
Pyrus communis Tunas dorman Sinar gamma 50-70 Gy Micke&Donini, 1993
Mangifera indica Tunas Sinar gamma 10-50 Gy Broertjes & Van Harten , 1988 Sumber : Micke & Donini (1993) :Broertjes & van Harten (1988) (dimodifikasi)
Sensitivitas bahan tanaman setelah iradiasi akut pada setiap spesies tanaman berbeda-beda baik dalam kondisi in vivo maupun in vitro. Biasanya untuk masing-masing varietas dipilih dua dosis untuk eksperimen, yaitu dosis sedang yang menghasilkan reduksi atau proliferasi lebih kurang 40 % dan dosis tinggi yang menghambat 60 % (Donini et al., 1990).
Mutan solid diperoleh bila embrio zigotik atau jaringan nuselar diiradiasi sebelum pembentukan embrio seperti pada jeruk (Donini et al., 1990). Pada mutan solid, mutasi terjadi pada satu tingkat sel, sedangkan pada jaringan meristem apikal biasanya mutasi terjadi pada sejumlah sel seperti epidermis (L1), sub-epidermis (L2)
dan sel-sel lainnya (L3). Apabila jaringan multiseluler dilakukan perlakuan iradiasi
dari tunas adventif biasanya bersifat non kimera, karena dihasilkan dari satu sel, yaitu sel epidermis (George, 1993).
Perlakuan iradiasi meristem apikal dapat terjadi di lapisan bagian luar saja atau lapisan bagian dalam saja atau keduanya. Kimera meriklinal atau sektoral dapat diisolasi dari jaringan yang termutasi. Selanjutnya jaringan tersebut menjadi periklinal yang diperoleh dari generasi M1V2 atau M1V3 dari pertumbuhan tunas
M1V1 melalui perbanyakan tunas aksilar (Donini et al.,1990).
Pada umumnya konstitusi genetik tanaman buah-buahan dan tanaman lain yang diperbanyak secara vegetatif bersifat heterosigos (Libby, 1987). Hal ini merupakan suatu keuntungan dalam efesiensi program pemuliaan mutasi, jika terjadi perubahan genetik suatu karakter yang diharapkan akibat mutasi maka dapat dipelihara dan diperbanyak secara vegetatif.
Seleksi induksi mutasi pada tanaman yang membiak vegetatif atau apomiksis sangat berbeda dengan tanaman yang diregenerasikan melalui biji. Tanaman membiak vegetatif, mutasi dapat terjadi pada sel-sel somatik yang hanya memungkinkan terjadinya pewarisan somatik (Micke & Donini, 1993), sedangkan tanaman yang dibiakan dengan biji, jaringan yang termutasi dapat diwariskan secara meiosis ke generasi selanjutnya. Kimera sektoral yang mungkin terjadi akibat iradiasi pada tanaman yang membiak secara vegetatif harus dapat dihilangkan. Pada kondisi in vivo mengisolasi mutan dari kimera sektoral akibat iradiasi sangat sulit dan membutuhkan waktu yang lama (Maluszynski et al., 1995), sedangkan kondisi in vitro mengisolasi mutan dari kimera dapat dilakukan dengan mudah dan membutuhkan waktu yang cepat.
mengurangi pembentukan kimera dan mempercepat seleksi karakter yang diharapkan (Maluszynski et al., 1995). Mutagenesis in vitro dengan menggunakan shoot tip sebagai eksplan kemudian dilakukan multiplikasi melalui tunas aksilar dapat mengurangi pembentukan kimera dan mendapatkan mutan solid dengan cepat, seperti dilakukan pada apel, cherry dan kentang.
Teknik kultur in vitro, seperti kultur kalus, suspensi sel, adventitious bud, proliferasi tunas aksilar dapat dikombinasikan dengan teknik induksi mutasi baik dengan menggunakan mutagen fisik atau kimia akan menghasilkan mutan stabil (Donini et al., 1990). Teknik in vitro dapat memisahkan dari jaringan kimera menjadi jaringan yang utuh dengan melakukan multiplikasi dua atau tiga kali (Donini et al., 1990). Apabila kalus atau embriogenesis diiradiasi kemungkinan besar dapat menghasilkan mutan solid karena kultur kalus atau embriogenesis somatik berasal dari satu sel (Maluszynski et al., 1995).
Mutan solid dapat diperoleh secara langsung, jika bagian yang diiradiasi adalah kalus, suspensi sel, embrio somatik atau protoplas, akan tetapi kelemahannya memiliki daya regenerasi yang rendah (van Harten, 1998). Untuk mendapatkan mutan solid dari jaringan kimera dapat dilakukan dengan mengisolasi jaringan kimera tersebut yang kemudian menumbuhkannya melalui kultur sel tunggal ataupun kultur protoplas (Wattimena dkk., 1992). Menurut Broertjes & van Harten (1988), ada beberapa keuntungan penggunaan mutan solid, yaitu : (1) seleksi lebih cepat dan mudah dilakukan, (2) mutan lebih stabil, (3) mutan dapat diperbanyak secara vegetatif, (4) mutan dapat digunakan dalam program pemuliaan konvensional.
Bagian tanaman yang diperbanyak secara vegetatif kemudian diiradiasi dengan sinar gamma maka tanaman disebut generasi MVo, sedangkan tanaman yang berasal
dari bagian tanaman yang diiradiasi disebut generasi MV1. Pengaruh iradiasi sinar
gamma pada tanaman generasi MV1 ada empat macam, yaitu : (1) kematian tanaman,
(2) pertumbuhan terhambat, (3) perkembangan morfologi yang abnormal dan (4) perubahan genetik (Chaudhari, 1971). Kerusakan fisiologis tanaman yang rendah dan perubahan genetik yang kuat sangat diharapkan dalam program pemuliaan (Gaul. 1977). Gejala-gejala kerusakan fisiologis sangat tergantung pada dosis iradiasi yang diberikan dan kepekaan atau radiosensitivitas dari materi yang diberikan selama perlakuan iradiasi.
Bila dibandingkan dengan metode pemuliaan mutasi in vivo, metode in vitro waktu yang diperlukan dari eksplan yang diberi perlakuan mutagen sampai pelepasan klon mutan relatif lebih cepat. Pada tahun pertama diperoleh keseragaman genetik di antara tanaman mutan, sedangkan tahun kedua sampai ketujuh uji kestabilan genetik tanaman termutasi dan tahun kedelapan dapat melepas klon mutan. Keuntungan metode in vitro, isolasi jaringan termutasi akan lebih mudah dilakukan dengan cara multiplikasi (Donini et al., 1990).
Mekanisme Mutasi pada Tanaman
Informasi genetik disimpan dalam bentuk rantai polinukleotida yang berstruktur double helik DNA. Ada empat basa nukleotida yang terdiri dari kelompok purin meliputi adenin (A) dan guanin (G), dan kelompok pirimidin meliputi timin (T) dan sitosin (C). Basa nukleotida terikat oleh grup fosfat dan gula deoksiribosa DNA. Dalam kondisi normal timin berpasangan dengan adenin dan guanin berpasangan dengan sitosin (van Harten, 1998).
Gutafsson & Ekberg (1977) menyatakan perubahan genetik akibat mutasi baik spontan maupun induksi dapat dikategorikan menjadi empat kelompok, yaitu:
2. Mutasi gen, yaitu perubahan yang terjadi pada satu atau lebih basa nukleotida. Mutasi gen dapat dikelompokan menjadi dua, yaitu :
a. Mikrolesi, yaitu perubahan pasang basa dalam bentuk subtitusi (transisi atau transversi), frame shift mutasi (insersi atau delesi pasang basa). Transisi adalah pertukaran satu basa purin/pirimidin ke satu basa purin/pirimidin lain. Ada empat kombinasi pertukaran basa pada transisi, yaitu AT→GC, GC→AT, TA →CG, dan CG→TA. Transversi adalah pertukaran dari basa purin ke basa pirimidin atau sebaliknya. Ada empat kombinasi pertukaran basa pada transversi, yaitu AT →TA, AT→CG, GC→CG, dan GC→TA Mikrolesi umumnya disebut mutasi titik (point mutation).
b. Makrolesi, yaitu perubahan pasang basa dalam jumlah besar (> dua pasang basa), seperti delesi, duplikasi dan rearrangement. Makrolesi dapat berpengaruh terhadap dua atau lebih sistron.
3. Mutasi kromosom, yaitu perubahan struktur atau aberasi kromosom. Mutasi kromosom dapat dikelompokkan menjadi empat:
a. Defesiensi (delesi), yaitu hilangnya segmen kromosom.
b. Translokasi, yaitu patahnya dua kromosom secara bersamaan dalam inti, patahan segmen kromosom bergabung dengan kromosom yang lain.
c. Duplikasi, yaitu penambahan segmen kromosom pada kromosom yang normal.
d. Inversi, yaitu segmen kromosom mengalami patah, kemudian segmen kromosom mengalami posisi terbalik (rotasi 180o).
4. Mutasi di luar inti, yaitu perubahan organel-organel, seperti plastida, mitokondria dan lain- lain.
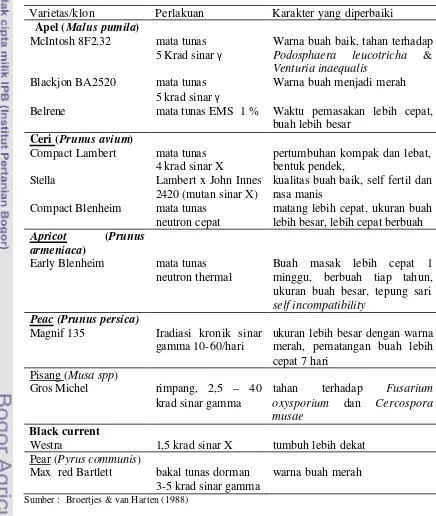
Pada tanaman buah-buahan telah berhasil dikembangkan varietas komersial akibat mutasi spontan atau induksi, seperti apel, pear, peac, ceri, apricot, black current, pisang (Tabel 3).
Tabel 3. Varietas/klon komersial tanaman buah-buahan yang dihasilkan mutasi dan karaketer yang diperbaiki
Varietas/klon Perlakuan Karakter yang diperbaiki Apel (Malus pumila)
McIntosh 8F2.32 mata tunas 5 Krad sinar γ
Warna buah baik, tahan terhadap Podosphaera leucotricha & Venturia inaequalis
Blackjon BA2520 mata tunas 5 krad sinar γ
Warna buah menjadi merah Belrene mata tunas EMS 1 % Waktu pemasakan lebih cepat,
buah lebih besar Ceri (Prunus avium)
Compact Lambert mata tunas 4 krad sinar X
pertumbuhan kompak dan lebat, bentuk pendek,
Stella Lambert x John Innes
2420 (mutan sinar X)
kualitas buah baik, self fertil dan rasa manis
Compact Blenheim mata tunas neutron cepat
matang lebih cepat, ukuran buah lebih besar, lebih cepat berbuah
Apricot (Prunus
armeniaca)
Early Blenheim mata tunas neutron thermal
Buah masak lebih cepat 1 minggu, berbuah tiap tahun, ukuran buah besar, tepung sari self incompatibility
Peac (Prunus persica)
Magnif 135 Iradiasi kronik sinar gamma 10-60/hari
ukuran lebih besar dengan warna merah, pematangan buah lebih cepat 7 hari
Pisang (Musa spp)
Gros Michel rimpang, 2,5 – 40 krad sinar gamma
tahan terhadap Fusarium oxysporium dan Cercospora musae
Black current
Westra 1,5 krad sinar X tumbuh lebih dekat Pear (Pyrus communis)
Max red Bartlett bakal tunas dorman 3-5 krad sinar gamma
warna buah merah
Deteksi Mutan dengan Analisis RAPD
Keragaman genetik tanaman yang terjadi akibat induksi mutasi dapat diamati langsung secara fenotipik/morfologi tanaman, jaringan tanaman, biokimia (protein, atau isozim), analisis sitologi/histologi atau tidak langsung dengan marka molekuler (DNA) (Brar, 2002).
Penggunaan karakter morfologi dalam analisis keragaman genetik tanaman mempunyai kelemahan terutama dalam hal konsistensi hasil karena penampakan karakter morfologi mungkin berubah setelah tanaman mencapai fase pertumbuhan tertentu. Pada tanaman tahunan perubahan morfologi itu membutuhkan waktu lama dan sangat dipengaruhi oleh faktor lingkungan dan mempunyai efek pleiotropi (Brar, 2002) dan epistasis (George & Sadasivam, 1997). Marka sitologi jarang sekali digunakan karena sulit untuk mengamati perbedaan kromosom, terutama untuk tanaman yang ukuran kromosomnya kecil dan jumlahnya banyak. Marka isozim digunakan untuk menganalisis keragaman genetik karena relatif cepat, mudah digunakan, dan biayanya murah, namun masih memiliki kelemahan, yaitu tingkat polimorfik yang terbatas (Meunier, 1992) dan dipengaruhi oleh fase perkembangan tanaman (Brar, 2002).
Marka DNA memberikan alternatif terbaik dalam menganalisis keragaman genetik tanaman karena mampu memberikan polimorfik pita DNA dalam jumlah banyak, konsisten, tidak dipengaruhi oleh faktor lingkungan dan tidak ada efek pleiotropi (Brar, 2002). Marka molekuler dapat diturunkan dan berasosiasi dengan genotip tertentu (Asiedu et al., 1989), keterpautan dengan karakter yang diinginkan (McCaskill & Giovannoni, 2002), dan pewarisannya mengikuti hukum mendel dan pewarisannya stabil (Brar, 2002).
(Brar, 2002). Analisis isozim dan RFLP mempunyai polimorfik relatif sedikit, sedangkan RAPD mempunyai polimorfik tinggi (Mulcahy et al., 1993).
RAPD adalah teknik biologi molekuler yang banyak digunakan untuk mendeteksi perbedaan polimorfik DNA antar individu dan spesies berdasarkan hasil amplifikasi reaksi berantai polimerase (PCR) (Saunder & Hopkins, 1999). Prinsip dasar PCR meliputi tiga tahapan, yaitu (1) Denaturation yaitu DNA target yang berutas ganda mengalami pemisahan menjadi utas tunggal, proses ini terjadi pada suhu 94 0C, (2) annealing, yaitu masing- masing utas tunggal DNA cetakan ditempeli oleh dua primer (oligonukleotida) berdasarkan pasangan komplementer antara basa-basa DNA cetakan dengan primer, proses ini terjadi pada suhu 55 – 60 oC, (3) extension yaitu perpanjangan komplemen basa-basa DNA cetakan dengan primer, proses ini terjadi pada suhu 72 – 74 oC (Varghese, 1997). Perpanjangan primer oleh enzim Taq DNA polimerase dimungkinkan karena adanya basa nuklotida (dATP, DGTP, dCTP dan dTTP) yang ditambahkan ke dalam reaksi, serta MgCl2 yang
berfungsi sebagai kofaktor enzim. Pengulangan siklus 25-50 kali akan meningkatkan jumlah fragmen DNA yang teramplifikasi secara eksponensial.
Marka RAPD menggunakan primer random oligonukleotida (dengan panjang 10 basa) yang amplifikasinya random pada sekuen DNA di dalam genom (McCaskill & Giovannoni, 2002). Teknik RAPD dapat mendeteksi variasi dengan ada atau tidak adanya produk amplifikasi polimorfik DNA oleh PCR yang divisualisasikan melalui elektroforesis DNA (Dowling et al., 1996; McCaskill & Giovannoni, 2002)). RAPD digunakan untuk mengidentifikasi variasi genetik di dalam atau di antara populasi dan pemetaan genom (Mayer et al., 1997; Varghese et al., 1997).
kesamaan interspesifik (Powell et al., 1996). Namun demikian teknik RAPD juga mempunyai beberapa keterbatasan, antara lain tidak dapat membedakan individu homosigot dan heterosigot karena bersifat domina n (Ronning & Schnell, 1995), perubahan kecil dalam kondisi reaksi dapat merubah jumlah dan intensitas produk amplifikasi sehingga reprodusibilitas sulit dipertahankan (Dowling et al., 1996), kesulitan dalam skoring data (Karp et al., 1997). Teknik RAPD telah berhasil digunakan untuk mengidentifikasi genotipa pada mawar (Gallego & Martinez, 1996); kakao (Ronning & Schnell, 1995); apel (Mulcahy et al., 1993); tomat (Klein-Lankhorst et al., 1991); krisan (Kirsten Wolff & Jenny Peter van Rijn, 1993), Pisang (George & Sadaivam, 1997) dan manggis (Mansyah, 2002).
Mansyah (2002) telah melakukan identifikasi 23 aksesi manggis dari sentra produksi di Jawa, yaitu Wanayasa (Purwakarta), Leuwiliang (Bogor), Cantayan (Sukabumi), Kaligesing (Purworejo), Watulimo (Trenggalek) dan Sumatera Barat yaitu Balai Baru (Padang), Padang Laweh dan Subarang Sukam (Sawahlunto Sijunjung) dengan menggunakan 5 primer, yaitu SB 13, SB 19, OPH 12, OPH 13 dan OPH 18 telah menghasilkan polimorfik berdasarkan marka RAPD.
Identifikasi Mutan dengan Anatomi Daun
Pengaruh mutagen baik fisik atau kimia menghasilkan tiga efek, yaitu : (1) kerusakan fisiologi (primary injury), (2) mutasi gen (point/gene mutation), (3) mutasi kromosom (chromosome aberration). Mutasi gen atau kromosom dapat diwariskan pada generasi M1 atau MV1 ke generasi selanjutnya, sedangkan efek fisiologis
umumnya terjadi pada generasi M1 atau MV1. Mutasi kromosom dapat diketahui
melalui perubahan mitosis atau meiosis (Gaul, 1977). Ketiga efek tersebut sangat tergantung pada dosis, kerusakan fisiologis meningkat dengan meningkat dosis. Akhir dari kerusakan fisiologis berupa kematian/letalitas tanaman.
Epidermis merupakan lapisan sel terluar pada daun, sifat sel epidermis susunannya yang kompak dan adanya kutikula dan stomata. Fungsi sel epidermis sebagai regulasi air, melindungi terhadap cahaya matahari, proteksi terhadap organisma, proteksi terhadap agen non biologi dan berfungsi sebagai sekresi (Mauseth, 1988). Kutikula adalah lapisan paling luar dinding epidermis. Kutikula merupakan senyawa komplek, poliester lipid dengan berat molekul tinggi yang dihasilkan dari polimerasi asam lemak tertentu (Mauseth, 1988). Kutikula bersifat hidrofobik sehingga berfungsi dalam ketahanan air dan indikator tumbuhan beradaptasi terhadap lingkungan kering (Mauseth, 1988).
Stomata adalah lubang pada epidermis yang dibatasi oleh dua epidermis khusus, yakni sel penjaga (Esau, 1965; Mauseth, 1988). Dengan mengubah bentuk sel, sel penjaga mengatur pelebaran dan penyempitan lubang. Sel-sel yang mengelilingi stomata dinamakan sel tetangga. Sel tetangga berperan penting perubahan osmotik yang menyebabkan gerakan sel penjaga yang mengatur lubang stomata (Esau, 1965). Pada daun, stomata ditemukan di kedua permukaan daun disebut amfistomik, atau hanya bagian permukaan atas atau adaksial disebut epistomik, atau hanya bagian permukaan bawah atau abaksial disebut hipostomik (Mauseth, 1988). Salisbury (1928) dalam Willmer (1983) memperkenalkan indeks stomata. Indeks stomata menunjukkan perbandingan jumlah stomata per unit area terhadap jumlah sel epidermis per unit area.
Gambar 4. Irisan transversal daun manggis (Pembesaran 400X)
Pada tumbuhan daerah sedang yang hidup di daerah berkadar air tinggi, jaringan palisade berada di sebelah atas (adaksial) dan jaringan bunga karang di bagian bawah, daun seperti ini disebut dorsiventral atau bifasial. Jika jaringan palisade berada di bagian atas (adaksial) dan bawah (abaksial) disebut unifasial atau isobifasial, seperti tumbuhan di daerah kering (xerofitik) (Mauseth, 1988).
Pada ke dua jaringan mesofil, kloroplas paling banyak terdapat pada jaringan palisade. Jaringan bunga karang terdiri dari sel yang bercabang yang tidak teratur bentuknya. Hubungan antar sel dan sel lainnya terbatas pada ujung cabang itu (Estiti, 1995).
Sistem jaringan pembuluh (vascular sytem) tersebar di seluruh helaian daun dan dengan demikian menunjukkan adanya hubungan ruang ya ng erat dengan mesofil. Jaringan pembuluh membentuk sistem yang saling berkaitan dan terletak dalam bidang median, sejajar dengan permukaan daun. Berkas pembuluh dalam daun biasanya disebut tulang daun (Estiti, 1995).
jaringan palisade
jaringan bunga karang epidermis atas
epidermis bawah
stomata kutikula atas
III. STUDI REGENERASI TANAMAN MANGGIS IN VITRO
Abstrak
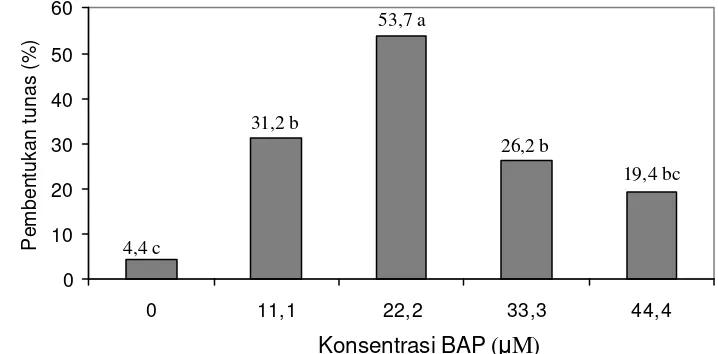
Regenerasi tanaman manggis in vitro dapat dilakukan melaui beberapa tipe regenerasi, yaitu perkecambahan biji, organogeneisis langsung dan organogenesis tidak langsung. Tujuan penelitian adalah mengembangkan tipe regenerasi tanaman yang efesien untuk menunjang pemuliaan mutasi in vitro pada manggis. Eksplan yang digunakan pada perkecambahan berupa biji, sedangkan organogenesis langsung berupa daun. Eksplan ditanam pada media MS (Murashige & Skoog) dengan konsentrasi (0,0; 11,1 ; 22,2 ; 33,3 ; 44,4) µM BAP (Benzilaminopurin). Pada organogenesis tidak langsung, induksi kalus nodular dari daun yang ditanam pada medium MS dengan konsentrasi BAP adalah 2,2 µM dan 4,4 µM, sedangkan konsentrasi TDZ (thidiazuron) adalah 1,14 µM, 2,27 µM, dan 4,54 µM. Kombinasi BAP dan TDZ digunakan sebagai perlakuan. Kalus nodular diregenerasikan membentuk tunas pada medium WPM (Woody Plant Medium) dengan konsentrasi (0,0 ;1,1 ; 2,2 ; 3,3; 4,4) µM BAP.
Hasil penelitian menunjukkan bahwa medium optimal pembentukan tunas pada perkecambahan biji dan organogenesis langsung adalah medium MS dengan konsentrasi 22,2 µM BAP. Pada organogenesis tidak langsung, medium optimal induksi kalus nodular adalah MS dengan perlakuan kombinasi konsentrasi 2,2 µM BAP dan 2,27 µM TDZ, sedangkan medium optimum regenerasi tanaman pada medium WPM dengan konsentrasi BAP 2,2 µM.
Kata kunci : tunas adventif, perkecambahan biji, organogenesis langsung dan organogenesis tidak langsung
Pendahuluan
Regenerasi tanaman sangat dipengaruhi oleh pemilihan eksplan, medium yang digunakan, zat pengatur tumbuh dan kondisi lingkungan yang cocok (Hartmann et al., 1997). Pertumbuhan dan morfogenesis tanaman in vitro diregulasi oleh interaksi ekplan dan medium, serta keseimbangan zat pengatur tumbuh yang digunakan (George, 1993). Pada kultur in vitro, zat pengatur tumbuh auksin dan sitokinin sangat penting dalam mengatur arah pertumbuhan dan morfogenesis pembentukan organ tanaman (George, 1993). Beberapa spesies tanaman, tunas adventif dapat diinduksi dengan kon